Optimization of Ultrasonic-Assisted Deep Eutectic Solvent Extraction of Flavonoids from Crataegus pinnatifida Using Response Surface Methodology
-
摘要: 考察超声辅助低共熔溶剂提取山楂总黄酮的效果,优化提取工艺参数。首先制备10种不同组分的低共熔溶剂提取山楂总黄酮,从中筛选出得率最高的低共熔溶剂。然后通过单因素实验,确定低共熔溶剂的含水量和组分比例,并利用响应面法优化超声辅助低共熔溶剂提取山楂总黄酮的提取温度、液料比及超声时间,获得最佳提取工艺。结果显示,含50%水的丙三醇/氯化胆碱(摩尔比3:1)低共熔溶剂是提取山楂总黄酮的最佳溶剂,优化的工艺条件为:液料比42 mL/g、超声时间21 min、提取温度72 °C。在此条件下,山楂总黄酮、芦丁、牡荆素、金丝桃苷、槲皮素的得率分别为7.72%、0.24%、0.33%、0.18%、0.27%,均优于传统的醇提法。在浓度为0.1 mg/mL时,山楂DESs提取物DPPH清除率为86%,高于山楂甲醇提取物,其抗氧化活性增强。因此,超声辅助低共熔溶剂可有效提升山楂总黄酮得率,为山楂资源的开发利用提供科学依据。Abstract: To investigate the extraction effect of total flavonoids from Crataegus pinnatifida by using ultrasonic-assisted deep eutectic solvents, and optimize the extraction parameters. Firstly, ten kinds of deep eutectic solvents (DESs) composed with different components were prepared for extracting total flavonoids of C. pinnatifida, and the DESs with the highest yield were selected. Then, water content and the proportion of each component contained in DESs were screened on the basis of the single factor experiments. Meanwhile, the response surface methodology (RSM) was employed to optimize extraction temperature, liquid-solid ratio and ultrasonic time, and obtain the extraction parameters. As results, glycerol/choline chloride (molar ratio 3:1) DESs containing 50% water was chosen as the optimal extraction solvent, and the optimum extraction parameters were as follow: Ultrasonic time (21 min), liquid-solid ratio (42 mL/g) and extraction temperature (72 ℃). Under the above extraction condition, the yield of total flavonoids, rutin, vitexin, hyperoside, quercetin in DESs extract were 7.72%, 0.24%, 0.33%, 0.18% and 0.27%, respectively, which were superior to the traditional alcohol extraction method. The DPPH radical scavenging rate of DESs extract at 0.1 mg/mL was 86%. Compared with methanol extract, the antioxidant activity of DESs extract was enhanced. Therefore, ultrasonic-assisted deep eutectic solvents extraction method could effectively improve the yield of total flavonoids from C. pinnatifida, and would provide the scientific evidence for the resource development and utilization of C. pinnatifida.
-
山楂,又名山里果、山里红等,主要来源于蔷薇科植物山里红Crataegus pinnatifida Bge. var. Major N. E. Br.或山楂Crataegus pinnatifida Bge,分布于全国各地[1-2]。山楂味酸甘,药食两用,应用历史悠久,其果干广受消费者欢迎,具有消食健胃、行气散瘀、化浊降脂的功效[3-4]。山楂含有丰富的营养成分、黄酮、有机酸等成分,如维生素C、金丝桃苷、牡荆素、齐墩果酸等活性成分,且安全性与保健价值高,被开发为各种食品、保健品或药品[5-6]。黄酮类化合物在山楂中含量较高,具有多种生物活性。Liu等[7]研究表明山楂黄酮可通过抗炎作用,减轻Caco-2细胞中TNF-ɑ诱发的肠上皮屏障缺陷,改善肠上皮通透性。Wang等[8]研究表明山楂黄酮可显著提升铜锌超氧化物歧化酶与过氧化氢酶的活性、mRNA水平,以减少过氧化物产物MDA产生。Xie等[9]研究表明山楂黄酮可调节FAS、HSL、TGH和SREBP-1c基因表达,以降低血脂浓度,并调节脂质代谢。Zhao等[10]研究发现山楂黄酮可改善H2O2诱导的细胞损伤发挥保护神经的作用。因此,对芦丁、金丝桃苷、牡荆素、槲皮素等山楂总黄酮进行高效的提取,具有良好的开发前景和市场经济价值。
传统的提取方法常使用甲醇、乙醇、乙酸乙酯等有机溶剂,普遍存在毒性、易挥发或易燃易爆等安全隐患。由氢键受体、氢键供体混合组成的低共熔溶剂(Deep eutectic solvents,DESs),具有安全性高、成本低、绿色环保等优势[11-12]。因此,DESs常作为提取溶媒,用于多糖、黄酮、多酚等天然成分的提取与分离研究。尿素/氯化胆碱(摩尔比3:1)组成的DESs提取玉竹多糖[13]、脯氨酸/乙酰丙酸(摩尔比1:2)组成的DESs提取金莲花黄酮[14]、氯化胆碱/柠檬酸组成的DESs提取百合多酚[15]等研究表明,DESs具有较好的亲和力,可显著提高多糖、黄酮、多酚等化合物的得率,实现目标成分的高效提取。因此,在食品、药品及化工等领域,低共熔溶剂应用前景广阔,经济价值高。
然而,低共熔溶剂含水量相对较少,黏度较大,提取时间长,效率低,不利于目标成分快速的扩散[16]。超声的空化作用、机械效应、热效应等可破坏细胞壁,有利于成分的快速释放与溶解,常用于中药提取。基于DESs高亲和力的提取优势,将超声的破壁特征与DESs联合使用可高效快速提取中药成分[17]。因此,本实验采用超声辅助低共熔溶剂提取山楂总黄酮,通过响应面法优化得到最佳提取工艺,并利用HPLC分析金丝桃苷、牡荆素、芦丁、槲皮素活性成分含量,结合山楂总黄酮提取物的抗氧化活性,为高效快速提取山楂总黄酮及其资源开发提供参考依据。
1. 材料与方法
1.1 材料与仪器
山楂 购于安徽亳州药材市场,经湖北中医药大学黄必胜教授鉴定为蔷薇科山楂属山楂(Crataegus pinnatifida Bge,C.pinnatifida)果实,编号YYH20210105,收藏于清华大学医学物理与工程研究所;硝酸铝、三氯化铝、亚硝酸钠、氢氧化钠、氯化胆碱、葡萄糖、蔗糖、尿素、L-脯氨酸、柠檬酸、丙三醇、乙二醇、1,3-丙二醇、1,2-丙二醇 分析纯,上海麦克林生化科技有限公司;芦丁、金丝桃苷、牡荆素、槲皮素 纯度≥99%,上海源叶生物科技有限公司;超纯水 实验室自制。
Ultimate 3000高效液相色谱仪、Spectramax i3x多功能酶标仪、Sorvall ST16R高速冷冻离心机 赛默飞世尔科技(中国)有限公司;PS-30超声波清洗仪 深圳市洁康洗净电器有限公司;New Classic ME电子精密天平 瑞士梅特勒-托利多集团;Direct-Q3实验室超纯水机 美国默克集团;FW1000A高速多功能粉碎机 常州市金坛友联仪器研究所。
1.2 实验方法
1.2.1 低共熔溶剂的制备
采用加热搅拌的方法制备低共熔溶剂[18],制备流程如下:将氢键受体与氢键供体混合后,加入质量分数为20%的水;在80 ℃条件下,水浴加热,搅拌至形成稳定、均匀的透明液体,即低共熔溶剂,备用。
1.2.2 山楂总黄酮的提取工艺
取0.5 g山楂粉末,分别加入10 mL不同类型DESs,置于超声仪中;水浴加热至60 ℃,功率180 W,超声20 min后,离心10 min(转速4000 r/min);取1.0 mL上清液,加50%甲醇稀释50倍,即样品,备用。
1.2.3 低共熔溶剂组分的选择
分别考察不同DESs提取溶剂对山楂总黄酮得率的影响,不同类型DESs的配制如表1所示,70%甲醇作对照实验。
表 1 不同组分DESs的制备Table 1. Preparation of DESs with different components编号 氢键供体 氢键受体 摩尔比 含水量 性状 DES1 尿素 氯化胆碱 2:1 20% 无色透明液体 DES2 蔗糖 无色粘稠液体 DES3 柠檬酸-水 无色透明液体 DES4 葡萄糖 无色透明液体 DES5 L-脯氨酸 淡黄色粘稠液体 DES6 乙二醇 无色透明液体 DES7 丙三醇 无色透明液体 DES8 1,3-丙二醇 无色透明液体 DES9 1,2-丙二醇 无色透明液体 DES10 乳酸 无色透明液体 M11 甲醇 30% 无色透明液体 1.2.4 单因素实验
以氯化胆碱和丙三醇分别作为氢键受体、氢键供体(摩尔比为3:1)、含水量50%、液料比20:1 mL/g、超声时间10 min、提取温度60 ℃作为初始提取条件,并依据1.2.2部分提取方法进行试验。按照摩尔比分别为1:1、2:1、3:1、4:1、5:1,含水量分别为20%、30%、40%、50%、60%,液料比分别为20、30、40、50 mL/g,超声时间分别为10、20、30、40、50 min,提取温度分别为50、60、70、80 ℃进行单因素实验,考察氢键受体与氢键供体的摩尔比、低共熔溶剂的含水量、液料比、超声时间、提取温度对山楂总黄酮得率的影响。
1.2.5 响应面优化试验
以单因素实验结果为基础,选取液料比、超声时间、温度作为考察因素,利用Box-Behnken Design(BBD)设计三因素三水平的响应面优化试验,共17组试验,如表2。
表 2 响应面因素水平设计Table 2. Factors and levels of response surface methodology水平 因素 A液料比(mL/g) B超声时间(min) C温度(℃) −1 30 10 60 0 40 20 70 1 50 30 80 响应面二次回归模型方程如下:
(1) 其中,β0为回归截距;βj、βjj、βij分别为回归系数;ei为正态随机误差。
1.2.6 山楂总黄酮的得率计算
1.2.6.1 标准曲线的制作
精密称量10.0 mg芦丁标准品置于10 mL容量瓶中,加入50%甲醇超声溶解,定容至刻度线,混匀;分别吸取0.1、0.3、0.5、0.7、0.9 mL芦丁标品溶液,转移至1 mL容量瓶,加50%甲醇定容,制得0.1~0.9 mg/mL的芦丁标准品溶液。采用亚硝酸钠-硝酸铝-氢氧化钠显色法测定总黄酮含量[19],并绘制标准曲线回归方程,得到回归方程:y=6.5357x+0.0119(R2=0.9996)。在0.04 ~ 0.2 mg/mL浓度范围内,总黄酮浓度(mg/mL)与吸光度呈现良好的线性关系。。
1.2.6.2 山楂总黄酮的含量测定及得率计算
根据1.2.6.1部分的实验方法与标准曲线方程,测定总黄酮得率:
(2) 式中:N(N=50)为稀释倍数;C为DESs检测液中山楂总黄酮浓度,mg/mL;M为山楂粉末质量,mg;V为DESs溶液体积,mL。
1.2.7 芦丁、牡荆素、金丝桃苷、槲皮素的得率测定
配制芦丁、牡荆素、金丝桃苷、槲皮素标准品溶液,利用HPLC对山楂提取物进行含量测定,以峰面积与浓度为变量绘制标准曲线,并依据式(3)计算山楂提取物中芦丁、牡荆素、金丝桃苷、槲皮素的得率[2,20]。
(3) 式中:N(N=50)为稀释倍数;C'分别为山楂DESs检测液中芦丁、牡荆素、金丝桃苷、槲皮素浓度,mg/mL;M为山楂粉末质量,mg;V为DESs溶液体积,mL。
HPLC测定山楂总黄酮色谱条件:Kromasil 100-5 C18色谱柱(5 μm,150×4.6 mm);流动相为乙腈(A)-0.1%甲酸水溶液(B);洗脱模式:0~5 min(乙腈:25%),5~10 min(乙腈:25%→50%),15~16 min(乙腈:50%→60%),16~20 min(乙腈:60%),20~21 min(乙腈:60%→25%),21~25 min(乙腈:25%);流速0.5 mL/min;柱温35 ℃;波长360 nm;进样量10 μL。
1.2.8 抗氧化活性测定
将山楂DESs提取后离心的上清液,冻干;取0.5 g山楂DESs提取物经D101大孔吸附树脂吸附,依次采用1.0 L水、1.0 L 10%甲醇、1.0 L 90%甲醇洗脱。90%甲醇洗脱液合并,冻干,得到山楂提取物。采用DPPH自由基清除率法,山楂DESs提取物、山楂甲醇提取物、维生素C浓度设置为0.1 mg/mL,分析各提取物抗氧化活性[21]。
1.3 数据处理
所有实验均重复三次,采用Origin 9.0软件处理实验数据,结果表示为
2. 结果与分析
2.1 单因素实验结果
2.1.1 低共熔溶剂组分的选择
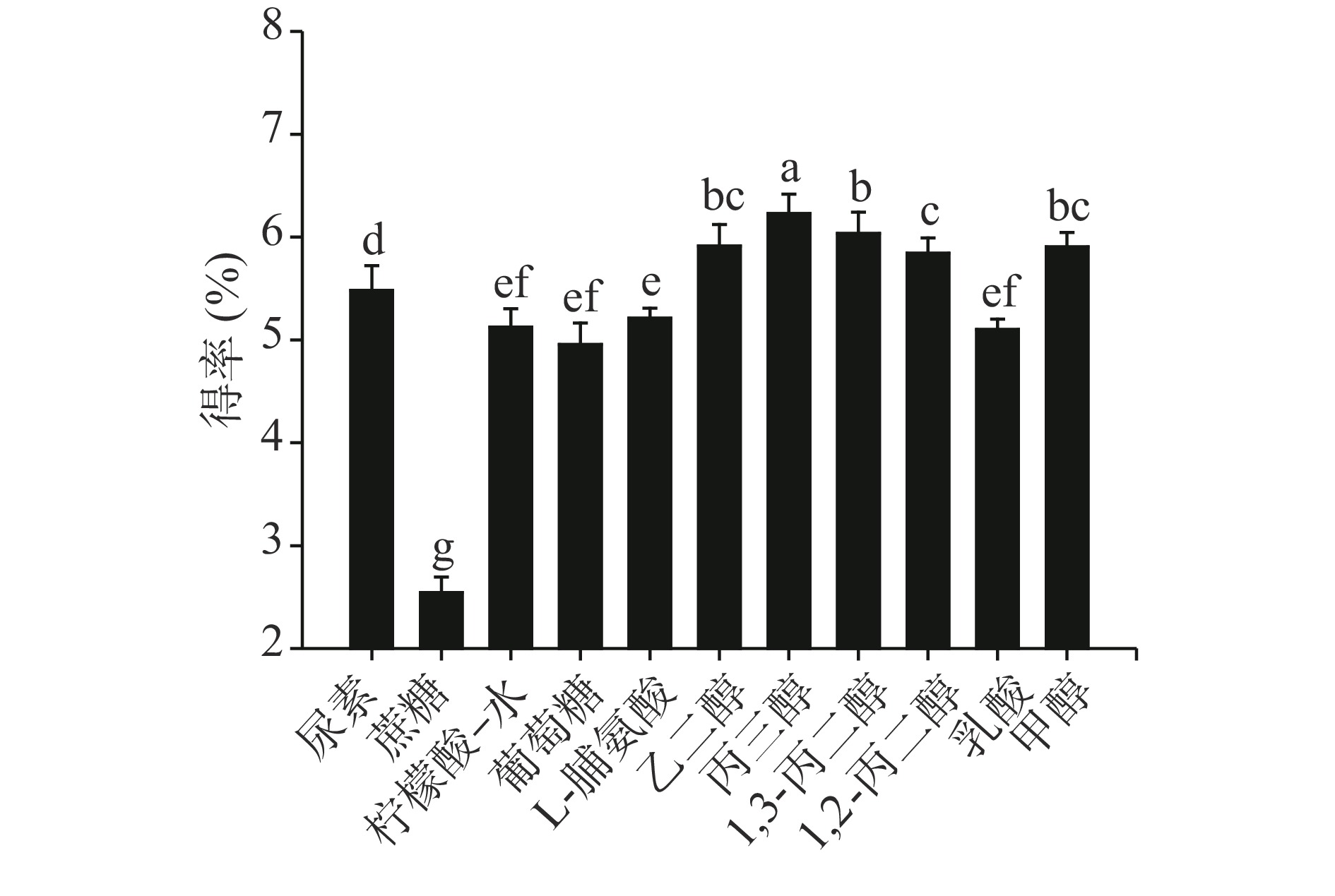
由于低共熔溶剂优越的溶解性,被广泛用于各种黄酮、多糖、多酚等天然成分的提取,如利用氯化胆碱/乙酰丙酸从紫萍提取到四种黄酮成分[22]、甜菜碱/乙酸提取黄精中抗氧化活性显著的黄酮类成分[23]、氯化胆碱/甘油从铁皮石斛中提取分离到两种新结构多糖[24]、氯化胆碱/1,2-丙二醇提取桑葚花青素[25]。由于氢键供体与氢键受体类型不同,导致分子间作用强度不同。通过上述因素可调整DESs的物理和化学特性,例如密度、黏度、极性等,从而达到对不同类型物质成分进行提取的效果[16-17]。实验结果如图1所示,不同类型DESs溶剂的山楂总黄酮得率具有明显的差异,其中乙二醇、丙三醇、1,3-丙二醇、1,2-丙二醇组的总黄酮得率相对较高。可能原因是,多元醇含有羟基相对较多,极性适中,黏度较小,有利于山楂黄酮成分的扩散与溶出。氯化胆碱/丙三醇的得率最高达6.23%,优于70%甲醇提取的得率5.93%,故选择氯化胆碱/丙三醇作为提取山楂总黄酮的提取溶媒。
2.1.2 氢键受体和氢键供体摩尔比的选择
氢键受体和氢键供体摩尔比是DESs形成的关键因素,还可调节DESs黏度、分子间作用力等,影响目标成分的得率[22-23]。实验结果如图2所示,随着氢键供体与氢键受体摩尔比的增加,山楂总黄酮的得率呈先增加后略降低的趋势,最高值为6.37%。原因可能是,当氢键供体与氢键受体摩尔比小于3:1时,丙三醇可增强DESs内分子间作用力,形成DESs溶液,降低DESs黏度;同时增强溶剂离子对山楂总黄酮的亲和力,从而提高山楂总黄酮得率。当氢键供体与氢键受体比例大于3:1时,DESs中氢键受体、离子比例降低,对山楂总黄酮的分子作用力减弱,从而使山楂总黄酮的得率呈下降趋势[22-23]。故选择丙三醇与氯化胆碱摩尔比为3:1。
2.1.3 低共熔溶剂含水量的选择
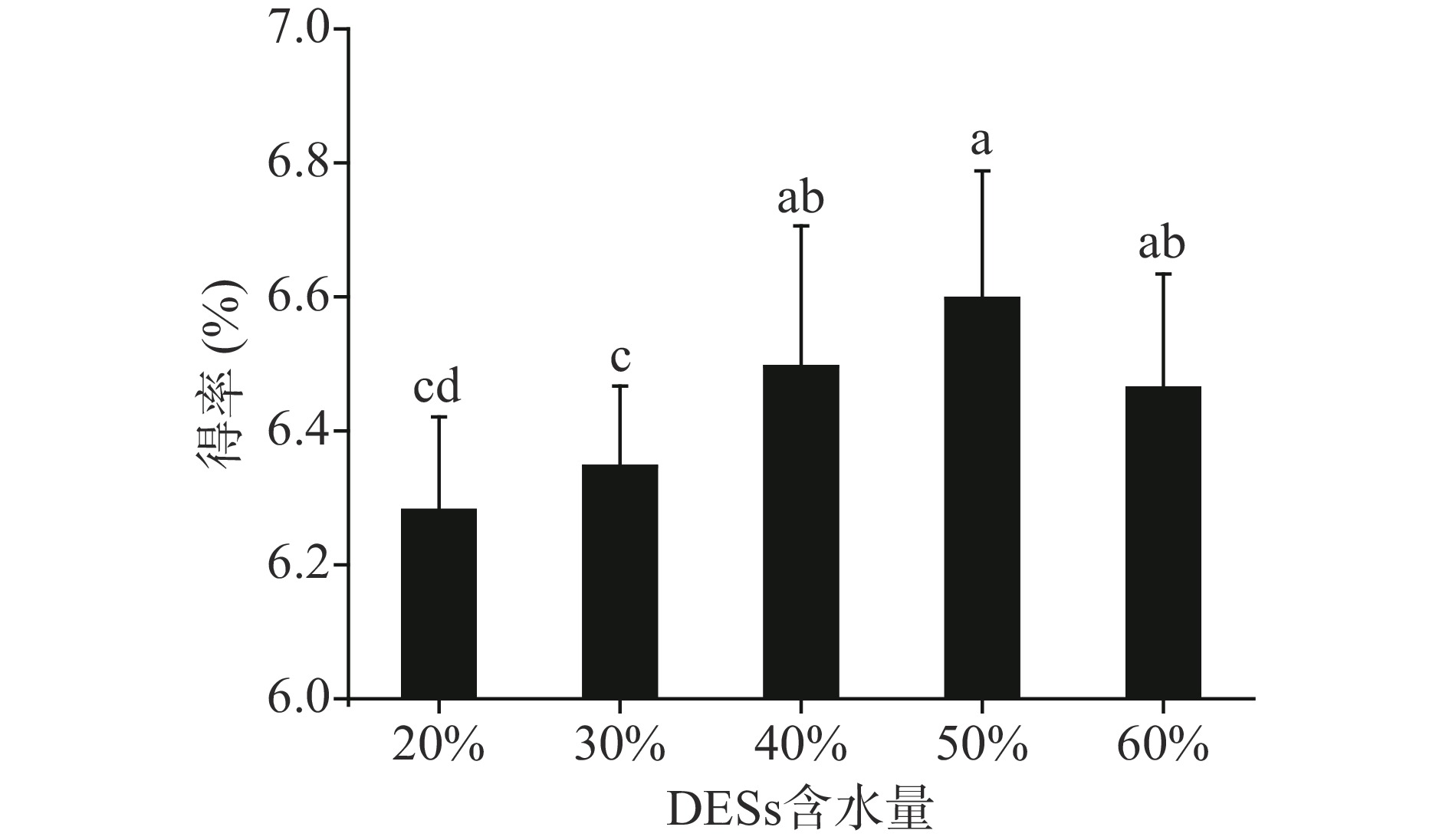
由于大多数低共熔溶剂含水量少、黏度较大,阻碍了分子扩散运动,会降低DESs提取效率。因此,通过加入适量的水调整其黏度,可达到更佳的提取效果[24-25]。实验结果如图3所示,随着DESs的含水量的增加,山楂总黄酮的得率呈现先增加后降低的趋势,最高值为6.57%。原因可能是,当DESs含水量低于50%时,随着含量水的增加,DESs黏度降低,更容易渗透至植物粉末和细胞内部。因此,山楂黄酮成分可更快更高效地从细胞内向细胞外扩散,提升山楂总黄酮的得率。当DESs含水量超过50%时,水分子破坏了DESs分子间作用力,对山楂总黄酮的分子作用力减弱,使DESs山楂总黄酮的得率呈下降趋势[24-25]。故氯化胆碱/丙三醇低共熔溶剂的含水量为50%。
2.1.4 液料比的选择
在提取工艺优化过程中,液料比是重要的工艺参数,可直接影响工艺的提取效率与生产成本[26-27]。结果如图4所示,随着液料比增加,DESs对山楂总黄酮的得率呈现先增加后降低的趋势,最高得率达6.96%。可能原因是,当液料低于40:1 mL/g时,增加提取溶剂,可使提取提取溶剂更充分的接触植物粉末和细胞,有利于山楂黄酮成分的扩散与溶出,从而提升山楂总黄酮的得率。当液料比超过40:1 mL/g时,溶剂过多,阻碍了植物粉末和细胞吸收超声能量,降低了破壁率,使DESs山楂总黄酮的得率呈下降趋势;同时,会增加多糖、蛋白质、氨基酸等杂质的溶出,加大后期分离提纯的工作量[26-27]。故选择液料比为40:1 mL/g。
2.1.5 超声时间的选择
超声是常用的提取工艺,其提取效率高、时间短、成本低,适用于水、乙醇、低共熔溶剂、双水相系统等溶剂提取中药成分[28-29]。结果如图5所示,随着超声时间增加,DESs对山楂总黄酮的得率呈现先大幅增加后缓慢降低的趋势,最高得率达7.16%。可能原因是,当超声时间低于20 min时,超声的空化作用、机械效应、热效应等可破坏细胞壁,有利于成分的快速扩散与溶出;结合DESs高亲和力的提取优势,可高效快速提取山楂黄酮成分,提升山楂总黄酮得率。当超声时间超过20 min时,能量消耗较大,可能引起了山楂总黄酮成分的分解,使DESs山楂总黄酮的得率呈下降趋势[28-29]。故选择超声时间为20 min。
2.1.6 提取温度的选择
适当的提取温度是中药提取的必要条件,有利于提高中药提取效率[29-30]。结果如图6所示,随着提取温度增加,山楂总黄酮的得率呈现先大幅增加后基本不变的趋势,最高为7.26%。可能原因是,当提取温度低于70 ℃时,温度升高可降低DESs黏度,加剧提取溶剂、黄酮分子的热运动,使提取溶剂可更高效的渗透至植物粉末和细胞内部,有利于山楂黄酮成分更高效地扩散与溶出,提升山楂总黄酮得率。当温度过高超过了70 ℃,破坏了DESs分子间作用力与稳定性,使得山楂黄酮分子溶出率下降。同时,提取温度过高会破坏山楂黄酮分子结构,导致去成分分解,降低山楂总黄酮的得率[29-30]。故选择提取温度为70 ℃。
2.2 响应面试验优化工艺
2.2.1 响应面试验设计与显著性分析
响应面试验结果与回归模型方差分析见表3~表4,山楂总黄酮得率y(%)与液料比(A,mL/g)、超声时间(B,min)、温度(C,℃)三因素的多项式回归模型:y=–31.47443+0.604568A+0.50.303487B+0.0.642293C–0.000149AB+0.000346AC–0.001050BC–0.007396A2–0.005375B2–0.004406C2。依据表4分析结果:模型P<0.0001,说明该模型具有显著性;P失拟项>0.05,F失拟项>0.5,表明模型拟合度良好;模型决定系数R2=0.9889,RAdj2=0.9747,表明该模型相关度较好;三种因素对模型的影响力次序为:液料比>提取温度>超声时间。
表 3 试验设计及山楂总黄酮得率Table 3. Experimental design and the yield of total flavonoids from C. pinnatifida实验号 A
液料比(mL/g)B
超声时间(min)C
提取温度(℃)总黄酮得率
(%)1 40 20 70 7.53 2 40 30 60 6.56 3 40 20 70 7.63 4 30 20 80 6.24 5 50 20 80 6.90 6 30 20 60 5.90 7 30 30 70 6.03 8 40 30 80 6.67 9 40 20 70 7.55 10 40 10 80 6.79 11 30 10 70 5.73 12 50 30 70 6.78 13 40 20 70 7.61 14 50 10 70 6.54 15 50 20 60 6.42 16 40 20 70 7.41 17 40 10 60 6.26 表 4 方差分析结果Table 4. Results of variance analysis方差来源 平方和 自由度 均方 F值 P值 模型 6.13 9 0.6812 69.50 < 0.0001 A 0.9321 1 0.9321 95.10 < 0.0001 B 0.0648 1 0.0648 6.61 0.0369 C 0.2691 1 0.2691 27.45 0.0012 AB 0.0009 1 0.0009 0.0909 0.7718 AC 0.0048 1 0.0048 0.4897 0.5067 BC 0.0441 1 0.0441 4.50 0.0716 A² 2.30 1 2.30 235.00 < 0.0001 B² 1.22 1 1.22 124.13 < 0.0001 C² 0.8173 1 0.8173 83.39 < 0.0001 残差 0.0686 7 0.0098 失拟项 0.0385 3 0.0128 1.70 0.3032 纯误差 0.0301 4 0.0075 总变异 6.20 16 注:P<0.01表示差异极显著;P<0.05表示差异显著。 2.2.2 模型的响应面分析
3D响应面图的曲线越陡峭,说明该因素对山楂总黄酮的得率影响越大。椭圆形的等高线说明两因素的交互作用较强,等高线越密集,表明因素对响应值的影响越显著[25-26]。由图7a~图7c可观察到三因素的坐标轴斜率,结果显示液料比对山楂总黄酮的得率影响比较大,依次为液料比、提取温度、超声时间;影响山楂总黄酮得率的各交互作用因素顺序为BC>AC>AB;最佳提取工艺为:料液比42.353 mL/g,提取温度72.109 ℃,超声时间20.601 min,山楂总黄酮的理论得率为7.609%。
2.3 验证试验
根据2.2实验部分的最佳提取工艺,选取液料比42 mL/g,提取温度72 ℃,超声时间21 min,并进行3次平行验证试验。在上述最佳工艺条件下,山楂总黄酮的实际得率为7.72%,与软件模拟预测值误差为1.47%,优于70%甲醇提取的山楂总黄酮得率5.904%。实验结果验证了响应面法优化超声辅助低共熔溶剂提取山楂总黄酮工艺的可行性与模型的有效性,表明低共熔溶剂对山楂黄酮类成分具有更好的亲和力、更高效的提取优势。同冷凝回流辅助DESs提取方法比较[31],超声辅助DESs提取的时间仅为21 min,缩短了65%,且温度低,大幅度提升了提取效率。实验表明超声辅助低共熔溶剂对山楂总黄酮具有良好的提取能力,是一种高效快速提取中药活性成分的方法。
2.4 芦丁、金丝桃苷、牡荆素、槲皮素的得率测定
芦丁、金丝桃苷、牡荆素、槲皮素是山楂总黄酮中含量较高的活性成分,也是山楂总黄酮质量的重要指标成分,具有抗氧化[2]、免疫调节[3]、抗炎[4]等多种生物活性。为进一步验证DESs提取山楂总黄酮的技术优势,利用HPLC分析芦丁、金丝桃苷、牡荆素、槲皮素的得率,各成分的标准曲线如表5所示,HPLC图谱如图8所示。芦丁、金丝桃苷、牡荆素、槲皮素的得率分别为0.24%、0.33%、0.18%、0.27%,高于甲醇提取芦丁、金丝桃苷、牡荆素、槲皮素的得率分别为0.17%、0.13%、0.18%、0.21%。因此,相对于传统的醇提法,DESs提取的山楂总黄酮活性成分得率更高,质量更佳。这可能是因为含50%水的丙三醇/氯化胆碱(摩尔比3:1)低共熔溶剂对山楂黄酮类成分具有更好的亲和力,从而达到对活性成分进行高效提取的效果。
表 5 芦丁、牡荆素、金丝桃苷、槲皮素含量测定标准曲线方程Table 5. Standard curve equation for determination of rutin, vitexin, hyperoside, quercetin化合物 线性回归曲线方程 决定系数(R2) 线性范围(mg/mL) 总黄酮 y1=6.5357x1+0.0119 0.9996 0.04~0.2 芦丁 y2=79.653x2−22.148 0.9998 0.001~0.1 牡荆素 y3=74.392x3+10.029 0.9992 0.001~0.1 金丝桃苷 y4=81.957x4−8.461 0.9998 0.001~0.1 槲皮素 y5=114.42x5−97.405 0.9997 0.001~0.1 注:x1、x2、x3、x4、x5分别为总黄酮、芦丁、牡荆素、金丝桃苷、槲皮素溶液浓度(mg/mL);y1、y2、y3、y4、y5分别为溶液吸光度、芦丁、牡荆素、金丝桃苷、槲皮素峰面积。 2.5 抗氧化活性
山楂总黄酮具有良好的抗氧化作用,可预防诸多慢性疾病,如癌症[5]、衰老[6]、心血管疾病[7]等。对山楂DESs提取物、山楂甲醇提取物的抗氧化活性进行了分析,实验结果显示(图9),山楂DESs提取物、山楂甲醇提取物、维生素C的DPPH自由基清除率分别为86%、73%、91%。从抗氧化活性角度出发,进一步表明DESs提取的山楂总黄酮质量优于甲醇提取的山楂总黄酮,验证了含50%水的丙三醇/氯化胆碱(摩尔比3:1)低共熔溶剂对山楂总黄酮具有较好的提取能力,更好的保留了活性成分。
3. 结论
DESs作为一种新的绿色提取溶剂,可明显提高多糖、黄酮、多酚等天然成分的提取率,实现目标成分的高效提取。然而,低共熔溶剂含水量相对较少,黏度较大,提取时间长,效率低,不利于目标成分快速的扩散。本实验采用超声辅助低共熔溶剂提取山楂总黄酮,首先设计合成了10种低共熔溶剂,通过单因素实验,确定了最优提取溶剂,即50%含水量的丙三醇/氯化胆碱(摩尔比为3:1)低共熔溶剂。以提取温度、液料比及提取时间为变量,山楂总黄酮得率为响应值,利用BBD响应面法优化超声辅助DESs提取山楂总黄酮的提取工艺。总黄酮含量测定结果显示,在最佳提取工艺(液料比42 mL/g,提取温度72 ℃,超声时间21 min)条件下,山楂总黄酮得率为7.72%,与模拟值误差为1.46%。芦丁、金丝桃苷、牡荆素、槲皮素作为山楂主要的活性成分,是山楂提取物质量的重要指标成分。HPLC分析结果显示,山楂DESs提取液中芦丁、牡荆素、金丝桃苷、槲皮素的得率分别为0.24%、0.33%、0.18%、0.27%,高于70%甲醇提取物中各化合物的得率。通过DPPH自由基清除实验,进一步验证了DESs提取的山楂总黄酮质量优于甲醇提取的山楂总黄酮。本研究从总黄酮得率、指标成分得率、生物活性三个角度表明,超声波辅助低共熔溶剂可高效快速提取山楂总黄酮,为山楂资源的开发利用提供科学依据。
-
表 1 不同组分DESs的制备
Table 1 Preparation of DESs with different components
编号 氢键供体 氢键受体 摩尔比 含水量 性状 DES1 尿素 氯化胆碱 2:1 20% 无色透明液体 DES2 蔗糖 无色粘稠液体 DES3 柠檬酸-水 无色透明液体 DES4 葡萄糖 无色透明液体 DES5 L-脯氨酸 淡黄色粘稠液体 DES6 乙二醇 无色透明液体 DES7 丙三醇 无色透明液体 DES8 1,3-丙二醇 无色透明液体 DES9 1,2-丙二醇 无色透明液体 DES10 乳酸 无色透明液体 M11 甲醇 30% 无色透明液体 表 2 响应面因素水平设计
Table 2 Factors and levels of response surface methodology
水平 因素 A液料比(mL/g) B超声时间(min) C温度(℃) −1 30 10 60 0 40 20 70 1 50 30 80 表 3 试验设计及山楂总黄酮得率
Table 3 Experimental design and the yield of total flavonoids from C. pinnatifida
实验号 A
液料比(mL/g)B
超声时间(min)C
提取温度(℃)总黄酮得率
(%)1 40 20 70 7.53 2 40 30 60 6.56 3 40 20 70 7.63 4 30 20 80 6.24 5 50 20 80 6.90 6 30 20 60 5.90 7 30 30 70 6.03 8 40 30 80 6.67 9 40 20 70 7.55 10 40 10 80 6.79 11 30 10 70 5.73 12 50 30 70 6.78 13 40 20 70 7.61 14 50 10 70 6.54 15 50 20 60 6.42 16 40 20 70 7.41 17 40 10 60 6.26 表 4 方差分析结果
Table 4 Results of variance analysis
方差来源 平方和 自由度 均方 F值 P值 模型 6.13 9 0.6812 69.50 < 0.0001 A 0.9321 1 0.9321 95.10 < 0.0001 B 0.0648 1 0.0648 6.61 0.0369 C 0.2691 1 0.2691 27.45 0.0012 AB 0.0009 1 0.0009 0.0909 0.7718 AC 0.0048 1 0.0048 0.4897 0.5067 BC 0.0441 1 0.0441 4.50 0.0716 A² 2.30 1 2.30 235.00 < 0.0001 B² 1.22 1 1.22 124.13 < 0.0001 C² 0.8173 1 0.8173 83.39 < 0.0001 残差 0.0686 7 0.0098 失拟项 0.0385 3 0.0128 1.70 0.3032 纯误差 0.0301 4 0.0075 总变异 6.20 16 注:P<0.01表示差异极显著;P<0.05表示差异显著。 表 5 芦丁、牡荆素、金丝桃苷、槲皮素含量测定标准曲线方程
Table 5 Standard curve equation for determination of rutin, vitexin, hyperoside, quercetin
化合物 线性回归曲线方程 决定系数(R2) 线性范围(mg/mL) 总黄酮 y1=6.5357x1+0.0119 0.9996 0.04~0.2 芦丁 y2=79.653x2−22.148 0.9998 0.001~0.1 牡荆素 y3=74.392x3+10.029 0.9992 0.001~0.1 金丝桃苷 y4=81.957x4−8.461 0.9998 0.001~0.1 槲皮素 y5=114.42x5−97.405 0.9997 0.001~0.1 注:x1、x2、x3、x4、x5分别为总黄酮、芦丁、牡荆素、金丝桃苷、槲皮素溶液浓度(mg/mL);y1、y2、y3、y4、y5分别为溶液吸光度、芦丁、牡荆素、金丝桃苷、槲皮素峰面积。 -
[1] Chinese Pharmacopoeia Commission. Pharmacopoeia of the people's republic of China (Vol. I)[S]. Beijing: China Medicine Science and Technology Press, 2020: 33.
[2] JIA Y Z, WU Q, YANG X, et al. Quality evaluation of Crataegi fructus from different habitats based on grey correlation-TOPSIS method[J]. Chinese Traditional and Herbal Drugs,2021,52(23):7317−7322.
[3] WANG Y L, LI J S, LI M Y, et al. Immunoregulatory effect of hawthorn flavonoids on spleen lymphocytes in mic[J]. Science and Technology of Food Industry,2019,40(20):127−132.
[4] LI T P, FU S Y, HUANG X, et al. Biological properties and potential application of hawthorn and its major functional components: A review[J]. Journal of Functional Foods,2022,90:104988. doi: 10.1016/j.jff.2022.104988
[5] ZHAO S, HAO E W, DU Z C, et al. Research progress on chemical constituents, pharmacological effects and quality control of Mali fructus[J]. Chinese Traditional Patent Medicine,2020,42(1):169−175.
[6] LI L, GAO X L, LIU J G, et al. Hawthorn pectin: Extraction, function and utilization[J]. Current Research in Food Science,2021,4:429−435. doi: 10.1016/j.crfs.2021.06.002
[7] LIU F, ZHANG X S, JI Y. Total flavonoid extract from hawthorn (Crataegus pinnatifida) improves inflammatory cytokines-evoked epithelial barrier deficit[J]. Medical Science Monitor,2020,26:920170.
[8] WANG H, ZHANG Z S, GUO Y, et al. Hawthorn fruit increases the antioxidant capacity and reduces lipid peroxidation in senescence-accelerated micet[J]. European Food Research and Technology,2011,232(5):743−751. doi: 10.1007/s00217-011-1435-7
[9] XIE W H, SUN C, LIU S M. Effect of hawthorn flavanone on blood-fat and expression of lipogenesis and lipolysis genes of hyperlipidemia model mouse[J]. China Journal of Chinese Materia Medica,2009,34(2):224−229.
[10] ZHAO P, QIU S, HOU Z L, et al. Sesquineolignans derivatives with neuroprotective activity from the fruits of Crataegus pinnatifida[J]. Fitoterapia,2020,143:104591. doi: 10.1016/j.fitote.2020.104591
[11] ORTEGA-ZAMORA C, GONZÁLEZ-SÁLAMO J, HERNÁNDEZ-BORGES J. Deep eutectic solvents application in food analysis[J]. Molecules,2021,26(22):6846. doi: 10.3390/molecules26226846
[12] MUSARURWA H, NIKITA TAWANDA T. Deep eutectic solvent-based dispersive liquid-liquid micro-extraction of pesticides in food samples[J]. Food Chemistry,2021,342:127943. doi: 10.1016/j.foodchem.2020.127943
[13] HE R Y, WANG F, SU X J, et al. Optimization of extraction process of Polygonatum odoratum polysaccharide by deep eutectic solvent and its antioxidant and anti glycosylation activities[J]. Food and Fermentation Industries,2022,48(8):190−198.
[14] ZUO J, MA P, GENG S, et al. Optimization of the extraction process of flavonoids from Trollius ledebouri with natural deep eutectic solvents[J]. Journal of Separation Science,2022,45(3):717−727. doi: 10.1002/jssc.202100802
[15] ZHANG X, ZHANG Q, XUE H, et al. A green and highly efficient method of extracting polyphenols from Lilium davidii var. unicolor Salisb using deep eutectic solvents[J]. Chemical Engineering Communications,2020,209:271−280.
[16] YANG Z. Natural deep eutectic solvents and their applications in biotechnology[J]. Advances in Biochemical Engineering/Biotechnology,2019,168:31−59.
[17] MANSINHOS I, GONÇALVES S, RODRÍGUEZ-SOLANA R, et al. Ultrasonic-assisted extraction and natural deep eutectic solvents combination: A green strategy to improve the recovery of phenolic compounds from Lavandula pedunculata subsp. lusitanica (Chaytor) Franco[J]. Antioxidants,2021,10(4):582. doi: 10.3390/antiox10040582
[18] WANG G, CUI Q, YIN L J, et al. Efficient extraction of flavonoids from Flos sophorae immaturus by tailored and sustainable deep eutectic solvent as green extraction media[J]. Journal of Pharmaceutical and Biomedical Analysis,2019,170:285−294. doi: 10.1016/j.jpba.2018.12.032
[19] WANG X J, YU Y W, CUI M L, et al. Study on extraction of total flavonoids from red jujube by deep eutectic solvent and ultrasonic wave[J]. China Condiment,2022,47(1):36−39.
[20] YANG Y, LIU Y, FENG W H, et al. HPLC fingerprint and content determination of three principal components in seeds of Crataegus pinnatifida[J]. China Journal of Chinese Materia Medica,2021,47(11):3000−3006.
[21] HOU Y T, ZHANG X Y, SU J F, et al. Optimization of enzymatic-assisted extraction of haw pectin by response surface methodology and its anti-oxidation/glycation activities in vitro[J]. Science and Technology of Food Industry,2018,39(22):180−186.
[22] HAO H, LIN L, LIU S, et al. Deep eutectic solvent-based microwave-assisted extraction for the chromatographic analysis of bioactive flavonoids in Spirodela polyrrhiza[J]. Journal of Chromatographic Science,2021,60(5):501−510.
[23] ZHANG H, HAO F, YAO Z, et al. Efficient extraction of flavonoids from Polygonatum sibiricum using a deep eutectic solvent as a green extraction solvent[J]. Microchemical Journal,2022,175:107168. doi: 10.1016/j.microc.2021.107168
[24] LIANG J, ZENG Y, WANG H, et al. Extraction, purification and antioxidant activity of novel polysaccharides from Dendrobium officinale by deep eutectic solvents[J]. Natural Product Research,2019,33(22):3248−3253. doi: 10.1080/14786419.2018.1471480
[25] MACLEAN A M G, SILVA Y, JIAO G, et al. Ultrasound-assisted extraction of anthocyanins from Haskap (Lonicera caerulea L.) berries using a deep eutectic solvent (DES) DES extraction of anthocyanins from Haskap berries[J]. Food Technology and Biotechnology,2021,59(1):56−62. doi: 10.17113/ftb.59.01.21.6869
[26] WANG R, ZHANG W, HE R, et al. Customized deep eutectic solvents as green extractants for ultrasonic-assisted enhanced extraction of phenolic antioxidants from Dogbane leaf-tea[J]. Foods,2021,10(11):2527. doi: 10.3390/foods10112527
[27] YUE X, XU F, LV P, et al. Analysis of antioxidant capacity of chromones in Saposhnikoviae radix obtained by ultrasonic-assisted deep eutectic solvents extraction[J]. Journal of Analytical Methods in Chemistry,2020,2020:8875788.
[28] LEKSAWASDI N, TAESUWAN S, PROMMAJAK T, et al. Ultrasonic extraction of bioactive compounds from green soybean pods and application in green soybean milk antioxidants fortification[J]. Foods,2022,11(4):588−588. doi: 10.3390/foods11040588
[29] ZHANG X, SU J, CHU X, et al. A green method of extracting and recovering flavonoids from Acanthopanax senticosus using deep eutectic solvents[J]. Molecules,2022,27(3):923. doi: 10.3390/molecules27030923
[30] TONG X, YANG J, ZHAO Y, et al. Greener extraction process and enhanced in vivo bioavailability of bioactive components from Carthamus tinctorius L. by natural deep eutectic solvents[J]. Food Chemistry,2021,348:129090. doi: 10.1016/j.foodchem.2021.129090
[31] CHEN X G, XU M, MA X P, et al. Study on the extraction of total flavonoids from hawthorn leaves by deep eutectic solvent[J]. Guangxi Journal of Light Industry,2021,37(12):27−30.





 下载:
下载:











 下载:
下载:
