Optimization of Preparation Process and Stability Investigation of Astaxanthin Vesicles
-
摘要: 目的:为提高虾青素在水相中的分散性,制备虾青素囊泡并考察其在不同环境条件下的稳定性。方法:以不饱和脂肪酸(花生四烯酸)及虾青素为原料,采用薄膜水化法制备了虾青素囊泡,并通过单因素实验和响应面试验优化虾青素囊泡的制备工艺,考察了虾青素囊泡的形态、粒径大小及分布、电位、包封率及贮藏、氧化、体外消化稳定性。结果:虾青素囊泡的最佳制备条件为:虾青素添加量0.14 mg/mL、表面活性剂与脂肪酸比例为1:1、表面活性剂亲水亲油平衡值为7、磷酸缓冲溶液pH为7.0、水化时间为21 min,此时,虾青素囊泡包封率平均值为89.58%±1.47%。透射电子显微镜及粒径分析均表明,虾青素囊泡具有较好的球形结构,平均粒径为(131.74±2.74)nm、PDI为0.25±0.01、Zeta电位为(−38.52±2.31)mV。稳定性实验结果表明16 d贮藏后虾青素囊泡在4 ℃、避光贮藏稳定性较好,与液体状态下贮藏相比,在冻干复溶后虾青素囊泡中虾青素保留率基本一致,且对盐离子有一定的耐受力。经过16 d贮藏后,油溶虾青素的POV和TBARS均为虾青素囊泡的两倍,经体外消化后,二者在小肠消化阶段结束后消化保留率分别为44.19%±2.21%、74.99%±4.37%。结论:本实验制备的虾青素囊泡粒径大小合适、分散性好、包封率较高、稳定性较好,可为开发虾青素衍生产品提供参考依据。Abstract: Objective: To enhance the dispersion of astaxanthin in aqueous phases, astaxanthin-loaded vesicles were fabricated, and their stability under various environmental conditions was examined. Methods: Using unsaturated fatty acid (arachidonic acid) and astaxanthin as raw materials, astaxanthin liposomes were prepared by thin film hydration method. The preparation process of astaxanthin liposomes was optimized through single-factor and response surface experiments, investigating the morphology, particle size and distribution, Zeta potential, encapsulation efficiency, and stability during storage, oxidation, and in vitro digestion. Results: The optimal conditions for preparing astaxanthin liposomes were as follows: Astaxanthin concentration of 0.14 mg/mL, surfactant to fatty acid ratio of 1:1, hydrophilic-lipophilic balance of surfactant of 7, phosphate buffer solution pH of 7.0, and hydration time of 21 min. Under these conditions, the average encapsulation efficiency of astaxanthin liposomes was 89.58%±1.47%. Transmission electron microscopy and particle size analysis showed that astaxanthin liposomes had a spherical structure with an average particle size of (131.74±2.74) nm, a PDI of 0.25±0.01, and a Zeta potential of (−38.52±2.31) mV. Stability experiments demonstrated that after 16 days of storage at 4 ℃ in the dark, astaxanthin liposomes showed good stability. The retention rate of astaxanthin in liposomes after freeze-drying and reconstitution was similar to that in liquid state, and they exhibited some tolerance to salt ions. After 16 days of storage, the peroxide value (POV) and TBARS of oil-soluble astaxanthin were twice those of astaxanthin liposomes. After in vitro digestion, the digestion retention rate of astaxanthin of the two was 44.19%±2.21% and 74.99%±4.37% at the end of small intestine digestion. Conclusion: The astaxanthin liposomes prepared in this experiment had suitable particle size, good dispersibility, high encapsulation efficiency, and good stability, providing a reference for the development of astaxanthin-derived products.
-
Keywords:
- astaxanthin /
- vesicles /
- preparation conditions /
- structural characterization /
- stability
-
虾青素(3,3’-二羟基-4,4’-二酮-β,β’胡萝卜素,astaxanthin,AST)是一种类胡萝卜素,属于萜烯类不饱和化合物[1]。在天然物质中AST具有极强的抗氧化活性[2],同时可对癌症[3]、炎症[4]、心血管病[5]等疾病具有预防和抵抗作用,因此受到人们越来越多的关注。然而,AST易受到光照、温度等影响发生氧化降解,导致其化学结构不稳定,从而影响生物活性及生理功能,因此在实际应用中受到限制。许多科学家尝试利用运载体系来解决AST不稳定的问题,多种运载体系如脂质体[6]、乳液[7]、纳米颗粒[8]等均已被证明可以提高AST的稳定性。但乳液和脂质体最大的缺点在于热力学不稳定,易发生药物泄露,而形成纳米颗粒的一些聚合物价格昂贵,且制备工艺复杂。
脂肪酸囊泡(fatty acid vesicles,FAV)是由脂肪酸的盐溶液通过自组成而形成的封闭脂质双层的胶体悬浮液,具有亲水和亲油特性[9]。由双亲性分子组合形成的FAV化学结构相对稳定,同时原料来源丰富且便宜,具有较高的可选择性[9];其次,脂肪酸囊泡是抗炎药物输送的潜在抗炎载体[10],此外,由于其在水相中的高溶解度,可以确保FAV在生物膜中分离效果良好[11]。因此FAV可以作为脂质体的替代品,可作为生物活性物质的包埋壁材,达到缓释的效果[12]。但FAV仅在水化介质pH为7~9范围才能形成囊泡,而加入非离子表面活性剂(脱水山梨醇脂肪酸酯)后囊泡的pH范围向弱酸性范围偏移,可与人体弱酸环境匹配[13−14]。研究发现油酸[15]、亚麻酸[16]、亚油酸[17]、癸酸[18]等均能形成类似脂质结构的脂肪酸囊泡,且能提高包埋物的稳定性。花生四烯酸(arachidonic acid,AA)是一种多不饱和脂肪酸,属于ω-6系列,对人体具有重要的生理功能作用,其广泛分布于动物界,花生四烯酸不仅对虾青素的吸收和生物可及性有促进作用[19],且负载虾青素后能够提高脂肪酸膜结构稳定性[6]。
本实验以虾青素为包埋对象,筛选虾青素脂肪酸囊泡(AST-FAV)包埋工艺并进行优化,制备AST-FAV。从贮藏、氧化、体外消化几方面考察AST-FAV稳定性,以期获得稳定性较好的AST-FAV,同时为囊泡在食品中的应用提供一定参考。
1. 材料与方法
1.1 材料与仪器
虾青素(纯度>96%) 陕西金康泰生物科技有限公司;虾青素标准品(纯度>98%)、过氧化氢异丙苯、1,1,3,3-四乙氧基丙烷 阿拉丁试剂上海有限公司;乙腈(色谱纯)、甲醇(色谱纯)、花生四烯酸(纯度40%) 上海麦克林生化科技有限公司;司盘60、吐温85 天津市富宇精细化工有限公司;无水乙醇、氯仿、氯化钡、硫酸亚铁、正丁醇、异丙醇、浓盐酸 分析纯,天津市天力化学试剂有限公司;氯化钠、硫酸氢铵、异辛烷、三氯乙酸 分析纯,天津市致远化学试剂有限公司;硫代巴比妥酸 分析纯,北京化工厂;人工唾液、人工胃液、人工肠液 上海源叶生物科技有限公司。
YRE-201D型旋转蒸发器、HH-WO2智能数显恒温水油浴锅、SHZ-DⅢ予华牌循环水真空泵 巩义市予华仪器有限责任公司;KQ-250DE型数控超声清洗器 昆山市超声仪器有限公司;DZF-6210BZ真空干燥箱 上海仪昕科学仪器有限公司;1260型高效液相色谱仪 安捷伦科技中国有限公司;TG16-WS台式高速离心机 湖南湘仪实验室仪器开发有限公司;Zetasizer Nano ZS90纳米粒径电位分析仪 英国Malvern公司;Spectrum Ⅱ傅里叶变换红外光谱仪(FTIR) 美国Perkin-Elmer公司;HT7800型透射电子显微镜(TEM) 美国FEI公司。
1.2 实验方法
1.2.1 虾青素囊泡的制备
采用薄膜水化-超声法制备囊泡[20]。用司盘60和吐温85配制不同亲水亲油平衡(hydrophile-lipophile balance,HLB)值的表面活性剂,将有机溶剂(氯仿:乙醇=3:2)、表面活性剂、花生四烯酸和虾青素加入圆底烧瓶中,轻摇至虾青素全部溶解于有机溶剂中。将圆底烧瓶安装在旋转蒸发仪上,30 ℃水浴,减压条件下将有机溶剂去除,直至圆底烧瓶底部形成橙红色膜,为防止有机溶剂残留,将圆底烧瓶置于25 ℃真空干燥箱过夜;往过夜后的圆底烧瓶中加入配制好的0.1 mol/L磷酸缓冲液20 mL于25 ℃ 40 W超声清洗仪中辅助处理一定时间,瓶底部所有薄膜再水化,从而形成0.15 mg/mL囊泡。水化完成后将形成的虾青素囊泡(AST-FAV)过0.45 μm滤膜。空白囊泡的制作过程与AST-FAV的制作过程一致,区别是不加AST。用花生油溶解虾青素最终形成浓度为0.15 mg/mL的油溶虾青素。
1.2.2 虾青素包封率的测定
1.2.2.1 虾青素标准曲线的建立
精密称取虾青素标准品1 mg,用甲醇溶解并定容至100 mL,用作后续实验的母液。用甲醇将母液稀释成不同浓度梯度(0、1、2、4、6、8、10 μg/mL)的工作液,过0.22 μm有机膜后按照下述色谱条件进样。
色谱条件:采用Agilent C18色谱柱(250 mm×4.6 mm×5 μm);检测器为紫外可见检测器;检测波长设置为474 nm;进样量为10 μL;流速为1 mL/min,运行时间5 min;柱温为25 ℃;流动相为甲醇:乙腈=9:1。
以峰面积y(mAU×S)为纵坐标,AST的质量浓度x(μg/mL)为横坐标,得到标准曲线为:y=201.18x+12.942,R2=0.9993。
1.2.2.2 AST包封率的计算
取1 mL已过0.45 μm滤膜的虾青素囊泡悬浮液及10 mL正己烷溶液至离心管中,超声30 min使其破乳,吸取1 mL于离心管中,用甲醇定容至10 mL,用1.2.2.1方法测定虾青素含量(c0)。另取1 mL虾青素囊泡悬浮液于离心管中,加入10 mL正己烷溶液,在8000 r/min离心20 min,萃取至正己烷层无色,然后分液分离出正己烷溶液,取1 mL置于离心管中用甲醇定容至10 mL,采用1.2.2.1方法测定游离虾青素含量(c1)。计算包封率,公式如下:
包封率(%)=c0−c1c0×100 (1) 式中:c0为虾青素囊泡中虾青素总含量,μg/mL;c1为虾青素囊泡中游离虾青素含量,μg/mL。
1.2.3 单因素实验优化
在固定条件:表面活性剂与脂肪酸比例为1:2,表面活性剂HLB值6,磷酸缓冲溶液pH6.8,水化时间为15 min的基础上,以AST-FAV包封率为指标,考察虾青素添加量(0.05、0.1、0.15、0.2、0.25 mg/mL)、表面活性剂与脂肪酸比例(1:3、1:2、1:1、3:2、2:1)、表面活性剂HLB值(5、6、7、8、9)、磷酸缓冲溶液pH(6.6、6.8、7.0、7.2、7.4)、水化时间(10、15、20、25、30 min)五个因素对AST-FAV包封率的影响,且后续因素的实验均在前一因素实验的较优结果上进行。
1.2.4 Box-Behnken响应面优化试验
结合单因素实验结果,选择对虾青素囊泡包封率影响较大的4个因素:输入指标为虾青素添加量(A)、表面活性剂与脂肪酸比例(B)、磷酸缓冲溶液pH(C)、水化时间(D),输出指标为AST-FAV包封率,表面活性剂HLB值7为固定因子,进行响应面试验设计。采用Box-Behnken响应面法进行工艺优化设计试验,因素及水平编码见表1。
表 1 Box-Behnken响应面因素及水平编码Table 1. Box-Behnken response surface factor and level coding水平 因素 A虾青素添加量
(mg/mL)B表面活性剂与
脂肪酸比例C磷酸缓冲
溶液pHD水化时间
(min)−1 0.1 1:2 6.8 15 0 0.15 1:1 7.0 20 1 0.2 3:2 7.2 25 1.2.5 结构表征
1.2.5.1 透射电子显微镜(TEM)
将在最佳条件下制备好的AST-FAV溶液稀释50倍后取一滴滴在铜网上,用滤纸将周围多余液体吸干,经自然干燥后再用质量分数2%的磷钨酸染色,干燥12 h,最后使用透射电子显微镜在200 kV电压下对AST-FAV形貌进行表征[21]。
1.2.5.2 傅里叶变换红外光谱(FTIR)
取适量空白花生四烯酸囊泡和虾青素囊泡悬浮液进行冷冻干燥制备得到冻干粉。分别取适量空白囊泡冻干粉和虾青素囊泡冻干粉,以质量比1:100加入溴化钾碾磨成粉末,然后压制成薄片,压片后进行傅里叶红外光谱仪分析测试。测试的条件分别为:分辨率2 cm−1;测试温度范围23~25 ℃;测量范围4000~400 cm−1;扫描次数32次[22]。
1.2.5.3 粒径、PDI、Zeta电位
取AST-FAV混悬液0.1 mL,蒸馏水稀释至5 mL,室温下采用粒度分析仪测定(粒径入射角165°),取2 mL装入马尔文比色皿中,采用纳米粒径电位分析仪测定囊泡的粒径分布、PDI及Zeta电位,平行3份,取平均值[23]。
1.2.6 虾青素囊泡稳定性考察
1.2.6.1 贮藏稳定性
将AST-FAV分别放置在不同温度(4、25、37 ℃)、光照(自然光、避光)、盐浓度(50、100、150、200、250 mmol/L)、冻溶稳定性(液体、冻干复溶),除温度及光照条件外其余均置于冰箱4 ℃避光存放,于第0、4、8、12、16 d取出,观察外观,测定保留率、平均粒径、PDI、Zeta电位,考察虾青素囊泡的贮藏稳定性。
保留率(%)=c1c0×100 (2) 式中:c1为虾青素囊泡贮藏一定时间后虾青素浓度,μg/mL;c0为新鲜虾青素囊泡中虾青素浓度,μg/mL。
1.2.6.2 氧化稳定性
为了测定贮藏过程中AST-FAV的氧化稳定性,用100 mL棕色容量瓶贮藏100 mL AST-FAV,在50 ℃恒温条件下加速氧化16 d。间隔4 d测定一次AST-FAV中初级和次级氧化产物。
初级氧化产物测定:参照Hu等[24]的方法,并稍作修改。将1.0 mL AST-FAV与5.00 mL异辛烷:异丙醇(2:1,v/v)试剂混合,涡旋3次共30 s,然后5000 r/min离心5 min。向2.80 mL甲醇:正丁醇(3:1,v/v)混合试剂中加入100.00 μL离心后的上清液、40.00 μL亚铁溶液(等量的0.132 mol/L氯化钡和0.144 mol/L硫酸亚铁制备)以及40.00 μL的3.94 mol/L硫氰酸铵溶液。避光反应20 min后,用紫外可见分光光度计在510 nm波长下测定吸光值。用1000 μg/mL过氧化氢异丙苯标准品制作标准曲线。标准曲线为y=0.421x−0.0553,R2=0.9992。
次级氧化产物测定:参考Fioramonti等[25]的测定方法。按照体积比1:2比例加入AST-FAV和TBA试剂(将15 g三氯乙酸+375 mg硫代巴比妥酸+1.76 mL浓盐酸加入少量蒸馏水溶解后,定容至100 mL,50 ℃下静置30 min,冷却后使用)在试管中混合,并置于沸水浴中15 min。将管冷却至室温10 min,然后离心(12000 r/min,15 min),收集上清液,用紫外可见分光光度计测定波长532 nm处的吸光度。根据1,1,3,3-四乙氧基丙烷制成的标准曲线测定样品中丙二醛的含量。标准曲线为y=0.539x+0.0684,R2=0.9990。
1.2.6.3 体外消化稳定性
参照Liu等[26]方法进行体外模拟消化实验。口腔阶段:将模拟口腔唾液与AST-FAV样品各取10 mL混合,随后将混合液pH调至6.8,在200 r/min 37 ℃条件下连续消化10 min。胃部阶段:将模拟胃液与经过口腔消化后的样品等量混合,随后将混合溶液pH调至2.5,在100 r/min 37 ℃条件下连续消化2 h。小肠阶段:将胃部消化后的混合溶液用质量分数为0.1 mol/L的NaOH溶液调节pH至7.0,随后加入10 mL模拟肠液。随后,将混合体系继续在37 ℃ 100 r/min的转速连续反应5 min及2 h。
取虾青素囊泡消化的各个阶段(初始、口腔10 min、胃2 h、肠5 min、肠2 h)的消化液样品,随后,使用高效液相色谱,根据1.2.2.1的条件,计算各时间段溶液中虾青素的含量。根据公式(3)计算虾青素消化过程中各个样品中消化保留率及粒径、电位的改变情况。
消化保留率(%)=c1c0×100 (3) 式中:c1为消化各阶段消化液中虾青素的浓度,μg/mL;c0为新鲜虾青素囊泡中虾青素浓度,μg/mL。
1.3 数据处理
所有实验平行测定三次,数据以平均值±标准差(SD)表示,采用Design-Expert 12进行响应面结果分析,使用Origin 2021软件进行绘图并作数据统计分析。
2. 结果与分析
2.1 单因素实验结果
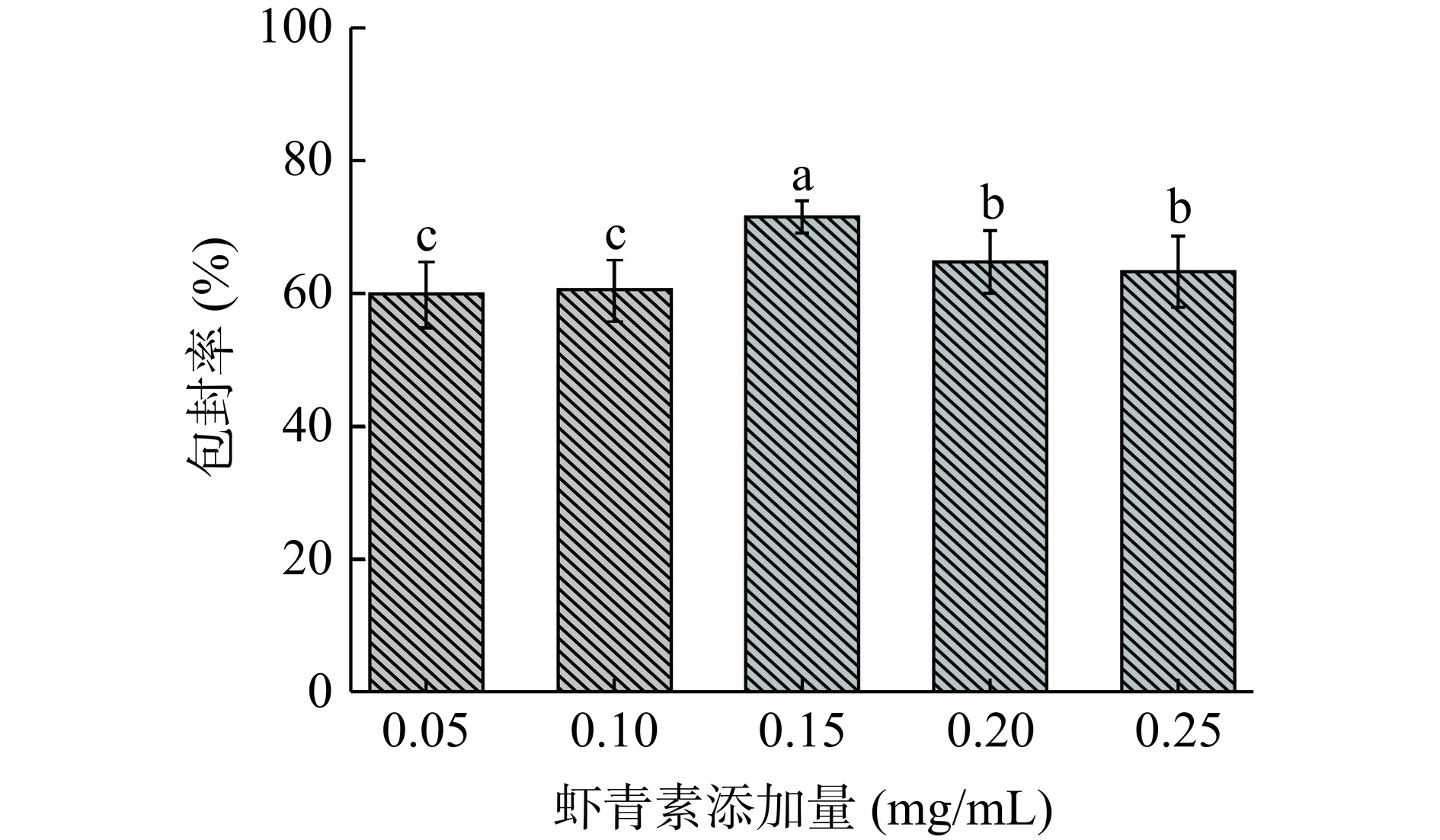
2.1.1 虾青素添加量对包封率的影响
不同虾青素添加量对包封率的影响如图1所示。如图可知,不同虾青素添加量对包封率的影响呈先上升后下降趋势。虾青素用量低于0.15 mg/mL时,包封率随虾青素添加量的增大而增大,可能是由于加入虾青素的量小于FAV最大容纳量[27];虾青素添加量大于0.15 mg/mL时,囊泡本身的负载能力是有限的,FAV内虾青素达到饱和,过量的活性物质会影响包封率,进而导致包封率急剧下降[28]。当添加量为0.15 mg/mL时,包封率达到最大值71.52%,与其他各水平之间存在显著性差异(P<0.05)。因此,确定虾青素的最佳添加量为0.15 mg/mL。
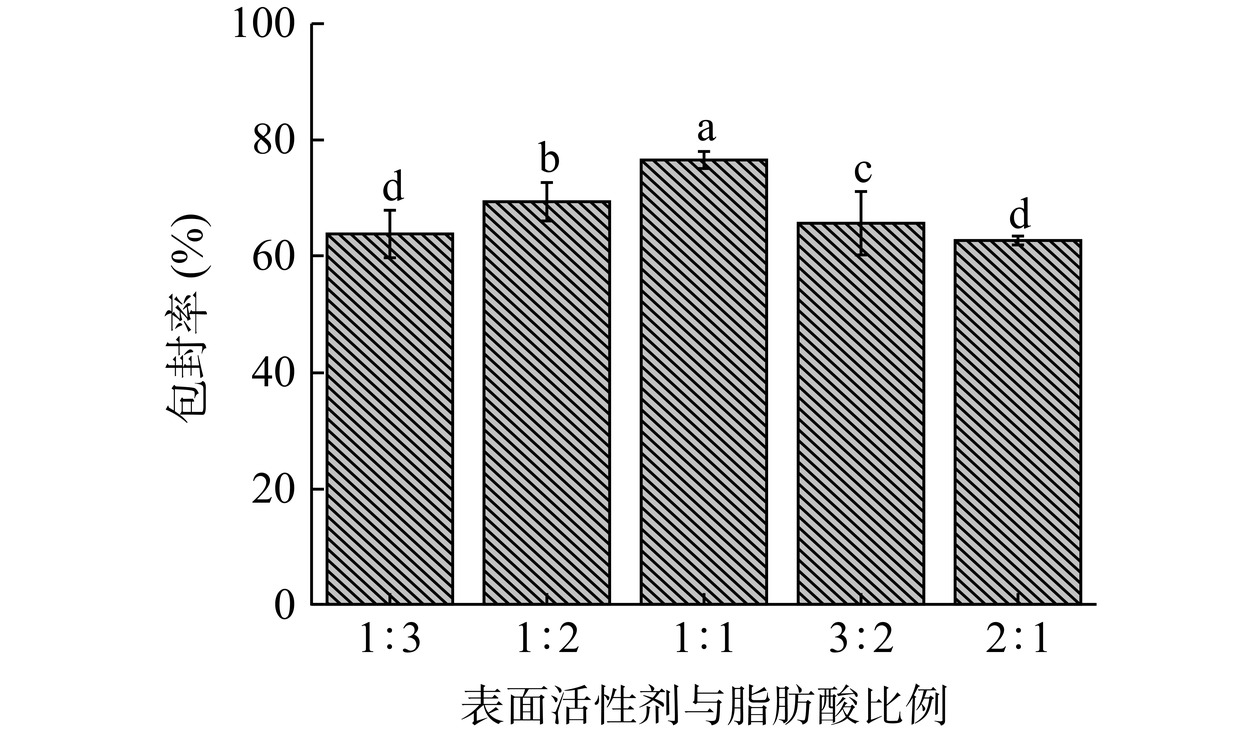
2.1.2 表面活性剂与脂肪酸比例对包封率的影响
不同表面活性剂与脂肪酸比例对包封率的影响如图2所示。由图可知,当添加不同表面活性剂与脂肪酸比例时,包封率呈先增加后减少趋势。当表面活性剂与脂肪酸比例小于1:1时,此时表面活性剂用量小于脂肪酸用量,导致囊泡的流动性较强,虾青素容易泄露,从而包封率下降[29];而当表面活性剂与脂肪酸比例大于1:1时,此时表面活性剂用量大于脂肪酸用量而包封率也随之下降,可能是因为过多的表面活性剂占据了FAV的内部空间、导致虾青素不能进入脂肪酸囊泡内部空间,导致包封率降低[28];当表面活性剂与脂肪酸比例为1:1时,虾青素囊泡的包封率为76.49%,与其他各水平之间差异显著(P<0.05)。因此,确定表面活性剂与脂肪酸比例为1:1。
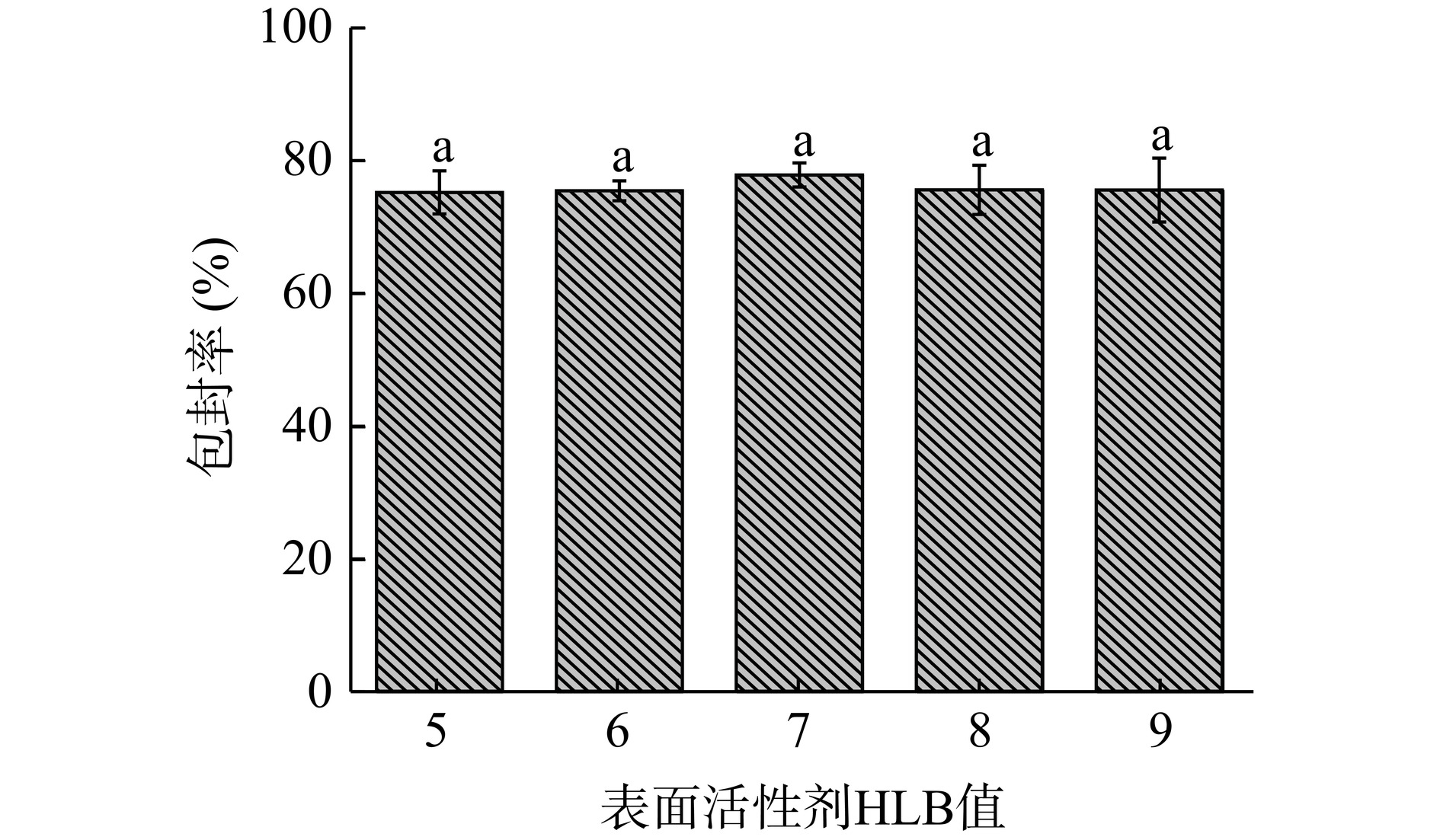
2.1.3 表面活性剂HLB值对包封率的影响
不同表面活性剂HLB值对包封率的影响如图3所示。HLB值在5和9之间的表面活性剂可以形成囊泡,表面活性剂HLB值在此范围内可以使其在虾青素和水溶液的界面上更好地排列,从而形成的囊泡包封率较高[30]。当表面活性剂HLB值为7时,此时虾青素囊泡的包封率最大77.66%,但整体与表面活性剂HLB值为5~9时差异不显著(P>0.05)。由于表面活性剂HLB值为7时,表面活性剂在虾青素表面吸附量最大,因此包封率最高,HLB值大于7时,亲水性增强,界面张力变大,导致包封率下降[31]。因此,确定表面活性剂HLB值为7。
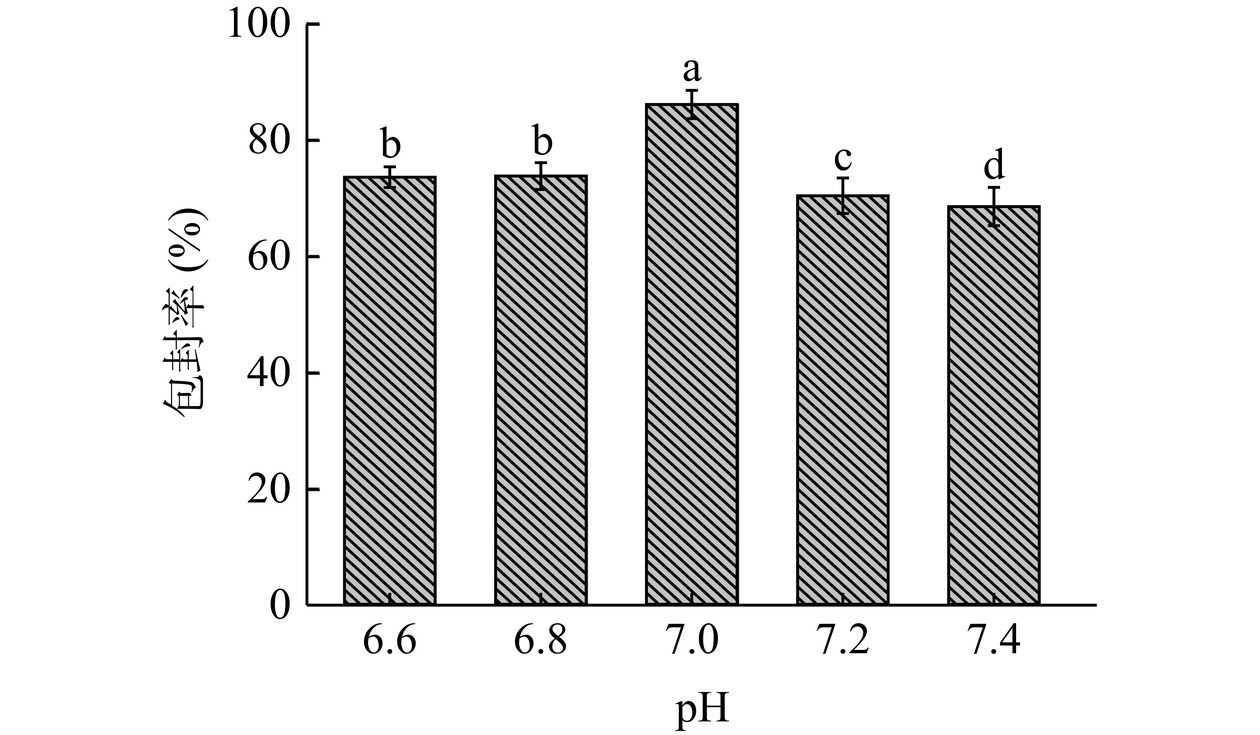
2.1.4 磷酸缓冲溶液pH对包封率的影响
不同磷酸缓冲溶液pH对包封率的影响如图4所示。在磷酸缓冲溶液的pH为6.6~7.4范围内,虾青素囊泡包封率先增大后减小。当pH为7.0时,虾青素囊泡的包封率最高,达到85.95%,与其他各水平之间具有显著性差异(P<0.05)。当pH大于或小于7.0时,可能是因为脂肪酸在H+或OH−存在下不稳定容易发生水解反应,导致虾青素外泄,导致包封率降低[32];此外,磷酸缓冲溶液的pH还能够通过改变AST-FAV表面的带电性质而改变虾青素囊泡的通透性,导致虾青素外漏[32]。因此,确定磷酸缓冲溶液pH为7.0。
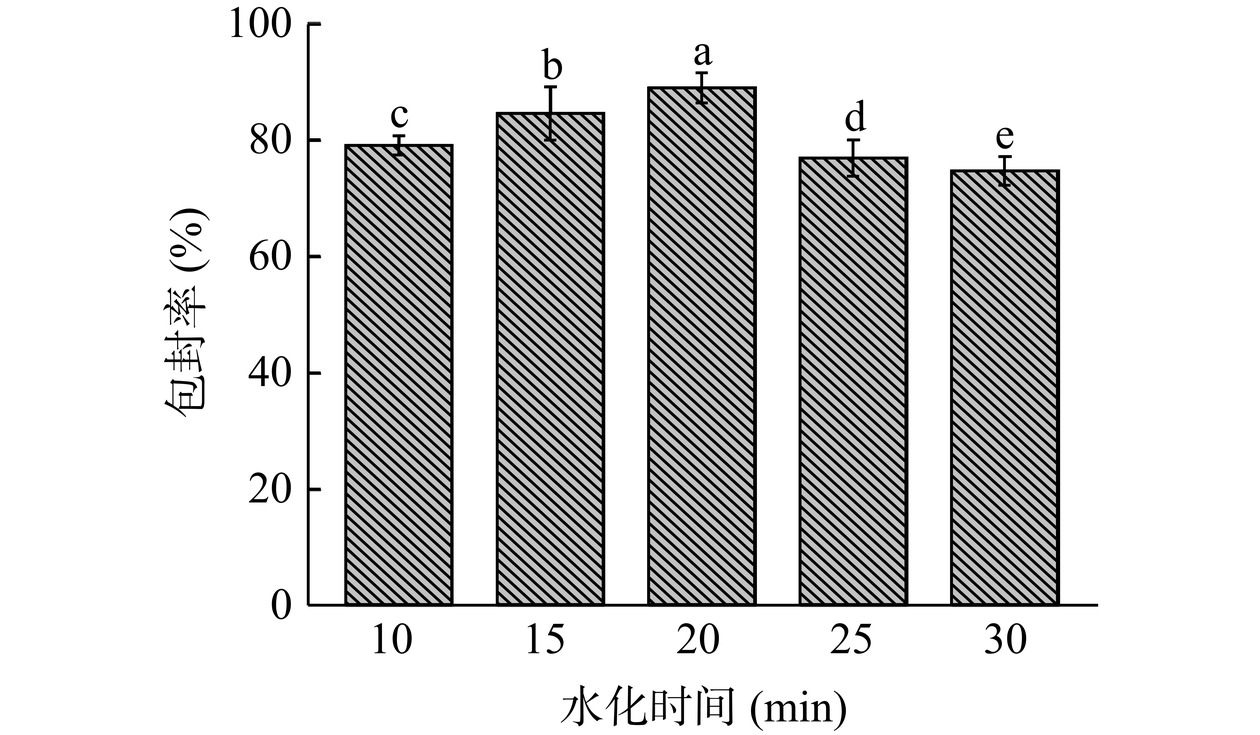
2.1.5 水化时间对包封率的影响
水化时间对包封率的影响如图5所示。由图可知,随着水化时间的延长虾青素囊泡的包封率先升高后降低。当水化时间为20 min时,包封率最高88.72%,且水化时间各水平对虾青素囊泡包封率具有显著影响(P<0.05)。这是由于水化时间在合适范围内可以起到乳化稳定作用[33]。当水化时间小于20 min,水化时间对包封率起到促进作用;当水化时间大于20 min,水化时间过长会导致包封率下降可能是因为水化过程中使用超声辅助,超声时间过长而导致整个溶液运动速率加快导致环境温度升高,引起AST-FAV的破裂,导致虾青素从脂肪酸囊泡中流出,包封率随之下降[34]。因此,确定水化时间为20 min。
2.2 虾青素囊泡制备的响应面试验
2.2.1 响应面试验结果
根据单因素实验结果,结合Box-Behnken的试验设计原理,用4因素3水平响应面分析法优化制备条件。随机设计了30组试验,其中中心点试验6个,用以估计试验误差。以A虾青素添加量、B表面活性剂与脂肪酸比例、C磷酸缓冲溶液pH、D水化时间为自变量,以脂肪酸囊泡包封率为响应值,响应面试验结果见表2。
表 2 响应面试验结果Table 2. Results of response surface experiment试验号 A B C D 包封率(%) 1 −1 −1 0 0 73.21 2 1 1 0 0 60.92 3 0 0 0 0 89.65 4 0 0 1 1 84.51 5 0 0 −1 −1 83.72 6 0 0 1 −1 75.62 7 0 0 −1 1 80.93 8 0 0 0 0 89.61 9 1 −1 0 0 69.12 10 −1 1 0 0 68.52 11 0 0 0 0 87.41 12 0 −1 1 0 78.15 13 0 −1 −1 0 84.12 14 1 0 0 −1 75.51 15 1 0 0 1 73.92 16 −1 0 0 −1 71.51 17 0 0 0 0 90.82 18 0 1 1 0 70.61 19 0 1 −1 0 77.62 20 −1 0 0 1 79.72 21 −1 0 −1 0 82.48 22 0 1 0 −1 75.85 23 0 0 0 0 88.27 24 0 0 0 0 88.72 25 0 −1 0 −1 80.62 26 −1 0 1 0 75.73 27 0 −1 0 1 84.51 28 1 0 1 0 75.81 29 1 0 −1 0 73.29 30 0 1 0 1 79.39 2.2.2 模型拟合与方差分析
根据表2中数据采用Design-Expert12统计分析软件进行数据分析,得到包封率对虾青素添加量(A)、表面活性剂与脂肪酸比例(B)、磷酸缓冲溶液pH(C)、水化时间(D)的二次多项式拟合,对二次多项式拟合方程中各项系数分别进行方差分析。
二次多项式拟合:Y=88.58−2.05A−2.74B−2.31C+1.51D−0.88AB+2.32AC−1.95AD−0.76BC−0.087BD+2.92CD−10.63A2−8.02B2−3.02C2−2.37D2,P<0.0001,R2=0.9461。
从表3可以看出,模型P<0.0001,达到极显著水平。分析4个因素对虾青素囊泡包封率的影响,一次项A、B、C及A2、B2、C2、D2在0.01水平上对包封率有极显著影响,而一次项D、交互项AC、AD、CD在0.05水平上对包封率影响显著。用该模型进行合理预测,结果表明,4个因素对包封率的影响顺序由小到大依次为D<C<A<B。失拟项P值为0.2495>0.05,失拟项差异不显著,表明该模型的真实值与预测值之间具有较高的相关性,对实验评价对象的影响不显著,说明该方程模拟较好,可以初步评估该方程具有一定的可靠性。R2=0.9642,调整后R2=0.9256,响应值的变异系数(C.V.)为2.58%,说明实验可靠性较高,可信。综上,说明该模型拟合程度较好,可用来分析和预测虾青素囊泡的制备工艺。
表 3 方差分析结果Table 3. Results of variance analysis变异来源 平方和 自由度 均方值 F值 P值 显著性 模型 1459.09 14 104.22 25.00 <0.0001 ** A 42.56 1 42.56 10.21 0.0070 ** B 112.98 1 112.98 27.10 0.0002 ** C 39.35 1 39.35 9.44 0.0089 ** D 33.84 1 33.84 8.12 0.0137 * AB 3.08 1 3.08 0.74 0.4056 AC 21.48 1 21.48 5.15 0.0409 * AD 24.01 1 24.01 5.76 0.0321 * BC 0.27 1 0.27 0.065 0.8029 BD 0.031 1 0.031 7.347E-003 0.9330 CD 34.11 1 34.11 8.18 0.0134 * A2 836.83 1 836.83 200.76 <0.0001 ** B2 459.34 1 459.34 110.20 <0.0001 ** C2 69.82 1 69.82 16.75 0.0013 ** D2 53.31 1 53.31 12.79 0.0034 ** 残差 54.19 13 4.17 失拟项 48.27 10 4.83 2.45 0.2496 ○ 误差项 5.92 3 1.97 总和 1554.97 29 注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01;○表示差异不显著,P>0.05。 2.2.3 响应面分析
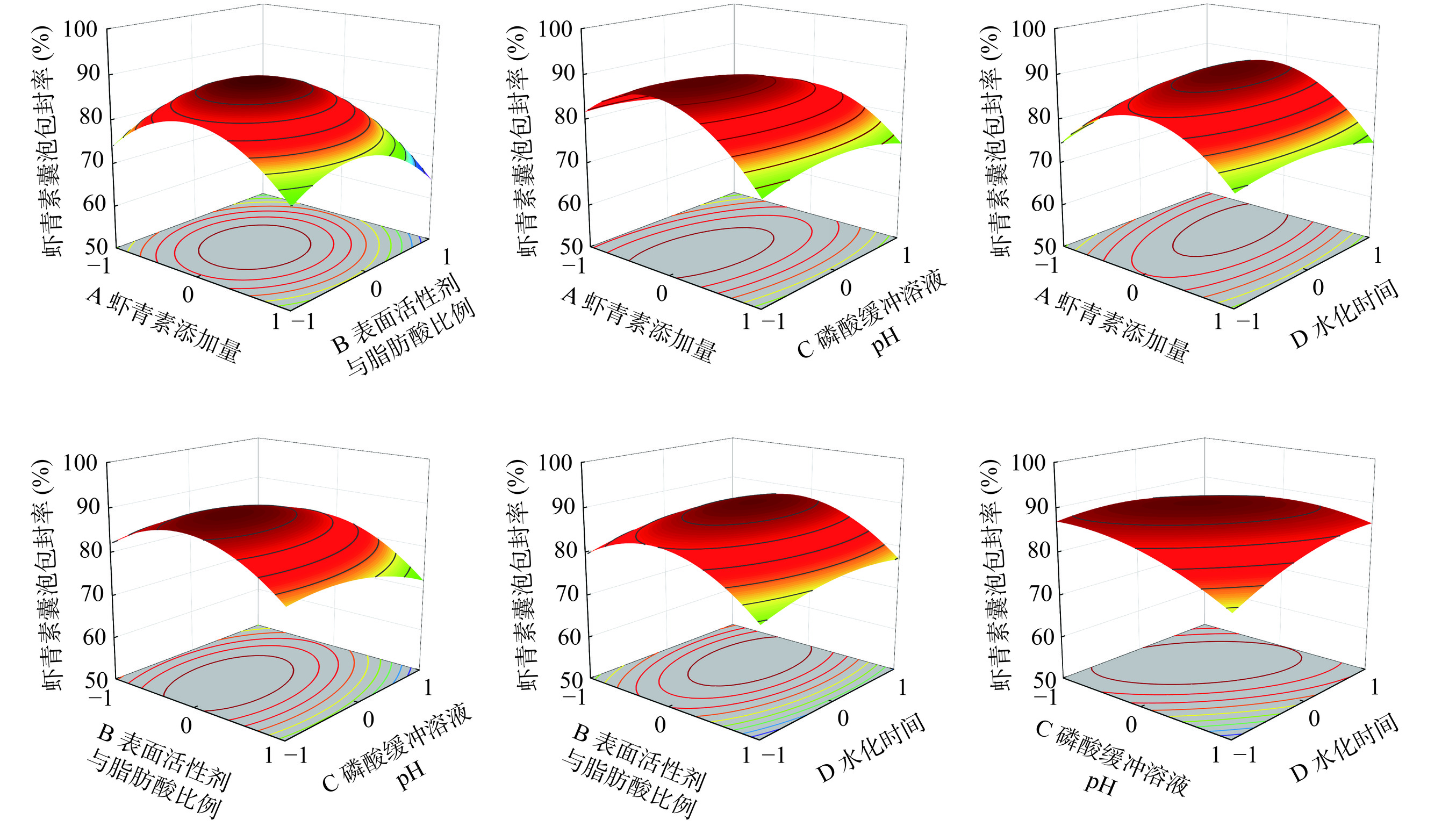
采用Design-Expert 12软件绘制虾青素添加量(A)、表面活性剂与脂肪酸比例(B)、磷酸缓冲溶液pH(C)、水化时间(D)之间的三维曲面图,结果如图6所示。
由图6结合表3可知,两因素交互作用中磷酸缓冲溶液pH与水化时间(CD)之间交互影响最大(P=0.0134<0.05),虾青素添加量与水化时间(AD)影响次之。综上,两因素对应的曲线中对虾青素囊泡的包封率影响由大到小依次为磷酸缓冲溶液pH与水化时间(CD)>虾青素添加量与水化时间(AD)>虾青素添加量与磷酸缓冲溶液pH(AC)>虾青素添加量与表面活性剂与脂肪酸比例(AB)>表面活性剂与脂肪酸比例与磷酸缓冲溶液pH(BC)>表面活性剂与脂肪酸比例与水化时间(BD)。
2.2.4 验证实验结果
经Design-Expert 12软件分析结果,虾青素囊泡制备的最佳参考工艺条件为虾青素添加量0.144 mg/mL、表面活性剂与脂肪酸比例为0.91:1、磷酸缓冲溶液pH6.95、水化时间21.25 min,此时包封率预测值为89.86%。根据软件预测最佳制备条件结合实验过程中实际可操作性进行修改,调整工艺为虾青素添加量0.140 mg/mL、表面活性剂与脂肪酸比例为1:1、磷酸缓冲溶液pH为7.0、水化时间为21 min条件下进行3次平行验证实验,虾青素囊泡包封率平均值为89.58%±1.47%。真实值与预测值接近,说明该回归模型优化虾青素囊泡制备工艺是有效的。因此,应用此工艺条件进行后续实验。
2.3 虾青素囊泡的表征
2.3.1 透射电子显微镜(TEM)
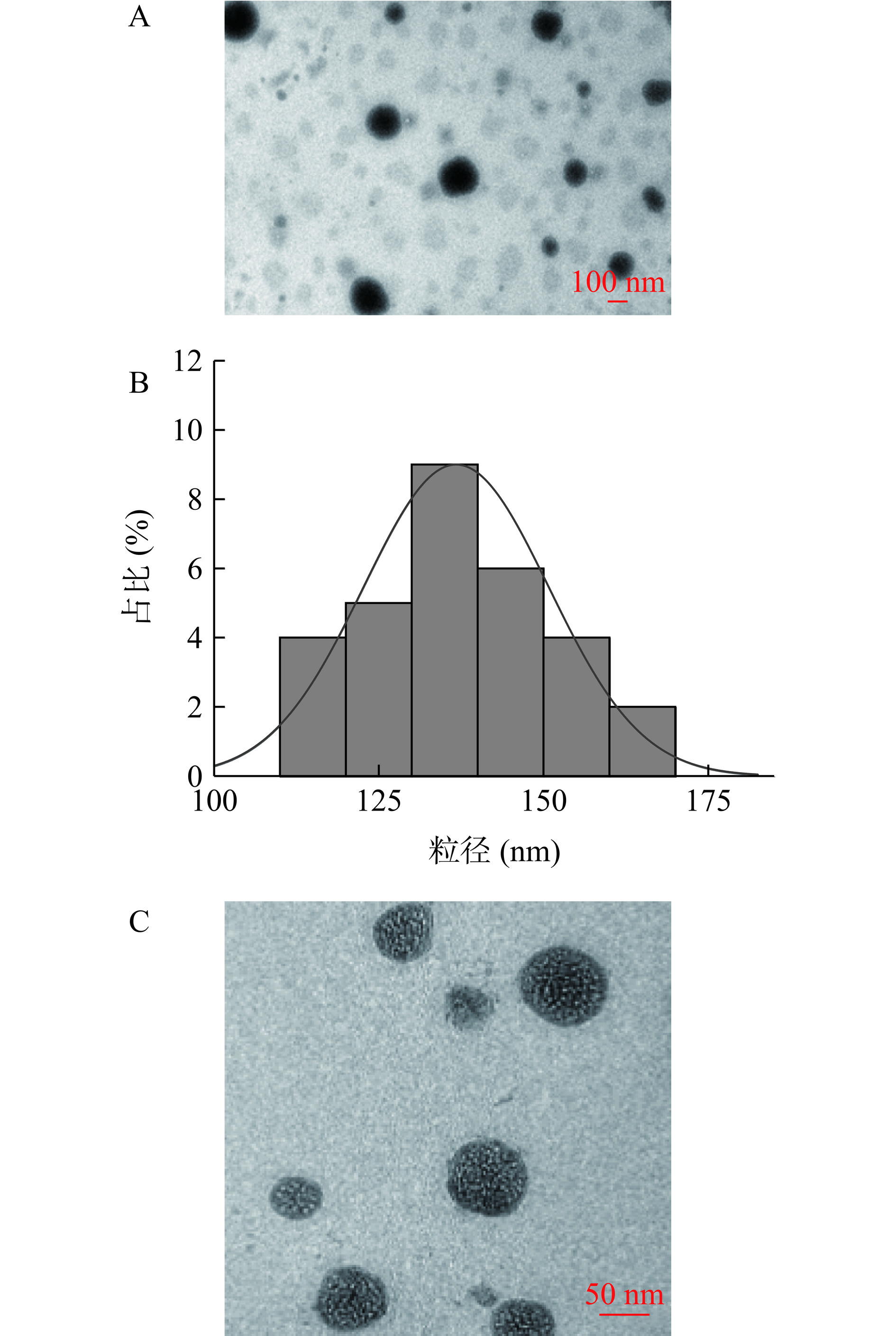
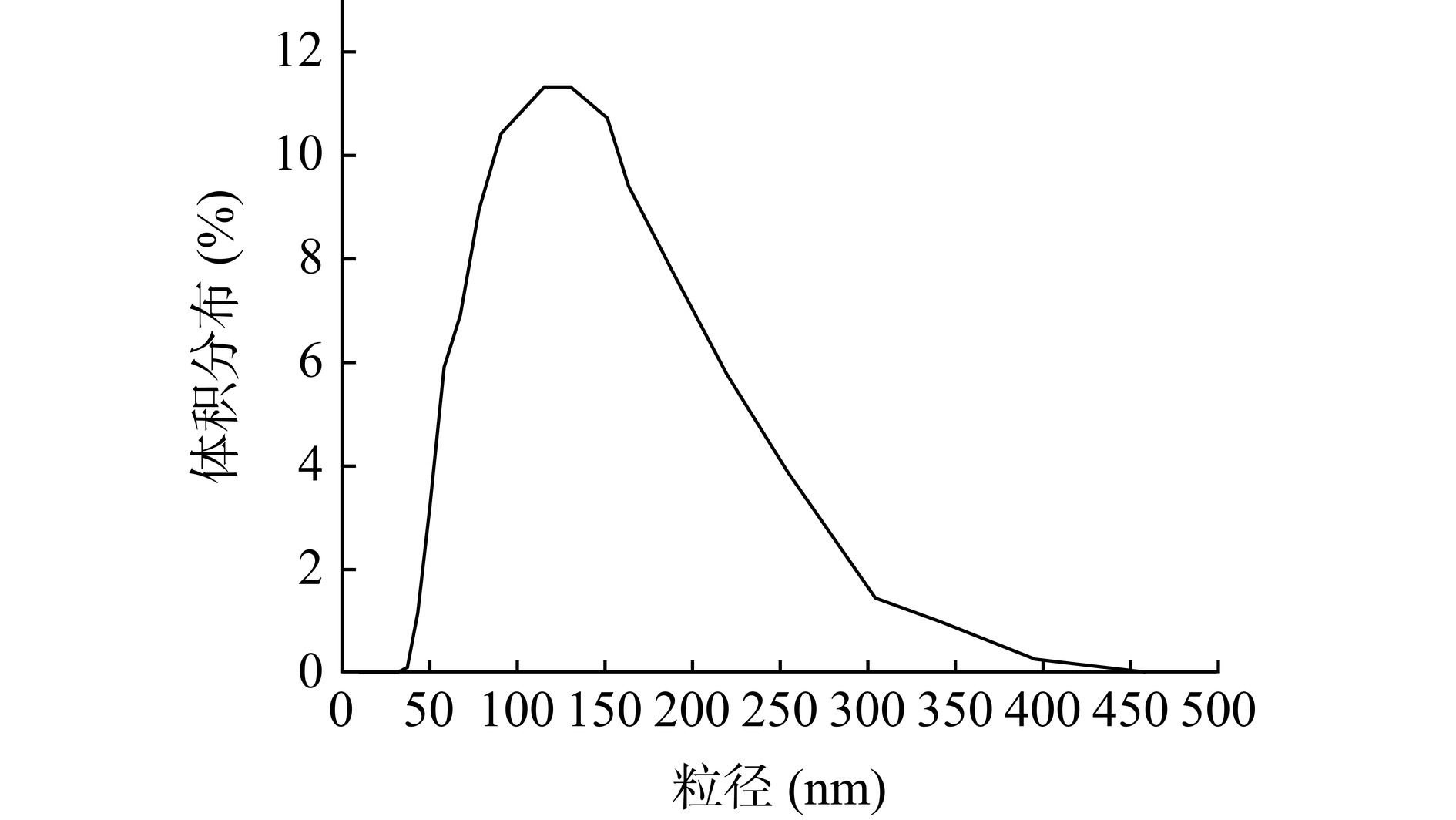
虾青素囊泡的TEM如图7所示,虾青素囊泡(图7A)得到了类似的球形囊泡,与空囊泡的TEM(图7C)相比,负载虾青素的囊泡核心颜色比外层深,这可能是由于囊泡将虾青素有效包裹于内部[35],而空囊泡中内部则被表面活性剂、水分子占据。虾青素囊泡的平均粒径为136.73 nm;粒径分布图(图7B)所示虾青素囊泡的粒径尺寸范围为110~160 nm。通过上述图可以看出虾青素囊泡呈球形且大小分布均匀。
2.3.2 傅里叶变换红外光谱(FTIR)
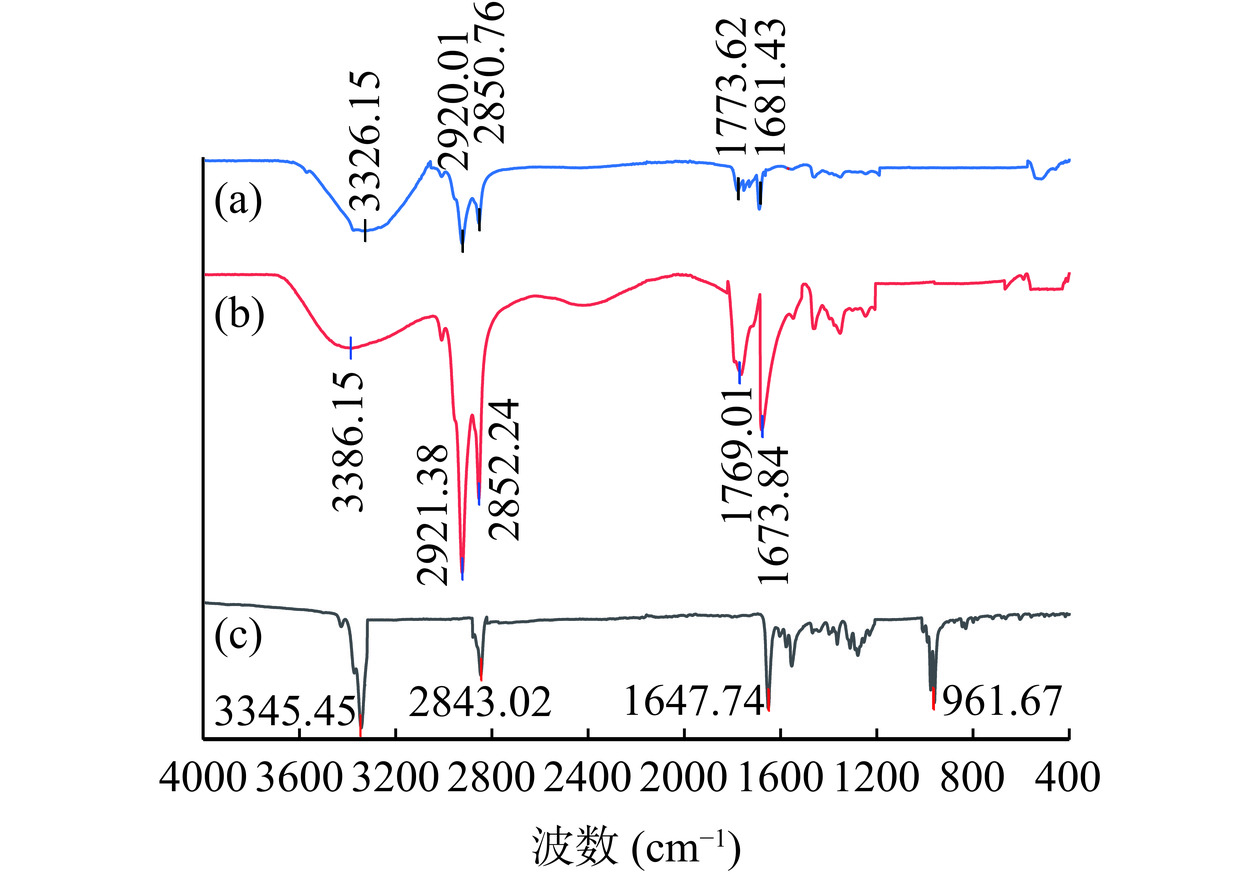
为了鉴定虾青素被囊泡包埋过程中是否发生了化学变化,采用傅里叶红外光谱对其特定吸收峰进行采集及对比。脂肪酸空囊泡(a)、虾青素囊泡(b)、虾青素(c)的FTIR红外光谱图如图8所示。由常见官能团红外吸收频率可知,虾青素有以下特征峰[36]:O-H伸缩振动吸收峰(3345 cm−1)、-CH3伸缩振动峰(2843 cm−1)、C=O伸缩振动峰(1647 cm−1)和C-H疏水性伸缩振动峰(961 cm−1)。而囊泡是由花生四烯酸组装形成的,花生四烯酸在红外谱图中,在1773 cm−1的伸缩振动为羧基基团上C=C[37]。图中(a)及(b)中的峰形基本一致,峰位有极小偏移,说明虾青素和脂肪酸囊泡各组分之间没有发生化学变化,只有极小的相互影响作用,使峰位发生偏移。比较虾青素囊泡与虾青素的谱线图,可知虾青素囊泡谱图中961 cm−1处的吸收峰消失,虾青素与囊泡之间通过氢键和疏水作用相互结合,并有效包封在囊泡中。袁巧月等[36]在研究纳米颗粒包埋虾青素时也发现了类似的结果。
2.3.3 粒径、PDI、Zeta电位
虾青素囊泡平均粒径为(131.74±2.74)nm(图9),PDI为0.25±0.01,PDI值低于0.3,表明物质的单分散性很高[38],证明虾青素囊泡在水溶液中分布均匀,Zeta电位为(−38.52±2.31)mV,表面带负电荷且绝对值大于30 mV,因此虾青素囊泡之间存在较强的强电排斥力,有较强的稳定性。
2.4 不同贮藏条件对AST-FAV稳定性的影响
2.4.1 温度对AST-FAV稳定性的影响
图10和表4为不同贮藏温度对虾青素囊泡稳定性的影响。从图10可以看出,所制备出的初始油溶虾青素呈橙红色澄清溶液,而虾青素囊泡呈橙红色混悬液,在不同温度下,随着贮藏时间的延长两组颜色出现变浅或消失现象。在25 ℃及37 ℃贮藏8 d后AST-oil及AST-FAV外观颜色出现变化,当贮藏16 d后,AST-oil在4、25、37 ℃外观颜色变化明显,而AST-FAV在4 ℃贮藏16 d后颜色变化不明显。由表4可知贮藏16 d后,不同温度下(4、25、37 ℃)保留率与初始值相比,AST-FAV保留率分别下降22.86%、43.07%、100%(P<0.05),而AST-oil保留率分别下降87.80%、100%、100%(P<0.05),当贮藏温度为37 ℃时,二者16 d后虾青素均完全降解,而AST-FAV在4 ℃贮藏时保留率下降最少。在不同温度条件下贮藏16 d后AST-FAV粒径分别增加了28.86、53.78、76.92 nm,而AST-oil粒径分别增加了42.23、56.70、95.15 nm,随着贮藏时间的延长AST-FAV和AST-oil中液滴发生迁移,液滴聚集导致粒径变大,随着贮藏温度升高,液滴迁移速率加快,粒径变大,温度越高,粒径越大。AST-FAV在4 ℃贮藏16 d后电位及PDI值与制备初始值接近,分布和均一性状态良好,而AST-oil PDI值大于0.3,说明虾青素在油溶介质中稳定性较低。结果表明AST-FAV在4 ℃下贮藏有利于提高其稳定性,在实际应用中具有一定潜力。
表 4 不同贮藏温度对AST-FAV稳定性的影响Table 4. Effects of different storage temperatures on the stability of AST-FAV贮藏时间(d) 贮藏温度(℃) 保留率(%) 粒径(nm) Zeta电位(mV) PDI AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV 0 4 100a 100a 231.32±4.60b 140.31±1.45b −31.52±0.75c −30.59±0.09b 0.24±0.01d 0.22±0.02d 25 100a 100a 235.99±7.52d 139.91±2.26d −31.47±0.93c −30.57±0.28c 0.22±0.01c 0.23±0.02c 37 100a 100a 221.53±5.14d 140.25±0.30d −30.96±0.93c −30.79±0.09d 0.22±0.01c 0.23±0.01c 4 4 79.53±0.72b 94.40±0.48b 244.74±4.21b 146.89±2.96b −33.01±0.53bc −30.65±0.31b 0.24±0.02d 0.23±0.01c 25 76.73±0.87b 94.31±0.12b 251.31±1.66c 146.71±1.05d −33.04±0.27c −32.24±0.65b 0.23±0.01c 0.23±0.01c 37 70.98±0.50b 83.30±0.35b 253.04±3.30c 147.91±1.10d −33.76±0.54b −32.25±0.38c 0.23±0.01c 0.24±0.01bc 8 4 62.79±1.40c 81.82±1.62c 253.96±3.62ab 158.28±4.35ab −34.69±0.82b −30.93±0.09b 0.26±0.01c 0.24±0.01bc 25 57.29±2.51c 74.09±0.36c 263.32±3.73b 155.59±3.96c −35.34±0.49b −33.36±0.75b 0.25±0.01b 0.24±0.01bc 37 45.66±6.03c 61.59±1.85c 274.56±3.52b 160.33±1.19c −35.84±0.76b −34.66±1.62c 0.28±0.01b 0.25±0.01b 12 4 34.93±3.16d 79.69±0.97d 261.38±5.85a 163.98±3.12a −35.16±1.18ab −31.72±0.22ab 0.28±0.01b 0.25±0.01b 25 18.67±5.23d 67.53±3.64d 277.76±4.79b 167.34±2.58b −37.78±1.26b −34.67±0.96b 0.30±0.01ab 0.25±0.01b 37 0 19.87±6.11d 281.22±2.49b 172.25±1.19b −40.34±0.93a −37.46±0.70b 0.33±0.01ab 0.25±0.01b 16 4 12.20±8.94e 77.14±2.30e 273.55±4.87a 169.17±1.28a −37.19±0.69a −33.23±0.49a 0.32±0.01a 0.27±0.01a 25 0 56.93±3.55e 292.69±2.25a 193.69±1.71a −41.22±0.64a −39.60±0.45a 0.33±0.01a 0.27±0.01a 37 0 0 316.68±9.58a 217.17±6.24a −43.70±1.55a −41.48±0.78a 0.35±0.01a 0.32±0.02a 注:不同小写字母表示相同组别、相同贮藏条件,不同贮藏时间之间存在显著性差异(P<0.05);表5~表7同。 2.4.2 光照对AST-FAV稳定性的影响
图11和表5为不同光照对虾青素囊泡稳定性的影响。可以看出不同光照条件下(自然光、避光)AST-oil在贮藏16 d后颜色均出现明显变化,而AST-FAV在避光条件下外观颜色变化很小,这是因为虾青素对光敏感,当虾青素暴露在自然光下时稳定性会降低,容易发生降解,从而失去其原有的营养价值。由表5可知,贮藏16 d后,在自然光组中AST-FAV和AST-oil保留率分别下降100%、59.22%(P<0.05),而在避光组中AST-FAV和AST-oil保留率分别下降86.48%、23.27%(P<0.05),在自然光下AST-oil在16 d后全部氧化分解,而在避光条件下AST-FAV保留率下降最少。贮藏16 d后,在光照、避光条件下AST-FAV粒径分别增大66.39、28.86 nm,AST-oil粒径分别增大79.22、47.70 nm,可以证明AST-FAV在贮藏期间出现的聚集粘连现象少于AST-oil。贮藏16 d后,在避光条件下AST-FAV的电位绝对值均大于30 mV,PDI值均小于0.3,说明AST-FAV体系相对稳定,粒径分布相对集中;而囊泡在光照条件下光敏氧化的反应速率大于自动氧化,会造成囊泡体系的失稳,从而引起电位变化[39]。结果表明在避光条件下AST-FAV与AST-oil相比,前者能较好地保护虾青素不被分解,从而提高其稳定性。
表 5 不同光照对AST-FAV稳定性的影响Table 5. Effects of different lighting conditions on the stability of AST-FAV贮藏时间(d) 光照 保留率(%) 粒径(nm) Zeta电位(mV) PDI AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV 0 自然光 100a 100a 231.53±15.61d 140.91±3.59d −31.11±0.92d −30.57±0.28c 0.25±0.01c 0.23±0.02e 避光 100a 100a 233.46±2.60c 140.31±0.88b −30.50±0.66c −30.59±0.09c 0.23±0.01e 0.22±0.02e 4 自然光 76.34±1.09b 97.16±0.13b 264.77±9.77c 163.62±5.12c −32.83±0.99cd −30.91±0.09c 0.25±0.01c 0.25±0.01d 避光 79.75±1.23b 97.13±0.05b 244.60±6.20c 146.89±2.96b −32.67±2.06b −30.65±0.31c 0.24±0.01d 0.24±0.03d 8 自然光 56.01±0.64c 82.31±0.16c 274.15±8.49c 181.49±6.11b −33.12±0.71c −31.30±0.44bc 0.25±0.01c 0.24±0.02c 避光 64.78±2.64c 83.60±0.25c 268.33±4.28b 158.28±4.35ab −34.07±0.48b −30.93±0.09bc 0.26±0.03c 0.22±0.02c 12 自然光 17.69±5.20d 69.12±2.53d 290.65±4.28b 199.11±4.14a −38.23±0.28b −32.56±0.45b 0.28±0.01b 0.28±0.02b 避光 36.55±8.42d 81.39±1.54d 277.16±6.48a 163.98±3.12a −37.34±1.35a −31.72±0.22b 0.24±0.02b 0.26±0.02b 16 自然光 0 40.78±7.01e 310.76±6.58a 207.30±6.14a −42.51±2.30a −34.29±0.64a 0.36±0.01a 0.29±0.01a 避光 13.52±5.78e 76.73±1.44e 281.16±8.82a 169.17±1.28a −39.66±0.37a −33.23±0.49a 0.34±0.01a 0.28±0.01a 2.4.3 不同NaCl浓度对AST-FAV稳定性的影响
图12和表6为不同NaCl浓度对虾青素囊泡稳定性的影响。从图12可以看出AST-FAV和AST-oil两组在50~150 mmol/L NaCl贮藏8 d后,外观颜色无明显差异,但AST-oil组在贮藏16 d后与贮藏8 d后相比颜色变化明显,而AST-FAV组颜色无明显差异。由表6可知,与第0 d相比,贮藏16 d后不同NaCl浓度(50、100、150、200、250 mmol/L)中AST-oil组的保留率分别下降92.81%、85.02%、67.69%、74.66%、95.80%(P<0.05),而AST-FAV组中保留率分别下降19.20%、20.59%、18.82%、27.05%、80.89%(P<0.05)。贮藏16 d后,AST-FAV在小于等于150 mmol/L NaCl时粒径变化较小,在150 mmol/L盐离子浓度下AST-FAV Zeta电位绝对值保持在30~40 mV之间,PDI保持在0.3以下。结果表明,AST-FAV理化性质在150 mmol/L盐离子浓度中有一定的耐受性。
表 6 不同NaCl浓度对AST-FAV稳定性的影响Table 6. Effects of different NaCl concentrations on the stability of AST-FAV贮藏时间
(d)NaCl
浓度(mmol/L)保留率(%) 粒径(nm) Zeta电位(mV) PDI AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV 0 50 100a 100a 240.74±2.47c 139.91±2.26c −31.86±0.53a −30.57±0.28c 0.25±0.01d 0.23±0.02d 100 100a 100a 225.45±3.59d 136.29±1.05b −30.54±0.52b −30.77±0.04c 0.25±0.01e 0.24±0.01d 150 100a 100a 219.25±3.95c 137.29±0.54b −31.69±0.78a −30.97±0.47c 0.25±0.01d 0.24±0.01d 200 100a 100a 230.71±4.76c 141.26±0.73d −31.22±0.86a −31.39±0.52c 0.26±0.01e 0.25±0.01d 250 100a 100a 239.11±4.67d 142.37±0.40d −30.64±0.65b −31.07±0.54e 0.26±0.01e 0.25±0.01e 4 50 80.17±0.94b 92.52±0.50b 242.61±4.91bc 146.89±2.96c −30.56±0.86a −30.65±0.31c 0.27±0.01c 0.25±0.01c 100 82.22±0.63b 94.22±0.38b 251.18±3.17c 144.39±3.02b −30.89±0.47b −33.40±1.69b 0.27±0.01d 0.25±0.01c 150 82.66±0.10b 95.44±0.28b 239.28±4.67b 144.64±2.23b −31.54±1.78a −34.82±0.08b 0.27±0.01c 0.25±0.01c 200 76.43±0.13b 92.90±0.47b 258.99±8.37b 156.93±1.59c −31.83±0.73a −36.32±0.71b 0.28±0.01d 0.27±0.01c 250 70.78±1.53b 91.29±0.35b 259.27±4.42c 167.75±2.07c −31.44±0.44a −37.81±0.38d 0.30±0.02d 0.26±0.01d 8 50 71.72±0.86c 82.94±1.03c 253.76±7.29b 158.28±4.35b −30.80±0.41a −30.93±0.09bc 0.28±0.01b 0.26±0.01b 100 72.24±1.61c 82.68±1.08c 272.30±8.41b 160.01±2.82a −31.17±0.35a −35.97±1.45ab 0.28±0.01c 0.24±0.01d 150 80.37±0.21c 85.09±0.47c 246.73±7.82b 164.49±0.55a −31.45±0.45a −35.98±0.63b 0.27±0.01c 0.26±0.01b 200 63.98±3.06c 80.39±0.84c 266.53±5.60b 177.40±2.63b −27.03±0.49b −38.40±0.43a 0.33±0.01c 0.27±0.01c 250 53.02±1.88c 77.90±1.16c 280.21±7.00b 185.36±4.05b −24.95±0.66c −38.92±0.07c 0.34±0.01c 0.30±0.01c 12 50 27.83±0.53d 81.60±1.38d 263.37±3.78ab 163.98±3.12ab −28.84±0.42b −31.72±0.22b 0.35±0.01a 0.27±0.01a 100 47.80±0.95d 80.21±0.32d 278.58±4.15b 165.20±2.55a −27.48±0.60c −36.49±0.60a 0.35±0.01b 0.26±0.01b 150 58.27±1.06d 83.94±0.65d 258.24±7.15ab 165.63±4.91a −29.87±0.36b −36.72±0.61ab 0.28±0.01b 0.26±0.01b 200 50.04±1.78d 78.26±0.71d 292.29±6.65a 190.07±6.67a −25.71±0.59c −39.21±0.43a 0.36±0.01b 0.31±0.01b 250 42.62±1.65d 60.77±4.33d 303.09±6.69a 191.08±1.96ab −22.21±1.35d −42.46±1.91b 0.36±0.01b 0.38±0.01b 16 50 7.19±5.24e 80.80±1.36e 275.14±8.54a 169.17±1.28a −21.15±0.79c −33.23±0.49a 0.35±0.01a 0.27±0.01a 100 14.98±6.23e 79.41±0.70e 289.10±0.97a 164.19±4.46a −24.29±1.39d −35.94±0.55b 0.36±0.01a 0.27±0.01a 150 32.31±2.92e 81.18±1.61e 267.38±8.99a 165.36±6.48a −26.10±0.81c −37.09±0.59a 0.32±0.01a 0.27±0.01a 200 25.34±2.98e 72.95±1.85e 297.50±1.61a 195.07±1.71a −23.09±1.67d −39.37±0.57a 0.37±0.01a 0.34±0.03a 250 4.20±0.48e 19.11±2.13e 314.91±1.03a 202.27±5.40a −19.38±0.58e −44.14±1.54a 0.38±0.01a 0.43±0.01a 2.4.4 冻干复溶对AST-FAV稳定性的影响
图13和表7为冻干复溶对虾青素囊泡稳定性的影响。由于AST-oil无法冻干,因此只探讨其为液体状态时稳定性。由图可知,AST-FAV冻干复溶后贮藏16 d后,其颜色与同等天数下液体贮藏无明显变化。由表可知,在液体状态下贮藏16 d后,AST-FAV和AST-oil保留率分别下降22.31%、88.55%(P<0.05),而AST-FAV在冻干条件下贮藏16 d后保留率下降19.48%,冻干后保留率略高于液体状态。AST-FAV在液体和冻干复溶状态下贮藏16 d后粒径分别增加32.32、35.99 nm,Zeta电位绝对值均在30~40 mV之间,PDI均小于0.3,差异不显著,说明了冻干复溶后AST-FAV具有良好的溶解性,溶解后液滴大小均一。实验结果表明,AST-FAV的冻干复溶后保留率与在液体环境下贮藏16 d后保留率差异不明显,在实际应用中为了方便贮藏及运输,可将其冻干后保存。
表 7 冻干复溶对AST-FAV稳定性的影响Table 7. Effects of lyophilized redissolved on the stability of AST-FAV贮藏时间(d) 冻干复溶 保留率(%) 粒径(nm) Zeta电位(mV) PDI AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV 0 液体 100a 100a 228.48±1.76c 136.85±0.67c −31.17±0.69d −30.45±0.23b 0.26±0.02c 0.24±0.01b 冻干 − 100a − 137.81±0.75d − −30.44±0.14c − 0.23±0.01d 4 液体 77.91±0.01b 94.76±0.37b 251.85±4.16b 146.89±2.96b −33.17±1.10c −30.65±0.31b 0.25±0.01d 0.23±0.01c 冻干 − 95.62±0.25b − 147.40±3.49c − −30.86±0.24c − 0.23±0.01d 8 液体 62.80±1.43c 82.77±1.24c 256.81±6.51b 158.28±4.35a −34.61±0.60c −30.93±0.09b 0.25±0.01d 0.24±0.01b 冻干 − 82.59±1.60c − 158.96±1.03b − −33.91±0.09b − 0.24±0.01c 12 液体 28.91±3.89d 81.12±1.18c 267.41±6.11b 163.98±3.12a −36.30±1.67b −31.72±0.22b 0.28±0.01b 0.24±0.01b 冻干 − 82.40±1.40c − 168.68±3.72a − −35.01±0.78a − 0.25±0.01b 16 液体 11.45±8.62e 77.69±0.93d 279.50±3.82a 169.17±1.28a −38.43±0.83a −33.23±0.49a 0.33±0.01a 0.25±0.01a 冻干 − 80.52±0.97d − 173.79±2.26a − −35.23±0.43a − 0.26±0.01a 2.5 加热氧化对AST-FAV稳定性的影响
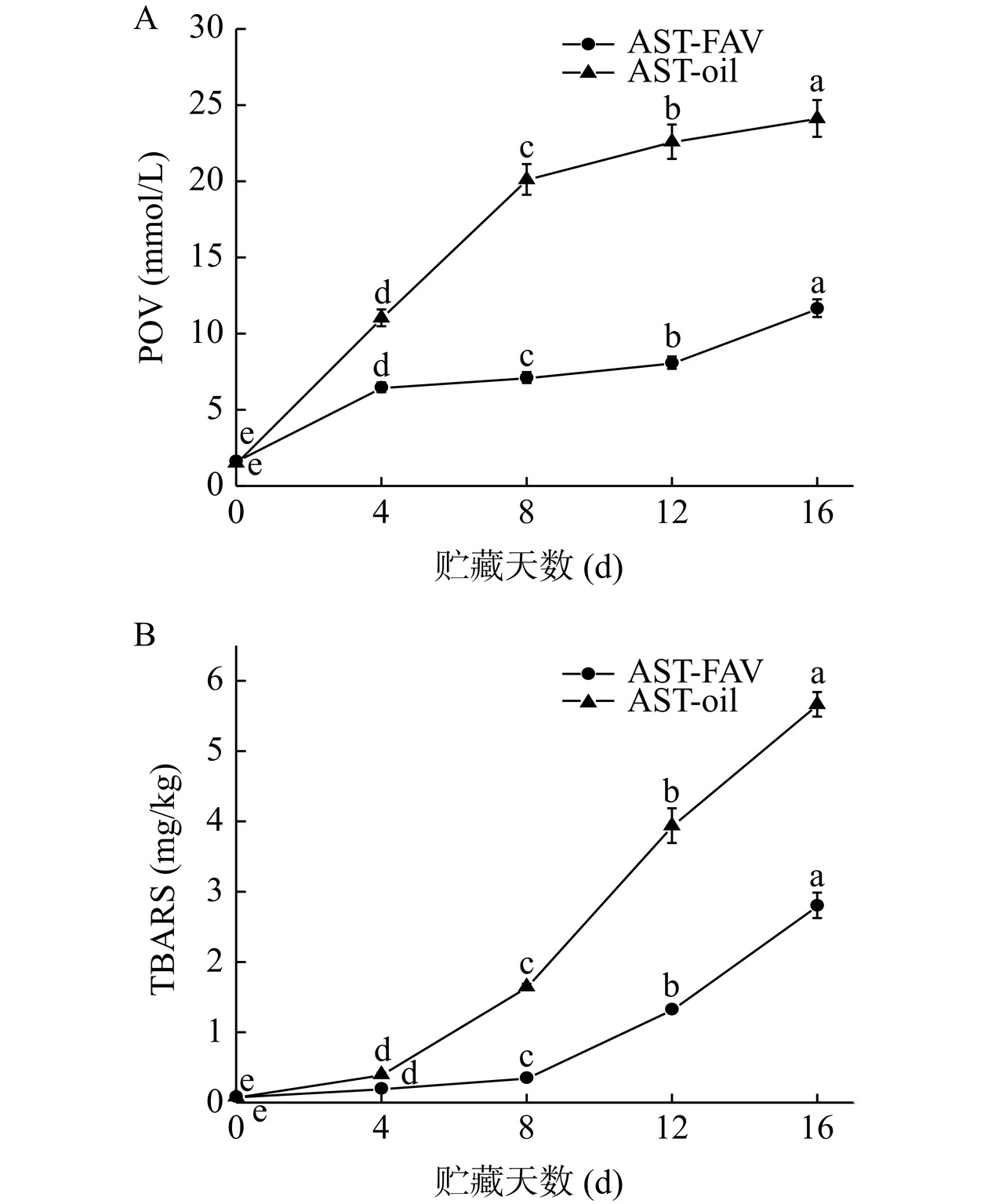
不同贮藏温度条件下,AST-FAV的POV和TBARS变化如图14A和图14B所示。脂质氧化会影响产品的口感,折损产品质量。氧化反应一旦产生,就会产生自由基并在后续反应中传播。在初始阶段,AST-FAV和AST-oil的POV和TBARS几乎为零,随着时间的延长,两组POV及TBARS逐渐增加,50 ℃贮藏4 d后,AST-oil组POV值迅速攀升,与AST-FAV形成显著性差异(P<0.05)。经过16 d贮藏后,AST-oil的POV和TBARS分别为24.12±1.12 mmol/L、5.66±0.17 mg/kg,而AST-FAV的POV和TBARS分别为11.66±0.58 mmol/L、2.80±0.18 mg/kg,且二者在贮藏期内具有显著变化(P<0.05)。由此可见,AST-FAV可以有效隔绝油脂接触外界氧气,避免促进氧化的物质接触,减慢氧化速度,有效延长贮藏时间。总的来说,AST-FAV不仅可以有效提高虾青素在贮藏期间的物理稳定性,还能有效抑制脂质氧化,提高虾青素的化学稳定性。
2.6 体外消化对AST-FAV稳定性的影响
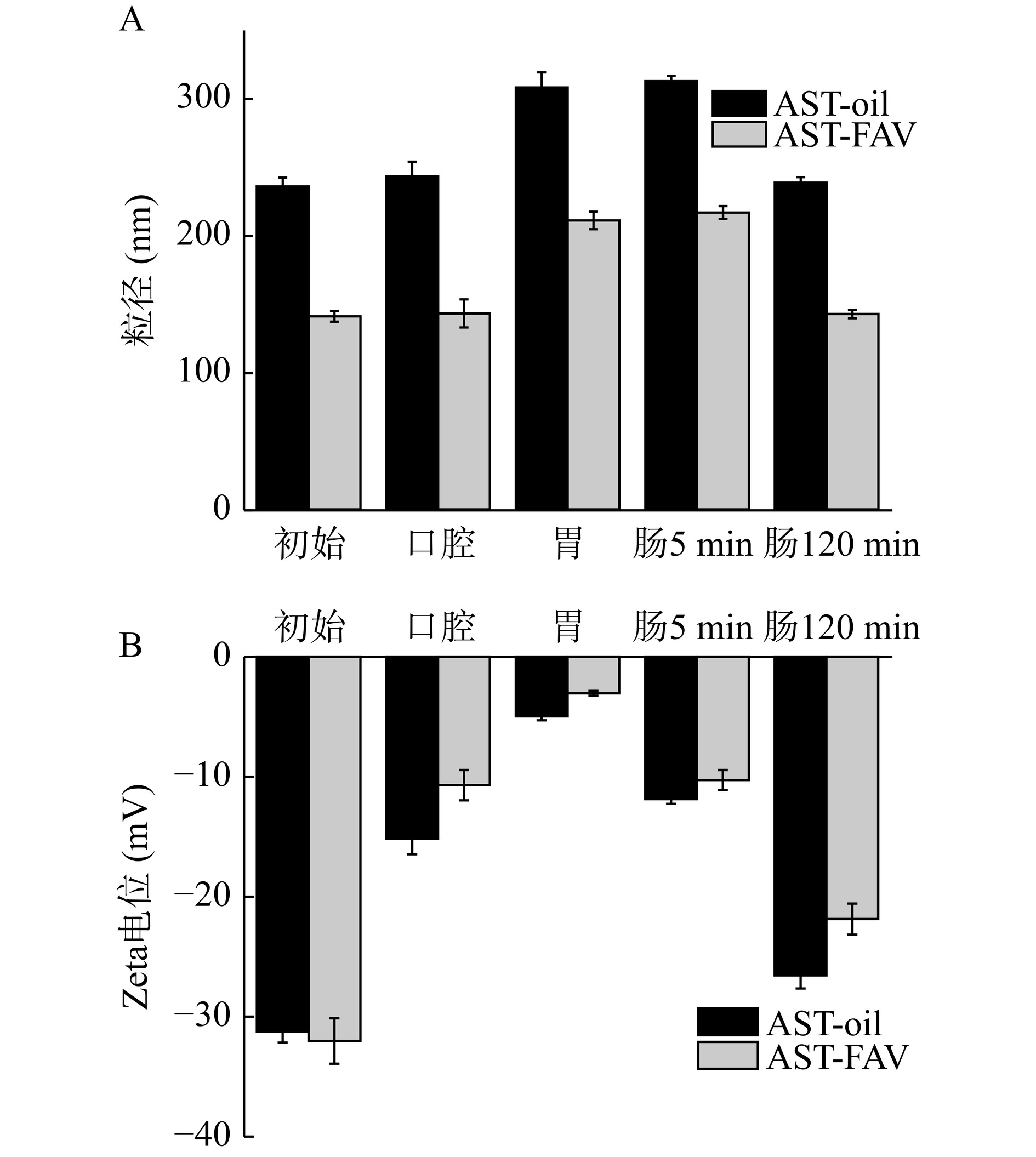
不同负载方式对虾青素消化各个阶段平均粒径和Zeta电位变化如图15A和图15B所示。如图15A所示,在模拟口腔消化阶段,AST-FAV和AST-oil两组平均粒径稍有增加,但无显著区别;在模拟胃消化阶段,两组都出现了不同程度粒径的增大,与初始液相比分别增加了70.07、72.28 nm,可能是由于消化液pH从中性(pH7)降低到强酸(pH2),pH剧烈变化会改变液滴之间的相互作用的强度和范围,使囊泡之间发生液滴聚集,造成了平均粒径增长较明显;在肠消化5 min后,两组均与胃相比粒径变化不明显,可能是由于消化时间过短消化不完全;AST-FAV和AST-oil两组在肠消化120 min阶段,粒径出现明显降低,与胃消化液相比分别降低了68.33、69.51 nm,由于消化过程中加入的脂肪酶水解液滴,产生游离脂肪酸,其他物质被水解为小分子肽和氨基酸,从而导致平均粒径的降低,且AST-oil被水解为游离脂肪酸直接释放到肠道消化液中。从图15A可以看出在整个消化阶段AST-oil粒径始终大于AST-FAV,这表示在整个消化过程中AST-FAV与消化液的接触面积都会大于AST-oil。如图15B所示,AST-FAV和AST-oil两组在肠消化阶段电位较高,可能是因为游离脂肪酸、氨基酸等物质使得样品表面具有强负电荷,而在水解过程中AST-FAV比AST-oil产生更多的游离脂肪酸,因此产生的负电荷更多。
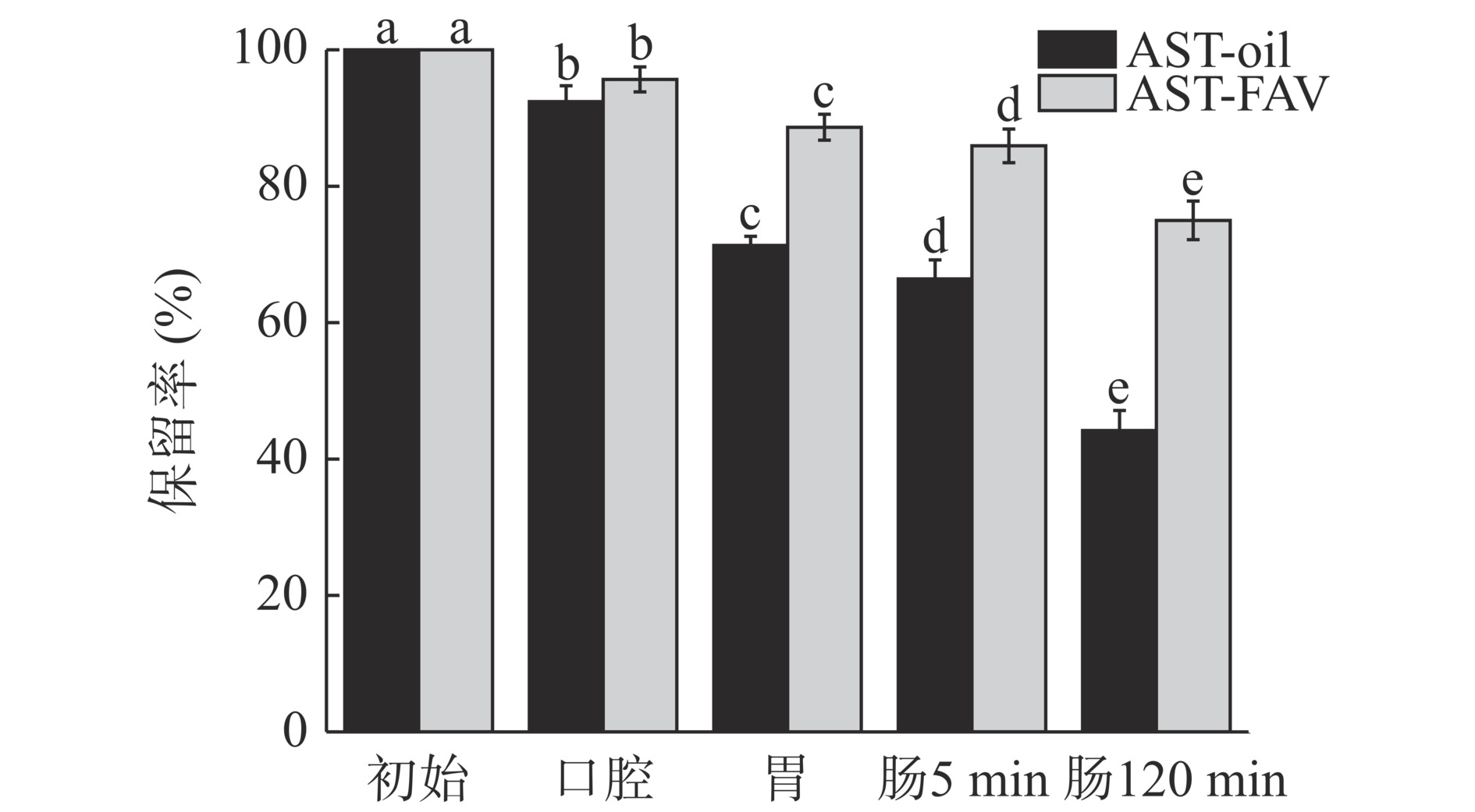
不同负载虾青素产品消化各个阶段消化保留率的变化如图16所示。由图可知,由于在消化过程中虾青素会发生一定程度的降解,消化保留率下降,AST-FAV在各个阶段中消化保留率均高于AST-oil。而在肠消化结束后AST-FAV和AST-oil两组消化保留率分别为44.19%±2.21%、74.99%±4.37%。相比之下,AST-oil中保留率发生了显著下降(P<0.05)。结果表明,与AST-oil相比,AST-FAV在体外消化过程中更稳定,这可能是因为虾青素在胃肠道环境中会发生严重降解。上述结果表明AST-FAV在pH为酸性环境下也能稳定地将虾青素包埋在囊泡中,有效提高其在消化过程中的保留率,提高虾青素的稳定性。
3. 结论
为了提高虾青素的水溶性,本文制备了粒径较小、分散性好、包封率较高、稳定性较好的虾青素囊泡,表明脂肪酸囊泡可以有效提高虾青素在水中的分散性。制备虾青素囊泡的最佳工艺为虾青素添加量0.14 mg/mL、表面活性剂与脂肪酸比例为1:1、表面活性剂亲水亲油平衡值为7、磷酸缓冲溶液pH为7.0、水化时间为21 min,此时,虾青素囊泡包封率平均值为89.58%±1.47%,其形态规则且分散均匀,平均粒径为131.74±2.74 nm。与油溶虾青素相比,在相同贮藏环境下虾青素囊泡在4 ℃、避光条件下其保留率、粒径、PDI变化较小,且虾青素囊泡对盐离子有一定的耐受力。经过16 d贮藏后,虾青素囊泡的POV和TBARS基本都为油溶虾青素的一半,经体外消化结束后,虾青素囊泡及油溶虾青素消化保留率分别为74.99%±4.37%、44.19%±2.21%,说明虾青素囊泡在pH为酸性条件下的稳定性明显优于油溶虾青素。本研究制备了虾青素囊泡,探究其贮藏、氧化、体外消化稳定性,为可为疏水性功能性物质的运输体系提供理论支持,为后续研究虾青素功能活性提供思路。
-
表 1 Box-Behnken响应面因素及水平编码
Table 1 Box-Behnken response surface factor and level coding
水平 因素 A虾青素添加量
(mg/mL)B表面活性剂与
脂肪酸比例C磷酸缓冲
溶液pHD水化时间
(min)−1 0.1 1:2 6.8 15 0 0.15 1:1 7.0 20 1 0.2 3:2 7.2 25 表 2 响应面试验结果
Table 2 Results of response surface experiment
试验号 A B C D 包封率(%) 1 −1 −1 0 0 73.21 2 1 1 0 0 60.92 3 0 0 0 0 89.65 4 0 0 1 1 84.51 5 0 0 −1 −1 83.72 6 0 0 1 −1 75.62 7 0 0 −1 1 80.93 8 0 0 0 0 89.61 9 1 −1 0 0 69.12 10 −1 1 0 0 68.52 11 0 0 0 0 87.41 12 0 −1 1 0 78.15 13 0 −1 −1 0 84.12 14 1 0 0 −1 75.51 15 1 0 0 1 73.92 16 −1 0 0 −1 71.51 17 0 0 0 0 90.82 18 0 1 1 0 70.61 19 0 1 −1 0 77.62 20 −1 0 0 1 79.72 21 −1 0 −1 0 82.48 22 0 1 0 −1 75.85 23 0 0 0 0 88.27 24 0 0 0 0 88.72 25 0 −1 0 −1 80.62 26 −1 0 1 0 75.73 27 0 −1 0 1 84.51 28 1 0 1 0 75.81 29 1 0 −1 0 73.29 30 0 1 0 1 79.39 表 3 方差分析结果
Table 3 Results of variance analysis
变异来源 平方和 自由度 均方值 F值 P值 显著性 模型 1459.09 14 104.22 25.00 <0.0001 ** A 42.56 1 42.56 10.21 0.0070 ** B 112.98 1 112.98 27.10 0.0002 ** C 39.35 1 39.35 9.44 0.0089 ** D 33.84 1 33.84 8.12 0.0137 * AB 3.08 1 3.08 0.74 0.4056 AC 21.48 1 21.48 5.15 0.0409 * AD 24.01 1 24.01 5.76 0.0321 * BC 0.27 1 0.27 0.065 0.8029 BD 0.031 1 0.031 7.347E-003 0.9330 CD 34.11 1 34.11 8.18 0.0134 * A2 836.83 1 836.83 200.76 <0.0001 ** B2 459.34 1 459.34 110.20 <0.0001 ** C2 69.82 1 69.82 16.75 0.0013 ** D2 53.31 1 53.31 12.79 0.0034 ** 残差 54.19 13 4.17 失拟项 48.27 10 4.83 2.45 0.2496 ○ 误差项 5.92 3 1.97 总和 1554.97 29 注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01;○表示差异不显著,P>0.05。 表 4 不同贮藏温度对AST-FAV稳定性的影响
Table 4 Effects of different storage temperatures on the stability of AST-FAV
贮藏时间(d) 贮藏温度(℃) 保留率(%) 粒径(nm) Zeta电位(mV) PDI AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV 0 4 100a 100a 231.32±4.60b 140.31±1.45b −31.52±0.75c −30.59±0.09b 0.24±0.01d 0.22±0.02d 25 100a 100a 235.99±7.52d 139.91±2.26d −31.47±0.93c −30.57±0.28c 0.22±0.01c 0.23±0.02c 37 100a 100a 221.53±5.14d 140.25±0.30d −30.96±0.93c −30.79±0.09d 0.22±0.01c 0.23±0.01c 4 4 79.53±0.72b 94.40±0.48b 244.74±4.21b 146.89±2.96b −33.01±0.53bc −30.65±0.31b 0.24±0.02d 0.23±0.01c 25 76.73±0.87b 94.31±0.12b 251.31±1.66c 146.71±1.05d −33.04±0.27c −32.24±0.65b 0.23±0.01c 0.23±0.01c 37 70.98±0.50b 83.30±0.35b 253.04±3.30c 147.91±1.10d −33.76±0.54b −32.25±0.38c 0.23±0.01c 0.24±0.01bc 8 4 62.79±1.40c 81.82±1.62c 253.96±3.62ab 158.28±4.35ab −34.69±0.82b −30.93±0.09b 0.26±0.01c 0.24±0.01bc 25 57.29±2.51c 74.09±0.36c 263.32±3.73b 155.59±3.96c −35.34±0.49b −33.36±0.75b 0.25±0.01b 0.24±0.01bc 37 45.66±6.03c 61.59±1.85c 274.56±3.52b 160.33±1.19c −35.84±0.76b −34.66±1.62c 0.28±0.01b 0.25±0.01b 12 4 34.93±3.16d 79.69±0.97d 261.38±5.85a 163.98±3.12a −35.16±1.18ab −31.72±0.22ab 0.28±0.01b 0.25±0.01b 25 18.67±5.23d 67.53±3.64d 277.76±4.79b 167.34±2.58b −37.78±1.26b −34.67±0.96b 0.30±0.01ab 0.25±0.01b 37 0 19.87±6.11d 281.22±2.49b 172.25±1.19b −40.34±0.93a −37.46±0.70b 0.33±0.01ab 0.25±0.01b 16 4 12.20±8.94e 77.14±2.30e 273.55±4.87a 169.17±1.28a −37.19±0.69a −33.23±0.49a 0.32±0.01a 0.27±0.01a 25 0 56.93±3.55e 292.69±2.25a 193.69±1.71a −41.22±0.64a −39.60±0.45a 0.33±0.01a 0.27±0.01a 37 0 0 316.68±9.58a 217.17±6.24a −43.70±1.55a −41.48±0.78a 0.35±0.01a 0.32±0.02a 注:不同小写字母表示相同组别、相同贮藏条件,不同贮藏时间之间存在显著性差异(P<0.05);表5~表7同。 表 5 不同光照对AST-FAV稳定性的影响
Table 5 Effects of different lighting conditions on the stability of AST-FAV
贮藏时间(d) 光照 保留率(%) 粒径(nm) Zeta电位(mV) PDI AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV 0 自然光 100a 100a 231.53±15.61d 140.91±3.59d −31.11±0.92d −30.57±0.28c 0.25±0.01c 0.23±0.02e 避光 100a 100a 233.46±2.60c 140.31±0.88b −30.50±0.66c −30.59±0.09c 0.23±0.01e 0.22±0.02e 4 自然光 76.34±1.09b 97.16±0.13b 264.77±9.77c 163.62±5.12c −32.83±0.99cd −30.91±0.09c 0.25±0.01c 0.25±0.01d 避光 79.75±1.23b 97.13±0.05b 244.60±6.20c 146.89±2.96b −32.67±2.06b −30.65±0.31c 0.24±0.01d 0.24±0.03d 8 自然光 56.01±0.64c 82.31±0.16c 274.15±8.49c 181.49±6.11b −33.12±0.71c −31.30±0.44bc 0.25±0.01c 0.24±0.02c 避光 64.78±2.64c 83.60±0.25c 268.33±4.28b 158.28±4.35ab −34.07±0.48b −30.93±0.09bc 0.26±0.03c 0.22±0.02c 12 自然光 17.69±5.20d 69.12±2.53d 290.65±4.28b 199.11±4.14a −38.23±0.28b −32.56±0.45b 0.28±0.01b 0.28±0.02b 避光 36.55±8.42d 81.39±1.54d 277.16±6.48a 163.98±3.12a −37.34±1.35a −31.72±0.22b 0.24±0.02b 0.26±0.02b 16 自然光 0 40.78±7.01e 310.76±6.58a 207.30±6.14a −42.51±2.30a −34.29±0.64a 0.36±0.01a 0.29±0.01a 避光 13.52±5.78e 76.73±1.44e 281.16±8.82a 169.17±1.28a −39.66±0.37a −33.23±0.49a 0.34±0.01a 0.28±0.01a 表 6 不同NaCl浓度对AST-FAV稳定性的影响
Table 6 Effects of different NaCl concentrations on the stability of AST-FAV
贮藏时间
(d)NaCl
浓度(mmol/L)保留率(%) 粒径(nm) Zeta电位(mV) PDI AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV 0 50 100a 100a 240.74±2.47c 139.91±2.26c −31.86±0.53a −30.57±0.28c 0.25±0.01d 0.23±0.02d 100 100a 100a 225.45±3.59d 136.29±1.05b −30.54±0.52b −30.77±0.04c 0.25±0.01e 0.24±0.01d 150 100a 100a 219.25±3.95c 137.29±0.54b −31.69±0.78a −30.97±0.47c 0.25±0.01d 0.24±0.01d 200 100a 100a 230.71±4.76c 141.26±0.73d −31.22±0.86a −31.39±0.52c 0.26±0.01e 0.25±0.01d 250 100a 100a 239.11±4.67d 142.37±0.40d −30.64±0.65b −31.07±0.54e 0.26±0.01e 0.25±0.01e 4 50 80.17±0.94b 92.52±0.50b 242.61±4.91bc 146.89±2.96c −30.56±0.86a −30.65±0.31c 0.27±0.01c 0.25±0.01c 100 82.22±0.63b 94.22±0.38b 251.18±3.17c 144.39±3.02b −30.89±0.47b −33.40±1.69b 0.27±0.01d 0.25±0.01c 150 82.66±0.10b 95.44±0.28b 239.28±4.67b 144.64±2.23b −31.54±1.78a −34.82±0.08b 0.27±0.01c 0.25±0.01c 200 76.43±0.13b 92.90±0.47b 258.99±8.37b 156.93±1.59c −31.83±0.73a −36.32±0.71b 0.28±0.01d 0.27±0.01c 250 70.78±1.53b 91.29±0.35b 259.27±4.42c 167.75±2.07c −31.44±0.44a −37.81±0.38d 0.30±0.02d 0.26±0.01d 8 50 71.72±0.86c 82.94±1.03c 253.76±7.29b 158.28±4.35b −30.80±0.41a −30.93±0.09bc 0.28±0.01b 0.26±0.01b 100 72.24±1.61c 82.68±1.08c 272.30±8.41b 160.01±2.82a −31.17±0.35a −35.97±1.45ab 0.28±0.01c 0.24±0.01d 150 80.37±0.21c 85.09±0.47c 246.73±7.82b 164.49±0.55a −31.45±0.45a −35.98±0.63b 0.27±0.01c 0.26±0.01b 200 63.98±3.06c 80.39±0.84c 266.53±5.60b 177.40±2.63b −27.03±0.49b −38.40±0.43a 0.33±0.01c 0.27±0.01c 250 53.02±1.88c 77.90±1.16c 280.21±7.00b 185.36±4.05b −24.95±0.66c −38.92±0.07c 0.34±0.01c 0.30±0.01c 12 50 27.83±0.53d 81.60±1.38d 263.37±3.78ab 163.98±3.12ab −28.84±0.42b −31.72±0.22b 0.35±0.01a 0.27±0.01a 100 47.80±0.95d 80.21±0.32d 278.58±4.15b 165.20±2.55a −27.48±0.60c −36.49±0.60a 0.35±0.01b 0.26±0.01b 150 58.27±1.06d 83.94±0.65d 258.24±7.15ab 165.63±4.91a −29.87±0.36b −36.72±0.61ab 0.28±0.01b 0.26±0.01b 200 50.04±1.78d 78.26±0.71d 292.29±6.65a 190.07±6.67a −25.71±0.59c −39.21±0.43a 0.36±0.01b 0.31±0.01b 250 42.62±1.65d 60.77±4.33d 303.09±6.69a 191.08±1.96ab −22.21±1.35d −42.46±1.91b 0.36±0.01b 0.38±0.01b 16 50 7.19±5.24e 80.80±1.36e 275.14±8.54a 169.17±1.28a −21.15±0.79c −33.23±0.49a 0.35±0.01a 0.27±0.01a 100 14.98±6.23e 79.41±0.70e 289.10±0.97a 164.19±4.46a −24.29±1.39d −35.94±0.55b 0.36±0.01a 0.27±0.01a 150 32.31±2.92e 81.18±1.61e 267.38±8.99a 165.36±6.48a −26.10±0.81c −37.09±0.59a 0.32±0.01a 0.27±0.01a 200 25.34±2.98e 72.95±1.85e 297.50±1.61a 195.07±1.71a −23.09±1.67d −39.37±0.57a 0.37±0.01a 0.34±0.03a 250 4.20±0.48e 19.11±2.13e 314.91±1.03a 202.27±5.40a −19.38±0.58e −44.14±1.54a 0.38±0.01a 0.43±0.01a 表 7 冻干复溶对AST-FAV稳定性的影响
Table 7 Effects of lyophilized redissolved on the stability of AST-FAV
贮藏时间(d) 冻干复溶 保留率(%) 粒径(nm) Zeta电位(mV) PDI AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV AST-oil AST-FAV 0 液体 100a 100a 228.48±1.76c 136.85±0.67c −31.17±0.69d −30.45±0.23b 0.26±0.02c 0.24±0.01b 冻干 − 100a − 137.81±0.75d − −30.44±0.14c − 0.23±0.01d 4 液体 77.91±0.01b 94.76±0.37b 251.85±4.16b 146.89±2.96b −33.17±1.10c −30.65±0.31b 0.25±0.01d 0.23±0.01c 冻干 − 95.62±0.25b − 147.40±3.49c − −30.86±0.24c − 0.23±0.01d 8 液体 62.80±1.43c 82.77±1.24c 256.81±6.51b 158.28±4.35a −34.61±0.60c −30.93±0.09b 0.25±0.01d 0.24±0.01b 冻干 − 82.59±1.60c − 158.96±1.03b − −33.91±0.09b − 0.24±0.01c 12 液体 28.91±3.89d 81.12±1.18c 267.41±6.11b 163.98±3.12a −36.30±1.67b −31.72±0.22b 0.28±0.01b 0.24±0.01b 冻干 − 82.40±1.40c − 168.68±3.72a − −35.01±0.78a − 0.25±0.01b 16 液体 11.45±8.62e 77.69±0.93d 279.50±3.82a 169.17±1.28a −38.43±0.83a −33.23±0.49a 0.33±0.01a 0.25±0.01a 冻干 − 80.52±0.97d − 173.79±2.26a − −35.23±0.43a − 0.26±0.01a -
[1] LIU X, OSAWA T. Cis Astaxanthin and especially 9-Cis astaxanthin exhibits a higher antioxidant activity in vitro compared to the all-trans isomer[J]. Biochemical and Biophysical Research Communications,2007,357(1):187−193.
[2] ZHAO T, YAN X, SUN L, et al. Research progress on extraction, biological activities and delivery systems of natural astaxanthin[J]. Trends in Food Science & Technology,2019,91:354−361.
[3] PONNURAJ N, GANAPASAM S. Astaxanthin inhibits tumor invasion by decreasing extracellular matrix production and induces apoptosis in experimental rat colon carcinogenesis by modulating the expressions of ERK-2, NFκB and COX-2[J]. Investigational New Drugs,2011,29(2):207−24. doi: 10.1007/s10637-009-9342-5
[4] ZHOU X, ZHANG F, HU X, et al. Inhibition of inflammation by astaxanthin alleviates cognition deficits in diabetic mice[J]. Physiology & Behavior,2015,151:412−420.
[5] PASHKOW F J, WATUMULL D G, CAMPBELL C L. Astaxanthin:A novel potential treatment for oxidative stress and inflammation in cardiovascular disease[J]. The American Journal of Cardiology, 2008, 101 (10):S58–S68.
[6] 杨婕, 熊迎欣, 何思琦, 等. 负载虾青素对富含DHA的磷脂酰胆碱脂质体膜结构稳定性的影响[J]. 中国海洋大学学报(自然科学版),2024,54(6):68−76. [YANG J, XIONG Y X, HE S Q, et al. Effect of embedded astaxanthin on membrane stability of DHA-PC liposome[J]. Periodical of Ocean University of China,2024,54(6):68−76.] YANG J, XIONG Y X, HE S Q, et al. Effect of embedded astaxanthin on membrane stability of DHA-PC liposome[J]. Periodical of Ocean University of China, 2024, 54(6): 68−76.
[7] BOONLAO N, SHRESTHA S, SADIQ M B, et al. Influence of whey protein-xanthan gum stabilized emulsion on stability and in vitro digestibility of encapsulated astaxanthin[J]. Journal of Food Engineering,2020,272:109859.
[8] WANG Q, ZHAO Y, GUAN L, et al. Preparation of astaxanthin-loaded DNA/chitosan nanoparticles for improved cellular uptake and antioxidation capability[J]. Food Chemistry,2017,227:9−15.
[9] KAUR A, SINGH G, KAUR L, et al. Recent advancements in biomimetic drug delivery system of single-chain fatty acids as ufasomes and ufosomes:A comprehensive review[J]. Current Nanoscience,2023,19(3):362−371.
[10] HAMED A S, HASSAN M A. Ufasomes nano-vesicles-based lyophilized platforms for intranasal delivery of cinnarizine:Preparation, optimization, ex-vivo histopathological safety assessment and mucosal confocal imaging[J]. Pharmaceutical Development and Technology,2016,21(6):706−715.
[11] PARDAKHTY A, VARSHOSAZ J, ROUHOLAMINI A. In vitro study of polyoxyethylene alkyl ether niosomes for delivery of insulin[J]. International Journal of Pharmaceutics,2007,328(2):130−141.
[12] 樊晔, 韩贻陈, 夏咏梅, 等. 共轭亚油酸与海藻酸钠囊泡化自组装纳米容器及其药物缓释性能[J]. 应用化学,2018,35(12):1478−1484. [FAN Y, HAN Y C, XIA Y M, et al. Investigation on self-assembly of nanocontainers by vesiculation of conjugated linoleic acid and sodium alginate and their drug delivery behavior[J]. Chinese Journal of Applied Chemistry,2018,35(12):1478−1484.] FAN Y, HAN Y C, XIA Y M, et al. Investigation on self-assembly of nanocontainers by vesiculation of conjugated linoleic acid and sodium alginate and their drug delivery behavior[J]. Chinese Journal of Applied Chemistry, 2018, 35(12): 1478−1484.
[13] 李珊珊. 壬酸在囊泡制备上的应用研究[D]. 贵阳:贵州大学, 2020. [LI S S. Study on the application of nonanoic acid invesicle preparation[D]. Guiyang:Guizhou University, 2020.] LI S S. Study on the application of nonanoic acid invesicle preparation[D]. Guiyang: Guizhou University, 2020.
[14] FAN Y, MA J, FANG Y, et al. Neutral and acid-adapted fatty acid vesicles of conjugated linoleic acid[J]. Colloids and Surfaces B:Biointerfaces,2018,167:385−391.
[15] GEBICKI J M, HICKS M. Preparation and properties of vesicles enclosed by fatty acid membranes[J]. Chemistry and Physics of Lipids,1976,16(2):142−160.
[16] 涂小艳. 刺梨渣中种子油提取及其在囊泡制备上的应用研究[D]. 贵阳:贵州大学, 2019. [TU X Y. Extraction of seed oil from prickly pear residue and its application in preparation of vesicles[D]. Guiyang:Guizhou University, 2019.] TU X Y. Extraction of seed oil from prickly pear residue and its application in preparation of vesicles[D]. Guiyang: Guizhou University, 2019.
[17] NAMANI T, ISHIKAWA T, MORIGAKI K, et al. Vesicles from docosahexaenoic acid[J]. Colloids and Surfaces B:Biointerfaces,2007,54(1):118−123.
[18] DEAMER D, SINGARAM S, RAJAMANI S, et al. Self-assembly processes in the prebiotic environment[J]. Philosophical Transactions:Biological Sciences,2006,361(1474):1809−1818.
[19] HUANG L, LI D, MA Y, et al . Dietary fatty acid-mediated protein encapsulation simultaneously improving the water-solubility, storage stability, and oral absorption of astaxanthin[J]. Food Hydrocolloids, 2022(123-Feb.):107152.
[20] ZHU T F, BUDIN I, SZOSTAK J W. Preparation of fatty acid or phospholipid vesicles by thin-film rehydration[J]. In Methods in Enzymology,2013,533:267−274.
[21] ZHAO L S, TEMELLI F. Preparation of anthocyanin-loaded liposomes usingan improved supercritical carbon dioxide method[J]. Innovative Food Science & Emerging Technologies,2017,39:119−128.
[22] SEPLVEDA C T, ALEM N A, ZAPATA J E, et al. Characterization and storage stability of spray dried soy-rapeseed lecithin/trehalose liposomes loaded with a tilapia viscera hydrolysate[J]. Innovative Food Science & Emerging Technologies,2021,71:102708.
[23] TAI K, RAPPOLT M, MAO L, et al. Stability and release performance ofcurcumin-loaded liposomes with varying content of hydrogenated phospholipids[J]. Food Chemistry,2020,326:126973.
[24] HU M, MCCLEMENTS J, DECKER E A. Lipid oxidation in corn oil-in-water emulsions stabilized by casein, whey protein isolate, and soy protein isolate[J]. Agriculture Food Chemistry,2003,51(6):1696−1700.
[25] FIORAMONTI S A, RUBIOLO A C, SANTIAGO L G. Characterisation of freeze-dried flaxseed oil microcapsules obtained by multilayer emulsions[J]. Powder Technology,2017,319:238−244.
[26] LIU W, WANG J, MCCLEMENTS D J, et al. Encapsulation of β-carotene-loaded oil droplets in caseinate/alginate microparticles:Enhancement of carotenoid stability and bioaccessibility[J]. Journal of Functional Foods,2018,40:527−535.
[27] 李贤. 辣椒红色素类脂囊泡的制备及稳定性研究[D]. 北京:北京林业大学, 2014. [LI X. Preparation and stability of paprika red noisome[D]. Beijing:Beijing Forestry University, 2014.] LI X. Preparation and stability of paprika red noisome[D]. Beijing: Beijing Forestry University, 2014.
[28] 常振刚, 刘彦君, 潘丽, 等. 植物甾醇油酸酯-虾青素复合脂质体的制备工艺优化[J]. 中国油脂,2023,48(6):108−113,144. [CHANG Z G, LIU Y J, PAN L, et al. Optimization of preparation process of liposomes co-encapsulating phytosterol oleate and astaxanthin[J]. China Oils and Fats,2023,48(6):108−113,144.] CHANG Z G, LIU Y J, PAN L, et al. Optimization of preparation process of liposomes co-encapsulating phytosterol oleate and astaxanthin[J]. China Oils and Fats, 2023, 48(6): 108−113,144.
[29] 禹瑞, 吕东霞, 谈秀凤. 橙皮苷脂质体的制备及其体内药动学研究[J]. 中成药,2022,44(8):2443−2449. [YU R, LÜ D X, TAN X F. Preparation and in vivo pharmacokinetics of hesperidin liposomes[J]. Chinese Traditional Patent Medicine,2022,44(8):2443−2449.] YU R, LÜ D X, TAN X F. Preparation and in vivo pharmacokinetics of hesperidin liposomes[J]. Chinese Traditional Patent Medicine, 2022, 44(8): 2443−2449.
[30] CHEN S, HANNING S, FALCONER J, et al. Recent advances in non-ionic surfactant vesicles (niosomes):Fabrication, characterization, pharmaceutical and cosmetic applications[J]. European Journal of Pharmaceutics and Biopharmaceutics,2019,144:18−39.
[31] SHARMA S, BHATT S, SAINI V. Formulation development and evaluation of novel vesicular carrier for enhancement of bioavailability of poorly soluble drug[J]. Food Chemistry,2021,9(1):70−82.
[32] 陈亮. 杜仲籽油脂质体制备及其理化性质研究[D]. 吉首:吉首大学, 2020. [CHEN L. Studies on the preparation and characteristics of Eucommia ulmoides seed oil liposome[D]. Jishou:Jishou University, 2020.] CHEN L. Studies on the preparation and characteristics of Eucommia ulmoides seed oil liposome[D]. Jishou: Jishou University, 2020.
[33] 徐硕, 何颖慧, 张子豪, 等. 高包埋率还原型谷胱甘肽纳米脂质体的制备工艺优化[J]. 山东理工大学学报(自然科学版),2022,36(3):38−44. [XU S, HE Y H, ZHANG Z H, et al. Optimization of preparation process of reduced glutathione nanoliposomes with high entrapment efficiency[J]. Shandong University of Technology,2022,36(3):38−44.] XU S, HE Y H, ZHANG Z H, et al. Optimization of preparation process of reduced glutathione nanoliposomes with high entrapment efficiency[J]. Shandong University of Technology, 2022, 36(3): 38−44.
[34] FAN Y, LIU J, WANG D, et al. The preparation optimization and immune effect of epimedium polysaccharide-propolis flavone liposome[J]. Carbohydrate Polymers,2013,94(1):24−30.
[35] BADR-ELDIN S, AHMED O. Optimized nano-transfersomal films for enhanced sildenafil citrate transdermal delivery:Ex vivo and in vivo evaluation[J]. Drug Design Development and Therapy, 2016:1323.
[36] 袁巧月, 吴梵, 王孝治, 等. 雨生红球藻虾青素纳米颗粒的制备及稳定性研究[J]. 食品工业科技,2022,43(16):98−104. [YUAN Q Y, WU F, WANG X Z, et al. Preparation and stability of nanoparticles containing astaxanthin from Haematococcus pluvialis[J]. Science and Technology of Food Industry,2022,43(16):98−104.] YUAN Q Y, WU F, WANG X Z, et al. Preparation and stability of nanoparticles containing astaxanthin from Haematococcus pluvialis[J]. Science and Technology of Food Industry, 2022, 43(16): 98−104.
[37] YEO L, THOMPSON D B, PETERSON D G. Inclusion complexation of flavour compounds by dispersed high-amylose maize starch (HAMS) in an aqueous model system[J]. Food Chemistry, 2016, 199(MAY 15):393−400.
[38] KASSEM M A, EL-SAWY H S, ABD-ALLAH F I, et al. Maximizing the therapeutic efficacy of imatinib mesylate-loaded niosomes on human colon adenocarcinoma using box-behnken design[J]. Journal of Pharmaceutical Sciences,2017,106(1):111−122.
[39] 刘彦君. 植物甾醇酯对虾青素脂质体的性质及膜结构的影响[D]. 郑州:河南工业大学, 2023. [LIU Y J. Effect of phytosterol esters on the propertiesand membrane structure of astaxanthin-loaded liposomes[D]. Zhengzhou:Henan University of Technology, 2023.] LIU Y J. Effect of phytosterol esters on the propertiesand membrane structure of astaxanthin-loaded liposomes[D]. Zhengzhou: Henan University of Technology, 2023.
-
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:




 下载:
下载:



