Mechanism of Acetophenone Fumigation to Inhibit Postharvest Botrytis cinerea in Grape
-
摘要: 灰霉病是葡萄采后贮藏的主要病害之一,探索苯乙酮气相熏蒸对灰霉病菌的抑制机理。当苯乙酮为最低抑菌浓度时,通过电镜观察灰葡萄孢菌丝形态和结构的变化,采用液相色谱-质谱联用仪测定灰葡萄孢脂质和脂肪酸的含量变化,同时测试苯乙酮对葡萄灰霉病的熏蒸防治效果。结果表明,苯乙酮气相熏蒸对灰葡萄孢的最低抑菌浓度(minimum inhibitory concentratio,MIC)为62.50 μL/L。体内条件下,对照组葡萄的病斑直径为MIC苯乙酮处理组的2.58倍(P<0.05),而2×MIC苯乙酮处理组则未出现发病症状。扫描电镜和透射电镜观察到灰葡萄孢受苯乙酮熏蒸后,其菌丝形态表面粗糙,出现干瘪、皱缩的现象,细胞内出现空腔,细胞质基质减少,局部伴有质壁分离现象,而对照组形态和结构则正常。与对照组相比,经苯乙酮气相熏蒸后,灰葡萄孢脂质中神经酰胺类(Cer)显著上调,而磷脂类(PE、LBPA、PS、CL、PA)等显著下调。经KEGG Pathway显著性富集分析差异极显著的通路为AGE-RAGE信号通路和鞘脂代谢。苯乙酮气相熏蒸处理组与对照组差异脂肪酸为22个,上调和下调脂肪酸分别为10个和12个。苯乙酮气相熏蒸能够破坏灰葡萄孢的形态和结构,通过影响其鞘脂代谢和脂肪酸进而控制脂质合成,体内和体外条件下均表现出抑制灰葡萄孢的生长,本研究为研制熏蒸剂应用于葡萄采后灰霉病的防治提供了理论依据。Abstract: Gray mold is one of the main diseases in postharvest storage of grape. To explore the inhibition mechanism of acetophenone fumigation on Botrytis cinerea. When acetophenone was the lowest fungistatic concentration, the morphology and structure of the hypha of B. cinerea were observed by electron microscope. The contents of lipid and fatty acid of B. cinerea were determined by liquid chromatography-mass spectrometry, and the fumigation control effect of acetophenone on B. cinerea was also tested. The results showed that the minimum inhibitory concentratio (MIC) of acetophenone fumigation for B. cinerea was 62.50 μL/L. In vivo, the lesion diameter of the control group was 2.58 times that of the MIC acetophenone treatment group (P<0.05), while no symptoms were observed in the 2×MIC acetophenone treatment group. Scanning electron microscopy (SEM) and transmission electron microscopy (TEM) showed that the mycelial morphology of B. cinerea fumigated with acetophenone was rough, shrimpy, empty cell, reduced cytoplasmic matrix, and local plasmic wall separation. The morphology and structure of the control group were normal. Compared with the control group, after acetophenone fumigation, the levels of Cer in the lipids were significantly up-regulated, while the levels of phospholipids (PE, LBPA, PS, CL, PA) were significantly down regulated. According to the KEGG Pathway enrichment analysis, the AGE-RAGE signaling pathway and sphingolipid metabolism showed significant differences. There were 22 different fatty acids between the acetophenone fumigation group and the control group, 10 up-regulated and 12 down-regulated fatty acids, respectively. Acetophenone fumigation can destroy the morphology and structure of B. cinerea, control lipid synthesis by affecting sphingolipid metabolism and fatty acids, and inhibit the growth of B. cinerea both in vivo and in vitro. This study provides a theoretical basis for the development of fumigants for the control of postharvest gray mold in grape.
-
Keywords:
- acetophenone /
- grapes /
- fumigation /
- Botrytis cinerea /
- inhibition mechanism
-
葡萄(Grape)因富含氨基酸、糖、有机酸、维生素及矿物质等多种营养物质,成为广大消费者喜欢的水果之一[1]。但葡萄采后由于水分持续损失,果梗变得干燥,果实会褐变、质量减轻和软化,极易受到真菌侵染,由灰葡萄孢(Botrytis cinerea)、青霉(Penicillium)、黑曲霉(Aspergillus niger)引起的灰霉病、青霉病、曲霉腐烂病等病害发生十分严重[2−3]。目前对葡萄采后灰霉病的防治中仍以化学杀菌剂二氧化硫(Sulfur dioxide,SO2)为主,其保鲜效果明显,是商业化鲜食葡萄保鲜剂的主要成分。200 μL/L SO2熏蒸处理24 h后损伤接种灰葡萄孢,可以显著降低木纳格葡萄的病情指数和病斑直径[4]。然而熏硫处理存在环境问题和人体安全隐患[5],急需环保高效的方法应用于葡萄保鲜。使用拮抗菌挥发性物质熏蒸处理逐渐成为一项关注度高的绿色采后保鲜技术。由拮抗菌产生的挥发性物质能够抑制病原菌生长和孢子萌发,影响病原菌的细胞膜和细胞壁及形态,干扰其代谢,诱导系统抗性,减轻果实采后病害[6−7]。
目前已有一些研究报道了挥发性物质对采后水果灰霉病菌的抑菌效果,2-乙基己醇可以显著抑制灰葡萄孢的生长,为控制采后灰霉病提供了新的、有前途的生物熏蒸剂[8]。2-苯乙醇[9]、二甲基丁酸、二甲基二硫、二甲基三硫[10]、桂皮醛[11]等也表现出对灰葡萄孢显著的抑制作用。使用苯乙酮(acetophenone)熏蒸处理果蔬可以抑制病原菌的进一步侵染。100 μL/L苯乙酮熏蒸处理后柑橘青霉病发病率降低了25%,当苯乙酮浓度提高至1000 μL/L后,柑橘青霉病发病率为0%[12]。100 μL/L苯乙酮熏蒸12 h后,在体外和体内均对辣椒炭疽病菌表现出较好的抗真菌活性[13]。根据现有数据,苯乙酮是国标GB 2760-2014食品添加剂中允许使用的一种用于食品领域的合成香料[14]。且苯乙酮不存在遗传毒性问题,克莱默分类为1级,低[15]。然而目前还未见关于苯乙酮熏蒸处理葡萄防治灰霉病及其抑制机理的文献报道。
本研究采用平板对扣法测定苯乙酮气相熏蒸对灰葡萄孢的最小抑菌浓度,测试体内条件下对葡萄灰霉病的防治效果,使用扫描电镜和透射电镜观察苯乙酮熏蒸处理灰葡萄孢菌丝形态的变化,通过LC-MS/MS测定灰葡萄孢响应苯乙酮的体内脂质组和脂肪酸的含量变化,阐明苯乙酮熏蒸处理对葡萄采后灰葡萄孢的抑制机理,为苯乙酮作为熏蒸剂控制葡萄采后灰霉病提供理论基础。
1. 材料与方法
1.1 材料与仪器
葡萄灰霉病菌灰葡萄孢 由新疆农业科学院加工所从发病的红地球葡萄中分离保存;甲醇、乙腈、甲酸、异丙醇、乙酸铵、甲基叔丁基醚(均为色谱级) 美国赛默飞世尔公司;异丙醇、乙腈、甲酸 色谱纯,成都市科隆化学品有限公司;苯乙酮 分析纯,上海源叶生物有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基 青岛高科技工业园海博生物技术有限公司;50种脂肪酸标准品和5种稳定同位素标记标准品 上海甄准生物科技有限公司;电镜固定液 武汉赛维尔生物科技有限公司。
Q Exactive™ HF质谱仪、Vanquish™ UHPLC色谱仪、Reacti-Therm氮吹仪 德国赛默飞世尔公司;D3024R低温离心机 美国Scilogex公司;1260 InfinityII 高效液相色谱仪 美国安捷伦科技有限公司;SX-500型高压灭菌锅 日本Tomy Digital Biology公司;Rotina 380R型高速冷冻离心机 郑州长城科工贸有限公司;SW-CJ-2FD型无菌超净工作台 苏州净化设备有限公司;AB Sciex QTRAP 6500+质谱仪、AB SciexExionLCTMAD液相色谱、SU8100扫描电子显微镜 日本HITACHI公司;K850临界点干燥仪 英国Quorum公司。
1.2 实验方法
1.2.1 苯乙酮气相熏蒸对灰葡萄孢的最低抑菌浓度的测定
采用平板对扣法测定苯乙酮气相熏蒸对灰葡萄孢的最低抑菌浓度(minimal inhibitory concentration,MIC)[16],使用打孔器打取直径为8 mm的已活化好的灰葡萄孢菌饼,接入新的PDA培养基中。在空培养皿中放置灭菌离心管管盖,分别吸取苯乙酮1.09、2.18、4.37、8.75和17.50 μL于离心管管盖中,将含灰葡萄孢菌饼的培养基置于其上,最终培养皿中的苯乙酮浓度分别为7.81、15.63、31.25、62.5、125 μL/L。对照组为不加任何试剂的空离心管管盖。每组处理重复3次,然后放置于22 ℃培养箱中培养,4 d后观察并采用“十字交叉法”测量灰葡萄孢的菌落直径。当处理组中灰葡萄孢的菌落直径仅为8 mm时,表示与对照组相比,病斑直径无扩展现象,即该浓度为最低抑菌浓度。
1.2.2 苯乙酮气相熏蒸对葡萄灰霉病的抑菌效果
灰葡萄孢孢子悬浮液的制作[17]:使用移液枪将30 mL无菌水添加至培养7 d后的含灰葡萄孢的培养基中,接种针轻轻划取菌丝,用8层灭菌纱布过滤菌悬液,获得灰葡萄孢孢子悬浮液,使用血球计数板稀释调整浓度为1×106个/mL,备用。
挑选成熟度一致(八成熟)、大小均一、无病虫害的红地球葡萄,使用2%次氯酸钠溶液浸泡2 min,对葡萄表面进行消毒,晾干备用。在无菌超净工作台内使用酒精棉球擦拭塑料盒(尺寸:长15.5 cm,宽10.0 cm,高7.0 cm)后,置于紫外下照射10 min,内部角落处放置灭菌的1.5 mL离心管管盖。根据计算,塑料盒体积为1085 cm3,分别移取浓度为MIC、2×MIC的苯乙酮于离心管管盖中;当塑料盒内苯乙酮终浓度分别为MIC和2×MIC时,应加入的体积为67.81 μL和135.62 μL;对照组则为空离心管管盖中不加入任何试剂。使用无菌注射器在红地球葡萄果实赤道部位打一个直径0.2 cm、深度0.5 cm的孔,使用移液枪吸取10 μL孢子悬浮液注入预先打好的孔内。每个塑料盒中放入15颗接种后的葡萄,盖子密封。室温条件下放置10 d后观察并测定果实的病斑直径。每组处理设6个重复。
1.2.3 采用扫描电镜和透射电镜观察灰葡萄孢菌丝形态的变化
取1.2.1中浓度为1/2×MIC的苯乙酮气相熏蒸对应的灰葡萄孢菌丝,迅速投入电镜固定液室温固定2 h,再转移至4 ℃保存。具体参考曹林青等[18]和李璇等[19]方法进行,并分别在扫描电子显微镜和透射电子显微镜下观察采集图像。
1.2.4 苯乙酮气相熏蒸对灰葡萄孢脂质组分的影响
按照1.2.1中在培养皿离心管盖中加入4.37 μL苯乙酮,使培养皿中苯乙酮最终浓度为31.25 μL/L,而对照组中不加入任何试剂。每组处理设3个重复。取样时使用手术刀刮取灰葡萄孢菌丝体,液氮冷冻后转移至−80 ℃冰箱中。
脂质的提取具体参考谢素雅等[20]的方法。色谱条件:色谱柱为Thermo Accucore C30,柱温:40 ℃流速:0.35 mL/min进样量:5 μL流动相A:(乙腈:水=60:40)+0.1%甲酸+10 mmol/L乙酸铵;流动相B:(异丙醇:乙腈=90:10)+0.1%甲酸+10 mmol/L乙酸铵,色谱梯度洗脱程序见表1。
表 1 色谱梯度洗脱程序Table 1. Chromatographic gradient elution procedure时间(min) 流动相A体积分数(%) 流动相B体积分数(%) 0 70 30 2 70 30 5 57 43 5.1 45 55 11 30 70 16 1 99 18 1 99 18.1 70 30 20 70 30 质谱条件:正负离子模式下,鞘气(sheath gas):40 psi;扫气(sweep gas):0 L/min;辅助气速率(auxiliary gas rate):10 L/min(负离子:7 L/min);电喷雾电压(spray voltage):3.5 kV;毛细管温度(capillary temperature):320 ℃;加热器温度(heater temperature):350 ℃;离子导入射频电平(S-Lens RF level):50;扫描范围(scan range):114~1700 m/z;自动增益控制目标离子数(automatic gain controltarget):3×106个;归一化碰撞能(normalized collision energy):22、24、28 eV(负离子:22、24、28 eV),最大等待注入时间(Injection time):100 ms;隔离窗口(Isolation window):1 m/z;自动增益控制目标离子数(automatic gain control target)(MS2) :2×105个;动态排除(dynamic exclusion):6 s。
1.2.5 苯乙酮气相熏蒸对灰葡萄孢脂肪酸的影响
取样按照1.2.4中进行。样品前处理:标准品准备,准确称取50种脂肪酸标准品,制备浓度为2000 μg/mL混标线性母液,甲醇稀释线性母液得到系列浓度分别为40000、20000、10000、4000、2000、1000、400、200、100、40、20、10 ng/mL的工作液。配制一定浓度的Decanoic acid-d19、Myristic acid-d2、Octadecanoic acid-d35、Eicosanoic acid-d39和Lignoceric acid-d4溶液,混匀得到内标溶液(IS)。线性、内标和质控的母液及工作溶液均保存于−20 ℃冰箱。
脂肪酸提取具体方法参考毕莹等[21]的方法,液氮研磨样本,称取100 mg的菌丝体加入质谱水中,涡旋混匀,为稀释样本;取稀释样本100 μL,加入混合内标溶液的300 μL 沉淀剂(乙腈:异丙醇=1:1),涡旋混匀,冰上静置 30 min,12000 r/min,4 ℃ 离心 10 min,取全部上清液相色谱-质谱联用仪( LC-MS )分析。取上述上清,用内标沉淀剂梯度稀释为20倍,涡旋混匀,12000 r/min离心10 min,取上清LC-MS分析。色谱、质谱方法[22]:A相:0.05%甲酸水溶液,B相:50%异丙醇乙腈;柱温:50 ℃;进样量:2 μL;流速:0.3 mL/min;色谱梯度如表2所示。
表 2 色谱梯度洗脱程序Table 2. Chromatographic gradient elution procedure时间(min) 流动相A体积分数(%) 流动相B体积分数(%) 0 70 30 1.0 70 30 2.0 35 65 11.0 0 100 13.5 0 100 14.0 70 30 15.0 70 30 质谱条件:电喷雾电离源(ESI),负离子电离模式。离子源温度550 ℃,离子源电压−4500 V,气帘气35 psi,雾化气和辅助气均为60 psi。采用多反应监测(MRM)进行扫描。
1.3 数据处理
多元统计分析部分,使用代谢组学数据处理软件metaX对数据进行转换后,进行主成分分析(Principal Components Analysis,PCA)和偏最小二乘法判别分析(Partial Least Squares Discrimination Analysis,PLS-DA),进而得每个代谢物的 变量投影重要度(Variable Importance in the Projection,VIP)值。单变量分析部分,基于t检验来计算各代谢物在两组间统计学显著性(P值),并计算代谢物在两组间的差异倍数(Fold Change,FC)值。差异代谢物筛选的默认标准为VIP>1,P<0.05且FC≥2或FC≤0.5。火山图和气泡图均采用R包ggplot2绘制,可以综合代谢物的VIP值、log2(Fold Change)和−log10(P值)三个参数,来筛选感兴趣的代谢物。采用SPSS 20软件的Duncan多重比较检验法进行差异显著性分析(P<0.05,差异显著),Excel绘制图表。
2. 结果与分析
2.1 苯乙酮气相熏蒸对灰葡萄孢菌落生长的影响
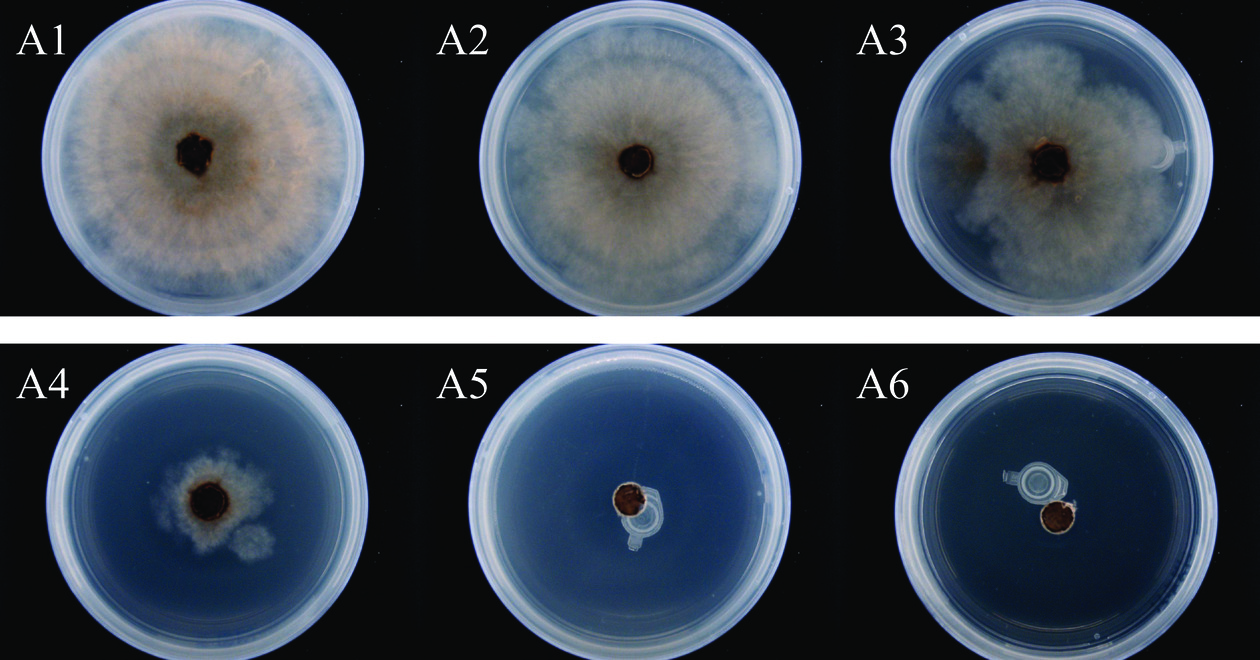
如图1所示,随着苯乙酮浓度升高,气相熏蒸对灰葡萄孢的抑制效果逐渐增强,表现出浓度效应。培养4 d后,对照组菌落生长至培养皿边缘,苯乙酮浓度为7.81、15.63 μL/L时,对灰葡萄孢无明显抑制效果;苯乙酮浓度为31.25 μL/L时,菌落直径为4.04±0.12 cm(表3)。当苯乙酮浓度升至62.50 μL/L时,则能够完全抑制灰葡萄孢的生长,且更高浓度条件下无菌落生长,而对照组正常生长至长满平板,因此,苯乙酮气相熏蒸对灰葡萄孢的最低抑菌浓度(minimum inhibitory concentratio,MIC)为62.50 μL/L。
表 3 苯乙酮气相熏蒸对灰葡萄孢菌落直径的影响Table 3. Effect of acetophenone fumigation on colony diameter of B.cinerea浓度(μL/L) 菌落直径(cm) 1 d 2 d 3 d 4 d CK 1.83±0.09a 3.80±0.15a 6.89±0.13a 9.00a 7.81 1.11±0.23bc 3.26±0.28b 6.65±0.13a 9.00a 15.63 1.16±0.08b 3.37±0.27b 6.22±0.08b 9.00a 31.25 0.93±0.04cd 1.52±0.16c 2.53±0.37c 4.04±0.12b 62.5 0.80d 0.80d 0.80d 0.80c 125 0.80d 0.80d 0.80d 0.80c 注:同列不同小写字母表示差异显著(P<0.05)。 2.2 苯乙酮气相熏蒸对葡萄灰霉病的抑制效果
使用浓度为MIC和2MIC(即62.50 μL/L和125 μL/L)的苯乙酮对接种灰葡萄孢的红地球葡萄进行密封熏蒸(图2),经7 d后,对照组、MIC组葡萄的病斑直径分别为1.88±0.12 cm和0.73±0.17 cm,达到显著性差异(P<0.05),而2×MIC组葡萄未出现发病症状。由此可以看出经过苯乙酮气相熏蒸后,显著减轻了葡萄灰霉病的发病程度,苯乙酮具有应用于葡萄采后保鲜的潜力。
2.3 苯乙酮气相熏蒸对灰葡萄孢菌丝形态的影响
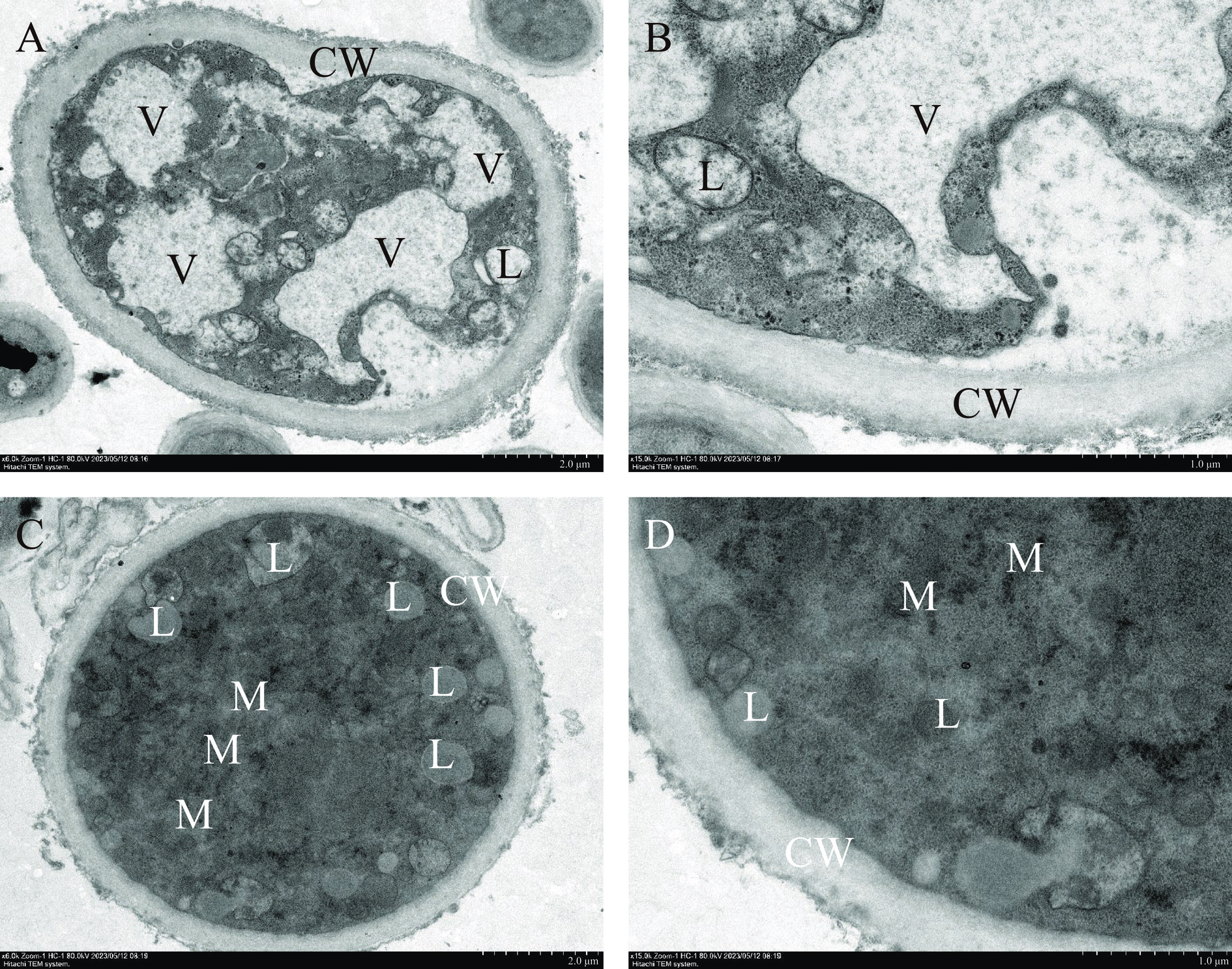
利用扫描电子显微镜(SEM)观察苯乙酮气相熏蒸对灰葡萄孢菌丝微观形态的影响。如图3A和图3B所示,经31.25 μL/L苯乙酮熏蒸后,视野中几乎看不到灰葡萄孢的孢子,菌丝表面粗糙,出现干瘪、皱缩的现象,并伴有孔洞,甚至菌丝断裂。而对照组中菌丝生长正常,饱满粗壮,孢子结构完整(图3C、图3D)。
利用透射电子显微镜(TEM)观察苯乙酮气相熏蒸对灰葡萄孢菌丝细胞内部各细胞器形态的影响。如图4A和图4B所示,经31.25 μL/L苯乙酮熏蒸后,灰葡萄孢细胞内出现空腔,细胞质基质减少,局部伴有质壁分离现象。对照组则细胞整体结构相对正常,切面结构清晰,胞质均匀。细胞壁完整,厚度均一。细胞膜结构正常,未见明显质壁分离。线粒体等细胞器结构正常,且轮廓清晰(图4C、图4D)。
2.4 苯乙酮气相熏蒸对灰葡萄孢脂质组分的影响
2.4.1 灰葡萄孢菌丝体差异脂质的筛选与鉴定
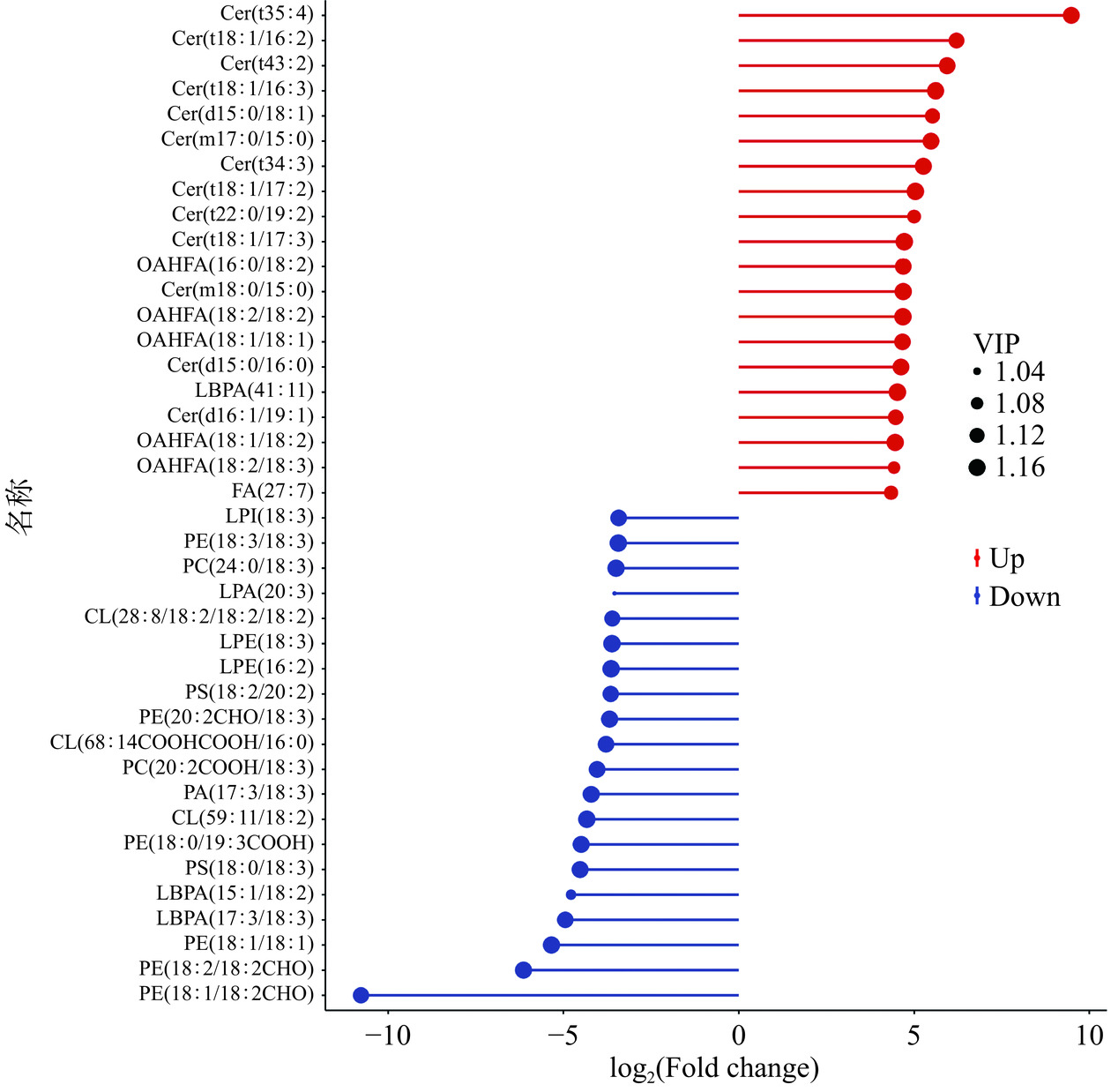
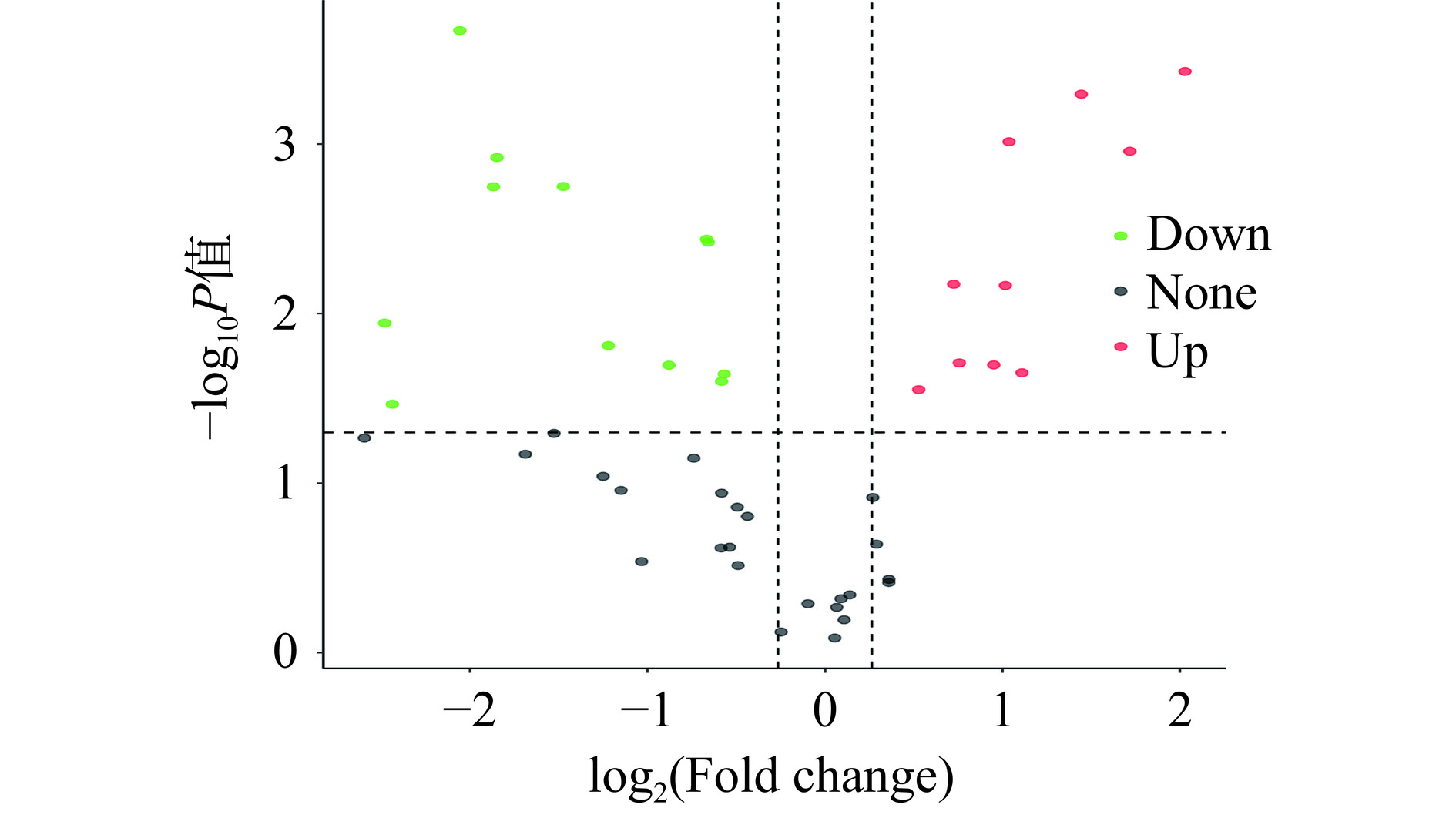
采用PLS-DA模型第一主成分的VIP值,并结合T-test的P值来寻找差异性表达代谢物,共筛选到253种差异代谢物,其中有122个代谢物显著上调,131个代谢物显著下调。将差异代谢物上调和下调差异倍数排名前20挑选出来,以代谢物差异倍数2为底取对数,作出火柴棍图(图5)。与对照组相比,经苯乙酮气相熏蒸后,灰葡萄孢脂质中神经酰胺类(Cer)均显著上调,其中Cer(t35:4)差异倍数高达9.49;而磷脂类(PE、LBPA、PS、CL、PA)等均显著下调,磷脂酰乙醇胺PE(18:1/18:2CHO)差异倍数达到10.78(P<0.05)。
2.4.2 灰葡萄孢菌丝体脂质代谢通路富集分析
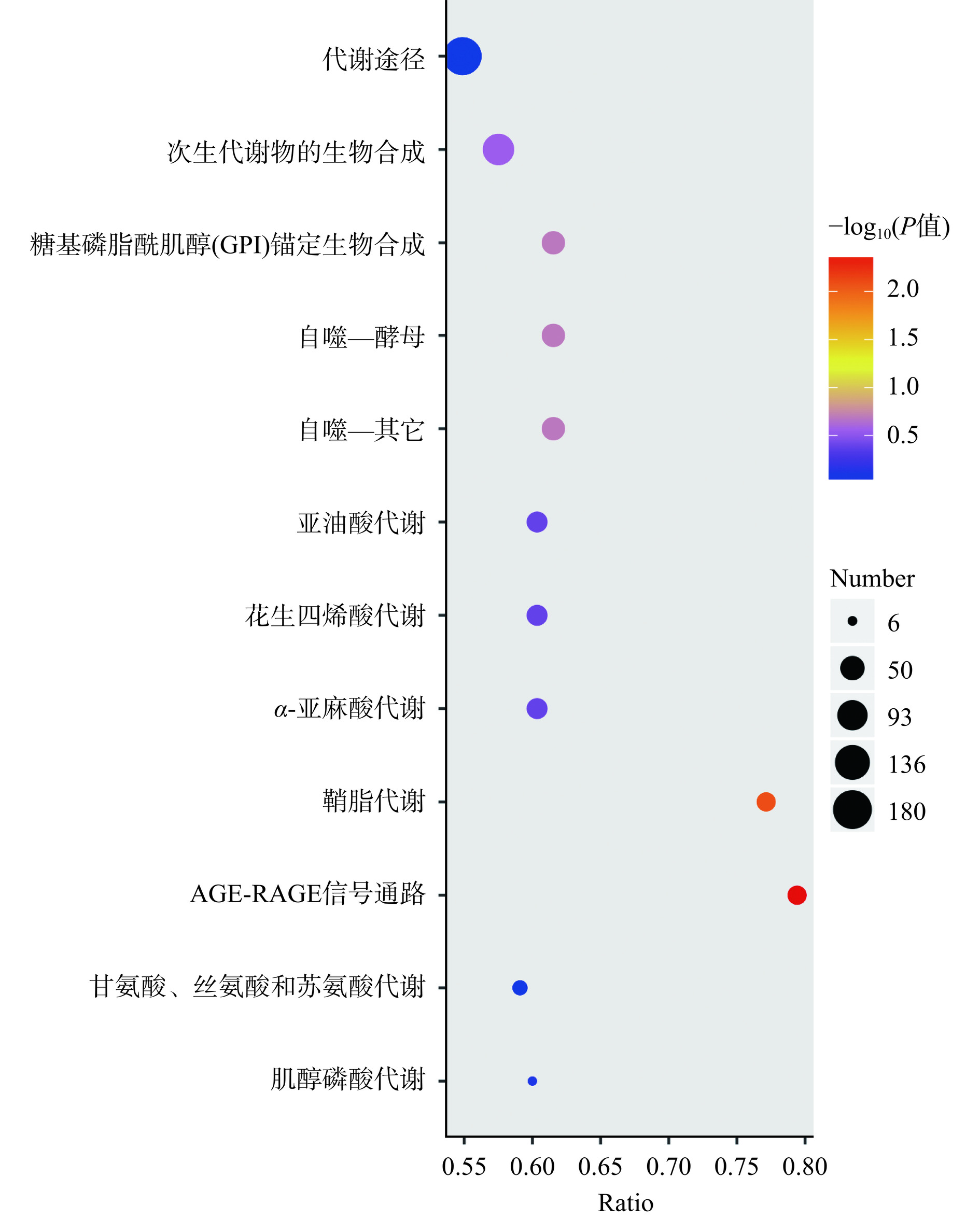
根据上述富集结果,绘制富集到的KEGG通路的分析气泡图(只展示top12的结果)。如图6所示,差异极显著的通路为AGE-RAGE信号通路和鞘脂代谢,P值分别为4.03×10−3和8.19×10−3(P<0.01),均富集到Cer(t35:4)等27种差异代谢脂质。而其它富集的通路P值都大于0.05,即未达到显著性差异。
2.5 苯乙酮气相熏蒸对灰葡萄孢脂肪酸的影响
对每个代谢物差异倍数以2为底取对数,将P值以10为底取对数的绝对值,做出火山图。如图7所示,苯乙酮气相熏蒸处理组与对照组差异表达代谢物为22个,上调和下调脂肪酸分别为10个和12个。筛选出22个差异脂肪酸相关情况具体见表4。由表可知,差异脂肪酸大都为不饱和脂肪酸,说明灰葡萄孢中不饱和脂肪酸受苯乙酮熏蒸处理影响较大。上调的脂肪酸中十五碳烯酸(顺-10),处理组与对照组差异倍数达到4.08倍(P<0.05)。而下调的脂肪酸中十八碳烯酸(顺-11)/异油酸*,处理组与对照组差异倍数达到0.68倍(P<0.05)。
表 4 处理组和对照组灰葡萄孢菌丝体的差异脂肪酸信息Table 4. Information of different fatty acids in the mycelia of B. cinerea between the treatment group and the control group名称 缩写 FC值 P值 log2FC 上调/下调 十三烷酸 C13:0 1.652546424 0.006715013 0.724690801 上调 十四烷酸/肉豆蔻酸 C14:0 2.721709201 0.000506782 1.444512931 上调 十四碳烯酸(顺-9)/肉豆蔻烯酸 C14:1 1.933010235 0.020005889 0.950849277 上调 十五烷酸 C15:0 1.441474772 0.028001631 0.527545588 上调 十五碳烯酸(顺-10) C15:1 4.083933745 0.000372126 2.029959461 上调 十五碳烯酸(反-10) C15:1T 3.290376838 0.001100943 1.718252822 上调 十六碳烯酸(顺-9)/棕榈油酸 C16:1 2.022611863 0.00683162 1.016219495 上调 十六碳烯酸(反-9)/反棕榈油酸 C16:1T 2.158811883 0.022262062 1.110237533 上调 十七碳烯酸(顺-10) C17:1 0.277711384 0.001198833 −1.848341779 下调 十七碳烯酸(反-10) C17:1T 0.273901766 0.001785116 −1.86826953 下调 十八碳烯酸(顺-9)/油酸* C18:1(n-9) 0.668455626 0.02501031 −0.581096302 下调 十八碳烯酸(顺-11)/异油酸* C18:1(n-7) 0.675482504 0.022647907 −0.566009692 下调 十八碳烯酸(反-9)/反油酸* C18:1(n-9)T 0.630194653 0.003645837 −0.666130582 下调 十八碳烯酸(反-11)/反异油酸* C18:1(n-7)T 0.634306423 0.003791811 −0.656748144 下调 十九碳烯酸(反-10) C19:1(n-9)T 0.179063889 0.011377688 −2.481453671 下调 二十碳烯酸(反-11) C20:1T 0.359966079 0.00177864 −1.474067133 下调 十八碳三烯酸(顺-9,12,15)/α-亚麻酸 C18:3(n-3) 0.544082171 0.02007379 −0.878103541 下调 二十碳二烯酸(顺-11,14) C20:2 0.240179696 0.000213299 −2.0578139 下调 二十二碳烯酸(反-13)/巴惟酸 C22:1T 0.429270829 0.015378019 −1.220039956 下调 二十二碳四烯酸(顺-7,10,13,16) C22:4 2.051906183 0.000968044 1.03696477 上调 二十碳三烯酸(顺-8,11,14)/HOMO-γ-亚麻酸 C20:3(n-6) 0.184472445 0.034134232 −2.438522762 下调 十八碳烯酸(顺-6)/岩芹酸 C18:1(n-12) 1.689458938 0.019463847 0.756561287 上调 注:标*物质为同分异构体无法分离。 3. 讨论
已有研究报道挥发性物质熏蒸可以抑制果实采后病害,郭虹娜[11]使用浓度为62.50 μL/L的桂皮醛预先熏蒸草莓,整个贮藏过程中对照组灰霉病斑直径始终明显大于处理组(P<0.05),尤其是第12 d时对照组病斑直径为2.3 cm,而处理组病斑直径仅为1.2 cm,对照组为处理组的1.9倍。本研究中使用最低抑菌浓度下(62.5 μL/L)苯乙酮熏蒸接种灰葡萄孢后的葡萄,对照组的病斑直径为处理组的2.58倍(P<0.05);而提高苯乙酮浓度至125 μL/L时,未出现发病症状。由此可见,苯乙酮具有应用葡萄采后灰霉病防治的潜力。
研究表明挥发性物质熏蒸处理能够显著改变病原菌的形态,20 μL/L 2-乙基己醇熏蒸处理灰葡萄孢菌丝出现大量畸形、多处粗细不均匀且存在不规则变形扭曲。空白对照菌丝正常、饱满且粗细均匀[23]。毕赤酵母W9挥发性物质熏蒸处理灰葡萄孢,菌丝细胞形成较大的空泡,部分细胞表现出轻微的质壁分离,线粒体出现肿胀,基体电子密度降低。对照组菌丝边界清晰,脂质体、线粒体、细胞核、核仁等细胞器清晰可见[24]。本研究中苯乙酮熏蒸处理后灰葡萄孢的形态和结构也发生了显著的变化,而对照组则正常,说明苯乙酮可以通过改变灰葡萄孢的形态和结构从而达到抑菌的作用。
脂质既是构成生物体膜的主要成分,也可作为细胞的信号分子和能量物质。甘油磷脂、鞘脂和甾醇是真菌细胞膜的主要成分,有大量证据表明脂质分子是真菌致病过程中的关键决定因素[25]。使用200 μg/mL香芹酚处理黄曲霉后,黄曲霉细胞内甘油三酯(TG)、甘油二酯(DG)、磷脂酸(PA)、磷脂酰胆碱(PC)、脑磷脂(PE)、磷脂酰丝氨酸(PS)、脂肪酸(FA)在香芹酚处理组均下调,磷脂酰肌醇(PI)和磷脂酰甘油(PG)上调[26]。Yang等[27]采用超高效液相色谱串联质谱(UHPLC- MS/MS)技术的脂质学方法,对纳米乳液处理下指状青霉菌丝体进行了脂质组绝对定量分析,结果表明菌丝体的脂质稳态被破坏,特别是脑磷脂、磷脂酰丝氨酸、磷脂酰肌醇、溶血卵磷脂(LPC)、溶血磷脂酸(LPA)、溶血脑磷脂(LPE)、甘油二酯(TG)和甘油三酯(DG)这8个脂质亚类发生了显著的变化。本研究中苯乙酮熏蒸处理后灰葡萄孢脑磷脂、磷脂酰丝氨酸和磷脂酸等显著下降,而神经酰胺类(cer)显著提高。使用浓度为MIC的棕榈酸处理溶藻弧菌后[28],也得到了相似的结果,其体内cer的合成过程显著增强,暗示棕榈酸促进菌体凋亡过程。苯乙酮熏蒸处理显著改变了灰葡萄孢脂质的含量,控制了脂质的合成,进而可能影响灰葡萄孢细胞膜的功能。
Qu等[29]利用超高效液相色谱-高分辨率质谱(UHPLC-HRMS)测定香芹酚对黄曲霉脂质组的影响结果表明,200 µg/mL香芹酚处理后,将对照组和处理组的不同脂质代谢途径进行分析,发现与香芹酚处理相关的脂质代谢途径中,甘油磷脂代谢最为丰富。本研究中处理组和对照组灰葡萄孢菌丝体脂质代谢通路富集分析差异极显著的通路有鞘脂代谢,在生物体内鞘脂是以鞘氨醇和脂肪酸为基本骨架构成的一类化合物,游离的鞘氨醇与不同的物质结合形成神经酰胺、鞘磷脂和鞘糖脂3类鞘脂。鞘脂代谢途径中产生的中间产物是重要的信号分子,影响着细胞的正常生理过程,抗逆反应以及信号转导等[30−31]。鞘脂还与病原真菌的生长和致病性密切相关,它能够显著影响稻瘟病菌附着孢的发育,从而阻止其侵染进程[32]。脂质组结果中差异脂质中鞘脂物质神经酰胺类(cer)上调表达,说明苯乙酮熏蒸处理通过影响灰葡萄孢鞘脂代谢从而干扰脂质合成,阻止灰葡萄孢的正常生长。
脂肪酸和脂质是密切相关的,脂肪酸是脂质的主要组成部分之一。经单癸酸甘油酯处理后,金黄色葡萄球菌、枯草芽孢杆菌和蜡样芽孢杆菌的细胞膜脂肪酸含量、短链脂肪酸(SCFAs)/支链脂肪酸(BCFAs)的比例和膜蛋白的分布均发生明显变化,导致膜流动性的显著性降低[33]。苯乙酮熏蒸处理显著影响了灰葡萄孢的脂肪酸变化,处理组与对照组差异表达代谢物为22个,上调和下调的脂肪酸分别为10个和12个,结合脂质组代谢结果,推测苯乙酮通过影响鞘脂代谢和脂肪酸进而控制脂质合成,表现为灰葡萄孢的生长受到抑制。
4. 结论
当苯乙酮浓度为62.50 μL/L时,灰葡萄孢菌丝形态和结构均受到显著改变,而对照组形态则正常。苯乙酮可以通过影响灰葡萄孢的鞘脂代谢和脂肪酸进而控制脂质合成,阻止灰葡萄孢正常生长,从而达到抑菌作用。同时体内条件下,2×MIC苯乙酮处理组能够完全控制红地球葡萄灰霉病的发生。因此,苯乙酮作为熏蒸剂应用于葡萄采后灰霉病的防治具有极大的潜力。
-
表 1 色谱梯度洗脱程序
Table 1 Chromatographic gradient elution procedure
时间(min) 流动相A体积分数(%) 流动相B体积分数(%) 0 70 30 2 70 30 5 57 43 5.1 45 55 11 30 70 16 1 99 18 1 99 18.1 70 30 20 70 30 表 2 色谱梯度洗脱程序
Table 2 Chromatographic gradient elution procedure
时间(min) 流动相A体积分数(%) 流动相B体积分数(%) 0 70 30 1.0 70 30 2.0 35 65 11.0 0 100 13.5 0 100 14.0 70 30 15.0 70 30 表 3 苯乙酮气相熏蒸对灰葡萄孢菌落直径的影响
Table 3 Effect of acetophenone fumigation on colony diameter of B.cinerea
浓度(μL/L) 菌落直径(cm) 1 d 2 d 3 d 4 d CK 1.83±0.09a 3.80±0.15a 6.89±0.13a 9.00a 7.81 1.11±0.23bc 3.26±0.28b 6.65±0.13a 9.00a 15.63 1.16±0.08b 3.37±0.27b 6.22±0.08b 9.00a 31.25 0.93±0.04cd 1.52±0.16c 2.53±0.37c 4.04±0.12b 62.5 0.80d 0.80d 0.80d 0.80c 125 0.80d 0.80d 0.80d 0.80c 注:同列不同小写字母表示差异显著(P<0.05)。 表 4 处理组和对照组灰葡萄孢菌丝体的差异脂肪酸信息
Table 4 Information of different fatty acids in the mycelia of B. cinerea between the treatment group and the control group
名称 缩写 FC值 P值 log2FC 上调/下调 十三烷酸 C13:0 1.652546424 0.006715013 0.724690801 上调 十四烷酸/肉豆蔻酸 C14:0 2.721709201 0.000506782 1.444512931 上调 十四碳烯酸(顺-9)/肉豆蔻烯酸 C14:1 1.933010235 0.020005889 0.950849277 上调 十五烷酸 C15:0 1.441474772 0.028001631 0.527545588 上调 十五碳烯酸(顺-10) C15:1 4.083933745 0.000372126 2.029959461 上调 十五碳烯酸(反-10) C15:1T 3.290376838 0.001100943 1.718252822 上调 十六碳烯酸(顺-9)/棕榈油酸 C16:1 2.022611863 0.00683162 1.016219495 上调 十六碳烯酸(反-9)/反棕榈油酸 C16:1T 2.158811883 0.022262062 1.110237533 上调 十七碳烯酸(顺-10) C17:1 0.277711384 0.001198833 −1.848341779 下调 十七碳烯酸(反-10) C17:1T 0.273901766 0.001785116 −1.86826953 下调 十八碳烯酸(顺-9)/油酸* C18:1(n-9) 0.668455626 0.02501031 −0.581096302 下调 十八碳烯酸(顺-11)/异油酸* C18:1(n-7) 0.675482504 0.022647907 −0.566009692 下调 十八碳烯酸(反-9)/反油酸* C18:1(n-9)T 0.630194653 0.003645837 −0.666130582 下调 十八碳烯酸(反-11)/反异油酸* C18:1(n-7)T 0.634306423 0.003791811 −0.656748144 下调 十九碳烯酸(反-10) C19:1(n-9)T 0.179063889 0.011377688 −2.481453671 下调 二十碳烯酸(反-11) C20:1T 0.359966079 0.00177864 −1.474067133 下调 十八碳三烯酸(顺-9,12,15)/α-亚麻酸 C18:3(n-3) 0.544082171 0.02007379 −0.878103541 下调 二十碳二烯酸(顺-11,14) C20:2 0.240179696 0.000213299 −2.0578139 下调 二十二碳烯酸(反-13)/巴惟酸 C22:1T 0.429270829 0.015378019 −1.220039956 下调 二十二碳四烯酸(顺-7,10,13,16) C22:4 2.051906183 0.000968044 1.03696477 上调 二十碳三烯酸(顺-8,11,14)/HOMO-γ-亚麻酸 C20:3(n-6) 0.184472445 0.034134232 −2.438522762 下调 十八碳烯酸(顺-6)/岩芹酸 C18:1(n-12) 1.689458938 0.019463847 0.756561287 上调 注:标*物质为同分异构体无法分离。 -
[1] ROMERO I, VAZQUEZ H M, MAESTRO G I, et al. Table grapes during postharvest storage:A review of the mechanisms implicated in the beneficial effects of treatments applied for quality retention[J]. International Journal Molecular Sciences,2020,21(23):9320. doi: 10.3390/ijms21239320
[2] 张苗苗, 张雨晨, 杨怡中, 等. 拮抗菌防治葡萄采后病害研究进展[J]. 食品工业科技,2024,45(9):410−418. [ZHANG M M, ZHANG Y C, YANG Y Z, et al. Inhibitory action to prevent and control postharvest diseases of grape research progress[J]. Food Industry Science and Technology,2024,45(9):410−418.] ZHANG M M, ZHANG Y C, YANG Y Z, et al. Inhibitory action to prevent and control postharvest diseases of grape research progress[J]. Food Industry Science and Technology, 2024, 45(9): 410−418.
[3] ROMANAZZI G, LICHTER A, GABLER F M, et al. Recent advances on the use of natural and safe alternatives to conventional methods to control postharvest gray mold of table grapes[J]. Postharvest Biology and Technology,2012,63:141−147. doi: 10.1016/j.postharvbio.2011.06.013
[4] 王曼. 基于硫代谢解析二氧化硫诱导葡萄采后对灰霉病抗性的影响[D]. 乌鲁木齐:新疆农业大学, 2022:20−22. [WANG M. Analysis of the effect of sulfur dioxide induced postharvest grape resistance to gray mold disease based on sulfur metabolism[D]. Urumqi:Xinjiang Agricultural University, 2022:20−22.] WANG M. Analysis of the effect of sulfur dioxide induced postharvest grape resistance to gray mold disease based on sulfur metabolism[D]. Urumqi: Xinjiang Agricultural University, 2022: 20−22.
[5] 王凤超. 二氧化硫处理对鲜食葡萄贮藏病害及生理的影响[D]. 乌鲁木齐:新疆农业大学, 2013:15. [WANG F C. Effects of sulfur dioxide treatment on storage diseases and physiology of table grapes[D]. Urumqi:Xinjiang Agricultural University, 2013:15.] WANG F C. Effects of sulfur dioxide treatment on storage diseases and physiology of table grapes[D]. Urumqi: Xinjiang Agricultural University, 2013: 15.
[6] TORAL L, RODRIGUEZ M, MARTINEZ C F, et al. Identification of volatile organic compounds in extremophilic bacteria and their effective use in biocontrol of postharvest fungal phytopathogens[J]. Front Microbiology,2021,12(12):773092.
[7] 钟涛, 王智荣, 杜木英. 微生物源挥发性物质防治采后果蔬病害的研究进展[J]. 微生物学报,2019,61(7):1771−1785. [ZHONG T, WANG Z R, DU M Y. Research progress on the control of postharvest fruit and vegetable diseases by volatile substances derived from microorganisms[J]. Acta Microbiologica Sinica,2019,61(7):1771−1785.] ZHONG T, WANG Z R, DU M Y. Research progress on the control of postharvest fruit and vegetable diseases by volatile substances derived from microorganisms[J]. Acta Microbiologica Sinica, 2019, 61(7): 1771−1785.
[8] WANG C, DUAN T, SHI L, et al. Characterization of volatile organic compounds produced by Bacillus siamensis YJ15 and their antifungal activity against Botrytis cinerea[J]. Plant Disease,2022,106(9):2321−2329. doi: 10.1094/PDIS-01-22-0230-RE
[9] YALAGE D S M, SCHMIDTKE L M, GAMBETTA J M, et al. Aureobasidium pullulans volatilome identified by a novel, quantitative approach employing SPME-GC-MS, suppressed Botrytis cinerea and Alternaria alternata in vitro[J]. Scientific Reports,2020,10(1):4498.
[10] 钟涛. 荧光假单胞菌ZX挥发性产物生物防治采后葡萄灰霉病及其抑菌机制研究[D]. 重庆:西南大学, 2022:31−32. [ZHONG T. Biological control of postharvest gray mold of grape by volatile products of Pseudomonas fluorescens ZX and its inhibitory mechanism[D]. Chongqing:Southwest University, 2025:31−32.] ZHONG T. Biological control of postharvest gray mold of grape by volatile products of Pseudomonas fluorescens ZX and its inhibitory mechanism[D]. Chongqing: Southwest University, 2025: 31−32.
[11] 郭虹娜. 葡萄汁有孢汉逊酵母挥发物抑制草莓采后灰霉病生防机理研究[D]. 南京:南京农业大学, 2020:57. [GUO H N. Study on the biocontrol mechanism of postharvest gray mold of strawberry inhibited by the volatiles of Hansenia saccharomyces spore in grape juice[D]. Nanjing:Nanjing Agricultural University, 2020:57.] GUO H N. Study on the biocontrol mechanism of postharvest gray mold of strawberry inhibited by the volatiles of Hansenia saccharomyces spore in grape juice[D]. Nanjing: Nanjing Agricultural University, 2020: 57.
[12] 李其利. 链霉菌的鉴定及其防病潜能和防病机制的研究[D]. 武汉:华中农业大学, 2011:120. [LI Q L. Identification of Streptomyces and its preventive potential and mechanism[D]. Wuhan:Huazhong Agricultural University, 2011:120.] LI Q L. Identification of Streptomyces and its preventive potential and mechanism[D]. Wuhan: Huazhong Agricultural University, 2011: 120.
[13] SAWAI B, WANIDA P, RUTHAIWAN B, et al. Fumigant activity of volatile compounds of Streptomyces philanthi RM-1-138 and pure chemicals (acetophenone and phenylethyl alcohol) against anthracnose pathogen in postharvest chili fruit[J]. Crop Protection,2018,103:1−8,10. doi: 10.1016/j.cropro.2017.09.002
[14] 中华人民共和国国家卫生和计划生育委员会. GB 2760-2014食品安全国家标准食品添加剂使用标准[S]. 北京:中国标准出版社, 2015. [National Health and Family Planning Commission, People's Republic of China. GB 2760-2014 Food Safety National standard Food additives use standard[S]. Beijing:Standards Press of China, 2015.] National Health and Family Planning Commission, People's Republic of China. GB 2760-2014 Food Safety National standard Food additives use standard[S]. Beijing: Standards Press of China, 2015.
[15] API A M, BELSITO D, BOTELHO D, et al. RIFM fragrance ingredient safety assessment, acetophenone, CAS Registry Number 98-86-2[J]. Food and Chemical Toxicology,2018,118:162−S169. doi: 10.1016/j.fct.2018.06.050
[16] 黄伟, 王宁, 刘峰娟, 等. 产香真菌M6-5的鉴定及其挥发性物质对库尔勒香梨果实采后黑斑病的抑制效果[J]. 食品科学, 2022, 43(22):199−206. [HUANG W, WANG N, LIU F J, et al. Identification of aroma producing fungus M6-5 and inhibitory effect of its volatile substances on postharvest black spot of Korla fragrant pear[J]. Food Science, 2002, 43(22):199−206.] HUANG W, WANG N, LIU F J, et al. Identification of aroma producing fungus M6-5 and inhibitory effect of its volatile substances on postharvest black spot of Korla fragrant pear[J]. Food Science, 2002, 43(22): 199−206.
[17] 李博雅, 鲁姸璇, 谢家贝, 等. 武夷菌素防治葡萄灰霉病的作用及机理[J]. 中国生物防治学报,2023,39(3):676−683. [LI B Y, LU Y X, XIE J B, et al. Effect and mechanism of Wuyiomycin in control of gray mold of grape[J]. Chinese Journal of Biological Control,2023,39(3):676−683.] LI B Y, LU Y X, XIE J B, et al. Effect and mechanism of Wuyiomycin in control of gray mold of grape[J]. Chinese Journal of Biological Control, 2023, 39(3): 676−683.
[18] 曹林青, 詹发强, 高宇洁, 等. 嗜线虫致病杆菌抑制灰葡萄孢的效应[J]. 微生物学通报, 2021, 48(11):4123−4133. [CAO L Q, ZHAN F Q, Gao Y J, et al. Inhibitory effect of nematophilic pathogenic bacillus on Botrys cinerea[J]. Bulletin of Microbiology, 2019, 48(11):4123−4133.] CAO L Q, ZHAN F Q, Gao Y J, et al. Inhibitory effect of nematophilic pathogenic bacillus on Botrys cinerea[J]. Bulletin of Microbiology, 2019, 48(11): 4123−4133.
[19] 李璇, 孔谦, 陈中健, 等. 不同温度下黄曲霉菌菌丝超微形态的比较研究[J]. 菌物学报,2021,40(7):1648−1659. [LI X, KONG Q, CHEN Z J, et al. Comparative study on the ultrastructure of fungal hypha of Aspergillus flavus at different temperatures[J]. Mycosystema,2021,40(7):1648−1659.] LI X, KONG Q, CHEN Z J, et al. Comparative study on the ultrastructure of fungal hypha of Aspergillus flavus at different temperatures[J]. Mycosystema, 2021, 40(7): 1648−1659.
[20] 谢素雅, 曹尚桥, 李红波, 等. 核桃内种皮脂质和氨基酸组成分析[J]. 农产品加工,2022(23):5−10. [XIE S Y, CAO S Q, LI H B, et al. Analysis of sebum lipid and amino acid composition in walnut seed[J]. Agricultural Processing,2022(23):5−10.] XIE S Y, CAO S Q, LI H B, et al. Analysis of sebum lipid and amino acid composition in walnut seed[J]. Agricultural Processing, 2022(23): 5−10.
[21] 毕莹, 王新宇, 李慧, 等. 不同品种哈密瓜果实脯氨酸代谢对低温的响应[J]. 食品科学, 2024, 45(6):216−224. [BI Y, WANG X Y, LI H, et al. Response of proline metabolism of different varieties of Cantaloupe to low temperature[J]. Food Science, 2019, 45(6):216−224.] BI Y, WANG X Y, LI H, et al. Response of proline metabolism of different varieties of Cantaloupe to low temperature[J]. Food Science, 2019, 45(6): 216−224.
[22] CHRISTINAT N, MORIN-RIVRON D, MASOODI M. High-throughput quantitative lipidomics analysis of nonesterified fatty acids in human plasma[J]. Journal of Proteome Research,2016,15(7):2228−2235. doi: 10.1021/acs.jproteome.6b00198
[23] 段天坤, 王燕, 袁佳琪, 等. 异辛醇对灰葡萄孢的抑菌作用及转录组分析[J]. 中国生物防治学报,2023,33(6):1434−1445. [DUAN T K, WANG Y, YUAN J Q, et al. Inhibitory effect of isooctanol on Botrytis cinerea and transcriptome analysis[J]. Chinese Journal of Biological Control,2023,33(6):1434−1445.] DUAN T K, WANG Y, YUAN J Q, et al. Inhibitory effect of isooctanol on Botrytis cinerea and transcriptome analysis[J]. Chinese Journal of Biological Control, 2023, 33(6): 1434−1445.
[24] ZOU X, WEI Y, ZHU J, et al. Volatile organic compounds of Scheffersomyces spartinae W9 have antifungal effect against Botrytis cinerea on strawberry fruit[J]. Foods,2023,12(19):3619. doi: 10.3390/foods12193619
[25] VISHWAKARMA M, HAIDER T, SONI V. Update on fungal lipid biosynthesis inhibitors as antifung-al agents[J]. Microbiology Research,2024,278:127517. doi: 10.1016/j.micres.2023.127517
[26] 李卓珍. 基于非靶向脂质组学的香芹酚抑制黄曲霉机理研究[D]. 郑州:河南工业大学, 2022:66-68. [LI Z Z. Mechanism of inhibition of Aspergillus flavus by carvacrol based on non-targeted lipidomics[D]. Zhengzhou:Henan University of Technology, 2022:66-68.] LI Z Z. Mechanism of inhibition of Aspergillus flavus by carvacrol based on non-targeted lipidomics[D]. Zhengzhou: Henan University of Technology, 2022: 66-68.
[27] YANG R P, MIAO J Y, ZHANG Z Y, et al. Untargeted lipidomics reveals the antifungal mechanism of essential oils nanoemulsionagainst Penicillium digitatum[J]. LWT-Food Science and Technology,2022,168:113−125.
[28] 韩洁. 掠榈酸对溶藻弧菌的抑菌机理及毒力调控机制研究[D]. 西安:陕西科技大学, 2023:23−26. [HAN J. Study on bacteriostatic mechanism and virulence regulation mechanism of palmitic acid against Vibrio alginolyticus[D]. Xi'an:Shaanxi University of Science and Technology, 2023:23−26.] HAN J. Study on bacteriostatic mechanism and virulence regulation mechanism of palmitic acid against Vibrio alginolyticus[D]. Xi'an: Shaanxi University of Science and Technology, 2023: 23−26.
[29] QU C L, LI Z Z, WANG X P. UHPLC-HRMS-based untargeted lipidomics reveal mechanism of antifungal activity of carvacrol against Aspergillus flavus[J]. Foods,2021,11(1):93. doi: 10.3390/foods11010093
[30] DICHSON R C, SUMANASEKERA C, LESTER R L. Functions and metabolism of sphingolipids in Saccharomyces cerevisiae[J]. Progress in Lipid Research,2006,45(6):447−465. doi: 10.1016/j.plipres.2006.03.004
[31] 李俊, 宋娟娟, 周映君, 等. 灰葡萄孢鞘脂代谢通路基因Bcsphl1克隆及功能分析[J]. 植物保护学报, 2022, 49(4):1046−1052. [LI J, SONG J J, ZHOU Y J, et al. Cloning and functional analysis of Bcsphl1 gene of sphingolipid metabolic pathway in Botris cinerea[J]. Journal of Plant Protection, 2002, 49(4):1046−1052.] LI J, SONG J J, ZHOU Y J, et al. Cloning and functional analysis of Bcsphl1 gene of sphingolipid metabolic pathway in Botris cinerea[J]. Journal of Plant Protection, 2002, 49(4): 1046−1052.
[32] LIU X H, LIANG S, WEI Y Y, et al. Metabolomics analysis identifies sphingolipids as key signaling moieties in appressorium morphogenesis and function in Magnaporthe oryzae[J]. mBio,2019,10(4):e01467−19.
[33] 马毛毛. 单癸酸甘油酯对大肠杆菌和金黄色葡萄球菌的抑菌活性及作用机制[D]. 南昌:南昌大学, 2022:100−101. [MA M M. Bacteriostatic activity and mechanism of glycerol monocaprate against Escherichia coli and Staphylococcus aureus[D]. Nanchang:Nanchang University, 2025:100−101.] MA M M. Bacteriostatic activity and mechanism of glycerol monocaprate against Escherichia coli and Staphylococcus aureus[D]. Nanchang: Nanchang University, 2025: 100−101.





 下载:
下载:


 下载:
下载:



