Research Progress on Effects of Cold Plasma on Cereal Quality
-
摘要: 谷物是人类膳食的重要原料,谷物及其制品的营养和安全与人体健康密切相关。冷等离子体是一种新型非热处理技术,在提升谷物及其制品的安全、营养和理化品质中的应用已得到广泛研究,这为解决全球粮食安全问题提供了一种环保解决方案。本文首先简要介绍了冷等离子体的原理及分类,然后重点综述了冷等离子体处理对谷物安全、营养、加工品质的影响。结果表明,冷等离子体可有效降解农药残留和真菌毒素、灭活有害微生物,还可改性谷物中蛋白质及淀粉,同时可以改善谷物制品的流变学特性和糊化特性等。因此,冷等离子体在谷物加工中具有巨大应用潜力,可对其进行更深层次研究,为该技术在谷物加工中的应用提供参考。Abstract: Cereals are important raw materials for human diet, while the nutrition and safety of cereals and cereal products are closely related to human health. Cold plasma is a new type of non-thermal processing technology, which is widely studied for enhancing the safety, nutritional and physicochemical qualities of cereals and their products, thus providing an environmentally friendly solution to the problem of global food security. The principle and classification of cold plasma are firstly introduced in this review, then it focuses on the impact of cold plasma treatment on the safety, nutritional, and processing qualities of cereals. Results show that cold plasma treatment can degrade the pesticide residues and mycotoxins, inactivate harmful microbes, and modify the protein and starch in cereals. Meanwhile, it also can improve the rheological properties and gelatinization properties of cereals products. Therefore, cold plasma has a great potential to be used in cereal processing and can be studied at a deeper level to provide references for the application of this technology in cereal processing.
-
Keywords:
- cold plasma /
- cereals /
- safety quality /
- nutritional quality /
- processing quality
-
我国谷物种类繁多,包括小麦、玉米、大米、高粱、小米、燕麦、荞麦、黑麦等,是世界上最主要的谷物主产国之一。长期以来,在谷物加工中存在以下问题:一是微生物、真菌毒素、农药残留引起的安全问题[1];二是谷物过度加工导致的营养流失问题;三是全谷物加工时皮层的引入导致感官品质较差的问题[2]。为了解决以上问题,常采用生物发酵、添加酶制剂或物理改性等方法改善谷物品质。在物理方法中,热处理对微生物具有较好的杀灭效果,能有效地降解真菌毒素和农药残留,同时热处理还对蛋白质、淀粉、膳食纤维等组分具有改性作用[3]。但过高的温度易破坏谷物中的蛋白质、淀粉和微量营养成分等。因此,对谷物组分影响较小的非热技术近年来受到越来越多的关注。
目前,在食品加工中研究较多的非热处理包括脉冲电场、高静水压力、超声波、超临界二氧化碳、电解氧化水、振荡磁场和冷等离子体(Cold Plasma,CP)等[4]。其中,冷等离子体是原子碰撞产生的部分或完全电离气体,离子和电子之间的电荷分离会产生电场,具有独特的迁移特性[5],还具有安全、能耗低、无二次污染等优点。冷等离子体技术最初用于电子工业、包装工业等[6],现已拓展到食品工业领域。近年来,冷等离子体在食品领域的主要研究包括对食品的微生物灭活[7]、农药残留控制[8]、食品包装材料的加工[9]、食品内源酶失活[10]、降解真菌毒素[11]、蛋白质改性[12]、肉制品护色[13]等。因此,冷等离子体对谷物影响的研究主要集中在农药及真菌毒素降解、微生物灭活、蛋白质及淀粉改性等方面。
本文综述了冷等离子体在谷物加工中应用的研究进展,首先简单介绍了冷等离子体的原理及分类,重点综述了该技术对谷物的安全品质、营养品质、加工品质的影响,以及冷等离子体的作用机理和研究现状;最后对冷等离子体在谷物加工中的未来研究和应用前景进行了展望,以期为该技术在谷物加工中的应用提供参考。
1. 冷等离子体概述
1.1 等离子体的概念及分类
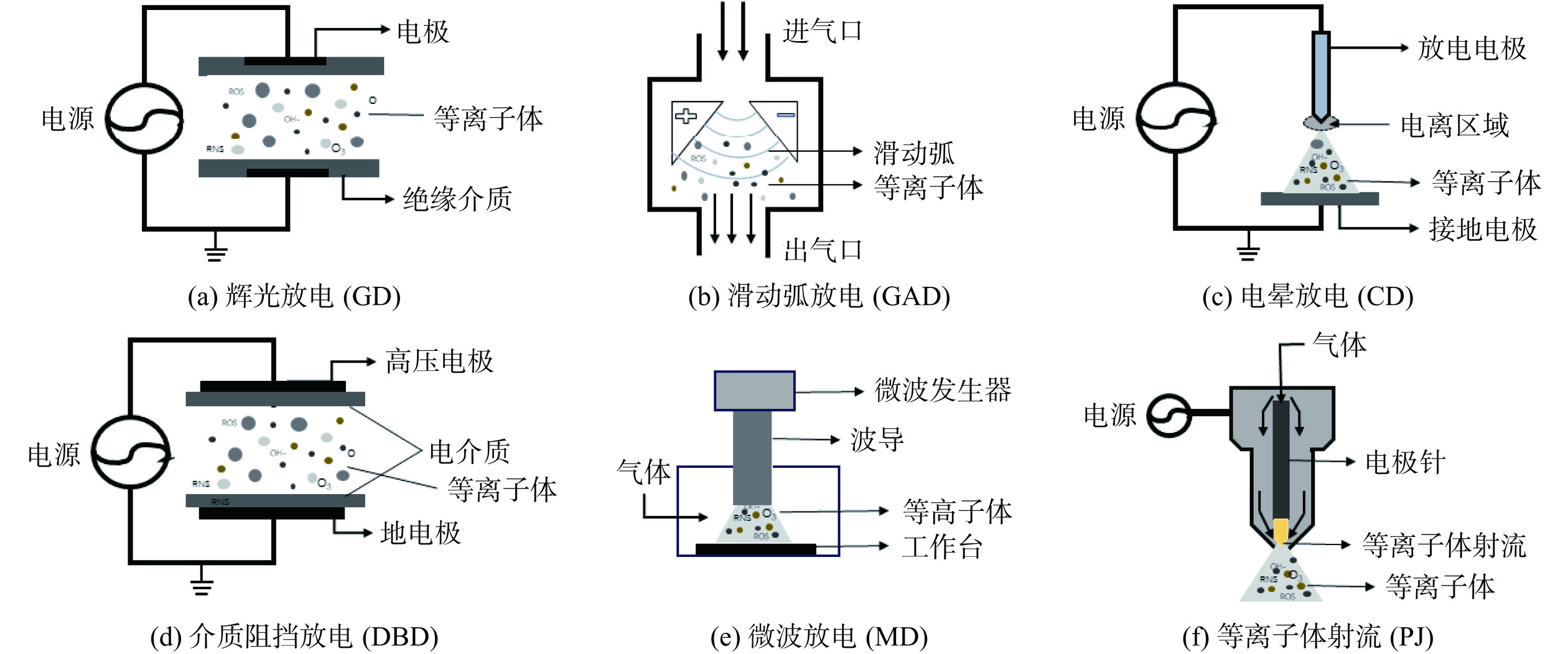
等离子体是指完全或部分电离的带电气体,主要由自由电子、离子、光子以及处于基态和激发态的原子组成[14]。由于激发后物质正负电荷的离子相同,内部系统呈现电中性,因此称其为等离子体[15]。根据等离子体中带电粒子温度高低,可将其分为高温等离子体(High-temperature Plasma,HTP)和低温等离子体(Low-temperature Plasma,LTP)。LTP又可根据粒子是否处于热平衡状态分为热等离子体和冷等离子体。当离子温度与电子温度相当且处于热平衡状态时,称为热等离子体。离子温度低于电子温度且处于非热平衡状态,则称为冷等离子体。冷等离子体由气体放电产生,其产生的载气可以是空气、氮气、氧气、惰性气体或不同的气体混合物[16]。冷等离子体的放电形式可根据放电所需的气压、电场力大小和电场的作用方式分为介质阻挡放电(Dielectric Barrier Discharge,DBD)、辉光放电(Glow Discharges,GD)、微波放电(Microwave Discharge,MD)、滑动电弧放电(Glide Arc Discharge,GAD)、电晕放电(Corona Discharge,CD)等[17],常见的冷等离子体放电装置示意图见图1。
目前在食品相关研究中应用较广泛的等离子体产生方式是DBD,因其价格低廉,并在安全性、操作参数、结构以及能源效率等方面具有优势[19]。DBD在两个金属电极之间产生等离子体,放电距离从0.1 mm到几厘米不等,其中一个电极连接到高压,而另一个电极接地并包裹在介电材料(如陶瓷,石英,塑料或聚合物层)中;工作气体在两个电极之间移动或分解,当两个电极在输入电压时电离气体时,产生等离子体[16]。PJ是在空气中放电工作气体而产生的非平衡等离子体,产生的等离子体可以通过气流或电场从产生区域传播到室外[20]。GD是电流通过低压气体而形成的等离子体,当施加电压超过其击穿电压并导致气体电离时形成了辉光放电等离子体[21]。GAD有两个或两个以上的电极分散并平行于一个平面,电弧从两个电极之间最窄的间隙开始,然后沿着气体注入的方向滑动并延长。CD主要使用一个电极在高压下工作,尖锐电极可以是正极或负极电晕[22]。MD是由频率大于300 MHz的电磁波引起的放电,微波波长范围从毫米到几十厘米取决于其应用[23]。冷等离子体处理参数有放电时间、功率、电压、气体类型、气体流量、频率、电极类型等。冷等离子体不同放电形式的优缺点如表1所示。
表 1 冷等离子体不同放电形式的优缺点Table 1. Advantages and disadvantages of different discharge forms of cold plasma1.2 冷等离子体技术作用机制
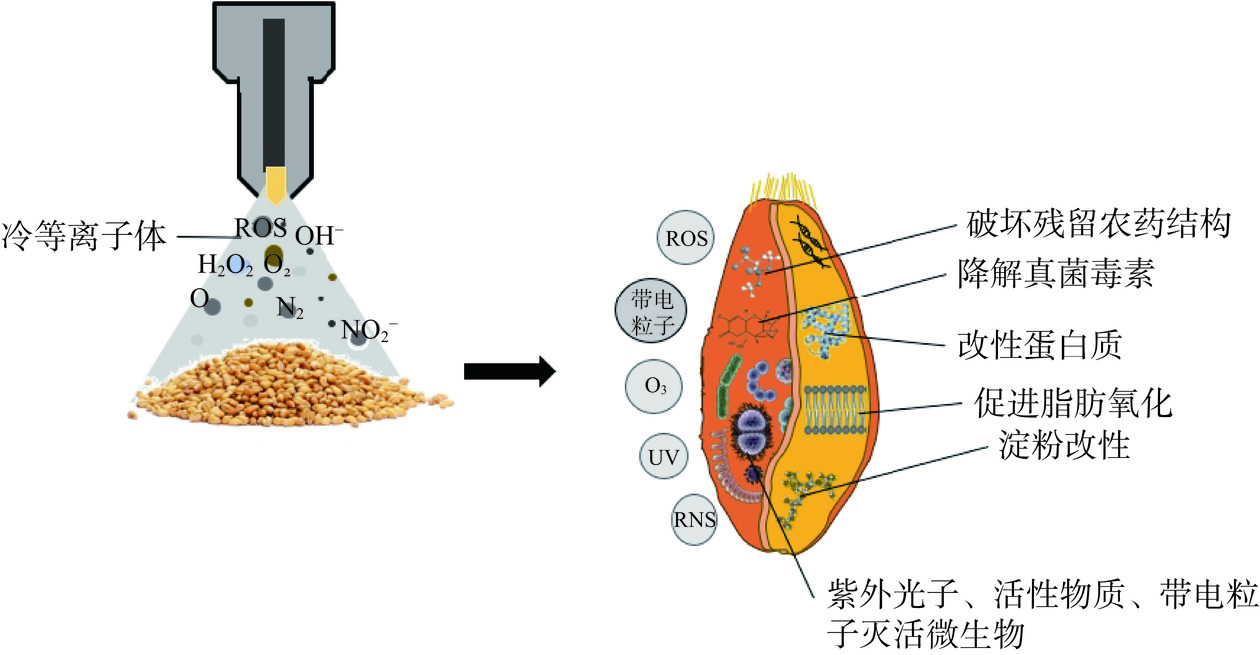
冷等离子体处理谷物有等离子活化水(Plasma Activates Water,PAW)和等离子体两种形式。等离子活化水是经冷等离子处理的水,含有不同于去离子水的化学成分(ROS和RNS等活性因子)[25]。PAW具有良好的流动性和均匀性,可用于处理形状不规则的原料[26]。冷等离子体对小麦籽粒的作用机制纵剖面图如图2所示,冷等离子体处理过程中产生的多种自由基和化学产物,如原子氧(O)、臭氧(O3)、羟基自由基(·OH)、单线态氧分子(1O2)、超氧阴离子(·O2−)、活性氧(Reactive Oxygen Species,ROS)和活性氮(Reactive Nitrogen Species,RNS)、紫外辐射、可见和红外光谱范围内的辐射、带电粒子、交变电场以及物理化学刻蚀等[27];这些活性成分不仅与谷物表面的农药和真菌毒素发生反应使其降解,杀灭微生物,而且通过破坏谷物中营养成分的化学键并引发各种化学反应,使谷物中蛋白质、淀粉、脂质等营养成分改性。
2. 冷等离子体处理对谷物安全品质的影响
2.1 农药残留
冷等离子体在降解农药残留方面具有高效、安全且无污染等优点而引起广泛重视。相关研究证明,冷等离子体能够有效降解水中农药(敌敌畏、马拉硫磷、硫丹[28])和水果中的农药(啶酰菌胺、吡虫啉、氯吡磷、氯氰菊酯等[29−30])。对于处理谷物中残留农药的研究相对较少(表2)。冷等离子体对农药降解的有效性归因于产生不同的反应气体种类[27];随着高能电子与化学键碰撞,自由基(O·,OH·,NO·)激发化学反应,实现谷物表面农药的降解。除了反应气体外,农药的降解率与等离子体处理的参数密切相关;随着功率的增加,气体分子与高能电子有效碰撞概率大,产生了更多的自由基、离子、电子,促进了农药与活性物质的有效碰撞,引起化学键断裂和各种氧化反应,增强农药的降解。农药本身化学结构的差异也是影响其降解的因素之一,研究显示相较于西维因稳定的萘酚结构,含有氮杂环的毒死蜱中的P-S键的S更易受自由基氧化和电子攻击,转化为P-O键[31],因此在相同的处理时间内,毒死蜱的降解率高于西维因。
表 2 冷等离子体对谷物中农药降解的效果Table 2. Effects of cold plasma on degradation of pesticides in cereals2.2 微生物
有研究表明,冷等离子体处理时产生的ROS在微生物失活过程中发挥着关键的作用,RNS是导致微生物细胞被损伤、酶失活和DNA切割的关键因子[34]。冷等离子体杀灭微生物的主要机制有三种:细胞与活性物质和带电粒子的直接化学相互作用;紫外线对细胞成分和细胞膜的损伤;通过紫外光子杀死微生物细胞可以有效地对抗抗生素耐受型微生物,使微生物的DNA和RNA分子分解,可以在微生物产生多种耐药性的情况下仍然保持高效的杀菌效果[35]。冷等离子体穿透深度是紫外线光子穿透深度的十倍,可达10 μm,这有助于杀灭形成孢子的细菌[36]。相对湿度也在杀灭微生物中发挥重要作用,水分子通过等离子体转化为羟基自由基,这些自由基具有较高的氧化能力,通过促进水的分解导致H2O2分子的形成,对失活具有协同作用[37]。
LEE等[38]研究冷等离子体处理对糙米中微生物的杀灭效果,接种蜡样芽孢杆菌、枯草芽孢杆菌和大肠杆菌的糙米样品经过20 min的等离子体处理后,总细菌计数由4.10 log CFU/g减少至2.30 log CFU/g。冷等离子体对不同的真菌影响不同,有研究用丝状真菌纯培养物人工污染小麦种子,发现经大气压冷等离子体处理对雪腐镰刀菌、黄色镰刀菌、单端孢霉属真菌、黄曲霉、棒曲霉的抑制效率依次递减[39]。MRAVLJE等[40]研究发现冷等离子体处理对普通荞麦和苦荞种子的萌发和真菌群落结构的影响,处理时间显著影响了两种荞麦种子的真菌定殖程度和多样性,但较长的处理时间降低了两种荞麦的发芽率。冷等离子体通过活性物质、紫外线和紫外光子对谷物表面的微生物具有杀灭作用,但过度处理可能会使谷物色泽加深、发芽率降低等。
2.3 真菌毒素
真菌毒素是由真菌在谷物中产生的有毒次级代谢产物,其化学分子结构多样,对人类和动物的健康造成严重损害。真菌毒素的降解主要是由冷等离子体放电过程中产生的O3、HO2·、·OH、·H、·O、·N、NO·、NO2·等活性物质与毒素分子的碰撞后,毒素分子的化学键断裂、紫外线辐照等多种降解机制共同作用的结果[41]。冷等离子体处理通过氧化、环氧化、氢化、裂解呋喃环等破坏真菌毒素的结构,从而降低谷物中真菌毒素的含量[42]。SICILIANO等[43]研究发现黄曲霉毒素B1和G1对于等离子体的敏感性高于黄曲霉毒素B2和G2,其原因是黄曲霉毒素B1和G1的呋喃环内存在C8-C9双键(烯烃位点),而黄曲霉毒素B2和G2缺乏该双键。冷等离子体放电过程中产生的臭氧分子具有氧化作用,导致该双键末端呋喃环的打开,从而形成原生臭氧及其衍生物,如有机酸、醛和酮[42]。水分子的存在导致·OH浓度增加,从而产生更多的氧化反应促进真菌毒素降解。但有研究显示增加含水量对呕吐毒素降解率的影响并不显著,而较高含水量会导致籽粒表面发生变化,增大谷物颗粒与大气压冷等离子体处理的接触面积,从而改变活性物质与毒素的反应速率,影响降解速率。冷等离子体对谷物中部分真菌毒素的降解如表3所示。
表 3 冷等离子体对谷物中真菌毒素的降解Table 3. Degradation of mycotoxins in cereals by cold plasma谷物 放电形式 真菌毒素 处理参数 实验结果 参考文献 小麦 DBD T-2、HT-2 输出频率:3500 Hz、放电时间:10 min、放电间隙:2 mm T-2和HT-2的最大降解率分别为79.8%和70.4% [44] 小麦 PAW 呕吐毒素 放电电压:50 kV、PAW处理时间:10 min、小麦处理时间:24 h 呕吐毒素的降解率为58.78% [45] 稻米、小麦 电晕放电射流 黄曲霉毒素B1 输出电压:20 kV、输出频率:58 kHz、处理时间:30 min 黄曲霉毒素B1的平均降解率在45%~56%之间 [46] 大麦 DBD 呕吐毒素 放电功率:300 W、放电时间:10 min、放电间隙:2 mm、输出频率:3500 Hz 大麦中呕吐毒素降解率为54.4% [19] 玉米 GD 黄曲霉毒素B1、伏马毒素B1 放电电压:6 kV、放电频率:20 kHz、放电时间:10 min 黄曲霉毒素B1和伏马毒素B1降解率达到65%和64% [47] 2.4 害虫
有研究报道常压等离子体射流产生的ROS对棉蚜、烟粉虱、棉铃虫、坎泽叶螨和棕榈粉虱的杀虫效果,在短时间(<3 min)处理条件下,烟粉虱被击倒时间最快(38.4±2.7 s),恢复时间最慢(699±133 s),未见死亡;另一方面,长期冷等离子体处理(<21 min)对烟粉虱和棕榈粉虱均有杀虫效果,其LT50(半数致死时间)值分别为6.3和9.6 min[48]。ZIUZINA等[49]研究了高压空气中冷等离子体对储粮变质中重要生物污染物蓖麻虫的杀虫性能和机理,成虫前阶段在几秒钟内的死亡率达95.0%~100%,但杀死成虫则需要更长的冷等离子体处理时间(5 min)。冷等离子体处理降低了昆虫的呼吸速率和体重,并影响了成年昆虫的氧化应激标志物水平。害虫死亡可能是由于存在的活性氧或氮以及等离子体成分(如高能紫外光子)对DNA的改变引起的,自由基影响脂质过氧化、过氧化氢酶、谷胱甘肽还原酶等抗氧化酶引起氧化应激,带电粒子引起表面损伤;以及脂质、氨基酸和核酸的氧化,从而导致害虫死亡[50]。因此,可将冷等离子体技术作为新的储粮害虫防治技术。
2.5 过敏原
食物过敏原主要是蛋白质通过诱导免疫球蛋白E(IgE)的释放引起过敏反应,这些免疫球蛋白与过敏原结合,产生组胺等物质引起过敏症状[51]。致敏蛋白的抗原决定因子称为表位,可分为线性表位和构象表位。冷等离子体可以通过其活性物质改变蛋白质的结构,影响IgE的结合位点,因此有可能通过改变蛋白质的表位来减少或消除蛋白质的致敏性[52]。也有报道称,冷等离子体诱导的自由基可以通过破坏或掩盖构象表位来降低IgE结合能力,因此使蛋白质致敏性降低[53]。
蛋白质的聚集和断裂以及蛋白质完整性的修饰对蛋白质的致敏性有显著影响。冷等离子体产生的·OH与含有二硫键的肽反应,形成RSH和RSO使肽分裂,或通过分子内二硫键形成蛋白质聚集体可能导致其致敏性降低。此外,O·还参与蛋白质的氧化;ROS和RNS会攻击对氧化敏感的氨基酸[53]。冷等离子体的产气方式和处理方式对过敏原的影响较大。MEINLSCHMIDT等[54]采用两种类型的等离子体装置直接(表面介电屏障空气放电(SDBD))或间接(微波产生的等离子体)处理大豆分离蛋白,直接处理降低蛋白的致敏性高达100%,间接处理的样品致敏性下降高达89%。VENKATARATNAM等[55]研究冷大气等离子体对脱脂花生粉(DPF)和全花生(WP)中Ara h 1蛋白抗原性的影响,其中,SDS-PAGE结果显示,DPF和WP的Ara h 1对应的蛋白强度带没有变化,而竞争性ELISA检测显示,DPF和WP的抗原性分别降低了43%和9.3%。在另一项研究中,采用空气和氮气两种等离子体处理气体对花生蛋白提取物中Ara h 1过敏原的抑制效果,结果显示,在冷等离子体处理13 min后,Ara h 1的抗原性降低了约55%,这可能由于α-螺旋结构的破坏;且氮气冷等离子体处理后花生保持了其大部分原始品质[56]。因此,还需要进一步研究冷等离子体处理降低过敏原的机制。
2.6 内源酶
冷等离子体可用于灭活内源酶,如过氧化物酶和多酚氧化酶[57]、碱性磷酸酶[58]、乳酸脱氢酶[59]、脂肪酶和脂氧合酶[60]等。许多研究表明,酶的活性随着冷等离子体处理时间和电压的增加而降低,电压对失活率的影响更为明显。TOLOUIE等[60]研究常压冷等离子体处理对小麦胚芽脂肪酶和脂氧合酶失活的影响,电压越高、处理时间越长,脂肪酶和脂氧合酶的失活率越高。可能是由于脂肪酶和脂氧合酶在贮藏过程中恢复了部分失去的活性;与脂氧合酶相比,脂肪酶的活性恢复更高。同时,也有研究表明,经等离子处理后的绿豆中的淀粉酶、蛋白酶、植酸酶的活性增加[61]。内源酶的失活有利于谷物的储存,酶活性的增加或减少取决于冷等离子体处理的条件以及酶本身的特性。
3. 冷等离子体处理对谷物营养品质的影响
3.1 蛋白质
谷物中蛋白质资源丰富,目前应用较多的有豌豆蛋白、花生蛋白、小麦蛋白、大米蛋白等。不同谷物之间的蛋白质含量和氨基酸组成的差异导致蛋白质组成和结构的不同,因此表现出不同的功能特性(溶解性、粘附性、吸水性、乳化性、起泡性、聚集和凝胶特性等)[62]。天然谷物蛋白的结构和不稳定的界面性质限制其在食品加工应用。研究表明,冷等离子体可改变谷物蛋白的表面结构,从而改善谷物蛋白的功能特性[63]。冷等离子体处理过程中产生的高能自由基通过破坏蛋白质的共价键并引发各种化学反应(氧化、硝化、羟基化)[64]。其中,ROS、RNS是改性蛋白质的主要活性成分,ROS可以引起游离氨基酸和蛋白质的氧化,导致芳香基团和脂肪族氨基酸侧链的羟基化,芳香氨基酸残基的硝化,巯基的亚硝基化,蛋氨酸残基的亚砜化,芳香基团和伯胺基的氯化,以及一些氨基酸残基转化为羰基衍生物。而RNS一般影响苯丙氨酸、酪氨酸、半胱氨酸和蛋氨酸,导致硝化和氧化[65]。PAW也能与蛋白水合后改变其结构、理化和功能特性,导致螺旋结构显著降低,β-转角增加3倍以上;PAW处理的蛋白氨基酸数据显示谷氨酸含量减少了20%;降低了蛋白质中酸性氨基酸的比例,并改善了起泡性能[66]。冷等离子体对谷物蛋白质的影响如表4所示,通过冷等离子体处理谷物蛋白,使谷物蛋白的微观结构发生改变,进而改变蛋白质的物理、化学和营养性质,从而拓宽谷物蛋白的应用范围。
表 4 冷等离子体对谷物蛋白质的影响Table 4. Effects of cold plasma on cereal protein样品 放电形式 处理参数 实验结果 参考文献 豌豆分离蛋白 DBD 电压:9.4/18.6 kVpp、处理时间:30/60 s 羰基、二硫键、双酪氨酸交联以及表面电荷的含量增加,蛋白质进入水油界面的吸收率降低;蛋白质在界面上的热力学稳定性、球蛋白解离和油滴表面电荷的增加 [67] 班巴拉花生球蛋白 PAW(由APPJ制备) PAW处理时间:1 h、输入功率:750 W 显著影响氨基酸组成,降低了酸性氨基酸的比例,并增加了蛋白质的β-折叠含量和表面疏水性的比例 [66] 豌豆蛋白 DBD 频率:3.0 kHz、电压:8.8 kVpp、放电间隙:
12 mm、处理时间:10 min水和脂肪结合能力及溶解度提高;色氨酸荧光光谱的变化证实了氧化引起的结构、组成的改变 [68] 小麦蛋白 GD 功率:50 W、电压:220 V、处理时间:10 s、频率:13.56 MHz、工作气压:30 Pa 面筋蛋白组分交联聚合成大分子聚合体、促使β-折叠、β-转角向分子间β-折叠结构转变,致使大分子聚合体含量增加 [69] 3.2 淀粉
淀粉约占谷物籽粒的70%,由直链淀粉和支链淀粉构成。未处理淀粉的溶解度差、在高温下结构不稳定限制了其应用[70]。相关研究表明,冷等离子体与淀粉的相互作用以三种不同的机制改变淀粉结构,如交联、淀粉支链的解聚和冷等离子体对淀粉颗粒的蚀刻,这些不同的机制导致了谷物表面改性[71]。在冷等离子体处理过程中,交联反应占主导地位,经冷等离子体处理后的淀粉具有更高的热稳定性和相对更强的结构,还使淀粉糊的浊度降低[72]。其次是冷等离子体高能离子的轰击导致淀粉分子的直链淀粉和支链淀粉侧链解聚,产生更小的片段,冷等离子体处理引起的解聚导致直链淀粉含量的变化[16]。最后则由冷等离子体物质引起的蚀刻导致淀粉的亲水性改变,缩短了水和淀粉颗粒之间的屏障,增加了淀粉的溶解度[73]。
采用扫描电镜研究DBD处理后轻碾米淀粉微观结构的变化,表面光滑、棱角分明的淀粉出现了大量裂纹、气孔,表面的棱角逐渐减少[74]。有研究将不同直链淀粉和支链淀粉含量的玉米淀粉经DBD和射频处理后淀粉颗粒表面形成空腔,等离子体物质通过空腔向内迁移,改变了淀粉颗粒的内部结构,从而提高了直链淀粉螺旋的有序性和热稳定性[75]。THIRUMDAS等[76]研究冷等离子体对大米淀粉的解聚和功能性质改变时发现,大米淀粉的结晶度略有下降,浊度和pH降低;且处理后直链淀粉分子的浸出增加。在二氧化碳-氩气射频冷等离子体对糯米、玉米和马铃薯改性中的研究中发现,冷等离子体处理导致玉米和马铃薯的抗性淀粉含量显著增加[77]。但在采用辉光放电等离子体处理半熟米粉的研究中,等离子体处理诱导淀粉交联,结晶度下降,与上述研究不同的是直链淀粉含量下降,这可能是由于直链淀粉侧链分裂[78]。由于不同放电形式的冷等离子体处理对不同谷物来源的淀粉的影响不同,改性的程度取决于谷物淀粉的来源。
3.3 脂质
脂类由饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸组成。脂肪酸中双键之间的C-H键或甲基易被氧化,脂质过氧化伴随着异味的产生,对食品的感官品质产生了显著影响。根据脂肪酸的不同,会产生氧化、腐臭、腥味、脂肪味或金属味[79]。ROS对脂质的攻击通过破坏不饱和脂肪酸的双键,形成脂肪酸自由基,然后被氧化成脂质过氧化氢[80]。有研究显示,小麦粉经冷等离子体处理(处理电压:15、20 V;处理时间:60、120 s)后,总非淀粉脂、非极性脂和糖脂的含量均无影响,但总游离脂肪酸和磷脂含量降低;而氧化指标(过氧化氢值和正己醛)随着处理时间和电压的增加而增加,促进脂质氧化加速[81]。采用冷等离子体处理花生,其脂质,过氧化值和酸价显著降低[82]。一般来说,谷物中脂肪含量低,冷等离子体处理不易引起显著的氧化。在室温、常压和不使用催化剂的情况下可以采用冷等离子体对谷物中脂质进行氢化[83],还可将冷等离子体作为加速脂质氧化的工具,以模拟缓慢的改变过程[84]。
3.4 酚类物质
酚类化合物是谷物中重要的生物活性代谢物之一,具有抗氧化应激及引起代谢紊乱的能力[85]。冷等离子体处理会影响谷物表面特性,特别是细胞壁层。随着冷等离子体功率的增加,谷物的抗氧化性增加。这是由于冷等离子体处理导致接近表面的颗粒内部释放出了萃取过程中的酚类化合物,或是冷等离子体生成过程中紫外线辐射的存在导致次级代谢物(多酚、类黄酮)的形成[86]。SOOKWONG等[87]首次将冷等离子体应用于提高谷物产品营养价值,在水稻种子发芽前进行冷等离子体处理,不仅提高了糙米的预发芽率,而且总酚类物质和γ-氨基丁酸含量升高。另有研究表明,冷等离子处理后的糙米在萌发过程中,总酚含量、结合酚含量和游离酚含量分别提高了63.16%、36.50%和76.67%;萌发过程中酚类化合物的生物合成和葡萄糖苷元的释放可能促进了萌发谷物中酚类含量的提高[88]。但也有研究发现冷等离子体处理的发芽水稻总酚含量较低,可能是由于低压冷等离子处理使苯丙氨酸解氨酶(苯丙氨酸解氨酶是酚类物质生物合成的关键酶)失活[89]。因此,需要进一步的研究来探究冷等离子体引起酚类物质变化的机理。
4. 冷等离子体处理对谷物加工品质的影响
4.1 流变学特性
冷等离子体可用于改善谷物流变性能(表5)[90]。冷等离子体在食品加工领域被用来修饰淀粉、蛋白质和面粉,并增强其功能和流变学特性[81]。冷等离子体通过改变淀粉的结构和蛋白质改性而改善谷物的流变学特性。在探究辉光放电等离子体对小麦面团流变学特性的改善的研究中,冷等离子体处理显著提高了面团弹性、耐揉性并改善了面团抗拉伸特性。DBD处理玉米淀粉时,发现其流变性能由假塑性(非牛顿)流体向牛顿流体转变,粘度降低[91]。淀粉的高粘度限制其应用,而冷等离子体处理的淀粉显示出高水平的分子解聚,降低了凝胶能力、粘度,淀粉颗粒上的空腔或孔洞在加热过程中减缓了直链淀粉的浸出,导致了流变学的变化[16]。冷等离子体处理引起的蛋白质变性也影响谷物的流变学特性,增加处理电压会增加粘性模量和弹性模量[92];冷等离子体处理导致蛋白质聚合和二硫键的形成从而形成模量较高的凝胶,网络中蛋白质含量越高,其强度、弹性和粘性性能越好[93]。小麦面粉蛋白氧化改变其分子量和溶解度,进而改变与水的相互作用以及形成面筋蛋白的能力;因此,冷等离子处理可通过蛋白质氧化或促进面筋蛋白组分交联聚合成大分子聚合体,进而改善面团流变学特性。此外,通过冷等离子体处理在淀粉-淀粉、蛋白质-蛋白质或蛋白质-淀粉分子之间产生的交联可以改善谷物的流变特性。
表 5 冷等离子体对不同谷物加工品质的影响Table 5. Effects of cold plasma on processing quality of different cereals样品种类 样品 放电形式 处理参数 品质变化 参考文献 小麦及其制品 小麦粉 DBD 功率:120 W、频率:80 kHz、电压:7 kV、
时间:1/3/5 min显著增强面团的粘弹性;面粉水化率提高6%~7% [103] 硬、软质麦
面粉DBD 频率:50 Hz、电压:60/70 kV、时间:5/10 min 硬质麦面粉的弹性模量和粘性模量增大;硬、软质麦面粉β-折叠减少,α-螺旋和β-转角增加 [104] 稻谷类及其
制品长粒糙米 真空等离子体 电压:1~3 kV、输出功率:1.2~3.6 W、处理时间:30 min 蒸煮时间、伸长率、宽度膨胀率、吸水率和蒸煮损失略微降低;峰值粘度和击穿显著降低 [105] 轻碾米 DBD 电压:1 kV、2 kV、时间:5/10 min 有效缩短蒸煮时间,硬度降低 [74] 糙米 真空等离子体 电压:1~3 kV、处理时间:30 min 缩短糙米蒸煮时间;提高延伸率,有效地改善了糙米的蒸煮性能 [100] 糙米 RFD 频率:13.56 MHz、功率:40/50 W、时间:
5/10 min蒸煮时间缩短了28%;吸水率提高了7.2% [101] 印度香米 真空射频 频率:13.56 MHz、功率:30/40 W、时间:
5/10 min缩短蒸煮时间 [99] 竹米 DBD 频率:50 Hz、电压:1~11 kV、时间:5/10 min 缩短蒸煮时间;提高浸泡速率;糊化温度增加;最终粘度降低 [96] 杂粮类及其
制品玉米淀粉 DBD 电压:50 V、输出功率:75 W、处理时间:1/5/10 min、放电间隙:3 mm 粘度显著降低;剪切应力随剪切速率的变化,从假塑性变为牛顿流体 [91] 玉米淀粉 APPJ 功率:400/600/800 W、时间:30 min 粘度降低,淀粉的溶解度和淀粉糊状清晰度增加 [94] 藜麦 DBD 频率:37.2 MHz、电压:50/60 kV、时间:
5/10 min粘性模量和弹性模量增加,强度、弹性和粘性性能越好;恒定电压下暴露时间的增加对焓值有正向影响 [92] 珍珠粟 APPJ 电压:40 kV、时间:5/10/15 min 随着暴露时间和电压的增加,其峰、谷、分解、回缩和最终粘度等糊化性能均有所提高 [98] 4.2 糊化特性
糊化特性主要用于评价淀粉的加工品质,核心指标有糊化温度、峰值粘度、崩解值、回生值等。冷等离子体对糊化特性的影响如表5所示。在常压冷等离子体射流改性玉米淀粉的研究中发现,淀粉样品的峰值粘度、最低粘度和最终粘度随着等离子体功率的增加而显著降低,有助于改善淀粉糊稳定性和减少淀粉的糊化[94]。由于残留活性物质的老化作用以及极性官能团的不稳定性,分子解聚和颗粒腐蚀导致淀粉糊或颗粒的不稳定可能导致粘度降低[95]。在处理竹米时发现,不仅米粉的最终粘度降低、糊化温度升高,竹米中的β-谷甾醇含量也有所上升[96]。除冷等离子体的功率、电压和时间的影响外,被处理样品同样对糊化特性的影响具有差异。将长粒米粉和短粒米粉分别进行冷等离子处理时,两种稻米的透光率、溶胀力、吸水率均随着等离子体的处理而增加,但由于长粒稻米中直链淀粉含量较高,表现出较高的峰值粘度、破碎粘度和较低的糊化温度[97]。处理后的样品峰值粘度升高可能是由于冷等离子体氧化引起的淀粉分子交联,或者是淀粉颗粒结构的松弛、破坏会使淀粉颗粒结构发生更大程度的膨胀[98]。不同研究中观察到的冷等离子体处理对糊化特性的影响不同可归因于不同的等离子体、处理条件和样品种类。因此还需要进一步的研究,以评估经冷等离子体处理参数对谷物及其制品糊化特性的影响。
4.3 蒸煮时间
对于谷物的加工,浸泡和蒸煮时间是至关重要的因素。有研究显示,冷等离子体处理后可缩短糙米、长粒糙米、印度香米、轻碾米等的蒸煮时间(表5)。冷等离子体处理引起稻谷自然表面形态的改变,籽粒表面出现了裂缝和凹陷,这种现象被称为“表面蚀刻”,水更易从表面渗透。经过冷等离子体处理,亲水基团(极性官能团)在聚合物表面上的结合,提高吸水率,缩短蒸煮时间[99]。冷等离子体处理糙米也有类似的效果,不仅糙米的蒸煮时间缩短,且煮熟的糙米质地柔软,更容易咀嚼[100]。冷等离子体处理可以使接触角(用来评价等离子体对谷物亲水性的影响)减小,表面能增加,使表面更亲水,使米粒吸收更多的水,从而缩短蒸煮时间[101]。在最佳蒸煮时间后,谷物的蒸煮性能得到改善,接触角的减小和表面自由能的增加进一步证实了表面蚀刻和改性的程度;若处理时间过长,冷等离子体处理导致谷物中的破损淀粉浸出,导致蒸煮损失增加[102]。由于冷等离子体缩短谷物的蒸煮时间,可将其应用于谷物加工产品的瞬时制备。
5. 结论与展望
冷等离子体作为一种新型的非热技术,在蛋白质和淀粉改性、降解毒素和农药残留等方面显示出巨大的安全可持续生产潜力,在谷物加工应用等方面还有许多有待探索的地方。冷等离子体可以改善谷物中营养成分的功能特性,改变谷物及其制品的加工品质,提高谷物的安全品质且对谷物本身特性影响较小。但根据工艺参数的不同,也可能对谷物的某些成分产生负面影响。因此,还需要进一步的研究来深入了解冷等离子体使农药和真菌毒素降解、微生物失活、以及谷物营养组分改性的作用机制,并优化工艺参数以最大限度地减少可能的不良影响。未来的研究趋势可倾向于冷等离子处理对谷物的潜在毒性风险和安全性评估;对食物过敏原化合物及真菌毒素作用机制的探究,对谷物中维生素、矿物质等营养组分的影响,以及紫外光子在冷等离子体处理过程中对不同食品成分结构变化中的影响等。
-
表 1 冷等离子体不同放电形式的优缺点
Table 1 Advantages and disadvantages of different discharge forms of cold plasma
表 2 冷等离子体对谷物中农药降解的效果
Table 2 Effects of cold plasma on degradation of pesticides in cereals
表 3 冷等离子体对谷物中真菌毒素的降解
Table 3 Degradation of mycotoxins in cereals by cold plasma
谷物 放电形式 真菌毒素 处理参数 实验结果 参考文献 小麦 DBD T-2、HT-2 输出频率:3500 Hz、放电时间:10 min、放电间隙:2 mm T-2和HT-2的最大降解率分别为79.8%和70.4% [44] 小麦 PAW 呕吐毒素 放电电压:50 kV、PAW处理时间:10 min、小麦处理时间:24 h 呕吐毒素的降解率为58.78% [45] 稻米、小麦 电晕放电射流 黄曲霉毒素B1 输出电压:20 kV、输出频率:58 kHz、处理时间:30 min 黄曲霉毒素B1的平均降解率在45%~56%之间 [46] 大麦 DBD 呕吐毒素 放电功率:300 W、放电时间:10 min、放电间隙:2 mm、输出频率:3500 Hz 大麦中呕吐毒素降解率为54.4% [19] 玉米 GD 黄曲霉毒素B1、伏马毒素B1 放电电压:6 kV、放电频率:20 kHz、放电时间:10 min 黄曲霉毒素B1和伏马毒素B1降解率达到65%和64% [47] 表 4 冷等离子体对谷物蛋白质的影响
Table 4 Effects of cold plasma on cereal protein
样品 放电形式 处理参数 实验结果 参考文献 豌豆分离蛋白 DBD 电压:9.4/18.6 kVpp、处理时间:30/60 s 羰基、二硫键、双酪氨酸交联以及表面电荷的含量增加,蛋白质进入水油界面的吸收率降低;蛋白质在界面上的热力学稳定性、球蛋白解离和油滴表面电荷的增加 [67] 班巴拉花生球蛋白 PAW(由APPJ制备) PAW处理时间:1 h、输入功率:750 W 显著影响氨基酸组成,降低了酸性氨基酸的比例,并增加了蛋白质的β-折叠含量和表面疏水性的比例 [66] 豌豆蛋白 DBD 频率:3.0 kHz、电压:8.8 kVpp、放电间隙:
12 mm、处理时间:10 min水和脂肪结合能力及溶解度提高;色氨酸荧光光谱的变化证实了氧化引起的结构、组成的改变 [68] 小麦蛋白 GD 功率:50 W、电压:220 V、处理时间:10 s、频率:13.56 MHz、工作气压:30 Pa 面筋蛋白组分交联聚合成大分子聚合体、促使β-折叠、β-转角向分子间β-折叠结构转变,致使大分子聚合体含量增加 [69] 表 5 冷等离子体对不同谷物加工品质的影响
Table 5 Effects of cold plasma on processing quality of different cereals
样品种类 样品 放电形式 处理参数 品质变化 参考文献 小麦及其制品 小麦粉 DBD 功率:120 W、频率:80 kHz、电压:7 kV、
时间:1/3/5 min显著增强面团的粘弹性;面粉水化率提高6%~7% [103] 硬、软质麦
面粉DBD 频率:50 Hz、电压:60/70 kV、时间:5/10 min 硬质麦面粉的弹性模量和粘性模量增大;硬、软质麦面粉β-折叠减少,α-螺旋和β-转角增加 [104] 稻谷类及其
制品长粒糙米 真空等离子体 电压:1~3 kV、输出功率:1.2~3.6 W、处理时间:30 min 蒸煮时间、伸长率、宽度膨胀率、吸水率和蒸煮损失略微降低;峰值粘度和击穿显著降低 [105] 轻碾米 DBD 电压:1 kV、2 kV、时间:5/10 min 有效缩短蒸煮时间,硬度降低 [74] 糙米 真空等离子体 电压:1~3 kV、处理时间:30 min 缩短糙米蒸煮时间;提高延伸率,有效地改善了糙米的蒸煮性能 [100] 糙米 RFD 频率:13.56 MHz、功率:40/50 W、时间:
5/10 min蒸煮时间缩短了28%;吸水率提高了7.2% [101] 印度香米 真空射频 频率:13.56 MHz、功率:30/40 W、时间:
5/10 min缩短蒸煮时间 [99] 竹米 DBD 频率:50 Hz、电压:1~11 kV、时间:5/10 min 缩短蒸煮时间;提高浸泡速率;糊化温度增加;最终粘度降低 [96] 杂粮类及其
制品玉米淀粉 DBD 电压:50 V、输出功率:75 W、处理时间:1/5/10 min、放电间隙:3 mm 粘度显著降低;剪切应力随剪切速率的变化,从假塑性变为牛顿流体 [91] 玉米淀粉 APPJ 功率:400/600/800 W、时间:30 min 粘度降低,淀粉的溶解度和淀粉糊状清晰度增加 [94] 藜麦 DBD 频率:37.2 MHz、电压:50/60 kV、时间:
5/10 min粘性模量和弹性模量增加,强度、弹性和粘性性能越好;恒定电压下暴露时间的增加对焓值有正向影响 [92] 珍珠粟 APPJ 电压:40 kV、时间:5/10/15 min 随着暴露时间和电压的增加,其峰、谷、分解、回缩和最终粘度等糊化性能均有所提高 [98] -
[1] 尚艳娥, 杨卫民. CAC、欧盟、美国与中国粮食中真菌毒素限量标准的差异分析[J]. 食品科学技术学报,2019,37(1):10−15. [SHANG Y E, YANG W M. Variation analysis of cereals mycotoxin limit standards in of CAC, EU, USA, and China[J]. Journal of Food Science and Technology,2019,37(1):10−15.] SHANG Y E, YANG W M. Variation analysis of cereals mycotoxin limit standards in of CAC, EU, USA, and China[J]. Journal of Food Science and Technology, 2019, 37(1): 10−15.
[2] HUANG J H, WANG Z, FAN L, et al. A review of wheat starch analyses:Methods, techniques, structure and function[J]. International Journal of Biological Macromolecules,2022,203:130−142. doi: 10.1016/j.ijbiomac.2022.01.149
[3] YE G D, WU Y N, WANG L P, et al. Comparison of six modification methods on the chemical composition, functional properties and antioxidant capacity of wheat bran[J]. LWT,2021,149:111996. doi: 10.1016/j.lwt.2021.111996
[4] MANDAL R, SINGH A, PRATAP SINGH A. Recent developments in cold plasma decontamination technology in the food industry[J]. Trends in Food Science & Technology,2018,80:93−103.
[5] VON KEUDELL A, GATHEN V S-V D. Foundations of low-temperature plasma physics—an introduction[J]. Plasma Sources Science and Technology,2017,26(11):113001. doi: 10.1088/1361-6595/aa8d4c
[6] OLATUNDE O O, BENJAKUL S, VONGKAMJAN K. High voltage cold atmospheric plasma:Antibacterial properties and its effect on quality of Asian sea bass slices[J]. Innovative Food Science & Emerging Technologies,2019,52:305−312.
[7] BANGAR P S, SURI S, NAYI P, et al. Cold plasma for microbial safety:Principle, mechanism, and factors responsible[J]. Journal of Food Processing and Preservation,2022,46(12):e16850. doi: 10.1111/jfpp.16850
[8] SOJITHAMPORN P, LEKSAKUL K, SAWANGRAT C, et al. Degradation of pesticide residues in water, soil, and food products via cold plasma technology[J]. Foods,2023,12(24):4386. doi: 10.3390/foods12244386
[9] WU X M, LIU Q, LUO Y H, et al. Improved packing performance and structure-stability of casein edible films by dielectric barrier discharges (DBD) cold plasma[J]. Food Packaging and Shelf Life,2020,24:100471. doi: 10.1016/j.fpsl.2020.100471
[10] SITU H Y, LI Y M, GAO J L, et al. Effects of cold atmospheric plasma on endogenous enzyme activity and muscle protein oxidation in Trachinotus ovatus[J]. Food Chemistry,2023,407:135119. doi: 10.1016/j.foodchem.2022.135119
[11] MISNAL M F I, REDZUAN N, ZAINAL M N F, et al. Cold plasma:A potential alternative for rice grain postharvest treatment management in malaysia[J]. Rice Science,2022,29(1):1−15. doi: 10.1016/j.rsci.2021.12.001
[12] LI B, PENG L X, CAO Y N, et al. Insights into cold plasma treatment on the cereal and legume proteins modification:Principle, mechanism, and application[J]. Foods,2024,13(10):1522. doi: 10.3390/foods13101522
[13] BAK K H, PAULSEN P. Changes in flavor and volatile composition of meat and meat products observed after exposure to atmospheric pressure cold plasma (ACP)[J]. Foods,2023,12(17):3295. doi: 10.3390/foods12173295
[14] NIKMARAM N, KEENER K M. The effects of cold plasma technology on physical, nutritional, and sensory properties of milk and milk products[J]. LWT,2022,154:112729. doi: 10.1016/j.lwt.2021.112729
[15] NWABOR O F, ONYEAKA H, MIRI T, et al. A cold plasma technology for ensuring the microbiological safety and quality of foods[J]. Food Engineering Reviews,2022,14(4):535−554. doi: 10.1007/s12393-022-09316-0
[16] PRAKASH S D, SILIVERU K, ZHENG Y. Emerging applications of cold plasma technology in cereal grains and products[J]. Trends in Food Science & Technology,2023,141:104177.
[17] 颜心怡, 李锦晶, 李赤翎, 等. 冷等离子体技术对食品组分的影响及其作用机制[J]. 食品工业科技,2023,44(12):445−454. [YAN X Y, LI J J, LI C L, et al. Effect and action mechanism of cold plasma technology on food components[J]. Science and Technology of Food Industry,2023,44(12):445−454.] YAN X Y, LI J J, LI C L, et al. Effect and action mechanism of cold plasma technology on food components[J]. Science and Technology of Food Industry, 2023, 44(12): 445−454.
[18] 相启森, 董闪闪, 郑凯茜, 等. 大气压冷等离子体在食品农药残留和真菌毒素控制领域的应用研究进展[J]. 轻工学报,2022,37(3):1−9. [XIANG Q S, DONG S S, ZHENG K X, et al. Research progress of atmospheric cold plasma in the control of food pesticide residues and mycotoxins[J]. Journal of Light Industry,2022,37(3):1−9.] XIANG Q S, DONG S S, ZHENG K X, et al. Research progress of atmospheric cold plasma in the control of food pesticide residues and mycotoxins[J]. Journal of Light Industry, 2022, 37(3): 1−9.
[19] FEIZOLLAHI E, IQDIAM B, VASANTHAN T, et al. Effects of atmospheric-pressure cold plasma treatment on deoxynivalenol degradation, quality parameters, and germination of barley grains[J]. Applied Sciences,2020,10(10):3530. doi: 10.3390/app10103530
[20] WANG T, WANG J H, WANG S Q, et al. Atmospheric micro-sized cold plasma jet created by a long and ultra-flexible generator with sputtered gold thin film electrode[J]. Journal of Micromechanics and Microengineering,2022,32(9):095006. doi: 10.1088/1361-6439/ac848a
[21] GONG X J, LIN Y C, LI X D, et al. Decomposition of volatile organic compounds using gliding arc discharge plasma[J]. Journal of the Air & Waste Management Association,2020,70(2):138−157.
[22] BARROS J H T, SAMPAIO U M, MONTENEGRO F M, et al. Efeito do plasma não térmico nos nutrientes de alimentos e matérias-primas à base de cereais[J]. Research, Society and Development,2022,11(3):e15611326261. doi: 10.33448/rsd-v11i3.26261
[23] LEBEDEV Y A. Microwave discharges at low pressures and peculiarities of the processes in strongly non-uniform plasma[J]. Plasma Sources Science and Technology,2015,24(5):053001. doi: 10.1088/0963-0252/24/5/053001
[24] YAHAYA A G, OKUYAMA T, KRISTOF J, et al. Direct and indirect bactericidal effects of cold atmospheric-pressure microplasma and plasma jet[J]. Molecules,2021,26(9):2523. doi: 10.3390/molecules26092523
[25] 冯琳琳, 闫溢哲, 张明月, 等. 等离子体活化水湿热处理对小麦淀粉结构和性能的影响研究[J]. 河南农业大学学报,2019,53(4):601−607. [FENG L L, YAN Y Z, ZHANG M Y, et al. Effects of plasma activated water combined with heat-moisture treatment on the structure and physicochemical properties of wheat starch[J]. Journal of Henan Agricultural University,2019,53(4):601−607.] FENG L L, YAN Y Z, ZHANG M Y, et al. Effects of plasma activated water combined with heat-moisture treatment on the structure and physicochemical properties of wheat starch[J]. Journal of Henan Agricultural University, 2019, 53(4): 601−607.
[26] 康超娣, 相启森, 刘骁, 等. 等离子体活化水在食品工业中应用研究进展[J]. 食品工业科技,2018,39(7):348−352. [KANG C D, XIANG Q S, LIU X, et al. A review of application of plasma-activated water in food industry[J]. Science and Technology of Food Industry,2018,39(7):348−352.] KANG C D, XIANG Q S, LIU X, et al. A review of application of plasma-activated water in food industry[J]. Science and Technology of Food Industry, 2018, 39(7): 348−352.
[27] PANKAJ S K, KEENER K M. Cold plasma:Background, applications and current trends[J]. Current Opinion in Food Science,2017,16:49−52. doi: 10.1016/j.cofs.2017.07.008
[28] SARANGAPANI C, MISRA N N, MILOSAVLJEVIC V, et al. Pesticide degradation in water using atmospheric air cold plasma[J]. Journal of Water Process Engineering,2016,9:225−232. doi: 10.1016/j.jwpe.2016.01.003
[29] SARANGAPANI C, O'TOOLE G, CULLEN P J, et al. Atmospheric cold plasma dissipation efficiency of agrochemicals on blueberries[J]. Innovative Food Science & Emerging Technologies,2017,44:235−241.
[30] PHAN K T K, PHAN H T, BOONYAWAN D, et al. Non-thermal plasma for elimination of pesticide residues in mango[J]. Innovative Food Science & Emerging Technologies,2018,48:164−171.
[31] FENG X X, MA X, LIU H X, et al. Argon plasma effects on maize:pesticide degradation and quality changes[J]. Journal of the Science of Food and Agriculture,2019,99(12):5491−5498. doi: 10.1002/jsfa.9810
[32] 谢瑾琢, 刘红霞, 冯鑫鑫, 等. 氩等离子体技术降解玉米表面毒死蜱的研究[J]. 西安交通大学学报,2020,54(3):113−118,178. [XIE J Z, LIU H X, FENG X X, et al. Degradation of chlorpyrifos on Maize Surface by Argon Plasma[J]. Journal of Xi'an Jiaotong University,2020,54(3):113−118,178.] XIE J Z, LIU H X, FENG X X, et al. Degradation of chlorpyrifos on Maize Surface by Argon Plasma[J]. Journal of Xi'an Jiaotong University, 2020, 54(3): 113−118,178.
[33] ANBARASAN R, JASPIN S, BHAVADHARINI B, et al. Chlorpyrifos pesticide reduction in soybean using cold plasma and ozone treatments[J]. LWT,2022,159:113193. doi: 10.1016/j.lwt.2022.113193
[34] LU H, PATIL S, KEENER K M, et al. Bacterial inactivation by high-voltage atmospheric cold plasma:Influence of process parameters and effects on cell leakage and DNA[J]. Journal of Applied Microbiology,2014,116(4):784−794. doi: 10.1111/jam.12426
[35] NIEMIRA B A. Cold plasma decontamination of foods[J]. Annual Review of Food Science and Technology,2012,3(1):125−142. doi: 10.1146/annurev-food-022811-101132
[36] THIRUMDAS R, SARANGAPANI C, ANNAPURE U S. Cold plasma:A novel non-thermal technology for food processing[J]. Food Biophysics,2014,10(1):1−11.
[37] MOSTASHARI P, AMIRI S, REZAZAD BARI L, et al. Physical decontamination and degradation of aflatoxins[M]. Berlin:Springer International Publishing, 2021:Chapter 10.
[38] LEE K H, KIM H-J, WOO K S, et al. Evaluation of cold plasma treatments for improved microbial and physicochemical qualities of brown rice[J]. LWT,2016,73:442−447. doi: 10.1016/j.lwt.2016.06.055
[39] ZAHORANOVÁ A, HENSELOVÁ M, HUDECOVÁ D, et al. Effect of cold atmospheric pressure plasma on the wheat seedlings vigor and on the inactivation of microorganisms on the seeds surface[J]. Plasma Chemistry and Plasma Processing,2015,36(2):397−414.
[40] MRAVLJE J, REGVAR M, STARIČ P, et al. Cold plasma affects germination and fungal community structure of buckwheat seeds[J]. Plants,2021,10(5):851. doi: 10.3390/plants10050851
[41] MISRA N N, YADAV B, ROOPESH M S, et al. Cold plasma for effective fungal and mycotoxin control in foods:Mechanisms, inactivation effects, and applications[J]. Comprehensive Reviews in Food Science and Food Safety,2018,18(1):106−120.
[42] YOUSEFI M, MOHAMMADI M A, KHAJAVI M Z, et al. Application of novel Non-thermal physical technologies to degrade mycotoxins[J]. Journal of Fungi,2021,7(5):395. doi: 10.3390/jof7050395
[43] SICILIANO I, SPADARO D, PRELLE A, et al. Use of cold atmospheric plasma to detoxify hazelnuts from aflatoxins[J]. Toxins,2016,8(5):125. doi: 10.3390/toxins8050125
[44] IQDIAM B M, FEIZOLLAHI E, ARIF M F, et al. Reduction of T‐2 and HT‐2 mycotoxins by atmospheric cold plasma and its impact on quality changes and germination of wheat grains[J]. Journal of Food Science,2021,86(4):1354−1371. doi: 10.1111/1750-3841.15658
[45] QIU Y, CHEN X L, ZHANG J Y, et al. Effects of tempering with plasma activated water on the degradation of deoxynivalenol and quality properties of wheat[J]. Food Research International,2022,162:112070. doi: 10.1016/j.foodres.2022.112070
[46] PULIGUNDLA P, LEE T, MOK C. Effect of corona discharge plasma jet treatment on the degradation of aflatoxin B1 on glass slides and in spiked food commodities[J]. LWT,2020,124:108333. doi: 10.1016/j.lwt.2019.108333
[47] WIELOGORSKA E, AHMED Y, MENEELY J, et al. A holistic study to understand the detoxification of mycotoxins in maize and impact on its molecular integrity using cold atmospheric plasma treatment[J]. Food Chemistry,2019,301:125281. doi: 10.1016/j.foodchem.2019.125281
[48] KWON D H, KIM H S, PARK M R. Plasma-based organism evaluation equipment using atmospheric-pressure plasma jets:Efficacy for controlling insect pests[J]. Journal of Asia-Pacific Entomology,2019,22(3):868−873. doi: 10.1016/j.aspen.2019.06.011
[49] ZIUZINA D, VAN CLEYNENBREUGEL R, TERSARUOLO C, et al. Cold plasma for insect pest control:Tribolium castaneum mortality and defense mechanisms in response to treatment[J]. Plasma Processes and Polymers,2021,18(10):2000178. doi: 10.1002/ppap.202000178
[50] PAUL A, RADHAKRISHNAN M, ANANDAKUMAR S, et al. Disinfestation techniques for major cereals:A status report[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(3):1125−1155. doi: 10.1111/1541-4337.12555
[51] MORAIS S, TORTAJADA-GENARO L A, MAQUIEIRA Á, et al. Biosensors for food allergy detection according to specific IgE levels in serum[J]. TrAC Trends in Analytical Chemistry,2020,127:115904. doi: 10.1016/j.trac.2020.115904
[52] RAVASH N, HESARI J, FEIZOLLAHI E, et al. Valorization of cold plasma technologies for eliminating biological and chemical food hazards[J]. Food Engineering Reviews,2024,16(1):22−58. doi: 10.1007/s12393-023-09348-0
[53] SARANGAPANI C, PATANGE A, BOURKE P, et al. Recent advances in the application of cold plasma technology in foods[J]. Annual Review of Food Science and Technology,2018,9(1):609−629. doi: 10.1146/annurev-food-030117-012517
[54] MEINLSCHMIDT P, UEBERHAM E, LEHMANN J, et al. The effects of pulsed ultraviolet light, cold atmospheric pressure plasma, and gamma-irradiation on the immunoreactivity of soy protein isolate[J]. Innovative Food Science & Emerging Technologies,2016,38:374−383.
[55] VENKATARATNAM H, SARANGAPANI C, CAHILL O, et al. Effect of cold plasma treatment on the antigenicity of peanut allergen Ara h 1[J]. Innovative Food Science & Emerging Technologies,2019,52:368−375.
[56] HSIEH K C, CHENG K C, LU T J, et al. Effect of plasma processing gas on Ara h 1 in peanut protein extract[J]. Food Control,2023,152:109848. doi: 10.1016/j.foodcont.2023.109848
[57] CHUTIA H, KALITA D, MAHANTA C L, et al. Kinetics of inactivation of peroxidase and polyphenol oxidase in tender coconut water by dielectric barrier discharge plasma[J]. LWT,2019,101:625−629. doi: 10.1016/j.lwt.2018.11.071
[58] SEGAT A, MISRA N N, CULLEN P J, et al. Effect of atmospheric pressure cold plasma (ACP) on activity and structure of alkaline phosphatase[J]. Food and Bioproducts Processing,2016,98:181−188. doi: 10.1016/j.fbp.2016.01.010
[59] ZHANG H, XU Z M, SHEN J, et al. Effects and mechanism of atmospheric-pressure dielectric barrier discharge cold plasmaon lactate dehydrogenase (LDH) enzyme[J]. Scientific Reports,2015,5(1):10031. doi: 10.1038/srep10031
[60] TOLOUIE H, MOHAMMADIFAR M A, GHOMI H, et al. The impact of atmospheric cold plasma treatment on inactivation of lipase and lipoxygenase of wheat germs[J]. Innovative Food Science & Emerging Technologies,2018,47:346−352.
[61] SADHU S, THIRUMDAS R, DESHMUKH R R, et al. Influence of cold plasma on the enzymatic activity in germinating mung beans (Vigna radiate)[J]. LWT,2017,78:97−104. doi: 10.1016/j.lwt.2016.12.026
[62] 刘宗浩, 张高鹏, 孙立娜, 等. 挤压对谷物蛋白的微观结构和功能特性影响的研究进展[J]. 中国粮油学报,2021,36(6):158−165. [LIU Z H, ZHANG G P, SUN L N, et al. Effects of microstructure and functional properties of cereal proteins by extrusion[J]. China Journal of Food and Oil,2021,36(6):158−165.] LIU Z H, ZHANG G P, SUN L N, et al. Effects of microstructure and functional properties of cereal proteins by extrusion[J]. China Journal of Food and Oil, 2021, 36(6): 158−165.
[63] SHARMA S, SINGH R K. Cold plasma treatment of dairy proteins in relation to functionality enhancement[J]. Trends in Food Science & Technology,2020,102:30−36.
[64] CHEN G Y, DONG S, CHEN Y, et al. Complex coacervation of zein-chitosan via atmospheric cold plasma treatment:Improvement of encapsulation efficiency and dispersion stability[J]. Food Hydrocolloids,2020,107:105943. doi: 10.1016/j.foodhyd.2020.105943
[65] STADTMAN E R, LEVINE R L. Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J]. Amino Acids,2003,25(3-4):207−218. doi: 10.1007/s00726-003-0011-2
[66] ALABI O O, ANNOR G A, AMONSOU E O. Effect of cold plasma-activated water on the physicochemical and functional properties of Bambara groundnut globulin[J]. Food Structure,2023,36:100321. doi: 10.1016/j.foostr.2023.100321
[67] MEHR H M, KOOCHEKI A. Effect of atmospheric cold plasma on structure, interfacial and emulsifying properties of Grass pea (Lathyrus sativus L.) protein isolate[J]. Food Hydrocolloids,2020,106:105899. doi: 10.1016/j.foodhyd.2020.105899
[68] BUßLER S, STEINS V, EHLBECK J, et al. Impact of thermal treatment versus cold atmospheric plasma processing on the techno-functional protein properties from Pisum sativum ‘Salamanca’[J]. Journal of Food Engineering,2015,167:166−174. doi: 10.1016/j.jfoodeng.2015.05.036
[69] 刘婷, 李淼, 齐先科, 等. 辉光放电冷等离子体处理对小麦加工品质的改善作用[J]. 食品科学,2023,44(15):87−94. [LIU T, LI M, QI X K, et al. Effect of glow discharge cold plasma treatment on wheat processing quality[J]. Food Science,2023,44(15):87−94.] doi: 10.7506/spkx1002-6630-20220920-193 LIU T, LI M, QI X K, et al. Effect of glow discharge cold plasma treatment on wheat processing quality[J]. Food Science, 2023, 44(15): 87−94. doi: 10.7506/spkx1002-6630-20220920-193
[70] GRGIĆ I, AČKAR Đ, BARIŠIĆ V, et al. Nonthermal methods for starch modification—A review[J]. Journal of Food Processing and Preservation,2019,43(12):e14242.
[71] OKYERE A Y, BOAKYE P G, BERTOFT E, et al. Temperature of plasma-activated water and its effect on the thermal and chemical surface properties of cereal and tuber starches[J]. Current Research in Food Science,2022,5:1668−1675. doi: 10.1016/j.crfs.2022.09.020
[72] WONGSAGONSUP R, DEEYAI P, CHAIWAT W, et al. Modification of tapioca starch by non-chemical route using jet atmospheric argon plasma[J]. Carbohydrate Polymers,2014,102:790−798. doi: 10.1016/j.carbpol.2013.10.089
[73] BANURA S, THIRUMDAS R, KAUR A, et al. Modification of starch using low pressure radio frequency air plasma[J]. LWT,2018,89:719−724. doi: 10.1016/j.lwt.2017.11.056
[74] ZHOU C G, ZHOU Y J, TANG Q Y, et al. Impact of argon dielectric barrier discharge cold plasma on the physicochemical and cooking properties of lightly-milled rice[J]. Innovative Food Science & Emerging Technologies,2024,92:103580.
[75] SIFUENTES-NIEVES I, MENDEZ-MONTEALVO G, FLORES-SILVA P C, et al. Dielectric barrier discharge and radio-frequency plasma effect on structural properties of starches with different amylose content[J]. Innovative Food Science & Emerging Technologies,2021,68:102630.
[76] THIRUMDAS R, TRIMUKHE A, DESHMUKH R R, et al. Functional and rheological properties of cold plasma treated rice starch[J]. Carbohydrate Polymers,2017,157:1723−1731. doi: 10.1016/j.carbpol.2016.11.050
[77] OKYERE A Y, BERTOFT E, ANNOR G A. Modification of cereal and tuber waxy starches with radio frequency cold plasma and its effects on waxy starch properties[J]. Carbohydrate Polymers,2019,223:115075. doi: 10.1016/j.carbpol.2019.115075
[78] SARANGAPANI C, THIRUMDAS R, DEVI Y, et al. Effect of low-pressure plasma on physico–chemical and functional properties of parboiled rice flour[J]. LWT,2016,69:482−489. doi: 10.1016/j.lwt.2016.02.003
[79] SUROWSKY B, BUßLER S, SCHLÜTER O K. Cold plasma interactions with food constituents in liquid and solid food matrices[M]. Pittsburgh:Academic Press, 2016.
[80] SARANGAPANI C, RYAN KEOGH D, DUNNE J, et al. Characterisation of cold plasma treated beef and dairy lipids using spectroscopic and chromatographic methods[J]. Food Chemistry,2017,235:324−333. doi: 10.1016/j.foodchem.2017.05.016
[81] BAHRAMI N, BAYLISS D, CHOPE G, et al. Cold plasma:A new technology to modify wheat flour functionality[J]. Food Chemistry,2016,202:247−253. doi: 10.1016/j.foodchem.2016.01.113
[82] 王向阳, 李淼, 王若兰, 等. 冷等离子体处理对花生中脂质及蛋白理化特性的影响[J]. 食品研究与开发,2022,43(7):89−95,125. [WANG X Y, LI M, WANG R L, et al. Effect of cold plasma treatment on physicochemical characteristics of lipid and protein in peanuts[J]. Food Research and Development,2022,43(7):89−95,125.] WANG X Y, LI M, WANG R L, et al. Effect of cold plasma treatment on physicochemical characteristics of lipid and protein in peanuts[J]. Food Research and Development, 2022, 43(7): 89−95,125.
[83] YEPEZ X V, KEENER K M. High-voltage Atmospheric Cold Plasma (HVACP) hydrogenation of soybean oil without trans-fatty acids[J]. Innovative Food Science & Emerging Technologies,2016,38:169−174.
[84] VANDAMME J, NIKIFOROV A, DUJARDIN K, et al. Critical evaluation of non-thermal plasma as an innovative accelerated lipid oxidation technique in fish oil[J]. Food Research International,2015,72:115−125. doi: 10.1016/j.foodres.2015.03.037
[85] VUOLO M M, LIMA V S, MARÓSTICA J M R. Phenolic compounds:Structure, classification, and antioxidant power[M]. Sawston:Woodhead Publishing, 2019.
[86] THIRUMDAS R, DESHMUKH R R, ANNAPURE U S. Effect of low temperature plasma on the functional properties of basmati rice flour[J]. Journal of Food Science and Technology,2016,53(6):2742−2751. doi: 10.1007/s13197-016-2246-4
[87] SOOKWONG P, YODPITAK S, DOUNGKAEW J, et al. Application of oxygen-argon plasma as a potential approach of improving the nutrition value of pre-germinated brown rice[J]. Journal of Food and Nutrition Research,2014,2(12):946−951. doi: 10.12691/jfnr-2-12-14
[88] LI R, LI Z J, WU N N, et al. The effect of cold plasma pretreatment on GABA, γ-oryzanol, phytic acid, phenolics, and antioxidant capacity in brown rice during germination[J]. Cereal Chemistry,2022,100(2):321−332.
[89] ZARGARCHI S, SAREMNEZHAD S. Gamma-aminobutyric acid, phenolics and antioxidant capacity of germinated indica paddy rice as affected by low-pressure plasma treatment[J]. LWT,2019,102:291−294. doi: 10.1016/j.lwt.2018.12.014
[90] PANKAJ S, WAN Z, KEENER K. Effects of cold plasma on food quality:A review[J]. Foods,2018,7(1):4. doi: 10.3390/foods7010004
[91] BIE P P, PU H Y, ZHANG B J, et al. Structural characteristics and rheological properties of plasma-treated starch[J]. Innovative Food Science & Emerging Technologies,2016,34:196−204.
[92] ZARE L, MOLLAKHALILI-MEYBODI N, FALLAHZADEH H, et al. Effect of atmospheric pressure cold plasma (ACP) treatment on the technological characteristics of quinoa flour[J]. LWT,2022,155:112898. doi: 10.1016/j.lwt.2021.112898
[93] HU Y M, WANG L J, LI Z G. Modification of protein structure and dough rheological properties of wheat flour through superheated steam treatment[J]. Journal of Cereal Science,2017,76:222−228. doi: 10.1016/j.jcs.2017.06.013
[94] WU T Y, CHANG C R, CHANG T J, et al. Changes in physicochemical properties of corn starch upon modifications by atmospheric pressure plasma jet[J]. Food Chemistry,2019,283:46−51. doi: 10.1016/j.foodchem.2019.01.043
[95] ZHU F. Plasma modification of starch[J]. Food Chemistry,2017,232:476−486. doi: 10.1016/j.foodchem.2017.04.024
[96] POTLURI S, SANGEETHA K, SANTHOSH R, et al. Effect of low‐pressure plasma on bamboo rice and its flour[J]. Journal of Food Processing and Preservation,2018,42(12):e13846. doi: 10.1111/jfpp.13846
[97] PAL P, KAUR P, SINGH N, et al. Effect of nonthermal plasma on physico-chemical, amino acid composition, pasting and protein characteristics of short and long grain rice flour[J]. Food Research International,2016,81:50−57. doi: 10.1016/j.foodres.2015.12.019
[98] LOKESWARI R, SHARANYAKANTH P S, JASPIN S, et al. Cold plasma effects on changes in physical, nutritional, hydration, and pasting properties of pearl millet (Pennisetum Glaucum)[J]. IEEE Transactions on Plasma Science,2021,49(5):1745−1751. doi: 10.1109/TPS.2021.3074441
[99] THIRUMDAS R, DESHMUKH R R, ANNAPURE U S. Effect of low temperature plasma processing on physicochemical properties and cooking quality of basmati rice[J]. Innovative Food Science & Emerging Technologies,2015,31:83−90.
[100] CHEN H H, CHEN Y K, CHANG H C. Evaluation of physicochemical properties of plasma treated brown rice[J]. Food Chemistry,2012,135(1):74−79. doi: 10.1016/j.foodchem.2012.04.092
[101] THIRUMDAS R, SARAGAPANI C, AJINKYA M T, et al. Influence of low pressure cold plasma on cooking and textural properties of brown rice[J]. Innovative Food Science & Emerging Technologies,2016,37:53−60.
[102] SARANGAPANI C, YAMUNA DEVI R, THIRUMDAS R, et al. Physico-chemical properties of low-pressure plasma treated black gram[J]. LWT,2017,79:102−110. doi: 10.1016/j.lwt.2017.01.017
[103] KHAN M J, JOVICIC V, ZBOGAR-RASIC A, et al. Enhancement of wheat flour and dough properties by non-thermal plasma treatment of wheat flour[J]. Applied Sciences,2022,12(16):7997. doi: 10.3390/app12167997
[104] MISRA N N, KAUR S, TIWARI B K, et al. Atmospheric pressure cold plasma (ACP) treatment of wheat flour[J]. Food Hydrocolloids,2015,44:115−121. doi: 10.1016/j.foodhyd.2014.08.019
[105] CHEN H H. Investigation of properties of long-grain brown rice treated by low-pressure plasma[J]. Food and Bioprocess Technology,2013,7(9):2484−2491.





 下载:
下载:
 下载:
下载:



