Research Progress on the Bitter Taste Formation Mechanism in Protein Hydrolysates and Their Enzymatic Debittering and Flavor Improvement
-
摘要: 蛋白质水解后会产生多种生物活性肽,含有生物活性肽的功能食品能够改善人体的健康。但因蛋白质在水解过程中会产生苦味物质苦味肽,具有不良口感,限制了蛋白质水解产物在功能性食品中的应用。在不影响蛋白质水解产物生物活性的前提下,氨肽酶和羧肽酶等蛋白酶的进一步水解能够有效降低其苦味,在低苦味多肽功能食品的开发方面具有广泛的应用前景。本文综合分析了影响蛋白质水解产物苦味的因素,包括苦味肽组成、蛋白质水解度、蛋白酶种类以及多肽构效关系。此外,本文还探讨了高效液相色谱-质谱联用技术、生物信息学模型和电子舌在苦味肽鉴定中的应用。文章强调了内肽酶-外肽酶分步酶解在降低蛋白质水解产物苦味和优化食品风味方面的协同效果。本文旨在为改善蛋白质水解产物的感官品质、提高其在功能食品领域中的应用提供参考。Abstract: Protein hydrolysis can yield a diversity of bioactive peptides, thus the functional foods containing protein hydrolysates can improve human health. However, the utilization of protein hydrolysates in functional foods is limited for the unpleasant taste attributed to the bitter peptides generated during the hydrolysis process. Without reducing the biological activity of protein hydrolysates, further enzymatic hydrolysis by employing aminopeptidase, carboxypeptidase, or other proteases can effectively attenuate their bitterness, which presents potential applications for developing peptide-based functional foods with low bitterness. Therefore, this paper presents a comprehensive review of the influencing factors of bitterness in protein hydrolysates, the identification of bitter peptides, and the applications of proteases in reducing bitter peptides and improving food flavor. In this review, the factors affecting the bitterness of protein hydrolysates are comprehensively analyzed, which include the composition of bitter peptides, the degree of protein hydrolysis, the types of proteases and the structure-activity relationship of peptides. Additionally, the applications of high performance liquid chromatography-mass spectrometry/mass spectrometry, bioinformatics model and electronic tongue in identifying bitter peptides are also discussed. This paper emphasizes the synergistic effect of endopeptidase-exopeptidase combination in reducing the bitterness of protein hydrolysates and optimizing food flavor. This review contributes to a reference for enhancing the sensory quality of protein hydrolysates as well as broadening their utilization in functional foods.
-
Keywords:
- protein hydrolysates /
- bitterness /
- debittering methods /
- exopeptidase /
- flavor improvement
-
蛋白质是人体所必需的营养素,具有多种生物活性,在补充营养和促进人体健康方面具有重要作用[1]。除了完整的蛋白质外,其水解产物因具有显著的抗氧化、抗炎、降血糖和抗癌等生物活性而被用作功能食品的原料[2−3]。蛋白质水解产物是通过化学或酶水解(包括发酵等过程)而产生的一种含有多肽和氨基酸的混合物[3]。食物来源的蛋白质水解产物富含多种生物活性肽,这些多肽具有作为健康食品中功能成分的潜力,受到科学界和食品行业的广泛关注[4−5]。研究发现生物活性肽的健康效益和苦味强度均与其疏水性氨基酸含量相关,疏水性氨基酸含量越高,其多肽的生物活性越强、苦味也越强[6−7]。如乳清蛋白水解产物中,苦味最重的多肽组分具有最高的疏水性氨基酸含量,且其血管紧张素转换酶(Angiotensin converting enzyme,ACE)抑制活性也最高[6]。蛋白质水解产物中的苦味肽能够通过疏水性基团激活人的苦味受体,使人感受到强烈的苦味,从而限制了蛋白质水解产物在食品领域中的应用[8]。
目前关于降低蛋白质水解产物苦味的技术方法主要包括理化类和生物类两种。理化类方法主要包括选择性分离法、掩蔽苦味法、美拉德反应法和包埋法;而生物类方法主要有蛋白酶水解法、酶法脱酰胺和类蛋白反应法。理化类方法可以有效降低蛋白质水解产物的苦味,但也存在改变蛋白质结构、损失生物活性肽或重现苦味等缺点。与理化脱苦法相比,生物类方法加工条件温和、脱苦成本较低,且脱苦效果稳定[9]。最重要的是,生物类方法在降低多肽苦味的同时,对多肽生物活性的负面影响较低[10]。因此,生物类方法尤其是蛋白酶水解法被广泛应用于降低苦味肽的苦味,改善多肽类产品的风味[11]。
蛋白酶水解在获得低苦味且生物活性较高的蛋白质水解产物上被证明具有显著的效果[10,12]。根据作用位点不同,蛋白酶可分为内肽酶和外肽酶[9]。内肽酶作用于肽链内部的肽键,而外肽酶(包括氨肽酶和羧肽酶)作用于肽链末端的肽键。内肽酶的水解作用通常会导致多肽末端疏水性氨基酸的暴露,导致苦味的产生;而外肽酶能够去除多肽末端暴露出的疏水性氨基酸,进而达到降低苦味肽苦味的效果[13]。因此,内肽酶与外肽酶之间的协同作用能够显著降低蛋白质水解产物的苦味,并保留其较高的生物活性[10,14]。蛋白酶的选择与开发对生物脱苦具有重要作用[9]。目前市面上常用的商用蛋白酶主要来源于动物、植物和微生物[15−17]。其中,微生物来源的多种氨肽酶在降低多肽苦味上也具有潜在的应用价值[13]。蛋白酶的多种来源为蛋白酶组合水解获得低苦味多肽提供了可行的方案[18]。
尽管近年来蛋白酶在改善蛋白质水解产物苦味方面已被广泛研究和应用,但很少有文献对这些内容进行系统总结分析。因此,本文系统地总结了影响蛋白质水解产物苦味的因素、苦味肽的鉴定、蛋白酶在减少苦味肽和改善食品风味上的研究及应用,以期为蛋白质水解产物的脱苦及其蛋白或多肽类功能食品的开发提供参考。
1. 影响蛋白质水解产物苦味的因素
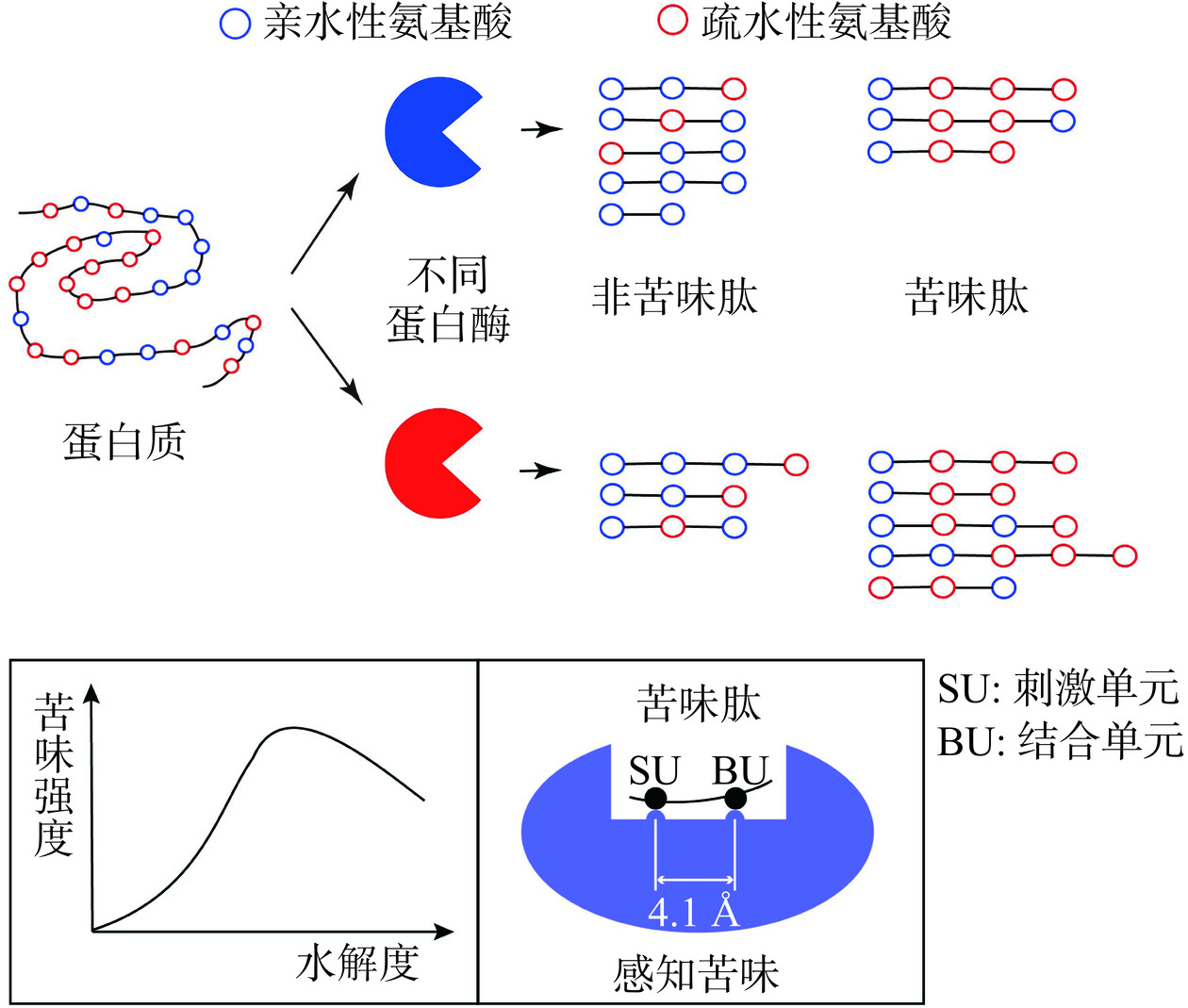
天然蛋白质不具有苦味,而被水解成多肽和氨基酸后却产生了苦味。Murray和Baker的研究表明,尽管某些游离氨基酸如甲硫氨酸可能带有轻微的苦味,但多肽是导致蛋白质水解产物出现强烈苦味的主要因素[19]。随后,越来越多的研究也发现蛋白质水解产物的苦味主要是由于水解过程释放了大量的疏水性多肽—苦味肽[9]。苦味肽是蛋白质在发酵、水解等过程中产生的一组结构多样、具有高苦味的疏水性寡肽[20−21]。蛋白质水解产物的苦味主要与疏水性氨基酸、水解度、蛋白酶种类以及苦味肽的构效关系有关(图1)[9]。
1.1 疏水性氨基酸
苦味肽中疏水性氨基酸的比例及位置在影响苦味肽的苦味强度方面起了重要作用。当苦味肽中含有较多疏水性氨基酸(例如丙氨酸、亮氨酸、异亮氨酸、色氨酸、苯丙氨酸和酪氨酸)时,其苦味越强[12]。当疏水性氨基酸(如丙氨酸、苯丙氨酸和亮氨酸)位于多肽的羧基端,且碱性氨基酸位于氨基端时,苦味肽的苦味值更加强烈[22]。Gan等[23]发现来源于罗非鱼副产物的潜在苦味肽的末端含有较多数量的赖氨酸,且N-端含有疏水性氨基酸丙氨酸、亮氨酸、异亮氨酸和甘氨酸的可能性较高。此外,在这些潜在的苦味肽中,丙氨酸和赖氨酸、异亮氨酸和赖氨酸、亮氨酸和亮氨酸、丙氨酸和亮氨酸分别在多肽N-端和C-端同时出现的频率更高。该研究还表明苦味肽的整体疏水性与其苦味强度之间没有直接关系,而是苦味肽中氨基酸侧链的疏水性起关键作用。另外,蛋白质的疏水性和其水溶性间存在着显著的负相关性[24]。因此,在相同水解条件下,水溶性较差的蛋白质通常疏水性较高,其水解后产生的多肽含有较高比例疏水性氨基酸的可能性就较大,即产生苦味肽的数量就较多,导致蛋白质水解产物的苦味较高[23]。
1.2 水解度
水解产物中多肽的苦味强度与其水解度之间存在着“钟形”关系,即随着蛋白质水解度的增加,多肽的苦味强度呈现出先增加后降低的趋势[9]。蛋白质结构在水解前期的变化影响了苦味肽的释放。水解度较低时,水解产物多为α-螺旋或不规则卷曲结构的大分子肽,这些大分子肽的疏水基团被嵌入蛋白质分子中,苦味肽的释放较少,且不易与味蕾上的味觉受体接触,因此苦味较低[25]。随着水解度的不断增加,蛋白质的肽链逐渐打开,释放出更多的苦味肽[22]。当水解度进一步增加时,苦味肽的总量没有显著增加,而是部分苦味肽释放出游离氨基酸,导致苦味肽的苦味阈值增加、苦味强度降低[9]。
蛋白质水解过程伴随着多肽分子量的减小。Tong等[12]发现大豆蛋白质经碱性蛋白酶(Protex 6 L)水解后,其产物主要存在着4种分子量范围的肽段:>10 kDa、5~10 kDa、1~5 kDa和<0.5 kDa。当该水解产物被蛋白酶Protease A 2SD继续水解时,>10 kDa和5~10 kDa的肽段含量分别从34.31%和29.73%下降到12.89%和9.71%;而分子量小于1 kDa和1~5 kDa的肽段含量增加,同时这些结果伴随着水解产物苦味的减少。另有研究发现,小麦谷蛋白质水解产物中分子量在180~1000 Da之间的组分被认为是苦味肽的主要成分,而<180 Da的组分主要是由游离氨基酸组成,不表现出苦味。该研究还发现,500~1000 Da范围内多肽一般含有4~8个氨基酸,苦味肽可能更容易与苦味受体结合,表现出强烈的苦味[22]。Cheung等[10]研究发现当外肽酶对耐热蛋白酶(PC10F)乳清蛋白水解产物进行水解时,水解产物中分子量小于200 Da的肽和游离氨基酸增多,而且增加的肽和游离氨基酸不具有苦味。
1.3 蛋白酶种类
蛋白酶的种类也是影响蛋白质水解产物苦味强度的重要因素。不同蛋白酶具有不同的活性作用位点,对蛋白质进行特异性酶解后产生不同的多肽序列,这些多肽的末端氨基酸的性质在很大程度上决定了水解产物的苦味程度。例如,扁豆蛋白经过相同时间的水解后,风味蛋白酶水解物的苦味强度低于碱性蛋白酶水解物,但其水解度(8.51%)却显著低于碱性蛋白酶水解物(20.12%)。这可能是因为风味蛋白酶中外肽酶的作用位点是多肽链末端,而蛋白质较大的分子量以及较复杂的空间构象使外肽酶与多肽链末端的接触受到限制,导致了较低的水解度[26]。在相同的水解度下,小麦谷蛋白的碱性蛋白酶水解产物苦味值(4.38)高于胰蛋白酶水解物(3.4)[22]。碱性蛋白酶是一种疏水特异性内肽酶,其活性位点为酪氨酸、色氨酸、苯丙氨酸等芳香氨基酸残基,以及疏水性氨基酸残基羧基端的肽键,导致水解后产生的多肽末端疏水性氨基酸比例较高,产生较重的苦味[22]。胰蛋白酶的酶活性位点为赖氨酸、精氨酸等碱性氨基酸,避免了脯氨酸位于肽链中间或与精氨酸相邻而产生的重苦味[27]。
1.4 苦味肽构效关系
人体能够感知到苦味是苦味肽和味蕾细胞苦味受体相互作用的结果。人类感知苦味的受体共有25种,属于味觉受体第二家族[20]。苦味肽的苦味强度与苦味肽的空间结构密切相关,主要体现于苦味肽构效关系[9]。苦味肽含有两个苦味决定位点,一个是由至少三个碳原子组成的疏水基团—结合单元(Binding unit,BU),另一个是由α-氨基或疏水基团构成的碱性基团—刺激单元(Stimulating unit,SU)。苦味肽功能单位之间的距离能够影响人体感知的苦味,当它们之间的距离小于或大于4.1 Å时,人体不能感受到苦味,而当它们之间的距离约为4.1 Å时,苦味受体能够通过疏水性识别区域识别苦味肽,引发神经信号级联反应,从而使人体感知到苦味肽的苦味[28]。
2. 苦味肽鉴定
近年来,基于质谱技术的多肽组学方法在探究小分子多肽的组成及变化规律上发挥着关键作用[29]。高效液相色谱串联质谱联用技术(High Performance Liquid Chromatography-Mass Spectrometry/Mass Spectrometry,HPLC-MS/MS)和生物信息学方法在苦味肽的定量和鉴定上具有重要意义[22−23]。Gan等[23]利用HPLC-MS/MS分别从鱼皮、鱼头和鱼骨蛋白水解物中鉴定出3727、3050和4302种潜在的苦味肽(例如APDPGPGPMG、KAEPAPAPAPAPAPAPAPAP和GVDNPGHPF),且这些多肽的分子量普遍小于2 kDa。此外,该研究在分析多肽的分子结构和感官特性之间的关系时,利用BIOPEP数据库分析发现RP、PG、PGP、PP、PL和LE等具有生物活性的序列在潜在苦味肽中出现的频率较高。这个结果表明利用生物活性多肽片段出现的频率可能会有助于预测多肽的苦味强度,但仍需要进一步的研究验证。
众所周知,多肽的苦味强度与其疏水性密切相关。Ney[30]提出了一个根据多肽疏水性来预测多肽苦味强度的假说—Q法则。其中,Q值是多肽的平均疏水度,即自由能的变化值与氨基酸残基数的比值,可以通过多肽的氨基酸序列以及氨基酸侧链的疏水度来预测。此外,当多肽的Q值<1300时,该多肽不具有苦味;当Q值>1400时,该多肽具有苦味;而当多肽的Q值介于1300和1400之间时,则无法判断该多肽是否具有苦味[31]。然而,由于Q法则属于经验公式,且在分子质量大于6 kDa的多肽苦味预测上具有限制性,因此Q法则只适用于多肽苦味预测的定性分析,而不能用于苦味强度的定量分析[30]。Q法则可以用于筛选质谱鉴定结果中的潜在苦味肽。例如,Ongkowijoyo等[32]通过质谱结合Q法则从豌豆蛋白质水解产物中鉴定出一种苦味肽PA1b(ASCNGVCSPFDIPPCGSPLCRCIPVGLVIGKCRNPYG)。
对苦味强度的评价主要包括体内和体外方法。体内评价主要指通过健康且经过味觉培训的受试者直接品尝样品来进行感官评价[22−23]。例如,从豌豆蛋白质水解产物中分离出的苦味肽PA1b通过传统的感官评价方法验证[32]。作为常用的体外感官评价方法,电子舌被广泛用于蛋白质水解物及多肽的感官评价,其苦味评价结果与体内感官评价结果之间存在正相关关系,且具有成本低、客观、高灵敏度、快速分析以及样品量小等优点[12,33−34]。电子舌的工作原理是利用由脂质或聚合物膜组成的化学传感器来模拟人类的味觉系统。当苦味物质通过静电或疏水相互作用吸附在传感器的膜上时,就会引起苦味电位发生变化,从而将苦味信息转换成电信号以识别苦味强度的差异[35]。电子舌在验证质谱鉴定出的潜在苦味肽上具有重要的应用。例如,有研究利用LC-MS/MS和生物信息学技术手段,从劣质火腿高苦味部分中筛选出11种潜在的苦味肽,通过电子舌评价进一步验证了这些多肽具有强烈的苦味。其中,PKAPPAK、VTDTTR和YIIEK等三种肽的苦味值最高[36]。
此外,开发基于多肽结构特征的定量构效关系的生物信息学模型有助于补充对苦味肽的感官评价以及提高苦味肽的鉴定效率,目前已经有许多研究开发出用于预测苦味肽苦味强度的生物信息学模型。Charoenkwan等[37]开发了BERT4Bitter模型,可以直接从氨基酸序列预测苦味肽,而不需要任何结构信息。该方法在交叉验证和独立试验中的准确率分别达到了0.861和0.922,为快速筛选和鉴定新型苦味肽提供了一个有效的工具。另外一种Bitter-RF模型综合了多肽序列内部信息和理化性质等多方面的信息,提高了苦味肽分类的准确性,在预测和筛选苦味肽方面具有潜在的应用价值[38]。基于轻量级梯度提升机算法,Yu等[39]结合多肽组学技术开发出了一套完整的苦味肽筛选流程,发现变质牛奶中潜在的苦味肽很可能是β-酪蛋白在某些非失活蛋白酶酶解作用下产生的,且位于多肽C端的赖氨酸残基对其苦味强度具有显著的增益效应。
3. 蛋白酶在减少苦味肽方面的作用研究
目前已用于减少、掩盖蛋白质水解物苦味的技术方法主要包括理化类方法和生物类方法[9]。理化类的脱苦技术主要包括选择性分离(如萃取、吸附、色谱分离、等电点沉淀和超滤分离等)、掩蔽苦味法、包埋(包括喷雾干燥、冷冻干燥和乳化等)和美拉德反应。为了避免损失生物活性、影响感官品质、多肽变性等问题,利用多种蛋白酶的底物特异性来实现对蛋白质水解物的脱苦受到广泛关注,如表1所示[12,40]。
表 1 蛋白酶酶解的脱苦作用Table 1. Debittering effect of protease enzymatic hydrolysis酶解种类 蛋白质 蛋白酶 水解条件 水解度(%) 苦味值 苦味值变化机理 参考文献 单酶酶解 大豆蛋白质 Protex 6L pH8.0,55 ℃,2 h 13.37 5.1 Protex 6L倾向于在疏水性氨基酸残基位置水解。因此,所得到的多肽在末端具有疏水性氨基酸残基,导致相对较高的苦味。 [12] 单酶酶解 大豆蛋白质 Protease A 2SD pH7.0,50 ℃,2 h 8.96 0.5 由于蛋白酶A 2SD具有较高的外肽酶和内肽酶活性,因此,所得到的大豆蛋白水解产物具有较低的苦味值。 [12] 多酶分步
酶解大豆蛋白质 Protex 6L;
Protease A 2SDProtex 6L水解2 h (pH8.0,55 ℃),Protease A 2SD水解
3 h(pH7.0,50 ℃)23.32 5.1→0.9 在Protex 6L酶解产生的大豆蛋白水解产物中,Protease A 2SD可能倾向于从苦肽的N-端切割亮氨酸和精氨酸残基而降解苦味肽,使肽中的疏水性氨基酸(丙氨酸、亮氨酸、异亮氨酸、色氨酸、苯丙氨酸和酪氨酸)数量减少,显著降低大豆Protex 6L酶酶解产物的苦味强度。 [12] 单酶酶解 绿扁豆
蛋白质碱性蛋白酶 pH8,60 ℃,3 h 20.12 2 碱性蛋白酶作为内肽酶,切割多肽内部。 [26] 单酶酶解 绿扁豆
蛋白质风味蛋白酶 pH7,50 ℃,3 h 8.51 0(低于检测线) 风味蛋白酶里主要为外肽酶,外肽酶从多肽的末端切割氨基酸残基。 [26] 多酶分步
水解绿扁豆
蛋白质碱性蛋白酶-
风味蛋白酶碱性蛋白酶(pH 8,
60 ℃,2 h)-风味蛋白酶(pH7,50 ℃,1 h)47.05 2→0(低于检测线) 第一步碱性蛋白酶的水解作用增加了多肽N-端位点的数量,促进了风味蛋白酶对多肽的水解,使水解度显著增加。 [26] 单酶酶解 酪朊酸钠 内肽酶Sternzym BP 25201 pH6.75,65 ℃,2.2 h 2.30 9.1 Sternzym BP 25201的对疏水性氨基酸(如亮氨酸、缬氨酸、苯丙氨酸和异亮氨酸)具有底物特异性,使得生成的多肽末端大多含有疏水性氨基酸,表现出较高的苦味。 [40] 多酶分步
酶解酪朊酸钠 Sternzym BP 25201-氨肽酶PepN Sternzym BP 25201:pH6.75,65 ℃,2.2 h;氨肽酶PepN:pH6.75,50 ℃,24 h 3.60 9.1→4.7 PepN显著降低了酪朊酸钠第一步酶解产物的苦味;由于Sternzym BP 25201的底物特异性,使其酶解产物中的大多数肽的N-端为亮氨酸、缬氨酸、苯丙氨酸或异亮氨酸,PepN能够切割这些N端的氨基酸,从而显著改善苦味。 [40] 多酶分步
酶解酪朊酸钠 Sternzym BP 25201-氨肽酶PepX Sternzym BP 25201:pH6.75,65 ℃,2.2 h;氨肽酶PepX:pH6.75,50 ℃,24 h 3.40 9.1→8.8 没有显著改变酪朊酸钠内肽酶酶解
产物的苦味。[40] 多酶分步
酶解酪朊酸钠 Sternzym BP 25201-氨肽酶PepA Sternzym BP 25201:pH6.75,65 ℃,2.2 h;氨肽酶PepA:pH6.75,50 ℃,24 h 3.60 9.1→7.8 没有显著改变酪朊酸钠内肽酶酶解产物的苦味,可能是因为该酶对亲水性氨基酸天冬氨酸、谷氨酸和丝氨酸具有特异性。 [40] 多酶分步
酶解酪朊酸钠 Sternzym BP 25201-从风味蛋白酶中分离出的外肽酶(Exo-flavourzyme) Sternzym BP 25201:pH6.75,65 ℃,2.2 h;风味蛋白酶中分离出的外肽酶:pH6.75,
50 ℃,24 h4.50 9.1→3 从风味蛋白酶中分离出的外肽酶显著降低了酪朊酸钠第一步酶解产物的苦味;由于Sternzym BP 25201的底物特异性,使其酶解产物中的大多数肽的N-端为亮氨酸、缬氨酸、苯丙氨酸或异亮氨酸,而从风味蛋白酶中分离出的外肽酶能够切割位于苦味肽末端的氨基酸,从而显著
改善了苦味。[40] 目前基于蛋白酶的脱苦方法主要是利用碱性蛋白酶、中性蛋白酶、风味蛋白酶等酶及其组合对苦味肽进行降解(包括单酶酶解和多酶分步酶解),减少苦味肽的数量,从而降低蛋白质水解产物的苦味强度[12]。
3.1 蛋白酶的来源和作用位点
蛋白酶是一种通过裂解肽键而将蛋白质水解成多肽并最终水解成部分氨基酸的酶。根据作用位点的差异,蛋白酶被分为内肽酶和外肽酶:内肽酶作用于多肽链的内部;而外肽酶能够催化多肽链末端肽键的水解,游离末端氨基酸[40]。此外,根据所切割肽链末端的不同,外肽酶又可分为氨肽酶和羧肽酶[40]。蛋白酶还可根据蛋白酶作用的氨基酸不同,分为丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸和谷氨酸蛋白酶和苏氨酸蛋白酶等[41]。
如表2所示,蛋白酶主要来源于微生物、植物和动物。在商业规模上,由于利用微生物生产蛋白酶所需要的资源较少,微生物来源的蛋白酶比植物和动物来源的更受欢迎[16]。微生物来源的商业蛋白酶主要包括中性蛋白酶、碱性蛋白酶和风味蛋白酶。中性蛋白酶(Neutrase)是一种来源于解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的金属蛋白酶(属于内肽酶),对疏水性氨基酸具有较高的特异性[42−43]。碱性蛋白酶是枯草杆菌蛋白酶的一种变体,是一种丝氨酸内肽酶,通常从地衣芽孢杆菌中获得[16]。碱性蛋白酶的活性位点为酪氨酸、色氨酸、苯丙氨酸等芳香氨基酸残基以及位于疏水性氨基酸残基羧基端的肽键,使被切割的多肽端疏水性氨基酸比例较高[22]。风味蛋白酶是一种来源于米曲霉的内外肽酶复合酶,包括二肽基肽酶-4、二肽基肽酶-5、亮氨酸氨肽酶-A、亮氨酸氨肽酶-2、中性蛋白酶-1、中性蛋白酶-2、碱性蛋白酶-1和α-淀粉酶A型-3[15,40]。此外,微生物来源的氨肽酶在水解位于多肽末端的疏水性氨基酸残基、降低苦味肽苦味方面具有重要作用[13]。木瓜蛋白酶、无花果蛋白酶和菠萝蛋白酶来源于热带水果,属于胱氨酸蛋白酶,其活性位点包含半胱氨酸[16]。胰蛋白酶来源于动物,能够水解位于肽链羧基端的赖氨酸和精氨酸残基,使产生苦味值较低的蛋白质水解产物[44]。
表 2 部分蛋白酶的来源、活性类别、活性作用位点及水解条件Table 2. Source, active types, active sites and hydrolysis conditions of some proteases蛋白酶 酶来源 酶活性类别 活性作用位点 水解条件 参考文献 碱性蛋白酶(Alcalase) 地衣芽孢杆菌(Bacillus licheniformis) 丝氨酸内肽酶 酪氨酸、色氨酸、苯丙氨酸等芳香氨基酸残基以及羧基端的疏水性氨基酸残基 50 ℃;pH7.5 [22,42,45] 蛋白酶Protease A 2SD 真菌 兼具内切和端解活性 N-端的亮氨酸和精氨酸 50 ℃;pH7.0 [12] Protex 6L 地衣芽孢杆菌(Bacillus licheniformis) 内肽酶 倾向于在疏水性氨基酸残基位置水解,产生多肽C-端为具有大侧链且无电荷的氨基酸(芳香族和脂肪族氨基酸)的肽,如异亮氨酸、亮氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、酪氨酸和色氨酸 55 ℃;pH8.0 [12,46] 中性蛋白酶 解淀粉芽孢杆菌(Bacillus amyloliquefaciens) 内肽酶 对疏水性氨基酸具有较高的特异性 50 ℃;pH8.0 [42−43] 胃蛋白酶 动物(如猪) 天冬氨酸内切蛋白酶 亮氨酸 37 ℃;pH3.0 [16,47] 胰蛋白酶 动物(如猪胰腺) 丝氨酸内肽酶 赖氨酸、精氨酸等碱性氨基酸 37 ℃;pH7.0 [22,44,47] 胰凝乳蛋白酶 动物(如牛) 丝氨酸内肽酶 切割由疏水性氨基酸形成的肽键 37 ℃;pH7.0 [16,47] 耐热蛋白酶 嗜热脂肪芽孢杆菌(Bacillus stearothermophilus) 内肽酶 含有疏水性氨基酸的肽键 65 ℃;pH6.86 [10] 蛋白酶Accelerzyme® CPG 转基因黑曲霉菌株ISO-528 丝氨酸型羧肽酶 对苯丙氨酸,异亮氨酸,亮氨酸,甲硫氨酸, 缬氨酸具有较高的特异性 37 ℃;pH4.0 [10] 肽酶R 米根霉(Rhizopus oryzae) 亮氨酸氨肽酶 精氨酸>丙氨酸,赖氨酸,苯丙氨酸,亮氨酸 52 ℃;pH6.0 [10] 蛋白酶AX(ProteAX) 米曲霉(Aspergillus oryzae) 亮氨酸氨肽酶;兼具内切和端解活性 谷氨酰胺、丝氨酸、苏氨酸、甲硫氨酸>精氨酸>丙氨酸、赖氨酸、苯丙氨酸、亮氨酸 60 ℃;pH6.0 [10] 风味蛋白酶 米曲霉(Aspergillus oryzae) 兼具内切和端解活性 位于C-端的疏水性氨基酸 50 ℃;pH7.0 [15,44] 木瓜蛋白酶 木瓜乳胶 半胱氨酸内肽酶 蛋白质或多肽上P1位置的精氨酸、P2位置的亮氨酸和P1位置的谷氨酰胺;P2位置上的疏水性氨基酸 55 ℃;pH6.5 [16,41,44] 菠萝蛋白酶 凤梨科(Bromeliaceae) 半胱氨酸蛋白酶 苄氧羰基-精氨酸-精氨酸;苯甲酰基-缬氨酸-精氨酸 55 ℃;pH6 [48−50] 无花果蛋白酶 无花果胶乳 巯基蛋白酶 对芳香族氨基酸残基具有偏好,但特异性不高 50 ℃;pH6 [51−52] 内肽酶(例如碱性蛋白酶)由于活性位点为多肽链内部且倾向于疏水性氨基酸残基,其水解产生的多肽末端为疏水性氨基酸的可能性较高,这就导致内肽酶酶解产物通常具有强烈的苦味[12]。而外肽酶例如氨肽酶PepX作用于肽链末端,能够水解位于多肽末端的疏水性氨基酸,进而降低多肽苦味[40]。此外,复合酶例如风味蛋白酶兼具内切和端解活性,在生产具有较低苦味的蛋白质水解产物上具有重要的应用价值[26]。
3.2 单酶酶解
由于蛋白酶具有底物特异性,在不同蛋白酶的酶解作用下同一种蛋白质的水解产物苦味具有明显差异。通常,具有外肽酶活性的蛋白酶水解产物的苦味通常要低于仅具有内肽酶活性的蛋白酶水解产物。内肽酶通常将蛋白质水解为末端含有疏水性氨基酸的苦味肽,而外肽酶能够切割位于苦味肽末端的疏水性氨基酸,从而降低苦味肽的苦味强度。例如,电子舌结果表明,大豆蛋白质Protease A 2SD和Protex 6L水解物的苦味强度值具有显著差异,即Protease A 2SD水解物的苦味值(<5)远远低于Protex 6L水解物的苦味强度(>10)[12]。Protease A 2SD和Protex 6L的活性位点不同导致了其水解物苦味强度的差异。首先,Protex 6L属于内肽酶中的丝氨酸蛋白酶,且倾向于水解位于疏水性氨基酸羧基端的肽键,这就导致产生的多肽C-端为疏水性氨基酸。而C-端为疏水性氨基酸是苦味肽的一种特征,这就使Protex 6L的大豆蛋白水解物含有大量苦味肽。区别于Protex 6L,Protease A 2SD兼具内切和-外肽酶的活性。这种差别导致因Protease A 2SD中内肽酶活性而产生的苦味肽会进一步被外肽酶降解,从而使其苦味强度低于Protex 6L大豆蛋白水解物[12]。与Protease A 2SD类似,蛋白酶A(Protease A)、蛋白酶P(Protease P)、ProteAX和风味蛋白酶也兼具内切和外肽酶活性。在关于牛肉酶解产物苦味强度的研究中,这4种蛋白酶酶解物的苦味强度低于内肽酶菠萝蛋白酶和木瓜蛋白酶的酶解物[18]。因此,使用含有内肽酶和外肽酶的复合蛋白酶在一定程度上能够减轻蛋白质水解产物的苦味。
另外,为了进一步研究风味蛋白酶中外肽酶的脱苦效果,Ewert等[40]在维持外肽酶活性高于80%的前提下,通过超滤和热处理将风味蛋白酶中的内肽酶活性降至1%以下,发现风味蛋白酶中的外肽酶能够有效降低酪蛋白内肽酶水解物的苦味强度。
3.3 多酶分步酶解
相比于单酶酶解,多酶分步酶解对蛋白质水解产物的脱苦效果更好,这是因为多酶分步酶解很好地结合了内肽酶与外肽酶的作用机理。内肽酶能够破坏蛋白质本来复杂的空间构象并将其水解成分子量更小的多肽片段,该阶段的水解产物可能由于位于多肽末端的疏水性氨基酸的存在而具有较高的苦味强度;而随后使用外肽酶酶解时,外肽酶更容易接触到多肽末端,从而提高外肽酶的利用效率,在提高蛋白质水解度的同时从多肽末端切割氨基酸残基,降低多肽中疏水性氨基酸的数量,从而达到降低蛋白质水解物苦味的效果[26]。例如,Tong等[12]通过Protex 6L、Protease A 2SD依次水解大豆蛋白后,其酶解物的苦味值低于单酶酶解物(Protex 6L或Protease A 2SD)的苦味值,并且随着第二步酶解的持续进行,最终酶解物的苦味值继续降低,直至酶解3 h后达到稳定值。
此外,外肽酶的种类在进一步改善内肽酶蛋白质水解产物苦味方面起着重要作用。当碱性蛋白酶作为第一步酶解牛奶蛋白质的蛋白酶时,第二步使用风味蛋白酶酶解会比使用Protease A 2SD(18.73%)、蛋白酶AXH(ProteAXH)(15.49%)和复合蛋白酶(13.09%)更能降低牛奶蛋白质酶解物的苦味,其水解度也最高(20.41%)[53]。由于风味蛋白酶含有多种外肽酶,因此在降低内肽酶酶解物的苦味方面具有显著效果[15,44]。例如,碱性蛋白酶-风味蛋白酶蛋白酶顺序酶解不仅显著改善了绿扁豆蛋白质水解产物的苦味,还提高了其鲜味[26]。除了参与第二步酶解的外肽酶对蛋白水解产物的苦味具有显著作用外,参与第一步反应的内肽酶种类在改变蛋白质水解物苦味上也有影响。当参与第二步酶解反应的蛋白酶为风味蛋白酶时,中性蛋白酶和复合蛋白酶作为第一步酶解反应的蛋白酶在降低小麦谷蛋白水解产物苦味上具有更显著的效果[11]。因此,为了达到更好的脱苦效果,需要探索最优的内肽酶-外肽酶组合。
另一方面,外肽酶的水解作用可以与美拉德反应联合起来进一步改善蛋白质水解物的风味。当蛋白质水解物在进行酶灭活(85~90 ℃下处理15 min)前加入适量的还原糖(如葡糖胺),葡糖胺会诱导多肽的特定氨基酸残基(例如赖氨酸和精氨酸残基)发生糖化,在形成美拉德反应肽的同时也减少了苦味肽和苦味氨基酸的含量,达到降低苦味及提升鲜味的效果[54]。
4. 蛋白酶在改善食品风味上的应用
在食品加工过程中,蛋白质可能会被降解为具有生物活性的多肽,但同时也会产生苦味肽影响口感,从而影响消费者对这些食品的接受度[55]。多种蛋白酶被用于改善食品尤其是富含多肽的功能食品的风味及口感(表3)[11,56]。此外,蛋白酶的利用还能够提高传统发酵工艺的效率,并保留其较好的感官品质[57]。
表 3 不同蛋白酶在改善食品风味上的应用Table 3. Application of various proteases in enhancing food flavor蛋白酶 产品 水解条件 风味及品质改善情况 参考文献 风味蛋白酶+
美拉德反应中华绒螯蟹加工
副产物风味蛋白酶酶解6 h;100 ℃下,2.5%葡萄糖浓度,蟹腿和蟹体分别进行70和60 min的美拉德反应。 酸、苦等不良气味减少;鲜味和咸味明显增强;鱼腥味降低;美拉德反应产生醛类、吡嗪类和含硫化合物等独特风味物质。 [63] 风味蛋白酶+
美拉德反应红豆沙 酶添加量:0.3%;
砂糖添加量:40%。红豆沙粘弹性降低,质地变软,香气增加;美拉德反应通过增加糖醛(0→15.69 μg/kg)、甲基吡嗪(0.29→0.68 μg/kg)、麦芽酚(7.27→
13.56 μg/kg)等挥发性有机化合物的含量提高了红豆沙的焦糖、烘焙风味(香气评分值:5→7;味道评分值:4→8)。[56] 风味蛋白酶+
葡萄糖非发酵可可豆 酶解:50 ℃,8 h;加入葡萄糖:50 ℃,5 h。 风味蛋白酶和葡萄糖共同处理非发酵的可可豆,能够通过增加总酸(13.33%→48.76%)、总吡咯(0.84%→4.49%)等挥发性化合物含量来改善非发酵可可粒的风味,使其具有与发酵可可豆相似的风味。 [59] 木糖葡萄球菌
蛋白酶哈尔滨风干肠 酶添加量:1.2 g/kg;发酵条件:25±2 ℃、30%~50%相对湿度条件下悬挂1 d,然后在25±
2 ℃、75%~80%相对湿度条件下成熟8 d。木糖葡萄球菌蛋白酶的酶解作用产生了酮、酸、酯等挥发性化合物,抑制了脂质氧化,促进了碳水化合物的分解代谢,加速了氨基酸的分解代谢,促进哈尔滨风干肠的特色风味,使哈尔滨风干肠的质构、气味、鲜味分值及接受度分别从3.13、4.13、4.56和5.26分别增加至4.43、5.08、5.38和5.41。 [60] 肉葡萄球菌蛋白酶 哈尔滨风干肠 酶添加量:0.45 g/kg;
发酵条件:在25±2 ℃和30%~50%相对湿度下放置
1 d,然后在25±2 ℃和相对湿度75%~80%放置8 d。肉葡萄球菌蛋白酶的酶解作用抑制了脂质氧化,具有苦杏仁气味的苯甲醛和苯乙醛含量升高(可能是促进了芳香氨基酸的代谢),加速了碳水化合物的分解代谢,具有独特成熟香气的乙酸(16.21→
41.35 μg/kg)和丁酸(10.24→20.31 μg/kg)含量升高,酯类化合物(如乙酸乙酯:3.73→7.31 μg/kg)含量升高,促进了哈尔滨风干肠的花香和水果香气,使嫩度、气味和鲜味值分别从4.13、4.83和4.56分别增加至 5.52、6.24和5.64。[61] 表皮葡萄球菌
蛋白酶发酵肉制品(猪肉肌原纤维蛋白) pH7.0,37 ℃,30 U/mL,
30~120 min。表皮葡萄球菌蛋白酶加速了猪肉肌原纤维蛋白向游离氨基酸的降解,一些氨基酸可以产生有助于肉蛋白风味的化合物,例如苯甲醛。 [62] 木瓜蛋白酶-风味蛋白酶混合酶 贻贝调味料 pH7.0,50 ℃,3 h。 鲜味等级较高。 [64] 风味蛋白酶-复合蛋白酶混合酶 鱼汤 pH6.5,55 ℃,E/S比为0.11%,
4 h。去除腥味,提升鲜味(鲜味当量值:455.74→3921.28 g/100 g)。 [65] 风味蛋白酶 奶酪调味料 乳酸菌发酵后:pH6.0,45 ℃,2、4、6、8、10和12 h。 降低牛奶蛋白水解产物的苦味(降低了90%)并提高其鲜味
(谷氨酸、天冬氨酸)。[67] 蛋白酶Flavorpro™ Umami 奶酪调味料 乳酸菌发酵后:pH6.0,45 ℃,2、4、6、8、10和12 h。 降低牛奶蛋白水解产物的苦味(降低了93%)并提高其鲜味
(谷氨酸、天冬氨酸)。[67] 4.1 植物基蛋白食品风味改善
风味蛋白酶、蛋白酶AX-K(ProteAX-K)等蛋白酶在降低植物蛋白产品的苦味以及提高其鲜味方面具有重要作用[11,17,58]。例如,风味蛋白酶的酶解作用能够改善红豆沙的风味和口感,在降低硬度的同时使其更加浓郁。而且,风味蛋白酶酶解产生的多肽和氨基酸能够促进红豆沙在煎炸过程中的美拉德反应,产生具有独特风味的挥发性物质[56]。未发酵可可豆在烘烤过程中不会形成风味前体物质,因此无法产生独特的巧克力风味。为解决这一问题,Tamimi等[59]利用风味蛋白酶对非发酵的可可豆进行酶解处理,同时添加葡萄糖,结果产生了巧克力风味,并改善了非发酵可可豆的感官品质。
多酶分步酶解在开发植物蛋白功能饮料中具有潜在的应用前景。例如,Lim等[11]发现利用碱性蛋白酶、复合蛋白酶、风味蛋白酶依次酶解4、1和1 h所获得的小麦谷蛋白水解产物饮料在分子量组成、抗氧化活性等方面具有较好的优势。但是当小麦谷蛋白水解物在最终产品中的比例高于3%时,肽的苦味会影响消费者的接受度。另外,在蛋白质酶解过程中,不同蛋白酶的酶解作用也会改变蛋白质的气味。花生蛋白水解后,其风味物质在酶解5~7 h内显著增加,例如具有甜味的胺类和芳香类化合物。此外,受碱性蛋白酶、中性蛋白酶和复合蛋白酶影响的风味物质还包括氮氧化物、低分子胺和有机酯、萜烯,有机酯、萜烯和脂肪烃的氧合衍生物,有机酯和萜烯、吡嗪、萜烯和酯等[17]。
4.2 肉制品和水产品风味改善
微生物来源的蛋白酶在实现肉类嫩化、抑制脂肪氧化以及促进风味物质产生方面具有显著效果。Sun等[60]发现在哈尔滨干肠中添加木糖葡萄球菌蛋白酶能够加速肉类蛋白质的水解、促进酮、酸、酯等关键挥发性化合物的产生,当酶添加量为1.2 g/kg时,感官评分最佳。此外,在哈尔滨干肠中添加肉糖葡萄球菌来源的蛋白酶(0.45 g/kg)能够促进蛋白质降解为多肽和游离氨基酸,从而实现嫩化和抑制脂肪氧化[61]。表皮葡萄球菌来源的蛋白酶在改善猪肉蛋白质质量方面具有关键作用。表皮葡萄球菌来源蛋白酶的水解作用能够显著提高肉制品中的游离氨基酸含量,尤其是谷氨酸和丙氨酸的含量,并促进醛、醇、酸等挥发性化合物的生成[62]。
风味蛋白酶、木瓜蛋白酶、中性蛋白酶和复合蛋白酶在降低水产品的腥味上也有重要应用。例如,风味蛋白酶处理过的中华绒螯蟹副产品具有较低的腥味,并且在美拉德反应作用下,产品具有独特的焦糖味[63]。除了减轻腥味,蛋白酶及其组合的酶解作用还能够提高水产品的鲜味。木瓜蛋白酶和风味蛋白酶组合酶的酶解能够使贻贝调味料呈现出饱满的鲜味[64]。Zhang等[65]采用固相微萃取法提取鱼汤中的风味物质,利用二维气相色谱-嗅觉检测-质谱联用(Two-dimensional comprehensive gas chromatography-olfactometry-mass spectrometry,GC×GC-O-MS)对其风味物质进行分析,发现蛋白酶水解明显减少了能够导致鱼腥味的化合物(包括1-辛烯-3-醇、己醛、庚醛、辛醛、E-2-辛烯醛、反,顺-2,6-壬二烯醛、2-戊基呋喃等),并促进了鲜味物质的释放(包括6-甲基-5-庚烯-2-酮、1-羟基-2-丙酮和2,5-二甲基吡嗪等)。其中,风味蛋白酶和复合蛋白酶协同改善风味的效果最好。
4.3 奶制品风味改善
奶酪在成熟过程中会发生糖酵解、脂解和蛋白质水解三大过程,其中蛋白质水解能够赋予其鲜味并产生大量风味前体氨基酸,但也产生了苦味[66−67]。为改善奶酪的感官品质、提高消费者接受度以及增强奶酪的特殊风味,可利用蛋白酶对奶酪进行酶解处理[66]。在奶酪制备过程中添加蛋白酶酶解工艺,可减少奶酪的苦味和涩味,并且增加风味物质乙酸的含量[66]。风味蛋白酶在降低奶酪调味料的苦味及提升其鲜味上具有显著效果,这与牛奶蛋白质水解物中较高含量的低分子质量多肽(MW<0.5 kDa)和释放的谷氨酸和天冬氨酸含量增加有关[67]。此外,蛋白酶的酶解作用还能够提高奶制品的生产效率。制备酸奶时添加中性蛋白酶能够缩短酸奶的发酵时间、减少发酵剂的使用量,且适当添加蛋白酶不会影响酸奶的感官品质[57]。
5. 结论与展望
蛋白质在水解过程中释放出的苦味肽导致蛋白质水解产物具有苦味,这限制了蛋白质水解产物在食品行业中的应用。蛋白质水解产物的苦味与疏水性氨基酸、水解度、蛋白酶种类以及苦味肽的构效关系密切相关。未来仍需要深入探究苦味肽的空间结构对其苦味强度的影响,并且提出科学且具有公信力的苦味肽苦味评价标准,以更精确地分析不同研究中苦味肽的苦味强度差异。虽然目前通过内肽酶和外肽酶的分步酶解技术能够在一定程度上减少苦味并保留生物活性,但仍需探索更有效的脱苦方法。未来可以尝试通过生物和物理脱苦技术联用(例如,酶解和微胶囊包埋技术联用)来实现对蛋白质水解物苦味的进一步脱除。同时,脱苦技术联用对苦味肽生物活性的影响机制也应成为研究的重点,以确保在降低苦味的同时,不损害其健康益处。
-
表 1 蛋白酶酶解的脱苦作用
Table 1 Debittering effect of protease enzymatic hydrolysis
酶解种类 蛋白质 蛋白酶 水解条件 水解度(%) 苦味值 苦味值变化机理 参考文献 单酶酶解 大豆蛋白质 Protex 6L pH8.0,55 ℃,2 h 13.37 5.1 Protex 6L倾向于在疏水性氨基酸残基位置水解。因此,所得到的多肽在末端具有疏水性氨基酸残基,导致相对较高的苦味。 [12] 单酶酶解 大豆蛋白质 Protease A 2SD pH7.0,50 ℃,2 h 8.96 0.5 由于蛋白酶A 2SD具有较高的外肽酶和内肽酶活性,因此,所得到的大豆蛋白水解产物具有较低的苦味值。 [12] 多酶分步
酶解大豆蛋白质 Protex 6L;
Protease A 2SDProtex 6L水解2 h (pH8.0,55 ℃),Protease A 2SD水解
3 h(pH7.0,50 ℃)23.32 5.1→0.9 在Protex 6L酶解产生的大豆蛋白水解产物中,Protease A 2SD可能倾向于从苦肽的N-端切割亮氨酸和精氨酸残基而降解苦味肽,使肽中的疏水性氨基酸(丙氨酸、亮氨酸、异亮氨酸、色氨酸、苯丙氨酸和酪氨酸)数量减少,显著降低大豆Protex 6L酶酶解产物的苦味强度。 [12] 单酶酶解 绿扁豆
蛋白质碱性蛋白酶 pH8,60 ℃,3 h 20.12 2 碱性蛋白酶作为内肽酶,切割多肽内部。 [26] 单酶酶解 绿扁豆
蛋白质风味蛋白酶 pH7,50 ℃,3 h 8.51 0(低于检测线) 风味蛋白酶里主要为外肽酶,外肽酶从多肽的末端切割氨基酸残基。 [26] 多酶分步
水解绿扁豆
蛋白质碱性蛋白酶-
风味蛋白酶碱性蛋白酶(pH 8,
60 ℃,2 h)-风味蛋白酶(pH7,50 ℃,1 h)47.05 2→0(低于检测线) 第一步碱性蛋白酶的水解作用增加了多肽N-端位点的数量,促进了风味蛋白酶对多肽的水解,使水解度显著增加。 [26] 单酶酶解 酪朊酸钠 内肽酶Sternzym BP 25201 pH6.75,65 ℃,2.2 h 2.30 9.1 Sternzym BP 25201的对疏水性氨基酸(如亮氨酸、缬氨酸、苯丙氨酸和异亮氨酸)具有底物特异性,使得生成的多肽末端大多含有疏水性氨基酸,表现出较高的苦味。 [40] 多酶分步
酶解酪朊酸钠 Sternzym BP 25201-氨肽酶PepN Sternzym BP 25201:pH6.75,65 ℃,2.2 h;氨肽酶PepN:pH6.75,50 ℃,24 h 3.60 9.1→4.7 PepN显著降低了酪朊酸钠第一步酶解产物的苦味;由于Sternzym BP 25201的底物特异性,使其酶解产物中的大多数肽的N-端为亮氨酸、缬氨酸、苯丙氨酸或异亮氨酸,PepN能够切割这些N端的氨基酸,从而显著改善苦味。 [40] 多酶分步
酶解酪朊酸钠 Sternzym BP 25201-氨肽酶PepX Sternzym BP 25201:pH6.75,65 ℃,2.2 h;氨肽酶PepX:pH6.75,50 ℃,24 h 3.40 9.1→8.8 没有显著改变酪朊酸钠内肽酶酶解
产物的苦味。[40] 多酶分步
酶解酪朊酸钠 Sternzym BP 25201-氨肽酶PepA Sternzym BP 25201:pH6.75,65 ℃,2.2 h;氨肽酶PepA:pH6.75,50 ℃,24 h 3.60 9.1→7.8 没有显著改变酪朊酸钠内肽酶酶解产物的苦味,可能是因为该酶对亲水性氨基酸天冬氨酸、谷氨酸和丝氨酸具有特异性。 [40] 多酶分步
酶解酪朊酸钠 Sternzym BP 25201-从风味蛋白酶中分离出的外肽酶(Exo-flavourzyme) Sternzym BP 25201:pH6.75,65 ℃,2.2 h;风味蛋白酶中分离出的外肽酶:pH6.75,
50 ℃,24 h4.50 9.1→3 从风味蛋白酶中分离出的外肽酶显著降低了酪朊酸钠第一步酶解产物的苦味;由于Sternzym BP 25201的底物特异性,使其酶解产物中的大多数肽的N-端为亮氨酸、缬氨酸、苯丙氨酸或异亮氨酸,而从风味蛋白酶中分离出的外肽酶能够切割位于苦味肽末端的氨基酸,从而显著
改善了苦味。[40] 表 2 部分蛋白酶的来源、活性类别、活性作用位点及水解条件
Table 2 Source, active types, active sites and hydrolysis conditions of some proteases
蛋白酶 酶来源 酶活性类别 活性作用位点 水解条件 参考文献 碱性蛋白酶(Alcalase) 地衣芽孢杆菌(Bacillus licheniformis) 丝氨酸内肽酶 酪氨酸、色氨酸、苯丙氨酸等芳香氨基酸残基以及羧基端的疏水性氨基酸残基 50 ℃;pH7.5 [22,42,45] 蛋白酶Protease A 2SD 真菌 兼具内切和端解活性 N-端的亮氨酸和精氨酸 50 ℃;pH7.0 [12] Protex 6L 地衣芽孢杆菌(Bacillus licheniformis) 内肽酶 倾向于在疏水性氨基酸残基位置水解,产生多肽C-端为具有大侧链且无电荷的氨基酸(芳香族和脂肪族氨基酸)的肽,如异亮氨酸、亮氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、酪氨酸和色氨酸 55 ℃;pH8.0 [12,46] 中性蛋白酶 解淀粉芽孢杆菌(Bacillus amyloliquefaciens) 内肽酶 对疏水性氨基酸具有较高的特异性 50 ℃;pH8.0 [42−43] 胃蛋白酶 动物(如猪) 天冬氨酸内切蛋白酶 亮氨酸 37 ℃;pH3.0 [16,47] 胰蛋白酶 动物(如猪胰腺) 丝氨酸内肽酶 赖氨酸、精氨酸等碱性氨基酸 37 ℃;pH7.0 [22,44,47] 胰凝乳蛋白酶 动物(如牛) 丝氨酸内肽酶 切割由疏水性氨基酸形成的肽键 37 ℃;pH7.0 [16,47] 耐热蛋白酶 嗜热脂肪芽孢杆菌(Bacillus stearothermophilus) 内肽酶 含有疏水性氨基酸的肽键 65 ℃;pH6.86 [10] 蛋白酶Accelerzyme® CPG 转基因黑曲霉菌株ISO-528 丝氨酸型羧肽酶 对苯丙氨酸,异亮氨酸,亮氨酸,甲硫氨酸, 缬氨酸具有较高的特异性 37 ℃;pH4.0 [10] 肽酶R 米根霉(Rhizopus oryzae) 亮氨酸氨肽酶 精氨酸>丙氨酸,赖氨酸,苯丙氨酸,亮氨酸 52 ℃;pH6.0 [10] 蛋白酶AX(ProteAX) 米曲霉(Aspergillus oryzae) 亮氨酸氨肽酶;兼具内切和端解活性 谷氨酰胺、丝氨酸、苏氨酸、甲硫氨酸>精氨酸>丙氨酸、赖氨酸、苯丙氨酸、亮氨酸 60 ℃;pH6.0 [10] 风味蛋白酶 米曲霉(Aspergillus oryzae) 兼具内切和端解活性 位于C-端的疏水性氨基酸 50 ℃;pH7.0 [15,44] 木瓜蛋白酶 木瓜乳胶 半胱氨酸内肽酶 蛋白质或多肽上P1位置的精氨酸、P2位置的亮氨酸和P1位置的谷氨酰胺;P2位置上的疏水性氨基酸 55 ℃;pH6.5 [16,41,44] 菠萝蛋白酶 凤梨科(Bromeliaceae) 半胱氨酸蛋白酶 苄氧羰基-精氨酸-精氨酸;苯甲酰基-缬氨酸-精氨酸 55 ℃;pH6 [48−50] 无花果蛋白酶 无花果胶乳 巯基蛋白酶 对芳香族氨基酸残基具有偏好,但特异性不高 50 ℃;pH6 [51−52] 表 3 不同蛋白酶在改善食品风味上的应用
Table 3 Application of various proteases in enhancing food flavor
蛋白酶 产品 水解条件 风味及品质改善情况 参考文献 风味蛋白酶+
美拉德反应中华绒螯蟹加工
副产物风味蛋白酶酶解6 h;100 ℃下,2.5%葡萄糖浓度,蟹腿和蟹体分别进行70和60 min的美拉德反应。 酸、苦等不良气味减少;鲜味和咸味明显增强;鱼腥味降低;美拉德反应产生醛类、吡嗪类和含硫化合物等独特风味物质。 [63] 风味蛋白酶+
美拉德反应红豆沙 酶添加量:0.3%;
砂糖添加量:40%。红豆沙粘弹性降低,质地变软,香气增加;美拉德反应通过增加糖醛(0→15.69 μg/kg)、甲基吡嗪(0.29→0.68 μg/kg)、麦芽酚(7.27→
13.56 μg/kg)等挥发性有机化合物的含量提高了红豆沙的焦糖、烘焙风味(香气评分值:5→7;味道评分值:4→8)。[56] 风味蛋白酶+
葡萄糖非发酵可可豆 酶解:50 ℃,8 h;加入葡萄糖:50 ℃,5 h。 风味蛋白酶和葡萄糖共同处理非发酵的可可豆,能够通过增加总酸(13.33%→48.76%)、总吡咯(0.84%→4.49%)等挥发性化合物含量来改善非发酵可可粒的风味,使其具有与发酵可可豆相似的风味。 [59] 木糖葡萄球菌
蛋白酶哈尔滨风干肠 酶添加量:1.2 g/kg;发酵条件:25±2 ℃、30%~50%相对湿度条件下悬挂1 d,然后在25±
2 ℃、75%~80%相对湿度条件下成熟8 d。木糖葡萄球菌蛋白酶的酶解作用产生了酮、酸、酯等挥发性化合物,抑制了脂质氧化,促进了碳水化合物的分解代谢,加速了氨基酸的分解代谢,促进哈尔滨风干肠的特色风味,使哈尔滨风干肠的质构、气味、鲜味分值及接受度分别从3.13、4.13、4.56和5.26分别增加至4.43、5.08、5.38和5.41。 [60] 肉葡萄球菌蛋白酶 哈尔滨风干肠 酶添加量:0.45 g/kg;
发酵条件:在25±2 ℃和30%~50%相对湿度下放置
1 d,然后在25±2 ℃和相对湿度75%~80%放置8 d。肉葡萄球菌蛋白酶的酶解作用抑制了脂质氧化,具有苦杏仁气味的苯甲醛和苯乙醛含量升高(可能是促进了芳香氨基酸的代谢),加速了碳水化合物的分解代谢,具有独特成熟香气的乙酸(16.21→
41.35 μg/kg)和丁酸(10.24→20.31 μg/kg)含量升高,酯类化合物(如乙酸乙酯:3.73→7.31 μg/kg)含量升高,促进了哈尔滨风干肠的花香和水果香气,使嫩度、气味和鲜味值分别从4.13、4.83和4.56分别增加至 5.52、6.24和5.64。[61] 表皮葡萄球菌
蛋白酶发酵肉制品(猪肉肌原纤维蛋白) pH7.0,37 ℃,30 U/mL,
30~120 min。表皮葡萄球菌蛋白酶加速了猪肉肌原纤维蛋白向游离氨基酸的降解,一些氨基酸可以产生有助于肉蛋白风味的化合物,例如苯甲醛。 [62] 木瓜蛋白酶-风味蛋白酶混合酶 贻贝调味料 pH7.0,50 ℃,3 h。 鲜味等级较高。 [64] 风味蛋白酶-复合蛋白酶混合酶 鱼汤 pH6.5,55 ℃,E/S比为0.11%,
4 h。去除腥味,提升鲜味(鲜味当量值:455.74→3921.28 g/100 g)。 [65] 风味蛋白酶 奶酪调味料 乳酸菌发酵后:pH6.0,45 ℃,2、4、6、8、10和12 h。 降低牛奶蛋白水解产物的苦味(降低了90%)并提高其鲜味
(谷氨酸、天冬氨酸)。[67] 蛋白酶Flavorpro™ Umami 奶酪调味料 乳酸菌发酵后:pH6.0,45 ℃,2、4、6、8、10和12 h。 降低牛奶蛋白水解产物的苦味(降低了93%)并提高其鲜味
(谷氨酸、天冬氨酸)。[67] -
[1] LI M Z, ZOU L, ZHANG L Z, et al. Plant-based proteins:advances in their sources, digestive profiles in vitro and potential health benefits[J]. Critical Reviews in Food Science and Nutrition, 2024:1−21.
[2] RAO Q, KLAASSEN KAMDAR A, LABUZA T P. Storage stability of food protein hydrolysates—A review[J]. Critical Reviews in Food Science and Nutrition,2013,56(7):1169−1192.
[3] RASHWAN A K, OSMAN A I, ABDELSHAFY A M, et al. Plant-based proteins:advanced extraction technologies, interactions, physicochemical and functional properties, food and related applications, and health benefits[J]. Critical Reviews in Food Science and Nutrition, 2023:1−28.
[4] DARY GUERRA-FAJARDO L, PAVON-PEREZ J, VALLEJOS-ALMIRALL A, et al. Advances in analytical techniques coupled to in vitro bioassays in the search for new peptides with functional activity in effect-directed analysis[J]. Food Chemistry,2022,397:133784. doi: 10.1016/j.foodchem.2022.133784
[5] MIRZAPOUR-KOUHDASHT A, MCCLEMENTS D J, TAGHIZADEH M S, et al. Strategies for oral delivery of bioactive peptides with focus on debittering and masking[J]. NPJ Science of Food,2023,7(1):22. doi: 10.1038/s41538-023-00198-y
[6] CHEISON S C, WANG Z, XU S Y. Use of macroporous adsorption resin for simultaneous desalting and debittering of whey protein hydrolysates[J]. International Journal of Food Science and Technology,2007,42(10):1228−1239. doi: 10.1111/j.1365-2621.2006.01461.x
[7] QIN N, CHEN C, ZHANG N, et al. Bitter almond albumin ACE-inhibitory peptides:Purification, screening, and characterization in silico, action mechanisms, antihypertensive effect in vivo, and stability[J]. Molecules, 2023, 28(16).
[8] WANG F F, ZHOU B. Quantitative structure-activity relationship models for bitter-tasting tripeptides based on integrated descriptors[J]. Structural Chemistry,2019,31(2):573−583.
[9] LIU B Y, LI N N, CHEN F S, et al. Review on the release mechanism and debittering technology of bitter peptides from protein hydrolysates[J]. Comprehensive Reviews in Food Science and Food Safety,2022,21(6):5153−5170. doi: 10.1111/1541-4337.13050
[10] CHEUNG L K Y, ALUKO R E, CLIFF M A, et al. Effects of exopeptidase treatment on antihypertensive activity and taste attributes of enzymatic whey protein hydrolysates[J]. Journal of Functional Foods,2015,13:262−275. doi: 10.1016/j.jff.2014.12.036
[11] LIM T, HE Y, PARK B, et al. Wheat gluten hydrolysates prepared by sequential treatment with different combinations of commercial proteases[J]. Journal of Food Measurement and Characterization,2022,16(5):4064−4074. doi: 10.1007/s11694-022-01506-y
[12] TONG X H, LIAN Z T, MIAO L M, et al. An innovative two-step enzyme-assisted aqueous extraction for the production of reduced bitterness soybean protein hydrolysates with high nutritional value[J]. LWT-Food Science and Technology, 2020, 134.
[13] WANG Y W, ZHAO P Y, ZHOU Y, et al. From bitter to delicious:properties and uses of microbial aminopeptidases[J]. World Journal of Microbiology & Biotechnology,2023,39(3):72.
[14] 丁沈利. 羧肽酶M32基因的表达优化及应用研究[D]. 无锡:江南大学, 2022. [DING S L. Optimization and application of carboxypeptidase M32 gene expression[D]. Wuxi:Jiangnan University, 2022.] DING S L. Optimization and application of carboxypeptidase M32 gene expression[D]. Wuxi: Jiangnan University, 2022.
[15] MERZ M, EISELE T, BERENDS P, et al. Flavourzyme, an enzyme preparation with industrial relevance:Automated nine-step purification and partial characterization of eight enzymes[J]. Journal of Agricultural and Food Chemistry,2015,63(23):5682−5693. doi: 10.1021/acs.jafc.5b01665
[16] REAL HERNANDEZ L M, GONZALEZ DE MEJIA E. Enzymatic production, bioactivity, and bitterness of chickpea (Cicer arietinum) peptides[J]. Comprehensive Reviews in Food Science and Food Safety,2019,18(6):1913−1946. doi: 10.1111/1541-4337.12504
[17] ZHANG L, SONG C H, CHANG J, et al. Optimization of protein hydrolysates production from defatted peanut meal based on physicochemical characteristics and sensory analysis[J]. LWT-Food Science and Technology, 2022, 163.
[18] FU Y, LIU J, HANSEN E T, et al. Structural characteristics of low bitter and high umami protein hydrolysates prepared from bovine muscle and porcine plasma[J]. Food Chemistry,2018,257:163−171. doi: 10.1016/j.foodchem.2018.02.159
[19] MURRAY T K, BAKER B E. Studies on protein hydrolysis. I. —preliminary observations on the taste of enzymic protein-hydrolysates[J]. Journal of the Science of Food and Agriculture,1952,3(10):470−475. doi: 10.1002/jsfa.2740031006
[20] MAEHASHI K, HUANG L. Bitter peptides and bitter taste receptors[J]. Cellular and Molecular Life Sciences,2009,66(10):1661−1671. doi: 10.1007/s00018-009-8755-9
[21] 高艺. 苦味肽苦味掩蔽型乳液体系构建及微胶囊产品开发[D]. 南昌:南昌大学, 2022. [GAO Y. Construction of bitter peptide bitter masking lotion system and development of microcapsule products[D]. Nanchang:Nanchang University, 2022.] GAO Y. Construction of bitter peptide bitter masking lotion system and development of microcapsule products[D]. Nanchang: Nanchang University, 2022.
[22] SUN X R, ZHENG J Y, LIU B Y, et al. Characteristics of the enzyme-induced release of bitter peptides from wheat gluten hydrolysates[J]. Frontiers in Nutrition,2022,9:1022257. doi: 10.3389/fnut.2022.1022257
[23] GAN R Q, HE Y F, LI Y C. Structural characteristics of taste active peptides in protein hydrolysates from tilapia by-products[J]. Journal of Food Measurement and Characterization,2022,16(2):1674−1687. doi: 10.1007/s11694-022-01302-8
[24] HAYAKAWA S, NAKAI S. Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins[J]. Journal of Food Science,1985,50(2):486−491. doi: 10.1111/j.1365-2621.1985.tb13433.x
[25] SEO W H, LEE H G, BAEK H H. Evaluation of bitterness in enzymatic hydrolysates of soy protein isolate by taste dilution analysis[J]. Journal of Food Science, 2008, 73(1): S41-S46.
[26] REZVANKHAH A, YARMAND M S, GHANBARZADEH B, et al. Characterization of bioactive peptides produced from green lentil (Lens culinaris) seed protein concentrate using alcalase and flavourzyme in single and sequential hydrolysis[J]. Journal of Food Processing and Preservation, 2021, 45(11).
[27] YARNPAKDEE S, BENJAKUL S, KRISTINSSON H G, et al. Antioxidant and sensory properties of protein hydrolysate derived from Nile tilapia (Oreochromis niloticus) by one- and two-step hydrolysis[J]. Journal of Food Science and Technology, 2014, 52(6): 3336-3349.
[28] ISHIBASHI N, KOUGE K, SHINODA I, et al. A mechanism for bitter taste sensibility in peptides[J]. Agricultural and Biological Chemistry,1988,52(3):819−827.
[29] SECHER A, KELSTRUP C D, CONDE-FRIEBOES K W, et al. Analytic framework for peptidomics applied to large-scale neuropeptide identification[J]. Nature Communications 2016, 7:11436.
[30] NEY K H. Prediction of bitterness of peptides from their amino acid composition[J]. Zeitschrift Fur Lebensmittel-Untersuchung Und-Forschung,1971,147(2):64−68. doi: 10.1007/BF01879606
[31] MATOBA T, HATA T. Relationship between bitterness of peptides and their chemical structures[J]. Agricultural and Biological Chemistry,1972,36(8):1423−1431. doi: 10.1080/00021369.1972.10860410
[32] ONGKOWIJOYO P, TELLO E, PETERSON D G. Identification of a bitter peptide contributing to the off-flavor attributes of pea protein isolates[J]. Journal of Agricultural and Food Chemistry,2023,71(19):7477−7484. doi: 10.1021/acs.jafc.3c00435
[33] NATH A, EREN B A, ZINIA ZAUKUU J L, et al. Detecting the bitterness of milk-protein-derived peptides using an electronic tongue[J]. Chemosensors, 2022, 10(6): 215.
[34] TAN J Z, XU J. Applications of electronic nose (e-nose) and electronic tongue (e-tongue) in food quality-related properties determination:A review[J]. Artificial Intelligence in Agriculture,2020,4:104−115. doi: 10.1016/j.aiia.2020.06.003
[35] FU Y, CHEN J, BAK K H, et al. Valorisation of protein hydrolysates from animal by-products:Perspectives on bitter taste and debittering methods:A review[J]. International Journal of Food Science & Technology,2018,54(4):978−986.
[36] DAI W F, XIANG A Y, PAN D D, et al. Insights into the identification of bitter peptides from Jinhua ham and its taste mechanism by molecular docking and transcriptomics analysis[J]. Food Research International,2024,189:114534. doi: 10.1016/j.foodres.2024.114534
[37] CHAROENKWAN P, NANTASENAMAT C, HASAN M M, et al. BERT4Bitter:A bidirectional encoder representations from transformers (BERT)-based model for improving the prediction of bitter peptides[J]. Bioinformatics,2021,37(17):2556−2562. doi: 10.1093/bioinformatics/btab133
[38] ZHANG Y F, WANG Y H, GU Z F, et al. Bitter-RF:A random forest machine model for recognizing bitter peptides[J]. Frontiers in Medicine, 2023, 10:1052923.
[39] YU Y, LIU S C, ZHANG X C, et al. Identification and prediction of milk-derived bitter taste peptides based on peptidomics technology and machine learning method[J]. Food Chemistry, 2024, 433:137288.
[40] EWERT J, SCHLIERENKAMP F, NESENSOHN L, et al. Improving the colloidal and sensory properties of a caseinate hydrolysate using particular exopeptidases[J]. Food Function,2018,9(11):5989−5998. doi: 10.1039/C8FO01749B
[41] FERNÁNDEZ-LUCAS J, CASTAÑEDA D, HORMIGO D. New trends for a classical enzyme:Papain, a biotechnological success story in the food industry[J]. Trends in Food Science & Technology,2017,68:91−101.
[42] CEYLAN F D, ADRAR N, GÜNAL-KÖROĞLU D, et al. Combined neutrase-alcalase protein hydrolysates from hazelnut meal, a potential functional food ingredient[J]. ACS Omega,2022,8(1):1618−1631.
[43] HYUN J, YANG H W, JE J G, et al. The potent antioxidant effect of neutrase-assisted hydrolysate from heat-resistant Pyropia yezoensis by molecular weight change[J]. Algal Research, 2023, 69.
[44] LIU B Y, ZHU K X, PENG W, et al. Effect of sequential hydrolysis with endo- and exo-peptidase on bitterness properties of wheat gluten hydrolysates[J]. RSC Advances,2016,6(33):27659−27668. doi: 10.1039/C5RA28171G
[45] FU Y, BAK K H, LIU J, et al. Protein hydrolysates of porcine hemoglobin and blood:Peptide characteristics in relation to taste attributes and formation of volatile compounds[J]. Food Research International,2019,121:28−38. doi: 10.1016/j.foodres.2019.03.017
[46] PRIET A, GUADIX E M, GUADIX A. Influence of temperature on protein hydrolysis in a cyclic batch enzyme membrane reactor[J]. Biochemical Engineering Journal,2008,42(3):217−223. doi: 10.1016/j.bej.2008.06.018
[47] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food - an international consensus[J]. Food Function,2014,5(6):1113−1124. doi: 10.1039/C3FO60702J
[48] DE LENCASTRE NOVAES L C, JOZALA A F, LOPES A M, et al. Stability, purification, and applications of bromelain:A review[J]. Biotechnology Progress,2016,32(1):5−13. doi: 10.1002/btpr.2190
[49] LESTARI P, SUYATA, IOP. Antibacterial activity of hydrolysate protein from Etawa goat milk hydrolysed by crude extract bromelain[C]. 13th Annual Joint Conference on Chemistry. Semarang, Indonesia:2019.
[50] TACIAS-PASCACIO V G, CASTAÑEDA-VALBUENA D, TAVANO O, et al. Peptides with biological and technofunctional properties produced by bromelain hydrolysis of proteins from different sources:A review[J]. International Journal of Biological Macromolecules, 2023, 253.
[51] HU R J, CHEN G J, LI Y H. Production and characterization of antioxidative hydrolysates and peptides from corn gluten meal using papain, ficin, and bromelain[J]. Molecules, 2020, 25(18): 4091.
[52] MORELLON-STERLING R, EL-SIAR H, TAVANO O L, et al. Ficin:A protease extract with relevance in biotechnology and biocatalysis[J]. International Journal of Biological Macromolecules,2020,162:394−404. doi: 10.1016/j.ijbiomac.2020.06.144
[53] CUI Q, SUN Y X, CHENG J J, et al. Effect of two-step enzymatic hydrolysis on the antioxidant properties and proteomics of hydrolysates of milk protein concentrate[J]. Food Chemistry,2022,366:130711. doi: 10.1016/j.foodchem.2021.130711
[54] FU Y, LIU J, ZHANG W, et al. Exopeptidase treatment combined with Maillard reaction modification of protein hydrolysates derived from porcine muscle and plasma:Structure-taste relationship[J]. Food Chemistry,2020,306:125613. doi: 10.1016/j.foodchem.2019.125613
[55] 司阔林, 李志国, 李玲玉, 等. 干酪苦味肽的形成及脱苦方法研究进展[J]. 食品工业,2021,42(3):267−271. [SI kuolin, LI Zhiguo, LI Lingyu, et al. Research progress on the formation and de bittering methods of cheese bitter peptides[J]. Food Industry,2021,42(3):267−271.] SI kuolin, LI Zhiguo, LI Lingyu, et al. Research progress on the formation and de bittering methods of cheese bitter peptides[J]. Food Industry, 2021, 42(3): 267−271.
[56] QU J L, ZHANG M W, HONG T T, et al. Improvement of adzuki bean paste quality by flavourzyme-mediated enzymatic hydrolysis[J]. Food Bioscience, 2023, 51.
[57] 曲杜娟, 赵强忠, 赵谋明. 乳清蛋白中性蛋白酶酶解物对酸奶发酵的促进作用及其对酸奶品质的影响研究[J]. 食品科技,2009,34(10):59−63. [QU Dujuan, ZHAO Qiangzhong, ZHAO Mouming. Study on the promoting effect of whey protein neutral protease hydrolysate on yogurt fermentation and its impact on yogurt quality[J]. Food Science and Technology,2009,34(10):59−63.] QU Dujuan, ZHAO Qiangzhong, ZHAO Mouming. Study on the promoting effect of whey protein neutral protease hydrolysate on yogurt fermentation and its impact on yogurt quality[J]. Food Science and Technology, 2009, 34(10): 59−63.
[58] GROSSMANN K K, MERZ M, APPEL D, et al. Impact of peptidase activities on plant protein hydrolysates regarding bitter and umami taste[J]. Journal of Agricultural and Food Chemistry,2021,69(1):368−376. doi: 10.1021/acs.jafc.0c05447
[59] TAMIMI K A, HIDAYAT C, UTAMI T, et al. Flavor precursor formation of non-fermented foraster ocoa beans after flavourzyme® and glucose treatment[J]. LWT-Food Science and Technology, 2023, 184.
[60] SUN F D, WANG H, LIU Q, et al. Proteolysis and quality characteristics of Harbin dry sausages caused by the addition of Staphylococcus xylosus protease[J]. Food Chemistry, 2023, 404(Pt B):134692.
[61] WANG H, XU J H, LIU Q, et al. Effect of the protease from Staphylococcus carnosus on the proteolysis, quality characteristics, and flavor development of Harbin dry sausage[J]. Meat Science,2022,189:108827. doi: 10.1016/j.meatsci.2022.108827
[62] WANG H, XU J H, LIU Q, et al. Interaction between protease from Staphylococcus epidermidis and pork myofibrillar protein:Flavor and molecular simulation[J]. Food Chemistry,2022,386:132830. doi: 10.1016/j.foodchem.2022.132830
[63] SUN Y, ZHOU Y, REN Y M, et al. Preparation and characterization of flavored sauces from chinese mitten crab processing by-products[J]. Foods, 2022, 12(1):51.
[64] 王蓓, 马言军, 许磊. 基于营养成分分析的贻贝调味料制备工艺研究[J]. 中国调味品,2023,48(1):152−154,163. [WANG Bei, MA Yanjun, XU Lei. Research on the preparation process of mussel seasoning based on nutritional analysis[J]. Chinese Seasoning,2023,48(1):152−154,163.] doi: 10.3969/j.issn.1000-9973.2023.01.027 WANG Bei, MA Yanjun, XU Lei. Research on the preparation process of mussel seasoning based on nutritional analysis[J]. Chinese Seasoning, 2023, 48(1): 152−154,163. doi: 10.3969/j.issn.1000-9973.2023.01.027
[65] ZHANG Y Y, ZHANG Y, SONG H L, et al. The fishy off-odor removal and umami enhancing effect of enzymatic hydrolysis of fish by-products by proteases[J]. Journal of Aquatic Food Product Technology,2023,32(2):218−234. doi: 10.1080/10498850.2023.2185846
[66] LI L, PEI Y L, CHENG K W, et al. Production and evaluation of enzyme-modified cheese adding protease or lipase to improve quality properties[J]. Journal of Bioscience and Bioengineering,2023,135(5):389−394. doi: 10.1016/j.jbiosc.2023.02.006
[67] XIANG Q, XIA Y X, FANG S C, et al. Enzymatic debittering of cheese flavoring and bitterness characterization of peptide mixture using sensory and peptidomics approach[J]. Food Chemistry, 2024, 440:138229.





 下载:
下载:
 下载:
下载:



