Preparation and Controlled Release Properties of Probiotic Hydrogel Carrier Based on Citrus Cellulose
-
摘要: 为提高益生菌在胃肠液中的存活率及释放率,本研究以柑橘纤维和羧甲基纤维素钠为包埋材料,柠檬酸为交联剂制备水凝胶。通过吸附包埋植物乳植杆菌B5,测定包埋后水凝胶的包埋率、控释性能、胆盐耐受性及储藏稳定性。结果表明,不同配比的水凝胶均具备良好的包埋效果,包埋率均高于79%;当柑橘纤维素和羧甲基纤维素钠的配比为1:4时,水凝胶的控释性能最佳,在模拟肠液中的释放率达到89.25%;载菌水凝胶能明显提高植物乳植杆菌B5在胆盐溶液中的存活率,最高达到87.09%;在4 ℃下保藏30 d后,水凝胶包埋的植物乳植杆菌B5的存活率均高于60%,当柑橘纤维素和羧甲基纤维素钠的配比为1:4时,水凝胶包埋的植物乳植杆菌B5存活率为70.66%,活菌数仍大于7 lg CFU/mL。研究表明柑橘纤维-羧甲基纤维素钠水凝胶能有效减少益生菌与外界环境中不利因素的接触,从而显著提高其在各种环境下的存活率。Abstract: To enhance the survival rate and release rate of probiotics in gastrointestinal fluids, hydrogels were prepared using citrus cellulose and sodium carboxymethylcellulose as embedding materials, with citric acid as the cross-linking agent. Lactiplantibacillus plantarum B5 was adsorbed and embedded in the hydrogels to evaluate the embedding rate, controlled release performance, bile salt tolerance, and storage stability. Results demonstrated that hydrogels with varying ratios exhibited favorable embedding effects, with an embedding rate exceeding 79%. The hydrogel with a citrus cellulose to sodium carboxymethylcellulose ratio of 1:4 showed optimal controlled release performance, achieving a release rate of 89.25% in simulated intestinal fluid. The bacteriophage-carrying hydrogel significantly enhanced the survival rate of L. plantarum B5 in bile salt solution, reaching 87.09%. The hydrogel maintained a storage stability of 30 days at 4 ℃, with the survival rate of embedded L. plantarum B5 exceeding 60% after 30 days, particularly reaching 70.66% with the 1:4 ratio of citrus cellulose to sodium carboxymethylcellulose, and maintaining viable bacteria levels above 7 lg CFU/mL. Studies have shown that citrus cellulose-sodium carboxymethylcellulose hydrogels are effective in reducing the exposure of probiotics to unfavorable factors in the external environment, thus significantly improving their survival in various environments.
-
益生菌是一种活的微生物,当摄入足够的量时,可以对宿主的健康产生积极的影响[1]。植物乳植杆菌是一种存在于人体肠道内的重要益生菌。研究表明,植物乳植杆菌可以治疗和预防多种疾病,如炎症性肠病[2]、血脂异常[3]、肥胖[4]、糖尿病[5]等。尽管益生菌具有潜在的健康益处,但由于加工、运输和储存等因素以及人体胃肠道的恶劣环境(其中含有胃酸、蛋白酶和胆汁盐)影响,益生菌很容易失活。通常认为,摄入的益生菌活菌数最低应为6 lg CFU/g[6]。对益生菌进行包埋是保护益生菌顺利到达肠道的最佳方式,既能保证益生菌在面对各种环境影响时的稳定性,又不会改变原菌株的特性。常见的益生菌递送载体包括微球(微胶囊)[7]、水凝胶[8]、片剂[9]等。
羧甲基纤维素钠因其廉价、安全、可生物降解等优点,被广泛用于制备水凝胶[10−11]。而柑橘纤维素作为益生元还具有其他优点,如改善肠道环境、抗氧化能力和增强免疫力等。Pérez-Burillo等[12−13]将柑橘纤维加入香肠中,探究不同配方香肠在人体肠道微生物群发酵后的抗氧化能力、短链脂肪酸产量及对炎症标志物的影响。结果表明在香肠中加入柑橘纤维能显著提高香肠的抗氧化能力,增加短链脂肪酸的产量及显著减少炎症标志物CRP和TNFα。同时研究表明,益生菌和益生元制备而成的合生元[14],能有效促进肠道微生物群平衡,同时益生元作为一种不能被消化的食物成分,以其为包埋材料能有效减少胃肠液对益生菌的影响。然而,目前尚无以柑橘纤维素为包埋材料的相关文献报道。
本研究以柑橘纤维素和羧甲基纤维素钠为主要包埋材料,柠檬酸为交联剂制备水凝胶。通过吸附包埋植物乳植杆菌,研究不同配比的水凝胶对植物乳植杆菌的包埋率。对载菌水凝胶进行结构表征,探究水凝胶的交联机制及益生菌的包埋情况。考察载菌水凝胶在模拟胃肠液中、胆盐溶液及低温条件下的释放率及存活率,从而评估水凝胶的控释性能、胆盐耐受性及储藏稳定性。为柑橘纤维素和羧甲基纤维素钠作为包埋材料应用于益生菌递送和功能食品领域提供一些理论依据和参考。
1. 材料与方法
1.1 材料与仪器
植物乳植杆菌B5(Lactiplantibacillus plantarum B5,L. plantarum B5) 分离自人类母乳,保存于中国微生物菌种保藏管理中心(CGMCC),保存号CGMCC No.27251;水溶性柑橘纤维素(Citrus cellulose,CRC) 广东金骏康生物技术有限公司;羧甲基纤维素钠(Sodium carboxymethylcellulose,CMCNa) 成都科隆化学品有限公司;柠檬酸(Citric acid,CA) 汕头西陇科学股份有限公司;胃蛋白酶(>3000 U/mg)、胰蛋白酶(>2500 U/mg) 上海麦克林生化科技有限公司;胆盐 上海源叶生物科技有限公司;MRS营养琼脂培养基、MRS液体培养基 青岛海博生物技术有限公司。
DF-101S集热式恒温加热磁力搅拌器 江苏金恰仪器科技有限公司;GZX-9240数显鼓风干燥箱 上海博讯实业有限公司;Y120电子天平 日本岛津公司;BCD-170CM冰箱 美的公司;LGJ-10冷冻干燥机 北京松源华兴科技发展有限公司;IS50傅里叶红外光谱仪 日本Hitachi公司;SU5000扫描电子显微镜 德国Bruker公司。
1.2 实验方法
1.2.1 菌悬液的制备
植物乳植杆菌B5经活化后,在MRS培养液中37 ℃孵育12~14 h。孵育后,在4 ℃下5000 r/min离心10 min,收集菌泥沉淀。然后用无菌生理盐水(0.9%,w/v)洗涤,按上述方法离心收集菌泥沉淀[15]。洗涤后的菌泥沉淀重新悬浮于无菌生理盐水中制成菌悬液,并调节菌浓度为10 lg CFU/mL。将植物乳植杆菌B5的菌悬液分为两部分,一部分用于水凝胶包埋,另一部分作为游离细胞进行对照。
1.2.2 载菌水凝胶的制备
以柠檬酸作为交联剂,在水中与可溶性柑橘纤维素和羧甲基纤维素钠反应,按表1制备获得水凝胶样品[16]。将可溶性柑橘纤维素和羧甲基纤维素钠溶于水中,在室温下轻轻搅拌,直至得到清澈的溶液。在溶液中加入0.1%的柠檬酸,搅拌至完全溶解。所有样品先在30 ℃下干燥24 h以去除水分,然后在80 ℃下保存24 h进行交联反应。制备得到的水凝胶浸泡在30 mL菌悬液中吸附包埋24 h。最后过滤收集包埋后的载菌水凝胶,4 ℃保存。
表 1 水凝胶组成成分表Table 1. Compositions of the hydrogel编号 CRC(g) CMCNa(g) CA(g) CCC-311 0.25 0.75 0.1 CCC-411 0.20 0.80 0.1 CCC-511 0.17 0.83 0.1 1.2.3 包埋率的测定
包埋率的测定参照Xu等[17]的研究,并作必要的修改。载菌水凝胶悬浮在0.01 mol/L磷酸盐缓冲盐水(PBS,pH7.4)中,在150 r/min条件下使载菌水凝胶充分释放24 h。根据GB 4789.35-2016平板计数法,测定活菌数。包埋率计算公式如下。
包埋率(%)=lgN1lgN2×100 式中,N1为水凝胶包埋活菌数,CFU/mL;N2为包埋前添加的活菌数,CFU/mL。
1.2.4 扫描电镜分析
分别取适量冻干植物乳植杆菌B5、包埋前及包埋后的冻干水凝胶样品,按程序对其表面进行喷金处理,再利用扫描电子显微镜观察其微观形态。
1.2.5 傅里叶红外光谱仪分析
取适量溴化钾,将其研磨成细微粉末,再取适量冻干水凝胶,与溴化钾粉末均匀混合,压片,在傅里叶红外光谱仪上进行测定[18],分辨率为4 cm−1,扫描300次,波数范围为4000~500 cm−1。
1.2.6 体外模拟胃肠液消化
益生菌载体的模拟释放参照Kamalian等[19]的方法进行。将2.0 g氯化钠和3.0 g胃蛋白酶悬浮于7.0 mL盐酸溶液(37%)中,用蒸馏水稀释至终体积为1 L,调节pH为2.0,制备模拟胃液(Simulated gastric fluid,SGF);将6.8 g磷酸二氢钾、10 g胰蛋白酶溶解于无菌水中,用1 mol/L氢氧化钠调节pH至6.8,并稀释至终体积为1 L,制备模拟肠液。分别将游离植物乳植杆菌B5和载菌水凝胶加入到20 mL的模拟胃液中,在37 ℃、150 r/min条件下培养3 h。随后,将载菌水凝胶转移到模拟肠液(Simulated intestinal fluid,SIF)中,并在相同条件下培养21 h。在体外模拟胃肠液消化的24 h期间每隔3 h进行活菌计数。活菌计数以CFU/mL表示,释放率计算公式如下。
释放率(%)=lgA1lgA2×100 式中,A1为每3 h释放的活菌数,CFU/mL;A2为模拟消化前游离植物乳植杆菌B5和载菌水凝胶的活菌数,CFU/mL。
1.2.7 胆盐耐受性实验
胆盐耐受性实验按照Chen等[20]的方法进行。分别将游离植物乳植杆菌B5和载菌水凝胶加入1.5%胆汁盐溶液(pH7.4)中,在150 r/min、37 ℃条件下连续搅拌3 h。在预定时间(0、1、2、3 h)后,将游离植物乳植杆菌B5和载菌水凝胶转移至PBS(0.01 mol/L,pH7.4)中,在150 r/min下持续搅拌孵育24 h后,进行活菌计数。
1.2.8 储藏稳定性实验
冻干后的游离植物乳植杆菌B5和载菌水凝胶在4 ℃条件下保藏30 d。在预定的时间间隔(5、10、15、20、25、30 d),将游离植物乳植杆菌B5和载菌水凝胶添加到PBS(0.01 mol/L,pH7.4)中,以150 r/min搅拌孵育24 h后进行活菌计数[21]。
1.3 数据处理
数据以三次重复实验的平均值±标准差表示。使用SPSS统计软件对数据进行显著性分析,利用Origin 2022进行绘图,P<0.05认为有统计学意义。
2. 结果与分析
2.1 包埋率的测定结果
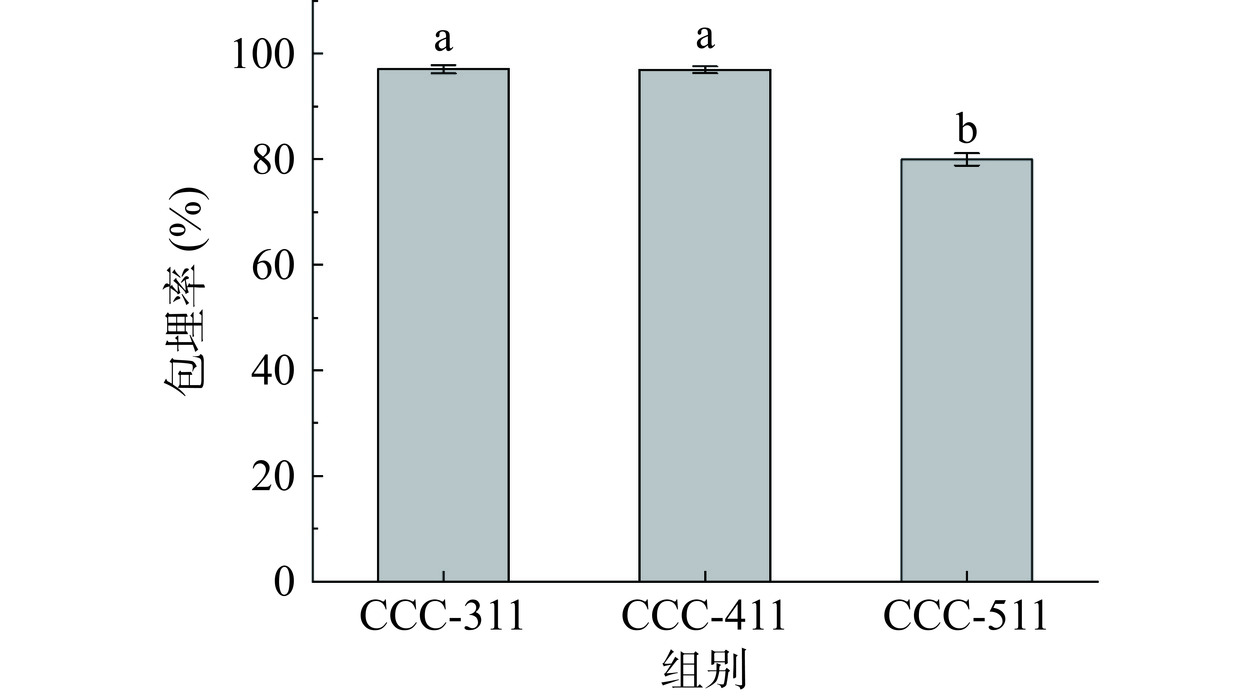
包埋率反映了植物乳植杆菌B5在包埋过程中的活力和可保留性,图1给出了不同水凝胶的包埋率。由图1可知,CCC-311水凝胶的包埋率为97.00%、CCC-411水凝胶的包埋率为96.91%、CCC-511水凝胶的包埋率为79.97%,可见水凝胶对植物乳植杆菌B5具有较好的包埋效果。相较于CCC-511,当柑橘纤维素与羧甲基纤维素钠的配比为1:3和1:4时,包埋率显著提高(P<0.05)。
2.2 扫描电镜结果分析
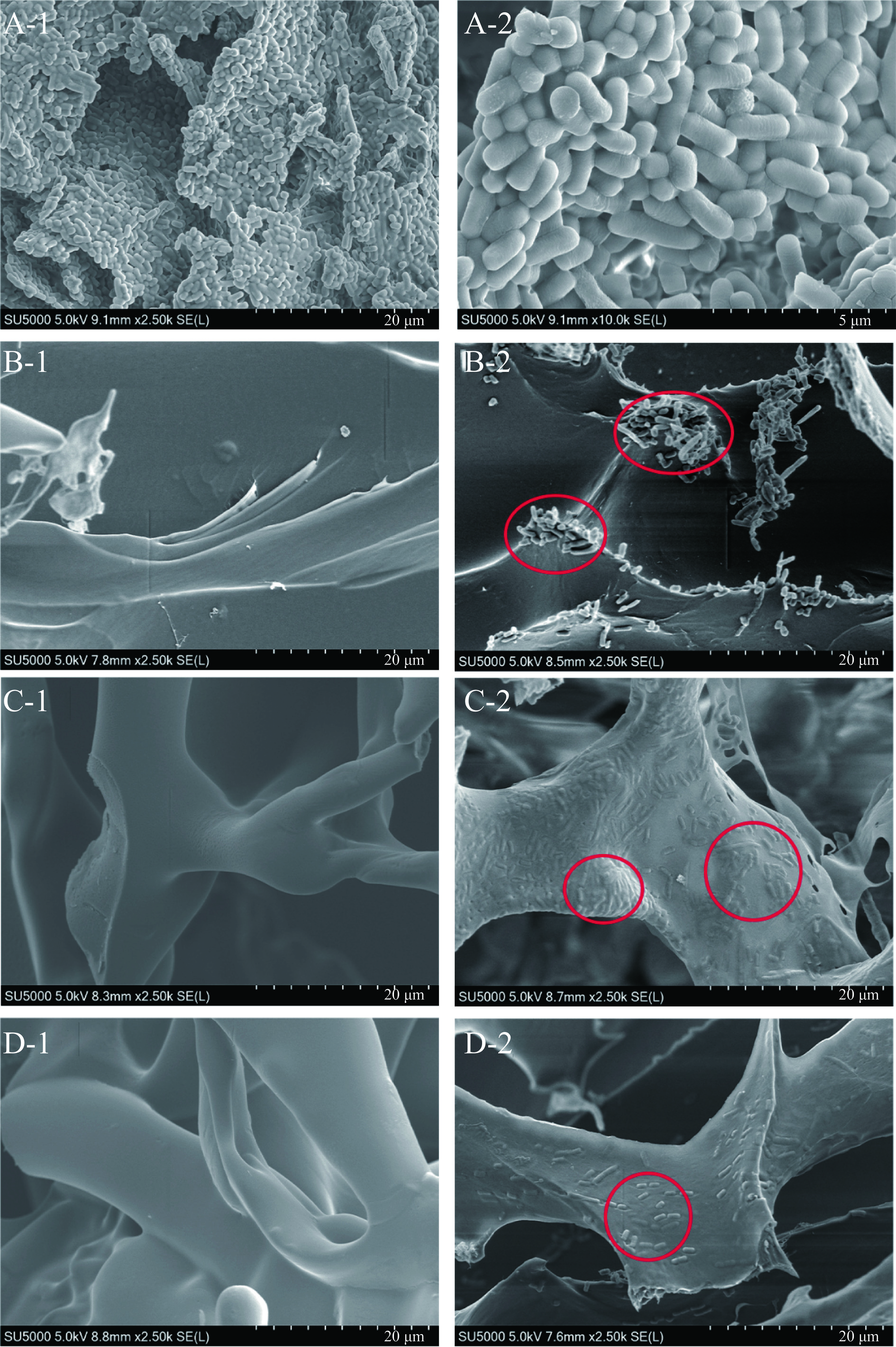
水凝胶及植物乳植杆菌B5的扫描电镜结果如图2所示。植物乳植杆菌B5在扫描电镜下呈圆端直杆结构,杆宽5 µm,杆长20 µm左右,无鞭毛,杆菌直或微曲。通过包埋前和包埋后的水凝胶电镜照片对比可以明显发现植物乳植杆菌B5在水凝胶的三维网络结构中随机分布,证明了植物乳植杆菌B5的成功包埋。吸附包埋益生菌后并未改变水凝胶的形态结构,证明柑橘纤维-羧甲基纤维素钠水凝胶可以为植物乳植杆菌B5提供一个良好的保护环境。
2.3 傅里叶红外光谱仪结果分析
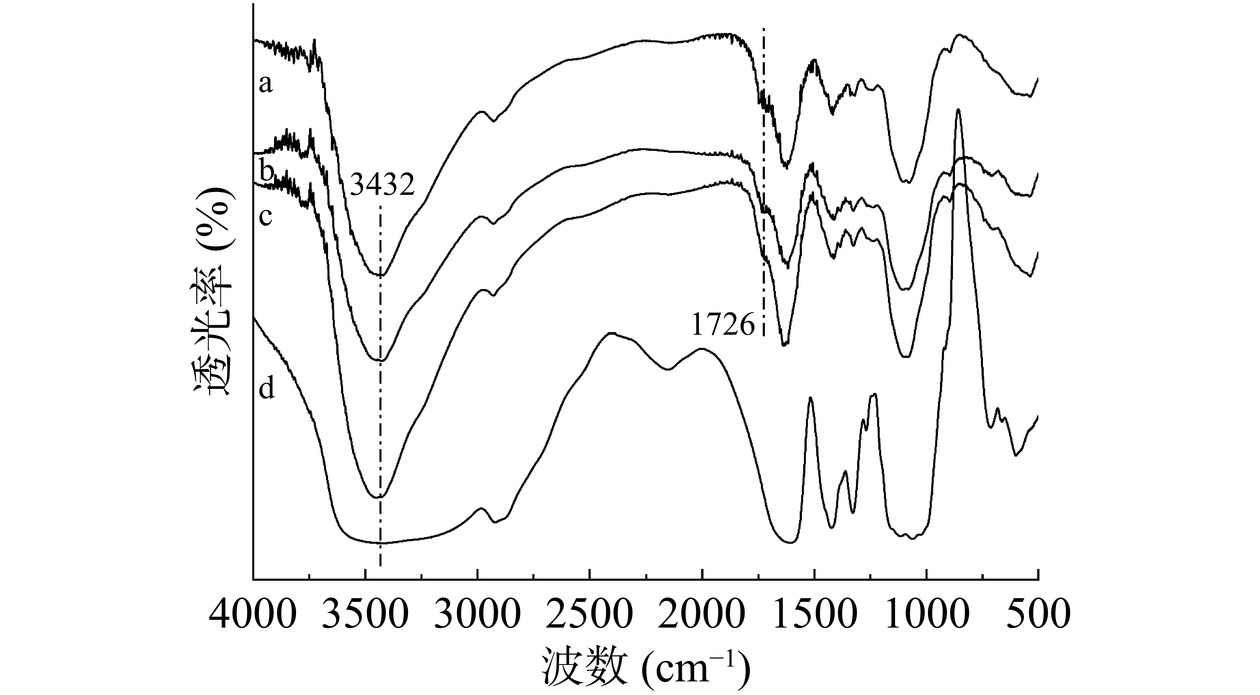
图3为三种水凝胶和羧甲基纤维素钠的红外光谱图。在3432 cm−1处出现了很强的O-H吸收峰,说明水凝胶的交联过程中还存在大量的分子内和分子间氢键。然而,与羧甲基纤维素钠的光谱相比,水凝胶在1726 cm−1处出现了一个新的吸收峰,这可以归因于羰基在较低频率上的特征拉伸带,这与酸酐的形成有关,酸酐是纤维素羟基与柠檬酸反应所必需的中间反应[16]。根据Zhuo等[22]的理论,柠檬酸通过酯化反应与纤维素交联,而酸酐是反应中重要的中间产物。水凝胶的傅里叶红外光谱结果证实了这一点。
2.4 体外模拟胃肠液释放结果分析
载菌水凝胶的首要任务是保护益生菌在进入人体后免受胃酸和蛋白酶的影响,并提高益生菌在肠道内的释放率。游离植物乳植杆菌B5在模拟胃液中的存活率如表2所示。在模拟胃液持续释放3 h后,菌体的活菌数显著降低(P<0.05),由初始活菌数11.82 lg CFU/mL降至3.20 lg CFU/mL。模拟胃液的最终存活率仅为27.09%。结果表明植物乳植杆菌B5对低pH和胃蛋白酶不耐受。
表 2 游离植物乳植杆菌B5在模拟胃液和胆盐溶液中的存活率Table 2. Survival rate of free Lactiplantibacillus plantarum B5 cells in simulated gastric fluid and bile salt solution时间(h) 模拟胃液 胆盐溶液 活菌数
(lg CFU/mL)存活率
(%)活菌数
(lg CFU/mL)存活率
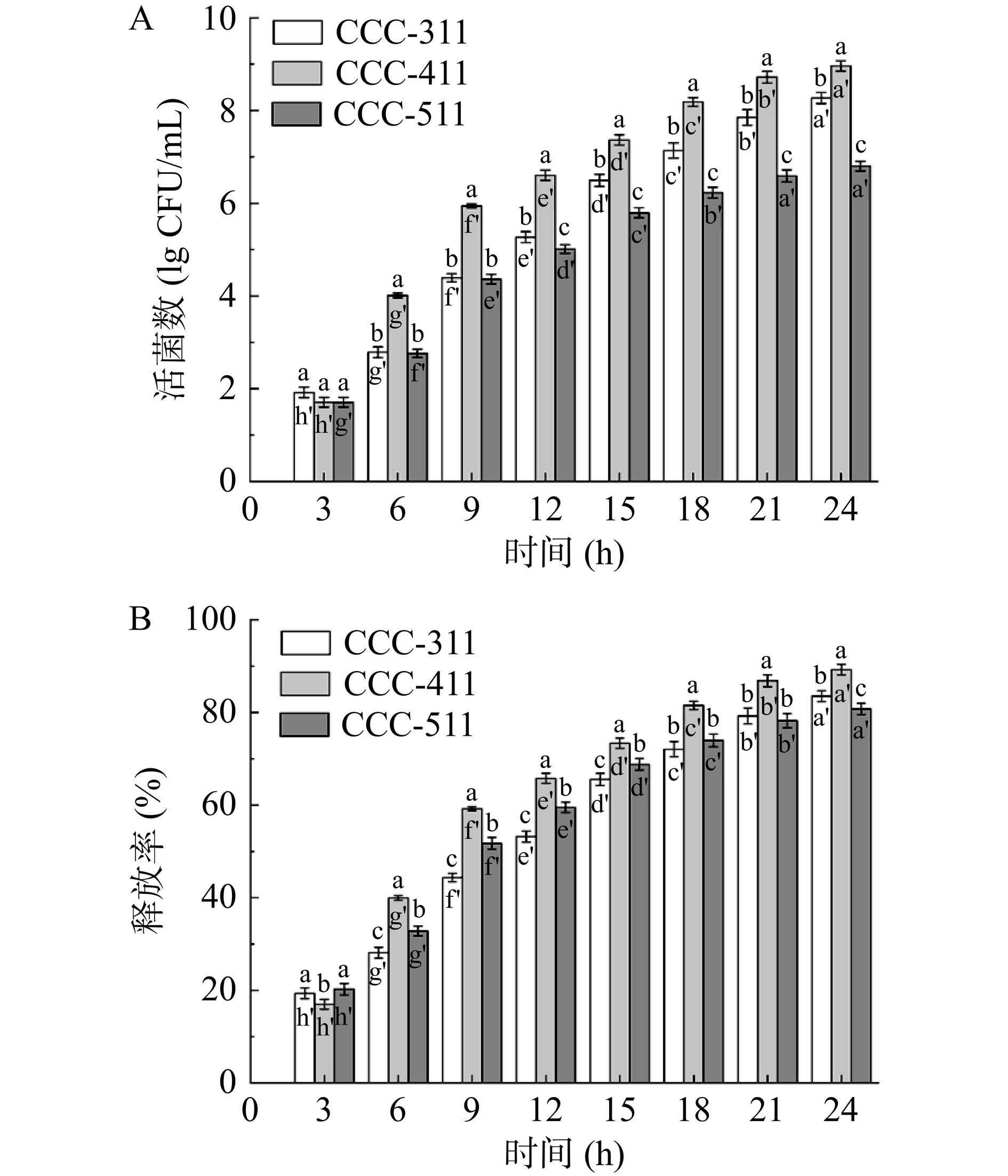
(%)0 11.82±0.22a 100a 9.38±0.18a 100a 1 8.91±0.19b 75.44±1.58b 9.29±0.04a 99.06±0.40a 2 5.49±0.20c 46.48±1.69c 8.35±0.15b 89.07±1.68b 3 3.20±0.17d 27.09±1.47d 6.66±0.09c 71.03±0.96c 注:同列不同字母代表游离植物乳植杆菌B5在模拟胃液和胆盐溶液中的活菌数及存活率的差异显著性(P<0.05)。 载菌水凝胶在模拟胃肠液中的释放率如图4所示。在模拟胃液中的3 h,三种载菌水凝胶的释放率处于较低水平,释放率均低于20%,CCC-411水凝胶的释放率显著低于另外两者(P<0.05)。将载菌水凝胶转移至模拟肠液后,三种水凝胶的释放活菌数及释放率显著提高(P<0.05),其中CCC-411水凝胶的释放率显著高于另外两种水凝胶(P<0.05),模拟消化24 h后,其包埋的菌体释放率为89.25%,活菌数从初始10.36 lg CFU/mL下降至 8.96 lg CFU/mL。在模拟胃液中的释放率最低而在模拟肠液中的释放率最高,表明CCC-411水凝胶的控释性能最佳。Singh等[23]用羧甲基纤维素钠和羟乙基纤维素制备水凝胶膜,在pH2.4时活菌数为7~8 lg CFU/mL,而在pH7.4时活菌数大于10 lg CFU/mL。但Singh等[23]只测试了膜在不同pH环境下的控释,并没有添加无机盐、蛋白酶等可能影响益生菌活性的物质。Hu等[24]以挤压法制备了海藻酸钠-果胶微球,其包埋的保加利亚乳杆菌经过模拟消化后,在模拟肠液中的活菌数下降了4.5 lg CFU/mL,益生菌的存活率为50%。Chen等[25]通过乳化法对益生菌进行微囊化,其制备的微球在模拟肠液中的释放量为6.41 lg CFU/mL,最终释放率为71%。与其他包埋方式制备的益生菌载体相比,本研究制备的柑橘纤维-羧甲基纤维素钠水凝胶表现出了更优秀的控释性能。
综上所述,体外模拟胃肠液释放结果表明三种柑橘纤维-羧甲基纤维素钠水凝胶均具备良好的控释效果,在模拟肠液的最终释放量仍大于6 lg CFU/mL,能显著提高植物乳植杆菌B5在模拟胃液中的存活率及模拟肠液中的释放率。证明水凝胶的三维网络结构可以有效保护植物乳植杆菌B5免受胃肠道环境的影响。
2.5 载菌水凝胶的释放特性
为了进一步研究水凝胶的释放机制,本实验基于Ritger-Peppas模型对释放结果进行动力学分析[21]。方程表示为:
MtM∞=ktn 式中,Mt表示t时刻的累积释放量,M∞表示微球内包封的益生菌总含量,k表示动力学常数,t表示释放时间,n表示释放指数。在该模型中,n<0.45表示释放机制为Fick型扩散,而0.45<n<0.89表示释放机制为non-Fick扩散。各水凝胶的释放指数、动力学常数及相关系数R2如表3所示。所有载菌水凝胶的n值均为大于0.45且小于0.89,说明载菌水凝胶的释放机制为菌体扩散和水凝胶骨架溶蚀的共同作用[26]。
表 3 载菌水凝胶的释放动力学分析Table 3. Kinetic analysis of release from bacteria-carrying hydrogel编号 n k R2 释放机制 CCC-311 0.71 0.09 0.99 non-Fick扩散 CCC-411 0.61 0.14 0.97 non-Fick扩散 CCC-511 0.60 0.13 0.98 non-Fick扩散 2.6 胆盐耐受性结果分析
当益生菌进入人体胃肠道时,除了受到胃酸和各种蛋白酶的降解外,还会因为胆汁的影响而降低活性。植物乳植杆菌B5在1.5%胆盐溶液中的存活率如表2所示。暴露于1.5%胆盐溶液中3 h后,植物乳植杆菌B5的存活率显著降低(P<0.05),但相较于其在模拟胃液中的存活率,植物乳植杆菌B5对胆盐溶液的敏感性要低一些,失活的细胞数量较少,表明植物乳植杆菌B5具有一定的胆盐耐受性。
载菌水凝胶在胆盐溶液中的存活率结果如图5所示。当柑橘纤维素和羧甲基纤维素钠的配比为1:4时,CCC-411水凝胶包埋的益生菌存活率显著高于另外两者(P<0.05),置于1.5%胆盐溶液中3 h,其包埋的益生菌活菌数由初始10.05 lg CFU/mL降至8.75 lg CFU/mL,存活率为87.09%。相较于以往的研究结果[27−28],本研究中载菌水凝胶对植物乳植杆菌B5在胆盐溶液中的保护效果更好。一方面,这可能是由于使用了不同的菌株。与保加利亚乳杆菌[29]、长双歧杆菌BL-05[30]等菌株相比,植物乳植杆菌B5对胆盐溶液的敏感性较低,具备一定的胆盐耐受性。另一方面,水凝胶提供了更强的物理屏障,可以有效减少胆盐溶液与菌体之间的接触。此外,载体基质与胆盐溶液之间的离子交换也可能是提高植物乳植杆菌B5活性的原因之一[31]。
2.7 储藏稳定性结果分析
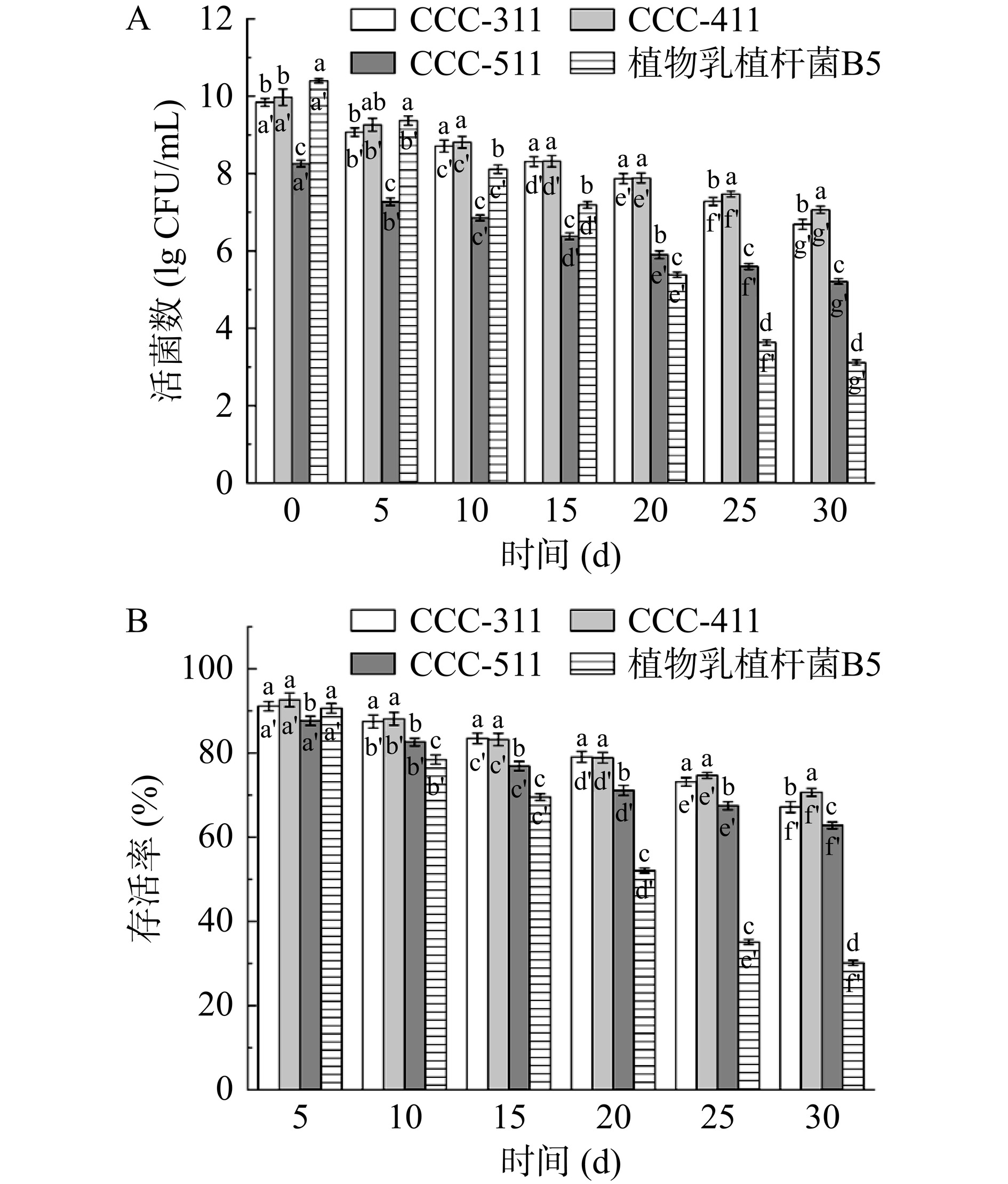
图6为游离和包埋的植物乳植杆菌B5在4 ℃下保藏1个月内的存活率。结果表明,植物乳植杆菌B5易受低温影响。4 ℃保存1个月内,未包埋的菌体活菌数显著降低(P<0.05),由最初的10.34 lg CFU/mL下降到3.12 lg CFU/mL,存活率为30.13%。然而,在相同的条件下,水凝胶显著提高了植物乳植杆菌B5的存活率(P<0.05)。当柑橘纤维素和羧甲基纤维素钠的配比为1:4时,CCC-411具有最良好的贮藏稳定性,其包埋的植物乳植杆菌B5在30 d后的存活率显著高于其他水凝胶及游离植物乳植杆菌B5(P<0.05),存活率达到70.66%。这是因为水凝胶为植物乳植杆菌B5提供了一个致密的包装环境,可以有效减少储存环境中氧胁迫等环境因素的影响。实验结果与已有文献一致。Fareez等[32]将植物乳杆菌LAB12包封在海藻酸盐和纤维素衍生物组成的微球中,在4 ℃下保存4周,细胞存活率最高可提高11.22%。Dusso等[33]发现,在海藻酸盐基微颗粒中加入不同的佐剂,可在4 ℃下保存24周,同时仍能保持6 lg CFU/mL以上的细胞活力。
3. 结论
植物乳植杆菌B5对酸性环境和胃蛋白酶等条件敏感,在胃液中的存活率低。本研究以柑橘纤维素和羧甲基纤维素钠为主要包埋材料,柠檬酸为交联剂,制备了植物乳植杆菌B5的水凝胶递送载体。实验结果表明,三种水凝胶均能有效包埋植物乳植杆菌B5,当柑橘纤维与羧甲基纤维素钠配比为1:3和1:4时,包埋效果最好,最大包埋率为97%。扫描电镜图像显示植物乳植杆菌B5随机分布在水凝胶的三维结构内部;红外光谱图证明了柠檬酸作为交联剂,与纤维素发生酯化作用,成功制备了柑橘纤维素-羧甲基纤维素钠水凝胶。将载菌水凝胶置于模拟胃肠液中模拟消化24 h,其包埋的植物乳植杆菌B5最高释放率为89.25%。与已有的研究结果相比,本研究制备的水凝胶具备了同样优秀的控释性能,能够有效提高益生菌在模拟肠液中的释放率。在4 ℃条件下储藏30 d,水凝胶包埋的益生菌在储藏结束后的存活率显著高于未包埋的益生菌(P<0.05),存活率最高为70.66%。
综上,本研究制备的益生菌载体能够有效保护益生菌免受环境中不利因素的影响,提高其在肠道内的释放率,使其能够有效发挥益生作用。目前国内外益生菌载体制备材料中,并未发现以柑橘纤维素作为主要材料进行研究的相关报道,本研究的实验结果证明了柑橘纤维素可以作为益生菌的包埋壁材,可以将其应用于益生菌递送领域,提供了一种新型益生菌递送方法。但本研究实验结果受限于体外模拟,后续实际应用可以通过动物实验、细胞毒性表征、不同温度下的稳定性等试验进一步探究柑橘纤维素-羧甲基纤维素钠水凝胶的应用潜力,为拓宽柑橘纤维素在食品工业中的应用奠定理论基础。
-
表 1 水凝胶组成成分表
Table 1 Compositions of the hydrogel
编号 CRC(g) CMCNa(g) CA(g) CCC-311 0.25 0.75 0.1 CCC-411 0.20 0.80 0.1 CCC-511 0.17 0.83 0.1 表 2 游离植物乳植杆菌B5在模拟胃液和胆盐溶液中的存活率
Table 2 Survival rate of free Lactiplantibacillus plantarum B5 cells in simulated gastric fluid and bile salt solution
时间(h) 模拟胃液 胆盐溶液 活菌数
(lg CFU/mL)存活率
(%)活菌数
(lg CFU/mL)存活率
(%)0 11.82±0.22a 100a 9.38±0.18a 100a 1 8.91±0.19b 75.44±1.58b 9.29±0.04a 99.06±0.40a 2 5.49±0.20c 46.48±1.69c 8.35±0.15b 89.07±1.68b 3 3.20±0.17d 27.09±1.47d 6.66±0.09c 71.03±0.96c 注:同列不同字母代表游离植物乳植杆菌B5在模拟胃液和胆盐溶液中的活菌数及存活率的差异显著性(P<0.05)。 表 3 载菌水凝胶的释放动力学分析
Table 3 Kinetic analysis of release from bacteria-carrying hydrogel
编号 n k R2 释放机制 CCC-311 0.71 0.09 0.99 non-Fick扩散 CCC-411 0.61 0.14 0.97 non-Fick扩散 CCC-511 0.60 0.13 0.98 non-Fick扩散 -
[1] 薛志朋, 王哲, 潘登, 等. 益生菌治疗和缓解便秘的机制及研究进展[J]. 食品研究与开发,2022,43(12):204−209. [XUE Z P, WANG Z, PAN D, et al. Mechanism and research progress of probiotics used to treat constipation[J]. Food Research and Development,2022,43(12):204−209.] doi: 10.12161/j.issn.1005-6521.2022.12.027 XUE Z P, WANG Z, PAN D, et al. Mechanism and research progress of probiotics used to treat constipation[J]. Food Research and Development, 2022, 43(12): 204−209. doi: 10.12161/j.issn.1005-6521.2022.12.027
[2] LIU Y W, SU Y W, ONG W K, et al. Oral administration of Lactobacillus plantarum K68 ameliorates DSS-induced ulcerative colitis in BALB/c mice via the anti-inflammatory and immunomodulatory activities[J]. International Immunopharmacology,2011,11(12):2159−2166. doi: 10.1016/j.intimp.2011.09.013
[3] SONG J J, TIAN W J, KWOK L Y, et al. Effects of microencapsulated Lactobacillus plantarum LIP-1 on the gut microbiota of hyperlipidaemic rats[J]. British Journal of Nutrition,2017,118(7):481−492. doi: 10.1017/S0007114517002380
[4] PARK S, JI Y, JUNG H Y, et al. Lactobacillus plantarum HAC01 regulates gut microbiota and adipose tissue accumulation in a diet-induced obesity murine model[J]. Applied Microbiology and Biotechnology,2017,101(4):1605−1614. doi: 10.1007/s00253-016-7953-2
[5] LI X, WANG N, YIN B, et al. Effects of Lactobacillus plantarum CCFM0236 on hyperglycaemia and insulin resistance in high-fat and streptozotocin-induced type 2 diabetic mice[J]. Journal of Applied Microbiology,2016,121(6):1727−1736. doi: 10.1111/jam.13276
[6] 常诗晗, 乌日娜, 方海田, 等. 负载2种益生菌的多核微胶囊制备方法及特性研究[J]. 食品科学技术学报,2023,41(6):127−138. [CHANG S H, WU R N, FANG H T, et al. Study on preparation method and characteristics of multi-core microcapsules loaded with two probiotics[J]. Journal of Food Science and Technology,2023,41(6):127−138.] CHANG S H, WU R N, FANG H T, et al. Study on preparation method and characteristics of multi-core microcapsules loaded with two probiotics[J]. Journal of Food Science and Technology, 2023, 41(6): 127−138.
[7] 黄雅萍, 叶景芬, 邓凯波, 等. 抗性淀粉用于微胶囊制备的研究进展[J]. 食品研究与开发,2019,40(7):218−224. [HUANG Y P, YE J F, DENG K B, et al. Research progress of resistant starch for microencapsulation[J]. Food Research and Development,2019,40(7):218−224.] doi: 10.3969/j.issn.1005-6521.2019.07.037 HUANG Y P, YE J F, DENG K B, et al. Research progress of resistant starch for microencapsulation[J]. Food Research and Development, 2019, 40(7): 218−224. doi: 10.3969/j.issn.1005-6521.2019.07.037
[8] GAO Y X, WANG X, XUE C H, et al. Latest developments in food-grade delivery systems for probiotics:A systematic review[J]. Critical Reviews in Food Science and Nutrition,2023,63(20):4371−4388. doi: 10.1080/10408398.2021.2001640
[9] 李月婵, 操俊, 庄林, 等. 三联益生菌复合发酵枸杞泡腾片的工艺优化及质量检测[J]. 食品研究与开发,2022,43(19):109−116. [LI Y C, CAO J, ZHUANG L, et al. Process optimization and quality inspection of triple probiotics-fermented wolfberry effervescent tablets[J]. Food Research and Development,2022,43(19):109−116.] doi: 10.12161/j.issn.1005-6521.2022.19.014 LI Y C, CAO J, ZHUANG L, et al. Process optimization and quality inspection of triple probiotics-fermented wolfberry effervescent tablets[J]. Food Research and Development, 2022, 43(19): 109−116. doi: 10.12161/j.issn.1005-6521.2022.19.014
[10] 袁琦, 王玉珑, 韩俊源, 等. 羧甲基纤维素钠/己二酸二酰肼水凝胶的制备及其重金属离子吸附性能研究[J]. 中国造纸学报,2021,36(4):38−47. [YUAN Q, WANG Y L, HAN J Y, et al. Study on preparation of sodium carboxymethyl cellulose/adipic dihydrazide hydrogel and its adsorption performance for heavy metal ions[J]. Transactions of China Pulp and Paper,2021,36(4):38−47.] doi: 10.11981/j.issn.1000-6842.2021.04.38 YUAN Q, WANG Y L, HAN J Y, et al. Study on preparation of sodium carboxymethyl cellulose/adipic dihydrazide hydrogel and its adsorption performance for heavy metal ions[J]. Transactions of China Pulp and Paper, 2021, 36(4): 38−47. doi: 10.11981/j.issn.1000-6842.2021.04.38
[11] 田振华, 赵文杰, 杜倩瑶, 等. 胶原/氧化羧甲基纤维素钠/纳米氧化锌复合水凝胶的构建[J]. 中国皮革,2022,51(5):9−17,21. [TIAN Z H, ZHAO W J, DU Q Y, et al. Construction of collagen/oxidized sodium carboxymethy cellulose/nano ZnO composite hydrogel[J]. China Leather,2022,51(5):9−17,21.] TIAN Z H, ZHAO W J, DU Q Y, et al. Construction of collagen/oxidized sodium carboxymethy cellulose/nano ZnO composite hydrogel[J]. China Leather, 2022, 51(5): 9−17,21.
[12] PEREZ-BURILLO S, MEHTA T, PASTORIZA S, et al. Potential probiotic salami with dietary fiber modulates antioxidant capacity, short chain fatty acid production and gut microbiota community structure[J]. LWT-Food Science and Technology,2019,105:355−362. doi: 10.1016/j.lwt.2019.02.006
[13] PEREZ-BURILLO S, PASTORIZA S, GIRONES A, et al. Potential probiotic salami with dietary fiber modulates metabolism and gut microbiota in a human intervention study[J]. Journal of Functional Foods,2020,66:103790. doi: 10.1016/j.jff.2020.103790
[14] 马航宇, 张士凯, 吴澎. 复配益生元微胶囊的制备及其消化耐受性[J]. 食品研究与开发,2023,44(3):152−161. [MA H Y, ZHANG S K, WU P. Preparation and digestive tolerance of compound prebiotic microcapsules[J]. Food Research and Development,2023,44(3):152−161.] doi: 10.12161/j.issn.1005-6521.2023.03.022 MA H Y, ZHANG S K, WU P. Preparation and digestive tolerance of compound prebiotic microcapsules[J]. Food Research and Development, 2023, 44(3): 152−161. doi: 10.12161/j.issn.1005-6521.2023.03.022
[15] 肖雨, 王刚, 于潇萧, 等. 保加利亚乳杆菌微胶囊化工艺研究[J]. 中国微生态学杂志,2018,30(6):654−658. [XIAO Y, WANG G, YU X X, et al. Microencapsulation of Lactobacillus bulgaricus[J]. Chinese Journal of Microecology,2018,30(6):654−658.] XIAO Y, WANG G, YU X X, et al. Microencapsulation of Lactobacillus bulgaricus[J]. Chinese Journal of Microecology, 2018, 30(6): 654−658.
[16] DEMITRI C, DEL SOLE R, SCALERA F, et al. Novel superabsorbent cellulose-based hydrogels crosslinked with citric acid[J]. Journal of Applied Polymer Science,2008,110(4):2453−2460. doi: 10.1002/app.28660
[17] XU D, ZHAO X, MAHSA G C, et al. Controlled release of Lactiplantibacillus plantarum by colon-targeted adhesive pectin microspheres:Effects of pectin methyl esterification degrees[J]. Carbohydrate Polymers,2023,313:120874. doi: 10.1016/j.carbpol.2023.120874
[18] 姚泽晨, 张根义. 植物乳杆菌微胶囊包载效果、物化性质及其胃肠道性能[J]. 食品工业科技,2019,40(14):112−117,133. [YAO Z C, ZHANG G Y. Encapsulation effect, physicochemical and gastrointestinal properties of Lactobacillus plantarum microcapsules[J]. Science and Technology of Food Industry,2019,40(14):112−117,133.] YAO Z C, ZHANG G Y. Encapsulation effect, physicochemical and gastrointestinal properties of Lactobacillus plantarum microcapsules[J]. Science and Technology of Food Industry, 2019, 40(14): 112−117,133.
[19] KAMALIAN N, MIRHOSSEINI H, MUSTAFA S, et al. Effect of alginate and chitosan on viability and release behavior of Bifidobacterium pseudocatenulatum G4 in simulated gastrointestinal fluid[J]. Carbohydrate Polymers,2014,111:700−706. doi: 10.1016/j.carbpol.2014.05.014
[20] CHEN L, YANG T, SONG Y J, et al. Effect of xanthan-chitosan-xanthan double layer encapsulation on survival of Bifidobacterium BB01 in simulated gastrointestinal conditions, bile salt solution and yogurt[J]. LWT-Food Science and Technology,2017,81:274−280. doi: 10.1016/j.lwt.2017.04.005
[21] DAFE A, ETEMADI H, DILMAGHANI A, et al. Investigation of pectin/starch hydrogel as a carrier for oral delivery of probiotic bacteria[J]. International Journal of Biological Macromolecules,2017,97:536−543. doi: 10.1016/j.ijbiomac.2017.01.060
[22] ZHOU Y J, LUNER P, CALUWE P. Mechanism of cross-linking of papers with polyfunctional carboxylic-acids[J]. Journal of Applied Polymer Science,1995,58(9):1523−1534. doi: 10.1002/app.1995.070580915
[23] SINGH P, MAGALHAES S, ALVES L, et al. Cellulose-based edible films for probiotic entrapment[J]. Food Hydrocolloids,2019,88:68−74. doi: 10.1016/j.foodhyd.2018.08.057
[24] HU X, LIU C, ZHANG H, et al. In vitro digestion of sodium alginate/pectin co-encapsulated Lactobacillus bulgaricus and its application in yogurt bilayer beads[J]. International Journal of Biological Macromolecules,2021,193:1050−1058. doi: 10.1016/j.ijbiomac.2021.11.076
[25] CHEN P, TIAN J, REN Y, et al. Enhance the resistance of probiotics by microencapsulation and biofilm construction based on rhamnogalacturonan I rich pectin[J]. International Journal of Biological Macromolecules,2024,258:128777. doi: 10.1016/j.ijbiomac.2023.128777
[26] MANDAVINIA G R, MOSALLANEZHAD A, SOLEYMANI M, et al. Magnetic-and pH-responsive κ-carrageenan/chitosan complexes for controlled release of methotrexate anticancer drug[J]. International Journal of Biological Macromolecules,2017,97:209−2017. doi: 10.1016/j.ijbiomac.2017.01.012
[27] WU Y, ZHANG G. Synbiotic encapsulation of probiotic Latobacillus plantarum by alginate-arabinoxylan composite microspheres[J]. LWT-Food Science and Technology,2018,93:135−141. doi: 10.1016/j.lwt.2018.03.034
[28] SANIANI M, NATEGHI L, HSHEMIRAVAN M. Investigation of microencapsulated Lactobacillus plantarum survival in alginate microsphere incorporated with inulin and dextran in order to produce a novel probiotic whey beverage[J]. Journal of Food Measurement and Characterization,2023,17(4):3683−3694. doi: 10.1007/s11694-023-01902-y
[29] SHI L E, LI Z H, ZHANG Z L, et al. Encapsulation of Lactobacillus bulgaricus in carrageenan-locust bean gum coated milk microspheres with double layer structure[J]. LWT-Food Science and Technology,2013,54(1):147−151. doi: 10.1016/j.lwt.2013.05.027
[30] YASMIN I, SAEED M, PASHA I, et al. Development of whey protein concentrate-pectin-alginate based delivery system to improve survival of B. longum BL-05 in simulated gastrointestinal conditions[J]. Probiotics and Antimicrobial Proteins,2019,11(2):413−426. doi: 10.1007/s12602-018-9407-x
[31] MURATA Y, TONIWA S, MIYAMOTO E, et al. Preparation of alginate gel beads containing chitosan salt and their function[J]. International Journal of Pharmaceutics,1999,176(2):265−268. doi: 10.1016/S0378-5173(98)00308-1
[32] FAREEZ I M, LIM S M, ZULKEFLI N A A, et al. Cellulose derivatives enhanced stability of alginate-based beads loaded with Lactobacillus plantarum LAB12 against low pH, high temperature and prolonged storage[J]. Probiotics and Antimicrobial Proteins,2018,10(3):543−557. doi: 10.1007/s12602-017-9284-8
[33] DUSSO D, SALOMON C J J. Solving the delivery of Lactococcus lactis:Improved survival and storage stability through the bioencapsulation with different carriers[J]. Journal of Food Science,2023,88(4):1495−1505. doi: 10.1111/1750-3841.16538





 下载:
下载:

 下载:
下载:



