Structural Changes of Myofibrillar Proteins in Marinated Duck Drumsticks during Ultra-high Pressure Processing Treatment
-
摘要: 为探究超高压处理对卤鸭腿嫩度的改善机制,本研究通过测定表面疏水性、巯基含量、化学作用力、二级结构、微观结构等指标,分析了超高压处理(400 MPa,15 min)过程中肌原纤维蛋白结构的变化规律。结果表明,肌原纤维蛋白表面疏水性先上升后下降,在处理12 min时达到最大值51.03。总巯基含量在处理15 min后下降了40.6%,而游离巯基含量上升了42.7%,二硫键显著(P<0.05)增加了189.2%。色氨酸和酪氨酸基团暴露。以上变化表明蛋白三级结构发生改变。超高压处理15 min后,肌原纤维蛋白α-螺旋含量从20.63%减少到13.45%,无规则卷曲含量从23.93%增加到28.67%,说明蛋白二级结构重排。SDS-PAGE电泳和扫描电镜结果分别显示,超高压处理后的肌原纤维蛋白发生解聚,颗粒尺寸明显减小且分布更加均匀。综上所述,在超高压处理过程中,鸭腿肌原纤维蛋白的三级结构、二级结构和微观结构均发生了明显变化,这有利于提高鸭肉嫩度。该研究为超高压技术在肉制品嫩度改善的应用提供了理论基础。Abstract: To investigate the improvement mechanism of ultra-high pressure treatment on the tenderness of marinated duck drumsticks, this study analyzed the pattern of structural changes of myofibrillar proteins during ultra-high pressure processing (400 MPa, 15 min) by determining the surface hydrophobicity, sulfhydryl content, chemical force, secondary structure and microstructure. The results showed that the hydrophobicity of myofibrillar proteins initially increased and then decreased, reaching a maximum of 51.03 after 12 min of treatment. The total thiol content decreased by 40.6% after 15 min of treatment, while the free thiol content increased by 42.7%, and disulfide bonds significantly (P<0.05) increased by 189.2%. Tryptophan and tyrosine residues were exposed, indicating changes in protein tertiary structure. After 15 min of ultra-high pressure treatment, the α-helix content of myofibrillar protein decreased from 20.63% to 13.45%, and the content of irregular coils increased from 23.93% to 28.67%, suggesting rearrangement of the protein secondary structure. SDS-PAGE electrophoresis and scanning electron microscopy results demonstrated protein depolymerization of ultra-high pressure processing treatment, significant reduction in particle size, and more uniform distribution. In conclusion, during ultra-high pressure processing, significant changes occur in the tertiary structure, secondary structure, and microstructure of duck drumsticks myofibrillar proteins, contributing to the improvement of duck meat tenderness. This study would provide a theoretical basis for the application of ultra-high pressure technology in improving meat tenderness.
-
中国是世界最大的鸭肉生产国,据联合国粮食及农业组织(FAO)统计,中国鸭肉产量占世界鸭肉总产量的85%,肉鸭年产量保持在4亿只以上[1]。鸭肉在中国市场的前景十分广阔,因其丰富的营养价值深受消费者喜爱。随着消费者对高品质肉类的需求增长,鸭肉的市场份额持续扩大,行业创新也将进一步推动市场发展。卤鸭制品作为鸭肉市场中的特色产品,其前景尤其值得期待。卤鸭制品不仅通过独特卤制工艺,融合香料与调料,使鸭肉更鲜美、细腻,还保留了鸭肉的营养与口感。卤鸭制品多样化的口味满足了不同消费者的需求,进一步拓宽了市场空间[2]。嫩度是评价卤肉制品质地的重要指标,直接反映了消费者最关注的肉质口感问题。肌原纤维蛋白(MP)对肉制品的嫩度和口感具有决定性影响。它通过调节肌肉纤维束的相互作用来影响肌肉的收缩或扩张。在肉制品加工中,MP的降解和聚合程度是控制嫩度的关键。适度降解能够软化肌肉纤维,增强肉制品的嫩滑感;而降解不足或过度则可能导致口感不佳[3]。
超高压作为一种新型的非热加工技术,因其高效率、低能耗、无毒无害的优势,近年来受到了广泛关注[4]。目前,超高压因其对病原菌细胞膜及细胞壁的强烈损伤作用,已广泛应用于食品的杀菌保鲜。有研究证明[5−6],超高压处理能明显提高肉制品产品的贮藏期安全性。此外,也有部分研究发现,超高压对肉制品的嫩度也有一定改善作用。徐菲菲等[7]发现超高压可以改善传统卤肉的嫩度和保水性。季现秋等[8]报道了新兴技术中超高压对牛肉的嫩化方面效果显著。孙树远等[9]发现超高压处理结合木瓜蛋白酶可以有效提升驼肉的嫩度。Zhang等[10]研究发现高压(100~500 MPa)处理可改善鹅肉的嫩度。Nath等[11]报道了高压使牛排的剪切力下降了60%。团队前期研究也发现,超高压处理对卤制鸭腿的嫩度有改善作用。但对于超高压改善鸭肉嫩度的机制探究还不够充分。
因此,本研究通过表面疏水性、巯基含量、化学作用力、傅里叶红外等测定方法对超高压处理过程中肌原纤维蛋白结构的变化规律进行探究,旨在揭示超高压处理对卤制鸭腿嫩度的影响机制,为超高压技术在肉制品嫩度改善的应用提供理论依据。
1. 材料与方法
1.1 材料与仪器
生鲜鸭腿 购买自华英食品有限公司;SDS-PAGE试剂盒 碧云天生物技术有限公司;Ellman试剂盒 赛默飞世尔科技(中国)有限公司;BSA(标准级)、甘氨酸(分析纯级) 广州赛国生物科技有限责任公司;溴化钾、磷酸氢二钾、磷酸二氢钾、乙二胺四乙酸二钠、三氯醋酸、溴酚蓝(均为分析纯级) 国药集团化学试剂有限公司;考马斯亮蓝R-250 美国Sigma公司。
HPP 600 MPa/3~5 L超高压冷杀菌机 包头科发高压科技有限责任公司;FW-3190抽真空封口机 广州市新鲜世界电器有限公司;SVC-313W真空烹饪机 德国宝有限公司;SU8600超高分辨场发射扫描电子显微镜 日本HITACHI公司;XHF-DY型高速分散器、GL-20G-Ⅱ型高速冷冻离心机 上海安亭科学仪器厂;F98荧光分光光度计 上海棱光技术有限公司;UV2000型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;PowerPac HC Power Supply高电流电泳仪、JY04S-3C型凝胶成像系统 北京君意东方电泳设备有限公司;Nicolet IS5傅里叶变换红外光谱 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 肌原纤维蛋白提取
称取10.0 g生鲜鸭腿样品,加入至40 mL 0.02 mol/L磷酸盐缓冲液中(0.1 mol/L NaCl,0.001 mol/L EDTA-2Na,pH7.0),10000 r/min冰浴中均质30 s,匀浆液10000 r/min离心10 min后,弃去上清液。重复上述操作4次,并在第4次操作离心前将混合液经双层纱布过滤后得滤液,滤液离心后得到沉淀,沉淀即为提纯的肌原纤维蛋白,以上操作均在4 ℃条件下进行。蛋白质量浓度采用双缩脲法进行测定,提取的蛋白质在4 ℃下保存,并在12 h内使用。将沉淀的肌原纤维蛋白用磷酸盐缓冲液溶解,将MP溶液质量浓度调整为1 mg/mL。溶解后装入聚乙烯袋中真空封口(100 mL/袋),70 ℃真空恒温加热8 h。
1.2.2 超高压处理
将真空加热(70 ℃,8 h)后的袋装样品放入加压舱内(室温)。其中,未进行加热和加压处理的样品设置为未处理组。前期研究结果证明,在400 MPa压力条件下处理15 min时,鸭腿嫩度可达到最佳。因此,本实验将超高压处理压力设置为400 MPa,以水为介质,对样品分别超高压处理0、3、6、9、12、15 min。将各处理后的样品经冻干干燥,得到MP粉末,保存在−80 ℃备用。
1.2.3 表面疏水性的测定
表面疏水性参照万红兵等[12]的方法适当修改进行测定。 将MP粉末溶于pH7.0的磷酸盐缓冲溶液中,并将肌原纤维蛋白溶液质量浓度调整为5 mg/mL,加入1 mL的1 mg/mL溴酚蓝(BPB),室温条件下搅拌10 min,混合均匀后离心(7000 r/min)15 min,将上清液稀释10倍后在595 nm下测定吸收值(A)。5 mL PBS(20 mmol/L,pH6.0)和1 mL BPB(1 mg/mL)均匀混合后作为溴酚蓝空白样(A0),用PBS(20 mmol/L,pH6.0)空白调零。每个样品至少平行测试3次。
溴酚蓝结合量(μg)=200μg×(A−A0)A0 (1) 1.2.4 总巯基与游离巯基含量的测定
总巯基与游离巯基含量的测定参照董智铭等[13]的方法。试剂的配制缓冲液1(pH8.0):每升溶液含1.2 g EDTA,6.9 g甘氨酸,10.42 g Tris。缓冲液2:在缓冲液1中加入480.48 g尿素。缓冲液3:在缓冲液1中加入600.06 g尿素。Elman试剂:0.1 g DTNB试剂溶于25 mL缓冲液1中(4 mg/mL)。12% TCA溶液:60 g三氯醋酸用去离子水定容到500 mL。总巯基和游离巯基含量:精确称取30 mg冻干后MP粉末,加入10 mL缓冲液(缓冲液1溶解游离巯基,缓冲液2溶解总巯基),振荡溶解,再加入0.1 mL Elman试剂,25 ℃下避光振荡1 h,离心(5000 r/min,10 min),测定上清液在412 nm处的吸光度,重复3次实验。按照公式(2)计算巯基含量:
SH(μmol/g)=73.53×A412×DC (2) 式中:A412:吸光值;D:稀释倍数;C:蛋白浓度,mg/mL;73.53=106/(1.36×104),1.36×104为TNBA(Elman试剂与巯基反应所生成的5-硫代-2-硝基苯甲酸(盐)阴离子)的摩尔消光系数,单位为L/(mol·cm)。
1.2.5 化学作用力的测定
根据陈旭等[14]的方法,测定MP分子间作用力。将MP用磷酸钠缓冲液(50 mmol/L,pH6.0)稀释至15 mg/mL,涡旋30 s。然后,在5 mL样品中分别加入20 mL反应液S1(0.05 mol/L NaCl)、S2(0.6 mol/L NaCl)、S3(0.6 mol/L NaCl,1.5 mol/L尿素)、S4(0.6 mol/L NaCl、8 mol/L尿素)和S5(0.6 mol/L NaCl、8 mol/L尿素和0.05 mol/L β-巯基乙醇)。再均质30 s后,将溶液在4 ℃下孵育90 min。然后将样品在4 ℃下以4600×g离心8 min。采用Bradford法测定上清液中蛋白质含量。通过溶液中的蛋白质溶解度确定离子键(S2和S1之间的差值)、氢键(S3和S2之间的差值)、疏水相互作用(S4和S3之间的差值)和二硫键(S5和S4之间的差值)的贡献。
1.2.6 二级结构的测定
参考Zhang等[15]的方法,采用傅里叶变换红外光谱仪分析肌原纤维蛋白的二级结构。准确称量冻干样品粉末2 mg、溴化钾200 mg,研磨压片后进行扫描,扫描范围为400~4000 cm−1,根据各指认峰及面积分析蛋白二级结构变化指认峰及面积分析蛋白质二级结构变化。
1.2.7 紫外吸收光谱的测定
将样品用磷酸盐缓冲液(pH7.0)稀释至1 mg/mL后,置于UV-1780紫外分光光度计中测定紫外吸收光谱,设置扫描波长范围为250~350 nm,扫描速率为2 nm/min。
1.2.8 内源荧光强度的测定
参考Chen等[16]的方法进行测定,取处理后肌原纤维蛋白溶于磷酸盐缓冲液中(0.01 mol/mL Na2HPO4,0.1 mol/L KCl,pH7.0)并将蛋白浓度依次调整为0.70 mol/mL。以PBS缓冲液为空白溶液,设置荧光光谱的激发波长为280 nm,扫描波长为300~450 nm,狭缝宽度为5 nm,扫描速度为600 nm/min。
1.2.9 聚丙烯酰胺凝胶电泳(SDS-PAGE)
参考Dara等[17]的方法并稍作改动:将冻干的MP粉末,加入生理盐水溶解至蛋白浓度为1 mg/mL后,同上样缓冲液以4:1比例混合,于100 ℃水浴加热10 min。提前预制的5%浓缩胶和12%分离胶,制样完毕后,在预制胶的孔中加入15 μL样品,先在60 V电压下与Tricine SDS缓冲液中通电30 min,后调电压至120 V继续通电40 min。电泳结束后,取下胶片,考马斯亮蓝染色液染色15 min后,再用脱色液进行脱色,最后用凝胶成像系统对胶片进行拍照。
1.2.10 MP微观结构的测定
采用冷场发射扫描电镜(SU-8600)观察BMP冻干粉的微观结构。不同处理的冻干粉进行相同的破碎处理。将MP粉末均匀粘附在导电胶粘剂上,喷金后观察。
1.3 数据处理
所有数据进行三次重复的独立试验并以平均值±标准差来表示。使用SPSS 22.0软件对数据进行统计分析,通过 Origin 9.0进行绘图。并通过单因素方差分析(ANOVA)和邓肯检验(Duncan)分析平均值之间的显著性差异(P<0.05)。
2. 结果与分析
2.1 超高压处理时间对肌原纤维蛋白表面疏水性的影响
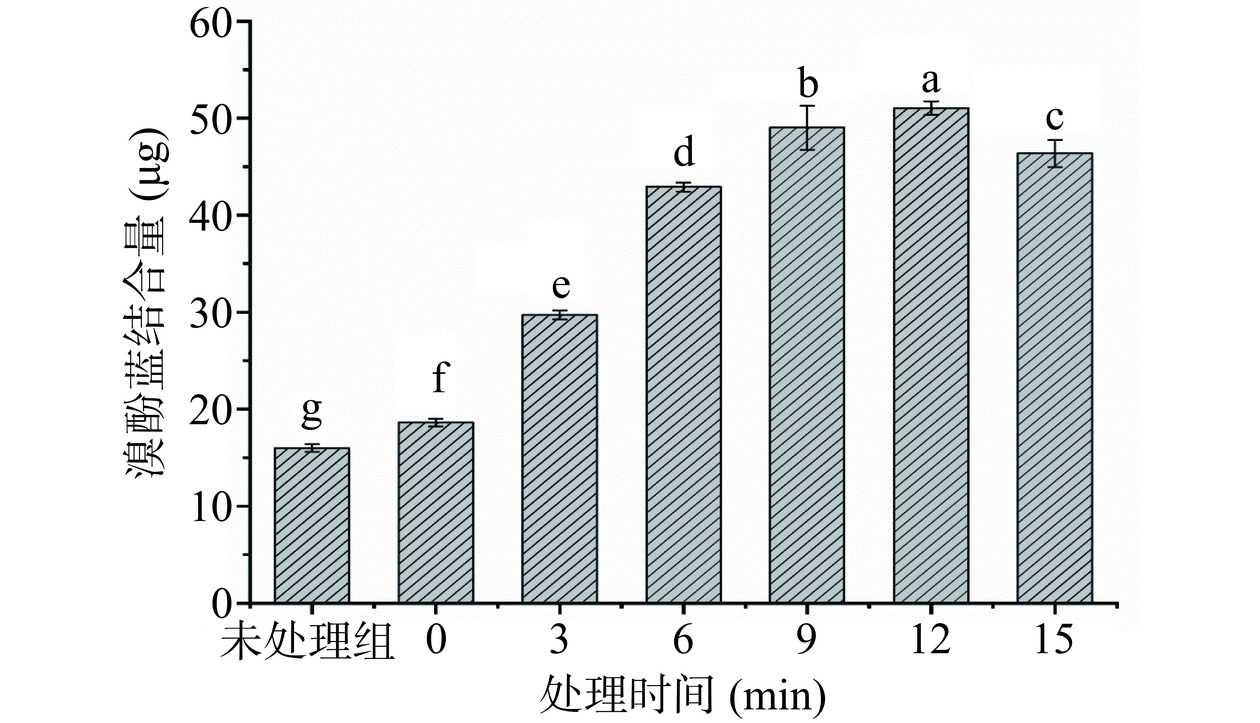
表面疏水性是蛋白质表面和极性溶液中疏水基团接触的主要表征参数,可反映出蛋白质分子微观构象的变化,影响蛋白质三级结构的形成和稳定[17]。如图1所示,与未处理组相比,鸭腿肌原纤维蛋白经加热后,其表面疏水性会显著提升(P<0.05)。由于加热会破坏蛋白质结构稳定性,使MP变性结构展开,导致疏水性残基暴露程度增加。而在超高压处理过程中MP的表面疏水性随着处理时间的延长呈显著增大的趋势(P<0.05),其中12 min疏水性指数达到最大值,比0 min组提升了173%。这可能是由于高压环境下,蛋白质变性导致构象改变,从而使得蛋白质内部隐藏的疏水氨基酸残基暴露在蛋白质表面,最终使表面疏水性增加[18]。然而,随着处理时间的延长,蛋白质表面疏水性显著减小(P<0.05)。这可能是高压处理时间过长,使MP结构进一步折叠,暴露的疏水性基团被重新掩盖,因此表面疏水性降低[19]。而且,处理时间过长蛋白质的构象结构因MP的拉伸和展开而变得松散和不稳定,这不利于溴酚蓝与蛋白质之间的疏水相互作用。
2.2 超高压处理时间对肌原纤维蛋白总巯基和游离巯基的影响
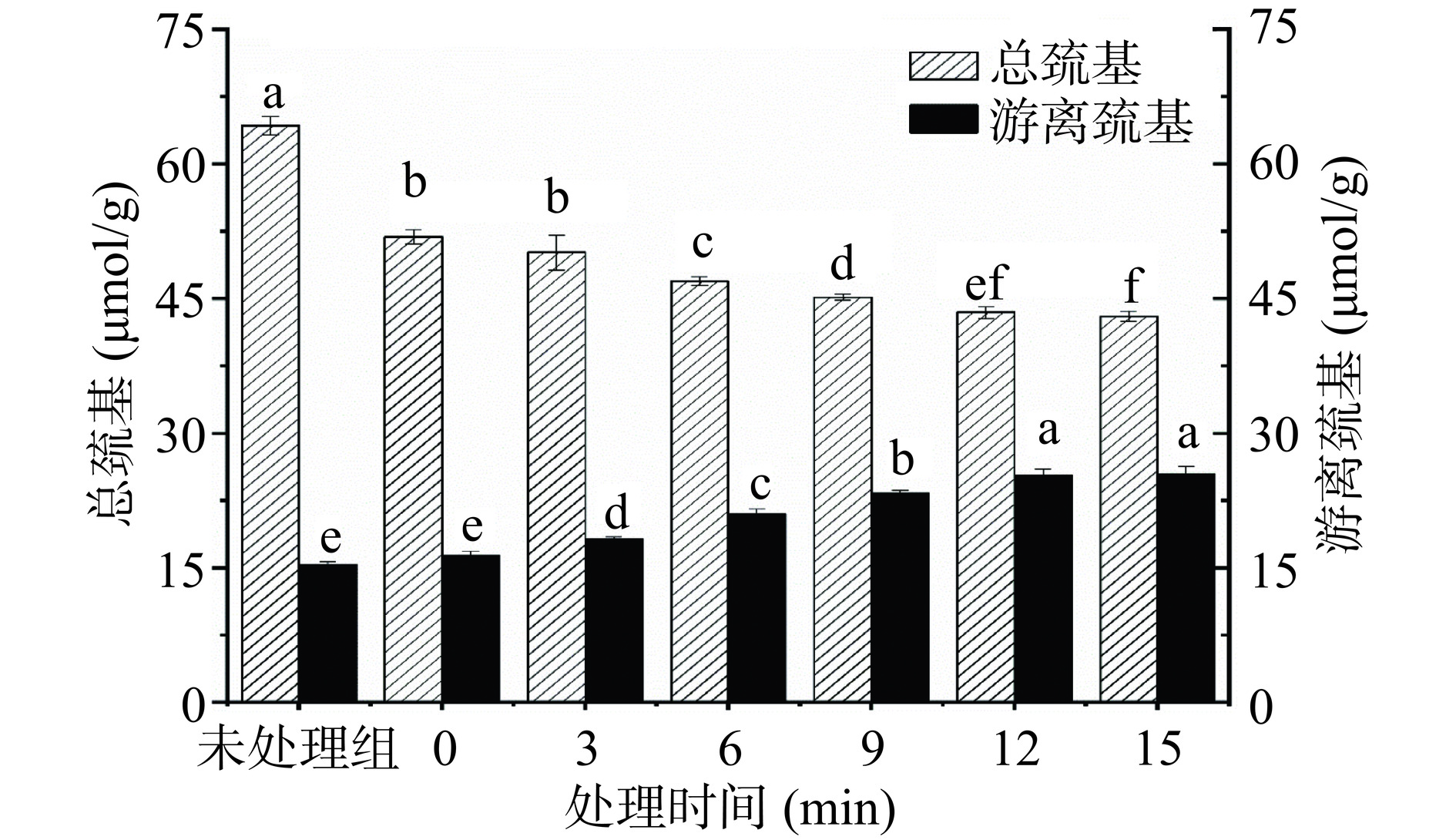
巯基含量的变化通常可以反应肌原纤维蛋白构象的变化[20]。如图2所示,与未处理组相比,加热后的鸭腿肌原纤维蛋白的总巯基含量减少了19.24%,这可能是因为热处理会加速鸭腿肌原纤维蛋白的氧化,蛋白质中的巯基氧化成二硫键,导致总巯基含量下降。另外,加热后MP的游离巯基含量增加了6.87%。这可能因为加热过程中巯基物质从结合态转化为游离态,使得游离巯基含量增加[21]。而在超高压处理过程中随着处理时间的增加,总巯基含量显著下降(P<0.05),总巯基基团的减少可能是由于在高压的环境中更多埋藏的巯基基团暴露出来,使一些巯基进一步氧化为二硫键[22]。Leite 等[23]也发现超高压处理过后的香肠总巯基含量下降了36%。由图2所示,随着超高压处理时间的增加,游离巯基含量呈显著上升的趋势(P<0.05),与0 min相比,15 min时游离巯基含量提升了65.89%。游离巯基含量的增加可能是由于在高压环境下蛋白质分子被拉伸和展开,导致蛋白质内部的巯基基团暴露出来。此外,蛋白质内巯基主要是多肽中半胱氨酸残基上的巯基基团,Ellman试剂难以接近,因此无法与Ellman试剂反应,而在外部高压改变了蛋白质构象结构,从而暴露和激活了巯基基团,因此可以被Ellman试剂检测到,导致游离巯基含量增加。
2.3 超高压处理时间对肌原纤维蛋白化学作用力的影响
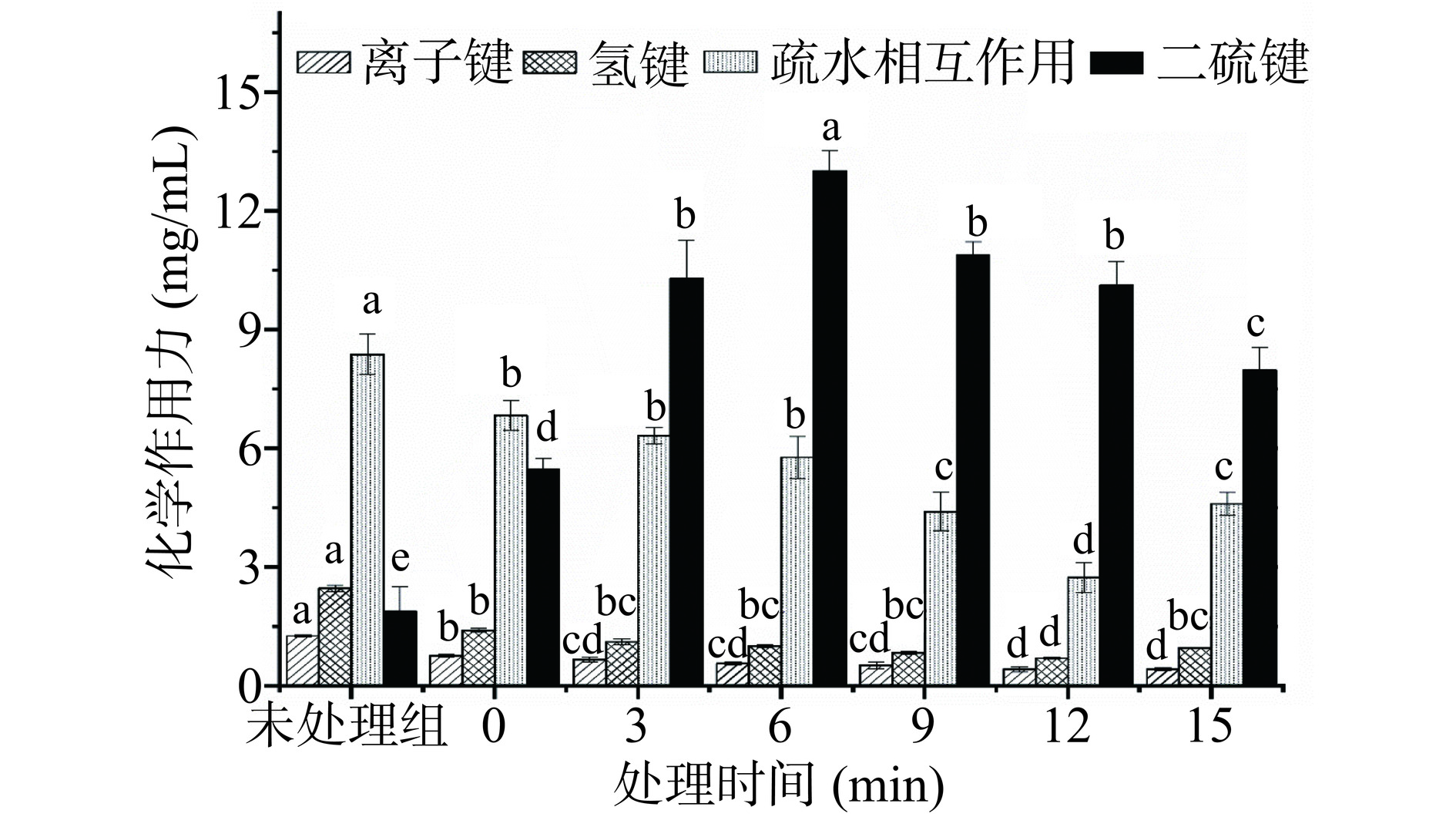
超高压可以通过解离非共价键、离子键、氢键和疏水键的方式,改变MP的二级、三级结构[24]。如图3所示,与未处理组相比,鸭腿肌原纤维蛋白经加热后,离子键含量下降了39.3%,离子键是弱相互作用,容易被高温破坏。MP中氢键含量下降了43.1%,氢键含量下降主要是由于高温破坏了维持蛋白质空间构象。疏水相互作用力下降了18%,这可能是加热过程中非极性氨基酸重新嵌入蛋白质聚集体内部,导致了疏水作用力的下降[25]。而二硫键含量增加了189.2%。这可能是在加热过程中,蛋白质中的巯基容易被氧化,形成二硫键。在超高压处理过程中随着处理时间的延长,离子键含量呈显著下降的趋势,离子键本质上是静电相互作用,由于静电相互作用对高压比较敏感,因此,在压力的作用下蛋白质的离子键含量会随着处理时间的增加而下降[26]。氢键的含量显著减少(P<0.05),这可能因为高压会破坏蛋白质分子间氢键结构,导致氢键含量减少。此外,在超高压处理过程中,水分子会进入亚基的结合区域,从而影响疏水相互作用,破坏亚基之间连接的稳定性,导致疏水相互作用力下降。图中二硫键的数量呈先增加后减少的趋势。处理时间在6 min前,二硫键含量随处理时间延长,逐渐增加,可能是由于蛋白质在高压环境下,巯基转化为二硫键,这与上述蛋白质的巯基含量变化结果(图2)一致。但是由于处理时间的进一步增加,6 min后,蛋白质分子内部的二硫键会发生断裂或重新排列[27],使二硫键数量下降。因此,图中二硫键的数量呈先上升后下降的趋势。
2.4 超高压处理时间对肌原纤维蛋白二级结构的影响
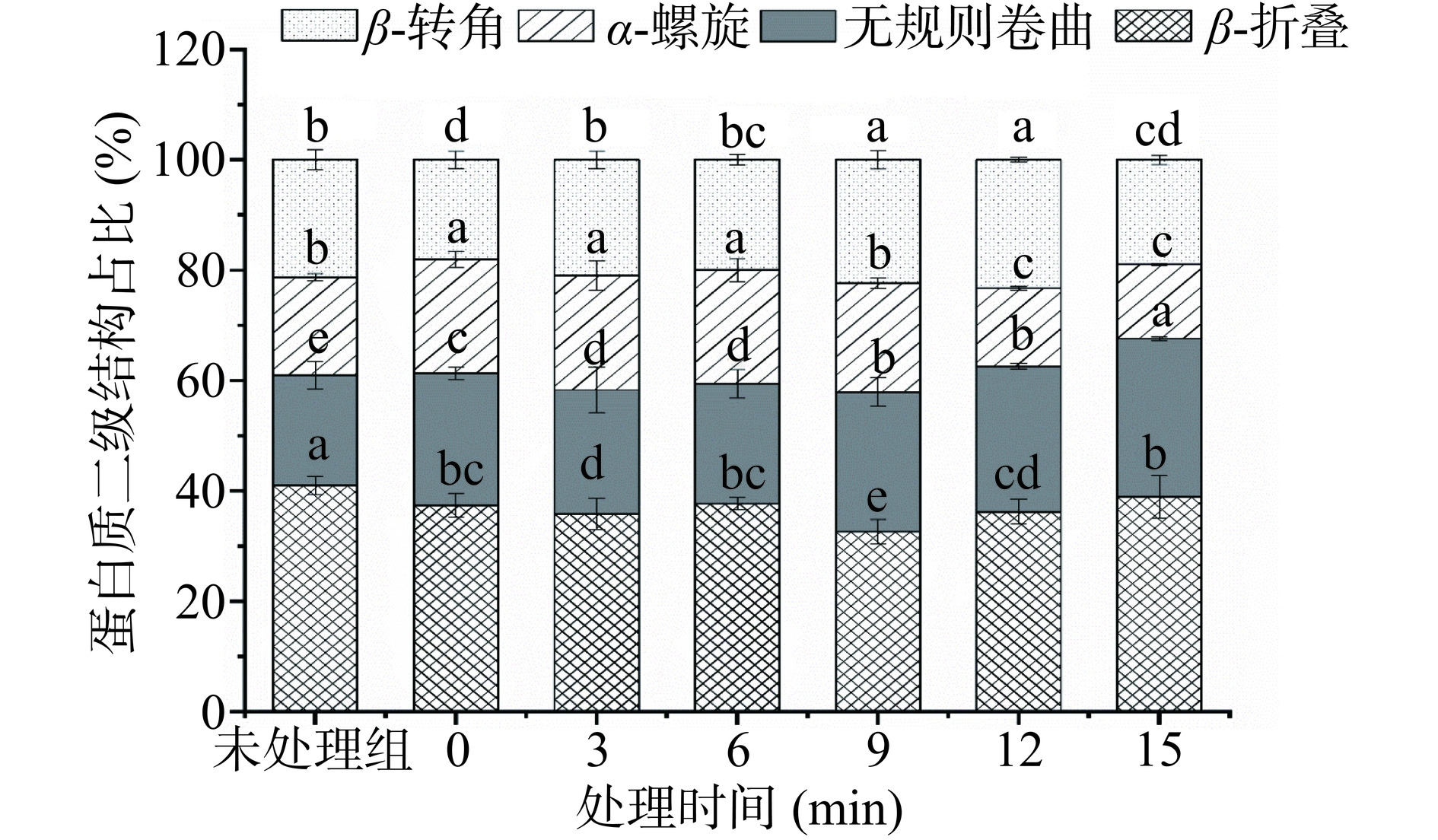
蛋白质的二级结构是指分子中多肽链的周期性折叠方式,主要有4种空间构型,包括α-螺旋、β-折叠、β-转角和无规卷曲。通过傅里叶交换红外光谱(FT-IR)可对其进行检测分析[28]。由图4可知,未处理的MP结构以β-折叠为主,占40.99%,其他三类β-转角、无规则卷曲、α-螺旋分别占21.26%、19.93%、17.80%。与未处理组相比,热处理后的鸭腿肌原纤维蛋白的β-转角减少了15.14%,这可能是因为在加热的环境中β-转角变得不稳定,容易发生转化或破坏。α-螺旋增加了15.86%,这可能是因为加热导致了蛋白质的天然结构被破坏,部分β-折叠结构可能转化为α-螺旋结构。无规则卷曲含量增加了20.07%,这可能是由于加热后蛋白质部分有序结构转化为了无规则卷曲结构,导致无规则卷曲含量增加。β-折叠含量减少了8.79%,在加热过程中,蛋白质内部的氢键被破坏,从而影响β-折叠结构的稳定性。此外,蛋白质变性过程可能导致β-折叠结构转化为其他结构[29]。由图4可知,在超高压处理过程中,β-转角含量呈先上升后下降的趋势,β-转角含量的增加可能是由于蛋白质结构的重排。然而,当处理时间增大时,β-转角结构可能受到破坏或转化为其他构象,因此含量降低。α-螺旋含量呈显著下降的趋势(P<0.05),α-螺旋含量减少可能是由于氢键的破坏,MP分子间与分子内N-H和C=O等基团形成的氢键作用力减弱,导致α-螺旋逐渐转化为相对无序β-转角和无规则卷曲[30]。除此以外,疏水基团(图1)、游离巯基(图2)和超高压诱导的MP的暴露也导致了α-螺旋的下降。无规则卷曲含量随处理时间的延长呈显著上升的趋势(P<0.05),这可能是因为超高压处理使蛋白质从有序的结构转变为无序的结构[31]。另外,超高压处理过程中α-螺旋转化为无规卷曲结构也促使其含量的增加。β-折叠的含量变化趋势与无规则卷曲相似,其含量的变化和氢键的破坏密切相关。这些结果表明超高压处理过程中MP的二级结构发生了明显的变化。Li等[32]在研究超高压对口虾蛄的MP结构的影响时也观测到超高压处理降低了口虾蛄的MP中α-螺旋含量。另外,Chen等[33]发现超高压处理增加了带鱼鱼糜MP中β-折叠和无规则卷曲含量。
2.5 超高压处理时间对肌原纤维蛋白紫外吸收光谱的影响
通过介于250至350 nm之间的紫外光谱,可以检测出色氨酸、酪氨酸残基微环境的改变,并揭示MP的三级结构特性[34]。热处理后的MP紫外吸收图谱如图5,与未处理组相比,热处理后MP的色氨酸残基(Trp)与酪氨酸残基(Tyr)的紫外吸收峰发生蓝移,并且紫外吸收强度升高。这可能是加热导致疏水基团的暴露,使Trp和Tyr进入更为疏水的环境中[35]。这些基团所处环境的非极性增加,从而使紫外的吸光度上升。同样,在超高压处理过程中,Trp与Tyr的紫外吸收峰随着处理时间的延长发生了蓝移,紫外吸收强度也随之升高。研究发现,肽链上Trp的吲哚环和Tyr的苯环π→π*跃迁产生了276 nm处的特征吸收峰[36]。从溶剂效应分析,表明了经超高压处理后,生色团所处的微环境由非极性转变为极性。由此可知,随处理时间的增加,MP展开,越来越多芳香族氨基酸残基暴露于蛋白质表面,表面疏水性增强,这与前面疏水性的研究结果一致。
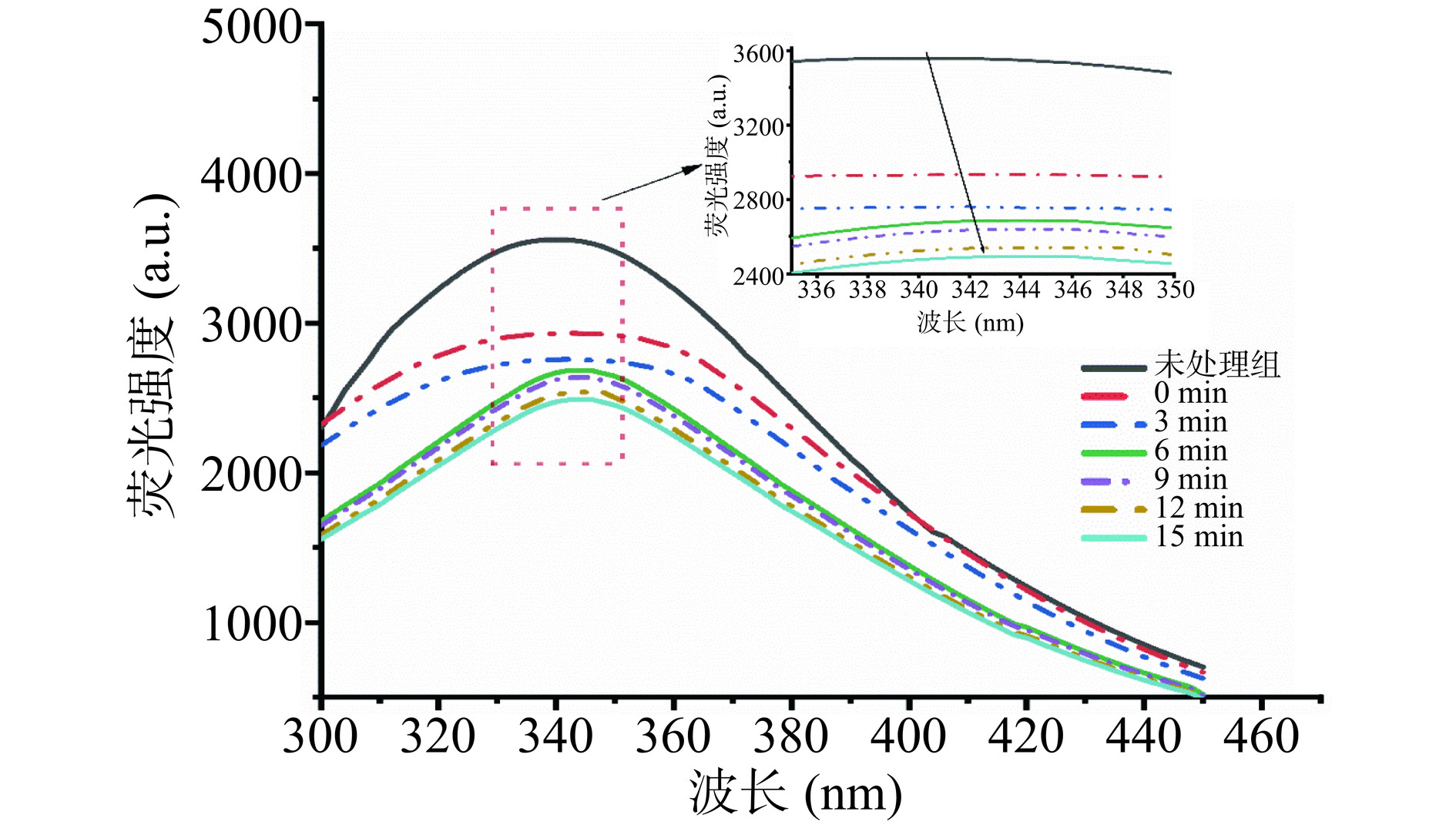
2.6 超高压处理时间对肌原纤维蛋白内源荧光强度的影响
分子内荧光光谱可以表征蛋白质三级结构的变化[37]。当蛋白质处于折叠状态时,色氨酸被包埋在蛋白质内部,内源荧光强度较高;随蛋白质结构展开,色氨酸暴露于蛋白质表面,内源荧光强度也随之降低[38]。如图6所示,加热后MP的荧光强度减小,可能是热处理使蛋白结构展开,阻碍了对色氨酸信号的检测,导致蛋白发生荧光淬灭[39]。在超高压处理过程中,随着处理时间的延长,MP内源荧光强度呈下降趋势,说明了超高压处理会使蛋白质发生去折叠,暴露出的Trp残基等发色基团导致了荧光强度降低,这与紫外光谱显示芳香族氨基酸残基暴露于蛋白质表面结果基本一致[37]。由表1可知,未处理组的鸭腿肌原纤维蛋白内源荧光峰值出现在340 nm,加热后的MP内源荧光峰值出现在342 nm,其中,15 min时荧光强度最弱,此时最大荧光发射值(λmax)红移至346 nm,红移现象表明在加压的环境下Trp残基向更亲水的环境移动,这可能是高压打开了肌原纤维蛋白的结构,导致Trp残基暴露[40]。然而,15 min时最大荧光值从12 min时的348 nm蓝移至346 nm,这可能是由于处理时间在较高的水平下(15 min)可促使暴露的Trp残基重新结合,而暴露的Trp残基被包埋,导致荧光值蓝移。这些结果与表面疏水性的变化基本一致。
表 1 超高压处理过程中肌原纤维蛋白最大荧光强度Table 1. Maximum fluorescence intensity of myofibrillar proteins during ultra-high pressure treatment组别 λmax(nm) FTmax 未处理 340 3558.02±2.80 0 min 342 2933.02±8.82 3 min 342 2759.49±9.17 6 min 344 2685.90±12.58 9 min 346 2637.49±10.59 12 min 348 2539.23±13.05 15 min 346 2490.10±10.04 注:最大荧光发射值(λmax),最大荧光强度(FTmax)。 2.7 超高压处理时间对肌原纤维蛋白SDS-PAGE的影响
SDS-PAGE凝胶电泳可以直观反映出含有亲核基团的氨基酸残基发生氧化和肽链断裂后,产生蛋白碎片或蛋白的聚合物的现象[41]。MP作为一类蛋白质群,有以下几条重要条带:肌球蛋白重链(MHC,200 kDa)、肌钙蛋白(TnT,37 kDa)。各处理组MP多种分子量蛋白的交联和降解情况如图7所示。从图中可以看出,与未处理组相比,加热后的鸭腿肌原纤维蛋白MHC条带颜色强度变浅,相似的肌原纤维蛋白TnT条带颜色强度也变浅,说明加热导致蛋白质发生降解。超高压处理后,肌球蛋白重链条带变浅,表明在超高压处理过程中,蛋白重链发生部分解聚,使蛋白质原本连接在一起的多肽链解离成单一的多肽链。同时,压力处理后的肌钙蛋白的条带颜色也有变浅,说明肌动蛋白结构也发生了解聚。Zhang 等[40]报道了高压处理对猪肉中蛋白质的影响,发现猪肉的肌球蛋白、α-肌动蛋白、肌动蛋白和肌钙蛋白T的能带强度随压力的增加而降低。Su等[42]报道了高压均质对MP聚集和降解的影响,发现高压均质处理MP时,部分条带会逐渐消失。王章存等[43]研究表明,超高压处理会引起肌原纤维蛋白降解,使其变为小分子的蛋白或者多肽甚至游离氨基酸,在电泳图谱上表现为蛋白条带变浅。这些研究结果与本研究结果基本一致,揭示了超高压处理对鸭腿肌原纤维蛋白的解聚和降解作用,进一步证实了超高压处理对蛋白质结构的显著影响。
2.8 超高压处理时间对肌原纤维蛋白微观结构的影响
不同处理组的肌原纤维蛋白冻干粉末的SEM结构如图8所示,在高倍率(3000倍)下,可以观察到未处理组的MP表面结构光滑、规则,蛋白质呈现球体结构,且分布均匀。而热处理后的MP呈现出不规整、断裂或碎片化的现象,这表明蛋白质的结构受到了热处理的影响。在超高压处理过程中,随着处理时间的延长,MP呈现均匀、松散的颗粒状结构。这些微观结构的变化可能是由于超高压破坏了MP分子之间的静电和疏水相互作用,从而减小了粒径,降低了蛋白质间的交联[44]。此外,超高压处理会导致MP表面较为粗糙,且相对疏松,出现蜂窝状结构(箭头方向)。这可能是因为超高压处理破坏了MP的二级结构,拉伸或者聚集了蛋白质分子。
3. 结论
本研究通过系统分析超高压处理过程中肌原纤维蛋白结构的变化,揭示了超高压处理对卤鸭腿嫩度的改善机制。研究结果表明,超高压处理使肌原纤维蛋白的微观结构遭到破坏,二级结构重排,三级结构发生改变。这些变化包括蛋白质表面疏水性先上升后下降,总巯基含量减少,游离巯基增加,二硫键显著增加,非共价键显著减少,以及蛋白质的α-螺旋含量下降和无规则卷曲含量上升。SDS-PAGE电泳和扫描电镜分析进一步证实了肌原纤维蛋白的解聚和颗粒尺寸减小及分布均匀。综上所述,本研究结果进一步证实了超高压处理可通过改变肌原纤维蛋白结构,显著改善真空低温卤制鸭腿的嫩度。该研究为超高压技术在肉制品加工中的应用提供了重要的理论基础和实验支持,为提升鸭肉产品品质提供了一条新的技术路径。但本研究未涉及对风味、营养成分等其他品质的综合分析。未来研究应通过优化处理参数,系统评估超高压对其风味变化影响机制及超高压处理过程中营养成分的稳定性,全面分析感官与营养品质,以全面提升鸭肉产品的整体质量。
-
表 1 超高压处理过程中肌原纤维蛋白最大荧光强度
Table 1 Maximum fluorescence intensity of myofibrillar proteins during ultra-high pressure treatment
组别 λmax(nm) FTmax 未处理 340 3558.02±2.80 0 min 342 2933.02±8.82 3 min 342 2759.49±9.17 6 min 344 2685.90±12.58 9 min 346 2637.49±10.59 12 min 348 2539.23±13.05 15 min 346 2490.10±10.04 注:最大荧光发射值(λmax),最大荧光强度(FTmax)。 -
[1] SUN D, XU C, LIU Y, et al. The impact of different relative humidity levels on the production performance, slaughter performance, and meat quality of white pekin ducks aged 4 to 42 days[J]. Animals,2023,13(23):3711−3718. doi: 10.3390/ani13233711
[2] 刘雪, 闫晓明. 酱卤肉制品研究进展[J]. 现代食品,2022,28(23):10−15. [LIU X, YAN X M. Research progress of marinated pork with soy sauce products[J]. Modern Food,2022,28(23):10−15.] LIU X, YAN X M. Research progress of marinated pork with soy sauce products[J]. Modern Food, 2022, 28(23): 10−15.
[3] WANG T T, ZHU Y C, XIE Y, et al. Research progress on changes in structure and functional properties of myoglobin during processing and storage and their effect on the quality of meat products[J]. Journal of Food Science,2023,44(3):393−399.
[4] 姜志东, 张君怡, 马嘉欣, 等. 超高压杀菌效果及机制研究进展[J]. 食品安全质量检测学报,2023,14(5):145−154. [JIANG Z D, ZHANG J Y, MA J X, et al. Research progress on the microbial inactivation effect and mechanism of high hydrostatic pressure [J]. Journal of Food Safety and Quality,2023,14(5):145−154.] doi: 10.3969/j.issn.2095-0381.2023.5.spaqzljcjs202305020 JIANG Z D, ZHANG J Y, MA J X, et al. Research progress on the microbial inactivation effect and mechanism of high hydrostatic pressure [J]. Journal of Food Safety and Quality, 2023, 14(5): 145−154. doi: 10.3969/j.issn.2095-0381.2023.5.spaqzljcjs202305020
[5] 陈腊梅, 唐善虎, 李思宁, 等. 超高压处理对牦牛肉贮藏性能的影响[J]. 食品工业科技,2023,44(6):351−360. [CHEN L M, TANG S H, LI S N, et al. Effects of high-pressure processing on the storage properties of yak meat[J]. Science and Technology of Food Industry,2023,44(6):351−360.] CHEN L M, TANG S H, LI S N, et al. Effects of high-pressure processing on the storage properties of yak meat[J]. Science and Technology of Food Industry, 2023, 44(6): 351−360.
[6] 陈方雪, 王世哲, 邱文兴, 等. 超高压和辐照杀菌对鲈鱼冷藏期间品质的影响[J]. 肉类研究,2023,37(6):34−40. [CHEN F X, WANG S Z, QIU W X, et al. Effect of ultra-high pressure versus irradiation sterilization on the quality of largemouth bass (Micropterus salmoides) during refrigerated storage[J]. Meat Research,2023,37(6):34−40.] CHEN F X, WANG S Z, QIU W X, et al. Effect of ultra-high pressure versus irradiation sterilization on the quality of largemouth bass (Micropterus salmoides) during refrigerated storage[J]. Meat Research, 2023, 37(6): 34−40.
[7] 徐菲菲, 胡小松, 薛文通, 等. 超高压技术用于中式传统卤味制品的研究进展[J]. 中国食品学报,2022,22(7):428−442. [XU F F, HU X S, XUE W T, et al. Research progress of ultrahigh pressure technology for Chinese traditional marinated products[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(7):428−442.] XU F F, HU X S, XUE W T, et al. Research progress of ultrahigh pressure technology for Chinese traditional marinated products[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(7): 428−442.
[8] 季现秋, 罗欣, 朱立贤, 等. 新型牛肉嫩化技术研究进展[J]. 食品与发酵工业,2021,47(1):327−333. [[JI X Q, LUO X, ZHU L X, et al. Research progress on new beef tenderization technology[J]. Food and Fermentation Industries,2021,47(1):327−333.] [JI X Q, LUO X, ZHU L X, et al. Research progress on new beef tenderization technology[J]. Food and Fermentation Industries, 2021, 47(1): 327−333.
[9] 孙树远, 陈琪, 何静, 等. 木瓜蛋白酶与超高压技术嫩化驼肉的研究[J]. 中国食品学报,2023,23(4):239−250. [SUN S Y, CHEN Q, HE J, et al. Papain and ultrahigh-pressure technique for tenderizing camel meat[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(4):239−250.] SUN S Y, CHEN Q, HE J, et al. Papain and ultrahigh-pressure technique for tenderizing camel meat[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(4): 239−250.
[10] ZHANG H, TANG D, YANG H, et al. Effects of high hydrostatic pressure assisted enzymatic tenderization on goose meat texture and myofibril protein[J]. LWT,2023,184:114845. doi: 10.1016/j.lwt.2023.114845
[11] NATH K G, PANDISELVAM R, SUNIL C. High-pressure processing:Effect on textural properties of food-A review[J]. Journal of Food Engineering, 2023:111521.
[12] 万红兵, 李海鹏, 雷元华, 等. 烹饪熟度对牛肉肌原纤维蛋白结构特性和氧化特性的影响[J]. 食品科学,2021,42(13):17−25. [WAN H B, LI H P, LEI Y H, et al. Effect of degree of doneness on structural and oxidation properties of beef myofibrillar protein[J]. Food Science,2021,42(13):17−25.] doi: 10.7506/spkx1002-6630-20200717-229 WAN H B, LI H P, LEI Y H, et al. Effect of degree of doneness on structural and oxidation properties of beef myofibrillar protein[J]. Food Science, 2021, 42(13): 17−25. doi: 10.7506/spkx1002-6630-20200717-229
[13] 董智铭, 么紫瑶, 姜萩婉, 等. 超声功率对牛肉干品质及其肌原纤维蛋白结构的影响[J]. 食品科学,2023,44(19):27−34. [DONG Z M, YAO Z Y, JIANG Q W, et al. Effect of ultrasonic power on the quality and myofibrillar protein structure of beef jerky[J]. Food Science,2023,44(19):27−34.] doi: 10.7506/spkx1002-6630-20221018-174 DONG Z M, YAO Z Y, JIANG Q W, et al. Effect of ultrasonic power on the quality and myofibrillar protein structure of beef jerky[J]. Food Science, 2023, 44(19): 27−34. doi: 10.7506/spkx1002-6630-20221018-174
[14] 陈旭, 余璐涵, 蔡茜茜, 等. 低温冷链贮藏对鱼糜凝胶化学作用力和肌原纤维蛋白结构及功能特性的影响[J]. 食品科学,2022,43(23):194−201. [CHEN X, YU L H, CAI X X, et al. Effect of cold chain storage on chemical interactions of surimi gel and structural and functional properties of myofibrillar protein[J]. Food Science,2022,43(23):194−201.] CHEN X, YU L H, CAI X X, et al. Effect of cold chain storage on chemical interactions of surimi gel and structural and functional properties of myofibrillar protein[J]. Food Science, 2022, 43(23): 194−201.
[15] ZHANG R, PANG X, LU J, et al. Effect of high intensity ultrasound pretreatment on functional and structural properties of micellar casein concentrates[J]. Ultrasonics Sonochemistry,2018,47:10−16. doi: 10.1016/j.ultsonch.2018.04.011
[16] CHEN M, WANG L, XIE B, et al. Effects of high-pressure treatments (ultra-high hydrostatic pressure and high-pressure homogenization) on bighead carp (Aristichthys nobilis) myofibrillar protein native state and its hydrolysate[J]. Food and Bioprocess Technology,2022,15(10):2252−2266. doi: 10.1007/s11947-022-02878-1
[17] DARA P K, GEETHA A, MOHANTY U, et al. Extraction and characterization of myofibrillar proteins from different meat sources:A comparative study[J]. Journal of Bioresources and Bioproducts,2021,6(4):367−378. doi: 10.1016/j.jobab.2021.04.004
[18] XU M, NI X, LIU Q, et al. Ultra-high pressure improved gelation and digestive properties of Tai Lake whitebait myofibrillar protein[J]. Food Chemistry:X,2023:101061.
[19] 甄宗圆, 李志杰, 梁迪, 等. 超高压技术在肉类杀菌及品质改善中的应用进展[J]. 现代食品科技,2021,37(8):350−356. [ZHEN Z Y, LI Z J, LIANG D, et al. Recent application of ultrahigh pressure processing for meat sterilization and quality improvement[J]. Modern Food Science and Technology,2021,37(8):350−356.] ZHEN Z Y, LI Z J, LIANG D, et al. Recent application of ultrahigh pressure processing for meat sterilization and quality improvement[J]. Modern Food Science and Technology, 2021, 37(8): 350−356.
[20] DU X, LI H, NUERJIANG M, et al. Influence of repeated freeze–thaw treatments on the functional and structural properties of myofibrillar protein from mirror carp (Cyprinus carpio L.)[J]. Food Biophysics,2021,16(4):492−501. doi: 10.1007/s11483-021-09689-5
[21] LI H, ZHAO T, LI H, et al. Effect of heat treatment on the property, structure, and aggregation of skim milk proteins[J]. Frontiers in Nutrition,2021,8:714869. doi: 10.3389/fnut.2021.714869
[22] WANG C, WANG J, ZHU D, et al. Effect of dynamic ultra-high pressure homogenization on the structure and functional properties of whey protein[J]. Journal of Food Science and Technology,2020,57:1301−1309. doi: 10.1007/s13197-019-04164-z
[23] LEITE L S, MOREIRA F K, MATTOSO L H, et al. Electrostatic interactions regulate the physical properties of gelatin-cellulose nanocrystals nanocomposite films intended for biodegradable packaging[J]. Food Hydrocolloids,2021,113:106424. doi: 10.1016/j.foodhyd.2020.106424
[24] GALANAKIS C M. Functionality of food components and emerging technologies[J]. Foods,2021,10(1):128−134. doi: 10.3390/foods10010128
[25] ZHOU K, CHEN H, ZHANG S, et al. Disulfide mediated reversible two-dimensional self-assembly of protein nanocages[J]. Chemical Communications,2019,55(52):7510−7513. doi: 10.1039/C9CC03085A
[26] HÖGG E, BOGUSLAWSKI S, SEVENICH R, et al. Influence of elevated temperature and high pressure treatments on structural changes of soy protein concentrate[J]. Innovative Food Science & Emerging Technologies,2023,91:103524.
[27] ZHANG Y, ZHANG X, ZHANG Z, et al. Effect of high hydrostatic pressure treatment on the structure and physicochemical properties of millet gliadin[J]. LWT,2022,154:112755. doi: 10.1016/j.lwt.2021.112755
[28] SUWANVICHANEE C, SINPRU P, PROMKHUN K, et al. Effects of β-alanine and L-histidine supplementation on carnosine contents in and quality and secondary structure of proteins in slow-growing Korat chicken meat[J]. Poultry Science,2022,101(5):101776. doi: 10.1016/j.psj.2022.101776
[29] 齐宝坤, 赵城彬, 李杨, 等. 热处理对大豆11S球蛋白溶解性和二级结构的影响[J]. 食品科学,2018,39(22):39−44. [QI B K, ZHAO C B, LI Y, et al. Effect of heat treatment on solubility and secondary structure of soybean 11Sglycinin[J]. Food Science,2018,39(22):39−44.] doi: 10.7506/spkx1002-6630-201822007 QI B K, ZHAO C B, LI Y, et al. Effect of heat treatment on solubility and secondary structure of soybean 11Sglycinin[J]. Food Science, 2018, 39(22): 39−44. doi: 10.7506/spkx1002-6630-201822007
[30] ZHANG M, LI C, ZHANG Y, et al. Impact of salt content and hydrogen peroxide-induced oxidative stress on protein oxidation, conformational/morphological changes, and micro-rheological properties of porcine myofibrillar proteins[J]. Food Chemistry,2022,370:131074. doi: 10.1016/j.foodchem.2021.131074
[31] 李长乐, 王琛, 郭全友. 超声波, 超高压处理对鲣鱼肌原纤维蛋白功能性质的影响[J]. 食品与发酵工业,2018,44(7):96−101. [LI C L, WANG C, GUO Q Y, et al. Effect of ultrasonic and ultrahigh pressure on the functional properties of skipjack myofibrillar protein[J]. Food and Fermentation Industries,2018,44(7):96−101.] LI C L, WANG C, GUO Q Y, et al. Effect of ultrasonic and ultrahigh pressure on the functional properties of skipjack myofibrillar protein[J]. Food and Fermentation Industries, 2018, 44(7): 96−101.
[32] LI Gaoshang, CHEN Yanting, XUAN Shifen, et al. Effects of ultra-high pressure on the biochemical properties and secondary structure of myofibrillar protein from Oratosquilla oratoria muscle[J]. Journal of Food Process Engineering,2019,42(6):e13231. doi: 10.1111/jfpe.13231
[33] CHEN Y, XU A, YANG R, et al. Myofibrillar protein structure and gel properties of trichiurus haumela surimi subjected to high pressure or high pressure synergistic heat[J]. Food and Bioprocess Technology,2020,13:589−598. doi: 10.1007/s11947-020-02416-x
[34] PENG Z, ZHU M, ZHANG J, et al. Physicochemical and structural changes in myofibrillar proteins from porcine longissimus dorsi subjected to microwave combined with air convection thawing treatment[J]. Food Chemistry,2021,343:128412. doi: 10.1016/j.foodchem.2020.128412
[35] WEN P, XIA C, ZHANG L, et al. Effects of different dry heating temperatures on the spatial structure and amino acid residue side-chain oxidative modification of soybean isolated proteins[J]. Food Chemistry,2023,405:134795. doi: 10.1016/j.foodchem.2022.134795
[36] NAGATOMO S, NAGAI M, OGURA T, et al. Near-UV circular dichroism and UV resonance Raman spectra of tryptophan residues as a structural marker of proteins[J]. The Journal of Physical Chemistry B,2013,117(32):9343−9353. doi: 10.1021/jp404685x
[37] LIU Z, GUO Z, WU D, et al. High-pressure homogenization influences the functional properties of protein from oyster (Crassostrea gigas)[J]. LWT,2021,151:112107. doi: 10.1016/j.lwt.2021.112107
[38] 李春翼, 王启明, 张驰, 等. 热诱导对麦醇溶蛋白-芦丁相互作用及其乳化特性的影响[J]. 食品科学,2022,12(12):27−34. [LI C Y, WANG Q M, ZHANG C, et al. Influence of thermal induction on whey solubilizing protein-rutin interaction and its emulsification properties[J]. Food Science,2022,12(12):27−34.] LI C Y, WANG Q M, ZHANG C, et al. Influence of thermal induction on whey solubilizing protein-rutin interaction and its emulsification properties[J]. Food Science, 2022, 12(12): 27−34.
[39] SHENG L, SU P, HAN K, et al. Synthesis and structural characterization of lysozyme–pullulan conjugates obtained by the Maillard reaction[J]. Food Hydrocolloids,2017,71:1−7. doi: 10.1016/j.foodhyd.2017.04.026
[40] ZHANG K, WEN Q, LI T, et al. Comparison of interaction mechanism between chlorogenic acid/luteolin and glutenin/gliadin by multi-spectroscopic and thermodynamic methods[J]. Journal of Molecular Structure,2021,1246:131219. doi: 10.1016/j.molstruc.2021.131219
[41] LIAO G, KANG J, ZHANG H, et al. Covalent and non-covalent interaction of myofibrillar protein and cyanidin-3-O-glucoside:Focus on structure, binding sites and in vitro digestion properties[J]. Journal of the Science of Food and Agriculture,2024,104(2):905−915. doi: 10.1002/jsfa.12978
[42] SU C, HE Z, WANG Z, et al. Aggregation and deaggregation:The effect of high-pressure homogenization cycles on myofibrillar proteins aqueous solution[J]. International Journal of Biological Macromolecules,2021,189(31):567−576.
[43] 王章存, 徐贤. 超高压处理对蛋白质结构及功能性质影响[J]. 粮食与油脂, 2007(11):10−12. [WANG Z C, XU X. Effect of ultrahigh pressure disposal on protein structure and property[J], Cereals & Oils. 2007(11):10−12.] WANG Z C, XU X. Effect of ultrahigh pressure disposal on protein structure and property[J], Cereals & Oils. 2007(11): 10−12.
[44] ZHAO F, ZHANG D, LI X, et al. High-pressure homogenization pretreatment before enzymolysis of soy protein isolate:The effect of pressure level on aggregation and structural conformations of the protein[J]. Molecules,2018,23(7):1775−1779. doi: 10.3390/molecules23071775





 下载:
下载:



 下载:
下载:



