Spectroscopic Study on the Effect of Glutamate on the Interaction Mechanism between Brilliant Blue and Bovine Serum Albumin
-
摘要: 为了了解谷氨酸(Glu)对食品添加剂亮蓝(BB)与载体蛋白之间结合机制的影响,本文从结合作用力、结合距离、结合位点,以及蛋白质构象变化等方面研究了Glu存在时BB与牛血清白蛋白(BSA)之间的相互作用机制。实验结果表明,BB通过静态猝灭的方式猝灭BSA的内源荧光,但在Glu存在下,BB对BSA的荧光猝灭常数由(8.31±0.52)×104 L·mol−1减小至(5.43±0.04)×104 L·mol−1,结合常数由(1.35±0.04)×105 L·mol−1减小至(3.81±0.20)×104 L·mol−1(313 K),即Glu削弱了BB与BSA的结合。此外,Glu还会缩短BB与BSA之间的结合距离(由3.49±0.02 nm变为3.45±0.04 nm),减小BB对BSA二级结构的改变(α-螺旋含量由36.09%±0.01%变为42.14%±0.01%([BSA-Glu]-BB为1:20:1)),即Glu在一定程度上阻止了BB对BSA构象的干扰。Abstract: To understand the effect of glutamate (Glu) on the binding mechanism between food additive brilliant blue (BB) and the carrier protein, the interaction mechanism between BB and bovine serum albumin (BSA) in the presence of Glu were studied considering binding force, binding distance, binding site, and protein conformational change. The experimental results showed that BB quenched the endogenous fluorescence of BSA via static quenching. However, the fluorescence quenching constant of BB towards BSA decreased from (8.31±0.52)×104 L·mol−1 to (5.43±0.04)×104 L·mol−1 in the presence of Glu, and the binding constant decreased from (1.35±0.04)×105 L·mol−1 to (3.81±0.20)×104 L·mol−1 (at 313 K), indicating that Glu weakened the binding of BB to BSA. Additionally, Glu also shortened the binding distance between BB and BSA (from 3.49±0.02 nm to 3.45±0.04 nm) and reduced the alteration of BSA's secondary structure by BB (the α-helix content changed from 36.09%±0.01% to 42.14%±0.01% (when the [BSA-Glu]-BB was 1:20:1)), indicating that Glu partially prevented the conformational disturbance of BSA by BB.
-
Keywords:
- brilliant blue /
- bovine serum albumin /
- glutamate /
- interaction mechanism
-
亮蓝(BB)是一种被广泛用于碳酸饮料、糖果、糕点等食品的着色剂[1]。然而有研究表明,过量摄入BB会引起过敏、哮喘,甚至癌症[2]。BB属于偶氮类化合物,在偶氮还原酶的作用下可能分解产生芳香胺类化合物,因偶氮化合物的还原产物具有毒性和致突变性,长期摄入即使低剂量也存在致癌的可能性[3]。BB的每日允许摄入量(ADI)为0~12.5 mg·kg−1(体重)/d[4]。 对于食品添加剂的毒理学评价包括其与血清白蛋白的相互作用[5]。血清白蛋白能够结合并运输许多外源性物质[6],牛血清白蛋白(BSA)与人血清白蛋白(HSA)是同源蛋白,并且具有价格低和性质稳定等优点,是食品添加剂与蛋白质作用研究的常用模型蛋白[7]。蛋白质的空间结构是其生物活性的基础,蛋白质的构象稳定性是其活性稳定性的先决条件[8],蛋白质的构象与其功能密切相关[9],生物医学研究表明,蛋白质构象异常会引起帕金森病、阿尔茨海默病、亨廷顿病和子痫前期等[10]。
近五年来,国内外对着色剂与血清白蛋白作用机制进行了大量的研究。王军等[11]研究表明柠檬黄与BSA有很强的结合能力;柠檬黄与BSA的结合使BSA的构象发生改变。Jana等[12]研究证明靛蓝胭脂红猝灭了HSA 和 BSA的荧光,并诱导了两种SA的二级结构变化。曹丽君等[13]的研究证实了BB与BSA之间存在相互作用,这种相互作用能够诱导BSA的构象发生改变。然而,关于如何有效减弱BB对BSA二级结构和氨基酸微环境造成的不良影响,从而稳定蛋白质的结构和功能仍需要进一步的研究。
考虑到谷氨酸(Glu)作为构成蛋白质的氨基酸之一[14],不仅参与蛋白质代谢[15],影响蛋白质的合成[16],还有助于稳定其四级结构[17]。本文重点研究了Glu在减弱BB对BSA不良影响方面的作用。通过荧光光谱法、紫外光谱法、红外光谱法等多种光谱法,从定性和定量两个角度深入分析了Glu对BB与BSA相互作用的影响,以及在稳定BSA构象中的作用。实验结果对于探索减弱BB对BSA不良影响的有效方法,食品中BB的合理使用,降低BB对人体健康的潜在风险以及确保食品的营养价值和安全性等方面提供了有价值的参考。
1. 材料与方法
1.1 材料与仪器
BSA(分析纯) 北京索莱宝科技有限公司;BB、Glu(分析纯) 上海毕得科技有限公司。
F-380型荧光分光光度计 天津港东科技股份有限公司;UV2800型紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;OPUS型傅里叶变换红外光谱仪 德国布鲁克分析仪器公司。
1.2 实验方法
1.2.1 溶液的配制
BSA溶液用Tris-HCl缓冲溶液(pH7.4)配制;BB溶液和Glu溶液用去离子水配制。
1.2.2 荧光光谱的测定
二元体系实验[18]:分别在298、309 和313 K温度下,向BSA溶液(1.0×10−6 mol·L−1)中滴加不同浓度的BB或Glu溶液(0、0.5×10−5、1.0×10−5、2.0×10−5、2.5×10−5、3.0×10−5、4.0×10−5 mol·L−1),充分混匀后记录荧光发射光谱。λex=280 nm,λem=290~490 nm,激发和发射狭缝均设置为5 nm,扫描速度1200 nm·min−1,PMT电压700 V。
三元体系实验:分别在298、309 和313 K温度下,将BSA溶液(1.0×10−6 mol·L−1)和Glu溶液(2.0×10−5 mol·L−1)充分混匀,再加入不同浓度的BB溶液(0、0.5×10−5、1.0×10−5、2.0×10−5、2.5×10−5、3.0×10−5、4.0×10−5 mol·L−1),记录混合溶液的荧光光谱,测量条件同二元体系实验。
根据公式(1),用BB(或Glu)在λex(280 nm)和λem(357 nm)处的吸光度(Aex和Aem)对测定的荧光强度(Fobs)进行荧光校正(Fcor),以消除内滤效应的影响[19],计算公式如下:
Fcor=Fobs×eAex+Aem2 (1) 式中,Fobs为测定的荧光强度;Fcor为校正后的荧光强度;Aex为λex处的吸光度;Aem为λem处的吸光度。
1.2.3 紫外光谱的测定
二元体系实验:向BSA溶液(1.0×10−6 mol·L−1)中加入不同浓度的BB(或Glu)溶液(0、0.5×10−5、1.0×10−5、2.0×10−5、2.5×10−5、3.0×10−5、4.0×10−5 mol·L−1),在200~300 nm范围内记录与BB/Glu作用前后BSA的紫外光谱。
三元体系实验:将BSA溶液(1.0×10−6 mol·L−1)与Glu溶液(2.0×10−5 mol·L−1)充分混匀,加入不同浓度的BB溶液(0、0.5×10−5、1.0×10−5、2.0×10−5、2.5×10−5、3.0×10−5、4.0×10−5 mol·L−1),仪器测量条件同二元体系实验。
1.2.4 同步荧光光谱的测定
二元体系实验:向BSA溶液(1.0×10−6 mol·L−1)中加入不同浓度的BB溶液(0、0.5×10−5、1.0×10−5、2.0×10−5、2.5×10−5、3.0×10−5、4.0×10−5 mol·L−1),记录混合溶液的同步荧光光谱。设置恒定波长间隔分别为15 nm和60 nm,测量范围为255~325 nm,激发和发射狭缝宽度设均设置为5 nm。
三元体系实验:将BSA溶液(1.0×10−6 mol·L−1)和Glu溶液(2.0×10−5 mol·L−1)充分混匀,再加入不同浓度的BB溶液(0、0.5×10−5、1.0×10−5、2.0×10−5、2.5×10−5、3.0×10−5、4.0×10−5 mol·L−1),记录混合溶液的同步荧光光谱,仪器测量条件同二元体系实验。
1.2.5 三维荧光光谱的测定
二元体系实验:向BSA溶液(5.0×10−6 mol·L−1)中滴加BB(或Glu)溶液(5.0×10−6 mol·L−1),充分混匀后记录三维荧光光谱。λex为180~480 nm,增量5 nm;λem为200~550 nm,增量2 nm,其它仪器条件同“1.2.2荧光光谱的测定”。
三元体系实验:将BSA溶液(5.0×10−6 mol·L−1)与Glu溶液(1.0×10−4 mol·L−1)充分混匀,再加入BB溶液(5.0×10−6 mol·L−1),记录混合溶液的三维荧光光谱,仪器测量条件同二元体系实验。
1.2.6 傅里叶变换红外光谱的测定
二元体系实验:向BSA溶液(5.0×10−6 mol·L−1)中滴加BB(或Glu)溶液(5.0×10−6 mol·L−1),充分混匀后记录红外光谱,分辨率4 cm−1,扫描64次。所有的红外光谱都用二阶导数拟合,通过高斯函数得到BSA各二级结构的含量。
三元体系实验:将BSA溶液(5.0×10−6 mol·L−1)与Glu溶液(5.0×10−6 mol·L−1或1.0×10−4 mol·L−1)充分混匀,再加入BB溶液(5.0×10−6 mol·L−1),记录混合溶液的红外光谱,仪器测量条件同二元体系实验。
1.2.7 位点竞争实验
将BSA溶液(1.0×10−6 mol·L−1)和华法林/布洛芬/血红素(1.0×10−6 mol·L−1)充分混匀,再加入不同浓度的BB(或Glu)溶液(0、0.5×10−5、1.0×10−5、2.0×10−5、2.5×10−5、3.0×10−5、4.0×10−5 mol·L−1),记录混合溶液的荧光光谱。测定条件同“1.2.2荧光光谱的测定”。
1.3 数据处理
实验平行三次测定,结果以平均值±标准偏差(SD)表示。采用SPSS 26.0进行方差分析,并使用ANOVA检验分析显著性差异(P<0.05),Origin 2021作图。
2. 结果与分析
2.1 BB与BSA作用的荧光光谱及Glu的影响
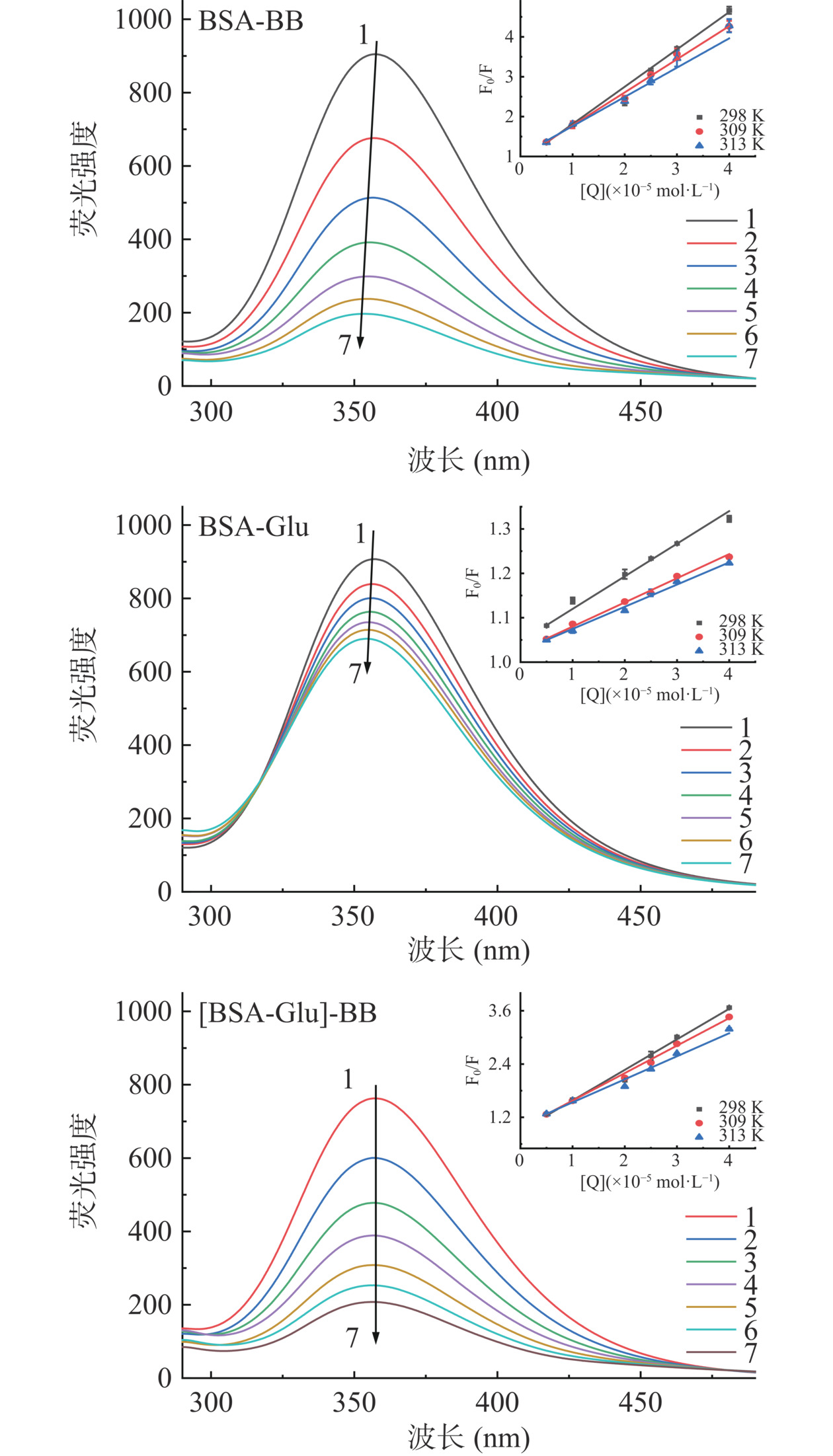
荧光光谱可用来研究BB与BSA的结合亲和力和结合作用力。BSA 在357 nm有较强荧光发射峰,其强度随BB(或Glu)浓度的增加而减小,浓度为4.0×10−5 mol·L−1的BB和Glu使其猝灭78.2%和23.9%,并且发生4 nm和2.4 nm的蓝移,光谱的变化表明BB和Glu都会与BSA发生相互作用,并诱导氨基酸残基周围微环境极性减小[20]。相比而言,Glu对BSA构象的影响较小。三元体系中,当Glu存在时,BB使BSA的荧光猝灭72.8%,且BSA发射光谱不再有明显的位移,说明 Glu在一定程度上影响了BB与BSA之间的相互作用。
BSA荧光被猝灭的原因可能为动态猝灭或静态猝灭,判断方法主要是根据Stern-Volmer猝灭常数(Ksv)与温度的关系[21]。升温会增加配体和BSA的碰撞,因此Ksv值随温度升高而增大的是动态猝灭;升温会使复合物的稳定性降低,因此Ksv值随温度升高而减小的是静态猝灭。根据Stern-Volmer方程(2)[22] ,由F0/F-[Q]曲线(图1)得到Ksv和荧光猝灭速率常数(kq),其中,F0为与BB或Glu作用前BSA的荧光强度;F为与BB或Glu相互作用后BSA的荧光强度;τ0为BSA的荧光寿命(约为6 ns);Q为BB或Glu的浓度。计算公式如下:
F0F=1+kqτ0[Q]=1+Ksv[Q] (2) 由表1可见,温度升高,BB或Glu与BSA作用的Ksv值减小,并且kq大于2.0×1010 L·mol−1·s−1(最大扩散猝灭常数)[22],说明BB(或Glu)对BSA的荧光猝灭不太可能是动态猝灭,而应该主要为静态猝灭。Glu减小了BB-BSA体系的Ksv和kq,说明Glu会减弱BB对BSA的荧光猝灭程度,但不会改变其荧光猝灭机制。
表 1 BSA与BB/Glu的猝灭常数Table 1. Quenching constants of BSA and BB/Glu体系 T(K) Ksv(L·mol−1) kq(L·mol−1·s−1) R2 BSA-BB 298 (9.52±0.16)×104 (1.59±0.16)×1013 0.9836 309 (8.44±0.36)×104 (1.41±0.36)×1013 0.9933 313 (8.31±0.52)×104 (1.39±0.52)×1013 0.9909 BSA-Glu 298 (6.72±0.11)×103 (1.12±0.11)×1012 0.9906 309 (5.25±0.06)×103 (8.75±0.06)×1011 0.9948 313 (5.13±0.07)×103 (8.55±0.07)×1011 0.9923 [BSA-Glu]-BB 298 (6.92±0.05)×104 (1.15±0.05)×1013 0.9855 309 (6.29±0.04)×104 (1.05±0.04)×1013 0.9949 313 (5.43±0.04)×104 (9.05±0.04)×1012 0.9857 2.2 BB与BSA作用的结合常数及Glu的影响
由静态荧光猝灭机制可知, BB或Glu都会与BSA形成复合物,二者之间的结合常数(Kb)和结合位点数(n)可以根据公式(3)[23]得到。计算公式如下:
log[(F0−F)/F]=nlog[Q]+logKb (3) BB与 BSA 作用的结合常数约为105 L·mol−1,n约为1(表2),说明BB与BSA以较强的结合力形成1:1复合物;Glu与 BSA 作用的结合常数约为102 L·mol−1,说明Glu与BSA的结合很弱。三元体系中,Glu使BB与BSA的Kb减小至104 L·mol−1,说明Glu会削弱BB与 BSA 的结合,即Glu会阻碍BB与 BSA 之间的相互作用。一般而言,Kb值越大说明结合亲和力越强,这可能意味着BB容易在体内积累,而Glu对BB与BSA结合的抑制作用,可能会加快BB的代谢,减弱了BB对人体产生的危害。
表 2 BSA与BB/Glu作用的Kb和n值Table 2. Kb and n value of BSA and BB/Glu体系 T(K) Kb(L·mol−1) n R2 BSA-BB 298 (2.79±0.20)×105 1.11±0.01 0.9894 309 (1.48±0.06)×105 1.06±0.01 0.9963 313 (1.35±0.04)×105 1.05±0.01 0.9929 BSA-Glu 298 (2.13±0.21)×102 0.64±0.01 0.9961 309 (3.26±0.38)×102 0.71±0.01 0.9959 313 (3.96±0.70)×102 0.74±0.01 0.9829 [BSA-Glu]-BB 298 (1.53±0.10)×105 1.08±0.01 0.9903 309 (1.08±0.05)×105 1.02±0.01 0.9977 313 (3.81±0.20)×104 0.97±0.01 0.9873 2.3 BB与BSA的相互作用力及Glu的影响
BB与BSA之间的结合可能是氢键、范德华力、静电作用力和疏水作用等非键作用[24],推断的依据是热力学常数,例如焓变(ΔH)和熵变(ΔS)的符号。根据公式(4)和(5)[25]得到ΔH、ΔS和自由能变化(ΔG)见表3,其中T为温度,R为气体摩尔常数。计算公式如下:
表 3 BSA与BB/Glu作用的热力学参数Table 3. Thermodynamics parameters of BSA with BB/Glu体系 T(K) ΔH(kJ·mol−1) ΔS(J·mol−1·K−1) ΔG(kJ·mol−1) BSA-BB 298 −38.76±3.04 −25.98±9.63 −31.02±0.17 309 −30.74±0.07 313 −30.63±0.03 BSA-Glu 298 30.11±1.55 145.61±5.12 −13.29±0.28 309 −14.89±0.38 313 −15.65±0.27 [BSA-Glu]-BB 298 −90.86±2.06 −204.80±6.61 −29.83±0.14 309 −28.80±0.12 313 −27.37±0.11 lnKb=−ΔHRT+ΔSR (4) ΔG=ΔH-TΔS (5) BSA-BB体系的ΔH和ΔS均小于零,表明BB与BSA的结合以范德华力为主;而BSA-Glu体系的ΔH和ΔS均大于零,说明Glu与BSA的结合以是疏水作用为主。三元体系中Glu没有改变BSA-BB体系的ΔH和ΔS值的符号,说明Glu对BB与BSA之间的作用力影响不大。ΔG值为负表示BB或Glu与BSA的结合是自发过程。
2.4 BB/Glu与BSA的结合距离及Glu的影响
BB与BSA的结合距离(r)是根据Föster能量转移理论[24],利用公式(6)[26] ,由能量转移效率(E)、临界距离(R0)、BSA的荧光光谱与BB/Glu的吸收光谱的光谱重叠积分(J)得到(表4)。计算公式如下:
表 4 BSA与BB/Glu的结合距离Table 4. Binding distance of BSA and BB/Glu体系 J(cm3·L·mol−1) E(%) R0(nm) r(nm) BSA-BB (5.94±0.04)×1015 6.72±0.08 2.23±0.02 3.49±0.02 BSA-Glu (7.57±0.02)×1015 3.82±0.06 2.34±0.02 4.00±0.03 [BSA-Glu]-BB (5.97±0.01)×1015 7.13±0.11 2.25±0.03 3.45±0.04 E=1−FF0=R60(R60+r6) (6) J=ΣF(λ)ε(λ)λ4ΔλΣF(λ)Δλ (7) BB和BSA之间足够的光谱重叠,以及小于7 nm的结合距离,表明二者之间发生能量转移的可能性很高。Glu存在时,BB与BSA的结合距离略有变化。
2.5 BB对BSA构象的改变及Glu的影响
2.5.1 紫外光谱
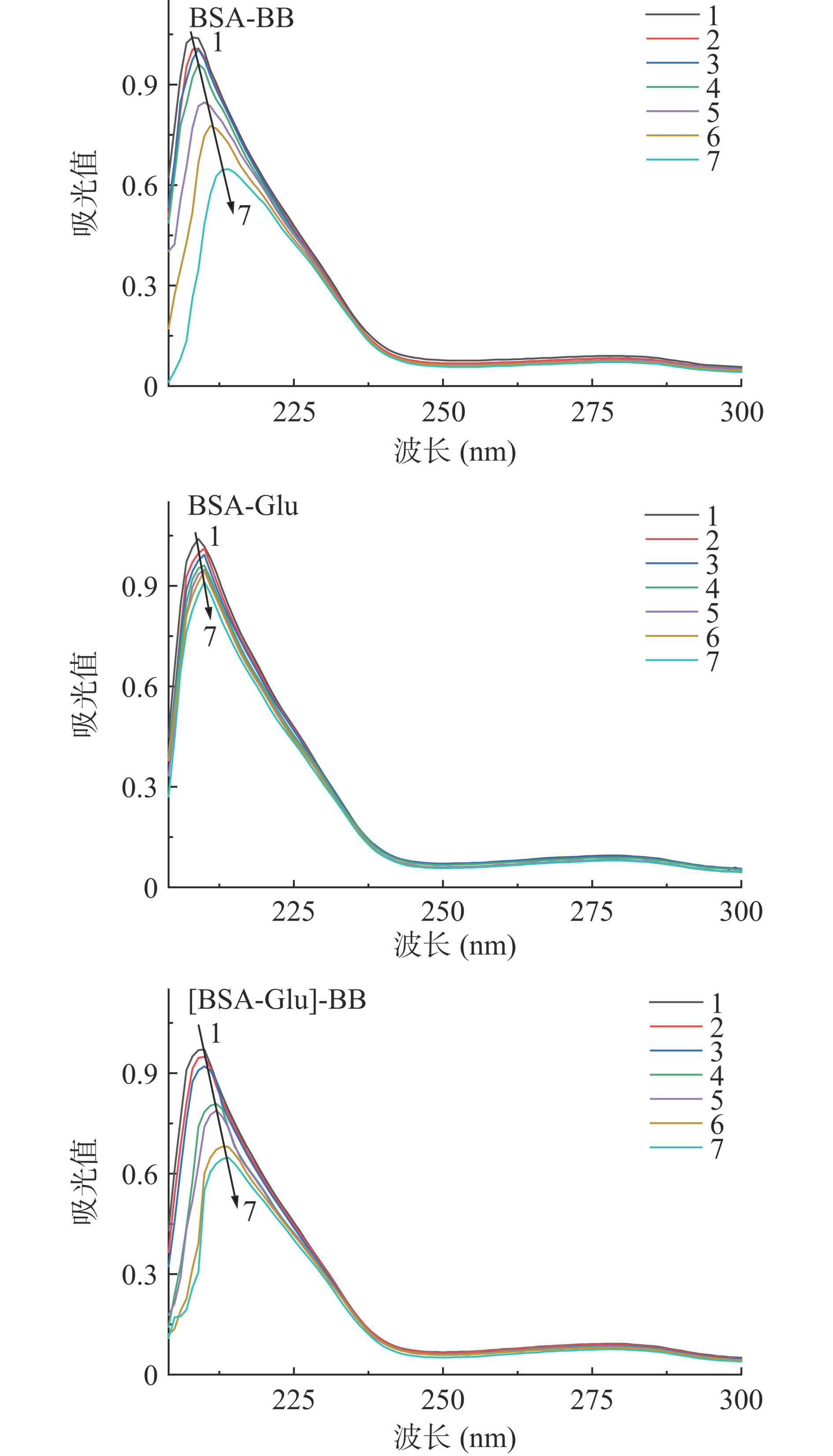
紫外光谱用来研究BB对BSA二级结构和氨基酸残基微环境极性的影响。BSA与BB/Glu作用的紫外光谱见图2。BSA在208和276 nm有两个吸收峰。BSA在208 nm处的较强吸收峰反映其骨架的二级结构信息[27],随着BB浓度的增大吸光度减小,4.0×10−5 mol·L−1的BB或Glu分别使BSA的吸光度降低37.8%和12.3%,并伴随6 nm和1 nm的红移,说明BB会极显著改变BSA的二级结构(P<0.001),而Glu略有影响。三元体系中,当Glu存在时,4.0×10−5 mol·L−1的BB使BSA吸光度降低33.3%,位移减小至 4 nm,说明Glu在一定程度上减弱了BB对BSA二级结构的改变。BSA在278 nm的吸收峰很弱,未能观察到BB或Glu对此吸收峰的影响。
2.5.2 同步荧光光谱
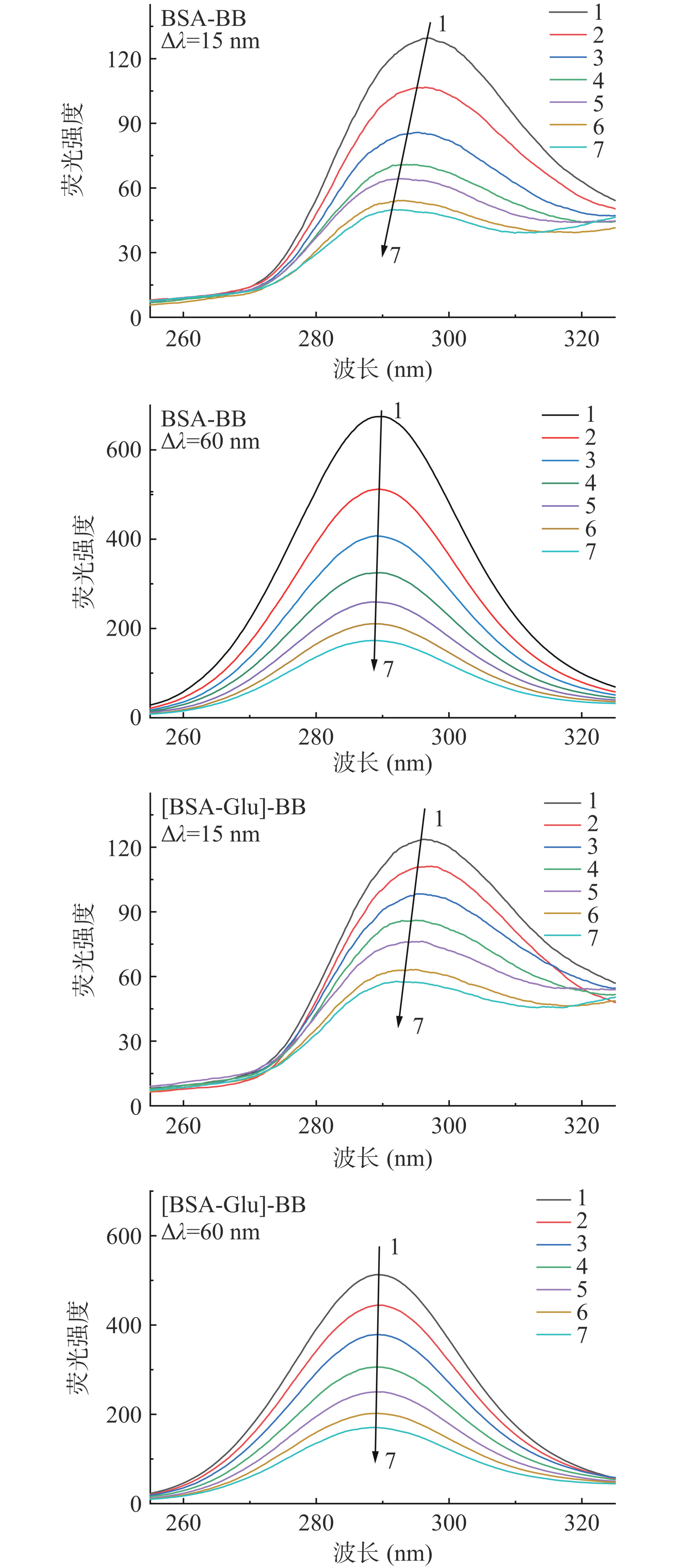
同步荧光光谱(图3)用来研究BB对BSA微环境的影响,Δλ=15 nm和60 nm分别反映酪氨酸残基和色氨酸残基的光谱特征[28],其荧光强度分别被BB猝灭了61.4%和74.4%,以及5 nm和1 nm的蓝移,说明BB使氨基酸残基更加暴露于疏水性环境。三元体系中,Glu存在时,BB对氨基酸的荧光猝灭减小至53.3%和66.8%,以及4 nm和1 nm的蓝移,说明由BB引起的氨基酸残基的疏水性暴露因Glu的共存而减少。
2.5.3 三维荧光光谱
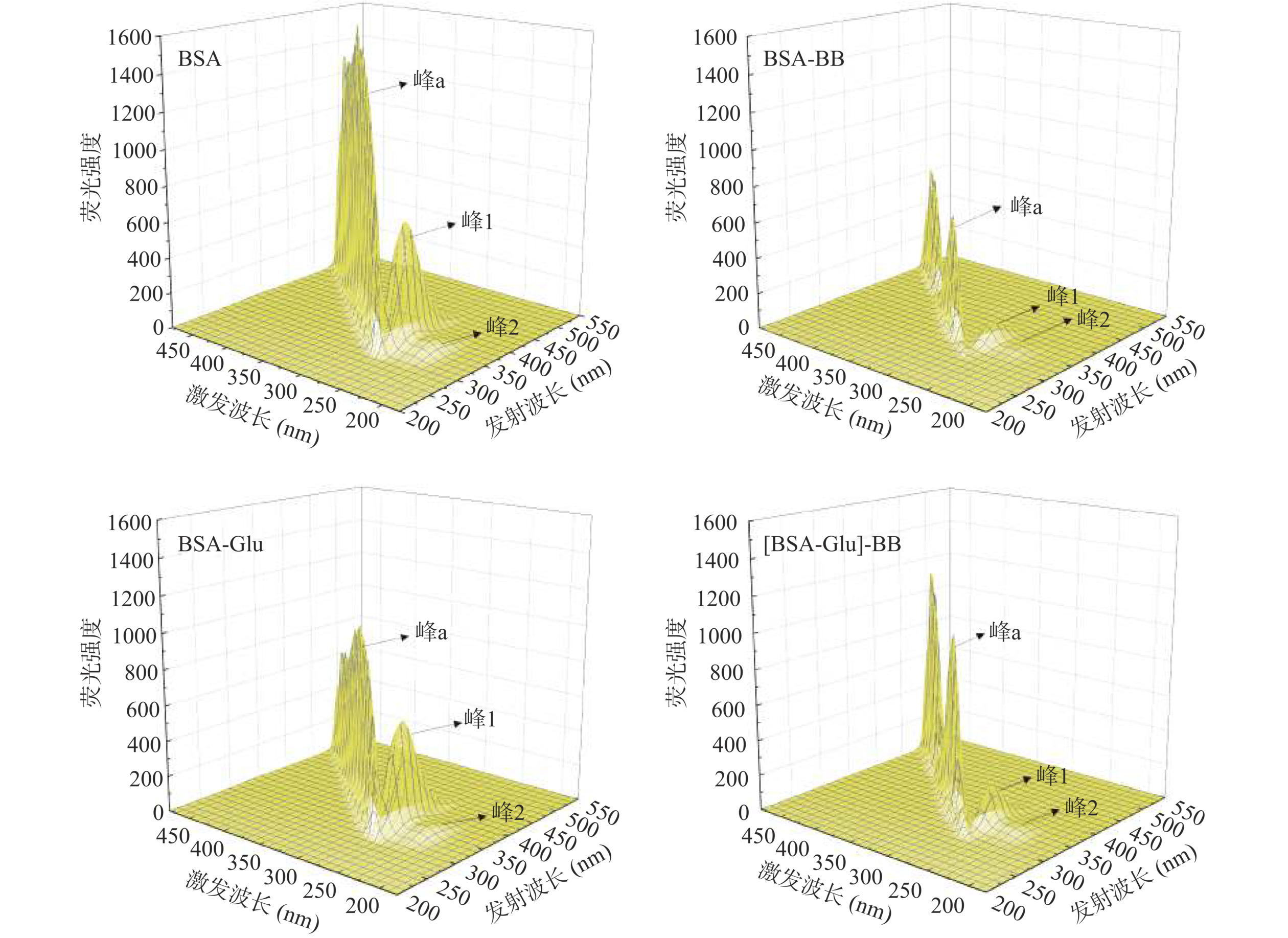
三维荧光光谱用于定性分析BSA构象的变化。BSA的三维荧光光谱中有峰1(λex/λem=275/342)和峰2(λex/λem=240/342)两个特征荧光峰(图4),以及瑞利散射峰a(λex=λem)。峰1反映氨基酸残基微环境极性的变化,峰2反映BSA多肽链的荧光光谱特性[29]。随着BB浓度的增加,峰1和峰2的荧光强度均减小,且红移了2 nm,表明BSA的多肽链结构以及氨基酸残基的微环境极性都受到了BB的干扰。BSA的瑞利散射峰a也在BB的作用下分裂为两个峰,可能是因为BB-BSA复合物的形成。Glu使峰1和峰2的荧光强度略有减小,但没有改变位移。三元体系中,当Glu存在时,BB对BSA的荧光猝灭程度减弱,且位移不再变化,说明Glu减弱了BB对BSA构象的影响。这与紫外光谱和同步荧光光谱的结果一致。
2.5.4 傅里叶变换红外光谱
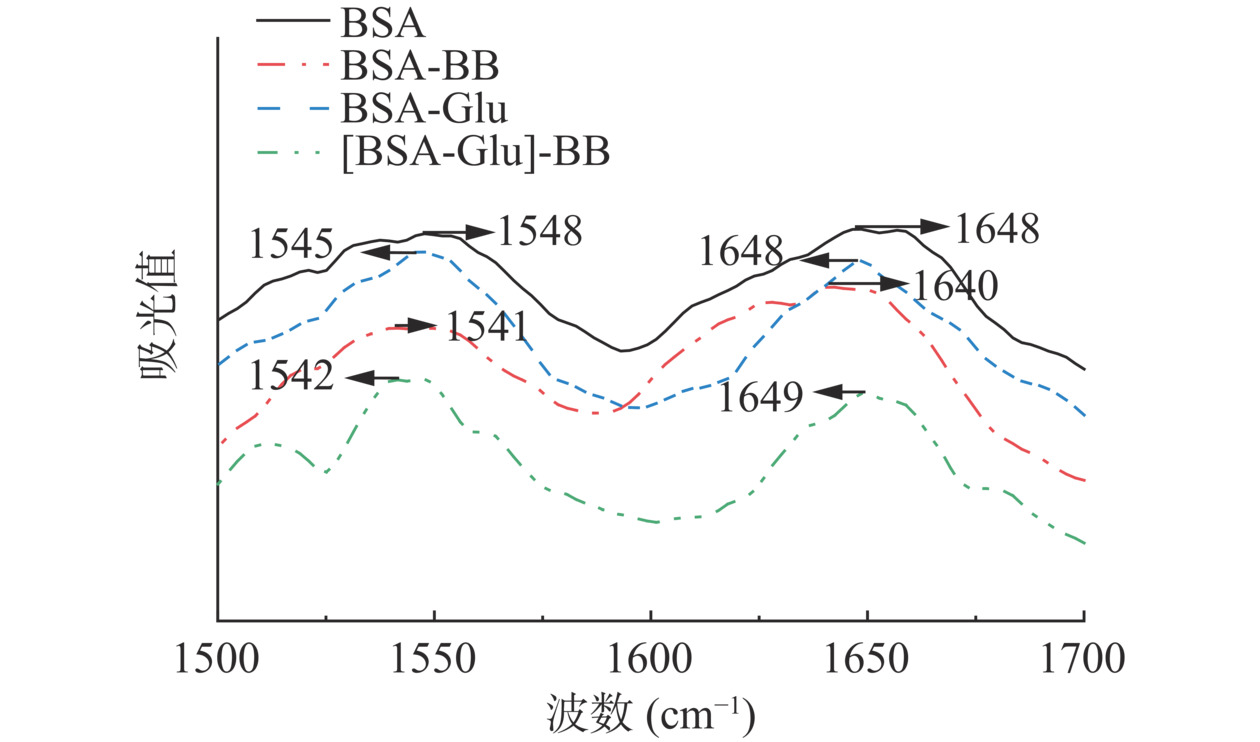
红外光谱法用来定量分析BB对BSA二级结构的影响。BSA与BB/Glu作用的红外光谱如图5所示。BB使得BSA的酰胺I带由1648 cm−1移动至1640 cm−1,酰胺II带由1548 cm−1移动至1541 cm−1。当Glu存在时,BB使得BSA的酰胺I带移动至1649 cm−1,酰胺II带移动至1542 cm−1。这表明BB的结合诱导BSA的二级结构发生改变,但Glu的存在削弱了BB对BSA二级结构的改变。
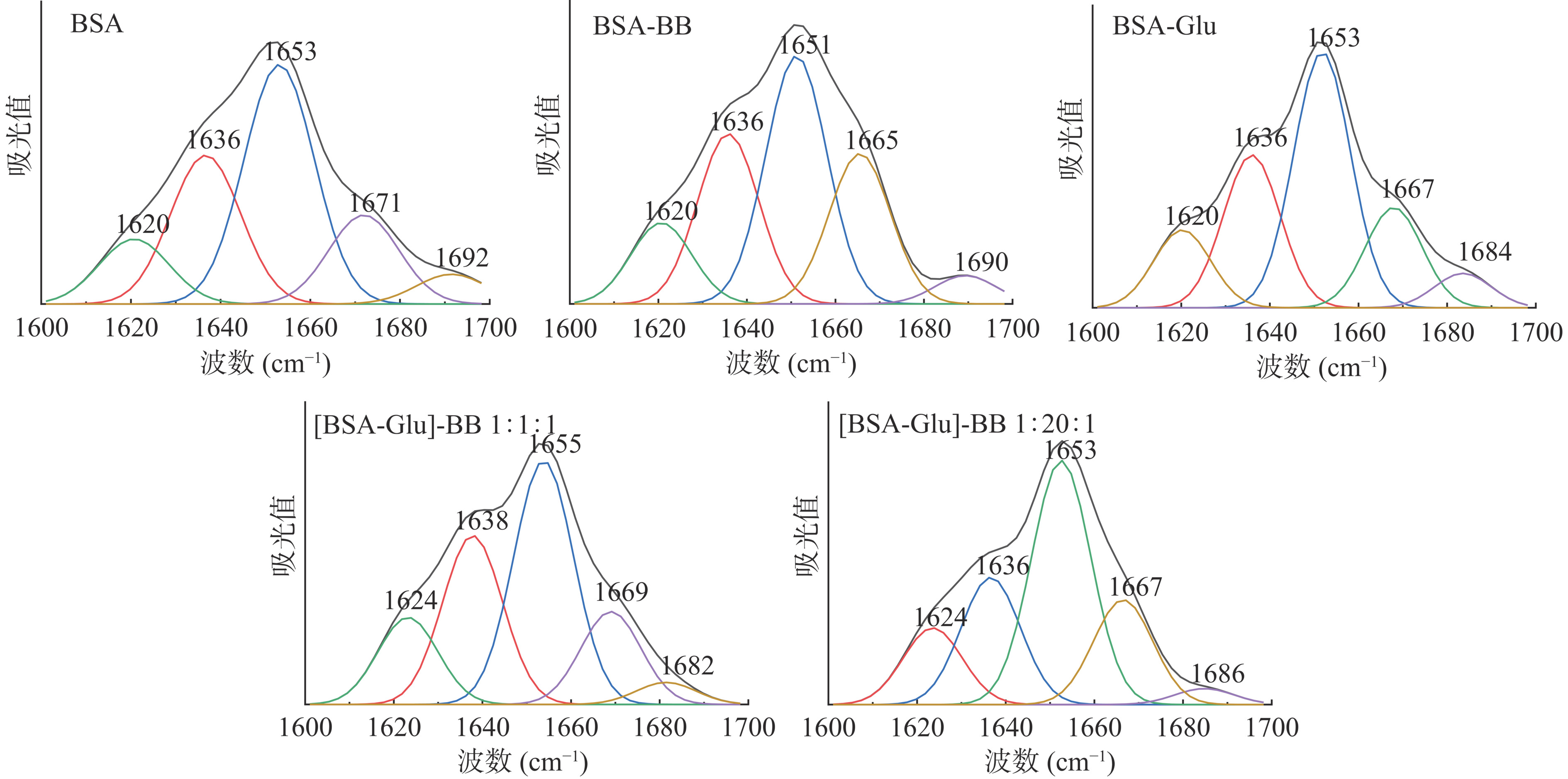
酰胺I带(1600~1700 cm−1)对BSA二级结构的变化最为敏感[30]。BSA与BB/Glu作用的酰胺I带红外曲线拟合图如图6所示,BSA各二级结构含量的变化如表5所示。与BB作用后,BSA的反平行β-折叠和α-螺旋含量减少,β-转角、β-折叠和无规则卷曲含量增加,说明BB改变了BSA的二级结构。α-螺旋是BSA最主要的二级结构,其中BSA-BB、BSA-Glu、[BSA-Glu]-BB 1:1:1、[BSA-Glu]-BB 1:20:1四组之间的α-螺旋含量差异不显著(P>0.05),但四组和BSA之间差异显著(P<0.05)。但当Glu存在时,BB使α-螺旋的变化减小,并且Glu浓度越大,由BB引起的α-螺旋的变化越小,说明Glu有助于稳定BSA的α-螺旋结构,会在一定程度上减弱BB对BSA二级结构的影响。
表 5 与BB/Glu作用前后BSA各二级结构的含量Table 5. Contents of secondary structures of BSA before and after interaction with BB/Glu体系 β-折叠(%)
1638~1610 cm−1无规则卷曲(%)
1648~1638 cm−1α-螺旋(%)
1660~1649 cm−1β-转角(%)
1680~1660 cm−1反平行β-折叠(%)
1690~1680 cm−1BSA 8.90±0.01a 18.83±0.01a 50.38±0.04a 13.30±0.02a 8.59±0.01a BSA-BB 11.64±0.01b 23.87±0.02b 36.09±0.01b 23.09±0.01b 5.31±0.02b BSA-Glu 12.53±0.04b 25.25±0.01b 41.16±0.02b 15.02±0.04b 6.04±0.01b
[BSA-Glu]-BB
1:1:116.15±0.11b 27.92±0.01b 39.18±0.03b 14.50±0.01b 2.24±0.02b [BSA-Glu]-BB 1:20:1 15.28±0.02b 18.60±0.03a 42.14±0.01b 20.29±0.02b 3.69±0.01b 注:同列不同小写字母表示差异显著(P<0.05);表6同。 2.6 BB或Glu在BSA上的结合位点
BSA的主要键合区位于亚结构域ⅡA(位点I)、ⅢA(位点II)和IB(位点III)的疏水腔中。华法林、布洛芬和血红素分别作为三个位点的标记物,被用来确定BB/Glu在BSA上的结合位点[31]。由表6可知,华法林与空白组之间的差异较大(P<0.05),说明华法林显著改变了BB(或Glu)与BSA结合的Kb值(P<0.05),即BB(或Glu)与华法林竞争BSA的同一个结合位点,即BB和Glu都结合在位点I与BSA发生作用。
表 6 标记物竞争实验的结合常数(Kb)Table 6. Binding constant of the marker competition experiment (Kb)体系 BSA-BB R2 BSA-Glu R2 空白 (2.79±0.20)×105a 0.9967 (2.13±0.21)×102a 0.9990 华法林 (7.99±0.15)×104c 0.9997 (2.05±0.17)×103c 0.9973 布洛芬 (1.18±0.07)×105b 0.9981 (6.32±0.32)×102b 0.9987 血红素 (1.39±0.10)×105b 0.9977 (3.38±0.24)×102a 0.9926 3. 结论
本文深入研究了BB与BSA之间的结合机制,以及Glu对二者相互作用的影响。实验结果表明,BB与BSA之间存在较强的相互作用,这种作用改变了BSA的二级结构和微环境极性。然而,Glu能够减弱BB与BSA的结合亲和力,并在一定程度上阻止BB对BSA构象的干扰。实验结果不仅有助于了解BB与蛋白质的作用机制,也为减少食品添加剂对人体健康的潜在风险,以及为食品添加剂的安全使用等提供参考依据。然而,尽管实验观察到了Glu在BB与BSA结合过程中的调节作用,但由于研究对象性质、实验条件和样本容量等因素的限制,关于食品添加剂与生物大分子作用机理的研究仍有许多问题亟待进一步探索。因此,我们需要综合利用多种方法和手段,以获取更多可靠的研究结果;探求更灵敏、更准确的方法用于相互作用的机理研究;同时,还需要探索建立体内实验方法,以此得到更科学合理的数据和结果。
-
表 1 BSA与BB/Glu的猝灭常数
Table 1 Quenching constants of BSA and BB/Glu
体系 T(K) Ksv(L·mol−1) kq(L·mol−1·s−1) R2 BSA-BB 298 (9.52±0.16)×104 (1.59±0.16)×1013 0.9836 309 (8.44±0.36)×104 (1.41±0.36)×1013 0.9933 313 (8.31±0.52)×104 (1.39±0.52)×1013 0.9909 BSA-Glu 298 (6.72±0.11)×103 (1.12±0.11)×1012 0.9906 309 (5.25±0.06)×103 (8.75±0.06)×1011 0.9948 313 (5.13±0.07)×103 (8.55±0.07)×1011 0.9923 [BSA-Glu]-BB 298 (6.92±0.05)×104 (1.15±0.05)×1013 0.9855 309 (6.29±0.04)×104 (1.05±0.04)×1013 0.9949 313 (5.43±0.04)×104 (9.05±0.04)×1012 0.9857 表 2 BSA与BB/Glu作用的Kb和n值
Table 2 Kb and n value of BSA and BB/Glu
体系 T(K) Kb(L·mol−1) n R2 BSA-BB 298 (2.79±0.20)×105 1.11±0.01 0.9894 309 (1.48±0.06)×105 1.06±0.01 0.9963 313 (1.35±0.04)×105 1.05±0.01 0.9929 BSA-Glu 298 (2.13±0.21)×102 0.64±0.01 0.9961 309 (3.26±0.38)×102 0.71±0.01 0.9959 313 (3.96±0.70)×102 0.74±0.01 0.9829 [BSA-Glu]-BB 298 (1.53±0.10)×105 1.08±0.01 0.9903 309 (1.08±0.05)×105 1.02±0.01 0.9977 313 (3.81±0.20)×104 0.97±0.01 0.9873 表 3 BSA与BB/Glu作用的热力学参数
Table 3 Thermodynamics parameters of BSA with BB/Glu
体系 T(K) ΔH(kJ·mol−1) ΔS(J·mol−1·K−1) ΔG(kJ·mol−1) BSA-BB 298 −38.76±3.04 −25.98±9.63 −31.02±0.17 309 −30.74±0.07 313 −30.63±0.03 BSA-Glu 298 30.11±1.55 145.61±5.12 −13.29±0.28 309 −14.89±0.38 313 −15.65±0.27 [BSA-Glu]-BB 298 −90.86±2.06 −204.80±6.61 −29.83±0.14 309 −28.80±0.12 313 −27.37±0.11 表 4 BSA与BB/Glu的结合距离
Table 4 Binding distance of BSA and BB/Glu
体系 J(cm3·L·mol−1) E(%) R0(nm) r(nm) BSA-BB (5.94±0.04)×1015 6.72±0.08 2.23±0.02 3.49±0.02 BSA-Glu (7.57±0.02)×1015 3.82±0.06 2.34±0.02 4.00±0.03 [BSA-Glu]-BB (5.97±0.01)×1015 7.13±0.11 2.25±0.03 3.45±0.04 表 5 与BB/Glu作用前后BSA各二级结构的含量
Table 5 Contents of secondary structures of BSA before and after interaction with BB/Glu
体系 β-折叠(%)
1638~1610 cm−1无规则卷曲(%)
1648~1638 cm−1α-螺旋(%)
1660~1649 cm−1β-转角(%)
1680~1660 cm−1反平行β-折叠(%)
1690~1680 cm−1BSA 8.90±0.01a 18.83±0.01a 50.38±0.04a 13.30±0.02a 8.59±0.01a BSA-BB 11.64±0.01b 23.87±0.02b 36.09±0.01b 23.09±0.01b 5.31±0.02b BSA-Glu 12.53±0.04b 25.25±0.01b 41.16±0.02b 15.02±0.04b 6.04±0.01b
[BSA-Glu]-BB
1:1:116.15±0.11b 27.92±0.01b 39.18±0.03b 14.50±0.01b 2.24±0.02b [BSA-Glu]-BB 1:20:1 15.28±0.02b 18.60±0.03a 42.14±0.01b 20.29±0.02b 3.69±0.01b 注:同列不同小写字母表示差异显著(P<0.05);表6同。 表 6 标记物竞争实验的结合常数(Kb)
Table 6 Binding constant of the marker competition experiment (Kb)
体系 BSA-BB R2 BSA-Glu R2 空白 (2.79±0.20)×105a 0.9967 (2.13±0.21)×102a 0.9990 华法林 (7.99±0.15)×104c 0.9997 (2.05±0.17)×103c 0.9973 布洛芬 (1.18±0.07)×105b 0.9981 (6.32±0.32)×102b 0.9987 血红素 (1.39±0.10)×105b 0.9977 (3.38±0.24)×102a 0.9926 -
[1] 辛成洁, 刘海舰, 李贞相, 等. 基于内滤效应的铜纳米团簇灵敏检测亮蓝色素的研究[J]. 化学研究与应用,2022,34(11):2647−2652. [XIN C J, LIU H J, LI Z X, et al. Sensitive detection of brilliant blue pigment in copper nanoclusters based on inner filter effect[J]. Chemical Research and Application,2022,34(11):2647−2652.] XIN C J, LIU H J, LI Z X, et al. Sensitive detection of brilliant blue pigment in copper nanoclusters based on inner filter effect[J]. Chemical Research and Application, 2022, 34(11): 2647−2652.
[2] LIU H, WANG M, LI Z, et al. A fluorescence sensing method for brilliant blue with gold nanoclusters based on the inner filter effect[J]. Analytical Methods,2020,12(37):4551−4555. doi: 10.1039/D0AY01355B
[3] BARCIELA P, PEREZ-VAZQUEZ A, PRIETO M A. Azo dyes in the food industry:Features, classification, toxicity, alternatives, and regulation[J]. Food and Chemical Toxicology,2023,178:113935. doi: 10.1016/j.fct.2023.113935
[4] 杨祖英. 食用色素的法规及卫生评价[J]. 食品工业科技,1992(2):34−37. [YANG Z Y. Regulation and health evaluation of food coloring[J]. Science and Technology of Food Industry,1992(2):34−37.] YANG Z Y. Regulation and health evaluation of food coloring[J]. Science and Technology of Food Industry, 1992(2): 34−37.
[5] MOHAMMADZADEH-AGHDASH H, AKBARI N, ESAZADEH K, et al. Molecular and technical aspects on the interaction of serum albumin with multifunctional food preservatives[J]. Food Chemistry,2019,293:491−498. doi: 10.1016/j.foodchem.2019.04.119
[6] SIDDIQUI S, AMEEN F, UR REHMAN S, et al. Studying the interaction of drug/ligand with serum albumin[J]. Journal of Molecular Liquids,2021,336:116200. doi: 10.1016/j.molliq.2021.116200
[7] GU J, ZHENG S, HUANG X, et al. Exploring the mode of binding between butylated hydroxyanisole with bovine serum albumin:Multispectroscopic and molecular docking study[J]. Food Chemistry,2021,357:129771. doi: 10.1016/j.foodchem.2021.129771
[8] SAIO T, GUAN X, ROSSI P, et al. Structural basis for protein antiaggregation activity of the trigger factor chaperone[J]. Science,2014,344(6184):1250494. doi: 10.1126/science.1250494
[9] OKUMURA T, YAMADA K, YAEGASHI T, et al. External AC electric field-induced conformational change in bovine serum albumin[J]. IEEE Transactions on Plasma Science,2017,45(3):489−494. doi: 10.1109/TPS.2017.2657748
[10] DEVI S, CHATURVEDI M, FATIMA S, et al. Environmental factors modulating protein conformations and their role in protein aggregation diseases[J]. Toxicology,2022,465:153049. doi: 10.1016/j.tox.2021.153049
[11] 王军, 王周利, 程晶晶. 多光谱法结合分子对接研究柠檬黄与牛血清白蛋白的相互作用[J]. 光谱学与光谱分析,2022,42(3):904−909. [WANG J, WANG Z J, CHENG J J. Interaction between tartrazine and bovine serum albumin using multispectral method and molecular dockin[J]. Chemical Research and Application,2022,42(3):904−909.] doi: 10.3964/j.issn.1000-0593(2022)03-0904-06 WANG J, WANG Z J, CHENG J J. Interaction between tartrazine and bovine serum albumin using multispectral method and molecular dockin[J]. Chemical Research and Application, 2022, 42(3): 904−909. doi: 10.3964/j.issn.1000-0593(2022)03-0904-06
[12] JANA G, SING S, DAS A, et al. Interaction of food colorant indigo carmine with human and bovine serum albumins:A multispectroscopic, calorimetric, and theoretical investigation[J]. International Journal of Biological Macromolecules,2024,259:129143. doi: 10.1016/j.ijbiomac.2023.129143
[13] 曹丽君, 程正军, 蒋晓慧. 多光谱法研究AG9/AB9与BSA相互作用的pH依赖行为[J]. 化学研究与应用,2017,29(12):1791−1799. [CAO L J, CHENG Z J, JIANG X H. Interaction of AG9/AB9 with BSA:pH-Dependent behavior study by multispectral techniques[J]. Chemical Research and Application,2017,29(12):1791−1799.] CAO L J, CHENG Z J, JIANG X H. Interaction of AG9/AB9 with BSA: pH-Dependent behavior study by multispectral techniques[J]. Chemical Research and Application, 2017, 29(12): 1791−1799.
[14] BLACHIER F, BOUTRY C, BOS C, et al. Metabolism and functions of L-glutamate in the epithelial cells of the small and large intestines[J]. The American Journal of Clinical Nutrition,2009,90(3):814S−821S. doi: 10.3945/ajcn.2009.27462S
[15] BRODSKY V Y, MALCHENKO L A, KONCHENKO D S, et al. Glutamic acid-amino acid, neurotransmitter, and drug-is responsible for protein synthesis rhythm in hepatocyte populations in vitro and in vivo[J]. Biochemistry (Moscow),2016,81:892−898. doi: 10.1134/S0006297916080101
[16] BRODSKY V Y, MALCHENKO L A, BUTORINA N N, et al. Glutamic acid as enhancer of protein synthesis kinetics in hepatocytes from old rats[J]. Biochemistry (Moscow),2017,82:957−961. doi: 10.1134/S0006297917080119
[17] BROSNAN M E, BROSNAN J T. Hepatic glutamate metabolism:A tale of 2 hepatocytes[J]. The American Journal of Clinical Nutrition,2009,90(3):857S−861S. doi: 10.3945/ajcn.2009.27462Z
[18] GU J L, MA Y X, LI Z M, et al. Probing the interaction of tert-butylhydroquinone and its β-cyclodextrin inclusion complex with bovine serum albumin[J]. Journal of Molecular Liquids,2023,384:122249. doi: 10.1016/j.molliq.2023.122249
[19] NAGTILAK M, PAWAR S, LABADE S, et al. Study of the binding interaction between bovine serum albumin and carbofuran insecticide:Multispectroscopic and molecular docking techniques[J]. Journal of Molecular Structure,2022,1249:131597. doi: 10.1016/j.molstruc.2021.131597
[20] LI Z Q, ZHAO L D, SUN Q M, et al. Study on the interaction between 2,6-dihydroxybenzoic acid nicotine salt and human serum albumin by multi-spectroscopy and molecular dynamics simulation[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2022,270:120868. doi: 10.1016/j.saa.2022.120868
[21] GAŁCZYŃSKA K, CIEPLUCH K, KURDZIEL K, et al. Spectroscopic and small-angle X-ray scattering analysis of binding between Copper (II)-1-allylimidazole complex, a potential anti-tumor agent, and bovine serum albumin[J]. Bioorganic Chemistry,2021,116:105327. doi: 10.1016/j.bioorg.2021.105327
[22] MAITY A, PAL U, CHAKRABORTY B, et al. Preferential photochemical interaction of Ru(III)doped carbon nano dots with bovine serum albumin over human serum albumin[J]. International Journal of Biological Macromolecules,2019,137:483−494. doi: 10.1016/j.ijbiomac.2019.06.126
[23] LÜ Y, LIANG Q, LI Y, et al. Study of the binding mechanism between hydroxytyrosol and bovine serum albumin using multispectral and molecular docking[J]. Food Hydrocolloids,2022,122:107072. doi: 10.1016/j.foodhyd.2021.107072
[24] YANG J, HUANG S C, WANG Y, et al. Multispectroscopic, electrochemical and molecular docking approaches on binding comparison of camptothecin, 10-hydroxycamptothecin to bovine serum albumin[J]. Journal of Molecular Liquids,2021,326:115296. doi: 10.1016/j.molliq.2021.115296
[25] LI J L, FENG H J, LIU R Q, et al. The computational and experimental studies on a 1, 2, 3-triazole compound and its special binding to three kinds of blood proteins[J]. Journal of Biomolecular Structure and Dynamics,2019,38(4):1185−1196.
[26] MERCKX R, SWIFT T, REES R, et al. Förster resonance energy transfer in fluorophore labeled poly (2-ethyl-2-oxazoline) s[J]. Journal of Materials Chemistry C,2020,8(40):14125−14137. doi: 10.1039/D0TC02830D
[27] BAI J, SUN X, GENG B, et al. Interaction mechanism of Cu+/Cu2+ on bovine serum albumin:Vitro simulation experiments by spectroscopic methods[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2023,293:122491. doi: 10.1016/j.saa.2023.122491
[28] NASIRI F, DEHGHAN G, SHAGHAGHI M, et al. Probing the interaction between 7-geranyloxycoumarin and bovine serum albumin:Spectroscopic analyzing and molecular docking study[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2021,254:119664. doi: 10.1016/j.saa.2021.119664
[29] WANG W, GAO D, ZHENG Q, et al. Interactions of isoorientin and its semi-synthetic analogs with human serum albumin[J]. Bioorganic Chemistry,2021,116:105319. doi: 10.1016/j.bioorg.2021.105319
[30] ABDELAZIZ M A, SHALDAM M, EL-DOMANY R A, et al. Multi-spectroscopic, thermodynamic and molecular dynamic simulation studies for investigation of interaction of dapagliflozin with bovine serum albumin[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2022,264:120298. doi: 10.1016/j.saa.2021.120298
[31] LU H N, LI Z S, ZHOU Y S, et al. Horizontal comparison of "red or blue shift" and binding energy of six fluoroquinolones:Fluorescence quenching mechanism, theoretical calculation and molecular modeling method[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2022,278:121383. doi: 10.1016/j.saa.2022.121383





 下载:
下载:
 下载:
下载:



