Sensitive Detection of Lasalocid Residue in Chicken by Surface Enhanced Raman Spectroscopy
-
摘要: 为提高鸡肉中抗球虫类兽药拉沙洛西(LAS)残留的监控检测效率,本研究利用表面增强拉曼光谱(SERS)技术建立了LAS残留的灵敏检测方法。本研究首先制备不同粒径的金纳米粒子(AuNPs),根据SERS增强效果选择最优粒径AuNPs作为基底,并利用4-氨基苯硫酚(PATP)作为探针分子评估AuNPs基底重现性;然后通过添加HNO3改变AuNPs聚集程度并增大LAS溶解度,进一步增强SERS信号;最后通过建立标准曲线并进行鸡肉样品加标回收试验对方法进行评价。结果表明,粒径40 nm的AuNPs增强效果较好,1118 cm−1处为LAS的SERS特征峰,基底具有良好的重现性,HNO3最优添加浓度为0.5 mol/L。本方法的线性范围为0.55×10−6~0.55 mg/mL,检测限为0.23 ng/mL,鸡肉样品的加标回收率为91.9%~107.3%,相对标准偏差为3.6%~5.7%,与国标法(GB31613.5-2022)的检测结果一致。本研究为LAS残留的灵敏检测提供了新方法,对于其他兽药残留的SERS检测方法研究具有参考价值。Abstract: In order to improve the efficiency of monitoring and detecting the residues of the anticoccidial veterinary drug lasalocid (LAS) in chicken, a sensitive method for the determination of LAS residues was established by surface-enhanced Raman spectroscopy (SERS). In this study, gold nanoparticles (AuNPs) with different particle sizes were first prepared, AuNPs with the optimal particle size were selected as the substrate according to SERS effect, and 4-aminophenthiophenol (PATP) was used as the probe molecule to evaluate the recurrence of AuNPs substrate. Then, by adding HNO3, AuNPs aggregation degree was changed and LAS solubility was increased to further enhance SERS signal. Finally, the method was evaluated by establishing the standard curve and the recovery test of chicken sample. Results showed that AuNPs with a particle size of 40 nm had good enhancement effect, the SERS characteristic peak of LAS was at 1118 cm−1, the AuNPs substrate had good reproducibility, and the optimal addition concentration of HNO3 was 0.5 mol/L. The linear range of this method was 0.55×10−6~0.55 mg/mL, the detection limit was 0.23 ng/mL, the recovery rate of chicken samples was 91.9%~107.3%, and the relative standard deviation was 3.6%~5.7%, which was consistent with the detection results of the national standard method (GB31613.5-2022). This study provides a new method for the sensitive detection of LAS residues, and has reference value for the study of SERS detection method of other veterinary drug residues.
-
Keywords:
- surface enhanced Raman spectroscopy /
- lasalocid /
- gold nanoparticles /
- chicken /
- detection
-
球虫病是由艾美尔球虫属的传染性单细胞原虫寄生于动物肠道上皮细胞所引起的一种寄生虫病,该疾病可导致雏鸡致死率高达80%[1]。拉沙洛西(Lasalocid,LAS)是预防和治疗球虫病一种常用药物,其由拉沙洛链霉菌产生,属于聚醚类离子载体型抗球虫药,在家禽养殖中应用广泛[2]。除了抗球虫作用外,LAS还能用作饲料添加剂,起到促进动物生长的作用,提高饲料利用率,改善繁殖性能[3−4]。我国《食品安全国家标准 食品中兽药最大残留限量》(GB31650-2019)中明确规定了LAS在食品中的最大残留限量,其中规定在鸡可食性组织中最大残留限量为1200 µg/kg,但近年来过量使用或不规范使用导致鸡肉中LAS残留超标的情况仍常有发生[5]。长期食用残留超标的鸡肉及其制品,会导致人体机体代谢和功能的异常,甚至会引起组织器官病变从而威胁生命安全[6]。因此,建立快速准确、简单高效的检测方法监控鸡肉中LAS残留,对维护消费者健康具有重要意义。
目前,用于LAS检测的方法主要依靠色谱技术和免疫分析技术,包括高效液相色谱法(HPLC)[7]、超高效液相色谱-串联质谱法(LC-MS/MS)[8]、液相色谱-荧光分析方法[9]、酶联免疫分析法(ELISA)[10]和侧流免疫层析法(FLIA)[11]等。色谱方法在药物检测过程中具有较高的灵敏度和准确性,但样品前处理复杂,仪器设备和运行成本相对较高,需要专业技术支持;免疫分析方法特异性较强,但抗体制备过程较为复杂,抗体制备过程复杂且周期长、生产程序复杂、保存条件苛刻,检测结果容易出现假阳性。随着现代分析技术的不断发展,表面增强拉曼光谱(Surface-enhanced Raman spectroscopy,SERS)技术突破了原有拉曼光谱检测的局限性,利用电磁场增强和化学增强效应,有效提高了拉曼光谱强度,使检测结果达痕量水平。因该技术灵敏度高且图谱信息丰富,现已成为分子识别和鉴定的有力工具,在动物性食品兽药残留高灵敏检测领域具有巨大的应用潜力[12]。
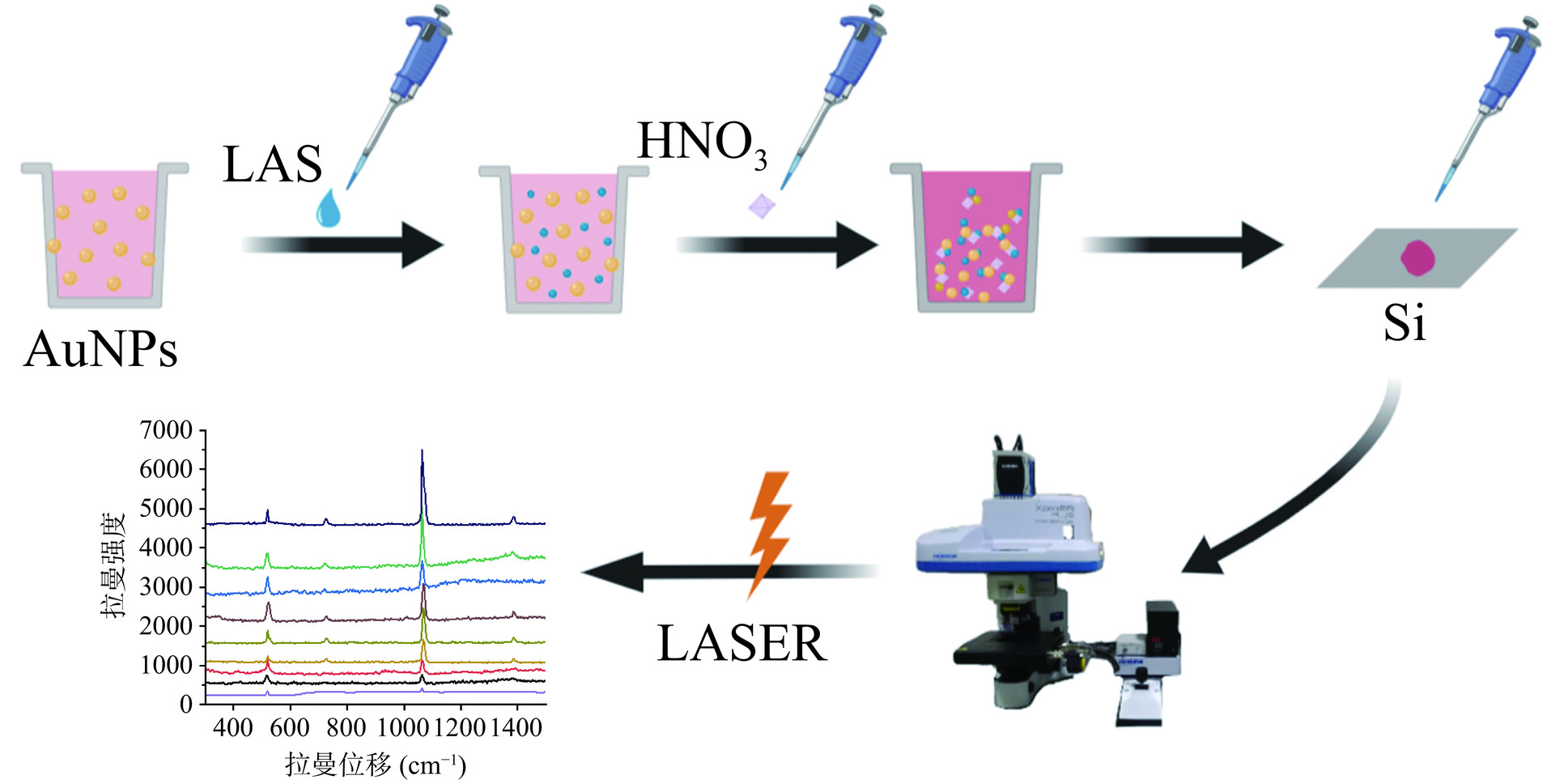
常用于构建SERS方法的增强基底包括金纳米粒子(Gold nanoparticles,AuNPs)和银纳米粒子(Silver nanoparticles,AgNPs),AuNPs的化学性质更稳定但SERS增强能力较弱。为改善溶胶型SERS基底检测性能,酸性条件下负电性AuNPs增强基底表面的柠檬酸根能得到质子而脱离基底,目标分子获得质子带正电,两者的共同作用有利于目标分子吸附在SERS增强基底表面,有利于SERS信号的提升[13−14]。经酸调控后的AuNPs基底可以使纳米粒子适当聚集提供大量热点,使更多的目标分子靠近SERS基底表面,有效增强了拉曼效应。因此,本研究首先制备并选择最优粒径AuNPs作为基底,然后通过添加HNO3提高AuNPs基底的SERS增强能力,建立灵敏检测LAS残留的SERS方法(图1)。本研究可为动物性食品中LAS残留的高效监测提供了有效检测手段,也可为其他兽药残留的SERS检测方法研究提供参考,对于保障动物性食品安全安全具有一定的实用价值。
1. 材料与方法
1.1 材料与仪器
氯金酸、柠檬酸钠 分析纯,阿拉丁中国上海公司;LAS标准品 分析纯,上海腾准生物科技有限公司;抗坏血酸 分析纯,天津市科密欧化学试剂有限公司;无水硫酸钠 分析纯,天津市德恩化学试剂有限公司;硝酸 分析纯,洛阳昊华化学试剂有限公司;甲醇、正己烷 色谱纯,天津市德恩化学试剂有限公司;乙腈 色谱纯,永华化学科技(江苏)有限公司;实验用玻璃器皿均用王水(VHCl:VHNO3=3:1)浸泡,并用去离子水冲洗干净;实验所用鸡肉样品为当地超市购买的新鲜鸡胸肉。
UV-2600紫外可见分光光度计 日本岛津有限公司;H1650R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;XploRA ONE激光拉曼光谱仪 法国HORIBA公司;H-ClassTQ-SMicro超高效液相色谱串联四级杆质谱联用仪 Waters公司;BeNano 90 Zeta纳米激光粒度仪 丹东百特仪器有限公司;Vortex 1涡旋混合机、C-MAG HS7加热磁力搅拌器 德国IKA公司;KQ3200DE超声清洗仪 昆山市超声仪器有限公司;JJ224BF型电子分析天平 德国Sartorius公司。
1.2 实验方法
1.2.1 SERS基底的制备
参照Frens的方法[15],利用柠檬酸钠还原氯金酸制备AuNPs。具体方法如下:先将1 mL 1% HAuCl4溶液加入79 mL超纯水中。然后,将1%柠檬酸钠溶液、0.1 mL 1%单宁酸、0.1 mL 25 mmol/L K2CO3溶液加入15.8 mL超纯水中。上述两种制备的溶液分别加热30 min并在高速搅拌下混合,溶液在60 ℃下保温30 min,直到颜色变红且不发生变化,冷却到室温,溶液存放在4 ℃保存备用。通过调整柠檬酸钠的添加量分别为1.5、1、0.8 mL制备出20、40、60 nm的AuNPs。分别利用纳米激光粒度仪和透射电镜(TEM)对AuNPs的粒径和均匀度进行表征。AuNPs制备完成后经10000 r/min转速离心5 min,通过重悬得到SERS基底,将基底滴在洁净的硅片上,风干后用来进行表面增强拉曼光谱检测。
1.2.2 基底的选择及重现性
在不同粒径的AuNPs中滴加一定量的LAS标准品,滴加在硅片上风干后用于SERS检测。对比5组平衡时间分别为1、3、5、7、9 h的AuNPs拉曼增强效果,选择增强效果最优粒径的AuNPs作为SERS基底。
选择10−6 mol/L PATP作为探针分子来评估基底重现性。在室温下,滴加10−6 mol/L PATP于基底中,吸附平衡10 min,在硅片上风干后用于SERS检测。在不同时间批次的10组基底上随机选择5处,共50个点对其进行拉曼光谱检测,10组时间处理方式为分别平衡1~10 d。利用Lab Spec 6软件采集拉曼光谱特征峰,利用Origin 2022对每个基底所选点的拉曼光谱值进行取平均数处理,并绘制拉曼光谱图。拉曼光谱仪参数:激发波长为785 nm,激光功率为50%,积分时间为10 s,积分次数为2,扫描范围为0~2500 cm−1。
1.2.3 HNO3添加浓度的优化
首先在200 µL基底中分别加入11组不同体积(1、5、10、15、20、40、80、100、200、400、500 µL)的0.1 mol/L HNO3,平衡相同时间后通过紫外可见吸收光谱和视觉颜色变化验证AuNPs基底经HNO3调控后的聚集现象。然后分别配制0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mol/L的HNO3溶液,将AuNPs基底与500 µg/mL LAS以1:1体积混合,室温下吸附平衡10 min,再加入基底体积1/2的HNO3溶液,混合均匀后进行SERS检测,根据特征峰信号强度选择最优HNO3添加浓度。
1.2.4 方法评价
配制不同浓度的LAS标准溶液,将制备的AuNPs基底及不同浓度的LAS标准溶液以1:1的体积比例混匀,室温下吸附平衡10 min,得到20 µL混合溶液,再加入5 µL的0.5 mol/L HNO3混合均匀后进行SERS检测。以LAS浓度为横坐标,特征峰强度为纵坐标,绘制标准曲线,根据检测限的计算公式3Sα/b(Sα为空白样本响应值标准偏差,b为标准曲线的斜率)进行线性回归计算[16]。
为评价SERS方法的准确性,将不同浓度的LAS标准溶液添加到鸡肉样品中,进行加标回收测定。参照《食品安全国家标准 鸡可食组织中抗球虫药物残留量的测定》(GB31613.5-2022)前处理方法,对鸡肉样品进行处理,具体步骤如下:称取鸡肉样品5 g(精确至0.01 g),加入5 g无水硫酸钠,加15 mL乙腈,均质后低温超声提取20 min,离心5 min取上清液。残渣再加入15 mL乙腈,重复上述提取过程一次,离心5 min后合并上清液,加入10 mL乙腈饱和正己烷液萃取两次,弃去正己烷层,待用。LAS标准溶液添加浓度分别为10、20和30 ng/mL。使用本方法和国标法(液相色谱-质谱联用法)同时进行检测,并将检测结果进行对比分析。
1.3 数据处理
在选择不同粒径AuNPs基底时拉曼光谱平行测定3次,在评价基底重现性时不同批次基底拉曼光谱平行采集5次,HNO3添加浓度优化及定量分析过程中每个样品采集随机10条拉曼光谱,数据结果以平均值±标准差进行表示。本试验拉曼光谱特征峰采集均利用Lab Spec 6软件,数据处理及拟合绘图软件为Origin 2022。
2. 结果与分析
2.1 AuNPs的表征
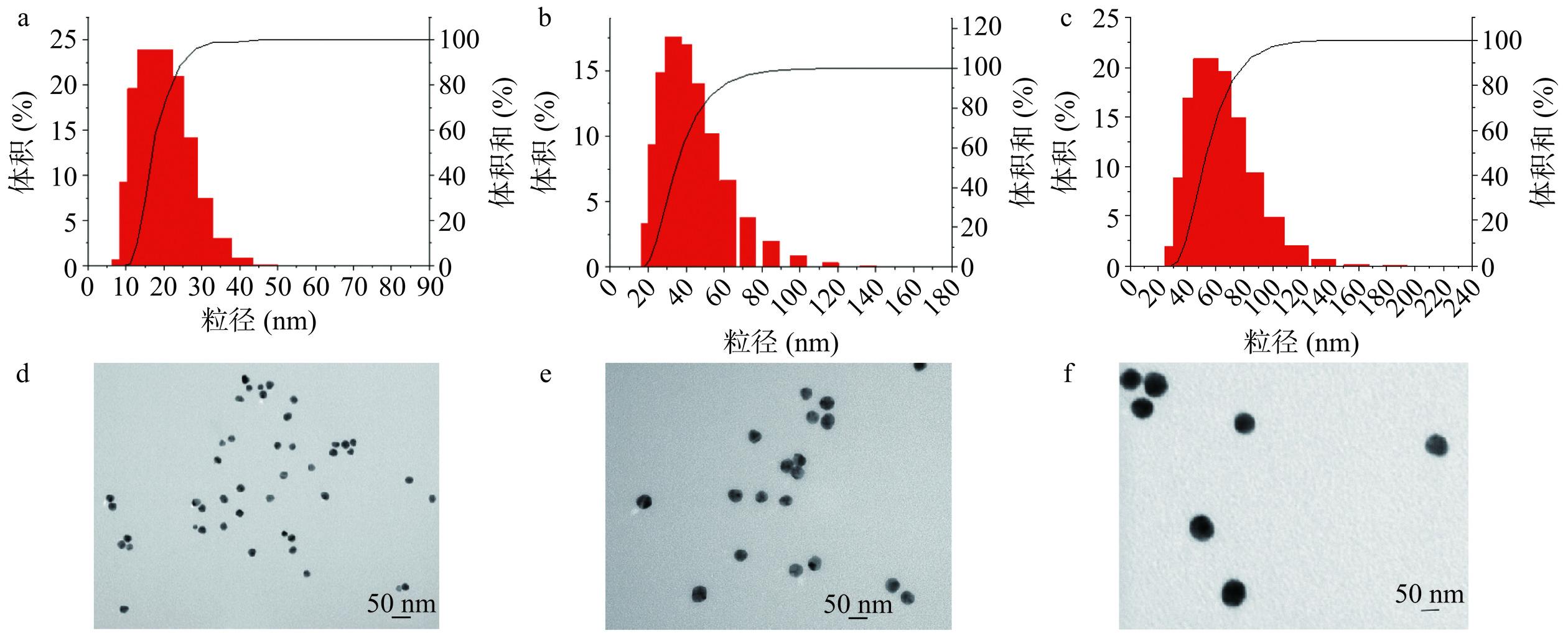
AuNPs的粒径分布结果如图2a~图2c所示,图中AuNPs的均粒径大小分别约为19、41和63 nm。TEM结果(图2d~图2f)显示该方法所合成的AuNPs粒径大小分布集中,表明颗粒较均匀且无明显团聚现象,有利于形成局域等离子场热点。
2.2 SERS基底的选择
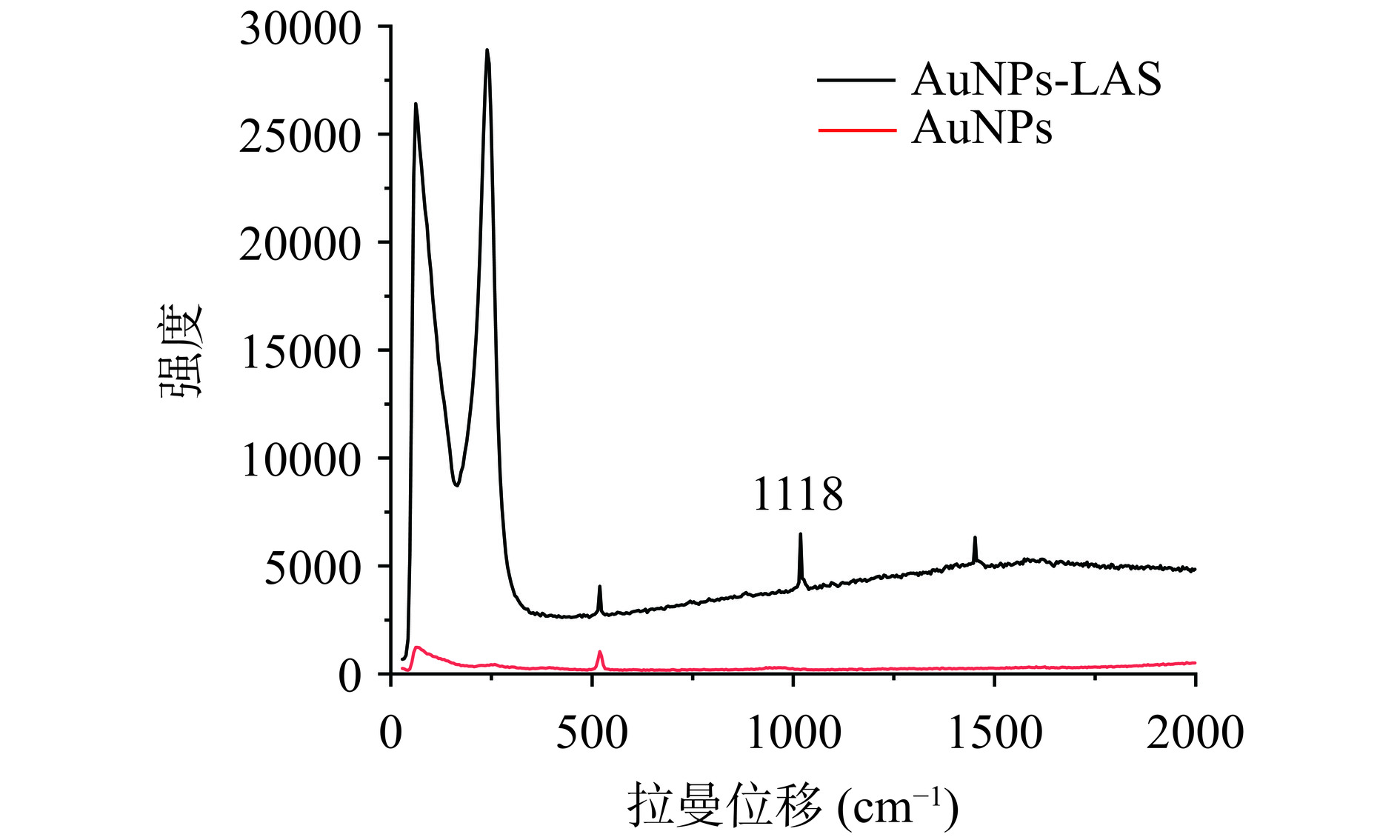
AuNPs的粒径大小对拉曼信号强度和SERS基底的稳定性有着重要的影响,采用激光拉曼光谱仪对其进行表征。如图3所示,相对于单纯的AuNPs基底,AuNPs-LAS的拉曼光谱在1118 cm−1处显示出明显的谱峰,此峰值主要由于LAS分子中C=C键的伸缩振动引起的[17]。当不添加LAS时AuNPs仍有部分拉曼信号,这是由于溶剂在硅片上检测,但硅片的拉曼出峰位置与LAS的特征峰位置不相同,可以忽略。因此,可以通过比较1118 cm−1处峰值强度来进行AuNPs基底粒径大小的选择。
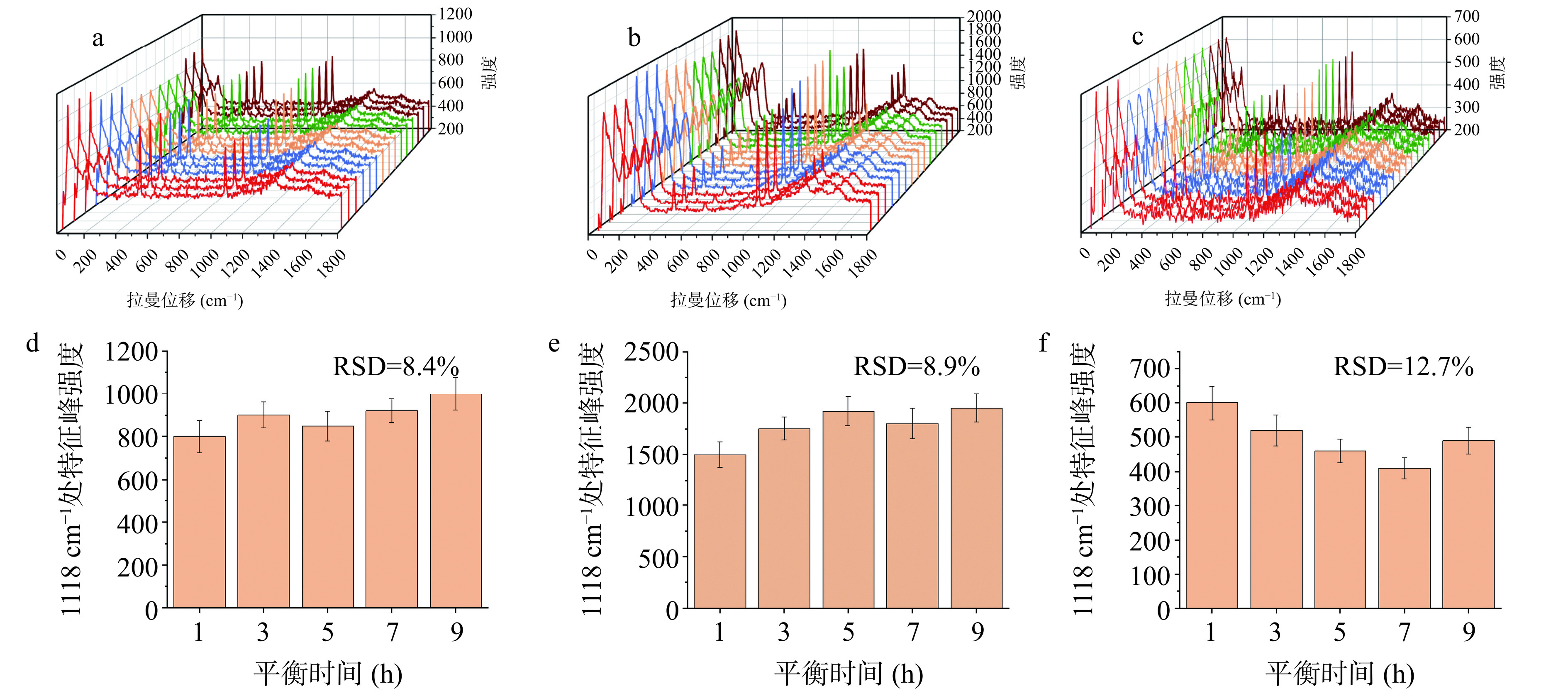
图4a~图4c分别是20、40和60 nm AuNPs对LAS的拉曼光谱检测结果,采集5组不同时间批次基底上共15个点的拉曼信号,计算1118 cm−1处峰值强度相对标准偏差(Relative standard deviation,RSD),可知40 nm左右AuNPs对LAS的SERS峰值较高增强效果更好,RSD为8.9%,这可能是因为40 nm左右AuNPs更有利于提高增强SERS所需的有效导电率和光散射率,更有利于基底热点的形成[18−19],所以选择40 nm AuNPs作为SERS基底进行后续的检测。
2.3 SERS基底的重现性
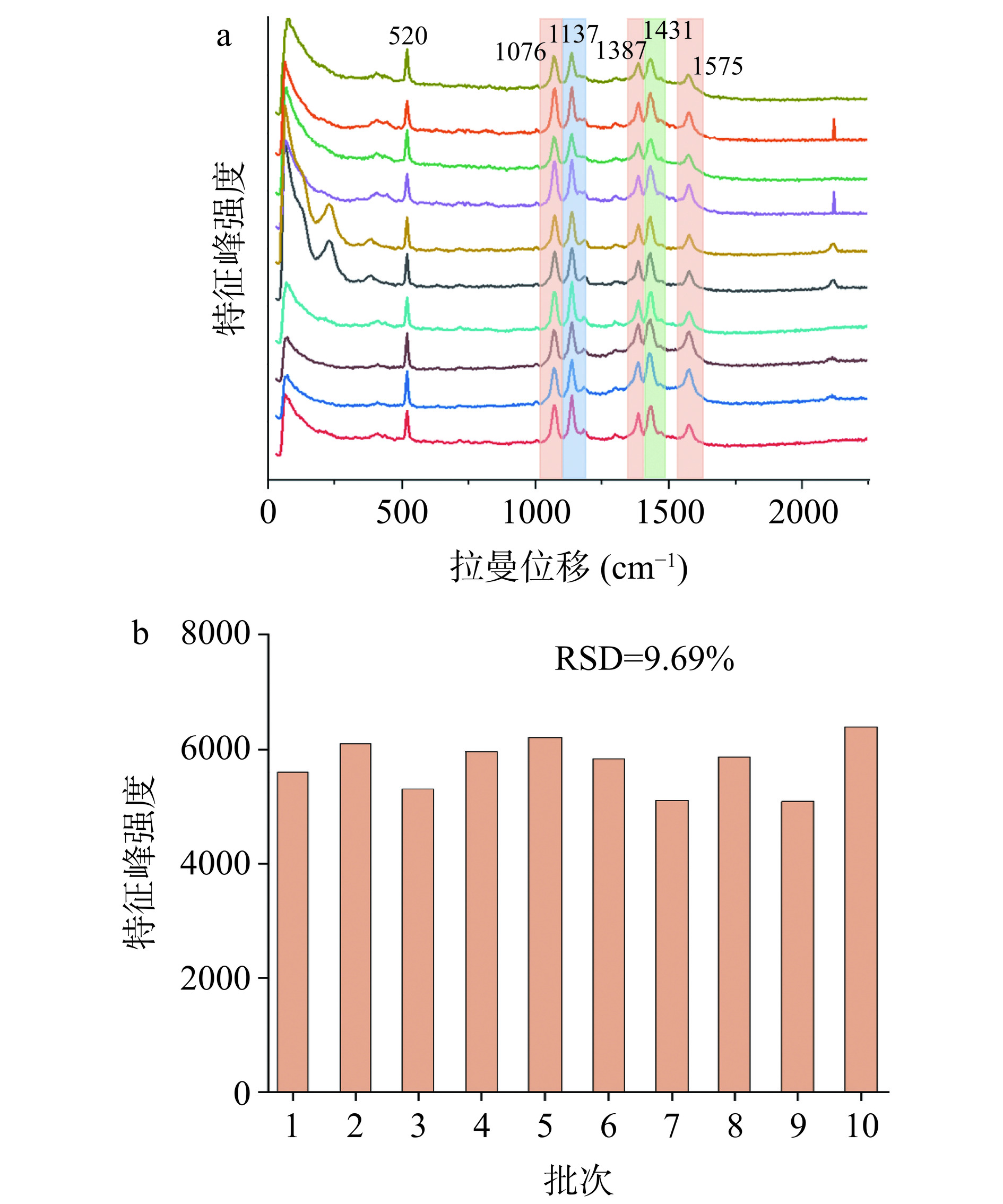
基底的重现性是保证SERS基底信号稳定的关键因素之一[20]。由于PATP分子具有双官能团利于形成夹心结构,并且因其结构的特性具备较大的散射截面,所以信号稳定,而且拉曼活性较高,在可见区域有明显的电子吸收光谱,能够稳定吸附在基底表面,因此将PATP作为探针分子可有效评估SERS基底增强效果及稳定性[21−22]。PATP在1000~1600 cm−1范围内分子信息比较丰富,1004 cm−1归属于C=C变形振动模式;1076 cm−1归属于C-S伸缩振动模式;1137 cm−1归属于C-H变形振动模式;1387 cm−1归属于C-H伸缩振动和C-H弯曲振动模式;1431 cm−1归属于C-C伸缩振动和C-H变形振动模式;1575 cm−1归属于C=C伸缩振动模式[23−24]。不同批次基底的拉曼特征峰图谱经软件处理后得到10条拉曼光谱(图5a),1076、1137、1387、1431、1575 cm−1五处特征峰强度值变化结果相似。以PATP在1076 cm−1处的峰值为例进行定量分析,统计测试点的峰值强度,结果所得PATP特征峰强度相同差异较小(图5b),RSD为9.69%,不同批次基底检测结果特征峰变化较小,表明该基底重现性较好。
2.4 HNO3添加浓度优化
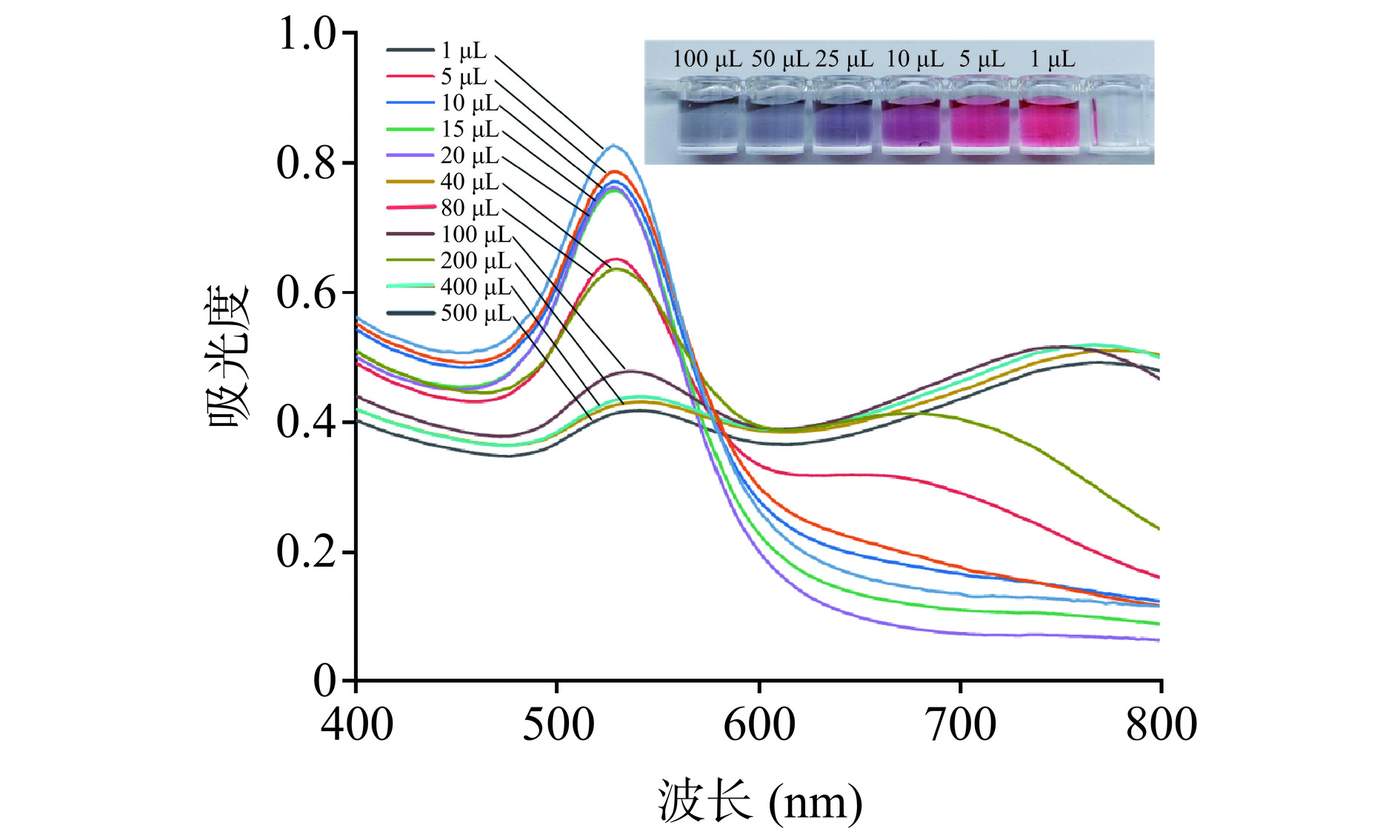
柠檬酸钠还原氯金酸时表面的柠檬酸盐及其降解产物带负电荷,合成的AuNPs在没有其他物质影响的情况下是比较稳定的。由于电荷吸引相互作用,HNO3可以诱导AuNPs产生聚集,影响胶体的稳定性。HNO3添加量从1 μL到100 μL时AuNPs所呈现的颜色由红色逐渐转变为蓝色,表明AuNPs聚集程度逐渐增高,如图6所示,随着HNO3添加量的增加,AuNPs在540 nm左右的紫外吸收峰值强度逐渐降低,由于多个等离子体共振模式引起吸收峰变宽且出现新的肩峰[25−26],表明HNO3的加入可以改变基底聚集程度,从而影响SERS“热点”形成。
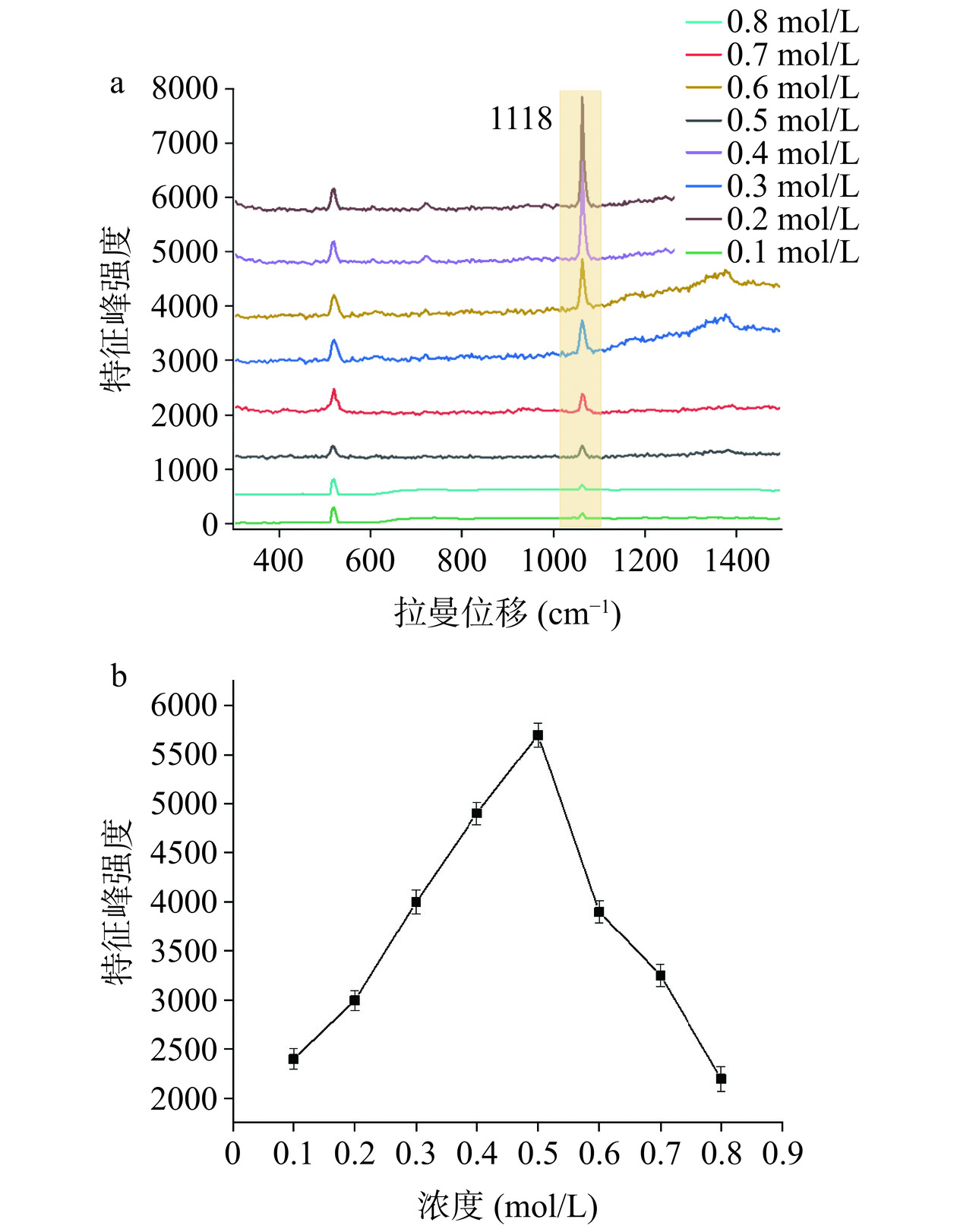
溶胶型SERS基底在不同酸性环境下的拉曼光谱,包括拉曼特征峰频率和强度会发生较大改变,这与物质溶解度或吸附方式的改变密切相关[27−28]。因此,通过调整AuNPs基底的酸度来考察LAS在不同体系中的SERS效应。LAS在酸性条件下导致的SERS信号增强是因为LAS阴离子具有更高的化学亲和力,并且在酸性环境下缺乏与硝酸根离子的竞争,在质子化LAS分子中,由于C-C-O拉伸振动而产生的拉曼波段具有更高的强度[29−30]。如图7所示,结果发现LAS的SERS特征峰强度首先随HNO3浓度从0.1到0.5 mol/L增大而增大;当HNO3浓度高于0.5 mol/L时,LAS的特征峰强度又逐渐减小。这可能是由于AuNPs基底酸性较弱时,LAS在其中的溶解性也较差,电子跃迁概率较低,对应的SERS效应较弱;而在后期,当HNO3浓度较大时,使AuNPs完全团聚,导致SERS效应反而降低。因此,将0.5 mol/L HNO3作为调控AuNPs聚集度的最佳浓度。
2.5 标准曲线建立
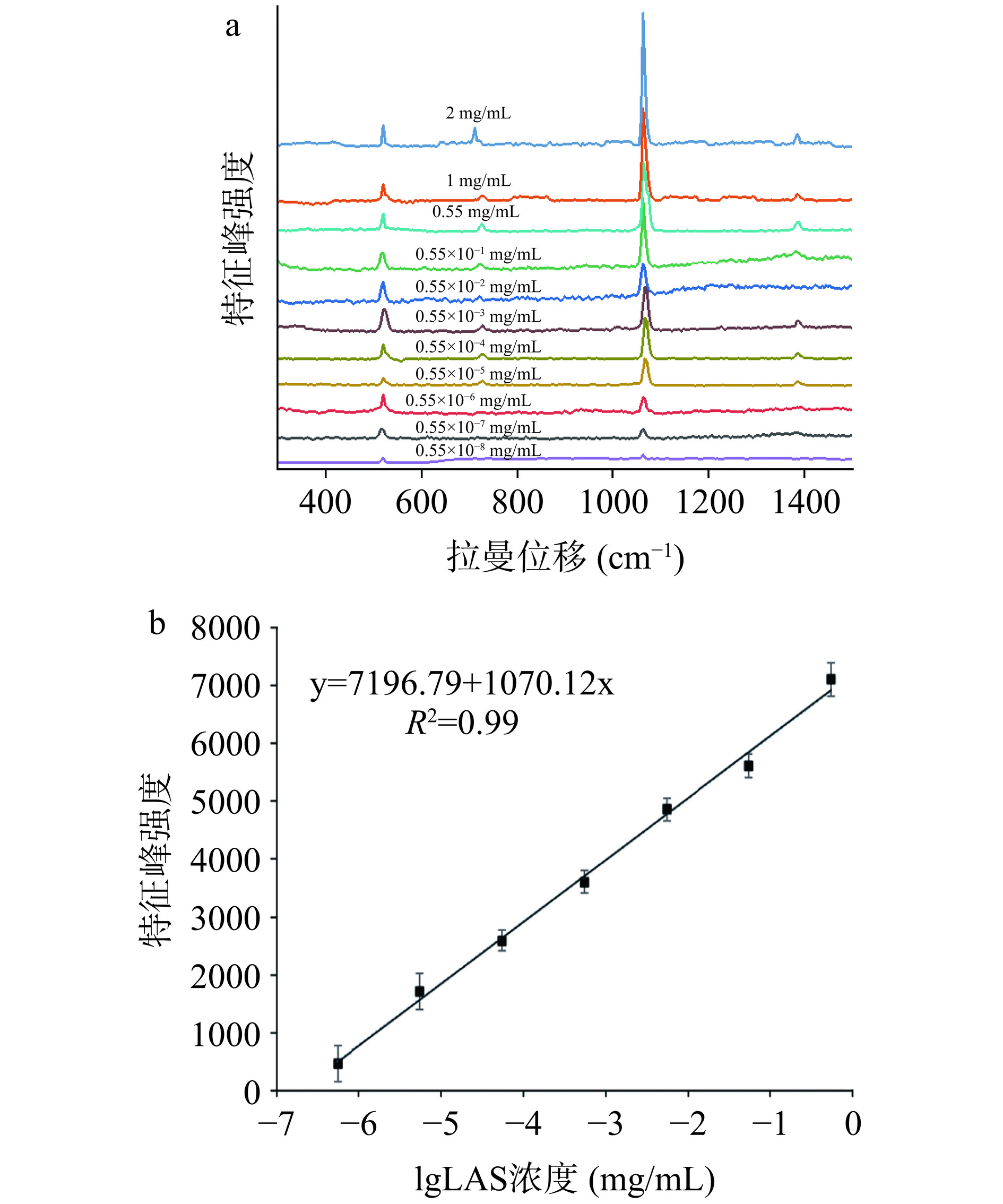
为评估经HNO3调控的SERS基底的灵敏度,将不同浓度LAS标准溶液滴加在SERS基底表面,待风干后进行SERS检测。由不同浓度LAS的SERS响应光谱(图8a)可见,1118 cm−1处特征峰强度与LAS浓度成线性关系。从图8a可以看到,随着LAS浓度从0.55 mg/mL降低到0.55×10−8 mg/mL时,1118 cm−1处特征峰强度逐渐减弱。如图8b所示,LAS在1118 cm−1处的峰值强度与其浓度对数间的线性关系,线性范围为0.55×10−6~0.55 mg/mL,线性方程为y=7196.79+1070.12x(R2=0.99),根据公式计算得检测限为0.23 ng/mL。将本方法与其他已建立的LAS残留检测方法进行对比(表1),本研究所建立的SERS方法在线性范围和检测限方面具有一定优势,可实现LAS残留的灵敏检测。
表 1 不同LAS残留检测方法对比Table 1. Comparison of different LAS residue detection methods2.6 实际样品检测
为评价方法的准确性,选用鸡肉作为实际样品,加入不同浓度的LAS标准品,每个样品重复测定三次,进行SERS分析并计算回收率。由表2可知,LAS的加标回收率范围为91.9%~107.3%,RSD在3.6%~5.7%之间,结果表明该方法可用于鸡肉中LAS的定量检测。
表 2 鸡肉中LAS加标回收试验结果Table 2. Results of LAS recovery test in chicken方法 添加值
(ng/mL)检测值
(ng/mL)加标回收率
(%)相对标准偏差
(RSD,%,n=3)10 10.73±0.58 107.3 5.7 SERS法 20 19.72±0.72 98.6 3.6 30 27.57±1.15 91.9 3.9 10 10.19±0.61 101.9 5.6 国标法 20 20.11±0.63 100.6 3.1 30 29.63±0.75 98.9 2.5 利用国标液相色谱-质谱联用法对加标样品进行检测,条件如下:色谱柱为C18(50 mm×2.1 mm,1.7 μm),柱温30 ℃,进样量为10 μL,扫描方式为正离子扫描。加标回收试验结果如表2所示,结果显示两种方法的准确度基本一致,证实了本方法的可靠性,且本方法相较于国标法所耗检测时间更短。
3. 结论
本研究制备了不同粒径的AuNPs,通过对比AuNPs基底的拉曼光谱强度,选择40 nm左右AuNPs作为SERS基底,并通过PATP作为探针分子验证基底具有良好的重现性。在此基础上,利用HNO3改善AuNPs基底的拉曼信号增强效果,优化得到调控AuNPs聚集度的HNO3最佳浓度为0.5 mol/L。配制不同浓度LAS标准溶液,经SERS方法检测,线性范围为0.55×10−6~0.55 mg/mL,检测限为0.23 ng/mL,远低于国家标准限量,满足检测需求。通过鸡肉样品加标回收试验,并与国标法检测结果对比,验证了方法具有准确性和可靠性,表明所建立的LAS残留SERS检测方法实现了鸡肉样品的灵敏检测。本研究能够为抗球虫类兽药残留的高灵敏检测提供方法支撑,但仍需在实际应用中拓展样品检测种类,探索该方法在同类兽药检测中的适用性,并利用便携式拉曼光谱检测装置实现快速检测,进一步提高动物性食品中抗球虫类兽药残留的监控效率。
-
表 1 不同LAS残留检测方法对比
Table 1 Comparison of different LAS residue detection methods
表 2 鸡肉中LAS加标回收试验结果
Table 2 Results of LAS recovery test in chicken
方法 添加值
(ng/mL)检测值
(ng/mL)加标回收率
(%)相对标准偏差
(RSD,%,n=3)10 10.73±0.58 107.3 5.7 SERS法 20 19.72±0.72 98.6 3.6 30 27.57±1.15 91.9 3.9 10 10.19±0.61 101.9 5.6 国标法 20 20.11±0.63 100.6 3.1 30 29.63±0.75 98.9 2.5 -
[1] MO J H, XIANG J, LI J, et al. Natural Magnolol ameliorates coccidiosis infected with Eimeria tenella by affecting antioxidant, anti-inflammatory, and gut microbiota of chicks[J]. Poultry Science,2023,102(11):102975−102975. doi: 10.1016/j.psj.2023.102975
[2] HUET A C, BIENENMANN-PLOUM M, VINCENT U, et al. Screening methods and recent developments in the detection of anticoccidials[J]. Analytical and Bioanalytical Chemistry,2013,405(24):7733−7751. doi: 10.1007/s00216-013-7035-6
[3] ZHANG D H, LU H, WANG E, et al. Toxic myopathy following monensin exposure:A case report with 12 year follow-up[J]. Int J Clin Exp Med,2018,11(5):5390−5393.
[4] ROILA R, BRANCIARI R, PECORELLI I, et al. Occurrence and residue concentration of coccidiostats in feed and food of animal origin; human exposure assessment[J]. Foods,2019,8(10):477. doi: 10.3390/foods8100477
[5] 王伟, 李晓芹, 胡文涛, 等. 动物源性食品中兽药残留检测技术研究进展[J]. 食品工业,2023,44(12):229−236. [WANG W, LI X Q, HU W T et al. Research progress on detection technology of veterinary drug residues in animal derived food[J]. Food Industry,2023,44(12):229−236.] WANG W, LI X Q, HU W T et al. Research progress on detection technology of veterinary drug residues in animal derived food[J]. Food Industry, 2023, 44(12): 229−236.
[6] 胡京枝, 尚兵, 刘进玺, 等. 抗球虫药检测技术研究进展[J]. 食品安全质量检测学报,2022,13(9):2825−2833. [HU J Z, SHANG B, LIU J X, et al. Research progress on detection technology of anticoccidial drugs[J]. Journal of Food Safety and Quality Inspection,2022,13(9):2825−2833.] doi: 10.3969/j.issn.2095-0381.2022.9.spaqzljcjs202209014 HU J Z, SHANG B, LIU J X, et al. Research progress on detection technology of anticoccidial drugs[J]. Journal of Food Safety and Quality Inspection, 2022, 13(9): 2825−2833. doi: 10.3969/j.issn.2095-0381.2022.9.spaqzljcjs202209014
[7] 韩鸿飞, 程林丽, 黄家模, 等. 4种饲料及1种饲料添加剂中拉沙洛西钠的高效液相色谱检测方法优化[J]. 饲料工业,2021,42(22):60−64. [HAN H F, CHENG L L, HUANG J M, et al. Optimization of high performance liquid chromatography detection method for lasalocid sodium in 4 feeds and 1 feed additive[J]. Feed Industry,2021,42(22):60−64.] HAN H F, CHENG L L, HUANG J M, et al. Optimization of high performance liquid chromatography detection method for lasalocid sodium in 4 feeds and 1 feed additive[J]. Feed Industry, 2021, 42(22): 60−64.
[8] ZHAO X, WANG B, XIE K Z, et al. Development and comparison of HPLC-MS/MS and UPLC-MS/MS methods for determining eight coccidiostats in beef[J]. J Chromatogr B,2018,1087−1088:98−107. doi: 10.1016/j.jchromb.2018.04.044
[9] OLEJNIK M, JEDZINIAK P, SZPRENGIER J T. The determination of six ionophore coccidiostats in feed by liquid chromatography with post column derivatization and spec-trigonometric/fluorescence detection[J]. Thescientific World Journal,2013,2013:763402. doi: 10.1155/2013/763402
[10] 杨小康, 张绘艳, 顾建红, 等. 拉沙里菌素单克隆抗体的研制及间接竞争ELISA检测方法的建立[J]. 中国畜牧兽医,2017,44(10):3049−3056. [YANG X K, ZHANG H Y, GU J H, et al. Development of monoclonal antibodies against lasalocid and establishment of indirect competitive ELISA detection method[J]. China Animal Husbandry and Veterinary Medicine,2017,44(10):3049−3056.] YANG X K, ZHANG H Y, GU J H, et al. Development of monoclonal antibodies against lasalocid and establishment of indirect competitive ELISA detection method[J]. China Animal Husbandry and Veterinary Medicine, 2017, 44(10): 3049−3056.
[11] WATANABE H, SATAKE A, KIDO Y, et al. Development of monoclonal-based enzyme-linked immunosorbent assay and immunochromatographic assay for lasalocid and semduramicin[J]. Food Hygiene and Safety Science,2004,45(3):107−112. doi: 10.3358/shokueishi.45.107
[12] 李春颖, 王红义, 陈高乐, 等. 表面增强拉曼光谱法在动物源性食品安全检测中的应用[J]. 食品工业科技,2023,44(16):434−443. [LI C Y, WANG H Y, CHEN G L, et al. Application of surface-enhanced Raman spectroscopy in the detection of animal-derived food safety[J]. Food Industry Science and Technology,2023,44(16):434−443.] LI C Y, WANG H Y, CHEN G L, et al. Application of surface-enhanced Raman spectroscopy in the detection of animal-derived food safety[J]. Food Industry Science and Technology, 2023, 44(16): 434−443.
[13] MANEESH K G, SEHOON C, SRIKANTH S, et al. pH-triggered SERS via modulated plasmonic coupling in individual bimetallic nanocobs[J]. Small,2011,7(9):1192−1198. doi: 10.1002/smll.201002169
[14] ANGELA C, DAISY M, FRANCESCO B, et al. Exploring the potentiality of a SERS-active pH nano-biosensor[J]. Frontiers in Chemistry,2019,7:413. doi: 10.3389/fchem.2019.00413
[15] FRENS G. Controlled nucleation for regulation of particle-size in monodisperse gold suspensions[J]. Nature,1972,241(105):20−22.
[16] SHRIVASTAVA A, GUPTA B V. Methods for the determination of limit of detection and limit of quantitation of the analytical methods[J]. Chronicles of Young Scientists,2011,2(1):21−25. doi: 10.4103/2229-5186.79345
[17] 金梦铭, 程林丽, 陈可心, 等. 鸡饲料中拉沙洛西钠的测定[J]. 饲料工业,2019,40(10):57−59. [JIN M M, CHENG L L, CHEN K X, et al. Determination of Lasalocid sodium in chicken feed[J]. Feed Industry,2019,40(10):57−59.] JIN M M, CHENG L L, CHEN K X, et al. Determination of Lasalocid sodium in chicken feed[J]. Feed Industry, 2019, 40(10): 57−59.
[18] LI H, WANG X C, WEI S N, et al. Applications of hybridization chain reaction optical detection incorporating nanomaterials:A review[J]. Analytica Chimica Acta,2022,1190:338930. doi: 10.1016/j.aca.2021.338930
[19] HOU M J, HUANG Y, MA L W, et al. Compositional analysis of ternary and binary chemical mixtures by surface-enhanced Raman scattering at trace levels[J]. Nanoscale Research Letters,2015,10(1):437. doi: 10.1186/s11671-015-1142-6
[20] JIANG L, HASSAN M, ALI S, et al. Evolving trends in sers-based techniques for food quality and safety:A review[J]. Trends in Food Science and Technology,2021,112:225−240. doi: 10.1016/j.jpgs.2021.04.006
[21] WANG Y Q, YAN B, CHEN L X. SERS tags:novel optical nanoprobes for bioanalysis[J]. Chemical Reviews,2013,113(3):1391−1428. doi: 10.1021/cr300120g
[22] LI Z Y, YUAN J, CHEN Y, et al. Direct imaging of core-shell structure in silver-gold bimetallic nanoparticles[J]. Applied Physics Letters,2005,87(24):19208−19212.
[23] LEE K M, YARBROUGH D, KOZMAN M M, et al. A rapid and convenient screening method for detection of restricted monensin, decoquinate, and lasalocid in animal feed by applying SERS and chemometrics[J]. Food and Chemical Toxicology,2020,144:111633. doi: 10.1016/j.fct.2020.111633
[24] ALI W H, DHEYAB A B, ALWAN M A, et al. Study the role of mud-like psi morphologies on the performance of aunps sers sensor for efficient detection of amoxicillin[J]. 8TH International Conference on Applied Science and Technology,2020,2290:050061.
[25] MALYSHEV D, OBERG R, LANDSTROM L, et al. pH-induced changes in Raman, UV–vis absorbance, and fluorescence spectra of dipicolinic acid (DPA)[J]. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy,2022,271:120869. doi: 10.1016/j.saa.2022.120869
[26] AZIZI B S. Investigation of metallic silver nanoparticles through UV-vis and optical micrograph techniques[J]. International Journal of Electrochemical Science,2017,12(1):363−373. doi: 10.20964/2017.01.22
[27] CHAKRABORTI S, BASU R N, PANDA S K. Vertically aligned silicon nanowire array decorated by Ag or Au nanoparticles as SERS substrate for bio-molecular detection[J]. Plasmonics,2018,13:1057−1080. doi: 10.1007/s11468-017-0605-2
[28] HIDI I J, HEIDLER J, WEBER K, et al. Ciprofloxacin:pH-dependent SERS signal and its detection in spiked river water using LoC-SERS[J]. Anal Bioanal Chem,2016,408:8393−8401. doi: 10.1007/s00216-016-9957-2
[29] ZHANG L, ZHAO Q Q, JIANG Z T, et al. Recent progress of Sers nanoprobe for pH detecting and its application in biological imaging[J]. Biosensors,2021,11(8):3−5.
[30] GUHLKE M, HEINER Z, KNEIPP J. Combined near-infrared excited sehrs and Sers spectra of pH sensors using silver nanostructures[J]. Physical Chemistry Chemical Physics,2015,17(39):26093−26100. doi: 10.1039/C5CP03844H
[31] DUBOIS M, PIERRET G, DELAHAUT P. Efficient and sensitive detection of residues of nine coccidiostats in egg and muscle by liquid chromatography-electrospray tandem mass spectrometry[J]. Journal of Chromatography B,2004,813(1):181−189.
-
期刊类型引用(13)
1. 高树财,闫格,胡桂芳,高火亮. 茶饮料中茶多酚含量测定方法的研究. 标准科学. 2025(01): 99-103 .  百度学术
百度学术
2. 邓婷婷,皮锦蝉,彭小平,姚于飞,李义全,李文娟. 茶多酚基于活性氧-线粒体途径发挥心血管保护作用的研究进展. 食品工业科技. 2025(04): 434-442 .  本站查看
本站查看
3. 蔡妙莹,钟雪莲,胡新涛,袁炎茹,梁花. 改性纤维中总多酚含量的测定. 中国纤检. 2025(03): 66-69 .  百度学术
百度学术
4. 苟祎,夏丽飞,马玉青,杨恺清,吴致远,普金霞,叶红,申时全. 不同花期紫娟茶树花的品质分析及加工工艺研究. 食品科技. 2025(02): 96-104 .  百度学术
百度学术
5. 黄珊由美,林东艺,马成英,荣杰峰,孙威江,黄艳. 茶饮料泡沫生成机理及控制技术研究进展. 茶叶科学. 2025(02): 181-190 .  百度学术
百度学术
6. 田宝明,叶芃,孔俊涛,杨开,孙培龙,陈红平,王舰,张相春. 茶多酚自组装纳米泡腾片的研制. 中国茶叶加工. 2024(02): 33-40 .  百度学术
百度学术
7. 陈俊婕,劳颖仪,陈晓维,余元善,温靖,吴继军,徐玉娟,肖更生,杨继国,唐延天,胡腾根. 茶多酚的功能活性及稳态化研究进展. 中国果菜. 2024(08): 25-31 .  百度学术
百度学术
8. 葛天睿,黄雪君,张娜,陈小强,沙如意,毛建卫. 茶多酚在医药和食品领域的应用研究进展. 食品安全质量检测学报. 2024(17): 176-184 .  百度学术
百度学术
9. 朱旋,田芸,孙海燕,王瑞,金文刚,陈琛. 茶多酚结合超高压处理对鲜切天麻贮藏品质的影响. 北方园艺. 2024(20): 83-90 .  百度学术
百度学术
10. 韩舒婷,华梓延,房耀维,杨光,侯晓月,周文梅,唐明,刘姝. 嗜热链球菌FUA329发酵绿茶浸提液及贮藏特性评价. 食品工业科技. 2024(21): 322-328 .  本站查看
本站查看
11. 辛皎瑜,钟雅静,沈启东,敖娜,梁玉文,付晶,刘春朋. 鹧鸪源大肠杆菌分离鉴定及茶多酚抑菌效果研究. 东北农业大学学报. 2024(07): 51-59 .  百度学术
百度学术
12. 陈晓真,韦怡含,蓝平,封余贤,黎笑笑,关欣,冯杰,何日梅. 茶多酚的提取纯化技术研究进展. 中国酿造. 2024(11): 20-25 .  百度学术
百度学术
13. 吴彤,刘丽莉,程伟伟,丁玥,徐宝成. NaCl和茶多酚对碱诱导鸡蛋清凝胶流变学特性及结构的影响. 食品与发酵工业. 2024(23): 194-201 .  百度学术
百度学术
其他类型引用(8)





 下载:
下载:
 下载:
下载:



