Effect of Gardenia Yellow Pigment on Dextran Sodium Sulfate-induced Colitis in Rats and Its Effect on Intestinal Flora
-
摘要: 目的:探究栀子黄色素(gardenia yellow pigment,GYP)对葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的溃疡性结肠炎(ulcerative colitis,UC)大鼠的影响。方法:实验设置对照组、模型组、阳性对照组和GYP干预组,采样当天记录大鼠的健康情况,进行疾病活动指数(disease active index,DAI)评分,比较4组大鼠体重变化、DAI评分、结肠组织形态、短链脂肪酸(short chain fatty acids,SCFAs)含量和肠道菌群构成;并通过网络药理学和分子对接对GYP缓解大鼠UC的机制进行初步分析。结果:补充GYP不仅可以有效缓解大鼠体质量减轻、便血、腹泻、结肠长度缩短以及结肠组织损伤等症状,而且可以显著增加厚壁菌门、放线菌门的相对丰度和乙酸含量(P<0.05),极显著降低拟杆菌门和螺旋菌门的相对丰度(P<0.01);通过网络药理学筛选出藏花酸为GYP缓解UC的关键成分,并得到38个交集靶点和86条KEGG通路。此外,分子对接结果显示,藏花酸对缓解UC的核心靶点具有良好的亲和力,其中ACE结合度最高。结论:GYP可改善DSS诱导的UC大鼠的肠道损伤和肠道微生物紊乱,其作用机制可能与增加SCFAs含量和维持肠道菌群的稳态有关。Abstract: Objective: To explore the effect of gardenia yellow pigment (GYP) on dextran sulfate sodium (DSS)-induced ulcerative colitis (UC) in rats. Methods: Four groups of rats were established: Normal group, model group, positive control group, and GYP intervention group. The health status of the rats was recorded on the day of sampling, and the disease activity index (DAI) score was calculated. The weight change, DAI score, colon tissue morphology, short chain fatty acids (SCFAs) content and the composition of intestinal flora were compared between the four groups. Furthermore, preliminary analysis was conducted on the mechanism of GYP in alleviating UC in rats through network pharmacology and molecular docking. Results: The results indicated that GYP not only effectively alleviated the symptoms of ulcerative colitis such as body mass loss, hematochezia, diarrhea, and the shortening of colon length and colon tissue injury in rats. Moreover, GYP significantly increased the relative abundance of Firmicutes and Actinobacteria, as well as the content of acetic acid (P<0.05), and significantly reduced the relative abundance of Bacteroidetes and Spirochetes (P<0.01). Through network pharmacology screening, crocetin was identified as a key component for alleviating UC in GYP, and 38 intersection targets and 86 KEGG pathways were identified. In addition, molecular docking results demonstrated that crocetin had good affinity for core targets for alleviating UC, among which ACE had the highest binding degree. Conclusion: GYP may alleviate intestinal damage and microbial disruption in DSS induced UC rats by increasing the content of short chain fatty acids and maintaining the homeostasis of gut microbiota.
-
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性和复发性炎症性肠病,主要特征为体重下降、腹泻和便血,其发生与外界环境和肠道菌群等多种因素有关[1]。最近几年,UC的发病率在中国等亚洲国家急剧上升,女性发病率高于男性,并向青少年转移;UC可以引起患者生活质量下降,从而造成较重的心理障碍和经济损失,其具体致病机制尚不清楚;用于缓解UC的传统药物有5-氨基水杨酸等,但效果有限并可能伴有一系列的副作用[2−3]。因此,有必要探索预防和缓解UC病情恶化的膳食替代方案。
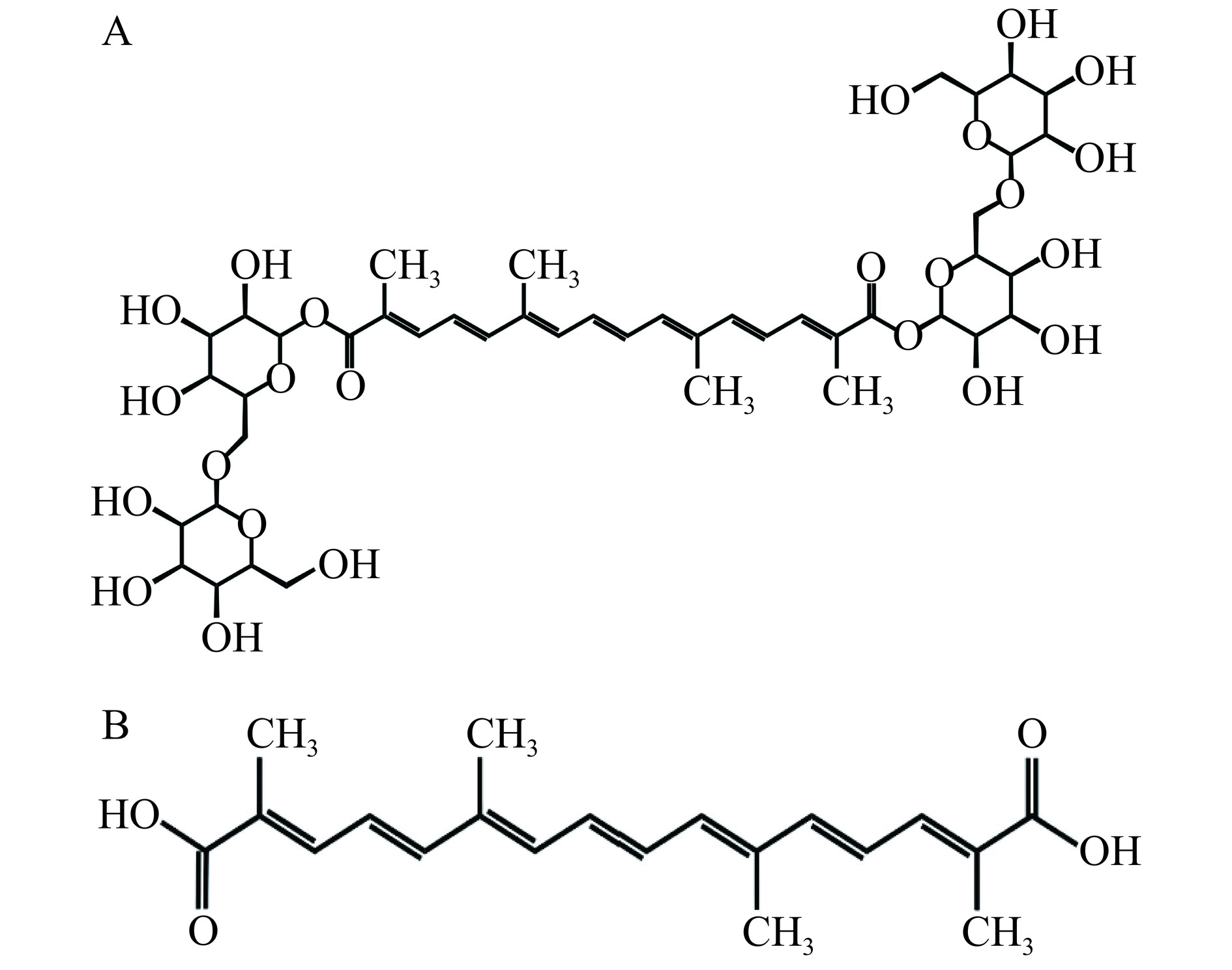
栀子(Gardenia jasminoides Ellis)是卫生部公布的第一批药食同源的中草药,作为江西省四大道地药材之一,在江西省内种植面积超过40万亩,产值数十亿元[4]。栀子黄色素(gardenia yellow pigment,GYP)是一种从栀子果实中提取的类胡萝卜素,其主要成分为藏花素和藏花酸[5−6],结构式如图1所示。GYP不仅作为重要的食用着色剂在食品领域中应用广泛,而且还具备一定的药理作用,如抗氧化、抗炎等[7]。Pan等[8]发现GYP具有较强的抗氧化作用,可有效减少活性氧含量和清除自由基。Guo等[9]发现GYP通过减少丙二醛的产生,增加超氧化物歧化酶活性和谷胱甘肽的含量来保护LO2细胞免受TGF-β诱导的炎症。据报道,类胡萝卜素中的虾青素能够显著缓解葡聚糖硫酸钠盐(dextransulfate sodium,DSS)诱导的UC小鼠炎症水平[10]。然而,同为类胡萝卜素的GYP对UC是否有类似功效鲜有研究。肠道菌群紊乱在UC的发病机制中起着核心作用,肠道菌群紊乱可能会破坏肠道黏膜屏障的完整性和功能,从而导致肠道通透性增加和肠道免疫失调,最终导致慢性肠道炎症[11],而GYP能否通过平衡肠道微生物群缓解UC症状尚不清楚。
因此,本研究采用DSS作为诱导剂建立UC大鼠模型,通过比较大鼠体重、疾病活动指数(disease activity index,DAI)、结肠组织形态、SCFAs含量和肠道菌群结构的变化,探究GYP对DSS诱导的UC大鼠的保护作用,并使用网络药理学和分子对接来识别GYP在UC缓解中的有效分子靶点,进一步探索其缓解UC的潜在机制,以期为GYP的高值化利用提供理论依据,并为膳食缓解UC提供参考。
1. 材料与方法
1.1 材料与仪器
20只雄性SD大鼠 购自湖南斯莱克景达实验动物有限公司,动物生产许可证号:SCXK(湘)2019-0004,实验室许可证号为SYXK(赣)2017-0004,动物伦理审查批号:JJU20240083;栀子 江西顺昌中药材公司;柳氮磺吡啶肠溶片(国药准字H31020840) 江西九江黄庆仁栈华氏大药房;葡聚糖硫酸钠盐 60316ES25(相对分子质量36000~50000 Da) 翌圣生物科技(上海)股份有限公司;乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸标准品、石蜡 上海阿拉丁生化科技股份有限公司;多聚甲醛、苏木素伊红 合肥Biosharp公司;无水乙醇、石油醚、偏磷酸、二甲苯等分析纯试剂 国药集团化学试剂有限公司;大鼠普通粮和垫料 江苏省协同医药生物工程有限责任公司;NKA大孔树脂 西安蓝晓科技新材料股份有限公司。
G3 ML旋转蒸发仪 苏州智瑞仪器科技有限公司;DL-5C离心机 上海安亭科学仪器厂;80A旋涡混合器 上海驰唐电子有限公司;GC-2030气相色谱仪 岛津公司;MSD501显微镜 广东迈时迪科技有限公司。
1.2 实验方法
1.2.1 GYP的制备
将栀子粉碎过40目筛,根据实验室前期方法[12]稍加修改,称取100 g栀子粉,按料液比1:10(g/mL)加入石油醚,于40 ℃恒温水浴摇床中浸提1 h进行脱脂,重复3次后得脱脂后的GYP,向脱脂后的GYP中按1:15(g/mL)加入60%乙醇,于50 ℃恒温水浴摇床中浸提2 h,重复3次,用旋转蒸发仪将提取的上清液进行浓缩,然后用NKA树脂对浓缩液进行纯化,最佳纯化条件为:样液质量浓度为0.72 g/L、体积为27柱体积(bed volume,BV),用10 BV去离子水、20 BV 15%乙醇依次洗杂,最后用20 BV 80%乙醇洗脱。得到纯化后的GYP(色价为61,OD值比率为0.29)。
1.2.2 大鼠UC模型的构建及分组
20只雄性SD大鼠饲养于九江学院附属医院动物饲养房,饲养环境温度21~25 ℃,12 h亮/暗循环,相对湿度50%~70%,自由饮水和采食。
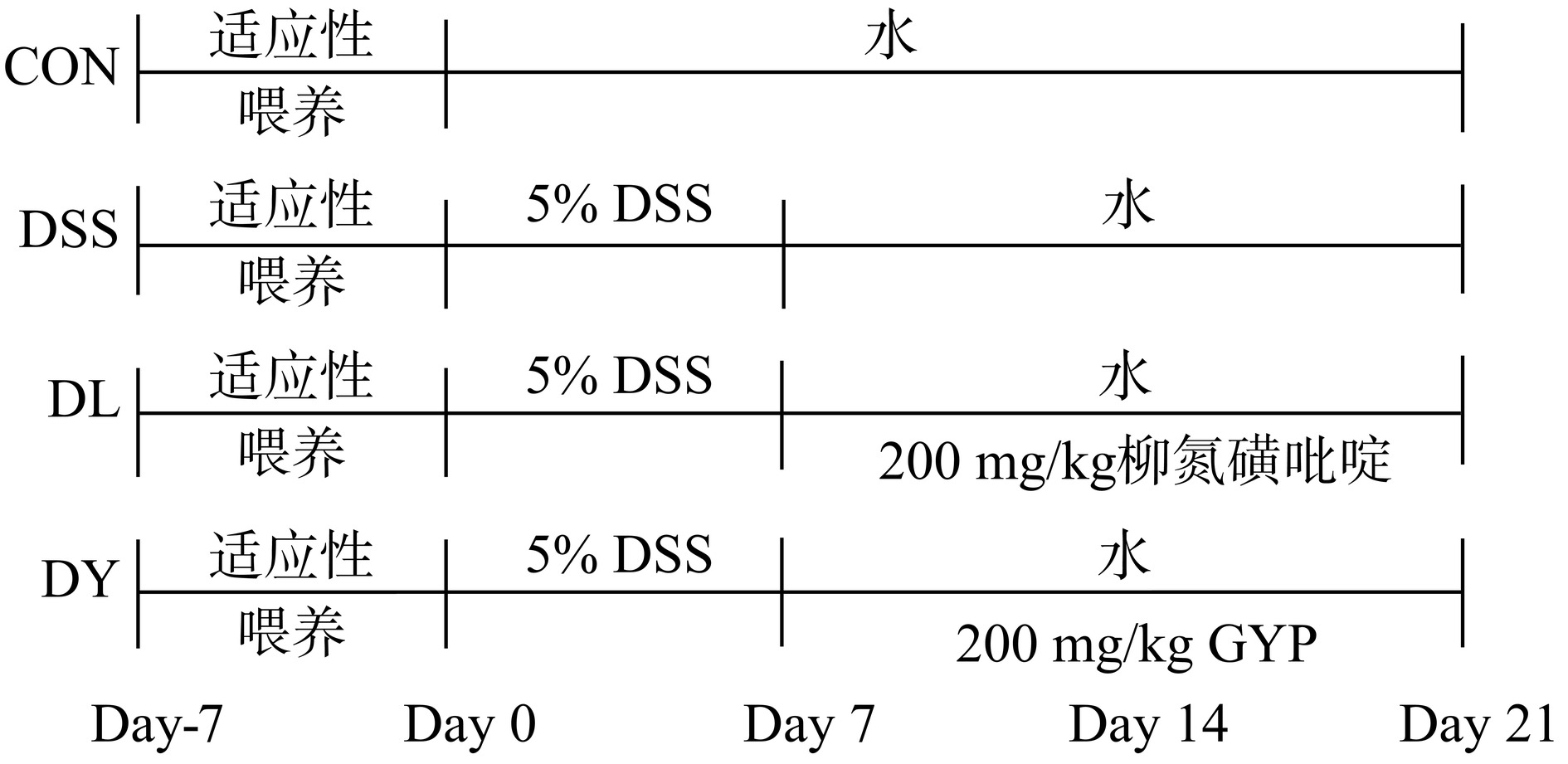
将大鼠随机分成4组,每组5只,体质量为370±20 g,分别为对照组(CON组)、模型组(DSS组)、阳性对照组(柳氮磺吡啶,DL组)及GYP干预组(GYP,DY组)。第一周适应性喂养,正常饮水饲喂,记录初始体重;第二周DSS组、DL组和DY组大鼠自由饮用5% DSS溶液一周[13],对照组正常饮水,记录体重及粪便情况;第三周开始DSS组、DL组和DY组换回正常饮用水,DL组以200 mg/kg柳氮磺吡啶灌胃,DY组以200 mg/kg GYP灌胃,该剂量与文献报道剂量一致[14]。DSS组和CON组大鼠以同等体积的生理盐水灌胃,每日固定时间给药1次,连续14 d(图2)。观察大鼠体重变化及粪便隐血情况。第27 d使用无菌无酶离心管收集大鼠粪便,−80 ℃冷冻,第28 d将大鼠全部麻醉后脱颈处死,并取其结肠组织及其内容物备用。
1.2.3 大鼠体重与DAI评分
实验期间记录大鼠每周的体重,观测其粪便形状和便血情况,根据表1和公式(1)进行评分并计算每只大鼠的DAI评分,评分标准参照[15],DAI评分计算参照[16]。
表 1 DAI评分标准Table 1. Scoring standard of DAI分数 体重下降率(%) 粪便形状 便血情况 0 0 正常 正常 1 1~5 松散但有形 有便血点 2 6~10 松散 成块便血 3 11~15 非常松散、潮湿 成片便血 4 >15 稀便 便血及肛门肿胀 DAI评分=体重下降率评分+粪便形状评分+便血情况评分3 (1) 1.2.4 大鼠结肠长度及结肠组织HE染色
测量大鼠结肠从直肠近端到回盲部的长度,截取大鼠肛门端1 cm处约0.5 cm左右的结肠片段进行HE染色,观察各组大鼠结肠病变情况并根据表2进行组织病理学评分,具体标准参照[17],结肠组织病理学评分按式(2)计算。
表 2 结肠组织病理学损伤评分Table 2. Histopathological damage score of colon评分 病变深度 隐窝损伤 炎症 0 无 无 无 1 粘膜层 1/3隐窝消失 轻度炎症和水肿 2 黏膜及黏膜下层 2/3隐窝消失 轻中度炎症 3 黏膜全层 隐窝基本消失,上皮层尚完整 中度炎症 4 黏膜全层及肌层 隐窝及上皮层完全消失 重度炎症 结肠组织病理学评分=病变深度评分+隐窝损伤评分+炎症评分3 (2) 1.2.5 SCFAs含量测定
将适量乙酸等SCFAs标准品和25%偏磷酸溶液混匀,用0.22 μm水系膜过滤,制成梯度混合溶液,用GC-MS技术对其进行3次测定,计算数据并绘制标准曲线[18]。根据王心舞[19]的方法稍加修改,称取300 mg结肠内容物与1 mL超纯水混匀,离心9 min(7500 r/min,4 ℃),取0.5 mL上清液和0.1 mL 25%偏磷酸至无酶无菌EP管中混匀,离心15 min(8500 r/min,4 ℃),将上清液经过0.22 μm滤膜过滤;用DB-FFAP(30 m×0.25 μm×0.25 mm)色谱柱进行GC-MS分析,进样口温度250 ℃,进样体积2 μL,载气为氮气,载气流速2.0 mL/min,分流比10:1,检测器温度270 ℃,升温条件为:初始温度50 ℃,保持1 min后以15 ℃/min的速率升温至120 ℃,再以5 ℃/min的速率升温至170 ℃,最后以15 ℃/min的速率升温至220 ℃,保持6 min。计算对应SCFAs峰面积,根据标准曲线方程计算各种SCFAs的浓度。
1.2.6 16S rRNA分析
每组随机收集的3只大鼠结肠内容物由上海美吉生物医药科技有限公司进行16S rRNA测序,通过对测序数据进行拼接和质控,获得最优序列。在此基础上,利用UPARSE(version 11)对分类操作单元(operational taxonomic unit,OTUs)进行聚类[20],获得OTU代表序列的分类学信息,并在美吉云平台(https://cloud.majorbio.com/)上对其进行生物信息学分析。与文献[21]报道一致。
1.2.7 GYP关键活性成分作用UC核心靶点预测及核心靶点的分子对接验证
利用Swiss Target平台,对GYP各活性成分的相关靶点进行检索;再通过Gene Cards、Dis Ge NET数据库2个平台查找UC的相关靶点,将获取的GYP关键活性成分靶点基因与UC靶点基因导入微生信在线作图工具绘制韦恩图,获得GYP关键活性成分与UC的共有靶点基因。通过STRING数据库构建GYP关键活性成分与UC共有靶点基因的蛋白互作关系(protein-protein interaction,PPI)网络。采用DAVID数据库筛选得到交叠靶点相关基因,开展基因本体(gene ontology,GO)功能与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。通过网络拓扑属性分析软件Cytoscape 3.7.0构建“GYP关键活性成分-靶点-UC”网络图和“GYP关键活性成分-靶点-KEGG通路”网络图[22]。最后通过Auto Dock Tools 1.5.6软件将核心靶点蛋白和GYP关键活性成分进行分子对接。
1.3 数据处理
用SPSS 26.0对数据进行统计分析,采用单因素方差分析(One-Way ANOVA)和Tukey检验对数据进行比较,用Wilcoxon秩和检验对大鼠肠道菌群的相对丰度进行比较,所得结果以平均值±标准差表示,P<0.05表示差异具有统计学意义。
2. 结果与分析
2.1 GYP对UC大鼠体重及DAI的影响
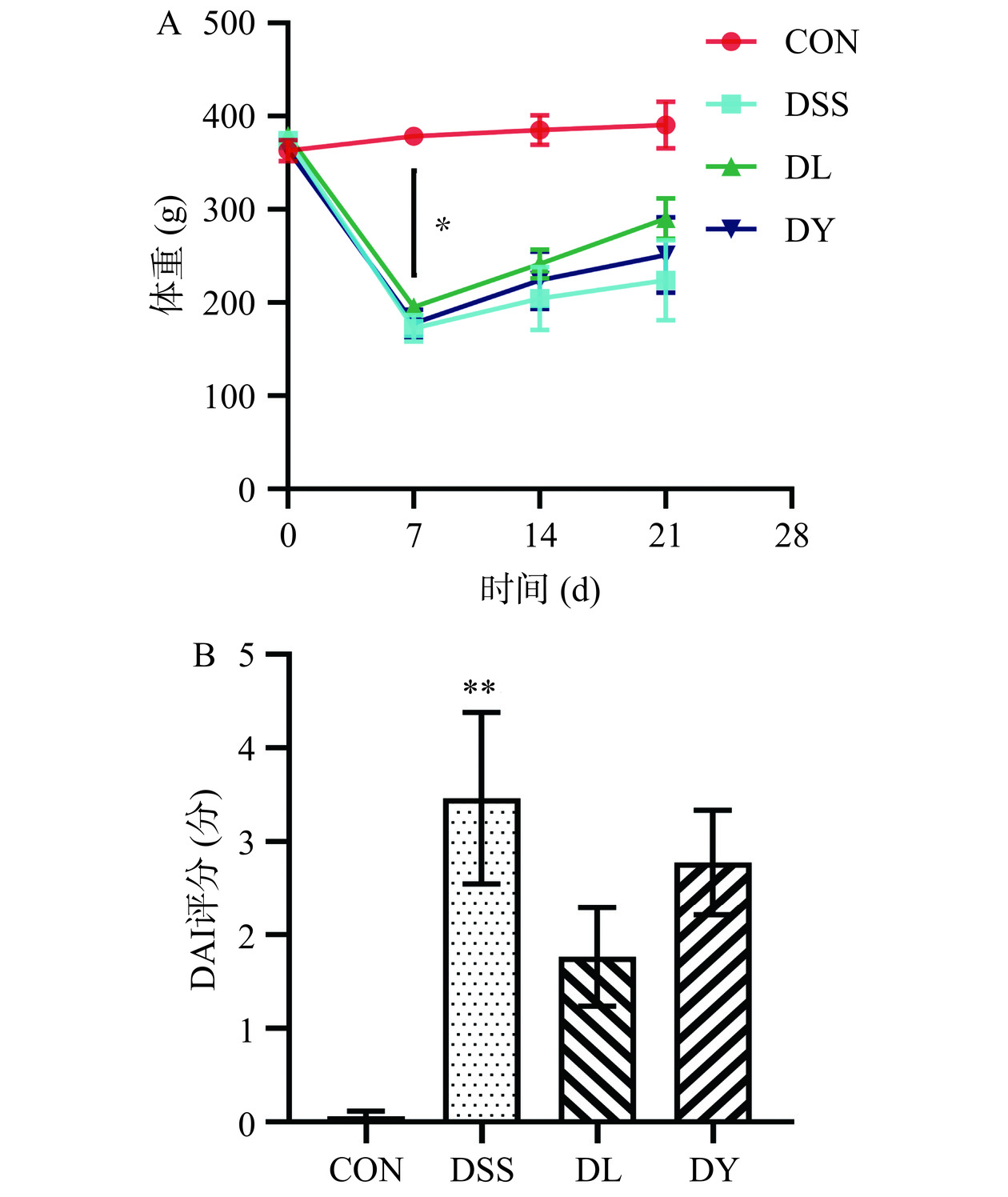
体质量下降是DSS诱导UC大鼠的典型症状之一[23]。如图3A所示,在实验第7 d,与CON组相比,DSS、DL和DY组大鼠的体重显著降低(P<0.05)。第7 d之后,各组大鼠体重开始上升。在实验第21 d,CON组体重最大,其次为DL组,再次是DY组,DSS组体重最小,四组间无统计学差异。DAI评分是评估UC大鼠的重要指标[24]。实验期间CON组、DL组和DY组大鼠无粪便隐血现象,DSS组大鼠存在粪便隐血现象并有水状粪便,肛门肿胀等症状。如图3B所示,DSS组大鼠的DAI评分极显著高于CON组(P<0.01),DSS组大鼠的DAI评分与DL和DY组无统计学差异,CON组大鼠的DAI评分最低,DSS组DAI评分最高,DY组DAI评分高于DL组。通过体质量和DAI评分结果可判定大鼠造模成功,同时,GYP对UC大鼠体重减轻、腹泻和便血现象有明显改善作用。这与马晓兰等[25]研究效果一致。
2.2 GYP对UC大鼠结肠组织病理损伤及结肠长度的影响
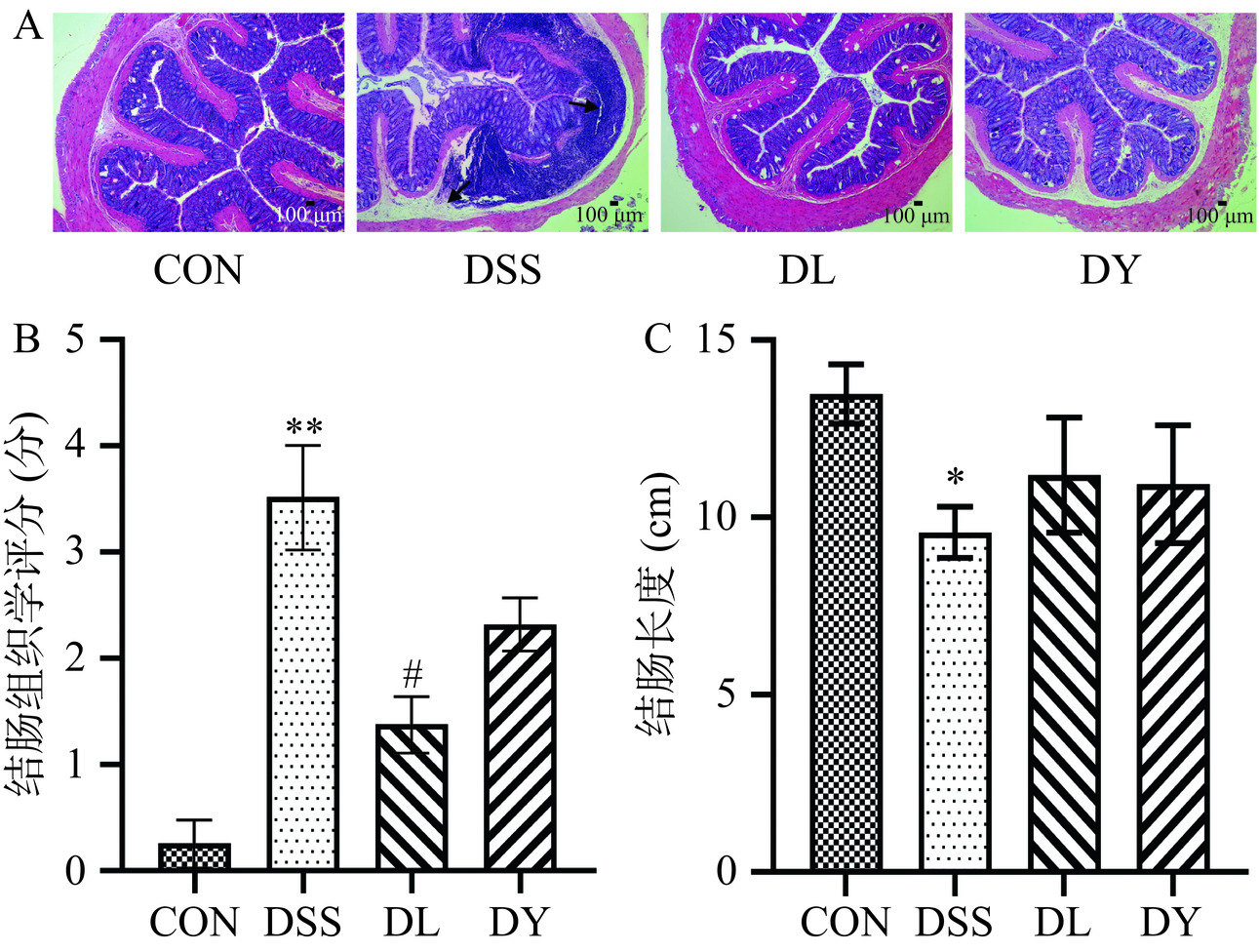
采用HE染色对UC大鼠进行结肠组织病理学观察,结果如图4A所示。CON组大鼠的肠黏膜和隐窝结构完整,未见炎症细胞浸润;DSS组结肠组织表现出上皮细胞脱落、炎性细胞浸润和隐窝破损甚至完全消失;DL和DY组上皮细胞完整,炎性细胞浸润现象减少和隐窝无破损。如图4B所示,与DSS组相比,DL和DY组组织病理学评分分别降低60.80%(P<0.05)和34.09%。UC大鼠常见的症状之一是结肠萎缩[26]。如图4C所示,CON组结肠长度为13.48±2.2 cm,DSS组为9.58±2.0 cm,DL组为11.2±2.0 cm,DY组为10.94±2.1 cm,DSS组大鼠的结肠长度较CON组显著缩短了3.9 cm(P<0.05);相比DSS组,DL和DY组分别增长了16.91%和14.20%。综上所述,GYP可以缓解DSS诱导的UC大鼠结肠损伤和结肠缩短症状,这与吴苹等[27]研究结果较为一致。
2.3 GYP对UC大鼠粪便中SCFAs含量的影响
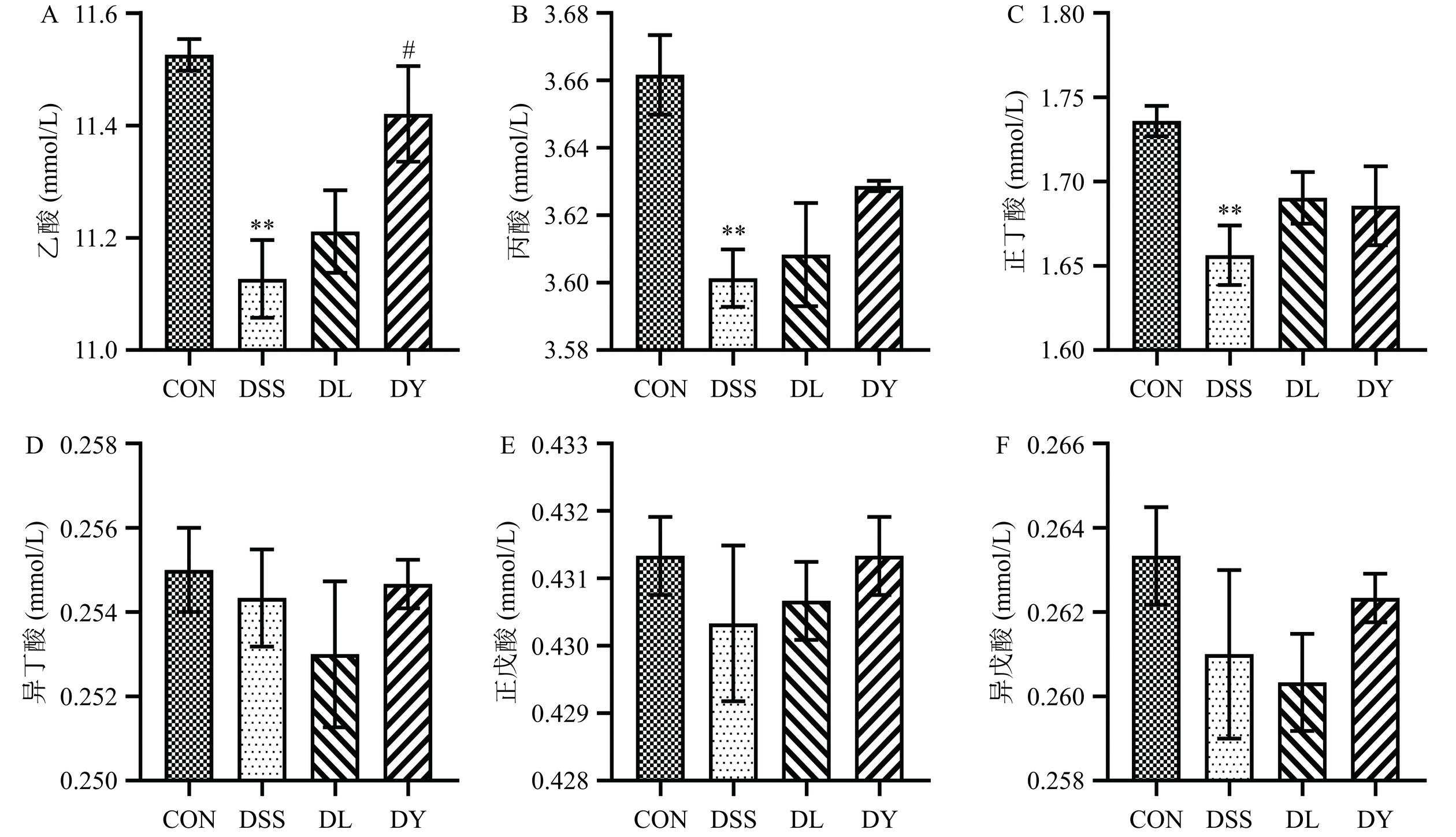
SCFAs是肠道菌群次生代谢的重要产物,它们在维持肠道稳态和功能方面发挥着关键作用[28−29]。由图5可知,含量最高的SCFAs为乙酸,与CON组比较,DSS组大鼠粪便中的SCFAs含量均降低,其中乙酸、丙酸、正丁酸含量极显著降低(P<0.01);与DSS组比较,DL组大鼠粪便中,除了异丁酸和异戊酸之外,其他SCFAs含量均升高,DY组大鼠粪便中SCFAs含量均升高,其中DY组乙酸含量显著增加(P<0.05)。Xie等[30]发现DSS会显著减少UC大鼠粪便中的乙酸、丙酸和丁酸含量。Ning等[31]发现UC小鼠体内乙酸含量增加有助于恢复肠道微生物群的平衡,减轻肠道炎症。说明GYP能够缓解UC大鼠粪便中SCFAs含量减少现象并可能通过显著增加乙酸含量恢复肠道微生物群的平衡来减轻UC症状。
2.4 GYP对UC大鼠肠道菌群的影响
2.4.1 肠道微生物Alpha多样性
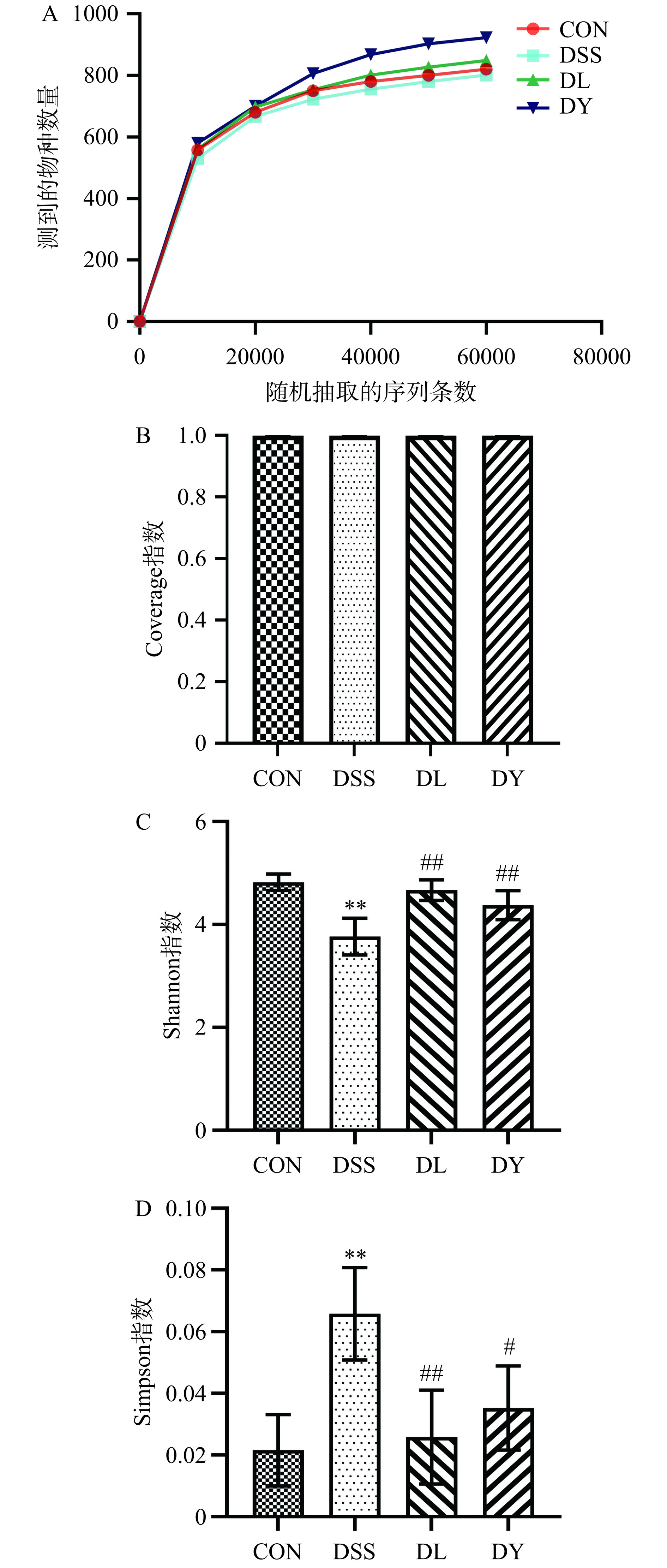
由图6A~B可知,物种的稀释曲线逐渐趋于平缓,各组大鼠的Coverage指数均在0.99以上,说明样本的覆盖率较高,能真实地反映出肠道菌群状况。图6C~D显示,DSS组Shannon指数极显著低于CON组(P<0.01),Simpson指数极显著高于CON组(P<0.01);DL和DY组Shannon指数极显著高于DSS组(P<0.01),DL组Simpson指数极显著低于DSS组(P<0.01),DY组Simpson指数显著低于DSS组(P<0.05)。越高的Shannon指数表明,肠道微生物多样性越高,Simpson指数与之相反[32]。说明GYP干预可增加DSS诱导的UC大鼠肠道微生物多样性。
2.4.2 肠道微生物Beta多样性
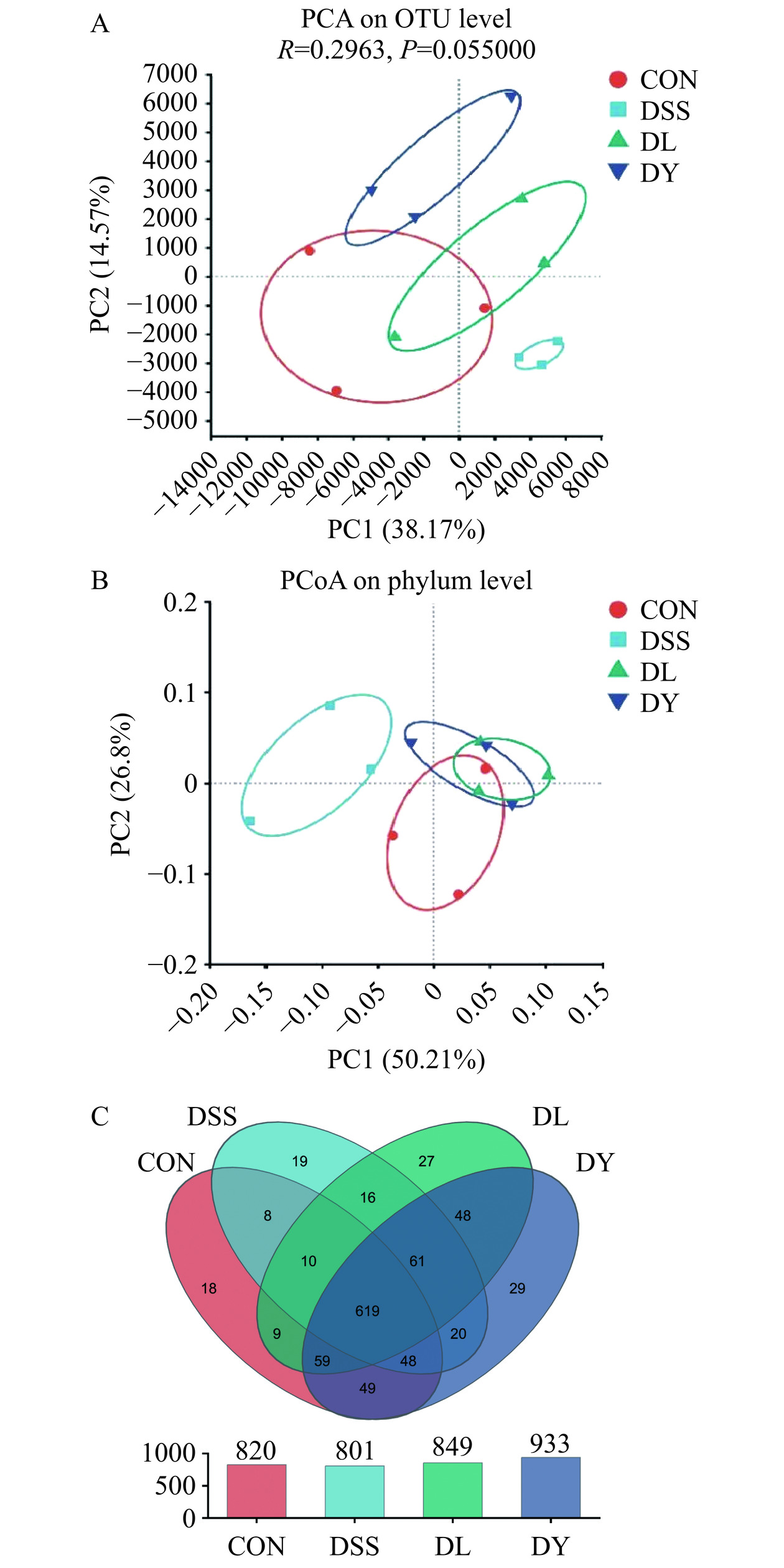
肠道微生物Beta多样性分析对于了解肠道微生物群落之间的相似性和差异性至关重要。PCA(图7A)和PCoA(图7B)显示,DSS组与其余三组聚集圈距离较远,DL组和DY组与CON组聚集圈距离接近,说明DSS组与其余三组肠道菌群Beta多样性差异较大,DL组和DY组与CON组肠道菌群Beta多样性较为相似。Venn图(图7C)表示4组中16个样本中所独有和共有的物种数目,从Venn图中可以观察到CON组、DSS组、DL组和DY组分别有820、801、849、933个OTUs,与CON组相比,DSS组减少了19个OTUs;与DSS组相比,DL组增加了48个OTUs,DY组增加了132个OTUs;DY组比DL组多了84个OTUs。结果说明GYP可以增加UC大鼠肠道菌群物种数目。
2.4.3 门水平上的物种相对丰度
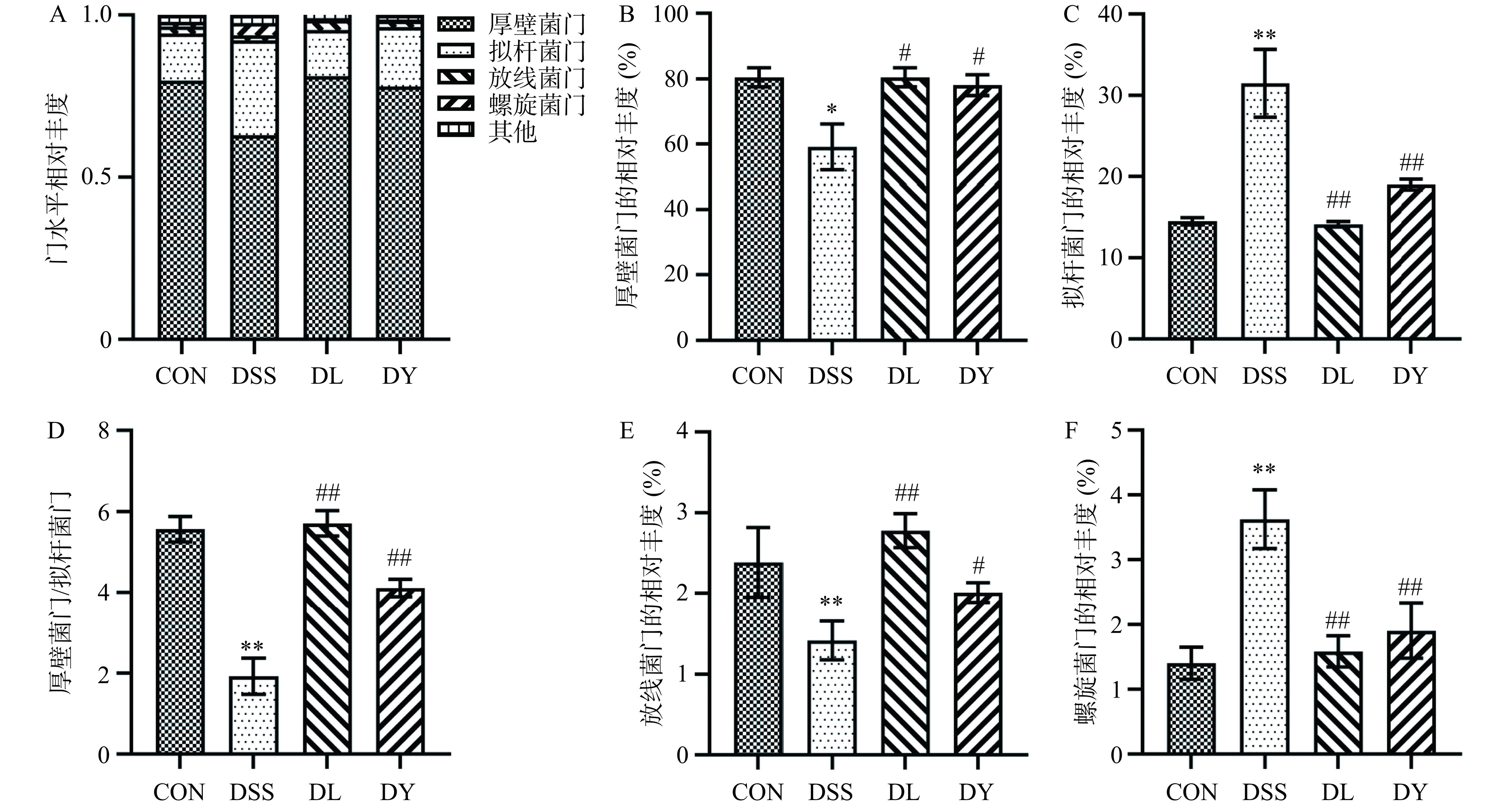
由图8A可知,在门水平,四组大鼠的肠道菌群以厚壁菌门、拟杆菌门、放线菌门和螺旋菌门为主。根据图8B~F的数据显示,与CON组相比,DSS组大鼠体内厚壁菌门的相对丰度显著降低(P<0.05),厚壁菌门和拟杆菌门的比值以及放线菌门的相对丰度极显著降低(P<0.01);拟杆菌门和螺旋菌门的相对丰度极显著增加(P<0.01)。与DSS组对比,DL组和DY组厚壁菌门的相对丰度显著增加(P<0.05),厚壁菌门和拟杆菌门的比值极显著增加(P<0.01),拟杆菌门和螺旋菌门的相对丰度极显著降低(P<0.01)。此外,与DSS组相比,DL组放线菌门的相对丰度极显著增加(P<0.01),DY组放线菌门的相对丰度显著增加(P<0.05)。这与Jia等[33]研究一致。厚壁菌门和放线菌门是常见的优势菌门,在维持肠道稳态中发挥着重要作用[34]。拟杆菌门能够刺激肠道产生过多的促炎因子,是UC主要的致病菌门[35]。肠道微生物群中厚壁菌门与拟杆菌门的比值降低是菌群失调的关键指标,已被用于评估UC的炎症程度[36]。螺旋菌门是一种潜在的肠道致病菌[37]。由此可见,DSS造模使UC大鼠肠道有益菌门减少,有害菌门增加;GYP能在一定程度上降低肠道有害菌门的相对丰度,增加有益菌门的数量。
2.4.4 属水平上的物种相对丰度
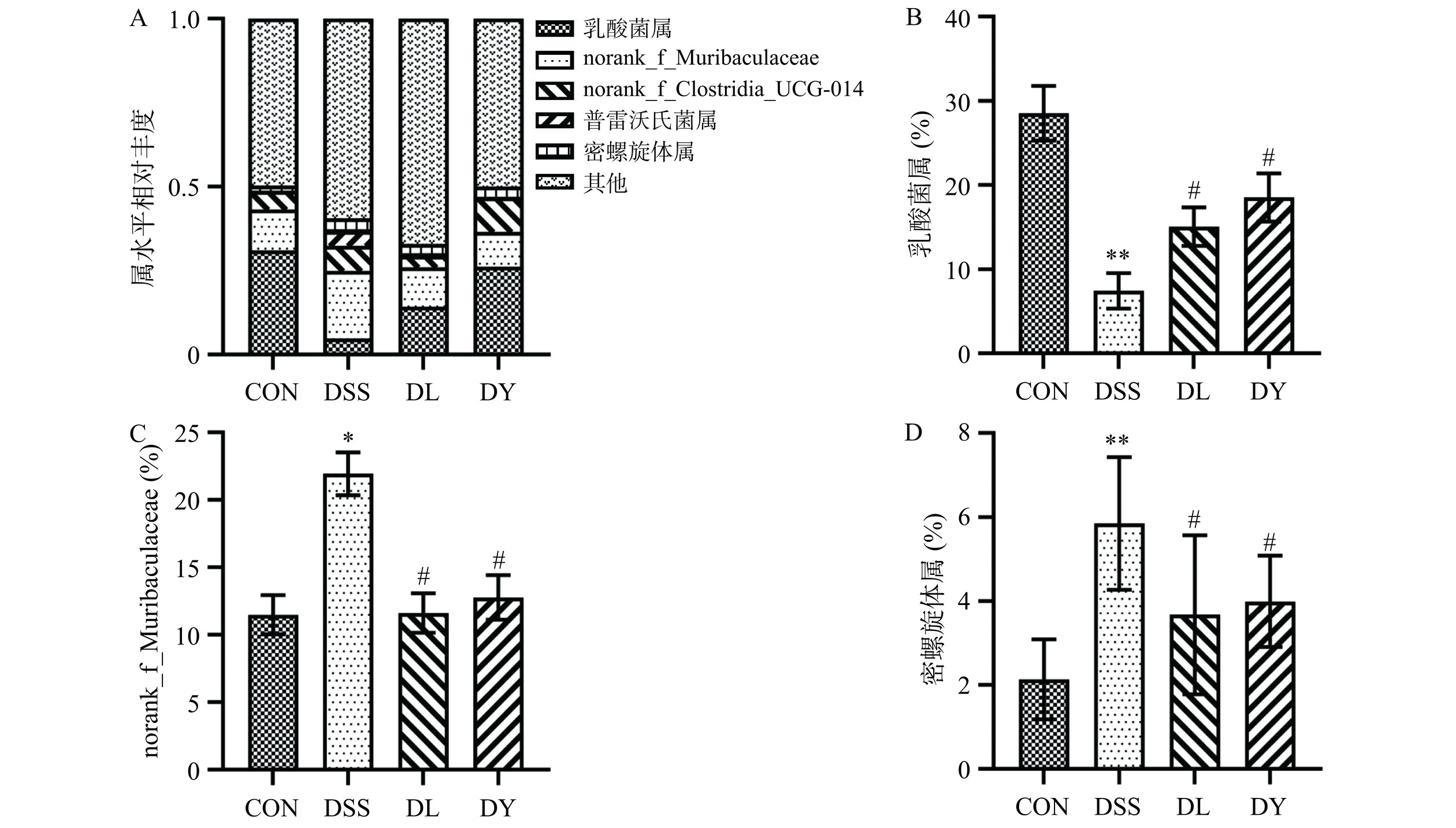
如图9所示,在属水平上,与CON组相比,DSS组极显著降低了乳酸菌属的相对丰度(P<0.01),极显著增加了密螺旋体属的相对丰度(P<0.01),显著增加了norank_f__Muribaculaceae的相对丰度(P<0.05);与DSS组相比,DL和DY组显著增加了乳酸菌属的相对丰度(P<0.05),显著降低了norank_f__Muribaculaceae和密螺旋体属的相对丰度(P<0.05)。Zou等[38]研究发现DSS组乳酸菌属的相对丰度降低,密螺旋体属和norank_f__Muribaculaceae的相对丰度增加。研究表明,乳酸菌属属于厚壁菌门,能作为益生菌缓解UC[39]。norank_f__Muribaculaceae属于拟杆菌门,norank_f__Muribaculaceae的变化主要与各种饮食治疗有关[40]。密螺旋体属因其外膜脱落而被称为“隐形病原体”,其主要成分为非免疫原性跨膜蛋白[41]。结果表明经GYP干预后,UC大鼠体内有益菌属(乳酸菌属)的相对丰度显著增加(P<0.05),有害菌属(norank_f__Muribaculaceae和密螺旋体属)的相对丰度显著降低(P<0.05)。
2.4.5 SCFAs与肠道菌群属水平优势物种的Pearson相关性分析
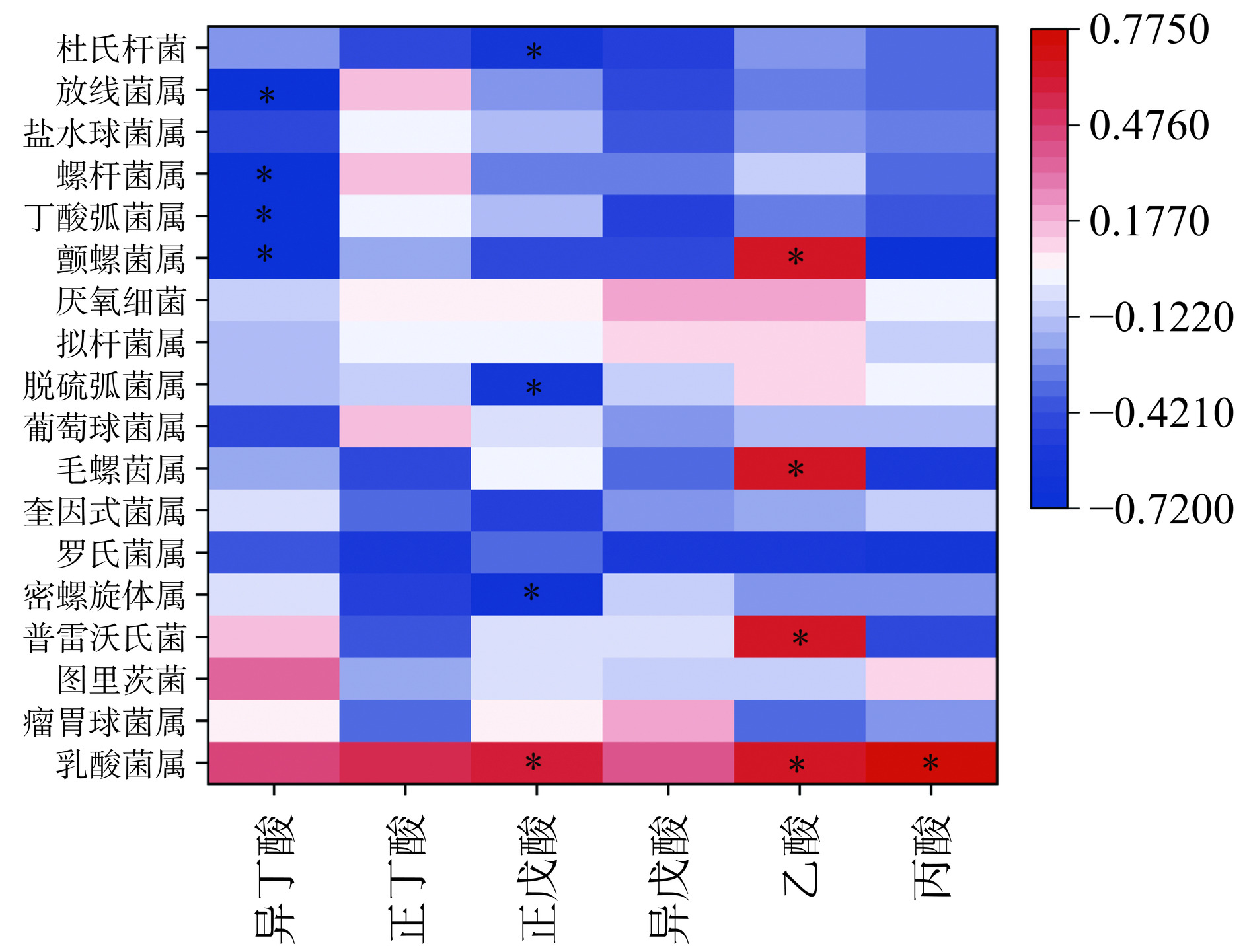
为了进一步探究肠道菌群与环境因子的相关性,使用Pearson相关性分析肠道微生物群和SCFAs之间的相关性。由图10可知,乳酸菌属、普雷沃氏菌、毛螺菌属和颤螺菌属与乙酸呈显著正相关(P<0.05);密螺旋体属和脱硫弧菌属与正戊酸呈显著负相关(P<0.05)。这些结果与彭宇等[42]报道一致。乳酸菌属可通过释放乙酸等抗菌介质来发挥肠道抗炎作用,抑制结肠炎的发生[43]。普雷沃氏菌属于拟杆菌门,普雷沃氏菌能够发酵多种复杂的碳水化合物,从而产生SCFAs,如乙酸等[44]。毛螺菌属属于厚壁菌门,被认为是潜在的有益菌[45]。颤螺菌属已被定性为下一代益生菌候选物之一[46]。脱硫弧菌属是一种潜在UC致病菌[47]。说明肠道菌群属水平物种与SCFAs有关,提示GYP能够通过调控乳酸菌属、普雷沃氏菌、毛螺菌属、颤螺菌属、密螺旋体属和脱硫弧菌属的相对丰度调控UC小鼠的乙酸和正戊酸含量。
2.5 网络药理学分析及分子对接
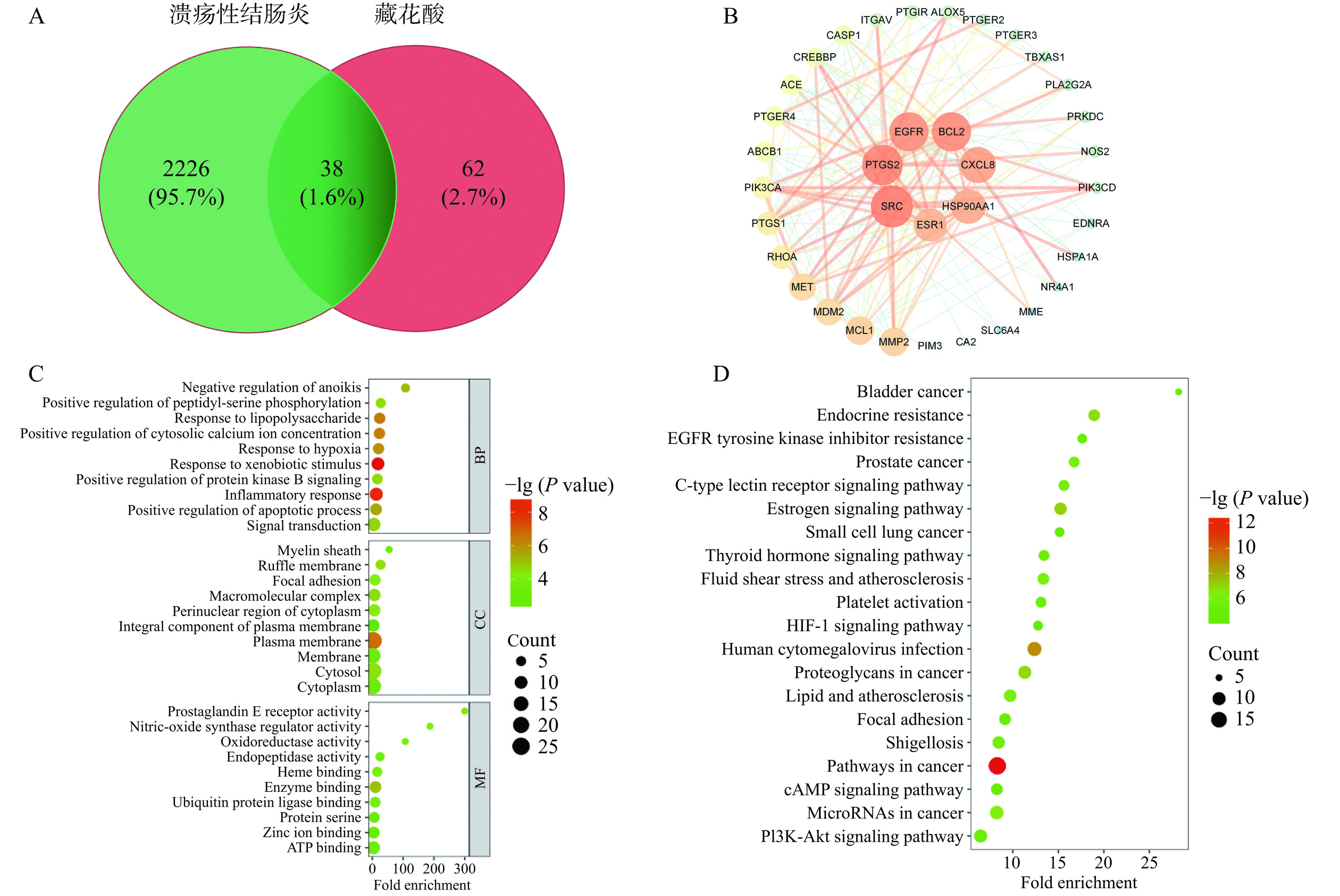
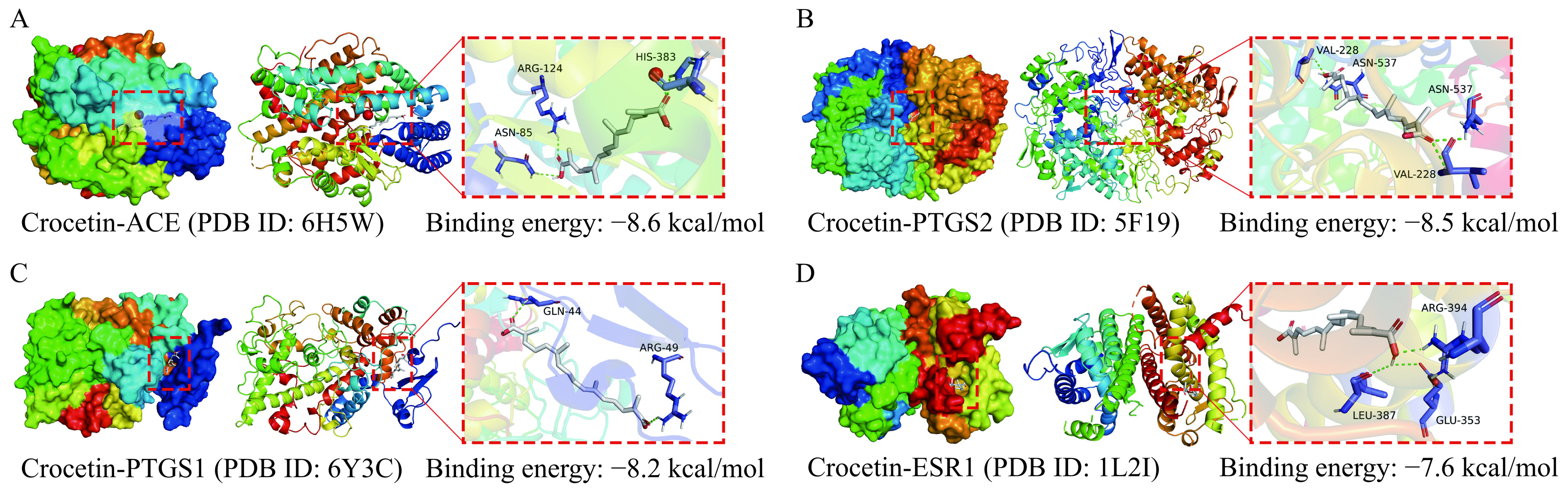
前期发现GYP中的藏花素与已知药物的相似性值为0.12、生物口服利用度值为7.06,且发现其与UC的有效靶点为0,基于此,选择藏花酸为后续研究的关键成分。从Swiss Target Prediction数据库中发现藏花酸靶点有100个,基于Dis Ge NET数据库中收集到的UC靶点1458个,Gene Card数据库中收集到的UC靶点5332个,并对Gene Card数据库中Relevance score小于3.0的数据进行筛除,最终得到1476个靶点。从Dis Ge NET数据库和Gene Card的数据库中共收集到2264个UC相关基因。图11A显示,藏花酸缓解UC潜在靶点基因有38个;图11B显示,藏花酸缓解UC核心靶蛋白共有36个节点,196条边,以Betweenness>27.83、Centrality>0.02、Degree>10.89为筛选条件,获得藏花酸缓解UC的核心靶蛋白有SRC、PTGS2、EGFR、BCL2、CXCL8、HSP90AA1、ESR1、MMP2、MDM2、PTGS1、ACE。将藏花酸缓解UC的38个交集靶点录入DAVID平台,进行GO功能分析。共得到GO通路208个条目,将排名前10的结果进行可视化,如图11C所示。生物过程包括162个条目,包括对外源性刺激的反应(response to xenobiotic stimulus)、炎症反应(inflammatory response)等;细胞成分包括29个条目,主要涉及质膜(plasma membrane)、大分子复合物(macromolecular complex)等;分子功能包括17个条目,主要涉及酶结合(enzyme binding)等。将藏花酸和UC的共有靶点进行KEGG通路富集分析,共得到86条信号通路,选出排名前20条通路进行可视化分析,如图11D所示,这些靶点主要汇集在HIF-1信号通路(HIF-1 signaling pathway)、脂质与动脉粥样硬化(lipid and atherosclerosis)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)等,HIF-1信号通路与肠道免疫之间存在密切联系[48],PI3K-Akt信号通路在抑制炎症过程中发挥着关键作用[49],这些通路可能是藏花酸缓解UC的关键通路。据报道,结合能越小说明分子与蛋白之间对接越好[50],表3显示藏花酸与11个核心靶点蛋白的结合能均小于−5.0 kcal/mol,其中ACE结合能最小。ACE可减少促炎细胞因子的释放,并对调节肠道菌群起到有益作用[51]。将结合能小于−7.0 kcal/mol的4个核心靶点蛋白进行分子对接可视化,结果如图12。以上结果表明,GYP可能通过藏花酸作用于ACE等核心靶蛋白,通过抑制肠道炎症反应等功能,实现缓解UC的作用。
表 3 核心靶蛋白与藏花酸的结合能Table 3. Binding energy of the core target protein to crocetin核心靶蛋白 结合能(kcal/mol) SRC -6.6 PTGS2 -8.5 EGFR -6.9 BCL2 -6.5 CXCL8 -6.4 HSP90AA1 -6.5 ESR1 -7.6 MMP2 -5.4 MDM2 -6.1 PTGS1 -8.2 ACE -8.6 3. 结论
本研究发现,GYP能显著缓解UC大鼠的症状,增加肠道有益菌群,特别是乳酸菌属,同时提高SCFAs含量,尤其是乙酸。通过计算机模拟和数据库分析,发现藏花酸是GYP缓解UC的关键成分,藏花酸可能通过HIF-1信号通路、PI3K-Akt信号通路和作用于ACE等靶点缓解UC。研究结果可为缓解UC提供一种潜在的新策略。未来的研究可以进一步探索藏花酸的最佳应用剂量和具体作用机制,为后续深入挖掘栀子功能成分提取物及开发栀子功能性产品提供更加充分的科学依据。
-
表 1 DAI评分标准
Table 1 Scoring standard of DAI
分数 体重下降率(%) 粪便形状 便血情况 0 0 正常 正常 1 1~5 松散但有形 有便血点 2 6~10 松散 成块便血 3 11~15 非常松散、潮湿 成片便血 4 >15 稀便 便血及肛门肿胀 表 2 结肠组织病理学损伤评分
Table 2 Histopathological damage score of colon
评分 病变深度 隐窝损伤 炎症 0 无 无 无 1 粘膜层 1/3隐窝消失 轻度炎症和水肿 2 黏膜及黏膜下层 2/3隐窝消失 轻中度炎症 3 黏膜全层 隐窝基本消失,上皮层尚完整 中度炎症 4 黏膜全层及肌层 隐窝及上皮层完全消失 重度炎症 表 3 核心靶蛋白与藏花酸的结合能
Table 3 Binding energy of the core target protein to crocetin
核心靶蛋白 结合能(kcal/mol) SRC -6.6 PTGS2 -8.5 EGFR -6.9 BCL2 -6.5 CXCL8 -6.4 HSP90AA1 -6.5 ESR1 -7.6 MMP2 -5.4 MDM2 -6.1 PTGS1 -8.2 ACE -8.6 -
[1] OLIVEIRA N, SCHNEIDER V S, BUENO L R, et al. CPW partially attenuates DSS-induced ulcerative colitis in mice[J]. Food Research International,2023,173(Pt 1):113−134.
[2] WANG Z H, ZHANG G Y, SUN C, et al. Targeting DSS-induced ulcerative colitis:Evaluating the therapeutic potential of WPI-stachyose conjugates[J]. Food & Function,2024,15(1):96−109.
[3] LE BERRE C, HONAP S, PEYRIN-BIROULET L. Ulcerative colitis[J]. Lancet,2023,402(10401):571−584. doi: 10.1016/S0140-6736(23)00966-2
[4] 潘媛, 李隆云, 王钰, 等. 我国主要栀子栽培资源分布与综合利用调查[J]. 天然产物研究与开发,2019,31(10):1823−1830. [PAN Y, LI L Y, WANG Y, et al. Investigation report on distribution and comprehensive utilization of Gardenia jasminoides cultivar resources in China[J]. Natural Product Research and Development,2019,31(10):1823−1830.] PAN Y, LI L Y, WANG Y, et al. Investigation report on distribution and comprehensive utilization of Gardenia jasminoides cultivar resources in China[J]. Natural Product Research and Development, 2019, 31(10): 1823−1830.
[5] 任治军, 何开泽, 谭健, 等. 大孔吸附树脂精制栀子黄色素[J]. 食品科学,2005,26(11):137−142. [REN Z J, HE K Z, TAN J, et al. Purification of gardenia yellow by macroporous adsorption resin[J]. Food Science,2005,26(11):137−142.] doi: 10.3321/j.issn:1002-6630.2005.11.029 REN Z J, HE K Z, TAN J, et al. Purification of gardenia yellow by macroporous adsorption resin[J]. Food Science, 2005, 26(11): 137−142. doi: 10.3321/j.issn:1002-6630.2005.11.029
[6] 汤丽琴, 刘昊澄, 温靖, 等. 栀子黄色素提取、精制及药理活性的研究进展[J]. 食品工业科技,2022,43(15):428−435. [TANG L Q, LIU H C, WEN J, et al. Research progress of gardenia yellow pigment extraction, refining and pharmacological activity[J]. Food Industry Science and Technology,2022,43(15):428−435.] TANG L Q, LIU H C, WEN J, et al. Research progress of gardenia yellow pigment extraction, refining and pharmacological activity[J]. Food Industry Science and Technology, 2022, 43(15): 428−435.
[7] WU J, WANG X, HE Y, et al. Stability evaluation of gardenia yellow pigment in presence of different phenolic compounds[J]. Food Chemistry,2022,373(Pt A):131−141.
[8] PAN C, WEN Q, MA L, et al. Green-emitting silicon nanoparticles as a fluorescent probe for highly-sensitive crocin detection and pH sensing[J]. New Journal of Chemistry,2022,46(26):12729−12738. doi: 10.1039/D2NJ00690A
[9] GUO H, RUAN C, ZHAN X, et al. Crocetin protected human hepatocyte LO2 cell from TGF-beta-induced oxygen stress and apoptosis but promoted proliferation and autophagy via AMPK/m-TOR pathway[J]. Frontiers in Public Health,2022,10:909125. doi: 10.3389/fpubh.2022.909125
[10] 陈佳音, 上官发炜, 王萍, 等. 虾青素对DSS诱导的小鼠溃疡性结肠炎的影响[J]. 药物生物技术,2023,30(2):124−129. [CHEN J Y, SHANGGUAN F W, WANG P, et al. The effect of astaxanthin on DSS induced ulcerative colitis in mice[J]. Pharmaceutical Biotechnology,2023,30(2):124−129.] CHEN J Y, SHANGGUAN F W, WANG P, et al. The effect of astaxanthin on DSS induced ulcerative colitis in mice[J]. Pharmaceutical Biotechnology, 2023, 30(2): 124−129.
[11] HE L, ZHANG F, JIAN Z, et al. Stachyose modulates gut microbiota and alleviates dextran sulfate sodium-induced acute colitis in mice[J]. Saudi Journal of Gastroenterology,2020,26(3):153−159. doi: 10.4103/sjg.SJG_580_19
[12] 曹亚楠, 刘常金, 韩世明, 等. 栀子黄色素富集纯化对其抑制LDL氧化修饰的影响[J]. 精细化工,2020,37(4):741−751. [CAO Y N, LIU C J, HAN S M, et al. Effect of gardenia yellow pigment enrichment and purification on its inhibition of LDL oxidation modification[J]. Fine Chemicals,2020,37(4):741−751.] CAO Y N, LIU C J, HAN S M, et al. Effect of gardenia yellow pigment enrichment and purification on its inhibition of LDL oxidation modification[J]. Fine Chemicals, 2020, 37(4): 741−751.
[13] DAKHLI N, RTIBI K, ARRARI F, et al. Prophylactic coloprotective effect of Urtica dioica leaves against dextran sulfate sodium (DSS)-induced ulcerative colitis in rats[J]. Medicina (Kaunas),2023,59(11):1−15.
[14] REN D D, CHEN K C, LI S S, et al. Panax quinquefolius polysaccharides ameliorate ulcerative colitis in mice induced by dextran sulfate sodium[J]. Frontiers in Immunology,2023,14:1161625. doi: 10.3389/fimmu.2023.1161625
[15] METTE K, MAJA NRGAARD K, RAMAKRISHNAN V, et al. Assessing acute colitis induced by dextran sulfate sodium in rats and its impact on gastrointestinal fluids[J]. Drug Delivery and Translational Research,2023,68:1−13.
[16] 袁丽, 练卓诗, 罗柳婷, 等. 陈皮酵素调节肠菌稳态及Nrf2/NLRP3通路修复肠黏膜改善小鼠急性溃疡性结肠炎[J]. 药学学报,2022,57(12):3513−3523. [YUAN L, LIAN Z S, LUO L T, et al. Xinhui citrus fermentation liquor ameliorates acute ulcerative colitis in mice via regulating intestinal bacteria homeostasis and Mrf2/NLRP3 pathway to repair intestinal mucosa[J]. Acta Pharmaceutica Sinica,2022,57(12):3513−3523.] YUAN L, LIAN Z S, LUO L T, et al. Xinhui citrus fermentation liquor ameliorates acute ulcerative colitis in mice via regulating intestinal bacteria homeostasis and Mrf2/NLRP3 pathway to repair intestinal mucosa[J]. Acta Pharmaceutica Sinica, 2022, 57(12): 3513−3523.
[17] BUENO L R, DA SILVA SOLEY B, ABBOUD K Y, et al. Protective effect of dietary polysaccharides from yellow passion fruit peel on DSS-induced colitis in mice[J]. Oxidative Medicine and Cellular Longevity,2022,2022:1−15.
[18] 吴睿婷, 付王威, 万敏, 等. 黑灵芝多糖对糖尿病大鼠血糖血脂调节及肠道菌群的影响[J]. 食品科学,2022,43(5):91−102. [WU R T, FU W W, WAN M, et al. Effect of polysaccharide from Ganoderma atrum on hyperglycemia, blood lipid and gut microbiota of diabetic rats[J]. Food Science,2022,43(5):91−102.] doi: 10.7506/spkx1002-6630-20201203-046 WU R T, FU W W, WAN M, et al. Effect of polysaccharide from Ganoderma atrum on hyperglycemia, blood lipid and gut microbiota of diabetic rats[J]. Food Science, 2022, 43(5): 91−102. doi: 10.7506/spkx1002-6630-20201203-046
[19] 王心舞. 噬菌体鸡尾酒-肠道菌群移植对细菌性结肠炎实验治疗及作用的分子机制[D]. 长春:吉林大学, 2022:72−73. [WANG X W. Phage cocktail-intestinal microbiota transplantation for experimental treatment of bacterial colitis and its molecular mechanism[D]. Changchun:Jilin University, 2022:72−73.] WANG X W. Phage cocktail-intestinal microbiota transplantation for experimental treatment of bacterial colitis and its molecular mechanism[D]. Changchun: Jilin University, 2022: 72−73.
[20] EDGAR R C. Uparse:Highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods,2013,10(10):996−998. doi: 10.1038/nmeth.2604
[21] KAWAI S, IIJIMA H, SHINZAKI S, et al. Indigo naturalis ameliorates murine dextran sodium sulfate-induced colitis via aryl hydrocarbon receptor activation[J]. Journal of Gastroenterology,2017,52(8):904−919. doi: 10.1007/s00535-016-1292-z
[22] 严媛, 吴伟杰, 郜海燕, 等. 茭白壳提取物对小鼠溃疡性结肠炎的预防作用[J]. 食品科学,2022,43(23):97−105. [YAN Y, WU W J, GAO H Y, et al. Preventive effect of Zizania latifolia shell extract on ulcerative colitis in mice[J]. Food Science,2022,43(23):97−105.] doi: 10.7506/spkx1002-6630-20220602-027 YAN Y, WU W J, GAO H Y, et al. Preventive effect of Zizania latifolia shell extract on ulcerative colitis in mice[J]. Food Science, 2022, 43(23): 97−105. doi: 10.7506/spkx1002-6630-20220602-027
[23] LARSEN I S, JENSEN B, BONAZZI E, et al. Fungal lysozyme leverages the gut microbiota to curb DSS-induced colitis[J]. Gut Microbes,2021,13(1):1988836. doi: 10.1080/19490976.2021.1988836
[24] YOU C, XING J, SUN J, et al. Anti-inflammatory and anti-oxidant impacts of lentinan combined with probiotics in ulcerative colitis[J]. Molecular Biotechnology,2023,11(1):1−14.
[25] 马晓兰, 董朕, 岳美杉, 等. 博落回叶提取物对小鼠溃疡性结肠炎的影响[J]. 中国畜牧兽医,2023,50(11):4664−4680. [MA X L, DONG Z, YUE M S, et al. Effect of Macleaya cordata leaf extract on ulcerative colitis in mice[J]. China Animal Husbandry & Veterinary Medicine,2023,50(11):4664−4680.] MA X L, DONG Z, YUE M S, et al. Effect of Macleaya cordata leaf extract on ulcerative colitis in mice[J]. China Animal Husbandry & Veterinary Medicine, 2023, 50(11): 4664−4680.
[26] JEON Y D, BANG K S, SHIN M K, et al. Retraction note:Regulatory effects of glycyrrhizae radix extract on DSS-induced ulcerative colitis[J]. BMC Complementary and Alternative Medicine,2023,23(1):213. doi: 10.1186/s12906-023-04051-3
[27] 吴苹, 刘晋倩, 董晶, 等. 鱼腥草多糖对DSS诱导小鼠结肠炎的改善作用[J]. 食品工业科技,2021,42(23):362−369. [WU P, LIU J Q, DONG J, et al. Improving effect of Houttuynia cordata polysaccharide on dextran sodium sulfate-induced ulcerative colitis[J]. Food Industry Science and Technology,2021,42(23):362−369.] WU P, LIU J Q, DONG J, et al. Improving effect of Houttuynia cordata polysaccharide on dextran sodium sulfate-induced ulcerative colitis[J]. Food Industry Science and Technology, 2021, 42(23): 362−369.
[28] MADJIREBAYE P, PENG F, MUEED A, et al. Exploring impact of probiotic-fermented soymilk on dextran-sulfate-sodium-induced ulcerative colitis via modulating inflammation and gut microbiota profile[J]. Molecular Nutrition Food Research,2024,68(5):e2300586. doi: 10.1002/mnfr.202300586
[29] SHIN Y, HAN S, KWON J, et al. Roles of short-chain fatty acids in inflammatory bowel disease[J]. Nutrients,2023,15(20):365−377.
[30] XIE J, LIU Y, CHEN B, et al. Ganoderma lucidum polysaccharide improves rat DSS-induced colitis by altering cecal microbiota and gene expression of colonic epithelial cells[J]. Food & Nutrition Research,2019,63(1):1−15.
[31] NING K, SHI C, CHI Y Y, et al. Portulaca oleracea L. polysaccharide alleviates dextran sulfate sodium-induced ulcerative colitis by regulating intestinal homeostasis[J]. International Journal of Biological Macromolecules, 2024, 256(Pt 2):128375.
[32] MO J, NI J, ZHANG M, et al. Mulberry anthocyanins ameliorate DSS-induced ulcerative colitis by improving intestinal barrier function and modulating gut microbiota[J]. Antioxidants,2022,11(9):1−17.
[33] JIA Y Q, YUAN Z W, ZHANG X S, et al. Total alkaloids of Sophora alopecuroides L. ameliorated murine colitis by regulating bile acid metabolism and gut microbiota[J]. Journal of Ethnopharmacology,2020,255:112775. doi: 10.1016/j.jep.2020.112775
[34] LEE J W, COWLEY E S, WOLF P G, et al. Formation of secondary allo-bile acids by novel enzymes from gut firmicutes[J]. Gut Microbes,2022,14(1):2132903. doi: 10.1080/19490976.2022.2132903
[35] CHEN L A, YU H, ALBESIANO E, et al. A sensitive stool diagnostic assay to study enterotoxigenic bacteroides fragilis in inflammatory bowel disease and colitis-associated cancer[J]. Gastroenterology,2011,140(5):S360−S360.
[36] CHANG H D, ZHEN J L, JING Z, et al. The protective effect of carnosic acid on dextran sulfate sodium-induced colitis based on metabolomics and gut microbiota analysis[J]. Food Science and Human Wellness,2023,12(4):1212−1223. doi: 10.1016/j.fshw.2022.10.003
[37] XIANG X, JIANG Q, SHAO W, et al. Protective effects of shrimp peptide on dextran sulfate sodium-induced colitis in mice[J]. Frontiers in Nutrition,2021,8:773064. doi: 10.3389/fnut.2021.773064
[38] ZOU W, FU Z, GUO X, et al. Whey protein hydrolysate exerts anti-inflammatory effects to alleviate dextran sodium sulfate (DSS)-induced colitis via microbiome restoration[J]. Nutrients,2023,15(20):4393. doi: 10.3390/nu15204393
[39] ROY S, DHANESHWAR S. Role of prebiotics, probiotics, and synbiotics in management of inflammatory bowel disease:Current perspectives[J]. World Journal of Gastroenterology,2023,29(14):2078−2100. doi: 10.3748/wjg.v29.i14.2078
[40] LAGKOUVARDOS I, LESKER T R, HITCH T, et al. Sequence and cultivation study of Muribaculaceae reveals novel species, host preference, and functional potential of this yet undescribed family[J]. Microbiome,2019,7(1):28. doi: 10.1186/s40168-019-0637-2
[41] MARCEKOVA P, MAD'AR M, STYKOVA E, et al. The presence of Treponema spp. in equine hoof canker biopsies and skin samples from bovine digital dermatitis lesions[J]. Microorganisms,2021,9(11):2190−2200. doi: 10.3390/microorganisms9112190
[42] 彭宇, 柴毛毛, 崔细鹏, 等. 丁酸类添加剂及其与合生元组合对肉鸡生长性能和肠道健康的影响[J]. 动物营养学报,2020,32(11):5145−5157. [PENG Y, CHAI M M, CUI X P, et al. Effects of butyric acids additives alone or combination with synbiotics on growth performance and gut health of broilers[J]. Chinese Journal of Animal Nutrition,2020,32(11):5145−5157.] doi: 10.3969/j.issn.1006-267x.2020.11.020 PENG Y, CHAI M M, CUI X P, et al. Effects of butyric acids additives alone or combination with synbiotics on growth performance and gut health of broilers[J]. Chinese Journal of Animal Nutrition, 2020, 32(11): 5145−5157. doi: 10.3969/j.issn.1006-267x.2020.11.020
[43] ZONG M, CHANG C, ANJUM R, et al. Multifunctional LPxTG-motif surface protein derived from Limosilactobacillus reuteri SH 23 in DSS-induced ulcerative colitis of mice[J]. The FASEB Journal,2023,37(5):e22895. doi: 10.1096/fj.2022-0252-RR
[44] WANG Y, LI Q, ZHANG J, et al. Ring1a protects against colitis through regulating mucosal immune system and colonic microbial ecology[J]. Gut Microbes,2023,15(2):2251646. doi: 10.1080/19490976.2023.2251646
[45] PRAAGH J B, GOFFAU M C, BAKKER I S, et al. Intestinal microbiota and anastomotic leakage of stapled colorectal anastomoses:A pilot study[J]. Gastroenterology,2016,30(6):2259−2265.
[46] YANG J, LI Y, WEN Z, et al. Oscillospira-a candidate for the next-generation probiotics[J]. Gut Microbes,2021,13(1):1987783. doi: 10.1080/19490976.2021.1987783
[47] BI Z, CUI E, YAO Y, et al. Recombinant bifidobacterium longum carrying endostatin protein alleviates dextran sodium sulfate-induced colitis and colon cancer in rats[J]. Frontiers in Microbiology,2022,13:927277. doi: 10.3389/fmicb.2022.927277
[48] KERBER E L, PADBERG C, KOLL N, et al. The importance of hypoxia-inducible factors (HIF-1and HIF-2) for the pathophysiology of inflammatory bowel disease[J]. International Journal of Molecular Sciences,2020,21(22):8551. doi: 10.3390/ijms21228551
[49] KIM J H, LEE G, CHO Y L, et al. Desmethylanhydroicaritin inhibits NF-kappaB-regulated inflammatory gene expression by modulating the redox-sensitive PI3K/PTEN/Akt pathway[J]. European Journal of Pharmacology,2009,602(2/3):422−431.
[50] KOORAVAND M, ASADPOUR S, HADDADI H, et al. An insight into the interaction between malachite green oxalate with human serum albumin:Molecular dynamic simulation and spectroscopic approaches[J]. Journal of Hazardous Materials,2021,407:124878. doi: 10.1016/j.jhazmat.2020.124878
[51] HAMAMOTO Y, KAWAMURA M, UCHIDA H, et al. Increased ACE2 and TMPRSS2 expression in ulcerative colitis[J]. Pathology-Research and Practice,2024,254:155108. doi: 10.1016/j.prp.2024.155108





 下载:
下载:
 下载:
下载:



