Inhibitory Effect of Genistein on α-Glucosidase and Its Molecular Mechanism
-
摘要: 为考察染料木素对α-葡萄糖苷酶的抑制作用,本文采用体外消化试验研究染料木素对淀粉消化特性影响,通过酶动力学、荧光光谱分析、分子对接等方法分析染料木素对α-葡萄糖苷酶的抑制类型及分子机制。结果表明,染料木素的加入使淀粉中的快消化淀粉含量显著减小(P<0.05),慢消化淀粉含量和抗性淀粉含量显著增加(P<0.05)。染料木素对α-葡萄糖苷酶的抑制呈剂量依赖性,半抑制浓度为1.10±0.06 mg/mL。抑制类型为以竞争性抑制作用占主导的混合性可逆抑制。染料木素通过与基态荧光团结合以及与激发态荧光团碰撞的方式,混合式淬灭α-葡萄糖苷酶的内在荧光。分子对接结合能小于−12 kJ/mol,表明染料木素与α-葡萄糖苷酶的结合能够自发进行。染料木素结合于α-葡萄糖苷酶疏水口袋,与Glu-429、Lys-432和Ile-419残基形成疏水相互作用,与Gly-161、Asn-235、Asn-317、Glu-422和His-423残基形成氢键,稳定染料木素与α-葡萄糖苷酶的结合,降低α-葡萄糖苷酶催化活性。本研究为染料木素在稳定血糖功能食品中的应用提供了理论支持。Abstract: To investigate the inhibitory effects of genistein on α-glucosidase activity, the effects of genistein on starch digestion characteristics were determined by in vitro digestion assays. The type and molecular mechanism of inhibition were examined based on enzyme kinetics, fluorescence spectroscopy, and molecular docking analyses. The results indicated that treatment with genistein significantly reduced the content of rapidly digestible starch (P<0.05) and promoted notable increases in the content of slowly digestible starch and resistant starch (P<0.05). Genistein inhibited α-glucosidase dose dependently, with an IC50 value of 1.10±0.06 mg/mL, and the inhibition type was identified to be predominantly competitive within a mixed reversible inhibition. Genistein quenching the intrinsic fluorescence of α-glucosidase with a mixed pattern by binding to the ground state fluorescent groups and colliding with the excited state fluorescent groups. The binding free energy from molecular docking was less than -12 kJ/mol, indicating that the binding of genistein to α-glucosidase could occur spontaneously. Moreover, genistein targeted the hydrophobic pocket of α-glucosidase, forming hydrophobic interactions with residues Glu-429, Lys-432, and Ile-419, and hydrogen bonds with Gly-161, Asn-235, Asn-317, Glu-422, and His-423. These interactions contributed to stabilizing the binding of genistein to α-glucosidase, thereby reducing its catalytic activity. The findings provide theoretical support for the application of genistein in functional foods for blood glucose stabilization.
-
Keywords:
- genistein /
- starch digestion /
- α-glucosidase /
- inhibition /
- fluorescence spectroscopy /
- molecular docking
-
糖尿病被认为是世界范围内的主要健康疾病之一[1]。全球成人中约有9%患有糖尿病,其中90%为2型糖尿病(type 2 diabetes mellitus,T2DM)[2]。T2DM由细胞对胰岛素的抵抗引起,是一种富含碳水化合物的食物被迅速消化吸收所导致的饮食调节疾病,T2DM及其并发症对全球健康造成了重大威胁[3]。淀粉是植物体中可再生的生物聚合物,在大多数国家,淀粉是每日能量供应的主要来源,几乎占人类膳食的40%~80%[4]。然而与其它食物相比,淀粉类食品的血糖反应较高,长期食用高血糖指数食物被认为是T2DM及其并发症的重要促成因素[5]。α-葡萄糖苷酶是将淀粉降解成单糖的关键消化酶,常作为T2DM的治疗靶点[6]。许多化合物通过对α-葡萄糖苷酶的抑制作用表现出其降血糖的生物活性[7−8]。常见的作为α-葡萄糖苷酶抑制剂的药物包括:阿卡波糖[9]、伏格列波糖[10]、米格列醇[11]。餐前低剂量口服阿卡波糖等α-葡萄糖苷酶抑制剂,能够减缓碳水化合物的消化,有效降低餐后血糖峰值[12]。然而许多α-葡萄糖苷酶抑制剂容易造成低血糖、胃肠功能紊乱、增加胰岛素抵抗和肝毒性等不良副作用[13],并且最终无法恢复葡萄糖稳态,因此寻找安全、有效、经济的膳食抗糖尿病化合物至关重要[14]。
食源性多酚作为一类天然的淀粉消化酶的抑制剂,普遍存在于果蔬等天然食物中,多酚类化合物因其较高的生物利用度和副作用小或无副作用的抗高血糖作用而受到广泛的关注[15]。染料木素是一种植物来源的多酚类天然有机化合物,是异黄酮类的植物次生代谢产物[16]。染料木素主要存在于豆科植物中,在槐角、苜蓿、大豆、山豆根、葛根中均有发现,人类饮食中的主要来源是大豆和豆制品[17]。染料木素具有多种生物活性,包括抗癌、抗氧化、抗糖尿病、预防骨质疏松等[18]。李勇等[19]从黑豆皮90%醇提物中分离得到6种酚酸类化合物,发现染料木素表现出较好的α-葡萄糖苷酶抑制活性,其半抑制浓度(IC50)低于阿卡波糖而高于大豆素。Son等[20]比较了来自大豆的4种多酚化合物抑制α-葡萄糖苷酶的能力,染料木素的抑制效力大于木犀草素和大豆异戊烯基异黄酮而小于大豆苷元,染料木素对α-葡萄糖苷酶的抑制表现出混合作用模式。基于分子对接和分子动力学模拟,证实染料木素能够降低人胰岛淀粉样多肽低聚物的毒性,抑制具有α-葡萄糖苷酶活性的N末端麦芽糖酶-葡萄糖淀粉酶[21]。
目前,染料木素对α-葡萄糖苷酶抑制作用靶点及影响机理研究较少。本研究以染料木素为研究对象,采用体外实验考察其对淀粉体外消化特性的影响,通过酶促动力学测定染料木素对α-葡萄糖苷酶的抑制效果,利用荧光光谱分析结合分子对接技术,探究染料木素抑制α-葡萄糖苷酶的结合位点及作用机制,以期为富含染料木素的植物资源的利用提供新思路,为染料木素在降糖类功能食品中的应用提供有益参考。
1. 材料与方法
1.1 材料与仪器
染料木素(纯度≥98%)、阿卡波糖(纯度≥98%)、对硝基苯基-α-D-吡喃葡萄糖苷(生物技术级,纯度99%)、大米淀粉 上海源叶生物科技有限公司;猪胰腺α-淀粉酶(E.C.3.2.1.1,10 U/mg)、黑曲霉淀粉葡萄糖苷酶(E.C.3.2.1.3,70 U/mg)、酿酒酵母α-葡萄糖苷酶(E.C.3.2.1.20,50 U/mg) 美国Sigma公司;葡萄糖测定试剂盒 爱尔兰Megazyme公司;其它试剂均为分析纯。
FA2004分析天平 上海越平科学仪器有限公司;HWS-26电热恒温水浴锅 上海一恒科学仪器有限公司;PHS-2F精密酸度计 上海雷磁仪电科学仪器有限公司;SHA-B水浴恒温振荡器 常州市国立试验设备研究所;TG16型高速离心机 上海卢湘仪离心机仪器有限公司;UV-5200紫外可见分光光度计 上海元析仪器有限公司;F-4600荧光分光光度计 日本日立公司。
1.2 实验方法
1.2.1 染料木素-淀粉混合体系消化特性测定
参考高嫚等[22]的方法,并稍作修改。配制一定体积的混合酶溶液,其中猪胰α-淀粉酶和淀粉葡萄糖苷酶的比活分别为150 U/mL和15 U/mL。在混合酶溶液中加入一定质量的染料木素使其质量浓度为0.4 mg/mL,并于37 ℃保温10 min。将100 mg大米淀粉加入25 mL含染料木素的混合酶溶液中,得到染料木素-淀粉混合体系。另取100 mg大米淀粉加入25 mL不含染料木素的混合酶溶液中,得到淀粉体系。将染料木素-淀粉混合体系和淀粉体系在37 ℃、160 r/min条件下水浴振荡。分别在0、20和120 min取出反应液,用葡萄糖测定试剂盒进行测定。按下列各式计算快消化淀粉(RDS)、慢消化淀粉(SDS)和抗性淀粉(RS)含量。
RDS(%)=(G20−G0)×0.9TS×100 (1) SDS%=(G120−G20)×0.9TS×100 (2) RS(%)=TS−RDS−SDSTS×100 (3) 式中:G0为淀粉中游离葡萄糖含量,mg;G20为孵育20 min后酶解液的葡萄糖含量,mg;G120为孵育120 min后酶解液的葡萄糖含量,mg;0.9为葡萄糖转化系数;TS为样品中总淀粉含量,mg。
1.2.2 α-葡萄糖苷酶抑制率测定
参考Wang等[23]的方法,并稍作修改。将不同质量(2、4、8、12、16、20 mg)的染料木素加入2 mL的α-葡萄糖苷酶溶液(0.01 U/mL)中,37 ℃孵育10 min后,加入2 mL的pNPG溶液(25.00 mmol/L)。37 ℃共孵育15 min后,加入6 mL的碳酸钠溶液(0.2 mol/L)终止反应。用分光光度计于405 nm进行比色,记录吸光值变化。以阿卡波糖作为阳性对照,将1 mL不同浓度(0.008、0.016、0.024、0.032、0.040、0.048 mg/mL)的阿卡波糖溶液加入1 mL的α-葡萄糖苷酶溶液(0.02 U/mL)中,37 ℃孵育10 min,加入2 mL的pNPG溶液(25.00 mmol/L)。37 ℃共孵育15 min后,加入6 mL的碳酸钠溶液(0.2 mol/L)终止反应并进行比色。按式(4)计算染料木素和阿卡波糖对α-葡萄糖苷酶的抑制率。通过SPSS非线性回归拟合计算半抑制浓度(IC50)。
抑制率(%)=(1−OD样品−OD样品空白OD酶液−OD缓冲液)×100 (4) 式中:OD样品为加入样品和酶的溶液吸光值;OD样品空白为只加样品不加酶的溶液吸光值;OD酶液为不加样品只加酶的溶液吸光值;OD缓冲液为缓冲溶液的吸光值。
1.2.3 酶抑制可逆性测定
参考Dong等[24]的方法,并稍作修改。取2 mL不同浓度(0.005、0.010、0.015、0.020、0.025 U/mL)的α-葡萄糖苷酶溶液,加入不同质量(0、4、8 mg)的染料木素,37 ℃孵育10 min。加入2 mL的pNPG溶液(25.00 mmol/L),37 ℃孵育15 min后,测定酶促反应体系吸光值变化。以酶浓度对酶促反应速度作图,分析染料木素对酶抑制作用的可逆性。
1.2.4 酶抑制动力学测定
参考Morteza等[25]的方法,并稍作修改。取2 mL的α-葡萄糖苷酶溶液(0.01 U/mL),加入不同质量(0、4、8 mg)的染料木素,37 ℃孵育10 min。加入2 mL不同浓度(5、10、15、20、25 mmol/L)的pNPG溶液,37 ℃孵育15 min后,加入6 mL的碳酸钠溶液(0.2 mol/L)终止反应。用分光光度计于405 nm进行比色,测定酶促反应体系吸光值变化。以酶促反应速度的倒数1/V对底物浓度的倒数1/[S]作图,分析染料木素对酶的可逆抑制作用类型。按Lineweaver-Burk方程计算米氏常数Km,按混合性可逆抑制作用方程计算竞争性抑制常数KIC和非竞争性抑制常数KIN[26]。
Lineweaver-Burk方程:
1V=KmVmax⋅1[S]+1Vmax (5) 混合性可逆抑制作用方程:
V=Vmax[S]Km(1+[I]KIC)+[S](1+[I]KIN) (6) 式(5)、(6)中:[S]为底物浓度,mg/mL;V为不同[S]时的反应速度,mg/(mL·min);Km为米氏常数,mg/mL;Vmax为最大反应速度,mg/(mL·min);[I]为抑制剂浓度,mg/mL;KIC为竞争性抑制常数,mg/mL;KIN为非竞争性抑制常数,mg/mL。
1.2.5 荧光光谱测定
参考Yu等[27]的方法,并稍作修改。在10 mL的α-葡萄糖苷酶溶液(1 U/mL)中,加入不同质量(0、5、10、20、30、40 mg)的染料木素,混匀后分别于273、298和310 K共孵育10 min,迅速测定其荧光强度。荧光分光光度计的激发、发射狭缝宽度5 nm,激发波长280 nm,发射波长300~400 nm,在发射光谱中扣除染料木素和缓冲液的背景空白。根据以下方程计算荧光淬灭参数。
Stern-Volmer动态碰撞淬灭方程:
F0F=1+KAτ0[Q] (7) 静态淬灭方程:
F0F=1+KQ[Q] (8) 解离常数双倒数方程:
1F0−F=1F0+KDF0[Q] (9) KD=1KAτ0 (10) 式中:F0和F为不存在和存在染料木素时酶的荧光强度;KA为表观淬灭速率常数,L/(mol·s);τ0为荧光体的荧光寿命,10 ns;[Q]为染料木素的浓度,mmol/L;KQ为静态淬灭常数,L/mol;KD为解离常数,mol/L。
结合力与热力学分析有助于确定淬灭剂对荧光体的抑制机制。根据式(11)计算不同温度下染料木素对α-葡萄糖苷酶的结合常数和结合位点数[28];根据式(12)、(13)计算染料木素与α-葡萄糖苷酶相互作用的热力学参数[29]。
lg(F0−FF)=lgKC+nlg[Q] (11) 式中:F0、F 和[Q]代表的含义同式(7);KC为结合常数,L/mol;n为结合位点数。
lnKQ2KQ1=ΔHR(1T1−1T2) (12) ΔG=−RTlnK=ΔH−TΔS (13) 式中:ΔH为焓变,kJ/mol;ΔG为自由能变化,kJ/mol;ΔS为熵变,J/(mol·K);R为气体常数,8.314 J/(mol·K);KQ1和KQ2为温度T1、T2时的静态淬灭常数,L/mol。
1.2.6 分子对接模拟
采用分子对接技术对小分子与蛋白质的结合构象进行研究,分析染料木素与α-葡萄糖苷酶相互作用的结合能、结合位点和结合模式。酿酒酵母α-葡萄糖苷酶晶体结构下载自RSCB蛋白质数据库,PDB ID: 3AJ7,使用PyMOL 2.3去除无关配体。染料木素三维结构下载自NCBI的PubChem数据库,Compound CID: 5280961。使用AutoDock 4.2对染料木素与α-葡萄糖苷酶进行分子对接,去除水分子、加极性氢后采用半柔性对接,利用拉马克遗传算法进行计算,对接测试100次。采用PyMOL 2.3进行可视化分析,通过PLIP Web工具分析非共价相互作用[30]。
1.3 数据处理
所有实验均进行3次重复,以平均值±标准差表示数据。使用SPSS 25对实验结果进行统计分析(P<0.05为差异显著)。图形使用Origin 2022进行绘制。
2. 结果与分析
2.1 染料木素对淀粉体外消化特性的影响
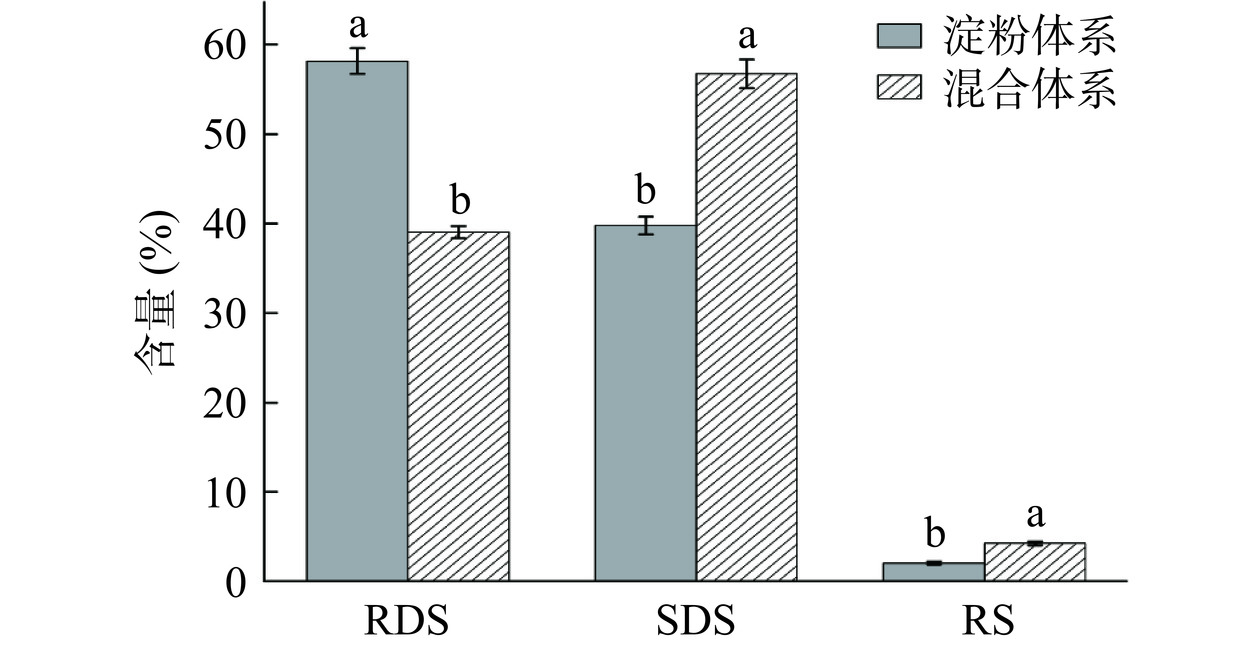
染料木素是一种有效的α-葡萄糖苷酶抑制剂,能够通过疏水结构域与酶发生相互作用,与α-葡萄糖苷酶可逆性的、缓慢的结合,影响酶的催化活性[31],进而延迟淀粉消化。然而,目前在酶抑制动力学的研究中,采用的α-葡萄糖苷酶的底物多为对硝基苯基-α-D-吡喃葡萄糖苷(pNPG)[32−33],但以淀粉作为反应底物,考察染料木素对淀粉体外消化特性的直接影响鲜有报道。本研究制备淀粉体系和染料木素-淀粉混合体系,其体外消化特性如图1所示。由图可知,添加染料木素后,混合体系的体外消化特性发生了明显的改变。淀粉体系的RDS含量58.15%±1.42%显著高于混合体系的RDS含量39.04%±0.68%(P<0.05),SDS和RS的含量显著低于混合体系(P<0.05)。说明染料木素对淀粉的消化有抑制作用,染料木素的添加使淀粉RDS的含量降低了32.86%,使SDS和RS的含量分别增加了42.57%和105.34%。Subaitha等[34]提到小米多酚含量的增加能够显著改善其对淀粉消化酶的抑制作用,从而降低了餐后血糖反应。多酚通过与淀粉消化酶特异位点的结合来降低淀粉消化率,也可能是通过改变淀粉的半结晶层导致V型淀粉形成,从而影响淀粉的体外消化特性[35]。
![]() 图 1 淀粉体系及混合体系体外消化特性注:不同小写字母表示有显著差异(P<0.05),图2同。Figure 1. In vitro digestion characteristics of starch systems and mixed systems
图 1 淀粉体系及混合体系体外消化特性注:不同小写字母表示有显著差异(P<0.05),图2同。Figure 1. In vitro digestion characteristics of starch systems and mixed systems2.2 染料木素对α-葡萄糖苷酶的抑制能力
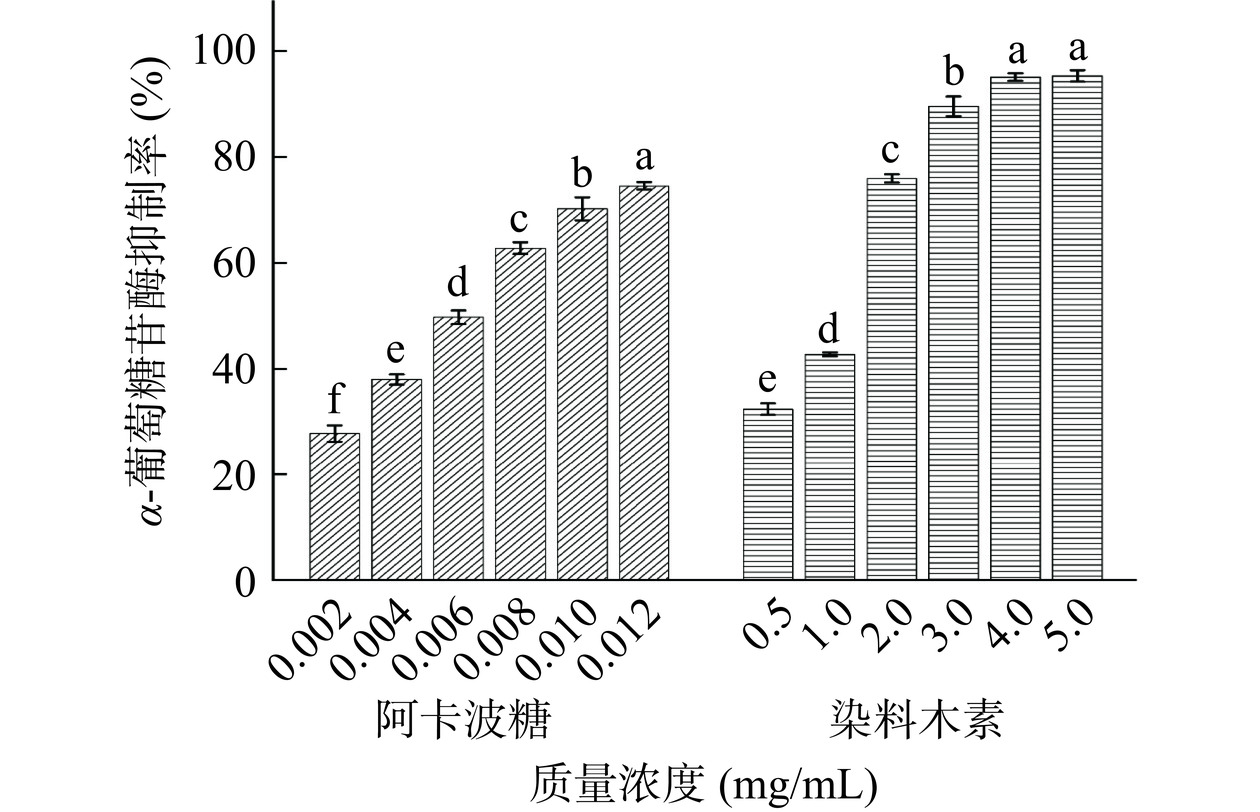
酶分子中必需基团的性质受到某些物质的影响而发生变化,导致酶活性的降低或丧失称为抑制作用。不同质量浓度的阿卡波糖(阳性对照)和染料木素对α-葡萄糖苷酶的抑制率如图2所示。随着质量浓度的增加,染料木素抑制α-葡萄糖苷酶的能力显著增强(P<0.05),表明染料木素对酶活性的抑制作用呈明显的剂量依赖性。Garbiec等[36]选择氨基酸与染料木素合成无定形体系,该体系表现出优越的α-葡萄糖苷酶抑制作用。非线性回归拟合计算染料木素的IC50为(1.10±0.06)mg/mL,阿卡波糖的IC50为(5.81±0.29)μg/mL,染料木素对α-葡萄糖苷酶的抑制能力低于阿卡波糖。
2.3 染料木素对α-葡萄糖苷酶抑制作用可逆性
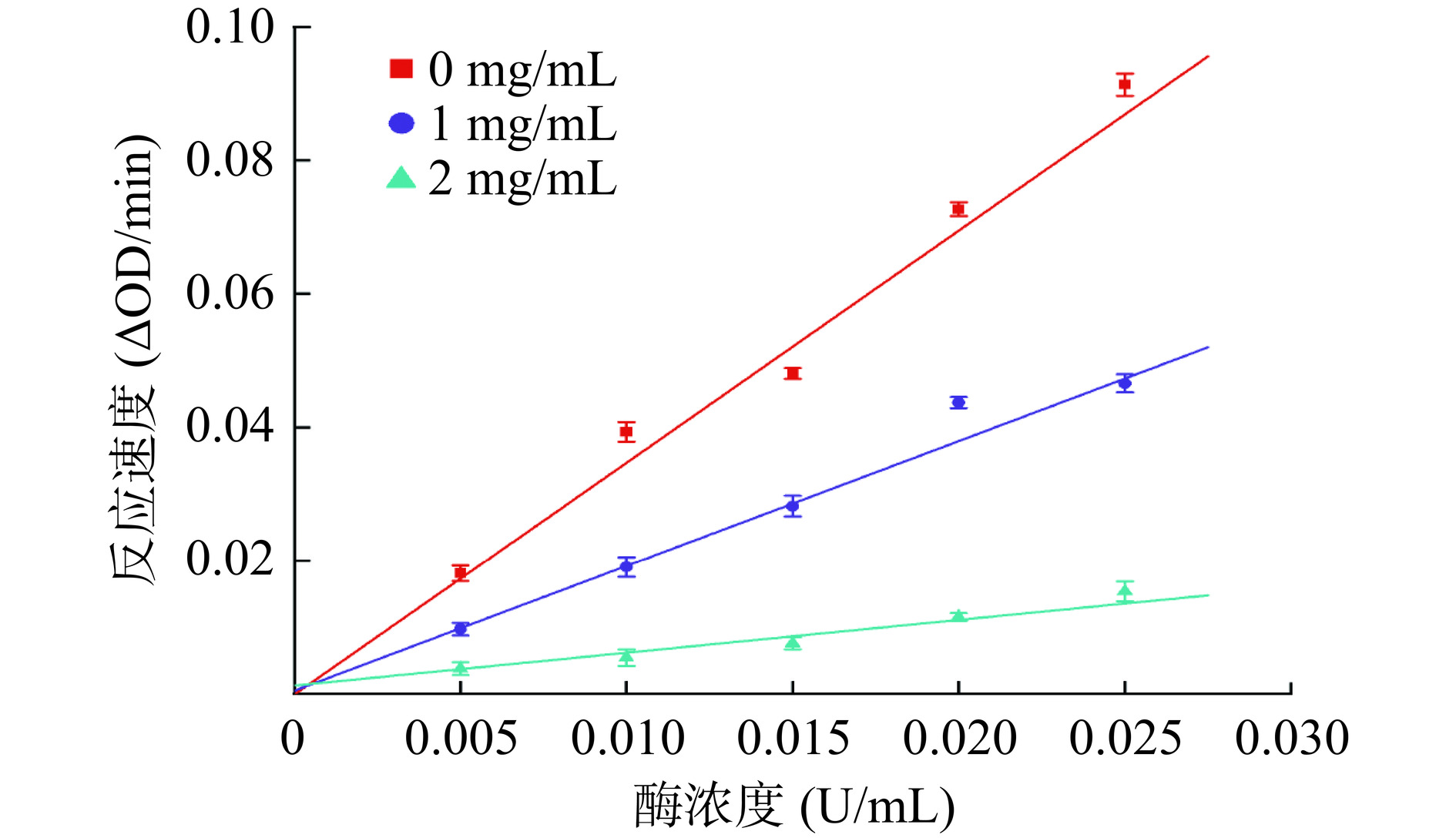
酶促反应抑制作用的类型分为可逆性抑制作用和不可逆性抑制作用。可逆性抑制作用是抑制剂以次级键与酶可逆结合,不可逆性抑制作用是抑制剂以较强的化学键(通常是共价键)与酶不可逆结合[37]。通过酶浓度对酶促反应速度作图,可以鉴别其抑制作用的类型。由图3可知,不同染料木素浓度的直线均相交于原点,且直线的斜率随着染料木素浓度的增加而下降,表明染料木素对α-葡萄糖苷酶的抑制作用是可逆的,染料木素通过次级键与α-葡萄糖苷酶可逆性结合。
2.4 染料木素对α-葡萄糖苷酶可逆抑制作用类型
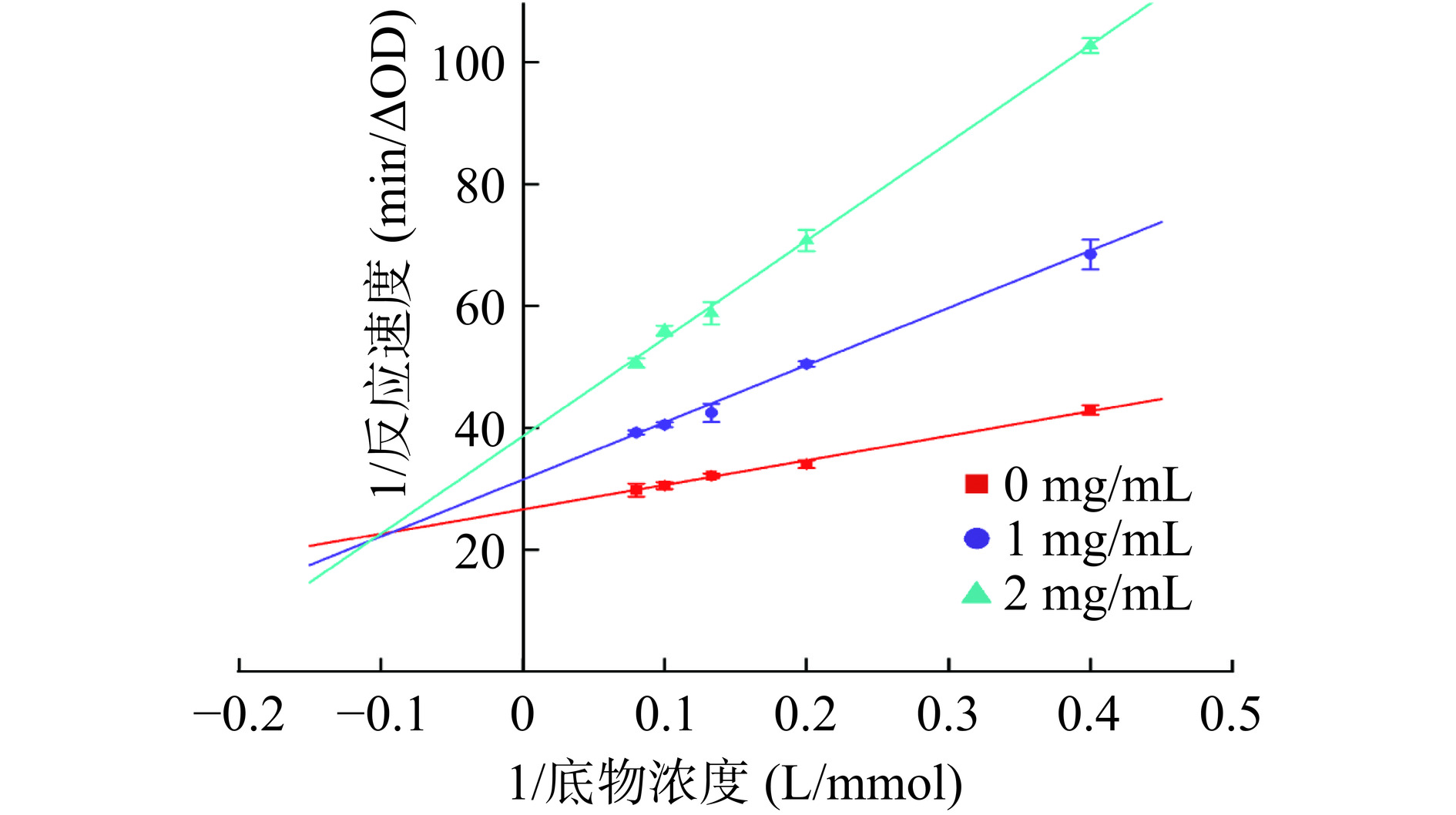
染料木素对α-葡萄糖苷酶的抑制动力学曲线如图4所示。不同浓度染料木素的Lineweave-Burk曲线线性关系良好,且相交于第二象限,随着染料木素浓度的增加,直线斜率增加,Km增加,Vmax减小,表明染料木素对α-葡萄糖苷酶的抑制属于混合性可逆抑制作用,其抑制程度介于竞争性抑制作用和非竞争性抑制作用之间[38]。染料木素既可以竞争酶活性中心的结合基团,产生竞争性抑制作用,也可以与酶活性中心的催化基团或活性中心以外的必需基团结合,产生非竞争性抑制作用。
米氏常数Km可近似表示酶对底物的亲和力,Km越大亲和力越小。抑制剂浓度为0、1和2 mg/mL时,Km分别为1.51、2.98和4.15 mg/mL,说明随着染料木素浓度的增加,α-葡萄糖苷酶对pNPG的亲和力明显下降。抑制常数KI可衡量抑制剂与酶的结合能力,染料木素的KIC为(0.71±0.03)mg/mL,KIN为(4.94±0.36)mg/mL。KIC值明显低于KIN值,表明在混合性可逆抑制作用中,竞争性抑制作用占主导,即染料木素与α-葡萄糖苷酶的结合比染料木素与α-葡萄糖苷酶-pNPG复合物的结合更稳定。
2.5 染料木素对α-葡萄糖苷酶的荧光淬灭效应
2.5.1 淬灭类型分析
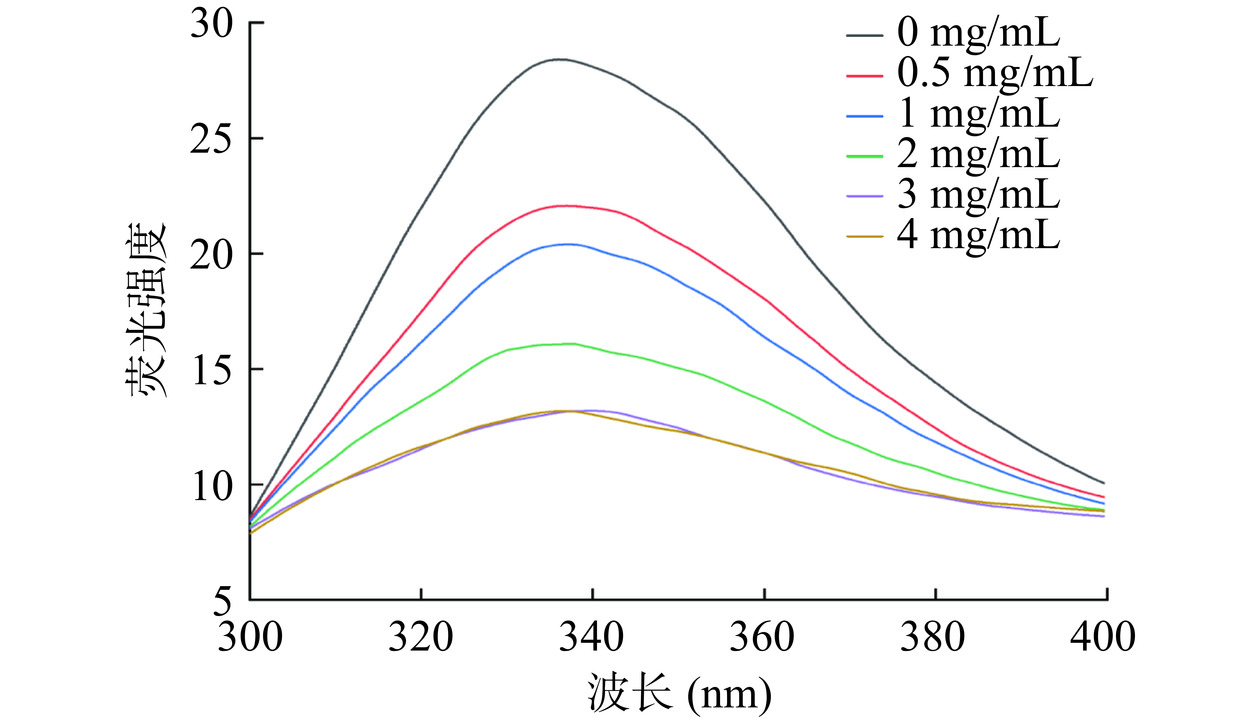
α-葡萄糖苷酶中的酪氨酸、色氨酸和苯丙氨酸等芳香族氨基酸在一定激发波长下,可以产生内源性荧光。荧光强度及最大发射波长位置与酶分子的折叠状态、氨基酸残基所处微环境密切相关[39]。如图5所示,α-葡萄糖苷酶在激发波长280 nm时,发射波长336 nm处观察到最大内源性荧光峰。随着染料木素质量浓度的增加,α-葡萄糖苷酶的荧光强度逐渐减弱,表现出一定的规律性,混合体系的最大发射波长轻微红移。染料木素和缓冲液的荧光强度很小,在发射光谱中已扣除。以上结果表明染料木素能够通过与α-葡萄糖苷酶相互作用来淬灭酶的内源性荧光,轻微红移说明染料木素减少了酶分子表面的疏水区域,导致构象改变。也可能是染料木素使发色基团周围的微环境发生变化,氨基酸残基暴露,极性增加疏水性降低[40]。
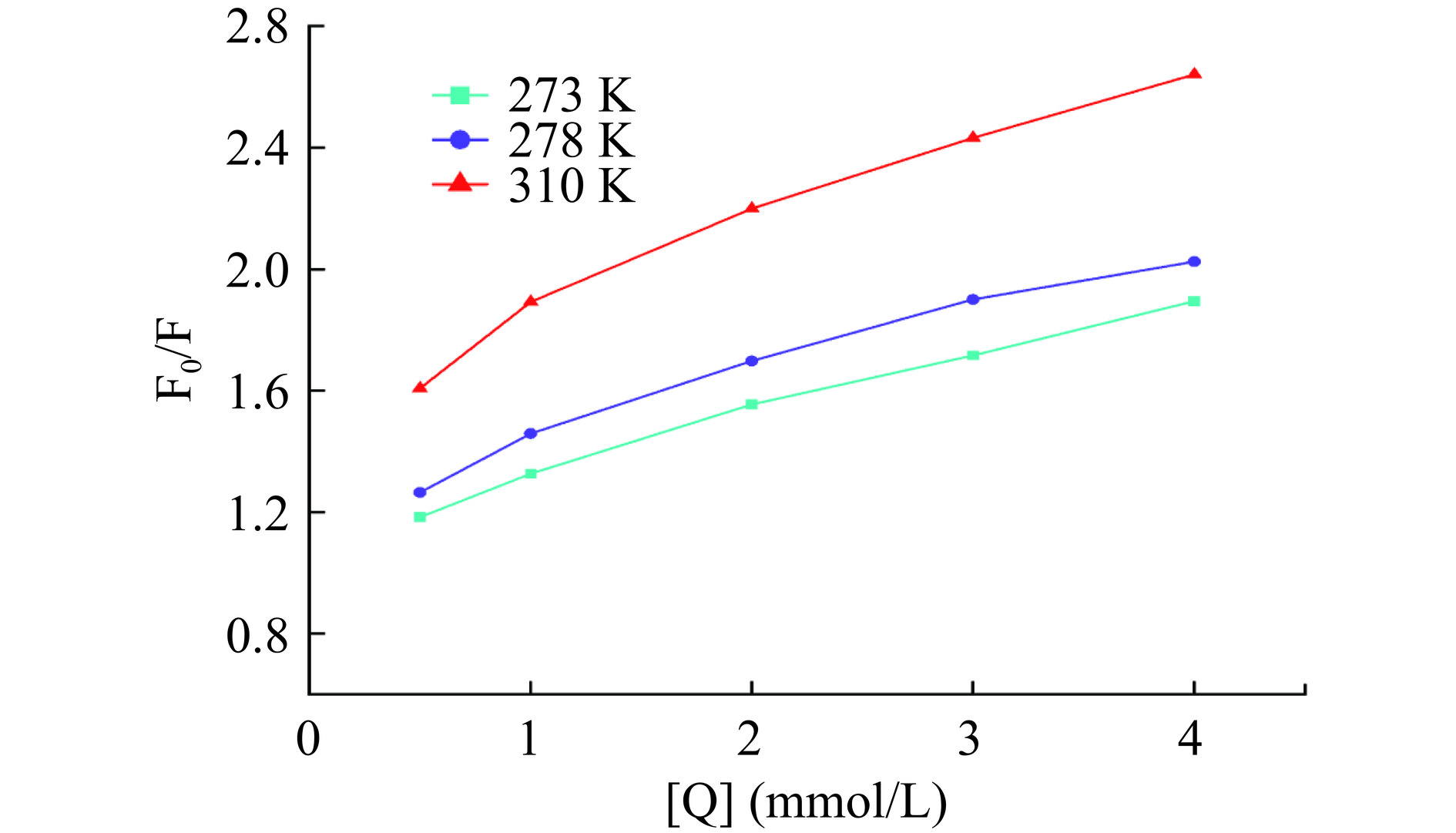
荧光淬灭类型包括动态淬灭、静态淬灭和动态-静态混合淬灭。动态淬灭是淬灭剂与激发态荧光团发生动态碰撞而使荧光强度降低;静态淬灭是淬灭剂与基态荧光团结合形成复合物从而降低荧光强度。Stern-Volmer淬灭曲线类型、不同温度下静态淬灭常数的变化以及表观淬灭速率常数大小是判断淬灭类型的重要依据[41]。由图6可以看出,以F0/F对[Q]作图,试验点略向下弯曲,Stern-Volmer淬灭曲线大体呈直线,说明α-葡萄糖苷酶中存在对于染料木素可接近的荧光团,且该淬灭类型以一种为主。不同温度下线性拟合曲线的相关系数>0.95并且曲线接近平行,静态淬灭常数呈略微上升趋势,因此淬灭类型为以静态淬灭为主的动态-静态混合淬灭。有报道称,黑大豆中亲和超滤得到的染料木素对α-葡萄糖苷酶荧光淬灭为静态淬灭类型[42],这种不同的结论,可能是由抑制剂的纯度、浓度以及淬灭温度和酶的比活等试验参数的不同所引起[43]。
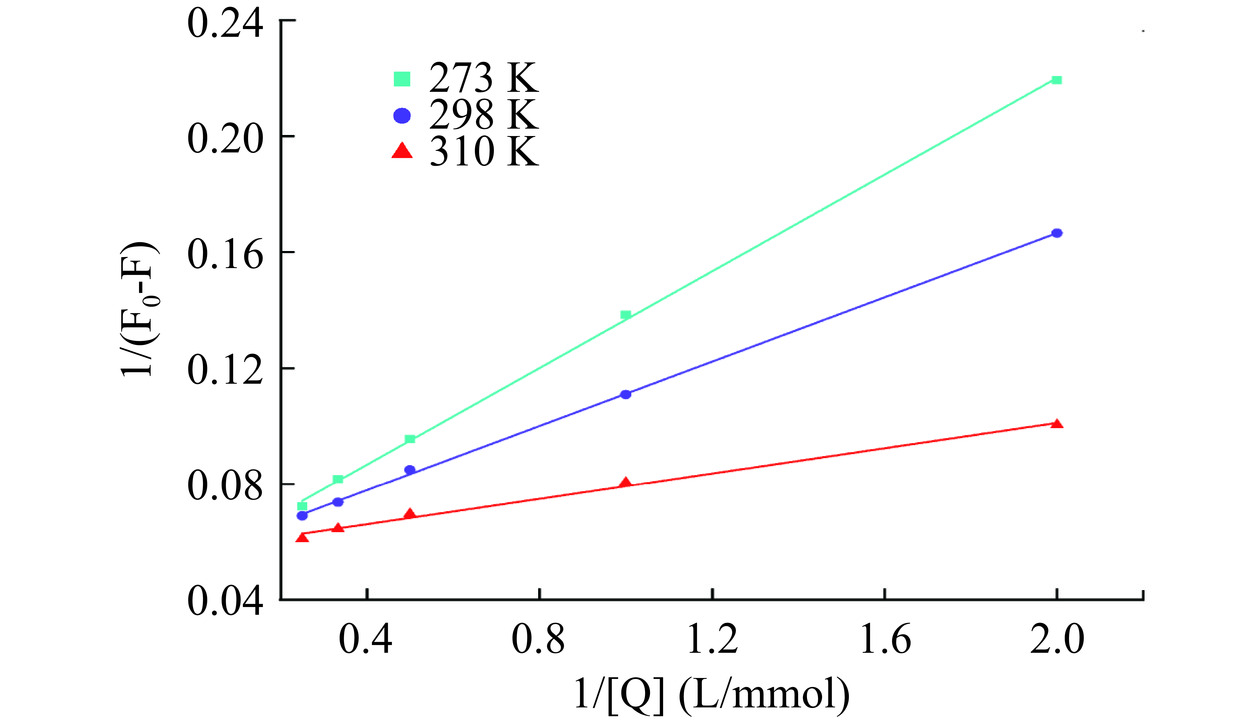
淬灭类型非纯静态淬灭,由于其实验点略微偏离线性,因此用静态淬灭方程计算的KA不够精确,采用式(9)的双倒数方程作图得到图7。图7的淬灭曲线线性良好,由其得出的解离常数KD和荧光淬灭机理较为一致。在273、298和310 K时,根据式(10)得出的表观淬灭速率常数分别为0.4094×1011、0.6250×1011和1.7343×1011 L/(mol·s),均明显大于生物大分子最大碰撞淬灭速率常数2×1010 L/(mol·s),进一步表明染料木素对α-葡萄糖苷酶的淬灭是以静态淬灭类型为主的混合淬灭。
2.5.2 结合力和热力学分析
结合常数可以表示抑制剂与酶的淬灭亲和力,KC值与淬灭亲和力正相关。由表1可以看出,结合常数随温度的升高而下降。说明染料木素和α-葡萄糖苷酶形成不稳定复合物,温度升高破坏了二者相互作用的结合力,复合物的稳定性随着温度的升高而降低,这符合以静态淬灭为主导的混合淬灭类型的一般特征。结合位点数是指抑制剂与酶结合时的n个相互独立且等同的平均结合位置数,不同温度下的结合位点数接近于1,可知染料木素在α-葡萄糖苷酶上仅有1个主要结合位点。随着温度的升高,结合位点数由0.76降至0.58,说明温度升高影响淬灭结合过程,降低了结合的稳定性,这与静态淬灭常数及结合常数的分析结果相一致。
表 1 荧光淬灭参数、结合常数和热力学参数Table 1. Fluorescence quenching parameters, binding constants and thermodynamic parameters温度(K) 静态淬灭常数
(103 L/mol)解离常数
(10−3 mol/L)表观淬灭速率常数
(1011 L/(mol·s))结合常数
(L/mol)结合位点数 ΔH
(kJ/mol)ΔS
((J/(mol·K))ΔG
(kJ/mol)273 0.2059 2.4426 0.4094 61.8 0.76 6.3117 67.4117 −12.0917 298 0.2602 1.6001 0.6250 60.7 0.71 8.1267 73.5023 −13.7770 310 0.2952 0.5766 1.7343 22.8 0.58 6.8510 69.3871 −14.6590 在表1中,不同温度的ΔG均为负值,说明染料木素与α-葡萄糖苷酶的结合能够自发进行。ΔH>0,表现为吸热过程,这与配体-受体结合反应的放热过程不一致,进一步证实淬灭过程受到分子动态碰撞的影响。不同温度的ΔS均为正值,显示反应体系的混乱度增加。以上结果表明染料木素与α-葡萄糖苷酶的结合过程是由熵驱动的吸热反应。Singh等[44]研究膳食多酚抑制血清蛋白糖基化时,也报道了类似的研究结果,即染料木素主要通过熵驱动过程与血清蛋白结合,可以用来预防糖尿病及相关并发症。
2.6 染料木素与α-葡萄糖苷酶分子对接分析
2.6.1 分子对接结合能
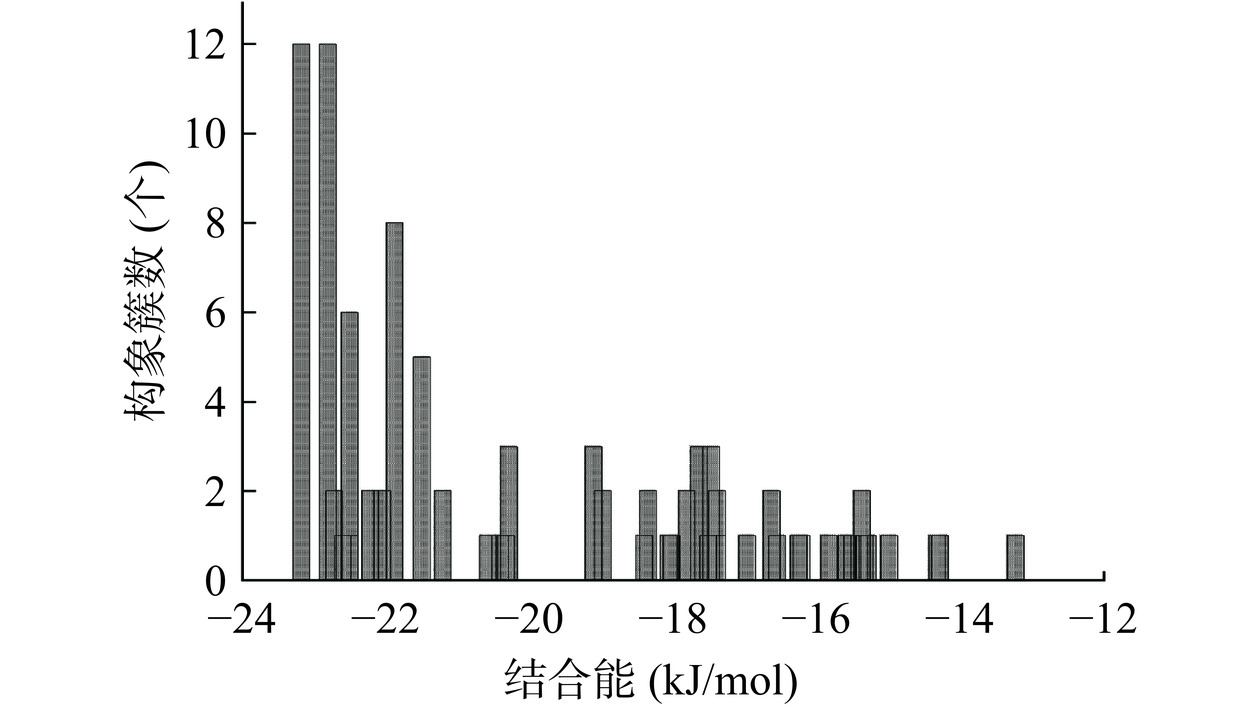
分子对接结合能的大小可以反映结合结构的稳定性。对染料木素与α-葡萄糖苷酶100次对接测试的构象聚类分析,用配体原子(23/23个总原子)进行,使用0.2 nm的RMSD公差。按能量增加的顺序排列,输出结构相似的集群,聚类分布如图8所示。在100次测试中发现不同构象簇数为44个,大于1次的构象簇数19个。各构象的结合能均小于−12 kJ/mol,结合能为负值表明染料木素与α-葡萄糖苷酶的结合能够自发进行[45],这与热力学研究的结果相一致。其中第1簇、2簇、6簇、9簇、10簇的最低结合能分别为−23.18、−22.81、−22.51、−21.88、−21.50 kJ/mol,最低结合能小于热力学实验中的ΔG,这是由于分子对接中主要采用晶体结构,未考虑溶剂化效应的影响。构象数分别为12次、12次、6次、8次、5次,该5簇的构象数多,染料木素与α-葡萄糖苷酶结合力较强,能够稳定结合,选取5簇中结合能最低的测试(第96次、66次、7次、48次、74次)作为优势构象进行对接参数分析。
2.6.2 染料木素与α-葡萄糖苷酶的对接构象评分
如表2可知,染料木素结合α-葡萄糖苷酶后,具有较低的最低结合能、分子间能、静电能和总内能,这些能量能够克服扭转自由能的影响。5个优势构象的氢键与疏水相互作用的总能量分别为−26.84、−27.17、−26.71、−25.79、−24.65 kJ/mol,对分子间能的贡献远大于各自的静电能,显示染料木素与α-葡萄糖苷酶的结合主要依赖于氢键和疏水相互作用。5个测试构象的平衡解离常数分别为90.08、104.49、118.53、152.80、177.66 μmol/L,表明染料木素与α-葡萄糖苷酶的结合稳定,具有较高的结合亲和力,这些对接结果与酶动力学试验结果一致,这种稳定性可能对染料木素在生物体内的生物活性和功能起到重要作用。
表 2 测试构象对接参数Table 2. Docking parameters of the dominant conformations测试构象 最低结合能
(kJ/mol)分子间能
(kJ/mol)静电能
(kJ/mol)总内能
(kJ/mol)扭转自由能
(kJ/mol)氢键与疏水相互作用
总能量(kJ/mol)平衡解离常数
(μmol/L)96 −23.18 −28.18 −1.34 −3.95 5.00 −26.84 90.08 66 −22.81 −27.80 −0.63 −3.91 5.00 −27.17 104.49 7 −22.51 −27.51 −0.80 −3.65 5.00 −26.71 118.53 48 −21.88 −26.88 −1.09 −3.70 5.00 −25.79 152.80 74 −21.50 −26.50 −1.85 −3.86 5.00 −24.65 177.66 2.6.3 染料木素与α-葡萄糖苷酶的结合模式
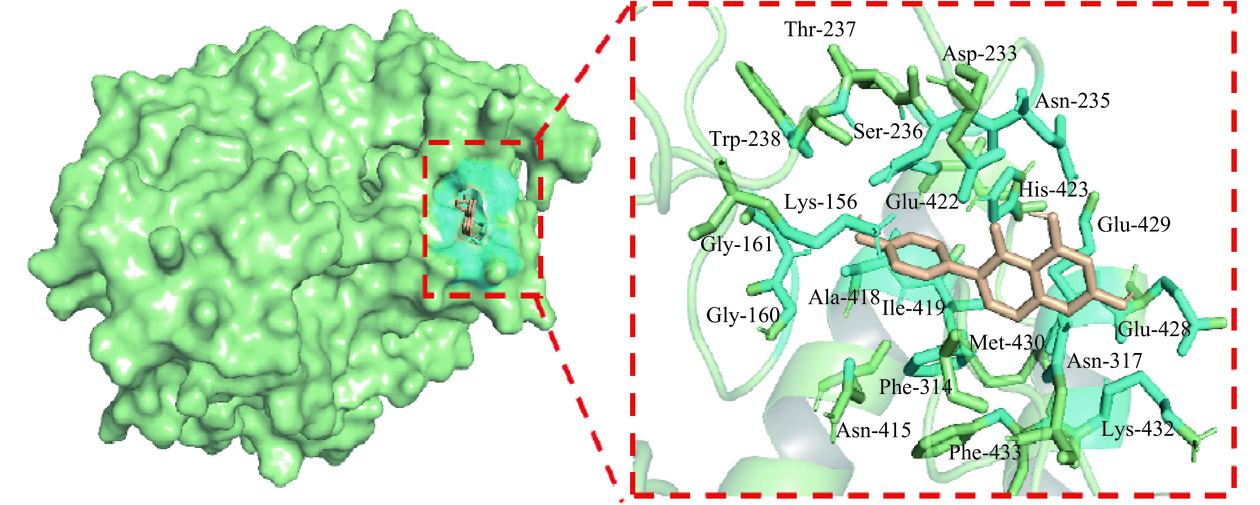
由图9可以看出,染料木素与α-葡萄糖苷酶结合时,结合部位处于α-葡萄糖苷酶的口袋空腔中。α-葡萄糖苷酶通过次级结构的改变形成疏水口袋,将染料木素包裹形成复合物。结合位点由残基Lys-156、Gly-160、Gly-161、Asp-233、Asn-235、Ser-236、Thr-237、Trp-238、Phe-314、Asn-317、Asn-415、Ala-418、Ile-419、Glu-422、His-423、Glu-428、Glu-429、Met-430、Lys-432和Phe-433构建。结合位点的构建残基既有酶活性中心的结合基团,也有非活性中心的必需基团,符合混合性可逆抑制类型的特征,与酶动力学实验结果相一致。此外,芳香族氨基酸残基Trp-238和Phe-314微环境的改变可能是染料木素淬灭α-葡萄糖苷酶荧光强度的重要原因[46]。
2.6.4 染料木素与α-葡萄糖苷酶的相互作用
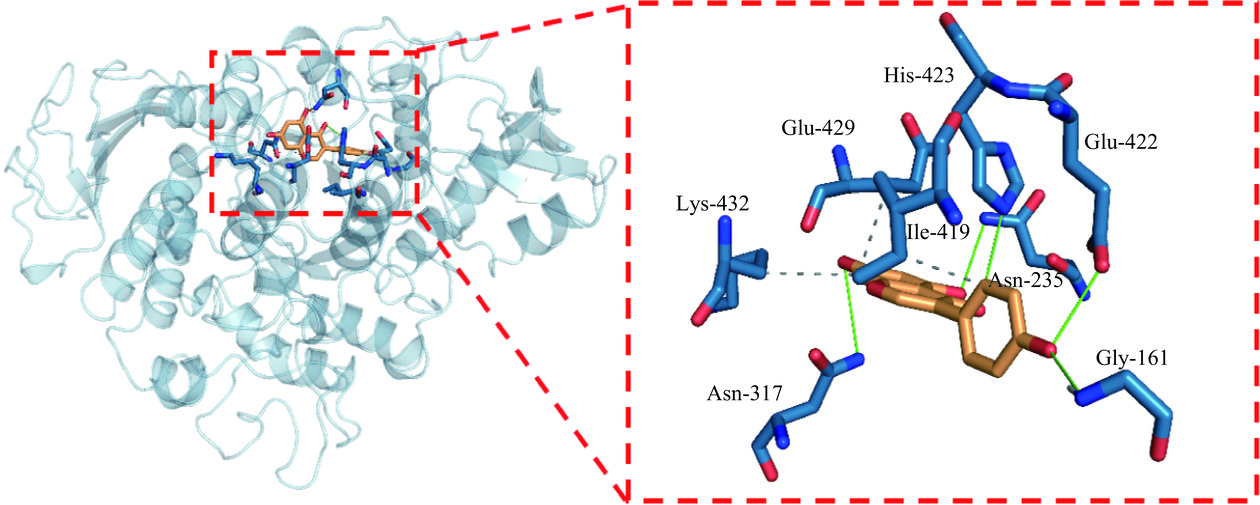
由图10和表3可知,α-葡萄糖苷酶的Glu-429残基和Lys-432残基与染料木素A环的C8形成疏水相互作用,C-C距离分别为0.371 nm和0.374 nm;Ile-419残基与染料木素B环C2'处形成疏水相互作用,C-C距离为0.351 nm。染料木素通过疏水相互作用与Glu-429、Lys-432和Ile-419残基周围的疏水腔相结合,进而影响其微环境的极性以及复合物的构象稳定性。
表 3 疏水相互作用参数Table 3. Parameters of hydrophobic interaction残基序号 残基类型 C-C距离(nm) 419 Ile 0.351 429 Glu 0.371 432 Lys 0.374 注:C-C距离,相互作用的碳原子之间的距离。 染料木素含有3个酚羟基,苯环的电子离域作用使其易于发生离子化,与酶形成氢键。由图10及表4可知,染料木素B环C4'处的羟基作为供氢体与α-葡萄糖苷酶Glu-422残基的侧链以及Gly-161的主链形成氢键,其H-A距离为0.219 nm和0.241 nm,D-A距离为0.313 nm和0.341 nm,供体角度为160.40°和166.80°,该处氢键对锚定染料木素分子有着重要贡献。α-葡萄糖苷酶的Asn-235、Asn-317以侧链作为供氢体与染料木素的A环形成氢键,His-423以侧链作为供氢体与染料木素的C环形成氢键,其H-A距离由0.203 nm至0.328 nm,D-A距离由0.296 nm至0.387 nm,这些氢键对稳定染料木素与α-葡萄糖苷酶的结合有着一定的帮助。以上结果表明,疏水相互作用和氢键共同加强了染料木素与α-葡萄糖苷酶复合物构象的稳定性,这与前面的对接构象评分结果一致。
表 4 氢键参数Table 4. Parameters of hydrogen bonds残基
序号残基
类型H-A距离
(nm)D-A距离
(nm)供体角度
(°)供氢体 氨基
酸链161 Gly 0.241 0.341 166.80 α-葡萄糖苷酶 主链 235 Asn 0.203 0.296 151.12 α-葡萄糖苷酶 侧链 317 Asn 0.328 0.380 113.19 α-葡萄糖苷酶 侧链 422 Glu 0.219 0.313 160.40 染料木素 侧链 423 His 0.308 0.387 134.27 α-葡萄糖苷酶 侧链 注:H-A距离,氢原子和受体原子之间的距离;D-A距离,供体原子和受体原子之间的距离;供体角度,供体、受体和氢原子之间的夹角;氨基酸链,氢键是由氨基酸的主链或侧链形成。 3. 结论
本文探究了染料木素对淀粉体外消化特性的影响及其对α-葡萄糖苷酶的抑制作用和互作机制。染料木素能够抑制淀粉的体外消化,使慢消化淀粉和抗性淀粉的含量分别增加42.57%和105.34%。染料木素对α-葡萄糖苷酶有良好的抑制活性,KIC为(0.71±0.03)mg/mL,KIN为(4.94±0.36)mg/mL,以混合性可逆抑制的方式来抑制α-葡萄糖苷酶的活性。荧光淬灭结果表明,染料木素通过动态-静态混合淬灭机制有效淬灭酶的内在荧光,染料木素与α-葡萄糖苷酶的结合是由熵驱动的吸热反应。分子对接模拟显示,染料木素与酶的Ile-419、Glu-429和Lys-432残基通过疏水相互作用结合,与酶的Gly-161、Asn-235、Asn-317、Glu-422和His-423残基形成氢键,诱导酶的构象发生变化,从而降低α-葡萄糖苷酶的催化活性。综上,染料木素能够抑制α-葡萄糖苷酶的催化活性,减缓淀粉的快速消化。该研究可为染料木素在辅助降血糖功能食品中的应用提供依据。
-
图 1 淀粉体系及混合体系体外消化特性
注:不同小写字母表示有显著差异(P<0.05),图2同。
Figure 1. In vitro digestion characteristics of starch systems and mixed systems
表 1 荧光淬灭参数、结合常数和热力学参数
Table 1 Fluorescence quenching parameters, binding constants and thermodynamic parameters
温度(K) 静态淬灭常数
(103 L/mol)解离常数
(10−3 mol/L)表观淬灭速率常数
(1011 L/(mol·s))结合常数
(L/mol)结合位点数 ΔH
(kJ/mol)ΔS
((J/(mol·K))ΔG
(kJ/mol)273 0.2059 2.4426 0.4094 61.8 0.76 6.3117 67.4117 −12.0917 298 0.2602 1.6001 0.6250 60.7 0.71 8.1267 73.5023 −13.7770 310 0.2952 0.5766 1.7343 22.8 0.58 6.8510 69.3871 −14.6590 表 2 测试构象对接参数
Table 2 Docking parameters of the dominant conformations
测试构象 最低结合能
(kJ/mol)分子间能
(kJ/mol)静电能
(kJ/mol)总内能
(kJ/mol)扭转自由能
(kJ/mol)氢键与疏水相互作用
总能量(kJ/mol)平衡解离常数
(μmol/L)96 −23.18 −28.18 −1.34 −3.95 5.00 −26.84 90.08 66 −22.81 −27.80 −0.63 −3.91 5.00 −27.17 104.49 7 −22.51 −27.51 −0.80 −3.65 5.00 −26.71 118.53 48 −21.88 −26.88 −1.09 −3.70 5.00 −25.79 152.80 74 −21.50 −26.50 −1.85 −3.86 5.00 −24.65 177.66 表 3 疏水相互作用参数
Table 3 Parameters of hydrophobic interaction
残基序号 残基类型 C-C距离(nm) 419 Ile 0.351 429 Glu 0.371 432 Lys 0.374 注:C-C距离,相互作用的碳原子之间的距离。 表 4 氢键参数
Table 4 Parameters of hydrogen bonds
残基
序号残基
类型H-A距离
(nm)D-A距离
(nm)供体角度
(°)供氢体 氨基
酸链161 Gly 0.241 0.341 166.80 α-葡萄糖苷酶 主链 235 Asn 0.203 0.296 151.12 α-葡萄糖苷酶 侧链 317 Asn 0.328 0.380 113.19 α-葡萄糖苷酶 侧链 422 Glu 0.219 0.313 160.40 染料木素 侧链 423 His 0.308 0.387 134.27 α-葡萄糖苷酶 侧链 注:H-A距离,氢原子和受体原子之间的距离;D-A距离,供体原子和受体原子之间的距离;供体角度,供体、受体和氢原子之间的夹角;氨基酸链,氢键是由氨基酸的主链或侧链形成。 -
[1] HERNANDEZ T R, ESETADA J M, SANSININER A J J, et al. Chia (Salvia hispanica L.), a pre-hispanic food in the treatment of diabetes mellitus:Hypoglycemic, antioxidant, anti-inflammatory, and inhibitory properties of α-glucosidase and α-amylase, and in the prevention of cardiovascular disease[J]. Molecules,2023,28(24):8069. doi: 10.3390/molecules28248069
[2] ZHENG Y, LEY S H, HU F B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications[J]. Nature Reviews Endocrinology,2018,14(2):88−98. doi: 10.1038/nrendo.2017.151
[3] WAHAB M, JANASWAMY S. Porous corn starch granules as effective host matrices for encapsulation and sustained release of curcumin and resveratrol[J]. Carbohydrate Polymers,2024,333:121967. doi: 10.1016/j.carbpol.2024.121967
[4] ZHOU D T, MA Z, YIN X X, et al. Structural characteristics and physicochemical properties of field pea starch modified by physical, enzymatic, and acid treatments[J]. Food Hydrocolloid,2019(93):386−394.
[5] CHI C D, LI X X, ZHANG Y P, et al. Modulating the in vitro digestibility and predicted glycemic index of rice starch gels by complexation with gallic acid[J]. Food Hydrocolloid,2019(89):821−828.
[6] LEE K S, RYU H S, TURK A, et al. Characterization of α-glucosidase inhibitory constituents of the fruiting body of lion’s mane mushroom (Hericium erinaceus)[J]. Journal of Ethnopharmacology,2020,262:113197. doi: 10.1016/j.jep.2020.113197
[7] SMIRNOVA I E, GALIMOVA Z I, SAPOZHNIKOVA T A, et al. New dipterocarpol-based molecules with α-glucosidase inhibitory and hypoglycemic activity[J]. Chembiochem:A European Journal of Chemical Biology,2023,25(3):e202300716.
[8] LUMADHAR C S, JULIO M, GUADALUPE J R, et al. Design, synthesis, in silico, and in vitro evaluation of benzylbenzimidazolone derivatives as potential drugs on α-glucosidase and glucokinase as pharmacological targets[J]. RSC Advances,2023,13(31):21153−21162. doi: 10.1039/D3RA02916F
[9] JARED B, MICHAEL E, WU G J, et al. The human microbiome encodes resistance to the antidiabetic drug acarbose[J]. Nature,2021,600(7887):110−115. doi: 10.1038/s41586-021-04091-0
[10] JAEHYUN B, YOUNG J L, EUGENE S, et al. The effects of the voglibose on non-alcoholic fatty liver disease in mice model[J]. Scientific Reports,2022,12(1):13595. doi: 10.1038/s41598-022-15550-7
[11] AHMED S, AHMED S, M. M E, et al. Miglitol-PMO nanoparticles, an alpha-glucosidase inhibitor, has prolonged action on blood glucose level in diabetic rats[J]. Journal of Drug Delivery Science and Technology, 2022, 72:103388.
[12] ISMAN A, NYQUIST A, MOEL M, et al. The efficacy and tolerability of intermittent prandial acarbose to reduce glucose spikes in healthy individuals[J]. Translational Medicine of Aging,2023,7:12−19. doi: 10.1016/j.tma.2023.04.002
[13] PATEL P, SHAH D, BAMBHAROLIYA T, et al. A review on the development of novel heterocycles as α-glucosidase inhibitors for the treatment of type-2 diabetes mellitus[J]. Medicinal Chemistry (Shariqah (United Arab Emirates)),2024,20(5):503−536. doi: 10.2174/0115734064264591231031065639
[14] THUPAKULA S, NIMMALA R S S, DAWOOD M S, et al. Synergistic anti-diabetic effect of phloroglucinol and total procyanidin dimer isolated from Vitis vinifera methanolic seed extract potentiates via suppressing oxidative stress:In-vitro evaluation studies[J]. Biotechniques,2024,14(3):76.
[15] SHAHWAN M, ALHUMAYDHI F, ASHRAF G M, et al. Role of polyphenols in combating type 2 diabetes and insulin resistance[J]. International Journal of Biological Macromolecules,2022(206):567−579.
[16] APARNA B, BOMMANAMANE H P. Screening of novel source for genistein by rapid and sensitive UPLC-APCI-TOF mass spectrometry[J]. International Journal of Food Science, 2021:5537917.
[17] EWA G, JUDYTA C, MAGDALENA K, et al. Genistein-opportunities related to an interesting molecule of natural origin[J]. Molecules,2022,27(3):815. doi: 10.3390/molecules27030815
[18] SANCHEZ F B, PEDRO J W, DOMINIK S, et al. A green approach for genistein and apigenin extraction optimization from by-products of soybean crops[J]. Sustainable Chemistry and Pharmacy,2024,37:101343. doi: 10.1016/j.scp.2023.101343
[19] 李勇, 芦冬涛, 董川, 等. 黑豆皮中天然产物抗氧化及降糖活性筛选[J]. 山西大学学报(自然科学版),2021,44(6):1186−1192. [LI Y, LU D T, DONG C, et al. Antioxidant activity and hypoglycemic screening of natural products from black soybean hulls[J]. Journal of Shanxi University (Natural Science Edition),2021,44(6):1186−1192.] LI Y, LU D T, DONG C, et al. Antioxidant activity and hypoglycemic screening of natural products from black soybean hulls[J]. Journal of Shanxi University (Natural Science Edition), 2021, 44(6): 1186−1192.
[20] SON H, YOON E, YOO C, et al. Effects of synergistic inhibition on α-glucosidase by phytoalexins in soybeans[J]. Biomolecules,2019,9(12):828. doi: 10.3390/biom9120828
[21] 王宇. 基于分子模拟探究五种类黄酮抑制hIAPP聚集与NtMGAM活性的机制[D]. 重庆:重庆大学, 2022. [WANG Y. Study on mechanism of five flavonoids inhibiting hIAPP aggregation and NtMGAM activity based on molecular simulation[D]. Chongqing:Chongqing University, 2022.] WANG Y. Study on mechanism of five flavonoids inhibiting hIAPP aggregation and NtMGAM activity based on molecular simulation[D]. Chongqing: Chongqing University, 2022.
[22] 高嫚, 贾健辉, 周迅, 等. 基于AOAC法对Englyst法测定粳米淀粉消化特性的优化[J]. 食品工业科技,2023,44(10):264−269. [GAO M, JIA J H, ZHOU X, et al. Optimization of Englyst method for determination of starch digestibility of japonica rice based on AOAC method[J]. Science and Technology of Food Industry,2023,44(10):264−269.] GAO M, JIA J H, ZHOU X, et al. Optimization of Englyst method for determination of starch digestibility of japonica rice based on AOAC method[J]. Science and Technology of Food Industry, 2023, 44(10): 264−269.
[23] WANG X S, ZHANG J M, WANG P X, et al. Evaluation of alpha-glucosidase inhibition activity and glycosides in the Syringa pubescens Turcz from different geographical origin[J]. Scientia Horticulturae,2023,320:112198. doi: 10.1016/j.scienta.2023.112198
[24] DONG Q, HU N, YUE H L, et al. Inhibitory activity and mechanism investigation of hypericin as a novel α-glucosidase inhibitor[J]. Molecules,2021,26(15):4566. doi: 10.3390/molecules26154566
[25] MORTEZA S, MEHRAN M, MUSTAFA G, et al. Exploring the inhibitory properties between biflavonoids and α-glucosidase; computational and experimental approaches[J]. International Journal of Biological Macromolecules,2023,253(P7):127380.
[26] 覃亚娟, 王萍, 陈小爱, 等. 3种黄酮类化合物对α-淀粉酶的抑制机制[J]. 食品科学技术学报,2023,41(5):110−122. [QIN Y J, WANG P, CHEN X A, et al. Study on the mechanism of flavonoids with different structures inhibiting α-amylase[J]. Journal of Food Science and Technology,2023,41(5):110−122.] doi: 10.12301/spxb202200834 QIN Y J, WANG P, CHEN X A, et al. Study on the mechanism of flavonoids with different structures inhibiting α-amylase[J]. Journal of Food Science and Technology, 2023, 41(5): 110−122. doi: 10.12301/spxb202200834
[27] YU Q, TIAN Y, FAN L P. Inhibition mechanisms of wounded okra on the α-glucosidase/α-amylase[J]. Food Bioscience,2023,51:102333. doi: 10.1016/j.fbio.2022.102333
[28] ZHENG Y, ZHANG R F, HUANG F, et al. α-Glucosidase inhibitors derived from black soybean and their inhibitory mechanisms[J]. LWT,2023,189:115502. doi: 10.1016/j.lwt.2023.115502
[29] DESSEAUX V, STOCKER P, BROUANT P, et al. The mechanisms of alpha-amylase inhibition by flavan-3-Ols and the possible impacts of drinking green tea on starch digestion[J]. Journal of Food Science,2018,83(11):2858−2865. doi: 10.1111/1750-3841.14353
[30] ADASME M F, LINNEMANN K L, BOLZ S N, et al. PLIP 2021:Expanding the scope of the protein-ligand interaction profiler to DNA and RNA[J]. Nucleic Acids Research,2021,49(1):530−534.
[31] VO T N, HOANG M H. Inhibition kinetics and mechanism of genistein against α-glucosidase[J]. Vietnam Journal of Chemistry,2024,62(4):493−499. doi: 10.1002/vjch.202200173
[32] WANG Y F, MA L, LI Z, et al. Synergetic inhibition of metal ions and genistein on α-glucosidase[J]. FEBS Letters,2004,576(1-2):46−50. doi: 10.1016/j.febslet.2004.08.059
[33] LEE D S, LEE S H. Genistein, a soy isoflavone, is a potent α-glucosidase inhibitor[J]. FEBS Letters,2001,501(1):84−86. doi: 10.1016/S0014-5793(01)02631-X
[34] SUBAITHA A Z, PRIYADARSHINI S, YOHA K, et al. Impact of post-harvest processing techniques on the glycemic index of millets[J]. Food Chemistry Advances,2024(4):100636.
[35] XU T, LI X X, JI S Y, et al. Starch modification with phenolics:Methods, physicochemical property alteration, and mechanisms of glycaemic control[J]. Trends in Food Science Technology,2021(111):12−26.
[36] GARBIEC E, ROSIAK N, ZALEWSKI P, et al. Genistein co-amorphous systems with amino acids:An investigation into enhanced solubility and biological activity[J]. Pharmaceutics,2023,15(12):2653. doi: 10.3390/pharmaceutics15122653
[37] 杨荣武, 丁智, 杨艳, 等. 基础生物化学原理[M]. 北京:高等教育出版社, 2021:129-130. [YANG R W, DING Z, YANG Y, et al. Fundamentals of biochemistry[M]. Beijing:Higher Education Press, 2021:129-130.] YANG R W, DING Z, YANG Y, et al. Fundamentals of biochemistry[M]. Beijing: Higher Education Press, 2021: 129-130.
[38] G D A, GABRIEL V, ERIKA S, et al. Synthesis and molecular docking studies of alkoxy- and imidazole-substituted xanthones as α-amylase and α-glucosidase inhibitors[J]. Molecules (Basel, Switzerland), 2023, 28(10).
[39] KANAE S, TAIJI K, NOZOMI I, et al. Cover feature:Fluorescence quenching‐based assay for measuring Golgi endo‐α‐mannosidase[J]. Chemistry-An Asian Journal,2019,14(11):1887. doi: 10.1002/asia.201900459
[40] ARPITA D, KUMUD P, MALA N, et al. Binding characterization of anthraquinone derivatives by stabilizing G-quadruplex DNA leads to an anticancerous activity[J]. Molecular Therapy-Nucleic Acids,2022(30):648−662.
[41] CHEN X, HE X, ZHANG B, et al. Wheat gluten protein inhibits α-amylase activity more strongly than a soy protein isolate based on kinetic analysis[J]. International Journal of Biological Macromolecules,2019,129:433−441. doi: 10.1016/j.ijbiomac.2019.01.215
[42] YANG Y, ZHANG J L, SHEN L H, et al. Inhibition mechanism of diacylated anthocyanins from purple sweet potato (Ipomoea batatas L.) against α-amylase and α-glucosidase[J]. Food Chemistry,2021,359(35):129934.
[43] THAKOR K P, LUNAGARIYA M V, BHATT B S, et al. Fluorescence and absorption studies of DNA-Pd(II) complex interaction:Synthesis, spectroanalytical investigations and biological activities[J]. Luminescence:The Journal of Biological and Chemical Luminescence,2019,34(1):113−124. doi: 10.1002/bio.3587
[44] SINGH I R, YESYLEVSKYY S O, MITRA S. Dietary polyphenols inhibit plasma protein arabinosylation:Biomolecular interaction of genistein and ellagic acid with serum albumins[J]. Biophysical Chemistry,2021,277:106651. doi: 10.1016/j.bpc.2021.106651
[45] ELAHEH I, SIAVASH R, ZEINAB A R, et al. A simple and robust model to predict the inhibitory activity of α-glucosidase inhibitors through combined QSAR modeling and molecular docking techniques[J]. Molecular Diversity,2021,25(3):1−15.
[46] LI W, SONG Y, SUN W S, et al. Both acidic pH value and binding interactions of tartaric acid with α-glucosidase cause the enzyme inhibition:the mechanism in α-glucosidase inhibition of four caffeic and tartaric acid derivates[J]. Frontiers in Nutrition,2021,8:766756. doi: 10.3389/fnut.2021.766756





 下载:
下载:
 下载:
下载:



