Construction and Encapsulation of Colloidal Vesicles Based on Bovine Serum Albumin-Dextran Interfacial Assembly
-
摘要: 蛋白质和多糖作为胶体结构化组分,其改性后组装形成的胶体囊泡是一种独特类型的人工细胞,具有良好的膜渗透性,因此被广泛应用于细胞工程、生物传感、药物输送和功能食品等领域。基于此,本研究拟以氨基化牛血清白蛋白(BSA-NH2)和羧基化葡聚糖(DEX-COOH)为构筑基元,利用Pickering乳液模板法构建胶体囊泡,优化复合物浓度、油/水体积比及交联剂浓度,探究不同温度下的储藏稳定性及包载不同分子量葡聚糖的能力。结果发现,复合物浓度为20 mg/mL、油/水体积比10:1、交联剂浓度0.75 mg/mL的条件下可得到形态稳定、分散均匀且具有稳定光滑球形及完整膜结构的胶体囊泡,其粒径为4.29±1.11 μm。囊泡在 4 ℃条件下储藏0、4、7 d均具有良好稳定性,粒径分别为5.13±1.15、4.81±1.03和5.01±1.33 μm,可有效包载分子量≤70 kDa的葡聚糖。因此,该囊泡可作为亲水性活性组分的有效载体,广泛应用于食品活性组分递送。Abstract: As colloidal structural components, the colloidal vesicles formed by the modified proteins and polysaccharides were a unique type of artificial cells with good membrane permeability, so they were widely used in cell engineering, biosensing, drug delivery and functional foods. Based on this, this study aimed to construct colloidal vesicles with aminoized bovine serum albumin (BSA-NH2) and carboxylated dextran (DEX-COOH) as the building blocks, and use Pickering emulsion template method to optimize complex concentration, oil/water volume ratio and crosslinker concentration. The storage stability at different temperatures and the ability to contain dextran with different molecular weight were investigated. Results showed that colloidal vesicles with stable morphology, uniform dispersion, stable smooth spherical shape and complete membrane structure were obtained under the conditions of compound concentration of 20 mg/mL, oil/water volume ratio of 10:1 and crosslinker concentration of 0.75 mg/mL, with size of 4.29±1.11 μm. The vesicles were stable at 4 ℃ on 0, 4 and 7 d, with sizes of 5.13±1.15, 4.81±1.03 and 5.01±1.33 μm, respectively, and could effectively contain dextran with molecular weight ≤70 kDa. Therefore, the vesicles can be used as an effective carrier of hydrophilic active components and widely used in food active component delivery.
-
Keywords:
- bovine serum albumin /
- dextran /
- vesicles /
- stability /
- encapsulation
-
随着现代生物合成技术的飞速发展,人工细胞作为一种新型仿生体系被广泛应用于细胞工程、生物传感、药物输送和功能食品等领域[1]。常见的人工细胞包括脂质囊泡[2]、蛋白质囊泡[3]、聚合物囊泡[4]、凝聚体微滴[5]和胶体囊泡[6]等,其中胶体囊泡是一种独特类型的人工细胞,可由生物聚合物、天然高分子及二氧化硅等无机材料在乳液界面组装而形成[7−8]。蛋白质、多糖组装形成的胶体囊泡具有膜透性,可作为包载和递送活性组分(如药物、食品添加剂和生物材料)的载体[9−11],广泛应用于功能因子递送、催化和生物诊断等领域[12]。
牛血清白蛋白(bovine serum albumin,BSA)具有分子量小、结构稳定等特点[13]。BSA自身携带大约30个氨基,由于蛋白质大分子空间位阻等使其表面氨基很难与其他物质发生反应。对其进行氨基化修饰可增加蛋白表面氨基数量,促使其与带负电的物质结合[14]。Wu等[15]以氨基化BSA(BSA-NH2)、金属离子簇和聚(N-异丙基丙烯酰胺)纳米耦联物为构建单元,构建了无机-蛋白质杂化微胶囊,其膜呈球形且坚固,可作为包载功能因子的有效载体。Fan等[16]研究指出咖啡酸-牛血清蛋白/玉米蛋白复合物制备的纳米颗粒可有效包载白藜芦醇,显著提高白藜芦醇的稳定性和抗氧化活性。葡聚糖(dextran,DEX)表面含有丰富的羟基,羧基化改性后可促使其与带正电物质结合。Su等[17]以BSA-NH2和DEX-COOH为原料形成凝聚微滴,并证明该微滴具有保护内部细胞的功能。Hu等[18]采用羧甲基壳聚糖(CMCS)和羧基化葡聚糖(DEX-COOH),开发了一种在单个细胞表面构建人工细胞膜的方法,该仿生细胞膜对包封物质具有很好的保护作用。然而,关于BSA-NH2和DEX-COOH基胶体囊泡的制备及相关性能的研究还鲜有报道。
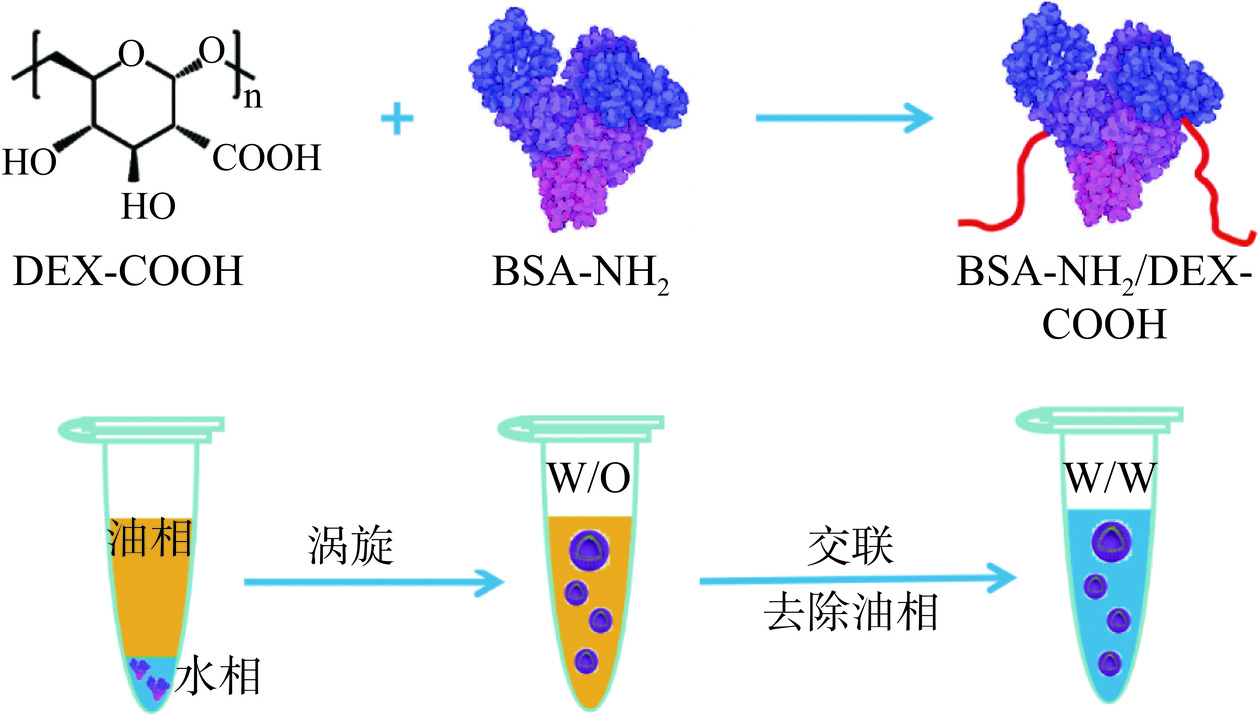
基于此,本研究拟以氨基化牛血清白蛋白(BSA-NH2)和羧基化葡聚糖(DEX-COOH)为构筑基元,利用羰氨缩合反应及静电相互作用形成蛋白-多糖复合物。通过Pickering乳液模板法构建油包水乳液,随后经过界面交联和相转移,得到中空、球形水包水胶体囊泡(图1),并探究其在不同温度下的稳定性及作为载体包载不同分子量DEX的能力。该研究为蛋白-多糖界面组装下的胶体囊泡体系构建提供了一种新思路,也为人工细胞构筑提供了理论支撑,同时在生物活性组分递送方面具有应用潜力。
1. 材料与方法
1.1 材料与仪器
牛血清白蛋白(66.8 kDa,纯度>98%) 上海源叶生物科技有限公司;葡聚糖(20、70、150和500 kDa,分析纯)、1,6-己二胺(分析纯)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDAC)(纯度>95%)、4-二甲基氨基吡啶(DMAP)(纯度>99%)、二甲基亚砜、戊二醛(分析纯) 上海麦克林生化科技有限公司;丁二酸酐、2-乙基己醇(化学纯) 阿拉丁公司。
Zetasizer Nano ZS纳米粒度表面电位分析仪 英国Malvern公司;INVENIO型傅里叶变换红外光谱 德国布鲁克Bruker公司;GL124-1SCN型电子分析天平 赛多利斯科学仪器(北京)有限公司;SB-5200D型超声波清洗机 宁波新芝生物科技股份有限公司;H1650R型高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;XH-C型涡旋混合器 常州越新仪器制造有限公司;WYS-37XB型倒置生物显微镜 微仪光电(天津)有限公司。
1.2 实验方法
1.2.1 BSA氨基改性
BSA的氨基改性参考Zhou等[19]的制备方法,并在此基础上进行改进。称取1.50 g 1,6-己二胺加入10 mL去离子水溶解,调节溶液pH至6.5(5 mol/L HCl)。随后称取0.20 g BSA溶解于10 mL去离子水中,调节溶液pH至6.5(5 mol/L HCl)。将配制好的1,6-己二胺加入到BSA溶液中后,加入0.10 g 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDAC)引发偶联反应活化羧基。室温搅拌5 h,添加0.05 g EDAC,使用稀盐酸将溶液pH维持在6.5,反应6 h,即得氨基化BSA(BSA-NH2)。0.45 µm水系蛋白质专用滤膜除掉反应液中的沉淀物,透析3 d后冷冻干燥,即得棉絮状产物氨基化BSA(BSA-NH2)。
1.2.2 DEX羧基改性
DEX的羧基改性参考Su等[17]的制备方法,并在此基础上进行改进。称取1.00 g DEX,以15 mL二甲基亚砜(DMSO)作为溶剂,通过超声法对其进行溶解。随后称取1.85 g丁二酸酐,继续通过DMSO溶解。待丁二酸酐完全溶解后,将其逐滴添加至DEX溶液中,再向混合溶液中加入0.05 g催化剂4-二甲氨基吡啶(DMAP),65 ℃条件下反应12~16 h。在此期间催化剂DMAP中的吡啶氮原子可与丁二酸酐中的羰基碳生成吡啶盐,再与DEX中的羟基发生成酯反应。最后在得到的透明液体中添加三倍量去离子水透析3 d并冷冻干燥,得到固体粉末即为被丁二酸酐修饰后表面带有羧基的葡聚糖(DEX-COOH)。
1.2.3 蛋白-多糖复合物(BSA-NH2/DEX-COOH)合成
PBS缓冲溶液(pH8.0,0.01 mol/L)配制浓度为1.0 mg/mL的BSA-NH2溶液,去离子水配制浓度为1.0 mg/mL的DEX-COOH溶液。然后将BSA-NH2溶液逐滴加入到DEX-COOH溶液中,充分搅拌混合12 h后,使用0.45 µm水系蛋白质专用滤膜过滤,并对其进行透析以去除未反应的原料和盐,最后经冷冻干燥得蛋白-多糖复合物(BSA-NH2/DEX-COOH)。
1.2.4 傅里叶变换红外光谱(FTIR)表征
分别称取BSA-NH2、DEX-COOH和BSA-NH2/DEX-COOH复合物1 mg与适量KBr混合研磨(100:1),制成压片,通过FTIR对其结构进行表征。在测试样品之前先进行空白校正以去除干扰因素(空气中的CO2和湿度),空白扫描32次以上,随后在4000~400 cm−1范围内进行红外光谱扫描。
1.2.5 Zeta-电位和粒径测定
将BSA-NH2、DEX-COOH及BSA-NH2/DEX-COOH用PBS(pH6.8,0.005 mol/L)配制成浓度为0.2 mg/mL的溶液,采用Zetasizer Nano ZS纳米粒度表面电位分析仪(Malvern)在25 ℃下测定样品的平均粒径和Zeta电位。所有样品均平行测定三次,结果取平均值。
1.2.6 胶体囊泡形成条件优化
通过Pickering乳液模板法构建胶体囊泡体系,具体步骤如下:将BSA-NH2/DEX-COOH复合物粉末溶于PBS缓冲溶液中,加入2-乙基己醇,涡旋振荡30 s后加入戊二醛避光交联6 h;倒掉上层油相,加入75%的乙醇充分洗涤,4000 r/min离心4 min,重复两次,去除水相中残留油相,最后将所得沉淀分散在1 mL去离子水中,即得胶体囊泡。
1.2.6.1 BSA-NH2/DEX-COOH复合物浓度优化
将BSA-NH2/DEX-COOH粉末溶于PBS缓冲溶液,分别配制成浓度为5、10、15、20和25 mg/mL的水溶液。取20 μL混合溶液加入EP管中,加入200 μL 2-乙基己醇(油/水体积比为10:1),涡旋振荡30 s后加入5 μL戊二醛(0.75 mg/mL)避光交联6 h。
1.2.6.2 油/水比例优化
将BSA-NH2/DEX-COOH粉末溶于PBS缓冲溶液制成20 mg/mL的水溶液。将20 μL该溶液加入EP管中,分别加入300 μL(油/水两相体积比15:1)、200 μL(油/水两相体积比10:1)、100 μL(油/水两相体积比5:1)、60 μL(油/水两相体积比3:1)、20 μL(油/水两相体积比1:1)、10 μL(油/水两相体积比0.5:1)的2-乙基己醇,涡旋振荡30 s左右得乳状液,然后加入5 μL戊二醛(0.75 mg/mL)避光交联6 h。
1.2.6.3 交联剂(戊二醛)浓度优化
将BSA-NH2/DEX-COOH粉末溶于PBS缓冲溶液制成20 mg/mL的水溶液。将20 μL该溶液加入EP管中,随后加入200 μL 2-乙基己醇(油/水体积比为10:1),涡旋振荡30 s左右得乳状液,然后加入5 μL浓度分别为5、1、0.75、0.5和0.1 mg/mL的戊二醛避光交联6 h。
1.2.7 微观形貌观察
取上述胶体囊泡至载玻片上,采用正置式显微镜在放大倍数为40倍下观察该囊泡微观形貌;再取上述胶体囊泡1 mL,加入20 μL浓度为1 mg/mL的荧光染料FITC,避光反应30 min染色,随后取该囊泡20 μL至载玻片上,采用正置荧光显微镜在放大倍数为40倍,激发通道为488 nm下观察该囊泡微观形貌。
1.2.8 接触角测试
将胶体囊泡滴于载玻片上使其厚度均匀,待囊泡干燥成膜后采用座滴法模式测定胶体囊泡膜的静态接触角。
1.2.9 胶体囊泡温度稳定性评价
将胶体囊泡分别置于4、25及37 ℃条件下储藏7 d后,取囊泡20 μL至载玻片上,显微镜下观察其表观形态。使用Image J软件计算同一温度不同储藏时间下胶体囊泡的平均直径变化。
1.2.10 胶体囊泡包封性探究
将BSA-NH2/DEX-COOH粉末溶于PBS缓冲溶液配制成20 mg/mL的水溶液,随后将等量浓度为10 mg/mL,分子量分别为20、70、150和500 kDa的异硫氰酸荧光素标记的葡聚糖(FITC-DEX)溶入其中,室温避光孵育30 min。接下来步骤同1.2.6。取胶体囊泡20 μL至载玻片上,荧光显微镜观察胶体囊泡包封不同分子量DEX的性能。
1.3 数据处理
所有试验均进行三次重复,使用Origin 2021软件对试验结果进行绘图,Image J软件进行图片的处理。
2. 结果与分析
2.1 BSA-NH2和DEX-COOH的改性
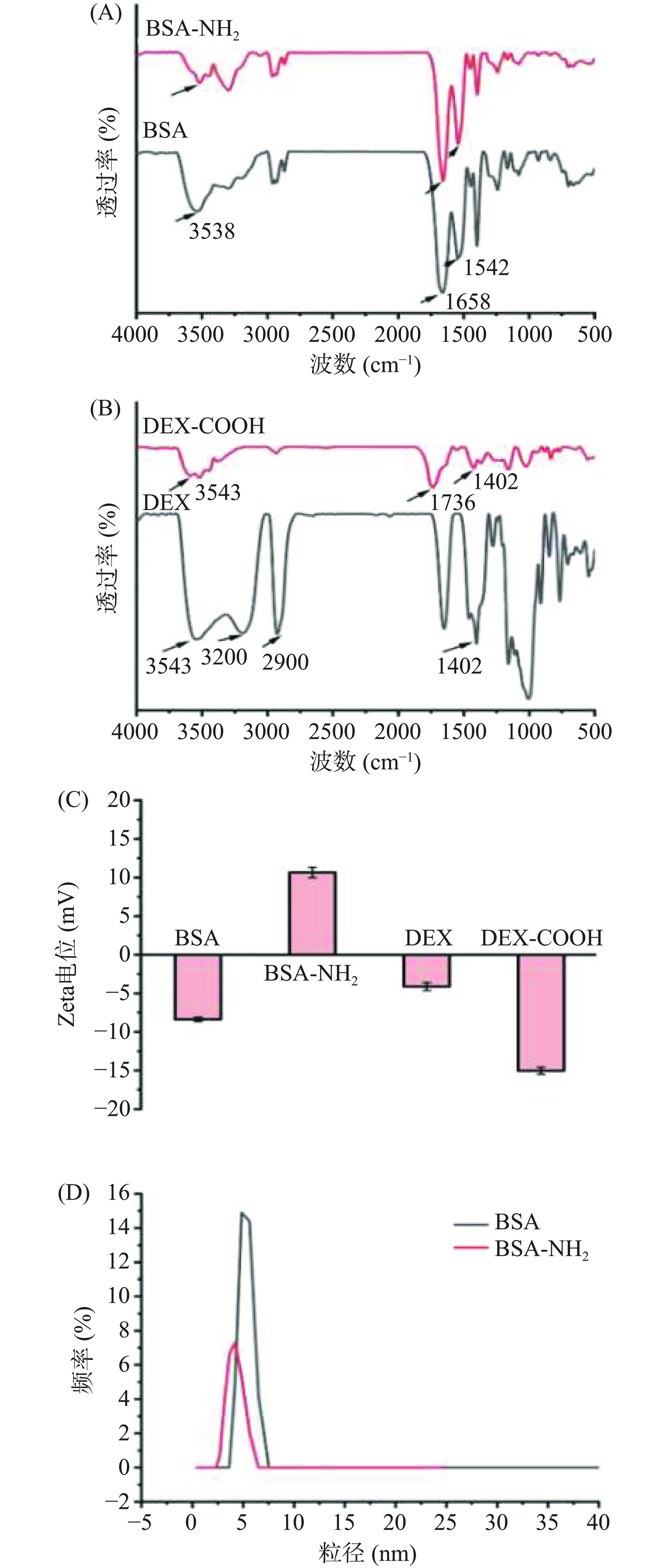
BSA表面约含有游离羧基60个,氨基30个,易接触的氨基位点较少,限制了其通过氨基基团桥接的功能化修饰。将游离的羧基转变为易接触的氨基,可有效提高BSA表面功能化修饰,羧基化改性增加了DEX与正电物质结合。通过FTIR验证BSA和DEX改性前后的结构变化。如图2(A)所示,因BSA本身携带氨基,对其进行氨基化修饰后,其特征官能团,如-OH伸缩振动吸收峰(峰值为3538 cm−1)、C=O伸缩振动吸收峰(峰值为1658 cm−1)和N-H弯曲振动峰(峰值为1542 cm−1)等并未发生明显变化。图2(B)中,DEX的特征吸收峰为3200~3600 cm−1处DEX的-OH伸缩振动峰,2900 cm−1处为DEX中碳氢键(C-H)对称和非对称伸缩振动,1402 cm−1处-OH的弯曲振动峰。经丁二酸酐修饰后,DEX-COOH已不能明显观察到这些峰值,而是出现了1736 cm−1的羰基(C=O)伸缩振动峰[20],证明羧基已成功修饰于DEX骨架上。
动态光散射(DLS)的目的是测量微粒在液体中的大小分布和粒子的运动速度,可以推断粒子尺寸及它们在溶液中的动力学行为。通过DLS对各构筑基元的表面电势及流体力学直径进行测定,图2(C)中,BSA Zeta-电势为−8.38 mV,经氨基化修饰后,其电势转变为+10.64 mV,表明BSA氨基化修饰成功。方野[21]研究表明,BSA经氨基化修饰后,其Zeta-电势可由负转正,与本文研究结果一致。此外,DEX经羧基化修饰后,Zeta-电势从−4.13 mV增加至−15.03 mV,表明羧基基团成功修饰于DEX表面[17]。图2(D)中,BSA直径约为5 nm,经氨基化修饰后,其流体力学直径几乎未发生变化,主要是因为连接的氨基分子量很小,不足以改变BSA分子尺寸[22]。综上,BSA-NH2和DEX-COOH改性成功,有助于形成BSA-NH2/DEX-COOH复合物。
2.2 蛋白-多糖复合物(BSA-NH2/DEX-COOH)的形成
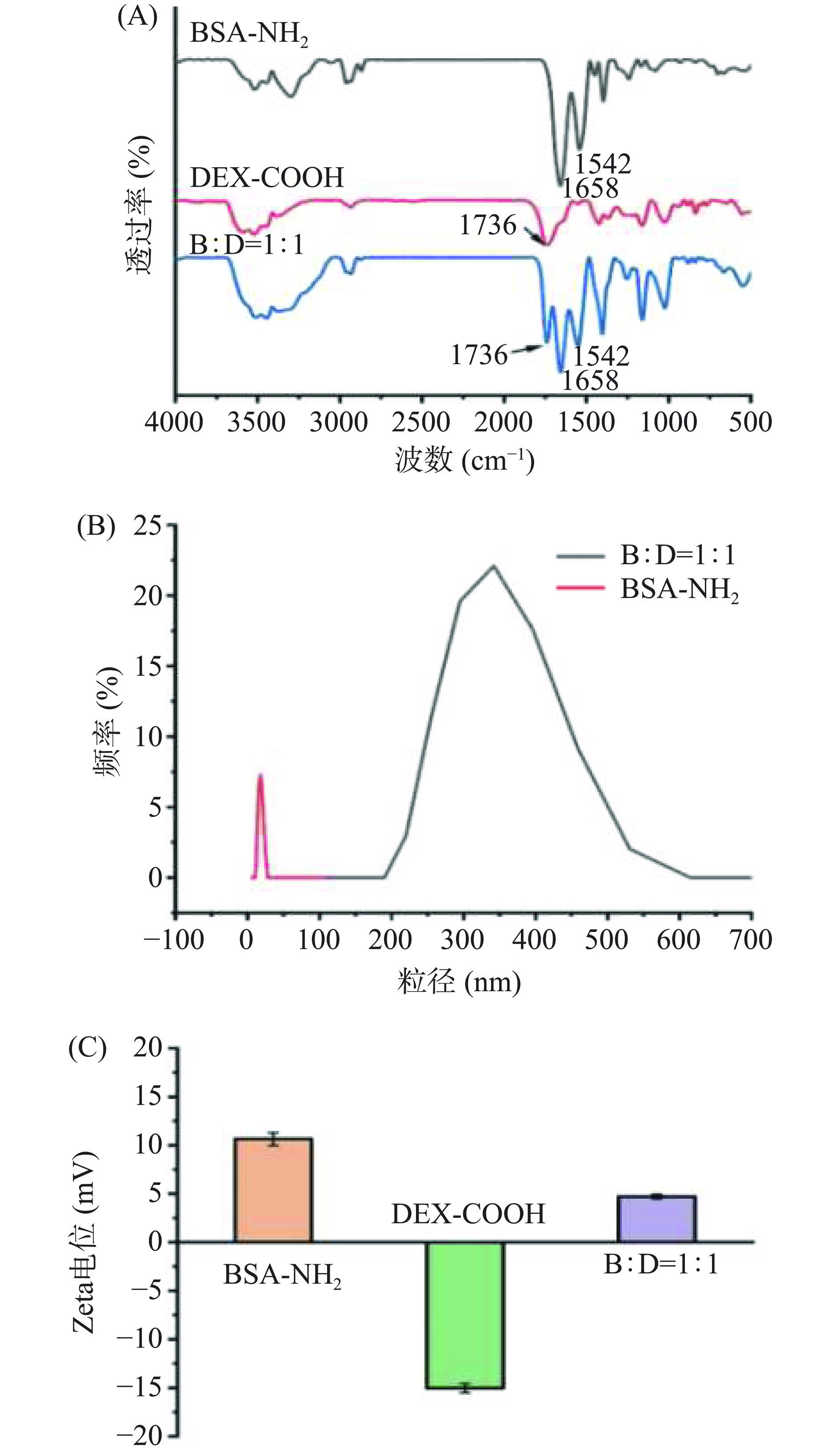
如图3(A)所示,DEX-COOH和BSA-NH2复合后,BSA-NH2的结构发生了改变,在C=O伸缩振动吸收峰(峰值为1658 cm−1)和N-H弯曲振动峰(峰值为1542 cm−1)的基础上又增加了羰基C=O的伸缩振动吸收峰(其峰值为1736 cm−1),表明DEX-COOH与BSA-NH2有效结合[23]。此外,复合物的流体力学直径与BSA-NH2相比大幅增加至300~400 nm左右(图3(B)),复合物表面电荷也发生明显变化,DEX-COOH Zeta-电势为−15.03 mV,与BSA-NH2复合后,所形成BSA-NH2/DEX-COOH复合物Zeta-电势增至+4.72 mV(图3(C))。复合物的表面电荷为正值,即复合物中仍有多余氨基,可进一步与交联剂戊二醛中的醛基缩合发生共价交联[24],BSA-NH2/DEX-COOH已成功复合,该复合物的合成为后续胶体囊泡的形成及相转移提供了有利条件。
2.3 胶体囊泡形成条件优化
2.3.1 不同复合物(BSA-NH2/DEX-COOH)浓度对胶体囊泡形成的影响
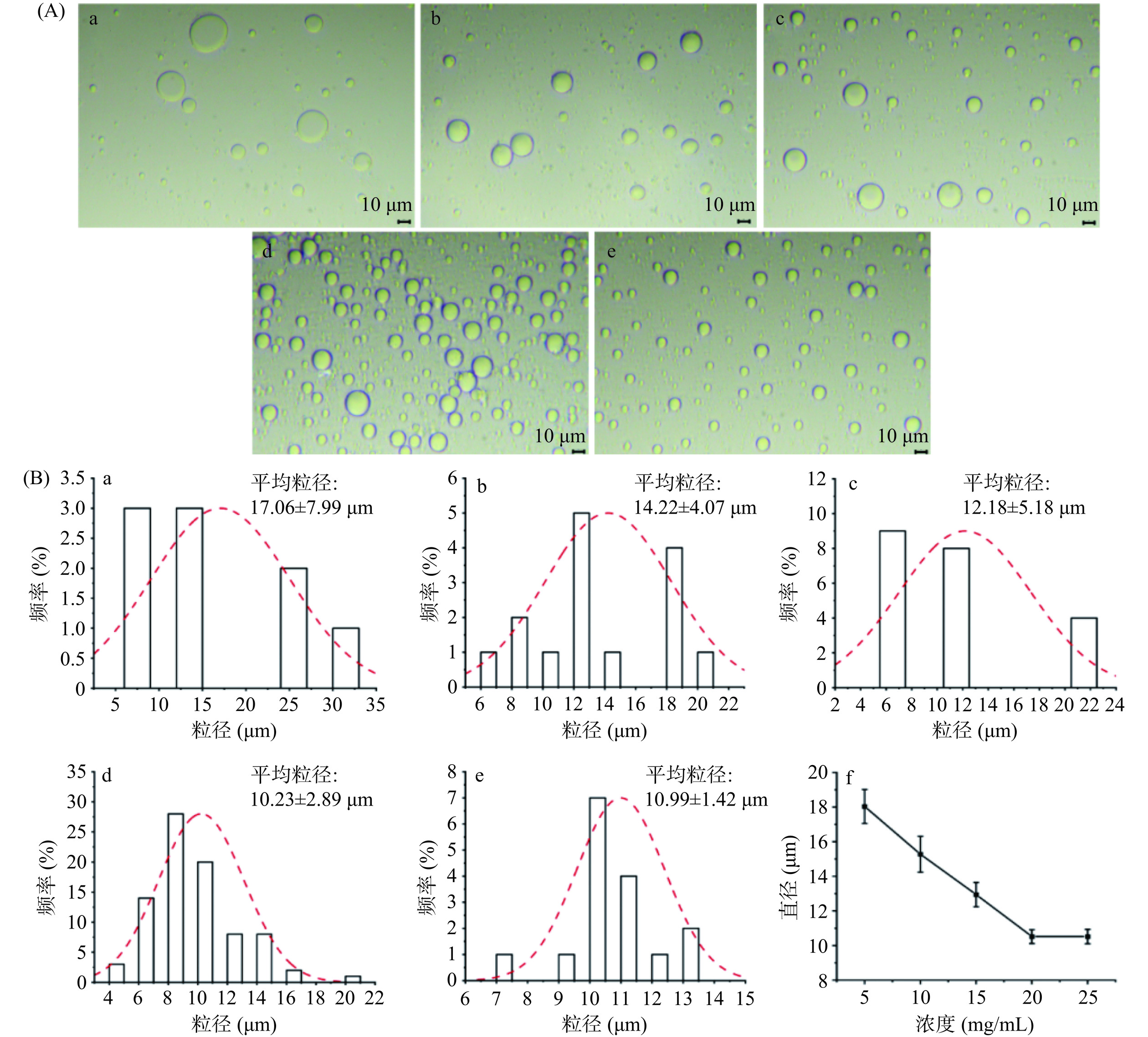
乳化剂的选择和添加量对胶体囊泡的形成起着重要作用[25]。本研究以BSA-NH2/DEX-COOH为乳化剂,对不同浓度BSA-NH2/DEX-COOH形成胶体囊泡的微观形貌进行观察。图4(A)中,随着BSA-NH2/DEX-COOH浓度从5 mg/mL增加到25 mg/mL,所得胶体囊泡的尺寸逐渐减小,囊泡分布愈加均匀、稳定,可能是因为低浓度BSA-NH2/DEX-COOH不足以使囊泡稳定,随着BSA-NH2/DEX-COOH浓度的逐渐增大,囊泡均匀分布,呈现较为规则的中空球状,直径约为10 μm,与战捷[26]在天然多糖构筑微尺度胶囊研究结果相似。当微尺度胶囊的构筑基元浓度≥4 mg/mL时,胶囊尺寸较稳定,当构筑基元浓度为1 mg/mL时,胶囊尺寸较大,且个数极少,即乳化剂浓度对形成囊泡稳定性起决定作用。图4(B)为胶体囊泡粒径分布图,随着BSA-NH2/DEX-COOH浓度的增加,胶体囊泡的尺寸分布逐渐变窄。比较不同浓度BSA-NH2/DEX-COOH所得胶体囊泡的平均尺寸,当BSA-NH2/DEX-COOH浓度达到20 mg/mL时,胶体囊泡的平均尺寸达到10.23 μm,而当BSA-NH2/DEX-COOH浓度增加至25 mg/mL时,胶体囊泡尺寸基本不变。因此,优选BSA-NH2/DEX-COOH浓度为20 mg/mL进行后续试验。
2.3.2 不同油水比例对胶体囊泡形成的影响
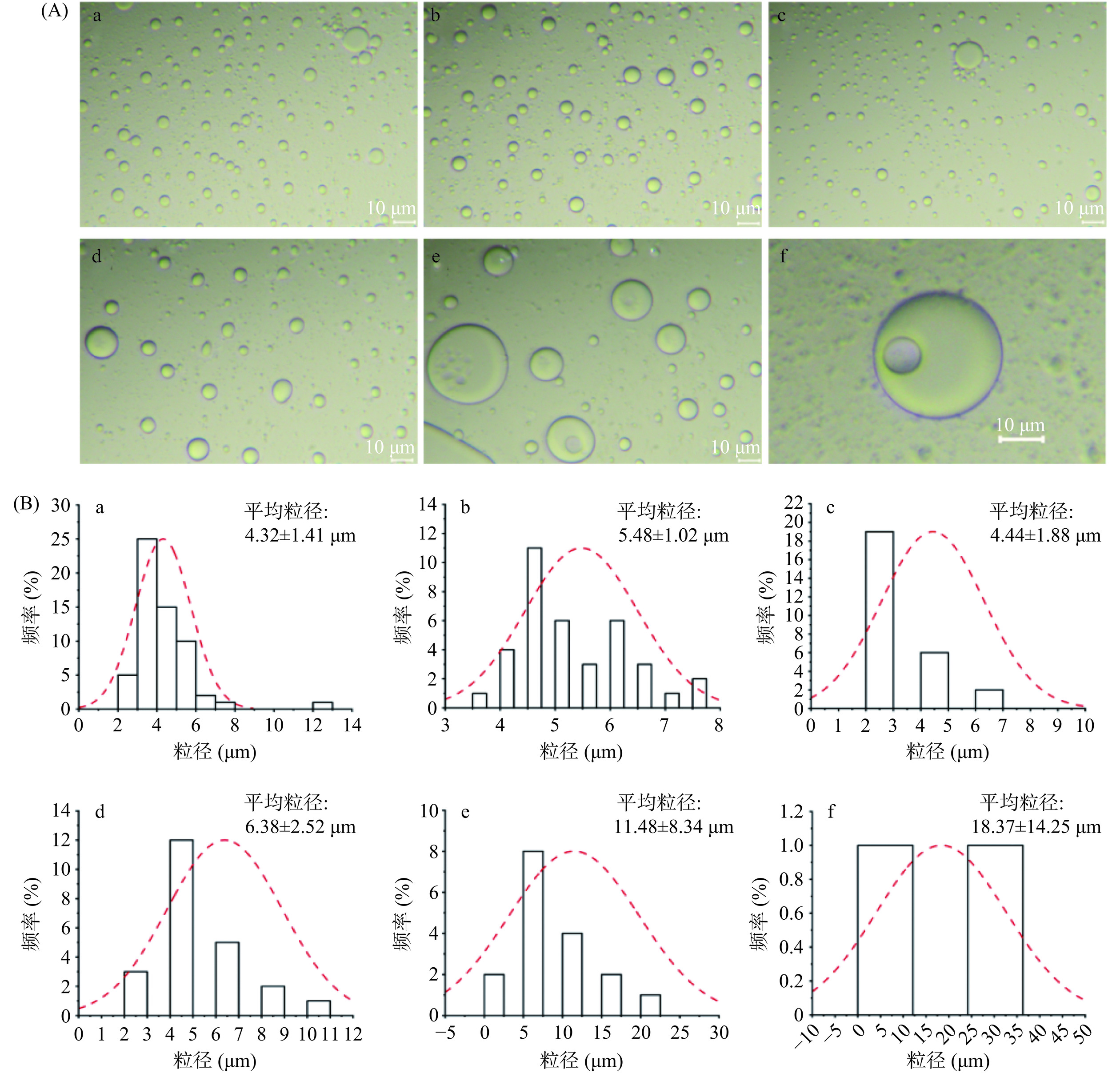
油/水两相体积比是胶体囊泡形成且形态稳定的重要因素[27],油/水比例变化不仅影响囊泡膜中各成分的含量和排列方式,也会影响囊泡表面张力的大小及内部相互作用力的强度。因此,适当的油/水比例可以帮助平衡囊泡表面张力,提高囊泡稳定性。当油/水两相体积分数接近0.5时,囊泡会发生相反转现象[28]。不同油水比例下所得胶体囊泡的微观形貌如图5(A)所示。当油/水两相体积比为15:1时,囊泡体系基本稳定,部分发生破裂;当油/水两相体积比为10:1时,囊泡非常稳定,基本无破裂现象;当油/水两相体积比为5:1时,囊泡有较少破裂出现;当油/水两相体积比为3:1时,囊泡很不稳定,在油包水的单室结构中,破裂现象较多;当油/水两相体积比为1:1时,出现了油包水囊泡与水包油包水多室囊泡共存现象;当油/水两相体积比为0.5:1时,囊泡体系非常不稳定,形成的多为水包油包水的多室囊泡,该现象与Chen等[29]研究结果相似。此外,胶体囊泡的粒径会随油/水体积比的增加而减小[30],当油/水两相体积比为1:1时,囊泡粒径约为11.48 μm;当油/水两相体积比为15:1时,囊泡粒径减小至4.32 μm左右。综上,优选油/水两相体积比为10:1构筑油包水单室结构胶体囊泡。
2.3.3 不同交联剂浓度对胶体囊泡形成的影响
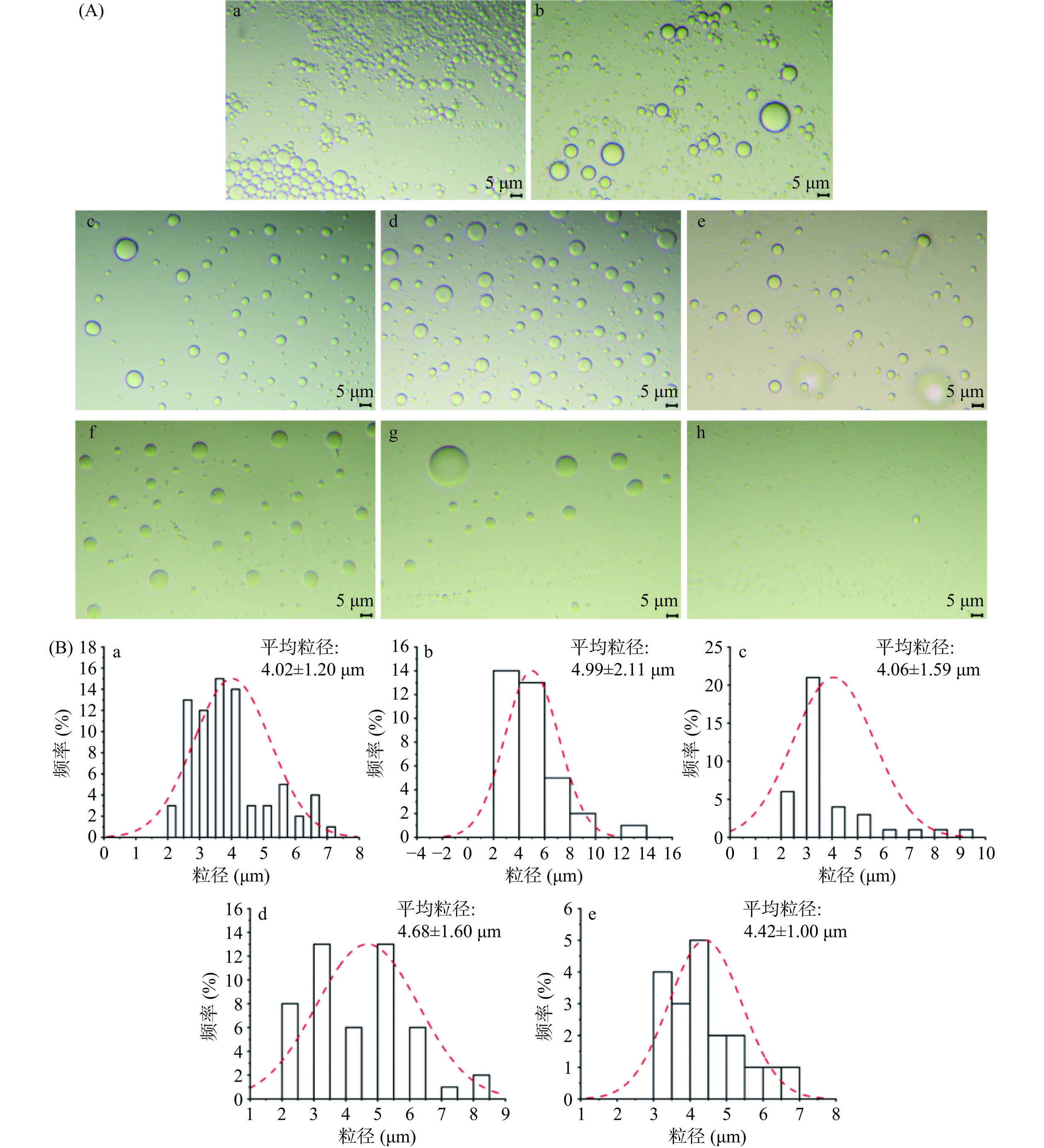
交联剂浓度对胶体囊泡的形成及相转移起决定性作用[31−32]。图6为不同交联剂浓度下所得胶体囊泡的微观形貌。当交联剂浓度为5 mg/mL时,由于交联剂浓度过大,所得囊泡形态不稳定,分散不均一,出现大量粘连现象。当交联剂浓度为1 mg/mL时,囊泡出现部分粘连现象。上述两种条件下形成的囊泡在进行相转移时均团聚成块,无法成功转移至水相。当交联剂浓度为0.75、0.5和0.1 mg/mL时,囊泡不仅在油相中形态稳定、分散均匀,也能成功转移至水相,其微观形貌如图6(f)~图6(h)所示。当交联剂浓度为0.75 mg/mL时,囊泡具有稳定光滑的球形结构。然而,当交联剂浓度为0.5 mg/mL和0.1 mg/mL时,囊泡转移至水相后会发生破裂,表明交联剂浓度过低,不足以使囊泡充分交联,不利于囊泡的跨相转移。图6(b)为交联剂浓度0.75~5 mg/mL范围内对应胶体囊泡的粒径分布图。由图可知,在该交联剂浓度范围内,其平均粒径均为4 μm左右,说明在上述交联剂浓度下,囊泡尺寸较为均一。因此,选择0.75 mg/mL作为最佳交联剂浓度。
2.4 胶体囊泡微观形貌表征
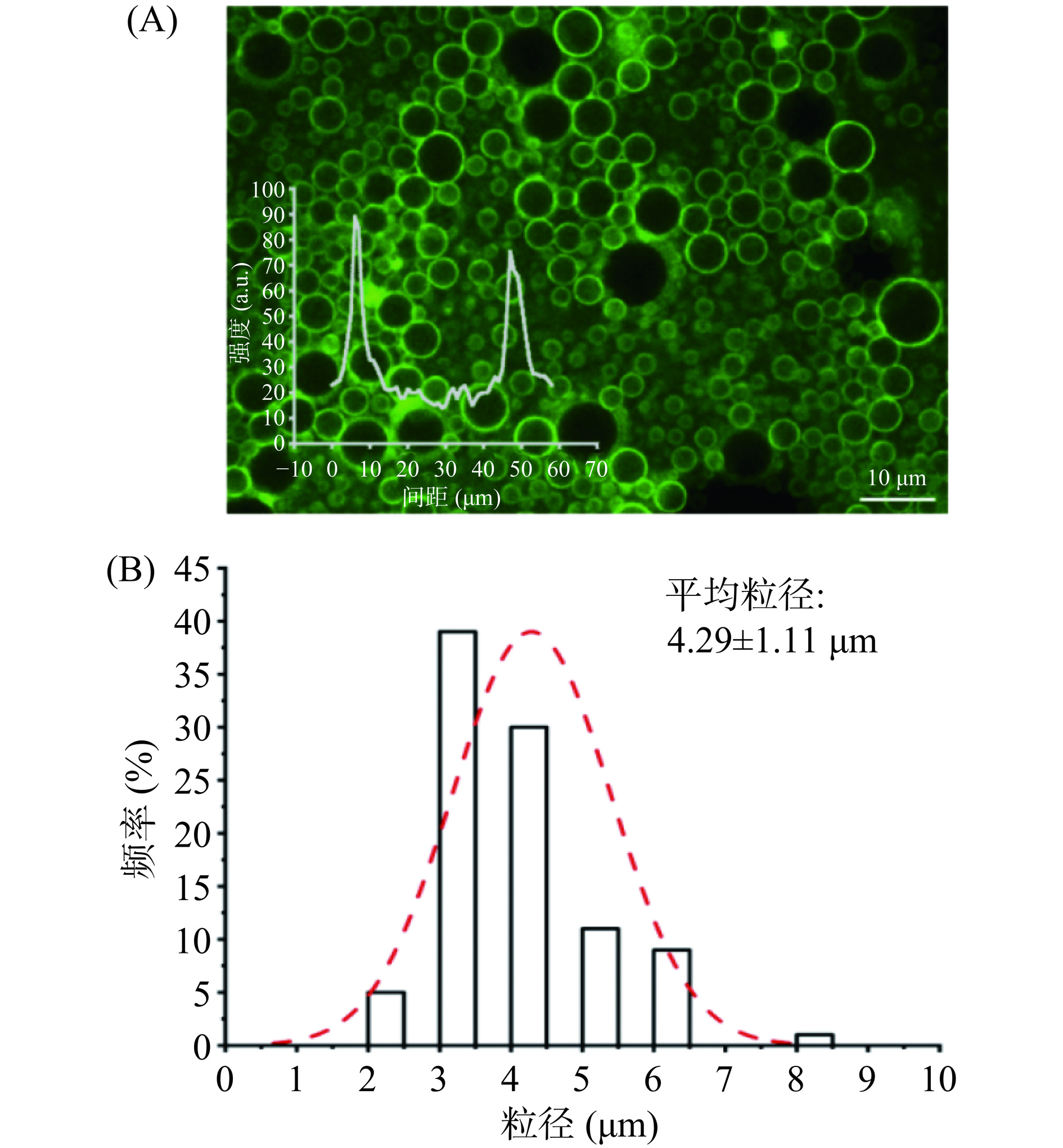
为验证所制备胶体囊泡呈球形且具有完整膜结构,采用荧光显微镜对其微观形貌进行观察。图7(A)为胶体囊泡经FITC染色的荧光显微镜图,插图为胶体囊泡的荧光强度分布。胶体囊泡膜上的荧光强度明显高于内部和外部,说明FITC成功标记于囊泡膜表面。通过对其粒径的测定,得到该球形、中空结构的胶体囊泡平均直径为4.29±1.11 μm(图7(B))。张明瑞等[33]在磷脂类似物囊泡的制备及人造细胞功能研究中,采用乳液法制备了大量囊泡,其结构与本研究所得囊泡类似,可用于模拟细胞结构,也可作为亲水性活性组分递送的良好载体。
2.5 胶体囊泡亲水性测定
接触角是反映测试样品浸润性及膜表面亲疏水性的常用指标,其大小与物质本身化学组成及表面微观结构有关[34]。接触角越小,亲水性越好,反之,则具有良好疏水性。本研究采用座滴法模式[35]对基于Pickering乳液模板法制备的胶体囊泡膜表面静态接触角进行测定。如图8所示,该囊泡膜表面接触角度数为36.4°±0.10°,即由Pickering乳液模板法制备的胶体囊泡具有良好亲水性。
2.6 胶体囊泡储藏稳定性评价
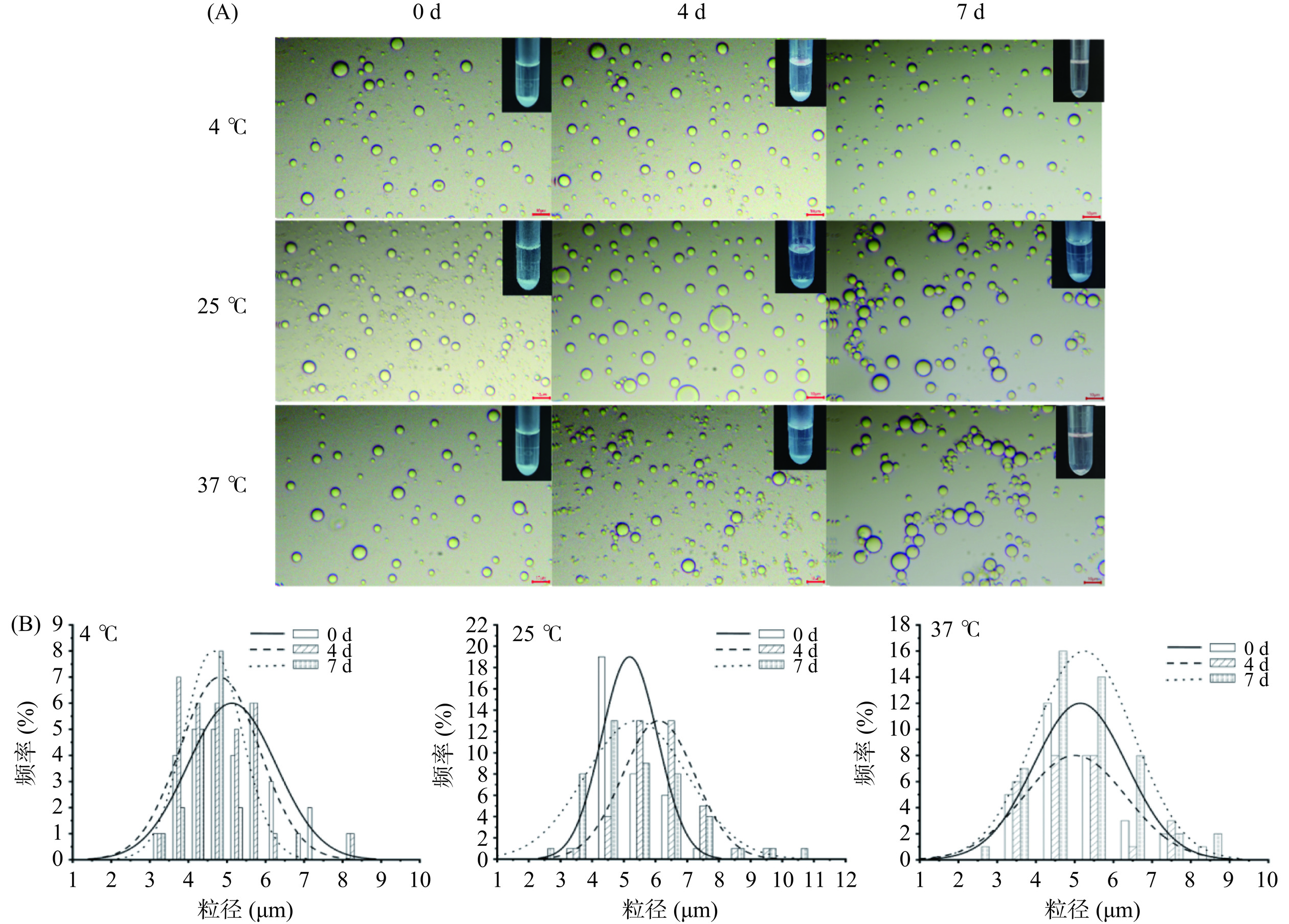
胶体囊泡由蛋白和多糖复合而成,温度会改变蛋白结构,进而影响囊泡稳定性[36],因此对不同温度下胶体囊泡的储藏稳定性进行探究。如图9所示,新鲜制备的囊泡形态稳定、分散均匀。不同温度下储藏4 d后,在4 ℃及25 ℃条件下囊泡具有稳定光滑球形结构,分散性良好,未出现明显絮凝、聚结和破裂现象,而37 ℃下,部分囊泡出现粘连,但基本稳定。当储藏7 d后,4 ℃下囊泡十分稳定,与新鲜制备无明显差异。另外,囊泡在不同温度下储藏7 d后,其粒径均呈正态分布(图9(B),表1),表明该囊泡具有良好的储藏稳定性,且在4 ℃下储藏效果最优。林幼萍[37]通过研究蛋白质基人工脂滴及动态行为发现,BSA脂滴具有稳定光滑球形结构,其在放置4 d过程中没有明显聚结现象,具有良好稳定性。因此,通过Pickering乳液模板法构建得到的球形、中空结构胶体囊泡在储藏过程中可保持其膜结构的完整及尺寸的稳定,可用于活性组分的有效包载。
表 1 不同时间和温度囊泡平均粒径Table 1. Mean size of vesicles at different times and temperatures时间 温度 4 ℃ 25 ℃ 37 ℃ 0 d 5.13±1.15 μm 5.18±0.88 μm 5.15±1.20 μm 4 d 4.81±1.03 μm 6.10±1.14 μm 5.01±1.33 μm 7 d 5.01±1.33 μm 5.40±1.61 μm 5.25±1.27 μm 2.7 胶体囊泡包封性探究
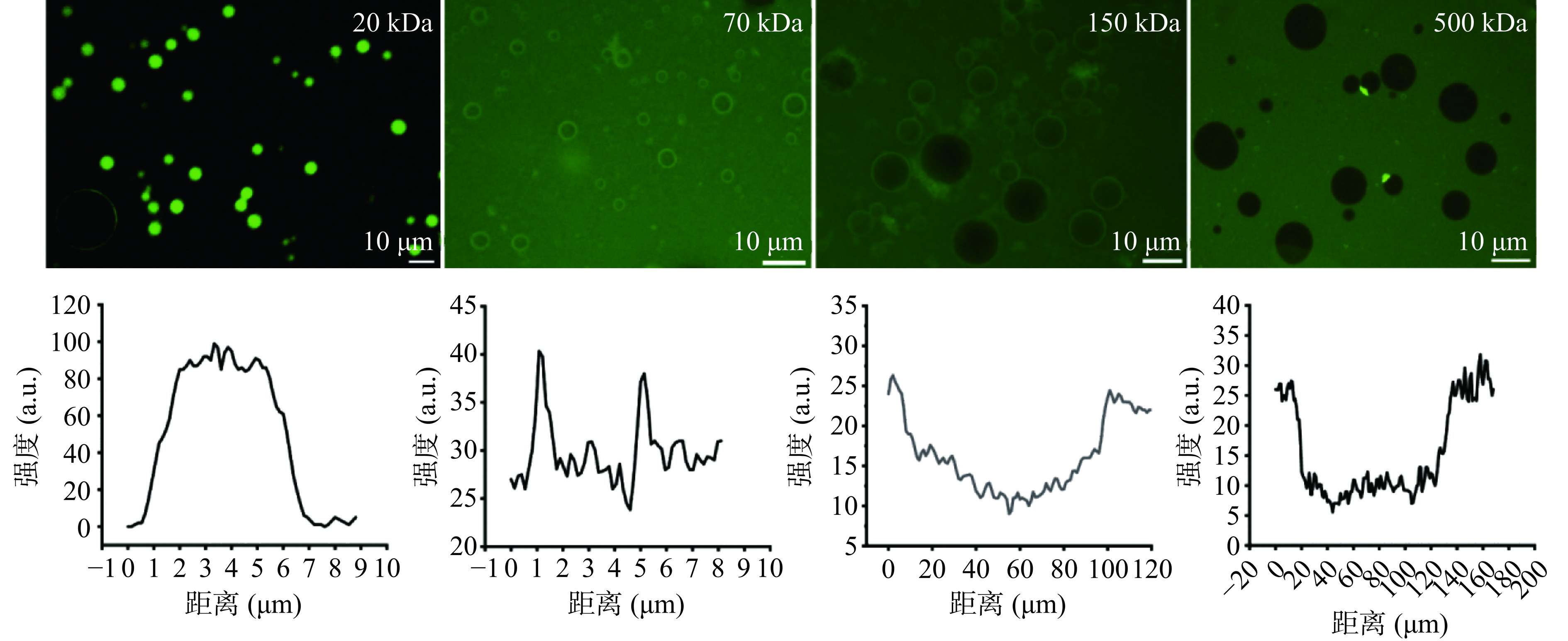
由于DEX本身无荧光,为了可视化胶体囊泡的包封性,分别将不同分子量的DEX经FITC标记,以探究胶体囊泡对不同分子量DEX的包封能力。本试验选用分子量分别为20、70、150和500 kDa的荧光物质FITC-DEX进行包载。图10为包载不同分子量FITC-DEX的胶体囊泡荧光显微镜照片及荧光强度分布图。当FITC-DEX分子量为20 kDa时,荧光染料被完全包封在囊泡内部,对应荧光强度谱图呈现“凸”字型;当FITC-DEX分子量为70 kDa时,胶体囊泡内外荧光强度处于动态平衡,部分荧光物质被包封于囊泡内部;当FITC-DEX分子量为150 kDa及500 kDa时,囊泡内部相对于外部无荧光,对应荧光强度谱图呈现“凹”字型,说明该囊泡可包封分子量≤70 kDa的亲水性物质。该结果与Li等[38]研究结果相似,主要是因为蛋白和多糖具有丰富的功能基团,由此组装形成的胶体囊泡具有可调控结构、良好生物相容性及较好的稳定性。综上,本研究构筑的球形、中空囊泡结构具有更强的可塑性,为成为载体提供便利,也为包载递送生物活性组分提供了良好技术思路。
3. 结论
本研究通过合成BSA-NH2和DEX-COOH,并以此为构筑基元,采用Pickering乳液模板法构建基于蛋白-多糖界面组装下的胶体囊泡。结果发现在交联剂浓度为0.75 mg/mL、聚合物浓度为20 mg/mL、油/水体积比为10:1条件下能够制备粒径约为5 μm、形态稳定、具有稳定光滑中空球形且完整膜结构的胶体囊泡。通过研究该囊泡在不同温度下的贮藏稳定性及包载不同分子量DEX的能力,表明该胶体囊泡在4 ℃条件下贮藏效果最优且可以成功包载分子量≤70 kDa的亲水性生物大分子。因此,蛋白-多糖组装形成的胶体囊泡能够包载生物活性组分,提高其营养吸收,为递送载体构建奠定理论基础,在食品及生物医药领域具有重大应用潜力。
-
表 1 不同时间和温度囊泡平均粒径
Table 1 Mean size of vesicles at different times and temperatures
时间 温度 4 ℃ 25 ℃ 37 ℃ 0 d 5.13±1.15 μm 5.18±0.88 μm 5.15±1.20 μm 4 d 4.81±1.03 μm 6.10±1.14 μm 5.01±1.33 μm 7 d 5.01±1.33 μm 5.40±1.61 μm 5.25±1.27 μm -
[1] XU C, HU S, CHEN X Y. Artificial cells:from basic science to applications[J]. Materials Today,2016,19(9):516−532. doi: 10.1016/j.mattod.2016.02.020
[2] VAN NIES P, WESTERLAKEN I, BLANKEN D, et al. Self-replication of DNA by its encoded proteins in liposome-based synthetic cells[J]. Nature Communications,2018,9(1):1583. doi: 10.1038/s41467-018-03926-1
[3] HUANG X, PATIL A J, LI M, et al. Design and construction of higher-order structure and function in proteinosome-based protocells[J]. Journal of the American Chemical Society,2014,136(25):9225−9234. doi: 10.1021/ja504213m
[4] PETERS R J, MARGUET M, MARAIS S, et al. Cascade reactions in multicompartmentalized polymersomes[J]. Angewandte Chemie,2014,126(1):150−154. doi: 10.1002/ange.201308141
[5] KUMAR R K, HARNIMAN R L, PATIL A J, et al. Self-transformation and structural reconfiguration in coacervate-based protocells[J]. Chemical Science,2016,7(9):5879−5887. doi: 10.1039/C6SC00205F
[6] DINSMORE A D, HSU M F, NIKOLAIDES M G, et al. Colloidosomes:selectively permeable capsules composed of colloidal particles[J]. Science,2002,298(5595):1006−1009. doi: 10.1126/science.1074868
[7] SUN Q, CHEN J F, ROUTH A F. Coated colloidosomes as novel drug delivery carriers[J]. Expert Opinion on Drug Delivery,2019,16(9):903−906. doi: 10.1080/17425247.2019.1652594
[8] THOMPSON K L, WILLIAMS M, ARMES S P. Colloidosomes:Synthesis, properties and applications[J]. Journal of Colloid and Interface Science,2015,447:217−228. doi: 10.1016/j.jcis.2014.11.058
[9] 缑青霞, 姚晓琳, 韦湘滢, 等. 基于Pickering乳液稳定机理的水包水乳液研究进展[J]. 食品科学,2023,44(13):289−296. [GOU Q X, YAO X L, WEI X Y, et al. Advances in research on water-in-water emulsions based on the stabilization mechanism of pickering emulsions[J]. Food Science,2023,44(13):289−296.] doi: 10.7506/spkx1002-6630-20220622-236 GOU Q X, YAO X L, WEI X Y, et al. Advances in research on water-in-water emulsions based on the stabilization mechanism of pickering emulsions[J]. Food Science, 2023, 44(13): 289−296. doi: 10.7506/spkx1002-6630-20220622-236
[10] NAN F F, WU J, QI F, et al. Preparation of uniform-sized colloidosomes based on chitosan-coated alginate particles and its application for oral insulin delivery[J]. Journal of Materials Chemistry B,2014,2(42):7403−7409. doi: 10.1039/C4TB01259C
[11] MANGA M S, CAYRE O J, WILLIAMS R A, et al. Production of solid-stabilised emulsions through rotational membrane emulsification:influence of particle adsorption kinetics[J]. Soft Matter,2012,8(5):1532−1538. doi: 10.1039/C1SM06547E
[12] TANG R, UMEMORI K, RABIN J, et al. Bifunctional nanoparticle‐stabilized hydrogel colloidosomes serve as both extracellular matrix and bioactive factor delivery vehicles[J]. Advanced Therapeutics,2020,3(11):2000156. doi: 10.1002/adtp.202000156
[13] ZHAO Y Y, LIU J X, ZHANG S M, et al. Fabrication and characterization of the H/J-type aggregates astaxanthin/bovine serum albumin/chitosan nanoparticles[J]. International Journal of Biological Macromolecules,2022,223:1186−1195. doi: 10.1016/j.ijbiomac.2022.11.006
[14] WEI N S, YANG J S, DONG K Q, et al. Amino-functionalized bovine serum albumin amyloid fibrils aerogel for absorbing copper from water[J]. Journal of Cleaner Production,2022,380:134955. doi: 10.1016/j.jclepro.2022.134955
[15] WU G Y, WANG L, ZHOU P, et al. Design and construction of hybrid microcapsules with higher-order structure and multiple functions[J]. Advanced Science,2018,5(2):1700460. doi: 10.1002/advs.201700460
[16] FAN Y T, LIU Y X, GAO L Y, et al. Improved chemical stability and cellular antioxidant activity of resveratrol in zein nanoparticle with bovine serum albumin-caffeic acid conjugate[J]. Food Chemistry, 261(2018):283−291.
[17] SU D Y, LIU X M, LIU L N, et al. In situ self-assembly of Coacervate microdroplets into viable artificial cell wall with heritability[J]. Advanced Functional Materials,2018,28(10):1705699. doi: 10.1002/adfm.201705699
[18] HU H J, LIANG X T, WANG S S, et al. A removable artificial cell wall for withstanding ciprofloxacin[J]. Macromolecular Bioscience,2020,20(12):2000185. doi: 10.1002/mabi.202000185
[19] ZHOU Y T, JIANMIN S, WANG L, et al. In situ gelation-induced death of cancer cells based on proteinosomes[J]. Biomacromolecules,2017,18(8):2446−2453. doi: 10.1021/acs.biomac.7b00598
[20] WEN P, LIU X M, WANG L, et al. Coordinated membrane fusion of proteinosomes by contact-induced hydrogel self-healing[J]. Small,2017,13(22):1700467. doi: 10.1002/smll.201700467
[21] 方野. 基于pH调控的牛血清白蛋白高效抗菌剂的设计构筑[D]. 哈尔滨:哈尔滨工业大学, 2021. [FANG Y. Construction of effective antimicrobialagent of bovine serum albumin based on pH response[D]. Harbin:Harbin Institute of Technology, 2021.] FANG Y. Construction of effective antimicrobialagent of bovine serum albumin based on pH response[D]. Harbin: Harbin Institute of Technology, 2021.
[22] FAN Y T, YI J, ZHANG Y Z, et al. Fabrication of curcumin-loaded bovine serum albumin (BSA)-dextran nanoparticles and the cellular antioxidant activity[J]. Food Chemistry,2018,239:1210−1218. doi: 10.1016/j.foodchem.2017.07.075
[23] JIANG Z Y, ZHAO S J, FAN Z Y, et al. A novel all-natural (collagen+pectin)/chitosan aqueous two-phase microcapsule with improved anthocyanin loading capacity[J]. Food Hydrocolloids,2023,134:107984. doi: 10.1016/j.foodhyd.2022.107984
[24] YU Z J, LI Q, HE X, et al. A multifunctional hydrogel based on nature polysaccharide fabricated by Schiff base reaction[J]. European Polymer Journal,2023,197:112330. doi: 10.1016/j.eurpolymj.2023.112330
[25] TAHA A, AHMED E, ISMAIEL A, et al. Ultrasonic emulsification:an overview on the preparation of different emulsifiers-stabilized emulsions[J]. Trends in Food Science & Technology,2020,105:363−377.
[26] 战捷. 基于天然多糖的耐高温微型反应器的构筑[D]. 哈尔滨:哈尔滨工业大学, 2019. [ZHAN J. Construction of high-temperature-resistant micro compartments based on natural polysaccharides[D]. Harbin:Harbin Institute of Technology, 2019.] ZHAN J. Construction of high-temperature-resistant micro compartments based on natural polysaccharides[D]. Harbin: Harbin Institute of Technology, 2019.
[27] 武飞扬, 谷月, 马鸣阳, 等. 水包油型食品乳液中天然小分子乳化剂的功能性质及与其他乳化剂相互作用关系的研究进展[J]. 食品科学,2021,42(23):284−293. [WU F Y, GU Y, MA M Y, et al. Progress in research on functional properties of natural small molecule emulsifiers in oil-in-water emulsions and their interactions with other emulsifiers[J]. Food Science,2021,42(23):284−293.] doi: 10.7506/spkx1002-6630-20201020-187 WU F Y, GU Y, MA M Y, et al. Progress in research on functional properties of natural small molecule emulsifiers in oil-in-water emulsions and their interactions with other emulsifiers[J]. Food Science, 2021, 42(23): 284−293. doi: 10.7506/spkx1002-6630-20201020-187
[28] ZHOU F Z, YU X H, LUO D H, et al. Pickering water in oil emulsions prepared from biocompatible gliadin/ethyl cellulose complex particles[J]. Food Hydrocolloids, 2023, 134:108050.
[29] CHEN Q, YANG Z Y, TAI X M, et al. Study on influencing factors of Pickering emulsion stabilized by modified montmorillonite and fatty alcohol polyoxyethylene ether[J]. Journal of Dispersion Science and Technology, 2022, 43(13):1959−1967.
[30] ROBERTS L A, XIE F, BROOKS B W. The production of small monomer drops in liquid–liquid dispersions by approaching a catastrophic phase inversion[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2006,274(1−3):179−184.
[31] JAGGERS R W, BON S A. Structure and behaviour of vesicles in the presence of colloidal particles[J]. Soft Matter,2018,14(34):6949−6960. doi: 10.1039/C8SM01223G
[32] LI S R, XIE X T, WANG W L, et al. Choline phosphate lipid as an intra-crosslinker in liposomes for drug and antibody delivery under guard[J]. Nanoscale,2022,14(6):2277−2286. doi: 10.1039/D1NR07103C
[33] 张明瑞, 韩晓军. 磷脂类似物囊泡的制备及其人造细胞功能研究[J]. 分析化学,2023,51(5):884−891. [ZHANG M R, HAN X J. Construction of phospholipid analogue vesicle and study of its artificial cell functions[J]. Analytical Chemistry,2023,51(5):884−891.] ZHANG M R, HAN X J. Construction of phospholipid analogue vesicle and study of its artificial cell functions[J]. Analytical Chemistry, 2023, 51(5): 884−891.
[34] MENG Y, NICOLAI T. The effect of the contact angle on particle stabilization and bridging in water-in-water emulsions[J]. Journal of Colloid and Interface Science,2023,638:506−512. doi: 10.1016/j.jcis.2023.02.006
[35] 孙照玲. 蛋白质聚合物单层膜的制备及对酶催化反应的调控[D]. 哈尔滨:哈尔滨工业大学, 2022. [SUN Z L. Single-layer protein polymer membrane for modulating biocatalytic reactions[D]. Harbin:Harbin Institute of Technology, 2022.] SUN Z L. Single-layer protein polymer membrane for modulating biocatalytic reactions[D]. Harbin: Harbin Institute of Technology, 2022.
[36] ZHOU X F, HE Z P, HUANG H. Secondary structure transitions of bovine serum albumin induced by temperature variation[J]. Vibrational Spectroscopy,2017,92:273−279. doi: 10.1016/j.vibspec.2017.08.001
[37] 林幼萍. 蛋白质基人工脂滴的构筑及其动态行为研究[D]. 哈尔滨:哈尔滨工业大学, 2021. [LIN Y P. Protein-based synthetic lipid droplet and its dynamic behaviors[D]. Harbin:Harbin Institute of Technology, 2021.] LIN Y P. Protein-based synthetic lipid droplet and its dynamic behaviors[D]. Harbin: Harbin Institute of Technology, 2021.
[38] LI J B, LIU X M, ABDELMOHSEN L K E A, et al. Spatial organization in proteinaceous membrane-stabilized coacervate protocells[J]. Small,2019,15(36):1902893. doi: 10.1002/smll.201902893





 下载:
下载:

 下载:
下载:



