Effect and Mechanism of Soluble Dietary Fiber from Corn Bran on Loperamide-induced Constipation in Mice
-
摘要: 本文主要研究玉米皮可溶性膳食纤维(corn bran soluble dietary fiber,CSDF)对洛哌丁胺诱导的小鼠便秘及小鼠肠道菌群变化的影响。60只BALB/c雄性小鼠随机分为正常组,模型组,CSDF低、中、高剂量组(3、6、12 g·kg−1·d)和联合组(CSDF:副干酪乳杆菌=30:1(v:v)),每组10只。CSDF持续干预14 d,干预结束后以洛哌丁胺悬浊液(10 mg·kg−1)诱导小鼠便秘,持续7 d。排便试验结果表明:与模型组相比,CSDF干预能显著缩短便秘小鼠首粒黑便时间,6 h排便量和粪便含水量显著提高(P<0.05)。小肠推进率和结肠病理试验表明,与模型组相比,联合组小肠推进率提升了110.58%,结肠隐窝深度提升了43.67%。与模型组相比,CSDF摄入后小鼠胃肠道相关神经递质(胃动素、5-羟色胺等)水平升高,提示CSDF可改善便秘性肠道神经系统紊乱。此外,补充CSDF后,有益肠道细菌(双歧杆菌、乳杆菌和毛螺菌等)丰度上调,短链脂肪酸(short chain fatty acids, SCFAs)含量升高,L-CSDF组中典型的SCFAs(乙酸、丙酸和丁酸)分别达到了模型组的1.89、1.60和4.35倍。综上,CSDF可通过调节神经递质水平和重塑肠道菌群及代谢物水平来缓解便秘,且联合益生菌后CSDF可更有效的缓解便秘引发的结肠炎症。
-
关键词:
- 玉米皮可溶性膳食纤维 /
- 副干酪乳杆菌 /
- 缓解便秘 /
- 肠道菌群
Abstract: This study was performed to elucidate effects of corn bran soluble dietary fibers (CSDF) on loperamide-induced constipation and changes in intestinal flora in mice. Sixty male BALB/c mice were randomly divided into a normal group, a model group, CSDF low, medium, and high dose groups (3, 6, and 12 g·kg−1·d), and a combination group (CSDF: Lactobacillus paracasei=30:1(v:v)), with 10 mice in each group. CSDF was administered for 14 d. At the end of the intervention, constipation was induced with single dose administration of a loperamide suspension (10 mg·kg−1), and mice were monitored for 7 d. Compared with the model group, CSDF intervention significantly shortened the time to the first black stool in constipated mice. The volume of defecation spanning 6 h and the water content of feces were also significantly increased (P<0.05). Small bowel propulsion rate and colon pathology experiments showed a 110.58% increase in small bowel propulsion rate, and a 43.67% increase in colonic crypt depth in the combined group compared with that of the model group. Compared to that of the model group, the levels of gastrointestinal tract-related neurotransmitters (motilin, 5-hydroxytryptamine, etc.) were elevated in mice that received CSDF, suggesting that CSDF could alleviate constipation in enteric nervous system disorders. CSDF supplementation also increased the abundance of beneficial gut bacteria (Bifidobacterium, Lactobacillus, and Lachnospiraceae) and elevated levels of short chain fatty acids (SCFAs), with typical SCFAs (acetic, propionic, and butyric acids) reaching 1.89-, 1.60-, and 4.35-fold higher levels, respectively, in the L-CSDF group than that in the model group. In conclusion, CSDF can alleviate constipation by regulating neurotransmitter levels and remodeling intestinal flora and metabolite levels, and its efficacy in alleviating constipation-induced colonic inflammation can be enhanced by administration in combination with probiotics. -
便秘是一种肠道功能性疾病,全球约有15%人口患有便秘[1],主要表现为排便困难、排便频率降低等症状[2],且便秘引发的肠道微生物失衡是引发动脉粥样硬化、血压异常、心律失常的关键原因[3]。近年来,肠道微生物及肠道分泌物与便秘之间的关系受到了广泛关注,便秘患者肠道生态失调严重,厚壁芽孢杆菌/合成代谢芽孢杆菌比例增加,乳杆菌、拟杆菌和双歧杆菌丰度减少,肠杆菌科(大肠杆菌、金黄色葡萄球菌等)丰度增加[4−5],说明菌群丰度的变化影响肠道蠕动,放线菌、拟杆菌和乳球菌丰度增加与肠道蠕动呈正相关,而粪肠球菌丰度增加与肠道蠕动呈负相关[6]。此外,肠道微生物代谢物(短链脂肪酸(SCFAs)和5-羟色胺(5-HT))已被证明通过刺激分泌吸收的肠道神经来影响肠道收缩运动[7]。目前渗透性和刺激性泻药或促动力药物仍然是治疗便秘的主要方法,治疗过程通常伴随着副作用,如腹胀、胃痉挛、肠胃胀气和头晕。这些副作用导致约47%的患者对药物干预失去耐心[8−9]。因此,迫切需要副作用更小的方法来代替传统药物治疗。
膳食补充剂与益生菌干预可作为药物治疗的代替性方案。可溶性膳食纤维(soluble dietary fiber, SDF)是一种具有复杂组成和结构的非淀粉多糖聚合物,其选择性地作为宿主微生物的底物,被肠道微生物发酵达到重塑肠道菌群的效果[10],进而发挥缓解便秘的作用。SDF的体内发酵可有效提高肠道菌群的丰度和多样性,例如增加普氏菌和双歧杆菌,减少脱硫弧菌[11−12]。同时,SDF促进肠道内SCFAs的产生,SCFAs作为免疫调节剂,通过预防肠道炎症降低便秘的风险[13]。此外,益生菌可通过使炎症相关的运动障碍正常化,对宿主肠道屏障和免疫系统产生有益的影响,从而预防肠道炎症[14−15],益生菌也被证明可以通过改变肠道环境来改善便秘,乳酸菌、双歧杆菌、副卡西乳杆菌、两歧双歧杆菌和短乳杆菌等可通过增加结肠转运率和改变粪便性状来调节便秘症状[16]。
玉米皮作为玉米深加工副产品主要用于饲料工业[17]。然而,玉米皮可作为SDF的主要来源,且(corn bran soluble dietary fiber,CSDF)具有多种生物活性[18−19]。副干酪乳杆菌被证实可通过调节肠道菌群和代谢物来有效缓解便秘[20−21]。因此,本研究旨在评估CSDF对洛哌丁胺诱导便秘的影响。此外,针对便秘模型设计CSDF与副干酪乳杆菌的合成元干预组,旨在探索益生元与益生菌联合使用是否是更有效的缓解便秘途径。
1. 材料与方法
1.1 材料与仪器
6周龄BALB/c雄性小鼠60只(16~18 g) 购于哈尔滨医科大学试验动物部(许可号:SYXK2021-014);玉米皮 京粮龙江生物工程有限公司;副干酪乳杆菌(1.0×1011 CFU/g) 中科嘉亿生物工程有限公司;洛哌丁胺 西安杨森制药有限公司;阿拉伯胶、活性炭粉 麦克林生物科技有限公司;标准维持饲料 江苏协同制药生物工程有限公司;苏木精-伊红染色液(H&E) Sigma-Aldrich公司;胃动素(motilin, MTL)、血管活性肠肽(vasoactive intestinal peptide, VIP)、生长抑素(somatostatin, SS)、P物质(Substance P, SP)、5-羟色胺(5-hydroxytryptamine, 5-HT)、乙酰胆碱酯酶(acetylcholinesteras, AchE) 上海酶联生物技术有限公司;FastDNA SPIN Kit试剂盒 美国MP Biomedicals公司;其他试剂均为分析纯。
1260 Infinity II高效液相色谱仪 美国Agilent公司;EG 1160包埋机 德国LEICA公司;RM 2135石蜡切片机 德国LEICA公司。
1.2 实验方法
1.2.1 玉米皮可溶性膳食纤维制备
将玉米皮粉碎过80目筛,筛下部分用石油醚脱脂并烘干备用。将干燥玉米皮和蒸馏水按一定比例混合。调pH至6.5, 温度60 ℃,加入1% α-淀粉酶水解1 h。调pH至9, 温度50 ℃,加入2%碱性蛋白酶水解3 h。pH调至4.5,温度50 ℃,加入1%淀粉葡萄糖苷酶水解2 h,酶解后沸水浴15 min使酶灭活。冷却后4000 r/min离心15 min,将上清液浓缩至约为原体积的1/3,加入4倍体积95%乙醇,4 ℃醇沉12 h,收集沉淀后冷冻干燥,得到玉米皮可溶性膳食纤维。
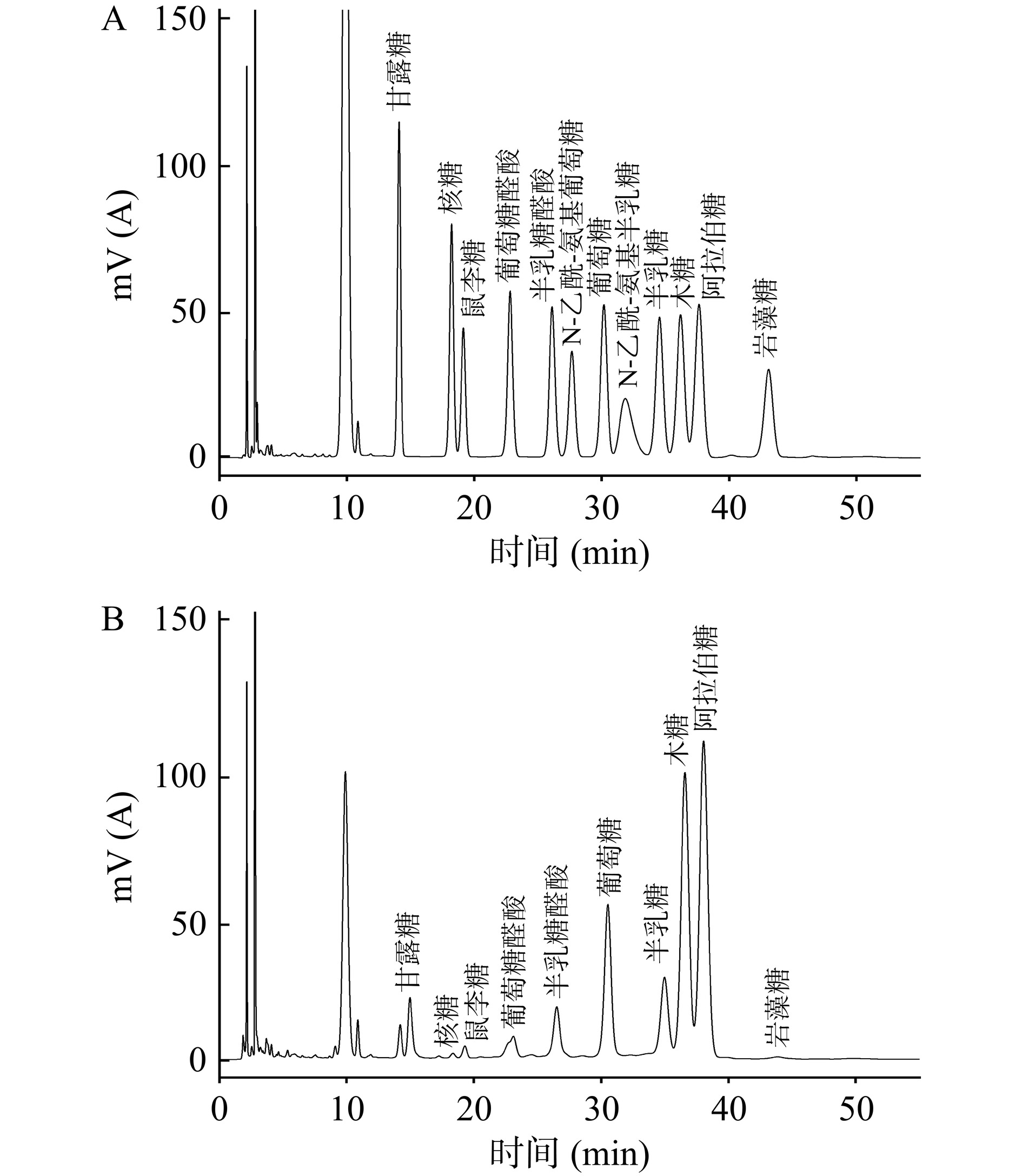
1.2.2 采用高效液相色谱法分析其单糖组成
样品水解:称取样品适量至安瓿瓶中,加入3.0 mL TFA(2.0 mol/L)于安瓿瓶中,充氮,封管,120 ℃酸解4 h。移取出加入甲醇氮吹挥干,加3 mL水复溶。
衍生:取250 μL混合对照溶液到EP管中,加入250 μL NaOH(0.60 mol/L),500 μL PMP-甲醇(0.40 mol/L),70 ℃反应1 h。冷却10 min;加入500 μL HCl(0.30 mol/L)中和,再加入1 mL氯仿漩涡1 min,3000 r/min离心10 min,取上清,萃取3次,上清液用于HPLC。
HPLC条件:色谱柱Xtimate C18( 4.6×200 nm 5 μm),柱温:30 ℃,流速:1.0 mL/min,检测波长:250 nm,进样量:2 μL,流动相:0.05 mol/L磷酸二氢钾溶液(pH 6.70):乙腈=83:17。
1.2.3 动物试验
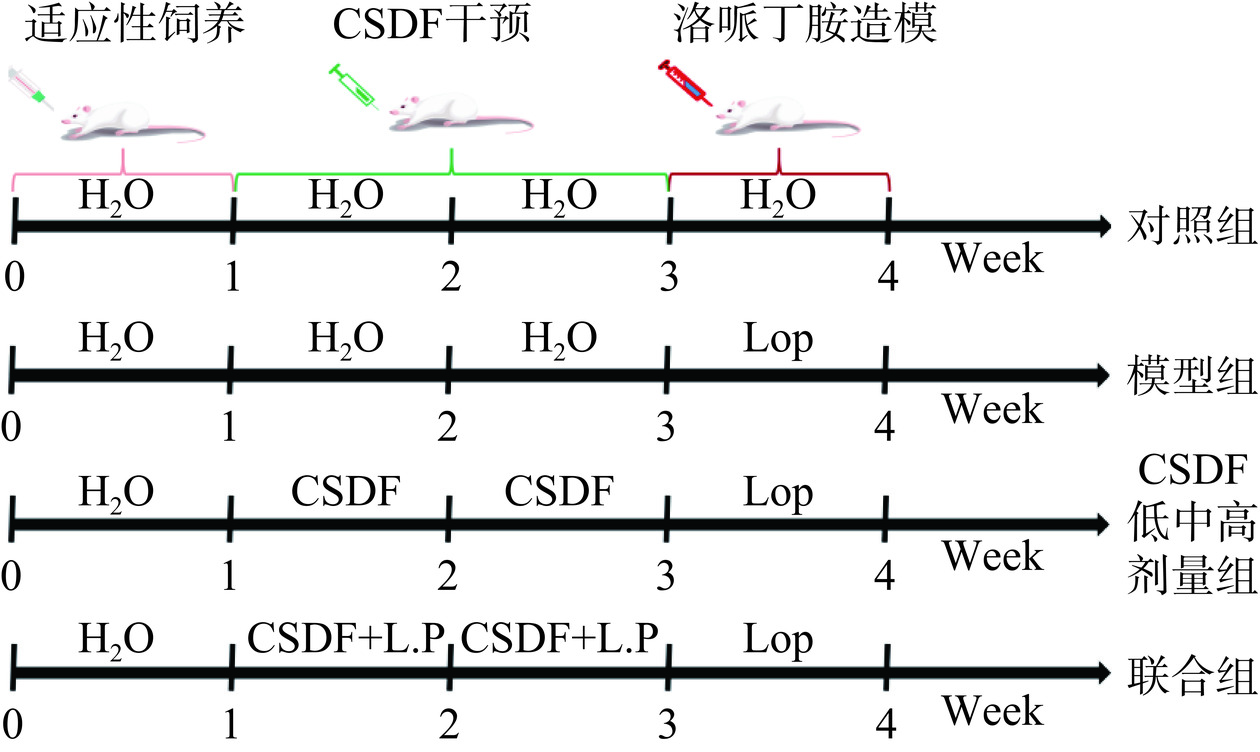
小鼠均饲养在黑龙江八一农垦大学生物技术中心,所有动物试验均获得黑龙江八一农垦大学动物伦理委员会批准(NO: Spxy 2023-018)。饲养室温度22~26 ℃,环境湿度60%~80%。试验动物每日饲喂标准维持饲料和无菌水,次日上午9点更换饲料与无菌水。小鼠试验流程示意图如图1所示。
小鼠适应性饲养7 d后,将小鼠随机分为6组,对照组(Normal, Nor),模型组(Loperamide, Lop),CSDF低、中、高剂量组(L-CSDF、M-CSDF、H-CSDF)和联合组(United, Uni)。其中,膳食纤维摄入量按照人体每日推荐摄入量30 g/d计算,低剂量组为1/2推荐摄入量,中剂量组为推荐摄入量,高剂量组为2倍推荐摄入量,联合组膳食纤维用量为推荐摄入量,小鼠灌胃量按照人体与小鼠表皮面积法按照1:12进行换算,并按照小鼠体重计算摄入量,每日灌胃0.5 mL,L-CSDF、M-CSDF和H-CSDF剂量分别为3、6和12 g·kg−1·d,CSDF和副干酪乳杆菌复配组中CSDF:副干酪乳杆菌=30:1(v:v),每组10只。干预14 d后,除Nor组外(给予等量无菌水),其余5组均灌胃洛哌丁胺0.2 mL (10 mg/kg),维持7 d造模。试验期间每周记录小鼠体重,观察小鼠体重变化规律。试验第29 d,各组小鼠禁食18 h,禁食期间自由饮水,进行以下试验。
1.2.4 小鼠排便试验
试验第29 d,每组随机选取3只小鼠,单独置于干净的笼子中,允许小鼠自由进食和饮水,6 h后收集粪便至无菌管中并称重,称重结束后,将粪便置于快速水分测定仪中测定小鼠粪便含水量。
油墨指示剂的制备:将50 g阿拉伯胶与400 mL蒸馏水煮沸至透明,加入25 g煮沸的活性炭粉,冷却。然后加入500 mL水,4 ℃保存,混合均匀后使用。为测定小鼠首次出现黑便的时间,每组3只小鼠空腹灌胃0.2 mL洛哌丁胺(10 mg/kg)。30 min后,所有小鼠灌胃0.2 mL墨水,所有小鼠被单独放置在干净的笼子中,可以自由获得水和食物。
在排便试验结束后,乙醚麻醉小鼠,脱颈处死,立即解剖,打开腹腔注射器收集血液并保存至离心管中,取幽门至盲肠为小鼠完整小肠段,生理盐水冲洗并去除结缔组织后并计量其长度,取小鼠盲肠将盲肠内容物取出保存至冻存管并−80 ℃保存,取小鼠结肠并去除其内容物,生理盐水冲洗后置于4%多聚甲醛中固定,室温保存。
根据小鼠首次黑便试验方法进行胃肠墨水推进试验,在末次给药后30 min灌胃墨水。解剖完整小肠,以幽门至墨迹末端的距离作为迁移距离。胃肠墨水推进率的计算公式如下:
胃肠墨汁推进率(%)=墨汁行近距离幽门到盲肠距离×100 1.2.5 结肠组织观察
4%多聚甲醛浸润结肠组织24 h,石蜡包埋,切成4 μm薄片。切片浸泡在二甲苯中脱蜡,置于乙醇中去除二甲苯,水化,苏木精和伊红染色,在显微镜下观察图像。
1.2.6 酶联反应吸附试验(ELISA)
小鼠腹腔取血,无菌管中保存,4 ℃下12000 r/min离心10 min,收集血清。血清MTL、VIP、SS、SP、5-HT和AchE水平采用酶联免疫吸附测定试剂盒测定。所有试验重复三次。
1.2.7 肠道菌群分析
使用FastDNA SPIN Kit从小鼠盲肠内容物中提取DNA。使用引物(B341F5′-CCTACGGGGNGGCWGCAG-3′和B785R 5′-GACTACHVGGGGTATCTAATCC-3′)扩增16S rDNA基因的V3~V4区。样品用AxyPrep DNA凝胶提取试剂盒纯化,并使用LightCycler® 96实时定量PCR仪进行定量。纯化的扩增子以等摩尔浓度汇集,并使用Illumino Novaseq 6000测序平台(开泰生物,杭州)进行测序(PE250)。使用 USEARCH 软件(7.0版本)对相似度≥97%的操作分类单元(OTUs)进行聚类。对相似度≥97%的操作分类单元(OTU)进行聚类,而微生物相关的QIIME(Ver.1.9.1)和R软件(Ver.3.5.0)对微生物群相关进行聚类。
1.2.8 短链脂肪酸(SCFAs)定量分析
采用气相色谱-质谱联用技术(GC-MS)定量测定小鼠盲肠中的短链脂肪酸。每个试验重复三次。
代谢物提取:取适量样本于1.5 mL离心管中,加500 μL水,加入100 mg玻璃珠,匀浆1 min,于4 ℃,12000 r/min离心10 min,取200 μL上清,加100 μL磷酸(15%),再加375 μg/mL的内标(4-甲基戊酸)溶液20 μL和乙醚280 μL匀浆1 min,于4 ℃,12000 r/min离心10 min,取上清上机测试。
色谱条件:Thermo Trace 1310(Thermo Fisher Scientific,美国)气相系统,色谱柱为Agilent HP-INNOWAX毛细管柱(30 m×0.25 mm,ID×0.25 μm);分流进样,进样量1 μL,分流比为10:1。进样口温度250 ℃;离子源温度300 ℃;传输线温度250 ℃。程序升温起始温度90 ℃;然后以10 ℃/min 升温至120 ℃;再以5 ℃/min升温至150 ℃;最后以25 ℃/min升温至250 ℃,维持2 min。载气为氦气,载气流速1.0 mL/min。
质谱条件:Thermo ISQ 7000质谱仪(Thermo Fisher Scientific,美国),电子轰击电离(EI)源,SIM扫描方式,电子能量70 eV。
1.3 数据处理
数据处理和统计分析采用IBM SPSS 26,数据分析采用单因素方差分析,采用Duncan检验,P<0.05表示差异显著;绘图工具为Origin 2023。每组重复三次试验。所有数据均以平均值±SD表示。
2. 结果与分析
2.1 CSDF单糖组成
膳食纤维的生理活性主要来自于其单糖的组成与连接,其不被小肠吸收但在结肠可选择性的被肠道微生物利用被降解为单糖从而经过各种途径产生短链脂肪酸[22]。CSDF单糖的组成由面积归一法计算,如图2所示,CSDF主要由甘露糖(1.64%)、核糖(0.30%)、鼠李糖(0.73%)、葡萄糖(14.72%)、葡萄糖醛酸(2.45%)、半乳糖(8.07%)、半乳糖醛酸(4.82%)、木糖(30.82%)、阿拉伯糖(36.03%)和岩藻糖(0.42%)组成,其中木糖和阿拉伯糖的比例较高,是CSDF的主要成分。
2.2 CSDF对便秘小鼠排便的影响
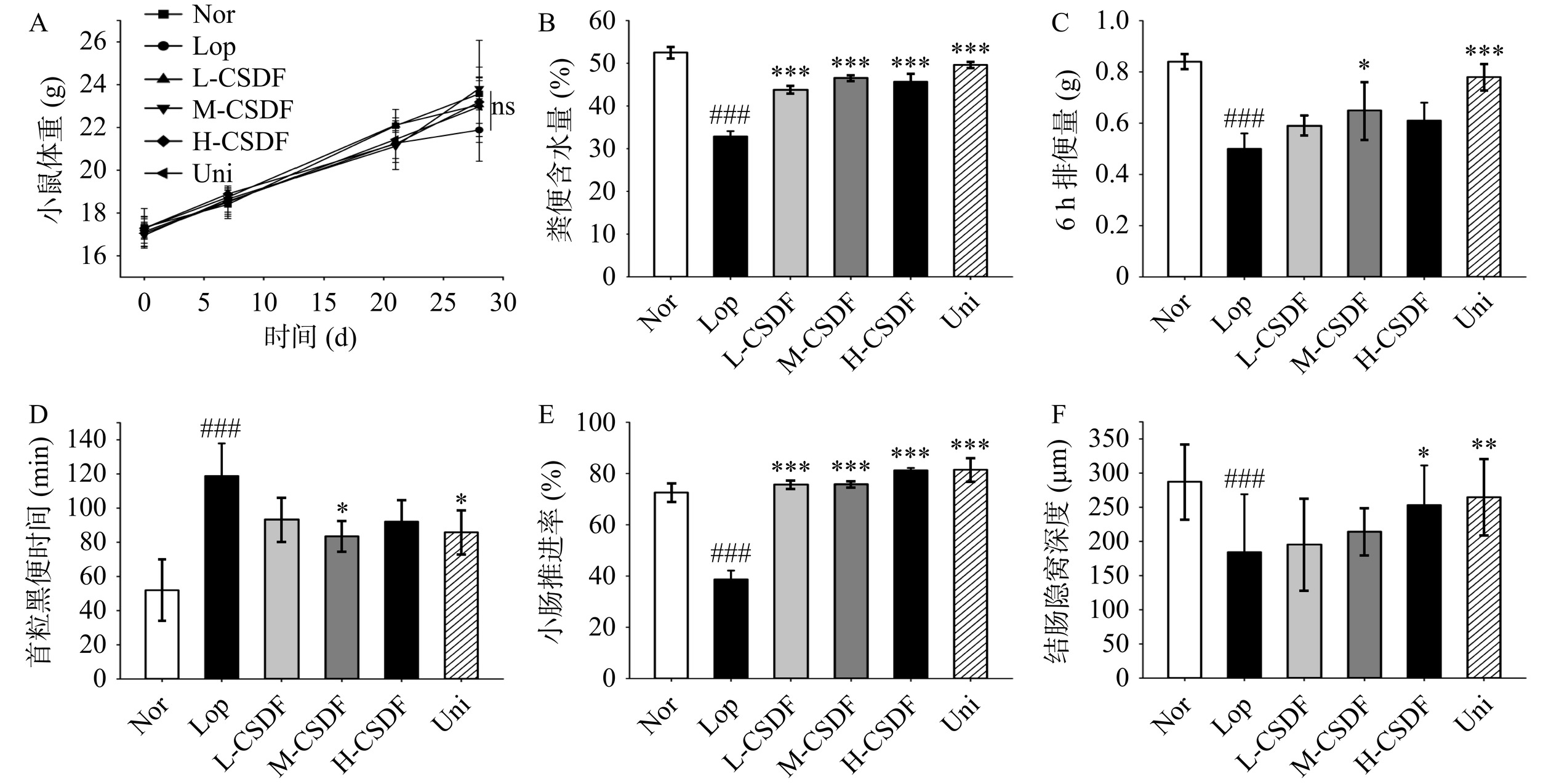
小鼠排便试验可直观的显示CSDF对小鼠排便困难、排便障碍的缓解作用,小鼠排便试验结果如图3所示。模型组小鼠排便量和粪便含水量与对照组相比显著降低(P<0.001),且第一次排便时间延长,说明便秘模型建立成功。与模型组相比,CSDF干预导致小鼠排便量得到不同程度的缓解且体重增加速率得到改善。此外,模型组小鼠小肠墨汁推进率显著低于对照组(P<0.001),而CSDF处理小鼠小肠墨汁推进率显著升高(P<0.001),排便试验显示Uni组对便秘小鼠排便频率及排便量的干预效果较好。
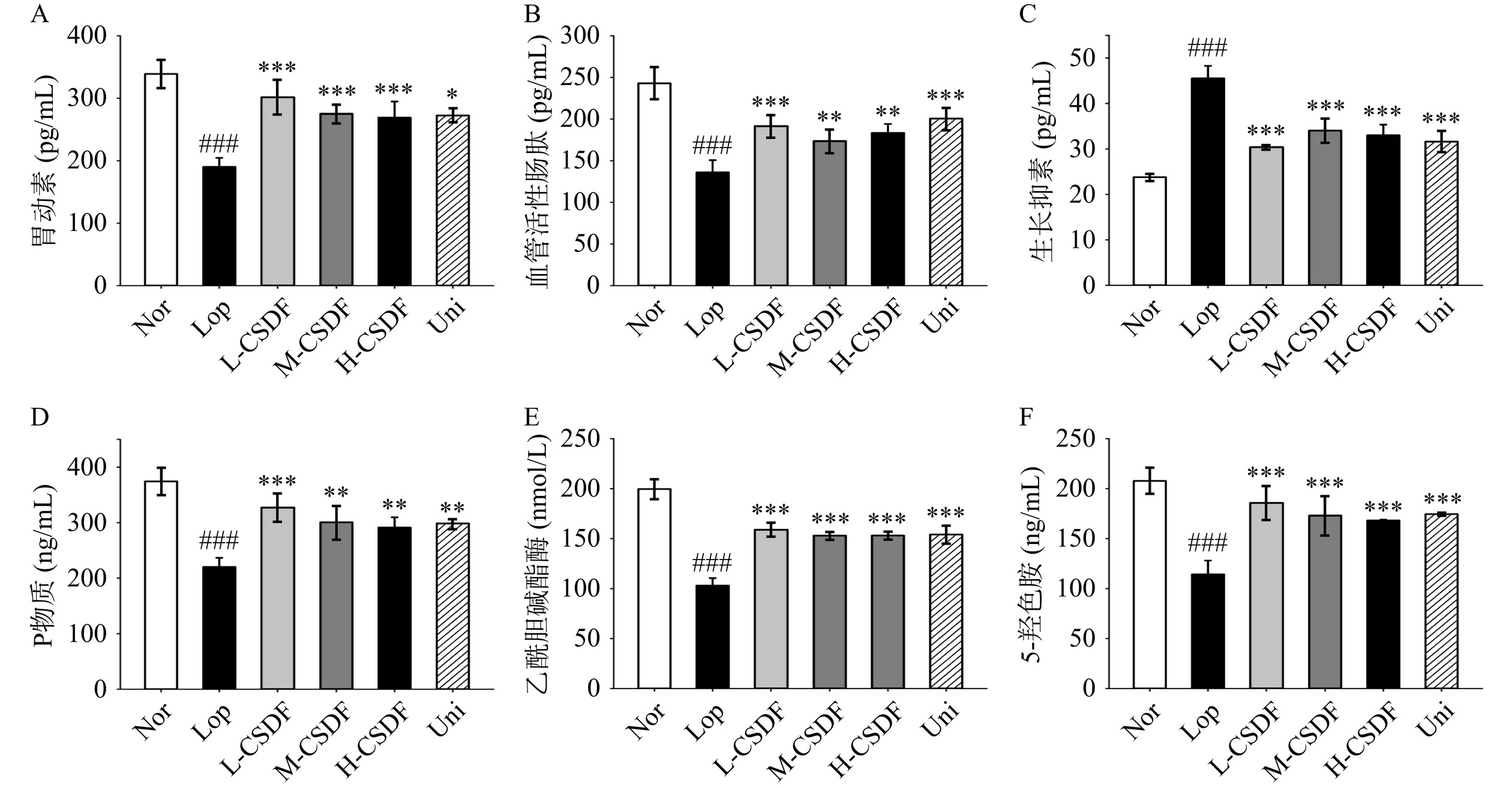
![]() 图 3 CSDF对便秘小鼠排便试验的影响注:(A) 小鼠体重变化;(B) 粪便含水量;(C) 6 h排便量;(D) 首粒黑便时间;(E) 肠墨推进率;(F) 结肠隐窝深度。#为Lop vs Nor两组比较,其中#P<0.05代表显著;##P<0.01代表高度显著;###P<0.001代表极显著;*为L-CSDF、M-CSDF、H-CSDF 和 Uni vs Lop,其中*P<0.05代表显著;**P<0.01代表高度显著;***P<0.001代表极显著。Figure 3. Effects of CSDF on defecation experiments in constipated mice
图 3 CSDF对便秘小鼠排便试验的影响注:(A) 小鼠体重变化;(B) 粪便含水量;(C) 6 h排便量;(D) 首粒黑便时间;(E) 肠墨推进率;(F) 结肠隐窝深度。#为Lop vs Nor两组比较,其中#P<0.05代表显著;##P<0.01代表高度显著;###P<0.001代表极显著;*为L-CSDF、M-CSDF、H-CSDF 和 Uni vs Lop,其中*P<0.05代表显著;**P<0.01代表高度显著;***P<0.001代表极显著。Figure 3. Effects of CSDF on defecation experiments in constipated mice2.3 CSDF对便秘小鼠结肠组织的影响
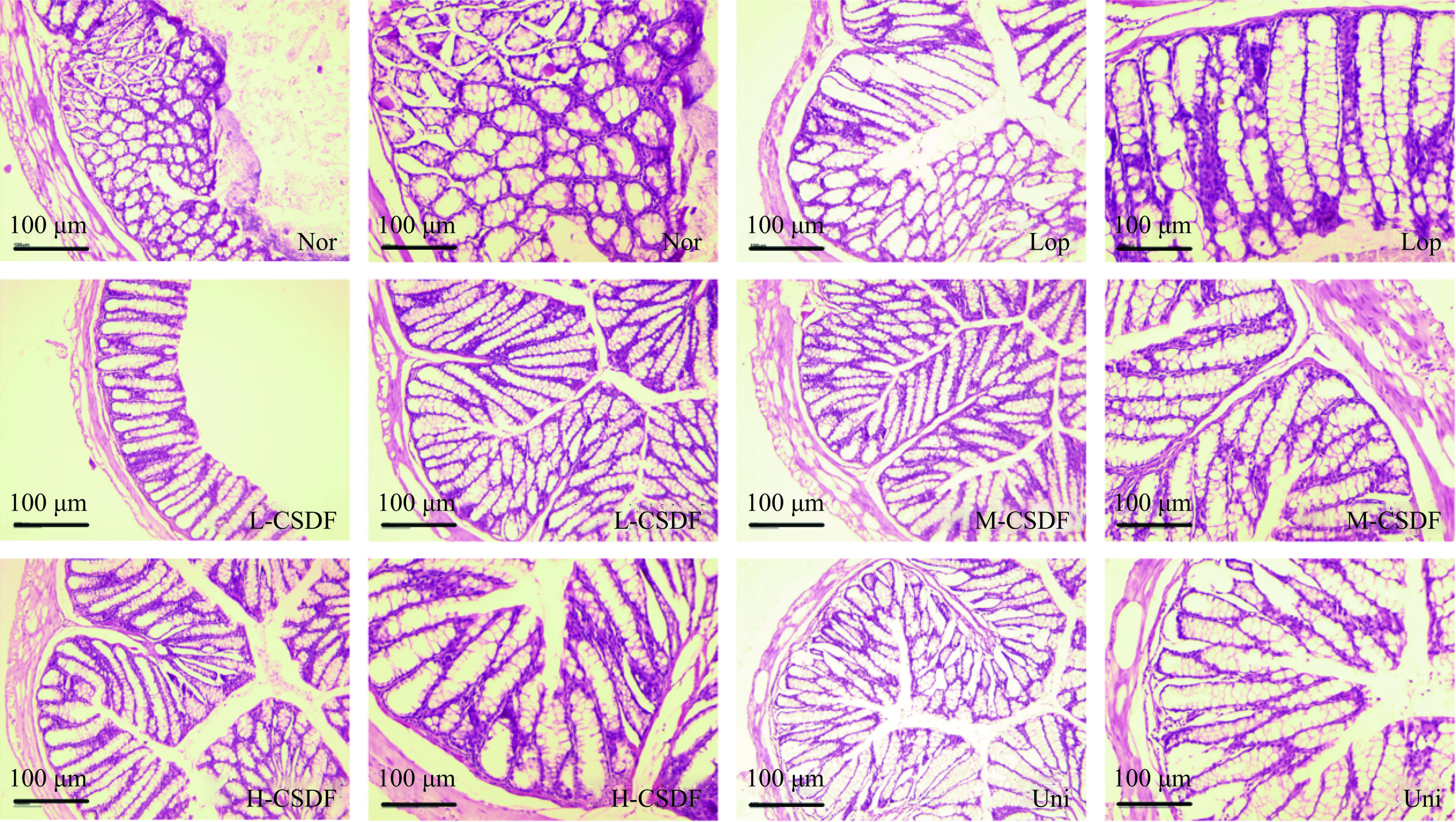
H&E染色观察小鼠结肠组织病变程度,如图4所示。各组结肠壁厚度不同,对照组结肠壁厚度饱满均匀,模型组结肠壁最薄且不完整。对照组结肠腺体丰富、密集、排列均匀,隐窝结构正常,无炎症细胞及炎性病变。模型组黏膜下结构部分可见炎性浸润,隐窝结构异常,大小不一,镜下腺体组织紊乱,部分被破坏。灌胃不同剂量CSDF后便秘小鼠结肠病变程度发生逆转,小鼠结肠肌层厚度、腺体排列趋于正常。隐窝深度如图3F所示。与模型组相比,Uni组隐窝深度明显增加,说明Uni组对便秘诱导的结肠病变有较好的缓解作用,且Uni组未见严重炎症反应,腺上皮细胞排列紧密,结肠切片形态正常。
结肠杯状细胞分泌黏液蛋白进入肠道,产生的黏液层形成肠道黏液屏障[23]。如图4所示,对照组单层柱状上皮内存在大量杯状细胞,排列致密,界限分明,形态饱满,粘液分泌丰富。与对照组相比,模型组的杯状细胞数量明显减少,粘液分泌减少,导致黏液层变薄,说明洛哌丁胺对结肠杯状细胞有一定程度的损伤,同时也破坏了抑制外源性致病菌的第一道防线,而CSDF处理缓解了这一现象。综上,Uni组对肠黏膜粘液分泌和杯状细胞数量均有显著影响,且炎症细胞数量较少,说明该合成元干预对缓解便秘引起的结肠炎症反应具有积极作用。
2.4 CSDF对胃肠道神经递质的影响
胃肠道相关神经递质的异常释放导致胃排空缓慢,肠平滑肌收缩功能障碍,胃肠道运输(水、电解质等)受损[24−25]。便秘相关的神经递质通常以兴奋性神经递质分泌减少和抑制性神经递质分泌增加为特征。SS是一种抑制激素释放调节肽,影响内分泌系统功能和肠道运动,便秘小鼠血清中SS浓度升高可作为便秘的生物标志[26]。MTL、SP、VIP和AchE与胃肠道运动有关,这些神经递质分泌减少导致胃肠道内容物运输受损和水盐流失[27]。如图5A所示,CSDF低、中、高剂量组血清MTL水平显著高于模型组(P<0.001)。图5B中L-CSDF组和Uni组血清VIP水平分别提高40.84%和47.50% (P<0.001),图5D中L-CSDF组血清SP水平较模型组提高48.61% (P<0.001)。与模型组相比,CSDF治疗后血清中5-HT和AchE释放量显著增加(图5E、图5F),血清SS含量显著降低(图5C),5-HT可通过激活肠运动反射和增加神经末梢乙酰胆碱的释放来刺激肠推进[28]。上述结果表明,CSDF可显著提高便秘小鼠血清内MTL、VIP、SP、5-HT、AchE质量浓度,降低SS浓度,提示CSDF可通过促进胃酸分泌,增强肠道蠕动提高胃肠道运动,还可以降低抑制性神经递质SS释放,减少其对胃肠道蠕动抑制作用,缩短肠传导时间。
2.5 CSDF对便秘小鼠肠道微生物的影响
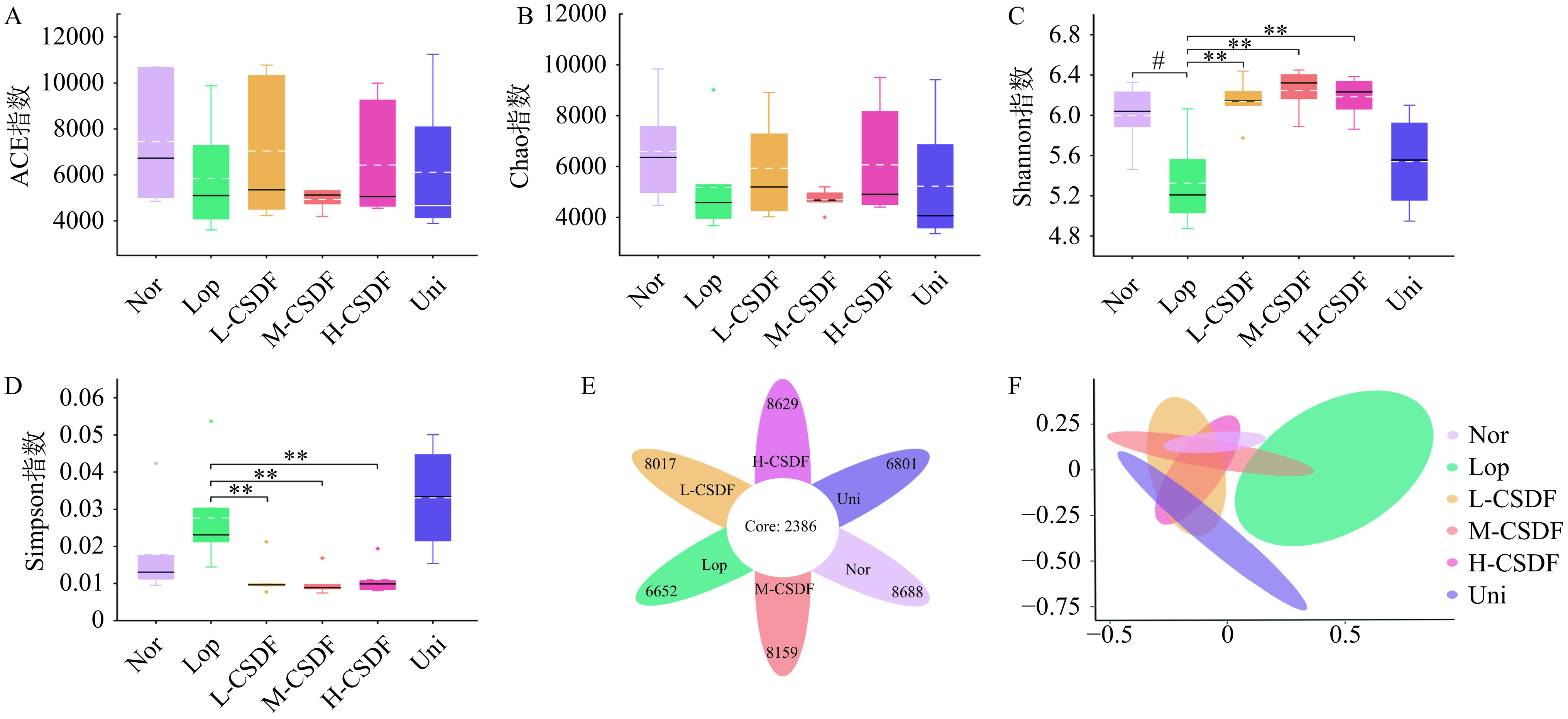
肠道菌群失衡在便秘的发生发展过程中不可忽视,肠道菌群可通过组织代谢、肠神经系统和免疫屏障系统刺激肠道黏液层分泌及发酵产生短链脂肪酸参与便秘的缓解作用[29]。通过取各组小鼠盲肠内容物进行16S rDNA测序,进一步观察便秘与肠道微生物的相关性。微生物群落多样性如图6所示。模型组的微生物丰度低于对照组(图6A、图6B),模型组的微生物群落多样性显著低于对照组(图6A、图6B) (P<0.05),经CSDF治疗后,与模型组相比,这一趋势得到逆转。如图6E所示,模型组与其他组相比,特有的OTUs数量最少,PCoA显示各组之间没有相交的置信区间(除M-CSDF),这表明各组之间的菌群结构不同,CSDF改变了组间的多样性。在门水平上,模型组厚壁菌门的丰度降低,拟杆菌门的比例增加,CSDF处理逆转了这一趋势。拟杆菌门的丰度较高,拟杆菌定植可以防御病原体的入侵,并可被同一病原体用作资源提供者[30],拟杆菌的异常衍生增加了后者的可能性。LEfSe分析表明,模型组中o_Enterobacteriales和f_Enterobacteriaceae是该组的优势目(科),两者均属于肠杆菌科。肠杆菌科作为一种有害肠道细菌,它们大量定植在肠道中导致肠道微生态环境受损。在排便前试验中发现模型组小鼠排出白色粘稠物质且腹部肿胀,说明模型组可能存在胃肠道炎症。科水平上,毛螺菌科(Lachnospiraceae)、Muribaculaceae和Ruminococcaceae占优势地位,其中模型组毛螺科菌的丰度降低。毛螺菌科是一种生产短链脂肪酸的细菌,其也可作为结肠调节性T细胞的诱导剂维持肠道免疫系统的稳定[31−32]。瘤胃球菌科(Ruminococcaceae)的比例降低表明便秘小鼠的消化系统出现了功能障碍[33]。肠道屏障损伤和肠易激综合征与阿克曼科(Ackermanniaceae)和普雷沃氏菌(Prevotella)呈正相关,两种细菌在模型组中丰度均显著高于对照组。选取相对丰度差异显著的30个属进行热图分析,结合释放神经递质水平与抑制结肠炎症结果分析,选择调节作用效果较好两组(L-CSDF、Uni)与模型组进行比较,图中显示干预前后特异性细菌丰度的变化情况。其中模型组的Parabacteroides、Alloprevotella、Bacteroidales_unclassified、Muribaculaceae_ge、Muribaculaceae_unclassified、Parasutterella、Bacteroides和Muribaculum的丰度显著上调。Ruminiclostridium_5、GCA-900066575、Lachnospiraceae_NK4A136_group、Ruminiclostridium_9、Alistipes、Ruminiclostridium等丰度显著降低。
线性分析结果如图7D所示。各组间OTU差异筛选结果表明,模型组在属水平上富集了Escherichia_Shigella、clostridiides、Clostridiumsensu_stricto_1和Klebsiella等。L-CSDF组检测到大量Ruminococcaceae_UCG_003和Ruminiclostridium_6等。M-CSDF、H-CSDF和Uni组中最丰富的属分别为Lachnospiraceae、GCA_900066225和Ruminococcaceae_UCG_014。在本研究中,CSDF在科水平上增加了几种有益菌(双歧杆菌科、乳杆菌科和毛螺菌科)的相对丰度(图7E)。其中双歧杆菌和乳酸菌可促进肠道蠕动,乳酸菌通过积累长链脂肪酸作用于结肠肌肉组织,增强肠道动力,毛螺菌科参与多种SCFAs(乙酸盐、丙酸盐和丁酸盐)的生物合成[34,13],毛螺菌科丰度的增加意味着SCFAs水平的上调。相比之下,模型组潜在致病菌丰度较高,如肠杆菌科(Enterobacteriaceae),埃希氏志贺氏菌(Escherichia_Shigella),消化链球菌科(Peptostreptococcaceae), 狭义梭菌属(Clostridium_sensu_stricto_1)和克雷伯氏菌属(Klebsiella),消化链球菌科和狭义梭菌属的大量定植是胃肠道感染的标志,可引发小鼠胃肠道炎症[35−36],经CSDF干预后,致病菌被抑制。模型组中发现富集大量Alloprevotella菌属,该菌属含有在黏液蛋白降解中起重要作用的酶,可能导致肠道通透性增加,此外该菌属丰富增加具有促炎效果,可能会加重小鼠结肠炎的发展。然而,在联合组属水平中,黏蛋白阿克曼氏菌属(Akkermansia)大量富集,该菌属是人体肠道重重要的共生菌属,依靠肠黏液层的黏蛋白生存,菌属定植结果与结肠病理中模型组与联合组结果相对应。综上,CSDF可通过重塑肠道菌群来缓解便秘症状,主要体现在双歧杆菌、乳杆菌和毛螺菌等有益菌富集,肠杆菌和肠球菌等致病菌丰度降低。此外,便秘小鼠服用日本糖精副产品膳食纤维后[37],在模型组中拟杆菌门丰度显著上升,在便秘小鼠体内发现Muribaculaceae_ge菌属解释了这一现象,该菌属隶属于拟杆菌门,本研究结果与之一致。
2.6 CSDF对便秘小鼠SCFAs的影响
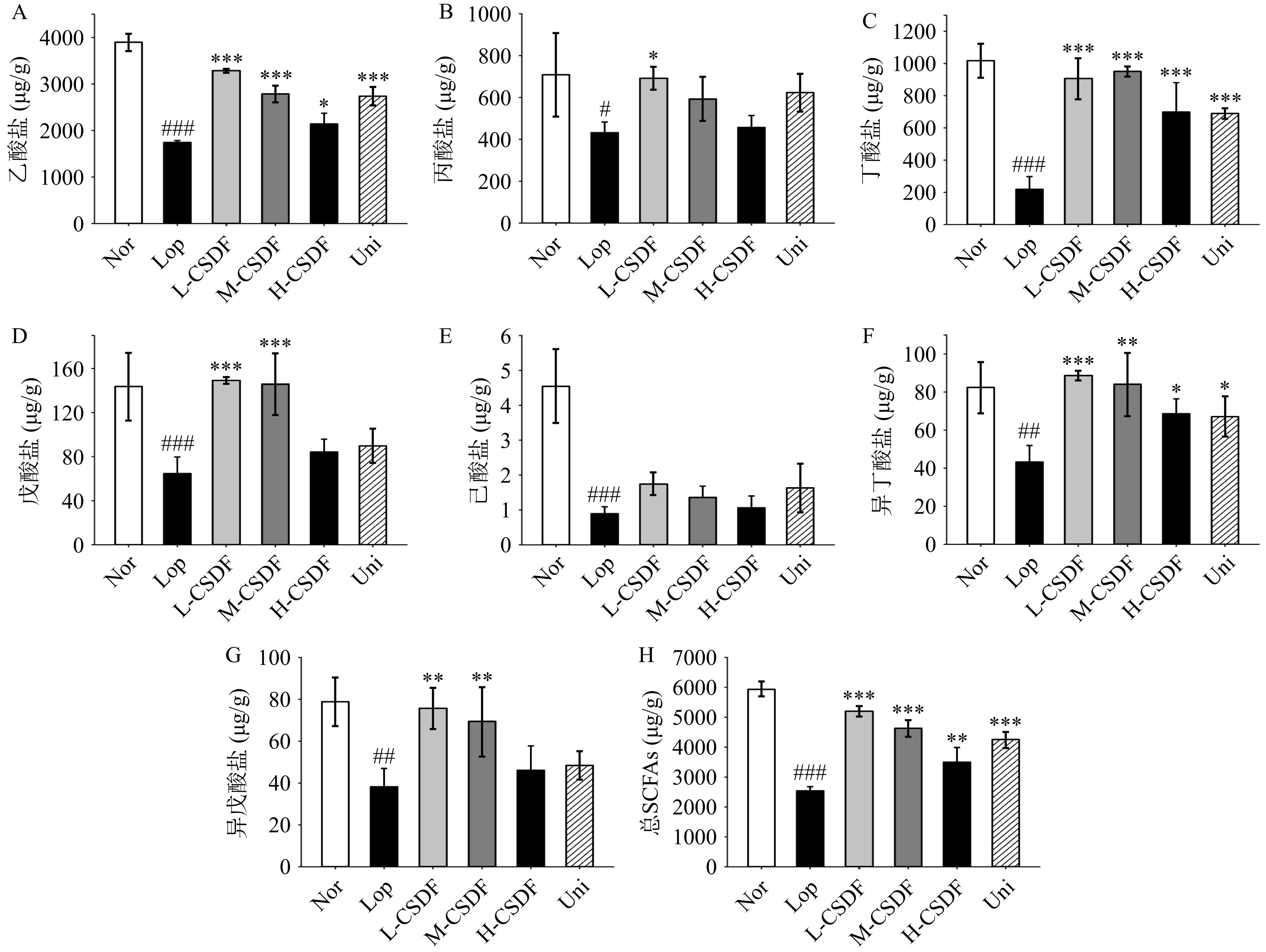
SCFAs作为肠道内膳食纤维发酵的主要产物被肠上皮细胞利用,促进屏障相关转录因子的稳定表达,从而增强肠道屏障功能[38]。此外,丁酸盐、丙酸盐和戊酸盐对结肠或远结肠期收缩有浓度依赖性[39]。收集小鼠盲肠内容物进行SCFAs定量分析,如图8所示。洛哌丁胺诱导便秘后,模型组SCFAs水平显著降低,CSDF治疗后,各干预组总SCFAs水平均显著升高(P<0.01),试验结果表明L-CSDF对SCFAs水平的调节效果较好。其中乙酸盐(Ace)、丁酸盐(But)、戊酸盐(Val)和异丁酸盐(Isobut)在L-CSDF干预后显著升高(P<0.001)。SCFAs在肠屏障保护、炎症反应发挥作用,SCFAs通过激活单磷酸腺苷(AMP)和腺苷酸活化蛋白激酶(AMPK)来上调紧密连接蛋白的表达,从而增强肠道屏障[40]。乙酸盐、丙酸盐和丁酸盐通过诱导5-HT浓度的增加而缩短结肠转运时间[41]。此外,丁酸盐是结肠黏膜的抗炎剂,能有效抑制肠道损伤[42]。SCFAs定量分析显示,L-CSDF组便秘小鼠的SCFAs水平显著升高(P<0.001)。肠道内的SCFAs依赖于一些厌氧细菌对底物的糖酵解,尤其是双歧杆菌和乳杆菌,同时,这些细菌在L-CSDF组中富集,这表明CSDF可通过调节肠道内SCFAs水平缓解便秘。然而,在肠道菌群分析中发现联合组中双歧杆菌科丰度较高,但该组毛螺菌科和乳杆菌科丰度较低,这影响了该组SCFAs的产生。此外,在膳食纤维与副干酪乳杆菌混合后发酵过程已经发生[43],这导致二者进入结肠后活菌数与纤维量的损失,宿主肠道菌群可利用膳食纤维减少影响了SCFAs的产生。值得一提的是,人体内95%的5-HT来自于肠道,本研究肠道5-HT水平与SCFAs水平呈对应关系,而小鼠肠道内5-HT的释放与SCFAs水平呈正相关[44],本研究结果与之一致。
![]() 图 8 SCFAs 含量注:(A) 乙酸盐 (Ace);(B) 丙酸盐 (Pro);(C) 丁酸盐 (But);(D) 戊酸盐 (Val);(E) 己酸盐 (Cap);(F) 异丁酸盐 (Isobut);(G) 异戊酸盐 (Isoval);(H) 总短链脂肪酸量。#为Lop vs Nor两组比较,其中#P<0.05代表显著;##P<0.01代表高度显著;###P<0.001代表极显著;*为L-CSDF、M-CSDF、H-CSDF 和 Uni vs Lop,其中*P<0.05代表显著;**P<0.01代表高度显著;***P<0.001代表极显著。Figure 8. Content of SCFAs
图 8 SCFAs 含量注:(A) 乙酸盐 (Ace);(B) 丙酸盐 (Pro);(C) 丁酸盐 (But);(D) 戊酸盐 (Val);(E) 己酸盐 (Cap);(F) 异丁酸盐 (Isobut);(G) 异戊酸盐 (Isoval);(H) 总短链脂肪酸量。#为Lop vs Nor两组比较,其中#P<0.05代表显著;##P<0.01代表高度显著;###P<0.001代表极显著;*为L-CSDF、M-CSDF、H-CSDF 和 Uni vs Lop,其中*P<0.05代表显著;**P<0.01代表高度显著;***P<0.001代表极显著。Figure 8. Content of SCFAs3. 结论
在排便试验中,联合组首粒黑便时间、排便量均显著提高,与模型组相比小肠推进率提升了110.58%,提示SDF联合益生菌对排便障碍具有较好的缓解作用。结肠病理观察各干预组均对便秘引起的结肠炎症有积极作用,其中联合组对抑制炎症细胞浸润效果较好。此外,联合组中益生菌对SDF的发酵使其进入结肠后被宿主微生物利用的膳食纤维及活菌数减少导致联合组中与代谢有关的神经递质与短链脂肪酸水平略低于同剂量组。菌群分析表明,L-CSDF组改善了便秘引起的肠道菌群失衡,双歧杆菌和乳杆菌等有益菌在该组大量富集。此外,联合组中嗜黏蛋白阿克曼氏菌增殖提示SDF与副干酪乳杆菌联合可修复肠道屏障。
本研究证实了CSDF对便秘小鼠的缓解作用,其作用体现在修复便秘对肠道屏障的损伤、调节胃肠神经递质水平、增强胃肠道运动性、重塑肠道菌群组成及其代谢物产物。结果表明低剂量的CSDF对肠道微生物的调节及重塑效果较好;而对于结肠炎症的缓解作用与益生菌联合要优于各干预组。后续试验可进一步通过炎症通路和蛋白表达探讨对便秘作用的机理,同时对膳食纤维联合益生菌的试验方案进行系统优化,为合成元在功能性研究中提供理论依据。
-
图 3 CSDF对便秘小鼠排便试验的影响
注:(A) 小鼠体重变化;(B) 粪便含水量;(C) 6 h排便量;(D) 首粒黑便时间;(E) 肠墨推进率;(F) 结肠隐窝深度。#为Lop vs Nor两组比较,其中#P<0.05代表显著;##P<0.01代表高度显著;###P<0.001代表极显著;*为L-CSDF、M-CSDF、H-CSDF 和 Uni vs Lop,其中*P<0.05代表显著;**P<0.01代表高度显著;***P<0.001代表极显著。
Figure 3. Effects of CSDF on defecation experiments in constipated mice
图 8 SCFAs 含量
注:(A) 乙酸盐 (Ace);(B) 丙酸盐 (Pro);(C) 丁酸盐 (But);(D) 戊酸盐 (Val);(E) 己酸盐 (Cap);(F) 异丁酸盐 (Isobut);(G) 异戊酸盐 (Isoval);(H) 总短链脂肪酸量。#为Lop vs Nor两组比较,其中#P<0.05代表显著;##P<0.01代表高度显著;###P<0.001代表极显著;*为L-CSDF、M-CSDF、H-CSDF 和 Uni vs Lop,其中*P<0.05代表显著;**P<0.01代表高度显著;***P<0.001代表极显著。
Figure 8. Content of SCFAs
-
[1] MUGIE S M, BENNINGA M A, LORENZO C D. Epidemiology of constipation in children and adults:A systematic review[J]. Best Practice & Research Clinical Gastroenterology,2011,25(1):3−18.
[2] AZIZ I, WHITEHEAD W E, PALSSON O S, et al. An approach to the diagnosis and management of Rome IV functional disorders of chronic constipation[J]. Expert Review of Gastroenterology & Hepatology,2020,14(1):39−46.
[3] CHIARELLI P, BROWN W, MCELDUFF P. Constipation in Australian women:prevalence and associated factors[J]. Int Urogynecol J,2000,11:71−78. doi: 10.1007/s001920050073
[4] KHALIF I L, QUIGLEY E M, KONOVITCH E A, et al. Alterations in the colonic flora and intestinal permeability and evidence of immune activation in chronic constipation[J]. Dig Liver Dis,2005,37:838−849. doi: 10.1016/j.dld.2005.06.008
[5] ZHANG X Y, YANG H B, ZHENG J P, et al. Chitosan oligosaccharides attenuate loperamide-induced constipation through regulation of gut microbiota in mice[J]. Carbohydrate Polymers, 2021, 253.
[6] PARTHASARATHY G, CHEN J, CHEN X, et al. Relationship between microbiota of the colonic mucosa vs feces and symptoms, colonic transit, and methane production in female patients with chronic constipation[J]. Gastroenterology, 2016,150(2):367−379.
[7] ZHANG S S, WANG R X, LI D Y, et al. Role of gut microbiota in functional constipation[J]. Gastroenterology Report,2021,9(5):392−401. doi: 10.1093/gastro/goab035
[8] BHARUCHA A E, LACY B E. Mechanisms, evaluation, and management of chronic constipation[J]. Gastroenterology,2020,158(5):1232−1249. doi: 10.1053/j.gastro.2019.12.034
[9] JOHANSON J F, KRALSTEIN J. Chronic constipation:a survey of the patient perspective[J]. Alimentary Pharmacology & Therapeutics,2007,25:599−608.
[10] LAI H, LI Y F, HE Y F, et al. Effects of dietary fibers or probiotics on functional constipation symptoms and roles of gut microbiota:a double-blinded randomized placebo trial[J]. Gut Microbes, 2023, 15(1).
[11] SONG X F, ZHONG L, LU N, et al. Inulin can alleviate metabolism disorders in ob/ob Mice by partially restoring leptin-related pathways mediated by gut microbiota, genomics[J]. Proteomics & Bioinformatics,2019,17(1):64−75.
[12] HANNAH D H, LAURA L B, VISHNUPRIYA G, et al. Agave inulin supplementation affects the fecal microbiota of healthy adults participating in a randomized, Double-Blind, Placebo-Controlled, crossover trial1, 2, 3[J]. The Journal of Nutrition,2015,145(9):2025−2032. doi: 10.3945/jn.115.217331
[13] LOUSI P, HOLD G, FLINT H. The gut microbiota, bacterial metabolites and colorectal cancer[J]. Nat Rev Microbiol,2014,12:661−672. doi: 10.1038/nrmicro3344
[14] LIU Y, TRAN D Q, RHOADS J M. Probiotics in disease prevention and treatment[J]. The Journal of Clinical Pharmacology,2018,58(10):164−179.
[15] YAMAMOTO Y, FURUKAWA S, MIYAKE T, et al. Severity of nocturia and constipation in patients with ulcerative colitis[J]. Urology,2023,18:119−123.
[16] MARTINEZ-MARTINEZ M I, CALABUIG-TOLSA R, CAULI O. The effect of probiotics as a treatment for constipation in elderly people:A systematic review[J]. Archives of Gerontology and Geriatrics,2017,71:142−149. doi: 10.1016/j.archger.2017.04.004
[17] YADAV M P, HICKS K B, JOHNSTON D B, et al. Production of bio-based fiber gums from the waste streams resulting from the commercial processing of corn bran and oat hulls[J]. Food Hydrocolloids,2016,53:125−133. doi: 10.1016/j.foodhyd.2015.02.017
[18] JIANG C X, WANG R, LIU X L, et al. Effect of particle size on physicochemical properties and in vitro hypoglycemic ability of insoluble dietary fiber from corn bran[J]. Front Nutr, 2022, 9.
[19] LI S, HU N N, ZHU J Y, et al. Influence of modification methods on physicochemical and structural properties of soluble dietary fiber from corn bran[J]. Food Chemistry:X, 2022, 14.
[20] DANG C, ZHAO K, XUN Y, et al. In vitro Intervention of Lactobacillus paracasei N1115 can alter fecal Microbiota and their SCFAs metabolism of pregnant women with constipation and diarrhea[J]. Curr Microbiol,2022,79:212. doi: 10.1007/s00284-022-02906-5
[21] CHEN C L, CHAO S H, PAN T. Lactobacillus paracasei subsp. Paracasei NTU 101 lyophilized powder improves loperamide-induced constipation in rats[J]. Heliyon, 6(4):e03804.
[22] 杨雪, 高亚男, 王加启, 等. 短链脂肪酸的功能研究进展[J]. 食品科学,2023,44(13):408−417. [YANG X, GAO Y N, WANG J Q, et al. Advances in functional studies of short-chain fatty acids[J]. Food Science,2023,44(13):408−417.] doi: 10.7506/spkx1002-6630-20220622-237 YANG X, GAO Y N, WANG J Q, et al. Advances in functional studies of short-chain fatty acids[J]. Food Science, 2023, 44(13): 408−417. doi: 10.7506/spkx1002-6630-20220622-237
[23] GUSTAFSSON J K, JOHANSSON M E V. The role of goblet cells and mucus in intestinal homeostasis[J]. Nat Rev Gastroenterol Hepatol,2020,19:785−803.
[24] WANG L L, HU L J, XU Q, et al. Bifidobacterium adolescentis Exerts strain-specific effects on constipation induced by Loperamide in BALB/c mice[J]. International Journal of Molecular Sciences,2017,18(2):318. doi: 10.3390/ijms18020318
[25] ARSLAN B, DOGAN G, ORENAY-BOYACIOGLU S, et al. Serotonin, ghrelin, and motilin gene/receptor/transporter polymorphisms in childhood functional constipation[J]. Revista Da Associação Médica Brasileira,2023,69(2):279−284.
[26] BORZSEI R, ZSIDO B Z, BALINT M, et al. Exploration of somatostatin binding mechanism to somatostatin receptor subtype 4[J]. International Journal of Molecular Sciences,2022,23(13):6878. doi: 10.3390/ijms23136878
[27] YEH K M, JOHANSSON O, LE H, et al. Cystic fibrosis transmembrane conductance regulator modulates enteric cholinergic activities and is abnormally expressed in the enteric ganglia of patients with slow transit constipation[J]. Journal of Gastroenterology,2019,54:994−1006. doi: 10.1007/s00535-019-01610-9
[28] BAI J Z, CAI Y J, HUANG Z Y, et al. Shouhui Tongbian Capsule ameliorates constipation via gut microbiota-5-HT-intestinal motility axis[J]. Biomedicine & Pharmacotherapy, 2022, 154.
[29] 马志发, 韩云蕾, 孙敬平. 老年性功能性便秘与肠道菌群及代谢产物的关系[J]. 成都医学院学报,2024,19(1):182−186. [MA Z F, HAN Y L, SUN J P. Relationship between senile functional constipation and intestinal flora and metabolites[J]. Journal of Chengdu Medical College,2024,19(1):182−186.] doi: 10.3969/j.issn.1674-2257.2024.01.036 MA Z F, HAN Y L, SUN J P. Relationship between senile functional constipation and intestinal flora and metabolites[J]. Journal of Chengdu Medical College, 2024, 19(1): 182−186. doi: 10.3969/j.issn.1674-2257.2024.01.036
[30] BORNET E, WESTERMANN A. The ambivalent role of Bacteroides in enteric infections[J]. Trends in Microbiology,2021,30(2):104−408.
[31] NEYRINCK A M, RODRIGUEZ J, TAMINIAU B, et al. Constipation mitigation by Rhubarb extract in middle-aged adults is linked to gut microbiome modulation:a double-blind randomized placebo-controlled Trial[J]. International Journal of Molecular Sciences,2022,23:14685. doi: 10.3390/ijms232314685
[32] ATARASHI K, YANOUE T, SHIMA T, et al. Induction of colonic regulatory T cells by indigenousClostridium species[J]. Science,2011,331:337−341. doi: 10.1126/science.1198469
[33] CHUA H H, CHOU H C, TUNG Y, L et al. Intestinal dysbiosis featuring abundance of ruminococcus gnavus associates with allergic diseases in Infants[J]. Gastroenterology,2018,154(1):154−167. doi: 10.1053/j.gastro.2017.09.006
[34] ZHAO L, HUANG Y F, LU L, et al. Saturated long-chain fatty acid-producing bacteria contribute to enhanced colonic motility in rats[J]. Microbiome,2018,6(1):107. doi: 10.1186/s40168-018-0492-6
[35] FUKUI A, TAKAGI T, NAITO Y, et al. Higher levels of streptococcus in upper gastrointestinal mucosa associated with symptoms in patients with functional dyspepsia[J]. Digestion,2020,101(1):38−45. doi: 10.1159/000504090
[36] SANDHU B K, MCBRIDE S M. Clostridioides difficile[J]. Trends in Microbiology,2018,26(12):1049−1050. doi: 10.1016/j.tim.2018.09.004
[37] CAO J H, WANG K, LI N X, et al. Soluble dietary fiber and cellulose from Saccharina japonica by-product ameliorate Loperamide-induced constipation via modulating enteric neurotransmitters, short-chain fatty acids and gut microbiota[J]. International Journal of Biological Macromolecules,2023,226:1319−1331. doi: 10.1016/j.ijbiomac.2022.11.243
[38] KELLY C, ZHENG L, COLGAN S, et al. Crosstalk between microbiota-derived short-chain fatty acids and intestinal epithelial hif augments tissue barrier function[J]. Cell Host Microbe,2015,17(5):662−671. doi: 10.1016/j.chom.2015.03.005
[39] YAJIMA T. Contractile effect of short-chain fatty-acids on the isolated colon of the rat[J]. J Physiol,1985,368(1):67−78.
[40] D’SOUZA W N, DOUANGPANYA J, MU S, et al. Differing roles for short chain fatty acids and GPR43 agonism in the regulation of intestinal barrier function and immune responses[J]. PLoS One, 2017, 12(7).
[41] FUKUMOTO S, TATEWAKI M, YAMADA T, et al. Short-chain fatty acids stimulate colonic transit via intraluminal 5-HT release in rats[J]. Am J Physiol Regul Integr Comp Physiol,2003,284(5):1269−1276. doi: 10.1152/ajpregu.00442.2002
[42] FERREIRA T M, LEONEL A J, MELO M A, et al. Oral supplementation of butyrate reduces mucositis and intestinal permeability associated with 5-fluorouracil administration[J]. Lipids,2012,47(7):669−678. doi: 10.1007/s11745-012-3680-3
[43] 李雅丽, 王默涵, 赵雯, 等. 益生菌与益生元组合的筛选及体外发酵特性研究[J]. 食品与发酵工业,2022,48(7):50−57. [LI Y L, WANG M H, ZHAO W, et al. Screening and in vitro fermentation characterization of probiotic and prebiotic combinations[J]. Food and Fermentation Industry,2022,48(7):50−57.] LI Y L, WANG M H, ZHAO W, et al. Screening and in vitro fermentation characterization of probiotic and prebiotic combinations[J]. Food and Fermentation Industry, 2022, 48(7): 50−57.
[44] 李勇骑, 王晓雯, 唐诚馨, 等. 基于肠道菌群探讨短链脂肪酸与功能性便秘的相关性[J]. 中国肛肠病杂志,2024,44(2):70−74. [LI Q Y, WANG X W, TANG C X, et al. Exploring the correlation between short-chain fatty acids and functional constipation based on intestinal flora[J]. Chinese Journal of Anorectal Diseases,2024,44(2):70−74.] doi: 10.3969/j.issn.1000-1174.2024.02.023 LI Q Y, WANG X W, TANG C X, et al. Exploring the correlation between short-chain fatty acids and functional constipation based on intestinal flora[J]. Chinese Journal of Anorectal Diseases, 2024, 44(2): 70−74. doi: 10.3969/j.issn.1000-1174.2024.02.023
-
期刊类型引用(4)
1. 杨春华,袁文侠,张世浩,何俊杰,李蕾,刘晓慧,黄玮,王白娟. 景迈山7个村寨古树茶的品质特征. 云南农业大学学报(自然科学). 2024(01): 111-119 .  百度学术
百度学术
2. 胡海敏,田佳乐,孙思霖,聂佳莹,何彬彬,丹彤. 固相微萃取-气相色谱-质谱结合电子鼻技术分析发酵乳中挥发性风味物质. 微生物学通报. 2023(01): 273-288 .  百度学术
百度学术
3. 刘格格,毕金峰,苟敏,吕健,吴昕烨,陈芹芹. 基于GC-MS及电子鼻技术结合化学计量法表征8种白桃关键香气的差异. 食品科学. 2023(18): 277-285 .  百度学术
百度学术
4. 黄奕洲,陈雪凤,赵承刚,吴圣进,张雯龙,刘增亮. 基于电子鼻的香菇杂交后代香味品质分析. 中国食用菌. 2023(05): 62-69 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:

 下载:
下载:
