Process Optimization and Application of Lipase Immobilized on Phenol Amino Modified MCM-41
-
摘要: 为构建新型固定化脂肪酶催化体系并提高脂肪酶的稳定性,利用酚氨基改性有序介孔材料有序介孔分子筛(MCM-41)进行脂肪酶的固定化研究,并将固定化酶应用于实际反应体系。结果表明,固定化酶的最优工艺条件为:固定化温度30 ℃,固定化pH8.0,固定化时间7 h,初始酶浓度4 mg/mL,此时材料的载酶量为26.40 mg/g。固定化酶的最佳反应温度为50 ℃,最佳反应pH为7.0,酶活力最高可达4108±34.74 U/g载体。固定化酶重复使用8次后,保留了54.70%的初始酶活,在4 ℃条件下储藏30 d后仍具有71.10%的初始酶活。将固定化酶用于催化月桂酸己酯的合成,月桂酸转化率最高可达65.38%。酚氨基改性MCM-41固定化脂肪酶具有较高的酶活力和良好的稳定性,将其应用于实际催化反应中,具有较高的催化效率。进一步证明酚氨基改性是一种绿色、有效的改性策略,为酚氨基涂层的进一步应用提供了思路。Abstract: In order to construct a new catalytic system of immobilized lipase and improve the stability of enzyme, the phenol amino modified ordered mesoporous material (MCM-41) was introduced for the study of lipase immobilization. The immobilized enzyme was also applied to the actual reaction system. The optimized conditions of lipase immobilization were as follows: Immobilization temperature of 30 ℃, immobilization pH of 8.0, immobilization time of 7 h, initial enzyme concentration of 4 mg/mL, and the enzyme loading was 26.40 mg/g. Meanwhile, the optimum reaction temperature of the immobilized enzyme was 50 ℃, and the optimum reaction pH was 7.0, together with the highest enzyme activity was 4108±34.74 U/g carrier. The immobilized enzyme was recycled for eight times, and it retained 54.70% of the initial enzyme activity. While after 30 days of storage at 4 ℃, it still kept 71.10% of the initial enzyme activity. In addition, the immobilized enzyme was used to catalyze the synthesis of hexyl laurate, and the highest conversion of lauric acid was 65.38%. It was indicated that the lipase immobilized on phenol amino modified MCM-41 exhibited high enzyme activity and good stability. When it was applied in the actual catalytic reaction, the immobilized enzyme displayed high catalytic efficiency. Furthermore, it was proved that phenol amino modification was a green and effective modification strategy, which could provide ideas for further application of phenol amino coating.
-
脂肪酶是一种重要的工业酶,其中来源于微生物的脂肪酶种类丰富、有机耐受性高,且可以通过对微生物进行分子改造,从而生产适合在不同反应体系中催化的脂肪酶[1−4]。由于其特殊的“盖子结构”和“界面活化机制”,能够在不同的体系中催化酯合成、酯交换等反应[5]。同时,脂肪酶还具有高度的底物选择性和催化能力[6],使其在生物柴油[7]、手性药物拆分[8]、食品添加剂[9]、保健品[10]、芳香酯[11]、洗涤剂[12]的生产等领域得到广泛应用。脂肪酶催化合成月桂酸酯是重要的工业应用之一[13−16]。与传统化学方法相比,用脂肪酶催化月桂酸和己醇合成月桂酸酯,不仅能够缩短反应时间,还能避免污染,简化产物提纯工艺。但是游离脂肪酶容易失活,且难以从反应体系中进行分离,生产成本较高,导致游离脂肪酶在月桂酸己酯的生产中受到限制[17]。
固定化酶技术能够很好地解决上述问题[18],利用共价结合法进行酶的固定化,还能进一步增加酶的立体特异性,提高酶的稳定性,更利于生产纯度高的产品[19]。近几年,贻贝仿生技术利用多巴胺(DA)在弱碱环境下进行氧化自聚,形成具有良好粘性的聚多巴胺(PDA)涂层,其上的醌基可作为酶的固定化位点,具有绿色环保的优点[20−22]。由于DA的价格较高,因此价格相对便宜且氧化后同样具有醌基的单宁酸(Tanic acid,TA)成为了DA的替代品[23]。TA是一种可水解单宁,也是一种水溶性多酚大分子,其含有的邻苯二酚及邻苯三酚基团可以与载体相互作用从而实现材料的改性。在碱性条件下,TA通过氧化自组装形成聚单宁酸涂层并生成醌基,为酶的共价固定提供结合位点,进一步可通过迈克尔加成和(或)希夫碱反应来实现对酶的固定化[24]。而3-氨丙基三乙氧基硅烷(APTES)水解后可以生成氨基,因此常用于硅基载体的氨基改性,从而提高固定化酶的载酶量和酶活[25−26]。TA与APTES共同修饰基材可以加快TA的氧化自聚,形成更加稳定的涂层。目前,由于酚氨基涂层良好的水油分离特性,已被应用于生物柴油[24]和污水处理[27]中,显示出了TA-APTES涂层良好的稳定性和普适性,而将TA/APTES涂层应用于固定化酶中的研究鲜有报道,具有较强的研究意义。
除了固定化方式外,载体本身也是固定化酶实现高催化活性的关键。介孔二氧化硅纳米材料由于具有较大的比表面积、良好的机械性能和稳定性而得到大规模应用[28]。其中,有序介孔分子筛(MCM-41)具有明显的六边形结构,且孔道均匀、孔径可控(3~5 nm),有利于底物与产物自由进出。同时,其表面存在的末端硅烷醇基团可以与酶分子之间形成氢键,因此是固定化酶的良好载体[29]。本研究采用TA与APTES共沉积于MCM-41的表面,并用于固定化脂肪酶,探究酶的固定化条件、稳定性及重复利用性,进一步将固定化脂肪酶应用于催化月桂酸和己醇合成月桂酸己酯,为工业化酶催化法高效生产月桂酸己酯提供参考。
1. 材料与方法
1.1 材料与仪器
脂肪酶(105 U/g,来源于黑曲霉)、单宁酸(98%)、棕榈酸对硝基苯酯 分析纯,上海麦克林生化科技股份有限公司;3-氨丙基三乙氧基硅烷(98%)、月桂酸(98%) 上海阿拉丁试剂有限公司;MCM-41 南京先锋纳米科技公司;Tris-base 北京索莱宝科技有限公司;盐酸(98%)、氢氧化钠、氢氧化钾 分析纯,天津市科密欧化学试剂有限公司;乙醇(99%) 天津市富宇精细化工有限公司;正己醇 分析纯,天津市大茂化学试剂厂。
SpectraMax Plus384酶标仪 上海仪电科学仪器股份有限公司;JSM 7800F型热场发射扫描电子显微镜 日本电子株式会社;能量色散X-射线光谱仪X-Max 50 英国牛津仪器公司;Spectrum 10傅里叶变换红外光谱仪 铂金埃尔默仪器有限公司;BSD-660S|BSD-660M全自动高通量高性能比表面积及孔径分析仪 贝士德仪器科技(北京)有限公司。
1.2 实验方法
1.2.1 TA/APTES修饰MCM-41的制备及条件优化
将适量TA加入到Tris-HCl缓冲溶液(0.05 mol/L,pH8.5)中,制备质量浓度为2 g/L的溶液。然后将APTES溶于无水乙醇中制备质量浓度为10 g/L的溶液。将TA溶液和APTES溶液以2:1的体积比混合,再加入0.5 g的MCM-41,超声处理10 min,使其均匀分散,然后置于磁力搅拌器上,室温条件下200 r/min共沉积18 h。反应结束后,将得到的固体物质用去离子水和乙醇交替洗涤3次,置于60 ℃的真空干燥箱中进行干燥,得到的材料记为MCM-41-TA/APTES。在TA和APTES溶液体积比为2:1条件下,研究不同共沉积时间(6、12、18、24 h)合成的载体对固定化酶酶活的影响。确定最佳共沉积时间后,研究TA与APTES溶液不同体积比(4:1、3:1、2:1、1:1、1:2、1:3)合成的载体对固定化酶酶活的影响。
1.2.2 MCM-41和MCM-41-TA/APTES的表征
1.2.2.1 扫描电子显微镜及能谱
取适量MCM-41及在最优制备条件下制备的MCM-41-TA/APTES样品,黏附在样品台上,对其进行喷金处理,电压为5 kV,观察其形貌特征[30]。使用能量色散X-射线光谱仪X-Max 50进行能谱扫描。
1.2.2.2 红外光谱
用KBr制片法对MCM-41及最优制备条件下制备的MCM-41-TA/APTES进行制样,并置于红外光谱仪器中,在4000~400 cm−1范围内进行扫描并得到数据及光谱图像[31]。
1.2.2.3 N2吸附/解吸
用BSD-660S|BSD-660M全自动高通量分析仪,采取静态容量法在低温条件下进行N2吸附,在80 ℃下脱气3 h,用Brunauer-Emmet-Teller(BET)法,由分析仪获得MCM-41及最优制备条件下制备的MCM-41-TA/APTES的比表面积[31]。
1.2.3 MCM-41-TA/APTES固定化脂肪酶的制备及优化
准备2份5 mL的PBS缓冲溶液(0.02 mol/L,pH7.0),将0.2 g MCM-41-TA/APTES均匀分散于其中一份溶液中,再将10 mg脂肪酶溶解于另一份溶液中,使得脂肪酶浓度为2 mg/mL。将这两份溶液混合(脂肪酶的终浓度为1 mg/mL),在30 ℃进行固定化5 h。然后用去离子水洗涤3次,于40 ℃条件下进行干燥,并将得到的固定化酶放于4 ℃冰箱中冷藏。在初始条件的基础下,依次改变固定化时间(3、4、5、6、7、8 h),固定化温度(20、25、30、35、40 ℃),固定化pH(6.0、6.5、7.0、7.5、8.0、8.5、9.0),初始酶浓度(1、2、3、4、5 mg/mL),分别以上述实验条件中的最高酶活为100%计算相对酶活,探究酶活变化。
1.2.4 酶水解活性的测定
利用改良的棕榈酸对硝基苯酯(p-NPP,5.0 mg/mL)的方法对脂肪酶的水解活性进行测定。将0.02 g固定化酶(或200 μL的游离酶)均匀分散于3 mL的Tris-HCl缓冲液(0.01 mol/L,pH7.0)中,置于37 ℃水浴10 min,反应结束后进行离心处理,取上清液稀释相应倍数后,使用酶标仪测定其在410 nm处的吸光值。根据罗旭聪[32]的酶活测定方法计算脂肪酶酶活。
酶活力(U)定义为:单位时间(1 min)内释放1 nmol的产物所需的酶量,定义为1 U。
固定化酶酶活(U/g载体)定义为:单位时间(1 min)内,在单位载体(1 g)上,释放单位产物(1 nmol)所需的酶量。
1.2.5 固定化酶的载酶量的计算
用Bradford法[33]测定固定化前酶液中的蛋白浓度以及固定化结束后离心得到的上清液的蛋白浓度,标准曲线公式为:y=0.2767x+0.2527,R2=0.9999。根据公式(1)计算固定化酶的载酶量(mg/g载体)。
载酶量=(固定化前酶液的蛋白浓度(mg/mL)−固定化后上清液的蛋白浓度(mg/mL))×溶液体积(mL)载体质量(g) (1) 1.2.6 固定化酶的稳定性研究
1.2.6.1 最佳反应温度及温度稳定性
先将游离酶与固定化酶置于不同温度的Tris-HCl缓冲液中(pH7.0,0.005 mol/L)进行反应,确定其最佳反应温度。分别以游离酶和固定化酶在最佳反应温度下的酶活为100%,探究不同温度条件下的酶活变化规律。再将游离酶与固定化酶置于Tris-HCl缓冲液(pH7.0,0.005 mol/L)中,放入不同温度下保存2 h后,以两者在最佳反应温度下的酶活为100%,探究其温度稳定性。
1.2.6.2 最佳反应pH及pH稳定性
将游离酶与固定化酶放入不同pH Tris-HCl缓冲液中(0.005 mol/L),在最佳反应温度下测定酶活力,以两者在最佳反应温度和最佳反应pH下的酶活为100%,探究不同pH条件下的酶活变化规律。再将两者分别置于不同pH下的Tris-HCl缓冲液(0.005 mol/L)中,于4 ℃下保存2 h后,以两者在最佳反应pH下的酶活为100%,探究其pH稳定性。
1.2.6.3 动力学研究
将游离酶与固定化酶置于最佳反应条件体系中,配制不同浓度(0.5、1.0、2.0、5.0、7.5、10、15 mg/mL)的p-NPP溶液作为底物,分别加入200 μL的底物反应10 min,测定酶活力,根据Lineweaver-Burk方程计算最大反应速度(Vmax)及表观米氏常数(Km),确定催化系数(Kcat)。
1.2.6.4 固定化酶的重复利用性
将0.02 g固定化酶投入3 mL的Tris-HCl缓冲液中(0.005 mol/L),加入200 μL,5 mg/mL的p-NPP溶液,于最适反应条件下进行循环反应,每次反应时间为10 min,循环结束后用去离子水洗涤3次,在6000 r/min条件下离心后再投入下一次循环。以固定化酶重复使用第一次的酶活力为100%,探究循环过程中酶活的变化。
1.2.6.5 储藏稳定性
将固定化酶与游离酶溶液(质量浓度为2 mg/mL)分别置于4 ℃冰箱中保存30 d,每5 d测一次酶活,以储存第0 d的酶活力为100%,计算出不同储存时间的相对酶活。
1.2.7 固定化酶在催化合成月桂酸己酯中的应用
在50 mL锥形瓶中加入月桂酸、己醇(总质量共8 g,酸醇摩尔比为1:3),在60 ℃恒温条件下预热15 min后加入质量分数为3%的固定化酶,分别反应不同时间(12、15、18、21、24 h),以确定最佳反应时间。确定反应时间后,分别改变月桂酸与己醇的摩尔比(1:1、1:2、1:3、1:4、1:5),探究转化率的变化。在最佳反应时间和最佳酸醇摩尔比后,改变反应温度(50、55、60、65、70、75 ℃),探究转化率的变化。在其他最佳条件确定后,改变添加固定化酶的量(质量分数分别为3%、4%、5%、6%、7%),研究转化率的变化。
1.2.8 月桂酸转化率的测定
根据文献[17],月桂酸与己醇的反应如下:
CH2(CH5)OH+CH3(CH2)10COOH⇋CH3(CH2)5COO(CH2)10CH3+H2O
由于反应体系中的酸值只由月桂酸提供,月桂酸具有弱酸性,羧基能够部分解离,随着反应的进行,越来越多的月桂酸与己醇反应合成月桂酸己酯,使反应体系总酸度不断降低,因此可以利用酸值在反应前后的差值来判断反应进程[34]。根据标准[35]利用热乙醇滴定法,分别测定反应前后月桂酸的量,按照公式(2)计算月桂酸的转化率。
\mathrm{月}\mathrm{桂}\mathrm{酸}\mathrm{转}\mathrm{化}\mathrm{率}(\text{%})=\left(1-\frac{{\mathrm{A}}_{1}}{{\mathrm{A}}_{0}}\right)\times 100 (2) 式中,A0为反应前体系中混合物中酸值,A1为反应后反应混合物中酸值。
1.3 数据处理
每组实验设置三组平行,利用Origin 8.0软件进行数据分析,测定结果以平均值±标准差表示,使用SPSS 25.0进行差异显著性分析。
2. 结果与分析
2.1 固定化载体的制备及工艺优化
2.1.1 共沉积时间
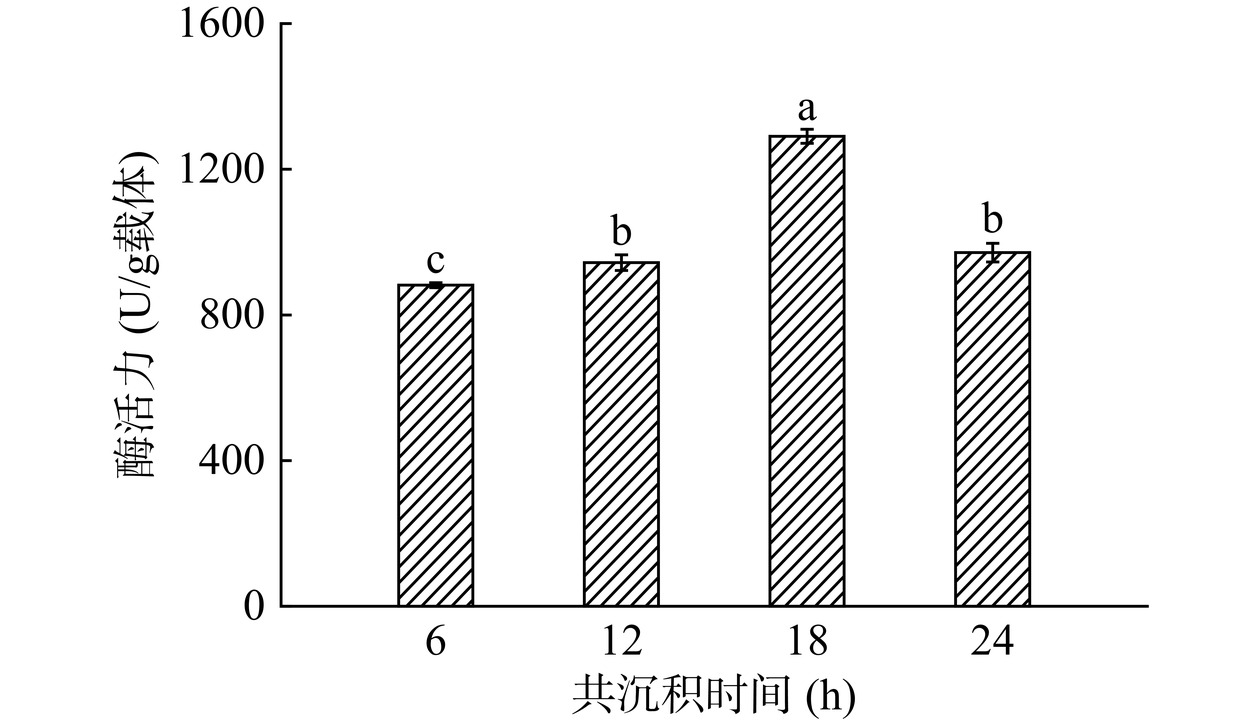
由图1可知,随着共沉积时间的延长,固定化脂肪酶的酶活逐渐升高。共沉积时间为18 h时,固定化酶的酶活显著提高(P<0.05),这与Zhou等[36]得出的实验结果相同,这可能是由于TA纳米粒子在不断增加,为酶的固定及反应提供了更多的结合位点。进一步增加共沉积时间,TA/APTES涂层仍可以修饰MCM-41,载体表面的纳米粒子过度沉积,在固定化脂肪酶时,酶分子更加聚集,影响了酶的空间构象和底物传质,反而使固定化酶酶活降低。因此,确定最佳共沉积时间为18 h进行后续实验。
2.1.2 共沉积体积比
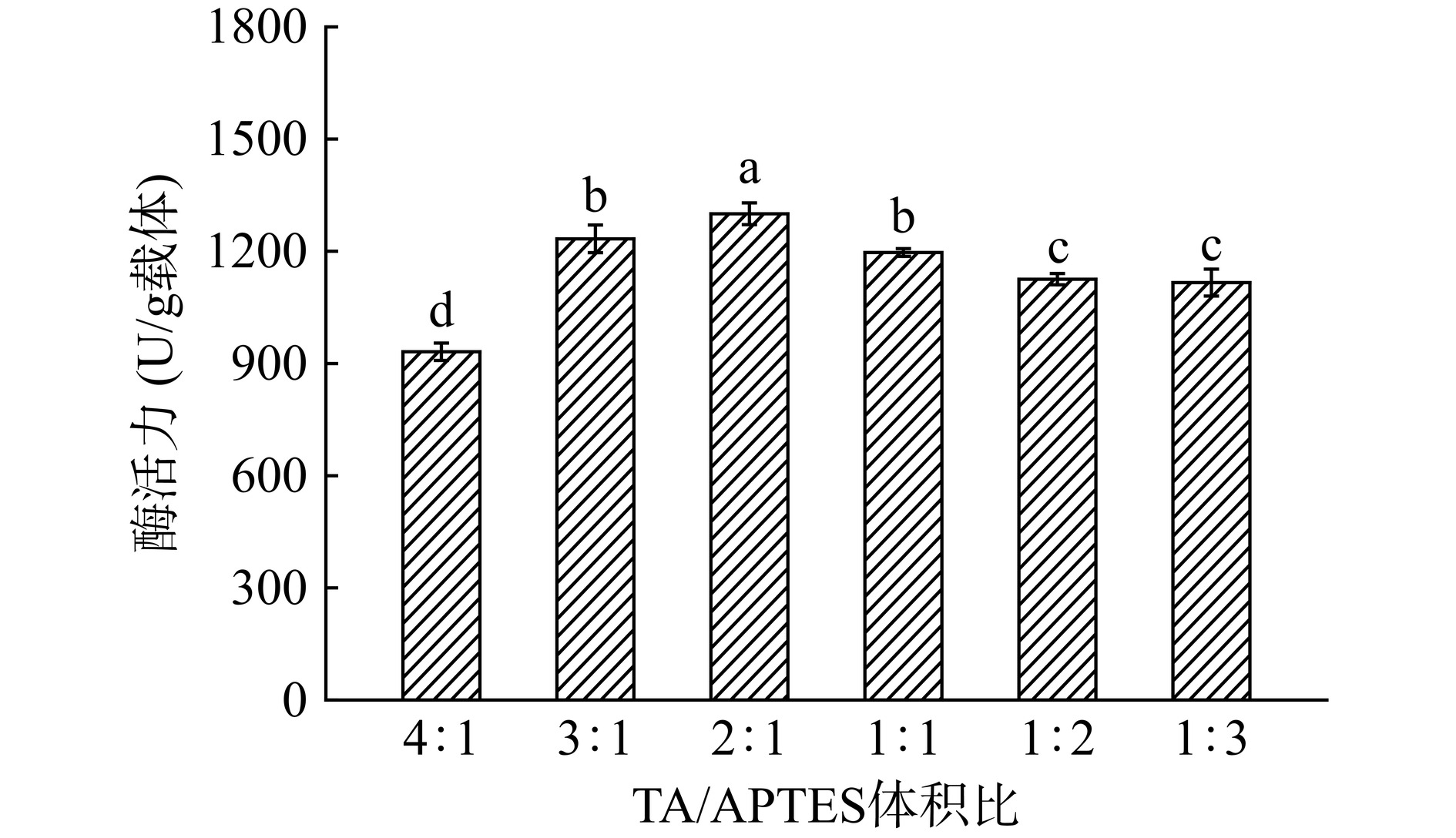
由图2可知,随着TA与APTES体积比逐渐减小,固定化酶酶活显著上升(P<0.05),这可能是由于TA分子沉积在MCM-41上的数量是有限的,过多的TA沉积并不会增加固定化酶的结合位点,而随着APTES在混合溶液中比例的增加,暴露在外的氨基增加,可以促进更多的酶被固定,进而使酶活表现出上升的趋势。当TA/APTES的体积比为2:1时,固定化酶的酶活达到最大值。继续减小体积比,固定化酶的酶活下降,这可能是由于混合涂层中主要依靠TA氧化后产生的醌基来作为酶的固定化位点,而TA与APTES体积比减少,使得TA的量减少,过量的APTES不利于混合涂层对载体的修饰,因此造成酶活降低[36]。选择TA与APTES体积比为2:1作为后续实验的共沉积体积比。
2.2 MCM-41及MCM-41-TA/APTES的表征
2.2.1 SEM与能谱分析
由图3可知MCM-41、MCM-41-TA/APTES都呈现出分散的球状,粒径大小约为500 nm,改性的过程中载体的形貌没有发生改变。如图3B所示,涂覆了TA/APTES涂层后,载体表面变得粗糙,存在微小的沟壑,表明TA/APTES成功涂覆。从图4以看出,MCM-41与MCM-41-TA/APTES相比,C元素和O元素的占比由修饰前的24.59%和40.60%分别提高到修饰后的26.08%和44.09%,进一步证明了TA/APTES涂层的成功涂覆。
2.2.2 红外光谱分析
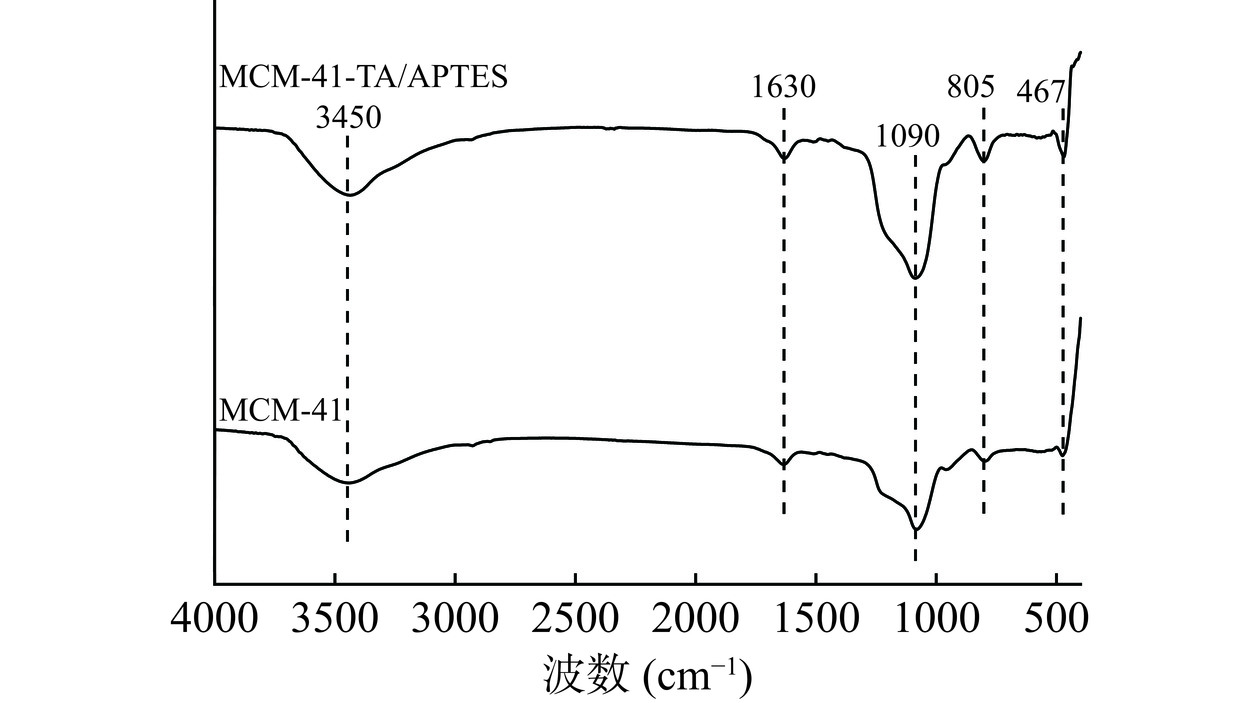
从图5可以看出,467、805和1090 cm−1处显示出的特征峰分别是Si-O-Si的对称、变形和不对称伸缩振动;3450 cm−1处的吸收峰为-OH的不对称拉伸振动吸收,证实了MCM-41的表面含有羟基[37−38]。1630 cm−1处的特征峰为单宁酸氧化后的C=O键的伸缩振动,固定化酶在此处的吸收峰强度显著增加,表明TA氧化并沉积在MCM-41的表面。而在1090 cm−1处的特征峰强度加强证明了氨基的成功结合[36]。
2.2.3 N2吸附/解吸分析
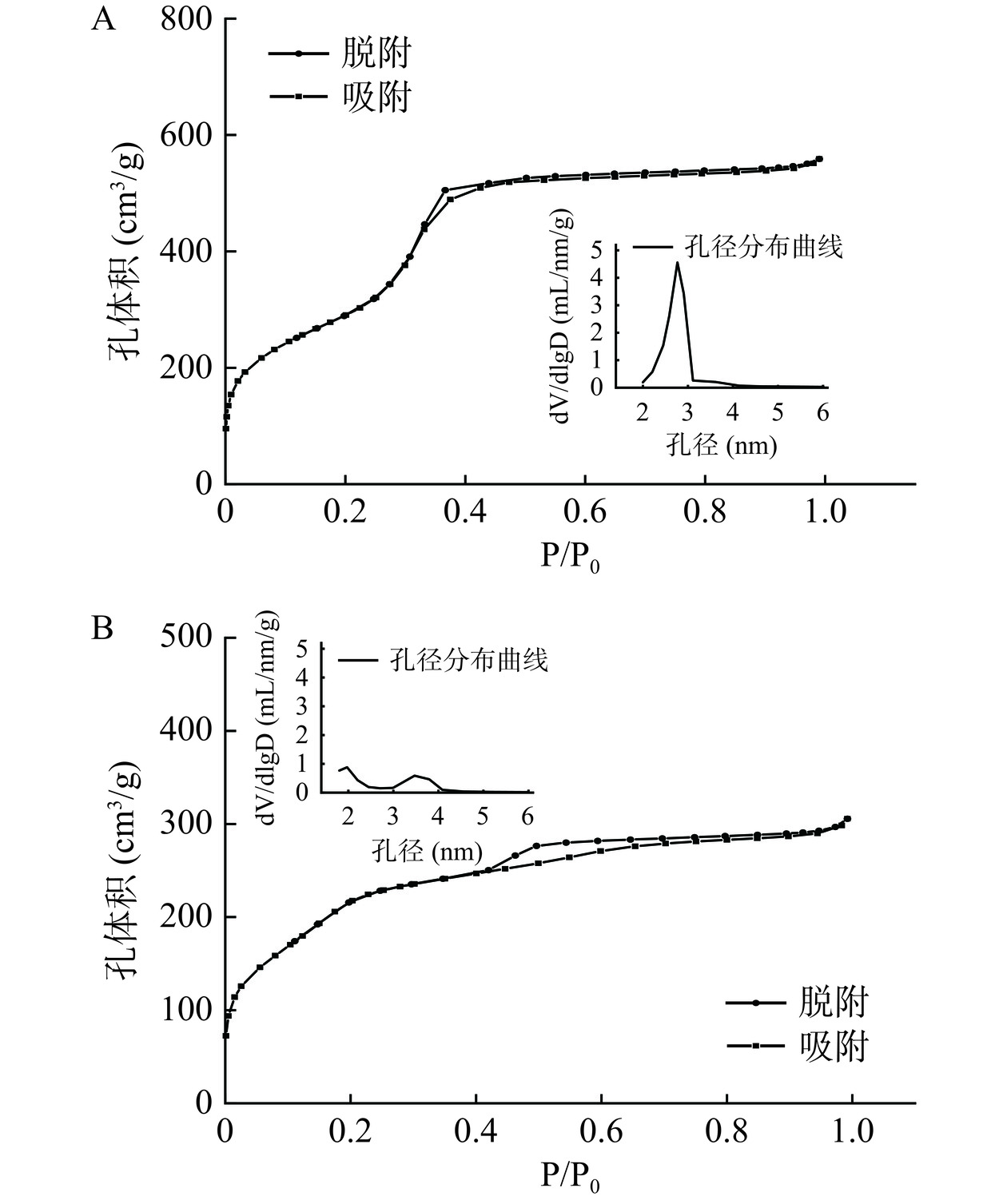
N2吸附/解吸实验结果如图6所示,MCM-41和MCM-41-TA/APTES的吸附/解吸等温线是典型的Ⅳ型等温线,具有明显的回滞环,说明载体存在介孔结构[31]。由孔径分布图可以看出MCM-41的孔径为3 nm,而经过修饰后孔径变小,证明TA/APTES涂层成功修饰在载体表面及孔内。同时,通过BET、BJH分析可知,MCM-41的比表面积、孔容积分别是1061.88 m2/g和0.86 mL/g,MCM-41-TA-APTES比表面积和孔容积为822.60 m2/g和0.47 mL/g,与MCM-41相比明显减小,这是因为MCM-41经过涂层涂覆后粒径变大,涂层占据了孔内的空间,证明了涂层成功涂覆。
2.3 固定化酶的制备及工艺优化
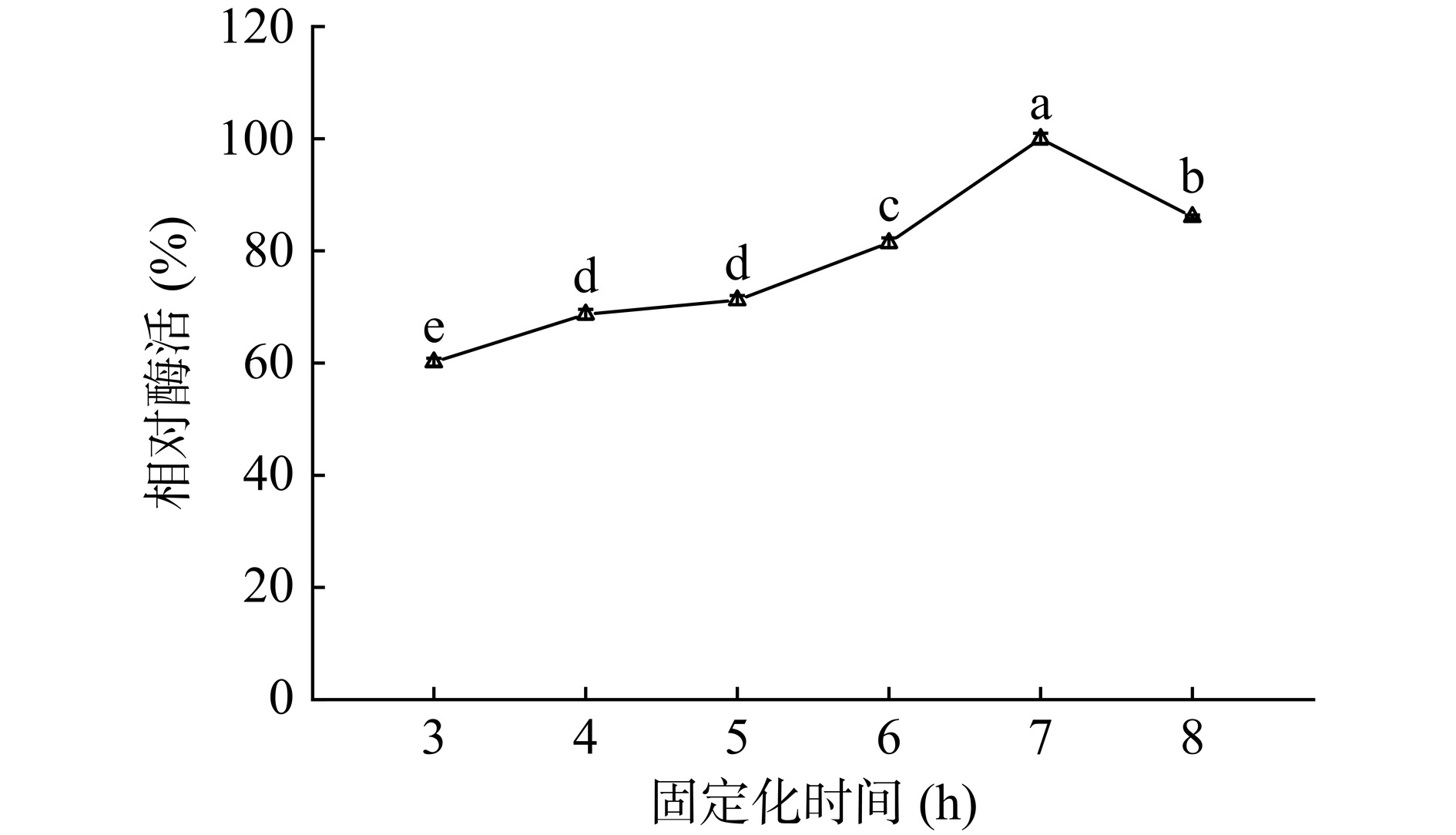
2.3.1 固定化时间
如图7所示,随着固定化时间的延长,相对酶活上升,且在7 h达到了最高值,而后随着时间的增加,相对酶活逐渐降低。这可能是因为在固定化时间为7 h时,载体负载的脂肪酶已经达到了饱和,由于酶分子的活性位点是有限的且需要一定空间来固定,如果继续延长固定化时间,会彼此覆盖活性位点,从而阻断底物结合导致酶活降低[39]。因此选择7 h为后续固定化时间。
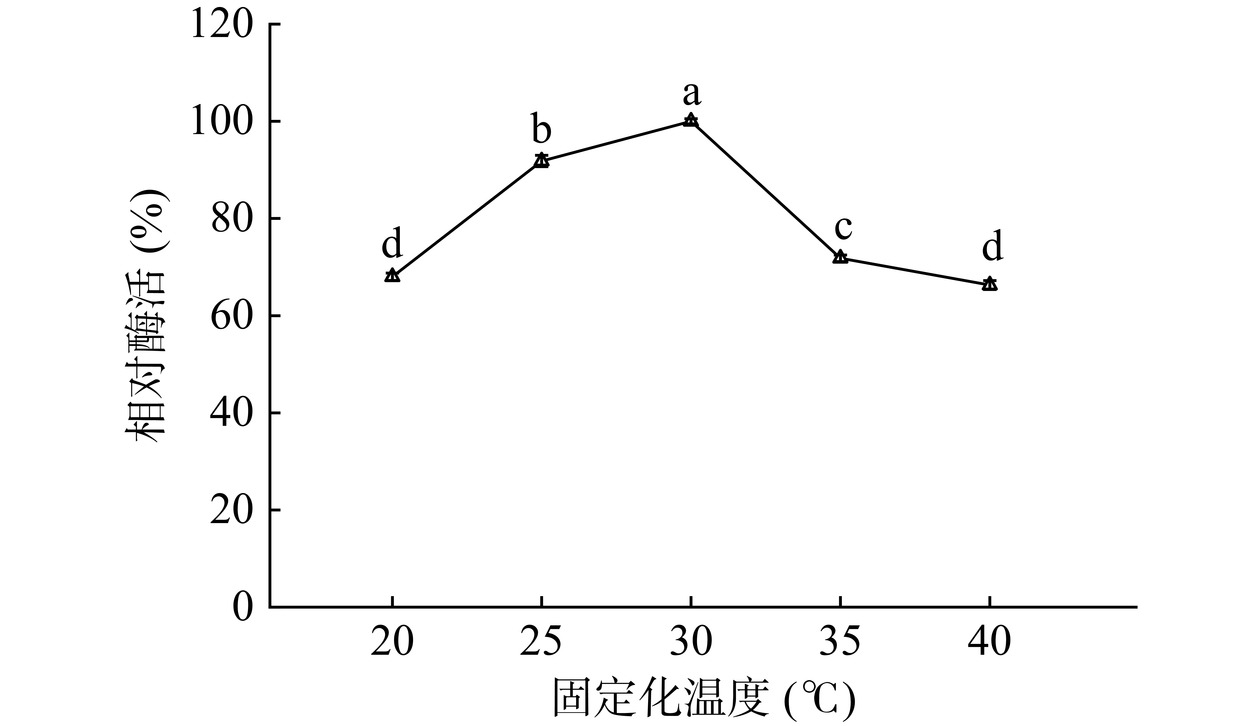
2.3.2 固定化温度
由图8可以看出,固定化酶的相对酶活随着温度增加而显著增加(P<0.05),在30 ℃达到酶活最高值1420.95 U/g载体。这是因为适当升温可以加快酶分子与载体共价连接的速度,同时席夫碱反应/迈克尔加成反应的速率也随之增加,固定化酶酶活上升[31]。温度继续升高,固定化酶相对酶活性下降至20 ℃时的水平。由此可见,低温不利于脂肪酶与载体的交联,而温度过高可能导致酶与载体之间的席夫碱键不稳定,加速了脂肪酶的扩散和解吸[39−40],造成酶活降低。因此选择30 ℃为较适宜的固定化温度进行后续实验。
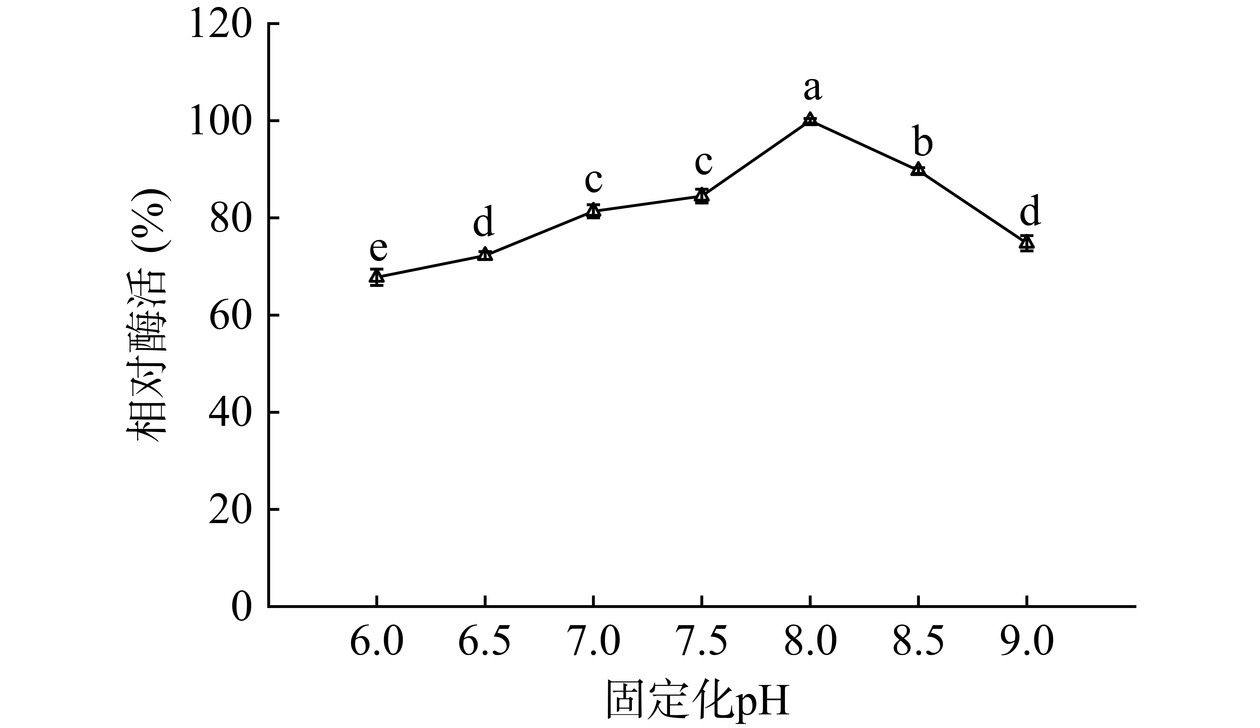
2.3.3 固定化pH
由图9可知,从pH由6.0逐渐变化到8.0,固定化酶的相对酶活逐渐增加,并在pH8.0时达到酶活最高值1416.23 U/g载体。而随着pH进一步增大到9.0,固定化酶相对活性显著下降(P<0.05),可能是因为pH的变化导致部分酶分子的构象发生改变,且酶与载体由席夫碱键和氢键连接,pH较低的条件下席夫碱键并不稳定,甚至会断裂导致酶分子脱落,王淑婧等[30]利用聚甲基丙烯酸缩水甘油酯固定化脂肪酶时的pH为7.0,与本实验的结果接近。因此选择pH8.0进行后续实验。
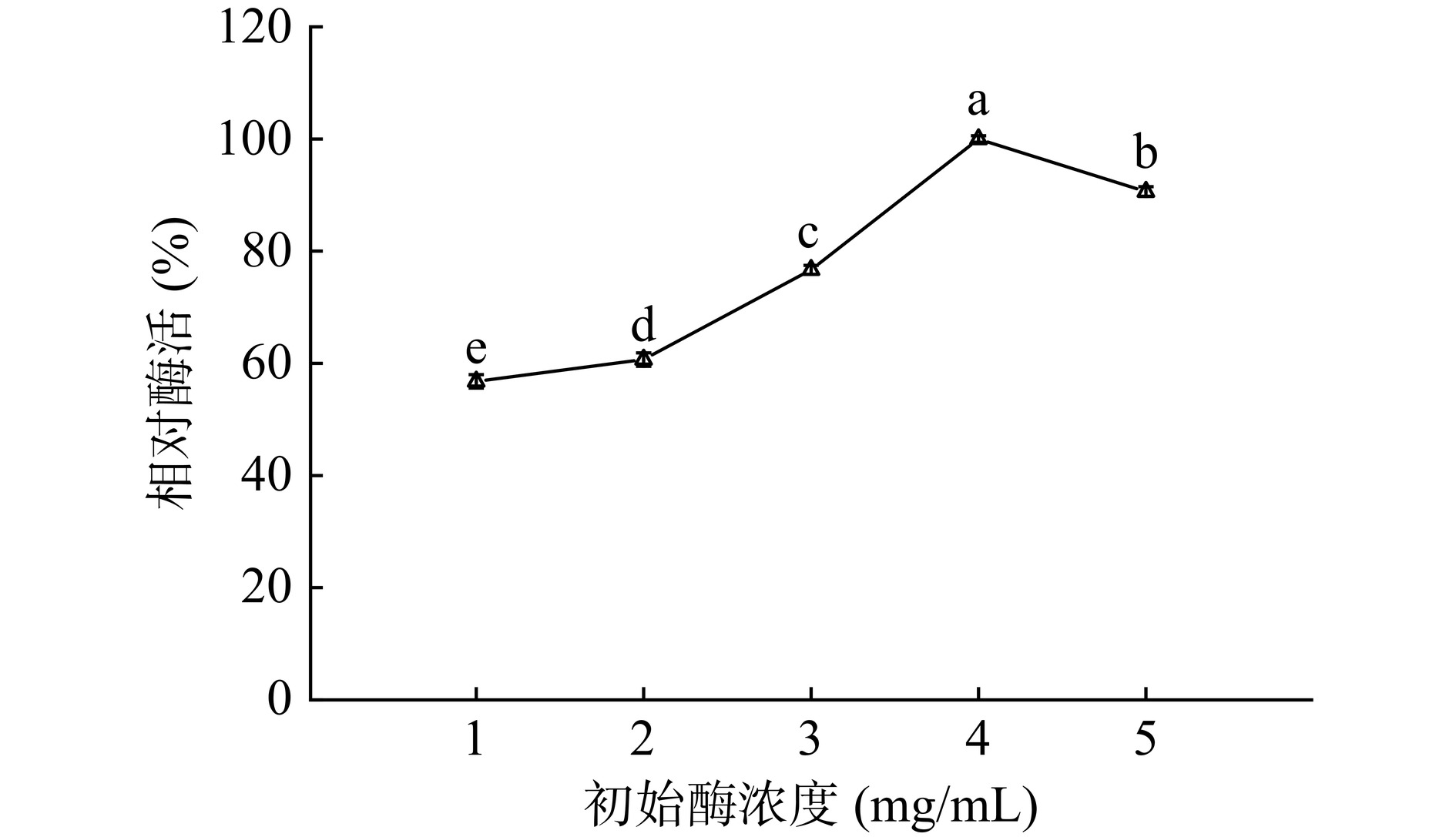
2.3.4 初始酶浓度
从图10可以看出,适当地增加初始酶浓度可以提高载酶量,从而提高酶活。在初始酶浓度为4 mg/mL时,达到酶活最高值2691.50 U/g载体,此时的载酶量为26.40 mg/g载体。继续增加初始酶浓度,载体上的载酶量有微量上升,但是固定化酶的酶活反而下降。这可能是由于在初始酶浓度为4 mg/mL时,载体与酶分子之间已经达到饱和。而载体的表面空间是有限的,再继续增加酶浓度,尽管会有更多的酶固定上去,但是酶分子之间彼此堆叠,很容易覆盖彼此的活性位点,影响底物传质[40]。因此,较适宜的初始酶浓度为4 mg/mL。
2.4 酶学性质研究
2.4.1 最佳反应温度及温度稳定性
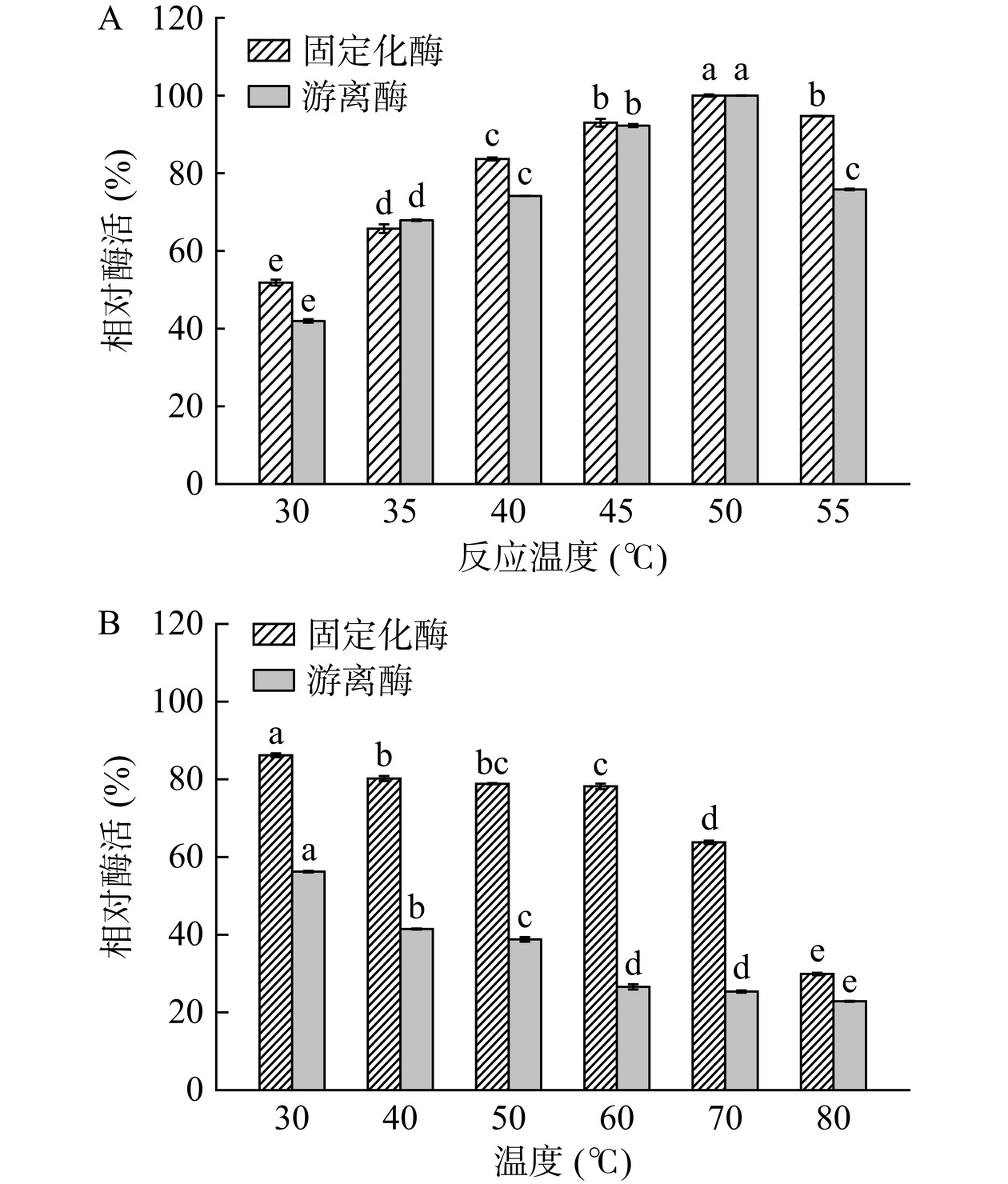
从图11A得知,无论是游离酶还是固定化酶,最佳反应温度均为50 ℃。此外,固定化脂肪酶在较高温度下表现出比游离脂肪酶更好的活性。从图11B可以看出,当温度达到70 ℃时,固定化脂肪酶保留了75%的活性,而游离脂肪酶只有40%的初始酶活,表明固定化使脂肪酶可以应用在更宽的温度范围内。这主要是由于通过固定化可以提供热阻,限制了酶分子的分子构象变化,维持了酶分子的空间结构[41]。而在80 ℃下,无论是固定化酶还是游离酶的酶活都显著降低(P<0.05),可能是由于温度过高导致酶分子失活。
2.4.2 最佳反应pH及pH稳定性
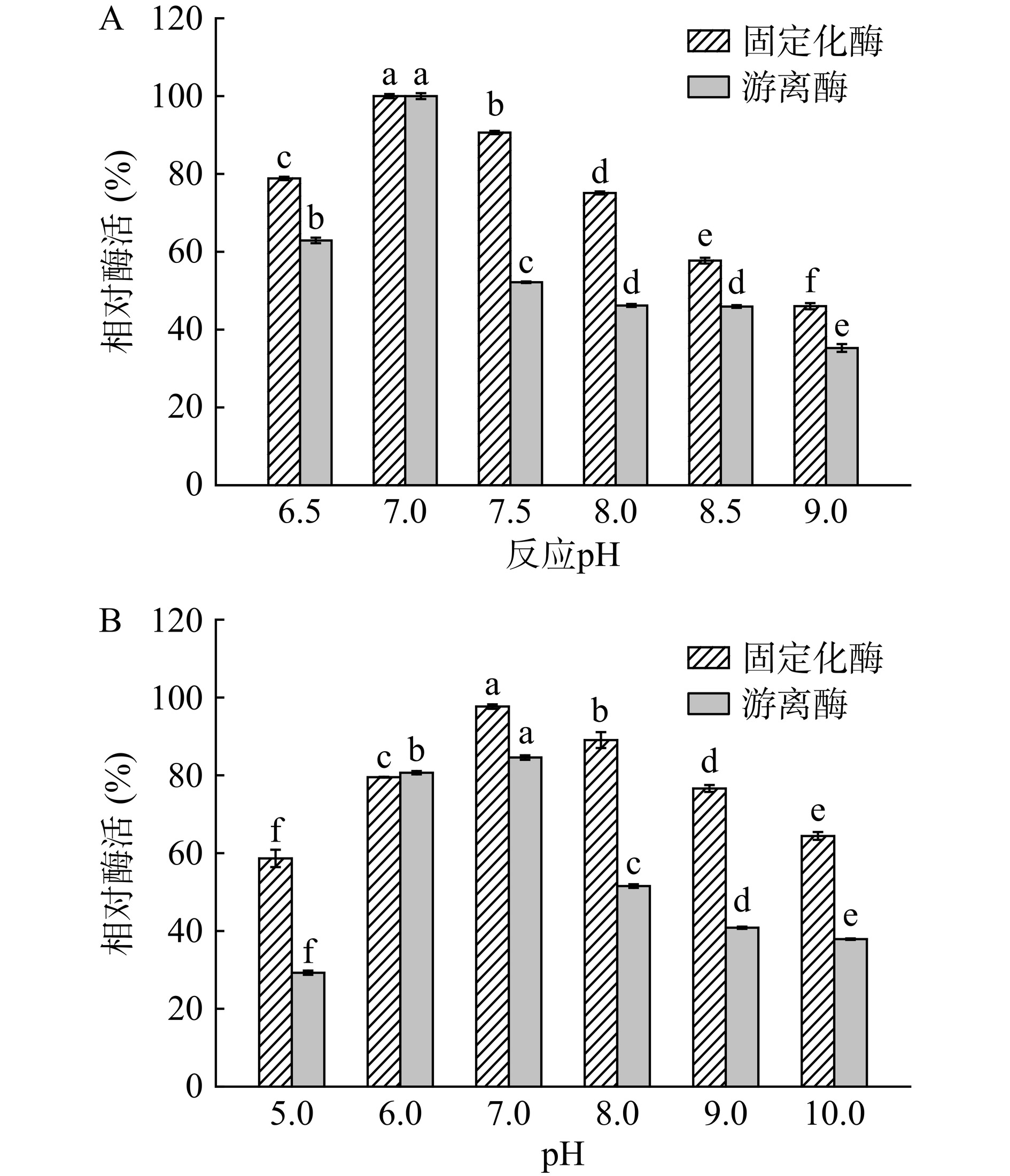
由图12A可看出,游离酶和固定化酶的最佳反应pH均为7.0。此时固定化酶在最佳反应条件下酶活为4108±34.74 U/g载体。从图12B中可以看出,将游离酶与固定化酶分别放入不同pH的缓冲溶液中保持2 h,固定化酶的酶活变化比游离酶的变化要小得多,且在pH为5.0时仍可以保持58.68%的酶活(游离酶在该pH条件下的酶活只有35.60%),表明固定化酶可以在一定程度上抵抗外界不利的pH环境,并具有更宽泛的应用范围。这可能是由于共价固定化将酶分子结合在载体上,使酶分子的柔性降低,刚性增强,因此固定化酶对反应体系的pH变化不敏感[42]。
2.4.3 酶促动力学
通过测量不同p-NPP浓度下固定化酶和游离酶的活性,研究了酶促反应动力学过程。通过Lineweaver-Burk米氏方程,测得了固定化脂肪酶的Km为2.2947 mmol·L−1,Vmax为7.3314 mmol·L−1·S−1,游离酶的Km为27.1281 mmol·L−1,Vmax为3.3113 mmol·L−1·S−1,说明固定化过程大大提高了酶与底物p-NPP的亲和度,最大反应速率也得到提升。固定化酶的Kcat/Km是游离酶的26.17倍,进一步证明了固定化酶的催化效率有效提高。
2.4.4 重复利用性
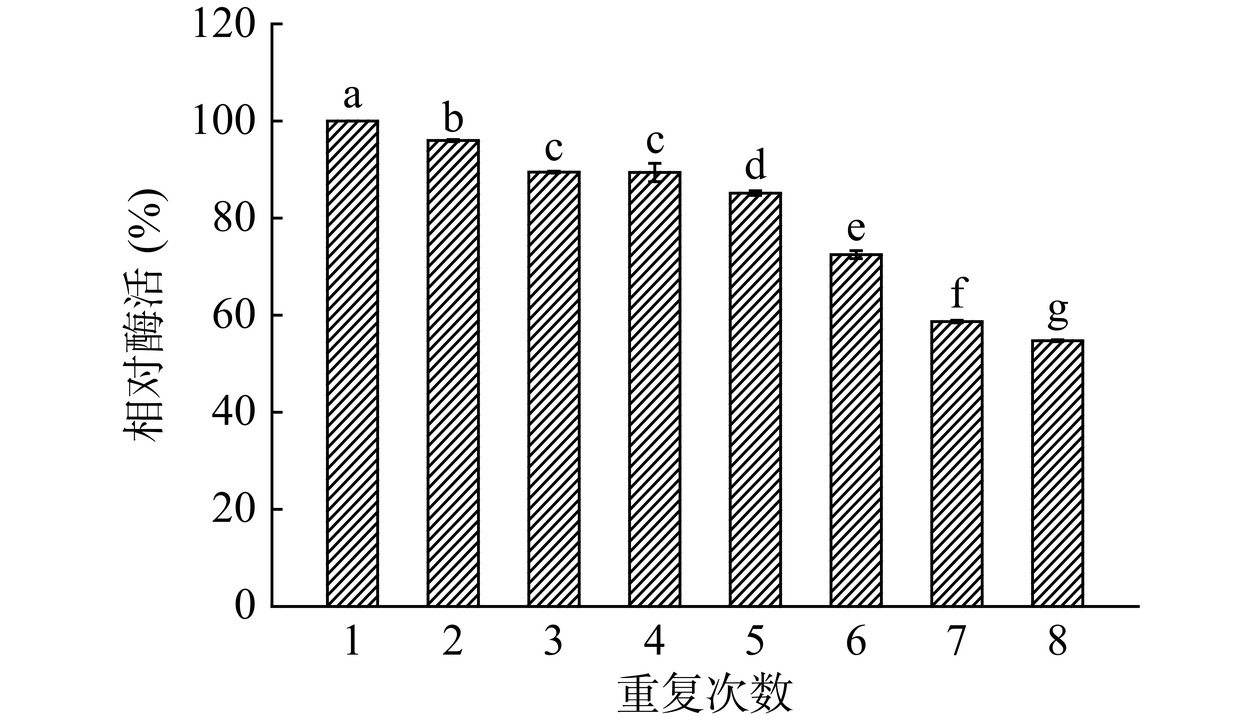
从图13可以看出,连续使用了5次后,固定化酶表现出85.10%的酶活。使用了8次以后,固定化酶仍具有54.70%的初始酶活力。固定化酶过程中,大部分酶分子是通过化学键与载体连接从而稳固地固定在载体上,而有一小部分则是通过材料本身的吸附作用固定在载体上的,这些酶分子较容易在反复洗涤的过程中从载体上脱落;同时在重复催化的过程中部分酶分子也会由于外界条件影响而失活,导致酶活降低。Liu等[43]使用羧基功能化共价有机框架固定化脂肪酶,在使用6次后,其活性保留了53.00%。Li等[42]用吸附-交联法固定化米根霉脂肪酶,在重复使用7个周期后酶活降至50.00%以下。王淑婧等[30]使用贻贝仿生涂层修饰聚合物微球固定化脂肪酶,重复使用了8次后保留了39.22%的初始酶活。酶活下降的原因可能是反复洗涤导致部分固定化酶损失,以及在重复催化的过程中酶分子失活或从载体上脱落等。本研究中由于使用TA/APTES形成的涂层与脂肪酶之间主要通过共价键连接,这种涂层的粘附能力很强,不易被破坏,使得酶分子不易脱落,且对酶分子没有毒害作用,因此重复利用性较好[36]。
2.4.5 储藏稳定性
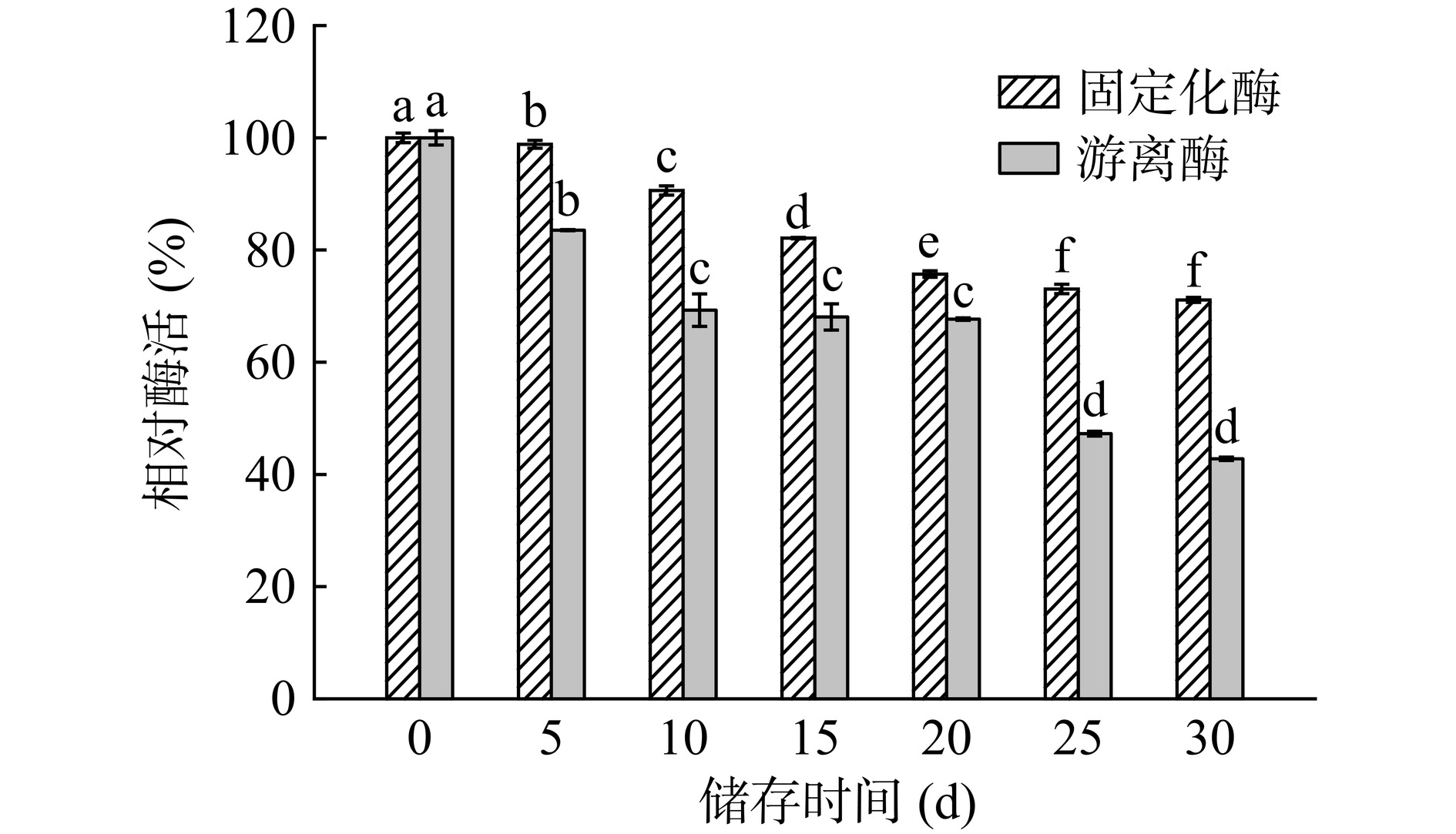
图14所示为储藏在4 ℃条件下固定化酶与游离酶的酶活变化,与第0 d相比,储藏了30 d的固定化酶和游离酶的酶活力都显著降低(P<0.05)。但是固定化酶能够保留71.10%的酶活力,相比于游离酶42.78%的酶活力,固定化酶酶活降低的幅度较小,且趋势平缓。说明MCM-41-TA/APTES固定化酶在一定程度上保护了酶的活性中心,避免了酶失活。
2.5 固定化酶在月桂酸己酯合成中的应用
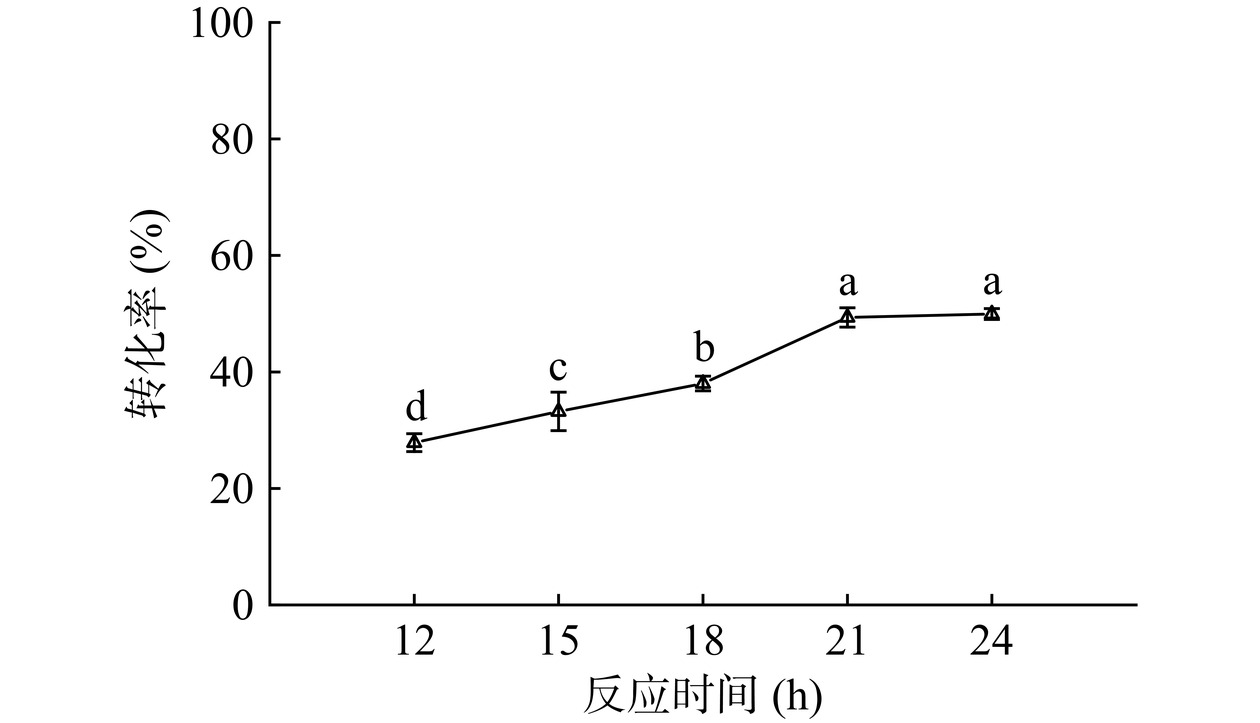
2.5.1 反应时间
如图15所示,延长反应时间,转化率呈上升趋势,这可能是随着反应时间的延长,固定化酶与底物之间能够更加充分地接触,促进了反应的进行。由于脂肪酶主要在油水界面进行反应,因此在反应前期,酯化反应产生的水逐渐包围脂肪酶,为脂肪酶提供了充足的水分,使酯的产率迅速提高[44]。在反应时间为21 h时,达到最高转化率49.36%。继续增加反应时间,月桂酸的转化率没有显著增加(P>0.05),可能是由于此时的底物和产物已经达到了动态平衡。因此选择21 h为最佳反应时间。
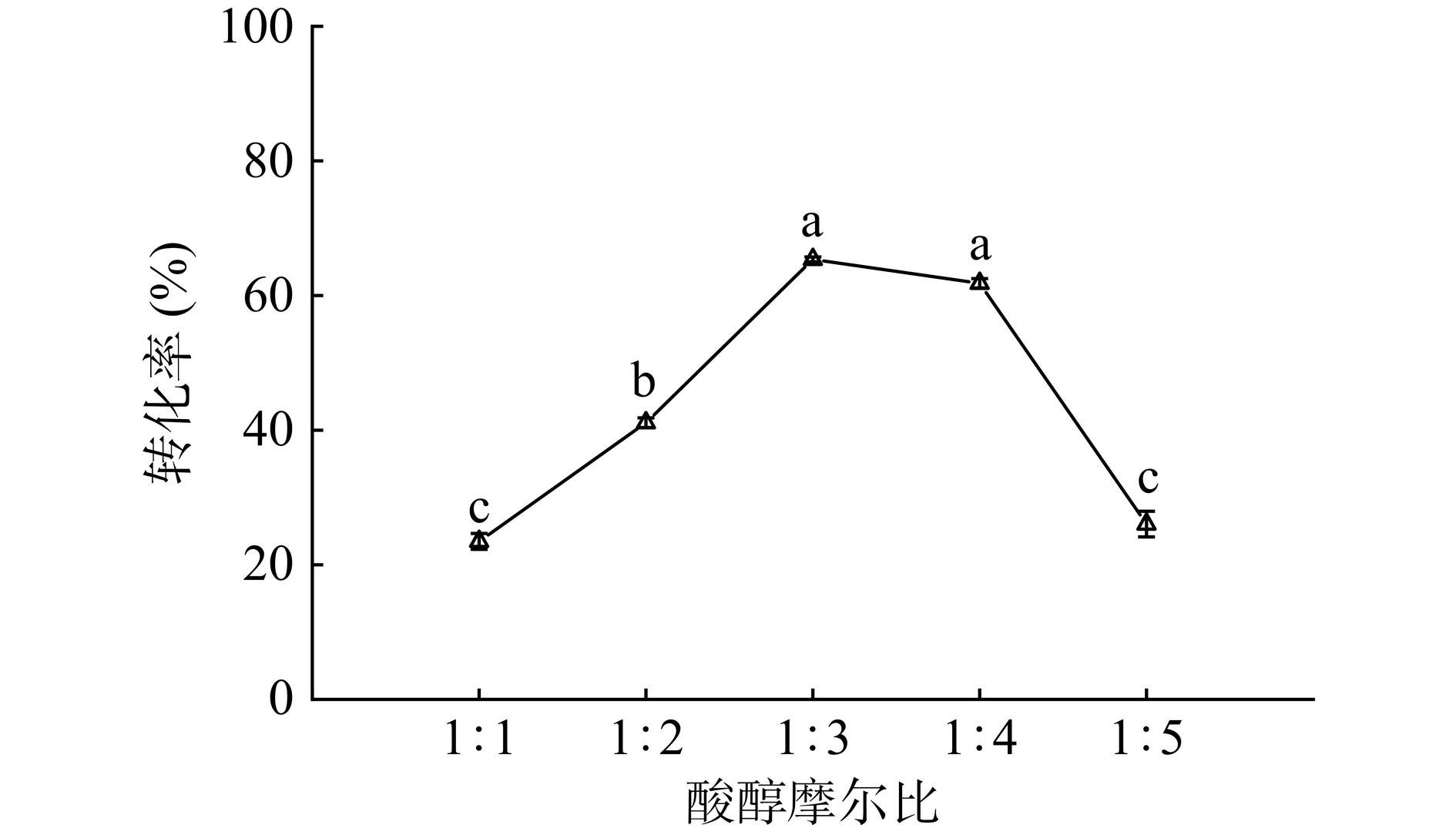
2.5.2 酸醇摩尔比
保持反应体系的总质量不变,改变月桂酸和己醇的摩尔比,研究其对月桂酸转化率的影响。从图16可以看出,月桂酸与己醇的摩尔比为1:3时,月桂酸的转化率最高为65.37%。继续增加己醇的比例,转化率显著降低(P<0.05),这可能是因为过量的己醇使酶周围环境的底物浓度太高,并且己醇与脂肪酶的表面与活性位点通道进行互相作用,对酶的酯化催化位点的结合产生限制[45],陈林林等[46]通过对酶促合成阿魏酸香茅醇酯工艺进行优化,选取阿魏酸与香茅醇的底物摩尔比为1:6为最优条件,且与本研究的变化趋势相似。因此选择酸醇摩尔比1:3为进一步反应的最佳比例。
2.5.3 反应温度
月桂酸的熔点为44~46 ℃,所以选择50 ℃为反应温度的起点。如图17所示,随着温度由50 ℃上升至65 ℃,月桂酸转化率显著上升并达到最高(P<0.05),月桂酸与己醇的酯化反应为可逆反应,温度升高有助于降低混合物的粘度,提高反应速率,促进反应的正向进行[46],而当温度继续升高时,转化率显著下降(P<0.05),这是因为脂肪酶的本质是蛋白质,尽管固定化酶提升了其温度稳定性,但是长时间处于过高的温度环境下仍然会失活,使得转化率也大幅度降低[47]。
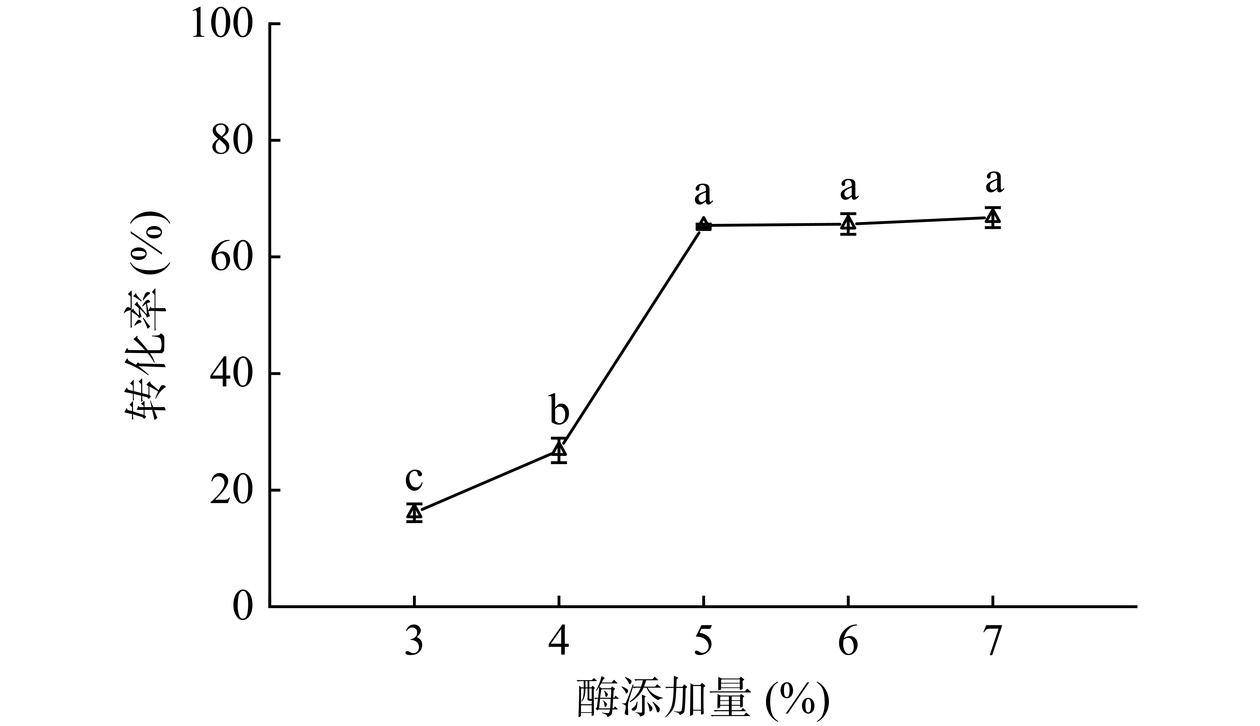
2.5.4 酶添加量
从图18可以看出,酶添加量由3%增加为5%时,转化率达到65.38%。继续增加酶添加量,转化率增加不显著(P>0.05),这种变化情况与王舒舒等[48]的实验结果相似,这可能是因为固定化酶加入过多,会在反应体系中团聚,进而影响酶与反应物的充分接触[48]。因此选择5%的酶添加量进行酶法催化月桂酸己酯的合成。
3. 结论
本研究通过将单宁酸与3-氨丙基三乙氧基硅烷共沉积于有序介孔二氧化硅材料MCM-41上,制备了一种新型仿生修饰固定化材料,利用扫描电镜、能谱、红外光谱及N2吸附/脱附的方法证明了涂层的有效修饰。对固定化工艺的研究结果表明,该材料可在不使用交联剂的条件下进行脂肪酶的固定化,且获得的固定化酶具有较高的酶活及良好的操作稳定性。最佳的固定化脂肪酶的条件为:固定化时间为7 h,固定化温度为30 ℃,固定化pH为8.0,初始酶浓度为4 mg/mL。在此条件下制备的固定化酶,最佳反应温度为50 ℃,最佳反应pH为7.0,最高酶活可达4108±34.74 U/g载体。与游离酶相比,本研究所制备的固定化酶具有良好的操作稳定性、更宽的催化反应范围及良好的储藏稳定性,重复使用了5次后保留了85.10%的初始酶活,使用了8次以后,固定化酶仍具有54.70%的初始酶活力。将其应用于催化月桂酸己酯的合成,转化率最高可达到65.38%,为酶法合成月桂酸己酯提供了数据支持,进一步为脂肪酶的绿色生产和工业化应用提供了新的技术路线。
-
-
[1] MEHTA A, BODH U, GUPTA R. Fungal lipases:A review[J]. Journal of Biotech Research,2017,8(1):58−77.
[2] REETZ M T. Biocatalysis in organic chemistry and biotechnology:Past, present, and future[J]. Journal of the American Chemical Society,2013(34):135.
[3] 多拉娜, 徐伟良, 李春冬, 等. 产脂肪酶微生物的研究进展及其在食品中的应用[J]. 粮食与油脂,2020,33(10):8−10. [DUO L N, XU W L, LI C D, et al. Research progress on the lipase-producing microbial and its application in food[J]. Cereals and Oils,2020,33(10):8−10.] doi: 10.3969/j.issn.1008-9578.2020.10.004 DUO L N, XU W L, LI C D, et al. Research progress on the lipase-producing microbial and its application in food[J]. Cereals and Oils, 2020, 33(10): 8−10. doi: 10.3969/j.issn.1008-9578.2020.10.004
[4] 胡兴翠, 刘建华. 微生物脂肪酶特性及工业应用[J]. 基因组学与应用生物学,2019,38(8):3572−3579. [HU X C, LIU J H. Characteristics and industrial applications of microbial lipase[J]. Genomics and Applied Biology,2019,38(8):3572−3579.] HU X C, LIU J H. Characteristics and industrial applications of microbial lipase[J]. Genomics and Applied Biology, 2019, 38(8): 3572−3579.
[5] SHEN J W, CAI X, DOU B J, et al. Expression and characterization of a CALB-type lipase from Sporisorium reilianum SRZ2 and its potential in short-chain flavor ester synthesis[J]. Frontiers of Chemical Science and Engineering,2020,14:868−879. doi: 10.1007/s11705-019-1889-x
[6] RODRIGUES R C, VIRGEN-ORTÍZ J J, DOS SANTOS J C S, et al. Immobilization of lipases on hydrophobic supports:Immobilization mechanism, advantages, problems, and solutions[J]. Biotechnology Advances,2019,37(5):746−770. doi: 10.1016/j.biotechadv.2019.04.003
[7] LOUHASAKUL Y, CHEIRSILP B. Potential use of industrial by-products as promising feedstock for microbial lipid and lipase production and direct transesterification of wet yeast into biodiesel by lipase and acid catalysts[J]. Bioresource Technology,2022,348:126742. doi: 10.1016/j.biortech.2022.126742
[8] CAI X, SHEN J W, QIANG Y, et al. Efficient activity enhancement of a lipase from Sporisorium reilianum for the synthesis of a moxifloxacin chiral intermediate via rational design[J]. Engineering,2022(12):10.
[9] ZHANG X, CHEN L, AI N, et al. Lipase-catalyzed enhancement of milk flavor components in the application of modified skim milk products[J]. Journal of Food Measurement and Characterization,2021,15(5):4256−4266. doi: 10.1007/s11694-021-01001-w
[10] AHRARI F, MOHAMMADI M. Combined cross-linking of Rhizomucor miehei lipase and Candida antarctica lipase B for the effective enrichment of omega-3 fatty acids in fish oil[J]. International Journal of Biological Macromolecules,2024,260:129362. doi: 10.1016/j.ijbiomac.2024.129362
[11] 张永民. 纤维素链霉菌AU-10源脂肪酶‒—一种可应用于洗涤剂配方的酶[J]. 中国洗涤用品工业,2020(7):64−72. [ZHANG Y M. Lipase from Streptomyces cellulose AU-10—An enzyme that can be applied to detergent formulations[J]. China Cleaning Industry,2020(7):64−72.] ZHANG Y M. Lipase from Streptomyces cellulose AU-10—An enzyme that can be applied to detergent formulations[J]. China Cleaning Industry, 2020(7): 64−72.
[12] NITBANI F O, TJITDA P J P, NITTI F, et al. Antimicrobial properties of lauric acid and monolaurin in virgin coconut oil:A review[J]. Chembioeng Reviews,2022,9(5):442−461. doi: 10.1002/cben.202100050
[13] CHEN C, LIU Y, TIAN H, et al. Metagenomic analysis reveals the impact of JIUYAO microbial diversity on fermentation and the volatile profile of Shaoxing-jiu[J]. Food Microbiology,2020,86:103326. doi: 10.1016/j.fm.2019.103326
[14] ZHAO M, CAI H, LIU M, et, al. Dietary glycerol monolaurate supplementation for the functional properties modification of egg white protein[J]. Journal of the Science of Food and Agriculture,2019,99(8):3852−3859. doi: 10.1002/jsfa.9607
[15] HUANG S M, LI H J, LIU Y C, et, al. An efficient approach for lipase-catalyzed synthesis of retinyl laurate nutraceutical by combining ultrasound assistance and artificial neural network optimization[J]. Molecules,2017,22(11):1972. doi: 10.3390/molecules22111972
[16] CHANG S W, SHAW J F, SHIEH C J. Optimization of enzymatically prepared hexyl butyrate by lipozyme IM77[J]. Food Technol Biotech,2003,41:237−42.
[17] CHANG S W, SHAW J F, YANG C K, et al. Optimal continuous biosynthesis of hexyl laurate by a packed bed bioreactor[J]. Process Biochemistry,2007,42(9):1362−1366. doi: 10.1016/j.procbio.2007.06.008
[18] 裴帅龙, 田盛, 姜璐, 等. 固定化酶技术及其载体材料研究[J]. 天津化工,2023,37(5):12−15. [PEI S L, TIAN S, JIANG L, et al. Study on immobilized enzyme technology and its carrier materials[J]. Tianjin Chemical Industry,2023,37(5):12−15.] doi: 10.3969/j.issn.1008-1267.2023.05.004 PEI S L, TIAN S, JIANG L, et al. Study on immobilized enzyme technology and its carrier materials[J]. Tianjin Chemical Industry, 2023, 37(5): 12−15. doi: 10.3969/j.issn.1008-1267.2023.05.004
[19] MAGHRABY Y R, EL-SHABASY R M, IBRAHIM A H, et al. Enzyme immobilization technologies and industrial applications[J]. ACS Omega,2023,8(6):5184−5196. doi: 10.1021/acsomega.2c07560
[20] ZHAI T, WANG C, GU F, et al. Dopamine/polyethylenimine-modified silica for enzyme immobilization and strengthening of enzymatic CO2 eonversion[J]. ACS Sustainable Chemistry and Engineering,2020,8(40):15250−15257. doi: 10.1021/acssuschemeng.0c04975
[21] ZHAO J, MA M, YAN X, et al. Green synthesis of polydopamine functionalized magnetic mesoporous biochar for lipase immobilization and its application in interesterification for novel structured lipids production[J]. Food Chemistry,2022,379:132148. doi: 10.1016/j.foodchem.2022.132148
[22] 孙晓杰. 基于多巴胺表面交联的高性能固定化酶用于多肽制备的动力学特性研究[D]. 烟台:鲁东大学, 2022. [SUN X J. Kinetic characterization of high-performance immobilized enzymes based on dopamine surface cross-linking for peptide preparation[D]. Yantai:Ludong University, 2022.] SUN X J. Kinetic characterization of high-performance immobilized enzymes based on dopamine surface cross-linking for peptide preparation[D]. Yantai: Ludong University, 2022.
[23] TANG W, CHEN C, SUN W, et al. Low-cost mussel inspired poly (catechol/polyamine) modified magnetic nanoparticles as a versatile platform for enhanced activity of immobilized enzyme[J]. International Journal of Biological Macromolecules,2019,128:814−824. doi: 10.1016/j.ijbiomac.2019.01.161
[24] TANG W, LI H, ZHANG W, et al. Site-specific and covalent immobilization of lipase on natural polyphenol-modified magnetic nanoparticles for effective biodiesel production[J]. ACS Sustainable Chemistry and Engineering,2022,10(17):5384−5395. doi: 10.1021/acssuschemeng.1c07881
[25] 朱衡, 林海蛟, 张继福, 等. 氨基载体共价结合固定化海洋假丝酵母脂肪酶[J]. 中国生物工程杂志,2019,39(7):71−78. [ZHU H, LIN H J, ZHANG J F, et al. Covalent immobilization of marine Candida rugosa lipase using amino carrier[J]. China Biotechnology,2019,39(7):71−78.] ZHU H, LIN H J, ZHANG J F, et al. Covalent immobilization of marine Candida rugosa lipase using amino carrier[J]. China Biotechnology, 2019, 39(7): 71−78.
[26] BOURKAIB M C, GAUDIN P, VIBERT F, et al. APTES modified SBA-15 and meso-macro silica materials for the immobilization of aminoacylases from Streptomyces ambofaciens[J]. Microporous and Mesoporous Materials,2021,323:111226. doi: 10.1016/j.micromeso.2021.111226
[27] 韩明才. 单宁酸(TA)-3-氨丙基三乙氧基硅烷(APTES)涂层的功能化及其在水处理中的应用研究[D]. 南昌:南昌大学, 2020. [HAN M C. Funcionalization of tannic acid(TA)-3-aninopropyltriethoxysilane (APTES) coating and its application in water treatment[D]. Nanchang:Nanchang University, 2020.] HAN M C. Funcionalization of tannic acid(TA)-3-aninopropyltriethoxysilane (APTES) coating and its application in water treatment[D]. Nanchang: Nanchang University, 2020.
[28] 张灿, 姜国芳, 杨江楠, 等. 多孔材料固定化脂肪酶的研究进展[J]. 分子催化,2020,34(4):378−396. [ZHANG C, JIANG G F, YANG J N, et al. Research progress of immobilized lipase on porous materials[J]. Journal of Molecular Catalysis(China),2020,34(4):378−396.] ZHANG C, JIANG G F, YANG J N, et al. Research progress of immobilized lipase on porous materials[J]. Journal of Molecular Catalysis(China), 2020, 34(4): 378−396.
[29] 徐鹏, 吴克, 俞志敏, 等. 介孔分子筛MCM-41固定中性脂肪酶条件的研究[J]. 生物学杂志,2012,29(3):27−30. [XU P, WU K, YU Z M, et al. Study on conditions of mesoporous molecular sieve MCM-41 fixed neutral lipase[J]. Journal of Biology,2012,29(3):27−30.] doi: 10.3969/j.issn.2095-1736.2012.03.027 XU P, WU K, YU Z M, et al. Study on conditions of mesoporous molecular sieve MCM-41 fixed neutral lipase[J]. Journal of Biology, 2012, 29(3): 27−30. doi: 10.3969/j.issn.2095-1736.2012.03.027
[30] 王淑婧, 曾祥冰, 孙西同, 等. 贻贝仿生涂层修饰聚合物微球固定化脂肪酶的制备及应用[J]. 食品工业科技,2024,45(1):108−117. [WANG S J, ZENG X B, SUN X T, et, al. Synthesis and application of lipase immobilized on mussel-inspired polymer microspheres[J]. Science and Technology of Food Industry,2024,45(1):108−117.] WANG S J, ZENG X B, SUN X T, et, al. Synthesis and application of lipase immobilized on mussel-inspired polymer microspheres[J]. Science and Technology of Food Industry, 2024, 45(1): 108−117.
[31] YU D, ZHANG X, WANG T, et al. Immobilized Candida antarctica lipase B (CALB) on functionalized MCM-41:Stability and catalysis of transesterifsication of soybean oil and phytosterol[J]. Food Bioscience,2021,40:100906. doi: 10.1016/j.fbio.2021.100906
[32] 罗旭聪. 基于共价有机框架材料构建生物催化剂及性能研究[D]. 天津:河北工业大学, 2020. [LUO X C. Construction of biocatalyst based on covalent organic frame materials and the catalytic performance[D]. Tianjin:Hebei University of Technology, 2020.] LUO X C. Construction of biocatalyst based on covalent organic frame materials and the catalytic performance[D]. Tianjin: Hebei University of Technology, 2020.
[33] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976(72):248−254.
[34] 梁准成. 月桂酸单甘酯类衍生物的合成及性质研究[D]. 广州:华南理工大学, 2015. [LIANG Z C. Research on synthesis and properties of glycerol monolaurin derivatives[D]. Guangzhou:South China University of Technology, 2015.] LIANG Z C. Research on synthesis and properties of glycerol monolaurin derivatives[D]. Guangzhou: South China University of Technology, 2015.
[35] 国家粮食局标准质量中心. LS/T 6107-2012 动植物油脂 酸值和酸度测定 自动滴定分析仪法[S]. 北京:国家粮食局, 2012. [National Food Bureau Standard Quality Center. LS/T 6107-2012 Animal and vegetable fats and oils Determination of acid value and acidity Method of automatic titration analyzer[S]. Beijing:National Food Bureau, 2012.] National Food Bureau Standard Quality Center. LS/T 6107-2012 Animal and vegetable fats and oils Determination of acid value and acidity Method of automatic titration analyzer[S]. Beijing: National Food Bureau, 2012.
[36] ZHOU F, LUO J, SONG S, et al. Nanostructured polyphenol-mediated coating:A versatile platform for enzyme immobilization and micropollutant removal[J]. Industrial and Engineering Chemistry Research,2020,59(7):2708−2717. doi: 10.1021/acs.iecr.9b05708
[37] 李笑迎, 白文静, 陶凯, 等. 大孔/介孔多级孔SiO2的制备及其在固定化脂肪酶中的应用[J]. 材料导报,2018,32(10):1695−1700,1715. [LI X Y, BAI W J, TAO K, et al. Preparation of hierarchical macroporous/mesoporous silica and its application in lipase immobilization[J]. Materials Review,2018,32(10):1695−1700,1715.] doi: 10.11896/j.issn.1005-023X.2018.10.024 LI X Y, BAI W J, TAO K, et al. Preparation of hierarchical macroporous/mesoporous silica and its application in lipase immobilization[J]. Materials Review, 2018, 32(10): 1695−1700,1715. doi: 10.11896/j.issn.1005-023X.2018.10.024
[38] 李雪玉, 周海燕, 周华, 等. 大孔树脂修饰固定化脂肪酶催化合成L-薄荷醇酯[J]. 高校化学工程学报,2018,32(5):1134−1139. [LI X Y, ZHOU H Y, ZHOU H, et al. Synthesis of L-menthol oleate catalyzed by lipase immobilized on modified macroporous resins[J]. Journal of Chemical Engineering of Chinese Universities,2018,32(5):1134−1139.] doi: 10.3969/j.issn.1003-9015.2018.05.019 LI X Y, ZHOU H Y, ZHOU H, et al. Synthesis of L-menthol oleate catalyzed by lipase immobilized on modified macroporous resins[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(5): 1134−1139. doi: 10.3969/j.issn.1003-9015.2018.05.019
[39] GUO H, LEI B, YU J, et al. Immobilization of lipase by dialdehyde cellulose crosslinked magnetic nanoparticles[J]. International Journal of Biological Macromolecules,2021,185:287−296. doi: 10.1016/j.ijbiomac.2021.06.073
[40] CAO X, XU H, LI F, et al. One-step direct transesterification of wet yeast for biodiesel production catalyzed by magnetic nanoparticle-immobilized lipase[J]. Renewable Energy,2021,171:11−21. doi: 10.1016/j.renene.2021.02.065
[41] 周晓彤, 许俊洋, 姜艳军, 等. 铈基介孔金属有机骨架固定化酶的构建及催化性能[J]. 化学通报,2023,86(9):1103−1111. [ZHOU X T, XU J Y, JIANG Y J, et al. Construction and catalytic performance of cerium-based mesoporous MOF immobilized enzymes[J]. Chemistry,2023,86(9):1103−1111.] ZHOU X T, XU J Y, JIANG Y J, et al. Construction and catalytic performance of cerium-based mesoporous MOF immobilized enzymes[J]. Chemistry, 2023, 86(9): 1103−1111.
[42] LI C, ZHANG G, LIU N, et al. Preparation and properties of Rhizopus oryzae lipase immobilized using an adsorption-crosslinking method[J]. International Journal of Food Properties,2016,19(8):1776−1785. doi: 10.1080/10942912.2015.1107732
[43] LIU X, WU J, YANG S, et al. Carboxy-functionalized covalent organic framework as a carrier for lipase immobilization and its application in inhibitors screening[J]. Applied Biochemistry and Biotechnology,2024,196:2024−4037.
[44] SUO H, GENG H, ZHANG L, et al. Covalent immobilization of lipase on an ionic liquid-functionalized magnetic Cu-based metal–organic framework with boosted catalytic performance in flavor ester synthesis[J]. Journal of Materials Chemistry B,2023,11(6):1302−1311. doi: 10.1039/D2TB02246J
[45] YADAV G D, VARGHESE S. Enhancing activity by supercritical CO2 mediated immobilization of lipase on mesocellular foam in preparation of hexyl laurate[J]. Applied Biochemistry and Biotechnology,2020,190(2):686−702. doi: 10.1007/s12010-019-03098-8
[46] 陈林林, 王玲, 杨茜瑶, 等. 非水相脂肪酶催化合成阿魏酸香茅醇酯[J]. 化学研究与应用,2023,35(6):1307−1315. [CHEN L L, WANG L, YANG X Y, et al. Lipase catalyzed synthesisofcitronellol ferulate in non-aqueous system[J]. Chemical Research and Application,2023,35(6):1307−1315.] doi: 10.3969/j.issn.1004-1656.2023.06.003 CHEN L L, WANG L, YANG X Y, et al. Lipase catalyzed synthesisofcitronellol ferulate in non-aqueous system[J]. Chemical Research and Application, 2023, 35(6): 1307−1315. doi: 10.3969/j.issn.1004-1656.2023.06.003
[47] SOSE M T, BANSODE S R, RATHOD V K. Solvent free lipase catalyzed synthesis of butyl caprylate[J]. Journal of Chemical Sciences,2017,129:1755−1760. doi: 10.1007/s12039-017-1391-2
[48] 王舒舒, 王俞涵, 杨旭, 等. 磁性壳聚糖纳米复合材料固定化褶皱假丝酵母脂肪酶催化合成木质甾醇酯[J]. 精细化工,2023,40(1):124−129. [WANG S S, WANG Y H, YANG X, et al. Synthesis of lignosterol esters catalyzed by Candida rugosa lipase immobilized on magnetic nanocomposites[J]. Fine Chemicals,2023,40(1):124−129.] WANG S S, WANG Y H, YANG X, et al. Synthesis of lignosterol esters catalyzed by Candida rugosa lipase immobilized on magnetic nanocomposites[J]. Fine Chemicals, 2023, 40(1): 124−129.





 下载:
下载:



 下载:
下载:



