Effect of Electric Field-assisted Washing on the Dissolution of Components and Gel Properties of Silver Carp Surimi
-
摘要: 本文研究了电场对鲢鱼糜组分溶出效果及凝胶性能的影响,并采用响应面分析法以优化电场辅助的节水漂洗工艺。结果表明:利用电场辅助漂洗可有效促进鱼糜脂肪、灰分及水溶性蛋白的溶出,使盐溶性蛋白得以富集,并通过抑制蛋白酶活性减缓了凝胶劣化,同时激活了转谷氨酰胺酶(transglutaminase,TGase),提高鱼糜凝胶强度。电场辅助节水漂洗最优工艺参数为:电场电压56 V、漂洗鱼水质量比1:3、漂洗时间3 min,在此条件下鱼糜实际盐溶性蛋白含量达到8.67 g/100 g鱼糜,蛋白酶活性为6.48 U/mg pro。相较于传统漂洗方式,该漂洗工艺显著(P<0.05)提高了鱼糜凝胶的白度、弹性、凝胶强度及持水性等性能,并使漂洗用水量减少40%,为电场技术在鱼糜节水漂洗中的应用提供了新思路。Abstract: In this study, the effect of electric field on the component dissolution and gel properties of silver carp surimi was investigated. The optimal process for electric field-assisted water-saving washing of surimi was obtained through response surface experimental design. The results showed that the electric field technology could effectively promote the solubilization of fat, ash and water-soluble proteins and the enrichment of salt-soluble proteins in surimi. Moreover, this technology significantly reduced gel degradation and increased the gel strength by inhibiting protease activity and activating transglutaminase (TGase). The optimal process parameters for electric field-assisted washing of surimi were as follows: Electric field voltage 56 V, fish-water mass ratio 1:3, washing time 3 min. The salt-soluble protein content was 8.67 g/100 g surimi, while the protease activity was 6.48 U/mg protein under these conditions. Meanwhile, this technology significantly increased the whiteness, elasticity, gel strength and water holding capacity of surimi gels (P<0.05), while reducing water consumption by 40%. This provides a new idea for the application of electric field in water-saving washing of surimi.
-
Keywords:
- electric field /
- silver carp surimi /
- water-saving washing /
- dissolution /
- endogenous enzyme /
- gel properties
-
鲢鱼(Hypophthalmichthys molitrix),作为我国第二大淡水鱼种,因其产量大、价格低廉且白度高,已成为淡水鱼糜及其制品的重要原料[1]。漂洗是鱼糜生产重要的工艺步骤,旨在去除鱼肉中的水溶性蛋白、脂肪、色素等组分,改善鱼糜的色泽和凝胶性能,并提高其贮藏稳定性[2−3]。传统工业生产1 t鱼糜消耗水量高达20~25 t,大量漂洗废水的处理也极大地增加了鱼糜生产成本。为降低漂洗用水量,有学者研究发现可通过弱碱盐溶液及钙盐溶液单次漂洗[4]、羧甲基壳聚糖与复合盐单次漂洗[5]来减少漂洗次数以达到节水目的,也有学者利用臭氧水漂洗[6−8]以改善鱼糜凝胶性能。然而漂洗水中大量的金属离子增加了废水处理成本,臭氧处理时间若控制不当,也将增大鱼糜中蛋白质和脂肪的氧化程度[9−11],不利于鱼糜凝胶的形成及风味。电场技术具有设备简单、效率高、无污染等特点,可应用于食品保鲜[12−13]、冷冻[14]、干燥[15]、解冻[16]等加工环节。目前关于外加电场对鱼糜漂洗环节组分变化及其凝胶特性的影响鲜有报道。有学者指出不同强度电场作用将不同程度地改变肌原纤维蛋白构象,影响其溶解度、乳化性等理化特性[17];另有学者研究发现一定的电场处理可显著改变酶的空间结构以影响其活性[18−19]。此外,不同大小、形状、结构的带电颗粒在电场中因所受电场力不同而产生不同的迁移行为[20],可实现组分的分离或富集,推测外电场会影响鱼糜漂洗过程中组分的溶出,进而影响其凝胶性能,然而目前尚未见相关报道。
本实验以鲢鱼为原料制作鱼糜,研究电场电压、漂洗鱼水质量比、漂洗时间对鲢鱼糜组分溶出的影响,结合鱼糜凝胶性能的变化,通过分析在电场作用下鱼糜漂洗过程中组分溶出效果与凝胶性能的相关性,探讨电场技术用于鱼糜漂洗的可行性,为鲢鱼糜节水漂洗工艺提供一种新思路。
1. 材料与方法
1.1 材料与仪器
新鲜白鲢 购于湖北武汉华中农业大学市场,约2.0~2.5 kg/尾;DL-二硫苏糖醇(DL-diththreioitol,DTT)、N,N-二甲基酪蛋白(N,N-dimethylcasein,DMC)、单丹磺酰尸胺(monodansylcadaverine,MDC) Sigma-Aldrich(美国)公司;其余试剂均为分析纯,国药集团化学试剂有限公司。
DYY-6C型双稳定时电泳仪电源(6~600 V) 北京六一生物科技有限公司;Avanti J-2型高速冷冻离心机 美国Beckman Coulter公司;T80高速分散均质机 德国IKT公司;UV-1750型紫外可见分光光度计 日本岛津公司;F-4600型荧光光度计 日本日立公司;CR-400型色差仪 日本柯尼卡-美能达公司;K600(3205)型食品调理机 德国博朗电器公司;TA-XT Plus质构仪 美国Stable Micro System公司。
1.2 实验方法
1.2.1 鲢鱼糜的制备
取鲜活鲢鱼,去头、尾、内脏后立即覆冰运至实验室,利用采肉机分离鱼皮、骨刺,获得鱼肉。鱼肉在冰浴条件下进行不同方式的漂洗,漂洗过程采用玻璃棒不断搅拌,并保持温度在10 ℃以下。漂洗后的鱼肉静置10 min,经200目纱布过滤浆液,离心脱水至鱼糜水分含量为76%~78%,置于4 ℃冰箱备用。
1.2.2 电场辅助漂洗装置的搭建
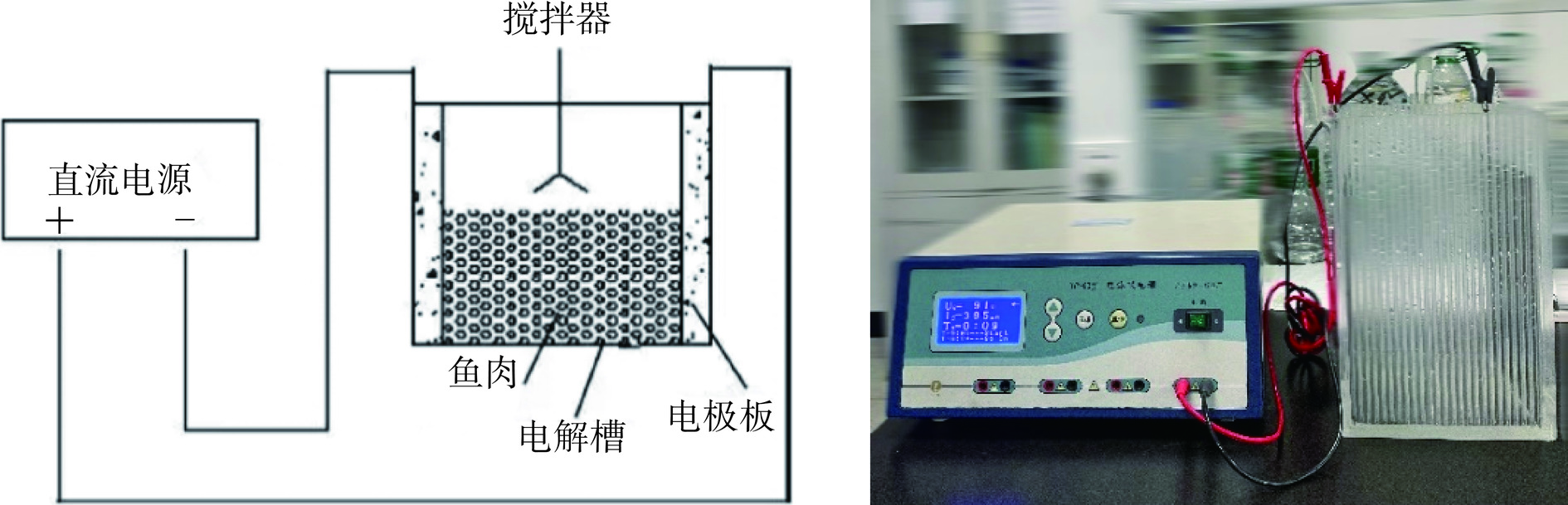
本课题所用电场辅助漂洗装置由团队定制搭建,如图1所示。该容器是由透明的亚克力板制成,电极板材质分别为阳极-钌铱钛、阴极-钛,尺寸150 mm×200 mm×1 mm,两电极之间的距离为150 mm。实验时两电极板卡入容器两侧槽中,通过电线夹分别接入电源。
1.2.3 鲢鱼糜电场辅助漂洗工艺的单因素实验
1.2.3.1 电场电压对鱼糜漂洗过程中组分溶出效果的影响
取新鲜鱼肉200 g放入漂洗容器,按1:3的质量比加入600 g清水,接通电源,分别调节电压为30、60、90、120、150 V,漂洗时间为9 min,其余步骤同1.2.1节,测定鱼糜基本组分含量及内源酶活性。以鱼糜未漂洗组(CG)及一次清水漂洗组(0 V)为对照组。
1.2.3.2 漂洗鱼水质量比对鱼糜漂洗过程中组分溶出效果的影响
在电场电压为90 V,漂洗时间为9 min的条件下,分别按照1:1、1:2、1:3、1:4、1:5、1:6的质量比加入鱼肉和清水,其余步骤同1.2.1节,测定鱼糜基本组分含量及内源酶活性。
1.2.3.3 漂洗时间对鱼糜漂洗过程中组分溶出效果的影响
在电场电压为90 V,漂洗鱼水质量比为1:3的条件下,分别漂洗3、6、9、12、15 min,其余步骤同1.2.1节,测定鱼糜基本组分含量及内源酶活性。
1.2.4 鲢鱼糜电场辅助漂洗工艺响应面试验设计
根据单因素实验结果,采用Box-Behnken组合方法设计电场电压(A)、漂洗鱼水质量比(B)和漂洗时间(C)3因素3水平的响应面分析试验,以鱼糜的盐溶性蛋白含量Y1(g/100 g鱼糜)及蛋白酶活性Y2(U/mg pro)分别为响应值,以优化电场辅助漂洗鲢鱼糜工艺,试验因素与水平设计见表1。
表 1 响应面试验因素与水平Table 1. Factors and levels used for response surface design因素 水平 −1 0 1 A电场电压(V) 30 60 90 B漂洗鱼水质量比 1:2 1:3 1:4 C漂洗时间(min) 3 6 9 1.2.5 鱼糜基本组分含量的测定
鱼糜水分的测定参照GB/T 5009.3-2016《食品安全国家标准 食品中水分的测定》;粗脂肪的测定参照GB 5009.6-2016《食品安全国家标准 食品中脂肪的测定》;灰分的测定参照GB/T 5009.4-2016《食品安全国家标准 食品中灰分的测定》;水溶性、盐溶性蛋白的提取参考Wang等[21]的方法,均采用Lowry法[22]测定蛋白质浓度。
1.2.6 鱼糜内源酶活性的测定
1.2.6.1 鱼糜内源性转谷氨酰胺酶活性的测定
TGase的提取参照严文莉[23]的方法。取鱼糜样品3 g,加入3倍体积的提取缓冲液(60 mmol/L Tris、40 mmol/L NaCl、5 mmol/L EDTA、2 mmol/L DTT、pH7.5),在8000 r/min条件下均质1 min,匀浆液离心15 min(12000 r/min,4 ℃)后取上清液得粗酶液,采用Lowry法[22]测定蛋白质浓度。TGase活性的测定参照Worratao和Yongsawatdigul[24]的方法,单位酶活性定义为:在37 ℃下,1 min内1 mg TGase催化MDC交联到DMC的量。
1.2.6.2 鱼糜蛋白酶活性的测定
参照刘茹等[25]的方法。取鱼糜样品3 g,加入等体积的磷酸盐缓冲液(pH7.0),在8000 r/min条件下均质15 s后于4 ℃下浸提1 h,匀浆液离心20 min(10000 r/min,4 ℃)后取上清液为粗酶液,采用Lowry法[22]测定蛋白质浓度。取1.0 mL酶液,在70 ℃预热2~3 min,加1.0 mL 2%酪蛋白溶液(pH7.5),保温30 min,加入2 mL 0.4 mol/L三氯乙酸终止反应,静置10 min后过滤。取滤液1.0 mL,加入5 mL 0.4 mol/L碳酸钠和1.0 mL福林酚试剂,在40 ℃发色20 min,冷却至室温,于680 nm处测定吸光值。单位酶活性定义为:在70 ℃下,1 min内1 mg蛋白酶催化酪蛋白水解成酪氨酸的量。
1.2.7 鱼糜凝胶样品的制备
参照Zhang等[26]的方法制备鱼糜凝胶样品。取鱼糜样品200 g置入调理机中,空斩1 min,添加冰冷水将鱼糜水分含量调至80%,继续斩拌1 min,添加鱼糜质量2.5% NaCl继续斩拌3 min。将斩拌后的鱼糜溶胶充入直径2 cm肠衣内,两端封口处理后进行二段式加热(40 ℃加热60 min,后于90 ℃加热30 min),加热完成后立即流水冷却,凝胶样品于4 ℃冷藏过夜备用。
1.2.8 鱼糜凝胶白度值的测定
参照Debusca等[27]的方法。鱼糜凝胶剥去肠衣后切成5 mm的薄片,采用色差仪测定样品的L*、a*、b*值,白度(whiteness,W)按下式计算:
W=100−√(100−L*)2+a*2+b*2 式中:L*表示亮度值;a*为红绿值;b*为黄蓝值。
1.2.9 鱼糜凝胶TPA与凝胶强度的测定
参照卢彦轩等[28]的方法。鱼糜凝胶于室温平衡30 min,切成高度为20 mm的圆柱体,采用TA-XT Plus质构仪进行测定。TPA测定参数:探头型号为P/36R,压缩比为40%,触发力为5.0 g,测前速度为5 mm/s,测试速度为1 mm/s,测后速度为5 mm/s。凝胶强度测定参数:探头型号为P/0.25S,压缩距离为15 mm,触发力为5.0 g,速度参数设置与TPA测定的一致。
1.2.10 鱼糜凝胶持水性的测定
参照张晓慧等[29]的方法。鱼糜凝胶剥去肠衣后切成厚度约5 mm的薄片,准确称其质量m0,用2层滤纸完全包裹样品置于离心管底部,5000 r/min离心15 min,立即取出样品再次称其质量m1。持水性(water holding capacity,WHC)按下式计算:
WHC(%)=m1m0×100 式中:m0为样品的质量,g;m1为离心后样品的质量,g。
1.3 数据处理
所有实验均进行三次重复,每个指标设3个平行,实验结果以平均值±标准偏差表示。采用Origin 2018软件作图,SPSS Statistics 26.0软件中Duncan分析进行显著性检验,P<0.05表示数据间差异显著。
2. 结果与分析
2.1 单因素实验结果分析
2.1.1 电场电压对鱼糜漂洗过程中组分溶出效果的影响
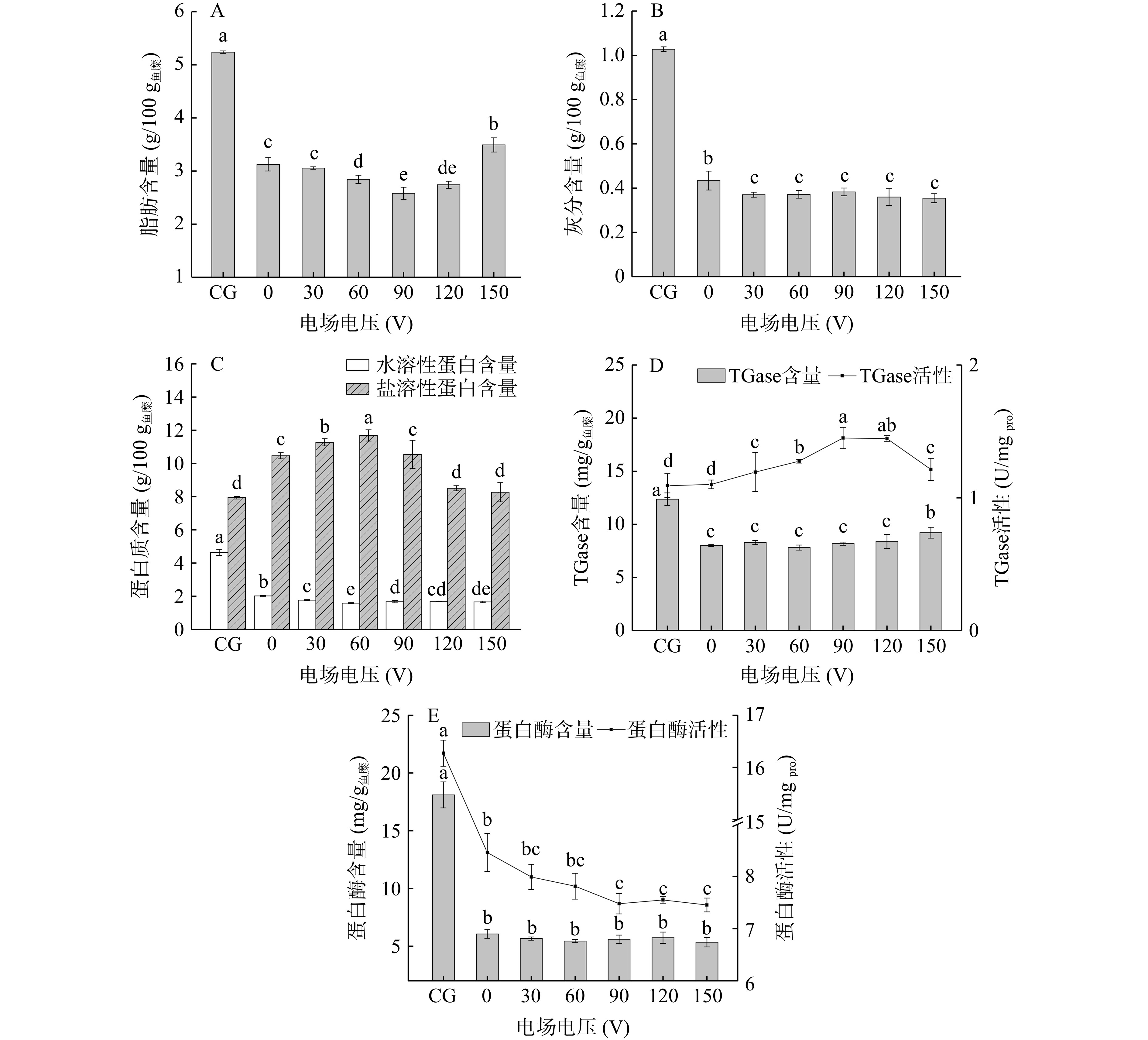
不同电压辅助漂洗所得鱼糜的基本组成如图2所示。漂洗可降低鱼糜中脂肪含量,且鱼糜脂肪含量随电压的升高而显著下降(P<0.05),当漂洗电压为90 V时,鱼糜脂肪含量较未漂洗降低了50.73%(图2A),说明电场作用可促进鱼糜脂肪的溶出。郭彦玲等[30]研究发现直流电场可促进蛋白乳化液中油滴的聚集,推测电场作用下鱼糜溶出的脂肪发生聚集更易被去除,从而降低了鱼糜脂肪含量。随着漂洗电压持续升高至90 V以上,鱼糜脂肪含量又呈上升趋势,推测可能是由于过高的电压造成漂洗液中聚集的油滴破碎,溶解速度提高,再次附着于鱼糜,最终导致鱼糜中脂肪含量的增加。朱忠辉[31]研究电场作用下液滴的变形时发现,当液滴所受电场力大于界面张力和内外压强差的合力作用时,液滴将会在电场力的作用下发生拉伸变形,且变形量随场强的增大而增大,当电场强度超出破碎的临界电场时,液滴破碎,李典[32]、范玉玲[33]也曾报道相似结论。
在电场的作用下鱼糜漂洗过程中灰分的溶出量显著高于无外加电场漂洗(P<0.05),但在不同电压条件下鱼糜中灰分含量无显著差异(P>0.05)(图2B)。鱼肌肉细胞膜的内外存在着大量的K+、Na+、Ca2+、Cl−等。李倩南[34]研究指出,外电场作用后细胞跨膜电压的最大值随着外加电场频率的增加而减小,膜一侧离子浓度相对变化量随外加电场幅值的增大而增大。因此,当细胞受到外加电场的作用时,将引起细胞跨膜电位差的改变,从而影响细胞膜对不同离子的通透性,离子跨细胞膜迁移,这可能是其促进灰分溶出的主要原因。
经电场辅助漂洗后,鱼糜中水溶性蛋白含量显著降低(P<0.05),而盐溶性蛋白含量显著提高(P<0.05),均于60 V时分别达到最小值(1.58 g/100 g鱼糜)和最大值(11.69 g/100 g鱼糜)(图2C),这说明电场可促进水溶性蛋白的溶出及盐溶性蛋白质的富集。有报道指出,细胞膜是外加电场作用的靶部位,外加电场可改变细胞膜内外场的分布、引起跨膜电位的改变[35]。推测随着电场电压的增大,诱导的偶极矩增大,导致鱼肌肉细胞膜对于离子和大分子的通透性增加,胞内肌浆蛋白、肌红蛋白等水溶性蛋白的溶出速度加快,经过漂洗后被除去。而当电场电压超过60 V,鱼糜盐溶性蛋白含量呈现显著下降的趋势(P<0.05),说明漂洗过程中过高的电场强度将导致肌原纤维蛋白的溶出。Huang等[17]研究指出,电场作用下鲶鱼肌原纤维蛋白的溶解度随着施加电压的增加而增大,这是由于在液体介质中,加速的带电粒子获得足够的能量以激发水分子,从而导致蛋白质-水的相互作用增强,溶解度增加。
如图2D所示,鱼糜TGase含量经漂洗后显著降低(P<0.05),在电场电压低于120 V时,电场处理对TGase的溶出无显著影响(P>0.05),而其活性随电压的升高显著增加(P<0.05),于电压为90 V时达到最大值(1.45 U/mg pro)。当电压持续增至150 V,TGase活性显著降低(P<0.05)。酶的催化活性高度依赖其活性中心的三维构象,推测低于120 V的电场作用下,维持TGase酶的部分次级键被破坏,使TGase分子构象改变,位于活性中心的半胱氨酸暴露,易与底物结合,进而增加其活性[36−39]。而随着电压的持续增加,较强的电场作用可能促进TGase分子内暴露基团间的相互作用,从而减弱了酶分子与底物的亲和力,导致酶活力下降[40]。
鱼糜中蛋白酶含量及酶活性经漂洗(无外加电场)后均显著降低(P<0.05),而采用电场辅助漂洗鱼糜的蛋白酶活性随电压的升高而显著下降(P<0.05)(图2E)。可见,电场对酶结构的影响与酶的种类有关,不同酶对电场的敏感程度因其结构和活性位点的不同而异[41],在较高的电压下通过介质的电流强度增加,水解离生成·H、·OH等活性自由基[42],可能改变蛋白酶的表面疏水性、羰基及巯基含量,从而降低内源性蛋白酶活性。综合各项指标结果及操作安全、经济和实用性考虑,选择电场电压为30、60、90 V进行响应面法优化试验。
2.1.2 鱼水质量比对鱼糜漂洗过程中组分溶出效果的影响
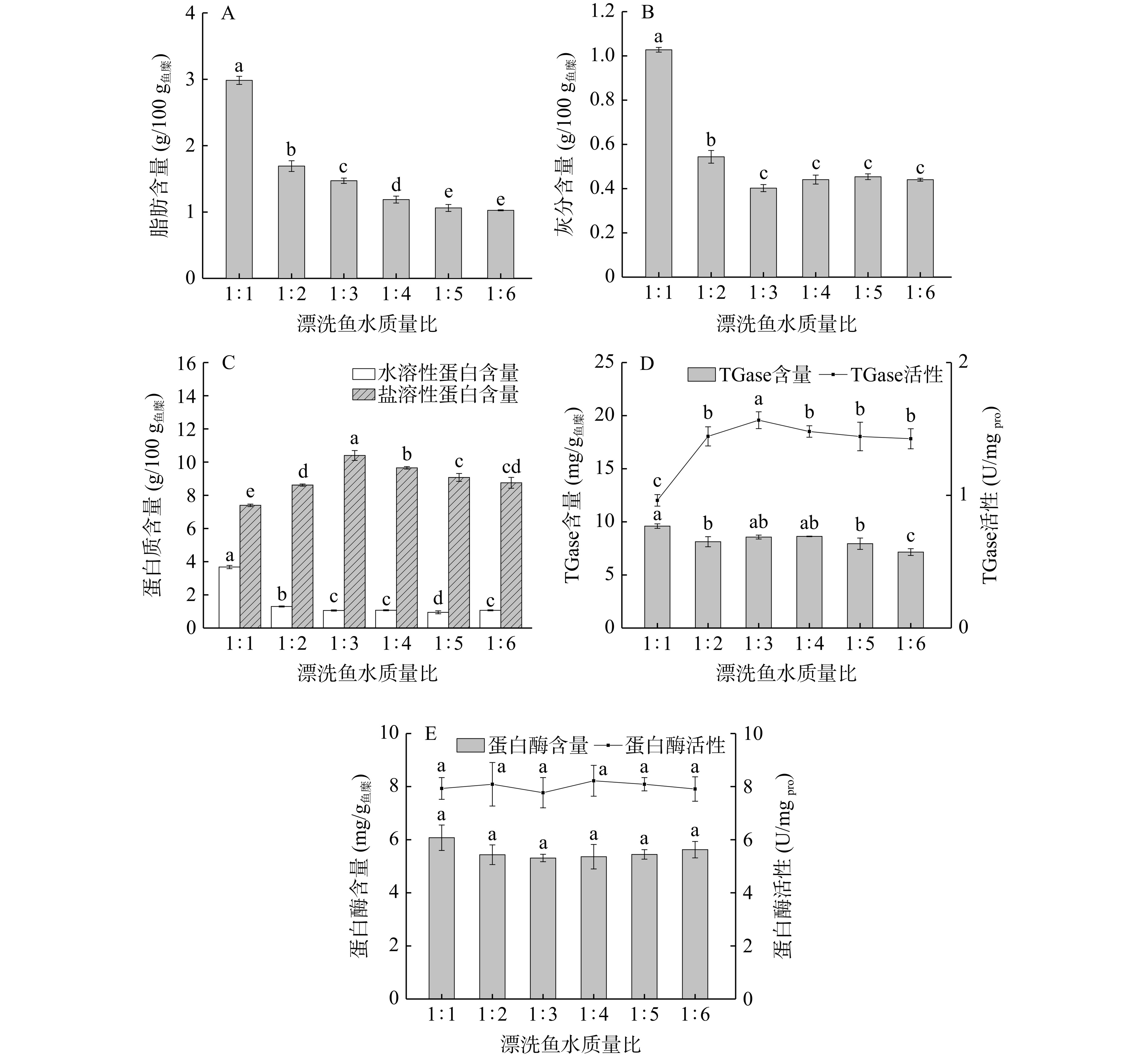
不同漂洗鱼水质量比下鱼糜的基本组成如图3所示。随着漂洗用水比例的增加,鱼糜的脂肪和水溶性蛋白质含量显著下降(P<0.05),灰分含量显著下降(P<0.05)随后趋于稳定,说明在电场作用下,增加漂洗用水量可以促进脂肪和灰分的溶出。而盐溶性蛋白含量随着漂洗用水比例的增加呈先上升后下降的趋势,在鱼水质量比为1:3时达最大值(10.40 g/100 g鱼糜)(图3C),说明漂洗用水量超过鱼糜质量的3倍时,促进水溶性蛋白溶出的同时也将导致肌原纤维蛋白的损失。
鲢鱼糜内源性TGase含量在漂洗用水量超过鱼糜质量4倍后显著下降(P<0.05),而其活性呈先上升后下降的趋势,鱼水质量比为1:3时的鱼糜中TGase活力显著高于其他处理组(P<0.05)(图3D),推测增加漂洗用水量可提升鱼糜颗粒在水中的分散性,从而增大鱼糜与电场的接触面积,电场效应更均匀、有效地促进酶分子链的伸展,TGase暴露出更多活性交联位点,增强了TGase催化效率。由图3E可知,漂洗用水量对鱼糜中蛋白酶含量及其活力无显著影响(P>0.05)。综合各项指标结果,选择漂洗鱼水质量比为1:2、1:3、1:4进行响应面法优化试验。
2.1.3 漂洗时间对鱼糜漂洗过程中组分溶出效果的影响
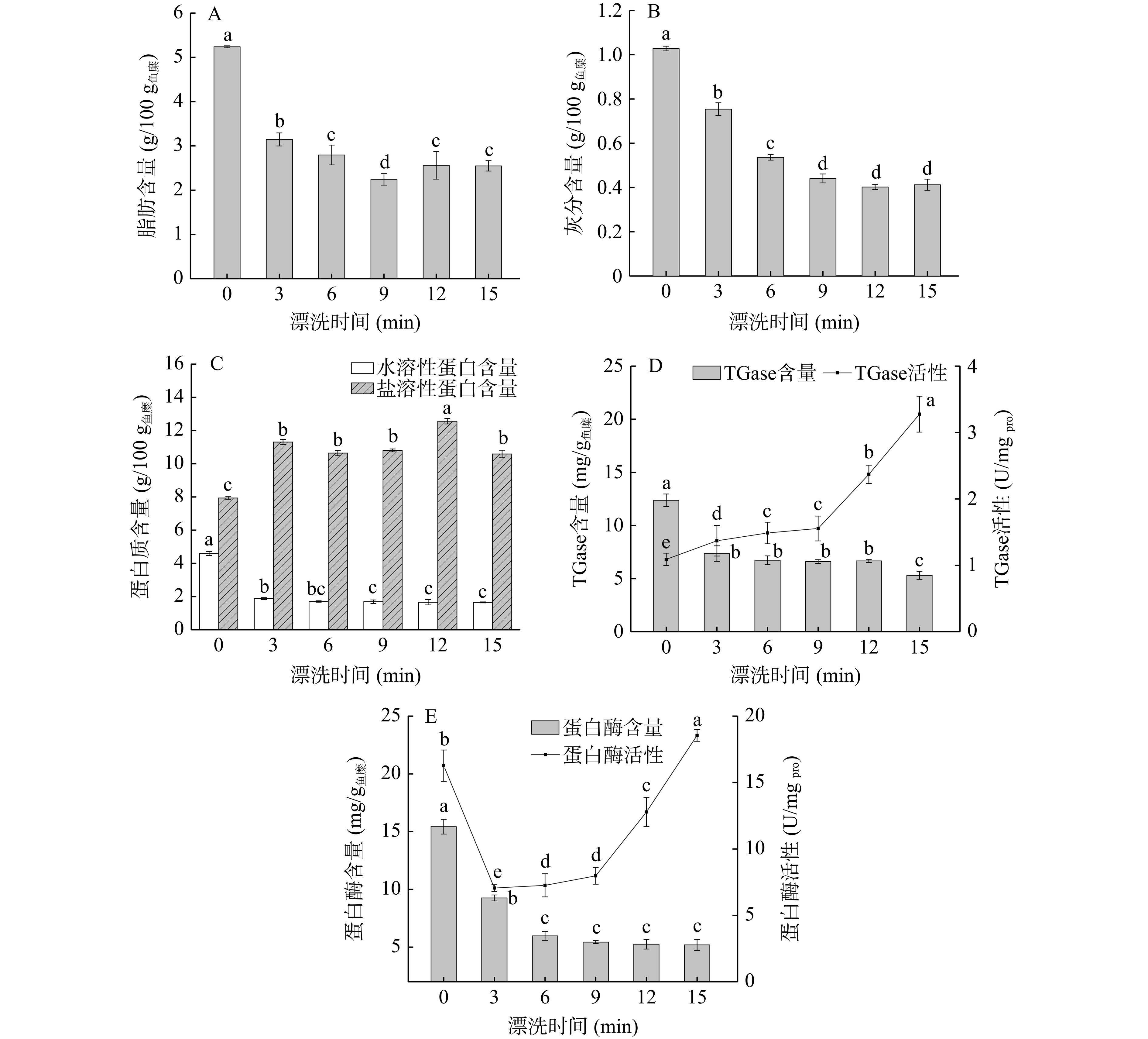
图4显示出了漂洗过程中鱼糜的基本组分及内源酶活性的变化。当漂洗时间为0~9 min时,随着漂洗时间的延长,鱼糜的脂肪、灰分和水溶性蛋白含量均先显著下降(P<0.05)后趋于平缓,而盐溶性蛋白含量随着漂洗时间的延长先显著升高(P<0.05),在15 min时又显著降低(P<0.05),可能是由于电场作用时间过长将破坏维持肌原纤维蛋白空间结构的非共价键作用力,如疏水相互作用和氢键,导致蛋白分子内部的疏水基团暴露,同时通过非共价键作用力重新形成分子聚集体[43−44]。此外,电场处理过程中可能伴随着空气电离产生臭氧,外加电场的存在可提高臭氧在水中的溶解度[45−46],肌原纤维蛋白的巯基可能在臭氧的存在下发生氧化,诱导分子内、分子间二硫键的形成,蛋白质发生聚集或变性[47−48]。Amiri等[16]研究也指出一定时间电场作用后,肌原纤维蛋白总巯基含量下降。
延长漂洗时间后鱼糜TGase含量显著降低(P<0.05),而其活性显著增大(P<0.05)(图4D),表明电场对酶蛋白构象的影响具有时间累积效应。Durham等[49]研究指出,应用电场处理可提高纤维素酶活性,且处理中期纤维素的水解反应速率显著高于初期(P<0.05)。因此,推测延长电场作用时间将导致鱼糜TGase肽链的伸展及活性位点的暴露程度增大,从而促进其与底物的接触。如图4E,当漂洗时间为0~6 min时,鱼糜蛋白酶溶出量显著增大(P<0.05);鱼糜蛋白酶活性在漂洗时间为3 min时显著低于其他试验组(P<0.05),而随着电场辅助漂洗时间的延长呈上升趋势。Fried等[50]报道指出,电场可直接作用于酶的氨基酸残基,引起酶构象的变化,进而影响酶活。推测延长电场作用时间促使蛋白酶构象变化,进而提高了其催化活性,对鱼糜凝胶不利。综合各项指标结果及生产成本、效率考虑,选择漂洗时间为3、6、9 min进行响应面法优化试验。
2.2 响应面优化试验结果分析
2.2.1 Box-Behnken响应面设计及结果
根据单因素实验结果,以电场电压(A)、漂洗鱼水质量比(B)和漂洗时间(C)为三因素,以鱼糜盐溶性蛋白含量(Y1)及蛋白酶活性(Y2)为响应值,采用Box-Behnken设计试验,试验因素水平及试验结果见表2。
表 2 响应面试验设计及结果Table 2. Experimental design and results for response surface analysis实验号 A电场
电压(V)B漂洗鱼水
质量比C漂洗时间
(min)盐溶性蛋白含量
Y1(g/100 g鱼糜)蛋白酶活性
Y2(U/mg pro)1 −1 −1 0 7.83 10.74 2 1 0 1 7.01 9.17 3 −1 0 1 7.66 10.89 4 1 0 −1 7.82 8.10 5 0 0 0 8.76 6.90 6 0 0 0 8.71 6.61 7 0 1 1 7.25 7.66 8 0 0 0 8.76 6.89 9 0 0 0 8.45 6.69 10 0 0 0 8.24 6.85 11 −1 0 −1 8.20 9.46 12 0 −1 −1 8.04 6.61 13 −1 1 0 7.47 9.87 14 1 1 0 7.29 9.46 15 0 −1 1 6.87 7.75 16 1 −1 0 6.34 8.95 17 0 1 −1 8.94 6.62 2.2.2 回归拟合及方差分析
利用Design Expert软件对表2结果进行二次回归拟合,可得鱼糜盐溶性蛋白(Y1)、蛋白酶活性(Y2)与电场电压(A)、漂洗鱼水质量比(B)和漂洗时间(C)三因素间的回归方程分别为:
Y1=1.215+0.057A+3.607B+0.248C+0.011AB−0.001AC−0.045BC−0.001A2−0.627B2−0.02C2
Y2=22.41−0.398A−2.869B+0.263C+0.012AB−0.001AC−0.008BC+0.003A2+0.361B2+0.001C2
方差分析和显著性检验结果见表3。
表 3 响应面试验方差分析Table 3. Analysis of variance of response surface regression model响应值 方差来源 平方和 自由度 均方 F值 P值 显著性 盐溶性
蛋白含量模型 8.44 9 0.94 10.91 0.0024 ** A电场电压 0.90 1 0.90 10.47 0.0143 * B漂洗鱼水
质量比0.44 1 0.44 5.09 0.0587 C漂洗时间 2.21 1 2.21 25.72 0.0014 ** AB 0.43 1 0.43 5.01 0.0602 AC 0.02 1 0.02 0.2261 0.6489 BC 0.07 1 0.07 0.8305 0.3924 A2 2.22 1 2.22 25.80 0.0014 ** B2 1.66 1 1.66 19.26 0.0032 ** C2 0.14 1 0.14 1.63 0.2408 残差 0.60 7 0.09 失拟项 0.40 3 0.13 2.55 0.1943 纯误差 0.21 4 0.05 总离差 9.04 16 R2=0.9334 ,R2Adj=0.8479 ,变异系数=3.73% 蛋白酶
活性模型 36.55 9 4.06 149.13 <0.0001 ** A电场电压 3.48 1 3.48 127.97 <0.0001 ** B漂洗鱼水
质量比0.03 1 0.03 0.95 0.3622 C漂洗时间 2.74 1 2.74 100.46 <0.0001 ** AB 0.48 1 0.48 17.54 0.0041 ** AC 0.03 0.03 1.14 0.3219 BC 0.00 1 0.00 0.08 0.7857 A2 28.61 1 28.61 1050.69 <0.0001 ** B2 0.55 1 0.55 20.18 0.0028 ** C2 0.00 1 0.00 0.02 0.9028 残差 0.19 7 0.03 失拟项 0.12 3 0.04 2.33 0.2157 纯误差 0.07 4 0.02 总和 36.74 16 R2=0.9948 ,R2Adj=0.9881 ,变异系数=2.02% 注:*显著(P<0.05);**极显著(P<0.01)。 由表3可知,Y1和Y2回归模型的P值均小于0.01,模型显著,方程的拟合度较高。其中,对鱼糜盐溶性蛋白含量的影响显著性大小顺序依次为:漂洗时间>电场电压>鱼水质量比,三个因素之间的两两交互作用对鱼糜盐溶性蛋白含量的影响均不显著(P>0.05)。在Y2回归模型中,A、C、AB、A2、B2对鱼糜蛋白酶活的影响达到极显著水平(P<0.01)。
2.2.3 响应面优化试验验证结果分析
回归模型经软件Design Expert 13分析,选择盐溶性蛋白Maximize、蛋白酶活性Minimize模式对鱼糜漂洗工艺进行优化,得出最优漂洗工艺为:电场电压56 V,漂洗鱼水质量比1:3,漂洗时间3 min,理论上此漂洗条件所得鱼糜盐溶性蛋白含量为8.94 g/100 g鱼糜,蛋白酶活性为6.33 U/mg pro。在此条件下实施平行实验,此时鱼糜盐溶性蛋白含量为8.67 g/100 g鱼糜,蛋白酶活性为6.48 U/mg pro,与预测值接近,可作为最优工艺参数。
2.3 电场辅助漂洗工艺对鲢鱼糜凝胶品质的影响
不同漂洗工艺所得鱼糜凝胶的白度值、质构性能及持水性如表4。结果表明,相较于传统漂洗方式,鱼糜经电场辅助漂洗工艺漂洗后,鱼糜凝胶具有更高的白度值。根据单因素实验中电场对鱼糜漂洗过程中各组分的溶出效果可知,电场作用促进鱼糜中水溶性蛋白(包括肌红蛋白、血红蛋白)的溶出,推测这是鱼糜凝胶的色泽得以改善的主要原因。相似地,Sinthusamran等[51]曾报道超声辅助漂洗因降低鱼糜中肌红蛋白含量而提高了鱼糜凝胶的白度值。电场辅助漂洗也显著提高了鱼糜凝胶的硬度、弹性、咀嚼性、凝胶强度和持水性(P<0.05),这是由于:电场辅助漂洗工艺可有效去除鱼肉中的大部分水溶性蛋白、脂肪,从而有利于盐溶性蛋白相对含量的提高,并一定程度激活了转谷氨酰胺酶,有利于蛋白质之间的共价交联[52],同时钝化了鱼糜中残留蛋白酶的活性,减缓蛋白酶对肌原纤维蛋白的水解,在一定程度上也提升了鱼糜的凝胶性能和持水性[53]。
表 4 漂洗工艺对鱼糜凝胶白度值、质构性能及持水性的影响Table 4. Effects of washing methods on the whiteness, textural properties and water holding capacity of surimi gels漂洗方式 白度值 硬度(g) 弹性 内聚性 咀嚼性(g) 凝胶强度(g·cm) 持水性(%) C 79.52±0.65b 2363.83±18.87b 0.87±0.00b 0.64±0.00a 1337.40±30.05b 293.57±29.79b 76.48±2.97b EF 82.19±0.36a 2459.04±24.36a 0.89±0.02a 0.66±0.01a 1450.33±67.46a 315.44±7.36a 79.99±5.42a 注:C:表示工业生产中鱼糜传统漂洗方式,鱼糜经两次清水漂洗,漂洗鱼水质量比1:5,漂洗时间9 min;EF:表示鱼糜经一次电场辅助最优漂洗工艺(电场电压56 V,漂洗鱼水质量比1:3,漂洗时间3 min)、一次清水漂洗(漂洗鱼水质量比1:3,漂洗时间3 min)。不同小写字母代表样品之间差异显著(P<0.05)。 3. 结论
电场辅助漂洗可以有效促进鱼糜脂肪、灰分及水溶性蛋白的溶出,使盐溶性蛋白富集;在电压低于120 V时,电场还能提高鱼糜TGase活性,而抑制其蛋白酶活性,有利于促进鱼糜凝胶形成过程中盐溶性蛋白的共价交联,并减缓蛋白酶诱导的蛋白水解,提高了鱼糜凝胶强度。外加电场的条件下,漂洗鱼水质量比和漂洗时间的变化均会显著影响鲢鱼糜组分溶出效果和内源性酶活性(P<0.05),进一步通过响应面优化确定出电场辅助漂洗的最优工艺参数:漂洗电压56 V,漂洗鱼水质量比1:3,漂洗时间3 min。相较于传统两次清水漂洗方式(漂洗鱼水质量比1:5),采用电场辅助漂洗工艺生产鱼糜可实现节水40%,并节省漂洗时间,所制备的鱼糜凝胶白度值、硬度、弹性、咀嚼性、凝胶强度及持水性均显著提高(P<0.05)。因此,电场辅助漂洗工艺有助于改善鱼糜的凝胶性能,可为鱼糜的节水生产提供参考,后续可开展电场辅助漂洗影响鱼糜蛋白质构象的具体研究,进一步阐明其改善鱼糜凝胶性能的机制。
-
表 1 响应面试验因素与水平
Table 1 Factors and levels used for response surface design
因素 水平 −1 0 1 A电场电压(V) 30 60 90 B漂洗鱼水质量比 1:2 1:3 1:4 C漂洗时间(min) 3 6 9 表 2 响应面试验设计及结果
Table 2 Experimental design and results for response surface analysis
实验号 A电场
电压(V)B漂洗鱼水
质量比C漂洗时间
(min)盐溶性蛋白含量
Y1(g/100 g鱼糜)蛋白酶活性
Y2(U/mg pro)1 −1 −1 0 7.83 10.74 2 1 0 1 7.01 9.17 3 −1 0 1 7.66 10.89 4 1 0 −1 7.82 8.10 5 0 0 0 8.76 6.90 6 0 0 0 8.71 6.61 7 0 1 1 7.25 7.66 8 0 0 0 8.76 6.89 9 0 0 0 8.45 6.69 10 0 0 0 8.24 6.85 11 −1 0 −1 8.20 9.46 12 0 −1 −1 8.04 6.61 13 −1 1 0 7.47 9.87 14 1 1 0 7.29 9.46 15 0 −1 1 6.87 7.75 16 1 −1 0 6.34 8.95 17 0 1 −1 8.94 6.62 表 3 响应面试验方差分析
Table 3 Analysis of variance of response surface regression model
响应值 方差来源 平方和 自由度 均方 F值 P值 显著性 盐溶性
蛋白含量模型 8.44 9 0.94 10.91 0.0024 ** A电场电压 0.90 1 0.90 10.47 0.0143 * B漂洗鱼水
质量比0.44 1 0.44 5.09 0.0587 C漂洗时间 2.21 1 2.21 25.72 0.0014 ** AB 0.43 1 0.43 5.01 0.0602 AC 0.02 1 0.02 0.2261 0.6489 BC 0.07 1 0.07 0.8305 0.3924 A2 2.22 1 2.22 25.80 0.0014 ** B2 1.66 1 1.66 19.26 0.0032 ** C2 0.14 1 0.14 1.63 0.2408 残差 0.60 7 0.09 失拟项 0.40 3 0.13 2.55 0.1943 纯误差 0.21 4 0.05 总离差 9.04 16 R2=0.9334 ,R2Adj=0.8479 ,变异系数=3.73% 蛋白酶
活性模型 36.55 9 4.06 149.13 <0.0001 ** A电场电压 3.48 1 3.48 127.97 <0.0001 ** B漂洗鱼水
质量比0.03 1 0.03 0.95 0.3622 C漂洗时间 2.74 1 2.74 100.46 <0.0001 ** AB 0.48 1 0.48 17.54 0.0041 ** AC 0.03 0.03 1.14 0.3219 BC 0.00 1 0.00 0.08 0.7857 A2 28.61 1 28.61 1050.69 <0.0001 ** B2 0.55 1 0.55 20.18 0.0028 ** C2 0.00 1 0.00 0.02 0.9028 残差 0.19 7 0.03 失拟项 0.12 3 0.04 2.33 0.2157 纯误差 0.07 4 0.02 总和 36.74 16 R2=0.9948 ,R2Adj=0.9881 ,变异系数=2.02% 注:*显著(P<0.05);**极显著(P<0.01)。 表 4 漂洗工艺对鱼糜凝胶白度值、质构性能及持水性的影响
Table 4 Effects of washing methods on the whiteness, textural properties and water holding capacity of surimi gels
漂洗方式 白度值 硬度(g) 弹性 内聚性 咀嚼性(g) 凝胶强度(g·cm) 持水性(%) C 79.52±0.65b 2363.83±18.87b 0.87±0.00b 0.64±0.00a 1337.40±30.05b 293.57±29.79b 76.48±2.97b EF 82.19±0.36a 2459.04±24.36a 0.89±0.02a 0.66±0.01a 1450.33±67.46a 315.44±7.36a 79.99±5.42a 注:C:表示工业生产中鱼糜传统漂洗方式,鱼糜经两次清水漂洗,漂洗鱼水质量比1:5,漂洗时间9 min;EF:表示鱼糜经一次电场辅助最优漂洗工艺(电场电压56 V,漂洗鱼水质量比1:3,漂洗时间3 min)、一次清水漂洗(漂洗鱼水质量比1:3,漂洗时间3 min)。不同小写字母代表样品之间差异显著(P<0.05)。 -
[1] 安玥琦, 阮秋凤, 张学振, 等. 6种淡、海水鱼糜制品的滋味特征及其指纹图谱的建立[J]. 食品科学,2023,44(10):231−239. [AN Yueqi, RUAN Qiufeng, ZHANG Xuezhen, et al. Taste characteristics and fingerprinting of surimi products made from three species of freshwater fish and three species of marine fish[J]. Food Science,2023,44(10):231−239.] AN Yueqi, RUAN Qiufeng, ZHANG Xuezhen, et al. Taste characteristics and fingerprinting of surimi products made from three species of freshwater fish and three species of marine fish[J]. Food Science, 2023, 44(10): 231−239.
[2] ZHANG Longteng, LI Qian, SHI Jing, et al. Changes in chemical interactions and gel properties of heat-induced surimi gels from silver carp (Hypophthalmichthys molitrix) fillets during setting and heating:Effects of different washing solutions[J]. Food Hydrocolloids,2018,75:116−124. doi: 10.1016/j.foodhyd.2017.09.007
[3] BALANGE A K, BENJAKUL S. Effect of oxidised tannic acid on the gel properties of mackerel (Rastrelliger kanagurta) mince and surimi prepared by different washing processes[J]. Food Hydrocolloids,2009,23(7):1693−1701. doi: 10.1016/j.foodhyd.2009.01.007
[4] PRIYADARSHINI B, XAVIER K A M, NAYAK B B, et al. Instrumental quality attributes of single washed surimi gels of tilapia:Effect of different washing media[J]. LWT,2017,86:385−392. doi: 10.1016/j.lwt.2017.08.022
[5] 陆婷婷, 张晓頔, 戴志远, 等. 羧甲基壳聚糖与复合盐单次漂洗对白鲢鱼糜品质的影响[J]. 中国食品学报,2024,24(1):169−178. [LU Tingting, ZHANG Xiaodi, DAI Zhiyuan, et al. Effect of single rinse treatment of carboxymethyl chitosan and compound salt on the quality of silver carp surimi[J]. Journal of Chinese Institute of Food Science and Technology,2024,24(1):169−178.] LU Tingting, ZHANG Xiaodi, DAI Zhiyuan, et al. Effect of single rinse treatment of carboxymethyl chitosan and compound salt on the quality of silver carp surimi[J]. Journal of Chinese Institute of Food Science and Technology, 2024, 24(1): 169−178.
[6] 阮秋凤, 蒋文馨, 熊善柏, 等. 臭氧漂洗工艺对鲢鱼糜品质的影响[J]. 华中农业大学学报,2020,39(6):67−73. [RUAN Qiufeng, JIANG Wenxin, XIONG Shanbai, et al. Effect of ozone rinsing process on quality of sliver carp surimi[J]. Journal of Huazhong Agricultural University,2020,39(6):67−73.] RUAN Qiufeng, JIANG Wenxin, XIONG Shanbai, et al. Effect of ozone rinsing process on quality of sliver carp surimi[J]. Journal of Huazhong Agricultural University, 2020, 39(6): 67−73.
[7] 李玮. 超声波辅助羧甲基壳聚糖与臭氧漂洗改善鲢鱼糜品质及机制的研究[D]. 武汉:华中农业大学, 2015. [LI Wei. Study on the effects and mechanism of silver carp surimi rinsing with CBC/ozone/ultrasonic sound treatment[D]. Wuhan:Huazhong Agricultural University, 2015.] LI Wei. Study on the effects and mechanism of silver carp surimi rinsing with CBC/ozone/ultrasonic sound treatment[D]. Wuhan: Huazhong Agricultural University, 2015.
[8] LIU Cikun, LI Wenxie, LIN Boyan, et al. Comprehensive analysis of ozone water rinsing on the water-holding capacity of grass carp surimi gel[J]. LWT-Food Science & Technology,2021,150:111919.
[9] FANG Mengxue, XIONG Shanbai, YIN Tao, et al. Proteomic profiling and oxidation site analysis of gaseous ozone oxidized myosin from silver carp (Hypophthalmichthys molitrix) with different oxidation degrees[J]. Food Chemistry,2021,363:130307. doi: 10.1016/j.foodchem.2021.130307
[10] JIANG Wenxin, HE Yufan, XIONG Shanbai, et al. Effect of mild ozone oxidation on structural changes of silver carp (Hypophthalmichthys molitrix) myosin[J]. Food & Bioprocess Technology,2017,10:370−378.
[11] ZHANG Tao, XUE Yong, LI Zhaojie, et al. Effects of ozone on the removal of geosmin and the physicochemical properties of fish meat from bighead carp (Hypophthalmichthys nobilis)[J]. Innovative Food Science & Emerging Technologies,2016,34:16−23.
[12] KO W C, YANG Shangyan, CHANG Chaokai, et al. Effects of adjustable parallel high voltage electrostatic field on the freshness of tilapia (Orechromis niloticus) during refrigeration[J]. LWT-Food Science & Technology,2016,66:151−157.
[13] 熊宇飞. 高压静电场结合制冷对刀额新对虾品质和作用机理的研究[D]. 广州:华南理工大学, 2020. [XIONG Yufei. Effect of high-voltage electrostatic field combined with refrigeration on the quality of prawn (Metapenaeus ensis) and mechanism research[D]. Guangzhou:South China University of Technology, 2020.] XIONG Yufei. Effect of high-voltage electrostatic field combined with refrigeration on the quality of prawn (Metapenaeus ensis) and mechanism research[D]. Guangzhou: South China University of Technology, 2020.
[14] XANTHAKIS E, HAVET M, CHEVALLIER S, et al. Effect of static electric field on ice crystal size reduction during freezing of pork meat[J]. Innovative Food Science & Emerging Technologies,2013,20:115−120.
[15] DINANI S T, HAMDAMI N, SHAHEDI M, et al. Quality assessment of mushroom slices dried by hot air combined with an electrohydrodynamic (EHD) drying system[J]. Food & Bioproducts Processing,2015,94:572−580.
[16] AMIRI A, MOUSAKHANI G A, SHAFIEKHANI S, et al. Effect of high voltage electrostatic field thawing on the functional and physicochemical properties of myofibrillar protein[J]. Innovative Food Science & Emerging Technologies,2019,56:102191.
[17] HUANG Jian, QUE Feng, XIONG Guangquan, et al. Physicochemical and functional properties changes in myofibrillar protein extracted from channel catfish by a high-voltage electrostatic field[J]. Food & Bioprocess Technology,2023,16(2):395−403.
[18] SHEN J, ZHANG M, MUJUMDAR A S, et al. Effects of high voltage electrostatic field and gelatin-gum Arabic composite film on color protection of freeze-dried grapefruit slices[J]. Food & Bioprocess Technology,2022,15(8):1881−1895.
[19] 杨春生. 电场对α-淀粉酶二级结构和酶活性的影响及其时间效应[D]. 呼和浩特:内蒙古大学, 2009. [YANG Chunsheng. Study of electric field on the α-amylase secondary structure and activity and its time-effect[D]. Hohhot:Inner Mongolia University, 2009.] YANG Chunsheng. Study of electric field on the α-amylase secondary structure and activity and its time-effect[D]. Hohhot: Inner Mongolia University, 2009.
[20] 曹生现, 徐佳宁, 王云汉, 等. 电磁作用下微生物传质建模及影响因素分析[J]. 东北师大学报:自然科学版,2017,49(1):83−87. [CAO Shengxian, XU Jianing, WANG Yunhan, et al. Establish microbial transfer model with EMF and analysis influence factors[J]. Journal of Northeast Normal University (Natural Science Edition),2017,49(1):83−87.] CAO Shengxian, XU Jianing, WANG Yunhan, et al. Establish microbial transfer model with EMF and analysis influence factors[J]. Journal of Northeast Normal University (Natural Science Edition), 2017, 49(1): 83−87.
[21] WANG Yudong, TIAN Yuxin, SUN Jingwen, et al. Physicochemical properties of grass carp surimi as affected by pH and NaCl concentration during washing[J]. International Journal of Food Properties,2023,26(1):952−962. doi: 10.1080/10942912.2023.2197168
[22] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,1951,193(1):265−275. doi: 10.1016/S0021-9258(19)52451-6
[23] 严文莉. 改性魔芋葡甘聚糖对鲢鱼糜凝胶特性的影响及增强机制[D]. 武汉:华中农业大学, 2022. [YAN Wenli. The effect of modified KGM on the gel properties of silver carp surimi and mechanism for surimi gelation enhancement[D]. Wuhan:Huazhong Agricultural University, 2022.] YAN Wenli. The effect of modified KGM on the gel properties of silver carp surimi and mechanism for surimi gelation enhancement[D]. Wuhan: Huazhong Agricultural University, 2022.
[24] WORRATAO A, YONGSAWATDIGUL J. Purification and characterization of transglutaminase from Tropical tilapia (Oreochromis niloticus)[J]. Food Chemistry,2004,93(4):651−658.
[25] 刘茹, 李俊杰, 熊善柏, 等. 内源酶在鱼肉和猪肉热胶凝过程中作用的比较研究[J]. 食品工业科技,2012,33(11):90−93,96. [LIU Ru, LI Junjie, XIONG Shanbai, et al. Comparative study on role of endogenous enzymes in fish and pork heat induced gelation[J]. Science and Technology of Food Industry,2012,33(11):90−93,96.] LIU Ru, LI Junjie, XIONG Shanbai, et al. Comparative study on role of endogenous enzymes in fish and pork heat induced gelation[J]. Science and Technology of Food Industry, 2012, 33(11): 90−93,96.
[26] ZHANG S N, MEENU M, YU Y. Insight into the mechanism of pressure shift freezing on water mobility, microstructure, and rheological properties of grass carp surimi gel[J]. Innovative Food Science & Emerging Technologies,2024,91:103528.
[27] DEBUSCA A, TAHERGORABI R, BEAMER S K. et al. Physicochemical properties of surimi gels fortified with dietary fiber[J]. Food Chemistry,2014,148:70−76. doi: 10.1016/j.foodchem.2013.10.010
[28] 卢彦轩, 王玉栋, 庄洋, 等. 甜橙油与马铃薯淀粉复配对鱼糜制品品质的影响[J]. 中国食品学报,2023,23(5):241−250. [LU Yanxuan, WANG Yudong, ZHUANG Yang, et al. The effect of orange oil and potato starch on the quality of surimi gel product[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(5):241−250.] LU Yanxuan, WANG Yudong, ZHUANG Yang, et al. The effect of orange oil and potato starch on the quality of surimi gel product[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(5): 241−250.
[29] 张晓慧, 郭全友, 郑尧, 等. 变性淀粉协同非肌肉蛋白对鱿鱼鱼糜制品凝胶特性及其蛋白构象的影响[J]. 食品科学,2023,44(20):43−52. [ZHANG Xiaohui, GUO Quanyou, ZHENG Yao, et al. Effects of combined addition of modified starch and non-muscle protein on gel properties and protein conformation of squid surimi products[J]. Food Science,2023,44(20):43−52.] doi: 10.7506/spkx1002-6630-20221219-194 ZHANG Xiaohui, GUO Quanyou, ZHENG Yao, et al. Effects of combined addition of modified starch and non-muscle protein on gel properties and protein conformation of squid surimi products[J]. Food Science, 2023, 44(20): 43−52. doi: 10.7506/spkx1002-6630-20221219-194
[30] 郭彦玲, 齐祥明. 低压直流电场下蛋白稳定的乳化液破乳行为分析[J]. 食品科技,2018,43(9):71−75. [GUO Yanling, QI Xiangming. Demulsification of oil-in-water emulsion stabilized by protein under low voltage direct current electric field[J]. Food Science and Technology,2018,43(9):71−75.] GUO Yanling, QI Xiangming. Demulsification of oil-in-water emulsion stabilized by protein under low voltage direct current electric field[J]. Food Science and Technology, 2018, 43(9): 71−75.
[31] 朱忠辉. 静电场中液滴聚并过程的数值模拟及机理研究[D]. 镇江:江苏大学, 2017. [ZHU Zhonghui. Numerical simulation and study on mechanism of droplet coalescence under electrostatic fields[D]. Zhenjiang:Jiangsu University, 2017.] ZHU Zhonghui. Numerical simulation and study on mechanism of droplet coalescence under electrostatic fields[D]. Zhenjiang: Jiangsu University, 2017.
[32] 李典. 外加电场下液滴动力学特性的研究[D]. 北京:华北电力大学, 2021. [LI Dian. Research on dynamic characteristics of droplet under external electric field[D]. Beijing:North China Electric Power University, 2021.] LI Dian. Research on dynamic characteristics of droplet under external electric field[D]. Beijing: North China Electric Power University, 2021.
[33] 范玉玲. 静电场作用下液滴聚并特性的分子动力学研究[D]. 青岛:中国石油大学(华东), 2021. [FAN Yuling. Molecular dynamics study of droplet coalescence under electrostatic field[D]. Qingdao:China University of Petroleum (East China), 2021.] FAN Yuling. Molecular dynamics study of droplet coalescence under electrostatic field[D]. Qingdao: China University of Petroleum (East China), 2021.
[34] 李倩南. 电场对细胞形变和离子跨膜迁移的影响研究[D]. 西安:西安工业大学, 2022. [LI Qiannan. Effect of electric field on cell deformation and ion trans-membrane migration[D]. Xi’an:Xi’an Technological University, 2022.] LI Qiannan. Effect of electric field on cell deformation and ion trans-membrane migration[D]. Xi’an: Xi’an Technological University, 2022.
[35] CHO Y, SON M, JEONG H, et al. Electric field-induced migration and intercellular stress alignment in a collective epithelial monolayer[J]. Molecular Biology of the Cell,2018,29(19):2292−2302. doi: 10.1091/mbc.E18-01-0077
[36] GOZDE C, KEILLOR J W, JOHNSON G V W, et al. Cytosolic guanine nucledotide binding deficient form of transglutaminase 2 (R580a) potentiates cell death in oxygen glucose deprivation[J]. PLoS One,2011,6(1):e16665. doi: 10.1371/journal.pone.0016665
[37] HAUSER C, WODTKE R, LOSER R, et al. A fluorescence anisotropy-based assay for determining the activity of tissue transglutaminase[J]. Amino Acids,2017,49:567−583. doi: 10.1007/s00726-016-2192-5
[38] 马永强, 岳文静, 张娜, 等. 转谷氨酰胺酶活性基团研究[J]. 食品与机械,2011,27(4):7−9,24. [MA Yongqiang, YUE Wenjing, ZHANG Na, et al. Determination of transglutaminase activity groups[J]. Food & Machinery,2011,27(4):7−9,24.] MA Yongqiang, YUE Wenjing, ZHANG Na, et al. Determination of transglutaminase activity groups[J]. Food & Machinery, 2011, 27(4): 7−9,24.
[39] LI Dandan, WU Zhengzong, WANG Pei, et al. Effect of moderate electric field on glucoamylase-catalyzed hydrolysis of corn starch:Roles of electrophoretic and polarization effects[J]. Food Hydrocolloids,2022,122:107120. doi: 10.1016/j.foodhyd.2021.107120
[40] 杨镕, 徐安琪, 朱煜康, 等. 辐照对带鱼鱼糜内源性转谷氨酰胺酶及凝胶特性的影响[J]. 食品科学,2020,41(11):71−76. [YANG Rong, XU Anqi, ZHU Yukang, et al. Effect of irradiation on endogenous transglutaminase and gel properties of hairtail surimi[J]. Food Science,2020,41(11):71−76.] doi: 10.7506/spkx1002-6630-20190502-008 YANG Rong, XU Anqi, ZHU Yukang, et al. Effect of irradiation on endogenous transglutaminase and gel properties of hairtail surimi[J]. Food Science, 2020, 41(11): 71−76. doi: 10.7506/spkx1002-6630-20190502-008
[41] 黄艺, 李丹丹, 杨哪, 等. 电场处理对酶活力的影响[J]. 中国食品学报,2021,21(11):377−388. [HUANG Yi, LI Dandan, YANG Na, et al. The effects of electric field treatments on enzyme activity[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(11):377−388.] HUANG Yi, LI Dandan, YANG Na, et al. The effects of electric field treatments on enzyme activity[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(11): 377−388.
[42] 李冠成, 康永林, 李明, 等. 水在电场、磁场作用下物理性质变化及其影响[J]. 现代物理知识,2001(2):30−31. [LI Guancheng, KANG Yonglin, LI Ming, et al. Changes of physical properties of water under the action of electric and magnetic fields and their effects[J]. Modern Physics,2001(2):30−31.] LI Guancheng, KANG Yonglin, LI Ming, et al. Changes of physical properties of water under the action of electric and magnetic fields and their effects[J]. Modern Physics, 2001(2): 30−31.
[43] SINGH A, ORSAT V, RAGHAVAN V. Soybean hydrophobic protein response to external electric field:A molecular modeling approach[J]. Biomolecules,2013,3(4):168−179.
[44] BUDI A, LEGGE F S, TREUTLEIN H, et al. Electric field effects on insulin chain-B conformation[J]. Journal of Physical Chemistry B,2005,109(47):22641−22648. doi: 10.1021/jp052742q
[45] HAN Yong, ZHANG Teng, JIAO Tifeng, et al. Insights into the mechanism of electrostatic field promoting ozone mass transfer in water:A molecular dynamics perspective[J]. The Science of the Total Environment,2022,848:157710. doi: 10.1016/j.scitotenv.2022.157710
[46] RAHBARI M, HAMDAMI N, MIRZAEI H, et al. Effects of high voltage electric field thawing on the characteristics of chicken breast protein[J]. Journal of Food Engineering,2018,216:98−106. doi: 10.1016/j.jfoodeng.2017.08.006
[47] 曹云刚, 马文慧, 艾娜丝, 等. 氧化强度对肌原纤维蛋白结构及凝胶性能的影响[J]. 食品科学,2019,40(20):21−27. [CAO Yungang, MA Wenhui, AI Nasi, et al. Effects of different oxidation intensities on the structure and gel properties of myofibrillar protein[J]. Food Science,2019,40(20):21−27.] doi: 10.7506/spkx1002-6630-20181105-059 CAO Yungang, MA Wenhui, AI Nasi, et al. Effects of different oxidation intensities on the structure and gel properties of myofibrillar protein[J]. Food Science, 2019, 40(20): 21−27. doi: 10.7506/spkx1002-6630-20181105-059
[48] UZUN H, IBANOGLU E, CATAL H, et al. Effects of ozone on functional properties of proteins[J]. Food Chemistry,2012,134(2):647−654. doi: 10.1016/j.foodchem.2012.02.146
[49] DURHAM E K, SASTRY S K. Moderate electric field treatment enhances enzymatic hydrolysis of cellulose at below-optimal temperatures[J]. Enzyme and Microbial Technology,2020,142:109678. doi: 10.1016/j.enzmictec.2020.109678
[50] FRIED D S, BOXER G S. Electric fields and enzyme catalysis[J]. Annual Review of Biochemistry,2017,86(1):387−415. doi: 10.1146/annurev-biochem-061516-044432
[51] SINTHUSAMRAN S, PONGSETKUL J, RUNGCHAWALA N, et al. Effect of low-intensity ultrasound-assisted washing on biochemical and gelling properties of surimi from yellowstripe scad[J]. Future Foods,2023,8:100283. doi: 10.1016/j.fufo.2023.100283
[52] 安玥琦, 熊善柏. 肌原纤维蛋白转谷氨酰胺酶交联程度对鱼糜凝胶及其风味释放影响的研究进展[J]. 食品科学,2015,36(7):235−239. [AN Yueqi, XIONG Shanbai. Effect of transglutaminase-catalyzed cross-Linking degree of myofibrillar protein on surimi gelation and flavor release[J]. Food Science,2015,36(7):235−239.] AN Yueqi, XIONG Shanbai. Effect of transglutaminase-catalyzed cross-Linking degree of myofibrillar protein on surimi gelation and flavor release[J]. Food Science, 2015, 36(7): 235−239.
[53] 张怡, 陈秉彦, 曾红亮, 等. 肌原纤维蛋白与鱼糜凝胶特性相关性概述[J]. 亚热带农业研究,2016,12(1):13−24. [ZHANG Yi, CHEN Bingyan, ZENG Hongliang, et al. Research progress on the correlation between myofibrillar protein and gel properties in surimi[J]. Subtropical Agriculture Research,2016,12(1):13−24.] ZHANG Yi, CHEN Bingyan, ZENG Hongliang, et al. Research progress on the correlation between myofibrillar protein and gel properties in surimi[J]. Subtropical Agriculture Research, 2016, 12(1): 13−24.
-
期刊类型引用(11)
1. 薛红梅,陆少兰,刘玉美,刘晓松,张雪苍. 大豆低聚肽双蛋白酸奶的研制及其活性益生菌数量评价. 粮食与油脂. 2025(01): 82-86 .  百度学术
百度学术
2. 孙文,李宝磊,侯保朝,洪维鍊,何剑,梁超,张宇,满朝新,姜毓君,郭鸰. 嗜热链球菌JM108发酵动力学模型的建立. 食品工业科技. 2025(03): 159-165 .  本站查看
本站查看
3. 康林芝,刘锶彤,庄紫婷,唐辉. 红薯发酵乳的加工工艺及品质分析研究. 农产品加工. 2024(02): 52-55 .  百度学术
百度学术
4. 郭嘉明,曹晏文,戴润芳,刘春,杨惠茹,李慧姣,付莹,张国华. 我国标识“乳酸菌”“益生菌”普通食品调查研究. 食品工业科技. 2024(12): 225-233 .  本站查看
本站查看
5. 任青霞,赵华,吴经纬,杨贞耐. 酪蛋白源活性肽的微胶囊化及其对酸乳品质的影响. 食品科学. 2024(16): 53-60 .  百度学术
百度学术
6. 冶海潇,杨洋洋,王金丽,朱成林,陈娟,唐俊妮. 三株乳酸菌混合发酵对发酵乳品质影响分析. 西南民族大学学报(自然科学版). 2024(06): 600-607 .  百度学术
百度学术
7. 杨姗,张其圣,史梅莓,吕鹏军,杨博文,汪冬冬,伍亚龙. 发酵燕麦浆的乳酸菌菌种筛选及品质分析. 食品与发酵科技. 2024(06): 70-78 .  百度学术
百度学术
8. 贾志磊,龙小梅,刘媛,孙金威,梁文星,付瑞东,李启明. 清洁标签椰子植物酸乳稳定性研究及产品开发. 食品科技. 2024(12): 36-45 .  百度学术
百度学术
9. 顾凡,徐志涛,赵存朝,陶亮,田洋. 核桃冻干酸奶的研制. 中国乳品工业. 2023(01): 57-64 .  百度学术
百度学术
10. 王晶,刘鹏莉,肖海滨. 牦牛原料乳冻藏条件对酸乳发酵性能的影响研究. 食品科技. 2023(02): 44-49 .  百度学术
百度学术
11. 耿瑶,曹颖,崔烓堃,刘继超,孙中贯. 食品中乳酸菌的种类及应用前景研究进展. 食品工业. 2023(03): 234-238 .  百度学术
百度学术
其他类型引用(9)





 下载:
下载:
 下载:
下载:
