Isolation and Purification, Structural Characterization, Hypoglycemic Activity of Soluble β-Glucan from Cordyceps chrysanthemi
-
摘要: 菌菇来源可溶性β-葡聚糖具有良好的生物活性,为开发利用蛹虫草中的β-葡聚糖(CMBG),本研究以蛹虫草子实体为原料,采用蛋白酶酶解、大孔树脂吸附、DEAE离子交换柱层析进行纯化,以脱色率及β-葡聚糖保留率进行加权评分,摸索建立最佳纯化工艺条件。对获得的β-葡聚糖进行结构分析,并研究其体外降血糖活性。结果显示:大孔树脂HPD-750具有最佳的吸附效果,其吸附最优条件为:上样流速5 mL/min、上样浓度4 mg/mL、上样体积400 mL、树脂质量40 g。利用DEAE-FF纤维素交换柱分离出两个β-葡聚糖组分CMBG-1和CMBG-2,相对分子量分别为13.57×104 Da和14.36×104 Da;两者均由Gal、Glc、Man三种单糖组成,其摩尔比分别为1.28:5.27:1.01和0.71:4.43:0.80。通过刚果红分析得出CMBG-1具有三螺旋结构,而CMBG-2不具备三螺旋结构,二者对α-淀粉酶及α-葡萄糖苷酶抑制率都与样品的浓度呈正相关,其对α-淀粉酶抑制的IC50分别为2.68和4.32 mg/mL,对α-葡萄糖苷酶抑制的IC50分别为2.37和3.01 mg/mL,拥有三螺旋结构的CMBG-1的降血糖活性明显高于不具备三螺旋结构的CMBG-2,在功能食品开发方面具有良好的前景。Abstract: Soluble β-glucan from mushroom source had good biological activity, in order to develop and utilize β-glucan (CMBG) in Cordyceps chrysanthemi, this study used Cordyceps chrysanthemi substrate as raw material, and was purified by proteolytic enzyme digestion, adsorption of macroporous resin, and chromatography of DEAE ion-exchange columns, and the decolorization rate and β-glucan retention rate were weighted and scored to feel out the establishment of the optimal purification process conditions. The obtained β-glucan was structurally analyzed and its in vitro hypoglycemic activity was investigated. The results showed that the macroporous resin HPD-750 had the best adsorption effect, and the optimal conditions for adsorption were as follows: up-sample flow rate of 5 mL/min, up-sample concentration of 4 mg/mL, up-sample volume of 400 mL, and mass of the resin of 40 g. Two β-glucan fractions, CMBG-1 and CMBG-2, with relative molecular weights of 13.57×104 Da and 14.36×104 Da, respectively, were isolated using a DEAE-FF cellulose exchange column. Both consisted of three monosaccharides, Gal, Glc, and Man, with molar ratios of 1.28:5.27:1.01 and 0.71:4.43:0.80, respectively. The Congo red analysis showed that CMBG-1 had a triple-helix structure, while CMBG-2 had no triple-helix structure, and the inhibition rates of both of them on α-amylase and α-glucosidase were positively correlated with the concentrations of the samples, and the IC50 of their inhibition on α-amylase were 2.68 and 4.32 mg/mL, and those on α-glucosidase were 2.37 and 3.01 mg/mL, respectively. The hypoglycemic activity of CMBG-1, which possessed a triple-helix structure, was significantly higher than that of CMBG-2, which did not possess a triple-helix structure, and it had good prospects for the development of functional foods.
-
蛹虫草(Cordyceps militaris)是一种昆虫性子囊菌,具有与野生冬虫夏草相似的药理作用。其子实体中含有虫草素、麦角甾醇、海藻糖、甘露醇以及多糖、核苷和氨基酸等多种生物活性物质,具有降血糖、降血脂、抗炎、抗肿瘤、抗细菌、抗真菌、抗病毒、抗氧化剂等多种药用特性[1−2]。由于其有益于人类健康以及易于栽培的特性,蛹虫草在2009年被列为新资源食品,市场规模迅速增长,年产值已超百亿,其活性物质开发利用也成为近年来蛹虫草高值化开发的热点[3−5]。
蛹虫草多糖是蛹虫草中主要的活性成分之一,具有α-葡萄糖苷酶抑制、抗炎、抗氧化、抗菌等多种生物活性。朱振元等[6]研究发现,蛹虫草多糖对α-葡萄糖苷酶的半数抑制浓度(IC50)为4.22 mg/mL,呈现出良好的降血糖效果;胡政宇等[7]研究发现蛹虫草多糖通过旁路途径抑制补体活化,具有良好的抗补体活性;秦令祥等[8]研究发现蛹虫草多糖对DPPH自由基、羟基自由基具有较强的清除能力,对大肠杆菌和金黄色葡萄球菌均具有一定的抑制作用。近年来的研究表明,多糖的生物活性与其单糖组成、糖苷键类型、分子量等密切相关,特别是以β-糖苷键连接而成的β-葡聚糖表现出良好的生物活性。Fernandez-julia等[9]和Chiozzi等[10]研究发现,谷物、真菌多糖活性功能的发挥与其中的β-葡聚糖密切相关,燕麦等谷物来源的β-葡聚糖可以有效抑制α-葡萄糖苷酶活性[11],开发成降糖食品,能够减少淀粉的肠道消化,有效缓解餐后高血糖[12]。
目前对蛹虫草多糖的研究较多,但对多糖中不同组分特别是β-葡聚糖抑制α-淀粉酶和α-葡萄糖苷酶的研究却鲜有报道。本研究以蛹虫草为原料,通过蛋白酶酶解、大孔树脂吸附和DEAE离子交换柱层析的方法分离纯化蛹虫草中的可溶性β-葡聚糖(CMBG),采用刚果红染色、红外光谱、离子色谱等方法对纯化得到的CMBG组分进行结构解析,并对其对α-淀粉酶及α-葡萄糖苷酶的抑制效果进行评价,为蛹虫草的高值化开发利用提供理论依据。
1. 材料与方法
1.1 材料与仪器
蛹虫草 福建省南平市菌妍生物科技;蛹虫草可溶性β-葡聚糖粗品粉末(纯度30.03%±1.22%) 本实验室自制;α-淀粉酶(50 U/mg) 上海麦克林公司;阿卡波糖、α-葡萄糖苷酶(25 U/mg) 上海阿拉丁公司;HPD-750、6RXTJ-20、6RX-15、NKA-9、LX-B40、D101、D1400、YKDH-2、ZG DM130树脂 天津允开树脂公司;中性蛋白酶(50000 U/g)、碱性蛋白酶(50000 U/g)、木瓜蛋白酶(50000 U/g) 南宁东恒华道公司;乙醇、可溶性淀粉、葡萄糖 分析纯,西陇化工公司;DEAE-FF离子交换柱 格来赛生命科技公司。
DF-101S型集热式恒温加热磁力搅拌器 巩义市予华仪器公司;Hei-VAP Value G3型旋转蒸发仪 德国Heidolph公司;UH5300型紫外-可见分光光度计 日本岛津公司;AKTA pure 150型蛋白纯化系统 格来赛生命科技公司;ICS-500型离子色谱仪、MULTISKAN Sky型全波长酶标仪 赛默飞世尔科技公司;DZF6050中型真空干燥箱 上海一恒科学仪器公司;SCIENTZ-30FG/A型冷冻干燥机 宁波新芝冻干设备公司;VERTEX70型傅里叶红外光谱仪 Bruker公司。
1.2 实验方法
1.2.1 CMBG粗品的制备
最佳制备工艺为本实验室前期预实验得出。利用超声辅助水提法提取CMBG,称取一定量的干燥蛹虫草样品,经过粉碎机粉碎后过50目筛,设定提取条件为:料液比1:30、超声提取时间60 min,水浴温度90 ℃,水浴提取时间3 h,获得提取液,加入2%样品体积的α-淀粉酶于50 ℃条件下搅拌孵育60 min去除CMBG提取液中的α-葡聚糖。加入乙醇调节样品中乙醇体积分数至80%,于4 ℃条件下醇沉过夜,离心,弃去上清液,将沉淀烘干得到CMBG粗制品。
1.2.2 蛹虫草β-葡聚糖除蛋白
将上述制备的CMBG粗品配制为10 mg/mL样品溶液,设定酶解条件为:木瓜蛋白酶添加量0.5%、酶解时间2 h、酶解温度45 ℃,获得酶解液,经过3500 kDa透析袋透析处理24 h,去除其中残留蛋白肽等小分子杂质。冷冻干燥获得脱蛋白后的CMBG。
1.2.3 蛹虫草β-葡聚糖脱色工艺
1.2.3.1 静态吸附法初筛树脂
称取酸碱及乙醇预处理后的大孔吸附树脂2.0 g于锥形瓶中,加入20.0 mL的2.0 mg/mL CMBG溶液,封口膜封口。将锥形瓶置于恒温摇床上以25 ℃,150 r/min的频率震荡吸附12 h。吸附完毕,滤去树脂,得吸附后样品溶液[13]。取一定量吸附液于420 nm测定溶液中色素的吸光度值,计算脱色率;按照下式计算β-葡聚糖含量。分别对脱色率和β-葡聚糖保留率两项指标进行加权求和,计算出综合评分较高的树脂进行下一步实验考察。
脱色率(%)=A1−A2A1×100 β-葡聚糖保留率(%)=M2M1×100 综合评分=0.5A+0.5B 式中:A1、A2分别为脱色前后β-葡聚糖溶液的吸光度;M1、M2分别为脱色前后β-葡聚糖含量;A为脱色率,%;B为β-葡聚糖保留率,%。
1.2.3.2 吸附动力学筛选最佳树脂
称取最优四种大孔树脂2.0 g于锥形瓶内,加入浓度为2.0 mg/mL的样品溶液20 mL,将锥形瓶置于25 ℃恒温摇床上以150 r/min的频率振荡吸附。固定取样体积2 mL。第1 h内,每隔20 min取样一次,取样后补足相同体积的去离子水。第2、3 h,每隔40 min取一次样,之后每过1 h取一次样至第6 h;取样后进行β-葡聚糖含量测定,以时间为横坐标,吸附率为纵坐标,绘制静态吸附动力学曲线[14]。
吸附率(%)=C1−CtC1×100 式中:C1为CMBG溶液β-葡聚糖的初始含量,mg/mL;Ct为某个时间点吸附液中β-葡聚糖含量,mg/mL。
1.2.3.3 单因素实验
根据静态吸附实验结果筛选出合适的树脂型号,湿法装柱,进行动态吸附实验。进行单因素实验设计:固定上样浓度4 mg/mL,树脂质量40 g,上样体积200 mL,考察上样流速(2.5~12.5 mL/min);固定树脂质量40 g,上样流速5 mL/min,上样体积200 mL,考察上样浓度(1~5 mg/mL);固定上样浓度4 mg/mL,上样流速5 mL/min,上样体积200 mL,考察树脂质量(25~45 g);固定上样浓度4 mg/mL,上样流速5 mL/min,树脂质量40 g,考察上样体积(100~500 mL)四个单因素对CMBG纯化效果的影响,以确定最佳吸附条件。
1.2.4 DEAE交换树脂分离组分
取200 mg经大孔树脂纯化冻干后的蛹虫草β-葡聚糖粉末,溶于10 mL纯水中,上样后依次使用浓度为0.0、0.2、0.4、0.6、0.8、1.0 mol/L的NaCl溶液作为流动相进行梯度洗脱,控制柱层析流速为1 mL/min,3 mL/瓶收集洗脱液。测定每瓶中β-葡聚糖的浓度,绘制分离洗脱曲线。不同洗脱组分分别用平板膜(1 kDa)脱除盐及小分子杂质,冷冻干燥获得样品[15],并按下式计算得率:
CMBG得率(%)=M1M2×100 式中:M1为CMBG各组分冷冻干燥后的质量;M2为CMBG溶解前的质量。
1.2.5 β-葡聚糖含量的计算
参照Mccleary等[16]的差异计算法,稍作修改。
总葡聚糖含量测定:称取10 mg样品,加入200 μL 12 mol/L的硫酸,冰水浴120 min随后加入1.2 mL蒸馏水,沸水浴120 min,加入600 μL 10 mol/L的氢氧化钾,以pH5的醋酸钠缓冲溶液定容至10 mL,离心吸取100 μL上清液,加入3 mL葡萄糖氧化酶-过氧化物酶试剂(GOPOD)于40 ℃孵育20 min,于510 nm测定吸光度。
α-葡聚糖含量测定:称取100 mg样品,加入2 mL 2 mol/L氢氧化钾,冰水浴20 min→加入8 mL pH4的醋酸钠缓冲溶液,加入1 mL α-淀粉酶(1 mg/mL)于50 ℃孵育60 min,离心取100 μL上清液,加入3 mL GOPOD试剂于40 ℃孵育20 min,于510 nm测定吸光度。
以无水葡萄糖作为标准品,吸光度A为横坐标,浓度C为纵坐标,求得葡萄糖标准曲线的回归线方程为:A=0.5726x+0.04,R²=0.9933,并按下式计算提取物中总葡聚糖及α-葡聚糖含量:
总葡聚糖及α-葡聚糖含量(%)=C×V×NM×100 式中:C为葡萄糖质量浓度,mg/mL;N为稀释倍数;V为提取液总体积,mL;M为样品质量,mg。
β-葡聚糖含量按下式计算:
β-葡聚糖含量(%)=总葡聚糖含量−α-葡聚糖含量 1.2.6 CMBG的结构解析
1.2.6.1 相对分子质量测定
采用高效凝胶过滤色谱-示差折光法(HPGPC-RID)测定CMBG及其组分的相对分子量,色谱条件:采用TSK gel G4000PWxL凝胶色谱柱(7.8 mm×30 mm,10 μm),PWxL凝胶色谱保护柱(6.0 mm×4 mm,12 μm),流动相:0.1 mol/L NaNO3,柱温:35 ℃;流速:0.4 mL/min;进样量:20 μL[17]。
1.2.6.2 傅里叶红外光谱分析
称取1 mg样品,与150 mg干燥KBr压片后,在4000~400 cm−1范围以4 cm−1的分辨率扫描16次[18]。
1.2.6.3 单糖组成分析
样品水解:配制5 mg/mL的样品溶液0.5 mL,加入0.5 mL 2 mmol/L三氟乙酸,充氮后置于110 ℃烘箱内水解2 h;冷却后加入1 mL甲醇,氮吹至干除尽TFA;加5 mL纯水充分溶解,为单糖酸水解混合物。
检测条件:色谱柱:Dionex carbopacTM PA20;检测器:RID示差检测器;柱温30 ℃;波长245 nm;流动相1 mmol/L NaOH;进样量10 µL、流速0.5 mL/min;检测时间20 min。
1.2.6.4 刚果红染色分析
配制0.5 mg/mL样品溶液2 mL,与等体积刚果红溶液混合,再加入不同体积的蒸馏水和NaOH溶液,使NaOH终浓度分别为0.00、0.10、0.20、0.30、0.40、0.50 mol/L,室温下反应10 min后,使用紫外-可见分光光度计在400~600 nm范围内测定各溶液的最大吸收波长[19]。
1.2.7 CMBG的降血糖活性分析
1.2.7.1 α-淀粉酶抑制活性测定
取不同浓度的样品溶液20 μL,与20 μL α-淀粉酶溶液(5.00 U/mL)涡旋混匀,37 ℃水浴10 min;随后加入1.00%淀粉溶液40 μL,37 ℃下继续反应10 min;最后加入80 μL DNS试剂,沸水浴中加热5 min终止反应,加入1 mL水稀释后在波长540 nm处测定吸光值[20]。α-淀粉酶抑制率的计算公式如下:
抑制率(%)=(A−B)−(C−D)(A−B)×100 式中:A为加酶不加样品的吸光度值;B为不加酶不加样品的吸光度值;C为加酶加样品的吸光度值;D为不加酶加样品的吸光度值。
1.2.7.2 α-葡萄糖苷酶抑制活性测定
取不同浓度的样液20.00 μL和α-葡萄糖苷酶溶液(0.25 U/mL)20.00 μL涡旋混匀,在37 ℃水浴10 min;完成后加入PNPG(2.5 mmol/L)溶液40.00 μL,37 ℃条件下继续反应10 min;最后加入80.00 μL Na2CO3(0.20 mol/L)终止反应,在波长405 nm处测定吸光值[20]。α-葡萄糖苷酶抑制率的计算公式同1.2.7.1。
1.2.7.3 体外降血糖抑制作用类型分析
固定α-葡萄糖苷酶浓度(0.25 U/mL)、α-淀粉酶浓度(5 U/mL),分别加入不同浓度的CMBG(0.00、1.00和2.00 mg/mL),测定不同底物浓度时的初速率,按Lineweaver-Burks双倒数作图法,以初速率(V)的倒数对底物浓度[S]的倒数作图,判断CMBG-1对α-葡萄糖苷酶的抑制类型[20]。
1.3 数据处理
上述实验均重复3次。实验数据以Excel进行数据整理,利用Origin 2022及GraphPad Prism 8.0软件进行绘图与方程拟合。
2. 结果与分析
2.1 CMBG的脱色工艺
2.1.1 大孔树脂的初筛选
2.1.1.1 大孔树脂的静态吸附
大孔树脂同时具有去除蛋白和脱色的作用,已成为多糖纯化的一种重要方法。本研究考察了9种不同型号的大孔树脂对CMBG的纯化效果,结果如表1所示。一般来说,脱色率和多糖保留率呈负相关,脱色越完全,多糖保留率越低。为综合评价树脂的脱色效果,设定综合评分=脱色率×0.5+保留率×0.5。各大孔树脂的综合评分由高到低依次为HPD-750>6RXTJ-20>6RX-15>NKA-9>LX-B40>D101>D1400>YKDH-2>ZGDM130,D101和AB-8的蛋白清除效果较好,其中HPD-750的综合评分显著优于其他型号树脂(P<0.05),高达66.40%±1.44%。此外,6RTXJ-20和6RX-15的脱色效果较好,它们的综合评分分别为64.65±2.50和63.61±1.99,二者之间并无显著差异。由此筛选出综合评分最高的4种树脂:HPD-750、6RXTJ-20、6RX-15、NKA-9进行吸附动力学考察实验。
表 1 大孔树脂静态吸附结果Table 1. Static adsorption results of macroporous resins型号 脱色率(%) 多糖保留率(%) 综合评分 HPD-750 69.28±1.21 63.52±0.75 66.40±1.44a 6RXTJ-20 73.20±1.98 56.1±1.22 64.65±2.50ab 6RX-15 75.59±1.33 51.63±1.42 63.61±1.99ab NKA-9 65.70±2.98 61.38±0.87 63.54±1.79ab LX-B40 68.40±4.33 56.08±1.25 61.39±0.33b D101 71.45±1.22 50.59±0.78 61.02±1.43b D1400 69.93±5.33 50.22±2.86 59.75±3.75b YKDH-2 64.27±3.41 55.09±1.87 59.68±4.53b ZG DM130 63.18±4.24 53.66±2.55 58.42±2.47b 注:同列不同小写字母表示差异显著(P<0.05)。 2.1.1.2 吸附动力学考察
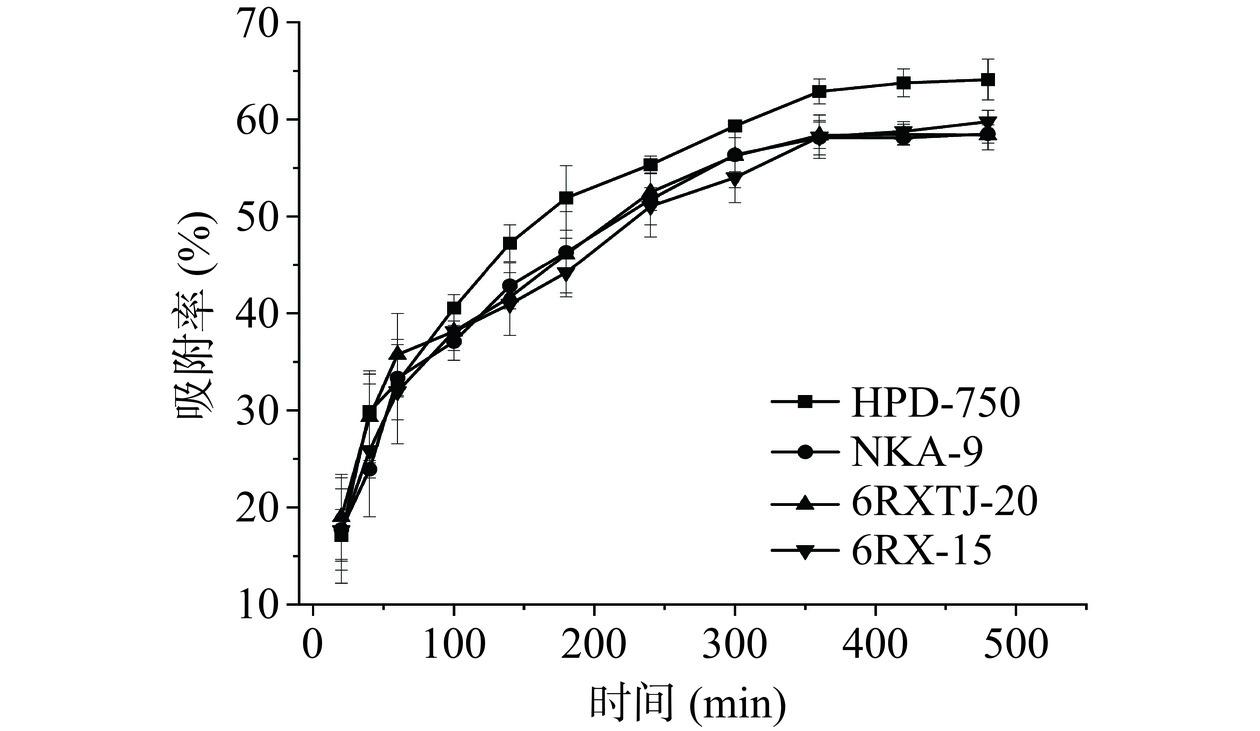
结果如图1所示,从中可以看出,在吸附的0~480 min内,四种大孔吸附树脂对CMBG的吸附量随着时间的延长而增多,在360 min以后,树脂对CMBG的吸附量趋于平衡,HPD-750大孔吸附树脂对CMBG的最终吸附率为64.09%±2.10%,而NKA-9、6RXTJ-20、6RX-15最终吸附率分别为58.50%±0.94%、58.39%±1.55%、59.76%±1.16%。综上分析可知,HPD-750大孔吸附树脂对CMBG具有较好的吸附性能,显著高于其余三种树脂(P<0.05),在吸附360 min时基本达到吸附饱和。故选择HPD-750型大孔吸附树脂纯化CMBG,吸附时间为360 min。
2.1.2 大孔树脂吸附条件的单因素实验
以大孔树脂吸附综合评分为指标,考察不同上样流速、上样浓度、树脂质量对CMBG的脱色效果,结果见图2。
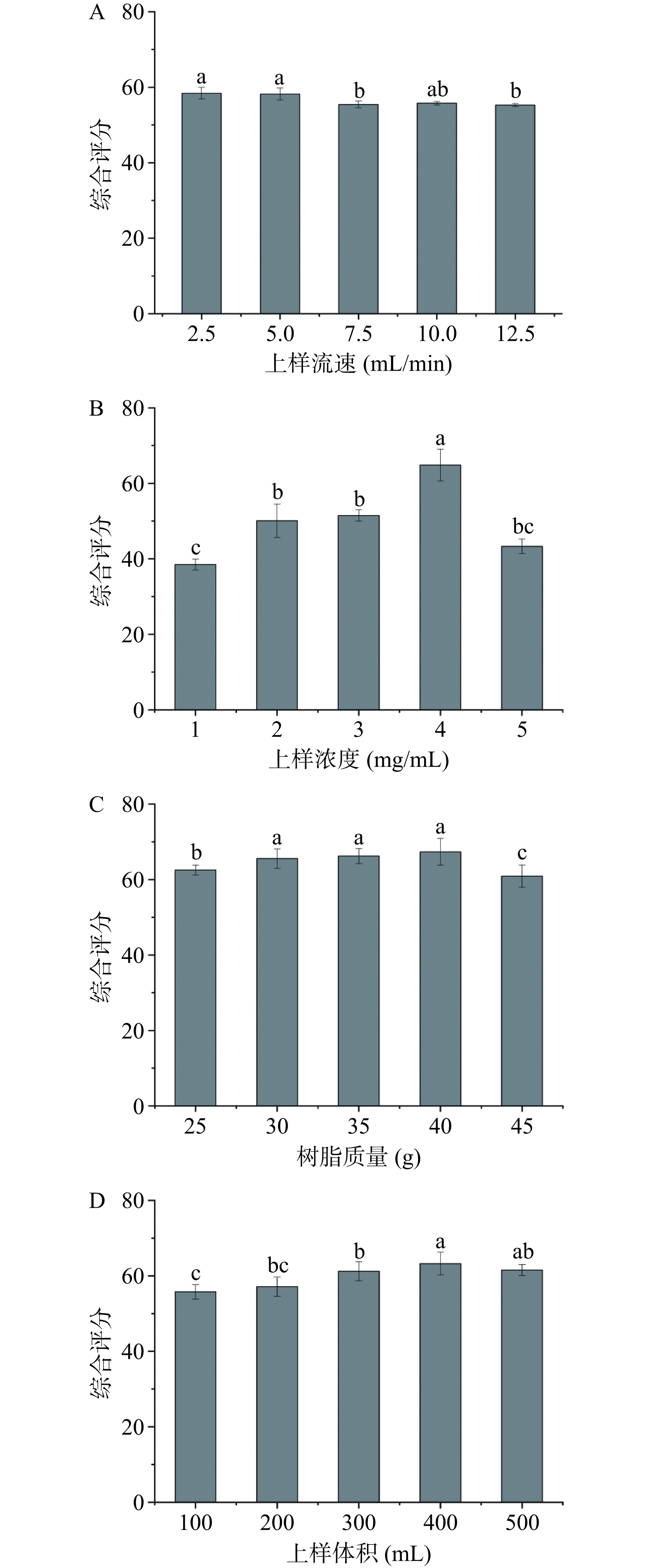
从图2可知,在2.5~12.5 mL/min范围内,树脂脱色的综合评分随上样流速的增加到5 mL/min后显著(P<0.05)下降,最高综合评分为58.20±1.57,与流速2.5 mL/min没有显著性差异,结合工艺效率选取5 mL/min作为最适上样流速。在CMBG上样液的质量浓度1~5 mg/mL范围内,树脂综合评分呈先上升后下降的趋势,当上样浓度为4 mg/mL时,树脂纯化综合评分显著高于其他组,为64.83±4.21,故选取4 mg/mL为最适上样浓度。综合评分随着树脂质量的增加(25~45 g)逐渐升高,当树脂质量为40 g时,综合评分达到最高的67.34±3.55,随后树脂质量再提高时,过高的径高比,使得树脂过度吸附造成CMBG的损失。上样体积在100~500 mL范围内,树脂综合评分随上样体积增大而升高随后稍微下降,在上样体积400 mL时,综合评分达到最高67.51±3.37,显著高于其余体积组(P<0.05),故选取400 mL为最佳上样体积。
2.2 DEAE离子交换柱层析
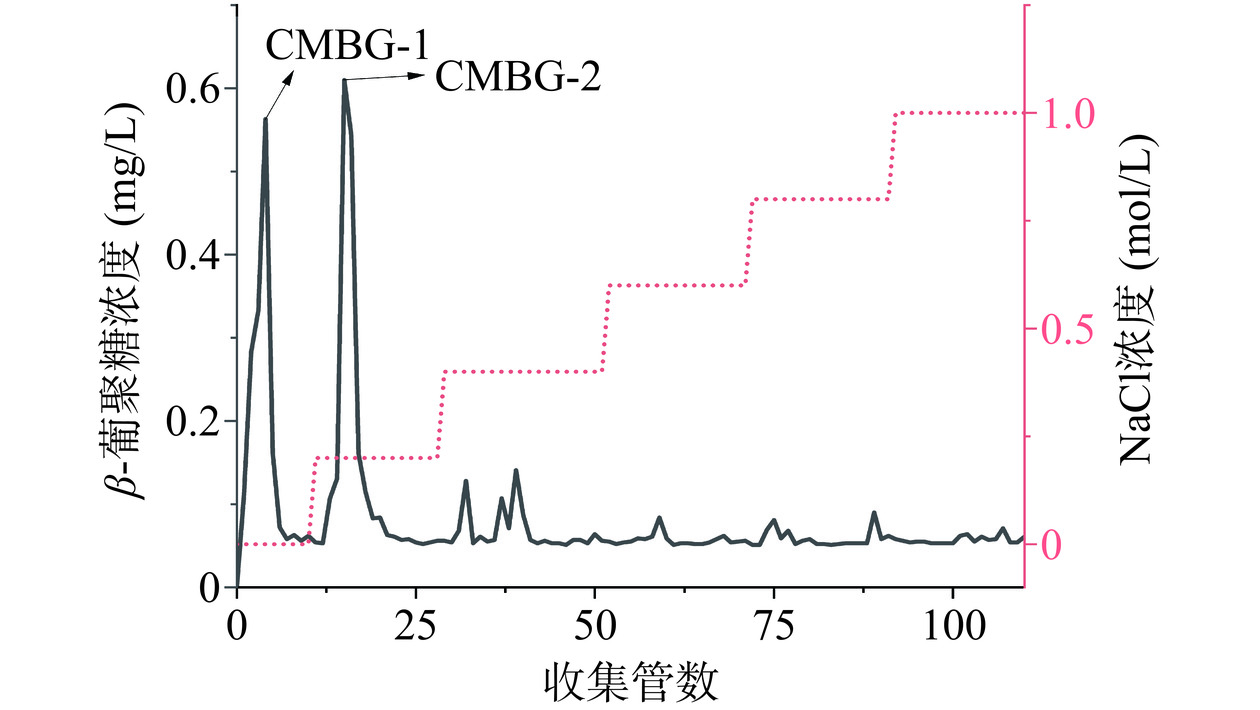
采用DEAE-FF纤维素柱层析对大孔树脂脱色后的CMBG进行纯化,结果如图3所示。CMBG出现一个由纯水洗脱的穿刺峰CMBG-1和一个明显的洗脱峰CMBG-2,对应的β-葡聚糖含量分别为30.55%±2.32%、28.64%±1.87%。CMBG-1及CMBG-2为CMBG中的主要成分,二者的洗脱峰峰形呈对称状态,表明其中成分较为均一。对二者进行浓缩、脱盐及冷冻干燥后得到纯化组分,其得率分别为34.33%±1.23%、36.53%±2.12%。损失率较高的原因可能是在1 kD平板膜设备脱盐时,损失了部分小分子组分。
2.3 蛹虫草β-葡聚糖的结构解析
2.3.1 相对分子量测定
采用凝胶色谱对分离得到的CMBG-1和CMBG-2的分子量进行了分析,结果如图4所示。根据保留时间计算二者的相对分子量分别为13.57×104 Da(CMBG-1)和14.36×104 Da(CMBG-2)。
2.3.2 傅里叶红外光谱扫描
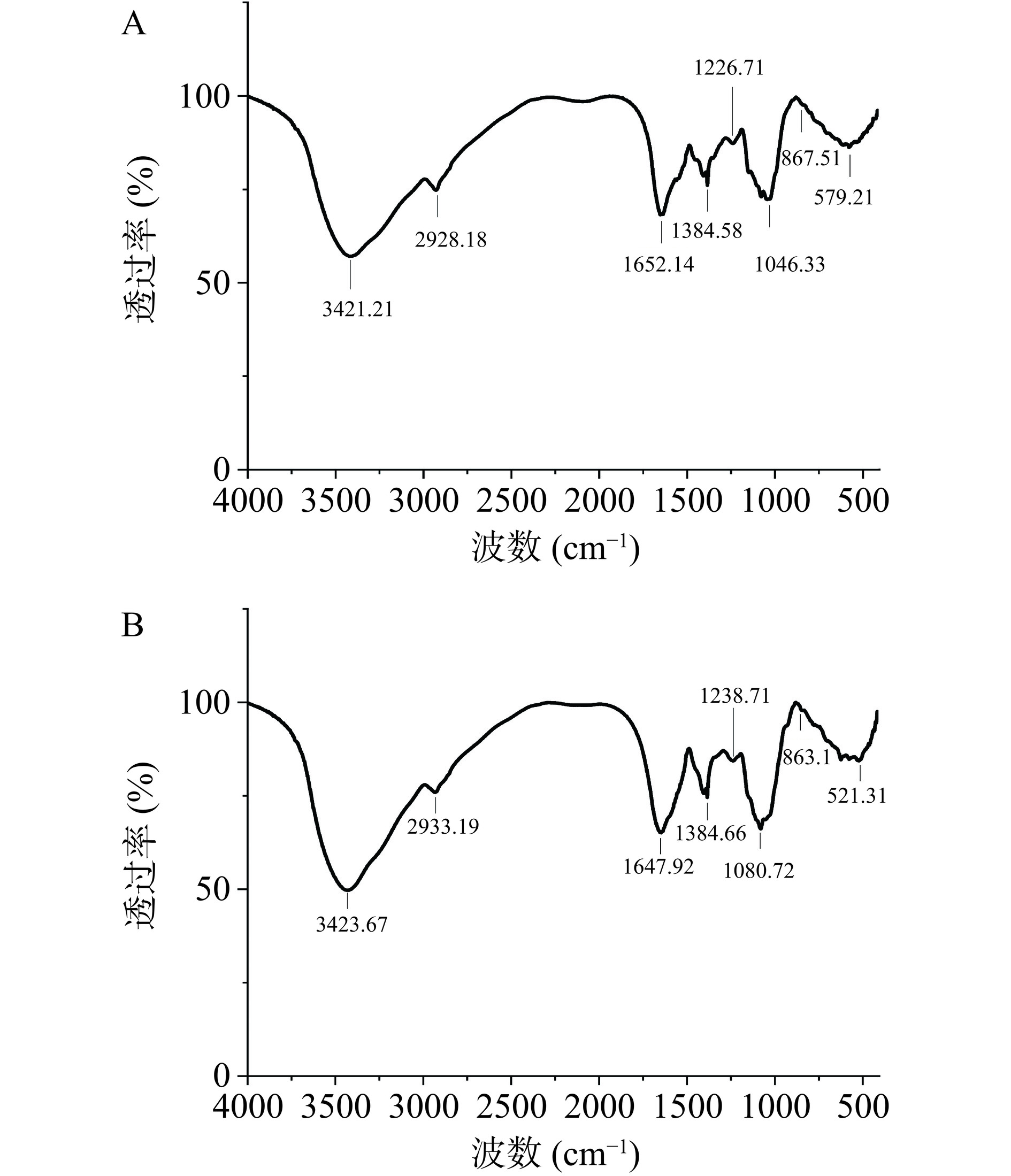
通过傅里叶红外光谱分析,能比较准确地对多糖的官能团进行分析,如图5所示。CMBG-1及CMBG-2中的官能团种类基本相同,其中多糖组分在3500~3300 cm−1处出现明显的吸收峰是由于O-H伸缩振动导致的,3000~2800 cm−1和1420 cm−1处的吸收峰与C-H的缩振动以及C-H的弯曲振动有关,1650 cm−1处出现的吸收峰是由于样品中C=O的伸缩振动,以上特征峰为多糖的典型吸收峰。1200~1000 cm−1处的吸收峰是C-O伸缩的吡喃环振动及β-糖苷键,1250 cm−1处的特征吸收峰对应于硫酸基的S=O拉伸振动,579.21 cm−1为COO的变形振动[21−24]。综上可知,CMBG-1及CMBG-2是一种具有β-糖苷键的硫酸多糖。
2.3.3 单糖组成分析
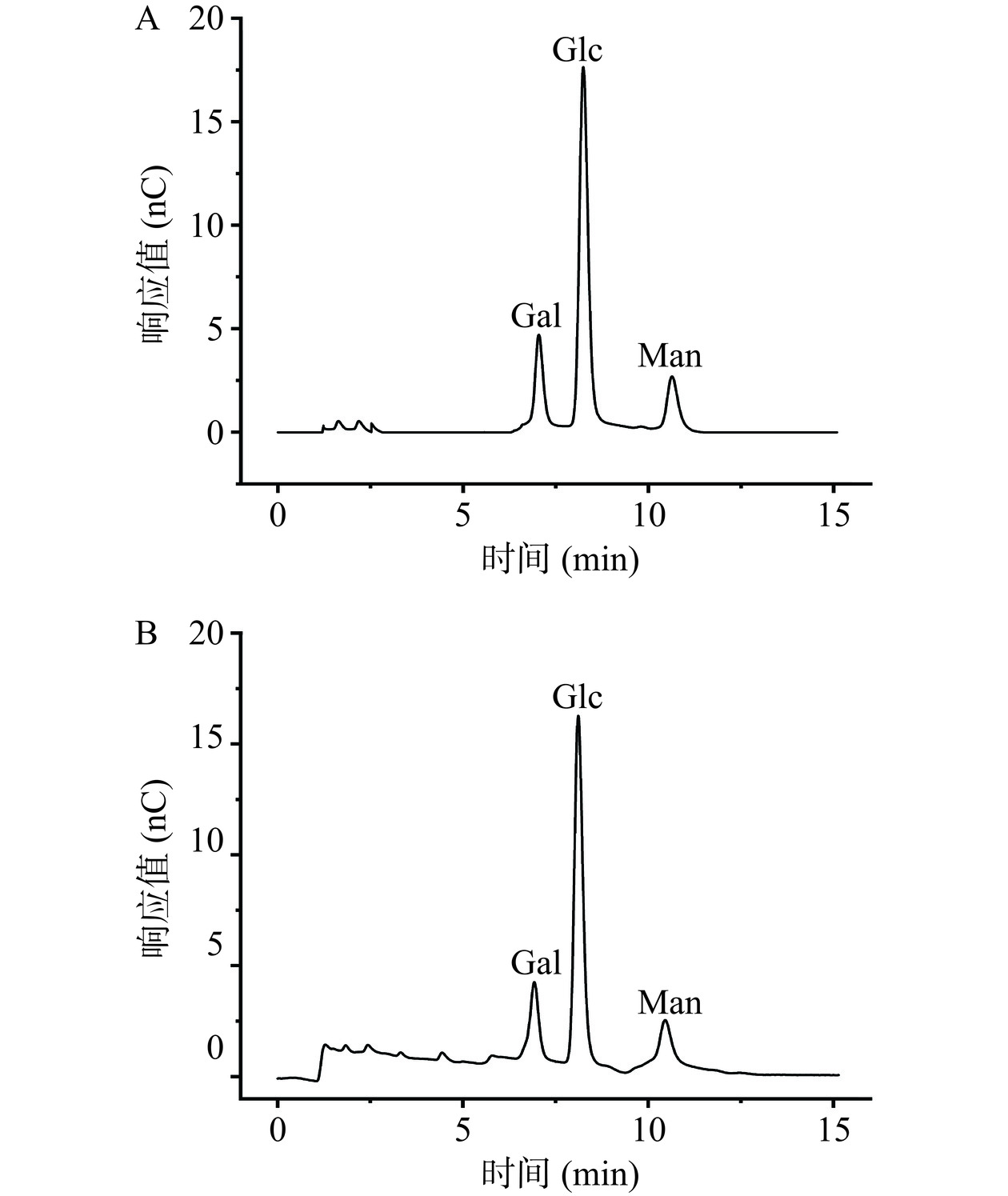
用离子色谱法对CMBG-1及CMBG-2进行单糖组分分析,结果见图6。由图可知,CMBG-1及CMBG-2两个组分均由Gal、Glc、Man三种单糖组成,其摩尔比分别为1.28:5.27:1.01(CMBG-1)和0.71:4.43:0.80(CMBG-2)。
2.3.4 三螺旋结构分析
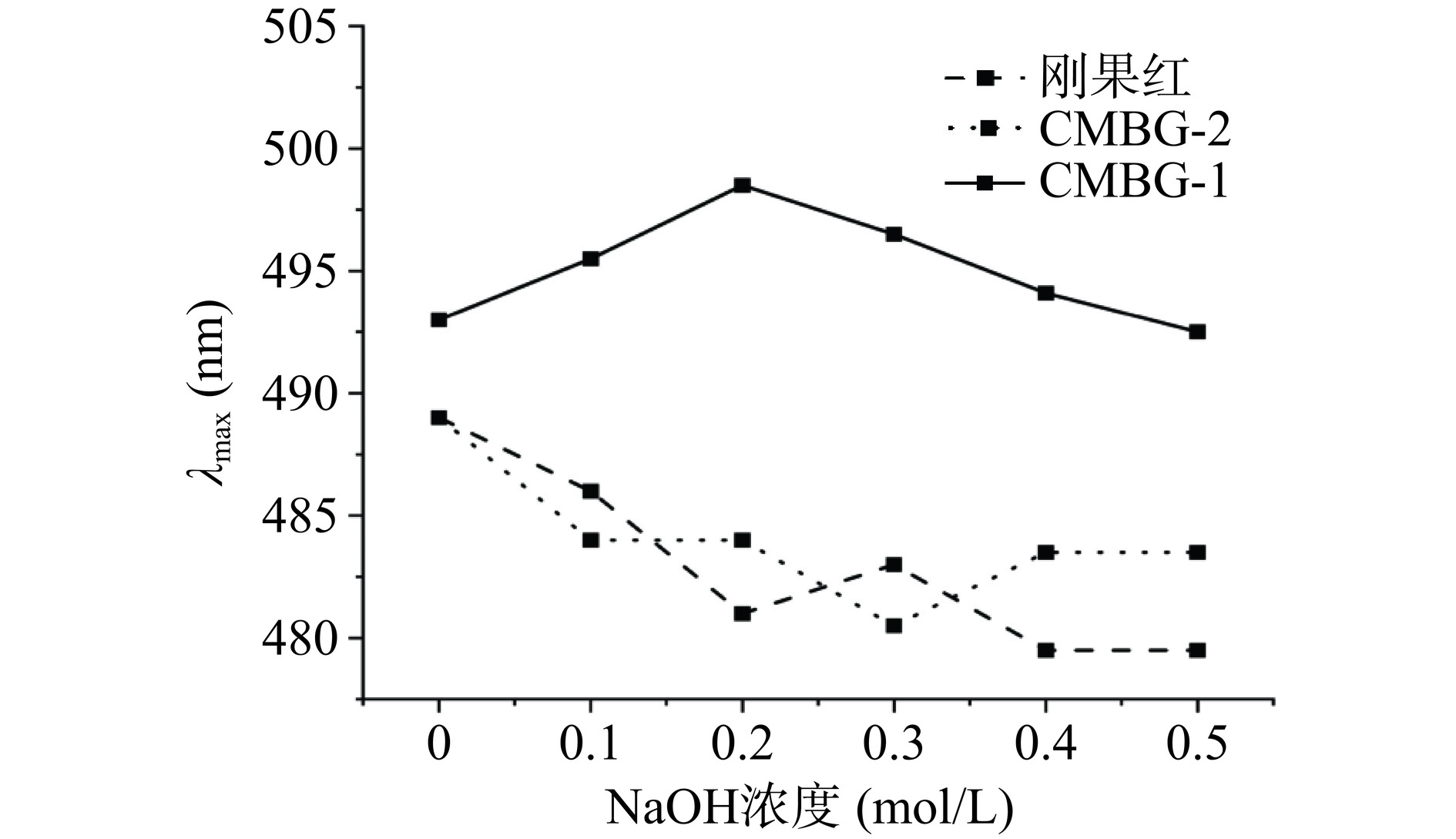
多糖的活性与其三螺旋结构关系密切。三螺旋多糖在水或低浓度NaOH中,呈有序的三螺旋结构,能够与刚果红结合使其最大吸收波长红移;随着NaOH浓度的上升,最大吸收波长急剧下降,表明多糖进入构象过渡时期,三螺旋结构由于氢键断裂而解聚,逐渐转变为无规卷曲构象[25];由于刚果红不能与无规则的卷曲多糖结合,所以NaOH浓度的升高不会引起刚果红最大吸收波长的红移[26]。刚果红染色实验结果如图7所示,在低NaOH浓度范围内,加入CMBG-1的刚果红最大吸收波长随着NaOH浓度的增加而逐渐红移,在NaOH浓度达到0.2 mol/L时达到最大值(498.5 nm),随后最大吸收波长逐渐蓝移,可能是NaOH浓度过高破坏了多糖的三螺旋结构形成了无规卷曲构象。而加入CMBG-2的刚果红以及空白对照没有呈现红移现象,表明CMBG-2不与刚果红结合,其为无规卷曲构象。
2.4 CMBG降血糖活性研究
食品中的淀粉成分在摄食后依次被体内的α-淀粉酶、α-葡萄糖苷酶降解,生成葡萄糖被人体吸收,使得血糖升高。抑制这两种酶的活性,能有效地减少餐后葡萄糖的生成,从而减少能被人体吸收的葡萄糖量,达到降低餐后高血糖的效果[27]。
2.4.1 CMBG对α-淀粉酶的抑制活性
CMBG对α-淀粉酶抑制活性如图8所示,纯化后的CMBG-1、CMBG-2对α-淀粉酶均有一定的抑制效果。在浓度为2.00~10.00 mg/mL时,抑制率随着浓度的增加而逐渐增大,二者的IC50分别为CMBG-1(2.68 mg/mL),CMBG-2(4.32 mg/mL),明显低于纯化前(4.88 mg/mL),低于大豆多糖(5.60 mg/mL)[28],但高于阳性对照阿卡波糖(1.12 mg/mL)。CMBG-1对α-淀粉酶具有相对较好的抑制效果可能与其较低的分子量以及具有利于发挥生物活性的三螺旋结构有关[29]。较好的α-淀粉酶抑制活性效果,能够使肠道中淀粉类物质转化为寡糖速率减缓,减少肠道菌群产气,在口服降糖药开发中具有一定优势。
2.4.2 CMBG对α-葡萄糖苷酶抑制活性
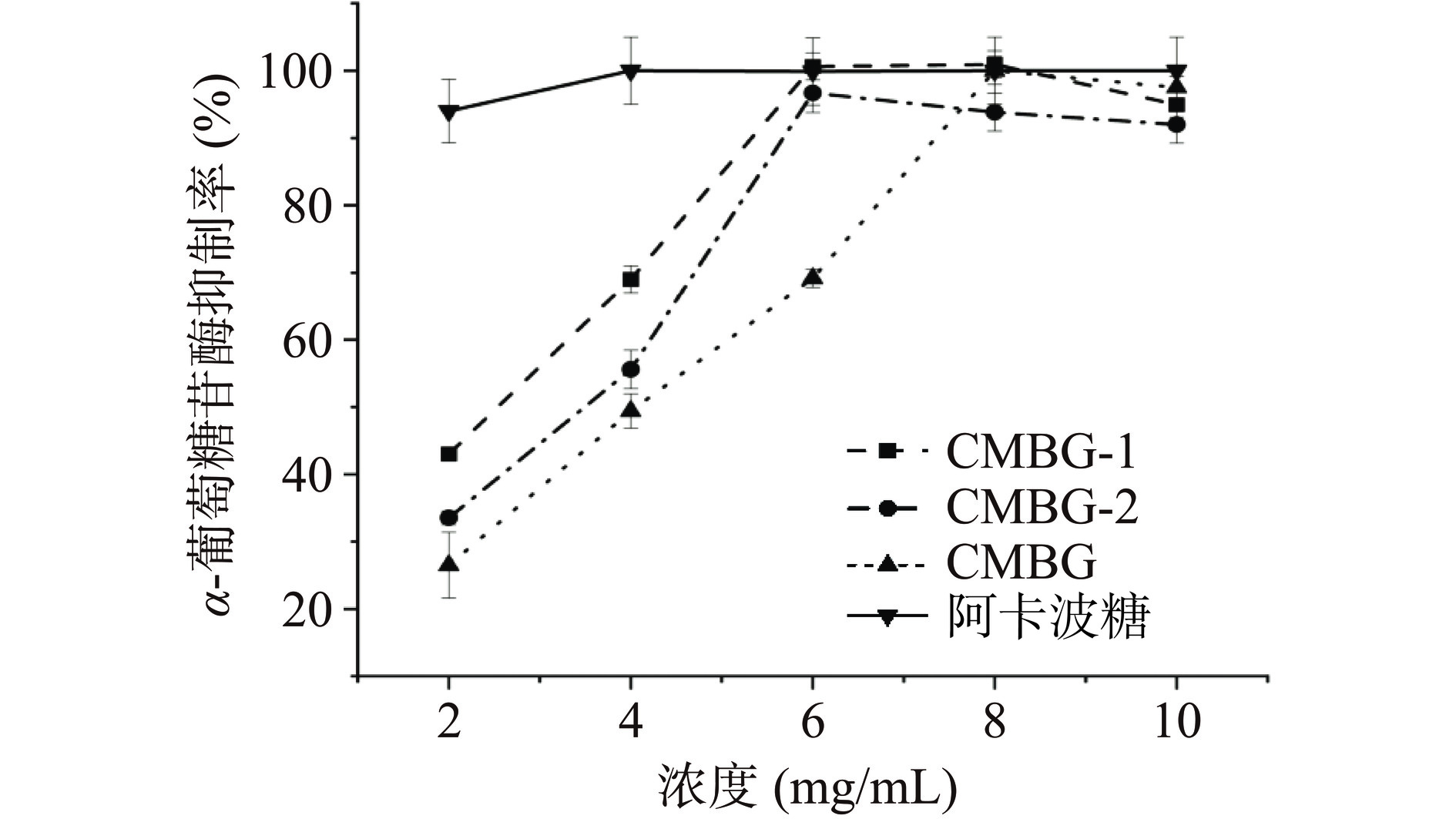
α-葡萄糖苷酶是寡糖降解生成葡萄糖的关键酶[30],样品对α-葡萄糖苷酶抑制效果如图9所示。纯化后的两个组分对α-葡萄糖苷酶均有一定的抑制效果。在浓度为2.00~10.00 mg/mL时,抑制率随着浓度的增加而逐渐增大,呈现出量效依赖关系。其中在2~10 mg/mL的浓度范围内,二者的IC50分别为2.37 mg/mL (CMBG-1)和3.01 mg/mL(CMBG-2),明显低于纯化前(3.95 mg/mL),但高于阳性对照阿卡波糖(1.12 mg/mL),低于桦褐孔菌菌丝体多糖(3.07 mg/mL)等[31]。较好的α-葡萄糖苷酶抑制活性效果,能够减少肠道中寡糖分解为葡萄糖的速率,减少葡萄糖的吸收,从而降低餐后血糖的升高。
2.4.3 CMBG体外降血糖抑制作用类型分析
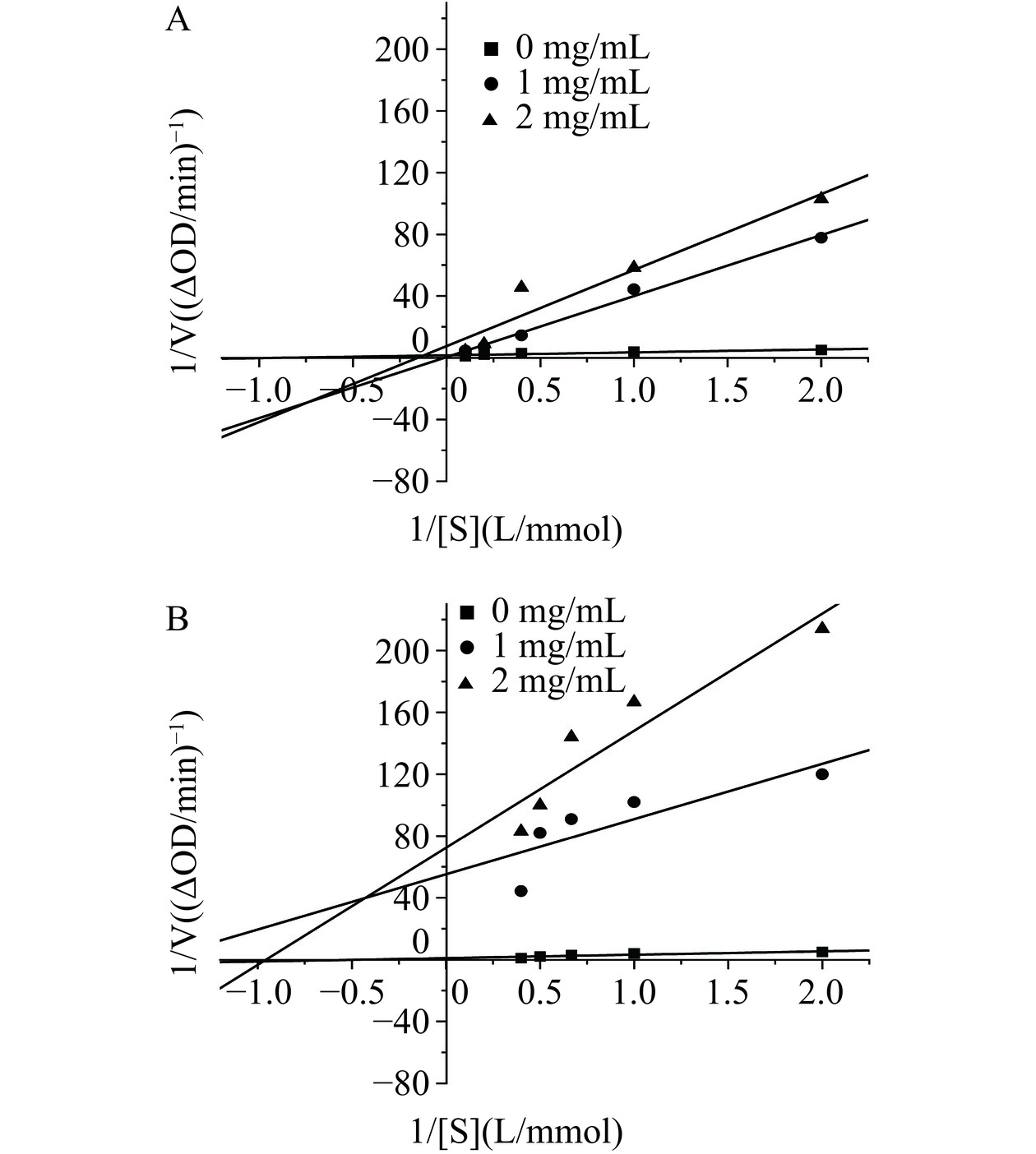
从上分析中可知,CMBG-1相较CMBG-2有更好的体外降血糖活性,针对CMBG-1对α-淀粉酶及α-葡萄糖苷酶的抑制类型进行分析,结果如图10所示。对α-淀粉酶,随着样品浓度的升高,酶反应速率Vmax逐渐减小,而Km亦逐渐降低(A),表明其抑制类型为反竞争性抑制。反竞争型抑制中抑制物不与酶发生反应而是直接同酶-底物复合物作用,即CMBG-1仅在α-淀粉酶与底物结合后才开始作用。对α-葡萄糖苷酶,随着样品浓度的升高,Km升高,Vmax降低(B),表明样品对其抑制类型为非竞争型与竞争型混合型抑制,与岩藻多糖[32]和焦棓酸[33]对α-葡萄糖苷酶的抑制类型类似。混合抑制与底物是否和酶结合无关,抑制剂都可以发挥抑制作用。该类型抑制作用的发挥受底物浓度的影响较小,在餐前低底物或者餐后高底物条件下均可对酶产生抑制作用[34]。综合考虑CMBG-1对上述两种酶的抑制机制,其适合开发成为餐后服用的降糖功能食品。
3. 结论
本文对蛹虫草可溶性β-葡聚糖进行了分离纯化和结构特征分析,并考察了纯化组分的体外降血糖活性。结果显示,经过纯化实验得出大孔树脂吸附最优条件为:上样流速5 mL/min、上样浓度4 mg/mL、树脂质量40 g、上样体积400 mL;经过DEAE-FF纤维素柱层析分离出CMBG-1和CMBG-2两种纯化组分,其中CMBG-1具有更好的降血糖活性,结构分析说明其具有β-糖苷键的三螺旋结构硫酸多糖,主要由Gal、Glc、Man三种单糖以摩尔比分别为1.28:5.27:1.01组成。CMBG-1对α-淀粉酶及α-葡萄糖苷酶的抑制率均与其浓度正相关,IC50分别为2.68和2.37 mg/mL;对α-淀粉酶的抑制类型为反竞争型抑制,对α-葡萄糖苷酶为混合型抑制,有望开发成餐后服用的降糖功能食品。
随着蛹虫草的食用价值、保健功效和药用价值越来越受到人们的重视,蛹虫草中活性成分的提取开发是提高蛹虫草附加值的重要方式。本研究建立了蛹虫草β-葡聚糖分离纯化的工艺方法,获得了具有良好的体外降血糖活性的蛹虫草β-葡聚糖分子片段,为蛹虫草资源的深度开发和体内降血糖活性研究提供了相应的理论支撑。后续将在提高样品得率,结构改造提升生物活性方面继续深入研究,推进蛹虫草β-葡聚糖降血糖功能食品的开发。
-
表 1 大孔树脂静态吸附结果
Table 1 Static adsorption results of macroporous resins
型号 脱色率(%) 多糖保留率(%) 综合评分 HPD-750 69.28±1.21 63.52±0.75 66.40±1.44a 6RXTJ-20 73.20±1.98 56.1±1.22 64.65±2.50ab 6RX-15 75.59±1.33 51.63±1.42 63.61±1.99ab NKA-9 65.70±2.98 61.38±0.87 63.54±1.79ab LX-B40 68.40±4.33 56.08±1.25 61.39±0.33b D101 71.45±1.22 50.59±0.78 61.02±1.43b D1400 69.93±5.33 50.22±2.86 59.75±3.75b YKDH-2 64.27±3.41 55.09±1.87 59.68±4.53b ZG DM130 63.18±4.24 53.66±2.55 58.42±2.47b 注:同列不同小写字母表示差异显著(P<0.05)。 -
[1] 李佩瑶, 高睿晗, 兰春阳, 等. 蛹虫草多糖免疫调节机制的研究进展[J]. 中国免疫学杂志,2023,39(6):1342−1345. [LI Peiyao, GAO Ruihan, LAN Chunyang, et al. Progress of immunoregulatory mechanism of Cordyceps sinensis polysaccharide[J]. Chinese Journal of Immunology,2023,39(6):1342−1345.] doi: 10.3969/j.issn.1000-484X.2023.06.047 LI Peiyao, GAO Ruihan, LAN Chunyang, et al. Progress of immunoregulatory mechanism of Cordyceps sinensis polysaccharide[J]. Chinese Journal of Immunology, 2023, 39(6): 1342−1345. doi: 10.3969/j.issn.1000-484X.2023.06.047
[2] KONTOGIANNATOS D, KOUTROTSIOS G, XEKALAKI S, et al. Biomass and cordycepin production by the medicinal mushroom Cordyceps militaris-A review of various aspects and recent trends towards the exploitation of a valuable fungus[J]. Journal of Fungi,2021,7(11):986. doi: 10.3390/jof7110986
[3] 贾薇, 余燕贞, 刘红丽, 等. 香菇子实体中高β-葡聚糖含量多糖提取物制备及体外免疫活性[J]. 食用菌学报,2023,30(4):51−58. [JIA Wei, YU Yanzhen, LIU Hongli, et al. Preparation of polysaccharide extracts with high β-glucan content from shiitake mushroom cotyledons and in vitro immunological activity[J]. Journal of Edible Mushrooms,2023,30(4):51−58.] JIA Wei, YU Yanzhen, LIU Hongli, et al. Preparation of polysaccharide extracts with high β-glucan content from shiitake mushroom cotyledons and in vitro immunological activity[J]. Journal of Edible Mushrooms, 2023, 30(4): 51−58.
[4] 刘雅利, 车会莲. β-葡聚糖增强肠道免疫功能研究进展[J]. 食品安全质量检测学报,2023,14(19):172−178. [LIU Yali, CHE Huilian. Progress of β-glucan in enhancing intestinal immune function[J]. Journal of Food Safety and Quality Testing,2023,14(19):172−178.] LIU Yali, CHE Huilian. Progress of β-glucan in enhancing intestinal immune function[J]. Journal of Food Safety and Quality Testing, 2023, 14(19): 172−178.
[5] LOU Haiwei, LIN Junfang, GUO Liqiong, et al. Advances in research on Cordyceps militaris degeneration[J]. Applied microbiology and biotechnology,2019,103(19):7835−7841. doi: 10.1007/s00253-019-10074-z
[6] 朱振元, 刘晓翠, 郭蓉, 等. 蛹虫草多糖对α-葡萄糖苷酶活性的抑制研究[J]. 现代食品科技,2014,30(12):55−60. [ZHU Zhenyuan, LIU Xiaocui, GUO Rong, et al. Study on the inhibition of α-glucosidase activity by polysaccharides from Cordyceps sinensis[J]. Modern Food Science and Technology,2014,30(12):55−60.] ZHU Zhenyuan, LIU Xiaocui, GUO Rong, et al. Study on the inhibition of α-glucosidase activity by polysaccharides from Cordyceps sinensis[J]. Modern Food Science and Technology, 2014, 30(12): 55−60.
[7] 胡政宇, 王佳鸣, 于瑞莹, 等. 蛹虫草多糖脱色工艺优化及其抗补体活性研究[J]. 中成药,2023,45(6):1973−1978. [HU Zhengyu, WANG Jiaming, YU Ruiying, et al. Optimization of the decolorization process of Cordyceps sinensis polysaccharide and its anticomplement activity[J]. Chinese Patent Medicine,2023,45(6):1973−1978.] doi: 10.3969/j.issn.1001-1528.2023.06.037 HU Zhengyu, WANG Jiaming, YU Ruiying, et al. Optimization of the decolorization process of Cordyceps sinensis polysaccharide and its anticomplement activity[J]. Chinese Patent Medicine, 2023, 45(6): 1973−1978. doi: 10.3969/j.issn.1001-1528.2023.06.037
[8] 秦令祥, 丁昱婵, 赵俊芳, 等. 蛹虫草多糖提取工艺优化及其抗菌、抗氧化活性[J]. 食品研究与开发,2023,44(11):159−165. [QIN Lingxiang, DING Yuchan, ZHAO Junfang, et al. Optimization of polysaccharide extraction process of Cordyceps sinensis and its antibacterial and antioxidant activities[J]. Food Research and Development,2023,44(11):159−165.] doi: 10.12161/j.issn.1005-6521.2023.11.023 QIN Lingxiang, DING Yuchan, ZHAO Junfang, et al. Optimization of polysaccharide extraction process of Cordyceps sinensis and its antibacterial and antioxidant activities[J]. Food Research and Development, 2023, 44(11): 159−165. doi: 10.12161/j.issn.1005-6521.2023.11.023
[9] FERNANDEZ-JULIA P J, MUNOZ-MUNOZ J, VAN SINDEREN D. A comprehensive review on the impact of beta-glucan metabolism by Bacteroides and Bifidobacterium species as members of the gut microbiota[J]. Int J Biol Macromol,2021,181:877−889. doi: 10.1016/j.ijbiomac.2021.04.069
[10] CHIOZZI V, ELIOPOULOS C, MARKOU G, et al. Biotechnological addition of β-glucans from cereals, mushrooms and yeasts in foods and animal feed[J]. Processes,2021,9(11):1889. doi: 10.3390/pr9111889
[11] ZHANG Y, LI J, XIE J, et al. The impact of food processing on the structure and hypoglycemic effect of oat beta-glucan[J]. Plant Foods Hum Nutr,2023,78(3):506−511. doi: 10.1007/s11130-023-01095-1
[12] BAO Y, SUN K, GUO Y. Effect of molecular weight on hypolipidemic and hypoglycemic activities of fermented Auriculaia auricula supernatant[J]. Food Science and Technology,2020,40(suppl 1):106−112.
[13] 曹敏. 大孔树脂分离纯化茶多酚中表没食子儿茶素没食子酸酯工艺优化[J]. 中成药,2023,45(11):3736−3740. [CAO Min. Optimization of the process for the separation and purification of Epigallocatechin gallate from tea polyphenols by macroporous resin[J]. Proprietary Chinese Medicine,2023,45(11):3736−3740.] doi: 10.3969/j.issn.1001-1528.2023.11.038 CAO Min. Optimization of the process for the separation and purification of Epigallocatechin gallate from tea polyphenols by macroporous resin[J]. Proprietary Chinese Medicine, 2023, 45(11): 3736−3740. doi: 10.3969/j.issn.1001-1528.2023.11.038
[14] 郭静, 赵鸿燕, 李莉, 等. 油樟叶多糖的大孔树脂纯化工艺研究[J]. 离子交换与吸附,2023,39(2):147−156. [GUO Jing, ZHAO Hongyan, LI Li, et al. Purification of polysaccharides from the leaves of Camphorus oleifera with macroporous resin[J]. Ion Exchange and Adsorption,2023,39(2):147−156.] GUO Jing, ZHAO Hongyan, LI Li, et al. Purification of polysaccharides from the leaves of Camphorus oleifera with macroporous resin[J]. Ion Exchange and Adsorption, 2023, 39(2): 147−156.
[15] 邢中夫, 于慧, 万新焕. 淫羊藿多糖提取、分离纯化、结构特征和生物活性研究进展[J]. 药学研究,2023,42(10):830−836. [XING Zhongfu, YU Hui, WAN Xinhuan. Progress of polysaccharide extraction, isolation and purification, structural characterization and bioactivity of Epimedium[J]. Pharmaceutical Research,2023,42(10):830−836.] XING Zhongfu, YU Hui, WAN Xinhuan. Progress of polysaccharide extraction, isolation and purification, structural characterization and bioactivity of Epimedium[J]. Pharmaceutical Research, 2023, 42(10): 830−836.
[16] MCCLEARY B V, DRAGA A. Measurement of beta-glucan in mushrooms and mycelial products[J]. J AOAC Int,2016,99(2):364−373. doi: 10.5740/jaoacint.15-0289
[17] 董一鑫, 陈洁, 于萍, 等. 竹节参多糖的结构表征及体外免疫活性研究[J]. 中药材,2023(11):2754−2759. [DONG Yixin, CHEN Jie, YU Ping, et al. Structural characterization and in vitro immunoreactivity of polysaccharides from Radix Bupleurum[J]. Chinese Materia Medica,2023(11):2754−2759.] DONG Yixin, CHEN Jie, YU Ping, et al. Structural characterization and in vitro immunoreactivity of polysaccharides from Radix Bupleurum[J]. Chinese Materia Medica, 2023(11): 2754−2759.
[18] 李亚童, 阿依夏古丽·巴卡斯, 李改茹, 等. 新疆芜菁酸性多糖分离纯化、抗氧化活性研究及红外表征[J]. 食品安全质量检测学报,2022,13(4):1050−1057. [LI Yatong, AYI Xiaguli Bakas, LI Changru, et al. Separation and purification, antioxidant activity and infrared characterization of acidic polysaccharides from Xinjiang turnip[J]. Journal of Food Safety and Quality Testing,2022,13(4):1050−1057.] doi: 10.3969/j.issn.2095-0381.2022.4.spaqzljcjs202204005 LI Yatong, AYI Xiaguli Bakas, LI Changru, et al. Separation and purification, antioxidant activity and infrared characterization of acidic polysaccharides from Xinjiang turnip[J]. Journal of Food Safety and Quality Testing, 2022, 13(4): 1050−1057. doi: 10.3969/j.issn.2095-0381.2022.4.spaqzljcjs202204005
[19] 李雪超, 赵建伟, 周星, 等. 红米米糠非淀粉多糖的提取纯化与结构表征[J]. 食品与发酵工业,2024,50(9):157−163. [LI Xuechao, ZHAO Jianwei, ZHOU Xing, et al. Extraction, purification and structural characterization of non-starch polysaccharides from red rice bran[J]. Food and Fermentation Industry,2024,50(9):157−163.] LI Xuechao, ZHAO Jianwei, ZHOU Xing, et al. Extraction, purification and structural characterization of non-starch polysaccharides from red rice bran[J]. Food and Fermentation Industry, 2024, 50(9): 157−163.
[20] 李雨鸿, 殷朝敏, 范秀芝, 等. 桑黄提取物的体外抗氧化、降血糖及降尿酸活性[J]. 现代食品科技,2022,38(5):71−80. [LI Yuhong, YIN Chaomin, FAN Xiuzhi, et al. In vitro antioxidant, hypoglycemic and uric acid-lowering activities of extracts of Morus alba[J]. Modern Food Science and Technology,2022,38(5):71−80.] LI Yuhong, YIN Chaomin, FAN Xiuzhi, et al. In vitro antioxidant, hypoglycemic and uric acid-lowering activities of extracts of Morus alba[J]. Modern Food Science and Technology, 2022, 38(5): 71−80.
[21] 刘养山, 张景, 任洪飞, 等. 冠县灵芝多糖的分离纯化、结构表征及抗氧化活性研究[J]. 食品工业科技,2023,44(12):81−89. [LIU Yangshan, ZHANG Jing, REN Hongfei, et al. Separation and purification, structural characterization and antioxidant activity of Ganoderma lucidum polysaccharides from Guanxian[J]. Food Industry Science and Technology,2023,44(12):81−89.] LIU Yangshan, ZHANG Jing, REN Hongfei, et al. Separation and purification, structural characterization and antioxidant activity of Ganoderma lucidum polysaccharides from Guanxian[J]. Food Industry Science and Technology, 2023, 44(12): 81−89.
[22] CAO W, WU J, ZHAO X, et al. Structural elucidation of an active polysaccharide from Radix Puerariae lobatae and its protection against acute alcoholic liver disease[J]. Carbohydrate Polymers,2024,325:121565. doi: 10.1016/j.carbpol.2023.121565
[23] HONG T, YIN J, NIE S, et al. Applications of infrared spectroscopy in polysaccharide structural analysis:Progress, challenge and perspective[J]. Food Chemistry:X,2021,12:100168.
[24] 李灿, 吕金博, 刘会平, 等. 分级醇沉裙带菜褐藻糖胶及其体外降血糖活性研究[J]. 食品工业科技,2024,45(8):309−317. [LI Can, LÜ Jinbo, LIU Huiping, et al. In vitro hypoglycemic activity of graded alcohol precipitated wakame fucoidan[J]. Food Industry Science and Technology,2024,45(8):309−317.] LI Can, LÜ Jinbo, LIU Huiping, et al. In vitro hypoglycemic activity of graded alcohol precipitated wakame fucoidan[J]. Food Industry Science and Technology, 2024, 45(8): 309−317.
[25] KOZO O J T T W. Complex of gel-forming β-1,3-D-glucan with congored in alkaline solution[J]. Chemistry Letters,1972,8(1):689−692.
[26] GUO X, KANG J, XU Z, et al. Triple-helix polysaccharides:Formation mechanisms and analytical methods[J]. Carbohydrate Polymers,2021,262:117962. doi: 10.1016/j.carbpol.2021.117962
[27] LE D T, KUMAR G, WILLIAMSON G, et al. Molecular interactions between polyphenols and porcine α-amylase:An inhibition study on starch granules probed by kinetic, spectroscopic, calorimetric and in silico techniques[J]. Food Hydrocolloids,2024,151:109821. doi: 10.1016/j.foodhyd.2024.109821
[28] 许梦粤, 丁泽宇, 李锦鹏, 等. 大豆多糖与纳豆多糖结构特征和主要生物活性比较[J]. 食品科学,2024,45(7):78−86. [XU Mengyue, DING Zeyu, LI Jinpeng, et al. Comparison of structural characteristics and major biological activities between soybean polysaccharides and natto polysaccharides[J]. Food Science,2024,45(7):78−86.] doi: 10.7506/spkx1002-6630-20230808-050 XU Mengyue, DING Zeyu, LI Jinpeng, et al. Comparison of structural characteristics and major biological activities between soybean polysaccharides and natto polysaccharides[J]. Food Science, 2024, 45(7): 78−86. doi: 10.7506/spkx1002-6630-20230808-050
[29] MUELLER A, RAPTIS J, RICE P J, et al. The influence of glucan polymer structure and solution conformation on binding to (1→3)-beta-D-glucan receptors in a human monocyte-like cell line[J]. Glycobiology,2000,10(4):339−346.
[30] GHOMI M K, DASTYAFTEH N, MONTAZER M N, et al. Synthesis, in vitro potency of inhibition, enzyme kinetics and in silico studies of quinoline-based α-glucosidase inhibitors[J]. Scientific Reports,2024,14(1):501. doi: 10.1038/s41598-023-50711-2
[31] 陈盛宇, 张淑梅, 王玉霞, 等. 桦褐孔菌菌丝体多糖提取工艺优化及其降血糖能力测定[J]. 食品研究与开发,2023,44(19):110−117. [CHEN Shengyu, ZHANG Shumei, WANG Yuxia, et al. Optimization of mycelial polysaccharide extraction process and determination of hypoglycemic ability of birch brown porcine fungus[J]. Food Research and Development,2023,44(19):110−117.] doi: 10.12161/j.issn.1005-6521.2023.19.016 CHEN Shengyu, ZHANG Shumei, WANG Yuxia, et al. Optimization of mycelial polysaccharide extraction process and determination of hypoglycemic ability of birch brown porcine fungus[J]. Food Research and Development, 2023, 44(19): 110−117. doi: 10.12161/j.issn.1005-6521.2023.19.016
[32] ZAHARUDIN N, STAERK D, DRAGSTED L O. Inhibition of α-glucosidase activity by selected edible seaweeds and fucoxanthin[J]. Food Chemistry,2019,270:481−486. doi: 10.1016/j.foodchem.2018.07.142
[33] ZHENG L, LEE J, YUE L, et al. Inhibitory effect of pyrogallol on α-glucosidase:Integrating docking simulations with inhibition kinetics[J]. International Journal of Biological Macromolecules,2018,112:686−693. doi: 10.1016/j.ijbiomac.2018.02.026
[34] 李志鹏, 周晨熠, 潘书童, 等. 2种青稞多糖对胰α-淀粉酶的抑制作用[J]. 食品科学,2023,44(22):192−199. [LI Zhipeng, ZHOU Chenyi, PAN Shutong, et al. Inhibitory effects of two barley polysaccharides on pancreatic α-amylase[J]. Food Science,2023,44(22):192−199.] doi: 10.7506/spkx1002-6630-20230105-035 LI Zhipeng, ZHOU Chenyi, PAN Shutong, et al. Inhibitory effects of two barley polysaccharides on pancreatic α-amylase[J]. Food Science, 2023, 44(22): 192−199. doi: 10.7506/spkx1002-6630-20230105-035





 下载:
下载:


 下载:
下载:
