Molecular Mechanism of Germinated Foxtail Millet Bioactive Peptides in Attenuating Copper-induced Oxidative Damage in Caenorhabditis elegans
-
摘要: 目的:以秀丽隐杆线虫(Caenorhabditis elegans,C. elegans)为模型,探究发芽粟米活性肽(Germinated foxtail millet bioactive peptides,GRBPs)对铜诱导的体内氧化损伤的缓解作用和相关机制。方法:将野生型N2秀丽隐杆线虫随机分为对照组、GRBPs组,观察喂食GRBPs对线虫接受铜刺激后运动能力和存活率的影响;通过检测活性氧(Reactive oxygen species,ROS)、谷胱甘肽(Glutathione,GSH)、过氧化氢酶(Catalase,CAT)和超氧化物歧化酶(Superoxide disumutase,SOD)活性,评估GRBPs对铜诱导线虫氧化损伤的影响;进一步,通过基因组及转录组测序技术(RNA-seq)以及非靶向代谢组学分析,探讨GRBPs的作用机制。最后对抗氧化相关基因进行逆转录和实时定量PCR(qPCR)验证。结果:GRBPs可明显提高铜刺激后线虫的存活率和运动能力;1 mg/mL浓度的GRBPs可极显著降低丙二醛(Malondialdehyde,MDA)含量(P<0.0001),增加CAT和SOD活性,同时调节特定基因(如ctl-1、ctl-2的上调和sod-1、sod-2的下调)的表达量。在基因水平上,GRBPs对线虫的影响主要是调控编码角质层结构成分和活性以及细胞色素酶P450的相关基因表达;在代谢水平上,GRBPs对线虫的影响主要是调控植物次生代谢产物的含量。结论:发芽粟米活性肽可以有效减轻铜诱导的氧化损伤,其作用机制可能是通过提高抗氧化酶活性、降低角质层和细胞色素酶P450相关基因表达和调节植物次生代谢产物的含量来实现。Abstract: Objective: This study aimed to explore the mitigating effects of germinated foxtail millet bioactive peptides (GRBPs) on copper-induced oxidative damage in Caenorhabditis elegans (C. elegans) and its potential mechanisms. Methods: By randomly grouping, the wild-type N2 C. elegans were divided into a control group and GRBPs groups to examine the effects of GRBPs feeding on mobility and survival rate of C. elegans induced by copper. The impact of GRBPs on oxidative damage was assessed by measuring the levels of reactive oxygen species (ROS), glutathione (GSH), and the activities of catalase (CAT), and superoxide dismutase (SOD). Furthermore, the mechanism of action of GRBPs was explored through genomic and transcriptomic sequencing techniques (RNA-seq) and untargeted metabolomics analysis. Antioxidant-related genes were validated by reverse transcription and real-time quantitative PCR (qPCR). Results: GRBPs obviously improved the survival rate and mobility of C. elegans after copper treatment, and a concentration of 1 mg/mL of GRBPs extremely significantly reduced the levels of MDA (P<0.0001), increased the activities of CAT and SOD, and regulated the expression of specific genes (such as upregulation of ctl-1, ctl-2, and downregulation of sod-1, sod-2). At the genetic level, GRBPs mainly regulated the structural constituent of cuticle and the expression of genes related to cytochrome enzyme P450 in C. elegans. At the metabolic level, GRBPs mainly regulated the content of biosynthesis of plant secondary metabolites in C. elegans. Conclusions: This study demonstrates that germinated millet bioactive peptides can effectively alleviate copper-induced oxidative damage, possibly through enhancing the activity of antioxidant enzymes, reducing the expression of cuticle and cytochrome enzyme P450 related genes, and regulating the content of plant secondary metabolites.
-
狐尾黍(Setaria italica)又称粟米,是全球早期种植的粮食作物之一,也是许多发展中地区重要的主食。粟米中蛋白质含量丰富,约占 4.88%~15.58%[1]。多项研究发现,粟米蛋白水解物及其分离出的活性肽具有良好的抗氧化[2]、抗高血压[3]、抗癌[4]、抗糖尿[5−6]和抗菌活性[7]。发芽可以提高粟米中的粗蛋白、总黄酮和多酚含量[8−10],从而提高其抗氧化性能[11]。目前国内外有关发芽粟米中活性成分的研究多集中黄酮和酚类化合物上[12],Theodoro等[13]研究表明发芽粟米因富含膳食纤维、黄酮和多酚类化合物可以缓解高脂高糖饮食引发的成年大鼠氧化应激,而发芽粟米中的蛋白质及活性肽的研究较为欠缺,限制了发芽粟米在食品和医药行业的进一步应用[14]。此前,本实验室已运用化学方法筛选出了粟芽蛋白消化产物超滤组分中小于3 kDa的肽组分,并证实其具有强抗氧化和抗炎潜力[15]。然而,这些组分的抗氧化作用尚未在体内进行评估。
铜是生命活动中必需的微量元素之一,但过量的铜进入生物体会引发氧化应激进而导致器官损伤[16−17]。秀丽隐杆线虫作为一种模式生物[18],因其短生命周期和完整的基因组信息而被广泛用于活性物质的功能评价[19−20]。因此,本研究旨在通过利用秀丽隐杆线虫模型,分析摄入发芽粟米活性肽(Germinated foxtail millet bioactive peptides,GRBPs)对其在过量铜暴露后生长发育和氧化应激相关酶等指标的影响,评估GRBPs的抗氧化作用,并联合转录组和代谢组学技术探究其中的潜在作用机制,为开发发芽粟米相关产品提供科学依据[21−22]。
1. 材料与方法
1.1 材料与仪器
豫谷18谷子 深圳华大小米股份有限公司;大肠杆菌(E. coli OP50)、野生型N2秀丽隐杆线虫 购于美国明尼苏达大学线虫库(Caenorhabditis Genetics Center,CGC);蛋白胨 上海硕联生物科技有限公司;琼脂粉、2,3-萘二甲醛NDA 上海阿拉丁生化科技有限公司;硫酸铜标准溶(0.01 mol/L)、氯化钾、硫酸镁、氯化钙、无水乙醇、磷酸氢二钠、磷酸二氢钾、次氯酸钠、柠檬酸二钠、七水合硫酸亚铁、一水合硫酸锰、七水合硫酸锌 分析纯,广东西陇科学股份有限公司;5-氟尿嘧啶(FUDR) 北京索莱宝科技有限公司;过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide disumutase,SOD)、总谷胱甘肽(Glutathione,GSH)、丙二醛(Malondialdehyde,MDA)测定试剂盒 南京建成生物工程研究所;BCA蛋白浓度测定试剂盒 上海碧云天;羟基苯荧光素HPF 上海懋康生物科技有限公司;PrimeScriptTM RT reagent Kit with qDNA Eraser(Perfect Real Time)、TB Green Premix EX TaqTM Ⅱ(Tli RNaseH Plus) Vazyme公司;无菌离心管、细胞培养板 无锡NEST公司。
B3342高压蒸汽灭菌锅 上海东亚压力容器制造有限公司;BHC-1300生物安全柜 苏州安泰空气技术有限公司;ZHWY-102C恒温培养振荡器 上海智城分析仪器有限公司;MIR-254-PC低温恒温培养箱 上海普和希医疗器械有限公司;Leica M205体式荧光显微镜 德国Leica公司;OLYMPUS BX53显微镜 日本奥林巴斯;Milli-Q超纯水系统 美国蜜理博公司;KZ-Ⅲ研磨仪 武汉塞维尔生物科技有限公司;BR680型多功能酶标仪、ABI数字PCR仪Q3 美国赛默飞世尔科技有限公司;ME204分析天平 瑞士梅特勒-托利多有限公司;真空冷冻干燥机 宁波新芝生物科技有限公司;FS500Y-3型摇摆式粉碎机 广州雷迈机械设备有限公司。
1.2 实验方法
1.2.1 发芽粟米活性肽制备
发芽粟米生物活性肽(GRBPs)的制备方法参考实验室前期研究[15]。发芽粟米蛋白经消化、离心和超滤后收集肽组分(<3 kDa)。
1.2.2 秀丽隐杆线虫的培养与同期化
根据Stiernagle[23]提出的方法对线虫进行培养和维护。用含有食物源(E. coli OP50)的线虫生长培养基(NGM)琼脂平板在20 ℃恒温培养箱中培养。
采用以8%次氯酸钠溶液为有效成分的无菌裂解液对产卵期线虫进行裂解同期化,用1.5 mL磷酸盐缓冲液(M9缓冲溶液,pH6.0)将产卵期成虫从NGM培养基洗至无菌离心管,用M9缓冲溶液洗涤1次后向离心管中加入1.5 mL裂解液,振荡至虫体基本消失后在离心机中4500 r/min离心1 min,除去上清液后加入2 mL M9溶液反复洗涤3次后滴加到空NGM上,虫体孵化后即可得到大量处于L1的线虫,再将其转移至含有OP50的NGM上约48 h加入125 μL FUDR溶液抑制线虫产卵即可得到同期化的L4期线虫。
1.2.3 秀丽隐杆线虫的分组及模型建立
将大量同期化的L4期秀丽隐杆线虫转移至含有一定量灭活OP50菌液、S-complete(S缓冲液)溶液的液体培养基中在25 ℃下培养24 h,分为空白对照组(Control)和实验组。实验组的培养基中分别含有0、0.5、1、1.5、2 mg/mL GRBPs,并记作模型组(Model)、低剂量组(LD)、中剂量组(MD)、中高剂量组(MHD)和高剂量组(HD)。培养结束后将实验组线虫暴露于125 µmol/L硫酸铜溶液中建立氧化应激模型,空白对照组线虫暴露于等体积的S-complete溶液中。
1.2.4 秀丽隐杆线虫的体长和运动能力实验
在空白对照组和实验组中每组随机取约2000条线虫于20 ℃培养6 h。培养结束后收集实验虫体并用M9缓冲溶液冲洗3~5次后放置显微镜下拍摄,并测定虫体长度。每组分析至少使用30条线虫,重复三次。
根据Wang等[24]的方法测定线虫的运动行为,每组随机挑取30条线虫放在新的NGM平板上,计算每30 s的线虫身体的弯曲次数和每20 s头部摇摆次数。
1.2.5 硫酸铜急性氧化应激实验
在Wang等[24]提出的方法上进行急性氧化应激实验。在空白对照组和实验组中每组随机选择100条线虫,每隔1 h监测线虫的存活状态,24 h后结束观察并记录存活率。
1.2.6 秀丽隐杆线虫体内氧化应激相关酶/非酶水平测定
在空白对照组和实验组中每组随机取约2000条线虫于20 ℃培养6 h后用M9溶液清洗3次去除多余的杂质和液体并分装到新的离心管中,加入研磨珠于研磨仪中研磨5 min(60 Hz,间隔20 s),将研磨液放于高速冷冻离心机中10000×g,4 ℃离心2 min取上清液。用BCA试剂盒测定上清液中的蛋白浓度,并按照试剂盒说明书步骤测定和计算CAT、SOD活力和MDA、GSH含量。
1.2.7 ROS和GSH相对水平测定
按照Chu等[25]的方法,分别使用HPF和NDA荧光探针测定细胞内活性氧(ROS)和谷胱甘肽(GSH)的水平。随机取约2000条同期化至L4期线虫分别转入Control、Model和GRBPs组(MD、MHD组)中20 ℃培养6 h后,清洗并分别转移到含有12.5 µmol/L HPF的400 μL M9 缓冲液和40.5 µmol/L的NDA溶液中,在20 ℃下放置1.5 h,然后用M9缓冲液清洗3次。用左旋咪唑麻醉后放置于2%琼脂糖垫片上,用盖玻片覆盖后使用正置荧光显微镜(10×)进行拍摄,图片经Image J 软件分析。
1.2.8 转录组学和代谢组学分析
在Control、Model、MD和MHD各组中随机挑选4000条培养6 h后的线虫,清洗后研磨制成样品送至上海派森诺生物科技有限公司,利用NovaSeq测序平台进行转录组和非靶向代谢组测序,以表达差异倍数|log2FoldChange|>1,显著性P<0.05为条件筛选差异表达基因后进行差异基因富集和对显著性差异代谢物的通路分析。
1.2.9 实时荧光定量qRCR
接收上海派森诺生物科技有限公司提取的各组线虫的总RNA进行反转录合成cDNA,按照试剂盒说明书步骤,以act-4为内参基因,PCR的2−ΔΔCt值进行定量分析。引物设计如表1。
表 1 引物序列Table 1. Primer synthesis sequence基因 上游引物 5’ to 3’ 下游引物 5’ to 3’ ctl-1 CCG TAC TCG TGA TGA TGT GAA GG CGT GGC TGC TCG TAG TTG TG ctl-2 TTC TAC ACC GAG GGA TG GTG AGT CTG TGG ATT ACG CTT CTG gst-1 CCG TGC TCT CGC TCG TCT TAA TG CCT TGC CGT CTT CGT AGT TTC TG skn-1 AGC CGA CGA CGA AGA AGA GAC TGA CGA TGA TTG GAT TGA GGT GTT G sod-1 CCG TGC TGT CGC TGT TCT TC TTC TCC TTC AAT AAC TGC CTG GTC sod-2 TTC AGC CAG CTC TCA AGT TCA ATG CTC CGC CGA TGG TTC TCC TC 1.3 数据处理
使用IBM SPSS 25.0软件进行单因素方差分析,结果均以平均数±标准偏差表示,并采用最小显著差异法(LSD)和塔姆黑尼检验进行多重比较。组间差异表现形式:显著(P<0.05),极显著(P<0.01、P<0.001、P<0.0001)。
2. 结果与分析
2.1 GRBPs对铜刺激后线虫体长、运动行为和存活率的影响
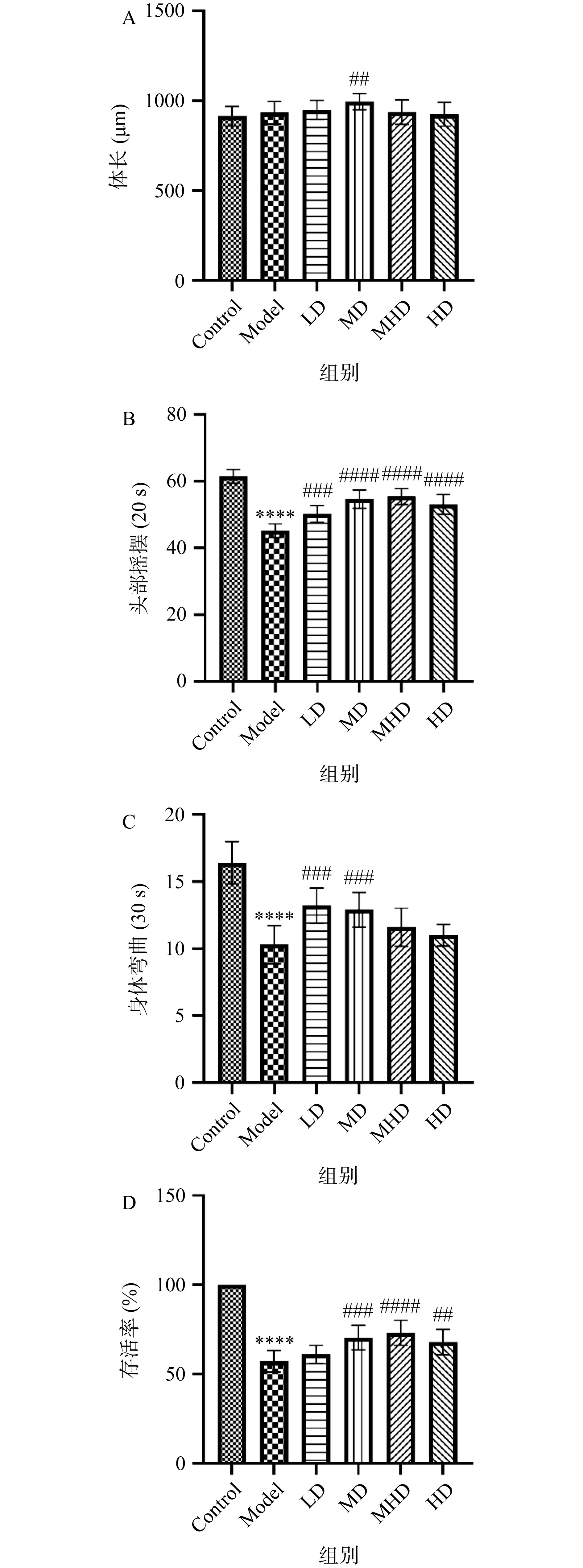
体长、头部摇摆和身体弯曲是反映线虫生长发育和运动能力的基本指标[26]。根据前期实验铜暴露测试选择125 µmol/L硫酸铜来刺激线虫。如图1A所示,与Model组相比,MD组体长增幅最大为6.62%(P<0.01),说明1 mg/mL GRBPs对线虫生长的促进作用最明显。由图1B和1C可知,与Control组相比,Model组线虫头部摇摆和身体弯曲的频率分别极显著减少了26.49%和37.2%(P<0.0001),这与Wang等[24]的研究中线虫暴露于铜离子浓度为100 µmol/L和150 µmol/L环境中时身体弯曲和头部摇摆频率分别下降18.7%~69.0%和19.9%~57.0%(P<0.001)结果一致,表明铜诱导线虫氧化应激模型造模成功。此外,与Model组相比,摄入GRBPs后的线虫头部摇摆和身体弯曲频率均有明显提高,其中LD和MD组线虫身体弯曲频率分别极显著提高了28.16%和25.24%(P<0.001),初步表明GRBPs能够缓解铜刺激引发的线虫运动行为缺陷。图1D显示与Control组相比,Model组线虫的存活率大幅降低了42.04%,差异极显著(P<0.0001);与Model组相比,GRBPs组中MHD组线虫存活率增幅最大为30.91%,具有极显著差异(P<0.0001)。以上结果说明GRBPs可以促进铜暴露下线虫的生长发育,从而提高其存活率。
![]() 图 1 摄入GRBPs后对铜诱导的线虫体长、运动行为和存活率的影响注:(A)体长;(B)头部摇摆;(C)身体弯曲;(D)存活率。与Control组相比,*表示差异显著(P<0.05),**及以上表示差异极显著(P<0.01、P<0.001、P<0.0001);与Model组相比,#表示差异显著(P<0.05);##及以上表示差异极显著(P<0.01、P<0.001、P<0.0001);图2、图3和图6同。Figure 1. Effects of copper stimulation on C. elegans body length, locomotion behaviors and survival rate after ingestion of GRBPs
图 1 摄入GRBPs后对铜诱导的线虫体长、运动行为和存活率的影响注:(A)体长;(B)头部摇摆;(C)身体弯曲;(D)存活率。与Control组相比,*表示差异显著(P<0.05),**及以上表示差异极显著(P<0.01、P<0.001、P<0.0001);与Model组相比,#表示差异显著(P<0.05);##及以上表示差异极显著(P<0.01、P<0.001、P<0.0001);图2、图3和图6同。Figure 1. Effects of copper stimulation on C. elegans body length, locomotion behaviors and survival rate after ingestion of GRBPs2.2 摄入GRBPs对线虫铜诱导氧化损伤的影响
2.2.1 摄入GRBPs对线虫抗氧化酶活力和非酶水平影响
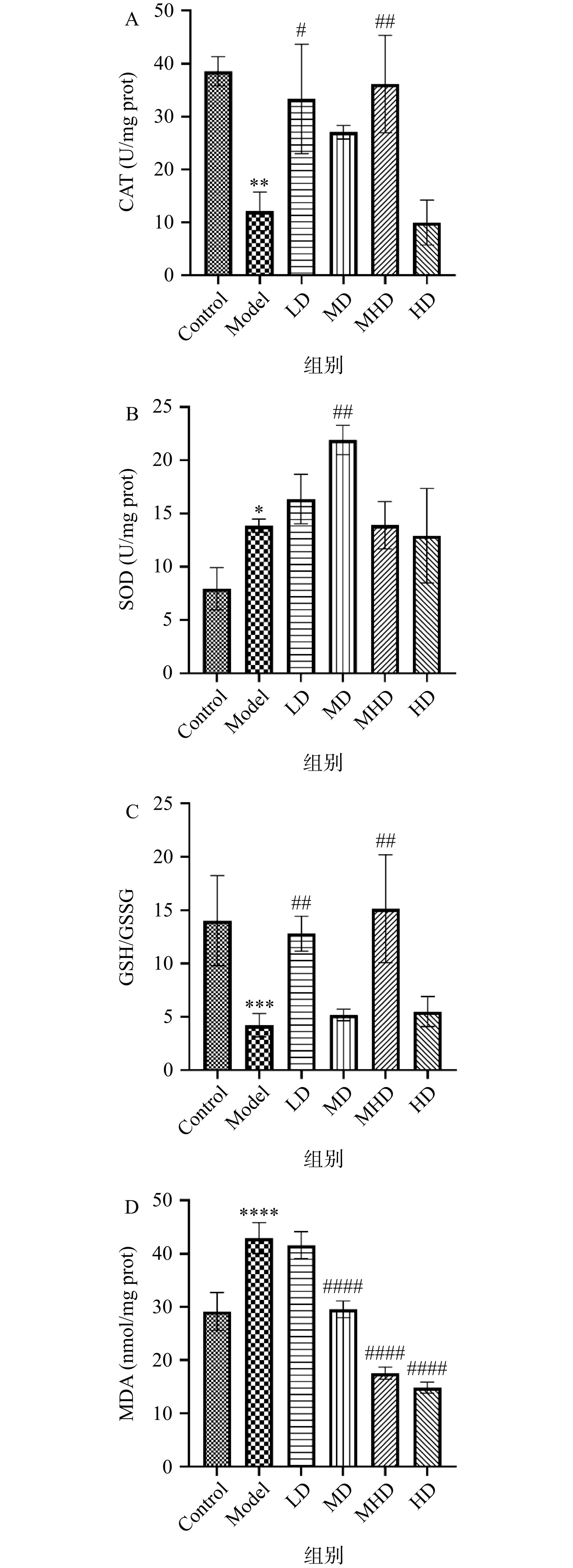
抗氧化酶是生物体抵御铜诱导氧化损伤不可或缺的,其中CAT可分解生物体内过多的活性氧,从而保护细胞;SOD可催化超氧阴离子转化为过氧化氢和氧气[27]。氧化型谷胱甘肽(GSH)和还原型谷胱甘肽(GSSG)含量的变化是反映机体氧化物积累的重要指标。MDA含量测定常被用来间接测定脂质过氧化对细胞造成的损害,通常与SOD活性测定相结合[28]。由图2A可知,与Control组相比,Model组线虫体内的CAT活力极显著下降了68.85%(P<0.01),说明铜暴露后线虫于体内发生了高水平的氧化应激。而LD和MHD组线虫体内的CAT活力分别比Model组显著提高1.76(P<0.05)和1.99倍(P<0.01)。图2B的结果表明,与Model组相比,MD组的SOD活性极显著提高(P<0.01)。以上结果说明GRBPs可通过上调CAT和SOD水平来提升线虫的抗氧化能力,这与王力等[29]实验中线虫摄入牡蛎多肽组分后CAT和SOD活力提升结果一致。图2C显示LD和MHD组线虫体内的GSH/GSSG水平分别比Model组极显著提高2.04和2.59倍(P<0.01),当线虫发生氧化应激时,细胞内GSH会转化为GSSG,说明LD和MHD组线虫体内GSH转化速率降低,抗氧化能力提升,受到氧化应激影响最小。由图2D可知,经GRBPs处理后可以极显著降低线虫体内MDA含量(P<0.0001),且存在剂量依赖关系。综上所述,GRBPs可能通过上调CAT、SOD水平来降低脂质过氧化终产物MDA的含量,从而有效减少铜诱导的氧化损伤。
2.2.2 摄入GRBPs对线虫体内ROS和GSH水平影响
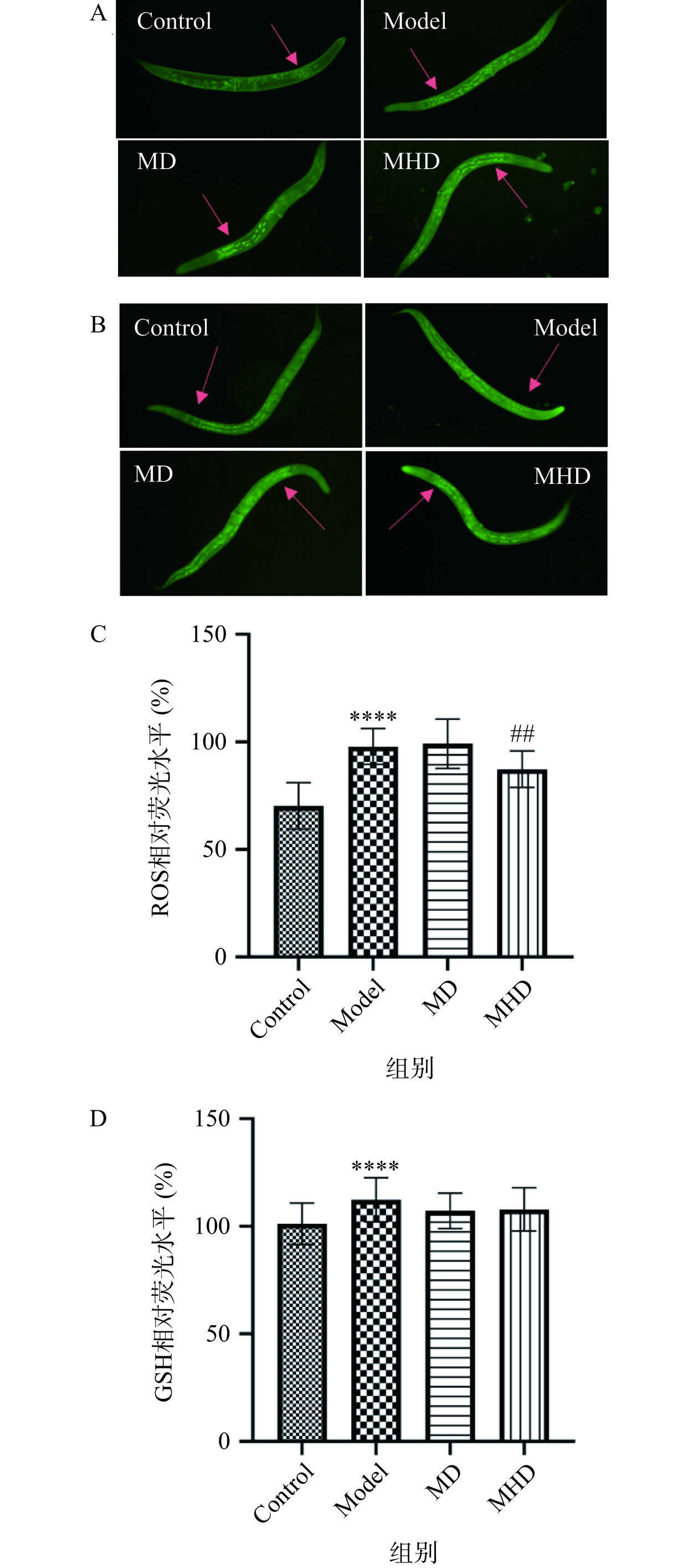
根据上一步实验结果,选择MD和MHD两组GRBPs抗氧化效果较显著的组别进行后续研究。图3A和3B分别为在显微镜下拍摄的线虫照片,通过Image J软件量化线虫体内ROS和GSH水平(图3C和3D),进一步评估GRBPs对线虫抗氧化应激能力的影响。由图3可知,与Control组相比,Model组线虫体内的ROS和GSH水平均极显著升高(P<0.0001),这与Li等[30]实验中线虫暴露在铜环境下后GSH水平升高(P<0.01)的结果一致。与Model组相比,实验组线虫体内ROS水平和GSH水平均下降,且摄入1.5 mg/mL GRBPs的线虫体内ROS水平降幅最高,为10.83%,差异极显著(P<0.01)。这与Sun等[31]的研究发现重组人金属硫蛋白III可有效降低线虫体内ROS水平来抵抗重金属诱导的氧化应激结果相符。以上结果表明,GRBPs可降低铜诱导产生的ROS水平来缓解氧化应激。
2.3 GRBPs 对铜诱导的氧化损伤线虫分子机制
2.3.1 转录组GO富集和KEGG分析
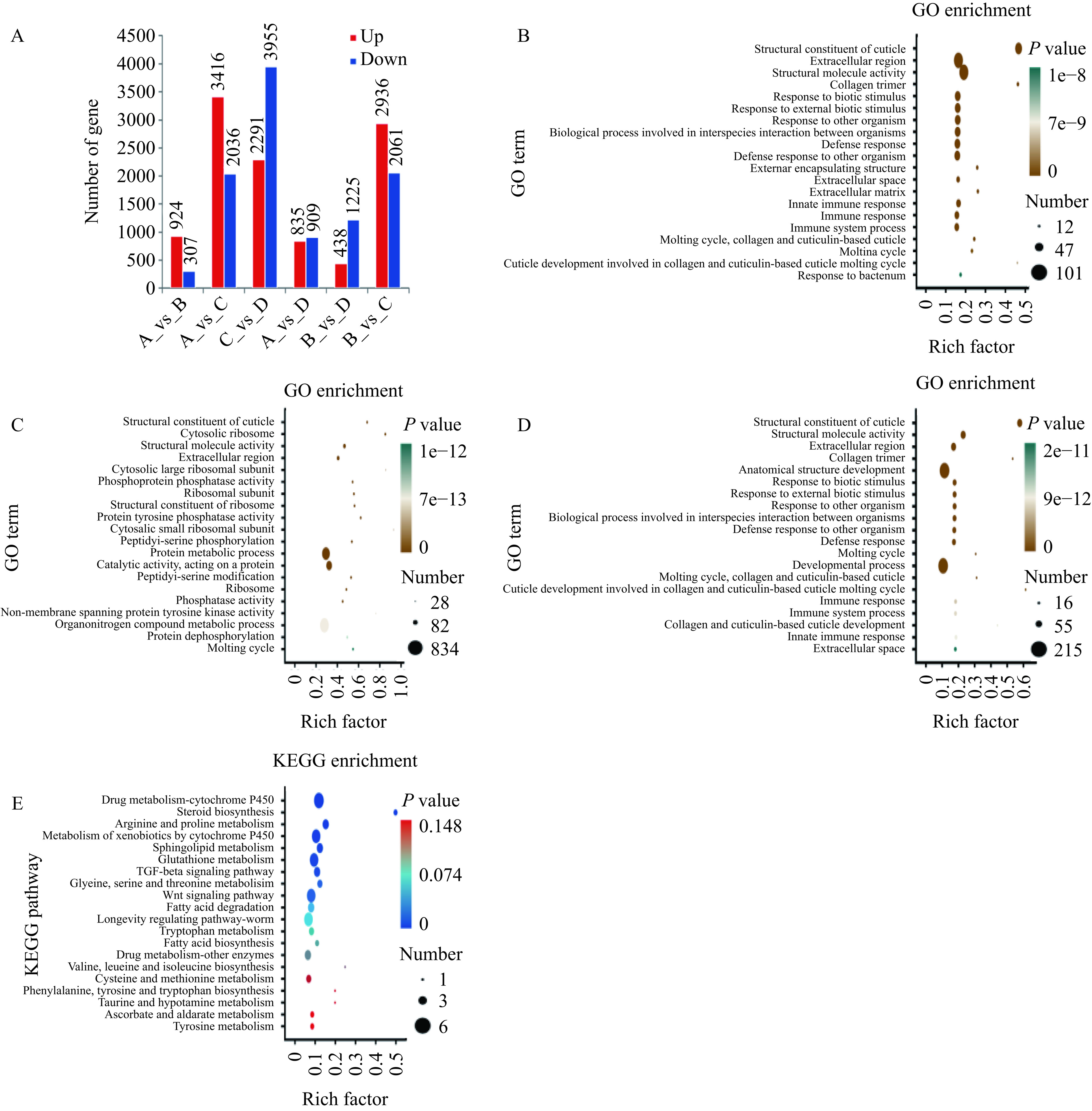
借助NovaSeq平台对四组样本进行了测序,每组有三个生物学平行样本。且RQN/RIN>9.9,相关性分析表明每个样本的相关性均在0.97以上,表明样本间具有良好的重复性。图4A显示Model组与Control组相比共有1231个差异基因(DEGs),其中924个上调,307个下调;MD组与Model组相比共有4997个DEGs(2936个上调,2061个下调),MHD组与Model组共有1663个DEGs(438个上调,1225个下调)。Gpx-5[32]属于谷胱甘肽过氧化物酶,并参与降低活性氧反应,MD组Gpx-5基因表达是Model组的两倍以上。此外,与Control组相比,其他三组中与酰基-CoA脱氢酶活性和谷胱甘肽S转移酶相关的基因(acdh-1和gst-29)以及铁蛋白编码基因ftn-1下调,研究表明acdh-1的表达参与了对秀丽隐杆线虫的进食和生长发育的调控[33],ftn-1基因的表达可影响秀丽隐杆线虫胰岛素/IGF-1信号通路来延长线虫的寿命[34]。因此,GRBPs可以通过影响Gpx-5、acdh-1和ftn-1基因的表达来提高线虫的抗氧化应激能力。
![]() 图 4 转录组基因表达和富集分析注:(A)差异基因结果统计;(B)Control _vs_ Model DEGs GO富集分析;(C)Model _vs_ MD DEGs GO富集分析;(D)Model _vs_ MHD DEGs GO富集分析;(E)Model _vs_ MHD KEGG通路富集分析;各实验结果中A代表Control组,B代表Model组,C代表MD组,D代表MHD组,图5同。Figure 4. Transcriptome gene expression and enrichment analysis
图 4 转录组基因表达和富集分析注:(A)差异基因结果统计;(B)Control _vs_ Model DEGs GO富集分析;(C)Model _vs_ MD DEGs GO富集分析;(D)Model _vs_ MHD DEGs GO富集分析;(E)Model _vs_ MHD KEGG通路富集分析;各实验结果中A代表Control组,B代表Model组,C代表MD组,D代表MHD组,图5同。Figure 4. Transcriptome gene expression and enrichment analysis采用GO富集进一步分析了DEGs富集最多的前20个基因,如图4B~4D所示。差异表达基因主要富集和注释到角质层的结构成分和结构分子活性(Structural constituent of cuticle)上,属于分子功能(MF)。在生物过程(BP)中,防御反应富集了68个DEGs,其中的50个被显著上调,例如clc-1、cnc-4和cpr-3。clc-1[35]参与了对革兰氏阳性菌的防御反应,cnc-4[36]参与了对真菌的防御反应和先天免疫反应。与Model组相比,细胞对氧化应激反应有关的sod-1和sod-3在MD组中出现下调,这说明MD组SOD活力提高可能与sod-1和sod-3等基因的下调有关。Model与MHD组KEGG富集结果如图4E,主要富集在药物代谢-细胞色素P450(Drug metabolism-cytochrome P450)通路上。细胞色素酶P450(cytochrome P450 enzyme system,CYP450)是一类血红蛋白偶联单加氧酶,主要参与药物的生物转化中氧化反应,包括失去电子、脱氢反应和氧化反应,CYP450是主要的药物代谢酶系。铜暴露后,此通路中大多数基因的表达量减少,Kim[37]等指出Cu2+对细胞色素P450催化的肝微粒体反应以及含有纯化P450和NADPH−P450还原酶(NPR)的重构有抑制作用[38]。综上所述,GRBPs通过影响线虫角质层结构成分和活性通路上的基因(如clc-1、cnc-4和cpr-3)以及细胞色素酶P450的相关基因来缓解铜诱导产生的氧化损伤。
2.3.2 代谢组学分析
采用UHPLC-Q-TOF MS对样品进行检测,并结合转录组结果进行对非靶向代谢组学分析。PCA得分图(图5A和5B)显示,每个组在正、负模式之间具有良好的分离效果(R2X>0.5)。比较各组间的PLS-DA模型,预测R2和Q2值均小于实际的R2和Q2值,说明模型没有过度拟合,可以很好地描述样本。所有样品共检测出6646个一级差异代谢物,对各组一级差异代谢物进一步筛选得到二级差异代谢物(DEMs)。如图5C,其中与Control组相比,Model组共有124个DEMs(27个上调,97个下调);与Model组相比,MD组共有28个DEMs(14个上调,14个下调),MHD组共有79个DEMs(37个上调,42个下调)。对各组的差异代谢物进行KEGG通路富集(图5D~5F),与Control组相比,Model组的DEMs大多富集在植物次生代谢物的生物合成(Biosynthesis of plant secondary metabolites)通路上。与Model组相比,MD组的DEMs大多富集在产热(Thermogenesis)通路上;与Model组相比,MHD组的DEMs大多富集在维生素的消化和吸收(Vitamin digestion and absorption)通路上,且在植物次生代谢物的生物合成通路上也存在显著富集,植物次生代谢产物中的一大类为黄酮类化合物,研究表明黄酮类化合物具有强抗氧化活性[39]。以上结果表明,摄入一定量的GRBPs可调控线虫植物次生代谢物的含量,提高线虫的抗氧化应激能力从而有效缓解铜诱导的氧化损伤。
2.4 GRBPs对铜诱导的氧化损伤线虫相关目的基因表达的影响
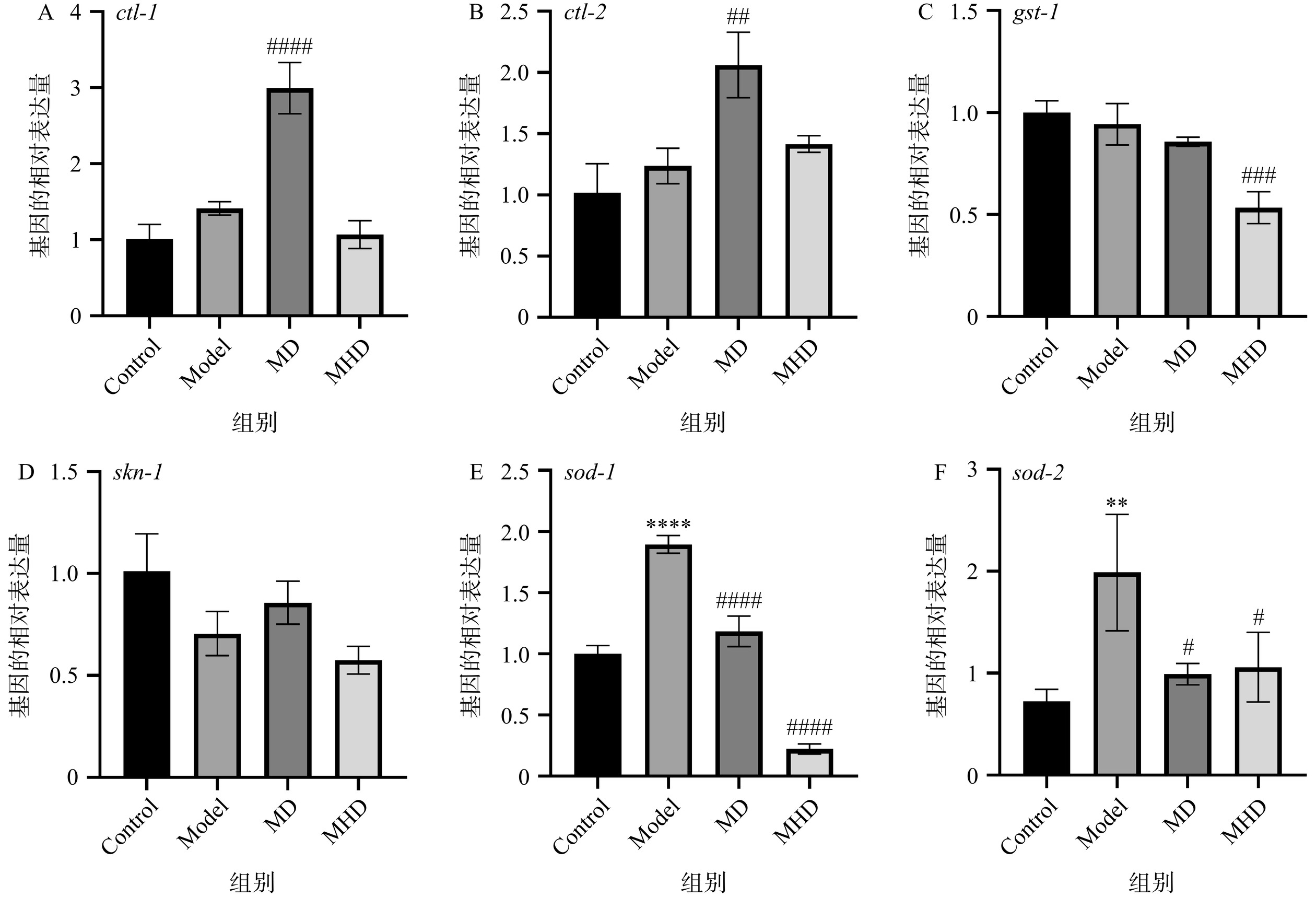
根据以上分析结果,选出了几个与氧化应激相关的目的基因,如表1所示(gst-1、ctl-1、ctl-2、sod-1、sod-2、skn-1),以act-4为内参进行了定量实时PCR(qPCR)。ctl-1[7]编码一种不常见的细胞膜过氧化氢酶,ctl-2[26]编码一种过氧异构体过氧化氢酶。如图6A和6B所示,与Control组相比,其余各组ctl-1和ctl-2基因表达在铜暴露后均呈升高趋势,这与Freedman等[40]发现经硫酸铜处理后治疗组线虫体内ctl-1和ctl-2的mRNA水平显著高于对照组结果一致,且ctl-1和ctl-2在铜解毒中发挥重要作用。此外,Yanase等[41]研究指出降低sod-1和sod-2的过表达触发的未折叠蛋白反应可延长线虫寿命,与Model组相比,GRBPs组sod-1和sod-2水平均显著降低(P<0.05)。氧化应激会导致细胞内skn-1和gst-1基因表达的降低[42],线虫可通过上调skn-1和gst-1基因的表达来对抗氧化应激[43]。但本研究中与Model组相比,只有MD组线虫skn-1的基因表达有所上调但并不显著(P>0.05)。综上所述,GRBPs通过上调抗氧化酶基因ctl-1、ctl-2的表达以及降低sod-1和sod-2的过表达来提高SOD和CAT的活性和抗应激能力从而减轻铜诱导的氧化应激损伤。
3. 结论
本研究揭示了摄入GRBPs能明显提高铜暴露下线虫的生长、运动能力和存活率以及体内的抗氧化酶活性,并降低脂质过氧化物MDA的积累以及ROS水平,有效缓解铜诱导的氧化应激。GRBPs对线虫的影响主要是通过调控编码角质层结构成分和活性、细胞色素酶P450的相关基因表达以及植物次生代谢产物的含量来实现的。另外,GRBPs还能通过调节与抗氧化相关基因ctl-1、ctl-2、sod-1和sod-2基因的表达来提高抗氧化酶活性,以减轻铜诱导的氧化损伤。本研究不仅阐释了GRBPs缓解铜诱导的线虫氧化损伤的作用机制,也为发芽粟米活性肽相关产品的研发和应用提供了理论支持。
-
图 1 摄入GRBPs后对铜诱导的线虫体长、运动行为和存活率的影响
注:(A)体长;(B)头部摇摆;(C)身体弯曲;(D)存活率。与Control组相比,*表示差异显著(P<0.05),**及以上表示差异极显著(P<0.01、P<0.001、P<0.0001);与Model组相比,#表示差异显著(P<0.05);##及以上表示差异极显著(P<0.01、P<0.001、P<0.0001);图2、图3和图6同。
Figure 1. Effects of copper stimulation on C. elegans body length, locomotion behaviors and survival rate after ingestion of GRBPs
图 4 转录组基因表达和富集分析
注:(A)差异基因结果统计;(B)Control _vs_ Model DEGs GO富集分析;(C)Model _vs_ MD DEGs GO富集分析;(D)Model _vs_ MHD DEGs GO富集分析;(E)Model _vs_ MHD KEGG通路富集分析;各实验结果中A代表Control组,B代表Model组,C代表MD组,D代表MHD组,图5同。
Figure 4. Transcriptome gene expression and enrichment analysis
表 1 引物序列
Table 1 Primer synthesis sequence
基因 上游引物 5’ to 3’ 下游引物 5’ to 3’ ctl-1 CCG TAC TCG TGA TGA TGT GAA GG CGT GGC TGC TCG TAG TTG TG ctl-2 TTC TAC ACC GAG GGA TG GTG AGT CTG TGG ATT ACG CTT CTG gst-1 CCG TGC TCT CGC TCG TCT TAA TG CCT TGC CGT CTT CGT AGT TTC TG skn-1 AGC CGA CGA CGA AGA AGA GAC TGA CGA TGA TTG GAT TGA GGT GTT G sod-1 CCG TGC TGT CGC TGT TCT TC TTC TCC TTC AAT AAC TGC CTG GTC sod-2 TTC AGC CAG CTC TCA AGT TCA ATG CTC CGC CGA TGG TTC TCC TC -
[1] AGRAWAL H, JOSHI R, GUPTA M. Purification, identification and characterization of two novel antioxidant peptides from finger millet (Eleusine coracana) protein hydrolysate[J]. Food research international,2019,120:697−707. doi: 10.1016/j.foodres.2018.11.028
[2] XIANG J, YUAN Y, DU L, et al. Modification on phenolic profiles and enhancement of antioxidant activity of proso millets during germination[J]. Food Chemistry:X,2023,18:100628.
[3] LIN Q, SONG B, ZHONG Y, et al. Effect of sodium hyaluronate on antioxidant and anti-ageing activities in Caenorhabditis elegans[J]. Foods,2023,12(7):1400. doi: 10.3390/foods12071400
[4] BARTOLOMEI M, CROPOTOVA J, BOLLATI C, et al. Rainbow trout (Oncorhynchus mykiss) as source of multifunctional peptides with antioxidant, ACE and DPP-IV inhibitory activities[J]. Nutrients,2023,15(4):829. doi: 10.3390/nu15040829
[5] LIU X, QIU B, LIU W, et al. The preventive effects of fermented and germinated foxtail millet whole grain on kidney damage in a diabetic mouse model[J]. Frontiers in Nutrition,2022,9:940404. doi: 10.3389/fnut.2022.940404
[6] CHAUDHARY J K, MUDGAL S. Antidiabetic and hypolipidaemic action of finger millet (Eleusine coracana)-enriched probiotic fermented milk:An in vivo rat study[J]. Food Technology and Biotechnology,2020,58(2):192. doi: 10.17113/ftb.58.02.20.6308
[7] ZHANG L, LIU Y, LA X, et al. The bound polyphenols of foxtail millet (Setaria italica) inner shell inhibit breast cancer by promoting lipid accumulation-induced autophagic death[J]. Food and Chemical Toxicology,2023,177:113855. doi: 10.1016/j.fct.2023.113855
[8] ARORA S, JOOD S, KHETARPAUL N. Effect of germination and probiotic fermentation on nutrient profile of pearl millet based food blends[J]. British Food Journal,2011,113(4):470−481. doi: 10.1108/00070701111123952
[9] MAGALHÃES T L S, DA SILVA B P, GRANCIERI M, et al. Germinated and non-germinated cooked whole millet (Pennisetum glaucum (L.) R. Br.) flours show a promising effect on protein quality, biochemical profile and intestinal health in vivo[J]. Food & Function,2023,14(12):5678−5689.
[10] 张泽俊, 沙坤. 粟米发芽过程中成分含量变化研究[J]. 粮食与油脂,2011(2):21−23. [ZHANG Z J, SHA K. Study on content changes of composition of millet during germination[J]. Cereals & Oils,2011(2):21−23.] doi: 10.3969/j.issn.1008-9578.2011.02.007 ZHANG Z J, SHA K. Study on content changes of composition of millet during germination[J]. Cereals & Oils, 2011(2): 21−23. doi: 10.3969/j.issn.1008-9578.2011.02.007
[11] OWHERUO J O, IFESAN B O, KOLAWOLE A O. Physicochemical properties of malted finger millet (Eleusine coracana) and pearl millet (Pennisetum glaucum)[J]. Food Science & Nutrition,2019,7(2):476−482.
[12] 刘敬科, 张爱霞, 赵巍, 等. 糙小米发芽过程中游离氨基酸的变化分析[J]. 粮油食品科技,2022,30(4):85−94. [LIU J K, ZHANG A X, ZHAO W, et al. Variations of free amino acids during the germination of brown foxtail millet[J]. Science & Technology of Cereals, Oils & Foods,2022,30(4):85−94.] LIU J K, ZHANG A X, ZHAO W, et al. Variations of free amino acids during the germination of brown foxtail millet[J]. Science & Technology of Cereals, Oils & Foods, 2022, 30(4): 85−94.
[13] THEODORO J M V, MARTINEZ O D M, GRANCIERI M, et al. Germinated millet flour (Pennisetum glaucum (L.) R. Br.) reduces inflammation, oxidative stress, and liver steatosis in rats fed with high-fat high-fructose diet[J]. Journal of Cereal Science,2021,99:103207. doi: 10.1016/j.jcs.2021.103207
[14] 胡帅, 高金燕, 武涌, 等. 发芽粟米研究进展[J]. 中国粮油学报,2019,34(1):138−146. [HU S, GAO J Y, WU Y, et al. Research progress on germinated millets[J]. Journal of the Chinese Cereals and Oils Association,2019,34(1):138−146.] HU S, GAO J Y, WU Y, et al. Research progress on germinated millets[J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(1): 138−146.
[15] HU S, YUAN J, GAO J, et al. Antioxidant and anti-inflammatory potential of peptides derived from in vitro gastrointestinal digestion of germinated and heat-treated foxtail millet (Setaria italica) proteins[J]. Journal of Agricultural and Food Chemistry,2020,68(35):9415−9426. doi: 10.1021/acs.jafc.0c03732
[16] 刘子睿, 彭成诚, 彭俊俊, 等. 高铜日粮对肉鸭肾氧化应激和自噬水平的影响[J] 中国兽医学报, 2023, 43(12):2606−2611. [LIU Z R, PENG C C, PENG J J. et al. Effect of high dietary copper on oxidative stress and autophagy in kidney of meat ducks[J]. Chinese Journal of Veterinary Science, 2023, 43(12):2606−2611.] LIU Z R, PENG C C, PENG J J. et al. Effect of high dietary copper on oxidative stress and autophagy in kidney of meat ducks[J]. Chinese Journal of Veterinary Science, 2023, 43(12): 2606−2611.
[17] 史晓群, 杜希友. 铜死亡机制及相关抗癌药物[J]. 生命的化学,2024,44(2):225−232. [SHI X Q, DU X Y. Cuproptosis:Mechanisms and anticancer drug development[J]. Chemistry of Life,2024,44(2):225−232.] SHI X Q, DU X Y. Cuproptosis: Mechanisms and anticancer drug development[J]. Chemistry of Life, 2024, 44(2): 225−232.
[18] ONRAET T, ZURYN S. C. elegans as a model to study mitochondrial biology and disease[C]//Seminars in Cell & Developmental Biology. Academic Press, 2023.
[19] HA N M, TRAN S H, SHIM Y H, et al. Caenorhabditis elegans as a powerful tool in natural product bioactivity research[J]. Applied Biological Chemistry,2022,65(1):1−18. doi: 10.1186/s13765-021-00671-w
[20] 张慧康, 马佳波, 司奇, 等. 基于线虫模型的木姜叶柯抗氧化应激及抗衰老作用[J]. 食品工业科技,2023,44(12):363−370. [ZHANG H K, MA J B, SI Q, et al. Antioxidative stress and anti-aging effects of Lithocarpus litseifolius folium based on Caenorhabditis elegans model[J]. Science and Technology of Food Industry,2023,44(12):363−370.] ZHANG H K, MA J B, SI Q, et al. Antioxidative stress and anti-aging effects of Lithocarpus litseifolius folium based on Caenorhabditis elegans model[J]. Science and Technology of Food Industry, 2023, 44(12): 363−370.
[21] ABIOYE V F, BABARINDE G O, OGUNLAKIN G O, et al. Varietal and processing influence on nutritional and phytochemical properties of finger millet:A review[J]. Heliyon,2022,8(12):e12310. doi: 10.1016/j.heliyon.2022.e12310
[22] 郑小梅, 郑平, 孙际宾. 面向工业生物技术的系统生物学[J]. 生物工程学报,2019,35(10):1955−1973. [ZHENG X M, ZHENG P, SUN J B. Systems biology for industrial biotechnology[J]. Chinese Journal of Biotechnology,2019,35(10):1955−1973.] ZHENG X M, ZHENG P, SUN J B. Systems biology for industrial biotechnology[J]. Chinese Journal of Biotechnology, 2019, 35(10): 1955−1973.
[23] STIERNAGLE T. Maintenance of C. elegans[J]. WormBook, 2006:1−11.
[24] WANG D, XING X. Assessment of locomotion behavioral defects induced by acute toxicity from heavy metal exposure in nematode Caenorhabditis elegans[J]. Journal of Environmental Sciences (China),2008,20(9):1132−1137. doi: 10.1016/S1001-0742(08)62160-9
[25] CHU Q, ZHANG S, YU X, et al. Fecal microbiota transplantation attenuates nano-plastics induced toxicity in Caenorhabditis elegans[J]. Science of the Total Environment,2021,779:146454. doi: 10.1016/j.scitotenv.2021.146454
[26] ZHANG Y, ZHOU Q, LU L, et al. Integrating transcriptomics and free fatty acid profiling analysis reveal Cu induces shortened lifespan and increased fat accumulation and oxidative damage in C. elegans[J]. Oxidative Medicine and Cellular Longevity,2022,2022:5297342.
[27] FUKAI T, USHIO-FUKAI M. Superoxide dismutases:Role in redox signaling, vascular function, and diseases[J]. Antioxidants & Redox Signaling,2011,15(6):1583−1606.
[28] ZHANG J, CHEN R, YU Z, et al. Superoxide dismutase (SOD) and catalase (CAT) activity assay protocols for Caenorhabditis elegans[J]. Bio-protocol,2017,7(16):e2505.
[29] 王力, 肖嵋方, 陈弘培, 等. 牡蛎多肽组分OE-I抗氧化活性及其对秀丽隐杆线虫抗衰老作用[J]. 食品科学,2022,43(3):152−160. [WANG L, XIAO M F, CHEN H P, et al. Antioxidant activity of oyster peptide fraction OE-I and its anti-aging effect on Caenorhabditis elegans[J]. Food Science,2022,43(3):152−160.] WANG L, XIAO M F, CHEN H P, et al. Antioxidant activity of oyster peptide fraction OE-I and its anti-aging effect on Caenorhabditis elegans[J]. Food Science, 2022, 43(3): 152−160.
[30] LI M, HU C, ZHU Q, et al. Copper and zinc induction of lipid peroxidation and effects on antioxidant enzyme activities in the microalga Pavlova viridis (Prymnesiophyceae)[J]. Chemosphere,2006,62(4):565−572. doi: 10.1016/j.chemosphere.2005.06.029
[31] SUN Z, QIN J, YUAN H, et al. Recombinant human metallothionein-III alleviates oxidative damage induced by copper and cadmium in Caenorhabditis elegans[J]. Journal of Applied Toxicology,2023,43(8):1242−1252. doi: 10.1002/jat.4460
[32] TOLMACHEVA A S, NEVINSKY G A. Essential protective role of catalytically active antibodies (Abzymes) with redox antioxidant functions in animals and humans[J]. International Journal of Molecular Sciences,2022,23(7):3898. doi: 10.3390/ijms23073898
[33] MACNEIL LESLEY T, WATSON E, ARDA H E, et al. Diet-induced developmental acceleration independent of TOR and insulin in C. elegans[J]. Cell,2013,153(1):240−252. doi: 10.1016/j.cell.2013.02.049
[34] ACKERMAN D. Gene regulatory mechanisms controlling ageing in Caenorhabditis elegans[D]. UCL (University College London), 2011.
[35] THAWNG C N, SMITH G B. Transcriptome software results show significant variation among different commercial pipelines[J]. BMC Genomics,2023,24(1):662. doi: 10.1186/s12864-023-09683-w
[36] SAPKOTA M, ADNAN QURESHI M, ARIF MAHMUD S, et al. A nematode-derived, mitochondrial stress signaling-regulated peptide exhibits broad antibacterial activity[J]. Biology Open,2021,10(5):bio058613. doi: 10.1242/bio.058613
[37] JOON-SIK K, TAEHO A, SUNG-KUN Y, et al. Differential effect of copper (II) on the cytochrome P450 enzymes and NADPH-cytochrome P450 reductase:Inhibition of cytochrome P450-catalyzed reactions by copper (II) ion[J]. Biochemistry,2002,41:9438−9447. doi: 10.1021/bi025908b
[38] DOYCHEVA D, XU N, TANG J, et al. Viral-mediated gene delivery of TMBIM6 protects the neonatal brain via disruption of NPR-CYP complex coupled with upregulation of Nrf-2 post-HI[J]. Journal of Neuroinflammation,2019,16(1):174. doi: 10.1186/s12974-019-1559-4
[39] 陈含, 李浙浙, 王东升, 等. 木槿花瓣中的总黄酮成分及抗氧化能力分析[J]. 食品工业科技,2022,43(22):336−344. [CHEN H, LI Z Z, WANG D S, et al. Analysis of total flavonoids and antioxidant capacity in petals of Hibiscus syriacus[J]. Science and Technology of Food Industry,2022,43(22):336−344.] CHEN H, LI Z Z, WANG D S, et al. Analysis of total flavonoids and antioxidant capacity in petals of Hibiscus syriacus[J]. Science and Technology of Food Industry, 2022, 43(22): 336−344.
[40] FREEDMAN J H, SONG S, ZHANG X, et al. Molecular basis for antioxidant enzymes in mediating copper detoxification in the nematode Caenorhabditis elegans[J]. PLoS One,2014,9(9):e107685. doi: 10.1371/journal.pone.0107685
[41] YANASE S, YASUDA K, ISHII N. Interaction between the ins/IGF-1 and p38 MAPK signaling pathways in molecular compensation of sod genes and modulation related to intracellular ROS levels in C. elegans[J]. Biochemistry and Biophysics Reports,2020,23:100796. doi: 10.1016/j.bbrep.2020.100796
[42] SETTIVARI R, VANDUYN N, LEVORA J, et al. The Nrf2/SKN-1-dependent glutathione S-transferase π homologue GST-1 inhibits dopamine neuron degeneration in a Caenorhabditis elegans model of manganism[J]. NeuroToxicology,2013,38:51−60. doi: 10.1016/j.neuro.2013.05.014
[43] LU H, SUN L, TONG S, et al. Latilactobacillus curvatus FFZZH5L isolated from pickled cowpea enhanced antioxidant activity in Caenorhabditis elegans by upregulating the level of glutathione S-transferase[J]. Food & Function,2023,14(18):8646−8660.





 下载:
下载:
 下载:
下载:



