Ginseng-derived Nanoparticles Inhibit Lung Cancer Cell Growth by Promoting Macrophage M1 Polarization
-
摘要: 目的:旨在探讨人参外泌体(Ginseng-derived nanoparticles,GDNPs)通过改变巨噬细胞极化状态,抑制人非小细胞肺癌细胞(A549)生长的分子机制,为人参鲜药的深入研究提供一定的理论基础。方法:采用CCK-8法检测人参外泌体对巨噬细胞(RAW264.7)活力的影响;实时定量PCR检测人参外泌体刺激巨噬细胞M1极化相关指标IL-6、iNOS、TNF-α、MCP-1转录水平;流式细胞术检测M1型巨噬细胞分子标志CD80的表达。收集LPS和人参外泌体处理的RAW264.7细胞衍生的上清液,制成条件培养基(CM),并与A549共培养。CCK8和流式细胞术检测A549细胞活力、细胞周期和细胞凋亡;采用Western blot检测GDNPs-CM对A549细胞中TLR4/MyD88通路相关蛋白表达的影响。结果:人参外泌体能够增强巨噬细胞的细胞活力(P<0.05,P<0.01),并提高巨噬细胞M1极化相关指标IL-6、iNOS、TNF-α、MCP-1转录水平的表达(P<0.05,P<0.01,P<0.0001);人参外泌体增强了M1型巨噬细胞分子标志CD80的表达(P<0.01)。在条件培养基作用下,A549细胞的细胞活力受到抑制,并发生G1期阻滞, A549细胞的凋亡率提高(P<0.05,P<0.01);同时,GDNPs-CM促进了A549细胞中TLR4、MyD88、NF-κB、iNOS、COX-2等炎症相关蛋白表达量(P<0.05,P<0.01)。结论:人参外泌体通过刺激巨噬细胞M1极化,抑制A549细胞增殖,调节A549细胞周期,激活TLR4/MyD88 /NF-κB信号通路提高炎症因子的表达水平,从而诱导肺癌细胞凋亡。Abstract: Objective: To explore the molecular mechanism by which ginseng-derived nanoparticles (GDNPs) inhibit the growth of human non-small cell lung cancer cells (A549) by altering the polarization state of macrophages. This study will provide a theoretical basis for further research on fresh ginseng medicine. Methods: The CCK-8 assay was employed to detect the effect of GDNPs on the viability of macrophages (RAW264.7). Real-time quantitative PCR was utilized to detect the transcript levels of IL-6, iNOS, TNF-α, and MCP-1, which were indicators related to the M1 polarization of macrophages stimulated by GDNPs. Flow cytometry was utilized to detect the expression of M1 macrophages molecular markers CD80, which was related to the M1 polarization of macrophages stimulated by GDNPs. RAW264.7 cells were treated with LPS and GDNPs, and the culture supernatants were collected to prepare a conditional medium (CM), which was subsequently co-cultured with A549 cells. CCK-8 and flow cytometry were employed to assess the cell viability, cell cycle, and apoptosis of A549 cells. Western blotting was performed to investigate the effect of GDNPs-CM on the expression of TLR4/MyD88 pathway-related proteins in A549 cells. Results: GDNPs enhanced the cell viability of macrophages (P<0.05, P<0.01) and increased the transcript levels of IL-6, iNOS, TNF-α, and MCP-1 (P<0.05, P<0.01, P<0.0001). GDNPs enhanced the the expression of M1 macrophages molecular markers CD80 (P<0.01). Under the influence of GDNPs-CM, the cell viability of A549 cells was inhibited, and the cells exhibited G1 phase arrest with an increased apoptosis rate (P<0.05, P<0.01). Simultaneously, GDNPs-CM promoted the expression levels of inflammation-related proteins, such as TLR4, MyD88, NF-κB, iNOS, and COX-2 in A549 cells (P<0.05, P<0.01). Conclusion: GDNPs induce apoptosis in lung cancer cells by stimulating M1 polarization of macrophages, inhibiting the proliferation of A549 cells, regulating the A549 cell cycle, and activating the TLR4/MyD88/NF-κB signaling pathway to promote the expression levels of inflammatory factors.
-
肺癌是全世界发病率和死亡率最高的癌症,其5年生存率低于18%,严重威胁着人类的健康和生存[1−2]。每年约有180万肺癌患者确诊,其中80%为癌症晚期[3]。80%的肺癌癌症病例为非小细胞肺癌(NSCLC)。尽管在早期检测和系统治疗方面取得了一些进展,但NSCLC患者的预后仍然很差。化疗是非小细胞肺癌的核心疗法,但几乎所有的患者都在短暂缓解后,出现耐药[4],化疗药物主要通过干扰细胞增殖的不同环节以抑制或消灭肿瘤细胞,然而此类药物毒副反应大,患者依从性差,且几乎所有化疗药物都缺乏明确的疗效预测标志物[5],因此,寻找一种有效、安全、可靠的新治疗方法变得尤为重要。
外泌体是一种直径约为30~150 nm的膜状囊泡,由细胞内多囊泡体与细胞膜融合后释放到细胞外,在细胞间和种间交流中起着重要作用[6],外泌体膜内含有大量蛋白质和脂质、DNA和RNA,可调控多种生理或病理反应[7],并且其还可以影响体内基因转录翻译、细胞分化、代谢调控、血管生成、肿瘤细胞侵袭和转移以及免疫应答等多种作用。
外泌体可由大多数类型的细胞分泌,分泌出的外泌体可能是与受体细胞的膜结合或融合,然后将其膜表面蛋白和膜内生物活性成分传递给受体细胞来参与细胞间通讯,研究表明它们可以调节受体细胞中的基因和蛋白质表达水平,从而介导多细胞生物的生理及病理功能[8]。在过去的很多年里,哺乳动物外泌体运输生物活性物质的能力刺激了对其生物学的研究和基于外泌体的诊断和测试的发展[9]。与哺乳动物细胞一样,植物细胞也分泌外泌体,可能参与植物细胞-细胞通信,作为调节植物先天免疫的一种手段[10]。肿瘤相关巨噬细胞(TAMs)是肿瘤微环境(tumor microenvironment,TME)的主要组成部分[11]。肿瘤微环境中肿瘤细胞和肿瘤相关巨噬细胞之间的复杂通信影响癌症的发展。TAMs可以在不同的环境产生促肿瘤或抗肿瘤作用[12]。经典活化巨噬细胞(M1s)和选择性活化巨噬细胞(M2s)是两种主要的巨噬细胞极化状态,也代表Th1/Th2分化模式[13],未极化的巨噬细胞可被细菌成分(如脂多糖)、肿瘤坏死因子(TNF-α)和干扰素(IFN-γ)等Th1细胞因子激活,然后向M1型巨噬细胞极化,M1型巨噬细胞高表达TNF-α、诱导型一氧化氮合酶(iNOS)、IL-6,并表现出抗肿瘤活性[14−15]。TAMs在肿瘤组织中的浸润已被证明支持肿瘤生长、血管生成、侵袭和转移;并且,肿瘤中TAMs的高密度与肿瘤进展和耐药性相关。因此,TAMs被认为是新型抗癌药物的有前途的靶点[16],有证据表明,来自哺乳动物细胞的天然和修饰外泌体可以在巨噬细胞中诱导抗肿瘤反应,以抑制肿瘤生长[17−18]。
人参因其具有许多药理特性而闻名,这些特性源于其与炎症、氧化应激、血管生成和癌症转移相关的信号通路的组成成分的调节活性[19],人参可以通过不同的机制诱导细胞凋亡,减少癌细胞的增殖,阻止血管生成过程,从而阻止癌症的转移,从而控制多种类型的癌症,如肝脏、皮肤、乳房、结肠和肺[20]。近年来,对人参外泌体的研究发现,人参外泌体可以通过调控免疫细胞的极化来抑制黑色素瘤的生长[21]。此外,人参外泌体通过活性血脑屏障渗透和肿瘤微环境调节来治疗胶质瘤,已经成为了一种在治疗神经胶质瘤方面有前途的药物选择[22];因此,本文主要探讨人参外泌体通过改变巨噬细胞极化状态抑制非小细胞肺癌细胞的生长的分子机制,为人参鲜药的深入研究提供一定的理论基础。
1. 材料与方法
1.1 材料与仪器
人参 市售6年新鲜人参,产地吉林;小鼠单核巨噬细胞 RAW264.7(CL-0190)、人非小细胞肺癌细胞A549(CL-0016)、Ham,s F-12K(WHB823P231)、RAW264.7专用培养基(WHAA23G033) 购自武汉普诺赛生命科技有限公司;LPS(S11060) 购自上海源叶生物科技有限公司;BCA蛋白测定试剂盒(P0012)、细胞周期试剂盒(C1052)、细胞凋亡试剂盒(C1062M) 购自上海碧云天公司;反转录试剂盒(AU341)、基因扩增试剂盒(AQ601) 购自全式金生物科技有限公司;β-Actin Rabbit mAb(AP0060)、TLR4 polyclonal antibody(BS91353)、MyD88 Rabbit monoclonal antibody(BS40219)、iNOS Rabbit monoclonal antibody(BS40374)、COX-2 polyclonal antibody(BS90326) 购自Bioworld;NF-κB P65 Rabbit mAb(8242T) 购自美国CST;FITC anti-mouse CD80 antibody(104705) 购自Biolegend。
Infinite 200 Pro酶标仪 瑞士TECAN公司;111型二氧化碳培养箱 美国Thermo公司;IX73荧光显微镜 日本Lympus公司;1645050型蛋白凝胶电泳仪 美国BIO-RAD公司;FL1000 iBright智能成像系统 美国赛默飞世尔科技有限公司;CFX96荧光定量PCR仪 美国BIO-RAD公司。
1.2 实验方法
1.2.1 人参外泌体的提取纯化
1.2.1.1 人参外泌体的提取
本研究通过参考卢姝言等[23]的实验方法对鲜参中的人参外泌体进行提取,具体提取纯化方法如下:将人参清洗干净,在匀浆器中加入PBS匀浆,过滤,加入蛋白酶抑制剂,使用1 mol·L−1 Tris-HCl调人参液的pH至7,在转速为400×g、800×g和10000×g条件下离心20 min取上清液,再用超速离心机在100000×g下离心1 h,用20 mmol·L−1 Tris-HCl重悬并充分涡旋沉淀。
1.2.1.2 人参外泌体的纯化
二浓度蔗糖垫纯化:配制1 mol·L−1、2 mol·L−1蔗糖溶液,在离心管内依次加入样品溶液、1 mol·L−1和2 mol·L−1蔗糖溶液,100000×g离心1 h,轻轻吸取样品层,然后加入20 mmol·L−1的Tris-HCl至全管,100000×g离心1 h,洗去多余的蔗糖,再用20 mmol·L−1的Tris-HCl重悬并充分涡旋沉淀,获得纯化的人参外泌体。本课题组通过透射电子显微镜观察人参外泌体,结果显示,纯化后的外泌体形态均一,粒径集中在317.90±4.43 nm,其外部有明显的双层膜结构,整体呈大小不一的茶托样或半球样结构,符合外泌体显微鉴别特征[23];通过BCA试剂盒测定纯化后人参外泌体蛋白质的浓度,根据不同浓度牛血清白蛋白标准品在562 nm处的吸光度值绘制标准曲线,根据标准曲线计算得出纯化后人参外泌体的收率为103 mg/kg。
1.2.2 细胞培养及条件培养基的制备
RAW264.7细胞使用RAW264.7细胞专用培养基养,置于37 ℃和5%CO2的细胞培养箱中培养。RAW264.7细胞培养24 h,阳性组给予1 µg·mL−1的LPS刺激,给药组加入浓度5、10、20 µg·mL−1的人参外泌体,培养24 h,收集细胞培养上清液,以2000 r/min离心10 min,并通过0.22 µm细胞滤网过滤,制备成条件培养基(CM)。A549细胞使用含10%胎牛血清、1%链霉素和青霉素的Ham's F-12K培养基培养,A549细胞铺板,培养24 h,弃去上清液,加入条件培养基2 mL后共培养24 h。
1.2.3 人参外泌体对RAW264.7细胞活力的测定实验
收集对数生长期RAW264.7细胞,以密度为2×104 个/mL接种于96孔细胞培养板中,在恒温培养箱中培养24 h;设置实验分组:空白对照组;阴性对照组(20 mmol·mL−1的Tris-HCl);阳性对照组(1 µg·mL−1的LPS);人参外泌体给药组(人参外泌体浓度为5、10、20 μg·mL−1),每组设置6个复孔,24 h后,在避光条件下,加入CCK-8,37 ℃孵育30 min;在波长为450 nm处检测各孔OD值。细胞存活率计算公式如下:
式中:A0为空白组的OD值;A样本为实验组的OD值;A空白为空白对照组OD值。
1.2.4 实时定量PCR
收集对数生长期的RAW264.7细胞,铺板密度为1.0×105个细胞/孔,接种于六孔培养板内,设置空白对照组、阳性对照组(浓度为1 µg·mL−1的LPS)、人参外泌体给药组(5、10、20 µg·mL−1),培养24 h,弃去原有培养基,按照分组给药,培养24 h后收集细胞,用Trizol提取总mRNA,根据反转录试剂盒说明合成cDNA。使用实时定量PCR检测IL-6、iNOS、TNF-α、MCP-1转录水平的含量。实时定量PCR扩增反应条件是94 ℃,30 min,1个循环;94 ℃,30 s,55 ℃,30 s,40个循环;95 ℃,1 min,72 ℃,10 min,1个循环,PCR引物序列如表1。
表 1 实时定量PCR引物序列Table 1. Sequences of real-time quantitative PCR primers基因 上游引物序列 上游引物序列 GAPDH 5'-ACATCGCTCAGACACCATG-3' 5'-TGTAGTTGAGGTCAATGAAG-3' IL-6 5'CGGAGAGGAGACTTCACAGAG-3' 5'-CATTTCCACGATTTCCCAGA-3' TNF-α 5'-TTGTCTACTCCCAGGTTCTCT-3' 5'GAGGTTGACTTTCTCCTGGTATG-3' iNOS 5'-GGACCCAGTGCCCTGCTTT-3' 5'-CACCAAGCTCATGCGGCCT-3' MCP-1 5'-AACTGCATCTGCCCTAAGGT-3' 5'-CTGTCACACTGGTCACTCCT-3' 以GAPDH为内参,根据2−ΔΔCt的方法确定转录水平变化。
1.2.5 流式细胞术检测人参外泌体对RAW264.7细胞极化的影响
RAW264.7细胞按照1.2.4培养,吸出原有的培养基,1000×g离心5 min收集细胞,PBS重悬,加入3 µL FITC anti-mouse CD80 antibody,4 ℃避光孵育30 min,1000×g离心5 min,弃去上清,PBS洗涤一次,1000×g离心5 min,弃去上清,300 µL重悬细胞,流式细胞术检测M1型巨噬细胞标志CD80的表达。
1.2.6 A549细胞活力测定实验
A549细胞按照密度3.0×104个细胞/孔铺板,培养24 h,吸出原有的培养基,加入相应的条件培养基,培养24 h,按照比例加入CCK-8溶液,在细胞培养箱孵育30 min,在450 nm处测定吸光度并计算。细胞存活率计算公式如下:
式中:A0为空白组的OD值;A样本为实验组的OD值;A空白为空白对照组OD值。
1.2.7 A549细胞周期实验
A549细胞按6.0×104个细胞/孔接种于六孔培养板内,培养24 h,弃去原有培养基,加入相应的条件培养基,培养24 h后,室温条件下,1000×g左右离心5 min,收集细胞,取细胞沉淀,按照细胞周期检测试剂盒说明书对细胞进行染色处理,利用流式细胞仪检测A549细胞周期的变化,运用分析软件FlowJo 7.6分析细胞周期变化。
1.2.8 A549细胞凋亡实验
细胞培养方法如1.2.7,使用胰酶消化,收集细胞到离心管中,1000 r/min离心5 min后弃去上清,加入400 μL Annexin V-FITC结合液轻轻重悬细胞,加入5 μL Annexin V-FITC和10 μL碘化丙啶染色液,混匀,37 ℃避光孵育20 min,用流式细胞分析仪检测人参外泌体刺激巨噬细胞极化对A549细胞凋亡的影响。
1.2.9 免疫印迹
细胞培养方法如1.2.7,收集细胞到离心管内,1000×g离心5 min,吸除上清,加入适量RIPA裂解液,充分裂解细胞。使用BCA蛋白测定试剂盒测定蛋白浓度并调整至相同浓度,利用十二烷基磺酸钠-聚丙稀酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)分离,恒流220 mA转膜90 min、使用5% PBS奶粉封闭1 h后,使用TLR4、MyD88、NF-κB、iNOS、COX-2一抗孵育过夜,回收一抗,PBST洗涤3次,二抗室温孵育1 h,PBST洗涤3次,使用iBright智能成像系统显色并观察条带,用Image J软件进行分析。
1.3 数据处理
实验数据采用GraphPad Prism 8.0软件进行统计学分析,数据资料采用均值±标准差(X±SD)表示,组间数据采用单因素方差分析,P<0.05表示显著性差异。
2. 结果与分析
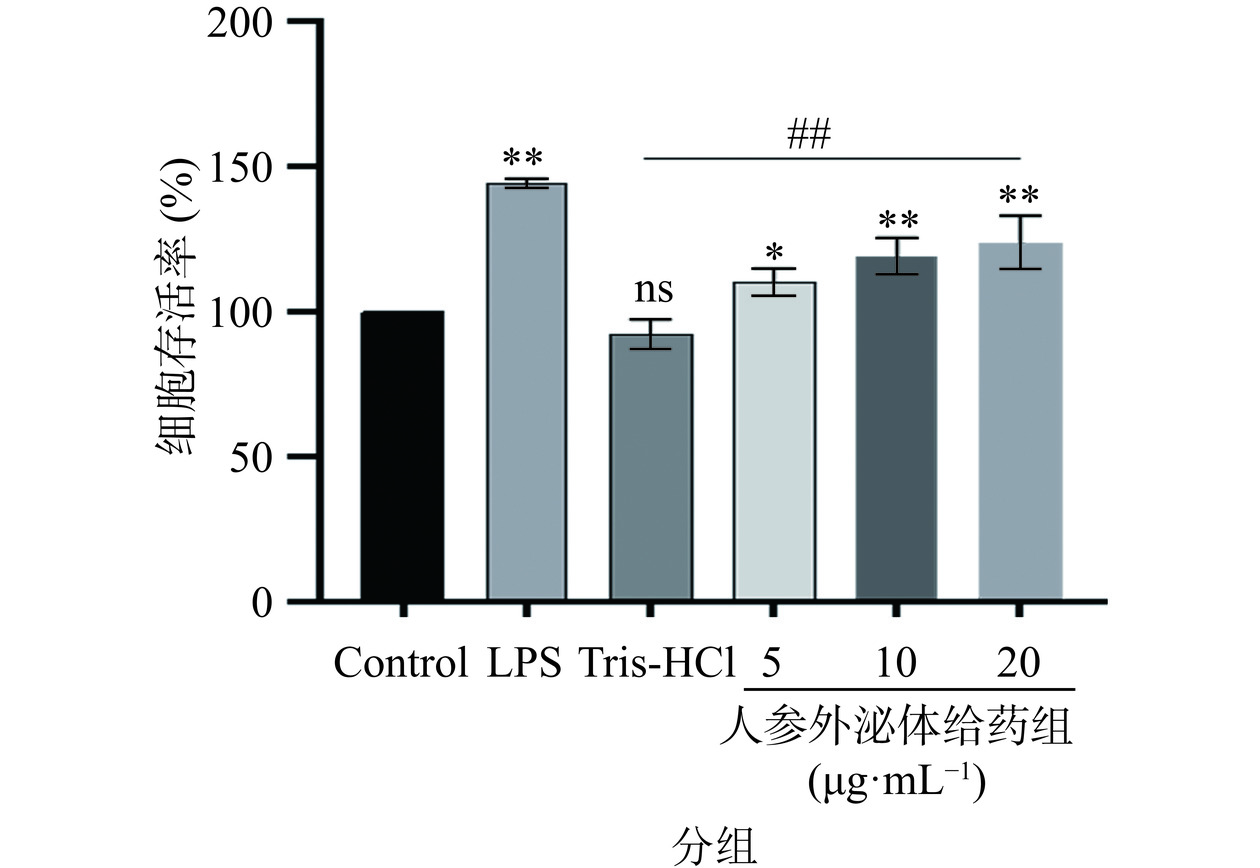
2.1 人参外泌体对RAW264.7的细胞活力的影响
RAW264.7经Tris-HCl、LPS以及不同浓度的人参外泌体处理24 h,与空白对照组(Control)相比,阴性对照组(Tris-HCl)对RAW264.7细胞没有增殖作用;在阳性对照组(LPS)浓度为1 µg·mL−1时,细胞活力显著增强(P<0.01);与空白对照组相比,随着GDNPs浓度的增加,细胞活力在浓度为5~20 μg·mL−1范围内显著增强,具有明显的浓度依赖性,人参外泌体浓度为20 μg·mL−1时RAW264.7的细胞活力最强(P<0.01),其次是人参外泌体浓度为10 μg·mL−1(P<0.01),浓度为5 μg·mL−1时细胞活力最弱(P<0.05);与阴性对照组相比,不同浓度的人参外泌体给药组对RAW264.7细胞活力的影响显著增强(P<0.01);与阳性对照组相比,不同浓度的人参外泌体对RAW264.7细胞活力的影响效果较弱(图1)。
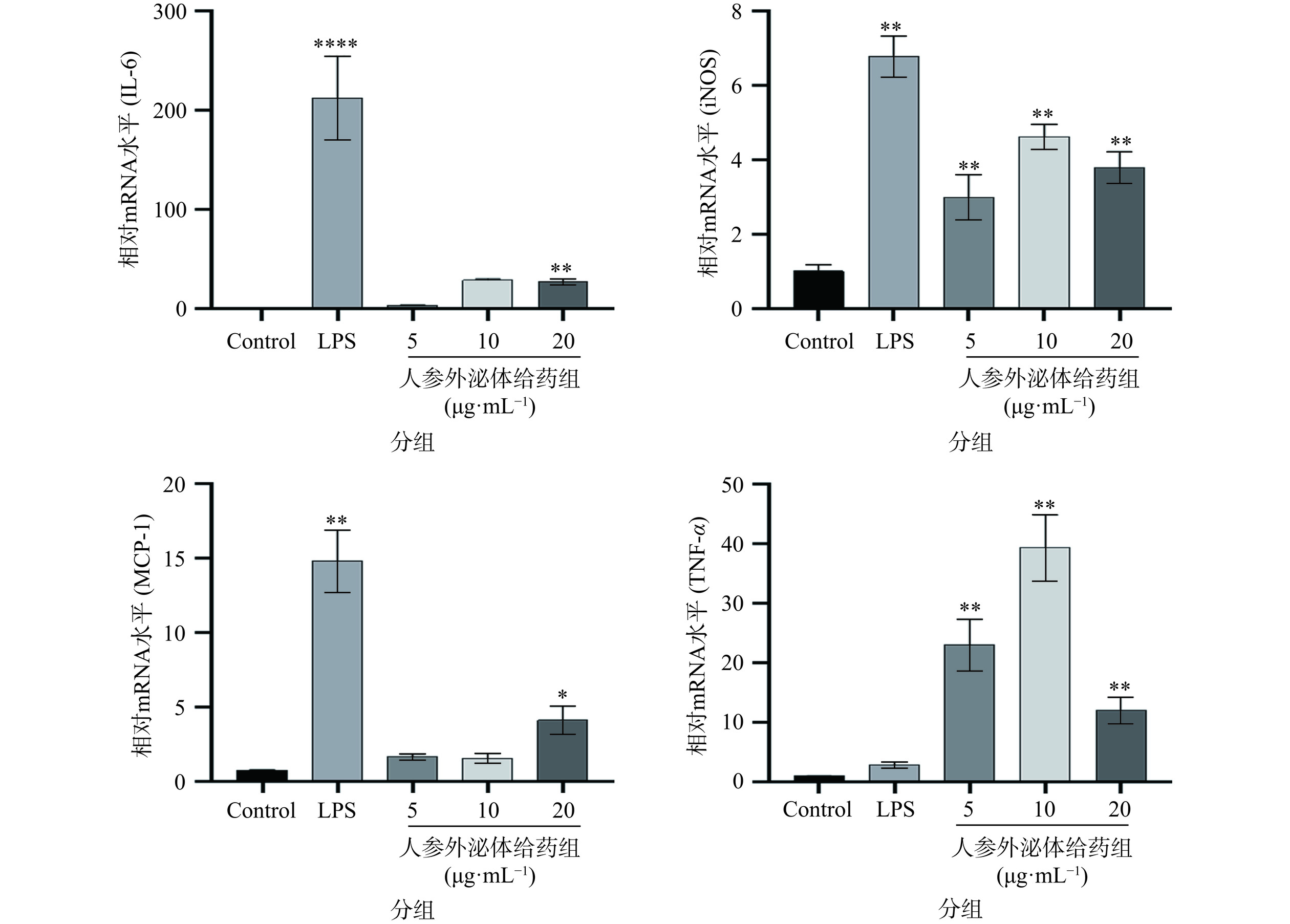
2.2 人参外泌体对RAW264.7细胞中炎症因子转录水平的影响
M1巨噬细胞在炎症因子分泌和抗肿瘤免疫中发挥作用,从而保护宿主免受各种细菌和病毒的侵害[24]。基于广泛的研究,有人提出M1巨噬细胞在肿瘤细胞中的高浸润与NSCLC患者的预后改善有关[25]。为了探讨人参外泌体对巨噬细胞RAW264.7细胞极化的影响,采用实时定量PCR检测巨噬细胞RAW264.7中IL-6、iNOS、MCP-1、TNF-α转录水平的表达情况,结果显示(图2),与空白对照组相比,LPS组IL-6、iNOS、MCP-1转录水平升高;不同剂量的人参外泌体处理后,与空白对照组相比,人参外泌体低剂量组iNOS、TNF-α转录水平显著升高(P<0.01),IL-6、MCP-1无显著差异;人参外泌体中剂量组iNOS、TNF-α转录水平显著升高(P<0.01),IL-6、MCP-1无显著差异;人参外泌体高剂量组IL-6、iNOS、MCP-1、TNF-α转录水平显著升高(P<0.01)。因此,人参外泌体可显著诱导巨噬细胞RAW264.7细胞向M1型极化。
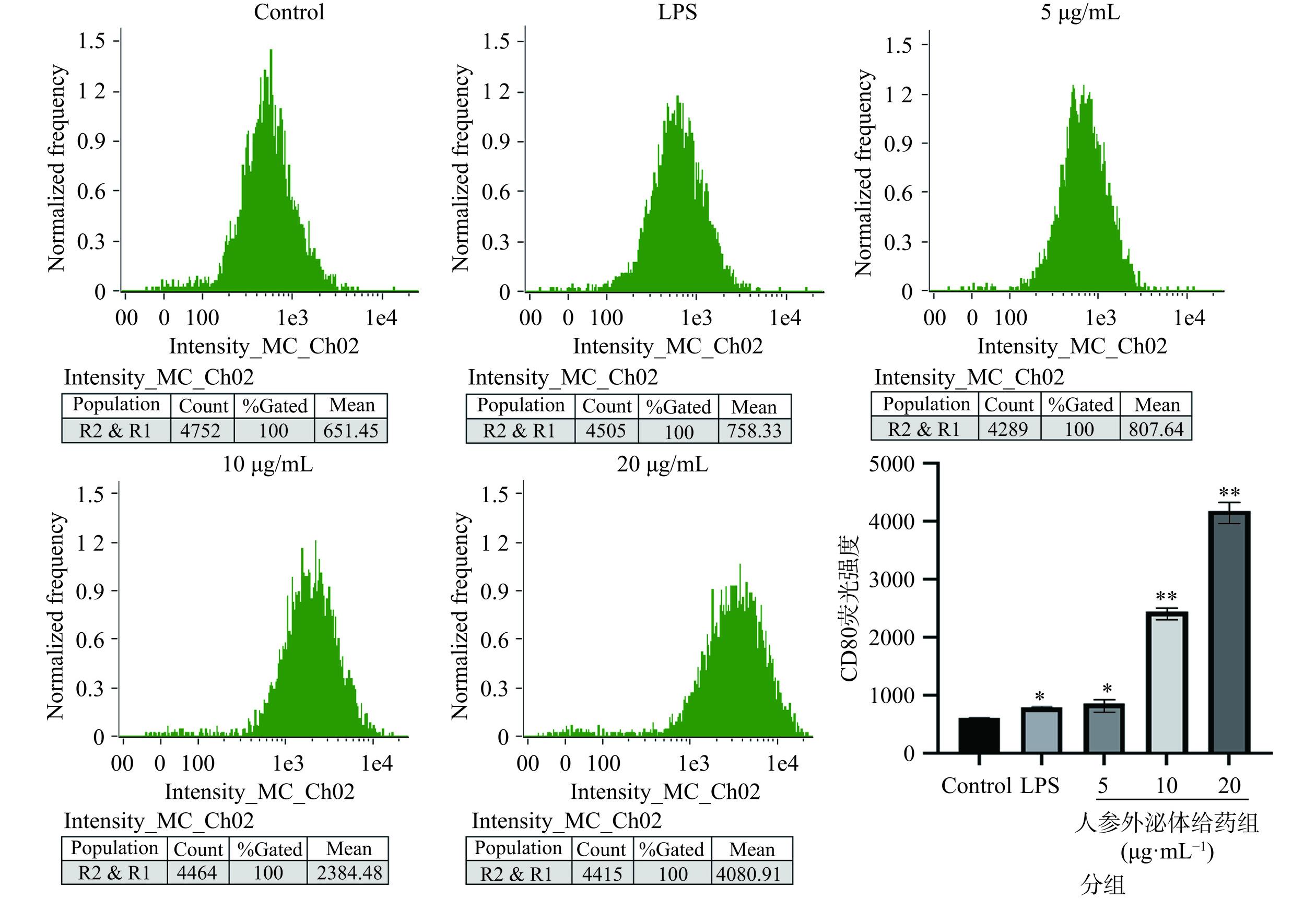
2.3 流式细胞术检测人参外泌体对RAW264.7细胞极化的影响
人参外泌体作用于RAW264.7细胞后,使用流式细胞术检测M1型巨噬细胞分子标志CD80的表达,实验结果表明(图3),与空白对照组相比,经过不同浓度的人参外泌体处理后,M1型巨噬细胞分子标志CD80显著升高(P<0.05),且具有浓度依赖性,浓度为20 µg/mL时,M1型巨噬细胞分子标志CD80上调最为显著(P<0.01),浓度为10 µg/mL时次之。这表明人参外泌体可以有效的刺激巨噬细胞向M1方向极化。
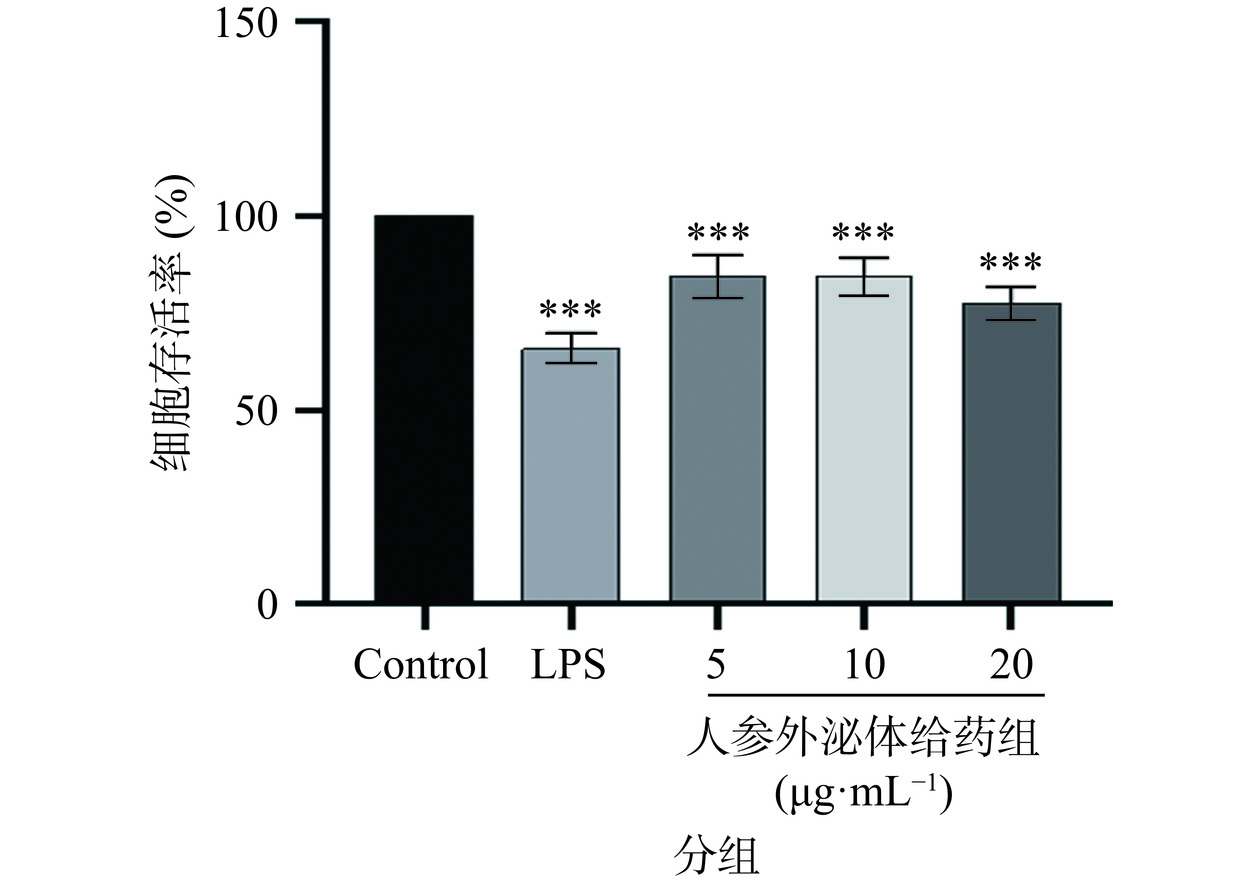
2.4 人参外泌体刺激巨噬细胞M1极化对A549细胞活力的影响
A549细胞与条件培养基共培养后,使用CCK-8检测A549细胞的活性,实验结果表明(图4),与空白对照组相比,LPS组A549细胞活力受到抑制(P<0.001);与空白对照组相比,随着人参外泌体给药浓度的增加,A549细胞活力呈梯度下降,人参外泌体浓度为20 μg·mL−1时,A549细胞的细胞活力最低(P<0.001),其次是人参外泌体浓度为10 μg·mL−1(P<0.001),人参外泌体浓度为5 μg·mL−1(P<0.001)时抑制能力最弱;这表明人参外泌体可以显著抑制A549细胞的生长,减弱肿瘤细胞A549的增殖能力。
2.5 人参外泌体刺激巨噬细胞极化对A549细胞周期的影响
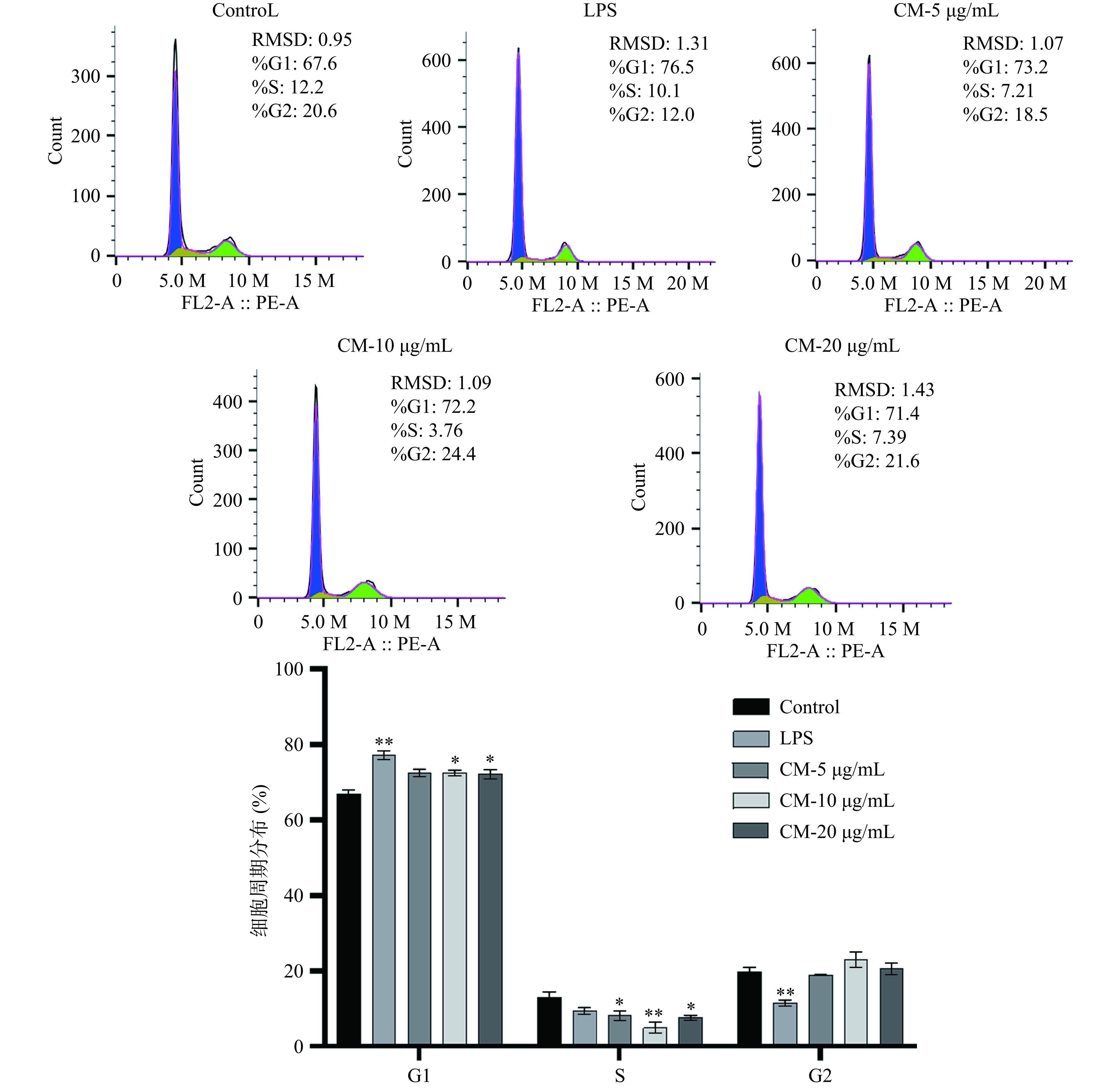
肿瘤细胞的快速增殖与细胞周期的进程密切相关,调控肿瘤细胞的细胞周期,促进其快速凋亡是目前肿瘤治疗的重要研究方向[26],细胞周期一般分为G0、G1、S、G2和M期,主要受c-myc、cyclin A、cyclin D1等基因调控[27],主要细胞分裂过程中发生的细胞周期停滞引起的损伤和错误很难修复[28]。通过流式细胞仪检测A549细胞的细胞周期,实验结果表明(图5),与空白对照组相比,LPS组A549细胞的G1期细胞数目增多(P<0.01),S期细胞数目减少;与空白对照组相比,人参外泌体中剂量组与人参外泌体高剂量A549细胞处于G1期细胞数目增多(P<0.05),S期的细胞数目显著减少(P<0.05)。这意味着人参外泌体在G1期阻断了A549细胞的细胞周期,从而阻止了DNA的正常复制,抑制了肿瘤的生长。
2.6 人参外泌体刺激巨噬细胞极化对A549细胞凋亡的影响
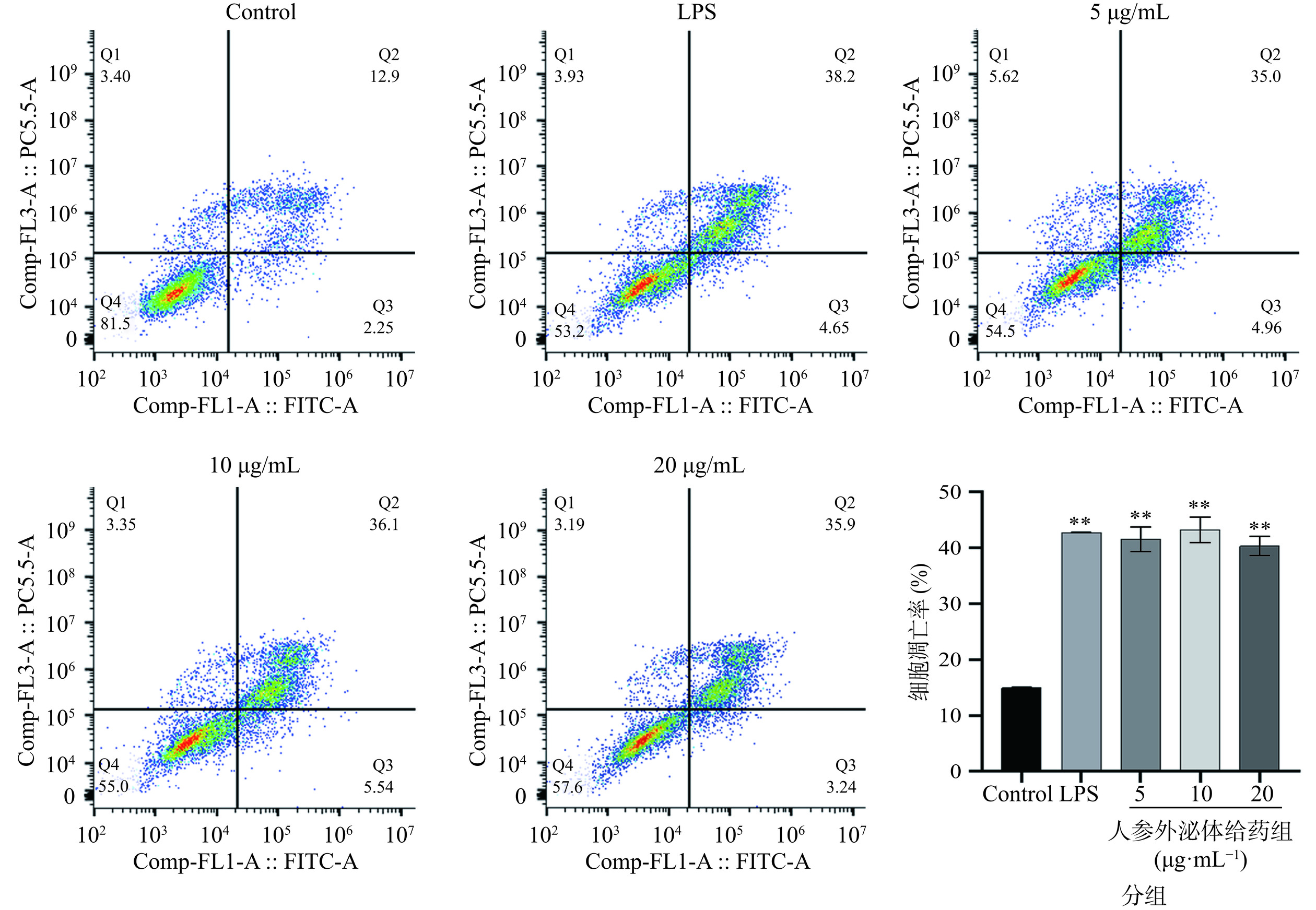
细胞周期进程被阻滞后,将会进一步导致细胞凋亡[29],凋亡是通过激活内在自杀机制而诱发的细胞程序性死亡过程。采用流式细胞仪检测人参外泌体刺激巨噬细胞M1极化对A549细胞凋亡的影响(图6),与空白对照组相比,LPS组凋亡的细胞比例显著升高(P<0.01);与空白对照组相比,人参外泌体给药组细胞凋亡的比例显著升高,人参外泌体的浓度为10 μg·mL−1凋亡的细胞比例最高(P<0.01),其次是人参外泌体浓度为20 μg·mL−1,人参外泌体浓度为5 μg·mL−1凋亡的细胞比例最低(P<0.01)。这表明人参外泌体通过刺激巨噬细胞M1极化从而有效地诱导了A549细胞的凋亡。
2.7 人参外泌体通过激活TLR4/MyD88信号通路促进A549细胞凋亡
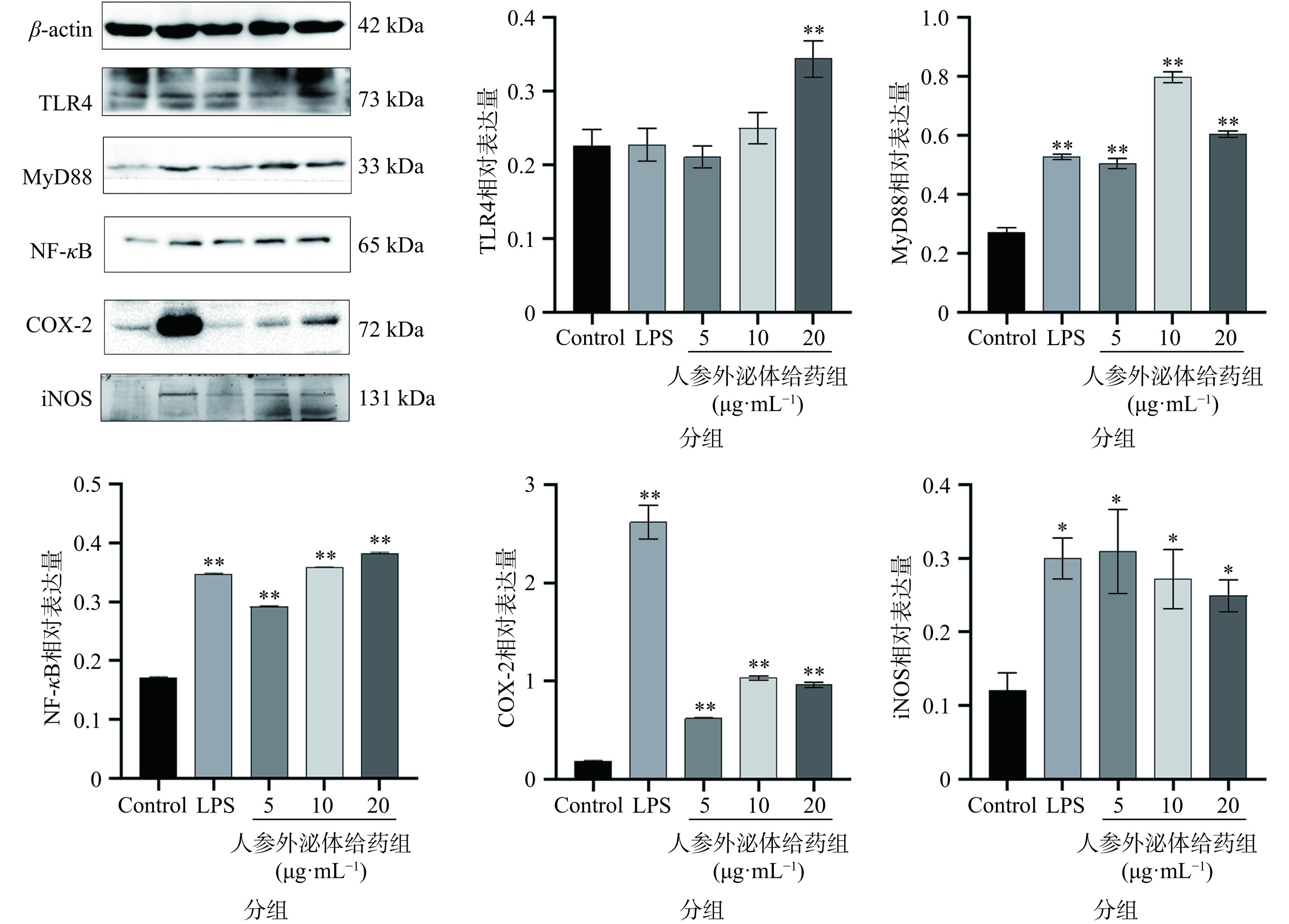
TLR4信号可通过MyD88和TRIF途径传递。MyD88通路通过募集IL-1受体相关激酶(IRAK-κ)诱导NF-κB的早期激活。IRAK蛋白与TNF受体相关因子6(TRAF6)相互作用并激活。TRAF6招募并激活TAK1。TAK1激活了核因子κB激酶(IKK),然后NF-κB结合抑制蛋白IκB被IKK磷酸化,随后泛素化和降解,导致NF-κB的二聚体p65-p50失去抑制作用,然后发挥其转录因子的作用,进入细胞核驱动炎性胞质分裂的转录基因[30−32]。NF-κB作为一种转录因子,与机体的炎症反应密切相关,NF-κB的活化将导致iNOS、COX-2蛋白表达增加[33]。为了进一步明确人参外泌体刺激巨噬细胞极化抑制A549细胞增殖的内在机制,采用Western blot检测A549细胞中TLR4、MyD88、NF-κB、iNOS、COX-2蛋白的表达,结果显示(图7),与空白对照组相比,LPS组和不同剂量的人参外泌体给药组TLR4、MyD88、NF-κB、iNOS、COX-2蛋白表达均增加。其中NF-κB的表达具有明显的浓度依赖性,与空白对照组相比,人参外泌体高剂量组NF-κB的表达最高(P<0.01),中剂量组次之(P<0.01),低剂量组NF-κB的表达最低(P<0.01)。
3. 结论
本次实验模拟肿瘤微环境,收集LPS和人参外泌体处理的RAW264.7细胞衍生的上清液,制成CM并与A549共培养,首次证实了人参外泌体促进巨噬细胞向M1极化,激活TLR4/MyD88/NF-κB信号通路促进炎症因子的表达水平,显著抑制A549细胞增殖,调节A549细胞周期,从而诱导A549细胞凋亡,发挥抗肿瘤作用。此外,本研究对人参外泌体在非小细胞肺癌(NSCLC)相关疾病的治疗领域奠定了实验基础,并为进一步探索人参外泌体在TLR4/MyD88/NF-κB信号通路方面的相关研究提供了理论支持。但人参外泌体促进巨噬细胞M1极化后M1型巨噬细胞所占比例尚不明确,我们将继续深入研究M1型巨噬细胞与A549细胞之间相互作用的具体机制。
-
表 1 实时定量PCR引物序列
Table 1 Sequences of real-time quantitative PCR primers
基因 上游引物序列 上游引物序列 GAPDH 5'-ACATCGCTCAGACACCATG-3' 5'-TGTAGTTGAGGTCAATGAAG-3' IL-6 5'CGGAGAGGAGACTTCACAGAG-3' 5'-CATTTCCACGATTTCCCAGA-3' TNF-α 5'-TTGTCTACTCCCAGGTTCTCT-3' 5'GAGGTTGACTTTCTCCTGGTATG-3' iNOS 5'-GGACCCAGTGCCCTGCTTT-3' 5'-CACCAAGCTCATGCGGCCT-3' MCP-1 5'-AACTGCATCTGCCCTAAGGT-3' 5'-CTGTCACACTGGTCACTCCT-3' -
[1] BONANNO L, PAVAN A, FERRO A, et al. Clinical impact of plasma and tissue next-generation sequencing in advanced non-small cell lung cancer:A real-world experience[J]. Oncologist,2020,25(12):e1996−e2005. doi: 10.1634/theoncologist.2020-0148
[2] BARTA J A, POWELL C A, WISNIVESKY J P. Global epidemiology of lung cancer[J]. Ann glob health,2019,85(1):8. doi: 10.5334/aogh.2419
[3] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin,2020,70(1):7−30. doi: 10.3322/caac.21590
[4] ZUGAZAGOITIA J, PAZ-ARES L. Extensive-stage small-cell lung cancer:First-Line and second-line treatment options[J]. J Clin Oncol,2022,40(6):671−680. doi: 10.1200/JCO.21.01881
[5] 王树滨, 高静, 朱宇, 等. 类器官药物敏感性检测指导肿瘤精准治疗临床应用专家共识(2022年版)[J]. 中国癌症防治杂志,2022,14(3):234−239. [WANG S B, GAO J, ZHU Y, et al. Expert consensus on the clinical application of organoid drug sensitivity testing to guide precision tumor therapy[J]. Chinese Journal of Cancer Prevention and Treatment,2022,14(3):234−239.] WANG S B, GAO J, ZHU Y, et al. Expert consensus on the clinical application of organoid drug sensitivity testing to guide precision tumor therapy[J]. Chinese Journal of Cancer Prevention and Treatment, 2022, 14(3): 234−239.
[6] ZHOU Y Y, TIAN T, ZHU Y, L et al. Exosomes transfer among different species cells and mediating miRNAs delivery[J]. J Cell Biochem,2017,118(12):4267−4274. doi: 10.1002/jcb.26077
[7] FAROOQI A A, DESAI N N, QURESHI M Z, et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds[J]. Biotechnol Adv,2018,36(1):328−334. doi: 10.1016/j.biotechadv.2017.12.010
[8] 张馨月, 胡克. 植物外泌体的抗炎抗癌机制研究进展[J]. 武汉大学学报(医学版),2023,44(11):1410−1414. [ZHANG X Y, HU K. Progress of anti-inflammatory and anti-cancer mechanism of plant exosomes[J]. Journal of Wuhan University (Medical Edition),2023,44(11):1410−1414.] ZHANG X Y, HU K. Progress of anti-inflammatory and anti-cancer mechanism of plant exosomes[J]. Journal of Wuhan University (Medical Edition), 2023, 44(11): 1410−1414.
[9] SUN D M, ZHUANG X Y, ZHANG S Q, et al. Exosomes are endogenous nanoparticles that can deliver biological information between cells[J]. Adv Drug Deliv Rev,2013,65(3):342−347. doi: 10.1016/j.addr.2012.07.002
[10] RUTTER B D, INNES R W. Extracellular vesicles isolated from the leaf apoplast carry stress-response proteins[J]. Plant Physiol,2017,173(1):728−741. doi: 10.1104/pp.16.01253
[11] NOY R, POLLARD J W. Tumor-associated macrophages:from mechanisms to therapy[J]. Immunity,2014,41(1):49−61. doi: 10.1016/j.immuni.2014.06.010
[12] ALMATROODI S A, MCDONALD C F, DARBY I A, et al. Characterization of M1/M2 tumour-associated macrophages (TAMs) and Th1/Th2 cytokine profiles in patients with NSCLC[J]. Cancer Microenviron,2016,9(1):1−11. doi: 10.1007/s12307-015-0174-x
[13] PARISI L, GINI E, BACI D, et al. Macrophage polarization in phronic inflammatory diseases:killers or builders?[J]. J Immunol Res,2018(2018):8917804.
[14] MURRAY P J, WYNN T A. Protective and pathogenic functions of macrophage subsets[J]. Nat Rev Immunol,2011,11(11):723−737. doi: 10.1038/nri3073
[15] MURRAY P J, ALLEN J E, BISWAS S K, et al. Macrophage activation and polarization:nomenclature and experimental guidelines[J]. Immunity,2014,41(1):14−20. doi: 10.1016/j.immuni.2014.06.008
[16] MANTOVANI A, SOZZANI S, LOCATI M, et al. Macrophage polarization:tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes[J]. Trends Immunol,2002,23(11):549−555. doi: 10.1016/S1471-4906(02)02302-5
[17] CHENG L F, WANG Y H, HUANG L. Exosomes from M1-polarized macrophages potentiate the cancer vaccine by creating a pro-inflammatory microenvironment in the lymph node[J]. Mol Ther,2017,25(7):1665−1675. doi: 10.1016/j.ymthe.2017.02.007
[18] SMAIL N, WANG Y, DAKHLALLAH D, et al. Macrophage microvesicles induce macrophage differentiation and miR-223 transfer[J]. Blood,2013,121(6):984−995. doi: 10.1182/blood-2011-08-374793
[19] JIMÉNEZ PÉREZ Z E, MATHIYALAGAN R, MARKUS J, et al. Ginseng-berry-mediated gold and silver nanoparticle synthesis and evaluation of their in vitro antioxidant, antimicrobial, and cytotoxicity effects on human dermal fibroblast and murine melanoma skin cell lines[J]. Int J Nanomedicine,2017,12:709−723. doi: 10.2147/IJN.S118373
[20] MAJEED F, MALIK F Z, AHMED Z, et al. Ginseng phytochemicals as therapeutics in oncology:Recent perspectives[J]. Biomed Pharmacother,2018,100:52−63. doi: 10.1016/j.biopha.2018.01.155
[21] CAO M, YAN H J, HAN X, et al. Ginseng-derived nanoparticles alter macrophage polarization to inhibit melanoma growth[J]. J Immunother Cancer,2019,7(1):326. doi: 10.1186/s40425-019-0817-4
[22] KIM J S, ZHU Y, CHEN S H, et al. Anti-glioma effect of ginseng-derived exosomes-like nanoparticles by active blood-brain-barrier penetration and tumor microenvironment modulation[J]. J Nanobiotechnology,2023,21(1):253. doi: 10.1186/s12951-023-02006-x
[23] 卢姝言, 杨松, 任李梅, 等. 人参外泌体促进HaCat细胞增殖和伤口愈合[J]. 中国生物化学与分子生物学报,2021,37(11):1510−1519. [LU S Y, YANG S, REN L M, et al. Ginseng exosomes promote HaCat cell proliferation and wound healing[J]. Chinese Journal of Biochemistry and Molecular Biology,2021,37(11):1510−1519.] LU S Y, YANG S, REN L M, et al. Ginseng exosomes promote HaCat cell proliferation and wound healing[J]. Chinese Journal of Biochemistry and Molecular Biology, 2021, 37(11): 1510−1519.
[24] WU J Y, HUANG T W, HSIEH Y T, et al. Cancer-derived succinate promotes macrophage polarization and cancer metastasis via succinate receptor[J]. Mol Cell,2020,77:213−227.
[25] JACKUTE J, ZEMAITIS M, PRANYS D, et al. Distribution of M1 and M2 macrophages in tumor islets and stroma in relation to prognosis of non-small cell lung cancer[J]. BMC Immunol,2018,19:3. doi: 10.1186/s12865-018-0241-4
[26] 李丽君, 柏淯文, 白杰, 等. 三氧化二砷阻滞头颈部鳞状细胞癌细胞周期调控肿瘤细胞凋亡的研究[J]. 临床口腔医学杂志,2020,36(5):259−262. [LI L J, BAI Y W, BAI J, et al. Arsenic trioxide blocks the cell cycle of head and neck squamous cell carcinoma to regulate tumor cell apoptosis[J]. Journal of Clinical Stomatology,2020,36(5):259−262.] LI L J, BAI Y W, BAI J, et al. Arsenic trioxide blocks the cell cycle of head and neck squamous cell carcinoma to regulate tumor cell apoptosis[J]. Journal of Clinical Stomatology, 2020, 36(5): 259−262.
[27] 尤雨桐, 贺小琼, 陆地, 等. 松萝烟酰胺对胃癌SGC-7901细胞增殖、凋亡、细胞周期及迁移的影响[J]. 中草药,2020,51(4):1024−1030. [YOU Y T, HE X Q, LU D, et al. Effects of pineal nicotinamide on proliferation, apoptosis, cell cycle and migration of gastric cancer SGC-7901 cells[J]. Chinese Herbal Medicine,2020,51(4):1024−1030.] YOU Y T, HE X Q, LU D, et al. Effects of pineal nicotinamide on proliferation, apoptosis, cell cycle and migration of gastric cancer SGC-7901 cells[J]. Chinese Herbal Medicine, 2020, 51(4): 1024−1030.
[28] PAN Z H, ZHANG X, YU P F, et al. Cinobufagin induces cell cycle arrest at the G2/M phase and promotes apoptosis in malignant melanoma cells[J]. Front Oncol,2019,9:853. doi: 10.3389/fonc.2019.00853
[29] 李淑兰, 贺倩倩, 宫凯凯, 等. 姜黄素通过PI3K/p53信号通路调控人胃癌细胞SGC-7901的增殖、凋亡和周期[J]. 安徽医科大学学报,2021,56(1):43−48. [LI S L, HE Q Q, GONG K K, et al. Curcumin regulates the proliferation, apoptosis and cycle of human gastric cancer cells SGC-7901 through PI3K/p53 signaling pathway[J]. Journal of Anhui Medical University,2021,56(1):43−48.] LI S L, HE Q Q, GONG K K, et al. Curcumin regulates the proliferation, apoptosis and cycle of human gastric cancer cells SGC-7901 through PI3K/p53 signaling pathway[J]. Journal of Anhui Medical University, 2021, 56(1): 43−48.
[30] BRYANT C E, SYMMONS M, GAY N J. Toll-like receptor signalling through macromolecular protein complexes[J]. Mol Immunol,2015,63(2):162−165. doi: 10.1016/j.molimm.2014.06.033
[31] ALMOG T, KANDEL-KFIR M, SHAISH A, et al. Knockdown of interleukin-1α does not attenuate LPS-induced production of interleukin-1β in mouse macrophages[J]. Cytokine,2015,73(1):138−143. doi: 10.1016/j.cyto.2015.01.029
[32] WANG Y B, MIAO Z W, QIN X X, et al. NOD2 deficiency confers a pro-tumorigenic macrophage phenotype to promote lung adenocarcinoma progression[J]. J Cell Mol Med,2021,25(15):7545−7558. doi: 10.1111/jcmm.16790
[33] 郝鹏飞, 丁生晨, 卞华, 等. 桔梗汤总皂苷对慢性阻塞性肺病大鼠IKK/NF-KB/MUC5AC通路的影响[J]. 中国医院药学杂志,2021,41(12):1197−1201,1207. [HAO P F, DING S C, BIAN H, et al. Effects of total saponins of Platycodon grandiflorum soup on IKK/NF-KB/MUC5AC pathway in rats with chronic obstructive pulmonary disease[J]. Chinese Journal of Hospital Pharmacy,2021,41(12):1197−1201,1207.] HAO P F, DING S C, BIAN H, et al. Effects of total saponins of Platycodon grandiflorum soup on IKK/NF-KB/MUC5AC pathway in rats with chronic obstructive pulmonary disease[J]. Chinese Journal of Hospital Pharmacy, 2021, 41(12): 1197−1201,1207.
-
期刊类型引用(8)
1. 张全通,郑尧,杨柳,张帅帅,郭全友. 计算机视觉结合卷积神经网络快速检测南极磷虾粉中的虾青素含量. 食品工业科技. 2025(03): 11-18 .  本站查看
本站查看
2. 刘鑫,马本学,李玉洁,陈金成,喻国威. 基于改进YOLOv7-ByteTrack的干制哈密大枣缺陷检测与计数系统. 农业工程学报. 2024(03): 303-312 .  百度学术
百度学术
3. 贾雅欣,李传峰,罗华平,吴明清. 基于边缘轮廓定积分测量红枣体积的研究. 塔里木大学学报. 2024(01): 75-83 .  百度学术
百度学术
4. 朱丽娟. 基于机器视觉的红枣裂纹特征提取. 科技风. 2024(10): 17-19 .  百度学术
百度学术
5. 吴思,诸定莲,鲁梦瑶,万以磊,高亮亮,陈龙,汤卫荣,吴文彪. 基于机器视觉的大闸蟹自动分级分选设备研究与开发. 扬州大学学报(农业与生命科学版). 2024(04): 137-146 .  百度学术
百度学术
6. 汤文祺,曹玉华,李应果. 基于机器视觉的一品红自动分级方法研究. 现代农业装备. 2024(05): 53-58 .  百度学术
百度学术
7. 赵晓梅,李洪港. 基于X射线图像的金属腐蚀深度估计方法. 山东冶金. 2023(05): 25-27 .  百度学术
百度学术
8. 蒋平. 一种快速红枣表面缺陷识别方法. 大众标准化. 2023(23): 55-57 .  百度学术
百度学术
其他类型引用(13)





 下载:
下载:
 下载:
下载:



