Screening of Fermentation Strains of Quinoa and Lonicera caerulea and Optimization of Complex Fermentation Process
-
摘要: 为了丰富杂粮功能性发酵食品的种类及解决小浆果类口感酸涩,季节性强的问题,对藜麦-蓝靛果复合发酵液的加工工艺进行了探究。以藜麦和蓝靛果为原料,利用酵母菌复配乳酸菌协同发酵,通过对比不同菌种发酵后藜麦-蓝靛果复合发酵液的超氧化物歧化酶(Superoxide dismutase,SOD)活力和活菌数,筛选出最适发酵菌种并优化发酵条件,采用单因素实验和响应面试验相结合的方法,以SOD活力和γ-氨基丁酸(γ-aminobutyricacid,GABA)含量为优化指标,确定藜麦-蓝靛果复合发酵液的最优工艺。结果表明:最优发酵菌种为帝伯仕牌活性干酵母(SELECTYS LA BAYANUS,BA)、植物乳杆菌(Lactiplantibacillus plantarum,LP)和嗜酸乳杆菌CICC6085(Lactobacillus acidophilus,LA)。酵母菌发酵阶段,接种量为0.30%,装瓶量为40 mL/100 mL,30 ℃摇床培养16 h,藜麦-蓝靛果复合发酵液的SOD活力为(139.740±0.485)U/mL、活菌数为(4.667±0.450)×106 CFU/mL;乳酸菌发酵阶段,接种量为2%,其中植物乳杆菌和嗜酸乳杆菌复配比例为1:1,37 ℃培养24 h,藜麦-蓝靛果复合发酵液的SOD活力为(174.000±3.055)U/mL、活菌数为(27.250±1.05)×108 CFU/mL;复合发酵阶段,藜麦-蓝靛果复合发酵液最佳发酵工艺条件为:初始pH为5.0、复配比例为1:3、白糖添加量10%、发酵温度为37 ℃。在最优工艺条件下,藜麦-蓝靛果复合发酵液的SOD活力为(318.245±3.245)U/mL,GABA含量为(0.647±0.018)mg/g,得到的藜麦-蓝靛果复合发酵液色泽透亮呈深紫色,富含SOD和GABA,为开发以杂粮和小浆果类为原料的功能性发酵食品提供理论依据。Abstract: In order to improve the variety of multigrain beneficial fermented foods and address the sour flavor and strong seasonality of tiny berries, research was conducted on the best processing method for the quinoa-Lonicera caerulea complex fermentation liquid. Using quinoa and Lonicera caerulea as raw materials, a synergistic fermentation process involving a combination of yeast and lactic acid bacteria was employed. By comparing the superoxide dismutase (SOD) activity and viable bacteria number of the quinoa-Lonicera caerulea complex fermentation solution following fermentation of different strains, the most appropriate fermentation strains were chosen, and the fermentation conditions were improved. SOD activity and γ-aminobutyric acid (GABA) concentration were used as optimization indices to further enhance the fermentation process of the quinoa-Lonicera caerulea complex fermentation solution by combining single component and response surface testing. Results showed that BA, LP, and LA were the best strains for fermentation. During the Saccharomyces fermentation stage, the inoculum amount was 0.30%, the bottling amount was 40 mL/100 mL, and the incubation was carried out in a shaker at 30 ℃ for 16 h, the SOD activity of quinoa-Lonicera caerulea complex fermentation liquid was measured at (139.740±0.485) U/mL, and the amount of live bacteria was (4.667±0.450)×106 CFU/mL during the yeast fermentation stage. During the Lactobacillus fermentation stage, the inoculum amount was 2%, with a 1:1 ratio of Lactobacillus plantarum and Lactobacillus acidophilus, and the culture was incubated at 37 ℃ for 24 hours, the SOD activity of quinoa-Lonicera caerulea complex fermentation solution was (174.000±3.055) U/mL, and the number of live bacteria was (27.250±1.05)×108 CFU/mL. During the composite fermentation stage, the optimal fermentation conditions for the quinoa-Lonicera caerulea complex fermentation were as follows: Initial pH was 5.0, mixing ratio was 1:3, sugar addition was 10%, fermentation temperature was 37°C, and under these optimal conditions, the SOD activity of quinoa-Lonicera caerulea complex fermentation was (318.245±3.245) U/mL, and the GABA content was (0.647±0.018) mg/g. The resultant quinoa-Lonicera caerulea complex fermentation solution was dark purple in color and rich in both SOD and GABA. It would provide the theoretical framework for creating functional fermented foods using tiny berries and grains as the primary ingredients.
-
Keywords:
- quinoa /
- Lonicera caerulea /
- fermentation process /
- strain screening /
- process optimization
-
藜麦(Chenopodium quinoa Willd.),被誉为“营养黄金”,食用与医药价值突出[1],是优质的无麸质假谷物[2],适合乳糜泻患者食用,且富含多酚类化合物、黄酮类化合物、GABA等生物活性成分,抗氧化、降血脂、抑菌、抗肿瘤、改善人体免疫功能等生理功能显著[3−4]。蓝靛果(Lonicera caerulea L.)作为“新兴的第三代小浆果之王”[5],富含维生素、氨基酸、多酚及黄酮类化合物等多种生物活性成分[6−7],具有抗氧化、抗肿瘤、降血脂、保护肝脏和预防糖尿病等生理功效[8−9]。
植物发酵液中富含活性酶,主要是蛋白酶、脂肪酶、淀粉酶和超氧化物歧化酶(Superoxide dismutase,SOD)。SOD具有解酒护肝、美白抗氧化、降糖降脂等功效,是目前食品行业研究热点[10−11],是发酵液加工过程中形成的关键生物活性酶,具有很强的抗氧化性。藜麦富含GABA,且乳酸菌发酵过程中会伴随累积大量的GABA,GABA也曾被报道在发酵液中含有,其是一种新资源食品添加剂,作为人类神经系统中重要的活性物质,其镇静神经、抗高血压、抗癌、抗糖尿病等功效也同样令人瞩目[12−13]。本研究后续主要对该发酵液进行了功能性的研究,因此同时选用SOD和GABA两种功能活性物质进行发酵条件优化。
人工接种发酵制备发酵液的常用菌种有:植物乳杆菌、酵母菌、鼠李糖乳杆菌、嗜酸乳杆菌、发酵乳杆菌、双歧杆菌、嗜热链球菌、凝结芽孢杆菌等。大量的动物实验和临床试验证明乳酸菌具有益生菌功效,能在低pH的胃肠道环境下生存,抑制病原体的生长和繁殖,从而增强机体免疫力和抵抗力[14]。酵母菌本身富含多种人体必需氨基酸和B族维生素(B1、B2和B3),在营养物质充足的条件下,酵母菌通过发酵也可以产生SOD等功效酶以及苯乙醇、异戊醇等芳香化合物。酵母菌和乳酸菌在发酵过程中具有协同的效果,共发酵技术更有利于发酵液产品品质的提升[15]。目前,多数研究集中在单一原料发酵,将杂粮与浆果结合,采用益生菌发酵的研究较少。藜麦和蓝靛果复配发酵不仅提升了营养价值和健康益处,还能改善风味和口感[16−17],满足市场需求,同时解决储藏问题,并提升产品的附加值。因此,本研究以藜麦和蓝靛果为原料,通过混菌液态发酵的方式,优化最佳发酵工艺,进而为藜麦和蓝靛果资源的深加工利用提供理论依据,进一步有效解决藜麦和蓝靛果利用率低、资源浪费等的行业瓶颈问题。
1. 材料与方法
1.1 材料与仪器
藜麦 产自山西;FR-3蓝靛果(成熟期采摘,冷冻保存)峰然蓝靛果苗木研发基地;耐高温α-淀粉酶(20000 U/mL)、糖化酶(10000 U/mL)、果胶酶(500 U/mg) 上海源叶生物科技有限公司;白糖 市售;SOD测试盒 南京建成生物工程研究所;安琪酵母粉(Angel yeast powder,YE) 湖北安琪酵母有限公司;帝伯仕牌活性干酵母(SELECTYS LA BAYANUS,BA)、帝伯仕牌活性干酵母(SELECTYS LA DELICIEUSE,DE) 烟台帝伯仕自酿机有限公司;植物乳杆菌(Lactiplantibacillus plantarum,LP) 东北农业大学实验室保藏;酿酒酵母CICC1406(Saccharomyces cerevisiae,Sce)、鼠李糖乳杆菌CICC6166(Lactobacillus rhamnosus,LR)、嗜酸乳杆菌CICC6085(Lactobacillus acidophilus,LA)、嗜热链球菌CICC21728(Sterptococcus thermophilus,S) 中国工业微生物菌种保藏中心。
BS224S电子天平 赛多利斯科学仪器有限公司;HCP-A7多功能料理机 海蒂诗国际集团;pHS-3C型pH计 上海浦春计量仪器有限公司;Victor Nivo酶标仪 美国PerkinElmer公司;HH-6电热恒温水浴锅 常州荣华仪器制造有限公司。
1.2 实验方法
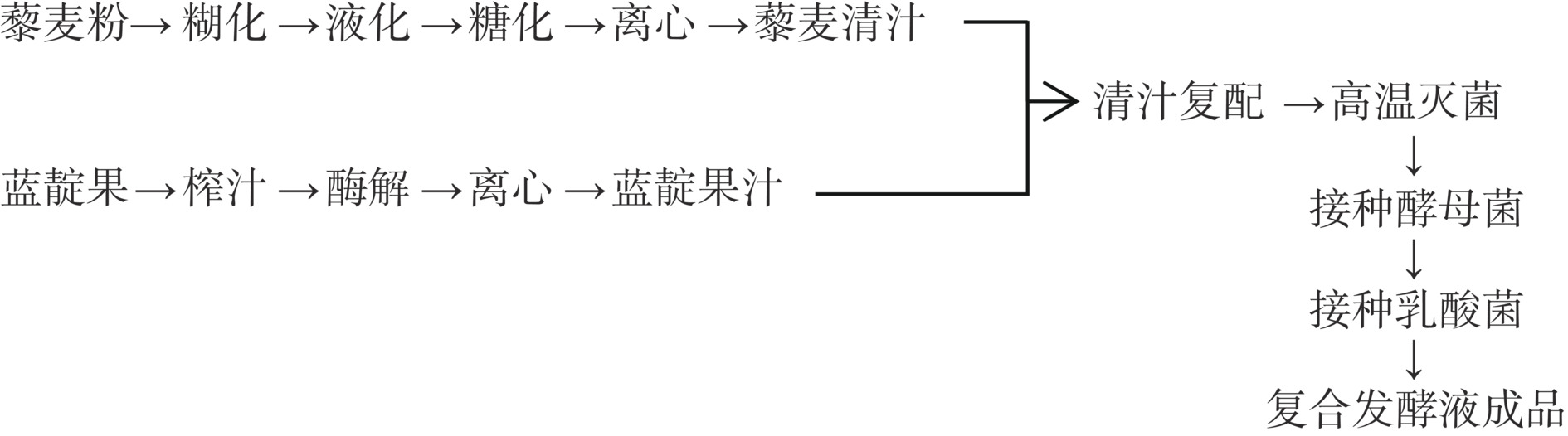
1.2.1 工艺流程
糊化:藜麦打粉过60目筛备用,料液比1:10(g/mL),水浴90 ℃,糊化30 min;液化:调节藜麦清汁pH为6.0,高温α-淀粉酶添加量为11 U/mL,水浴95 ℃,液化45 min;糖化:调节藜麦清汁pH为4.5,糖化酶添加量为110 U/mL,水浴60 ℃,糖化30 min;酶解:蓝靛果添加40%蒸馏水,粉碎榨汁,添加2.5%果胶酶,水浴45 ℃,酶解30 min。
1.2.2 菌种的活化与培养
活性干酵母溶解于10倍体积无菌水中,30~35 ℃恒温水浴活化30 min待用;取1管于EP管中甘油保藏的乳酸菌37 ℃活化后,接入灭菌后的MRS肉汤培养基中,于37 ℃恒温培养箱中培养24 h后待用。对实验中所用菌株进行编号,分别将YE记为S1,Sce记为S2,BA记为S3,DE记为S4,LA记为L1,LP记为L2,LR记为L3,S记为L4。
1.2.3 酵母菌筛选及发酵条件确定
1.2.3.1 发酵菌种及时间选择
以藜麦-蓝靛果复合发酵液中SOD活力和活菌数为双指标,在初始装瓶量30 mL、pH5.0、接种量为0.20%条件下,接种BA、DE、YE和Sce菌液于藜麦-蓝靛果复合清汁中,30 ℃下分别发酵8、16、24、32、40 h。
1.2.3.2 接种量选择
以藜麦-蓝靛果复合发酵液中SOD活力和活菌数为双指标,在初始装瓶量30 mL、pH5.0条件下,接种0.15%、0.20%、0.25%、0.30%、0.35%酵母菌。
1.2.3.3 装瓶量选择
以藜麦-蓝靛果复合发酵液中SOD活力和活菌数为双指标,在初始装瓶量30 mL、pH5.0、接种量为0.20%条件下,100 mL锥形瓶中分别装10、20、30、40、50 mL藜麦-蓝靛果复合清汁后接种酵母菌,发酵16 h。
1.2.4 活菌数的测定
酵母菌采用血球计数板法计数;乳酸菌采用平板法计数。
1.2.5 SOD活力的测定
按照超氧化物歧化酶(SOD)测定试剂盒说明书方法测定。
1.2.6 乳酸菌筛选及发酵条件确定
1.2.6.1 乳酸菌生长曲线及产酸性能的测定
将乳酸菌在其最适条件下培养,每隔4 h取样,使用酶标仪测量其OD值绘制生长曲线,使用精密pH计测定pH绘制产酸曲线。
1.2.6.2 发酵菌种及时间选择
以藜麦-蓝靛果复合发酵液中活菌数和SOD活力为双指标,在初始pH5.0、发酵温度37 ℃条件下,接种量为3%的LA、LP、LR和S菌液于藜麦-蓝靛果复合清汁中,37 ℃下分别发酵8、16、24、32、40 h。
1.2.6.3 接种量选择
以藜麦-蓝靛果复合发酵液中SOD活力和活菌数为双指标,在初始pH5.0、发酵温度37 ℃条件下,分别接种1%、2%、3%、4%、5%菌液,L1、L2、L3发酵24 h、L4发酵16 h。
1.2.6.4 复配比例选择
以藜麦-蓝靛果复合发酵液中SOD活力和活菌数为双指标,在初始pH5.0、发酵温度37℃条件下,将上述两种最优乳酸菌按1:3、1:2、1:1、2:1、3:1比例接种,分别发酵24 h。
1.2.7 复配菌种发酵藜麦-蓝靛果复合发酵液工艺优化
1.2.7.1 单因素实验
藜麦-蓝靛果复合清汁初始pH5.0,原料复配比例为1:1,添加6%白砂糖,灭菌后先接种0.02%酵母菌30 ℃预发酵16 h,再接种2%复配乳酸菌37 ℃发酵24 h,测定藜麦-蓝靛果复合发酵液SOD活力和GABA含量。固定其它条件,分别考察初始pH(3.5、4.0、4.5、5.0、5.5)、发酵温度(26.5、30.0、33.5、37.0、40.5 ℃)、原料复配比例(1:5、1:3、1:1、3:1、5:1)、白糖添加量(4%、6%、8%、10%、12%)对藜麦-蓝靛果复合发酵液SOD活力、GABA含量的影响。
1.2.7.2 响应面试验设计
利用Design-Expert 10软件中Box-Behnken模型,以藜麦-蓝靛果复合发酵液SOD活力为响应值,进行白糖添加量、复配比例(藜麦清汁:蓝靛果果汁)、接种量、发酵温度4个单因素对藜麦-蓝靛果复合发酵液SOD活力的响应面分析,优化发酵工艺参数。试验因素水平如表1所示。
表 1 Box-Behnken试验设计因素及水平Table 1. Factors and levels used in Box-Behnken design水平 因素 A初始pH B复配比例
(mL/mL)C白糖添加量
(%)D发酵温度
(℃)−1 4.5 1:5 8 33.5 0 5.0 1:3 10 37 1 5.5 1:1 12 40.5 1.2.8 GABA 含量测定
参考汤彩云等[18]的方法绘制标准曲线,藜麦-蓝靛果复合发酵液的GABA质量浓度测定方法与标准品相同,将测得的吸光度值带入标准曲线方程y=2.1796x+0.0553,R2=0.9995,求出GABA的质量浓度,即为藜麦-蓝靛果复合发酵液的GABA含量。
1.3 数据处理
所有试验重复3次,采用SPSS 25进行单因素方差分析,P<0.05具有统计学意义,Design Expert 10中Box-Behnken模型进行响应面试验设计及分析、GraphPad Prism 9软件作图。
2. 结果与分析
2.1 酵母菌筛选
2.1.1 不同酵母菌发酵过程中对复合发酵液的SOD活力和活菌数的影响
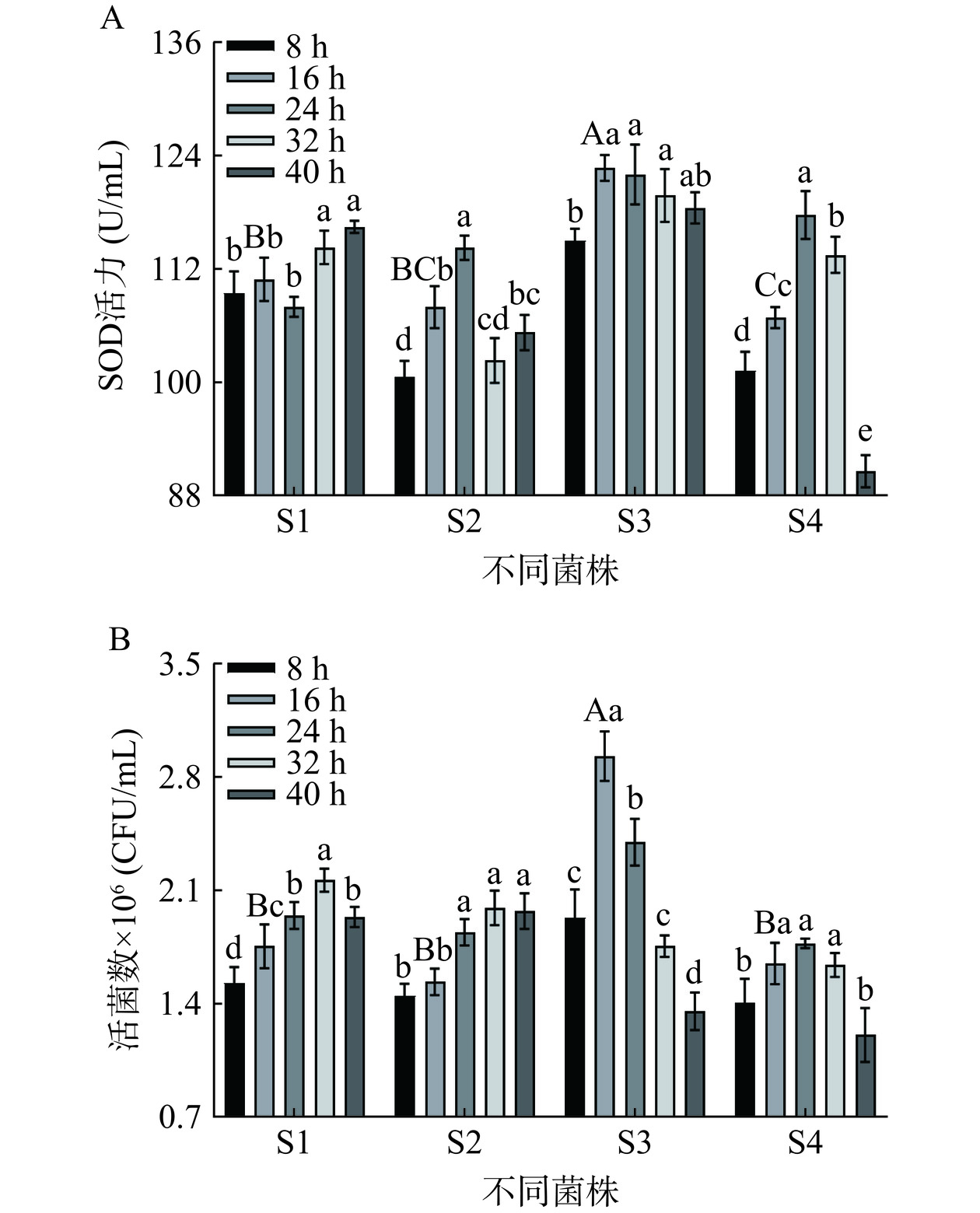
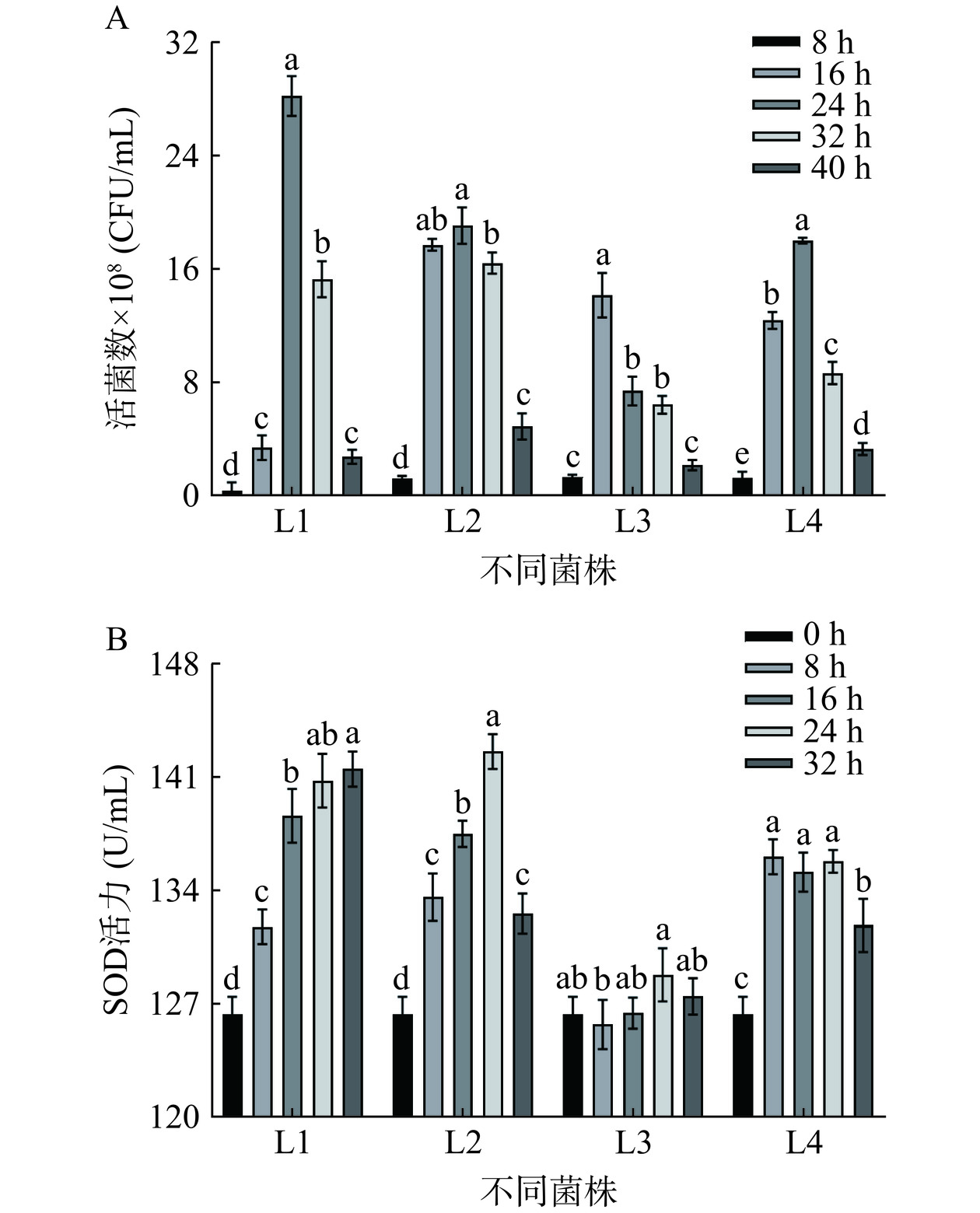
由图1A、图1B可知,发酵16 h时,S3菌株发酵的复合发酵液SOD活力和活菌数均达最大值(122.728 mg/mL,2.933×106 CFU/mL)。纵观S3、S4酵母菌发酵整个过程,藜麦-蓝靛果复合发酵液的SOD活性与活菌数正相关,发酵16 h时,S3酵母菌的SOD活力和活菌数显著(P<0.05)高于S1、S2、S4,这与陈秋慧等[19]研究的酵母菌菌种对刺梨果渣酵素SOD活力及酵母菌活菌数的影响结果一致。SOD活力和活菌数的变化可能是因为发酵基质中的营养物质消耗量随着发酵时间的延长而增加,后期营养物质不充分,酵母菌繁殖速度下降,导致SOD酶活力和酵母菌活菌数下降[18]。故选择S3作为复合发酵液的最佳酵母菌种,确定发酵16 h进行后续研究。
2.1.2 不同酵母菌接种量对复合发酵液SOD活力和活菌数的影响
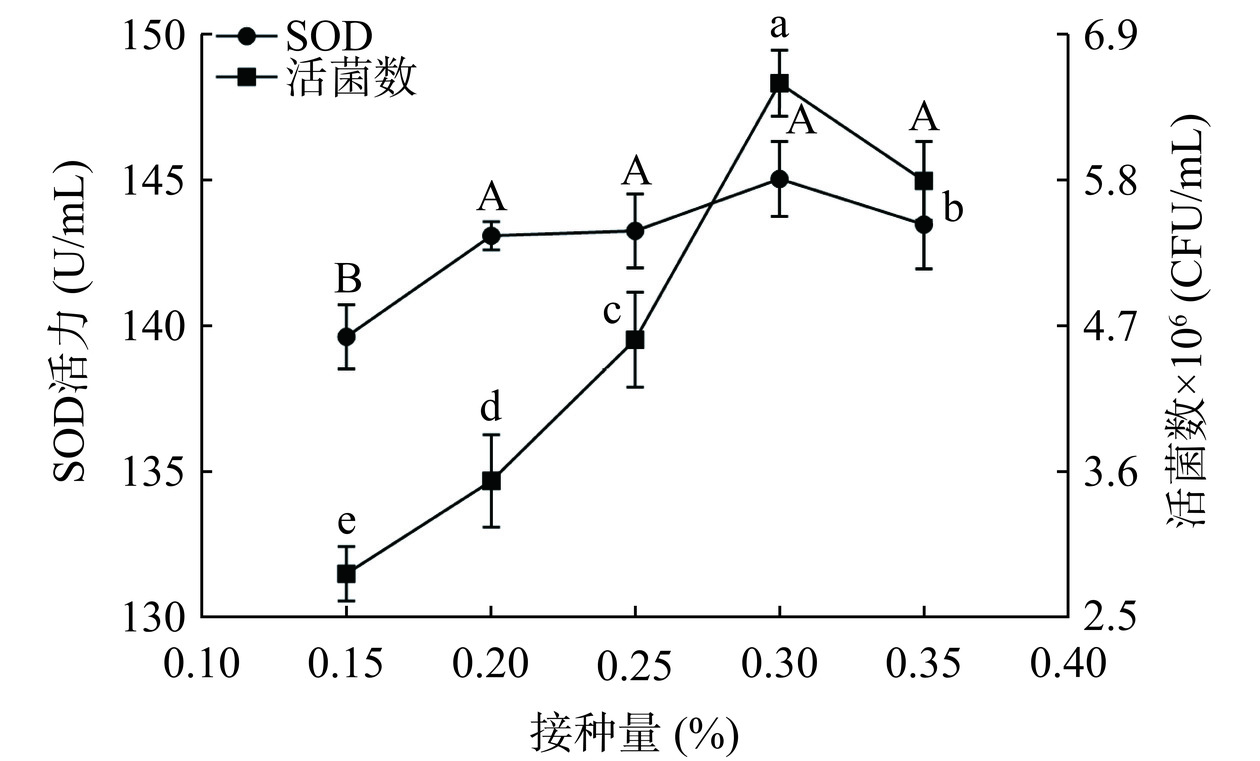
由图2可知,当接种量为0.30%时,藜麦-蓝靛果复合发酵液的SOD活力和活菌数分别达到最大值,为145.062 U/mL和6.533×106 CFU/mL,接种量的大小直接影响着酵母菌的生长繁殖速度,接种量过大,发酵初期代谢迅速,引起发酵液中溶氧不足,菌丝体提前衰老,影响酵母菌代谢产物合成;接种量过小,酵母菌生长代谢缓慢,培养时间延长,代谢产物合成缓慢或降低,从而降低了产品的质量[18],因此确定接种S3发酵的接种量为0.30%。
![]() 图 2 不同酵母菌接种量和复合清汁装瓶量对复合发酵液SOD活力和活菌数的影响注:大写字母代表SOD的组内差异性(P<0.05),小写字母代表活菌数的组内差异性(P<0.05);图3同。Figure 2. Effects of different yeast inoculations and complex clear juice bottling amount on SOD activity and viable bacteria number of complex fermentation liquid
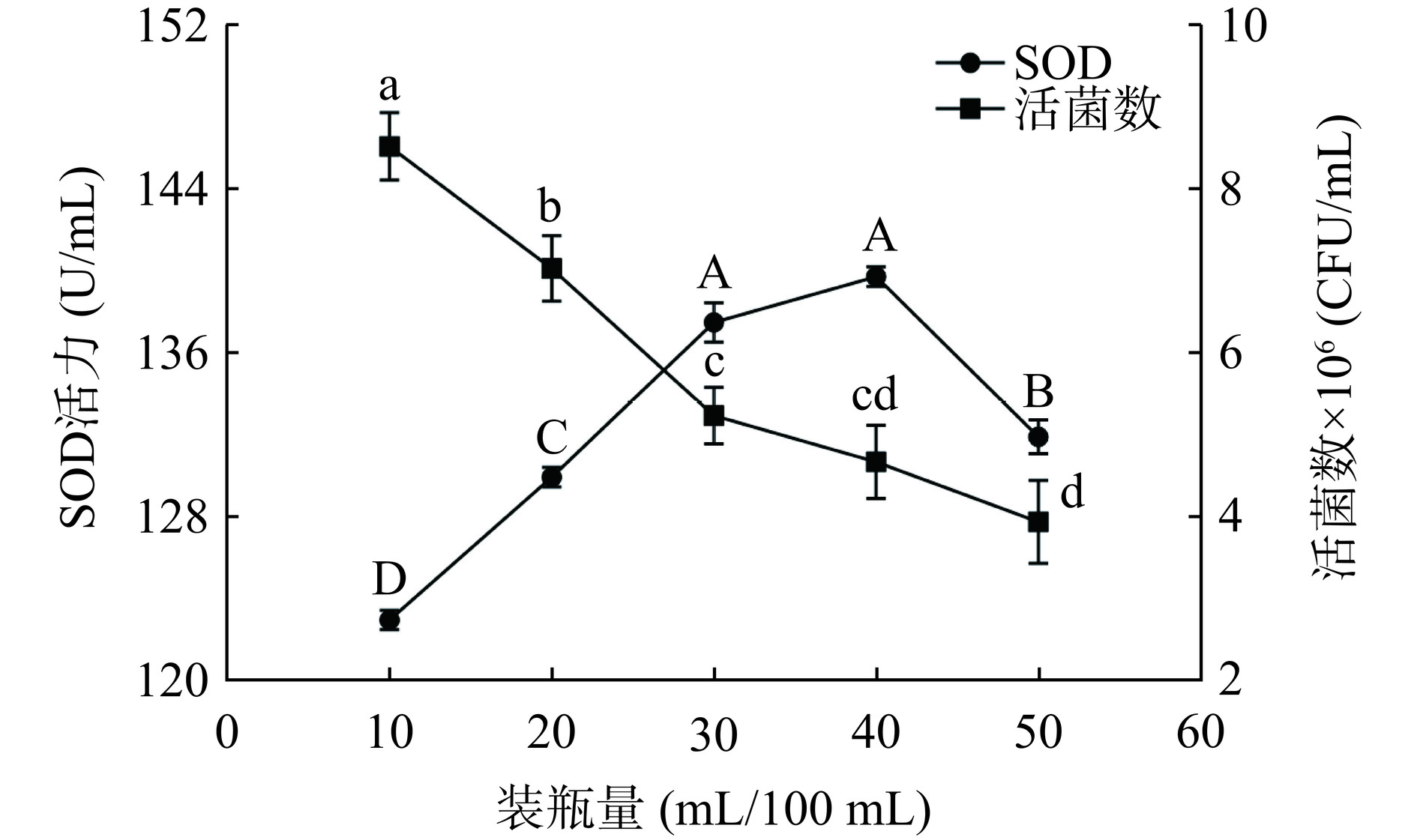
图 2 不同酵母菌接种量和复合清汁装瓶量对复合发酵液SOD活力和活菌数的影响注:大写字母代表SOD的组内差异性(P<0.05),小写字母代表活菌数的组内差异性(P<0.05);图3同。Figure 2. Effects of different yeast inoculations and complex clear juice bottling amount on SOD activity and viable bacteria number of complex fermentation liquid2.1.3 不同复合发酵液装瓶量对SOD活力和活菌数的影响
酵母菌是发酵过程中分有氧发酵和无氧发酵两个阶段的需氧型菌种,体系含氧量对产酶能力影响较大[20]。由图3可知,藜麦-蓝靛果复合发酵液中活菌数随装瓶量的增加显著(P<0.05)降低,而SOD活力随装瓶量的增加呈先升后降的趋势,在装瓶量为40 mL时达到最高值为139.741 U/mL,这与王迪等[21]研究的不同装瓶量的芸豆酵素SOD活力变化趋势一致。随装瓶量的增加,体系中氧气含量的减少抑制了酵母菌的生长,从而导致复合发酵液中SOD活力和活菌数均下降。故降低装瓶量有利于酵母菌产酶,故最终确定复合清汁装瓶量为40 mL/100 mL。
2.2 乳酸菌筛选
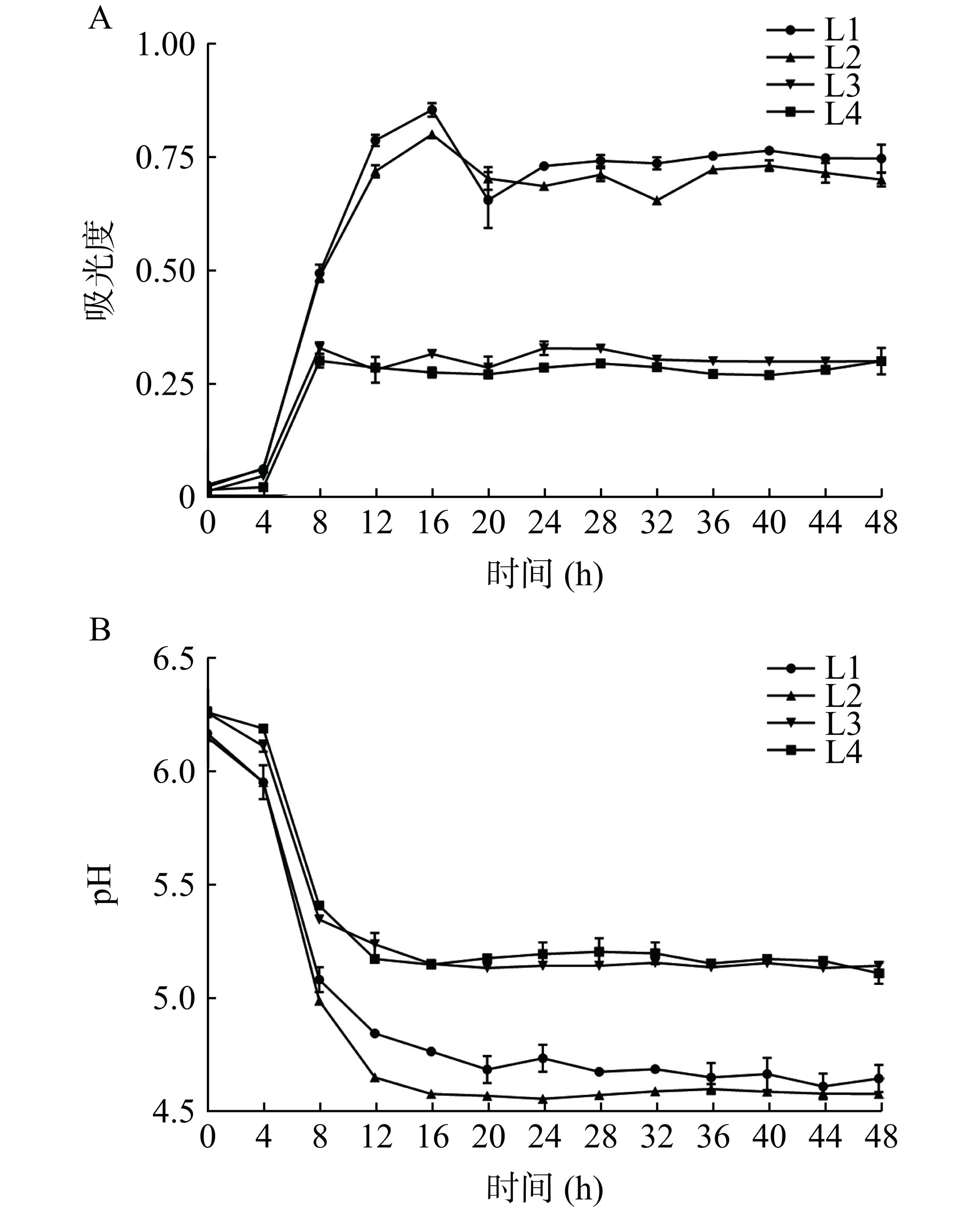
2.2.1 不同乳酸菌生长曲线及产酸性能的测定
乳酸菌的发酵性能可通过比较菌株的生长速率和产酸量来体现。由图4A可知,四种乳酸菌均在4 h后进入对数增长期,L1和L2在16 h后进入稳定期,L3和L4在8 h后进入稳定期,L1和L2达到稳定期的吸光度值较大,即细胞数较多,且L1和L2的对数期比L3和L4的对数期更长。由图4B可知,随着发酵时间的延长,四种乳酸菌的pH整体呈下降趋势,乳酸菌生长繁殖产生的有机酸会导致发酵体系pH降低,从而抑制腐败菌的生长[22],其中L1和L2进入稳定期后的pH较低,因此L1和L2的产酸能力较强,故可判断L1和L2发酵能力较强。
2.2.2 不同乳酸菌发酵过程中对复合发酵液活菌数和SOD活力的影响
由图5A和图5B可知,随着发酵时间的增加,接种不同菌株的发酵液活菌数和SOD活力产生了不同变化。L1、L2、L4发酵的藜麦-蓝靛果复合发酵液活菌数均在24 h达到最大,分别为28.300×108 、19.160×108 、18.100×108 CFU/mL,L3活菌数在16 h时达最大。L2、L3在24 h时SOD活力最强,L1在32 h时SOD活力最强,L4在8 h时SOD活力最强,L1、L3、L4的SOD活力最大值前后时间点的差异不显著(P<0.05)。综上,以乳酸菌活菌数为主要参考指标,确定接种L1、L2、L4的藜麦-蓝靛果复合清汁最优发酵时间为24 h,接种L3的藜麦-蓝靛果复合清汁最优发酵时间为16 h。
![]() 图 5 不同乳酸菌发酵过程中复合发酵液的活菌数和SOD活力变化注:小写字母代表组内差异性(P<0.05);图6同。Figure 5. Changes of viable count and SOD activity of compound fermentation broth during fermentation of different lactic acid bacteria
图 5 不同乳酸菌发酵过程中复合发酵液的活菌数和SOD活力变化注:小写字母代表组内差异性(P<0.05);图6同。Figure 5. Changes of viable count and SOD activity of compound fermentation broth during fermentation of different lactic acid bacteria2.2.3 不同乳酸菌接种量对复合发酵液活菌数和SOD活力的影响
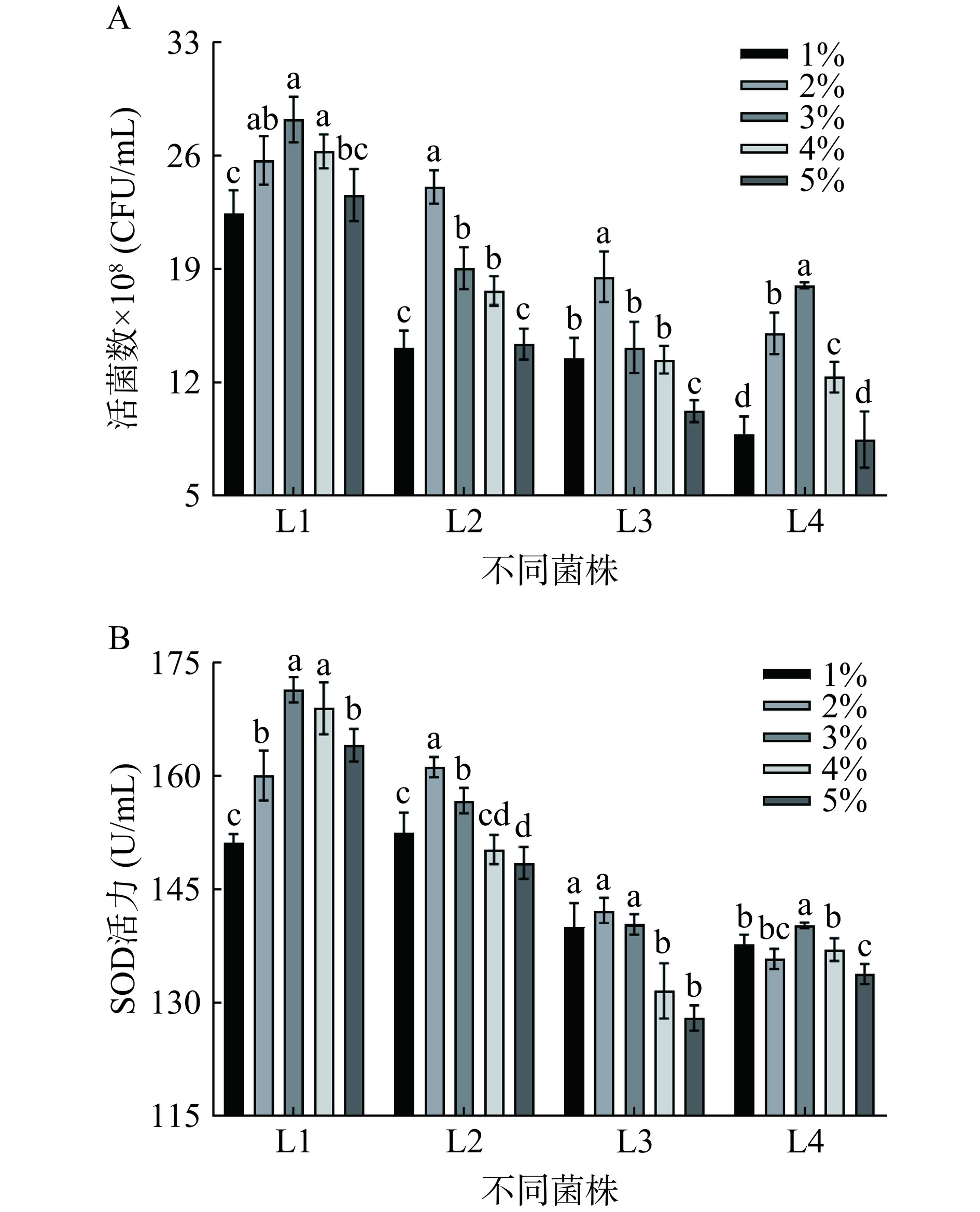
接种量会影响藜麦-蓝靛果复合发酵液中的菌液浓度,进而影响发酵时间与发酵进程[23]。由图6A和图6B可知,四种乳酸菌分别在最佳发酵时间发酵时,随接种量递增,活菌数和SOD值均呈先上升后下降的抛物线趋势。接种量2%时,L2和L3的藜麦-蓝靛果复合清汁活菌数和SOD值最大,分别为24.143×108 CFU/mL、161.333 U/mL,18.627×108 CFU/mL、142.388 U/mL;接种量3%时,L1和L4的复合清汁活菌数和SOD值均达到最大,分别为28.300×108 CFU/mL、171.556 U/mL,18.100×108 CFU/mL、140.444 U/mL。综上,复合清汁中接种L1和L4的最佳接种量为3%,接种L2和L3的最佳接种量为2%,故选用SOD活力高的L1和L2进行后续复配比例的选择。
2.2.4 不同乳酸菌复配比例对复合发酵液活菌数和SOD活力的影响
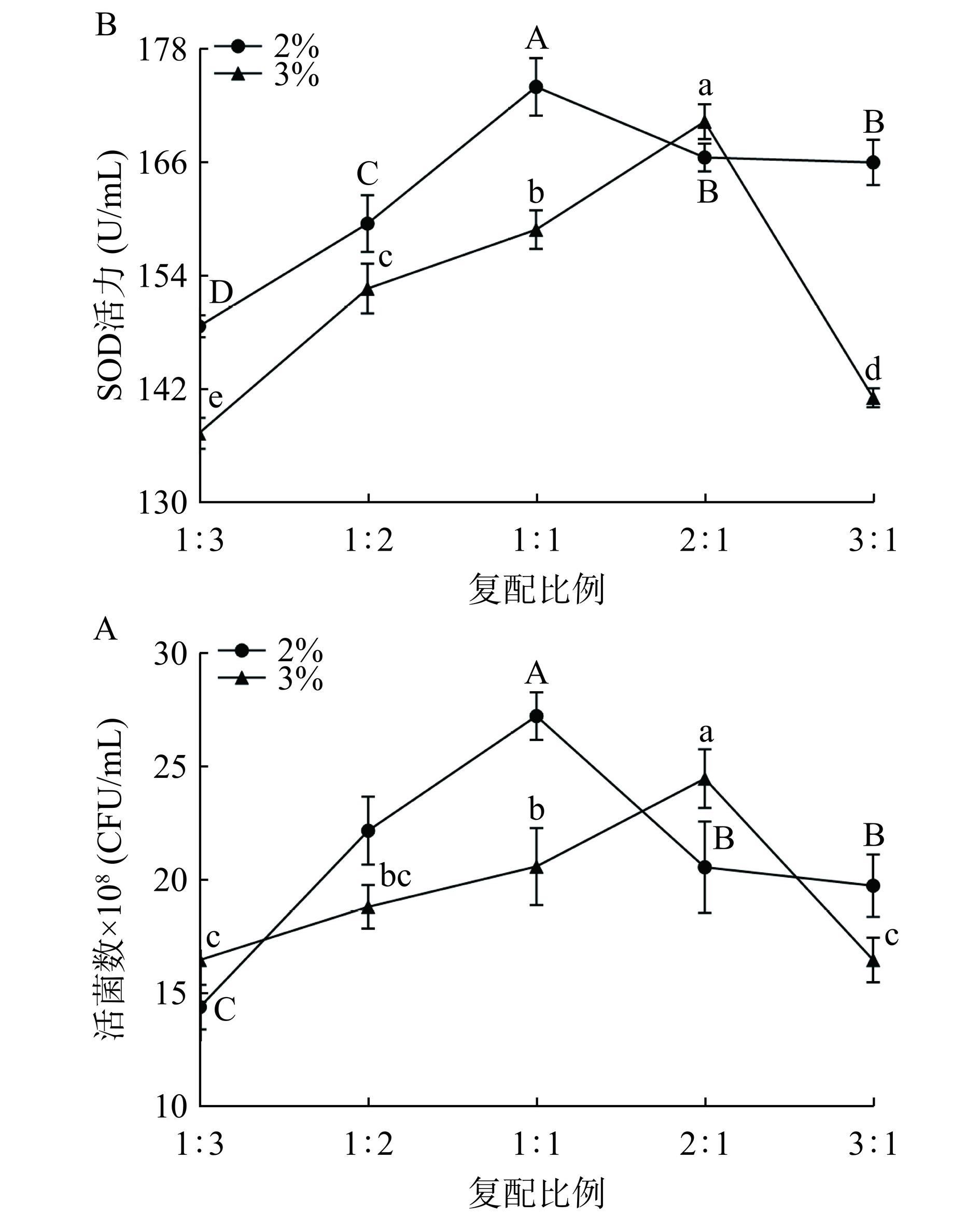
由图7A、图7B可知,L1和L2以不同比例复配进行24 h发酵,发酵过程中活菌数和SOD值随着复配比例的减少均呈先上升后下降的趋势,在接种量为2%时,L1和L2的复配比例均为1:1时,藜麦-蓝靛果复合发酵液活菌数和SOD值均达到最大,分别为27.250×109 CFU/mL、174.000 U/mL;在接种量为3%时,L1和L2的复配比例为2:1时,复合发酵液活菌数和SOD值达到最大,分别为24.490×108 CFU/mL、170.333 U/mL。选用接种量为2%时,复合发酵液的活菌数及SOD值高于接种量为3%时的活菌数及SOD值。综上,接种L1和L2的最佳接种量为2%,其复配比例为1:1。
2.3 酵母菌乳酸菌复合发酵
2.3.1 单因素实验
SOD是发酵液的功效酶之一,可催化超氧阴离子自由基(O2−·)歧化成分子氧和过氧化氢,在应对氧化应激中起关键作用[24],GABA主要是由谷氨酸或其盐类在谷氨酸脱羧酶的催化下发生不可逆的α-脱羧反应形成的,在发酵体系中被广泛研究[25]。不同菌株适宜生长和耐受pH是不同的,发酵过程中,初始pH影响着微生物的生长及其代谢产物的生成[26]。由图8A可知,SOD活力和GABA含量随着初始pH的增大呈先上升后下降的趋势,可能是SOD化学本质为蛋白质,其结构易受pH、温度等物理或化学因素影响,导致空间结构被破坏,酶活性降低[27];由图8B可知,随着发酵温度的升高,SOD活力和GABA含量先升高后下降,在发酵温度为37 ℃时,发酵液的SOD活力达到最大值282.269 U/mL,GABA含量达到最大值0.636 mg/mL,Dong等[28]对乳酸菌筛选研究表明发酵温度越高,乳酸菌的乳酸产量越大,发酵效果越好,但温度过高会破坏一些结构不稳定的活性物质,导致导致有机酸被分解出来,酸性环境不利于菌株的生长,导致SOD活力和GABA含量均会下降。
由图8C、图8D可知,在原料复配比例为1:3时,SOD活力达到最大值310.185 U/mL,在原料复配比例为1:1时,GABA含量达到最大值0.637 mg/mL。随着白糖添加量的增加,SOD活力和GABA含量呈上升趋势,当白糖添加量超过10%时,SOD活力及GABA含量下降。糖为酵母菌和乳酸菌生长提供碳源,酵母菌和乳酸利用糖进行生长繁殖并完成营养代谢的过程,若发酵体系中含糖量过高,发酵体系形成高渗透压状态,抑制了发酵菌种的生长和代谢,导致产酶活力下降,从而抑制菌的生长[29],最终影响SOD活力和GABA含量。
综上,确定发酵液初始pH为5.0,原料复配比例为1:3,白糖添加量为10%,发酵温度为37 ℃。
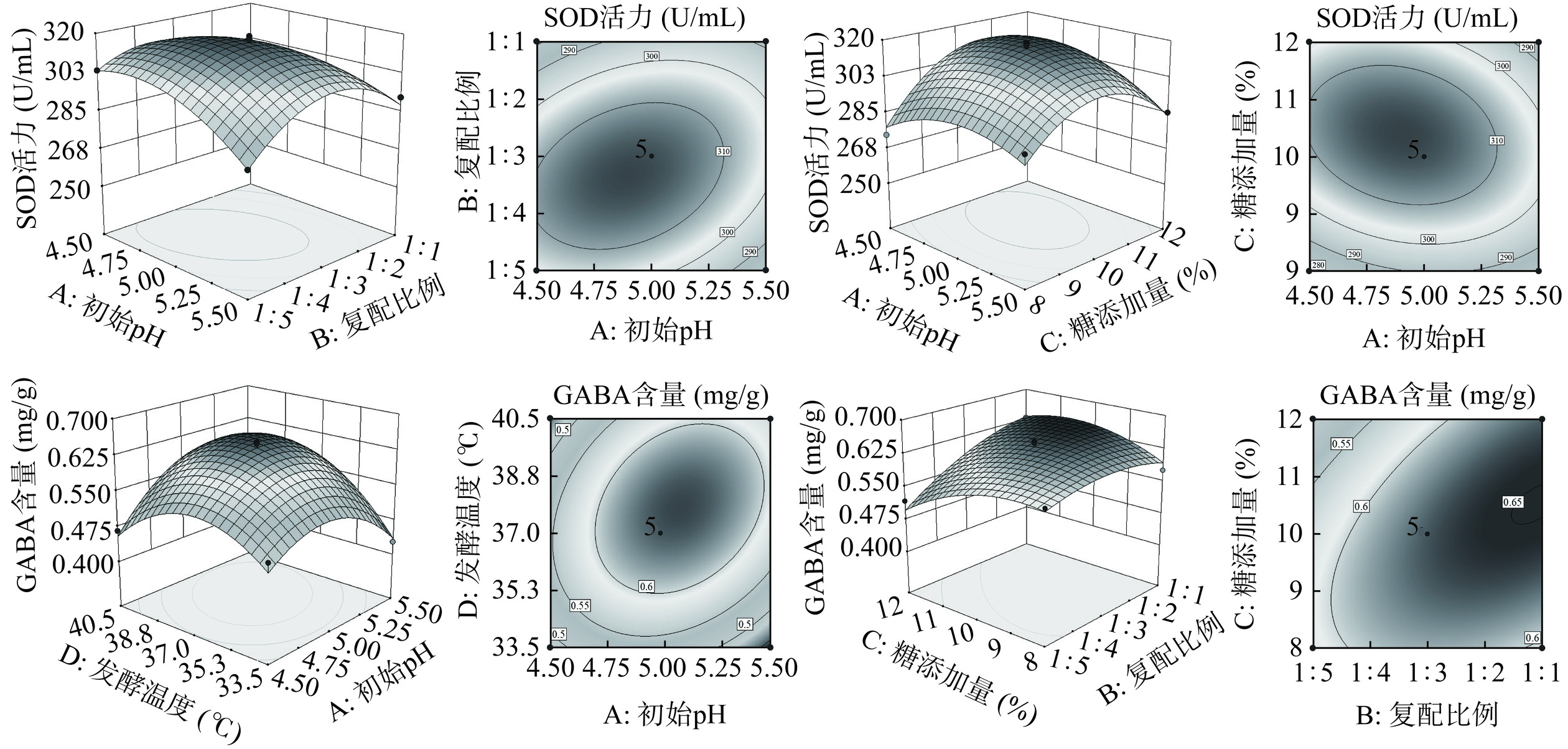
2.3.2 响应面试验结果与分析
本次研究依据Box-Behnken试验设计原则,以初始pH(A)、复配比例(B)、白糖添加量(C)、发酵温度(D)4个因素作为主要影响因素,以SOD活力和GABA含量为响应值,设计4因素3水平试验模型。
通过Design-Expert 10软件对试验数据进行多元二次多项式回归拟合,得到二次多项回归方程:YSOD活力=316−3.09A−4.42B+6.21C−3.38D+7.81AB−5.49AC+7.98AD+6.82BC+3.16BD−0.67CD−10.23A2−17.74B2−19.24C2−15.65D2
YGABA含量 = 0.64 + 0.016A + 0.036B − 0.012C +0.027D+0.015AB−0.025AC+0.04AD+0.032BC+ 0.015BD−0.024CD−0.072A2−0.023B2−0.034C2− 0.078D2
由表2可知,该模型项极显著(P<0.0001),失拟项不显著(P>0.05),R2=0.9506,说明模型拟合程度优良,能较为直观地拟合试验结果;R2Adj=0.9012,说明模型的相关性和解释度都很好,可以用此模型对SOD活力进行理论分析和预测。分析方差数据可以看出,对响应值影响极显著(P<0.01)的因素有:复配比例、白糖添加量,AB、AD、A2、B2、C2、D2;对响应值影响显著(P<0.05)的因素有:初始pH、发酵温度,AC、BC。各因素对SOD活力影响程度为C>B>D>A,即白糖添加量>复配比例>发酵温度>初始pH。
表 2 SOD活力模型及回归系数的回归分析结果Table 2. Results of regression analysis of SOD activity model and regression coefficient来源 离差平方和 自由度 均方 F值 P值 显著性 模型 6256.27 14 446.88 19.24 <0.0001 ** A-初始pH 114.58 1 114.58 4.93 0.0433 * B-复配比例 234.91 1 234.91 10.11 0.0067 ** C-白糖添加量 462.46 1 462.46 19.91 0.0005 ** D-发酵温度 137.17 1 137.17 5.91 0.0291 * AB 244.3 1 244.30 10.52 0.0059 ** AC 120.44 1 120.44 5.19 0.039 * AD 254.82 1 254.82 10.97 0.0051 ** BC 185.91 1 185.91 8 0.0134 * BD 39.93 1 39.93 1.72 0.2109 CD 1.77 1 1.77 0.076 0.7866 A2 678.69 1 678.69 29.22 < 0.0001 ** B2 2042.17 1 2042.17 87.92 < 0.0001 ** C2 2400.15 1 2400.15 103.34 < 0.0001 ** D2 1588.1 1 1588.10 68.37 < 0.0001 ** 残差 325.17 14 23.23 失拟项 286.77 10 28.68 2.99 0.1515 ns 纯误差 38.4 4 9.60 总和 6581.44 28 R2=0.9506 R2Adj=0.9012 注:*表示显著,P<0.05;**表示极显著,P<0.01;ns表示不显著,P>0.05;表3同。 从表3可知,该模型项极显著(P<0.0001),失拟项不显著(P>0.05),同时模型回归系数R2=0.9617,说明模型拟合程度优良,能较为直观地拟合试验结果;R2Adj=0.9234,说明模型的相关性和解释度都很好,可以用此模型对GABA含量进行理论分析和预测。分析方差数据可以看出,影响极显著(P<0.01)的因素有:初始pH、复配比例、发酵温度、AD、BC;影响显著(P<0.05)的因素有:白糖添加量、AC、CD。各因素对GABA含量影响程度为:B>D>A>C,即复配比例>发酵温度>初始pH>白糖添加量。
表 3 GABA含量模型及回归系数的回归分析结果Table 3. Results of regression analysis of GABA content model and regression coefficient来源 离差平方和 自由度 均方 F值 P值 显著性 模型 0.1100 14 0.0078 25.13 <0.0001 ** A-初始pH 0.0032 1 0.0032 10.49 0.0059 ** B-复配比例 0.0150 1 0.0150 49.73 <0.0001 ** C-白糖添加量 0.0019 1 0.0019 6.00 0.0281 * D-发酵温度 0.0085 1 0.0085 27.5 0.0001 ** AB 0.0009 1 0.0009 2.82 0.1151 AC 0.0026 1 0.0026 8.27 0.0122 * AD 0.0065 1 0.0065 21.01 0.0004 ** BC 0.0042 1 0.0042 13.49 0.0025 ** BD 0.0009 1 0.0009 2.82 0.1151 CD 0.0023 1 0.0023 7.32 0.0171 * A2 0.0340 1 0.0340 110.03 <0.0001 ** B2 0.0035 1 0.0035 11.44 0.0045 ** C2 0.0076 1 0.0076 24.78 0.0002 ** D2 0.0390 1 0.0390 127.4 <0.0001 ** 残差 0.0043 14 0.0003 失拟项 0.0035 10 0.0003 1.67 0.3274 Ns 纯误差 0.0008 4 0.0002 总和 0.11 28 R2=0.9617 R2Adj=0.9234 使用Design-Expert 10软件对试验结果绘图见图9,AB、AC、AD、BC交互作用对响应值影响的响应面图坡度陡峭,等高线图线条排列密集,说明以上交互作用对响应值的影响均有显著作用。
2.3.3 最优工艺及验证试验结果
以SOD活力、GABA含量最大值为优化目标,Design-Expert 10软件优化参数,预测SOD活力为314.814 U/mL、GABA含量为0.642 mg/g,采用优化后的所得的参数进行验证试验,条件参数设为初始pH为5.0、复配比例为1:3、白糖添加量10.14%、发酵温度为37 ℃;重复试验3次,测得SOD活力平均值为(318.245±3.245)U/mL、GABA含量为(0.647±0.018)mg/g,与模型预测值314.814 U/mL、GABA含量为0.642 mg/g,在5%偏差范围内,说明该模型优化得到的工艺参数可靠。
3. 结论
本研究以藜麦与蓝靛果为原料,筛选出藜麦-蓝靛果复合发酵液的最优发酵菌种为酵母菌BA和乳酸菌LA和LP。经单因素实验和响应面试验优化酵母菌和乳酸菌复合发酵的工艺,得到优化后最佳工艺参数条件:藜麦与蓝靛果复配比例1:3,白糖添加量10.14%,初始pH为5.0,先30 ℃摇床培养16 h再37 ℃培养24 h,优化工艺参数后的藜麦-蓝靛果复合发酵液SOD活力和GABA含量分别比未发酵提高1.41、1.08倍,说明酵母菌、乳酸菌协同发酵对藜麦和蓝靛果复合发酵有积极影响,不仅保留了藜麦和蓝靛果中固有的营养物质且SOD活力和GABA含量得到累积增加,这与蔡丽琴[30]研究结果一致。本文主要对藜麦-蓝靛果复合发酵液的发酵工艺进行了优化,未对发酵过程中活性物质的变化情况进行分析,因此后期将进一步深入研究,以探究其功能活性组分及挥发性风味物质变化等。本实验为杂粮和小浆果类食品的加工创制提供了理论依据和试验数据支撑。
-
图 2 不同酵母菌接种量和复合清汁装瓶量对复合发酵液SOD活力和活菌数的影响
注:大写字母代表SOD的组内差异性(P<0.05),小写字母代表活菌数的组内差异性(P<0.05);图3同。
Figure 2. Effects of different yeast inoculations and complex clear juice bottling amount on SOD activity and viable bacteria number of complex fermentation liquid
图 5 不同乳酸菌发酵过程中复合发酵液的活菌数和SOD活力变化
注:小写字母代表组内差异性(P<0.05);图6同。
Figure 5. Changes of viable count and SOD activity of compound fermentation broth during fermentation of different lactic acid bacteria
表 1 Box-Behnken试验设计因素及水平
Table 1 Factors and levels used in Box-Behnken design
水平 因素 A初始pH B复配比例
(mL/mL)C白糖添加量
(%)D发酵温度
(℃)−1 4.5 1:5 8 33.5 0 5.0 1:3 10 37 1 5.5 1:1 12 40.5 表 2 SOD活力模型及回归系数的回归分析结果
Table 2 Results of regression analysis of SOD activity model and regression coefficient
来源 离差平方和 自由度 均方 F值 P值 显著性 模型 6256.27 14 446.88 19.24 <0.0001 ** A-初始pH 114.58 1 114.58 4.93 0.0433 * B-复配比例 234.91 1 234.91 10.11 0.0067 ** C-白糖添加量 462.46 1 462.46 19.91 0.0005 ** D-发酵温度 137.17 1 137.17 5.91 0.0291 * AB 244.3 1 244.30 10.52 0.0059 ** AC 120.44 1 120.44 5.19 0.039 * AD 254.82 1 254.82 10.97 0.0051 ** BC 185.91 1 185.91 8 0.0134 * BD 39.93 1 39.93 1.72 0.2109 CD 1.77 1 1.77 0.076 0.7866 A2 678.69 1 678.69 29.22 < 0.0001 ** B2 2042.17 1 2042.17 87.92 < 0.0001 ** C2 2400.15 1 2400.15 103.34 < 0.0001 ** D2 1588.1 1 1588.10 68.37 < 0.0001 ** 残差 325.17 14 23.23 失拟项 286.77 10 28.68 2.99 0.1515 ns 纯误差 38.4 4 9.60 总和 6581.44 28 R2=0.9506 R2Adj=0.9012 注:*表示显著,P<0.05;**表示极显著,P<0.01;ns表示不显著,P>0.05;表3同。 表 3 GABA含量模型及回归系数的回归分析结果
Table 3 Results of regression analysis of GABA content model and regression coefficient
来源 离差平方和 自由度 均方 F值 P值 显著性 模型 0.1100 14 0.0078 25.13 <0.0001 ** A-初始pH 0.0032 1 0.0032 10.49 0.0059 ** B-复配比例 0.0150 1 0.0150 49.73 <0.0001 ** C-白糖添加量 0.0019 1 0.0019 6.00 0.0281 * D-发酵温度 0.0085 1 0.0085 27.5 0.0001 ** AB 0.0009 1 0.0009 2.82 0.1151 AC 0.0026 1 0.0026 8.27 0.0122 * AD 0.0065 1 0.0065 21.01 0.0004 ** BC 0.0042 1 0.0042 13.49 0.0025 ** BD 0.0009 1 0.0009 2.82 0.1151 CD 0.0023 1 0.0023 7.32 0.0171 * A2 0.0340 1 0.0340 110.03 <0.0001 ** B2 0.0035 1 0.0035 11.44 0.0045 ** C2 0.0076 1 0.0076 24.78 0.0002 ** D2 0.0390 1 0.0390 127.4 <0.0001 ** 残差 0.0043 14 0.0003 失拟项 0.0035 10 0.0003 1.67 0.3274 Ns 纯误差 0.0008 4 0.0002 总和 0.11 28 R2=0.9617 R2Adj=0.9234 -
[1] 王俊敏, 黑藜麦山楂酒的研制及抗氧化分析[D]. 太原:山西大学, 2021. [WANG J M, Development and antioxidant analysis of black quinoa and hawthorn wine[D]. Taiyuan:Shanxi University, 2021.] WANG J M, Development and antioxidant analysis of black quinoa and hawthorn wine[D]. Taiyuan: Shanxi University, 2021.
[2] 黄其程. 藜麦无麸质面条的挤压法制备及其消化特性研究[D]. 无锡:江南大学, 2022. [HUANG Q C, Study on preparation and digestion characteristics of quinoa gluten-free noodles by extrusion method[D]. Wuxi:Jiangnan University, 2022.] HUANG Q C, Study on preparation and digestion characteristics of quinoa gluten-free noodles by extrusion method[D]. Wuxi: Jiangnan University, 2022.
[3] 胡洁. 藜麦萌发过程中营养物质变化规律及藜麦芽饮料研制[D]. 太原:山西大学, 2017. [HU J. Changes of nutrients in quinoa during germination and development of quinoa malt beverage[D]. Taiyuan:Shanxi University, 2017.] HU J. Changes of nutrients in quinoa during germination and development of quinoa malt beverage[D]. Taiyuan: Shanxi University, 2017.
[4] 付荣霞, 周学永, 肖建中, 等. 藜麦多酚研究进展[J]. 粮食与油脂,2020,33(6):24−26. [FU R X, ZHOU X Y, XIAO J Z, et al. Research progress of quinoa polyphenols[J]. Food and Oil,2020,33(6):24−26.] doi: 10.3969/j.issn.1008-9578.2020.06.007 FU R X, ZHOU X Y, XIAO J Z, et al. Research progress of quinoa polyphenols[J]. Food and Oil, 2020, 33(6): 24−26. doi: 10.3969/j.issn.1008-9578.2020.06.007
[5] GERBRANDT E M, BORS R H, CHIBBAR R N, et al. Blue honeysuckle (Lonicera caerulea L.) vegetative growth cessation and leaf drop phenological adaptation to a temperate climate[J]. Genetic Resources and Crop Evolution,2018,65(5):1471−1484. doi: 10.1007/s10722-018-0631-8
[6] SENICA M, STAMPAR F, MIKULIC-PETKOVSEK M. Blue honeysuckle (Lonicera cearulea L.) berry:A rich source of some nutrients and their differences among four different cultivars[J]. Scientia Horticulturae,2018,238:215−221. doi: 10.1016/j.scienta.2018.04.056
[7] 乔锦莉, 秦栋, 郭良川, 等. 蓝果忍冬的生物活性物质及其功效研究进展[J]. 食品科学,2020,41(9):276−284. [QIAO J L, QIN D, GUO L C, et al. Research progress of bioactive substances and their efficacy in Loniceria caerulea L doi: 10.7506/spkx1002-6630-20190416-211 J]. Food Science,2020,41(9):276−284. doi: 10.7506/spkx1002-6630-20190416-211
[8] LEE Y S, CHO I J, KIM J W, et al. Hepatoprotective effects of blue honeysuckle on CCl4-induced acute liver damaged mice[J]. Food Science & Nutrition,2018,7(1):322−338.
[9] 徐雅琴, 刘柠月, 李大龙, 等. 蓝靛果多糖功能特性、结构及抗糖基化活性[J]. 食品科学,2020,41(2):8−14. [XU Y Q, LIU N Y, LI D L, et al. Functional properties, structure and antiglycosylation activity of indigo fruit polysaccharide[J]. Food Science,2020,41(2):8−14.] doi: 10.7506/spkx1002-6630-20190105-069 XU Y Q, LIU N Y, LI D L, et al. Functional properties, structure and antiglycosylation activity of indigo fruit polysaccharide[J]. Food Science, 2020, 41(2): 8−14. doi: 10.7506/spkx1002-6630-20190105-069
[10] 李占东, 王丁, 李皓. 酵素主要功能及其行业展望[J]. 食品工业,2019,40(1):301−303. [LI Z D, WANG D, LI H. Main functions of enzymes and their industry prospects[J]. Food Industry,2019,40(1):301−303.] LI Z D, WANG D, LI H. Main functions of enzymes and their industry prospects[J]. Food Industry, 2019, 40(1): 301−303.
[11] 陈秀丽, 李沛波, 彭维, 等. 水果酵素醋对胰岛素抵抗糖脂代谢紊乱大鼠的影响[J]. 药学研究,2020,39(10):559−561,600. [CHEN X L, LI P B, PENG W, et al. Effect of fruit enzyme vinegar on insulin resistance in rats with glucose and lipid metabolism disorder[J]. Journal of Pharmaceutical Research,2020,39(10):559−561,600.] CHEN X L, LI P B, PENG W, et al. Effect of fruit enzyme vinegar on insulin resistance in rats with glucose and lipid metabolism disorder[J]. Journal of Pharmaceutical Research, 2020, 39(10): 559−561,600.
[12] ABDELAZEZ A, ABDELMOTAAL H, EVIVIE E, et al, Screening potential probiotic characteristics of Lactobacillus brevis strains in vitro and intervention effect on type I diabetes in vivo[J]. BioMed Research International, 2018, 2018:7356173.
[13] BARLA F, KOYANAGI T, TOKUDA N, et al. The γ-aminobutyric acid-producing ability under low pH conditions of lactic acid bacteria isolated from traditional fermented foods of Ishikawa Prefecture, Japan, with a strong ability to produce ACE-inhibitory peptides[J] Biotechnology Reports, 2016, 10:105−110.
[14] ZHAO X, QIAN Y, LI G J, et al. Lactobacillus plantarum YS2 (yak yogurt Lactobacillus) exhibited an activity to attenuate activated carbon-induced constipation in male Kunming mice[J]. Journal of Dairy Science,2019,102(1):26−36. doi: 10.3168/jds.2018-15206
[15] WANG M, LEI M, SAMINA N, et al. Impact of Lactobacillus plantarum 423 fermentation on the antioxidant activity and flavor properties of rice bran and wheat bran[J]. Food Chemistry,2020,330:127156. doi: 10.1016/j.foodchem.2020.127156
[16] ABDELSHAFY M A, RASHWAN K A, OSMAN I A. Potential food applications and biological activities of fermented quinoa:A review[J]. Trends in Food Science & amp; Technology,2024,144:104339-.
[17] LUO J Y, JIANG L, LIANG S, et al. Fermentation of Lonicera caerulea by complex probiotics and its Effect on hypolipidemic[J]. Food Bioscience,2024,57:103502-. doi: 10.1016/j.fbio.2023.103502
[18] 汤彩云, 王涛, 屠洁, 等. 比色法与HPLC法对比测定桑叶茶中γ-氨基丁酸的含量[J]. 食品科学,2018,39(24):256−260. [TANG C Y, WANG T, TU J, et al. Determination of γ-aminobutyric acid in mulberry leaf tea by colorimetric method and HPLC method[J]. Food Science,2018,39(24):256−260.] doi: 10.7506/spkx1002-6630-201824038 TANG C Y, WANG T, TU J, et al. Determination of γ-aminobutyric acid in mulberry leaf tea by colorimetric method and HPLC method[J]. Food Science, 2018, 39(24): 256−260. doi: 10.7506/spkx1002-6630-201824038
[19] 陈秋慧, 魏建敏, 穆先, 等. 刺梨果渣酵素复合发酵工艺优化[J]. 中国调味品,2023,48(9):122−130. [CHEN Q H, WEI J M, MU X et al. Optimization of composite fermentation process of fructus roxburgh residue enzyme[J]. Chinese Condiments,2023,48(9):122−130.] CHEN Q H, WEI J M, MU X et al. Optimization of composite fermentation process of fructus roxburgh residue enzyme[J]. Chinese Condiments, 2023, 48(9): 122−130.
[20] 李志芳, 佐兆杭, 王颖, 等. 芸豆/大豆复合发酵液代谢组分及功能性研究[J]. 食品与机械,2021,37(11):38−43. [LI Z F, ZUO Z H, WANG Y et al. Study on metabolic components and function of kidney bean/soybean complex fermentation broth[J]. Food and Machinery,2021,37(11):38−43.] LI Z F, ZUO Z H, WANG Y et al. Study on metabolic components and function of kidney bean/soybean complex fermentation broth[J]. Food and Machinery, 2021, 37(11): 38−43.
[21] 王迪, 王颖, 张艳莉, 等. 芸豆酵素发酵过程中组分及抗氧化功能研究[J]. 食品工业科技,2021,42(18):18−24. [WANG D, WANG Y, ZHANG Y L, et al. Study on components and antioxidant function of kidney bean fermentation[J]. Science and Technology of Food Industry,2021,42(18):18−24.] WANG D, WANG Y, ZHANG Y L, et al. Study on components and antioxidant function of kidney bean fermentation[J]. Science and Technology of Food Industry, 2021, 42(18): 18−24.
[22] 赵永慧, 杨杰, 朱卿正, 等. 一株植物乳杆菌MMB-03的筛选鉴定及抑菌特性研究[J]. 安徽农业科学,2020,48(17):189−192,196. [ZHAO Y H, YANG J, ZHU Q Z, et al. Screening identification and bacteriostasis characteristics of Lactobacillus plantarum MMB-03[J]. Journal of Anhui Agricultural Sciences,2020,48(17):189−192,196.] ZHAO Y H, YANG J, ZHU Q Z, et al. Screening identification and bacteriostasis characteristics of Lactobacillus plantarum MMB-03[J]. Journal of Anhui Agricultural Sciences, 2020, 48(17): 189−192,196.
[23] OLANBIWONINUL A A, ODUNFA S A. Microbial interaction in selected fermented vegetable condiments in Nigeria[J]. Int Food Res J,2018,25(1):439−445.
[24] 张秋月, 黎谢飞, 曾小群, 等. 产超氧化物歧化酶乳酸菌的筛选及发酵条件优化[J]. 中国食品学报,2021,21(10):143−150. [ZHANG Q Y, LI X F, ZENG X Q, et al. Screening of superoxide dismutase-producing lactic acid bacteria and optimization of fermentation conditions[J]. Chinese Journal of Food Science,2021,21(10):143−150.] ZHANG Q Y, LI X F, ZENG X Q, et al. Screening of superoxide dismutase-producing lactic acid bacteria and optimization of fermentation conditions[J]. Chinese Journal of Food Science, 2021, 21(10): 143−150.
[25] BUATONG A, MEIDONG R, TRONGPANICH Y, et al. Production of plant-based fermented beverages possessing functional ingredients antioxidant, γ-aminobutyric acid and antimicrobials using a probiotic Lactiplantibacillus plantarum strain L42g as an efficient starter culture[J]. Journal of Bioscience and Bioengineering,2022,134(3):226−232. doi: 10.1016/j.jbiosc.2022.05.008
[26] 洪厚胜, 朱曼利, 李伟, 等. 葡萄果渣酵素的发酵工艺优化及其理化特性[J]. 食品科学,2019,40(8):63−72. [HONG H S, ZHU M L, LI W, et al. Optimization of fermentation process and physicochemical properties of grape residue enzymes[J]. Food Science,2019,40(8):63−72.] HONG H S, ZHU M L, LI W, et al. Optimization of fermentation process and physicochemical properties of grape residue enzymes[J]. Food Science, 2019, 40(8): 63−72.
[27] 王迪, 王颖, 张艳莉, 等. 芸豆酵素复合发酵工艺优化及功能性分析[J]. 中国粮油学报,2021,36(7):62−68. [WANG D, WANG Y, ZHANG Y L, et al. Process optimization and functional analysis of kidney bean enzyme complex fermentation[J]. Journal of Cereals and Oils,2021,36(7):62−68.] WANG D, WANG Y, ZHANG Y L, et al. Process optimization and functional analysis of kidney bean enzyme complex fermentation[J]. Journal of Cereals and Oils, 2021, 36(7): 62−68.
[28] DONG A R, THUY HO V T, LO R, et al. A genetic diversity study of antifungal Lactobacillus plantarum isolates[J]. Food Control,2017,72:83−89. doi: 10.1016/j.foodcont.2016.07.026
[29] 郝子娜, 李杰, 田思雨, 等. 南果梨皮渣红糖酵素的工艺优化及品质分析[J]. 粮食与油脂,2023,36(11):134−137,162. [HAO Z N, LI J, TIAN S Y, et al. Process optimization and quality analysis of brown glyzyme from Nanguo pear peel residue[J]. Food and Oil,2023,36(11):134−137,162.] HAO Z N, LI J, TIAN S Y, et al. Process optimization and quality analysis of brown glyzyme from Nanguo pear peel residue[J]. Food and Oil, 2023, 36(11): 134−137,162.
[30] 蔡丽琴. 猕猴桃酵素发酵过程中代谢产物变化规律研究[D]. 杭州:浙江工商大学, 2022. [CAI L Q. Study on the changes of metabolites during the fermentation of kiwifruit[D]. Hangzhou:Zhejiang Gongshang University, 2022.] CAI L Q. Study on the changes of metabolites during the fermentation of kiwifruit[D]. Hangzhou: Zhejiang Gongshang University, 2022.
-
期刊类型引用(4)
1. 周柯鑫,张晨曦,吴柔芬,王文俊,杨轩. 植物纳米纤维素材料制备的研究进展. 中国科学:化学. 2025(01): 242-257 .  百度学术
百度学术
2. 席越阳,余秋雨,蒙志明,刘莹,朱迎春. 金针菇纳米纤维素复合凝胶的制备及结构表征. 肉类研究. 2024(02): 1-8 .  百度学术
百度学术
3. 吴奇,户昕娜,卢舒瑜,崔然然,马涛,宋弋. 纤维素纳米纤维复合膜的制备及其作为食品包装材料的优异性能研究进展. 食品工业科技. 2024(17): 436-444 .  本站查看
本站查看
4. 肖梦兰,彭钟海,谢冰和,黎惠红. 聚乳酸材料的阻气性能研究进展. 食品安全质量检测学报. 2024(24): 153-160 .  百度学术
百度学术
其他类型引用(6)





 下载:
下载:

 下载:
下载:
