Process Optimization and Flavor Substance Analysis of Probiotic Fermented Apple Juice
-
摘要: 为开发营养健康且果香浓郁的益生菌发酵苹果汁。以高酸苹果与鲜食苹果1:1混合苹果汁为原料,采用植物乳杆菌和嗜热链球菌发酵苹果汁并对其发酵工艺进行优化,并利用气相色谱-离子迁移光谱(Gas Chromatography-Ion Mobility Spectrometry,GC-IMS)及电子鼻技术对发酵苹果汁的香气成分进行比较分析。结果表明,最佳发酵工艺为发酵时间27.0 h、发酵温度30.0 ℃、初始糖度15.0ºBx,在此条件下,发酵苹果汁中的活菌数为7.2×108 CFU/mL,感官评分92.13分。与未发酵苹果汁相比,发酵苹果汁多酚、黄酮含量显著升高(P<0.05),还原糖和乳酸含量显著下降(P<0.05)。样品中GC-IMS共鉴定出35种挥发性成分,包括酯类6种,醛酮类11种,酸类6种,醇类3种,吡嗪类3种以及其他类6种,其发酵与未发酵苹果汁共有成分有11种,包括2-甲基丁酸乙酯、3,7-二甲基-2-亚甲-6-辛烯醛、2-庚酮、2-环己烯-1-酮、甲基异丁基甲酮、3-己酮、左旋香芹酮、正戊酸、2,3-二甲基-5-乙基吡嗪、乙二醇乙醚、2,2,4,6,6-五甲基庚烷。发酵苹果汁中的酯类、醛酮类和其他类香气物质的种类和含量均高于未发酵苹果汁(P<0.05),赋予了发酵苹果汁更浓郁的花香和果香。电子鼻分析中发酵苹果汁在各个传感器上的响应值均高于未发酵苹果汁,说明益生菌能够增加苹果汁中芳香类挥发性风味物质的含量。Abstract: To develop a probiotic fermented apple juice that was nutritious and rich in fruit aroma. A blend of high-acid and fresh-eating apples in a 1:1 ratio was used as the raw material. Lactobacillus plantarum and Streptococcus thermophilus were employed for the fermentation process, which was optimized for best results. Gas chromatography-ion mobility spectrometry (GC-IMS) and electronic nose were employed to analyze and compared the aroma components of the fermented apple juice. Results indicated that the optimal fermentation conditions were determined as follows: 27 h of fermentation time, a fermentation temperature of 30.0 ℃, and an initial sugar content of 15.0ºBx. Under these conditions, the fermented apple juice exhibited a viable cell count of 7.2×108 CFU/mL and received a sensory score of 92.13 points. Compared to the unfermented apple juice, the fermented counterpart exhibited a significant increase in polyphenol and flavonoid content (P<0.05), while the levels of reducing sugars and lactic acid decreased significantly (P<0.05). A total of 35 volatile components were identified through GC-IMS analysis, including 6 esters, 11 aldehydes and ketones, 6 acids, 3 alcohols, 3 pyrazines, and 6 other compounds. Eleven of these components were common to both fermented and unfermented apple juices, including ethyl 2-methylbutanoate, 3,7-dimethyl-2-methylen-6-octenal, 2-heptanone, 2-cyclohexen-1-one, methyl isobutyl ketone, 3-hexanone, L(-)-carvone, pentanoic acid, 2,3-dimethyl-5-ethyl pyrazine, ethylene glycol ethyl ether, and 2,2,4,6,6-pentamethylheptane. The fermented apple juice exhibited higher levels of esters, aldehydes and ketones, and other aroma compounds compared to the unfermented counterpart (P<0.05), contributing to its enhanced floral and fruity aroma profile. Electronic nose analysis demonstrated higher response values for the fermented apple juice across all sensors compared to the unfermented counterpart, indicating that probiotics could increase the content of aromatic volatile flavor substances in apple juice.
-
苹果(Malus domestica)为蔷薇科苹果属植物果实,在全国地区广泛种植,苹果中不仅富含抗氧化化合物、碳水化合物和膳食纤维,还含有丰富的矿质元素[1−2],是各年龄段人群喜爱的水果之一[3]。果蔬汁作为一种营养丰富的饮料在果蔬加工产品中占据市场主流,然而,果蔬汁中的某些酶和化学物质可能对消化道产生不良影响,益生菌不仅可以改善这种不良影响,还具有降低胆固醇水平、增强免疫力等功效[4]。已有研究表明,苹果汁可作为益生菌发酵的良好载体[5]。因此,利用益生菌发酵苹果汁不仅促进苹果产业的发展,还提高了苹果的附加值和经济价值[6]。
近年来,果蔬深加工技术的进步为益生菌在果蔬汁发酵中的应用提供了更多可能性,相关的研究报道也频繁出现,如Hashemi等[7]研究发现利用甜柠檬汁进行发酵可以提高其抗氧化、抗菌等化学性能,并可作为非乳类功能性食品,Alves等[8]以麦芽糖糊精为干燥剂,低进料流量的喷床干燥制得的益生菌橙汁粉,成为新的益生菌食品生产的一个很好的选择。通过益生菌发酵,果蔬制品的风味得以改善,其医疗保健作用也得到了增强,此外,这一技术的应用还极大地丰富了果蔬制品的种类,为消费者提供了更多元化的选择[9]。Zahra等[10]采用嗜酸乳杆菌b103发酵橙汁使产品具有更好的生物活性和高益生菌活力,张桂芝等[11]成功地利用乳酸菌发酵研制出新型火龙果复合发酵果蔬汁饮料,黄杰等[12]利用植物乳杆菌和发酵乳杆菌对香蕉胡萝卜复合果蔬汁进行发酵,并确定了最佳的发酵工艺条件。这些研究不仅展示了果蔬深加工技术的潜力,也为消费者带来了更多健康美味的食品选择。研究结果表明,与未发酵的样品相比,经过益生菌发酵的果蔬汁中多酚和黄酮的质量浓度显著升高(P<0.05),这些样品对DPPH自由基、·OH和ABTS+阳离子自由基的清除能力也得到了增强,尤其是在模拟胃消化阶段更为明显。然而,目前益生菌发酵果蔬汁的研究主要集中在理化指标的分析以及工艺条件优化上,但关于混合益生菌发酵果蔬汁对果蔬汁本身香气成分影响的研究仍然相对较少,不同益生菌发酵果蔬汁的香气成分间存在较明显的差异,因此,研究不同的单菌、复合菌以及调节复合菌种的比例对益生菌发酵果蔬汁的风味特征及健康功能具有重要的指导意义。
本研究以高酸苹果与鲜食苹果1:1混合苹果汁为原料,采用植物乳杆菌和嗜热链球菌发酵苹果汁并对其发酵工艺进行优化,并利用气相色谱-离子迁移光谱(Gas Chromatography-Ion Mobility Spectrometry,GC-IMS)及电子鼻技术对发酵苹果汁的香气成分进行比较分析。探究混合菌种发酵益生菌苹果汁香气的变化,旨在为开发营养健康、香气典型的益生菌发酵苹果汁提供参考,也为苹果产业提供理论基础。
1. 材料与方法
1.1 材料与仪器
高酸苹果、鲜食苹果 高酸苹果品种为宁夏中卫市红日苹果,鲜食苹果品种为宁夏中卫市红富士苹果,选取果实大小均匀、果肉饱满、无病虫害机械损伤的苹果;植物乳杆菌、嗜热链球菌 生合生物科技(扬州)有限公司;MRS琼脂培养基 青岛高科技工业园海博生物技术有限公司;芦丁标准品、没食子酸标准品 美国CATO公司;氢氧化钠(分析纯)、硝酸铝(分析纯)、福林酚、抗坏血酸(分析纯) 国药集团化学试剂有限公司;亚硝酸钠(分析纯)、无水乙醇(分析纯) 南京化学试剂股份有限公司;碳酸钠(分析纯) 天津市光复科技发展有限公司;果胶酶(30000 U/mL) 宁夏夏盛实业集团有限公司。
Flavour Spec®风味分析仪 德国G.A.S公司;cTongue电子鼻 上海保圣公司;LHS-250SC恒温恒湿箱、HWS-26型电热恒温水浴锅 上海一恒科学仪器有限公司;722N可见分光光度计 上海仪电分析仪器有限公司;SX-500型高压蒸汽灭菌锅 70 MYKOGYO有限公司;SW-CJ/2480型超净工作台 苏州安泰空气技术有限公司;AL104型电子天平 梅特勒-托利多公司;PH630便携式pH计 上海任氏电子有限公司;PAL-BXI ACID5型糖酸度计 日本ATAGO公司。
1.2 实验方法
1.2.1 益生菌发酵苹果汁的制备流程
苹果→清洗→破碎→酶解→榨汁→护色→过滤→高酸苹果与富士苹果1:1混合→成分调整→巴氏灭菌→冷却→接种→发酵→灌装→益生菌苹果汁。
1.2.2 操作要点
果实在室温下自然后熟,可溶性固形物含量(Soluble Solids Content,SSC)为15.0%左右。自来水清洗、沥水后打浆榨汁,果浆中加入0.04 g/kg果胶酶,40 ℃酶解2 h,添加0.08%抗坏血酸护色[13];用200目尼龙纱布过滤酶解果浆得到苹果汁,加蔗糖调节SSC为15.0%,于75 ℃杀菌10 min;果汁冷却后在无菌操作台上按照108 CFU/mL接种量加入植物乳杆菌和嗜热链球菌1:1复合菌种,30 ℃发酵27 h,得益生菌发酵苹果汁。
1.2.3 益生菌发酵苹果汁单因素实验
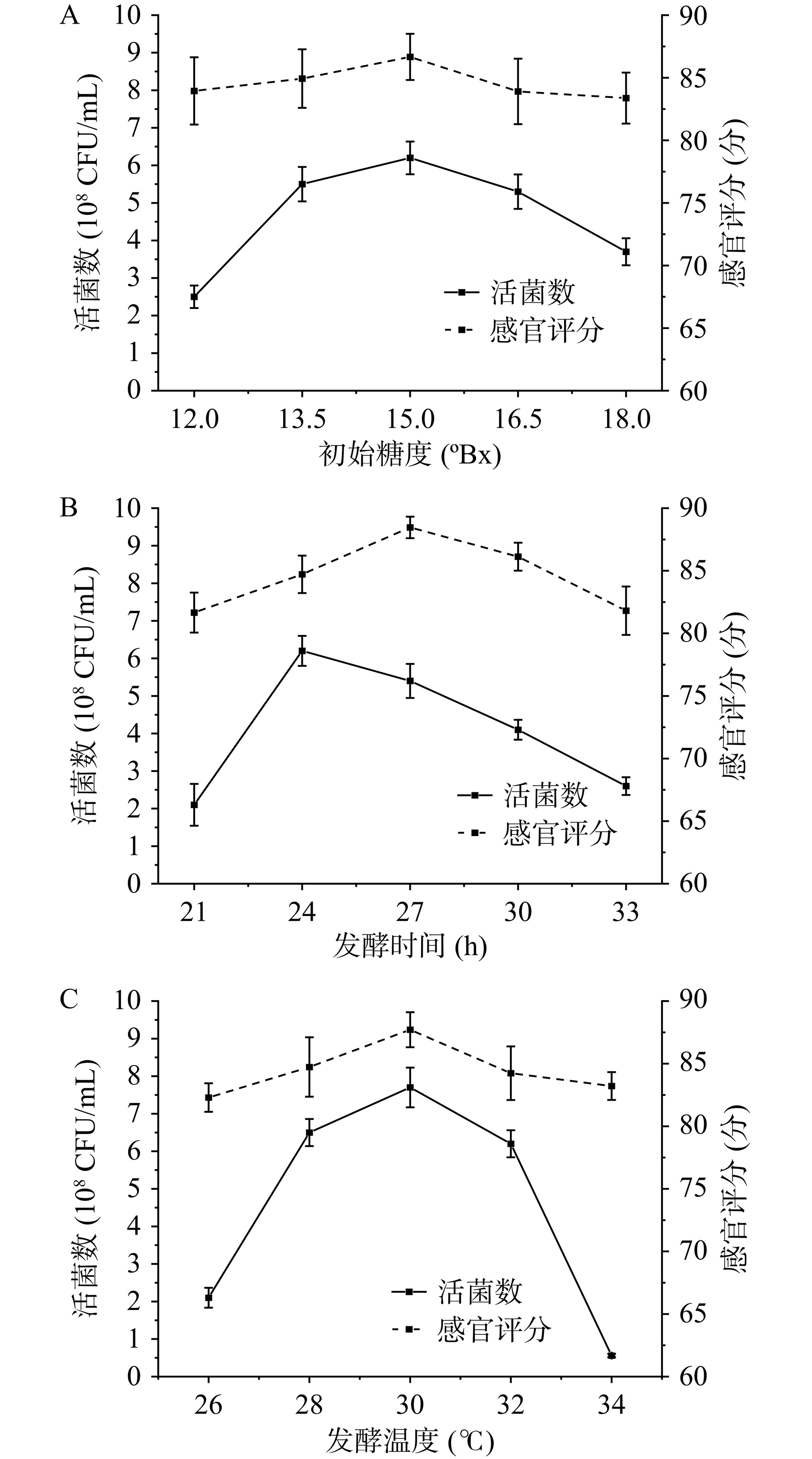
固定发酵时间24.0 h、初始糖度15.0ºBx,考察不同发酵温度(26.0、28.0、30.0、32.0和34.0 ℃)对发酵苹果汁品质的影响;固定发酵温度30.0 ℃、初始糖度15.0ºBx,考察不同发酵时间(21.0、24.0、27.0、30.0和33.0 h)对发酵苹果汁品质的影响;固定发酵时间24.0 h、发酵温度30.0 ℃,考察不同初始糖度(12.0ºBx、13.5.0ºBx、15.0ºBx、16.5.0ºBx和18.0ºBx)对发酵苹果汁品质的影响。以发酵苹果汁的活菌数和感官评分为评价指标。
1.2.4 响应面优化试验
在单因素实验基础上,将感官评分和活菌数作为响应值,确定发酵时间、发酵温度和初始糖度3个因素为自变量,运用Design-Expert 13进行三因素三水平试验设计,试验因素及水平见表1,实验重复3次[14−16]。
表 1 响应面试验因素与水平Table 1. Factors and levels of response surface tests水平 因素 A初始糖度(ºBx) B发酵时间(h) C发酵温度(℃) −1 13.5 24 28 0 15 27 30 1 16.5 30 32 1.2.5 指标测定
还原糖测定:还原糖的测定采用DNS试剂盒(3,5-二硝基水杨酸溶液)的测定方法;乳酸测定:参照GB 12456-2021《食品中总酸的测定》[17]的方法测定乳酸含量;多酚测定:参照李俶等[18]的福林酚法测定多酚含量;黄酮测定:参照王华等[19]的硝酸铝-亚硝酸钠比色法测定总黄酮含量;活菌数:参照GB 4789.2-2022《食品安全国家标准 食品微生物学检验 菌落总数测定》[20]的方法测定菌落总数。
1.2.6 GC-IMS分析
样品预处理:称3 mL样品置于20 mL顶空瓶。在常温下经顶空进样,并采用气相色谱-离子迁移谱仪进行测定,每个样品重复测定3次。
GC条件:MXT-5气相色谱柱(15 m×0.53 mm×1 μm),柱温为40 ℃;载气为99.99%的纯氮气,载气流量系统初始流量为2 mL/min,保持2 min,15 mL/min保持10 min,流量增加到100 mL/min保持20 min,20 min流量增加到150 mL/min。IMS条件:IMS温度为45 ℃,E1漂移气流速为150 mL/min,漂移气为99.99%的纯氮气。
1.2.7 电子鼻和感官评定分析
采用电子鼻测定样品的挥发性气味,量取5 mL苹果汁样品置于30 mL样品瓶中,加盖密封,室温富集30 min后进行测试。电子鼻参数设置:检测时间60 s,清洗时间120 s,进样流量和载气流速均为1 L/min。
感官评定:随机请具有食品感官评价课程背景的15位老师和学生组成感官评定小组进行无记名打分,分别从组织状态、色泽、香气、口感对发酵苹果汁进行综合评价。取平均值作评分结果,总分为100分。感官评分标准如表2所示。
表 2 感官评价标准Table 2. Sensory evaluation criteria因素 评语 分数 色泽
(25分)呈金黄色,色泽透明,有光泽 15~25 呈暗黄色,色泽较暗,略有光泽 9~14 色泽暗淡,无光泽 0~8 组织状态
(25分)果汁澄清,无沉淀,无杂质 15~25 果汁略微浑浊,少许沉淀或杂质 9~14 果汁浑浊,有沉淀和杂质 0~8 香气
(25分)具有典型苹果香气,柔和清爽,无外来香气 15~25 苹果香味较淡,略有外来香气 9~14 香味淡,刺激性气味较重,有外来香气 0~8 口感
(25分)口感柔和,酸甜适中,苹果风味突出,无异味 15~25 口感一般,酸味较重,略有刺激感,稍有异味 9~14 口感粗糙、寡淡,刺激感明显,较难接受 0~8 1.3 数据处理
所有指标进行平行实验3次。采用Excel 2022和Origin 2021进行数据统计分析(ANOVA)和图形绘制,Design-Expert 13进行Box-Behnken分析,风味分析仪配套的分析软件VOCal用于分析谱图和数据的定性定量,应用软件内置的数据库和IMS数据库可对物质进行定性分析。
2. 结果与分析
2.1 苹果汁发酵工艺优化单因素实验结果
将高酸苹果和鲜食苹果直接榨汁后1:1混合,按照108 CFU/mL的接种量加入植物乳杆菌和嗜热链球菌复合菌种进行发酵。各个单因素对于发酵苹果汁感官评分和活菌数的影响如图1所示。由图1A可知,随着初始糖度的增加,感官评分和活菌数在15.0ºBx时达到最大值,随后开始呈下降趋势,这是因为当糖度过大时,不仅影响发酵苹果汁的口感,菌种也不适应在高糖的环境中生存,因此确定初始糖度的最佳取值范围在13.5ºBx~16.5ºBx;由图1B可知,发酵时间为27.0 h时,感官评分最佳,活菌数在24.0 h时达到最大值,菌种适应新环境后,开始快速生长繁殖并积累代谢产物,但随着时间的延长,营养物质被消耗殆尽,生存条件已不适应菌种生长,故菌种生长受到抑制,因此发酵时间选择为24.0~30.0 h;由图1C可知,发酵温度的感官评分和活菌数都呈先上升后下降的趋势,并在发酵温度30.0 ℃时达到最大值,这是因为温度升高,不适宜菌种生长繁殖,故积累代谢产物减少,进而感官评分降低。因此确定发酵温度的范围在28.0~32.0 ℃。
2.2 响应面法优化苹果汁发酵工艺
2.2.1 响应面试验设计及结果
根据以上单因素实验结果,进行响应面试验设计,结果如表3。
表 3 响应面试验设计及结果Table 3. Response surface test design and results试验号 A初始
糖度B发酵
时间C发酵
温度R1感官
评分(分)R2活菌数
(×108 CFU/mL)1 −1 0 −1 87.32 2.00 2 −1 0 1 88.14 2.30 3 −1 −1 0 84.53 2.10 4 −1 1 0 86.08 0.74 5 0 1 1 84.87 3.80 6 0 0 0 90.92 6.80 7 0 0 0 91.48 6.80 8 0 −1 1 84.24 3.00 9 0 0 0 91.62 6.70 10 0 0 0 91.74 7.60 11 0 0 0 92.12 7.30 12 0 −1 −1 84.73 4.80 13 0 1 −1 85.42 3.50 14 1 0 1 87.34 5.20 15 1 −1 0 84.31 4.20 16 1 1 0 85.10 5.50 17 1 0 −1 87.57 6.40 2.2.2 模型建立及显著性分析
运用Design-Expert 13软件对益生菌发酵苹果汁的感官评分和活菌数试验结果进行方差分析,得到的二次多项式回归方程为:R1=91.58−0.2075×A+0.4575×B−0.0450×C−0.1900×A×B−0.2850×A×C−0.015×B×C−1.91×A2−4.66×B2−2.10×C2;R2 = 7.04 + 1.65 × A − 0.0700 × B −0.1750×C+0.6650×A×B−0.1250×A×C+0.5250×B×C−1.98×A2−1.93×B2−1.34×C2。回归模型方差分析结果见表4、表5。
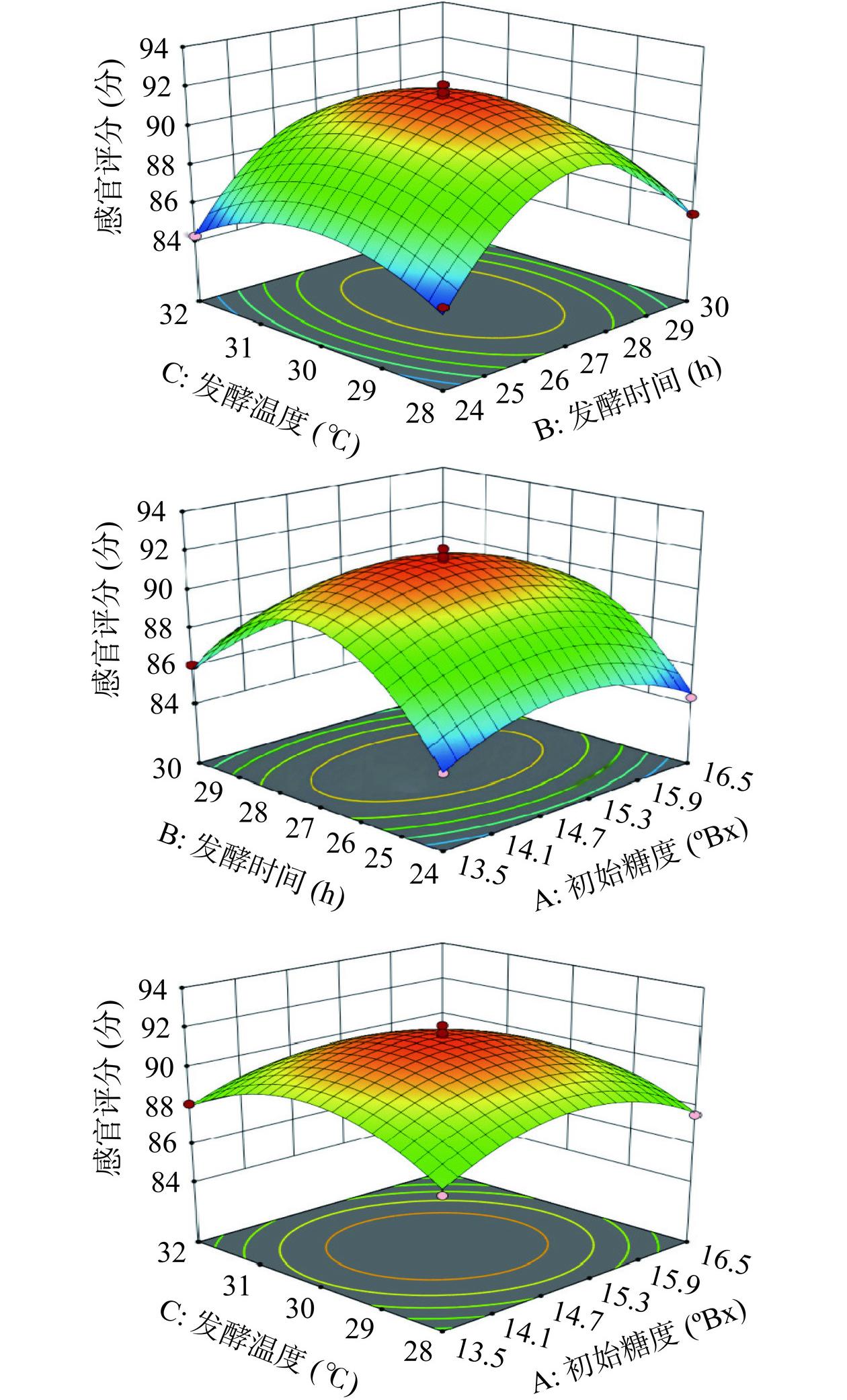
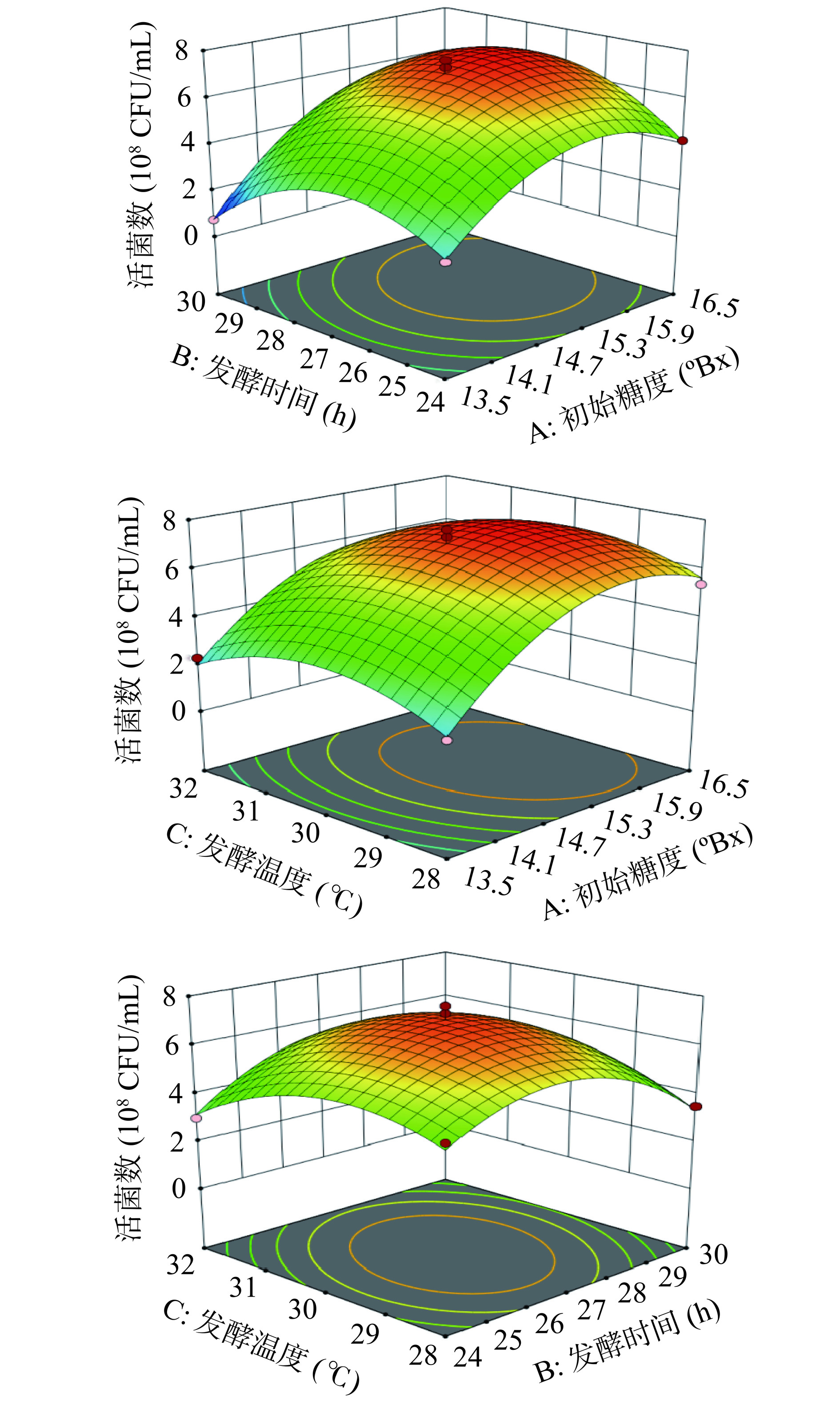
表 4 感官评分回归模型方差分析Table 4. Sensory score regression model ANOVA方差来源 平方和 自由度 均方 F值 P值 模型 139.33 9 15.48 119.64 <0.0001** A初始糖度 0.3445 1 0.3445 4.24 0.2205 B发酵时间 1.67 1 1.67 20.62 0.0209* C发酵温度 0.0162 1 0.0162 0.1995 0.7790 AB 0.1444 1 0.1444 1.78 0.4127 AC 0.3249 1 0.3249 4.00 0.2327 BC 0.0009 1 0.0009 0.0111 0.9471 A2 15.33 1 15.33 72.21 <0.0001** B2 91.55 1 91.55 803.06 <0.0001** C2 18.53 1 18.53 97.34 <0.0001** 残差 1.33 7 0.1904 失拟方差 0.5683 3 0.1894 0.9914 0.4819 误差 0.7643 4 0.1911 总变异 140.66 16 R2 0.9905 R2Adj 0.9783 注:*表示显著(P<0.05),**表示极显著(P<0.01);表5同。 表 5 活菌数回归模型方差分析Table 5. Number of viable bacteria regression model ANOVA方差来源 平方和 自由度 均方 F值 P值 模型 68.99 9 7.67 53.91 <0.0001** A初始糖度 21.65 1 21.65 152.24 <0.0001** B发酵时间 0.0392 1 0.0392 0.2757 0.6158 C发酵温度 0.2450 1 0.2450 1.72 0.2307 AB 1.77 1 1.77 12.44 0.0096** AC 0.0625 1 0.0625 0.4395 0.5286 BC 1.10 1 1.10 7.75 0.0271* A2 16.47 1 16.47 115.79 <0.0001** B2 15.64 1 15.64 110.01 0.0001** C2 7.53 1 7.53 52.97 0.0002** 残差 0.9954 7 0.1422 失拟方差 0.3834 3 0.1278 0.8353 0.5405 误差 0.6120 4 0.1530 总变异 69.99 16 R2 0.9858 R2Adj 0.9675 如表4和表5所示,所有模型均达到极显著,根据P值以及F值对各因素的影响显著性分析,结果为各因素对感官评分和活菌数影响显著。R1、R2模型的R2分别为0.9905、0.9858,失拟项P值分别为0.4819、0.5405(>0.05),R2值接近1,模型的失拟项均不显著,说明方程的拟合度较好。其中R1的B显著,说明发酵时间对益生菌发酵苹果汁的感官评分影响较大。R2的A、AB达到极显著,BC显著,说明初始糖度、初始糖度和发酵时间的交互作用以及发酵时间和发酵温度的交互作用对益生菌发酵苹果汁的活菌数影响较大。由F值可知,三个因素对发酵苹果汁感官评分的影响顺序为:B>A>C,即发酵时间>初始糖度>发酵温度。三个因素对活菌数的影响顺序为:A>C>B,即初始糖度>发酵温度>初始糖度。
2.2.3 响应面三维模型分析
运用Design-Expert 13软件做出各因素之间交互作用对发酵苹果汁感官评分和活菌数影响的等高线及响应曲面图,见图2、图3。响应曲面图在水平方向落下的投影是等高线,等高线若呈椭圆形,表示这两因素有极为显著的交互作用,呈圆形则表示不显著[21]。并且各因素响应曲面坡度的陡峭程度反映该因素对发酵苹果汁感官评分和活菌数的影响程度,越陡峭,说明影响越大[22]。
由图2可知,通过响应面图分析可以得到两个因素交互作用的程度大小,三个因素之间的交互作用对益生菌发酵苹果汁感官评分作用不显著。由图3可知,AB与BC交互的图更接近椭圆形,因此初始糖度和发酵时间以及发酵时间和发酵温度之间的交互对益生菌发酵苹果汁活菌数作用显著(P<0.05)。
2.2.4 最优条件预测及验证
以高酸苹果和富士苹果1:1混合苹果汁为原料,采用植物乳杆菌和嗜热链球菌1:1复合菌种发酵苹果汁,以感官评分和活菌数为评价指标进行工艺优化,并通过Design-Expert 13软件对实验数据进行优化预测,得到益生菌发酵苹果汁的最佳工艺配方为初始糖度15.31ºBx,发酵时间27.11 h,发酵温度29.91 ℃,该工艺条件下益生菌发酵苹果汁的感官评分预测值为91.46分,活菌数预测值为7.30×108 CFU/mL。结合实际操作,选取初始糖度15.0ºBx,发酵时间27.0 h,发酵温度30.0 ℃,测得益生菌发酵苹果汁的感官评分为92.13分,活菌数为7.2×108 CFU/mL与模型预测值较为接近,说明该模型可用于益生菌发酵苹果汁的工艺优化。
2.3 工艺优化后苹果汁的理化指标测定结果
如表6所示,发酵苹果汁与未发酵苹果汁相比,活菌数为7.2×108 CFU/mL,多酚含量显著升高了5.36%(P<0.05),黄酮含量极显著升高了21.05%(P<0.01),发酵苹果汁的多酚含量是未发酵苹果汁的1.05倍;黄酮含量是未发酵苹果汁的1.21倍。还原糖和乳酸含量分别极显著下降了14.43%、44.12%(P<0.01),还原糖含量降低是因为在发酵过程中菌种适应新的营养条件后,迅速生长繁殖,消耗大量的糖类,产生氨基酸、短链脂肪酸等优良产物;然而,还原糖含量的降低并没有观察到乳酸含量的升高,可能是因为苹果汁是高酸苹果汁和富士苹果汁的混合汁,高酸苹果汁具有较高的酸度,从而导致未发酵苹果汁的乳酸含量较高;另外可能是因为在转化成乳酸的代谢途径中,不具有适当的转运机制或者酶的活性不好均可能影响乳酸的转化含量[23−24]。而且植物乳杆菌和嗜热链球菌混合菌种是一种温和产酸的发酵剂,植物乳杆菌和嗜热链球菌产生的协同作用可能会调节发酵苹果汁的糖酸度,从而改善苹果汁的风味口感。
表 6 理化指标检测结果Table 6. Results of physical and chemical index tests样品 活菌数(×108 CFU/mL) 还原糖(%) 乳酸(g/L) 多酚(mg/mL) 黄酮(mg/mL) 未发酵苹果汁 − 26.13±0.64 0.34±0.03 0.56±0.01 0.57±0.01 发酵苹果汁 7.2±0.62 22.36±0.39** 0.19±0.03** 0.59±0.01* 0.69±0.01** 注:*代表差异显著(P<0.05),**代表差异极显著(P<0.01)。 2.4 工艺优化后苹果汁的香气成分分析
2.4.1 发酵与未发酵苹果汁的挥发性风味物质GC-IMS图谱分析
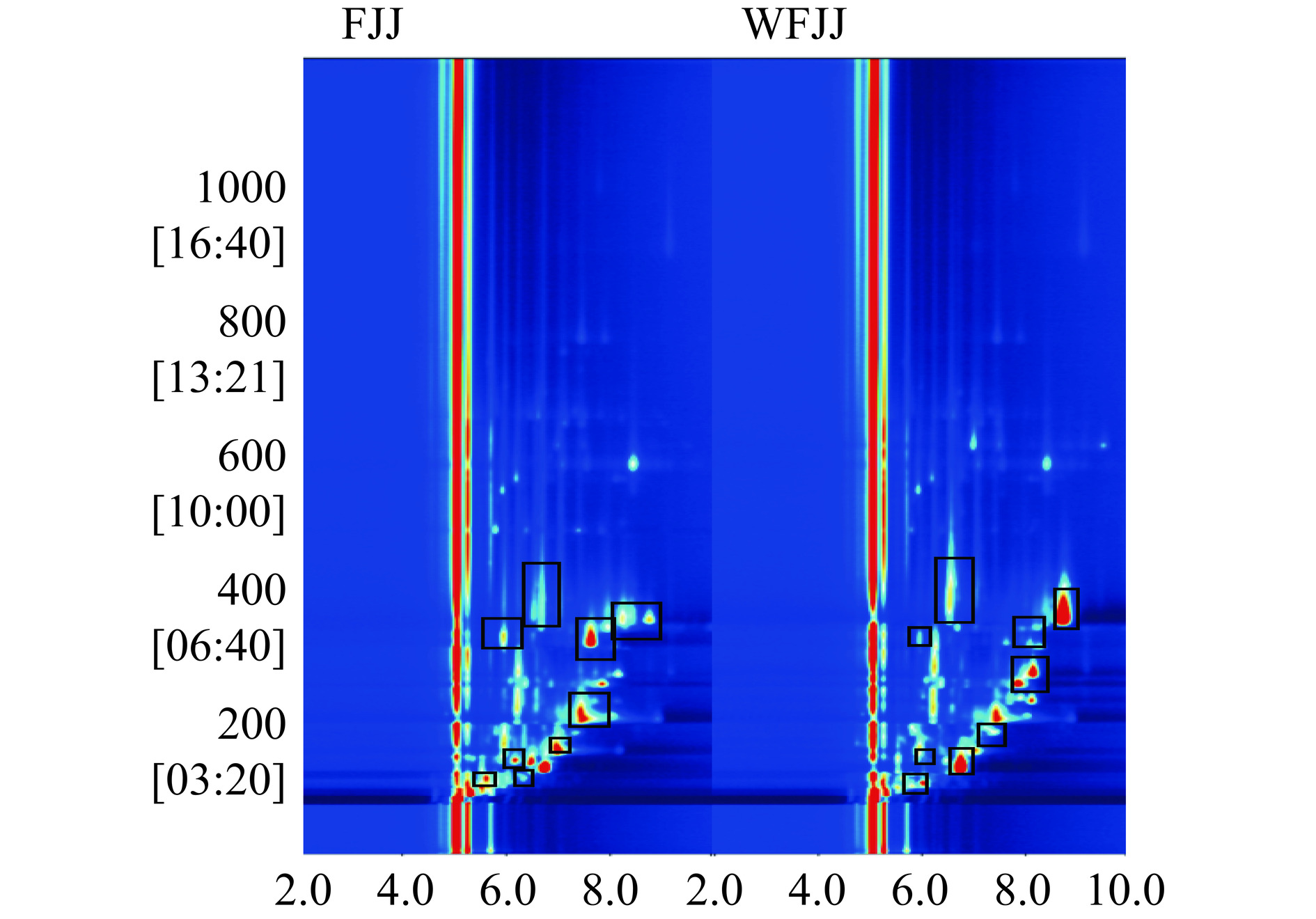
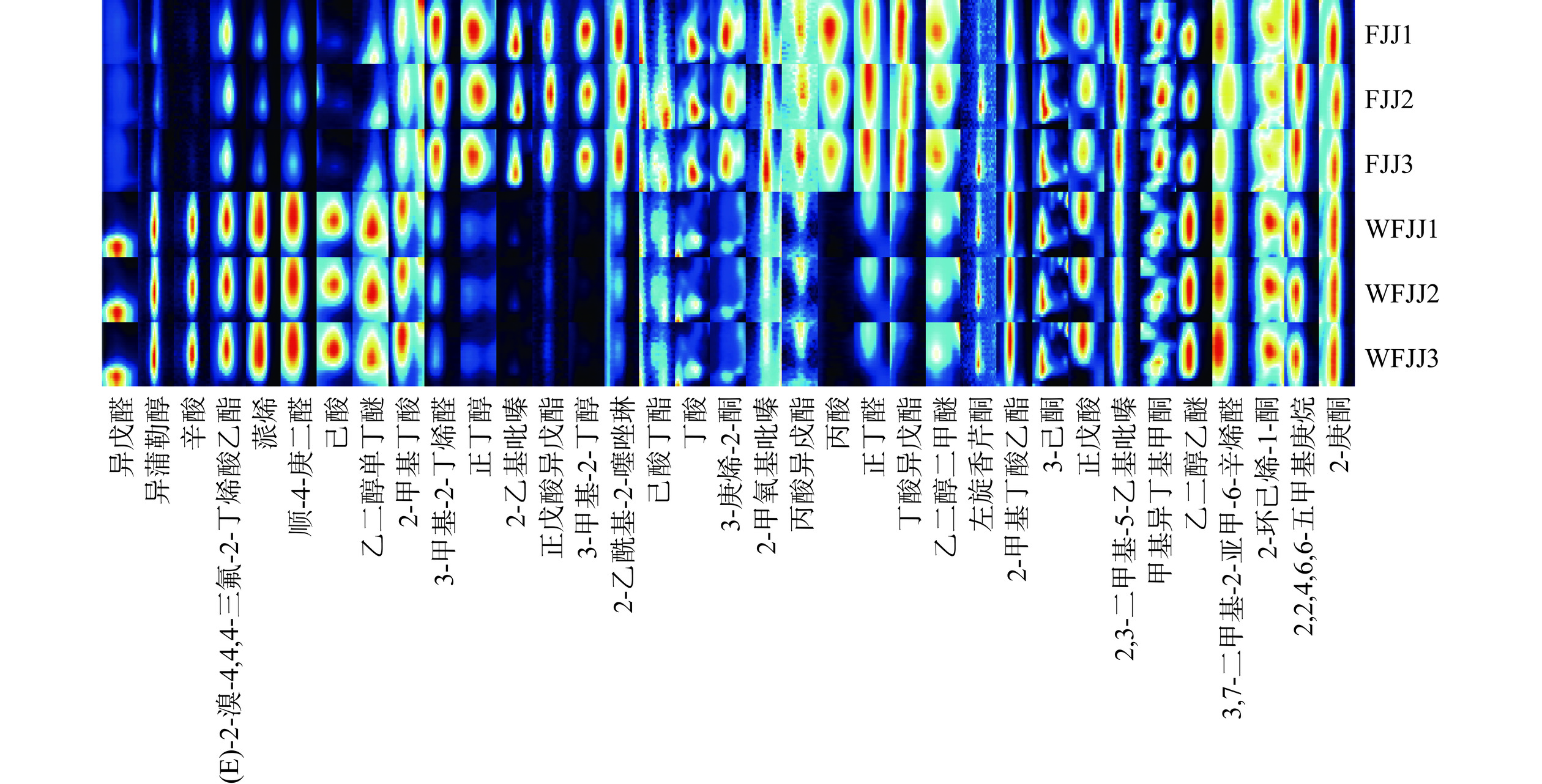
发酵与未发酵苹果汁的挥发性风味物质的气相色谱-离子迁移谱见图4。横坐标1.0处红色竖线为反应离子峰(Reactive Ion Peak,RIP),RIP峰两侧的每一个点代表一种挥发性有机物。颜色代表物质的浓度,白色表示浓度较低,红色表示浓度较高,颜色越深表示浓度越大[25]。由图4可知,样品中挥发性有机物成分在1200 s完成GC分离,在2 ms内完成IMS分离。大部分化合物能够在前800 s内出峰并有较好分离度。发酵与未发酵苹果汁检测到的挥发性有机物种类大致相同,但各物质在含量上有所区别。
2.4.2 发酵与未发酵苹果汁的挥发性风味物质分析
通过GC-IMS检测出的挥发性风味物质检测结果见表7。由表7可知,样品中共检出35种挥发性成分,可分为6类,包括酯类6种,醛酮类11种,酸类6种,醇类3种,吡嗪类3种以及其他类6种,其共有成分有11种。为了进一步比较发酵苹果汁和未发酵苹果汁中挥发性风味成分之间的差异,挥发性风味物质指纹图谱见图5。
表 7 GC-IMS鉴定出的挥发性风味物质Table 7. Volatile flavor substances identified by GC-IMS种类 化合物 分子量(Da) 迁移时间(ms) 保留时间(s) 保留指数 酯类 正戊酸异戊酯 172.3 486.2 1.4707 1063.1 (E)-2-溴-4,4,4-三氟-2-丁烯酸乙酯 114.1 253.0 1.5580 897.6 2-甲基丁酸乙酯 130.2 271.2 1.2371 915.7 己酸丁酯 172.3 666.6 1.4620 1140.2 丙酸异戊酯 144.2 271.3 1.8270 915.7 丁酸异戊酯 158.2 584.4 1.4031 1108.1 醛酮类 顺-4-庚二醛 112.2 912.9 268.4 912.9 异戊醛 86.1 656.7 114.4 656.7 3-甲基-2-丁烯醛 84.1 738.4 143.6 738.4 正丁醛 72.1 653.0 113.5 653.0 3,7-二甲基-2-亚甲-6-辛烯醛 140.2 547.5 1.1792 1092.1 3-庚烯-2-酮 172.3 351.1 1.6362 1063.1 2-庚酮 114.1 255.3 1.2602 897.6 3-己酮 130.2 203.8 1.4715 915.7 甲基异丁基甲酮 100.2 156.6 1.1795 765.3 2-环己烯-1-酮 96.1 207.1 1.4053 843.4 左旋香芹酮 150.2 923.9 1.8196 1220.0 酸类 正戊酸 102.1 198.3 1.2303 831.7 丁酸 88.1 154.4 1.3865 760.9 丙酸 74.1 114.5 1.2628 657.2 2-甲基丁酸 102.1 260.4 1.2120 905.1 辛酸 144.2 617.1 1.8863 1121.4 己酸 116.2 311.1 1.6493 951.3
醇类异蒲勒醇 154.3 616.1 1.3889 1121.0 正丁醇 74.1 101.3 1.1846 598.8 3-甲基-2-丁醇 88.1 139.5 1.2363 729.3
吡嗪类2,3-二甲基-5-乙基吡嗪 136.2 565.0 1.2244 1099.8 2-乙基吡嗪 108.1 317.3 1.5150 956.5 2-甲氧基吡嗪 110.1 279.5 1.4654 923.5 其他类 乙二醇乙醚 90.1 128.1 1.3364 702.8 乙二醇二甲醚 90.1 124.1 1.2931 692.9 乙二醇单丁醚 118.2 317.3 1.6023 956.5 2,2,4,6,6-五甲基庚烷 170.3 340.7 1.3253 974.9 蒎烯 136.2 350.6 1.7359 982.4 2-乙酰基-2-噻唑啉 129.2 487.5 1.1544 1063.8 酯类是苹果汁中存在最广泛和最重要的化合物,这也是赋予了发酵苹果汁更加丰富的口感、香气与滋味的原因。在发酵苹果汁和未发酵苹果汁中,分别检测出酯类物质5、2种,发酵苹果汁产生了己酸丁酯、丙酸异戊酯、丁酸异戊酯以及正戊酸异戊酯4种特征酯类物质。丁酸异戊酯具有强烈的香蕉、洋梨芳香气味[26],正戊酸异戊酯具有独特的青香和果香,己酸丁酯具有菠萝和葡萄酒似香气[27]。2-甲基丁酸乙酯是两者共有的酯类物质,未发酵果汁的含量高于发酵苹果汁(P<0.05),可能是因为益生菌发酵后产生更多的特征风味物质,2-甲基丁酸乙酯对发酵后苹果汁的风味影响较小。
醛酮类化合物同样是苹果汁中重要挥发性物质之一[28],在发酵苹果汁和未发酵苹果汁中,分别检测出醛酮类物质10和8种。3-庚烯-2-酮、3-甲基-2-丁烯醛以及正丁醛是发酵苹果汁产生的特征醛酮类物质,3-庚烯-2-酮具有强烈的青草气味,3-甲基-2-丁烯醛具有甜果香,正丁醛具有特殊的清香味[29],这些醛酮类物质为发酵苹果汁增添了香气。醛酮类化合物通常具有特殊的香气,与酸类化合物对总体香气起到协调、融合的作用[30]。
有机酸类物质不仅是苹果汁重要的呈香呈味物质,也是形成酯类的前体物质,可用作调合苹果香、菠萝香、梨香、草莓香等果味。在发酵苹果汁和未发酵苹果汁中,分别检测出酸类物质3、4种。发酵苹果汁产生了丁酸和丙酸2种特征酸类物质,丁酸和丙酸均是短链脂肪酸的主要成员,丁酸盐离子以及类似的丁酸离子不仅可以增强人类和许多其他动物物种的肠道健康[31],还可以与醇脱水生成具有愉快的水果香味的酯类;丙酸不仅赋予苹果汁天然酸味,还能延长保存时间。两种酸类物质在发酵苹果汁中含量很高,因此可以调和苹果汁的口感,使发酵苹果汁醇和爽口,起到助香的作用[32]。
醇类化合物由糖代谢、氨基酸脱氢脱羧等作用产生,也是酯类化合物的前体物质[33]。张璐等[34]研究表明醇类物质是混合菌种发酵猕猴桃汁产生的特征香气物质,赋予了猕猴桃发酵汁醇厚的风味和独特复杂的香气。在本研究中,分别检测出醇类物质2和1种,且发酵苹果汁含量高于未发酵苹果汁(P<0.05)。正丁醇和3-甲基-2-丁醇是发酵苹果汁产生的特征醇类物质,具有醇类特有的气味和辛辣的味道,但醇类可与酸类物质反应生成酯类,赋予其独特复杂的香气。
吡嗪类物质对苹果汁的风味具有一定的影响,主要来自发酵苹果汁的微生物代谢途径[35]。在发酵苹果汁和未发酵苹果汁中,分别检测出吡嗪类物质3和1种,且发酵苹果汁含量高于未发酵苹果汁(P<0.05)。2-乙基吡嗪和2-甲氧基吡嗪是发酵苹果汁产生的特征香气物质,2-乙基吡嗪具有坚果香、木香、烤香、可可香等气味,2-甲氧基吡嗪具有特殊的芳香味,吡嗪类物质的融合使发酵苹果汁味道更加复杂醇厚,令消费者喜爱。
除了常见的酯类、醛酮类、酸类、醇类、吡嗪类等香气成分,苹果汁也会产生一些其他类的挥发性物质,醚类、烯烃类、烷烃类等。这些物质具有的特殊香味融合在苹果汁中,也会为发酵苹果汁做出贡献[34]。
2.4.3 发酵与未发酵苹果汁的电子鼻差异分析
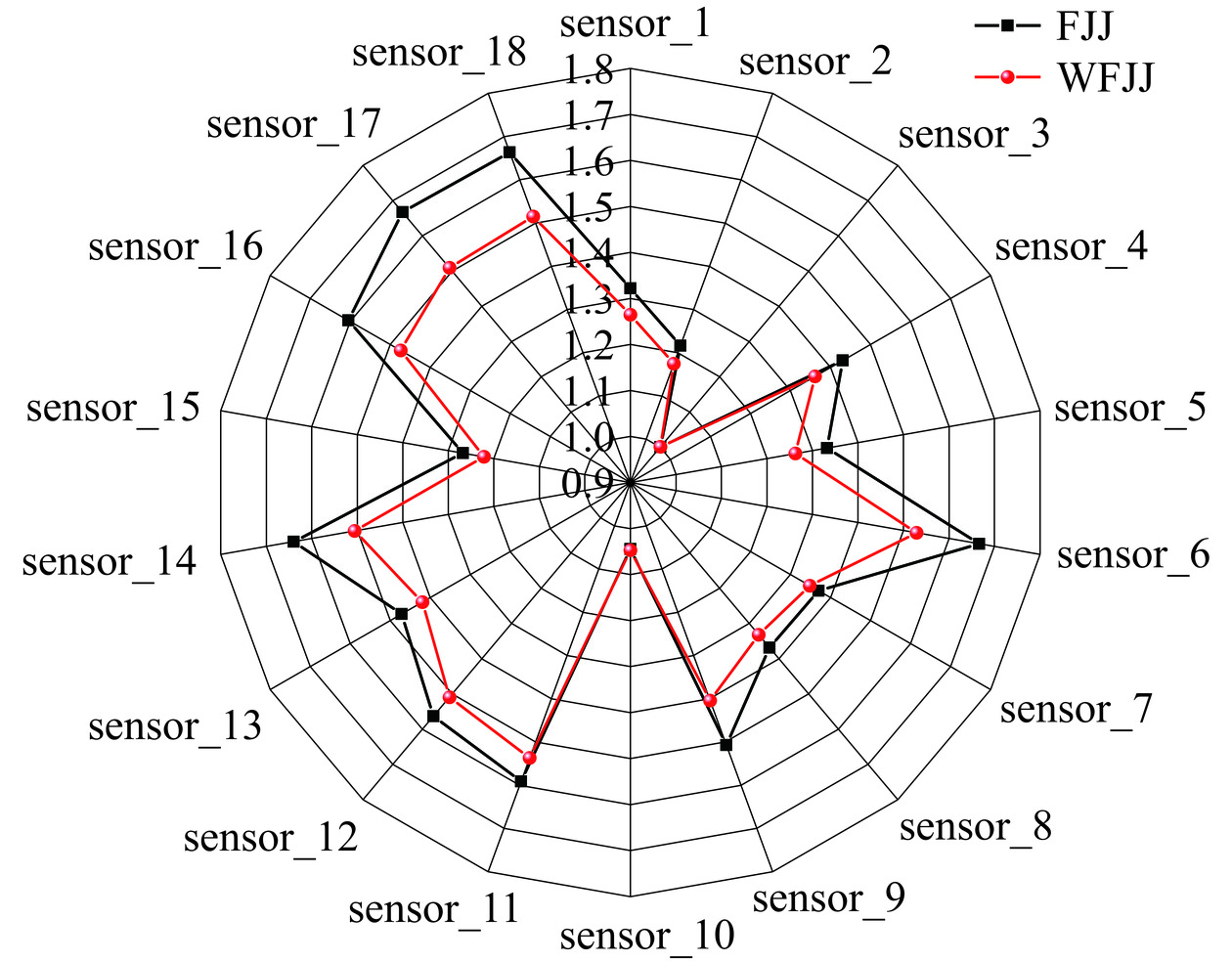
将提取到的各个传感器的响应强度值建立样品的气味雷达图,如图6所示。所有的传感器响应值均在1以上,可作为评判气味特征的主要指标。发酵苹果汁在各个传感器上的响应值均高于未发酵苹果汁。其中sensor6和sensor9传感器均对芳香成分灵敏,从图中可知,发酵苹果汁这2个传感器响应强度值整体最高,说明益生菌发酵有利于提高苹果汁中的芳香成分,这主要是由于在发酵过程中微生物代谢积累代谢产物产生了相应的苯环类芳香族化合物所致。这与GC-IMS中发酵赋予苹果汁更加丰富的口感、香气与滋味的结果一致。Sensor16传感器对氮化物敏感,发酵和未发酵的苹果汁对该传感器的响应值也较高,但是发酵苹果汁的响应值更高,说明益生菌发酵会使苹果汁产生更多的氮化物,这可能是因为益生菌在发酵过程中利用有机物质,积累较多的含氮的代谢产物,从而使氮化物含量较高。Sensor18和Sensor10传感器分别对乙醇和氢气敏感,乙醇的响应强度值整体较高,氢气的响应强度值整体最低,但发酵苹果汁的响应值高于未发酵苹果汁,可能是益生菌在发酵过程中产生大量醇类物质并释放少量氢气,这与GC-IMS中发酵苹果汁的醇类物质种类高于未发酵苹果汁,并赋予发酵苹果汁更加独特复杂的香气结果一致。
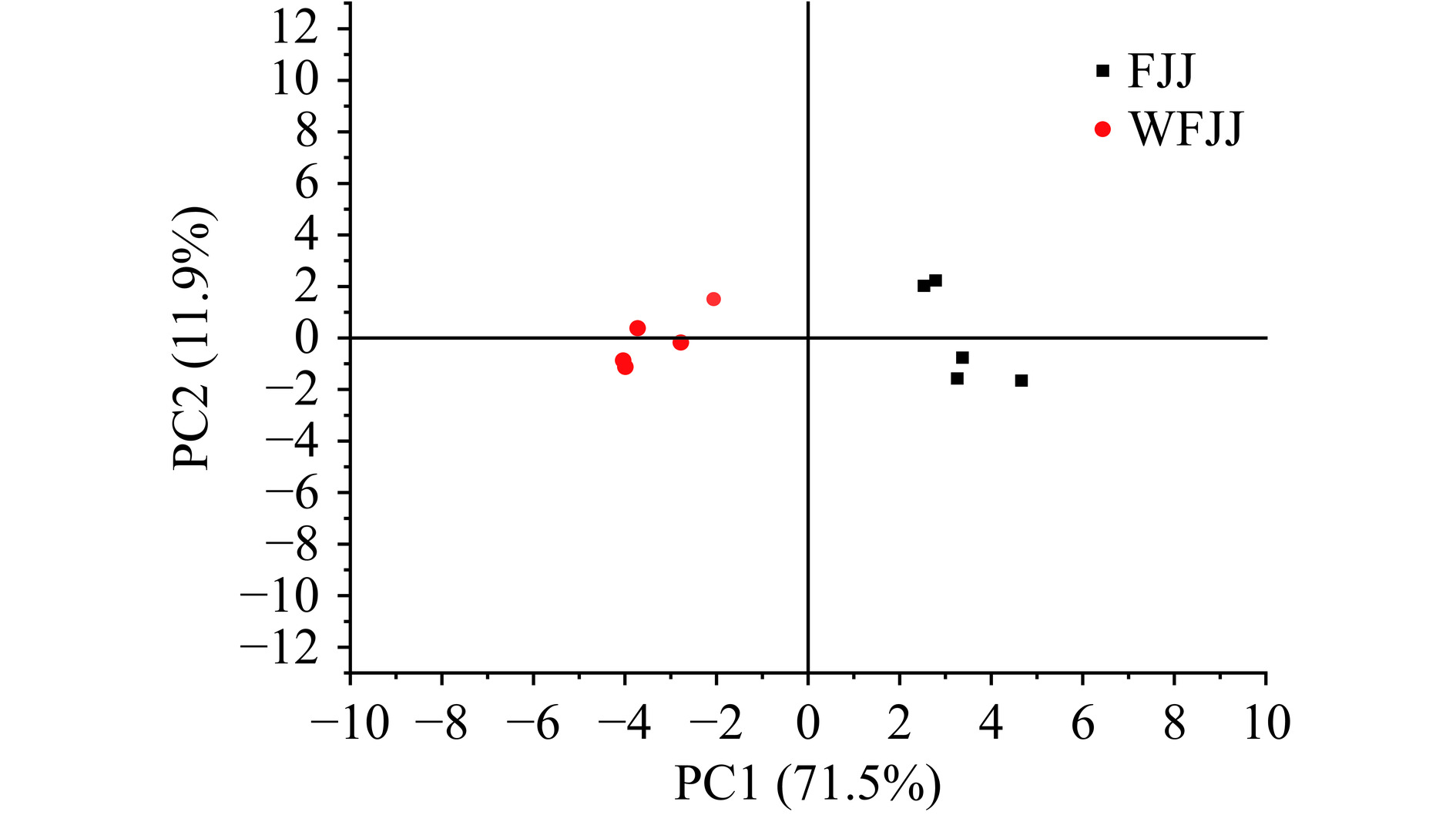
利用主成分分析发酵与未发酵的苹果汁香气,结果如图7。贡献率越高,证明PC对原始多指标信息的反映越好[36],PC1和PC2的累计贡献率大于80%,说明前两个主成分涵盖了样品的绝大部分信息。结果表明,第1主成分得分为71.5%,第2主成分得分为11.9%。发酵苹果汁与未发酵苹果汁组内差距较近,组间差距较远,说明两种苹果汁的滋味和气味有显著差异。因此,通过第1和第2主成分可以很好的区分两种苹果汁样品。
3. 讨论与结论
本文将高酸苹果和鲜食苹果直接榨汁后1:1混合,按照108 CFU/mL的接种量加入植物乳杆菌和嗜热链球菌复合菌种进行发酵。通过单因素和响应面优化试验,益生菌发酵苹果汁的最佳发酵工艺为发酵时间27.0 h、发酵温度30.0 ℃、初始糖度15.0ºBx,在此条件下,发酵苹果汁中的活菌数为7.2×108 CFU/mL,感官评分为92.13分。与未发酵苹果汁相比,发酵苹果汁多酚含量显著升高了5.36%(P<0.05),益生菌发酵苹果汁多酚含量变化可能是因为发酵过程中产生的酶和羧酸可能破坏了细胞的结构,释放出酚类物质[37];益生菌发酵后苹果汁的黄酮含量显著增加了21.05%(P<0.05)。其原因可能是益生菌可分泌糖苷酶[38],将不溶性膳食纤维结合的黄酮释放形成水溶性黄酮;同时又可能将水溶性黄酮苷水解成不溶性黄酮苷元。这与李维妮等[39]研究复合益生菌发酵苹果汁显著提高了多酚和黄酮的质量浓度的结果一致。还原糖和乳酸含量显著下降(P<0.05)。还原糖含量降低是因为在发酵过程中菌种适应新的营养条件后,迅速生长繁殖,消耗大量的糖类,产生氨基酸、短链脂肪酸等优良产物;乳酸含量降低可能是因为苹果汁是高酸苹果汁和富士苹果汁的混合汁,高酸苹果汁具有较高的酸度,从而导致未发酵苹果汁的乳酸含量较高;另外可能是因为在转化成乳酸的代谢途径中,不具有适当的转运机制或者酶的活性不好均可能影响乳酸的转化含量,这与Redzepovic等[40]的结果相似但略有不同。样品中GC-IMS共鉴定出35种挥发性成分,包括酯类6种,醛酮类11种,酸类6种,醇类3种,吡嗪类3种以及其他类6种,其发酵与未发酵苹果汁共有成分有11种,包括2-甲基丁酸乙酯、3,7-二甲基-2-亚甲-6-辛烯醛、2-庚酮、2-环己烯-1-酮、甲基异丁基甲酮、3-己酮、左旋香芹酮、正戊酸、2,3-二甲基-5-乙基吡嗪、乙二醇乙醚、2,2,4,6,6-五甲基庚烷。发酵与未发酵苹果汁中挥发性物质成分含量及种类存在明显差异,发酵苹果汁产生了己酸丁酯、丙酸异戊酯、丁酸异戊酯、丙酸、3-庚烯-2-酮以及正丁醛等特征物质,这些香气化合物赋予发酵苹果汁更浓郁的青香、花香和果香,风味与滋味也得到改善,这与陈月星等[5]研究混菌发酵样品的香气成分含量与香气值显著高于未发酵样品和单菌发酵样品的结果一致。电子鼻分析中发酵苹果汁在各个传感器上的响应值均高于未发酵苹果汁,说明益生菌能够增加苹果汁中芳香类挥发性风味物质的含量,分析结果与GC-IMS鉴定的结果一致。混合菌种益生菌发酵的苹果汁饮品酸甜可口,色泽均匀,果香浓郁且典型,适于发酵苹果汁的生产。研究结果不仅为开发益生菌发酵苹果汁提供了理论依据,还为苹果的多领域深加工提供技术支撑,但对于益生菌发酵过程中的功能性成分的变化以及调节肠道菌群的机制还需要进一步研究探索。
-
表 1 响应面试验因素与水平
Table 1 Factors and levels of response surface tests
水平 因素 A初始糖度(ºBx) B发酵时间(h) C发酵温度(℃) −1 13.5 24 28 0 15 27 30 1 16.5 30 32 表 2 感官评价标准
Table 2 Sensory evaluation criteria
因素 评语 分数 色泽
(25分)呈金黄色,色泽透明,有光泽 15~25 呈暗黄色,色泽较暗,略有光泽 9~14 色泽暗淡,无光泽 0~8 组织状态
(25分)果汁澄清,无沉淀,无杂质 15~25 果汁略微浑浊,少许沉淀或杂质 9~14 果汁浑浊,有沉淀和杂质 0~8 香气
(25分)具有典型苹果香气,柔和清爽,无外来香气 15~25 苹果香味较淡,略有外来香气 9~14 香味淡,刺激性气味较重,有外来香气 0~8 口感
(25分)口感柔和,酸甜适中,苹果风味突出,无异味 15~25 口感一般,酸味较重,略有刺激感,稍有异味 9~14 口感粗糙、寡淡,刺激感明显,较难接受 0~8 表 3 响应面试验设计及结果
Table 3 Response surface test design and results
试验号 A初始
糖度B发酵
时间C发酵
温度R1感官
评分(分)R2活菌数
(×108 CFU/mL)1 −1 0 −1 87.32 2.00 2 −1 0 1 88.14 2.30 3 −1 −1 0 84.53 2.10 4 −1 1 0 86.08 0.74 5 0 1 1 84.87 3.80 6 0 0 0 90.92 6.80 7 0 0 0 91.48 6.80 8 0 −1 1 84.24 3.00 9 0 0 0 91.62 6.70 10 0 0 0 91.74 7.60 11 0 0 0 92.12 7.30 12 0 −1 −1 84.73 4.80 13 0 1 −1 85.42 3.50 14 1 0 1 87.34 5.20 15 1 −1 0 84.31 4.20 16 1 1 0 85.10 5.50 17 1 0 −1 87.57 6.40 表 4 感官评分回归模型方差分析
Table 4 Sensory score regression model ANOVA
方差来源 平方和 自由度 均方 F值 P值 模型 139.33 9 15.48 119.64 <0.0001** A初始糖度 0.3445 1 0.3445 4.24 0.2205 B发酵时间 1.67 1 1.67 20.62 0.0209* C发酵温度 0.0162 1 0.0162 0.1995 0.7790 AB 0.1444 1 0.1444 1.78 0.4127 AC 0.3249 1 0.3249 4.00 0.2327 BC 0.0009 1 0.0009 0.0111 0.9471 A2 15.33 1 15.33 72.21 <0.0001** B2 91.55 1 91.55 803.06 <0.0001** C2 18.53 1 18.53 97.34 <0.0001** 残差 1.33 7 0.1904 失拟方差 0.5683 3 0.1894 0.9914 0.4819 误差 0.7643 4 0.1911 总变异 140.66 16 R2 0.9905 R2Adj 0.9783 注:*表示显著(P<0.05),**表示极显著(P<0.01);表5同。 表 5 活菌数回归模型方差分析
Table 5 Number of viable bacteria regression model ANOVA
方差来源 平方和 自由度 均方 F值 P值 模型 68.99 9 7.67 53.91 <0.0001** A初始糖度 21.65 1 21.65 152.24 <0.0001** B发酵时间 0.0392 1 0.0392 0.2757 0.6158 C发酵温度 0.2450 1 0.2450 1.72 0.2307 AB 1.77 1 1.77 12.44 0.0096** AC 0.0625 1 0.0625 0.4395 0.5286 BC 1.10 1 1.10 7.75 0.0271* A2 16.47 1 16.47 115.79 <0.0001** B2 15.64 1 15.64 110.01 0.0001** C2 7.53 1 7.53 52.97 0.0002** 残差 0.9954 7 0.1422 失拟方差 0.3834 3 0.1278 0.8353 0.5405 误差 0.6120 4 0.1530 总变异 69.99 16 R2 0.9858 R2Adj 0.9675 表 6 理化指标检测结果
Table 6 Results of physical and chemical index tests
样品 活菌数(×108 CFU/mL) 还原糖(%) 乳酸(g/L) 多酚(mg/mL) 黄酮(mg/mL) 未发酵苹果汁 − 26.13±0.64 0.34±0.03 0.56±0.01 0.57±0.01 发酵苹果汁 7.2±0.62 22.36±0.39** 0.19±0.03** 0.59±0.01* 0.69±0.01** 注:*代表差异显著(P<0.05),**代表差异极显著(P<0.01)。 表 7 GC-IMS鉴定出的挥发性风味物质
Table 7 Volatile flavor substances identified by GC-IMS
种类 化合物 分子量(Da) 迁移时间(ms) 保留时间(s) 保留指数 酯类 正戊酸异戊酯 172.3 486.2 1.4707 1063.1 (E)-2-溴-4,4,4-三氟-2-丁烯酸乙酯 114.1 253.0 1.5580 897.6 2-甲基丁酸乙酯 130.2 271.2 1.2371 915.7 己酸丁酯 172.3 666.6 1.4620 1140.2 丙酸异戊酯 144.2 271.3 1.8270 915.7 丁酸异戊酯 158.2 584.4 1.4031 1108.1 醛酮类 顺-4-庚二醛 112.2 912.9 268.4 912.9 异戊醛 86.1 656.7 114.4 656.7 3-甲基-2-丁烯醛 84.1 738.4 143.6 738.4 正丁醛 72.1 653.0 113.5 653.0 3,7-二甲基-2-亚甲-6-辛烯醛 140.2 547.5 1.1792 1092.1 3-庚烯-2-酮 172.3 351.1 1.6362 1063.1 2-庚酮 114.1 255.3 1.2602 897.6 3-己酮 130.2 203.8 1.4715 915.7 甲基异丁基甲酮 100.2 156.6 1.1795 765.3 2-环己烯-1-酮 96.1 207.1 1.4053 843.4 左旋香芹酮 150.2 923.9 1.8196 1220.0 酸类 正戊酸 102.1 198.3 1.2303 831.7 丁酸 88.1 154.4 1.3865 760.9 丙酸 74.1 114.5 1.2628 657.2 2-甲基丁酸 102.1 260.4 1.2120 905.1 辛酸 144.2 617.1 1.8863 1121.4 己酸 116.2 311.1 1.6493 951.3
醇类异蒲勒醇 154.3 616.1 1.3889 1121.0 正丁醇 74.1 101.3 1.1846 598.8 3-甲基-2-丁醇 88.1 139.5 1.2363 729.3
吡嗪类2,3-二甲基-5-乙基吡嗪 136.2 565.0 1.2244 1099.8 2-乙基吡嗪 108.1 317.3 1.5150 956.5 2-甲氧基吡嗪 110.1 279.5 1.4654 923.5 其他类 乙二醇乙醚 90.1 128.1 1.3364 702.8 乙二醇二甲醚 90.1 124.1 1.2931 692.9 乙二醇单丁醚 118.2 317.3 1.6023 956.5 2,2,4,6,6-五甲基庚烷 170.3 340.7 1.3253 974.9 蒎烯 136.2 350.6 1.7359 982.4 2-乙酰基-2-噻唑啉 129.2 487.5 1.1544 1063.8 -
[1] ABID M, JABBAR S, WU T, et al. Sonication enhances polyphenolic compounds, sugars, carotenoids and mineral elements of apple juice[J]. Ultrasonics Sonochemistry,2014,21(1):93−97. doi: 10.1016/j.ultsonch.2013.06.002
[2] PRETI R, TAROLA A M. Study of polyphenols, antioxidant capacity and minerals for the valorisation of ancient apple cultivars from Northeast Italy[J]. European Food Research and Technology,2021,247(1):273−287.
[3] LIAUDANSKAS M, VIŠKELIS P, JAKŠTAS V, et al. Application of an optimized HPLC method for the detection of various phenolic compounds in apples from lithuanian cultivars[J]. Journal of Chemistry, 2014:542121.
[4] XU Y, HLAING M M, GLAGOVSKAIA O, et al. Fermentation by probiotic lactobacillus gasseri strains enhances the carotenoid and fibre contents of carrot juice[J]. Foods,2020,9(1803):1−15.
[5] 陈月星, 谭思远, 李倩钰, 等. 不同益生菌配比发酵对苹果汁主要香气成分的影响[J]. 西北农业学报,2022,31(9):1131−1141. [CHEN Y X, TAN S Y, LI Q Y, et al. Effect of fermentation with different proportions of probiotics on aroma components of apple juice[J]. Acta Agric Boreal Sin,2022,31(9):1131−1141.] doi: 10.7606/j.issn.1004-1389.2022.09.006 CHEN Y X, TAN S Y, LI Q Y, et al. Effect of fermentation with different proportions of probiotics on aroma components of apple juice[J]. Acta Agric Boreal Sin, 2022, 31(9): 1131−1141. doi: 10.7606/j.issn.1004-1389.2022.09.006
[6] 李东阳, 陈培琴, 张国庆, 等. 宁夏沙地发展苹果产业的几点思考[J]. 果农之友,2022(11):87−90,93. [LI D Y, CHEN P Q, ZHANG G Q, et al. Some thoughts on the development of apple industry in ningxia sandy land[J]. Friends of Fruit Farmers,2022(11):87−90,93.] doi: 10.3969/j.issn.1671-7759.2022.11.032 LI D Y, CHEN P Q, ZHANG G Q, et al. Some thoughts on the development of apple industry in ningxia sandy land[J]. Friends of Fruit Farmers, 2022(11): 87−90,93. doi: 10.3969/j.issn.1671-7759.2022.11.032
[7] HASHEMI S M B, MOUSAVI K A, BARBA F J, et al. Fermented sweet lemon juice (Citrus limetta) using Lactobacillus plantarum LS5:Chemical composition, antioxidant and antibacterial activities[J]. Journal of Functional Foods,2017,38:409−414. doi: 10.1016/j.jff.2017.09.040
[8] ALVES N N, MESSAOUD G B, DESOBRY S, et al. Effect of drying technique and feed flow rate on bacterial survival and physicochemical properties of a non-dairy fermented probiotic juice powder[J]. Journal of Food Engineering,2016,189:45−54. doi: 10.1016/j.jfoodeng.2016.05.023
[9] LI Z X, TENG J, LÜ Y L, et al. Enhanced antioxidant activity for apple juice fermented with Lactobacillus plantarum ATCC14917[J]. Molecules,2019,24(1):51−63.
[10] ZAHRA K, BEHROOZ A B, HOSSEIN J, et al. Probiotic viability, physicochemical, and sensory properties of probiotic orange juice[J]. Journal of Food Measurement and Characterization,2023,17:1817−1822. doi: 10.1007/s11694-022-01771-x
[11] 张桂芝, 吴小禾, 陈淑贤, 等. 火龙果复合发酵果蔬汁饮料的研制[J]. 饮料工业,2022,25(2):50−54. [ZHANG G Z, WU X H, CHEN S X, et al. Study onpitaya compound juice fermented by probiotics[J]. The Beverage Industry,2022,25(2):50−54.] doi: 10.3969/j.issn.1007-7871.2022.02.014 ZHANG G Z, WU X H, CHEN S X, et al. Study onpitaya compound juice fermented by probiotics[J]. The Beverage Industry, 2022, 25(2): 50−54. doi: 10.3969/j.issn.1007-7871.2022.02.014
[12] 黄杰, 韦璐, 郑博强, 等. 香蕉胡萝卜复合果蔬汁的发酵工艺优化及抗氧化活性研究[J]. 中国酿造,2021,40(6):129−134. [HUANG J, WEI L, ZHENG B Q, et al. Optimization of fermentation technology and antioxidant activity of banana carrot compound fruit and vegetable juice[J]. China Brewing,2021,40(6):129−134.] doi: 10.11882/j.issn.0254-5071.2021.06.025 HUANG J, WEI L, ZHENG B Q, et al. Optimization of fermentation technology and antioxidant activity of banana carrot compound fruit and vegetable juice[J]. China Brewing, 2021, 40(6): 129−134. doi: 10.11882/j.issn.0254-5071.2021.06.025
[13] 周劝娥, 杜小强, 王玉, 等. 混菌发酵苹果汁菌种筛选与工艺优化[J]. 食品科技,2021,46(9):32−39. [ZHOU Q E, DU X Q, WANG Y, et al. Screening of probiotic strains and process optimization for mix fermentation of apple juice[J]. Food Science and Technology,2021,46(9):32−39.] ZHOU Q E, DU X Q, WANG Y, et al. Screening of probiotic strains and process optimization for mix fermentation of apple juice[J]. Food Science and Technology, 2021, 46(9): 32−39.
[14] 李翔, 邓杰, 徐宏, 等. 响应面法优化羊肚菌红枣复合营养粉的加工工艺[J]. 食品研究与开发,2019,49(17):58−63. [LI X, DENG J, XU H, et al. Optimization of the processing technology of compound nutrition powder of morcella and red jujube by response surface method[J]. Food Research and Development,2019,49(17):58−63.] doi: 10.12161/j.issn.1005-6521.2019.17.011 LI X, DENG J, XU H, et al. Optimization of the processing technology of compound nutrition powder of morcella and red jujube by response surface method[J]. Food Research and Development, 2019, 49(17): 58−63. doi: 10.12161/j.issn.1005-6521.2019.17.011
[15] WU S Z, HE Z P, WANG Q Q, et al. Response surface optimization of enzymatic hydrolysis of peptides of Chinese pecan (Carya cathayensis) and analysis of their antioxidant capacities and structures[J]. International Journal of Peptide Research and Therapeutics,2021,27(3):1239−1251.
[16] BOONSOM T, DUMKLIANG E. Response surface optimization on microencapsulation of lemongrass essential oil using spray drying[J]. Key Engineering Materials,2020,859:271−276. doi: 10.4028/www.scientific.net/KEM.859.271
[17] 中华人民共和国国家标准. GB 12456-2021, 食品安全国家标准 食品中总酸的测定[S]. 北京:中国标准出版社. [National Standard of the People's Republic of China. GB 12456-2021, National standards for food safety Determination of total acid in food[S]. Beijing:Standards Press of China, 2021.] National Standard of the People's Republic of China. GB 12456-2021, National standards for food safety Determination of total acid in food[S]. Beijing: Standards Press of China, 2021.
[18] 李俶, 沈佩仪, 吴华星, 等. 超声波提取菠萝皮渣中多酚类物质的研究[J]. 食品与机械,2011,27(2):55−58. [LI C, SHEN P Y, WU H X, et al. Study on technology of extracting polyphenols from pineapple peel residue by ultrasonic wave[J]. Food and Machinery,2011,27(2):55−58.] doi: 10.3969/j.issn.1003-5788.2011.02.016 LI C, SHEN P Y, WU H X, et al. Study on technology of extracting polyphenols from pineapple peel residue by ultrasonic wave[J]. Food and Machinery, 2011, 27(2): 55−58. doi: 10.3969/j.issn.1003-5788.2011.02.016
[19] 王华, 曹婧, 翟丽娟, 等. 猕猴桃果肉提取物抗氧化活性研究[J]. 华北农学报,2013,28(2):144−149. [WANG H, CAO Q, ZHAI L J, et al. Studies on the antioxidant activity of kiwifruit pulp extracts[J]. North China Journal of Agriculture,2013,28(2):144−149.] doi: 10.3969/j.issn.1000-7091.2013.02.026 WANG H, CAO Q, ZHAI L J, et al. Studies on the antioxidant activity of kiwifruit pulp extracts[J]. North China Journal of Agriculture, 2013, 28(2): 144−149. doi: 10.3969/j.issn.1000-7091.2013.02.026
[20] 中华人民共和国国家标准. GB 4789.2-2022, 食品安全国家标准 食品微生物学检验 菌落总数测定[S]. 北京:中国标准出版社. [National standard of the People's Republic of China. GB 4789.2-2022, National standards for food safety Food microbiology determination of total number of bacterial colonies[S]. Beijing:Standards Press of China, 2022.] National standard of the People's Republic of China. GB 4789.2-2022, National standards for food safety Food microbiology determination of total number of bacterial colonies[S]. Beijing: Standards Press of China, 2022.
[21] 李云嵌, 杨曦, 刘江, 等. 超声波辅助碱法提取美藤果分离蛋白及其加工性质研究[J]. 食品与发酵工业,2021,47(9):128−135. [LI Y Q, YANG X, LIU J, et al. Ultrasonic-assisted alkaline extraction of plukenetia volubilis protein isolate and its processing properties[J]. Food and Fermentation Industries,2021,47(9):128−135.] LI Y Q, YANG X, LIU J, et al. Ultrasonic-assisted alkaline extraction of plukenetia volubilis protein isolate and its processing properties[J]. Food and Fermentation Industries, 2021, 47(9): 128−135.
[22] 叶学林, 程水明, 温露文, 等. 响应面法优化桑葚果酒发酵工艺[J]. 中国酿造,2017,36(12):105−109. [YE X L, CHENG S M, WEN L W, et al. Optimization of fermentation technology for mulberry wine by response surface methodology[J]. China Brewing,2017,36(12):105−109.] YE X L, CHENG S M, WEN L W, et al. Optimization of fermentation technology for mulberry wine by response surface methodology[J]. China Brewing, 2017, 36(12): 105−109.
[23] BERGENTALL M K, NIIMI J, PERSSON I, et al. Malolactic fermentation in lingonberry juice and its use as a preservative[J]. Food Microbiology,2024,121:104500. doi: 10.1016/j.fm.2024.104500
[24] EITEMAN M A, RAMALINGAM S. Microbial production of lactic acid[J]. Biotechnology Letters,2015,37:955−972. doi: 10.1007/s10529-015-1769-5
[25] 顾双, 任芳, 韦真博, 等. 基于气相-离子迁移谱技术快速鉴定黄酒酒龄及品牌[J]. 中国食品学报,2020,20(9):248−255. [GU S, REN F, WEI Z B, et al. Rapid identification of age and brand of yellow wine based on gas-ion mobility spectrometry technique[J]. China Food Journal,2020,20(9):248−255.] GU S, REN F, WEI Z B, et al. Rapid identification of age and brand of yellow wine based on gas-ion mobility spectrometry technique[J]. China Food Journal, 2020, 20(9): 248−255.
[26] 梁水连, 吕岱竹, 马晨, 等. ‘桂蕉1号’香蕉成熟过程中挥发性成分和香气特征分析[J]. 食品工业科技,2021,42(14):99−106. [LIANG S L, LÜ D Z, MA C, et al. Characterization of volatile components and aroma during ripening of 'Gui Banana 1' banana[J]. Science and Technology of Food Industry,2021,42(14):99−106.] LIANG S L, LÜ D Z, MA C, et al. Characterization of volatile components and aroma during ripening of 'Gui Banana 1' banana[J]. Science and Technology of Food Industry, 2021, 42(14): 99−106.
[27] 李孟涛, 许德富, 敖宗华, 等. 浓香型基酒中糊味特征物质解析[J]. 食品科学,2024,45(13):173−180. [LI M T, XU D F, AO Z H, et al. Analysis of burnt substances in strong-flavor base Baijiu[J]. Food Science,2024,45(13):173−180.] doi: 10.7506/spkx1002-6630-20230905-039 LI M T, XU D F, AO Z H, et al. Analysis of burnt substances in strong-flavor base Baijiu[J]. Food Science, 2024, 45(13): 173−180. doi: 10.7506/spkx1002-6630-20230905-039
[28] JIAJIA Y, HONGBO L, SHANGQIAO C, et al. Monitoring of volatile compounds of ready-to-eat kiwifruit using GC-IMS[J]. Foods,2023,12(24):4394. doi: 10.3390/foods12244394
[29] 沈棚, 薛红玮. 基于GC-IMS不同年份黄酒挥发性风味物质分析[J]. 中国酿造,2023,42(12):237−243. [SHEN P, XUE H W. Analysis of volatile flavor substances in different vintages of yellow wine based on GC-IMS[J]. China Brewing,2023,42(12):237−243.] SHEN P, XUE H W. Analysis of volatile flavor substances in different vintages of yellow wine based on GC-IMS[J]. China Brewing, 2023, 42(12): 237−243.
[30] 石黎琳, 李安, 牟方婷, 等. 不同品种小米对黄酒风味影响的研究[J]. 中国酿造,2021,40(3):54−63. [SHI L L, LI A, MU F T, et al. Study on the effect of different varieties of millet on the flavor of yellow wine[J]. China Brewing,2021,40(3):54−63.] doi: 10.11882/j.issn.0254-5071.2021.03.011 SHI L L, LI A, MU F T, et al. Study on the effect of different varieties of millet on the flavor of yellow wine[J]. China Brewing, 2021, 40(3): 54−63. doi: 10.11882/j.issn.0254-5071.2021.03.011
[31] 梁胜男, 柯楚新, 黄鹤, 等. 肠道内产丁酸细菌及其产物丁酸生理功能的研究进展[J]. 微生物学通报,2021,48(3):948−959. [LIANG S N, KE C X, HUANG H, et al. Butyrate-producing bacteria in the intestinal tract and the physiological function of their metabolite butyrate:A review[J]. Microbiology Bulletin,2021,48(3):948−959.] LIANG S N, KE C X, HUANG H, et al. Butyrate-producing bacteria in the intestinal tract and the physiological function of their metabolite butyrate: A review[J]. Microbiology Bulletin, 2021, 48(3): 948−959.
[32] 方超, 刘治国, 乔潞, 等. 基于感官定量描述分析法和GC-MS对山庄老酒3种香型白酒挥发性特征风味的分析[J]. 食品科学,2023,44(10):291−299. [FANG C, LIU Z G, QIAO L, et al. Analysis of volatile characteristic flavors of three aroma types of shanzhuang laojiu by sensory quantitative descriptive analysis and gas chromatography-mass spectrometry[J]. Food Science,2023,44(10):291−299.] doi: 10.7506/spkx1002-6630-20220821-241 FANG C, LIU Z G, QIAO L, et al. Analysis of volatile characteristic flavors of three aroma types of shanzhuang laojiu by sensory quantitative descriptive analysis and gas chromatography-mass spectrometry[J]. Food Science, 2023, 44(10): 291−299. doi: 10.7506/spkx1002-6630-20220821-241
[33] 王志伟, 闫凤霞, 徐嘉良, 等. 3种高粱品种淀粉特性和酿造黄酒的风味品质分析[J]. 食品科学,2019,40(13):45−51. [WANG Z W, YAN F X, XU J L, et al. Analysis of starch characteristics and flavor quality of three sorghum varieties for making yellow wine[J]. Food Science,2019,40(13):45−51.] doi: 10.7506/spkx1002-6630-20180528-388 WANG Z W, YAN F X, XU J L, et al. Analysis of starch characteristics and flavor quality of three sorghum varieties for making yellow wine[J]. Food Science, 2019, 40(13): 45−51. doi: 10.7506/spkx1002-6630-20180528-388
[34] 张璐, 梁锦, 黄天姿, 等. 单一及混合益生菌发酵猕猴桃果汁的香气成分分析[J]. 食品科学,2021,42(24):213−220. [ZHANG L, LIANG J, HUANG T Z, et al. Analysis of aroma components of fermented kiwifruit juice inoculated with single and mixed probiotics[J]. Food Science,2021,42(24):213−220.] doi: 10.7506/spkx1002-6630-20200809-122 ZHANG L, LIANG J, HUANG T Z, et al. Analysis of aroma components of fermented kiwifruit juice inoculated with single and mixed probiotics[J]. Food Science, 2021, 42(24): 213−220. doi: 10.7506/spkx1002-6630-20200809-122
[35] 刘家欢, 孙细珍, 熊亚青, 等. 不同轮次酱香型白酒中吡嗪类化合物含量分析[J]. 食品与发酵科技,2023,59(3):103−110. [LIU J H, SUN X Z, XIONG Y Q, et al. Analysis of pyrazines in different rounds of soy sauce-type white wine[J]. Food and Fermentation Technology,2023,59(3):103−110.] doi: 10.3969/j.issn.1674-506X.2023.03-018 LIU J H, SUN X Z, XIONG Y Q, et al. Analysis of pyrazines in different rounds of soy sauce-type white wine[J]. Food and Fermentation Technology, 2023, 59(3): 103−110. doi: 10.3969/j.issn.1674-506X.2023.03-018
[36] MAGAGNA F, VALVERDE-SOM L, RUÍZ-SAMBLÁS C, et al. Combined untargeted and targeted fingerprinting with comprehensive two-dimensional chromatography for volatiles and ripening indicators in olive oil[J]. Analytica Chimica Acta,2016,936(14):245−258.
[37] FILANNINO P, BAI Y, DI C R, et al. Metabolism of phenolic compounds by Lactobacillus spp. during fermentation of cherry juice and broccoli puree[J]. Food Microbiology,2014,46:272−279.
[38] 李志华. 产β-葡萄糖苷酶乳酸菌菌株的特性研究[D]. 延边:延边大学, 2014. [LI Z H. Study on characteristics of lactic acid bacteria strains producing β-glucosidase[D]. Yanbian:Yanbian University, 2014.] LI Z H. Study on characteristics of lactic acid bacteria strains producing β-glucosidase[D]. Yanbian: Yanbian University, 2014.
[39] 李维妮, 张宇翔, 魏建平, 等. 益生菌发酵苹果汁工艺优化及有机酸的变化[J]. 食品科学,2017,38(22):80−87. [LI W N, ZHANG Y X, WEI J P, et al. Optimization of the process of probiotic fermentation of apple juice and changes in organic acids[J]. Food Science,2017,38(22):80−87.] doi: 10.7506/spkx1002-6630-201722013 LI W N, ZHANG Y X, WEI J P, et al. Optimization of the process of probiotic fermentation of apple juice and changes in organic acids[J]. Food Science, 2017, 38(22): 80−87. doi: 10.7506/spkx1002-6630-201722013
[40] REDZEPOVIC S, ORLIC S, MAJDAK A, et al. Differential malic acid degradation by selected strains of Saccharomyces during alcoholic fermentation[J]. International Journal of Food Microbiology,2003,83(1):49−61. doi: 10.1016/S0168-1605(02)00320-3





 下载:
下载:
 下载:
下载:



