Protective Effect of Black Bean-Whey Double Protein Diet on Intestinal Barrier Injury Induced by Lipopolysaccharide in Rats
-
摘要: 本研究旨在探讨黑豆-乳清双蛋白(Black Bean-Whey Double Protein,B-W DP)膳食对脂多糖(Lipopolysaccharide,LPS)诱导肠屏障损伤大鼠的保护作用,以SD大鼠为试验对象,饲喂低、中、高剂量的B-W DP对其进行28 d膳食干预,随后采用脂多糖诱导大鼠肠屏障损伤。通过H&E染色观察大鼠的肠道形态、免疫组化检测紧密连接蛋白表达量、实时荧光定量PCR对TLR4、MyD88的表达水平进行测定。结果表明,与低剂量和高剂量B-W DP相比,中剂量的B-W DP能够极显著(P<0.01)地对LPS引起的肠屏障损伤起到预保护作用,使绒毛长度(Vuff Length,VL)数值增加26.69%,隐窝深度(Crypt Depth,CD)数值降低22.61%,二者比值提升了46.78%;三种剂量的B-W DP均能够对紧密连接蛋白起到不同的调节作用,中剂量干预效果最显著(P<0.01),使ZO-1、Claudin-1、Occludin的表达量分别提高了14.32%、31.80%、16.67%;三种剂量的B-W DP均能极显著(P<0.01)地抑制炎症传导途径,中剂量效果最明显,使TLR4和MyD88的表达水平分别降低了37.25%和33.04%。综上,中剂量B-W DP可改善肠道形态,提高肠道的消化吸收能力,增加紧密连接蛋白的表达量,维持上皮细胞完整,降低肠道通透性,下调TLR4和MyD88的表达水平,减轻炎症反应,对LPS诱导的肠屏障损伤产生了有效的保护作用。Abstract: To explore the protective effects of a black bean-whey double protein (B-W double protein, B-W DP) diet on intestinal barrier injury induced by lipopolysaccharides (LPS) in rats. Sprague-Dawley rats were fed low, medium, and high doses of B-W DP for 28 d, and then, LPS was used to induce intestinal barrier injury. The intestinal morphology of the rats was observed using hematoxylin and eosin staining. The expression of tight junction proteins was quantified using immunohistochemistry, and the TLR4 and MyD88 expression levels were determined using real-time fluorescence quantitative polymerase chain reaction. Results showed that compared with low- and high-dose B-W DP, intermediate-dose B-W DP significantly (P<0.01) protected against intestinal barrier injury caused by LPS, increased villus length by 26.69%, reduced crypt depth by 22.61%, and increased their ratio by 46.78%. Three doses of B-W DP regulated tight junction proteins in different manners, and the intermediate dose exhibited the most significant effect (P<0.01), increasing ZO-1, Claudin-1, and Occludin expression levels by 14.32%, 31.80%, and 16.67%, respectively. Three doses of B-W DP significantly inhibited the inflammatory pathway (P<0.01), and the intermediate dose exhibited the most significant effect, reducing TLR4 and MyD88 protein levels by 37.25% and 33.04%, respectively. In summary, a moderate dose of B-W DP can improve intestinal morphology, intestinal digestion, and absorption capacity, increase the expression of tight junction proteins, maintain the integrity of epithelial cells, reduce intestinal permeability, downregulate TLR4 and MyD88 protein expression, and alleviate inflammatory reactions. All of which exhibit effective protective effects on LPS-induced intestinal barrier injury.
-
随着社会生活节奏的加快,不良的饮食和作息规律使肠道疾病的发病率持续升高,有研究表示,1990~2019年,我国因肠道问题死亡的患者数量呈下降趋势,但发病率呈上升趋势[1]。由此可见肠道问题带来的困扰不容小觑,已然成为全社会需要共同解决的重要问题。肠屏障是由肠黏膜上皮细胞、肠道菌群、免疫球蛋白、肠道内相关淋巴组织、胃酸、胆汁等物质组成的机械屏障、生物屏障、化学屏障和免疫屏障四道防线的总和[2−4],能有效防止肠道内细菌和内毒素等有害物质进入机体,保障肠道健康。肠屏障的损伤不仅会带来炎症性肠病以及肠易激综合征等疾病,还会引起机体其他器官的病变,如肺部、肝部、肾部以及心脑血管疾病[5−8]。
脂多糖来自于革兰氏阴性菌的细胞壁,其进入机体后通过激活Toll样受体(TLR4)和髓样分化因子(MyD88)等因子引起NF-κB和丝裂原活化蛋白激酶(MAPK)两条通路,对肠屏障功能造成损伤,破坏肠道完整性[9−11]。有文献表明乳清蛋白能够通过促进上皮细胞增殖、修复肠损伤形态、调节免疫细胞以及细胞因子等方式对肠屏障起到保护作用,并且作为肠内营养物质应用于临床营养[12−13]。也有学者通过验证细菌移位率、回肠绒毛高度、黏膜细胞增殖等指标,阐明了大豆蛋白对肠屏障的保护作用[14]。
乳清蛋白营养价值高、易消化吸收、必需氨基酸种类齐全且富含甲硫氨酸,是一种完全蛋白质,且含有β-乳球蛋白、α-乳白蛋白、免疫球蛋白等活性蛋白成分[15−16],但过量食用会导致体内脂肪含量和胆固醇指数升高。黑豆作为大豆属的一种,其蛋白质含量同样丰富,是植物性的完全蛋白质,甲硫氨酸含量虽然偏少,但其含有其他活性成分,可以降低胆固醇、血脂并预防心血管疾病的活性成分[17−18]。黑豆-乳清(Black bean-whey,B-W)双蛋白作为动植物蛋白的结合,既有动物蛋白易消化吸收的特点,也有豆类蛋白不含胆固醇的特性,且在甲硫氨酸含量上互补。课题组前期研究成果表明,B-W DP可提高机体免疫力[19],并且相较于单一黑豆蛋白和乳清蛋白B-W DP能够改善肠组织形态,促进肠绒毛生长发育,提高肠道菌群多样性[20],多位学者研究表明肠道菌群能通过水解外层黏液层维持内外黏液层的动态平衡,通过直接或间接的方式以代谢产物影响肠上皮细胞的代谢和发育,一些益生菌的细胞外囊泡也可通过调节紧密连接蛋白改善肠道通透性[21],故猜测B-W DP可对肠屏障损伤起到保护作用。因此本研究以SD大鼠为研究对象,分别饲喂低、中、高剂量B-W DP膳食,与对照组和LPS诱导的肠屏障损伤大鼠对比,通过肠道形态、紧密连接蛋白、TLR4和MyD88表达量等指标探究B-W DP膳食对肠屏障损伤的保护作用。
1. 材料与方法
1.1 材料与仪器
SPF级SD大鼠(雌性、7周龄、体质量120~130 g) 购于长春市亿斯实验动物技术有限责任公司,生产许可证号:SCXK(吉)2023-0002。全部实验动物均饲养于哈尔滨兽医研究所动物实验中心。饲养条件:室温(23±2)℃、光暗环境12 h交替,鼠笼规格475 mm×350 mm×200 mm,每只鼠笼4只鼠,底部铺盖灭菌垫料。大鼠自由活动、摄食及饮水。所有实验操作严格遵守黑龙江八一农垦大学动物伦理审查委员会要求,动物实验伦理学审批号:SPXY2023016;大鼠食用的基础饲料(AIN93-G) 购于长春市亿斯实验动物技术有限责任有限公司,生产许可证编号:SCXK-(吉)2020-0001;黑豆蛋白 纯度90.30%,购于西安恒基化工有限公司;乳清蛋白 纯度90.66%,购于郑州龙生化工有限公司;4%多聚甲醛组织固定液 购于中国BioSharp公司;脂多糖 购于美国Sigma公司;白介素-1β(IL-1β)、白介素-6(IL-6)、白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)检测试剂盒 购于上海朗顿生物科技有限公司;二甲苯 购于天津市凯通化学试剂有限公司;柠檬酸盐修复液、PBS缓冲液粉末、过氧化物酶封闭液、抗鼠/兔二步法检测试剂盒、DAB显色试剂盒、苏木素染液、中性树胶 均购于Ebiogo公司;RNA提取试剂(RNAiso Plus)、反转录试剂盒(PrimeScript™RT reagent Kit) 购于北京宝日医生物技术有限公司;荧光定量PCR预混液(Hieff qPCR SYBR Green Master Mix) 购于上海翌圣生物科技股份有限公司;引物 购于北京擎科生物科技股份有限公司。
CF16RN型高速冷冻离心机 日本日立工机;BM175型-80 ℃超低温冰箱 欧洲法莱宝集团;HH35000310多功能酶标仪 珀金埃尔默仪器有限公司;Axioscope 5型光学显微镜 德国ZEISS;Tiss-24型高速组织研磨仪 上海净信实业发展有限公司;ZT-12M型生物组织自动脱水机、YB-7LF型生物组织包埋机 湖北亚光医用电子技术有限公司;MyCycler基因扩增仪 伯乐生命医学产品有限公司;ViiA7型荧光定量PCR仪 美国应用生物系统公司。
1.2 实验方法
1.2.1 动物模型的建立及分组
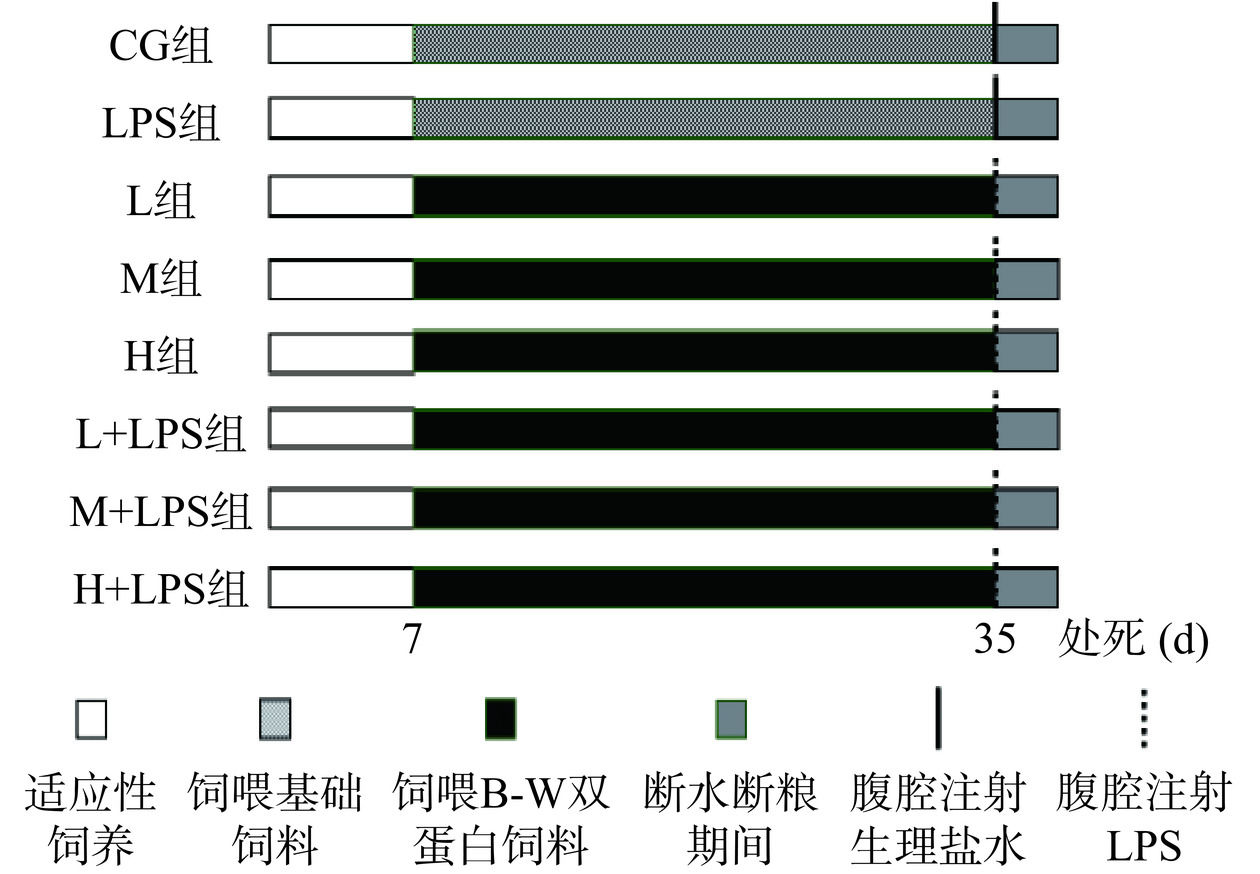
图1为实验流程图。SD大鼠适应性饲养7 d后随机分为5组:空白组、LPS 4 h组、LPS 8 h组、LPS 12 h组、LPS 24 h组,每组8只。对照组大鼠腹腔注射生理盐水,其余4组大鼠腹腔注射1 mg/kg·bw LPS溶液[22],后处死各组实验动物,腹主动脉取血,取十二指肠、空肠、回肠,通过肠道形态指标以及检测炎症因子含量确定LPS的最佳作用时间以及作用肠段。
上阶段实验结束后,复购64只SD大鼠,适应性饲养7 d后随机分为CG组、双蛋白低剂量组(L)、双蛋白中剂量组(M)、双蛋白高剂量组(H)、模型组(LPS)、低剂量干预组(L+LPS)、中剂量干预组(M+LPS)、高剂量干预组(H+LPS)。1985年世界粮农组织/世界卫生组织(FAO/WHO)提出成人蛋白质推荐摄入量为每日每千克体重0.75 g,根据每千克体重剂量折算系数法换算[23],设成人体重为60 kg,则大鼠的剂量=6.25(换算系数W)×0.75(g/kg/d)×大鼠体重(kg),双蛋白膳食干预前大鼠的平均体重为0.18 kg(后续干预剂量根据大鼠体重变化作出相应调整),计算得出实验动物的剂量为0.84 g/kg,并以此作为M组大鼠的蛋白摄入量,以L:M:H=1:2:3的比值计算L组和H组的蛋白摄入量。根据课题组前期研究结果,黑豆蛋白与乳清蛋白的复配比例为1:2时体外消化率最高[24],故按照此比例称取相应质量的黑豆蛋白和乳清蛋白掺入已打碎的基础饲料中制成B-W双蛋白饲料。对CG、LPS组大鼠饲喂基础饲料,L、M、H、L+LPS、M+LPS、H+LPS组大鼠饲喂双蛋白饲料,饲料详细信息见表1。8组大鼠喂养28 d后对LPS、L+LPS、M+LPS、H+LPS组大鼠腹腔注射1 mg/kg·bw LPS溶液,其余组注射生理盐水,后断水断粮12 h,根据预试验阶段结果处死实验动物以及取用肠组织。
表 1 不同蛋白来源饲料的配方组成及能量差异(g/100 g)Table 1. Formula composition and energy difference of feeds from different protein sources (g/100 g)成分 基础饲料 低剂量B-W
DP饲料中剂量B-W
DP饲料高剂量B-W
DP饲料酪蛋白 20 20 20 20 黑豆蛋白 − 6.7 12.5 20 乳清蛋白 − 13.3 25 40 玉米淀粉 39.75 39.75 39.75 39.75 玉米糊精 13.2 13.2 13.2 13.2 蔗糖 10 10 10 10 大豆油 7 7 7 7 纤维素 5 5 5 5 矿物质 3.5 3.5 3.5 3.5 维生素 1 1 1 1 L-胱氨酸 0.3 0.3 0.3 0.3 氯化胆碱 0.25 0.25 0.25 0.25 特丁基对苯二酚 0.001 0.001 0.001 0.001 能量 1611.55 kJ 1801.31 kJ 1941.08 kJ 2121.32 kJ 1.2.2 肠道形态观察
解剖实验动物,用消过毒的剪刀取出实验动物小肠,用生理盐水冲洗肠道内容物后用从低到高浓度梯度的乙醇将浸泡在4%多聚甲醛溶液中的肠道脱水,使其变透明,后浸蜡并包埋,切为5~8 μm的薄片放到载玻片上在45 ℃恒温箱中烘干水分,用二甲苯脱去石蜡后在苏木精水溶液中染色数分钟,依次在酸水和氨水中浸泡数秒进行分色,冲洗后入蒸馏水,酒精脱水后用伊红染色液染色2~3 min,在光学显微镜下观察肠道形态,用Caseviewer软件处理染色结果,用Image J软件测量绒毛长度(Vuff Length,VL)及隐窝深度(Crypt Depth,CD)。
1.2.3 酶联免疫吸附实验
腹主动脉取血后放置于离心管中,于18000 r/min,4 ℃离心10 min,随后在常温下4000 r/min离心10 min,分离血清。根据酶联免疫吸附实验(ELISA)试剂盒说明书对IL-1β、IL-6、IL-10、TNF-α含量进行检测,结果用ELISA Calc处理。
1.2.4 免疫组化
采用免疫组化检测ZO类蛋白(ZO-1)、密封蛋白(Claudin-1)、闭合蛋白(Occludin)。解剖实验动物,用消过毒的剪刀剪取4~5 cm十二指肠,用生理盐水冲洗肠道内容物,用pH7.4的4%多聚甲醛磷酸缓冲液固定肠道防止抗原弥散,脱水后浸蜡包埋,后切成5 μm的薄片,切片放入干燥箱65 ℃烤30 min,浸泡二甲苯溶液3次,每次5 min。后浸泡3次乙醇溶液(100%-95%-80%),每次3 min。将切片放入烧杯中,流水缓慢冲去乙醇,直到切片干净透明。抗原高压修复:在高压锅内配制2000 mL pH为6.0的柠檬酸盐修复液,电磁炉加热,放入切片盖上锅盖,喷气后计时2 min,然后停止加热,流水缓慢冲洗高压锅盖直至冷却。阻断内源性过氧化物酶:切片放入3% H2O2中室温孵育20 min,蒸馏水冲洗3次,画疏水圈,PBS溶液冲洗3次。甩去切片上多余的液体,滴加一抗,加盖置于37 ℃培养箱孵育60 min。取出切片,PBS溶液冲洗3次。甩去切片上多余的液体,滴加二抗,加盖置于37 ℃培养箱孵育30 min(抗体参考试剂盒说明稀释,ZO-1抗体稀释比例1:500、Claudin-1抗体稀释比例1:200、Occludin抗体稀释比例1:200)。取出切片,PBS溶液冲洗3次。甩去切片上多余的液体,滴加DAB显色剂,显微镜下控制显色时间,有阳性终止显色,蒸馏水冲洗干净。苏木素衬染2~5 min,蒸馏水洗冲洗干净;1%盐酸酒精分化数秒,水洗干净。碳酸锂溶液蓝化30 s,水洗干净。常规脱水,二甲苯透明。中性树胶封片,显微镜观察结果。
1.2.5 实时荧光定量PCR
用消过毒的剪刀剪取4~5 cm十二指肠,用生理盐水冲洗肠道内容物,样品中加入液氮研磨至粉状后转移至离心管中加入1 mL RNAiso Plus振荡混匀静置5 min,加入氯仿,振荡混匀15 s后室温静置约3 min,4 ℃,12000 r/min,离心15 min,转移至新的离心管中加入异丙醇,混匀后室温静置10 min,4 ℃,12000 r/min,离心10 min,弃上清,加入75%的乙醇,混匀后在4 ℃下,7500 r/min,离心5 min,弃上清,加入适量的焦碳酸二乙酯(Diethyl Pyrocarbonate,DEPC)溶解RNA沉淀,用分光光度计测定总RNA浓度和纯度。RT反应液按照试剂盒要求配制,货号RR037A,按照37 ℃,15 min;85 ℃,5 s进行反转录。采用三步法进行检测,预变性:95 ℃,5 min,变性95 ℃,10 s,退火60 ℃,30 s重复40个循环,得到TLR4和MyD88的Ct值,GAPDH为内参,采用2−△△Ct计算表达量。表2为所用引物序列。
表 2 荧光定量PCR引物序列Table 2. Primer sequence of fluorescence quantitative PCR基因 上游引物序列(5’-3’段) 下游引物序列(5’-3’段) GAPDH AGACAGCCGCATCTTCTTGT TGATGGCAACAATGTCCACT TLR4 GAGGCAGCAGGTCGAATTGT AGAAGATGTGCCTCCCCAGA MyD88 AGTTCTACCATCAAGGGGGC CGTGCCACTACCTCATGCAA 1.3 数据处理
采用SPSS 26进行统计学分析,所有结果以平均值±标准差(¯x±s)的形式表示,采用单因素ANOVA分析,LSD进行多重比较,P<0.05表示具有显著性差异,采用Origin 2018进行绘图。
2. 结果与分析
2.1 肠屏障损伤大鼠模型验证
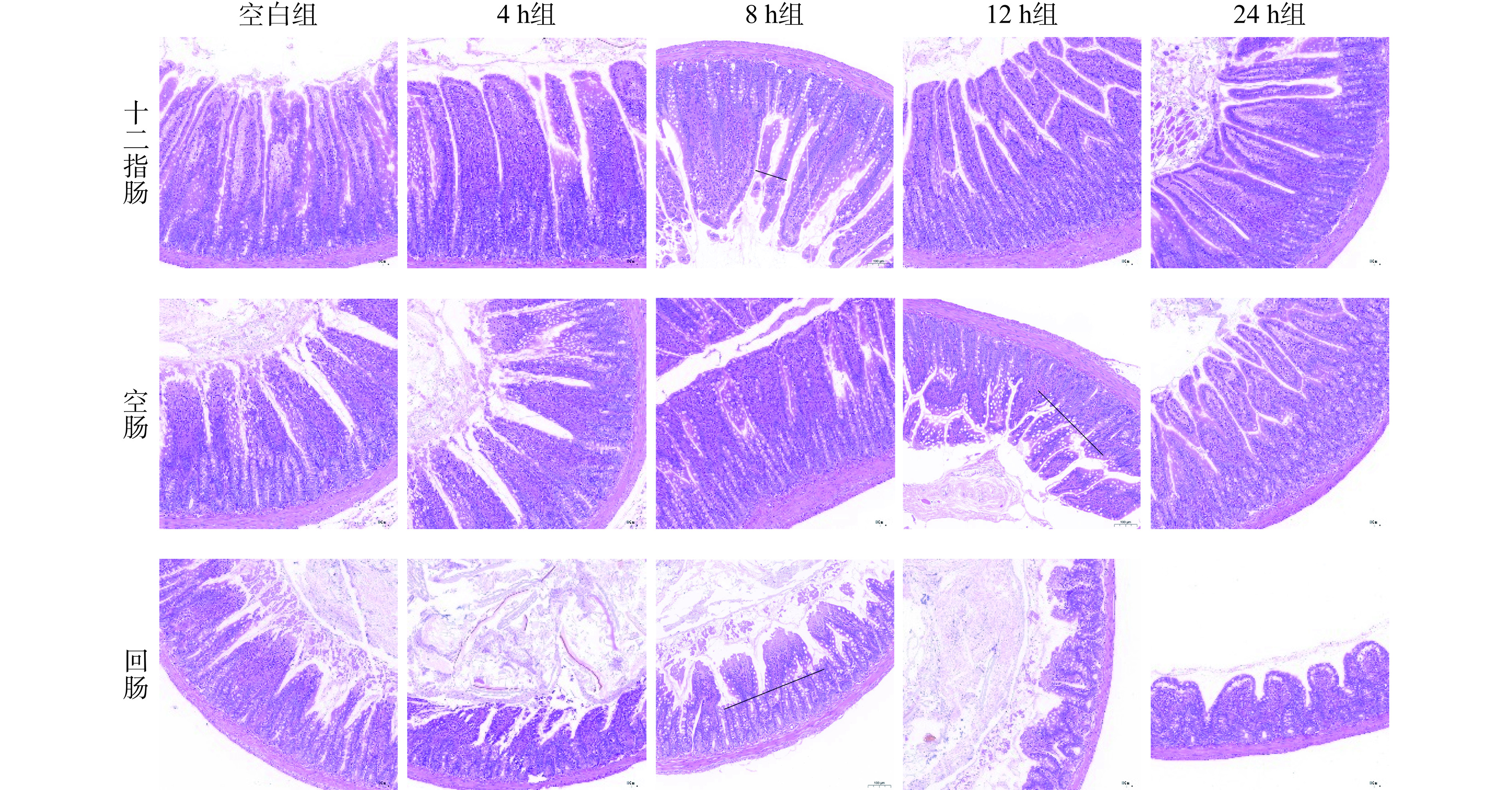
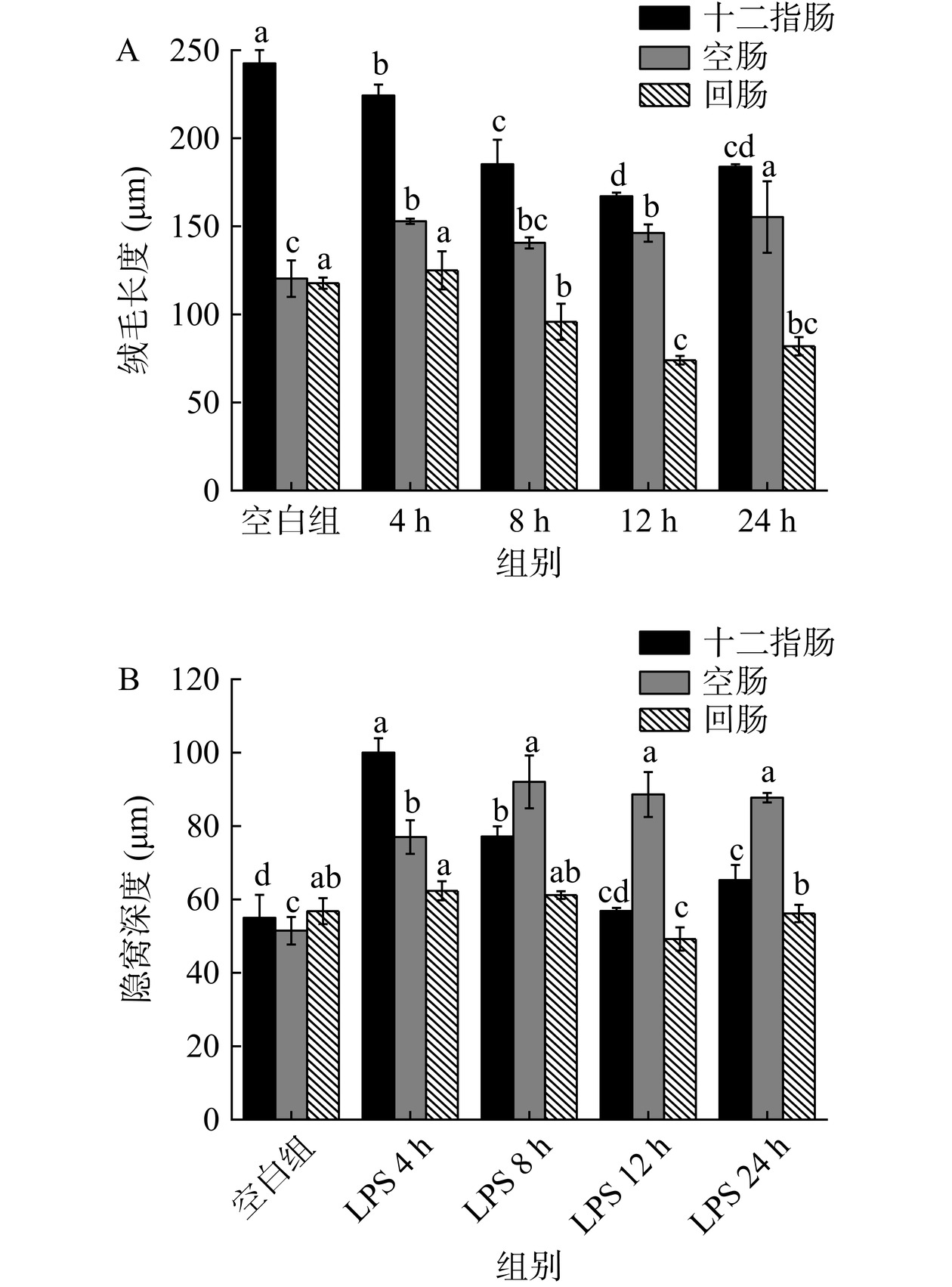
为确保本研究肠屏障损伤动物模型成功建立,注射LPS后4、8、12、24 h对十二指肠、空肠、回肠的肠道形态进行观察,对VL和CD进行了测定,并检测了血清中炎症因子的含量。图2结果显示,相比于空白组,三个肠段在注射LPS后的各个时间段都发生了不同程度的损伤,肠绒毛发生断裂(图中黑色横线处),并出现炎症细胞浸润现象。图3A结果表明十二指肠和回肠的VL在12 h时变化最大,均显著低于空白组长度(P<0.05),十二指肠数值下降了31.10%,回肠数值下降了34.93%。图3B结果显示十二指肠在LPS注射4 h时CD达最大值,显著高于空白组(P<0.05),增加了57.88%;空肠的隐窝深度在8 h时达最大值(P<0.05),增加了78.79%,而回肠的隐窝深度同样在4 h时达最大值(P<0.05),增加了15.26%。小肠绒毛是小肠内皱襞上的突起,它将小肠的吸收面积扩大了将近600倍,以更好的吸收营养物质,其长度越长,对于营养物质的吸收效果越好。而隐窝底部的肠上皮中,干细胞不断分裂,一部分干细胞存留在隐窝中,一部分向上推进至肠绒毛进行肠道的修复,故隐窝深度的高低决定了肠道自我修复的能力。由本实验结果可知,LPS对肠绒毛均造成了不同程度的损伤,并且使隐窝深度有不同程度的变化,这说明LPS降低了小肠吸收营养物质的有效面积,同时影响了干细胞对肠道的修复[25−26],这种情况在十二指肠和空肠的数据表现上更加明显。
由表3可知,随着LPS进入体内后作用时间的增加,各类炎症因子的含量均呈现出先升高后降低的趋势,并在12 h达到最大值,与空白组相比,在LPS注射12 h后IL-1β的含量提高了1.5倍,显著高于空白组(P<0.05);IL-6的含量同样在12 h显著提高了126.14%(P<0.05);IL-10和TNF-α含量同样在12 h时显著升高(P<0.05),分别升高了45.45%和51.62%。
表 3 LPS注射前后炎症因子含量的变化(ng/L)Table 3. Changes of inflammatory factors before and after LPS injection (ng/L)组别 IL-1β IL-6 IL-10 TNF-α 空白组 5.6±1.1d 54.7±2.1c 70.4±7.0d 37.0±2.9c 4 h组 9.8±1.9bc 70.1±7.8bc 81.7±8.5c 49.4±4.8c 8 h组 11.3±1.6b 59.8±5.2b 94.6±4.6b 52.1±5.2a 12 h组 14.0±2.4a 123.7±6.0a 102.4±4.8a 56.1±2.0a 24 h组 9.6±1.2c 54.7±2.4c 92.2±1.6b 48.0±1.2b 注:同列上标不同字母表示差异具有显著性(P<0.05)。 结果表明,炎症反应在12 h达到最大值,IL-1β、TNF-α等因子各司其职,共同抵御LPS对机体的损伤,最终在24 h时基本得到恢复。
综合上述结果,1 mg/kg·bw LPS能够引起实验动物肠屏障损伤,十二指肠的整体形态修长,更方便观察,且其绒毛长度的变化较符合预期,最终确定以十二指肠为目标肠段;而通过炎症因子的检测,发现在12 h时含量最高,且与十二指肠的绒毛长度变化相呼应,故以12 h为LPS作用时间进行下一步实验。
2.2 双蛋白膳食对大鼠体重的影响
在探究双蛋白膳食对大鼠肠屏障及肝脏损伤保护作用的喂养试验期间,对大鼠体重进行了监测,结果如表4所示。由结果可看出,处死时的体重较前一天的体重有所下降,这极有可能是由于在注射LPS后断水断粮造成的。除此以外双蛋白膳食对大鼠体重无显著影响(P>0.05),各组大鼠的体重在未注射LPS之前均为正常的稳步上升趋势,同一天内不同组别大鼠之间也无显著的差异(P>0.05)。王涛等[27]研究发现,高蛋白膳食改善了小鼠的肥胖,本文的研究结果与其类似,虽然不同剂量的B-W双蛋白饲料能量有差异,但并没有使大鼠的体重产生改变,这说明不同剂量的双蛋白膳食不会对体重产生显著影响。
表 4 双蛋白膳食干预期间大鼠体重变化(g)Table 4. Changes in body weight of rats during the intervention period of double protein diet (g)组别 初始体重 第9 d体重 第18 d体重 第27 d体重 处死时体重 CG组 198.63±9.63 215.39±11.81 236.56±16.25 265.26±20.23 242.95±18.22 L组 193.83±9.44 213.98±12.21 233.11±13.63 258.15±15.14 238.03±19.40 M组 197.23±9.13 219.14±12.98 235.66±14.77 262.09±18.09 240.35±18.54 H组 196.70±9.83 220.27±14.02 237.16±17.05 262.70±18.83 238.97±18.19 2.3 双蛋白膳食对肠道形态的影响
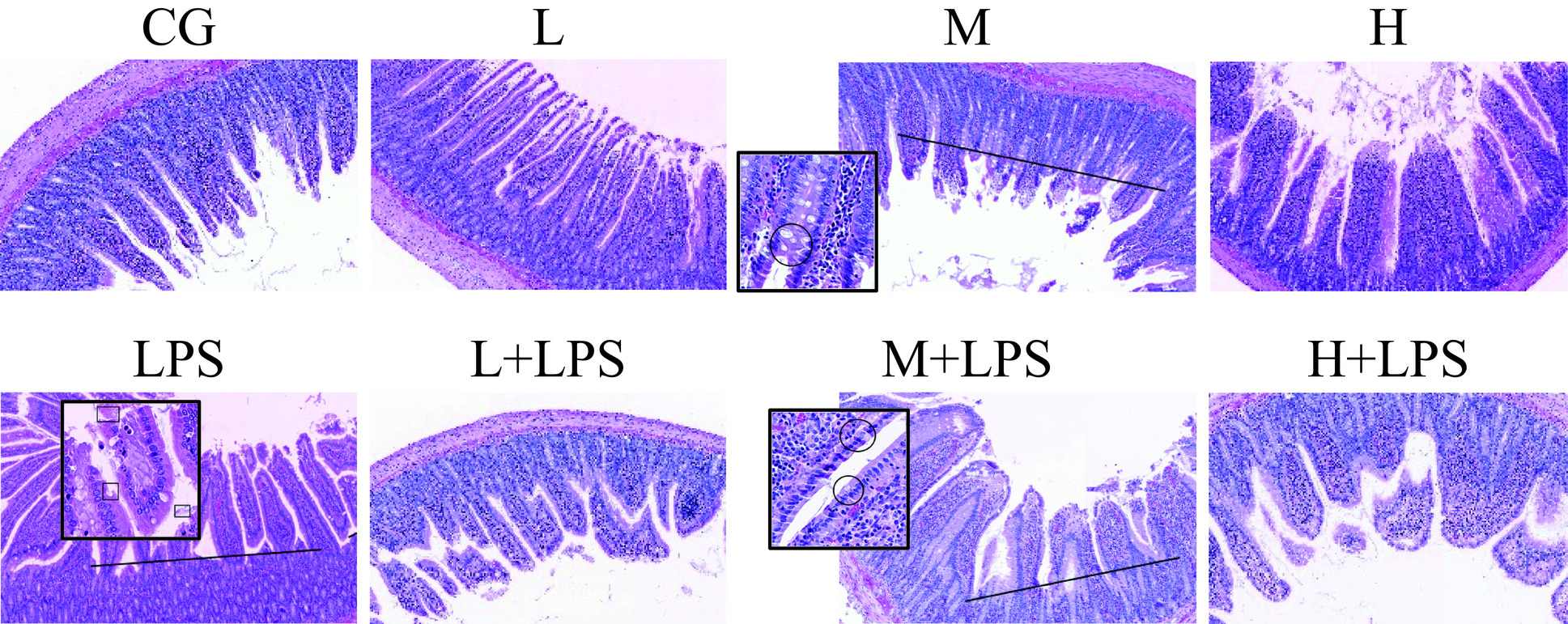
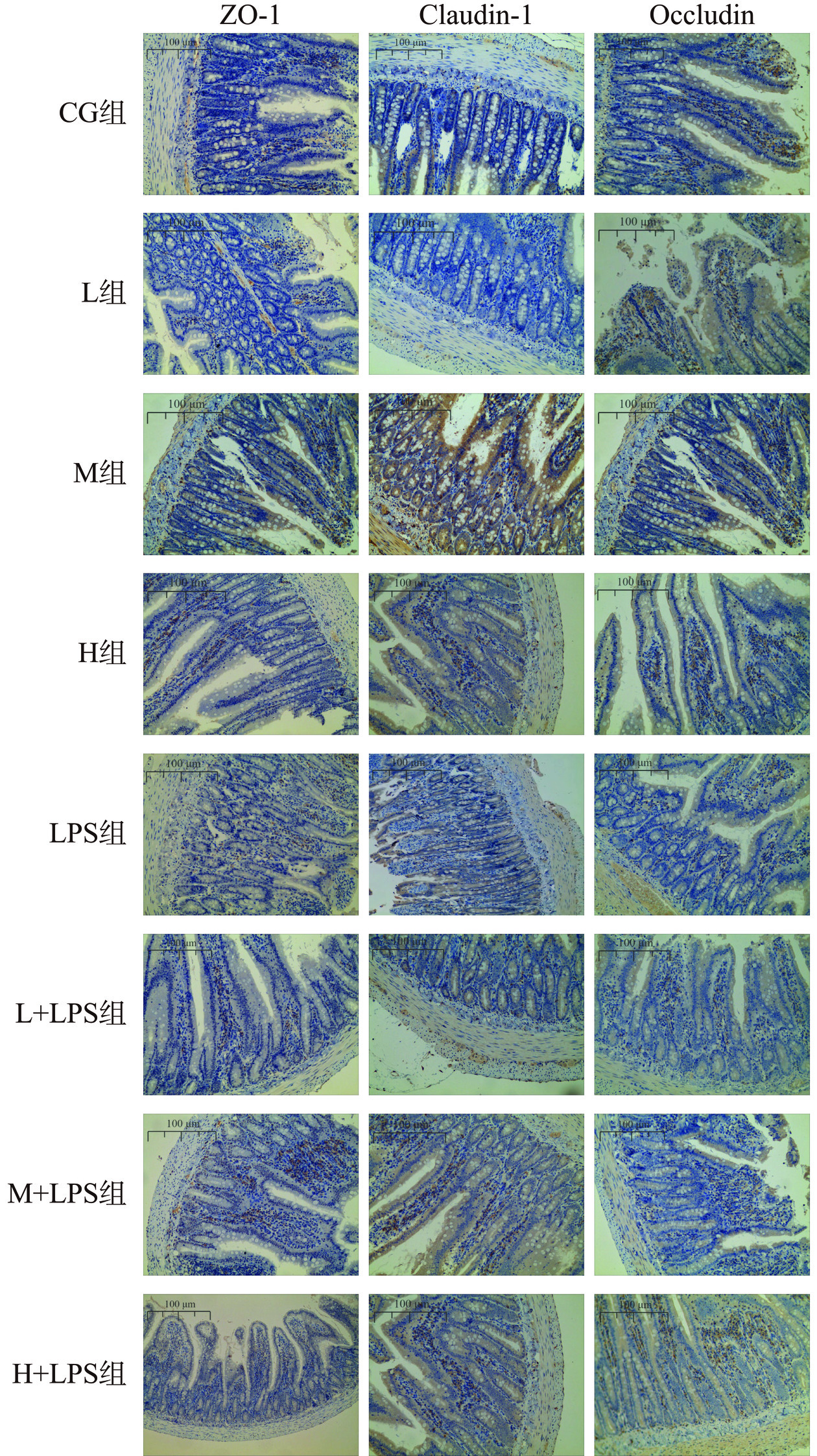
由图4可看出,CG、L、M、H组肠黏膜和细胞形态完整,绒毛整齐完好无断裂,无上皮细胞脱落。LPS组肠绒毛(图中黑色横线处)断裂严重,基层可见水肿且伴有肠黏膜结构受损,肠绒毛上皮细胞脱落伴随杯状细胞减少(图中黑色矩形处)。L+LPS和H+LPS组肠道形态有所转变,M+LPS组相比于LPS组肠道形态差异明显,绒毛断裂明显减少,绒毛结构也相对完整,上皮细胞脱落减少(图中黑色圆圈处)。
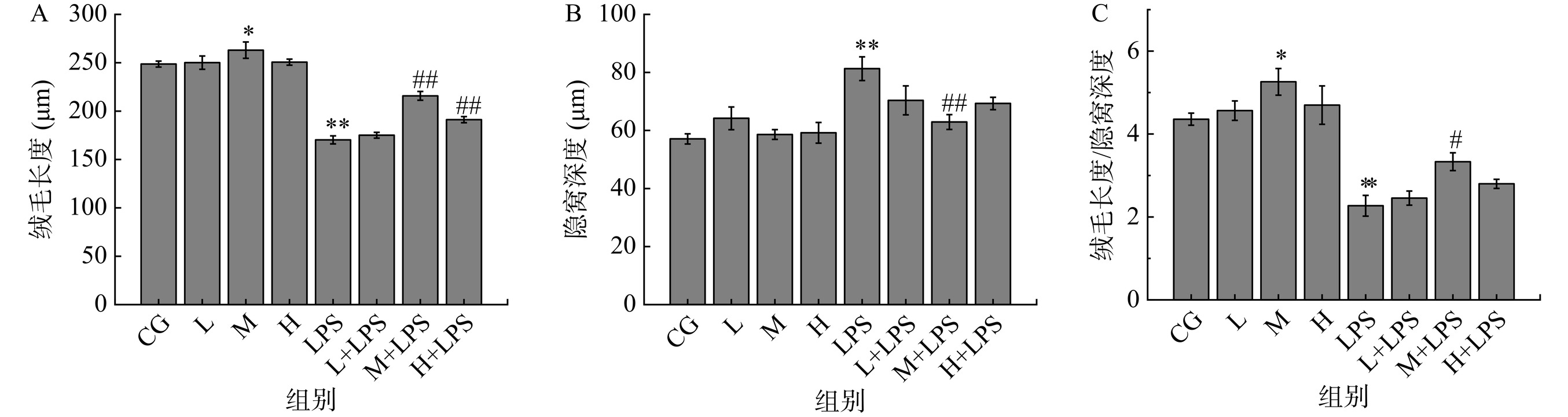
由图5A可看出,与CG组相比,L组和H组大鼠的绒毛长度并没有发生显著改变,而M组的绒毛长度显著增加了5.79%(P<0.05),LPS组大鼠的绒毛长度相比于CG组极显著地下降了31.15%(P<0.01),M+LPS组和H+LPS组的绒毛长度与LPS组相比差异极显著(P<0.01),分别提高了26.69%和9.20%。由图5B可看出,LPS组大鼠的隐窝深度相比于CG组的隐窝深度数值明显升高(P<0.05),增加了42.35%,相比于LPS组,M+LPS组大鼠的隐窝深度变化极其显著,降低了22.61%(P<0.01),其余干预组均无显著影响(P>0.05)。VL和CD的比值在一定程度可反应出小肠的吸收能力,比值下降说明肠道功能异常,吸收能力降低[28]。由图5C可看出,相比于CG组,M组VL/DP比值显著提高了20.68%(P<0.05),LPS组显著下降了47.91%(P<0.01),而M+LPS组相较于LPS组显著增加了46.78%(P<0.01)。
Li等[29]通过脂多糖诱导C57BL/6N小鼠肠屏障损伤,探究乳铁蛋白和骨桥蛋白协同保护作用,其结果表明该组合通过Notch信号促进隐窝细胞增殖和分化,使绒毛长度增加了1.66倍,隐窝深度也降低了1.57倍左右,本研究的结果与之相似。适量的蛋白质摄入会降低小肠的pH,降低小肠的受损风险,从而进一步保护肠道健康,促进消化吸收能力[30−31]。这说明,中剂量B-W双蛋白对小肠绒毛具有一定的保护作用,在肠屏障发生损伤的情况下,对肠道形态的完整性以及小肠的吸收消化功能有一定的缓解。
2.4 双蛋白膳食对紧密连接蛋白表达量的影响
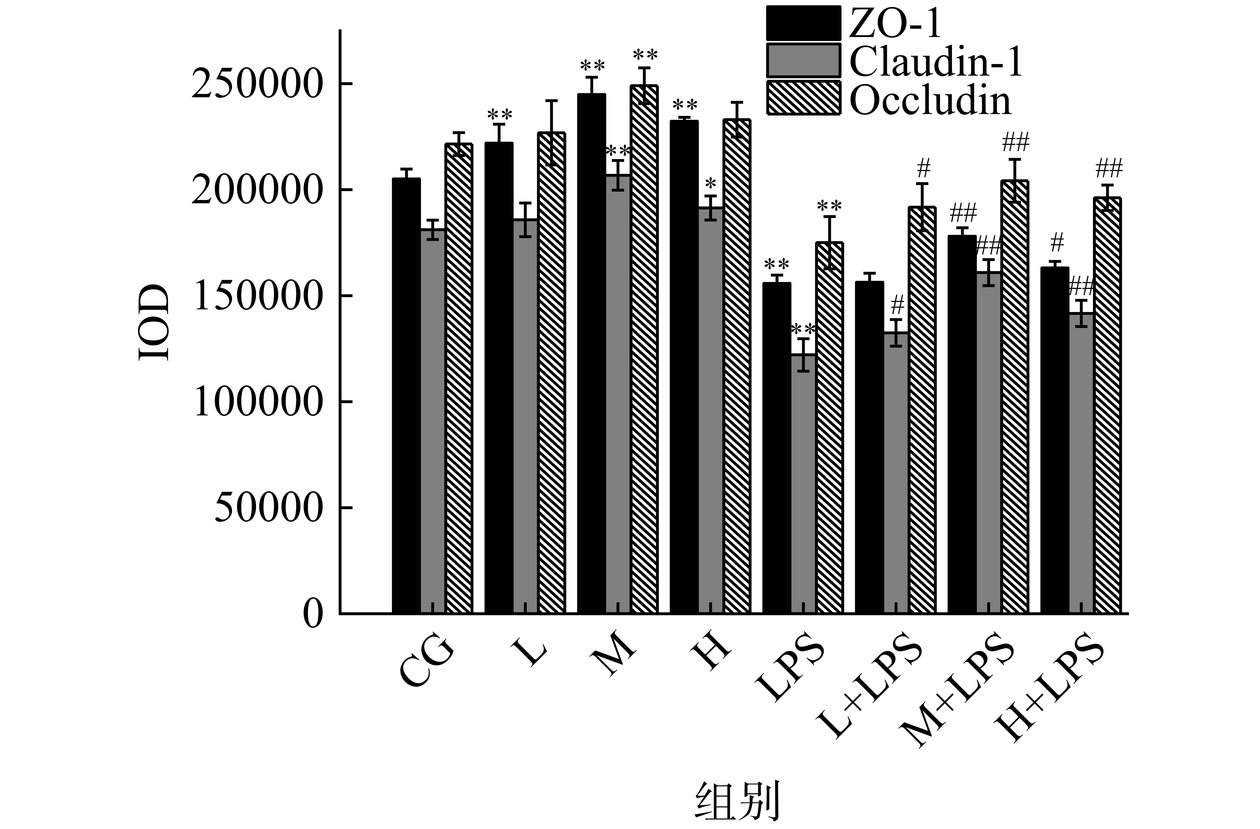
紧密连接蛋白作为肠屏障中机械屏障的基础,由连接粘附分子ZO类蛋白、密封蛋白(Claudin)、闭合蛋白(Occludin)等组成。ZO蛋白负责将肌动蛋白纤维和Claudin、Occludin以及连接粘附分子胞内区连接起来,形成整体,起到了保持上皮细胞完整性作用[32]。由图6和图7可看出,L、M、H组大鼠的ZO-1表达量均极显著高于CG组(P<0.01),其中M组的效果最为明显,升高了19.42%。Arranz等[33]采用乳清蛋白和豌豆蛋白以1:3的比例制成复合蛋白,对其进行体外模拟消化,消化后的蛋白作用于肠道细胞后对其进行检测,结果表明复合蛋白可以通过上调ZO-1和Claudin-1的转录来维持肠屏障的健康,本研究与其结果基本相符。在注射LPS后,LPS组的ZO-1表达量下降了24.06%,极显著低于CG组(P<0.01),与LPS组大鼠相比,L+LPS组差异不显著(P>0.05),H+LPS组表达量升高了4.72%,显著高于LPS组(P<0.05),M+LPS组表达量升高了14.23%,极显著地高于LPS组(P<0.01)。Li等[29]的实验也证明了蛋白质可以调节紧密连接蛋白以改善脂多糖诱导的肠屏障损伤。
Claudin蛋白除维持细胞屏障完整性以外,还对细胞的极性起着至关重要的作用[34],可以预防肿瘤等疾病的发生[35−36]。Occludin蛋白具有调控细胞通透性的作用,是小分子物质的“把控者”,对肠道健康有重要作用[37]。紧密连接蛋白表达量降低意味着肠道通透性的增加,易引起一系列疾病发生。由图6和图7可看出,相比于CG组大鼠,L组大鼠的Claudin-1和Occludin表达量没有显著变化(P>0.05),M组大鼠两种紧密连接蛋白的表达量分别提高了14.20%和12.44%,极显著高于CG组(P<0.01),H组大鼠Claudin-1的表达量提高了5.70%,显著高于CG组(P<0.05),但Occludin的表达量变化不显著(P>0.05);注射LPS后,LPS组大鼠的Claudin-1和Occludin表达量相比于CG组大鼠分别降低了32.57%和20.99%,差异极其显著(P<0.01),与LPS组大鼠相比,L+LPS组大鼠Claudin-1和Occludin的表达量分别增加了8.51%和9.58%,显著高于LPS组(P<0.05),M+LPS组Claudin-1和Occludin的表达量分别增加了31.80%和16.67%;H+LPS组大鼠两种紧密连接蛋白的表达量分别提高了16.01%和12.10%,均极其显著的高于LPS组(P<0.01)。
中剂量的B-W DP均衡地提供了人体所需的多种氨基酸,其中就包括谷氨酸和天冬氨酸,而二者的合成产物谷氨酰胺是肠细胞重要的代谢底物,也是一种非必须氨基酸,有研究表明,其可以对紧密连接蛋白产生特异性作用,从而保持上皮细胞完整,降低肠道通透性[38−39],形成牢固的屏障以抵御外来威胁,维持肠道内微环境的稳定。
2.5 双蛋白膳食对TLR4和MyD88 mRNA表达水平的影响
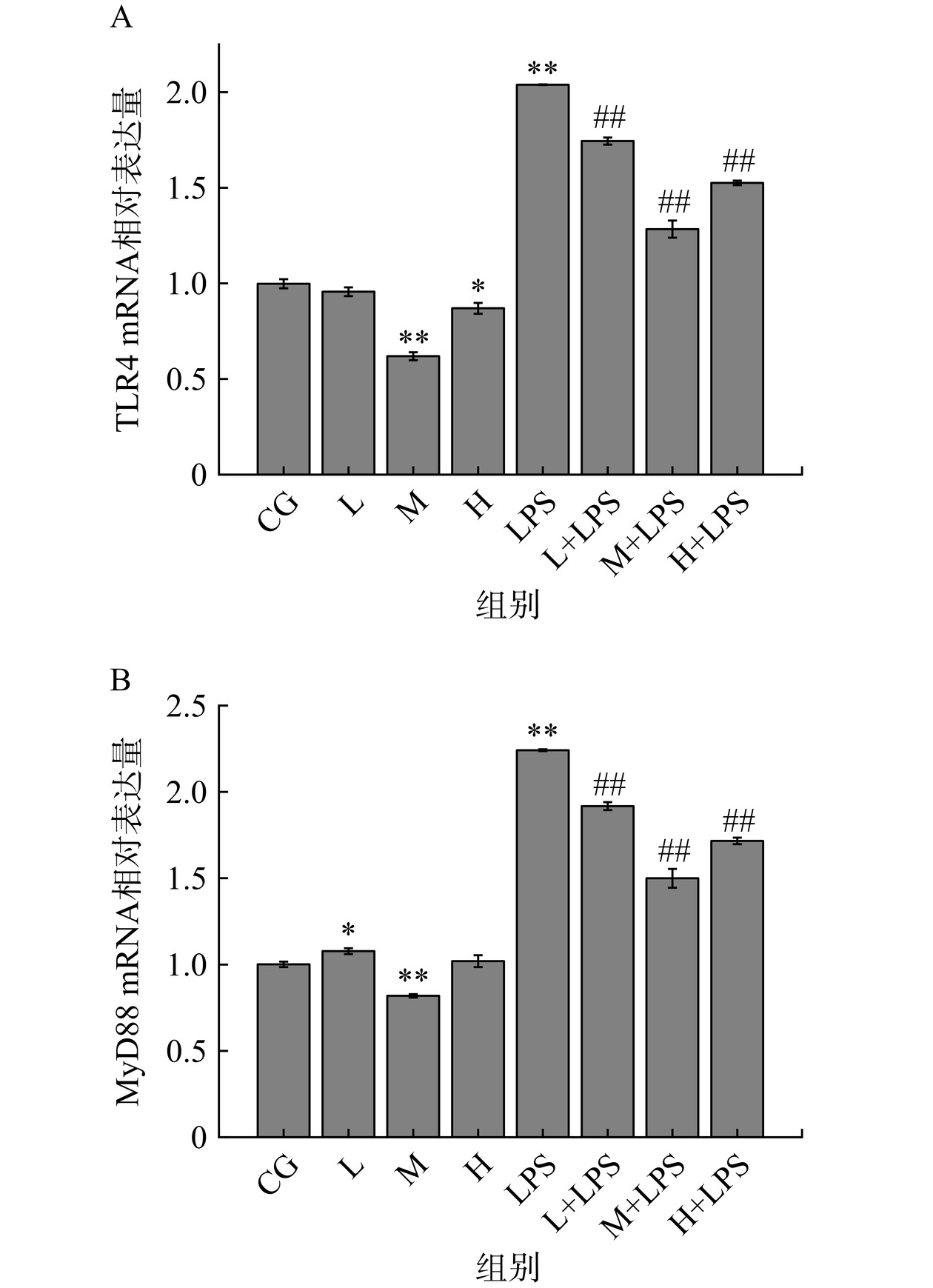
由图8A可看出,在没有注射LPS时,相比于CG组大鼠,L组大鼠TLR4 mRNA的相对表达量差异不显著(P>0.05);M组大鼠TLR4 mRNA的表达水平降低了38.00%,极显著的低于CG组(P<0.01);H组大鼠表达量降低了13.00%,显著低于CG组(P<0.05)。注射LPS后,LPS组大鼠TLR4 mRNA的表达水平极显著高于CG组1.04倍(P<0.01),在B-W 双蛋白膳食的干预下,L+LPS、M+LPS、H+LPS组大鼠的TLR4的表达水平均极显著低于LPS组大鼠(P<0.01),中剂量的效果最为明显,降低了37.25%。
TLR4是LPS诱导引发炎症的关键因子,当LPS进入机体后,脂多糖结合蛋白(LBP)可以识别LPS,与LPS单体结合运送至髓源性细胞表面时CD14与之结合,形成LPS-LBP-CD14三联复合体,随后将其转运至TLR4-MD2蛋白复合体处,在MD-2的帮助下与TLR4结合,激活TLR4。TLR4被激活后,胞内的集团构象发生变化,将信号传入胞内,激活髓样分化因子(MyD88),IL-1R相关蛋白激酶(IRAK)通过MyD88和MyD88转接蛋白类似物聚集到受体复合物中,使IRAK磷酸化激活。随后IRAK从复合物中解离,把信号传给肿瘤坏死因子受体相关因子6(TRAF6),使之活化。观察图8B可知,在没有注射LPS时,M组大鼠MyD88 mRNA的表达水平降低了12.00%,同样极显著地低于CG组(P<0.01)。而LPS介入后,LPS组大鼠的MyD88 mRNA的表达水平高于CG组1.24倍,变化极其显著(P<0.01),相比于LPS组,L+LPS、M+LPS、H+LPS组大鼠MyD88的表达水平同样极显著低于LPS组(P<0.01),中剂量干预的效果最为突出,降低了33.04%。
活化的TRAF6通过激活核因子-κB诱导激酶(NIK)和转化生长因子β活化的激酶(TAK1)进行信号转导,激活相应的NF-κB和丝裂原活化蛋白激酶(MAPK)两条通路。通过这两条通路,最终引起IL-1、IL-6、TNF-α等炎症因子的释放,形成炎症反应。前期课题组实验得出B-W DP能够改善肠道菌群的组成和丰富性,有研究表明肠道内有益的微生物可能对NF-κB通路进行调控,从而抑制炎症反应的发生[40],推测这可能是B-W DP能够起到保护作用的原因之一,另外甘氨酸和天冬氨酸也经研究证明具有调控TLR4等关键因子从而抑制NF-κB通路发生的作用[41−42]。本研究中剂量干预组的TLR4和MyD88的表达量明显降低,这说明中剂量的B-W DP对肠屏障具有一定的预保护作用。
3. 结论
本研究以SD大鼠为试验对象,通过对绒毛长度、隐窝深度、肠道形态、炎症因子含量的测定,确定了LPS对小肠的最佳作用时间为12 h,选用肠段为十二指肠。随后探究了不同剂量B-W DP膳食对脂多糖诱导的肠屏障损伤大鼠的保护作用。试验结果表明不同剂量的B-W双蛋白膳食并不会引起大鼠体重的显著变化;相比于CG组,中剂量B-W DP能够使试验动物VL数值增加6%,VL/DP比值也分别增加21%;使ZO-1、Claduin-1以及Occuldin的表达量,分别增加了19.42%、14.20%、12.44%;同时能够下调TLR4和MyD88的表达量,分别达到38.00%和12.00%。相比于LPS组,中剂量B-W DP能够使试验动物VL数值增加26.69%,CD数值下降22.61%,VL/DP比值升高46.78%;也能降低ZO-1、Claduin-1以及Occuldin的表达量,分别增加了14.23%、31.80%、16.67%;同样对TLR4和MyD88的表达量起到下调作用,二者分别下降了37.25%和33.04%。
实验结果表明中剂量B-W DP膳食能够显著降低LPS对肠道形态的损伤程度;增加紧密连接蛋白表达量,保证肠上皮形态的完整性、极性以及通透性,预防在肠屏障损伤时因其他因素导致更为严重的疾病;能够下调TLR4和MyD88的水平,减缓因LPS带来的肠屏障损伤,发挥预防炎症的作用。由此可知中剂量黑豆-乳清双蛋白对小肠具有一定保护作用,可有效降低肠屏障损伤带来的影响,本试验结果可以为具有肠道保护功效的动-植源双蛋白食品提供理论支撑。
回顾整个试验过程,本研究还缺少B-W DP膳食对于实验动物在健康状态下的作用机制研究,对于B-W DP在体内消化吸收的生理活性方面将是下一步实验重点探索的内容。
-
表 1 不同蛋白来源饲料的配方组成及能量差异(g/100 g)
Table 1 Formula composition and energy difference of feeds from different protein sources (g/100 g)
成分 基础饲料 低剂量B-W
DP饲料中剂量B-W
DP饲料高剂量B-W
DP饲料酪蛋白 20 20 20 20 黑豆蛋白 − 6.7 12.5 20 乳清蛋白 − 13.3 25 40 玉米淀粉 39.75 39.75 39.75 39.75 玉米糊精 13.2 13.2 13.2 13.2 蔗糖 10 10 10 10 大豆油 7 7 7 7 纤维素 5 5 5 5 矿物质 3.5 3.5 3.5 3.5 维生素 1 1 1 1 L-胱氨酸 0.3 0.3 0.3 0.3 氯化胆碱 0.25 0.25 0.25 0.25 特丁基对苯二酚 0.001 0.001 0.001 0.001 能量 1611.55 kJ 1801.31 kJ 1941.08 kJ 2121.32 kJ 表 2 荧光定量PCR引物序列
Table 2 Primer sequence of fluorescence quantitative PCR
基因 上游引物序列(5’-3’段) 下游引物序列(5’-3’段) GAPDH AGACAGCCGCATCTTCTTGT TGATGGCAACAATGTCCACT TLR4 GAGGCAGCAGGTCGAATTGT AGAAGATGTGCCTCCCCAGA MyD88 AGTTCTACCATCAAGGGGGC CGTGCCACTACCTCATGCAA 表 3 LPS注射前后炎症因子含量的变化(ng/L)
Table 3 Changes of inflammatory factors before and after LPS injection (ng/L)
组别 IL-1β IL-6 IL-10 TNF-α 空白组 5.6±1.1d 54.7±2.1c 70.4±7.0d 37.0±2.9c 4 h组 9.8±1.9bc 70.1±7.8bc 81.7±8.5c 49.4±4.8c 8 h组 11.3±1.6b 59.8±5.2b 94.6±4.6b 52.1±5.2a 12 h组 14.0±2.4a 123.7±6.0a 102.4±4.8a 56.1±2.0a 24 h组 9.6±1.2c 54.7±2.4c 92.2±1.6b 48.0±1.2b 注:同列上标不同字母表示差异具有显著性(P<0.05)。 表 4 双蛋白膳食干预期间大鼠体重变化(g)
Table 4 Changes in body weight of rats during the intervention period of double protein diet (g)
组别 初始体重 第9 d体重 第18 d体重 第27 d体重 处死时体重 CG组 198.63±9.63 215.39±11.81 236.56±16.25 265.26±20.23 242.95±18.22 L组 193.83±9.44 213.98±12.21 233.11±13.63 258.15±15.14 238.03±19.40 M组 197.23±9.13 219.14±12.98 235.66±14.77 262.09±18.09 240.35±18.54 H组 196.70±9.83 220.27±14.02 237.16±17.05 262.70±18.83 238.97±18.19 -
[1] 包云丽, 汪哲, 唐海茹, 等. 1990-2019年中国炎症性肠病疾病负担及变化趋势分析[J]. 中国全科医学,2023,26(36):4581−4586. [BAO Y L, WANG Z, TANG H R, et al. Disease burden and variation tendency of inflammatory bowel disease in China from 1990 to 2019[J]. Chinese General Practice,2023,26(36):4581−4586.] BAO Y L, WANG Z, TANG H R, et al. Disease burden and variation tendency of inflammatory bowel disease in China from 1990 to 2019[J]. Chinese General Practice, 2023, 26(36): 4581−4586.
[2] 吴国豪. 肠道屏障功能[J]. 肠外与肠内营养,2004,11(1):44−47. [WU G H. Intestinal barrier function[J]. Parenteral & Enteral Nutrition,2004,11(1):44−47.] doi: 10.3969/j.issn.1007-810X.2004.01.014 WU G H. Intestinal barrier function[J]. Parenteral & Enteral Nutrition, 2004, 11(1): 44−47. doi: 10.3969/j.issn.1007-810X.2004.01.014
[3] ENAUD R, HOOKS B K, BARRE A, et al. Intestinal inflammation in children with cystic fibrosis is associated with crohn’s-like microbiota disturbances[J]. Journal of Clinical Medicine,2019,8(5):645. doi: 10.3390/jcm8050645
[4] ZHANG K Y, HORNEF M W, DUPONT A. The intestinal epithelium as guardian of gut barrier integrity[J]. Cellular Microbiology,2015,17(11):1561−1569. doi: 10.1111/cmi.12501
[5] VANCAMELBEKE, VERMEIRE M, SEVERINE. The intestinal barrier:a fundamental role in health and disease[J]. Expert Review of Gastroenterology & Hepatology,2017,11(7/12):821−834.
[6] 姚鹏, 郝娜. 肠屏障功能与消化系统疾病关系的研究进展[J]. 中国中西医结合外科杂志,2021,27(5):785−787. [YAO P, HAO N. Research progress on the relationship between intestinal barrier function and digestive system diseases[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine,2021,27(5):785−787.] doi: 10.3969/j.issn.1007-6948.2021.05.023 YAO P, HAO N. Research progress on the relationship between intestinal barrier function and digestive system diseases[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine, 2021, 27(5): 785−787. doi: 10.3969/j.issn.1007-6948.2021.05.023
[7] 褚宇瑶, 戴岳. 肠黏膜屏障及其与多种疾病相关性的研究进展[J]. 中国现代医药杂志,2020,22(7):102−105. [CHU Y Y, DAI Y. Research progress of intestinal mucosal barrier and its correlation with many diseases[J]. Modern Medicine Journal of China,2020,22(7):102−105.] CHU Y Y, DAI Y. Research progress of intestinal mucosal barrier and its correlation with many diseases[J]. Modern Medicine Journal of China, 2020, 22(7): 102−105.
[8] NAGPAL R, YADAV H, et al. Bacterial translocation from the gut to the distant organs:An overview[J]. Annals of Nutrition & Metabolism,2017,71(Suppl.1):11−16.
[9] SUPAJATURA V, USHIO H, NAKAO A, et al. Differential responses of mast cell Toll-like receptors 2 and 4 in allergy and innate immunity[J]. Journal of Clinical Investigation,2002,109(10):1351−1359. doi: 10.1172/JCI0214704
[10] DEGUINE J, BARTON M G. MyD88:A central player in innate immune signaling[J]. F1000 Prime Reports,2014,6:97.
[11] LI R N, HONG P, ZHENG X. β-carotene attenuates lipopolysaccharide-induced inflammation via inhibition of the NF-κB, JAK2/STAT3 and JNK/p38 MAPK signaling pathways in macrophages[J]. Animal Science Journal,2019,90(1):140−148. doi: 10.1111/asj.13108
[12] NAVIS M, MUNCAN V, SANGILD T P, et al. Beneficial effect of mildly pasteurized whey protein on intestinal integrity and innate defense in preterm and near-term piglets[J]. Nutrients,2020,12(4):1125−1125. doi: 10.3390/nu12041125
[13] 李云亮, 刘晓霜, 徐雅宣, 等. 乳清蛋白在临床肠内营养中的应用进展[J]. 中国乳品工业,2023,51(7):45−51. [LI Y L, LIU X S, XU Y X, et al. Progress in the application of whey protein in clinical enteral nutrition[J]. China Dairy Industry,2023,51(7):45−51.] LI Y L, LIU X S, XU Y X, et al. Progress in the application of whey protein in clinical enteral nutrition[J]. China Dairy Industry, 2023, 51(7): 45−51.
[14] 蔡东联, 曹翔, 李燕, 等. 大豆蛋白抗辐射对肠屏障的损害[J]. 中国临床营养杂志,2001,9(3):16−19. [CAI D L, CAO X, LI Y, et al. Alleviating radiation damage and protecting the bowel barrier functio n in SD rat by using the soybean protein[J]. Chinese Journal of Clinical Nutrition,2001,9(3):16−19.] CAI D L, CAO X, LI Y, et al. Alleviating radiation damage and protecting the bowel barrier functio n in SD rat by using the soybean protein[J]. Chinese Journal of Clinical Nutrition, 2001, 9(3): 16−19.
[15] 蒲玲玲, 郭长江. 乳清蛋白的组成及其主要保健功能[J]. 中国食物与营养,2011,17(6):68−70. [PU L L, GUO C J. Composition of whey protein and its main health care function[J]. Food and Nutrition in China,2011,17(6):68−70.] PU L L, GUO C J. Composition of whey protein and its main health care function[J]. Food and Nutrition in China, 2011, 17(6): 68−70.
[16] ZHAO X, XU X X, LIU Y, et al. The in vitro protective role of bovine lactoferrin on intestinal epithelial barrier[J]. Molecules,2019,24(1):148. doi: 10.3390/molecules24010148
[17] 张亮. 大豆异黄酮降脂作用及其机制研究[D]. 延边:延边大学, 2014. [ZHANG L. Study on lipid-lowering effect of soybean isoflavone and its mechanism[D]. Yanbian:Yanbian University, 2014.] ZHANG L. Study on lipid-lowering effect of soybean isoflavone and its mechanism[D]. Yanbian: Yanbian University, 2014.
[18] 张翠芬. 大豆异黄酮对心血管疾病的研究综述[J]. 中国食品添加剂,2018(9):210−213. [ZHANG C F. Research review of soybean isoflavones on cardiovascular diseases[J]. China Food Additives,2018(9):210−213.] ZHANG C F. Research review of soybean isoflavones on cardiovascular diseases[J]. China Food Additives, 2018(9): 210−213.
[19] 梁得福, 孟维洪, 舒欣, 等. 黑豆-乳清双蛋白膳食对大鼠体内免疫的调节作用[J]. 现代食品科技, 2024, 40(1):1−9. [LIANG D F, MENG W H, SHU X, et al. Regulatory effect of black bean-whey double protein diet on immunity in rats[J]. Modern Food Science & Technology, 2021, 40(1):1−9.] LIANG D F, MENG W H, SHU X, et al. Regulatory effect of black bean-whey double protein diet on immunity in rats[J]. Modern Food Science & Technology, 2021, 40(1): 1−9.
[20] ZHUANG K J, MENG W H, SHU X, et al. Fecal metabonomics combined with 16S rDNA sequencing to analyze the changes of gut microbiota in rats fed with different protein source diets[J]. European Journal of Nutrition,2023,62(6):2687−2703. doi: 10.1007/s00394-023-03168-y
[21] 杨轶仑, 路晓光. 肠道菌群与肠黏膜机械屏障关系研究进展[J]. 内蒙古医学杂志,2019,51(10):1195−1197. [YANG Y L, LU X G. Research progress on the relationship between intestinal flora and intestinal mucosal mechanical barrier[J]. Inner Mongolia Medical Journal,2019,51(10):1195−1197.] YANG Y L, LU X G. Research progress on the relationship between intestinal flora and intestinal mucosal mechanical barrier[J]. Inner Mongolia Medical Journal, 2019, 51(10): 1195−1197.
[22] 杨宇. β-胡萝卜素对脂多糖诱导的大鼠肠道炎症反应的调节作用及分子机理研究[D]. 长春:吉林农业大学, 2021. [YANG Y. Regulation of β-carotene on the rat intestinal inflammation induced by lipopolysaccharide and its molecular mechanisms[D]. Changchun:Jilin Agricultural University, 2021.] YANG Y. Regulation of β-carotene on the rat intestinal inflammation induced by lipopolysaccharide and its molecular mechanisms[D]. Changchun: Jilin Agricultural University, 2021.
[23] 赵伟, 孙国志. 不同种实验动物间用药量换算[J]. 畜牧兽医科技信息,2010(5):52−53. [ZHAO W, SUN G Z. Conversion of dosage between different experimental animals[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine,2010(5):52−53.] ZHAO W, SUN G Z. Conversion of dosage between different experimental animals[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2010(5): 52−53.
[24] 周荣荣, 庄柯瑾, 许庆鹏, 等. 优质豆类蛋白筛选及其与乳清蛋白最佳复配比例的研究[J]. 中国粮油学报,2022,37(5):93−101. [ZHOU R R, ZHUANG K J, XU Q P, et al. Study on screening of high-quality legume protein and the optimum mixing ratio with whey protein[J]. Journal of the Chinese Cereals and Oils Association,2022,37(5):93−101.] ZHOU R R, ZHUANG K J, XU Q P, et al. Study on screening of high-quality legume protein and the optimum mixing ratio with whey protein[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(5): 93−101.
[25] AZKANAZ M, COROMINAS-MURTRA B, ELLENBROEK T J S, et al. Retrograde movements determine effective stem cell numbers in the intestine[J]. Nature,2022,607(Jul.21):548−554.
[26] WANG Z, QU Y J, CUI M. Modulation of stem cell fate in intestinal homeostasis, injury and repair.[J]. World Journal of Stem Cells,2023,15(5):354−368. doi: 10.4252/wjsc.v15.i5.354
[27] 王涛, 季珊珊, 汤鑫磊, 等. 大豆和猪肉来源的高蛋白饮食对肥胖小鼠的干预作用及肠道菌群的影响[J/OL]. 食品科学技术学报:1−13[2024-11-05]. DOI:10.1151.ts.20240125.1932.002. [WANG T, JI S S, TANG X L, et al. Intervention and intestinal microflora effects of soybean and pork high-protein diets on obese mice[J/OL]. Journal of Food Science and Technology:1−13[2024-11-05]. DOI:10.1151.ts.20240125.1932.002.html.] WANG T, JI S S, TANG X L, et al. Intervention and intestinal microflora effects of soybean and pork high-protein diets on obese mice[J/OL]. Journal of Food Science and Technology: 1−13[2024-11-05]. DOI: 10.1151.ts.20240125.1932.002.html.
[28] ZHANG Z, LU W J, LIU P F, et al. Microbial modifications with Lycium barbarum L. oligosaccharides decrease hepatic fibrosis and mitochondrial abnormalities in mice[J]. Phytomedicine:International Journal of Phytotherapy and Phytopharmacology,2023,120:155068. doi: 10.1016/j.phymed.2023.155068
[29] LI C G, SUN Y N, HE T C, et al. Synergistic effect of lactoferrin and osteopontin on intestinal barrier injury[J]. International Journal of Biological Macromolecules,2023,253(P7):127416−127416.
[30] 胡光源, 赵峰, 张宏福, 等. 饲粮蛋白质来源与水平对生长猪空肠液组成的影响[J]. 动物营养学报,2010,22(5):1220−1225. [HU G Y, ZHAO F, ZHANG H F, et al. Effects of the source and level of dietary protein on the composition of jejunal fluid in growing pigs[J]. Chinese Journal of Animal Nutrition,2010,22(5):1220−1225.] HU G Y, ZHAO F, ZHANG H F, et al. Effects of the source and level of dietary protein on the composition of jejunal fluid in growing pigs[J]. Chinese Journal of Animal Nutrition, 2010, 22(5): 1220−1225.
[31] GAO J, YIN J, XU K, et al. Protein level and infantile diarrhea in a postweaning piglet model[J]. Mediators of Inflammation,2020,2020:1937387.
[32] BEUTEL O, MARASPINI R, POMBO-GARCIA K, et al. Phase separation of zonula occludens proteins drives formation of tight junctions[J]. Cell,2019,179(4):923−936. doi: 10.1016/j.cell.2019.10.011
[33] ARRANZ E, SEGAT A, VELAYOS G, et al. Dairy and plant based protein beverages:In vitro digestion behaviour and effect on intestinal barrier biomarkers[J]. Food Res Int, 2023, 169:112815.
[34] DIAS C M, COISNE C, LAZAREVIC I, et al. Publisher correction:claudin-3-deficient C57BL/6J mice display intact brain barriers[J]. Scientific Reports,2019,9(1):1. doi: 10.1038/s41598-018-37186-2
[35] SOUZA D F W, FORTUNATO-MIRANDA N, ROBBS K B, et al. Claudin-3 overexpression increases the malignant potential of colorectal cancer cells:roles of ERK1/2 and PI3K-Akt as modulators of EGFR signaling[J]. PLoS ONE,2017,8(9):e74994.
[36] TANAKA H, IMASATO M, YAMAZAKI Y, et al. Claudin-3 regulates bile canalicular paracellular barrier and cholesterol gallstone core formation in mice[J]. Journal of Hepatology:The Journal of the European Association for the Study of the Liver,2018,69(6):1308−1316.
[37] 邢晓辉, 李力仙, 郭天林, 等. Occludin蛋白与细胞间紧密连接关系及其临床意义[J]. 现代生物医学进展,2015,15(8):1553−1555,1405. [XING X H, LI L X, GUO T L, et al. Relationship between Occludin protein and tight junction between cells and its clinical significance[J]. Progress in Modern Biomedicine,2015,15(8):1553−1555,1405.] XING X H, LI L X, GUO T L, et al. Relationship between Occludin protein and tight junction between cells and its clinical significance[J]. Progress in Modern Biomedicine, 2015, 15(8): 1553−1555,1405.
[38] BEUTHEU S, GHOUZALI I, GALAS L, et al. Glutamine and arginine improve permeability and tight junction protein expression in methotrexate-treated Caco-2 cells[J]. Clin Nutr,2013,32(5):863−869. doi: 10.1016/j.clnu.2013.01.014
[39] AMEHO C K, ADJEI A A, HARRISON E K, et al. Prophylactic effect of dietary glutamine supplementation on interleukin 8 and tumour necrosis factor alpha production in trinitrobenzene sulphonic acid induced colitis[J]. Gut,1997,41(4):487−493. doi: 10.1136/gut.41.4.487
[40] 胡天念. 罗伊氏乳杆菌SBC5-3对肠上皮细胞的免疫调节机制研究[D]. 昆明:云南农业大学, 2023. [HU T N. Study on Immunomodulatory mechanism of Lactobacillus reuteri SBC5-3 on intestinal epithelial cells[D]. Kunming:Yunnan Agricultural University, 2023.] HU T N. Study on Immunomodulatory mechanism of Lactobacillus reuteri SBC5-3 on intestinal epithelial cells[D]. Kunming: Yunnan Agricultural University, 2023.
[41] 吴欢听. 甘氨酸对脂多糖刺激的仔猪肠道损伤及肌肉蛋白质合成和降解的调控作用[D]. 武汉:武汉轻工大学, 2015. [WU H T. Regulative effect of glycine on intestinal injury and muscle protein sythesis and degradation of piglets after lipopolysaccharide challenge[D]. Wuhan:Wuhan Polytechnic University, 2015.] WU H T. Regulative effect of glycine on intestinal injury and muscle protein sythesis and degradation of piglets after lipopolysaccharide challenge[D]. Wuhan: Wuhan Polytechnic University, 2015.
[42] LENG W B, LIU Y L, SHI H F, et al. Aspartate alleviates liver injury and regulates mRNA expressions of TLR4 and NOD signaling-related genes in weaned pigs after lipopolysaccharide challenge[J]. The Journal of Nutritional Biochemistry,2014,25(6):592−599. doi: 10.1016/j.jnutbio.2014.01.010
-
期刊类型引用(1)
1. 舒欣,孟维洪,谢文静,张东杰,王鹤霖,富天昕,庄柯瑾. 黑豆-乳清双蛋白对大鼠十二指肠屏障和肝损伤的保护作用. 食品工业科技. 2025(05): 355-363 .  本站查看
本站查看
其他类型引用(0)





 下载:
下载:
 下载:
下载:



