Preparation of Plasma Active Water and Its Effect on Storage Quality of Fresh Beef
-
摘要: 为研究等离子体活性水(PAW)喷淋处理对生鲜牛肉贮藏期间品质特性的影响,本文利用介质阻挡等离子体(DBD-CP)制备PAW,检测不同处理时间条件下PAW中特定活性氧氮自由基浓度的变化规律,通过分析贮藏期(4 ℃,贮藏7 d)牛肉中微生物数量、a*值、pH和挥发性盐基氮(TVB-N)值的变化趋势,评估PAW对生鲜牛肉贮藏期品质的影响。结果表明,随着DBD处理时间的增加,PAW中活性氧浓度均显著上升(P<0.05)。但处理时间超过5 min后,亚硝酸盐浓度下降,可能是由于H2O2浓度增加限制了亚硝酸盐的生成和转化。同时发现PAW处理能显著(P<0.05)抑制牛肉中菌落总数、大肠杆菌及假单胞菌的数量。其中,4、5、6 min制备的PAW组(T4、T5、T6)抑菌表现最好,在贮藏7 d后菌落总数分别下降1.58、1.72和1.82 lg CFU/g,大肠杆菌总数下降0.59、0.60、0.72 lg CFU/g,假单胞菌总数下降0.88、1.03和1.10 lg CFU/g;PAW能减缓肉品pH、TVB-N的升高,T4~T6组pH和TVB-N值在贮藏期内均显著低于CK组(P<0.05);T5和T6组由于氧化程度较高,其肉品a*值在贮藏期内均显著(P<0.05)低于CK组,T4组在贮藏后期a*值升高,第5 d后显著高于CK组(P<0.05)。综合考虑,T4组不仅能有效抑制微生物生长,且能延缓牛肉理化指标及a*值的劣变,具有良好的保鲜效果。本研究可为PAW在生鲜牛肉贮藏保鲜中的应用提供参考依据。Abstract: To study the effects of plasma active water (PAW) spray treatment on quality characteristics of fresh beef during storage, PAW was prepared by dielectric barrier plasma (DBD-CP). The concentration changes of specific reactive oxygen species and reactive nitrogen species in PAW prepared with different treatment time were detected. And the effects of PAW on fresh-keeping quality of fresh beef during storage were evaluated by analyzing the changes of microbial quantity, a* value, pH and total volatile base nitrogen (TVB-N) value during storage (4 ℃, stored for 7 d). The results showed that with the increase of DBD treatment time, the concentration of reactive oxygen species in PAW was significantly increased (P<0.05). However, after the treatment time exceeded 5 min, the nitrite concentration decreased, possibly because the increase of H2O2 concentration limited the generation and transformation of nitrite. It was found that PAW treatment could significantly inhibit the total number of colonies, the growth of Escherichia coli and pseudomonas in fresh beef. Among them, PAW group prepared in 4, 5 and 6 min (T4, T5, T6) group had the best antibacterial performance. After 7 d of storage, the total number of colonies decreased by 1.58, 1.72 and 1.82 lg CFU/g, the total number of Escherichia coli decreased by 0.59, 0.60 and 0.72 lg CFU/g, and the total number of pseudomonas decreased by 0.88, 1.03 and 1.10 lg CFU/g, respectively. In addition, PAW could slow down the increase of pH and TVB-N of meat products, and the pH and TVB-N values in T4~T6 group were significantly lower than those in CK group during storage (P<0.05). However, due to the high degree of oxidation, a* value of meat in T5 and T6 groups was significantly lower than that in CK group during the whole storage period (P<0.05), while a* value in T4 group increased at the late storage stage, and was significantly higher than that in CK group after the 5th day (P<0.05). Comprehensive consideration, T4 group could not only effectively inhibit the reproduction of microorganisms, but also delay the deterioration of physical and chemical indexes and a* value, that had a good fresh-keeping effect. This study can provide reference for the application of PAW in fresh beef storage and preservation.
-
Keywords:
- plasma activated water /
- fresh beef /
- free radicals /
- microorganism /
- quality
-
牛肉富含人体所需的各种营养物质,且牛肉蛋白质的各种氨基酸的比例与人体氨基酸组成基本一致。但丰富的营养使其容易繁殖积累微生物,加速牛肉品质劣变,因此在生鲜牛肉储运过程中的安全问题成为消费者和生产者关注的焦点[1]。鉴于传统的热杀菌方式存在破坏产品营养及感官品质的缺点,寻找新兴有效的非热杀菌方式来延长产品货架期成为研究的热点。
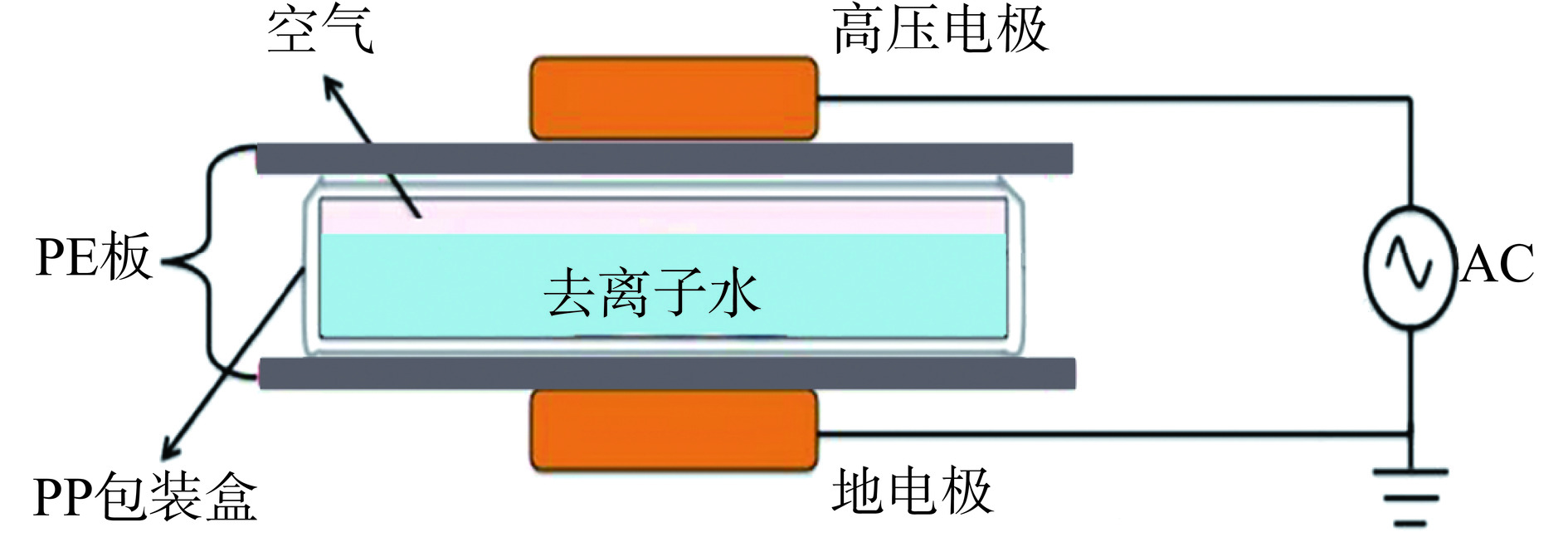
低温等离子体(Cold plasma,CP)是一种新型的非热杀菌技术。当CP处理水溶液时,会在溶液中产生大量的活性氧(ROS)和活性氮(RNS)自由基,使溶液具有较强的杀菌能力,这种等离子体溶液被称为等离子体活性水(Plasma active water,PAW),被证明对大多数热敏食品具有良好抑菌作用的同时能保持产品的感官品质[2]。介质阻挡放电低温等离子体(DBD-CP)由两个电极组成,其中至少有一个电极被绝缘阻挡材料覆盖[3]。DBD-CP由于操作简单,常被用来制备PAW(图1),通过在液体表面放电,击穿气体产生活性物质,随后活性物质与水溶液反应产生其他活性成分[4]。它们的生命周期从几纳秒到几天,例如过氧化氢(H2O2)在气液界面的半衰期是1 ms,而在液体中H2O2的半衰期是8 h~20 d[5]。近年来,研究人员开始关注PAW在肉品保鲜中的应用,Zhao等[6]利用PAW间隔不同时间喷淋生鲜牛肉并于4 ℃下贮藏,发现间隔24 h后牛肉表面菌落总数减少3.1 lg CFU/g。Qian等[7]也发现PAW处理对鸡肉表面的沙门氏菌和细菌均有显著抑制效果,同时不会破坏鸡肉的感观品质和蛋白质构成。
细菌是导致生鲜牛肉腐败的主要微生物,其中优势腐败菌的形成与肉的贮藏条件密切相关,有氧条件下多为假单胞菌及肠杆菌[8],随着贮藏时间的延长,生鲜牛肉中优势腐败菌逐渐占据主导地位。顾春涛等[9]分析了冷鲜牛肉贮藏过程中菌相组成的变化,发现贮藏初期菌群构成复杂,主要由热死环丝菌、嗜冷菌、假单胞菌、气单胞菌等微生物组成,随着冷藏期的延长,假单胞菌属和热死环丝菌超过90%。Reid等[10]也证明了牛肉在低温有氧贮藏末期假单胞菌和热死环丝菌是主要腐败菌。Ercolini等[11]研究发现牛肉在低温条件下普通和气调包装的优势生长腐败菌分别为假单胞菌和乳酸杆菌。因此,本文探讨PAW处理对牛肉贮藏期间腐败菌的影响时,选择假单胞菌属为研究对象。
本研究使用DBD-CP制备PAW,分析PAW在制备过程中主要自由基的变化规律,并利用不同的PAW喷淋处理生鲜牛肉,研究PAW处理对生鲜牛肉贮藏期间保鲜品质的影响,为后期PAW喷淋杀菌应用于生鲜牛肉保鲜工业化提供一定理论依据。
1. 材料与方法
1.1 材料与仪器
新鲜牛肉里脊 当天购自当地市场,碎冰贮藏1 h内送至实验室。在实验室无菌条件下剔除脂肪,剪切成5 cm×5 cm×2 cm的肉块,用PAW处理后放在无菌均质袋中,置于冰箱4 ℃储藏;PE板 东莞市信达塑胶绝缘材料有限公司;聚酰胺/聚乙烯复合膜 青岛赛诺新材料有限公司;平板计数琼脂、伊红美蓝琼脂、假单胞菌CFC培养基、LB(Luria-Bertani)液体培养基 青岛海博生物技术有限公司;Hydrogen Peroxide Assay试剂盒 艾博抗(上海)贸易有限公司;单线态氧荧光探针 赛默飞世尔科技公司;NaNO2标准溶液、磺胺、N-(1-萘基)-乙二胺盐酸盐 美国Sigma公司。
AY120型电子天平 上海民桥精密仪器有限公司;Testo 230多功能pH计 Lenzkirch公司;DBD等离子体发生器 南京苏曼等离子科技有限公司;UV5紫外可见分光光度计 瑞士梅特勒-托利多国际有限公司;SPARK多功能酶标仪 帝肯(上海)试验器材有限公司;CR-400色彩色差计 柯尼卡美能达有限公司;MAP-H360复合气调保鲜包装机 苏州森瑞保鲜设备有限公司;恒温培养摇床 上海一恒科学仪器有限公司;MT-30K-8高速匀浆机 博科勒生物科技(上海)有限公司。
1.2 实验方法
1.2.1 PAW制备
在聚丙烯包装盒中(188 mm×132 mm×38 mm,透氧率:12 cm3/m2/24 h,透水率:12 g/m2/24 h)加入100 mL去离子水,使用聚酰胺/聚乙烯复合膜热封包装,空气为介质气体,将包装盒放在DBD上下电极中间进行处理,电极由聚乙烯作为介质阻挡材料,聚乙烯板与包装盒距离为2 mm。制备好的PAW溶液于4 ℃冰箱冷藏,当天内使用。其中处理电压为60 kV、处理时间为1~6 min。
1.2.2 PAW制备过程中ROS和RNS变化
分别测定不同制备时间的PAW溶液(0、1、2、3、4、5、6 min)H2O2、单线态氧、羟基自由基、亚硝酸盐含量的变化。
1.2.2.1 H2O2含量测定
采用试剂盒测定PAW制备过程中H2O2含量的变化。在检测孔内加入50 μL样品,随后在每个孔内加入100 μL H2O2检测试剂。振荡后在室温放置30 min。随后在A560 nm处测定吸光值。根据标准曲线计算样品中H2O2浓度。标准曲线以H2O2标准稀释液绘制[12]。
1.2.2.2 单线态氧测定
采用单线态氧荧光探针(SOSG)测定PAW中单线态氧的含量。SOSG储存液制备:用甲醇制备储存液,每100 µg粉末加入33 µL甲醇制备5 mmol/L储存液。在CP处理溶液时,加入SOSG溶液,含SOSG(1 µmol/L)和亚甲基蓝(10 µmol/L)溶于100 mmol/L pH7.5 Tris Buffer;单线态氧清除剂叠氮钠(NaN3,1 mmol/L),每20 s完成一次荧光测定,每次测定间隔30 s。利用荧光光度计在激发波长488 nm和发射波长525 nm时测定荧光强度[13]。
1.2.2.3 羟基自由基含量测定
采用对苯二甲酸钠盐作为捕捉剂测定样品中羟基自由基含量。CP处理溶液后,体系产生的羟基自由基与对苯二甲酸纳盐反应生成2-羟基对苯二甲酸(HTA)在激发波长315 nm和发射波长425 nm的条件下测定其荧光强度。然后再将测得的HTA浓度换算成羟基自由基浓度[14]。
1.2.2.4 亚硝酸盐含量测定
根据Luo等[15]的方法稍加修改测定,采用分光光度法测定PAW中亚硝酸盐的含量。CP处理后,立即将100 mL 10 g/L磺胺与10 mL PAW溶液在室温下混合3 min,充分混合的溶液与100 mL 1.0 g/L N-(1-萘基)-乙二胺盐酸盐反应20 min。完全溶解后在540 nm处利用分光光度计测定吸光度值计算PAW中亚硝酸盐浓度。
1.2.3 PAW处理牛肉
采用去离子水(Deionized water,DW)作为对照,分别使用PAW和去离子水在超净工作台内对生鲜牛肉样品进行喷淋,喷淋量为50 mL,沥干后平铺于聚丙烯包装盒(188 mm×132 mm×38 mm)上,进行空气密封包装,包装膜材料为聚酰胺/聚乙烯复合膜。
1.2.4 贮藏期试验
将包装后的样品分为7组,每组处理条件分别如下:
CK组:使用DW喷淋样品,处理完成后于超净台内沥干,再装入包装盒中。
PAW处理组:不同制备时间的PAW喷淋样品,处理完成后于超净台内沥干,再装入包装盒中,按PAW制备时间不同分组。
T1:PAW制备时间为1 min;T2:PAW制备时间为2 min;T3:PAW制备时间为3 min;T4:PAW制备时间为4 min;T5:PAW制备时间为5 min;T6:PAW制备时间为6 min。
处理后的样品贮藏于4 ℃的冰箱中,并于贮藏期的第 1、3、5、7 d进行取样,检测相关指标。
1.2.5 PAW处理对牛肉品质的影响
1.2.5.1 微生物的测定
参照国标GB/T 9695.19-2008食品安全国家标准 肉与肉制品取样方法[16],在无菌条件下,取10 g牛肉加入90 mL生理盐水,均质器拍打2 min后,制备1:10稀释液,然后逐步稀释。菌落总数按照GB 4789.2-2016食品安全国家标准 食品微生物学检验与菌落总数测定方法进行[17];假单胞菌总数参照张玉华等[18]的方法培养计数;大肠杆菌总数参照GB 4789.38-2012食品安全国家标准 食品微生物学检验 大肠埃希氏菌计数的方法[19]进行。实验结果用lg CFU/g表示。
1.2.5.2 pH的测定
取5 g牛肉样品,在20 mL去离子水中10000 r/min匀浆3min后,使用pH计测定匀浆pH。
1.2.5.3 红度值(a*)值的测定
使用色差仪测定样品贮藏期内表面色泽变化。使用标准白色瓷砖校准后,将探头(孔径为8 mm)垂直于样品表面,每个样品随机取3个点进行测量,结果取平均值。
1.2.5.4 挥发性盐基氮(TVB-N)的测定
肉样挥发性盐基氮的测定按照国标GB 5009.228-2016食品安全国家标准 食品中挥发性盐基氮的测定采用自动凯氏定氮仪法进行[20],挥发性盐基氮结果表达为mg/100 g。
1.3 数据处理
所有试验都随机抽取3个重复(n=3)进行指标分析。使用Origin 8.5软件对数据作图。试验数据用SPSS 19.0统计软件进行单因素方差分析(ANOVA),利用Duncan多重比较法对不同均值之间进行差异显著性检验(P<0.05)。
2. 结果与分析
2.1 PAW制备过程中ROS和RNS的变化
2.1.1 H2O2含量变化
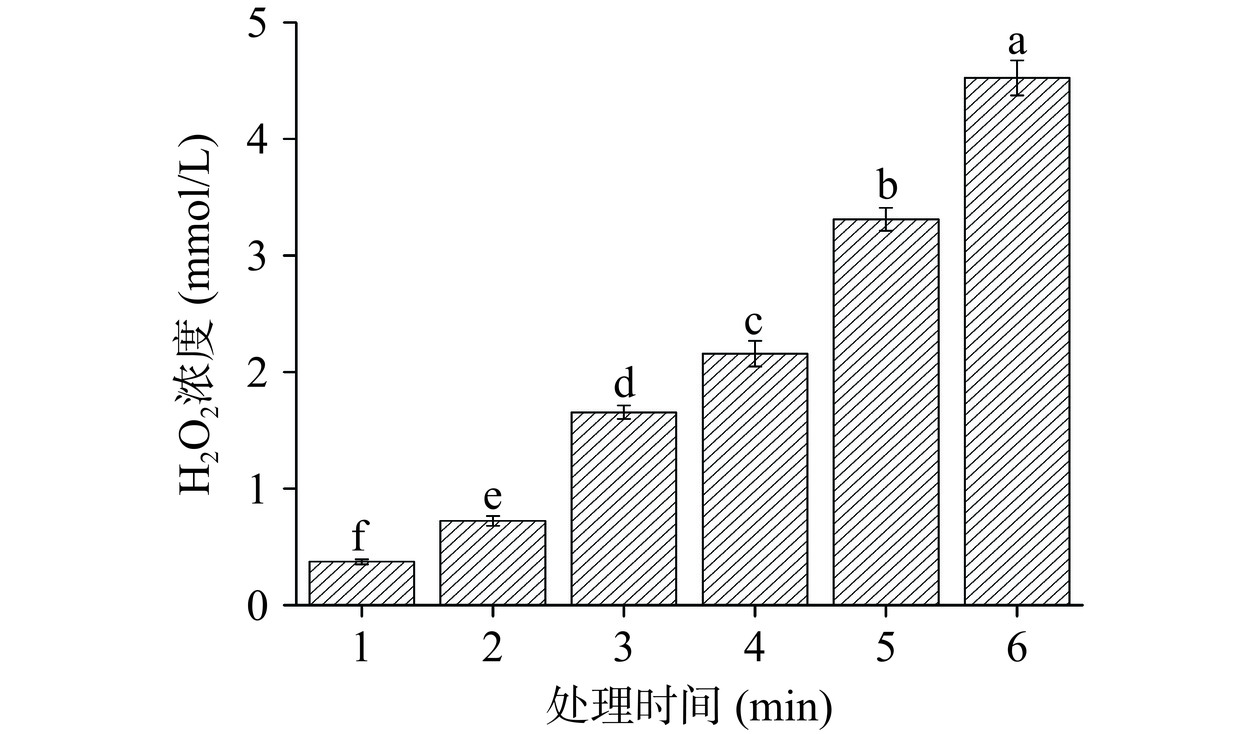
PAW制备过程中产生的ROS和RNS对PAW的抑菌性能起关键作用。在制备过程中,等离子体处理溶液会产生H2O2、硝酸和过氧硝酸等酸性物质,研究表明,等离子体处理溶液后,PAW的pH在0~5之间[21],因此PAW制备后呈酸性。在PAW的ROS中H2O2相对稳定,是维持PAW氧化活性最基本的成分。H2O2虽然在气液界面的半衰期是1 ms,但在液体中的半衰期可以延长到8 h~20 d[5]。PAW制备过程中产生的存在于气相中的·OH可被转化为H2O2,随后溶解到溶液中,因此推测PAW中产生的H2O2可能是由水分子与解离电子碰撞形成,以及·OH重组产生[5]。
图2结果反应了PAW在制备过程中H2O2含量的变化,随着处理时间的增加,PAW中H2O2的含量显著(P<0.05)提升。研究发现,PAW处理过程产生的活性氧氮自由基(RONS)与H2O2的浓度密切相关[22]。随着PAW处理时间的延长,可以产生更多的H2O2,高浓度的H2O2会诱导等离子体在气液界面产生“一级反应”及在溶液中发生“二级反应”,产生更多的RONS(表1)。
表 1 PAW制备过程中H2O2参与的RONS产生途径[22]Table 1. RONS generation pathway involved in H2O2 during PAW generation[22]序号 H2O2相关化学反应 序号 H2O2相关化学反应 1 O+H2O→2OH 9 NO2+NO2+H2O→NO2−+NO3−+2H+ 2 O+H2O→H2O2 10 NO2−+H+→HNO2 3 H2O+e−→H2O++2e− 11 HNO2+H+→NO++H2O 4 H2O++H2O→OH+H3O+ 12 NO2−+H2O2+H+→O=NOOH+H2O 5 N2O+e−→H2O++2e− 13 HNO2+H2O2→O=NOO−+H2O 6 N2++H2O→NO+H 14 NO·+HO2·→O=NOOH 7 ·OH+·OH→H2O2 15 NO2−+O3→NO3−+O2 8 HNO2+HNO2→
NO·+NO2·+H2O16 H2O2+O3→·OH+HO2˙+O2 2.1.2 单线态氧含量变化
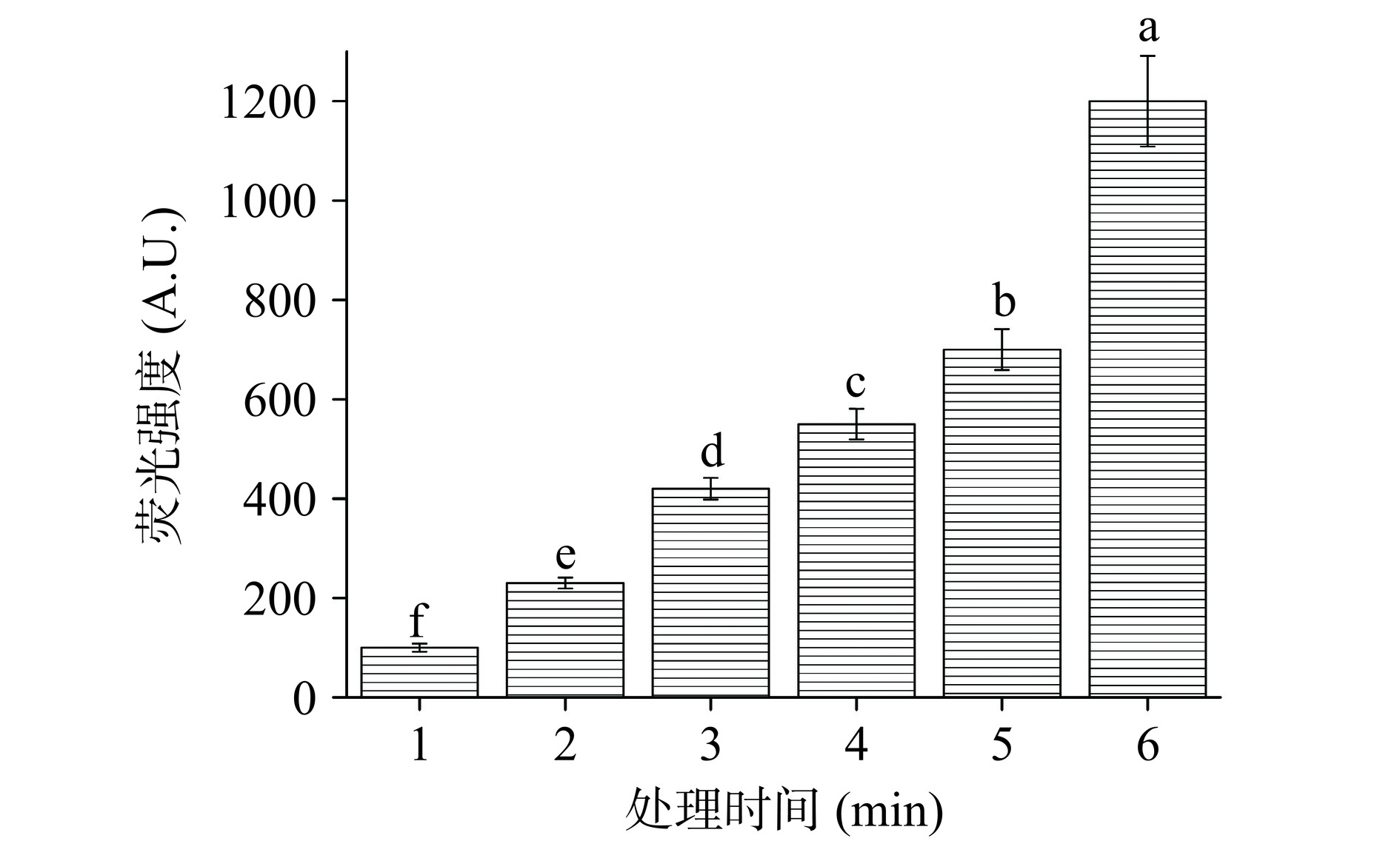
单线态氧(1O2)是一种具有高氧化能力的活性氧自由基,几乎对所有生命体中的有机物都具有强氧化作用,是一种激发态活性氧分子。在PAW溶液中的产生途径参考文献[23]。
由图3所示,随着CP处理时间的增加,溶液中1O2的含量显著(P<0.05)提升。随着处理时间的增加,PAW中H2O2浓度显著增加,这也加速了溶液中的1O2自由基浓度的显著上升(P<0.05),当在溶液中达到稳定的动态“二级反应”时,两种自由基浓度即可不断累积。
2.1.3 羟基自由基含量变化
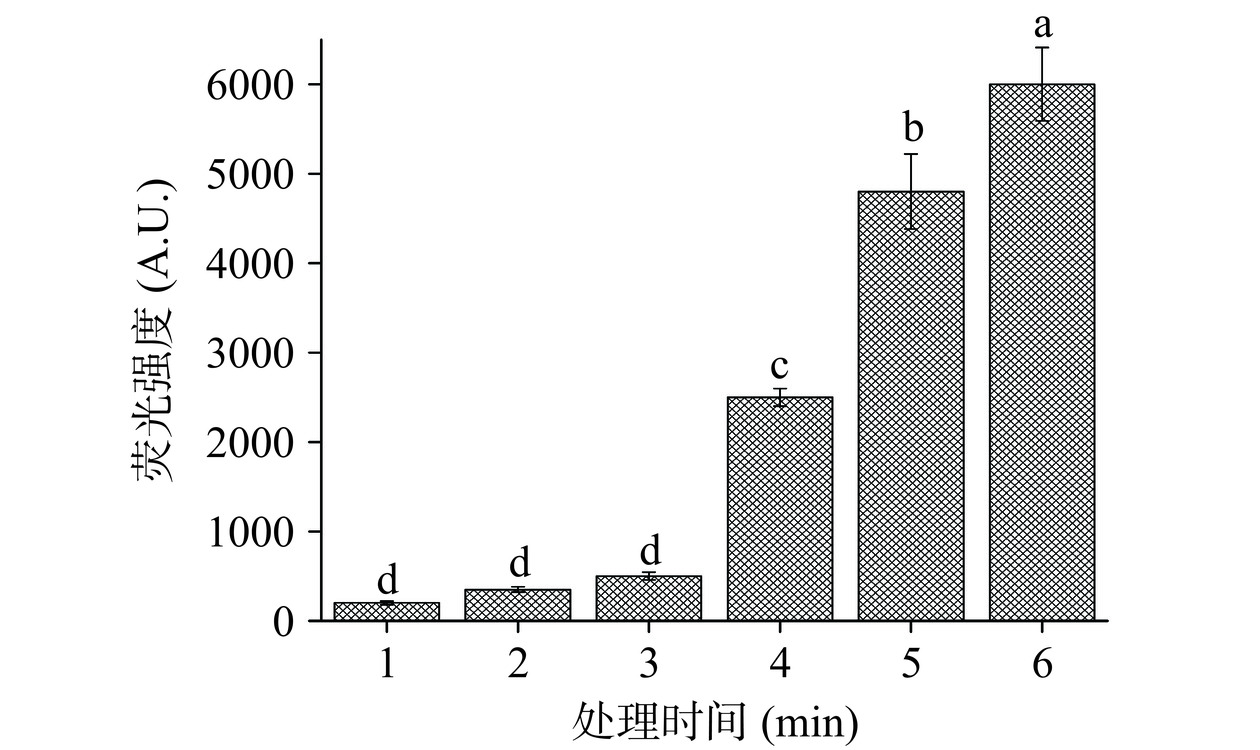
·OH也是PAW中存在的一种活性氧自由基,非常容易与有机物发生反应。·OH是在光照条件下通过H2O2与高能电子和O3反应产生的[24]。
如图4可知,随着CP处理时间的增加,·OH浓度显著增加(P<0.05),这可能由于CP在处理过程中产生的紫外光、ROS和RNS等活性成分,使得溶液中的H2O2通过能量转化产生·OH。
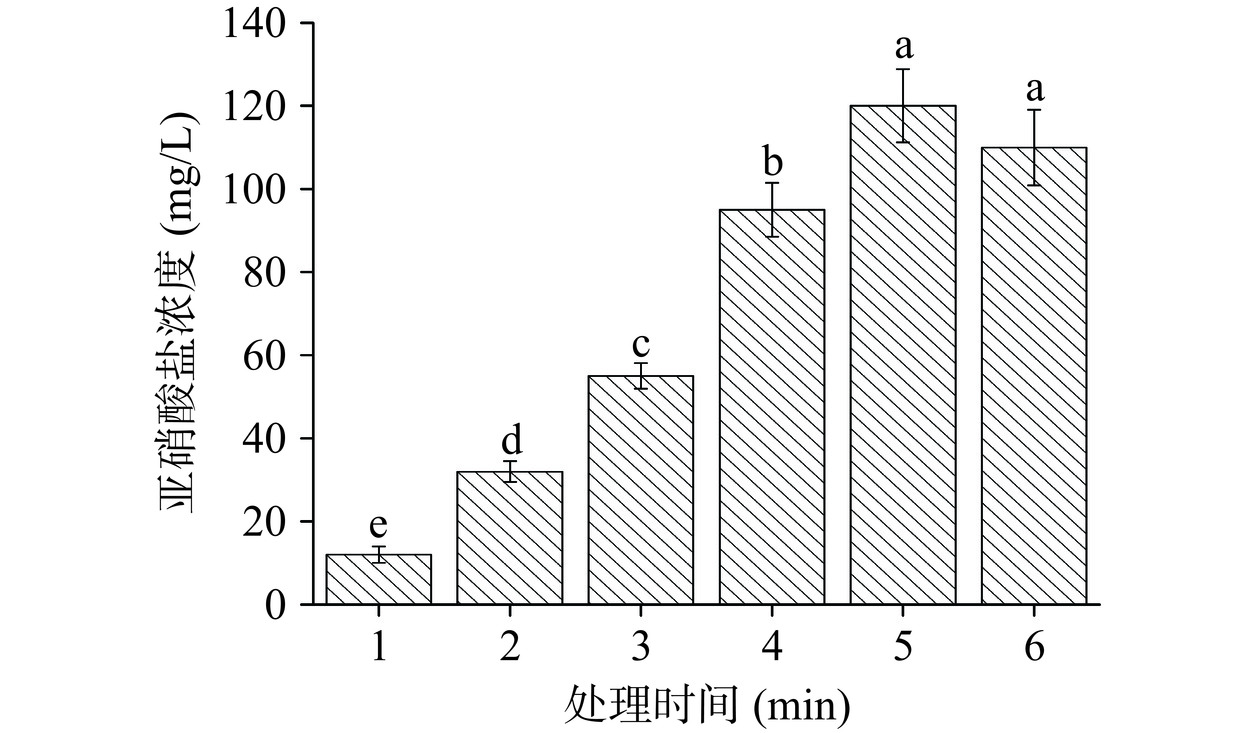
2.1.4 亚硝酸盐含量变化
PAW中除了ROS外,还有大量的RNS,大部分以硝酸盐、亚硝酸盐和过氧亚硝酸盐的形式存在。由于CP处理产生ROS等氧化产物,使得PAW具有较强的氧化性质,促进NO氧化为NO2,导致NO3−的浓度随着时间的推移而下降。由图5所示,在处理过程中,随着时间增加PAW溶液的亚硝酸盐含量先显著(P<0.05)增加后有下降趋势,但T6与T5组相比差异不显著(P>0.05)。在水相中溶解的氮氧化物与溶剂分子或ROS的相互作用可形成亚硝酸盐和硝酸盐离子,当PAW中存在大量的ROS时,较强的氧化性会导致PAW中形成的亚硝酸及其共轭酸迅速转化为硝酸或过氧亚硝酸[25]。而在酸性条件下,过氧亚硝酸极不稳定,通过分解和异构化快速衰减。因此过长时间的制备产生过高浓度的H2O2限制了RNS的生成和转化。
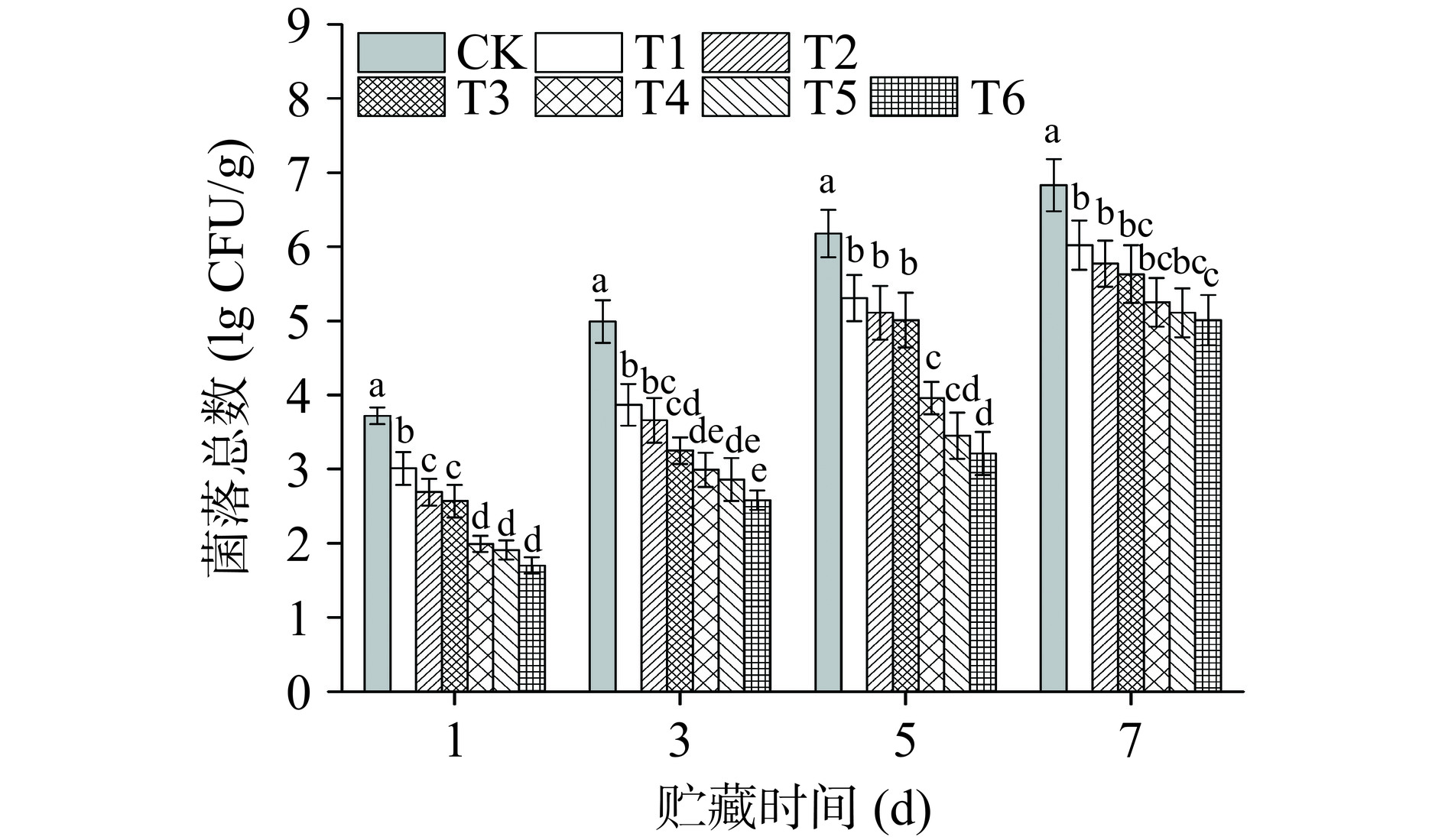
2.2 PAW处理对生鲜牛肉贮藏期主要微生物变化的影响
牛肉的腐败主要是由于微生物的增长及其胞外酶分解代谢引起的,因此控制牛肉中微生物的数量是延长生鲜牛肉货架期的关键。图6为PAW处理后生鲜牛肉在4 ℃贮藏期间菌落总数的变化。可以看出,第1 d的对照组菌落总数为3.72 lg CFU/g,经T1~T6 PAW处理后,菌落总数分别减少了0.71、1.03、1.15、1.73、1.81、2.02 lg CFU/g。随后对照组菌落总数在贮藏期内迅速上升,贮藏第3 d时达到4.99 lg CFU/g,而组T1、T2、T3在第5 d均超过5 lg CFU/g,组T4~T6在第7 d才超过5 lg CFU/g,分别为5.25、5.11和5.01 lg CFU/g。
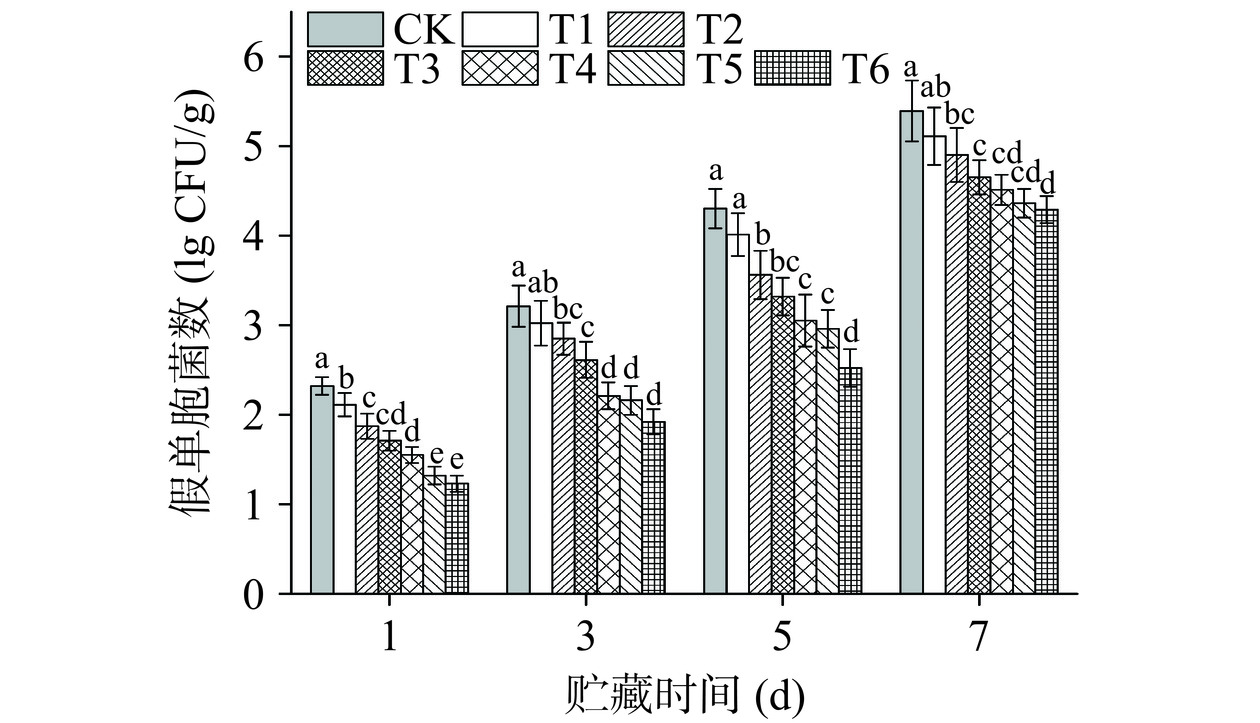
假单胞菌是冷鲜牛肉贮藏后期的优势腐败菌,且与其他腐败菌相比,可以产生更多的腐败代谢产物和微生物数量[26],因此本文研究了PAW处理对生鲜牛肉假单胞菌的抑制效果。从图7可以看出,PAW处理后生鲜牛肉中假单胞菌总数下降显著(P<0.05),T2~T6组分别从CK的2.32 lg CFU/g下降到1.87、1.71、1.55、1.32和1.13 lg CFU/g。T4、T5和T6组的抑菌效果始终好于其他处理组,贮藏期到第7 d时,T4~T6与CK组相比仍然降低了0.88、1.03和1.10 lg CFU/g(P<0.05)。
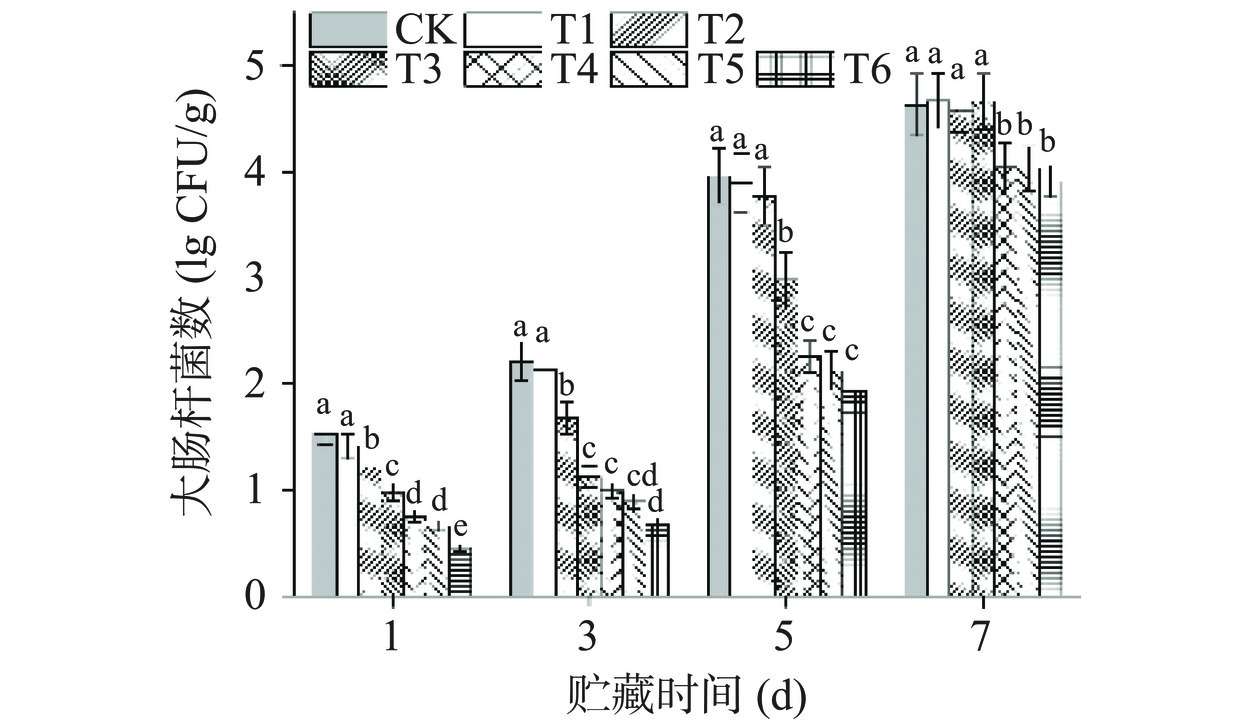
大肠杆菌作为食品污染最常见的微生物之一,是食品杀菌的主要对象。牛肉在加工、运输包装、分装销售环节极易感染大肠杆菌[27],因此在探究PAW对于生鲜牛肉贮藏期评估时,需要分析PAW对于大肠杆菌的杀菌效果。如图8所示,PAW处理对牛肉样品中大肠杆菌抑菌效果明显,T1~T6组处理后大肠杆菌分别从1.53 lg CFU/g降低到1.41、1.21、0.98、0.75、0.66及0.45 lg CFU/g。随后在贮藏3~7 d时,大肠杆菌开始增长,在贮藏7 d时,T1~T3组大肠杆菌数量已接近CK组,且无显著性差异(P>0.05),而T4~T6组分别较CK组减少了0.59、0.60和0.72 lg CFU/g(P<0.05),进一步验证了随着处理时间的延长,PAW的抑菌效果增加。
研究发现等离子体技术的抑菌作用主要由于等离子体产生的RONS造成细胞膜通透性及细胞膜完整性的破坏[28],或者通过干扰细胞代谢途径,影响细胞的转录、逆转录和翻译从而导致微生物的死亡[29]。因此随着PAW中RONS的增加使得其抑菌效果增强。本试验中,PAW处理组均可以有效抑制微生物的活性,等离子体杀菌效果与长时间处理所产生的RONS相关,如1O2、·O2-、·NO和·NO2等[30],这些初级产物经一系列反应生成稳定的次级产物O3、H2O2、O2−以及NO2−等,其中PAW的长效抑菌物质为H2O2、HNO2和ONOOH[31],等离子体产生的有效抑菌成分可作用于微生物不同靶器官,从多方面打破微生物动态平衡。在贮藏期后期,PAW处理组出现微生物的逆生长,可能是由于单一栅栏因子的诱导,使得微生物应激抗逆机制的产生,贮藏后期开始繁殖[32]。
2.3 PAW处理对生鲜牛肉贮藏期pH变化的影响
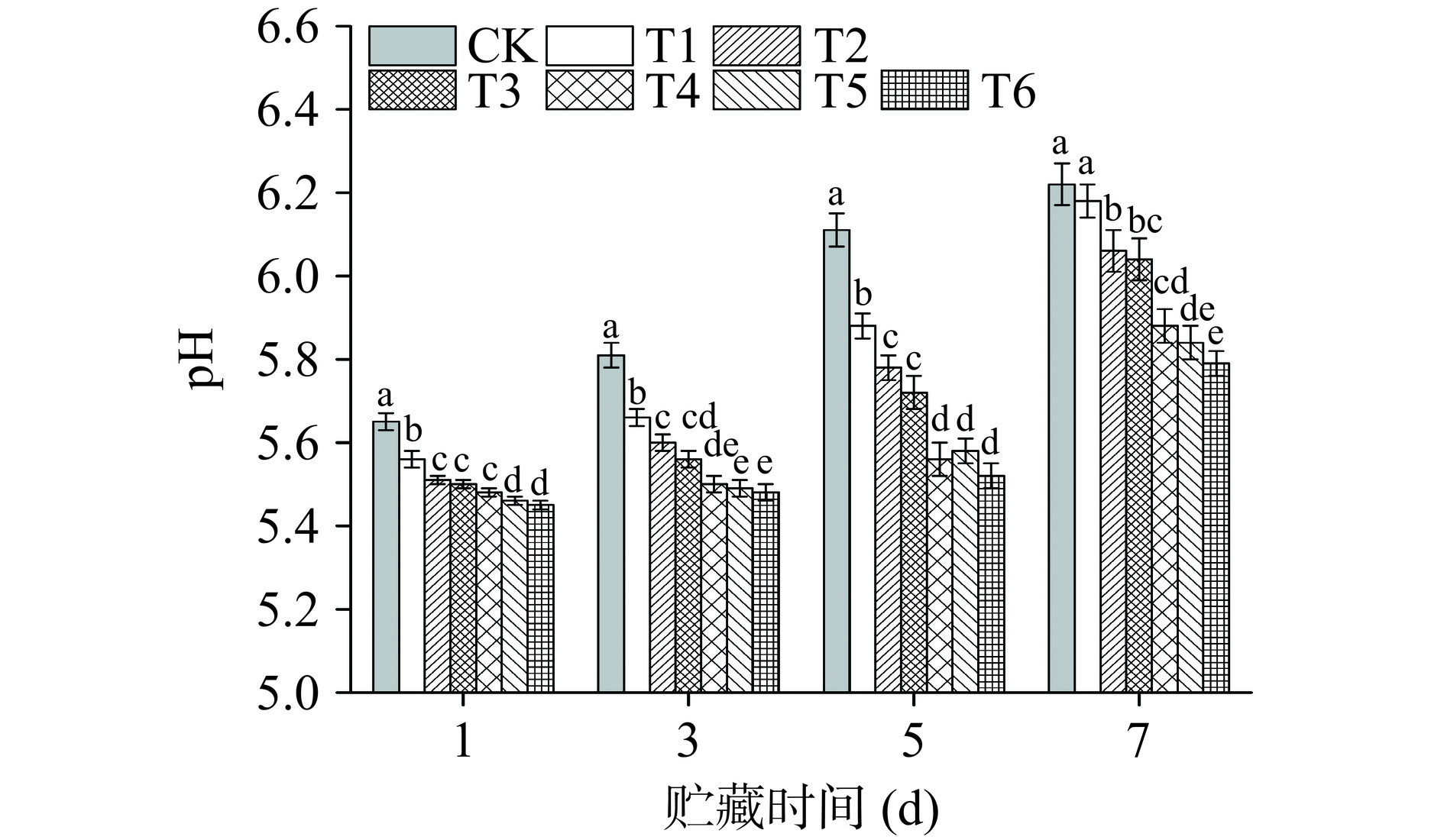
PAW处理牛肉从微生物相关指标来看可以显著延长货架期,但消费者是否选择购买还取决于牛肉理化品质,所以PAW处理对生鲜牛肉理化品质的影响也非常重要。pH是判断肉及肉制品是否新鲜的重要指标之一。图9显示了不同PAW处理下冷鲜牛肉贮藏期间pH的变化。整个贮藏期间,相比于CK组,PAW组的pH增长速度较慢,这与PAW溶液本身的酸性相关。而后期pH持续上升,可能是因为牛肉表面增长微生物在糖原消耗完毕后开始分泌蛋白酶分解蛋白质,生成胺类、硫化物等碱性含氮物质从而造成了pH的升高[33],这与微生物菌落总数的变化趋势相似。CK组及T1组的pH在第5 d和第7 d分别达到6.11和6.18,达到了次级鲜肉的标准[34];T2~T3组在第5 d的pH分别为5.78、5.72均未超过6.0,直到第7 d这2组pH超过6.0。而T4、T5和T6组的pH在第7 d仍未超过6.0,仅为5.88、5.84和5.79。证明PAW处理可通过抑制微生物的繁殖控制牛肉pH上升。
2.4 PAW处理对生鲜牛肉贮藏期TVB-N变化的影响
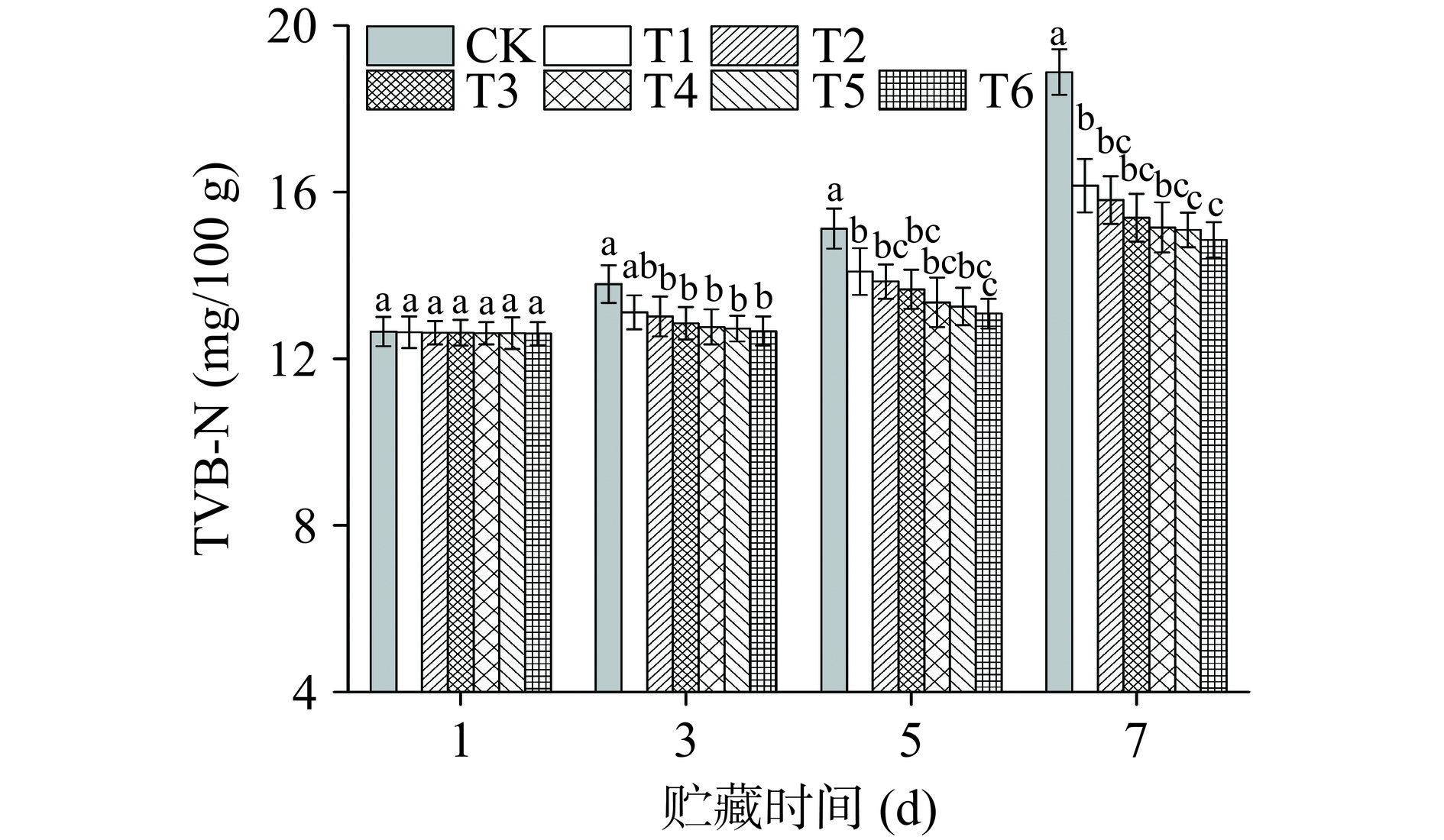
挥发性盐基氮(TVB-N)是一种碱性含氮物质,其产生于肉类腐败过程中由内源酶和腐败菌作用下蛋白质分解而产生的氨以及胺类物质,这类物质随肉类腐败而逐渐增加。TVB-N值与菌落总数有较高的相关性,TVB-N值被看作牛肉腐败的重要衡量指标[35]。根据我国食品安全标准GB 2707-2016食品安全国家标准 鲜(冻)畜、禽产品[36],鲜冻肉TVB-N值≤15 mg/100 g。如图10所示,在贮藏1 d时,各组样品均未呈现明显差异(P>0.05),贮藏期到第3 d时,CK处理组值达到了13.79 mg/100 g,与次级鲜肉标准非常接近,T2~T6处理组均与CK组有显著性差异,其中T6组值为12.66 mg/100 g;第5 d时,CK组达到腐败肉标准,T2~T5组在第7 d才达到腐败肉标准;T6组在第7 d时仍低于腐败肉标准(14.85 mg/100 g),证明长时间制备的PAW处理可有效抑制牛肉腐败。
2.5 PAW处理对生鲜牛肉贮藏期a*值变化的影响
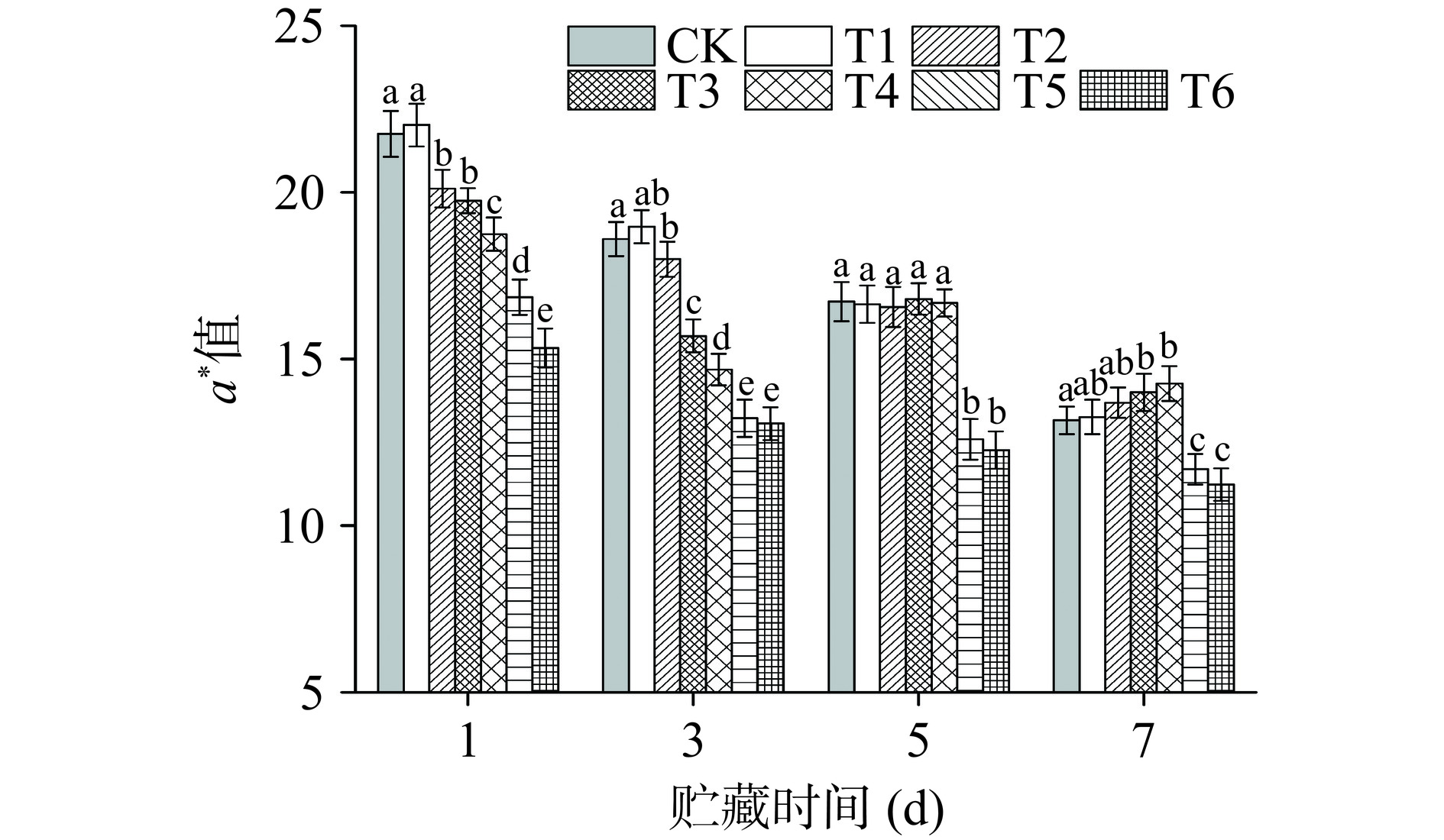
牛肉的色泽是衡量肉类新鲜程度的重要指标,对于红肉贮藏期肉色的变化,研究更注重保鲜方式对牛肉a*值的影响[37]。从图11可以看出,所有样品的a*值随着贮藏时间的延长均呈现下降趋势,且T5和T6组a*值在整个贮藏期内均低于CK组,这可能是由于高氧环境使得牛肉中脱氧肌红蛋白被不可逆的氧化成了棕色的高铁肌红蛋白[38],过量的RONS诱导了不可逆的脂质和蛋白的氧化。贮藏1 d时,T1组与CK无明显差异(P>0.05),T2~T5组随着处理强度的增加,氧化程度上升,a*值显著降低(P<0.05)。T1组在整个贮藏期间与CK组无显著差距(P>0.05),而T3~T4组在贮藏到第5 d时,a*值与CK组已无显著差异(P>0.05),贮藏第7 d,T3~T4组a*值均显著高于CK组(P<0.05),可能是由于后期亚硝酸盐浓度的上升,增加了肉品的a*值。羿庆燕[39]也发现贮藏期牛肉pH的变化趋势与a*值呈显著负相关,这与本试验结果一致。
3. 结论
本文利用DBD-CP制备PAW,分析不同制备时间下PAW中RONS的浓度变化,并研究了PAW处理对生鲜牛肉贮藏期间微生物和品质的影响,以求在不显著影响生鲜牛肉理化指标及品质的基础上探索最佳的PAW处理条件。研究发现随着DBD-CP处理时间的延长,PAW中RONS浓度显著上升,而高浓度的RONS有助于增强PAW的杀菌能力。微生物试验也证明PAW处理能显著抑制生鲜牛肉中的菌落总数、大肠杆菌及假单胞菌。其中,T4~T6组抑菌表现最好。同时PAW处理能减缓牛肉贮藏期间理化品质的下降速度,所有PAW处理组均能显著抑制牛肉pH、TVB-N的升高,其中T4~T6组效果最好。但T5和T6组牛肉a*值在贮藏期间均显著低于CK组,而T4组在贮藏到第5 d时,a*值与CK组已无显著差异,第7 d时T4组a*值显著高于CK组。综上所述,T4处理组不仅可延长牛肉保质期,且a*值贮藏后期显著高于CK组,综合处理效果最佳。本研究可为PAW喷淋处理在牛肉贮藏保鲜中的应用提供理论参考。
-
表 1 PAW制备过程中H2O2参与的RONS产生途径[22]
Table 1 RONS generation pathway involved in H2O2 during PAW generation[22]
序号 H2O2相关化学反应 序号 H2O2相关化学反应 1 O+H2O→2OH 9 NO2+NO2+H2O→NO2−+NO3−+2H+ 2 O+H2O→H2O2 10 NO2−+H+→HNO2 3 H2O+e−→H2O++2e− 11 HNO2+H+→NO++H2O 4 H2O++H2O→OH+H3O+ 12 NO2−+H2O2+H+→O=NOOH+H2O 5 N2O+e−→H2O++2e− 13 HNO2+H2O2→O=NOO−+H2O 6 N2++H2O→NO+H 14 NO·+HO2·→O=NOOH 7 ·OH+·OH→H2O2 15 NO2−+O3→NO3−+O2 8 HNO2+HNO2→
NO·+NO2·+H2O16 H2O2+O3→·OH+HO2˙+O2 -
[1] 黄明明, 乔维维, 章建浩, 等. 低温等离子体冷杀菌对生鲜牛肉主要腐败菌及生物胺抑制效应研究[J]. 食品科学技术学报,2018,36(4):17−23. [HUANG Mingming, QIAO Weiwei, ZHANG Jianhao, et al. Study on the inhibition effect of low temperature plasma cold sterilization on main spoilage bacteria and biogenic amines in fresh beef[J]. Journal of Food Science and Technology,2018,36(4):17−23.] doi: 10.3969/j.issn.2095-6002.2018.04.003 HUANG Mingming, QIAO Weiwei, ZHANG Jianhao, et al. Study on the inhibition effect of low temperature plasma cold sterilization on main spoilage bacteria and biogenic amines in fresh beef[J]. Journal of Food Science and Technology, 2018, 36(4): 17−23. doi: 10.3969/j.issn.2095-6002.2018.04.003
[2] GAVAHIAN M, KHANEGHAH A M. Cold plasma as a tool for the elimination of food contaminants:Recent advances and future trends[J]. Critical Reviews in Food Science and Nutrition,2019,60(14):1581−1592.
[3] XIANG Q S, FAN L M, LI Y F, et al. A review on recent advances in plasma-activated water for food safety:Current applications and future trends[J]. Critical Reviews in Food Science and Nutrition,2020(3):1852173.
[4] LUO J, XU W M, LIU Q, et al. Dielectric barrier discharge cold plasma treatment of pork loin:Effects on muscle physicochemical properties and emulsifying properties of pork myofibrillar protein[J]. LWT-Food Science and Technology, 2022, 162(Pt 3):113484.
[5] SUN P, WU H, BAI N, et al. Inactivation of Bacillus subtilis spores in water by a direct-current, cold atmospheric-pressure air plasma microjet[J]. Plasma Processes and Polymers,2012,9(2):157−164. doi: 10.1002/ppap.201100041
[6] ZHAO Y, ZHAO Z, CHEN R, et al. Plasma-activated water treatment of fresh beef:Bacterial inactivation and effects on quality attributes[J]. Ieee Transactions on Radiation and Plasma Medical Sciences,2020,4(1):113−120. doi: 10.1109/TRPMS.2018.2883789
[7] QIAN J, YAN L, YING K, et al. Plasma-activated water:A novel frozen meat thawing media for reducing microbial contamination on chicken and improving the characteristics of protein[J]. Food Chemistry,2021,375:131661.
[8] ERCOLINI D, RUSSO F, TORRIERI E, et al. Changes in the spoilage-related microbiota of beef during refrigerated storage under different packaging conditions[J]. Applied and Environmental Microbiology,2006,72(7):4663−4671. doi: 10.1128/AEM.00468-06
[9] 顾春涛, 毕伟伟, 朱军莉. 冷鲜牛肉贮藏中菌群结构及优势菌致腐性的分析[J]. 食品科学,2019,40(18):76−82. [GU Chuntao, BI Weiwei, ZHU Junli. Analysis of bacterial community structure and putricity of dominant bacteria in storage of chilled beef[J]. Food Science,2019,40(18):76−82.] doi: 10.7506/spkx1002-6630-20180925-263 GU Chuntao, BI Weiwei, ZHU Junli. Analysis of bacterial community structure and putricity of dominant bacteria in storage of chilled beef[J]. Food Science, 2019, 40(18): 76−82. doi: 10.7506/spkx1002-6630-20180925-263
[10] REID R, FANNING S, WHYTE P, et al. Comparison of hot versus cold boning of beef carcasses on bacterial growth and the risk of blown pack spoilage[J]. Meat Science,2017,125:46−52. doi: 10.1016/j.meatsci.2016.11.012
[11] ERCOLINI D, RUSSO F, NASI A, et al. Mesophilic and psychrotrophic bacteria from meat and their spoilage potential in vitro and in beef[J]. Applied and Environmental Microbiology,2009,75(7):1990−2001. doi: 10.1128/AEM.02762-08
[12] CHENG J H, CHEN Y Q, SUN D W. Effects of plasma activated solution on the colour and structure of metmyoglobin and oxymyoglobin[J]. Food Chemistry,2021,353:129433. doi: 10.1016/j.foodchem.2021.129433
[13] JOSHI S G, COOPER M, YOST A, et al. Nonthermal dielectric-barrier discharge plasma-induced inactivation involves oxidative DNA damage and membrane lipid peroxidation in Escherichia coli[J]. Antimicrobial Agents and Chemotherapy,2011,55(3):1053−1062. doi: 10.1128/AAC.01002-10
[14] 奚文灏, 兰彦, 沈洁, 等. 大气压等离子体射流引发液相OH与H_(2)O_(2)的研究[J]. 安徽大学学报:自然科学版,2022,46(3):3−13. [XI Wenhao, LAN Yan, SHEN Jie, et al. Study on OH and H_(2)O_(2) induced by atmospheric pressure plasma jets[J]. Journal of Anhui University:Natural Science Edition,2022,46(3):3−13.] XI Wenhao, LAN Yan, SHEN Jie, et al. Study on OH and H_(2)O_(2) induced by atmospheric pressure plasma jets[J]. Journal of Anhui University: Natural Science Edition, 2022, 46(3): 3−13.
[15] LUO J, YAN W, NASIRU M M, et al. Evaluation of physicochemical properties and volatile compounds of Chinese dried pork loin curing with plasma-treated water brine[J]. Scientific Reports,2019,9(1):13793. doi: 10.1038/s41598-019-50351-5
[16] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 肉与肉制品取样方法:GB/T 9695.19-2008[S]. 北京:中国标准出版社, 2008. [National health and family planning commission, People's Republic of China. National standards for food safety sampling methods for meat and meat products:GB/T 9695.19-2008[S]. Beijing:Standards Press of China, 2008.] National health and family planning commission, People's Republic of China. National standards for food safety sampling methods for meat and meat products: GB/T 9695.19-2008[S]. Beijing: Standards Press of China, 2008.
[17] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品微生物学检验与菌落总数测定:GB 4789.2-2016[S]. 北京:中国标准出版社, 2016. [National health and family planning commission, People's Republic of China. National standards for food safety microbiological detection of food and determination of total number of colonies:GB 4789.2-2016[S]. Beijing:Standards Press of China, 2016.] National health and family planning commission, People's Republic of China. National standards for food safety microbiological detection of food and determination of total number of colonies: GB 4789.2-2016[S]. Beijing: Standards Press of China, 2016.
[18] 张玉华, 孟一, 郭风军, 等. 基于预测微生物学的冷却牛肉货架期预测模型的建立[J]. 肉类研究,2019,33(11):61−66. [ZHANG Yuhua, MENG Yi, GUO Fengjun, et al. Establishment of shelf life prediction model for chilled beef based on predictive microbiology[J]. Meat Research,2019,33(11):61−66.] ZHANG Yuhua, MENG Yi, GUO Fengjun, et al. Establishment of shelf life prediction model for chilled beef based on predictive microbiology[J]. Meat Research, 2019, 33(11): 61−66.
[19] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品微生物学检验 大肠埃希氏菌计数:GB 4789.38-2012[S]. 北京:中国标准出版社, 2012. [National health and family planning commission, People's Republic of China. National standards for food safety food microbiological examination of Escherichia coli count:GB 4789.38-2012[S]. Beijing:Standards Press of China, 2012.] National health and family planning commission, People's Republic of China. National standards for food safety food microbiological examination of Escherichia coli count: GB 4789.38-2012[S]. Beijing: Standards Press of China, 2012.
[20] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中挥发性盐基氮的测定:GB 5009.228-2016[S]. 北京:中国标准出版社, 2016. [National health and family planning commission, People's Republic of China. National standards for food safety determination of total volatile basic nitrogen in food:GB 5009.228-2016[S]. Beijing:Standards Press of China, 2016.] National health and family planning commission, People's Republic of China. National standards for food safety determination of total volatile basic nitrogen in food: GB 5009.228-2016[S]. Beijing: Standards Press of China, 2016.
[21] MA R, WANG G, TIAN Y, et al. Non-thermal plasma-activated water inactivation of food-borne pathogen on fresh produce[J]. Journal of Hazardous Materials,2015,300:643−651. doi: 10.1016/j.jhazmat.2015.07.061
[22] SAMUEL H, HOU C Y, LIN C M, et al. Nonthermal plasma-activated water:A comprehensive review of this new tool for enhanced food safety and quality[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20(1):583−626. doi: 10.1111/1541-4337.12667
[23] LI Y, KOJTARI A, FRIEDMAN G, et al. Decomposition of L-valine under nonthermal dielectric barrier discharge plasma[J]. The Journal of Physical Chemistry B,2014,118(6):1612−1620. doi: 10.1021/jp411440k
[24] LUKES P, DOLEZALOVA E, SISROVA I, et al. Aqueous-phase chemistry and bactericidal effects from an air discharge plasma in contact with water:Evidence for the formation of peroxynitrite through a pseudo-second-order post-discharge reaction of H2O2 and HNO2[J]. Plasma Sources Science & Technology,2014,23(1):15−19.
[25] PUAC N, SKORO N, SPASIC K, et al. Activity of catalase enzyme in Paulownia tomentosa seeds during the process of germination after treatments with low pressure plasma and plasma activated water[J]. Plasma Processes & Polymers,2018,15(2):9.1−9.12.
[26] MANSUR A R, SONG E, CHO Y, et al. Comparative evaluation of spoilage-related bacterial diversity and metabolite profiles in chilled beef stored under air and vacuum packaging[J]. Food Microbiology,2019,77:166−172. doi: 10.1016/j.fm.2018.09.006
[27] 陈雨, 梁莹, 周萍萍, 等. 不同贮藏温度下进口生鲜牛肉中大肠杆菌生长预测模型的建立[J]. 食品工业科技,2021,42(12):81−88. [CHEN Yu, LIANG Ying, ZHOU Pingping, et al. Establishment of Escherichia coli growth prediction model in imported fresh beef under different storage temperatures[J]. Science and Technology of Food Industry,2021,42(12):81−88.] CHEN Yu, LIANG Ying, ZHOU Pingping, et al. Establishment of Escherichia coli growth prediction model in imported fresh beef under different storage temperatures[J]. Science and Technology of Food Industry, 2021, 42(12): 81−88.
[28] ZHAO J, QIAN J, LUO J, et al. Morphophysiological changes in staphylococcus aureus biofilms treated with plasma-activated hydrogen peroxide solution[J]. Applied Sciences-Basel,2021,11(24):11597. doi: 10.3390/app112411597
[29] WANG Z B, WANG X T, SHENG X W, et al. Unraveling the antibacterial mechanism of plasma-activated lactic acid against pseudomonas ludensis by untargeted metabolomics[J]. Foods,2023,12(8):1605. doi: 10.3390/foods12081605
[30] BAUER A, NI Y, BAUER S, et al. The effects of atmospheric pressure cold plasma treatment on microbiological, physical-chemical and sensory characteristics of vacuum packaged beef loin[J]. Meat Science,2017,128:77−87. doi: 10.1016/j.meatsci.2017.02.003
[31] THIRUMDAS R, KOTHAKOTA A, ANNAPURE U, et al. Plasma activated water (paw):Chemistry, physico-chemical properties, applications in food and agriculture[J]. Trends in Food Science & Technology,2018,77:21−31.
[32] CHENG H, YANG H, CHOU C. Influence of acid adaptation on the tolerance of Escherichia coli o157:h7 to some subsequent stresses[J]. Journal of Food Protection,2002,65(2):260−265. doi: 10.4315/0362-028X-65.2.260
[33] BEKHIT A E A, HOLMAN B W B, GITERU S G, et al. Total volatile basic nitrogen (TVB-N) and its role in meat spoilage:A review[J]. Trends in Food Science & Technology,2021,109:280−302.
[34] CULLERE M, DALLE Z A, TASONIERO G, et al. Effect of diet and packaging system on the microbial status, pH, color and sensory traits of rabbit meat evaluated during chilled storage[J]. Meat Science,2018,141:36−43. doi: 10.1016/j.meatsci.2018.03.014
[35] HAO R, ROY K, PAN J, et al. Critical review on the use of essential oils against spoilage in chilled stored fish:A quantitative meta-analyses[J]. Trends in Food Science & Technology,2021,111:175−190.
[36] 中华人民共和国国家卫生和计划生育委员会. GB 2707-2016食品安全国家标准 鲜(冻)畜、禽产品[S]. 北京:中国标准出版社, 2016. [National health and family planning commission, People's Republic of China. GB 2707-2016 National standards for food safety Fresh (frozen) livestock and poultry products[S]. Beijing:Standards Press of China, 2016.] National health and family planning commission, People's Republic of China. GB 2707-2016 National standards for food safety Fresh (frozen) livestock and poultry products[S]. Beijing: Standards Press of China, 2016.
[37] KIM S, MIN S C, SHIN H, et al. Evaluation of the antioxidant activities and nutritional properties of ten edible plant extracts and their application to fresh ground beef[J]. Meat Science,2013,93(3):715−722. doi: 10.1016/j.meatsci.2012.11.029
[38] WANG X, WANG Z, ZHUANG H, et al. Changes in color, myoglobin, and lipid oxidation in beef patties treated by dielectric barrier discharge cold plasma during storage[J]. Meat Science,2021,176:108456. doi: 10.1016/j.meatsci.2021.108456
[39] 羿庆燕. 不同质量等级延边黄牛肉品质的比较研究[D]. 延吉:延边大学, 2013. [YI Q Y. Comparative study on meat quality of Yanbian yellow cattle with different quality grades[D]. Yanji:Yanbian University, 2013.] YI Q Y. Comparative study on meat quality of Yanbian yellow cattle with different quality grades[D]. Yanji: Yanbian University, 2013.
-
期刊类型引用(4)
1. 任菲菲,张静,张艳红,郑艳青. UPLC-MS/MS测定僵蚕中多种兽药残留. 食品与药品. 2025(01): 46-51 .  百度学术
百度学术
2. 孙梅梅,吴银良. 固相萃取-液相色谱-串联质谱法快速测定猪肉中27种兽药及代谢物残留量. 食品安全质量检测学报. 2024(17): 30-38 .  百度学术
百度学术
3. 管益涛,陈明华,谷翠梅,马淑青. QuEChERS结合GC-MS/MS检测果蔬中13种农药残留. 食品安全导刊. 2024(27): 63-67 .  百度学术
百度学术
4. 罗登武,张帅,胡中海,胡惠茗,王飞,罗炽增. SinChERS净化结合UPLC-MS/MS法测定茶叶中农药多残留的基质效应研究. 食品安全导刊. 2023(32): 65-72 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



