Alpha-Linolenic Acid Attenuates Inflammatory Response in LPS-stimulated Macrophages by Regulating TLR4/MyD88/NF-κB Signaling Pathway
-
摘要: ω-3脂肪酸具有自然的抗炎属性,而α-亚麻酸(ALA)是一种人体必需的ω-3脂肪酸,为了阐明其体外抗炎机制,本实验采用脂多糖(LPS)刺激巨噬细胞构建炎症模型,通过测定单核细胞趋化蛋白(MCP-1)、白细胞介素4(IL-4)、白细胞介素13(IL-13)等炎症因子的水平、活性氧(ROS)生成量和炎症信号通路相关蛋白表达情况探讨α-亚麻酸减轻脂多糖诱导的炎症反应的机制。结果表明,α-亚麻酸能显著抑制MCP-1的释放,提高抗炎细胞因子IL-13的分泌水平;同时,α-亚麻酸还可以降低ROS生成量,缓解ROS介导的炎性损伤。此外,α-亚麻酸可以通过增加抗氧化酶SOD的表达,减少MDA的堆积,从而减轻炎症反应中氧化应激的伴随性危害。蛋白印迹分析进一步证实,α-亚麻酸可抑制TLR4、MyD88的表达以及下游p65和IκBα的磷酸化水平。以上结果表明,α-亚麻酸可明显抑制LPS诱导的RAW264.7细胞炎症反应,其机制可能与抑制TLR4/MyD88/NF-κB信号通路激活有关。Abstract: Omega-3 fatty acids have natural anti-inflammatory properties, and α-linolenic acid (ALA) is an essential ω-3 fatty acid. In order to elucidate its anti-inflammatory mechanism in vitro, lipopolysaccharide (LPS) was used to stimulate macrophages to construct an inflammatory model. The levels of monocyte chemotactic protein (MCP-1), interleukin4 (IL-4), interleukin13 (IL-13), the production of reactive oxygen species (ROS) and the expression of related proteins in inflammatory signaling pathways were determined to explore the mechanism of α-linolenic acid in alleviating LPS-induced inflammatory response. The results showed that α-linolenic acid significantly inhibited the release of MCP-1 and increased the secretion level of anti-inflammatory cytokine IL-13. At the same time, α-linolenic acid also reduced ROS production and alleviated ROS-mediated inflammatory damage. In addition, α-linolenic acid could reduce the accumulation of MDA by increasing the expression of antioxidant enzymes SOD, thereby reducing the concomitant harm of oxidative stress in inflammatory responses. Western blot analysis further confirmed that α-linolenic acid inhibited the expression of TLR4, MyD88, and phosphorylation levels of downstream p65 and IκBα. These results indicate that α-linolenic acid can significantly inhibit the LPS-induced inflammatory response of RAW264.7 cells, and the mechanism may be related to inhibiting the activation of TLR4/MyD88/NF-κB signaling pathway.
-
Keywords:
- α-linolenic acid /
- macrophage /
- inflammation /
- signaling pathways
-
炎症反应是身体对各种压力、病原体的原始反应。从简单的损伤到复杂的感染,人体的免疫系统会对抗这些病原体并修复受损的组织[1]。巨噬细胞是一种非特异性免疫细胞,当抗原进入机体时,巨噬细胞或上皮细胞通过抗原递呈分泌趋化因子,从而对抗炎症损伤[2−4]。细菌脂多糖(Lipopolysaccharide,LPS)可以激活膜上的Toll样受体4(Toll-like receptor 4,TLR4),从而影响下游信号通路上炎症蛋白基因(NF-κB和MAPK)的转录和翻译,导致炎症介质、细胞因子和趋化因子的分泌增加[1,5]。同时,LPS还可以通过烟酰胺腺嘌呤二核苷酸磷酸氧化酶和线粒体电位去极化途径激活氧自由基[6]。李鸿洋等[7]揭示大蒜素能显著抑制脂多糖诱导的小鼠腹腔巨噬细胞的炎症反应,其机制可能与抑制NF-κB信号通路激活有关;姜特等[8]基于TLR4-MyD88/NF-κB信号通路探讨热淋清颗粒对脂多糖诱导小鼠肺泡巨噬细胞抗炎作用的机制。因此,脂多糖诱导的炎性巨噬细胞可作为体外筛选抗炎活性成分的经典模型。
α-亚麻酸(α-Linolenic acid,ALA)是一种含有三个双键的n-3多不饱和脂肪酸,它在绿色植物种子中含量丰富,在亚麻籽油、大豆油和苏籽油中含量较高[9],并且具有多种生物学功效,例如可以调节血脂,预防心脑血管疾病,对一些慢性炎症性和自身免疫性疾病(如糖尿病、类风湿关节炎、炎症性肠病等)明显改善作用[10−14]。天然植物来源的α-亚麻酸的抗炎活性逐渐得到证实[15]。α-亚麻酸通过去饱和和碳链延伸产生一系列上游多不饱和脂肪酸EPA(Eicosapentaenoic acid)和DHA(Docosahexaenoic acid),并通过环氧合酶(Cyclooxygenase,COX)、脂氧合酶(Lipoxygenase,LOX)和细胞色素p450(Cytochrome,CYP)途径进一步代谢为下游的小分子如类二十烷酸[16],这类物质在炎症的发展和消退中发挥着不同的作用。本课题组前期研究发现亚麻籽油可以减轻脂多糖引起的急性炎症损伤,推测这可能与亚麻籽油的主要成分α-亚麻酸有关。事实上,α-亚麻酸在免疫调节和炎症反应中的作用已被研究,Kim等[17]研究表明α-亚麻酸可以缓解硫酸葡聚糖钠诱导小鼠溃疡性结肠炎,但其在细胞水平上的炎症调节活性研究相对有限,作用机制也尚不明确,需进一步探究阐明。
基于上述实验背景,本文提出ALA可能通过TLR4-MyD88/NF-κB信号通路调节炎症损伤的假说。为了验证这一假设,本研究通过细胞毒性实验确定ALA给药浓度,并利用脂多糖构建巨噬细胞炎症模型,以细胞炎症因子、活性氧、氧化应激相关蛋白以及TLR4-MyD88/NF-κB信号通路上关键蛋白的表达为指标评估ALA调节巨噬细胞的炎症反应的分子机制。
1. 材料与方法
1.1 材料与仪器
小鼠单核巨噬细胞RAW264.7 中国科学院细胞库;噻唑四氮唑(MTT) 上海阿拉丁生化科技股份有限公司;DMEM高糖培养基 北京索莱宝科技有限公司;胎牛血清 以色列生物工业公司;脂多糖、α-亚麻酸 Sigma公司;总SOD活性检测试剂盒、脂质氧化检测试剂盒、DCFH-DA荧光探针、细胞裂解液、蛋白浓度测定试剂盒、超敏发光显色液检测试剂盒 上海碧云天生物有限公司;还原型谷胱甘肽测定试剂盒 南京建成生物公司;MCP-1、IL-4、IL-13的ELISA试剂盒 武汉博士德生物技术有限公司;TLR4、MyD88、p65、p-p65、IκBα、pIκBα 美国Cell Signaling Technology公司;小鼠β-actin抗体 美国Abcam公司;辣根过氧化物酶标记山羊抗鼠、山羊抗兔免疫球蛋白G(Immunoglobulin G,IgG)二抗 北京中杉金桥生物技术有限公司。
HH-2数显恒温水浴锅 常州国华电器有限公司;MULTISKAN MK3酶标仪、HERACELL 150i二氧化碳细胞恒温培养箱 美国Thermo Scientific公司;GelDoc XR Biorad凝胶成像系统、Mini-PROTEAN Tetra电泳仪、1704150全能型蛋白转印系统 美国伯乐公司。
1.2 实验方法
1.2.1 细胞培养
用10%高糖DMEM培养基培养RAW264.7巨噬细胞。隔天进行传代,用PBS润洗细胞后,用细胞刮刀轻轻从上至下刮取细胞转移到新的EP管中,常温1000 r/min离心5 min。然后重悬用吸管反复轻柔吹打,按照1:3的比例转移至75 cm2培养瓶中[18]。
1.2.2 细胞毒性实验
选择生长状态良好的巨噬细胞,接种于细胞密度为1.5×104个/孔的96孔板中。在细胞生长和粘附24 h后,加入α-亚麻酸(0、25、50、100、200和400 μmol/L),在培养箱中培养12 h,在490 nm全自动酶标记仪上用MTT法测定巨噬细胞的吸光度,以反映ALA对巨噬细胞存活率的影响。细胞存活率计算公式如下[19]:
细胞存活率(%)=[(OD2−OD0)/(OD1−OD0)]×100 (1) 式中:OD0为调零孔;OD1为空白孔;OD2为实验孔。
1.2.3 MCP-1、IL-4和IL-13的ELISA检测
选择对数生长的巨噬细胞,调节浓度为1.5×105个/mL,接种于6孔板。细胞贴壁后,去除旧培养基。正常组(NC)和模型组(LPS)只加培养基,α-亚麻酸组加入α-亚麻酸溶液(12.5、25、50和100 μmol/L),在培养箱中培养12 h后,NC组正常换液,模型组和α-亚麻酸组分别加入1 μg/mL的LPS溶液2 mL,12 h后收集上清。按照ELISA试剂盒说明书检测MCP-1、IL-4和IL-13的含量。
1.2.4 活性氧(ROS)释放量测定
巨噬细胞处理同1.2.3。去除旧培养基后,α-亚麻酸组加入不同浓度的α-亚麻酸(12.5、25、50、100 μmol/L)培养12 h后再加入1 μg/mL的脂多糖溶液继续培养12 h。模型组更换新鲜培养基,继续培养12 h后加入1 μg/mL的脂多糖溶液培养12 h。达到培养时间后,去除旧培养基,加入含有10 mmol/L DCFH-DA的培养基1 mL,37 ℃避光孵育30 min。反应结束后,加入PBS缓冲液润洗孔板中的细胞3次,用荧光分光光度法检测。
1.2.5 超氧化物歧化酶(SOD)活力测定、丙二醛(MDA)和还原型谷胱甘肽(GSH)相对含量测定
参照1.2.3的方法培养巨噬细胞,24 h后吸出旧培养基并加入2 mL PBS清洗3次。使用预制备的裂解液(PMSF:IP裂解液=1:99),放入冰箱裂解8 min,用吸管枪反复吸收裂解液,吹打孔板底,然后转移到2 mL EP管中。4 ℃,10000 r/min离心5 min,离心后将上清吸收到新的EP管中备用。根据试剂盒说明书测定超氧化物歧化酶(SOD)活性、丙二醛(MDA)和谷胱甘肽(GSH)的含量。
1.2.6 蛋白免疫印迹法检测TLR4/MyD88/NF-κB信号通路蛋白表达情况
按照1.2.5处理巨噬细胞。裂解细胞后,体内的总蛋白采用BCA蛋白检测试剂盒测定。接着进行蛋白免疫印迹实验。配制电泳液,加入各组样品。电泳结束后,用专用板撬开玻璃板,比对Marker用剪刀剪出目标蛋白,转移到PVDF膜上。覆盖一层转移膜棉,形成棉花、膜、胶、棉的“三明治”结构,最后轻轻擀出气泡进行转膜。将目标条带置于5% BSA中室温孵育45 min,加入相应一抗,4 ℃冰箱孵育过夜。回收一抗,用TBST洗涤三次,在条带盒中加入对应的二抗。最后加入Super ECL Plus显色液在凝胶成像仪中检测蛋白灰度值。通过条带的灰度值来估算蛋白的相对表达量并使用Image Lab软件进行条带的灰度分析,从而实现半定量分析。
1.3 数据处理
所有实验进行三次平行重复。所有结果均以平均值±标准差(Mean±SD)表示。采用Graphpad prism 8.0进行单因素方差分析(ANOVA)。与正常组相比,P<0.05(#)显著,P<0.01(##)极显著。与模型组相比,P<0.05(*)显著,P<0.01(**)极显著。
2. 结果与分析
2.1 α-亚麻酸对巨噬细胞RAW264.7细胞存活率的影响
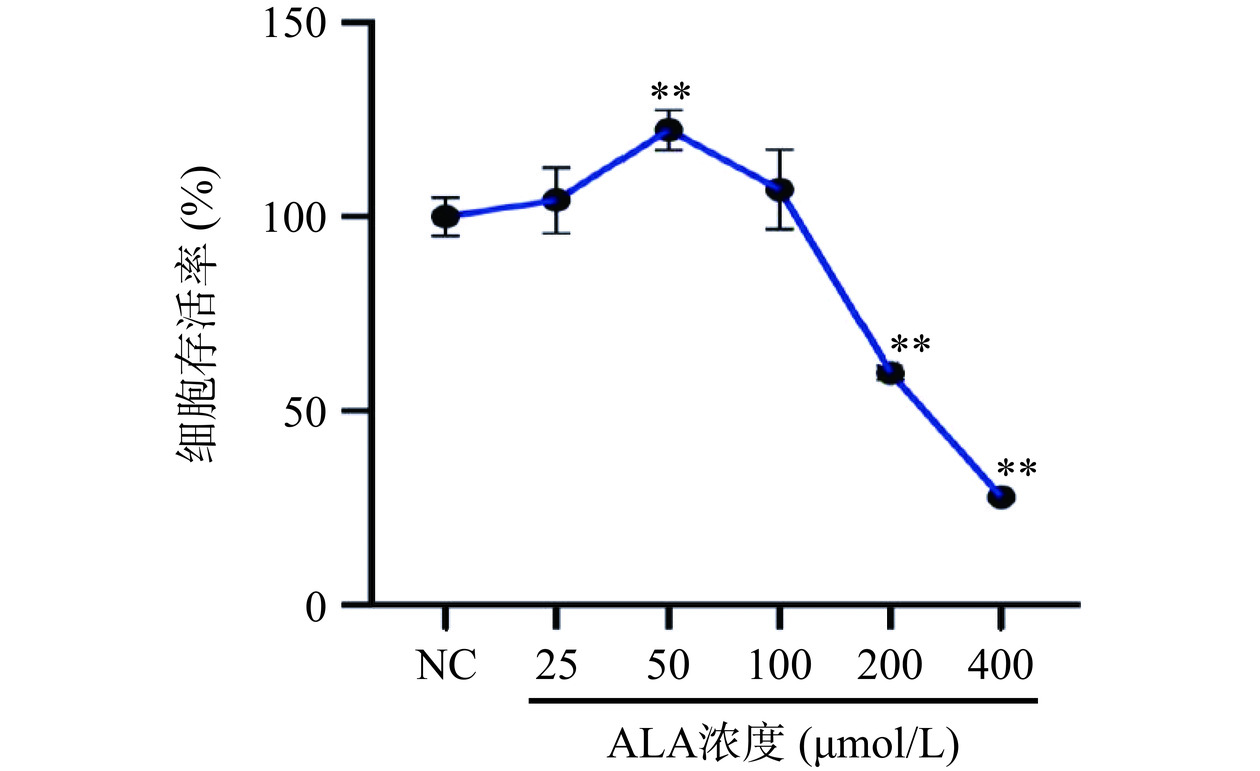
为了评价α-亚麻酸(ALA)对巨噬细胞存活率的影响,采用MTT比色法测定α-亚麻酸(0~400 μmol/L)对巨噬细胞的细胞毒性损伤。如图1所示,在0~100 μmol/L实验浓度范围内,存活率均在90%以上,且50 μmol/L的ALA能够促进细胞增殖,说明α-亚麻酸对巨噬细胞无毒性作用。当浓度为200和400 μmol/L时,细胞存活率呈陡崖式下降,分别为59.78%和27.75%,说明此时ALA对细胞有极显著毒性作用(P<0.01),抑制细胞生长。因此,选取0~100 μmol/L剂量范围内12.5、25、50、100 μmol/L四个浓度进行后续实验。
2.2 α-亚麻酸对炎症因子分泌量的影响
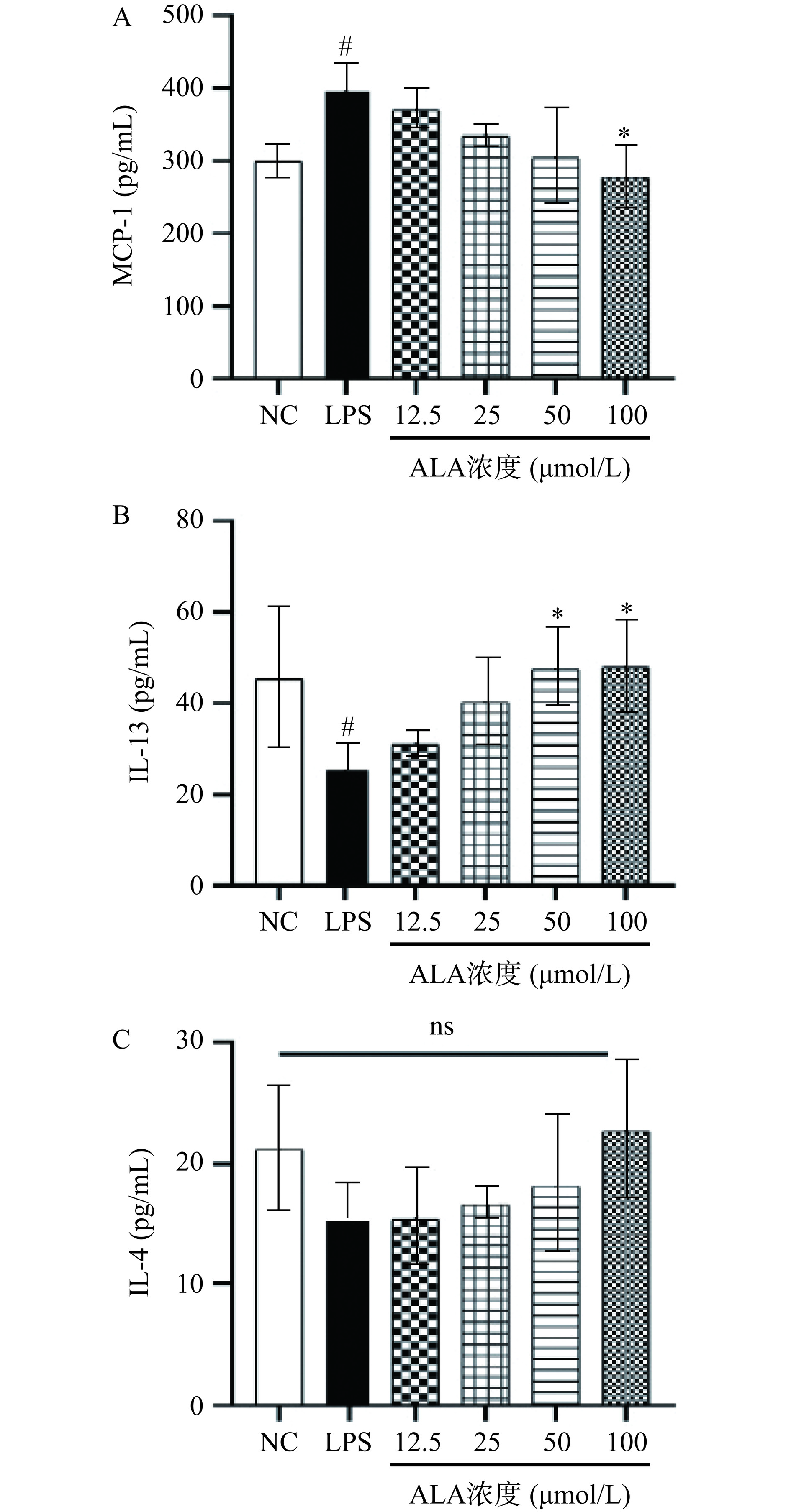
巨噬细胞是一种参与调节机体各种生理病理过程的先天免疫细胞[2]。在干扰素-γ单独或与LPS联合作用下,巨噬细胞倾向于表现出M1表型的促炎分化,其特征是释放各种细胞因子和衍生介质,促进淋巴细胞成熟,从而驱动适应性炎症反应和病理损伤[3]。小鼠单核细胞趋化蛋白-1(MCP-1)是调节巨噬细胞迁移和炎性浸润的关键驱动因子之一,而在炎症环境中活化的巨噬细胞也可以分泌抗炎因子IL-4和IL-13等来达到促炎和抗炎的平衡[20]。由图2A~2C得出,与正常组相比,脂多糖处理能够使MCP-1水平显著上升,IL-13水平显著降低(P<0.05),而对IL-4水平影响不显著(P>0.05)。α-亚麻酸干预后,与模型组相比,100 μmol/L的剂量可以显著降低MCP-1的分泌(P<0.05),50和100 μmol/L的ALA显著促进了IL-13的分泌(P<0.05)。但是在IL-4指标上并未表现出理想效果,差异均不显著(P>0.05)。因此,总的来说α-亚麻酸可以通过抑制MCP-1的分泌和促进IL-13的分泌来调节炎症反应。
2.3 α-亚麻酸对ROS分泌量的影响
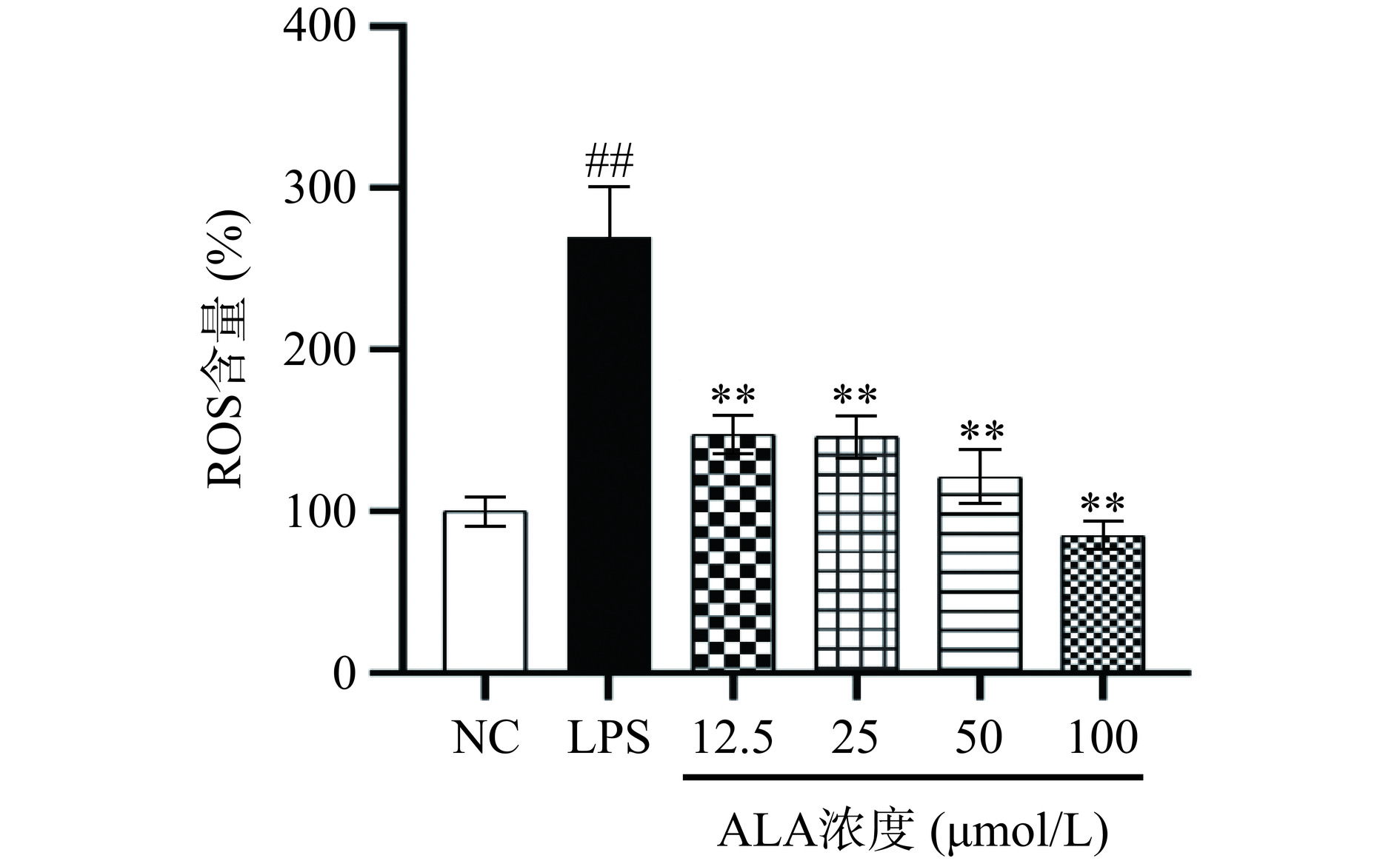
ROS主要由细胞自身、外源环境或其他生物反应副产物产生,作为细胞毒性分子在炎症反应中发挥重要作用。ROS调节分子信号通路(如MAPK和NF-κB通路),增加细胞因子表达[21]。为了确定α-亚麻酸对炎性巨噬细胞ROS分泌的影响,采用荧光探针DCFH-DA进行染色测定荧光强度。脂多糖刺激后巨噬细胞ROS分泌量极显著上升(P<0.01),约是正常组的2.7倍。不同浓度的α-亚麻酸预处理细胞可以极显著降低ROS的水平(P<0.01),并且在25~100 μmol/L之间有明显的剂量依赖性(图3)。高剂量的α-亚麻酸(100 μmol/L),其ROS的分泌甚至低于对照组,仅为89.83%,表明α-亚麻酸对脂多糖诱导的ROS的异常分泌上具有显著抑制效果。此结果和张博等[21]一致,ALA可以降低ROS的产生,显著增强体外后绵羊卵母细胞的抗氧化能力。
2.4 α-亚麻酸缓解ROS介导的氧化应激水平
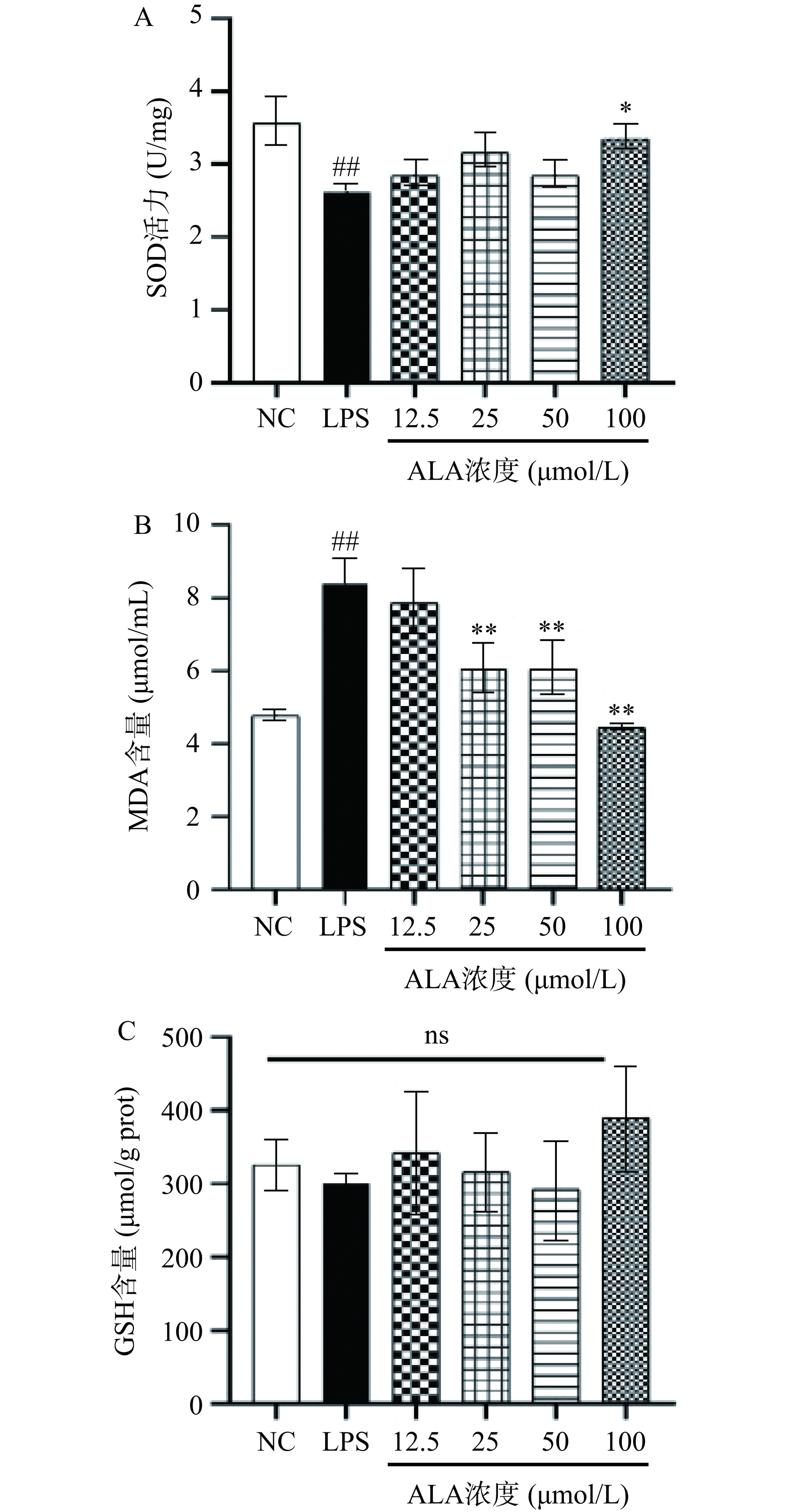
氧化还原平衡反应也参与了炎症反应中巨噬细胞的起始、进展和消退过程[22−24]。许多研究表明,在炎性巨噬细胞中,活性氧自由基ROS介导的氧化应激可导致蛋白质变性、线粒体损伤、脂质过氧化积累、超氧化物歧化酶SOD水平降低[25]。α-亚麻酸的干预对炎性巨噬细胞RAW264.7氧化应激水平的影响如图4A~4C所示。与正常组相比,LPS刺激后导致SOD酶活力极显著下降到2.64 U/mg,造成MDA过度堆积(P<0.01),从正常组的4.78 μmol/mL累积到8.38 μmol/mL,是原来的1.75倍,对GSH含量虽有抑制趋势,但是差异不显著(P>0.05),说明脂多糖成功诱导炎症造成氧化损伤。高浓度的α-亚麻酸(100 μmol/L)处理后能显著恢复SOD酶的活性(P<0.05),含量达到3.34 U/mg,而对于GSH虽有增加的趋势,但差异不具有显著意义(P>0.05)。α-亚麻酸浓度在25~100 μmol/L之间对MDA均具有极显著清除效果(P<0.01)。这些结果表明,α-亚麻酸可以减少脂多糖诱导的ROS介导的氧化应激反应,以对抗炎性氧化损伤。
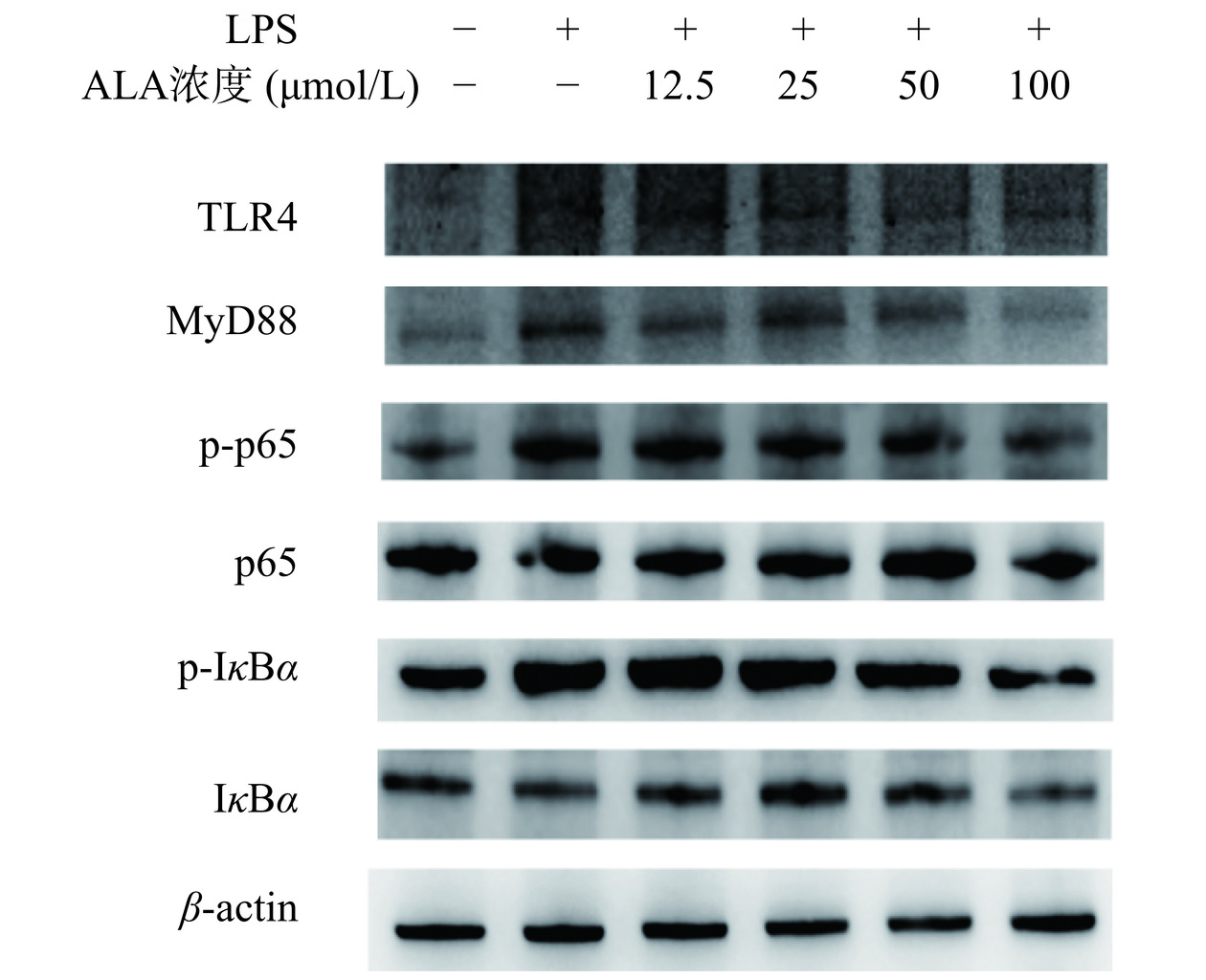
2.5 α-亚麻酸调控TLR4/MyD88/NF-κB信号通路
TLR4不仅参与外源性免疫反应,还作为内源性炎症反应的细胞膜受体[26]。其介导的信号传递是炎症激活和炎症反应的关键途径。TLR4与接头蛋白MyD88结合后,可通过MAPK通路激活核转录因子,从而调节多种炎症介质的分泌[27]。为了验证α-亚麻酸是否通过TLR4及下游级联途径抑制巨噬细胞活化,采用Western blot检测TLR4、MyD88蛋白的表达。如图5和图6A结果显示,与正常组相比,LPS成功激活了TLR4,其表达量是正常组的1.63倍(P<0.01),并对MyD88进行了信号转导,其表达量是正常组的1.48倍(P<0.05)。而50和100 μmol/L的α-亚麻酸极显著抑制了TLR4的激活(P<0.01),其表达量分别为1.23和1.27,但12.5和25 μmol/L的剂量组与模型组之间并未表现出显著差异(P>0.05)。同样图6B结果表明ALA在影响接头蛋白MyD88过程中,12.5和25 μmol/L的剂量并未显著影响蛋白表达(P>0.05),而50 μmol/L则表现出显著的抑制作用(P<0.05),100 μmol/L的浓度极显著抑制MyD88的表达(P<0.01),MyD88相对表达量仅为0.89。
NF-κB是一种参与免疫和炎症相关基因调控的转录因子,可能是促炎细胞因子释放的关键旋钮[28]。作为MyD88下游的另一种信号通路受体蛋白,本研究探究了不同浓度α-亚麻酸干预脂多糖诱导的炎性巨噬细胞后NF-κB信号通路的激活情况。如图6C和6D所示,LPS刺激后p-NF-κB p65与NF-κB p65之比、p-IκBα与IκBα之比较正常组极显著升高(P<0.01),分别是正常组的1.52倍和2.50倍。经α-亚麻酸干预炎性巨噬细胞后,12.5~50 μmol/L的剂量并不能显著抑制IκBα的磷酸化(P>0.05),但100 μmol/L的高剂量浓度下表现出磷酸化受阻(P<0.05)。NF-κB p65的磷酸化水平在12.5和25 μmol/L的剂量下无明显变化,但随着剂量浓度升高到50和100 μmol/L时,蛋白磷酸化则显著受到抑制(P<0.05),分别是正常组的1.17倍和1.09倍。此结果与其他n-3不饱和脂肪通过抑制NF-κB蛋白活性发挥抗炎作用一致。α-亚麻酸初级代谢产物EPA和DHA能够降低由脂多糖引起的NF-κB激活和环氧合酶的表达[29],同时n-3不饱和脂肪酸能够抑制IκBα的磷酸化使其不能降解,阻止三聚体NF-κB无法进入细胞核,细胞内信号传递受阻,基因表达无法完成。因此,结果表明α-亚麻酸的干预可以调节炎性巨噬细胞TLR4/MyD88/NF-κB信号通路的激活情况。
3. 结论
综上所述,本实验利用脂多糖构建的巨噬细胞炎症模型,证实了α-亚麻酸对炎症巨噬细胞的抗炎和抗氧化活性是通过调节ROS介导的TLR4/MyD88/NF-κB信号通路发挥作用。这种作用是通过抑制TLR4受体结合,阻断MyD88信号传递,抑制NF-κB的核易位,降低活性氧的表达,清除过度堆积的脂质过氧化物,从而影响巨噬细胞中MCP-1、IL-4、IL-13等炎症因子的分泌水平、GSH含量和SOD蛋白酶的活性。本研究加深了对α-亚麻酸抗炎作用机制的了解,且富含α-亚麻酸的食用油可作为一种天然抗炎物质应用于食品及保健品等领域,同时该项研究也为进一步开发α-亚麻酸生物活性制剂提供了理论基础和参考依据。
-
-
[1] YE Y, WANG Y, YANG Y, et al. Aloperine suppresses LPS-induced macrophage activation through inhibiting the TLR4/NF-κB pathway[J]. Inflammation Reseach,2020,69:375−383.
[2] LOCATI M, CURTALE G, MANTOVANI A. Diversity, mechanisms, and significance of macrophage plasticity[J]. Annual Review of Pathology,2020,15:123−147. doi: 10.1146/annurev-pathmechdis-012418-012718
[3] SHAPOURI-MOGHADDAM A, MOHAMMADIAN S, VAZINI H, et al. Macrophage plasticity, polarization, and function in health and disease[J]. Journal of Cell Physiology,2018,233:6425−6440.
[4] SUN Q, HU S, LOU Z, et al. The macrophage polarization in inflammatory dermatosis and its potential drug candidates[J]. Biomedicine & Pharmacotherapy,2023,161:114469.
[5] YU C, WANG D, LI Q, et al. Trans-anethole ameliorates LPS-induced inflammation via suppression of TLR4/NF-κB pathway in IEC-6 cells[J]. International Immunopharmacology,2022,108:108872. doi: 10.1016/j.intimp.2022.108872
[6] BRUNE B, DEHNE N, GROSSMANN N, et al. Redox control of inflammation in macrophages[J]. Antioxidants Redox Signaling,2013,19:595−637. doi: 10.1089/ars.2012.4785
[7] 李鸿洋, 李敬双, 高泉颀, 等. 大蒜素对脂多糖诱导腹腔巨噬细胞炎症反应的抑制作用及机制[J]. 食品工业科技,2020,41(18):308−313,323. [LI H Y, LI J S, GAO Q Q, et al. Inhibitory effect of allicin on lipopolysaccharide-induced inflammation of peritoneal macrophages and its mechanism[J]. Science and Technology of Food Industry,2020,41(18):308−313,323.] LI H Y, LI J S, GAO Q Q, et al. Inhibitory effect of allicin on lipopolysaccharide-induced inflammation of peritoneal macrophages and its mechanism[J]. Science and Technology of Food Industry, 2020, 41(18): 308−313,323.
[8] 姜特, 李来来, 柴艺汇, 等. 基于TLR4/MyD88/NF-κB信号通路探讨热淋清颗粒对LPS诱导的MH-S小鼠肺泡巨噬细胞的抗炎作用机制[J]. 中药材,2023,10:2591−2594. [JIANG T, LI L L, CHAI Y H, et al. To investigate the anti-inflammatory mechanism of reluqing granules on LPS induced MH-S mouse alveolar macrophages based on TLR4/MyD88/NF-κB signaling pathway[J]. Traditional Chinese Medicinal Materials,2023,10:2591−2594.] JIANG T, LI L L, CHAI Y H, et al. To investigate the anti-inflammatory mechanism of reluqing granules on LPS induced MH-S mouse alveolar macrophages based on TLR4/MyD88/NF-κB signaling pathway[J]. Traditional Chinese Medicinal Materials, 2023, 10: 2591−2594.
[9] KIM K B, NAM Y A, KIM H S, et al. Alpha-linolenic acid:Nutraceutical, pharmacological and toxicological evaluation[J]. Food and Chemical Toxicology,2014,70:163−178. doi: 10.1016/j.fct.2014.05.009
[10] HASSAN A, IBRAHIM A, MBODJI K, et al. An alpha-linolenic acid-rich formula reduces oxidative stress and inflammation by regulating NF-κB in rats with TNBS-induced colitis[J]. Journal of Nutrition,2010,140:1714−1721.
[11] SALA-VILA A, FLEMING J, KRIS-ETHERTON P, et al. Impact of α-linolenic acid, the vegetable ω-3 fatty acid, on cardiovascular disease and cognition[J]. Advances in Nutrition,2022,13:1584−1602. doi: 10.1093/advances/nmac016
[12] 田福忠, 彭勇, 周天华, 等. α-亚麻酸在疾病治疗中的研究进展[J]. 农业与技术,2019,39:23−24. [TIAN F Z, PENG Y, ZHOU T H, et al. Research progress of α-linolenic acid in the treatment of diseases[J]. Agriculture and Technology,2019,39:23−24.] TIAN F Z, PENG Y, ZHOU T H, et al. Research progress of α-linolenic acid in the treatment of diseases[J]. Agriculture and Technology, 2019, 39: 23−24.
[13] 吴晓霞, 徐亮, 綦晓龙. ω-3多不饱和脂肪酸的免疫调节功能研究进展[J]. 现代诊断与治疗,2009,20:227−230. [WU X X, XU L, QI X L. Research progress on immunomodulatory function of omega-3 polyunsaturated fatty acids[J]. Modern Diagnosis and Treatment,2009,20:227−230.] doi: 10.3969/j.issn.1001-8174.2009.04.016 WU X X, XU L, QI X L. Research progress on immunomodulatory function of omega-3 polyunsaturated fatty acids[J]. Modern Diagnosis and Treatment, 2009, 20: 227−230. doi: 10.3969/j.issn.1001-8174.2009.04.016
[14] 徐建国, 徐敏. ω-3多不饱和脂肪酸与炎症及免疫功能[J]. 实用医学杂志,2008,24:3978−3980. [XU J G, XU M. Omega-3 polyunsaturated fatty acids and inflammation and immune function[J]. Journal of Practical Medicine,2008,24:3978−3980.] doi: 10.3969/j.issn.1006-5725.2008.22.079 XU J G, XU M. Omega-3 polyunsaturated fatty acids and inflammation and immune function[J]. Journal of Practical Medicine, 2008, 24: 3978−3980. doi: 10.3969/j.issn.1006-5725.2008.22.079
[15] 任杰, 杨泽华, 郑圣顕, 等. α-亚麻酸的体外抗炎作用机制研究[J]. 云南大学学报,2009,31:419−426. [RENG J, YANG Z H, ZHENG S X, et al. Study on anti-inflammatory mechanism of α-linolenic acid in vitro[J]. Journal of Yunnan University,2009,31:419−426.] RENG J, YANG Z H, ZHENG S X, et al. Study on anti-inflammatory mechanism of α-linolenic acid in vitro[J]. Journal of Yunnan University, 2009, 31: 419−426.
[16] BURDGE G C. Polyunsaturated fatty acid intakes and α-linolenic acid metabolism[J]. The American Journal of Clinical Nutrition,2011,93:665−666.
[17] KIM J, AHN M, CHOI Y, et al. Alpha-linolenic acid alleviates dextran sulfate sodium-induced ulcerative colitis in mice[J]. Inflammation,2020,43:1876−1883. doi: 10.1007/s10753-020-01260-7
[18] 曲航, 高鑫, 伊娟娟, 等. 红松松仁多糖对脂多糖诱导RAW264.7细胞炎症反应的抑制作用[J]. 食品工业科技,2020,41(11):328−334. [QU H, GAO X, YIN J J, et al. Inhibitory effect of pine kernel polysaccharide on lipopolysaccharide-induced inflammation of RAW264.7 cells[J]. Science and Technology of Food Industry,2020,41(11):328−334.] QU H, GAO X, YIN J J, et al. Inhibitory effect of pine kernel polysaccharide on lipopolysaccharide-induced inflammation of RAW264.7 cells[J]. Science and Technology of Food Industry, 2020, 41(11): 328−334.
[19] 赵倩, 戴天浥, 洪文龙, 等. 铁皮石斛糖蛋白对皮肤炎症期的调控作用及机制[J]. 食品工业科技,2020,41(21):304−310,316. [ZHAO Q, DAI T Y, HONG W L, et al. Regulation and mechanism of Dendrobium officinale glycoprotein on skin inflammation stage[J]. Science and Technology of Food Industry,2020,41(21):304−310,316.] ZHAO Q, DAI T Y, HONG W L, et al. Regulation and mechanism of Dendrobium officinale glycoprotein on skin inflammation stage[J]. Science and Technology of Food Industry, 2020, 41(21): 304−310,316.
[20] SARMIENTO-SALINAS F L, PEREZ-GONZALEZ A, ACOSTA-CASIQUE A, et al. Reactive oxygen species:Role in carcinogenesis, cancer cell signaling and tumor progression[J]. Life Sciences,2021,284:119942. doi: 10.1016/j.lfs.2021.119942
[21] 张博, 宋玉坤, 努日比娅姆·麦麦提托合提, 等. α-亚麻酸通过提高GSH水平、降低ROS水平促进绵羊卵母细胞抗氧化与氧化平衡能力[J]. 中国畜牧杂志,2020,56(1):21−24. [ZHANG B, SONG Y K, NURIBIYAMU M M T T H T, et al. α-Linolenic acid can promote the antioxidant and oxidative balance ability of sheep oocytes by increasing GSH level and decreasing ROS level[J]. Chinese Journal of Animal Science,2020,56(1):21−24.] ZHANG B, SONG Y K, NURIBIYAMU M M T T H T, et al. α-Linolenic acid can promote the antioxidant and oxidative balance ability of sheep oocytes by increasing GSH level and decreasing ROS level[J]. Chinese Journal of Animal Science, 2020, 56(1): 21−24.
[22] VALKO M, LEIBFRITZ D, MONCOL J, et al. Free radicals and antioxidants in normal physiological functions and human disease[J]. The International Journal of Biochemistry & Cell Biology,2007,39:44−84.
[23] MOLONEY J N, COTTER T G. ROS signalling in the biology of cancer[J]. Seminars in Cell & Developmental Biology,2018,80:50−64.
[24] 南瑛, 赵美娜, 张薇. α-亚麻酸抑制高脂诱导的脂肪细胞氧化应激和促炎因子的释放[J]. 免疫学杂志,2018,34:921−927. [NAN Y, ZHAO M N, ZHANG W. α-Linolenic acid inhibits hyperlipid-induced oxidative stress and the release of proinflammatory factors in adipocytes[J]. Journal of Immunology,2018,34:921−927.] NAN Y, ZHAO M N, ZHANG W. α-Linolenic acid inhibits hyperlipid-induced oxidative stress and the release of proinflammatory factors in adipocytes[J]. Journal of Immunology, 2018, 34: 921−927.
[25] ROCHA D M, CALDAS A P, OLIVEIRA L L, et al. Saturated fatty acids trigger TLR4-mediated inflammatory response[J]. Atherosclerosis,2016,244:211−215. doi: 10.1016/j.atherosclerosis.2015.11.015
[26] BAYER A L, ALCAIDE P. MyD88:At the heart of inflammatory signaling and cardiovascular disease[J]. Journal of Molecular and Cellular Cardiology,2021,161:75−85. doi: 10.1016/j.yjmcc.2021.08.001
[27] LI Y, ZHANG L, REN P, et al. Qing-Xue-Xiao-Zhi formula attenuates atherosclerosis by inhibiting macrophage lipid accumulation and inflammatory response via TLR4/MyD88/NF-κB pathway regulation[J]. Phytomedicine,2021,93:153812. doi: 10.1016/j.phymed.2021.153812
[28] LIU P, LI Y, WANG W, et al. Role and mechanisms of the NF-κB signaling pathway in various developmental processes[J]. Biomedicne and Pharmacotherapy,2022,153:113513. doi: 10.1016/j.biopha.2022.113513
[29] GODBOUT J P, BERG B M, KRZYSZTON C, et al. A-tocopherol attenuates NFκB activation and pro-inflammatory cytokine production in brain and improves recovery from lipopolysaccharide-induced sickness behavior[J]. Journal of Neuroimmunology,2005,169:97−105. doi: 10.1016/j.jneuroim.2005.08.003





 下载:
下载:

 下载:
下载:



