Pickering Emulsion by OSA-modified Starch with Different Molecular Structures and Its Releasing Property
-
摘要: 淀粉作为Pickering乳液的常用载体材料,在生物活性物质输送中有较广泛的应用。针对淀粉链结构对其Pickering乳液的影响,本研究以普通玉米淀粉(Corn)和蜡质玉米淀粉(Waxy)为原料,先经辛烯基琥珀酸(OSA)改性后,再分别经酸降解(Acid Degradation,AD)或酸热复合降解(Acid-heat Composite Degradation,AH)获得4种具有不同分子结构的淀粉基材料,并制备相应的Pickering乳液。通过傅里叶红外光谱、X-射线衍射分析、排阻色谱法对材料结构进行表征,并对相应的Pickering乳液的粒径、ζ-电位及释放特性等进行研究。结果表明,酸降解得到的辛烯基琥珀酸玉米淀粉酯(OSA-AD-Corn)具有一定的有序结构,且短链分子数量约为90.7%±0.02%,链长分布更为均匀。受链结构影响,OSA-AD-Corn Pickering乳液具有较小的尺寸和较大的表面电位。在后续的模拟消化实验中,该乳液在模拟小肠部位释放的游离脂肪酸达42.86%±0.54%。在功能因子控释方面,OSA-AD-Corn Pickering乳液可稳定递送姜黄素,在模拟胃液和小肠液中的释放率分别为52.48%±0.42%和27.98%±0.22%,相较于其他淀粉基载体材料,能控制更多的功能因子递送在小肠部位。本研究结果为活性功能因子的生物高效利用提供合适的载体材料。
-
关键词:
- 辛烯基琥珀酸淀粉酯 /
- 淀粉基Pickering乳液 /
- 功能因子控释
Abstract: As a carrier material, starch has a wider application in the delivery of bioactive compounds. Targeting the effects of starch chain structure on the characteristics of Pickering emulsion, this study used normal corn starch (Corn) and waxy corn starch (Waxy) as raw materials, and octenyl succinic acid (OSA) modification was applied to obtain OSA modified starch. These modified starches were then subjected to acid degradation (AD) or acid-heat composite degradation (AH) to obtain four starch-based materials with different molecular structures, which were then used to prepare Pickering emulsions respectively. The structure of the prepared starch materials were characterized using fourier transform infrared spectroscopy, X-ray diffraction, and size exclusion chromatography, and particle size, ζ-potential, and releasing property corresponding Pickering emulsions were also investigated. The results showed that after acid hydrolysis, the OSA corn starch subjected to acid degradation (OSA-AD-Corn) remained some ordered structure, while its chain length distribution was more was uniformly distributed with a proportion of short chains being 90.7%±0.02%. Related with the chain structure, the OSA-AD-Corn Pickering emulsion had smaller particle sizes and a higher ζ-potential. The following in vivo digestion results showed that this Pickering emulsion had 42.86%±0.54% free fatty acid releasing in small intestine. And in terms of the release of functional components, the OSA-AD-Corn Pickering emulsion provided stable delivery of curcumin, which the releasing rate in simulated gastric fluid and small intestinal fluid being 52.48%±0.42% and 27.98%±0.22%, respectively. Compared with other starch-based materials, the OSA-AD-Corn starch sample could deliver more bioactive ingredients to the small intestinal. These results would provide information for producing appropriate carrier materials for the efficient utilization of functional compounds. -
Pickering乳液是一种由固体颗粒而非传统的小分子表面活性剂稳定的乳液,具有储存稳定性高、环境污染小、乳化剂用量少等优点[1−2]。亲脂性生物活性物质在水中的分散性较差,难以直接被胃肠道吸收而降低其生物利用度,而Pickering乳液则有利于脂溶性活性物质分散,具有良好的生物相容性,进而提高脂溶性成分的吸收利用,提高了活性物质的生物利用率。
天然大分子(如:淀粉、果胶、壳聚糖、蛋白质等)是稳定Pickering乳液的常用材料来源,具有生物相容性好和环境友好等特点[3−4]。天然淀粉由直链淀粉和支链淀粉构成,由于淀粉具有大量羟基亲水基团而影响实际使用,需要通过改性调控淀粉分子结构和性能,以满足Pickering乳液的稳定需求[3−6]。Li等[5]在利用改性淀粉稳定Pickering乳液时发现,即使经过31 d的储存,姜黄素仍保留了55.38%。Yan等[7]将改性淀粉与壳聚糖结合生成复合物,改善了油水界面的润湿性,降低了乳液的界面张力,所制得的Pickering乳液在酸性环境中仍然保持稳定。Marefati等[8]利用改性藜麦淀粉稳定Pickering乳液,乳液储存8年仍保持稳定,不发生凝聚。
随着对淀粉基Pickering乳液的深入研究,发现乳液的功能特性与淀粉基材料的分子结构和特性(如淀粉的不同取代度、晶体结构和分子量等)密切相关。Chang等[9]使用辛烯基琥珀酸酐(Octenyl Succinic Anhydride,OSA)改性蜡质玉米淀粉,当油相体积分数在40%~74%时,形成的Pickering乳液的稳定性随着取代度(Degree of Substitution,DS)的增加而增加。Zheng等[10]通过酸水解处理高直链玉米淀粉,制备相应的Pickering乳液,并对吲哚-3-甲醇进行包埋,研究发现在载体材料较高取代度情况下,Pickering乳液有良好的储存稳定性,包封率高达80%。另外,Qin等[11]以不同脱支程度和聚合度(Degree of Polymerization,DP)的直链淀粉为原料,制备脱支淀粉纳米颗粒及相应的姜黄素Pickering乳液,控制DP,乳液中姜黄素包埋率最高可达92.49%。淀粉基Pickering乳液在功能因子递送方面得到了广泛的应用与研究,但受淀粉材料的分子结构差异影响,Pickering乳液的性能有所差异,进而影响了功能因子的高效生物利用。通过文献查阅发现,OSA淀粉取代度、结晶度、聚合度、支化度等对淀粉基Pickering乳液的性能影响已有研究,但淀粉的分子结构复杂,分子量大小/分布、直支比等也会影响淀粉基材料的性质,进而改变Pickering乳液对功能因子的递送效果,而这些方面的研究仍鲜见报道。
因此,本文采用酸降解和酸热复合降解法对辛烯基琥珀酸淀粉改性。对改性前后淀粉进行表征与分析,探究改性处理对OSA淀粉分子结构的影响,并重点探究改性后链结构差异与其淀粉基Pickering乳液递送功能因子性能之间的关系,为后续活性功能因子递送提供合适的载体材料及制备方法,为功能因子生物高效利用提供基础。
1. 材料与方法
1.1 材料与仪器
辛烯基琥珀酸酐 分析纯,广州化学试剂有限公司;普通玉米淀粉、27%直链淀粉和73%支链淀粉 河北古松农产品有限公司;蜡质玉米淀粉 直链淀粉含量≥ 98%,河北古松农产品有限公司;玉米油 食用级,中国嘉里粮油有限公司;α-淀粉酶(12 U/mg)、胃蛋白酶(3000 U/g)、胰蛋白酶(4000 U/g)和糖化酶(100 U/mg) 广东皖东生物科技有限公司;其余试剂均为分析纯。
Vertex 70 傅里叶红外光谱仪 美国赛默飞科技公司;ZS90纳米粒度及Zeta电位分析仪 英国马尔文仪器有限公司;D/Max-200 X射线衍射仪 日本Rigaku Denki公司;GRAM 100 和 GRAM 1000 尺寸排阻色谱 德国Mainz公司;DAWN HELEOS-II 多角度光散射检测器 美国怀亚特公司;Optilab T-rEX 示差检测器 美国怀亚特公司。
1.2 实验方法
1.2.1 辛烯基琥珀酸改性淀粉的制备
参考梁世濠等[12]所采用的OSA淀粉制备方法,配制30%(w/w)的淀粉乳,并用2%的氢氧化钠溶液将淀粉乳pH调至9.0。向淀粉乳中加入OSA,其中,蜡质玉米淀粉改性添加4.2 g OSA,普通玉米淀粉改性添加2.7 g OSA,制备DS为0.001的OSA改性淀粉。根据淀粉不同来源,蜡质玉米淀粉(Waxy)和普通玉米淀粉(Corn)经OSA改性后的淀粉样品,分别命名为OSA-Native-Waxy和OSA-Native-Corn。称取上述合成的OSA改性淀粉50 g(干基),与5 mL 10%的盐酸溶液混合,在25 ℃下放置2 h后在45 ℃下干燥12 h,得到酸降解OSA淀粉材料,不同原料来源的样品,分别命名为OSA-AD-Corn和OSA-AD-Waxy。随后,再分别称取上述制得的50 g酸降解OSA-AD-Corn和OSA-AD-Waxy淀粉(干基),在150 ℃的烘箱中干燥2 h,得到酸热复合改性淀粉材料,不同原料的样品分别命名为OSA-AH-Corn和OSA-AH-Waxy。
1.2.2 淀粉的结构表征
1.2.2.1 结晶结构测定
将样品表面压平放入X-射线衍射仪(X-ray Diffractometer,XRD)中,采用单色Cu-Kα射线,在管压40 kV、管流40 mV、衍射角 (2θ) 扫描区域4°~40°、步长0.033°、扫描速度10°/min条件下进行测试样品的晶体结构。同时,使用MDI Jade软件程序计算样品的相对结晶度。
1.2.2.2 链结构测定
参考Liu等[13]报道的方法,利用傅里叶变换红外光谱测定(Fourier Transform Infrared Spectroscopy,FTIR),对淀粉样品的链结构进行测定。采用溴化钾压片法,以空气为背景,使用红外光谱仪在波长4000~600 cm–1范围内进行光谱扫描,光谱分辨率为4 cm−1,扫描64次后得到样品谱图。
1.2.2.3 链长分布的测定
参考He等[14]报道的方法,运用尺寸排阻色谱法(Size Exclusion Chromatography,SEC)测定淀粉的直链淀粉含量及其淀粉链长的分布。称取6 mg淀粉溶于pH3.5的醋酸盐缓冲液,加入异淀粉酶在37 ℃下解离3 h,并冷冻干燥。将上述冻干样品溶于含有0.5% LiBr的二甲基亚砜(DMSO)溶液中,80 ℃恒温混匀3 h,8000 r/min离心10 min后取100 μL上清液进行色谱分析。以DMSO/LiBr溶液为流动相,在流速为0.6 mL/min、柱温为80 ℃的条件下,对样品进行测定。
1.2.3 淀粉基Pickering乳液的制备及性能分析
称取0.04 g OSA淀粉溶于40 mL蒸馏水,加入2.1 mL玉米油,并用超声波细胞破碎仪超声10 min,得到淀粉基Pickering乳液。将上述淀粉基Pickering乳液用去离子水稀释100倍,超声处理15 min,在25 ℃下分别测定粒径及ζ-电位。每个样品检测3次,结果取平均值。
参考梁世濠等[12]的方法,通过体外模拟消化实验,以模拟小肠液中游离脂肪酸(Free Fatty Acid,FFA)的释放率为指标,考察该乳液对脂溶性物质的递送能力。游离脂肪酸释放率,按下式计算:
游离脂肪酸释放率(%)=VNaOH(t)×CNaOH×Mw油脂2M乳液×100 (1) 其中,VNaOH(t)是时间t所消耗的NaOH溶液体积,mL;CNaOH是所用NaOH的浓度,mol/L;Mw油脂是油脂的平均分子质量,mol/g;M乳液是乳液中油脂的质量,g。
1.2.4 姜黄素在模拟消化过程中的释放情况
在玉米油(0.1%,w/t)中加入姜黄素(Curcumin,CCM),并在避光条件下搅拌12 h。同时,取OSA淀粉溶于40 mL蒸馏水,制备浓度为2%的淀粉悬浮液,再加入2.1 mL含CCM的玉米油,并超声10 min,得到负载CCM的淀粉基Pickering乳液。借助上述的体外模拟消化实验过程,利用三氯甲烷对模拟胃、模拟小肠阶段的消化液中CCM进行萃取收集,并在425 nm下测定紫外吸光度,计算CCM含量,以此计算CCM的释放率。姜黄素释放率的计算公式,如下:
姜黄素释放率(%)=(1−C2C1)×100 其中,C1是姜黄素在原始乳液中的含量,mg;C2是消化后的消化液中姜黄素的含量,mg。
1.3 数据处理
全部试验重复测定3次,结果表示为平均值±标准差,采用Origin 2019、Excel对数据进行绘图和统计分析,用SPSS 22.0软件对数据的显著性差异(P<0.05)进行单因素方差分析。
2. 结果与分析
2.1 OSA淀粉的结构表征
2.1.1 淀粉结晶结构变化
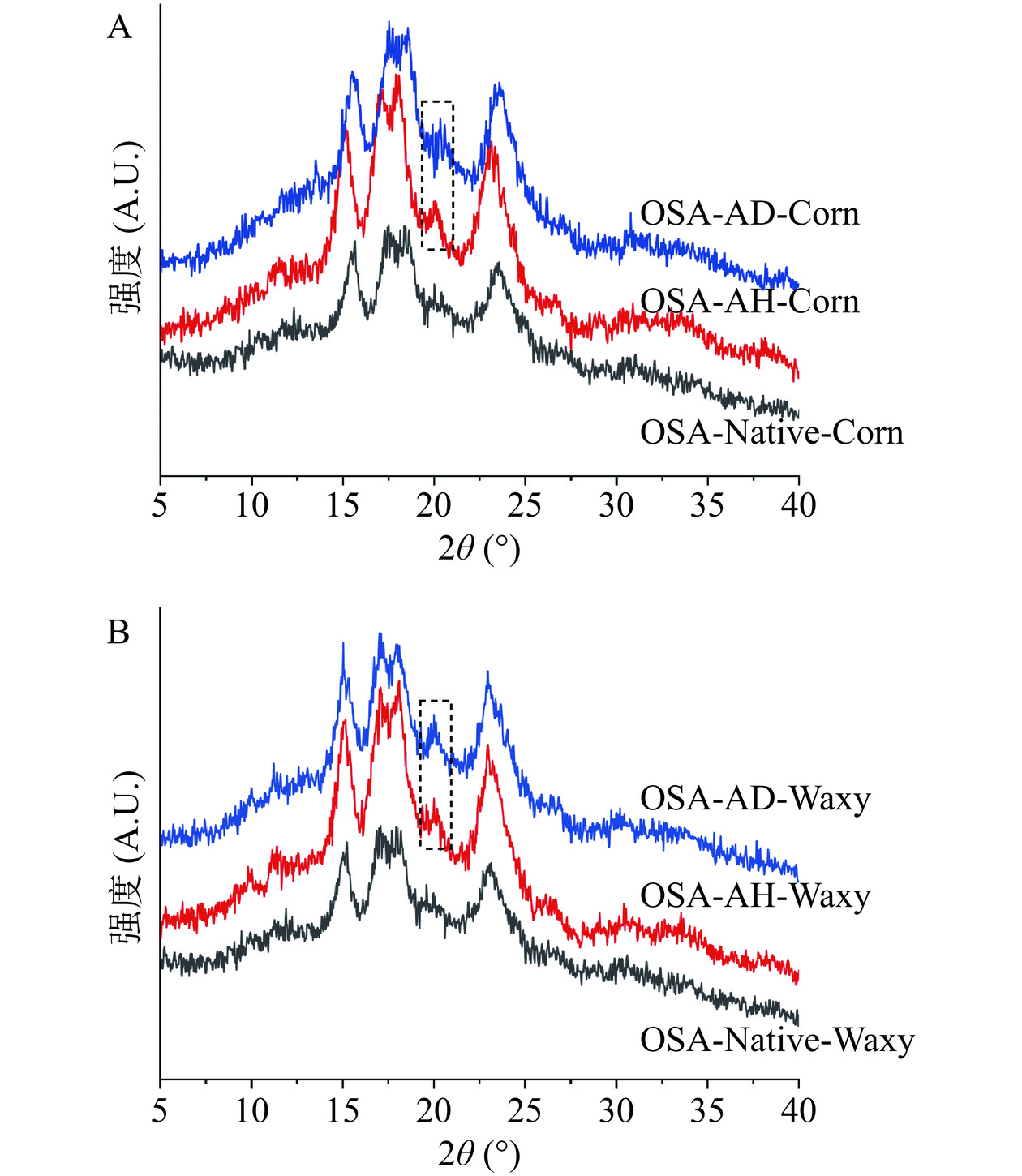
OSA-AD-Corn、OSA-AH-Corn、OSA-Native-Corn、OSA-AD-Waxy、OSA-AH-Waxy和OSA-Native-Waxy六种改性淀粉的XRD谱图,如图1所示。玉米淀粉在15°、17°、18°和23°处有特征峰,为典型的A型结晶结构。改性后,OSA-AD-Corn、OSA-AH-Corn、OSA-AD-Waxy和OSA-AH-Waxy淀粉在20°处观察到一个弱吸收峰,代表V型结晶的形成,即经过酸和热降解处理后,淀粉的晶体结构由A型转变为A+V型,这是由于支链淀粉在降解过程中形成了更多的直链淀粉[15]。利用MDI Jade计算淀粉的相对结晶度,结果如表1所示。由表1可知,与OSA-Native-Corn和OSA-Native-Waxy淀粉相比,经酸降解和酸热复合降解后的样品相对结晶度显著降低(P<0.05)。实验结果表明,经过酸和热处理后淀粉的结晶区被破坏,无定形区的面积增加,但淀粉仍然保留着结晶结构。另外,酸处理的淀粉结晶度大于酸热复合处理淀粉的结晶度,这是因为H+可以渗入结晶层,随后的热处理在一定程度上破坏了淀粉的双螺旋结构,增大了对淀粉结晶结构的破坏程度[16−17]。
表 1 改性淀粉的相对结晶度和短程有序度Table 1. Relative crystallinity (RC) and short-range ordered degree of modified starches样品 相对结晶度(%) R1045/1022 OSA-AD-Corn 37.24±0.83c 0.3869±0.0001a OSA-AH-Corn 30.65±0.65e 0.2637±0.0001c OSA-Native-Corn 40.52±0.45a 0.2788±0.0007b OSA-AD-Waxy 38.19±0.39b 0.2122±0.0015d OSA-AH-Waxy 31.88±0.23d 0.2590±0.0001c OSA-Native -Waxy 40.13±0.27a 0.2733±0.0075b 注:同一列不同小写字母表示显著差异(P<0.05),表2同。 2.1.2 淀粉链结构的变化
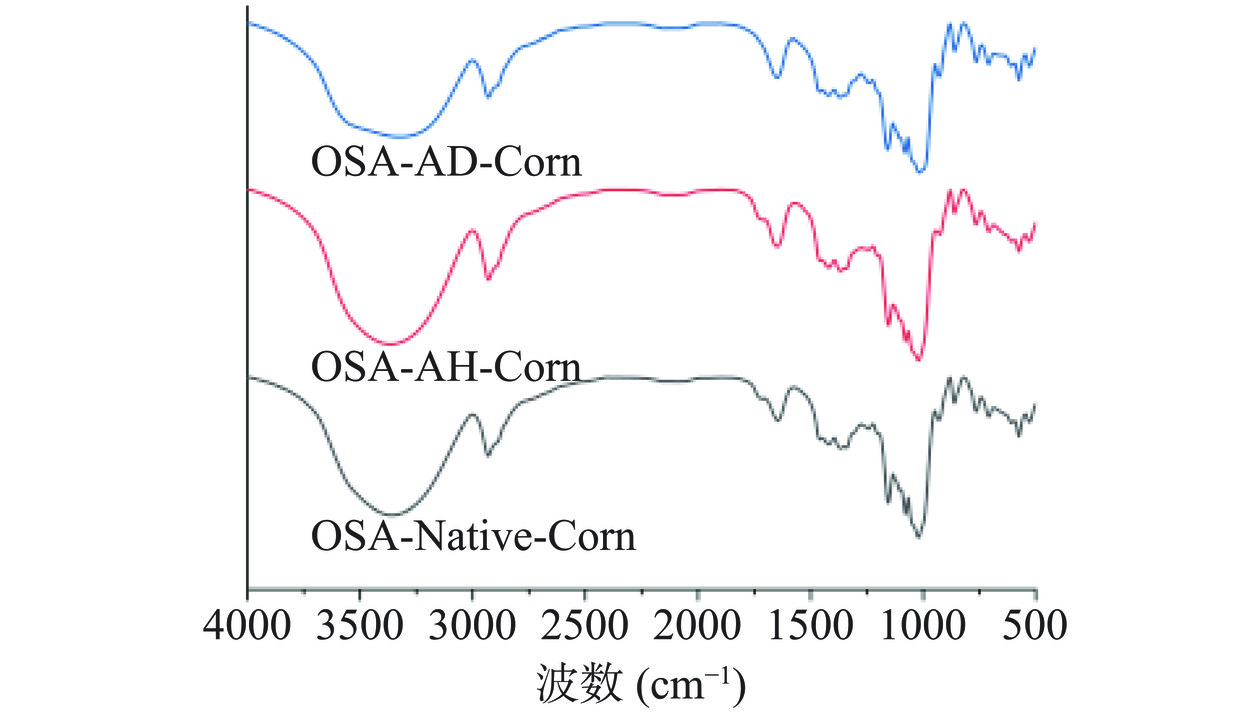
OSA-AD-Corn、OSA-AH-Corn、OSA-Native-Corn、OSA-AD-Waxy、OSA-AH-Waxy和OSA-Native-Waxy六种改性淀粉的FTIR光谱如图2。其中,3600~3200 cm−1范围内出现的宽峰是淀粉分子中O-H的伸缩振动峰,2935 cm−1附近的峰值与葡萄糖中C-H键的拉伸和振动有关。此外,1675 cm−1处的峰是由于淀粉中残余结合水中的-OH剪切振动引起,1250~1000 cm−1区间内出现的峰是C-H和H-C-H弯曲振动引起的[18]。与原淀粉相比,OSA-Corn和OSA-Waxy在1735 cm−1处出现了新的特征峰,是因为淀粉分子发生了酯化反应,由C=O的拉伸振动而引起的[19]。
研究表明,在1045 cm−1和1022 cm−1的特征峰强度分别对淀粉表面的有序结构和无定形结构较为敏感,二者的比值R1045/1022可以用来表征淀粉的表面分子短程有序结构[20]。由表1可知,相比于原淀粉,OSA-AH-Corn和OSA-AH-Waxy的R1045/1022比值显著下降,说明复合降解后淀粉的短程有序结构被破坏,这与XRD分析结果一致。OSA-AD-Waxy的R1045/1022比值下降,原因是酸对淀粉的降解首先发生在无定形区域,而蜡质玉米淀粉的支链淀粉含量极高(98%以上),而颗粒中游离于无定形区域的支链淀粉分子较易被酸渗入并发生水解[21],因此其R1045/1022要低得多。相较于OSA-AD-Waxy,OSA-AD-Corn采用普通玉米淀粉为原料,直链淀粉与支链淀粉均含有α-1,4糖苷键不易被酸水解,从而保留了OSA-AD-Corn的有序结构,故OSA-AD-Corn的R1045/1022比值较高。
2.1.3 淀粉链长分布变化
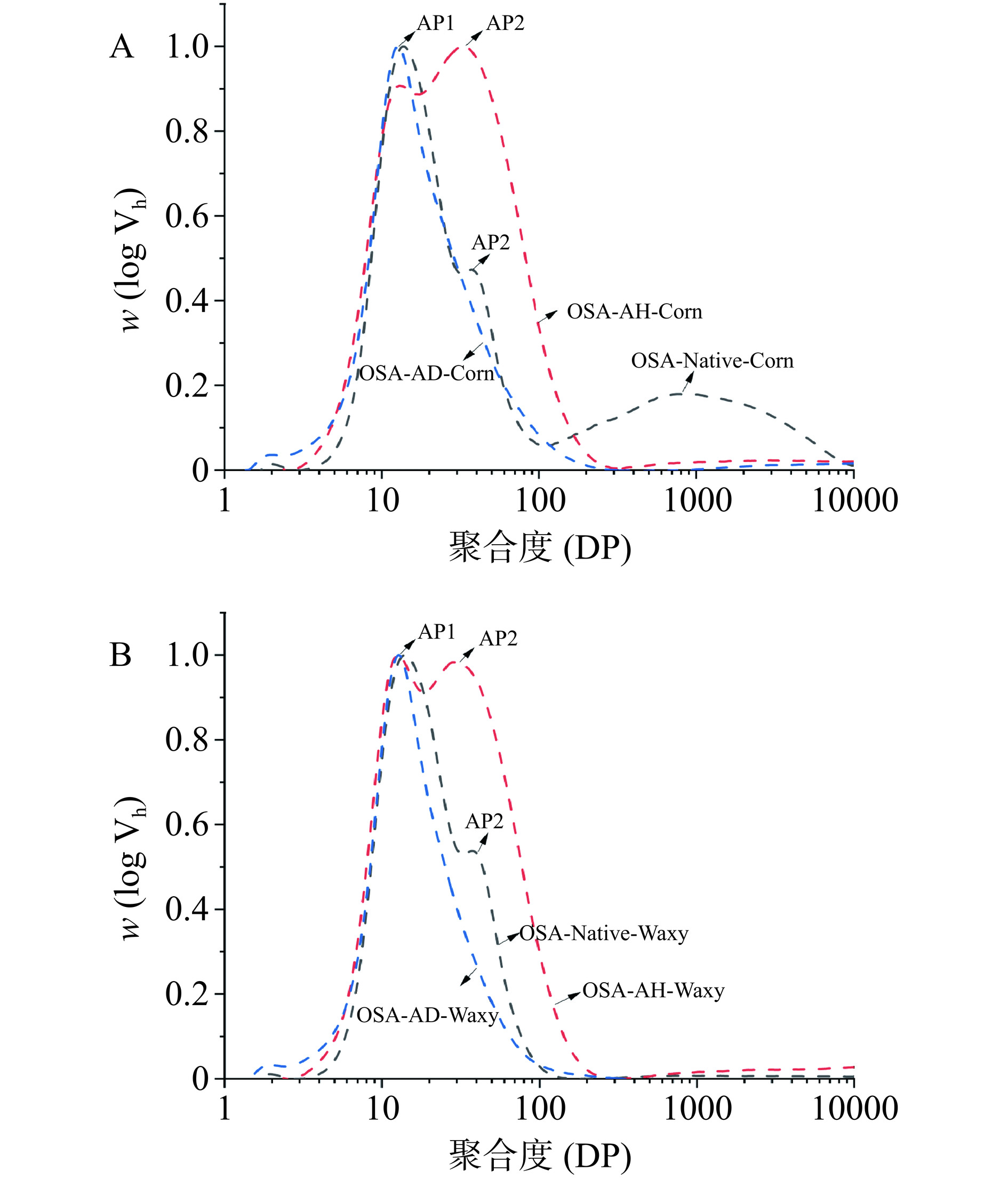
OSA-AD-Corn、OSA-AH-Corn、OSA-Native-Corn、OSA-AD-Waxy、OSA-AH-Waxy和OSA-Native-Waxy六种改性淀粉的淀粉链长分布(Chain Length Distributions,CLDs)见图3。聚合度(Degree of polymerization,DP)>100的脱支链淀粉通常被表征为直链淀粉链,且SEC呈单峰;DP≤100为支链淀粉链,SEC具有两个峰值[22]。
从图3和表2可知,改性后,淀粉材料中直链淀粉的含量明显降低,说明淀粉链在改性处理过程中发生了降解。同时,受蜡质玉米淀粉原料分子结构的影响,OSA-Native-Waxy大多由支链淀粉构成。由此可知,改性过程及原淀粉的差异,均会对改性淀粉的CLD产生影响。
表 2 淀粉材料的链长分布拟合参数Table 2. Fitting parameters for CLDs of starches样品 6<DP<12
(%)12<DP<24
(%)24<DP<36
(%)36<DP<100
(%)100<DP<1000
(%)1000<DP<10000
(%)OSA-Native-Corn 17.8±0.0107d 31.0±0.0035d 10.3±0.0008d 12.2±0.0016e 14.6±0.0095a 12.9±0.0050a OSA-AD-Corn 25.9±0.0027b 37.1±0.0091c 13.2±0.0036c 14.5±0.0061d 1.9±0.0017d 1.6±0.0110bcd OSA-AH-Corn 16.8±0.0048d 26.1±0.0039f 16.6±0.0030a 30.8±0.0061a 5.4±0.0008b 2.9±0.0095b OSA-Native -Waxy 22.9±0.0035c 41.1±0.0059b 15.1±0.0031b 18.0±0.0046c 0.7±0.0042e 1.1±0.0112cd OSA-AD-Waxy 29.0±0.0017a 42.1±0.0045a 12.9±0.0008c 11.0±0.0065f 0.6±0.0015e 0.0±0.0000d OSA-AH-Waxy 17.5±0.0063d 27.9±0.0022e 16.8±0.0002a 29.7±0.0006b 4.1±0.0004c 2.1±0.0110bc 另外,在DP≤100的支链淀粉峰中,第一个峰(AP1)由较短的支链淀粉(DP<30)组成,仅跨越一个结晶片层,而第二个峰(AP2)代表较长的支链淀粉(DP 39~99),可跨越两个或多个结晶片层[23]。在本研究中,改性OSA淀粉在30<DP<100的区间内的比例显著增加(P<0.05),这与酸水解引起的长淀粉链降解及短支链淀粉链产生有关。其中,OSA-AH-Corn在支链淀粉区域占比为90.3%±0.02%,OSA-AD-Corn在支链淀粉区域占比为90.7%±0.02%,而OSA-AD-Corn的链长分布更为均匀,这与复合降解处理有关,酸处理后的高温复合降解使得较短的支链淀粉发生聚合,小分子之间产生缔合[24]。由此可见,受原淀粉不同来源和改性处理影响,改性淀粉在链长分布、有序结构和结晶结构上存在差异,这将影响Pickering乳液的性质。
2.2 OSA淀粉Pickering乳液的性质
2.2.1 淀粉浓度对Pickering乳液粒径和ζ-电位的影响
由表3可知,OSA-AD-Corn Pickering乳液和OSA-AD-Waxy Pickering乳液的粒径小于OSA-AH-Corn和OSA-AH-Waxy的;而OSA-AD-Corn Pickering乳液和OSA-AD-Waxy Pickering乳液的ζ-电位绝对值大于OSA-AH-Corn和OSA-AH-Waxy的。OSA改性淀粉中存在大量的亲脂性基团,对油相具有亲和力,这允许淀粉颗粒在油水界面上吸附[25−26]。另外,刘元宏[27]发现颗粒浓度与乳液液滴的油水界面覆盖率有关,随着淀粉浓度的增加,更多的淀粉颗粒吸附在油水界面。Feng等[28]发现当颗粒在乳液界面上达到全覆盖时,乳液的粒径会一直保持稳定直至界面上形成的单层颗粒逐渐形成紧密的结构,乳滴的粒径增大。从淀粉基材料角度考虑,改性淀粉中的糖苷键在酸解过程中发生断裂,导致淀粉链变短。从SEC结果可知,经酸降解处理的改性淀粉比经酸热复合降解的改性淀粉,含有更多的短链分子,小分子链具有更好的移动性能[29],促使淀粉颗粒灵活分散在Pickering乳液界面上,且小分子链形成的淀粉颗粒尺寸小而有助于稳定乳液[30]。
表 3 不同淀粉基Pickering乳液的ζ-电位、粒径和包油量Table 3. ζ-Potential, mean diameter, and oil-liquid encapsulation efficiency of different starch-based Pickering emulsion不同浓度的淀粉基Pickering乳液 粒径(nm) ζ-电位(mV) 油脂包埋率
(%,w/w)OSA-AD-Corn 0.1% 782.46±73.48a −26.70±0.78a 22.80±2.12c 1% 448.85±13.47b −27.40±1.15a 87.07±1.14b 2% 385.25±7.28c −26.93±0.19a 97.30±0.04a OSA-AH-Corn 0.1% 544.65±11.54b −37.12±0.43c 66.67±4.42b 1% 683.33±18.82a −25.34±0.63b 91.27±0.42a 2% 681.74±26.77a −25.67±0.31a 91.27±0.42a OSA-AD-Waxy 0.1% 563.63±23.68a −25.26±0.21a 36.05±6.15b 1% 331.13±6.75c −25.92±0.71a 88.20±0.41a 2% 413.53±18.13b −30.91±0.65c 92.50±4.64a OSA-AH -Waxy 0.1% 595.52±2.29a −15.24±0.29a 38.65±4.35b 1% 403.90±6.05c −27.58±0.85b 85.40±0.79a 2% 531.73±21.49b −27.78±0.12b 91.90±1.79a 注:表中同一样品、不同浓度下,不同字母表示数据间存在显著差异(P<0.05)。 2.2.2 Pickering乳液在体外模拟消化过程中的控释行为
由表3可知,随着淀粉基材料浓度从0.1%增加到2%,OSA-AD-Waxy、OSA-AD-Corn、OSA-AH-Waxy和OSA-AH-Corn制备的Pickering乳液的载油量不断增加。这与油滴表面淀粉颗粒的覆盖率有关,随着界面上淀粉颗粒覆盖面积的增大,油滴被更好的覆盖形成小液滴,增加了油脂的包埋率。
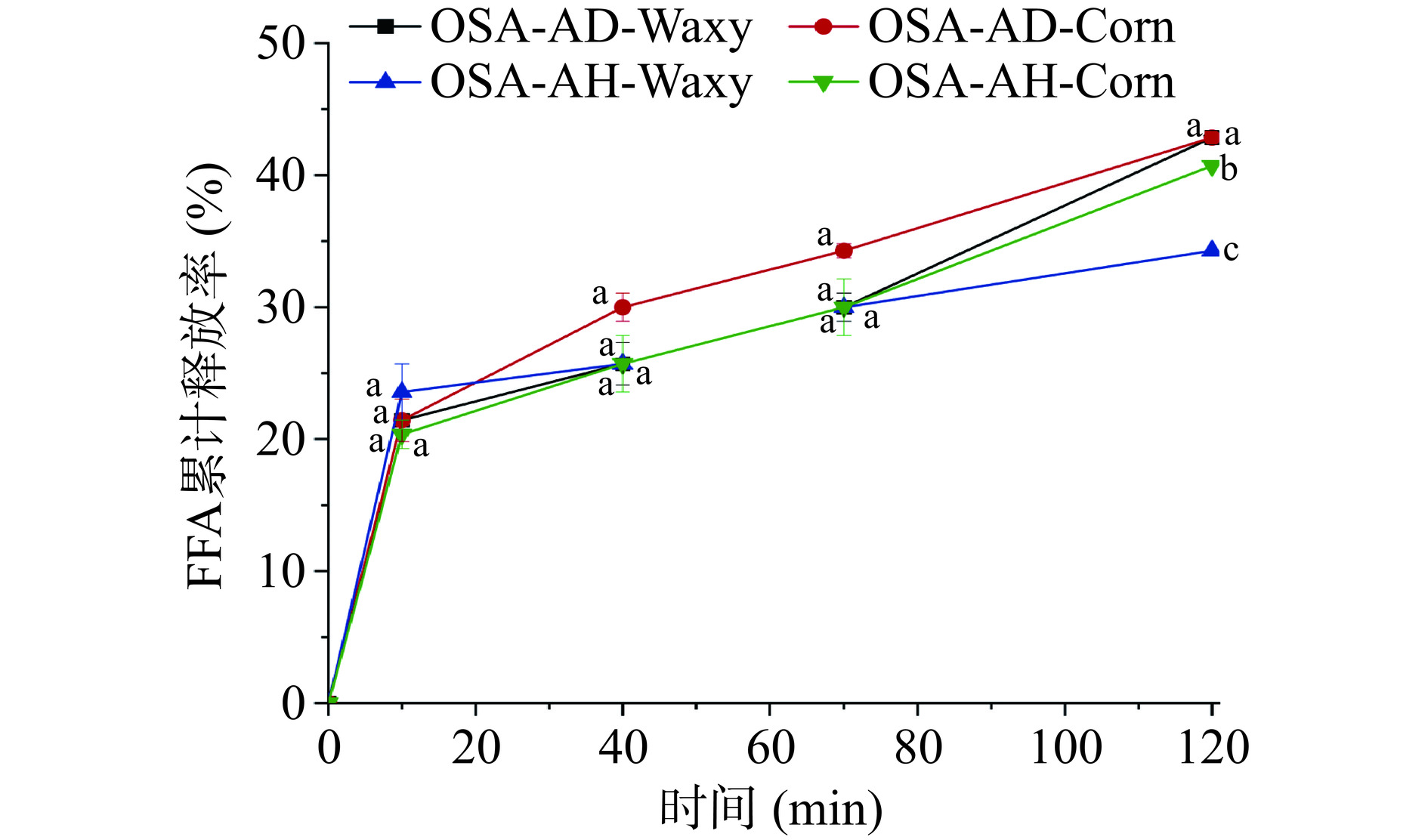
受脂肪酶的限制,食物中脂类的消化和吸收主要在小肠中进行,因此,本研究对淀粉Pickering乳液(淀粉浓度2%)在模拟小肠部位消化过程中所释放的FFA进行测定。从图4可知,无论是哪种OSA淀粉,FFA的释放速率均呈现出先迅速释放随后趋于平稳的趋势。在消化120 min后,OSA-AD-Corn的Pickering乳液总FFA释放率达到42.86%±0.39%。而OSA-AH-Waxy和OSA-AH-Corn Pickering乳液FFA相对较低,这与淀粉分子之间发生相互作用导致液滴聚集有关,使许多油滴难以与脂肪酶接触。
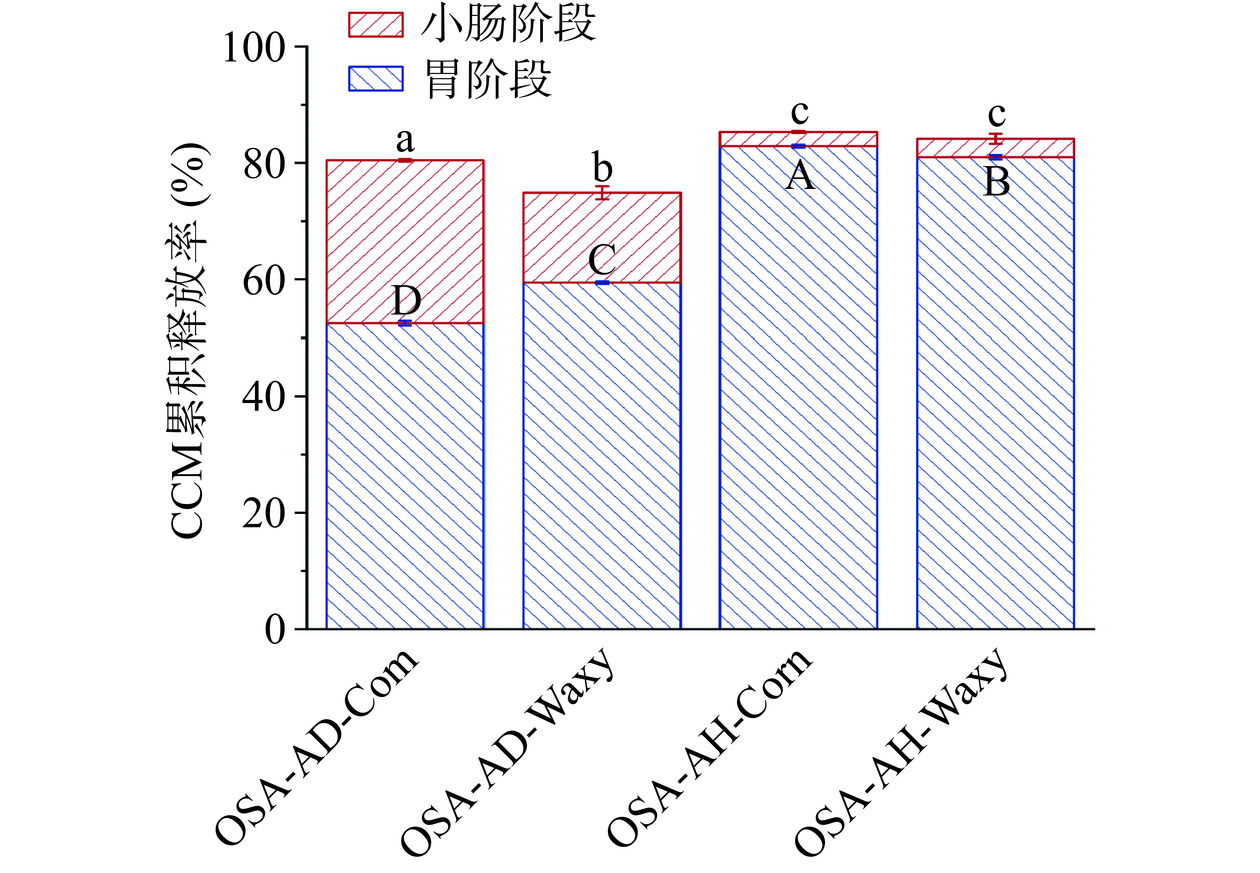
进一步地,通过负载有CCM的淀粉基Pickering乳液,探讨淀粉基Pickering乳液在模拟胃和模拟肠消化环境中对CCM的控释作用。如图5所示,OSA-AD-Corn Pickering乳液保留了27.98%±0.22%的CCM至小肠阶段才释放,与其他三种OSA淀粉相比,其在生物递送及释放方面具有优异的能力。在模拟胃液消化中,经酸热复合改性的OSA淀粉稳定的Pickering乳液的结构更容易遭到破坏,从而放出更多的CCM。
2.3 淀粉基Pickering乳液的功能因子递送能力与淀粉结构关系探究
结合OSA改性淀粉的XRD、FTIR和SEC分析结果可知,酸处理会导致淀粉的分子结构发生显著变化,结晶结构下降,淀粉短程有序程度下降,淀粉链长下降。而复合改性处理,由于酸化后进行高温降解,增大了对淀粉结构的破坏程度,但高温处理也引起了淀粉链的重新排列和组合,使得淀粉链长分布不均。因此,不同的改性处理使得淀粉基材料分子链段长短有明显差异。
在淀粉基材料分子结构差异基础上,所制得的Pickering乳液在粒径、ζ-电位、油脂包埋、脂溶性功能成分递送上也有差异。其中,以改性淀粉OSA-AD-Corn为例,短链分子更多且分布更加均匀的淀粉基材料所制备的Pickering乳液具有较小的粒径和ζ-电位,从而乳液具有较大的比表面积,在模拟小肠消化阶段,有利于与消化酶接触,靶向释放出最多的FFA,因此,OSA-AD-Corn Pickering乳液具有更高的FFA释放率。而酸热复合改性淀粉所制得的Pickering乳液液滴粒径较大,ζ-电位绝对值较小,减少了颗粒之间的静电排斥力,使更多的淀粉分子之间发生相互作用,这导致了液滴聚集,使许多油滴难以与脂肪酶接触,因此,OSA-AH-Waxy和OSA-AH-Corn Pickering乳液FFA相对较低。
在功能因子CCM递送方面,OSA-AD-Corn Pickering乳液在胃阶段释放出的CCM较少,更多的CCM则保留至小肠阶段中才释放,这与FFA的释放规律一致。与之相比,酸热复合改性淀粉所制得的Pickering乳液在模拟胃液消化中所释放的CCM较多,这与淀粉基载体材料中短链分子缔合形成的新结构受低酸性胃液侵蚀有关[31],从而影响了CCM在后续消化部位的递送释放。因此,受淀粉基载体材料分子结构的影响,链长合适且分布均匀的淀粉短链分子所形成的Pickering乳液在小肠靶向递送方面更具优势。
3. 结论
为了有效改善活性成分的生物利用度,本论文探讨了淀粉链结构对其Pickering乳液的影响。在所制备的多种淀粉基材料(OSA改性淀粉)中,酸降解得到的OSA-AD-Corn淀粉具有一定的有序结构,其FTIR光谱在1047 cm−1/1022 cm−1的比值增大,R1045/1022=0.3869±0.0000;SEC分析结果也显示,OSA-AD-Corn具有更高比例的短支链淀粉,且分布均匀。由此所制得的Pickering乳液具有更小的粒径和更大的ζ-电位,分别为385.25±7.28 nm和−27.40±1.15 mV。且该乳液负载CCM后,在模拟胃液和小肠液中CCM的释放率分别为52.48%±0.42%和27.98%±0.22%,在模拟小肠部位的CCM释放量明显增加,为功能因子靶向递送至小肠提供可能。本研究为口服靶向递送系统提供合适的载体材料与实现方法,有助于活性功能因子生物高效利用。
-
表 1 改性淀粉的相对结晶度和短程有序度
Table 1 Relative crystallinity (RC) and short-range ordered degree of modified starches
样品 相对结晶度(%) R1045/1022 OSA-AD-Corn 37.24±0.83c 0.3869±0.0001a OSA-AH-Corn 30.65±0.65e 0.2637±0.0001c OSA-Native-Corn 40.52±0.45a 0.2788±0.0007b OSA-AD-Waxy 38.19±0.39b 0.2122±0.0015d OSA-AH-Waxy 31.88±0.23d 0.2590±0.0001c OSA-Native -Waxy 40.13±0.27a 0.2733±0.0075b 注:同一列不同小写字母表示显著差异(P<0.05),表2同。 表 2 淀粉材料的链长分布拟合参数
Table 2 Fitting parameters for CLDs of starches
样品 6<DP<12
(%)12<DP<24
(%)24<DP<36
(%)36<DP<100
(%)100<DP<1000
(%)1000<DP<10000
(%)OSA-Native-Corn 17.8±0.0107d 31.0±0.0035d 10.3±0.0008d 12.2±0.0016e 14.6±0.0095a 12.9±0.0050a OSA-AD-Corn 25.9±0.0027b 37.1±0.0091c 13.2±0.0036c 14.5±0.0061d 1.9±0.0017d 1.6±0.0110bcd OSA-AH-Corn 16.8±0.0048d 26.1±0.0039f 16.6±0.0030a 30.8±0.0061a 5.4±0.0008b 2.9±0.0095b OSA-Native -Waxy 22.9±0.0035c 41.1±0.0059b 15.1±0.0031b 18.0±0.0046c 0.7±0.0042e 1.1±0.0112cd OSA-AD-Waxy 29.0±0.0017a 42.1±0.0045a 12.9±0.0008c 11.0±0.0065f 0.6±0.0015e 0.0±0.0000d OSA-AH-Waxy 17.5±0.0063d 27.9±0.0022e 16.8±0.0002a 29.7±0.0006b 4.1±0.0004c 2.1±0.0110bc 表 3 不同淀粉基Pickering乳液的ζ-电位、粒径和包油量
Table 3 ζ-Potential, mean diameter, and oil-liquid encapsulation efficiency of different starch-based Pickering emulsion
不同浓度的淀粉基Pickering乳液 粒径(nm) ζ-电位(mV) 油脂包埋率
(%,w/w)OSA-AD-Corn 0.1% 782.46±73.48a −26.70±0.78a 22.80±2.12c 1% 448.85±13.47b −27.40±1.15a 87.07±1.14b 2% 385.25±7.28c −26.93±0.19a 97.30±0.04a OSA-AH-Corn 0.1% 544.65±11.54b −37.12±0.43c 66.67±4.42b 1% 683.33±18.82a −25.34±0.63b 91.27±0.42a 2% 681.74±26.77a −25.67±0.31a 91.27±0.42a OSA-AD-Waxy 0.1% 563.63±23.68a −25.26±0.21a 36.05±6.15b 1% 331.13±6.75c −25.92±0.71a 88.20±0.41a 2% 413.53±18.13b −30.91±0.65c 92.50±4.64a OSA-AH -Waxy 0.1% 595.52±2.29a −15.24±0.29a 38.65±4.35b 1% 403.90±6.05c −27.58±0.85b 85.40±0.79a 2% 531.73±21.49b −27.78±0.12b 91.90±1.79a 注:表中同一样品、不同浓度下,不同字母表示数据间存在显著差异(P<0.05)。 -
[1] ZHU F. Starch based pickering emulsions:fabrication, properties, and applications[J]. Trends in Food Science & Technology,2019,85:129−137.
[2] LÓPEZ-PEDROUSO M, LORENZO J M, MOREIRA R, et al. Potential applications of pickering emulsions and high internal-phase emulsions (hipes) stabilized by starch particles[J]. Current Opinion in Food Science,2022,46:100866. doi: 10.1016/j.cofs.2022.100866
[3] MATOS M, MAREFATI A, BARRERO P, et al. Resveratrol loaded pickering emulsions stabilized by osa modified rice starch granules[J]. Food Research International,2021,139:109837. doi: 10.1016/j.foodres.2020.109837
[4] MU M D, KARTHIK P, CHEN J S, et al. Effect of amylose and amylopectin content on the colloidal behaviour of emulsions stabilised by osa-modified starch[J]. Food Hydrocolloids,2021,111:106363. doi: 10.1016/j.foodhyd.2020.106363
[5] LI S N, ZHANG B, TAN C P, et al. Octenylsuccinate quinoa starch granule-stabilized pickering emulsion gels:preparation, microstructure and gelling mechanism[J]. Food Hydrocolloids,2019,91:40−47. doi: 10.1016/j.foodhyd.2019.01.001
[6] LI Y X, LIU H L, WU Y Q, et al. Differences in the structural properties of three osa starches and their effects on the performance of high internal phase pickering emulsions[J]. International Journal of Biological Macromolecules,2024,258:128992. doi: 10.1016/j.ijbiomac.2023.128992
[7] YAN C, MCCLEMENTS D J, ZHU Y Q, et al. Fabrication of osa starch/chitosan polysaccharide-based high internal phase emulsion via altering interfacial behaviors[J]. Journal of Agricultural and Food Chemistry,2019,67(39):10937−10946. doi: 10.1021/acs.jafc.9b04009
[8] MAREFATI A, RAYNER M. Starch granule stabilized pickering emulsions:An 8-year stability study[J]. Journal of the Science of Food and Agriculture,2020,100(6):2807−2811. doi: 10.1002/jsfa.10289
[9] CHANG S Q, CHEN X, LIU S W, et al. Novel gel-like pickering emulsions stabilized solely by hydrophobic starch nanocrystals[J]. International Journal of Biological Macromolecules,2020,152:703−708. doi: 10.1016/j.ijbiomac.2020.02.175
[10] ZHENG W X, REN L, HAO W Z, et al. Encapsulation of indole-3-carbinol in pickering emulsions stabilized by osa-modified high amylose corn starch:Preparation, characterization and storage stability properties[J]. Food Chemistry,2022,386:132846. doi: 10.1016/j.foodchem.2022.132846
[11] QIN Y, WANG J P, QIU C, et al. Effects of degree of polymerization on size, crystal structure, and digestibility of debranched starch nanoparticles and their enhanced antioxidant and antibacterial activities of curcumin[J]. ACS Sustainable Chemistry & Engineering,2019,7(9):8499−8511.
[12] 梁世濠, 谭可宜, 刘泳琪, 等. 辛烯基琥珀酸淀粉酯分子结构差异对其Pickering乳液释放性能的作用机制[J]. 食品研究与开发,2022,43(21):1−7. [LIANG S H, TAN K Y, LIU Y Q, et al. Mechanism of octenyl succinic anhydride-esterified starches with different molecular structures in regulating releasing property of pickering emulsion[J]. Food Research and Development,2022,43(21):1−7.] doi: 10.12161/j.issn.1005-6521.2022.21.001 LIANG S H, TAN K Y, LIU Y Q, et al. Mechanism of octenyl succinic anhydride-esterified starches with different molecular structures in regulating releasing property of pickering emulsion[J]. Food Research and Development, 2022, 43(21): 1−7. doi: 10.12161/j.issn.1005-6521.2022.21.001
[13] LIU Y F, CHEN L, XU H S, et al. Understanding the digestibility of rice starch-gallic acid complexes formed by high pressure homogenization[J]. International Journal of Biological Macromolecules,2019,134:856−863. doi: 10.1016/j.ijbiomac.2019.05.083
[14] HE T, ZHAO L, WANG L, et al. Gallic acid forms v-amylose complex structure with starch through hydrophobic interaction[J]. International Journal of Biological Macromolecules,2024,260:129408. doi: 10.1016/j.ijbiomac.2024.129408
[15] KANG X M, LIU P F, GAO W, et al. Preparation of starch-lipid complex by ultrasonication and its film forming capacity[J]. Food Hydrocolloids,2020,99:105340. doi: 10.1016/j.foodhyd.2019.105340
[16] HUI G, ZHU P L, WANG M C. Structure and functional properties of taro starch modified by dry heat treatment[J]. International Journal of Biological Macromolecules,2024,261:129702. doi: 10.1016/j.ijbiomac.2024.129702
[17] DAI L M, ZHANG J, CHENG F. Succeeded starch nanocrystals preparation combining heat-moisture treatment with acid hydrolysis[J]. Food Chemistry,2019,278:350−356. doi: 10.1016/j.foodchem.2018.11.018
[18] HOU H R, CHI C D, WANG T X, et al. Multi-responsive starch-based nanocapsules for colon-targeting delivery of peptides:in vitro and in vivo evaluation[J]. International Journal of Biological Macromolecules,2023,242:124953. doi: 10.1016/j.ijbiomac.2023.124953
[19] WANG X, HAO Z W, LIU N N, et al. Influence of the structure and physicochemical properties of osa modified highland barley starch based on ball milling assisted treatment[J]. International Journal of Biological Macromolecules,2024,259:129243. doi: 10.1016/j.ijbiomac.2024.129243
[20] 郑波. 热挤压3D打印构建大米淀粉-儿茶素复合物的消化性能及抗肥胖机理研究[D]. 广州:华南理工大学, 2021. [ZHENG B. The mechanism study on digestibility and anti-obesity effects of rice starch-catechin complex constructed by Hot-extrusion 3D printing[D]. Guangzhou:South China University of Technology, 2021.] ZHENG B. The mechanism study on digestibility and anti-obesity effects of rice starch-catechin complex constructed by Hot-extrusion 3D printing[D]. Guangzhou: South China University of Technology, 2021.
[21] LI C, HU Y M. Effects of acid hydrolysis on the evolution of starch fine molecular structures and gelatinization properties[J]. Food Chemistry,2021,353:129449. doi: 10.1016/j.foodchem.2021.129449
[22] HE T, WANG K, ZHAO L, et al. Interaction with longan seed polyphenols affects the structure and digestion properties of maize starch[J]. Carbohydrate Polymers,2021,256:117537. doi: 10.1016/j.carbpol.2020.117537
[23] KUANG Q, XU J C, WANG K, et al. Structure and digestion of hybrid indica rice starch and its biosynthesis[J]. International Journal of Biological Macromolecules,2016,93:402−407. doi: 10.1016/j.ijbiomac.2016.08.023
[24] TRITHAVISUP K, KRUSONG K, TANANUWONG K. In-depth study of the changes in properties and molecular structure of cassava starch during resistant dextrin preparation[J]. Food Chemistry,2019,297:124996. doi: 10.1016/j.foodchem.2019.124996
[25] MUHAMMAD Z, RAMZAN R, ZHANG R F, et al. Enhanced bioaccessibility of microencapsulated puerarin delivered by pickering emulsions stabilized with osa-modified hydrolyzed pueraria montana starch:in vitro release, storage stability, and physicochemical properties[J]. Foods,2022,11(22):3591. doi: 10.3390/foods11223591
[26] PAN Y, WU Z Z, ZHANG B, et al. Preparation and characterization of emulsion stabilized by octenyl succinic anhydride-modified dextrin for improving storage stability and curcumin encapsulation[J]. Food Chemistry,2019,294:326−332. doi: 10.1016/j.foodchem.2019.05.053
[27] 刘元宏. 辛烯基琥珀酸小米淀粉酯Pickering乳液的制备及其负载姜黄素的研究[D]. 泰安:山东农业大学, 2023. [LIU Y H. Preparation of millet starch octenyl succinate pickering emulsion and study on curcumin loading[D]. Taian:Shandong Agricultural University, 2023.] LIU Y H. Preparation of millet starch octenyl succinate pickering emulsion and study on curcumin loading[D]. Taian: Shandong Agricultural University, 2023.
[28] FENG T T, WANG X J, WANG X W, et al. High internal phase pickering emulsions stabilized by pea protein isolate-high methoxyl pectin-egcg complex:Interfacial properties and microstructure[J]. Food Chemistry,2021,350:129251. doi: 10.1016/j.foodchem.2021.129251
[29] 刘微. OSA淀粉的结构特征与乳化性质的相关性分析[D]. 无锡:江南大学, 2019. [LIU W. Correlation analysis between structural characteristics and emulsification capacity of OSA starch [D]. Wuxi:Jiangnan University, 2019.] LIU W. Correlation analysis between structural characteristics and emulsification capacity of OSA starch [D]. Wuxi: Jiangnan University, 2019.
[30] XU T, YANG J, HUA S X, et al. Characteristics of starch-based pickering emulsions from the interface perspective[J]. Trends in Food Science & Technology,2020,105:334−346.
[31] SOLER A, VALENZUELA-DÍAZ E D, VELAZQUEZ G, et al. Double helical order and functional properties of acid-hydrolyzed maize starches with different amylose content[J]. Carbohydrate Research,2020,490:107956. doi: 10.1016/j.carres.2020.107956





 下载:
下载:
 下载:
下载:



