Effect of Ultrasonic Combined with Ethanol Modification on the Structural and Functional Properties of Porcine Heart Protein
-
摘要: 为改善猪心蛋白的功能性质,提高其在食品工业中的应用可行性,本研究通过超声波(频率20 kHz,功率350 W,处理时间8 min,工作5 s间歇2 s)联合不同浓度乙醇(0~80%)处理对猪心蛋白(porcine heart protein,PHP)进行改性,测定改性后PHP的分子结构、微观结构、活性巯基含量、表面疏水性、溶解度、乳化性、乳液粒径及乳液Zeta电位值等指标的变化情况。结果表明,在超声波和40%浓度乙醇改性处理的共同作用下,PHP的一级结构、二级结构以及微观结构发生明显改变,PHP的紫外吸光强度最大,活性巯基含量及表面疏水性最大,蛋白的溶解性显著降低(P<0.05),乳化活性及乳化稳定性改善效果最佳,蛋白乳液粒径最小、Zeta电位绝对值最大。综合考虑PHP乳化特性的改善效果,超声波联合40%浓度的乙醇改性处理为PHP的最佳改性条件。Abstract: In order to improve the functional properties of porcine heart protein and improve its application feasibility in the food industry, this study modified porcine heart protein (PHP) by ultrasonic (frequency of 20 kHz, power of 350 W, treatment for 8 min, working 5 s with 2 s intervals) combined with different concentrations of ethanol (0~80%). The changes of molecular structure, microstructure, active sulfhydryl content, surface hydrophobicity, solubility, emulsification, emulsion particle size and emulsion Zeta potential of modified PHP were determined. The results showed that the primary structure, secondary structure and microstructure of PHP were significantly changed under the combined action of ultrasonic and 40% ethanol modification. The ultraviolet absorption intensity of PHP was the largest, the active sulfhydryl content and surface hydrophobicity were the largest. The solubility of protein was significantly reduced (P<0.05), the emulsifying activity and emulsifying stability were the best, the particle size of protein emulsion was the smallest, and the absolute value of Zeta potential was the largest. Considering the improvement effect of PHP emulsification characteristics, ultrasonic combined with 40% ethanol modification treatment is the best modification condition for PHP.
-
随着人民生活水平日益提高,大众对于猪肉的需求也在逐步加大,由此也产生了许多副产品如猪心、猪肝以及猪肺等,其中猪心的重量约占猪体重的0.33%[1]。猪心不仅价格低廉,且具有较高的食用和药用价值。现代科学研究证明,猪心内含有丰富的蛋白质、钙、铁、锌及各类维生素等,且猪心中还富含多种人体所需的必需氨基酸,其中缬氨酸、赖氨酸和苯丙氨酸的含量相对较高[1]。虽然猪心有着诸多优点,但其自身有着一种特殊的腥味且容易发生氧化褐变,并且猪心的消费会受到多种因素的影响,如消费者对优质肉类产品的认知标准,饮食、宗教或道德的限制等,因此猪心在食品工业中的发展受到了较大的阻碍。猪心中的蛋白质含量约为18%[1],因此从猪心中提取蛋白质并运用于食品工业中可以有效地解决猪心资源浪费的问题。然而,有学者研究报道称从动物内脏中分离出的蛋白其功能特性如乳化性等往往较差[2],加之蛋白的提取等过程通常需要进行干燥处理,由此会导致内脏蛋白的功能特性进一步下降,阻碍了其在生产中的应用。
为了让天然蛋白质能够更为广泛地应用于食品工业中,对蛋白进行改性处理,改善其功能特性已成为一种常用的科学方法。蛋白质改性是指通过特殊方法(物理改性、化学改性以及生物改性等)改变蛋白质的分子结构或化学基团,以改变其功能特性和生物活性的过程[3]。超声波处理是一种绿色、新颖和可持续的物理改性技术,与传统热处理工艺相比,该工艺具有更高的效率、更便捷的操作及应用以及更少的污染等优点[4−5]。Yang等[6]通过研究超声波处理对大豆蛋白的影响得出结论,超声波处理可以显著减小大豆蛋白粒径,提高其溶解性和乳化特性。除了超声波处理外,乙醇改性处理也是一种能够改变蛋白质结构和功能的化学改性方式。与水相比醇类的极性往往较低,因此醇溶液的添加会降低蛋白溶液体系的介电常数,醇会与蛋白溶液发生争夺水化水的现象,分子间的静电相互作用显著增强,使得稳定蛋白质结构的非共价相互作用被削弱或破坏,从而导致蛋白质的结构发生改变[7]。乙醇具有易挥发的特点,因此对蛋白进行改性处理后可以较为容易地去除多余的乙醇。Liu等[8]发现乙醇改性处理使得牛血清白蛋白的二级和三级结构发生改变,并且导致蛋白发生聚集现象,溶解度显著降低,使得蛋白质的功能特性发生改变。Chang等[9]报道称75%(v/v)浓度的乙醇可以使得扁豆分离蛋白的表面疏水性及乳化特性显著提高,且乙醇的添加可以有效去除蛋白中的异味。以上学者的研究表明,适度的超声波处理以及乙醇改性处理可以有效地改变蛋白质的结构,从而对蛋白质的乳化性等功能特性起到明显的改善作用。然而,目前关于超声波联合乙醇改性处理对猪心蛋白结构及功能特性的影响还鲜有报道。
本研究旨在利用物理与化学联合改性方法改善猪心蛋白的功能特性,选择超声波频率20 kHz、超声波功率350 W、超声波处理时间8 min作为超声波改性处理条件,随后使用不同浓度的乙醇(0~80%)对猪心蛋白进行乙醇改性处理,考察超声波与乙醇处理相结合的改性方式对猪心蛋白结构和功能特性的影响,分析探讨猪心蛋白结构和功能特性变化的内在原因,以期为猪心蛋白资源在食品工业中作为乳化剂应用于乳化肉糜生产提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
新鲜猪心 市售;透析袋(分子截留量为8000~14000 Da) 北京怡美妙科技有限公司;一级大豆油 益海嘉里食品有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶试剂盒 北京索莱宝科技有限公司;无水磷酸二氢钠、无水磷酸氢二钠、5,5'-二硫代双-(2-硝基苯甲酸)(5,5'-Dithio bis-(2-nitrobenzoic acid),DTNB)、考马斯亮蓝R-250 上海麦克林生化科技有限公司;氢氧化钠、氯化钠、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、甲醇、无水乙醇 成都市科隆化学品有限公司;五水硫酸铜 广东光华科技有限公司;牛血清蛋白、甘氨酸(glycine,Gly)、三羟甲基氨基甲烷(tris-(hydroxymethyl)-aminomethane,Tris)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 德国Biofroxx公司;酒石酸钾钠、冰醋酸 宁波大川精细化工有限公司;溴酚蓝 北京鼎国生物技术有限责任公司。以上试剂均为分析纯及以上。
TGL-16高速冷冻离心机 四川蜀科仪器有限公司;JS39D-250多功能食品加工机 浙江苏泊尔股份有限公司;XHF-D内切式匀浆机、SCIENTZ-1500F超声波分散仪 宁波新芝生物科技股份有限公司;ZEN3690马尔文激光粒度分析仪、Mastersizer 3000020502马尔文激光粒度分析仪 英国马尔文仪器公司;Spectrum100红外光谱仪 美国珀金埃尔默仪器有限公司;TM4000Plus10101扫描电镜 日立高新公司。
1.2 实验方法
1.2.1 猪心蛋白的提取
参考Steen等[10]和田星等[11]的方法并进行适当修改。将猪心清洗干净,随后将其切割成小块,用绞肉机打成猪心泥。往猪心泥中加入4倍体积的含0.6 mol/L NaCl的NaH2PO4/Na2HPO4缓冲溶液(pH7.4),用匀浆机以10000 r/min的转速匀浆2 min,随后将猪心泥离心20 min(9000×g,4 ℃),用纱布过滤沉淀物,收集滤液。向过滤出的沉淀物中继续加入4倍体积的磷酸盐缓冲溶液,重复上述操作3次。将所有滤液合并,用透析袋透析48 h(每3 h换一次水),随后冷冻干燥48 h,得到的产物即为猪心蛋白,将其储存于−18 ℃环境中。通过凯氏定氮法测定猪心蛋白粉的蛋白含量为(85.95±0.70)g/100 g。
1.2.2 超声波联合乙醇改性对猪心蛋白的处理
参考冯旸旸[12]的方法并稍加修改。用磷酸盐缓冲液将提取出的蛋白溶液浓度稀释至2.5 mg/mL,随后对蛋白溶液进行超声波处理(超声波频率20 kHz,超声波功率350 W,超声波处理时间8 min,工作5 s间歇2 s),在过程中使用冰水浴将溶液温度控制在4 ℃左右。将部分经超声波处理过的蛋白溶液分为四等份,每份添加等量的不同浓度(20%、40%、60%、80%,v/v)的乙醇,使得蛋白溶液的蛋白浓度为2 mg/mL。随后用保鲜膜将蛋白溶液密封避免乙醇的挥发,并用磁力搅拌器在500 r/min的转速下搅拌4 h。将改性好的PHP溶液透析48 h(每3 h换一次水),最后将其冷冻干燥48 h,得到的产物即为改性后的猪心蛋白,将其储存于-18 ℃环境中。此处设置两个对照组,一组为未经过改性处理的PHP,一组为只经过超声波处理但未经过乙醇改性处理的PHP。将经过超声波联合乙醇改性的四组PHP分别命名为U-20%E、U-40%E、U-60%E和U-80%E。
1.2.3 SDS-PAGE凝胶电泳测定
参考Li等[13]的方法并稍加修改。使用所购凝胶试剂盒中的试剂配制浓度为12%与5%的分离胶和浓缩胶。将蛋白浓度为2.5 mg/mL的样品与上样缓冲液按4:1(v/v)的比例进行混合,于100 ℃沸水水浴加热5 min,随后取出样品让其自然冷却。冷却后取20 μL样品于浓缩胶泳道中,开启电泳槽电源。样品进入分离胶之前将电压设置为60 V,样品进入到分离胶之后将电压提高至80 V。样品迁移至距离胶下端还有约1 cm处时将电源关闭,取下胶片,去除浓缩胶,将分离胶放置于考马斯亮蓝R-250染色液中,使用摇床染色3 h,然后在脱色液中脱色直到背景清晰为止,最后进行拍照。
1.2.4 红外光谱测定
参考赵飞[14]的方法并稍加修改。使用红外光谱仪在4000~600 cm−1范围内采集蛋白粉的吸收光谱,设置吸光度分辨率为4 cm−1,扫描次数为32次。用EZ OMNIC软件对数据进行基线校正、平滑和归一化等操作,用Peakfit软件对1600~1700 cm−1的谱带范围进行分析处理,计算PHP二级结构的相对含量。
1.2.5 紫外吸收光谱测定
参考王立等[15]的方法并进行适当修改,测定蛋白质结构变化情况。用磷酸盐缓冲溶配制浓度为2.5 mg/mL的蛋白溶液,随后对其进行紫外吸收光谱扫描。扫描条件:扫描波长范围:200~500 nm,扫描速度300 nm/min,步长1 nm。
1.2.6 微观结构分析
参考王立宇[16]的方法并稍加修改。取适量蛋白粉于导电胶上,固定后进行喷金,随后在加速电压10 kV的条件下使用扫描电镜观察蛋白的微观结构并拍照。
1.2.7 活性巯基含量测定
参考Beveridge等[17]的测定方法,使用Ellman试剂法测定PHP的活性巯基含量。用磷酸盐缓冲溶液配制浓度为2.5 mg/mL的猪心蛋白溶液,取1 mL蛋白溶液于离心管中,加入9 mL Tris-甘氨酸缓冲液(0.086 mol/L Tris,0.09 mol/L Gly,4 mmol/L EDTA,pH8.0),随后离心15 min(4 ℃,10000 r/min),取4.5 mL上清液加入0.5 mL Ellman试剂(4 mg DTNB溶于1 mL Tris-甘氨酸缓冲液),振荡使其混合均匀,在30 ℃的条件下避光水浴反应30 min,使用紫外分光光度计在412 nm处测定吸光度,以不加蛋白的磷酸盐缓冲液为空白。蛋白活性巯基含量的计算公式如下:
式中:A412为蛋白溶液在412 nm处的吸光度;D为稀释倍数;C为蛋白质浓度(mg/mL);73.53由106/1.36×104计算而得;13600为摩尔吸收率。
1.2.8 表面疏水性测定
参考Chin等[18]的测定方法。用磷酸盐缓冲溶液配制浓度为2.5 mg/mL的猪心蛋白溶液,将1 mL猪心蛋白溶液以及200 μL溴酚蓝溶液添加至离心管中,空白组以缓冲溶液代替蛋白溶液。将离心管在25 ℃的条件下振荡10 min,随后离心15 min(4 ℃,2000 r/min),取上清液稀释10倍后使用分光光度计于595 nm处测定吸光值A。蛋白表面疏水性的计算公式如下:
式中:A空白为空白组在595 nm处的吸光值;A样品为处理组在595 nm处的吸光值。
1.2.9 溶解度测定
参考Agyare等[19]的测定方法。用磷酸盐缓冲溶液配制浓度为2.5 mg/mL的猪心蛋白溶液,随后离心15 min(5500 r/min,4 ℃)得到溶液上清液,使用双缩脲法测定PHP的浓度。蛋白溶解度的计算公式如下:
1.2.10 乳化活性和乳化稳定性测定
参考Agyare等[19]和Pearce等[20]的测定方法。用磷酸盐缓冲溶液配制浓度为2.5 mg/mL的猪心蛋白溶液,将6 mL蛋白溶液加入含有2 mL大豆油的离心管中,在10000 r/min转速下匀浆30 s,随后立即从距离管底约0.5 cm处吸取50 μL乳液转移至试管中,加入5 mL 0.1% SDS溶液混合均匀,使用紫外分光光度计测定样品在500 nm处的吸光值,空白对照为50 μL超纯水加入到5 mL 0.1% SDS溶液。将匀浆好的乳液静置10 min后,按照上述同样的方法测定其在500 nm处的吸光值。蛋白乳化体系的乳化活性和乳化稳定性计算公式如下:
式中:ϕ为油相体积分数(油的体积/乳化体系的体积);C为蛋白质浓度(g/mL);A0为乳液在0 min时的吸光值;A10为乳液在10 min时的吸光值;2为固定系数;2.303为阿伦尼乌斯常数;101为稀释倍数。
1.2.11 猪心蛋白乳液粒径测定
参考崔珊珊[21]的测定方法。取200 μL新鲜乳化液加入至5 mL浓度为1%(w/v)的SDS溶液中,振荡使其均匀混合,随后使用马尔文激光粒度分析仪测定乳液的粒度分布情况。参数设置如下:激光衍射波长:λ=633 nm;傅里叶构象焦距:45 mm;进样器:Hydro 2000MU (A);颗粒折射率:1.520;颗粒吸收率:0.1;分散剂:水;分散剂折射率:1.330;噪音:30 s;背景测试持续时间:15 s;搅拌速率:2000 r/min。
1.2.12 猪心蛋白乳液Zeta电位值测定
参考张小影等[22]的测定方法并稍加修改。使用1.2.10所制得的新鲜乳液,用磷酸盐缓冲溶液将其稀释50倍,在室温25 ℃条件下用马尔文纳米粒度仪ZEN3690测定其Zeta电位值。
1.3 数据处理
每个实验至少重复3次,实验结果以平均值±标准差表示。用Excel 2016软件对数据进行处理,用SPSS Statistics 25.0软件对数据进行显著性分析,P<0.05表明结果具有差异显著性,用Origin 2018软件进行绘图。
2. 结果与分析
2.1 超声波联合乙醇改性对PHP组成成分的影响
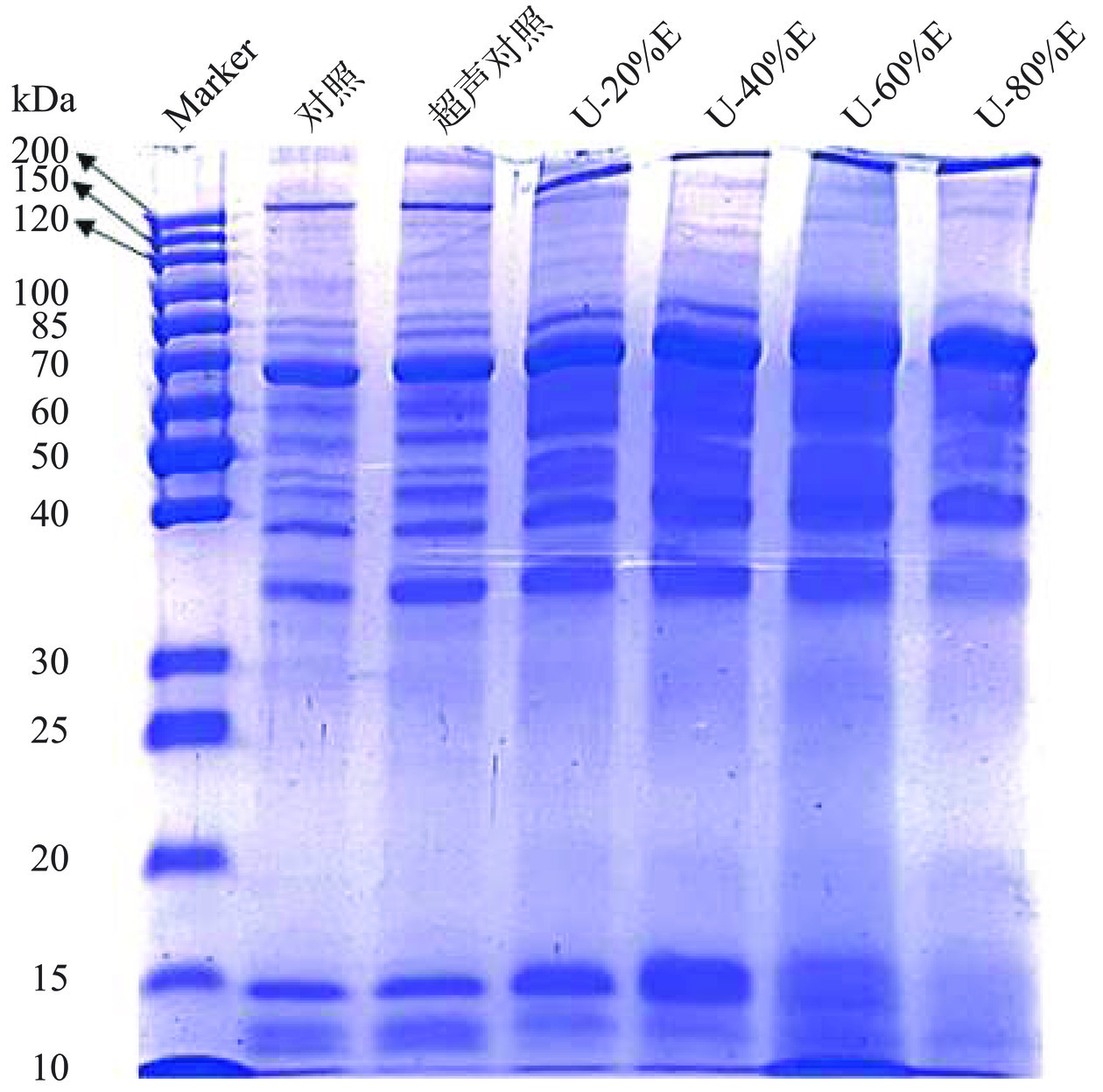
SDS-PAGE可以反映蛋白的种类以及分子量的大致分布情况。从图1中可以看出,未经过改性处理的PHP条带主要集中在200、70、35和15 kDa上,且PHP经过超声波处理后蛋白的分子量没有发生明显的改变。吴凡[23]在研究超声波处理对牡蛎蛋白的影响时也发现,超声波处理并没有明显改变蛋白的电泳条带。查越[24]报道称,紫贻贝蛋白在经过超声波处理后蛋白的分子量和分布情况并无明显区别。PHP经过联合改性后部分蛋白分子量大于200 kDa,在约70 kDa处的电泳条带也随着乙醇的添加开始变宽,并且当乙醇的浓度提高至60%和80%(v/v)时蛋白在15 kDa处的条带颜色变浅且模糊不清,这是由于超声波处理使得PHP原本包埋在蛋白内部的巯基暴露出来,随后乙醇的加入导致大量巯基被氧化为二硫键,促使蛋白发生聚集作用[12],同时部分分子量较小的蛋白也受到乙醇的影响发生了聚集现象从而形成了聚合物。冯旸旸[12]在研究乳清分离蛋白的乙醇改性时也发现,乙醇的改性处理使得电泳凝胶顶部出现大分子量聚合物,并且聚合物在β-巯基乙醇的还原作用下发生了解离,这说明蛋白聚集现象的产生是由于二硫键的作用。
2.2 超声波联合乙醇改性对PHP二级结构的影响
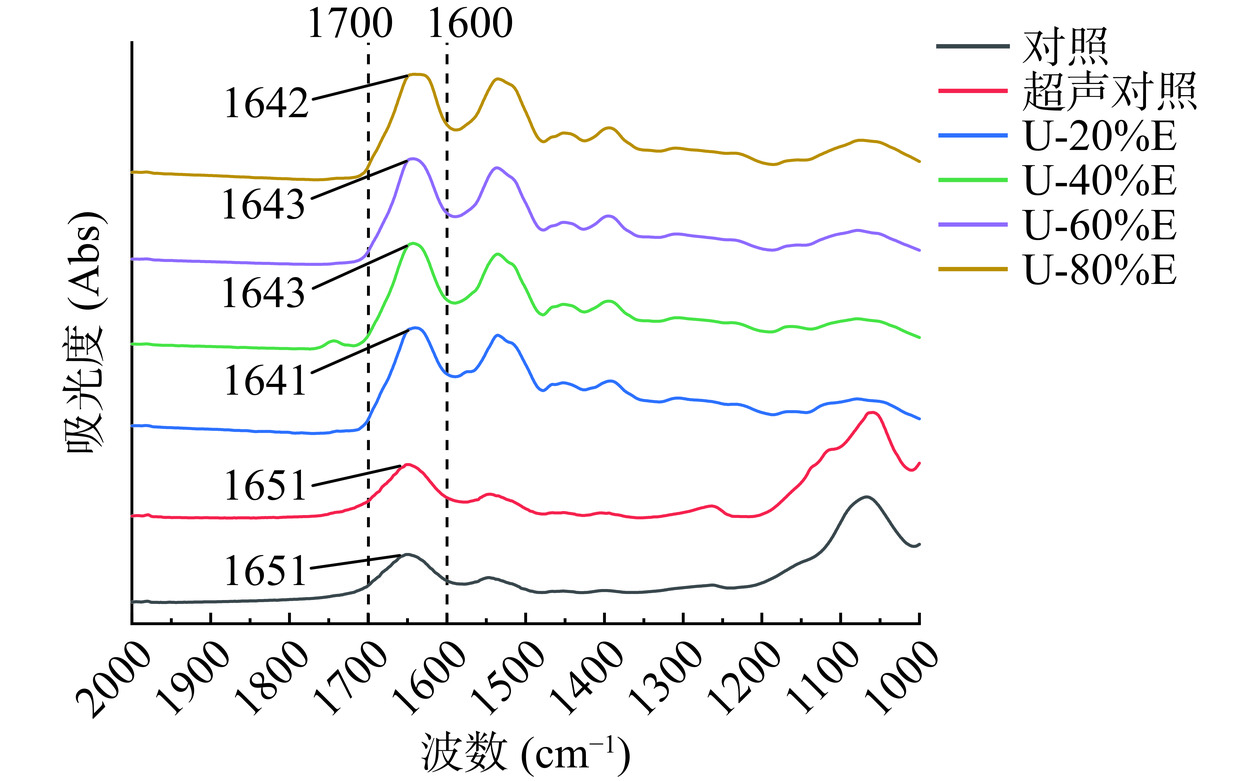
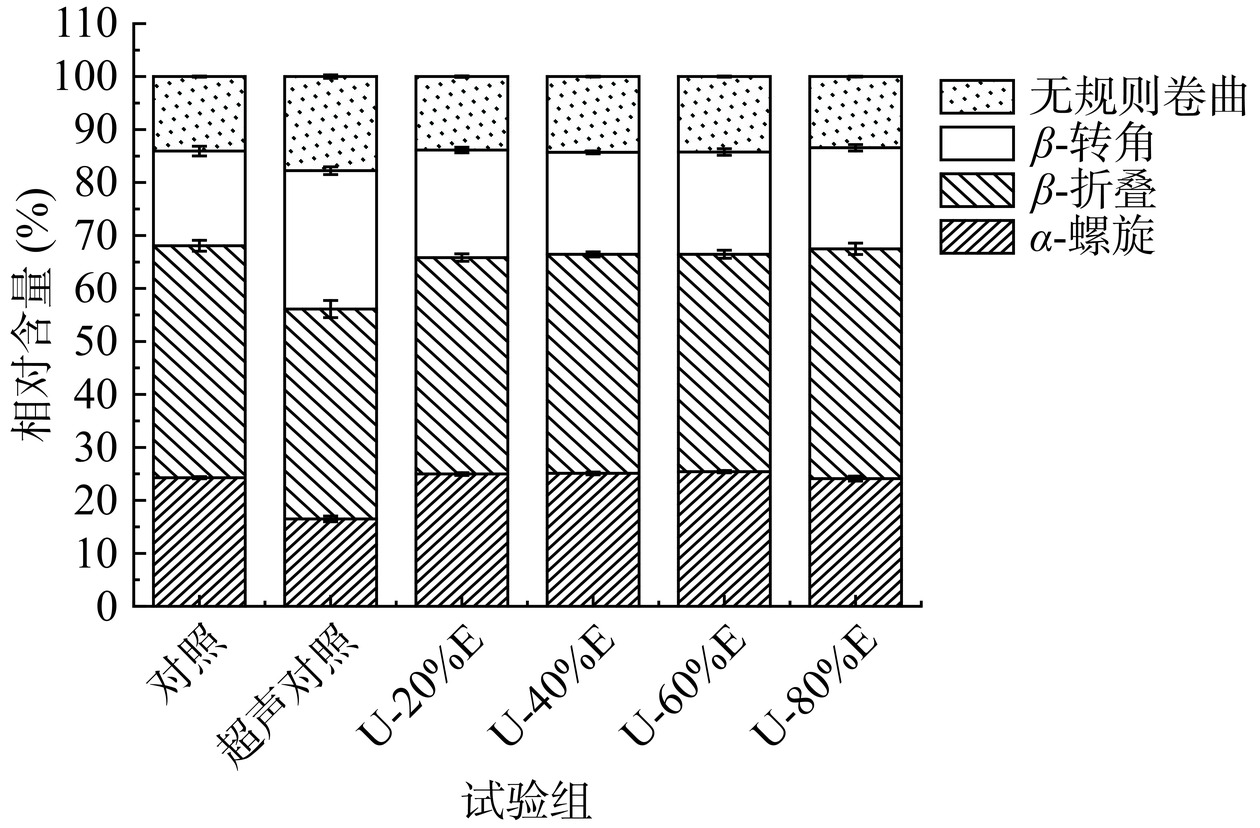
红外光谱是研究蛋白质二级结构构象变化的重要手段之一,其中酰胺I带(1700~1600 cm−1)往往用于研究蛋白二级结构的变化情况[25],其主要结构为α-螺旋(1650~1660 cm−1),β-折叠(1600~1640 cm−1),β-转角(1660~1700 cm−1)和无规则卷曲(1640~1650 cm−1)[26]。其中,α-螺旋是蛋白质中较常见的稳定二级结构,而β-折叠、β-转角和无规则卷曲则相对无序和松散[27]。超声波联合乙醇改性对PHP红外光谱及二级结构的影响如图2和图3所示。一般情况下,α-螺旋结构的稳定主要依赖于蛋白质多肽链上羰基和氨基之间分子内氢键的形成[28],而超声波处理组的α-螺旋结构相对含量显著下降(P<0.05)说明超声波的介入会对蛋白结构中的氢键造成不利影响,导致α-螺旋结构转化为β-转角或无规则卷曲结构[29]。但随着乙醇改性处理的加入,PHP的α-螺旋结构相对含量开始回升,当乙醇浓度为60%(v/v)时达到最高值25.41%。有研究表明[30],乙醇的使用可以稳定蛋白中的α-螺旋结构并且提高其相对含量,其原因为乙醇的极性较低,蛋白处于低极性的环境中有利于蛋白氢键的形成,从而促进了α-螺旋结构的形成[31]。Shiraki等[30]也报道称,适当浓度的乙醇可以有效促进α-螺旋结构的形成,并促进蛋白结构的展开。冯旸旸[12]在研究乳清分离蛋白的乙醇改性时也发现,蛋白的α-螺旋结构相对含量随乙醇浓度的增加(20%~80%,v/v)呈先增加后降低的趋势,且用40%或60%(v/v)乙醇处理的乳清分离蛋白具有最高的α-螺旋结构相对含量。
2.3 超声波联合乙醇改性对PHP紫外吸收光谱的影响
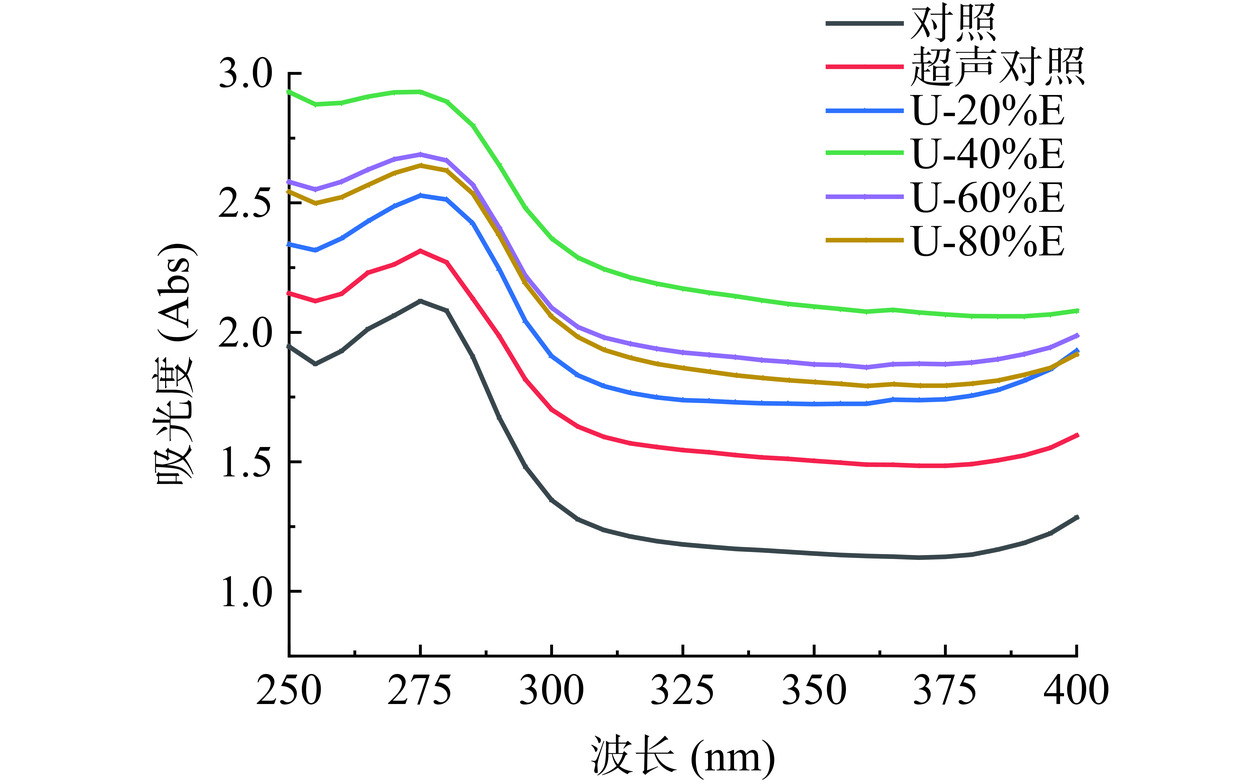
紫外吸收光谱的吸光度反映了蛋白质中芳香族氨基酸(色氨酸、酪氨酸、苯丙氨酸)以及组氨酸和半胱氨酸的残基侧链基团对紫外光的吸收程度[32]。从图4中可以看出,所有处理组均在波长约280 nm处出现最大吸收峰,说明对PHP的紫外吸收光谱主要是受到色氨酸和酪氨酸的共同影响[33]。超声波处理使得PHP的紫外吸光度明显增大,加入乙醇的改性处理后蛋白的紫外吸收强度进一步增加,且随着乙醇浓度的增大蛋白的紫外吸收强度呈先上升后下降的趋势,当乙醇浓度为40%(v/v)时,PHP的紫外吸光度达到最大值。该现象的出现说明乙醇改变了PHP的空间构象,使得疏水性氨基酸残基如色氨酸和酪氨酸等从蛋白分子的内部结构区域中大量暴露出来[34],导致环境中的发色基团含量增加。Liu等[35]也报道称,乙醇的加入可以有效地破坏大豆β-伴球蛋白的疏水区域,使得改性后的蛋白紫外吸光强度显著提高。Nikoladis等[36]研究发现,当乙醇浓度从20%增加到50%(v/v)时,乙醇对乳清分离蛋白变性的影响明显增强,蛋白紫外吸光强度显著提高。当乙醇浓度提升至60%(v/v)后PHP的紫外吸光度开始下降,这可能是由于较高浓度的乙醇会诱导蛋白发生重折叠现象,因此发色基团被重新包埋至蛋白内部[34]。
2.4 超声波联合乙醇改性对PHP微观结构的影响
超声波联合乙醇改性对PHP外观结构的影响如图5所示。有研究表明,冷冻干燥技术可能会导致蛋白呈破碎层状结构[37],经过冷冻干燥之后PHP也形成了典型的碎玻璃片状结构,其外表也较为平滑。从图中可以看出,超声波的使用使得蛋白表面出现了一些突起及小颗粒状结构,这是由于空化效应所产生的剪切力破坏了猪心蛋白分子间的氢键和范德华力,从而使更多的巯基和疏水性基团暴露于蛋白表面[38]。乙醇的加入使得PHP的形态和结构出现了较为明显的变化,随着乙醇浓度的增加(20%~40%,v/v),PHP的形状开始由碎玻璃片状逐渐转变为更加不规则的形状,PHP的表面变得更为粗糙并出现了大量孔洞,且与前两个对照组相比出现了更多的突起和颗粒。这一现象的出现可能是由于PHP经过超声波的处理后部分内部基团暴露至蛋白表面,乙醇的加入则进一步诱导了蛋白质结构的变性和展开[34],因此在两者的共同作用下PHP的结构发生了较大改变。但是当乙醇浓度提高至60%(v/v)及以上时PHP开始重新聚集,说明高浓度乙醇会引发蛋白结构发生更为显著的展开和变性,导致大量的疏水基团在短时间内暴露出来,同时蛋白中的巯基会被氧化为二硫键,因此在疏水效应和二硫键作用下蛋白会迅速聚集形成聚合物[39]。
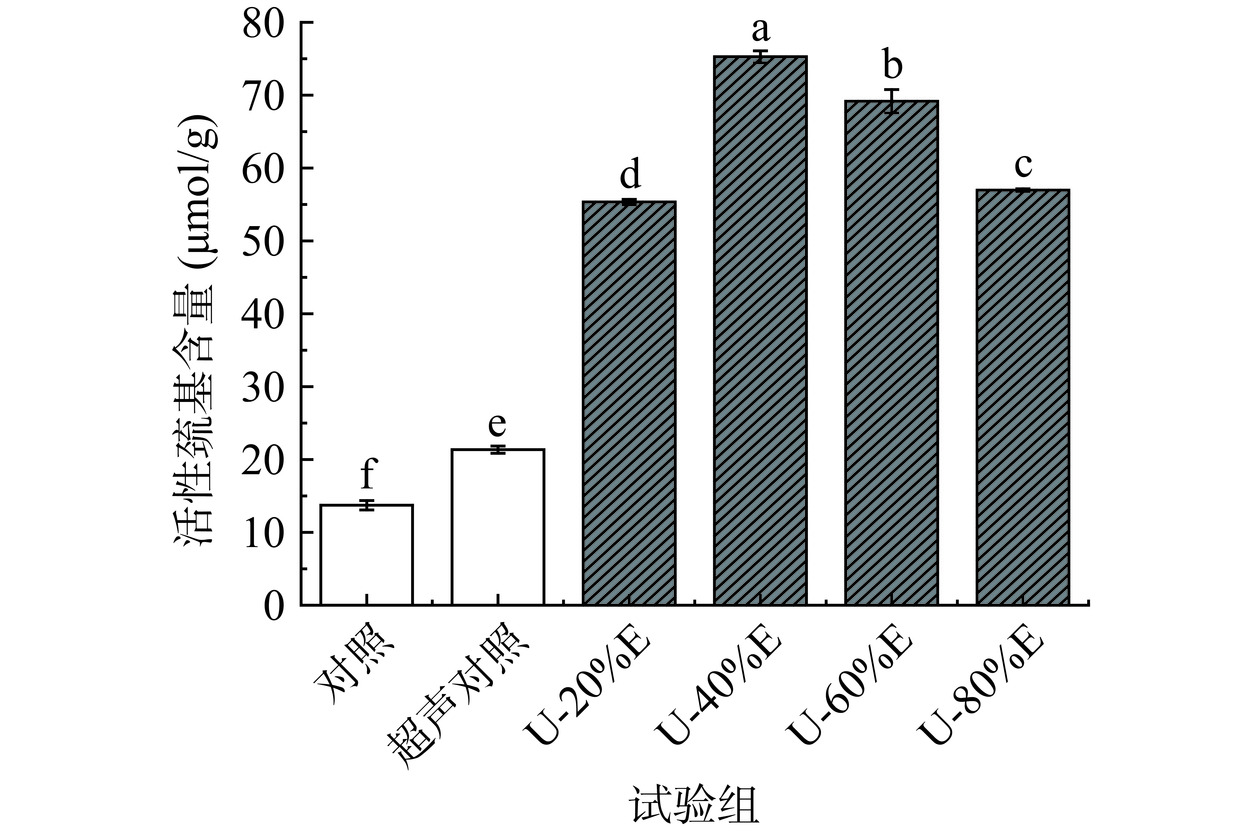
2.5 超声波联合乙醇改性对PHP活性巯基含量的影响
巯基是蛋白中一种活性较强的基团,主要由表面的活性巯基和包埋在蛋白内部的巯基组成[40]。通常情况下,大多数巯基往往是包埋在紧凑的蛋白分子内部[41],而分布在表面的活性巯基则易被氧化生成二硫键[42]。从图6可以看出,乙醇处理组的活性巯基含量显著高于对照组(P<0.05),当乙醇浓度为40%(v/v)时,蛋白的活性巯基含量达最高值75.27 μmol/g。出现该现象的原因为乙醇浓度相对较小时(20%~40%,v/v),乙醇的介入可以使得蛋白质结构进一步展开,从而使得原本掩埋在蛋白内部的游离巯基暴露出来。在此乙醇浓度下,活性巯基氧化为二硫键的速率低于巯基暴露的速率,因此导致了活性巯基含量显著增加(P<0.05)。但是,当乙醇浓度提高至60%(v/v)后PHP的活性巯基含量显著下降(P<0.05),其原因为高浓度的乙醇会加速蛋白中活性巯基的氧化,使得大量蛋白通过氧化生成的二硫键组合成聚合物,而蛋白的大量聚集也会使得一部分活性巯基被重新掩藏,进而降低了蛋白的活性巯基含量[12]。
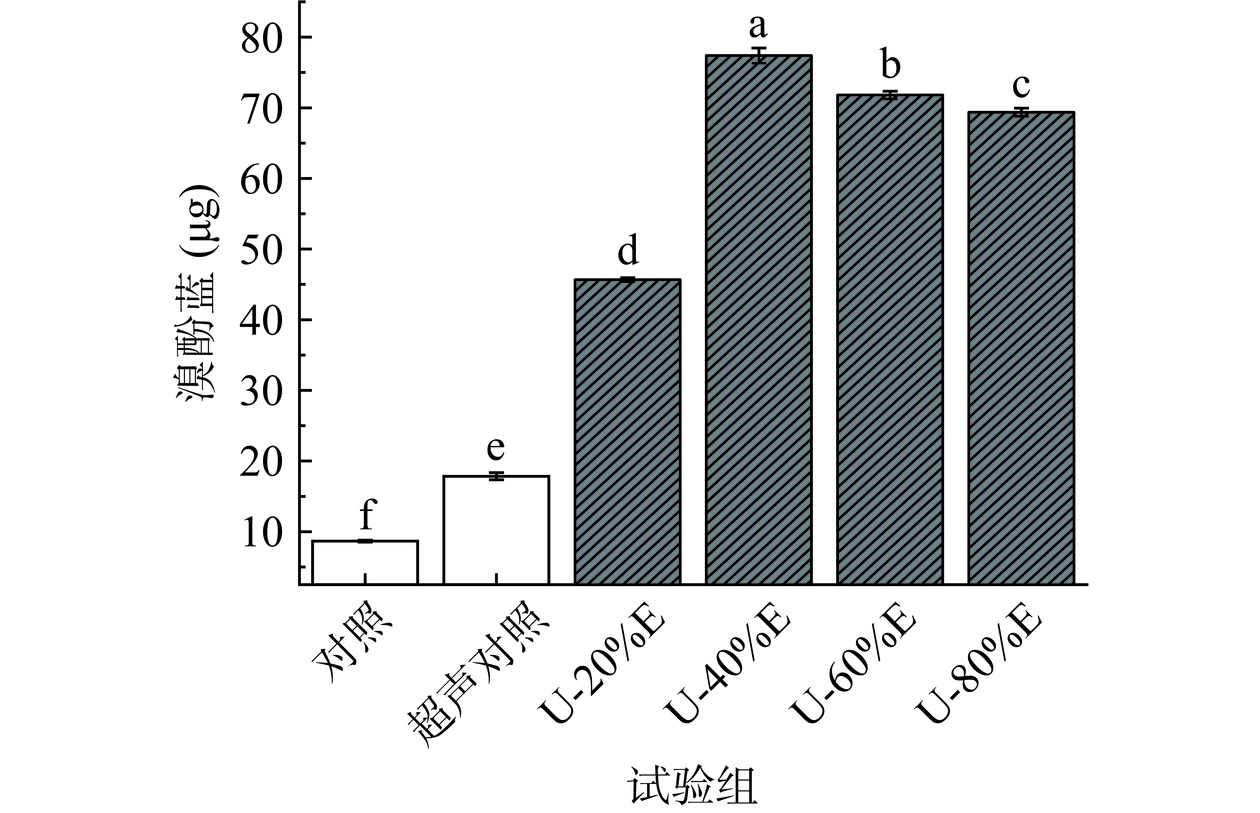
2.6 超声波联合乙醇改性对PHP表面疏水性的影响
蛋白质的表面疏水性是影响蛋白质功能性质的重要因素,可以很好地反映蛋白质结构的变形程度,是表征蛋白质结构变化的重要指标[43]。从图7中可以看出,乙醇的加入使得PHP的表面疏水性显著增大(P<0.05),且在乙醇浓度为40%(v/v)时取得最大值。分析其原因,可能是PHP经过超声波处理后蛋白结构已发生变化,乙醇的加入可以诱导PHP的结构发生更为明显的改变和展开,使得原本隐藏在蛋白内部结构的疏水基团如色氨酸和酪氨酸等大量暴露,蛋白的疏水作用增强,表面疏水性明显提高。也有研究表明,蛋白质表面疏水性的提高可能是由于蛋白质表面周围电荷密度的变化以及受到蛋白质分子之间相互作用的影响[44]。Peng等[45]也报道称,当乙醇浓度为0~40%(v/v)时,大豆β-聚球蛋白的表面疏水性随着乙醇浓度的增大而显著上升(P<0.05)。当乙醇浓度提升至60%(v/v)后,PHP的表面疏水性开始下降,其原因是蛋白的疏水区域遭到了乙醇的破坏,因此导致了蛋白表面疏水性的降低[12],也可能是由于高浓度的乙醇使得大量的疏水基团在短时间内从蛋白内部暴露,蛋白疏水作用的迅速增强反而使得蛋白加速聚集形成大颗粒,最终导致疏水基团被重新包埋起来。
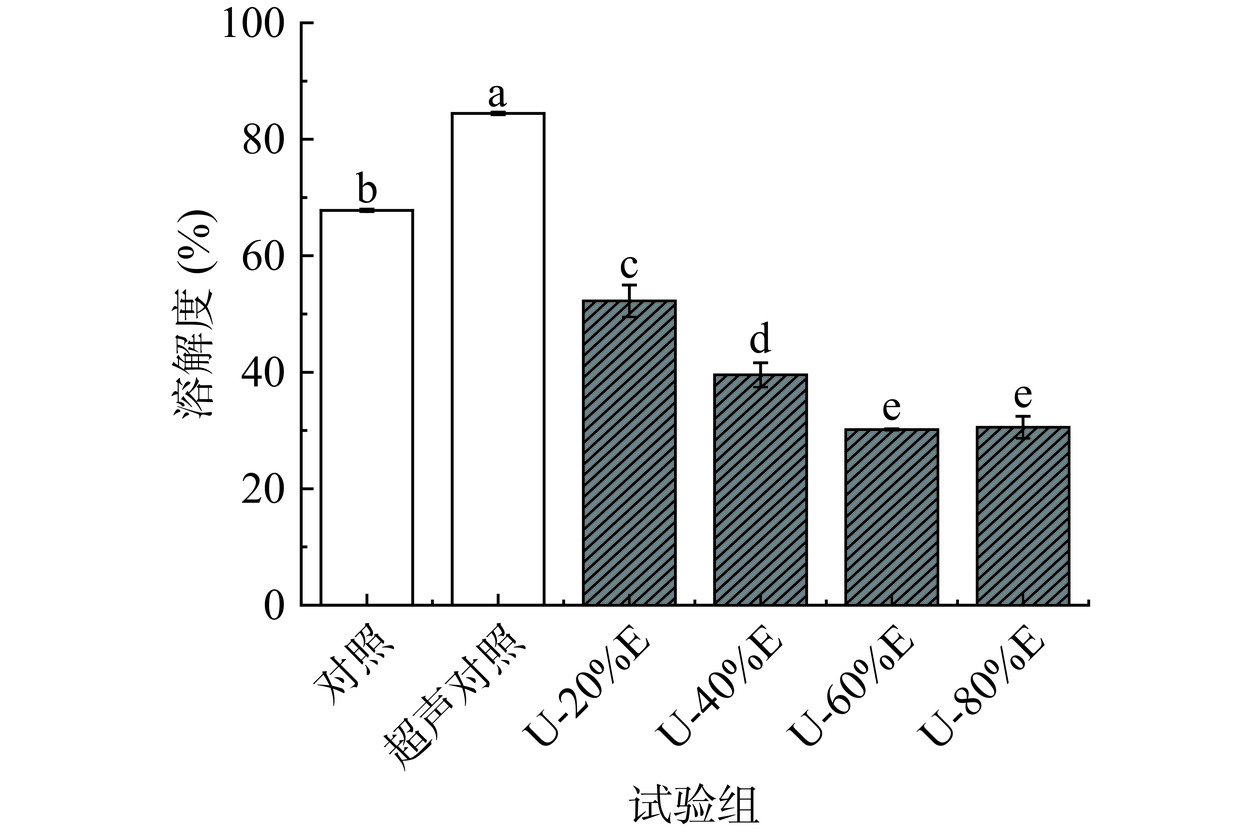
2.7 超声波联合乙醇改性对PHP溶解度的影响
溶解度是蛋白质重要的功能性质,溶解度的高低反映了蛋白在体系中的分散程度,影响着蛋白质的其他功能特性[46]。从图8中可以看出,超声波处理使得PHP的溶解度提升至84.44%,这是由于超声波的剪切作用使得PHP的粒径减小,而乙醇改性处理会使得PHP样品的溶解度显著下降(P<0.05),说明乙醇的加入可以改变PHP的构象,使得原本掩埋在蛋白内部的疏水性氨基酸暴露,蛋白的疏水作用增加,蛋白开始大量聚集,最终导致蛋白溶解度显著下降[39]。Wang等[31]也报道称,使用乙醇处理大豆蛋白会显著降低其溶解度(P<0.05),当用浓度为65%(v/v)的乙醇溶液处理大豆蛋白时,蛋白溶解度会从原来的93%急剧下降至8%。刘君[47]在研究玉米醇溶蛋白时也发现,高浓度的乙醇溶液会使得蛋白度解性显著下降(P<0.05)。
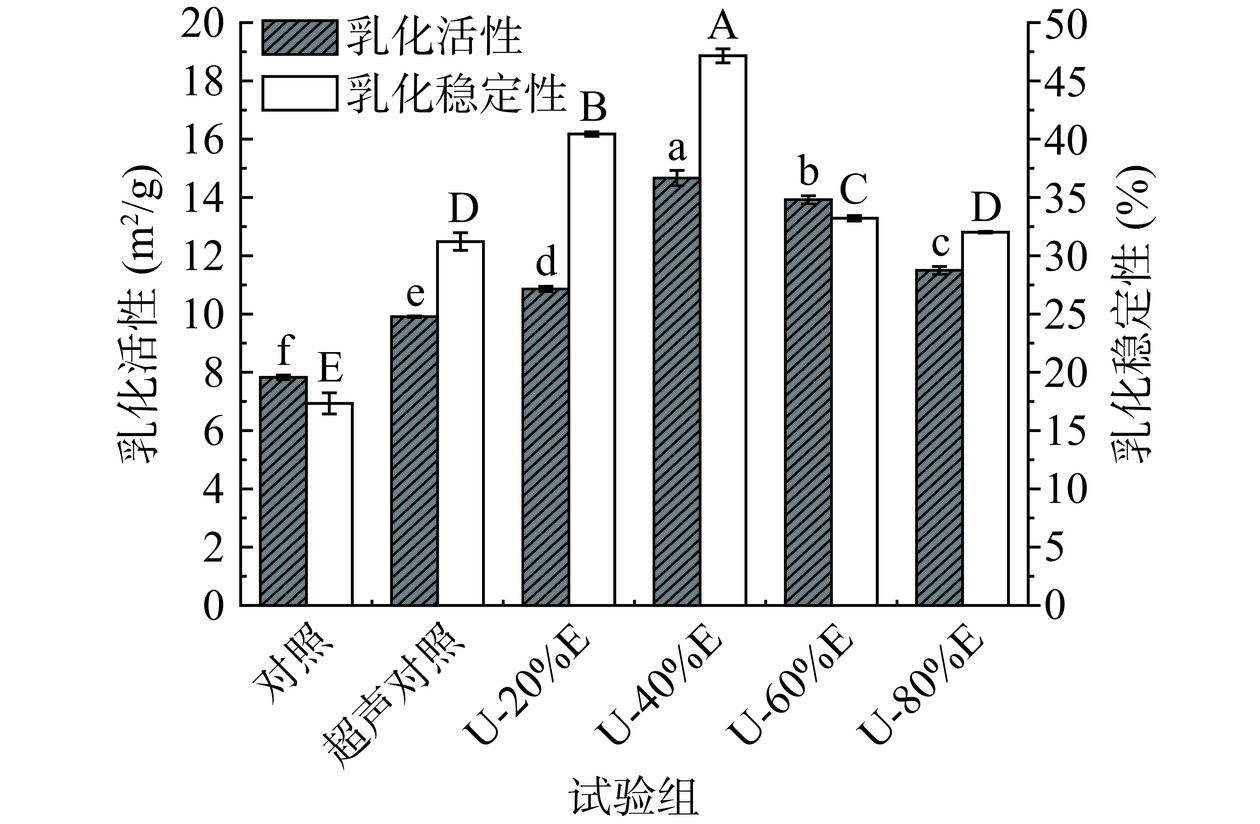
2.8 超声波联合乙醇改性对PHP乳化活性和乳化稳定性的影响
乳化活性和乳化稳定性是表征蛋白质乳化特性的重要指标,可以反映蛋白质参与形成乳化体系及稳定乳化体系的能力大小。从图9中可以看出,与前两个对照组相比,乙醇处理组的EAI和ESI显著增加(P<0.05),且均随着乙醇浓度的增加(20%~80%,v/v)呈先上升后下降的趋势,当乙醇浓度为40%(v/v)时EAI及ESI均取得最大值。有研究表明,蛋白乳化特性受蛋白溶解性和表面疏水性等特性的影响[48−49],而乙醇的改性作用会导致PHP溶解性显著下降、表面疏水性显著提高(P<0.05),因此PHP乳化特性增加的主要原因之一可能是受到表面疏水性的影响。此外,超声波处理可以导致蛋白质的结构发生变化,且乙醇的加入会使得蛋白结构进一步展开和变性,因此导致大量的疏水基团从蛋白内部暴露出来,这将有利于蛋白质在油-水界面中更均匀有效地展开和分散。当乙醇浓度为20%~40%(v/v)时,PHP结构的展开较为适宜,此时蛋白具有较大的静电排斥力且对油滴有着较高的吸附稳定性,因此提高了乳液的稳定性[34]。当乙醇浓度大于40%(v/v)时PHP的乳化性有所下降,这是由于高浓度的乙醇导致了蛋白质变性程度增加,疏水基团在短时间内大量暴露,因此较强的疏水作用会促使蛋白开始大量凝集,疏水基团反而被重新包埋至蛋白内部,最终导致PHP的乳化特性受到不利影响。
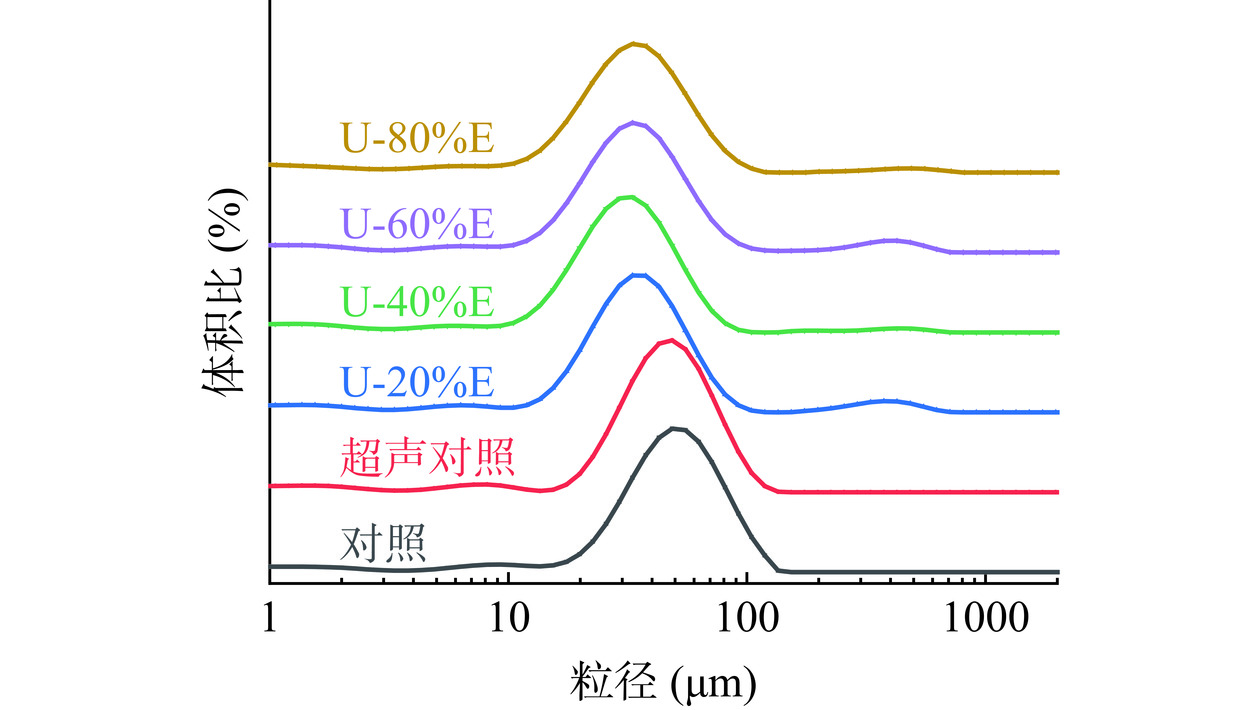
2.9 超声波联合乙醇改性对PHP乳液粒径的影响
乳液粒径是影响乳液流变性、稳定性等理化性质的主要参数之一[50],通常情况下乳液粒径较小时乳液的稳定性也越好。从图10中可以看出,PHP经过超声波处理后其乳液的粒径有所减小,加入乙醇对PHP进行联合改性后蛋白乳液的粒径呈先减小后增大的趋势,并且在乙醇浓度为40%(v/v)时乳液的粒径达到最小值,该现象与上述PHP乳化稳定性的测定结果相对应。当乙醇浓度为20%~40%(v/v)时,乳液粒径呈持续减小趋势,出现这一现象的原因为乙醇的加入使得PHP结构变性和展开,PHP的疏水基团增加,使得蛋白质可以在油-水界面中更均匀有效地展开和分散,从而提高了乳液的稳定性。冯旸旸[12]在研究乙醇改性对乳清蛋白乳状液稳定性的影响时也发现,乙醇的加入可以使得蛋白在乳化的过程中形成更小的液滴,乳液的整体粒径有所减小。但是当乙醇浓度提高至60%(v/v)之后,PHP乳液粒径有所增大,其原因为较高的乙醇浓度会引发PHP发生较为严重的聚集现象,导致疏水基团又被重新包埋至蛋白内部,乳液稳定性也因此下降。
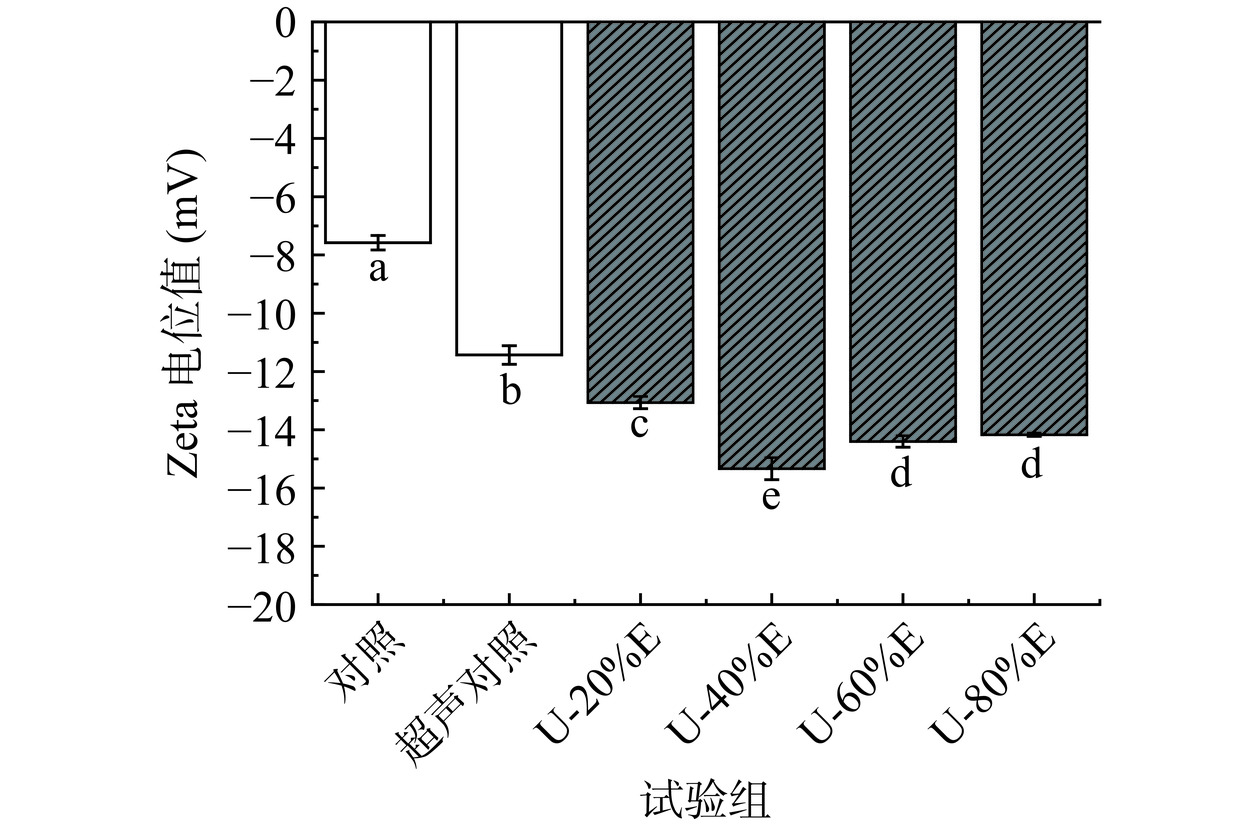
2.10 超声波联合乙醇改性对PHP乳液Zeta电位值的影响
Zeta电位值可以反映颗粒表面发生的静电相互作用,电位绝对值越大说明乳液液滴表面的静电荷数量越多,乳液的稳定性也越好。从图11中可以看出,与对照组相比乙醇处理组的乳液Zeta电位绝对值显著增大(P<0.05),且当乙醇浓度为40%(v/v)时乳液的Zeta电位绝对值取得最大值15.33 mV。乙醇的加入导致蛋白结构进一步展开和变性,大量的带电基团从蛋白内部暴露出来,使得PHP乳液表面负载了更多的负电荷,因此导致乳液的Zeta电位绝对值增大。乳液表面携带较多电荷时可以有效加强乳滴之间的静电排斥作用,从而使乳滴之间可以保持一定的空间距离,对防止液滴聚集和聚结起到了积极作用[12]。Wooster等[51]报道称,随着乳状液液滴之间空间稳定性的增加,液滴发生絮凝和聚结等现象的概率逐渐降低。而较高浓度乙醇(60%~80%,v/v)的使用会使得PHP乳液Zeta电位绝对值呈下降趋势,其原因是蛋白之间形成了粒径较大的聚集体,带电基团被重新掩埋,使得乳液表面的电荷量减少。
3. 结论
本试验主要探究了超声波联合乙醇改性处理对猪心蛋白结构和功能特性的影响,以期为猪心蛋白作为乳化剂在食品中的应用提供一定的参考依据。由试验结果可知,与两组对照组相比,超声波联合乙醇改性处理可以使得PHP的蛋白分子量及微观结构发生明显改变,蛋白的α-螺旋结构相对含量以及活性巯基含量上升,蛋白紫外吸收强度显著提高。此外,联合改性处理还使得PHP的溶解度显著下降,蛋白的表面疏水性及乳化性、乳液稳定性得到提高,乳液粒径减小,乳液Zeta电位绝对值增大,并且当乙醇的浓度为40%时PHP的乳化相关特性改善效果最佳。综上所述,超声波联合乙醇处理可以改变猪心蛋白的结构并改善其乳化特性,改性后的猪心蛋白具有作为优良乳化剂应用于肉糜加工业中的潜质。
-
-
[1] SEONG P N, PARK K M, CHO S H, et al. Characterization of edible pork by-products by means of yield and nutritional composition[J]. Korean Journal for Food Science of Animal Resources,2014,34(3):297−306. doi: 10.5851/kosfa.2014.34.3.297
[2] LU Y Y, PAN D D, XIA Q, et al. Impact of pH-dependent succinylation on the structural features and emulsifying properties of chicken liver protein[J]. Food Chemistry,2021,358:129868. doi: 10.1016/j.foodchem.2021.129868
[3] NASRABADI M N, DOOST A S, MEZZENGA R. Modification approaches of plant-based proteins to improve their techno-functionality and use in food products[J]. Food Hydrocolloids,2021,118:106789. doi: 10.1016/j.foodhyd.2021.106789
[4] GHARIBZAHEDI S M T, SMITH B. The functional modification of legume proteins by ultrasonication:A review[J]. Trends in Food Science & Technology,2020,98:107−116.
[5] WEN C T, ZHANG J X, YAO H, et al. Advances in renewable plant-derived protein source:The structure, physicochemical properties affected by ultrasonication[J]. Ultrasonics Sonochemistry,2019,53:83−98. doi: 10.1016/j.ultsonch.2018.12.036
[6] YANG J Q, LIU G Y, ZENG H B, et al. Effects of high pressure homogenization on faba bean protein aggregation in relation to solubility and interfacial properties[J]. Food Hydrocolloids,2018,83:275−286. doi: 10.1016/j.foodhyd.2018.05.020
[7] THOMAS P D, DILL K A. Local and nonlocal interactions in globular-proteins and mechanisms of alcohol denaturation[J]. Protein Science,1993,2(12):2050−2065. doi: 10.1002/pro.5560021206
[8] LIU R T, QIN P F, WANG L, et al. Toxic effects of ethanol on bovine serum albumin[J]. Journal of Biochemical and Molecular Toxicology,2010,24(1):66−71. doi: 10.1002/jbt.20314
[9] CHANG C, STONE A K, GREEN R, et al. Reduction of off-flavours and the impact on the functionalities of lentil protein isolate by acetone, ethanol, and isopropanol treatments[J]. Food Chemistry,2019,277:84−95. doi: 10.1016/j.foodchem.2018.10.022
[10] STEEN L, GLORIEUX S, GOEMAERE O, et al. Functional properties of pork liver protein fractions[J]. Food and Bioprocess Technology,2016,9(6):970−980. doi: 10.1007/s11947-016-1685-2
[11] 田星, 兰中贇, 肖淑婷, 等. 猪肉盐溶性蛋白提取工艺优化研究[J]. 肉类工业,2019(8):25−28. [TIAN X, LAN Z Y, XIAO S T, et al. Study on optimization of extraction technology of salt extractable protein from pork[J]. Meat Industry,2019(8):25−28.] doi: 10.3969/j.issn.1008-5467.2019.08.005 TIAN X, LAN Z Y, XIAO S T, et al. Study on optimization of extraction technology of salt extractable protein from pork[J]. Meat Industry, 2019(8): 25−28. doi: 10.3969/j.issn.1008-5467.2019.08.005
[12] 冯旸旸. 乳清分离蛋白的乙醇改性及其对乳状液稳定性影响的研究[D]. 哈尔滨:东北农业大学, 2021. [FENG Y Y. Modified whey protein isolate induced by ethanol treatment and its effect on stabilities of oil-in-water emulsion[D]. Harbin:Northeast Agricultural University, 2021.] FENG Y Y. Modified whey protein isolate induced by ethanol treatment and its effect on stabilities of oil-in-water emulsion[D]. Harbin: Northeast Agricultural University, 2021.
[13] LI Y H, CHENG Y, ZHANG Z L, et al. Modification of rapeseed protein by ultrasound-assisted pH shift treatment:Ultrasonic mode and frequency screening, changes in protein solubility and structural characteristics[J]. Ultrasonics Sonochemistry,2020,69:105240. doi: 10.1016/j.ultsonch.2020.105240
[14] 赵飞. 物理预处理对大豆分离蛋白结构和理化性质的影响机制[D]. 泰安:山东农业大学, 2019. [ZHAO F. Effect of physical pretreatment on structure and physicochemical properties of soybean protein isolate[D]. Taian:Shandong Agricultural University, 2019.] ZHAO F. Effect of physical pretreatment on structure and physicochemical properties of soybean protein isolate[D]. Taian: Shandong Agricultural University, 2019.
[15] 王立, 张坤, 邹烨, 等. 超声辅助提取对鸡肝蛋白结构及功能特性的影响[J]. 江苏农业学报,2018,34(5):1153−1160. [WANG L, ZHANG K, ZOU Y, et al. Effect of ultrasound assisted extraction on the structural and functional characteristics of chicken liver protein[J]. Jiangsu Journal of Agricultural Sciences,2018,34(5):1153−1160.] doi: 10.3969/j.issn.1000-4440.2018.05.026 WANG L, ZHANG K, ZOU Y, et al. Effect of ultrasound assisted extraction on the structural and functional characteristics of chicken liver protein[J]. Jiangsu Journal of Agricultural Sciences, 2018, 34(5): 1153−1160. doi: 10.3969/j.issn.1000-4440.2018.05.026
[16] 王立宇. 不同盐渍方式对毛肚理化性质与肌原纤维蛋白氧化的影响[D]. 重庆:西南大学, 2022. [WANG L Y. Effects of different curing ways on physicochemical properties and myofibrin oxidation of tripe[D]. Chongqing:Southwest University, 2022.] WANG L Y. Effects of different curing ways on physicochemical properties and myofibrin oxidation of tripe[D]. Chongqing: Southwest University, 2022.
[17] BEVERIDGE T, TOMA S J, NAKAI S. Determination of SH-groups and SS-groups in some food proteins using ellmans reagent[J]. Journal of Food Science,1974,39(1):49−51. doi: 10.1111/j.1365-2621.1974.tb00984.x
[18] CHIN K B, GO M Y, XIONG Y L. Konjac flour improved textural and water retention properties of transglutaminase-mediated, heat-induced porcine myofibrillar protein gel:Effect of salt level and transglutaminase incubation[J]. Meat Science,2009,81(3):565−572. doi: 10.1016/j.meatsci.2008.10.012
[19] AGYARE K K, ADDO K, XIONG Y L L. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids,2009,23(1):72−81. doi: 10.1016/j.foodhyd.2007.11.012
[20] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins-evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry,1978,26(3):716−723. doi: 10.1021/jf60217a041
[21] 崔珊珊. 超高压处理甘薯蛋白酶解产物乳化特性的研究[D]. 乌鲁木齐:新疆农业大学, 2015. [CUI S S. The study on emulsifying properties of sweet potato hydrolysates with high pressure treatment[D]. Urumqi:Xinjiang Agricultural University, 2015.] CUI S S. The study on emulsifying properties of sweet potato hydrolysates with high pressure treatment[D]. Urumqi: Xinjiang Agricultural University, 2015.
[22] 张小影, 齐宝坤, 孙禹凡, 等. 盐离子对大豆-乳清混合蛋白乳液的稳定性及界面特性的影响[J]. 食品工业科技,2021,42(6):22−28. [ZHANG X Y, QI B K, SUN Y F, et al. Effect of salt ion on the stability and interfacial adsorption characteristics of soybean[J]. Science and Technology of Food Industry,2021,42(6):22−28.] ZHANG X Y, QI B K, SUN Y F, et al. Effect of salt ion on the stability and interfacial adsorption characteristics of soybean[J]. Science and Technology of Food Industry, 2021, 42(6): 22−28.
[23] 吴凡. 物理加工对牡蛎(Ostrea edulis)蛋白结构和功能性质的影响[D]. 大连:大连工业大学, 2019. [WU F. Effects of physical processing on structure and functional properties of oyster (Ostrea edulis) protein[D]. Dalian:Dalian Polytechnic University, 2019.] WU F. Effects of physical processing on structure and functional properties of oyster (Ostrea edulis) protein[D]. Dalian: Dalian Polytechnic University, 2019.
[24] 查越. 物理加工对紫贻贝(Mytilus edulis)蛋白结构和功能性质的影响[D]. 大连:大连工业大学, 2019. [ZHA Y. Effects of physical processing on the structure and functional properties of mussel (Mytilus edulis) protein[D]. Dalian:Dalian Polytechnic University, 2019.] ZHA Y. Effects of physical processing on the structure and functional properties of mussel (Mytilus edulis) protein[D]. Dalian: Dalian Polytechnic University, 2019.
[25] ZHANG Q T, TU Z C, XIAO H, et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing,2014,92(C1):30−37.
[26] 曾琪, 胡淼, 王欢, 等. pH值处理对黑豆分离蛋白结构、流变特性及乳化性能的影响[J]. 食品科学,2020,41(22):15−21. [ZENG Q, HU M, WANG H, et al. Effect of pH treatment on structure, rheological properties and emulsifying properties of black bean protein isolate[J]. Food Science,2020,41(22):15−21.] doi: 10.7506/spkx1002-6630-20190906-080 ZENG Q, HU M, WANG H, et al. Effect of pH treatment on structure, rheological properties and emulsifying properties of black bean protein isolate[J]. Food Science, 2020, 41(22): 15−21. doi: 10.7506/spkx1002-6630-20190906-080
[27] LIU H T, ZHANG H, LIU Q, et al. Solubilization and stable dispersion of myofibrillar proteins in water through the destruction and inhibition of the assembly of filaments using high-intensity ultrasound[J]. Ultrasonics Sonochemistry,2020,67:105160. doi: 10.1016/j.ultsonch.2020.105160
[28] LI F F, WANG B, KONG B H, et al. Decreased gelling properties of protein in mirror carp (Cyprinus carpio) are due to protein aggregation and structure deterioration when subjected to freeze-thaw cycles[J]. Food Hydrocolloids,2019,97:105223. doi: 10.1016/j.foodhyd.2019.105223
[29] ZHU Z B, ZHU W D, YI J H, et al. Effects of sonication on the physicochemical and functional properties of walnut protein isolate[J]. Food Research International,2018,106:853−861. doi: 10.1016/j.foodres.2018.01.060
[30] SHIRAKI K, NISHIKAWA K, GOTO Y. Trifluoroethanol-induced stabilization of the α-helical structure of β-lactoglobulin:Implication for non-hierarchical protein folding[J]. Journal of Molecular Biology,1995,245(2):180−194. doi: 10.1006/jmbi.1994.0015
[31] WANG J M, YANG X Q, YIN S W, et al. Structural rearrangement of ethanol-denatured soy proteins by high hydrostatic pressure treatment[J]. Journal of Agricultural and Food Chemistry,2011,59(13):7324−7332. doi: 10.1021/jf201957r
[32] XU Y J, ZHAO Y Q, WEI Z X, et al. Modification of myofibrillar protein via glycation:Physicochemical characterization, rheological behavior and solubility property[J]. Food Hydrocolloids,2020,105:105852. doi: 10.1016/j.foodhyd.2020.105852
[33] 王海蜂. 超声波改性对鱼源肌原纤维蛋白功能特性的调控机制研究[D]. 杭州:浙江工商大学, 2022. [WANG H F. Study on the regulation mechanism of ultrasonic modification on the functional properties of myofibrillar protein extracted from fish[D]. Hangzhou:Zhejiang Gongshang University, 2022.] WANG H F. Study on the regulation mechanism of ultrasonic modification on the functional properties of myofibrillar protein extracted from fish[D]. Hangzhou: Zhejiang Gongshang University, 2022.
[34] FENG Y Y, MA X L, KONG B H, et al. Ethanol induced changes in structural, morphological, and functional properties of whey proteins isolates:Influence of ethanol concentration[J]. Food Hydrocolloids,2021,111:106379. doi: 10.1016/j.foodhyd.2020.106379
[35] LIU L L, LI X T, ZHANG N, et al. Novel soy beta-conglycinin nanoparticles by ethanol-assisted disassembly and reassembly:Outstanding nanocarriers for hydrophobic nutraceuticals[J]. Food Hydrocolloids,2019,91:246−255. doi: 10.1016/j.foodhyd.2019.01.042
[36] NIKOLAIDIS A, ANDREADIS M, MOSCHAKIS T. Effect of heat, pH, ultrasonication and ethanol on the denaturation of whey protein isolate using a newly developed approach in the analysis of difference-UV spectra[J]. Food Chemistry,2017,232:425−433. doi: 10.1016/j.foodchem.2017.04.022
[37] MA J J, MAO X Y, WANG Q, et al. Effect of spray drying and freeze drying on the immunomodulatory activity, bitter taste and hygroscopicity of hydrolysate derived from whey protein concentrate[J]. LWT-Food Science and Technology,2014,56(2):296−302. doi: 10.1016/j.lwt.2013.12.019
[38] XUE F, ZHU C S, LIU F, et al. Effects of high-intensity ultrasound treatment on functional properties of plum (Pruni domesticae semen) seed protein isolate[J]. Journal of the Science of Food and Agriculture,2018,98(15):5690−5699. doi: 10.1002/jsfa.9116
[39] 彭丽萍. 乙醇诱导大豆β-伴球蛋白组装强化其乳化性能的途径及应用[D]. 广州:华南理工大学, 2021. [PENG L P. Approach and application of ethanol-induced assembly of soybean β-conglycinin to enhance its emulsification properties[D]. Guangzhou:South China University of Technology, 2021.] PENG L P. Approach and application of ethanol-induced assembly of soybean β-conglycinin to enhance its emulsification properties[D]. Guangzhou: South China University of Technology, 2021.
[40] 吴佳. DHPM处理和Salecan添加量对低盐条件下肌原纤维蛋白理化特性和结构的影响[D]. 重庆:西南大学, 2021. [WU J. Effects of DHPM treatment and Salecan addition on the physical and chemical properties and structure of myofibrillar protein under low-salt condition[D]. Chongqing:Southwest University, 2021.] WU J. Effects of DHPM treatment and Salecan addition on the physical and chemical properties and structure of myofibrillar protein under low-salt condition[D]. Chongqing: Southwest University, 2021.
[41] CHEN X, XU X, LIU D, et al. Rheological behavior, conformational changes and interactions of water-soluble myofibrillar protein during heating[J]. Food Hydrocolloids,2018,77:524−533. doi: 10.1016/j.foodhyd.2017.10.030
[42] 李亚丽, 许玉娟, 徐幸莲. 多酚对肌原纤维蛋白结构与功能特性的影响研究进展[J]. 食品与发酵工业,2021,47(19):296−306. [LI Y L, XU Y J, XU X L. Research progress on the effect of polyphenols on the structural and functional properties of myofibrillar protein[J]. Food and Fermentation Industries,2021,47(19):296−306.] LI Y L, XU Y J, XU X L. Research progress on the effect of polyphenols on the structural and functional properties of myofibrillar protein[J]. Food and Fermentation Industries, 2021, 47(19): 296−306.
[43] BADII F, HOWELL N K. A comparison of biochemical changes in cod (Gadus morhua) and haddock (Melanogrammus aeglefinus) fillets during frozen storage[J]. Journal of the Science of Food and Agriculture,2002,82(1):87−97. doi: 10.1002/jsfa.998
[44] KUNDU S, ASWAL V K, KOHLBRECHER J. Effect of ethanol on structures and interactions among globular proteins[J]. Chemical Physics Letters,2017,670:71−76. doi: 10.1016/j.cplett.2016.12.067
[45] PENG L P, XU Y T, LI X T, et al. Improving the emulsification of soy beta-conglycinin by alcohol-induced aggregation[J]. Food Hydrocolloids,2020,98:105307. doi: 10.1016/j.foodhyd.2019.105307
[46] 马旭阳. 超声辅助冻结对猪肉品质和肌原纤维蛋白结构功能的影响研究[D]. 郑州:郑州轻工业大学, 2022. [MA X Y. Effects of ultrasound-assisted freezing on pork quality and myofibrillar protein structure and function[D]. Zhengzhou:Zhengzhou University of Light Industry, 2022.] MA X Y. Effects of ultrasound-assisted freezing on pork quality and myofibrillar protein structure and function[D]. Zhengzhou: Zhengzhou University of Light Industry, 2022.
[47] 刘君. 玉米醇溶蛋白在醇水中的凝聚行为和性质研究[D]. 天津:天津科技大学, 2013. [LIU J. Study on aggregation behavior and property of zein dissolved in alcohol aqueous solution[D]. Tianjin:Tianjin University of Science and Technology, 2013.] LIU J. Study on aggregation behavior and property of zein dissolved in alcohol aqueous solution[D]. Tianjin: Tianjin University of Science and Technology, 2013.
[48] 刘紫薇, 朱明明, 王凤新, 等. 高温湿热处理对大豆分离蛋白的结构及其功能特性的影响[J]. 食品与发酵工业,2021,47(15):157−164. [LIU Z W, ZHU M M, WANG F X, et al. Effect of high temperature hydrothermal treatment on structure and functional properties of soybean protein isolate[J]. Food and Fermentation Industries,2021,47(15):157−164.] LIU Z W, ZHU M M, WANG F X, et al. Effect of high temperature hydrothermal treatment on structure and functional properties of soybean protein isolate[J]. Food and Fermentation Industries, 2021, 47(15): 157−164.
[49] JIANG L Z, WANG J, LI Y, et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J]. Food Research International,2014,62:595−601. doi: 10.1016/j.foodres.2014.04.022
[50] SUI X N, BI S, QI B K, et al. Impact of ultrasonic treatment on an emulsion system stabilized with soybean protein isolate and lecithin:Its emulsifying property and emulsion stability[J]. Food Hydrocolloids,2017,63:727−734. doi: 10.1016/j.foodhyd.2016.10.024
[51] WOOSTER T J, AUGUSTIN M A. The emulsion flocculation stability of protein-carbohydrate diblock copolymers[J]. Journal of Colloid and Interface Science,2007,313(2):665−675. doi: 10.1016/j.jcis.2007.04.054
-
期刊类型引用(10)
1. 胡业慧,段凯露,梅显贵,徐凌峰,范圣此. 山药采收加工过程中非药用部位及副产物的资源化利用研究进展. 中国现代中药. 2025(02): 374-380 .  百度学术
百度学术
2. 刘盈,张欣,刘会平,王兵,马笑笑,张慧慧,李灿. 西瓜皮中3种多糖的初步表征及抗氧化活性对比. 食品研究与开发. 2024(04): 110-117 .  百度学术
百度学术
3. 袁高阳,秦心睿,聂晓兵,金文芳,杨玉玉,刘诗菡,范宝磊,苗潇磊. 基于熵权TOPSIS模型对白芨多糖脱蛋白体系的评价研究. 食品工业科技. 2024(07): 76-85 .  本站查看
本站查看
4. 杨欣宇,高赛,刘寅初,高晓炜,冯随,高晓光. 响应面法优化山楂多糖和山药多糖的提取工艺及其抗氧化活性研究. 中国调味品. 2024(07): 38-44+59 .  百度学术
百度学术
5. 黄子芬,李晨月,徐柠檬,刘晨,赵海婷,陈勇杏,华燕,郭磊. 真空干燥对美味牛肝菌生物活性成分及其抗氧化活性的影响. 中国食品添加剂. 2024(07): 55-61 .  百度学术
百度学术
6. 马传贵,张志秀,沈亮,贺宗毅. 山药多糖药理作用及提取技术研究进展. 蔬菜. 2024(07): 22-27 .  百度学术
百度学术
7. 刘权,刘雨婷,霍滢,肖驰骋,李欣. 食品与生物样品糖类及其衍生物检测方法研究进展. 食品安全质量检测学报. 2024(14): 115-124 .  百度学术
百度学术
8. 张喜贺,李淑娅,宋新玲,陈伟. 茯苓多糖组分对复合乳酸菌的冻干保护作用及机理. 食品与发酵工业. 2024(18): 134-140 .  百度学术
百度学术
9. 阚金涛,皮正林,杨锴莉,赵津好,刘笑焱,张玉锋. 硫酸化修饰对椰子吸器多糖结构和抗氧化活性的影响. 食品工业科技. 2024(20): 114-123 .  本站查看
本站查看
10. 曾婷,杨然,李庆军,宫亚楠,王书珍,刘谦. 基于PI3K/AKT/Gsk-3β通路研究山药多糖对运动疲劳小鼠的影响. 山东科学. 2024(06): 51-58 .  百度学术
百度学术
其他类型引用(3)
-
其他相关附件
-
其他文件格式
EI收录证明
-





 下载:
下载:

 下载:
下载:



