Research Progress on Preparation, Biological Activity and Application of Collagen Peptides
-
摘要: 胶原蛋白肽具有良好的生物相容性、生物活性及易被人体吸收利用等优点,在食品、生物医用材料及化妆品领域均得到了广泛研究与开发利用。针对近年来胶原蛋白肽在制备方法、生物活性及其应用方面的研究,本文对相关进展进行了归纳与总结。首先,概述了当前胶原蛋白肽的制备方法和原理,并比较了不同方法的优势与不足;其次,归纳了胶原蛋白肽现已发掘的生物活性,包括抗氧化性、抗菌性、抗冻性、血管紧张素转化酶(ACE)抑制活性及二肽基态酶-Ⅳ(DPP-IV)抑制活性等;最后,探讨了基于上述生物活性,胶原蛋白肽在食品领域中作为食品添加剂和功能性食品的应用情况,同时也介绍了其在医药、化妆品等领域中的最新应用。Abstract: Collagen peptides, renowned for their excellent biocompatibility, bioactivity, and facile absorption by human body, have been extensively developed and utilized in the food, biomedical, and cosmetic industries. This review focuses on recent development in the preparation methods, bioactivities, and applications of collagen peptides. Firstly, an overview of the current preparation methods and principles of collagen peptides is provided, followed by a comparison of the advantages and limitations of different methods. Subsequently, a summary of the bioactivities exhibited by collagen peptides is presented, including the antioxidant activity, antimicrobial activity, antifreeze activity, inhibition of angiotensin-converting enzyme (ACE) and dipeptidyl peptidase-IV (DPP-IV). Finally, the application of collagen peptides in food additives and functional foods, based on the bioactivity has been discussed. Additionally, the latest applications of collagen peptides in the fields of medicine and cosmetics have also been introduced.
-
Keywords:
- collagen peptides /
- preparation /
- biological activity /
- application
-
胶原蛋白是细胞外基质的主要成分,也是动物体内含量最为丰富的结构蛋白,约占动物体蛋白质总量的1/3,广泛存在于动物的皮肤、骨骼、肌腱及软骨等组织中,起支撑器官及保护基体作用[1−2]。胶原蛋白分子量高达30 ku,直接添加到食品中不易被人体消化吸收[3]。将胶原蛋白通过酶水解、酸碱水解或其他生物转化技术分解后,可获得由2~20个氨基酸残基组成的胶原蛋白肽[4]。与胶原蛋白相比,一方面,胶原蛋白肽分子量低,更容易被肠壁吸收[5];另一方面,胶原蛋白肽具有抗氧化、抗菌和抗ACE等多种生物活性,对皮肤、骨骼、心血管系统及免疫系统等均具有潜在益处。目前,研究者对胶原蛋白肽的诸多生物活性进行了持续探索,并基于不同的生物活性发掘了其在医学[6]、食品[7]及护肤美容[8−9]等领域的应用潜力。然而,迄今为止,胶原蛋白肽的绿色高效制备和高附加值应用仍面临挑战。基于此,本文总结了近年来胶原蛋白肽在制备方法、生物活性以及基于生物活性的多领域应用研究进展,并展望了胶原蛋白肽的研究开发前景。
1. 胶原蛋白肽的制备方法
胶原蛋白肽制备的原料主要来自于海洋源和陆生源加工副产物,如鲢鱼鱼磷、金枪鱼皮及牛骨等[10−11]。胶原蛋白肽的制备过程主要分三步:首先对原料预处理,去除其脂肪和杂蛋白;然后使用物理、化学或生物酶法破坏胶原纤维结构,削弱其内部的疏水作用力和氢键作用,获得胶原蛋白;最后对胶原蛋白进行水解或酶解,破坏部分肽键,最终获得具有生物活性的胶原蛋白肽[3]。其中,化学水解(例如酸/碱水解)可以破坏肽链的酰胺键,水解产物为氨基酸和短链肽。但水解过程难以控制,产物不可预测,且高浓度的酸碱试剂易造成设备腐蚀和环境问题[12]。酶解法反应条件比化学水解法更温和,并且由于酶具有特异性,因此产物相对可预测。目前,酶解法是制备胶原蛋白肽最为常见和最具优势的方法。但酶解法存在反应时间较长、成本较高等问题。除上述方法外,现有制备方法还包括物理辅助酶法、微生物发酵法及其他制备方法。表1列举了不同胶原蛋白肽的制备方法、工艺参数与生物活性。
表 1 胶原蛋白肽的制备方法、工艺参数及生物活性Table 1. Preparation methods, process parameters and biological activity of collagen peptides原料来源 制备方法 工艺参数 生物活性 参考文献 鲢鱼鱼鳞 酶法(胃蛋白酶) 加酶量16.1%,料液比1:15.6,4.9 h 酪氨酸酶抑制活性 [13] 鱿鱼皮 酶法(中性蛋白酶) 加酶量600 U/g,45 ℃,4 h,pH6.0 − [15] 鳕鱼皮 酶法(胰蛋白酶) 加酶量0.4%,5 h,pH9.0 抗皮肤老化 [16] 黄鳍金枪鱼皮 酶法(碱性蛋白酶) 加酶量0.034 U/g,54.7 ℃,5.2 h,pH8.0 抗氧化活性、抗冻活性 [28] 鱿鱼皮 分步酶法(碱性蛋白酶、木瓜蛋白酶) 底物质量浓度4%,加酶量4000 U/g,先碱性蛋白酶于pH8.0,2 h,50 ℃;后木瓜蛋白酶于pH6.0,3 h,45 ℃ 抗冻活性 [20] 藏羊皮 超声辅助(碱性蛋白酶) 超声处理(150 W,11 min),料液比1:20,加酶量6000 U/g,
40 ℃,4 h,pH9.0抗氧化活性 [23] 牛骨 超声辅助(碱性蛋白酶和风味蛋白酶) 超声处理(400 W,120 min),底物质量浓度4.4%,加酶量6000 U/g 抗氧化活性 [24] 动物软骨 微波辅助 微波处理(200 W,280 s),酶6%,2.26 h,50 ℃,
料液比1:17 mg/mL,底物质量浓度10%,pH7.0− [26] 海地瓜 微波辅助(碱性蛋白酶) 微波处理(300 W,30 min),加酶200 U/mg,45 ℃,1 h,pH10.0 抗氧化活性 [29] 罗非鱼骨 微生物发酵
(枯草芽孢杆菌Bacillus sp. A-5)接种量7.8%,发酵温度36.6 ℃,鱼骨浆添加量13.3%,发酵时间30 h − [30] 鲮鱼皮 微生物发酵(假交替单胞菌Pseudoalteromonas sp. SHK1-2) 接种量2%,发酵温度17 ℃,酶与底物1:10,
酶解温度37 ℃,5 h抗氧化活性 [31] 金枪鱼皮 亚临界水解 反应温度150~300 ℃,压力50~100 bar,反应时间5 min 抗氧化活性 [32] 牛骨 蒸汽爆破 蒸汽压力2 MPa,反应时间30 min − [33] 1.1 酶解法
酶解法是利用蛋白酶对胶原蛋白进行水解,其原理主要是选用特定的酶来切割胶原蛋白分子,使其分解成较小的多肽片段。目前常用蛋白酶包括胃蛋白酶[13]、菠萝蛋白酶[14]、中性蛋白酶[15]、酸性蛋白酶[16]、生姜蛋白酶[17]、木瓜蛋白酶[18]等。早期研究主要采用单一酶法。然而,由于酶切位点的特异性,单一酶制剂只能破坏胶原蛋白肽链上特定位置的肽键,导致所得胶原蛋白肽分子量大且分布较为局限,从而难以发挥其生物活性。复合酶法可以实现对胶原蛋白的多位点酶切,所得产物酶解度高,分子量小且分布范围广,能有效解决单一酶法的缺陷。然而,复合酶法虽在一定条件下能够实现不同酶的优势互补,但需要考虑潜在的酶活性相互抑制的问题[19]。为解决这一问题,研究者提出了分步添加酶的改进策略。蔡金秀等[20]分两步加酶从鱿鱼皮胶原蛋白中制备出具有抗冻活性的胶原蛋白肽:先以碱性蛋白酶于pH8.0、50 ℃条件下酶解2 h,灭酶后再用木瓜蛋白酶于pH6.0、45 ℃下酶解3 h,制备出的胶原蛋白肽分子量主要分布在1~5 ku。与复合酶法相比,分步酶法便于独立添加和控制每种酶的反应条件和浓度,有利于发挥出酶的最大反应效率,但由于步骤较多,其制备工艺会更加复杂且耗时。由上述可知,根据不同的底物与目标产物,需选择合适的酶或者复合酶制剂,并精心设计最优酶解工艺,才可高效制备出具有不同结构与生物活性的胶原蛋白肽[21]。
1.2 物理辅助法
物理辅助法指利用一些物理技术来辅助制备胶原蛋白肽的方法,旨在提高生产效率。最常见的物理辅助法包括超声波和微波辅助法。目前,这些物理技术主要与酶解法相结合[22]。
超声辅助酶法主要利用超声波的机械作用和空化效应破坏胶原纤维组织,从而有助于酶作用以提高提取率。然而,超声时间过长会导致体系温度升高,造成胶原蛋白结构破坏[23]。郭佳俊等[24]研究发现,超声时间是超声辅助酶法的主要影响因素,其次依次是超声功率、加酶量及底物浓度。此外,研究结果还表明超声辅助能有效提高胶原蛋白肽的抗氧化性能。
微波辅助制备是利用微波能量促使溶剂分子振动并加速渗透,从而提高胶原蛋白肽提取率[25]。有研究表明,与常规酶解法相比,微波辅助酶法制备胶原活性肽的反应时间缩短了近50%,且水解度和分子量范围在180~1000 u的肽链比例均明显提高[26]。此外,微波辅助还能提高胶原蛋白肽的得率,且在感官评价上(颜色、气味等)优于无微波辅助制备的胶原蛋白肽[27]。
由上述可知,这两种物理辅助技术能够明显提高胶原蛋白肽提取效率,改善产品性能。然而,这些辅助技术对胶原蛋白肽性质的影响机制尚不完全明确,还需加以深入研究。
1.3 微生物发酵法
微生物发酵也是较为常用的胶原蛋白肽制备方法,其利用微生物发酵分泌蛋白水解酶对胶原蛋白进行水解,通过控制水解反应条件,获得不同分子量的胶原蛋白肽。在发酵过程中,微生物代谢产生的酶系还可将原料中少量的脂类和杂蛋白降解为营养物质,供微生物自身吸收利用。目前用于胶原多肽制备的菌种主要有枯草芽孢杆菌、霉菌及酵母菌等。例如,韦倩妮[30]使用枯草芽孢杆菌(Bacillus sp. A-5)进行发酵,从罗非鱼鱼骨中获得胶原蛋白肽,发现制备的最佳工艺条件为接种量7.8%、发酵温度36.6 ℃、鱼骨浆添加量13.3%、发酵时间30 h,其水解度最高达28.52%。武翠玲等[31]采用液体发酵培养法对假交替单胞菌(Pseudoalteromonas sp. SHK1-2)进行发酵产酶,获得的胞外蛋白酶用于制备鲮鱼皮胶原蛋白肽,随后通过超滤、羟丙基葡聚糖凝胶(Sephadex LH-20)分子筛层析获得具有二苯代苦味酰基自由基清除能力(35.6%±7%)、氧自由基清除能力并能抑制DNA氧化损伤的多肽,其抗氧化活性肽序列为TAGHPGTH,是一种新型抗氧化肽。与酶解法和物理辅助法相比,微生物发酵法不需要添加除培养基之外的化学试剂,也不会造成环境污染问题。此外,该方法还具有条件温和、效率高及水解产物较为稳定等优点,未来有望成为工业上高活性胶原蛋白肽的主要生产方式。
1.4 其他制备法
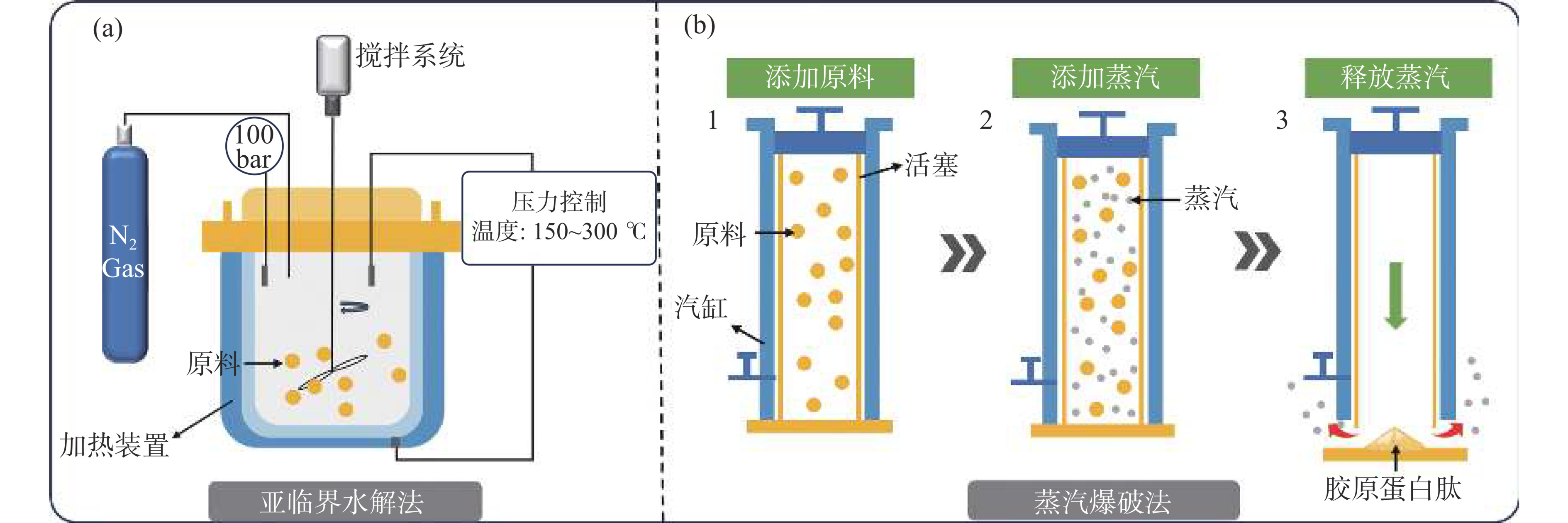
最近几年,亚临界水解法被开发作为胶原蛋白肽的一种新型制备方法。如图1(a)所示,在高温高压条件下,使用压力高于饱和值但低于临界值的水作为反应介质,通过形成水合氢离子和氢氧化物,使其在亚临界状态下充当催化剂催化水解胶原蛋白[34]。整个过程无需酶或其他试剂即可将胶原蛋白水解为小分子肽链。基于这一原理,Ahmed等[32]通过控制不同温度和压力,在处理时间为5 min的条件下从金枪鱼皮中制备出具有抗氧化和抗菌活性的胶原蛋白肽。与传统酶法相比,亚临界水解法制备时间更短,但该方法成本较高,目前不适合大规模生产[35]。此外,2023年报道了采用蒸汽爆破法制备胶原蛋白肽的研究工作,其制备过程如图1(b)所示。将原料加入到反应容器后,通过控制蒸汽压力和处理时间进行水解,从而获得不同分子量范围的胶原蛋白肽[33]。蒸汽爆破法具有突破常用制备方法局限性、提高产物品质的潜力,但是该方法制备条件较苛刻,还需进一步开发以提高产品品质稳定性。
2. 胶原蛋白肽的生物活性
胶原蛋白肽是一类具有多种生物学功能的生物活性肽,其具有比氨基酸更优越的吸收机制和功能特性[36]。近年来,越来越多的研究工作表明胶原蛋白肽具有多种有益的生物活性。除对骨骼、关节及皮肤有益外,胶原蛋白肽还具有抗高血压、糖尿病、抗氧化及抗菌等活性[37]。此外,胶原蛋白肽的部分生物活性已通过体内动物模型乃至人体临床试验验证。表2中列举了胶原蛋白肽的生物活性类型以及基于这些生物活性的相关氨基酸残基序列。
表 2 胶原蛋白肽的生物活性及相关氨基酸序列Table 2. Biological activity of collagen peptides and related amino acid sequence来源 制备方法 生物活性 相关序列 参考文献 牛骨 酶法(碱性蛋白酶) 抗氧化活性 − [38] 安康鱼鱼鳔 酶法(木瓜蛋白酶) 抗氧化活性 YDYD、ARW和DDGGK [39] 鳗鱼皮 酶法(胃蛋白酶、胰蛋白酶) 抗氧化活性 − [40] 可口革囊星虫 酶法(木瓜蛋白酶、中性蛋白酶) 抗氧化活性 AGDDAPRAVF、PSIV、LVAGGL、VVGIVA和GIPGAP [41] 鲍鱼内脏 亚临界水解 抗氧化活性 − [42] 牛皮 超声辅助(木瓜蛋白酶、复合蛋白酶) DPP-IV抑制活性 GPVGPPG [43] 羊皮 酶法(碱性蛋白酶) DPP-IV抑制活性 GPAGPOGFPG [44] 耗牛骨 酶法(碱性蛋白酶、木瓜蛋白酶) ACE抑制活性、抗氧化活性 − [45] 罗非鱼皮 酶法(碱性蛋白酶) ACE抑制活性 − [37] 罗非鱼鳞 酶法(木瓜蛋白酶) 抗氧化活性、抗菌活性 − [46] 金枪鱼皮 亚临界水水解 抗菌活性 − [32] 各种鱼类副产品 酶法(碱性蛋白酶) 抗菌活性 − [47] 猪皮 酶法(碱性蛋白酶) 抗冻活性 GLLGPLGPRGL [48] 罗非鱼皮 酶法(碱性蛋白酶) 抗冻活性 -NHGK [49] 鲑鱼皮 微生物发酵法(弧菌胞外蛋白酶) 抗冻活性、抗氧化活性 PMAGGGGTHT [50] 2.1 抗氧化活性
正常情况下,人体的氧化和抗氧化防御系统处于平衡状态。活性氧是呼吸过程的代谢产物,发挥着充当细胞生长因子和细胞间信号调节器等特定作用。然而在不利的外源环境或疾病发作期间,体内会产生大量的活性氧[39]。而在食品工业中,食品变质往往可能与脂质氧化或过量的次级脂质过氧化产物的形成有关。因此,抗氧化剂在食品系统和人体中都发挥着重要作用。据报道,胶原蛋白肽具有清除自由基和抗氧化的活性,其肽序列中Tyr、Phe、Trp、His、Met及Pro被认为具有增强自由基清除的特性,上述氨基酸可向缺电子自由基提供质子[36]。然而,胶原蛋白肽抗氧化活性的作用机制尚未完全阐明。目前有研究报道分子量对抗氧化活性存在一定影响。例如,马慧[51]用墨鱼皮制备出三种分子量的胶原蛋白肽,电子顺磁光谱结果表明,分子量低于3 ku的肽组分具有更强的抗氧化活性。此外,从鲣鱼、牛皮及鲤鱼提取的胶原蛋白肽也具有一定的抗氧化特性[52−54]。东海海参制备的胶原蛋白肽对O2−、OH及DPPH自由基均有较好的清除作用,且抗氧化活性与浓度呈正相关[55]。此外,胶原蛋白肽还能延缓脂质过氧化,这使其有望作为食品保鲜的添加剂以延长保质期。
2.2 抗菌活性
胶原蛋白肽中部分氨基酸残基能通过静电作用与细菌细胞膜表面结合,穿透并破坏膜结构,导致细菌死亡[56]。与传统抗生素的单靶点杀菌原理不同,胶原蛋白肽的抗菌特性表现为能够通过破坏多个靶点来消灭病原体,从而显著减少耐药菌的出现[57]。大量研究表明,鱼类经过酶水解可以产生具有抗菌活性的胶原蛋白肽。例如,从大西洋鲭鱼中分离出的胶原蛋白肽在1.88 mmol/L时能完全抑制金黄色葡萄球菌的生长[58]。据报道,胶原蛋白肽的抗菌活性受其分子量的影响。Hernández-Ruiz等[46]从罗非鱼鱼鳞中制备出分子量分布在5~10 ku范围内和分子量小于5 ku的胶原蛋白肽,发现分子量在5~10 ku的胶原蛋白肽具有更强的抗菌性能。此外,Wald等[59]发现水解程度对抗菌活性也有较大影响,在30%水解度下的胶原蛋白肽具有最高的抗菌活性,并在该水解度下针对嗜冷黄杆菌和鲑鱼肾杆菌的最低抑制质量浓度分别为2 mg/mL和5 mg/mL。因此,具有抗菌活性的胶原蛋白肽适于作为食品加工中的防腐剂[60]。但其应用潜力还需要经过进一步的研究和验证。
2.3 抗冻活性
抗冻肽能够降低冰晶生长点且不影响其熔点来抑制冰晶生长和重结晶,以防止冷冻损伤[61]。因此,抗冻肽在食品领域中能够保持冷冻食品(如肉糜制品和冰淇淋等)的结构和质地,延长产品货架期。据报道,胶原蛋白肽中脯氨酸和羟脯氨酸可通过氢键与冰晶棱面相结合,再通过疏水相互作用协同抑制冰晶生长,从而增强抗冻性[20,62]。Wu等[50]使用弧菌胞外蛋白酶水解鲑鱼皮胶原蛋白制成胶原蛋白肽,其中分子量高于3000 u的胶原蛋白肽表现出抗冻活性。Cao等[48]通过碱性蛋白酶和柱色谱分离从纯化的猪胶原蛋白中制备了一种分子量为1162.8 u的高活性胶原蛋白抗冻肽(GLLGPLGPRGLL),且在pH8.0、15%水解度、5%碱性蛋白酶条件下水解的胶原蛋白肽具有最高热滞后性(5.28 ℃),将其应用到冰淇淋中可提高产品的再结晶性、耐熔性和玻璃化转变温度。目前的胶原蛋白肽抗冻性研究主要集中于抗冻机制研究;在应用方面仍有待深入探索,特别是在不同食品体系中的应用潜力。
2.4 ACE抑制活性
高血压是一个严重的全球健康问题,是发生心血管疾病的主要危险信号之一。血管紧张素转化酶(ACE)通过催化血管紧张素I转化为具有升血压活性的血管紧张素II,并使具有血管舒张作用的缓激肽失活,从而导致血压上升[63]。抑制ACE活性是阻碍血压上升的有效途径。胶原蛋白肽中许多支链氨基酸能够与ACE酶竞争性地结合,阻断血管紧张素Ⅰ的转化,从而降低血管紧张素Ⅱ的生成,减少血管收缩,最终导致血压下降[41]。在与ACE酶结合过程中,胶原蛋白肽的C端所在环境的亲疏水性是活性部位发挥作用的关键[45]。近年来,多项研究工作先后证实了该作用机制。例如,Chen等[14]通过酶解罗非鱼皮获得胶原蛋白肽,发现其C端三肽位置疏水氨基酸的存在能够增强对ACE活性的抑制作用。邵燕秋等[63]利用碱性蛋白酶制得胶原蛋白肽,其ACE活性抑制率约为70%,其中疏水性氨基酸(Pro、Val、Ile、Leu、Phe)是抑制ACE活性的重要氨基酸。此外,Sun等[37]证实胶原蛋白肽C端中C3位脯氨酸可抑制ACE活性,而C2位脯氨酸起促进作用。在原料选择方面,研究者也报道从牦牛骨[45]、海蜇[64]等获得具有抑制ACE活性的胶原蛋白肽,并在临床试验中取得了较好的效果。
2.5 DPP-IV抑制活性
胰高血糖素样肽1(GLP-1)具有强烈的葡萄糖依赖性促胰岛素特性;然而,GLP-1在体内会被DPP-IV快速裂解并失活,从而导致人体糖尿病发作[43]。DPP-IV抑制剂可通过延缓葡萄糖依赖性促进胰岛素多肽和GLP-1的降解,从而在血糖水平调节中发挥关键作用,进一步促进胰岛素分泌。据报道,胶原蛋白肽能够结合DPP-IV活性位点,并与活性位点区域残基之间形成强相互作用来抑制DPP-IV。如胶原蛋白肽的Pro与疏水性DPP-IV中的S1位点有相互作用[44]。目前,较多研究已证实通过酶解法得到的特定肽段具有较强的DPP-IV抑制活性。例如,He等[43]采用双酶水解和超声辅助技术制备的GPVGPPG序列胶原蛋白肽具有较高的DPP-IV抑制活性,并通过合成序列的最低半抑制浓度(IC50)验证这一结果。此外,尹剑等[65]利用LC-MS/MS质谱分析对分离纯化后的鲟鱼皮胶原蛋白肽的氨基酸序列进行鉴定,结果表明,GPSGLDGAK序列的胶原蛋白肽的DPP-IV抑制活性最强,其IC50值约为62 μmol/L。尽管已有大量研究报道胶原蛋白肽的体外DPP-IV抑制活性,但还需临床试验来验证胶原蛋白肽的功效。
2.6 其他生物活性
除上述提到的生物活性外,研究发现,胶原蛋白肽还具有酪氨酸酶抑制活性和抗炎活性等。例如,从鲢鱼鱼鳞制备的胶原蛋白肽显示出较高酪氨酸酶抑制活性(82.25%)[13]。此外,Liu等[66]从鲑鱼皮中分离并鉴定出9种胶原蛋白的小分子肽,可显著减少巨噬细胞中NO、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)和肿瘤坏死因子(TNF-α)的分泌,其中QA序列的胶原二肽表现出最佳抗炎作用,对脂多糖诱导的巨噬细胞NO分泌的IC50值为849.3 μmol/L。在过去的几年中,胶原蛋白肽还被证明具有抗癌活性,一些体外研究显示了其在不同癌症类型中的潜力。例如,将鲭鱼的副产物用猕猴桃素水解,然后再用碱性酶水解产生的胶原蛋白肽,在1 mg/mL浓度下其抗氧化和抗癌活性分别为67.75%和96.93%[67]。然而,仍需进一步阐明这些生物活性的作用机制,以便为不同应用领域提供理论依据。
3. 胶原蛋白肽的应用
3.1 食品工业中的应用
3.1.1 食品添加剂
胶原蛋白肽作为天然生物活性肽,食用安全性高,常被添加到肉类、乳制品及面包等食品中,用作食品添加剂的功能性成分[68]。在肉制品方面,将胶原蛋白肽作为抗氧化剂添加到肉丸中能减弱肉丸脂质氧化程度,同时显著降低肉丸中硫代巴比妥酸值和过氧化值[69];在乳制品方面,将胶原蛋白肽添加到冰淇淋中能够改善冰淇淋的重结晶和抗融化性,可用作低温加工食品的有益添加剂[57]。此外,胶原蛋白肽中的谷氨酸、组氨酸及丝氨酸等亲水氨基酸可以提高乳酸菌活性。因此,适当添加胶原蛋白肽可以优化酸奶发酵过程,从而提高其整体品质[62]。在烘培食品方面,添加海洋胶原蛋白肽能够改善饼干粉的理化特性和品质,同时降低总热量[70]。
3.1.2 功能性食品
胶原蛋白肽作为功能性营养食品的主要成分,可参与人体多种代谢和生理调节,起到预防疾病和增强免疫力的功效。在保健食品中,胶原蛋白肽主要用于促肠道吸收、降低血压及调节血糖[3,12]。有研究结果表明,胶原蛋白肽在人体消化道中分解吸收后,能够提高肠道细胞活力,刺激肠粘膜,加速肠道蠕动,从而促进消化吸收[71]。另外,人体肠道中,调节健康的益生菌多以蛋白质为食。因此,胶原蛋白肽作为保健食品能够改善肠道健康。此外,口服水解胶原蛋白补充剂可以到达皮肤深层,改善皮肤色泽、弹性等[72]。在运动营养食品中加入胶原蛋白肽还可增强骨骼的健康状况和功能、改善肌少症等[73]。
尽管胶原蛋白肽已经广泛应用于食品领域,但其在食品加工和储存过程中可能受到pH、温度、氧化及酶解等因素的影响,导致其稳定性下降,从而影响产品的品质与功效。因此,作为一种功能性食品主要成分,胶原蛋白肽与其他成分在食品加工和储存过程中的相互作用还需进一步探索。
3.2 其他领域的应用
3.2.1 医学领域
除食品领域外,胶原蛋白肽在医学领域也具有较好的应用潜力。Song等[74−75]研究发现口服鲢鱼皮胶原蛋白肽可抑制衰老小鼠的血小板活化,此外,还鉴定出抗血小板活性最高的三肽Hyp-Asp-Gly在血浆中表现出良好的稳定性,当添加剂量为200 μmol/kg时,胶原三肽还具有体内抗血栓形成作用。此外,胶原蛋白肽还能有效抵抗骨质疏松,在小鼠日粮中添加胶原蛋白肽饲喂56 d后,其骨机械强度、骨密度及骨胶原蛋白含量均增加[76]。另有研究证明胶原蛋白肽还具有促进伤口愈合[77]和抗高尿酸[78]等作用。
3.2.2 化妆品中的应用
胶原蛋白肽具有促进皮肤细胞再生、抗氧化及抗衰老作用,可用于各类护肤品的开发,以改善皮肤问题[79−80]。李继城等[81]将胶原蛋白肽与羧甲基壳聚糖复配成润肤霜,测试结果表明,该产品无刺激性、安全无毒,同时还具有抗氧化活性,适用于紫外线中等偏弱的户外活动。此外,含有胶原蛋白肽的面霜、精华液等能提高皮肤角质层的含水量,且锁水效果高于普通保湿剂[82]。尽管胶原蛋白多肽作为化妆品与护肤品的功能性成分,具有独特的优势,但胶原蛋白肽的渗透能力和稳定性,以及在不同类型护肤产品中的最佳使用方法等方面还需进一步研究。
4. 总结与展望
尽管当前胶原蛋白肽的研究取得了一定进展,然而,关于胶原蛋白肽的研究仍存在许多需深入探讨的问题。目前的胶原蛋白肽制备方法主要利用酶解法、物理辅助法及微生物发酵法等。然而,这些方法在提高产率和降低成本方面尚有较大提升空间。为了进一步优化制备过程并保持胶原蛋白肽的生物活性,未来研究可考虑采用一些新的加工技术,如脉冲电场处理等。目前,胶原蛋白肽已被证实具有多种生物活性,但关于其作用机制和影响因素的研究尚不完善。未来研究应进一步揭示胶原蛋白肽与受体之间的相互作用、信号传导途径以及不同来源、分子量和结构的胶原蛋白肽对功能特性的影响,为胶原蛋白肽的应用提供更为精确的理论依据。通过对胶原蛋白肽的持续研究和探索,相信不久的将来,胶原蛋白肽在食品、生物医药、化妆品等领域能够发挥更广泛的作用,为人类健康福祉做出更大贡献。
-
表 1 胶原蛋白肽的制备方法、工艺参数及生物活性
Table 1 Preparation methods, process parameters and biological activity of collagen peptides
原料来源 制备方法 工艺参数 生物活性 参考文献 鲢鱼鱼鳞 酶法(胃蛋白酶) 加酶量16.1%,料液比1:15.6,4.9 h 酪氨酸酶抑制活性 [13] 鱿鱼皮 酶法(中性蛋白酶) 加酶量600 U/g,45 ℃,4 h,pH6.0 − [15] 鳕鱼皮 酶法(胰蛋白酶) 加酶量0.4%,5 h,pH9.0 抗皮肤老化 [16] 黄鳍金枪鱼皮 酶法(碱性蛋白酶) 加酶量0.034 U/g,54.7 ℃,5.2 h,pH8.0 抗氧化活性、抗冻活性 [28] 鱿鱼皮 分步酶法(碱性蛋白酶、木瓜蛋白酶) 底物质量浓度4%,加酶量4000 U/g,先碱性蛋白酶于pH8.0,2 h,50 ℃;后木瓜蛋白酶于pH6.0,3 h,45 ℃ 抗冻活性 [20] 藏羊皮 超声辅助(碱性蛋白酶) 超声处理(150 W,11 min),料液比1:20,加酶量6000 U/g,
40 ℃,4 h,pH9.0抗氧化活性 [23] 牛骨 超声辅助(碱性蛋白酶和风味蛋白酶) 超声处理(400 W,120 min),底物质量浓度4.4%,加酶量6000 U/g 抗氧化活性 [24] 动物软骨 微波辅助 微波处理(200 W,280 s),酶6%,2.26 h,50 ℃,
料液比1:17 mg/mL,底物质量浓度10%,pH7.0− [26] 海地瓜 微波辅助(碱性蛋白酶) 微波处理(300 W,30 min),加酶200 U/mg,45 ℃,1 h,pH10.0 抗氧化活性 [29] 罗非鱼骨 微生物发酵
(枯草芽孢杆菌Bacillus sp. A-5)接种量7.8%,发酵温度36.6 ℃,鱼骨浆添加量13.3%,发酵时间30 h − [30] 鲮鱼皮 微生物发酵(假交替单胞菌Pseudoalteromonas sp. SHK1-2) 接种量2%,发酵温度17 ℃,酶与底物1:10,
酶解温度37 ℃,5 h抗氧化活性 [31] 金枪鱼皮 亚临界水解 反应温度150~300 ℃,压力50~100 bar,反应时间5 min 抗氧化活性 [32] 牛骨 蒸汽爆破 蒸汽压力2 MPa,反应时间30 min − [33] 表 2 胶原蛋白肽的生物活性及相关氨基酸序列
Table 2 Biological activity of collagen peptides and related amino acid sequence
来源 制备方法 生物活性 相关序列 参考文献 牛骨 酶法(碱性蛋白酶) 抗氧化活性 − [38] 安康鱼鱼鳔 酶法(木瓜蛋白酶) 抗氧化活性 YDYD、ARW和DDGGK [39] 鳗鱼皮 酶法(胃蛋白酶、胰蛋白酶) 抗氧化活性 − [40] 可口革囊星虫 酶法(木瓜蛋白酶、中性蛋白酶) 抗氧化活性 AGDDAPRAVF、PSIV、LVAGGL、VVGIVA和GIPGAP [41] 鲍鱼内脏 亚临界水解 抗氧化活性 − [42] 牛皮 超声辅助(木瓜蛋白酶、复合蛋白酶) DPP-IV抑制活性 GPVGPPG [43] 羊皮 酶法(碱性蛋白酶) DPP-IV抑制活性 GPAGPOGFPG [44] 耗牛骨 酶法(碱性蛋白酶、木瓜蛋白酶) ACE抑制活性、抗氧化活性 − [45] 罗非鱼皮 酶法(碱性蛋白酶) ACE抑制活性 − [37] 罗非鱼鳞 酶法(木瓜蛋白酶) 抗氧化活性、抗菌活性 − [46] 金枪鱼皮 亚临界水水解 抗菌活性 − [32] 各种鱼类副产品 酶法(碱性蛋白酶) 抗菌活性 − [47] 猪皮 酶法(碱性蛋白酶) 抗冻活性 GLLGPLGPRGL [48] 罗非鱼皮 酶法(碱性蛋白酶) 抗冻活性 -NHGK [49] 鲑鱼皮 微生物发酵法(弧菌胞外蛋白酶) 抗冻活性、抗氧化活性 PMAGGGGTHT [50] -
[1] DING C, CHENG K, WANG Y, et al. Dual green hemostatic sponges constructed by collagen fibers disintegrated from Halocynthia roretzi by a shortcut method[J]. Materials Today Bio,2024,24:100946. doi: 10.1016/j.mtbio.2024.100946
[2] 王越, 程宽, 易一帆, 等. 真海鞘中胶原的提取及理化性质研究[J]. 食品科技,2023,48(9):210−216. [WANG Y, CHENG K, YI Y F, et al. Extraction and characterization of collagen from Halocynthia Roretzi[J]. Food Science and Technology,2023,48(9):210−216.] WANG Y, CHENG K, YI Y F, et al. Extraction and characterization of collagen from Halocynthia Roretzi[J]. Food Science and Technology, 2023, 48(9): 210−216.
[3] 杨晓东, 张杨, 张寿, 等. 胶原蛋白肽的提取及应用研究进展[J]. 食品工业科技,2022,43(9):469−476. [YANG X D, ZHANG Y, ZHANG S, et al. Research progress in extraction and application of collagen ceptides[J]. Science and Technology of Food Industry,2022,43(9):469−476.] YANG X D, ZHANG Y, ZHANG S, et al. Research progress in extraction and application of collagen ceptides[J]. Science and Technology of Food Industry, 2022, 43(9): 469−476.
[4] INDRIANI S, SAE-LEAW T, BENJAKUL S, et al. Impact of different ultrasound-assisted processes for preparation of collagen hydrolysates from Asian bullfrog skin on characteristics and antioxidative properties[J]. Ultrasonics Sonochemistry,2022,89:106163.
[5] 凌嘉阳, 曾晓房. 畜禽类骨胶原蛋白及其肽的研究进展[J]. 肉类工业,2021(6):51−57. [LING J Y, ZENG X F. Research progress of livestock and poultry bone collagen and its peptides[J]. Meat Industry,2021(6):51−57.] doi: 10.3969/j.issn.1008-5467.2021.06.011 LING J Y, ZENG X F. Research progress of livestock and poultry bone collagen and its peptides[J]. Meat Industry, 2021(6): 51−57. doi: 10.3969/j.issn.1008-5467.2021.06.011
[6] ELANGO J, ROBINSON J, ZHANG J, et al. Collagen peptide upregulates osteoblastogenesis from bone marrow mesenchymal stem cells through MAPK-runx2[J]. Cells,2019,8(5):446. doi: 10.3390/cells8050446
[7] JAZIRI A A, SHAPAWI R, MOHD MOKHTAR R A, et al. Tropical marine fish surimi by-products:Utilisation and potential as functional food application[J]. Food Reviews International,2023,39(6):3455−3480. doi: 10.1080/87559129.2021.2012794
[8] SHENG Y, QIU Y T, WANG Y M, et al. Novel antioxidant collagen peptides of siberian sturgeon (Acipenser baerii) cartilages:The preparation, characterization, and cytoprotection of H2O2-damaged human umbilical vein endothelial cells (huvecs)[J]. Marine Drugs,2022,20(5):325. doi: 10.3390/md20050325
[9] 武亚琪, 琚海燕, 吕永钢. 天然胶原多肽及其护肤功效的研究进展[J]. 生物医学工程学杂志,2022,39(6):1254−1262. [WU Y Q, JU H Y, LÜ Y G. Research progress of natural collagen peptides and its skincare efficacy[J]. Journal of Biomedical Engineering,2022,39(6):1254−1262.] doi: 10.7507/1001-5515.202207009 WU Y Q, JU H Y, LÜ Y G. Research progress of natural collagen peptides and its skincare efficacy[J]. Journal of Biomedical Engineering, 2022, 39(6): 1254−1262. doi: 10.7507/1001-5515.202207009
[10] 高博雅, 李平兰. 微生物发酵技术生产水产胶原蛋白肽的研究进展[J]. 中国酿造,2023,42(3):1−7. [GAO B Y, LI P L. Research progress on the production of aquatic collagen peptides by microbial fermentation technology[J]. China Brewing,2023,42(3):1−7.] GAO B Y, LI P L. Research progress on the production of aquatic collagen peptides by microbial fermentation technology[J]. China Brewing, 2023, 42(3): 1−7.
[11] XIANG Z, XUE Q, GAO P, et al. Antioxidant peptides from edible aquatic animals:Preparation method, mechanism of action, and structure-activity relationships[J]. Food Chemistry,2023,404(Pt B):134701.
[12] 程宽, 易一帆, 王越. 海洋源活性胶原的提取及其应用研究进展[J]. 食品研究与开发,2024,45(16):198−204. [CHEN K, YI Y F, WANG Y. Research progress on the extraction and application of active collagen from marine sources[J]. Food Research and Development,2024,45(16):198−204.] CHEN K, YI Y F, WANG Y. Research progress on the extraction and application of active collagen from marine sources[J]. Food Research and Development, 2024, 45(16): 198−204.
[13] ZU X Y, LI M J, XIONG G Q, et al. Silver carp (Hypophthalmichthys molitrix) scales collagen peptides (scps):Preparation, whitening activity screening and characterization[J]. Foods,2023,12(7):1552. doi: 10.3390/foods12071552
[14] CHEN J, SUN S, LI Y, et al. Proteolysis of tilapia skin collagen:Identification and release behavior of ACE-inhibitory peptides[J]. LWT-Food Science and Technology,2021,139:110502. doi: 10.1016/j.lwt.2020.110502
[15] 张国玉, 俞存兵, 余奕珂, 等. 酶法制备鱿鱼皮胶原蛋白肽工艺[J]. 食品工业,2022,43(11):12−14. [ZHANG G Y, YU C B, YU Y K, et al. Enzymatic preparation of collogen peptide from squid skin[J]. The Food Industry,2022,43(11):12−14.] ZHANG G Y, YU C B, YU Y K, et al. Enzymatic preparation of collogen peptide from squid skin[J]. The Food Industry, 2022, 43(11): 12−14.
[16] 艾丽奇. 鳕鱼皮胶原蛋白肽的抗皮肤光老化功效及其作用机制研究[D]. 广州:华南理工大学, 2020. [AI L Q. Study on protective effect of cod skin collagen peptides against skin photoaging and its action mechanism[D]. Guangzhou:South China University of Technology, 2020.] AI L Q. Study on protective effect of cod skin collagen peptides against skin photoaging and its action mechanism[D]. Guangzhou: South China University of Technology, 2020.
[17] TAGA Y, KUSUBATA M, OGAWA-GOTO K, et al. Collagen-derived X-Hyp-Gly-Type tripeptides promote differentiation of Mc3t3-E1 pre-osteoblasts[J]. Journal of Functional Foods,2018,46:456−462. doi: 10.1016/j.jff.2018.05.017
[18] 孔惠, 邢晓平, 孙安琪, 等. 鲑鱼皮胶原蛋白肽的保湿性研究[J]. 日用化学工业,2017,47(7):389−393. [KONG H, XING X P, SUN A Q, et al. Study on moisturizing efficacy of collagen peptides from salmon skin[J]. China Surfactant Detergent & Cosmetics,2017,47(7):389−393.] KONG H, XING X P, SUN A Q, et al. Study on moisturizing efficacy of collagen peptides from salmon skin[J]. China Surfactant Detergent & Cosmetics, 2017, 47(7): 389−393.
[19] 张崟, 郭思亚, 熊伟, 等. 胶原蛋白酶解制备肽工艺研究进展[J]. 中国调味品,2018,43(2):89−95. [ZHANG Y, GUO S Y, XIONG W, et al. Research progress on preparation progress of peptides from collagen by proteinase hydrolysis[J]. China Flavoring,2018,43(2):89−95.] doi: 10.3969/j.issn.1000-9973.2018.02.020 ZHANG Y, GUO S Y, XIONG W, et al. Research progress on preparation progress of peptides from collagen by proteinase hydrolysis[J]. China Flavoring, 2018, 43(2): 89−95. doi: 10.3969/j.issn.1000-9973.2018.02.020
[20] 蔡金秀, 马佳雯, 何璐瑶, 等. 复合酶法制备鱿鱼皮胶原蛋白抗冻肽的工艺研究[J]. 核农学报,2023,37(4):749−757. [CAI J X, MA J W, HE L Y, et al. Research on preparation technology for collagen antifreeze peptide from squid skin by composite enzymatic hydrolysis[J]. Journal of Nuclear Agricultural Sciences,2023,37(4):749−757.] doi: 10.11869/j.issn.1000-8551.2023.04.0749 CAI J X, MA J W, HE L Y, et al. Research on preparation technology for collagen antifreeze peptide from squid skin by composite enzymatic hydrolysis[J]. Journal of Nuclear Agricultural Sciences, 2023, 37(4): 749−757. doi: 10.11869/j.issn.1000-8551.2023.04.0749
[21] NGO D H, RYU B, VO T S, et al. Free radical scavenging and angiotensin-I converting enzyme inhibitory peptides from pacific cod (Gadus macrocephalus) skin gelatin[J]. International Journal of Biological Macromolecules,2011,49(5):1110−1116. doi: 10.1016/j.ijbiomac.2011.09.009
[22] ZHENG Z, ZHANG M, FAN H, et al. Effect of microwave combined with ultrasonic pretreatment on flavor and antioxidant activity of hydrolysates based on enzymatic hydrolysis of bovine bone[J]. Food Bioscience,2021,44:101399. doi: 10.1016/j.fbio.2021.101399
[23] 牛金鸽, 吴海玥, 马世科, 等. 响应面优化藏羊皮胶原蛋白肽超声辅助提取工艺及其体内抗氧化活性分析[J]. 食品工业科技,2023,44(11):163−170. [NIU J G, WU H Y, MA S K, et al. Optimization of ultrasonic assisted extraction of Tibetan sheep skin collagen peptide by response surface methodology and its antioxidant activity in vivo[J]. Science and Technology of Food Industry,2023,44(11):163−170.] NIU J G, WU H Y, MA S K, et al. Optimization of ultrasonic assisted extraction of Tibetan sheep skin collagen peptide by response surface methodology and its antioxidant activity in vivo[J]. Science and Technology of Food Industry, 2023, 44(11): 163−170.
[24] 郭佳俊, 袁江涛, 刘贵珊. 牛骨胶原蛋白肽的超声辅助提取及抗氧化活性研究[J]. 食品与发酵工业,2023,49(10):185−192. [GUO J J, YUAN J T, LIU G S. Ultrasound-assisted extraction and antioxidant activity of bovine bone collagen peptides[J]. Food and Fermentation Industries,2023,49(10):185−192.] GUO J J, YUAN J T, LIU G S. Ultrasound-assisted extraction and antioxidant activity of bovine bone collagen peptides[J]. Food and Fermentation Industries, 2023, 49(10): 185−192.
[25] 段振华, 孙小苓, 汪菊兰. 微波技术在鱼鳔蛋白提取中的应用[J]. 食品科学,2009,30(16):149−152. [DUAN Z H, SUN X L, WANG J L. Application of microwave technology in protein extraction from swim bladder of silver carp[J]. Food Science,2009,30(16):149−152.] doi: 10.3321/j.issn:1002-6630.2009.16.029 DUAN Z H, SUN X L, WANG J L. Application of microwave technology in protein extraction from swim bladder of silver carp[J]. Food Science, 2009, 30(16): 149−152. doi: 10.3321/j.issn:1002-6630.2009.16.029
[26] 闵瑞. 微波辅助酶解提取硫酸软骨素下脚料中胶原蛋白肽的工艺研究[J]. 粮食与食品工业,2016,23(3):51−54. [MIN R. Study on the effect of microwave assisted enzymatic hydrolysis methods on extracting of collagen peptide from leftovers of chondroitin sulfate[J]. Cereal & Food Industry,2016,23(3):51−54.] doi: 10.3969/j.issn.1672-5026.2016.03.012 MIN R. Study on the effect of microwave assisted enzymatic hydrolysis methods on extracting of collagen peptide from leftovers of chondroitin sulfate[J]. Cereal & Food Industry, 2016, 23(3): 51−54. doi: 10.3969/j.issn.1672-5026.2016.03.012
[27] 王溢, 盛彩虹, 袁宏丽, 等. 微波辅助酶解前处理对鱼鳞胶原蛋白肽粉品质的影响[J]. 食品工业科技,2014,35(20):170−173. [WANG Y, SHENG C H, YUAN H L, et al. Effect of microwave assisted enzymatic hydrolysis methods on the quality of fish scale collagen peptide[J]. Science and Technology of Food Industry,2014,35(20):170−173.] WANG Y, SHENG C H, YUAN H L, et al. Effect of microwave assisted enzymatic hydrolysis methods on the quality of fish scale collagen peptide[J]. Science and Technology of Food Industry, 2014, 35(20): 170−173.
[28] NGUYEN B C, KHA T C, NGUYEN K H N, et al. Optimization of enzymatic hydrolysis of collagen from yellowfin tuna skin (Thunnus albacares) by response surface methodology and properties of hydrolyzed collagen[J]. Journal of Food Processing and Preservation,2021,45(4):e15319.
[29] 李岩. 海地瓜胶原蛋白肽的制备、抗氧化活性评价及作用机制研究 [D]. 舟山:浙江海洋大学, 2021. [LI Y. Preparation of acaudina molpadioides collagen peptide, evaluation of antioxidant activity and mechanism of action[D]. Zhoushan:Zhejiang Ocean University, 2021.] LI Y. Preparation of acaudina molpadioides collagen peptide, evaluation of antioxidant activity and mechanism of action[D]. Zhoushan: Zhejiang Ocean University, 2021.
[30] 韦倩妮. 罗非鱼骨发酵制备胶原蛋白肽工艺的响应面优化[J]. 现代食品,2022,28(21):41−44. [WEI Q N. Response surface optimization of tilapia bone fermentation for preparation of collagen peptides[J]. Modern Food,2022,28(21):41−44.] WEI Q N. Response surface optimization of tilapia bone fermentation for preparation of collagen peptides[J]. Modern Food, 2022, 28(21): 41−44.
[31] 武翠玲, 吴日帮, 刘丹, 等. 鲮鱼皮胶原肽的制备及其抗氧化活性的检测[J]. 生物工程学报,2016,32(12):1727−1734. [WU C L, WU R B, LIU D, et al. Preparation and antioxidant activity detection of collagen peptide from Cirrhinus molitorella skin[J]. Chinese Journal of Biotechnology,2016,32(12):1727−1734.] WU C L, WU R B, LIU D, et al. Preparation and antioxidant activity detection of collagen peptide from Cirrhinus molitorella skin[J]. Chinese Journal of Biotechnology, 2016, 32(12): 1727−1734.
[32] AHMED R, CHUN B S. Subcritical water hydrolysis for the production of bioactive peptides from tuna skin collagen[J]. The Journal of Supercritical Fluids,2018,141:88−96. doi: 10.1016/j.supflu.2018.03.006
[33] ZHANG H, LIU H, QI L, et al. Application of steam explosion treatment on the collagen peptides extraction from cattle bone[J]. Innovative Food Science & Emerging Technologies,2023,85:103336.
[34] ULUG S K, JAHANDIDEH F, WU J. Novel technologies for the production of bioactive peptides[J]. Trends in Food Science & Technology,2021,108:27−39.
[35] POWELL T, BOWRA S, COOPER H J. Subcritical water hydrolysis of peptides:Amino acid side-chain modifications[J]. Journal of the American Society for Mass Spectrometry,2017,28(9):1775−1786. doi: 10.1007/s13361-017-1676-1
[36] FU Y, THERKILDSEN M, ALUKO R E, et al. Exploration of collagen recovered from animal by-products as a precursor of bioactive peptides:Successes and challenges[J]. Critical Reviews in Food Science and Nutrition,2018,59(13):2011−2027.
[37] SUN S, GAO Y, CHEN J, et al. Identification and release kinetics of peptides from tilapia skin collagen during alcalase hydrolysis[J]. Food Chemistry,2022,378:132089. doi: 10.1016/j.foodchem.2022.132089
[38] SONG H, ZHANG S, ZHANG L, et al. Effect of orally administered collagen peptides from bovine bone on skin aging in chronologically aged mice[J]. Nutrients,2017,9(11):1209. doi: 10.3390/nu9111209
[39] SHENG Y, WANG W Y, WU M F, et al. Eighteen novel bioactive peptides from monkfish (Lophius litulon) swim bladders:Production, identification, antioxidant activity, and stability[J]. Marine Drugs,2023,21(3):169. doi: 10.3390/md21030169
[40] 李鹤年, 胡雨嘉, 张弛, 等. 鳗鱼皮胶原蛋白水解物对结肠炎的改善作用[J]. 中国食品学报,2023,23(4):96−105. [LI H N, HU Y J, ZHANG C, et al. The effect of collagen hydrolysate of eel skin on the improvement of colitis[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(4):96−105.] LI H N, HU Y J, ZHANG C, et al. The effect of collagen hydrolysate of eel skin on the improvement of colitis[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(4): 96−105.
[41] 彭易鑫. 可口革囊星虫胶原抗氧化肽的分离鉴定及其细胞抗氧化活性研究[D]. 福州:福建农林大学, 2022. [PENG Y X. Isolation and identification of collagen antioxidant peptide from Phascolosoma esculenta and its antioxidant activity in cells[D]. Fuzhou:Fujian Agriculture and Forestry University, 2022.] PENG Y X. Isolation and identification of collagen antioxidant peptide from Phascolosoma esculenta and its antioxidant activity in cells[D]. Fuzhou: Fujian Agriculture and Forestry University, 2022.
[42] ZHENG P, HAO G, WENG W, et al. Antioxidant activities of hydrolysates from abalone viscera using subcritical water-assisted enzymatic hydrolysis[J]. Food and Bioprocess Technology,2019,12(6):910−918. doi: 10.1007/s11947-019-02270-6
[43] HE L, WANG X, WANG Y, et al. Production and identification of dipeptidyl peptidase IV (DPP-IV) inhibitory peptides from discarded cowhide collagen[J]. Food Chemistry,2023,405(Pt A):134793.
[44] WANG B, YU Z, YOKOYAMA W, et al. Collagen peptides with DPP-IV inhibitory activity from sheep skin and their stability to in vitro gastrointestinal digestion[J]. Food Bioscience,2021,42:101161. doi: 10.1016/j.fbio.2021.101161
[45] 于小栋. 牦牛骨胶原蛋白肽的制备及其功能特性研究[D]. 西宁:青海师范大学, 2019. [YU X D. Preparation and functional properties of yakbone collagen peptide[D]. Xining:Qinghai Normal University, 2019.] YU X D. Preparation and functional properties of yakbone collagen peptide[D]. Xining: Qinghai Normal University, 2019.
[46] HERNÁNDEZ-RUIZ K L, LÓPEZ-CERVANTES J, SÁNCHEZ-MACHADO D I, et al. Collagen peptide fractions from tilapia (Oreochromis aureus Steindachner, 1864) scales:Chemical characterization and biological activity[J]. Food Bioscience,2023,53:102658. doi: 10.1016/j.fbio.2023.102658
[47] ZAMORANO-APODACA J C, GARCÍA-SIFUENTES C O, CARVAJAL-MILLÁN E, et al. Biological and functional properties of peptide fractions obtained from collagen hydrolysate derived from mixed by-products of different fish species[J]. Food Chemistry,2020,331:127350. doi: 10.1016/j.foodchem.2020.127350
[48] CAO H, ZHAO Y, ZHU Y B, et al. Antifreeze and cryoprotective activities of ice-binding collagen peptides from pig skin[J]. Food Chemistry,2016,194:1245−1253. doi: 10.1016/j.foodchem.2015.08.102
[49] CAO L, MAJURA J J, LIU L, et al. The cryoprotective activity of tilapia skin collagen hydrolysate and the structure elucidation of its antifreeze peptide[J]. LWT-Food Science and Technology,2023,179:114670. doi: 10.1016/j.lwt.2023.114670
[50] WU R, WU C, LIU D, et al. Antioxidant and anti-freezing peptides from salmon collagen hydrolysate prepared by bacterial extracellular protease[J]. Food Chemistry,2018,248:346−352. doi: 10.1016/j.foodchem.2017.12.035
[51] 马慧. 墨鱼皮胶原蛋白水解物的制备及性能研究[D]. 北京:北京化工大学, 2018. [MA H. Preparation and properties of the collagen hydrolysate from cuttlefish skin[D]. Beijing:Beijing University of Chemical Technology, 2018.] MA H. Preparation and properties of the collagen hydrolysate from cuttlefish skin[D]. Beijing: Beijing University of Chemical Technology, 2018.
[52] DING D, DU B, ZHANG C, et al. Isolation and identification of an antioxidant collagen peptide from skipjack tuna (Katsuwonus pelamis) bone[J]. RSC Advances,2019,9(46):27032−27041. doi: 10.1039/C9RA04665H
[53] GONZALEZ-SERRANO D J, HADIDI M, VARCHEH M, et al. Bioactive peptide fractions from collagen hydrolysate of common carp fish byproduct:Antioxidant and functional properties[J]. Antioxidants (Basel),2022,11(3):509. doi: 10.3390/antiox11030509
[54] XIE Z, WANG X, YU S, et al. Antioxidant and functional properties of cowhide collagen peptides[J]. J Food Sci,2021,86(5):1802−1818. doi: 10.1111/1750-3841.15666
[55] 于平, 易明花, 黄星星, 等. 东海海参胶原蛋白酶解物的制备与抗氧化活性及其对神经细胞损伤的保护作用[J]. 中国食品学报,2018,18(12):89−98. [YU P, YI M H, HUANG X X, et al. Preparation of acaudina molpadioides collagen hydrolysates and their antioxidant activity and protective effect on injured nerve cells[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(12):89−98.] YU P, YI M H, HUANG X X, et al. Preparation of acaudina molpadioides collagen hydrolysates and their antioxidant activity and protective effect on injured nerve cells[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(12): 89−98.
[56] WEI D, ZHANG X. Biosynthesis, bioactivity, biotoxicity and applications of antimicrobial peptides for human health[J]. Biosafety and Health,2022,4(2):118−134. doi: 10.1016/j.bsheal.2022.02.003
[57] XU S, ZHAO Y, SONG W, et al. Improving the sustainability of processing by-products:Extraction and recent biological activities of collagen peptides[J]. Foods,2023,12(10):1965. doi: 10.3390/foods12101965
[58] ENNAAS N, HAMMAMI R, GOMAA A, et al. Collagencin, an antibacterial peptide from fish collagen:Activity, structure and interaction dynamics with membrane[J]. Biochemical and Biophysical Research Communications,2016,473(2):642−647. doi: 10.1016/j.bbrc.2016.03.121
[59] WALD M, SCHWARZ K, REHBEIN H, et al. Detection of antibacterial activity of an enzymatic hydrolysate generated by processing rainbow trout by-products with trout pepsin[J]. Food Chemistry,2016,205:221−228. doi: 10.1016/j.foodchem.2016.03.002
[60] TKACZEWSKA J. Peptides and protein hydrolysates as food preservatives and bioactive components of edible films and coatings-a review[J]. Trends in Food Science & Technology,2020,106:298−311.
[61] DEVRIES A L, WOHLSCHLAG D E. Freezing resistance in some antarctic fishes[J]. Science,1969,163(3871):1073−1075. doi: 10.1126/science.163.3871.1073
[62] 董世荣, 徐微, 李欣, 等. 胶原蛋白肽对凝固型酸奶品质的影响[J]. 食品工业科技,2020,41(16):1−6. [DONG S R, XU W, LI X, et al. Effect of collagen peptide on the quality of set-style yoghurt[J]. Science and Technology of Food Industry,2020,41(16):1−6.] DONG S R, XU W, LI X, et al. Effect of collagen peptide on the quality of set-style yoghurt[J]. Science and Technology of Food Industry, 2020, 41(16): 1−6.
[63] 邵燕秋, 黄卉, 李来好, 等. 鳗鱼骨胶原蛋白ACE抑制肽的制备及性质研究[J]. 南方水产科学,2022,18(6):137−145. [SHAO Y Q, HUANG H, LI L H, et al. Preparation and properties of collagen ACE inhibitory peptides from bone of eel (Anguilla japonica)[J]. South China Fisheries Science,2022,18(6):137−145.] doi: 10.12131/20210358 SHAO Y Q, HUANG H, LI L H, et al. Preparation and properties of collagen ACE inhibitory peptides from bone of eel (Anguilla japonica)[J]. South China Fisheries Science, 2022, 18(6): 137−145. doi: 10.12131/20210358
[64] 李玉芬, 郑明星, 叶秀云, 等. 海蜇胶原蛋白肽的生物活性研究[J]. 食品工业科技,2018,39(8):67−72,84. [LI Y F, ZHEN M X, YE X Y, et al. The bioactive of collagen peptides from jellyfish[J]. Science and Technology of Food Industry,2018,39(8):67−72,84.] LI Y F, ZHEN M X, YE X Y, et al. The bioactive of collagen peptides from jellyfish[J]. Science and Technology of Food Industry, 2018, 39(8): 67−72,84.
[65] 尹剑, 武瑞赟, 胡锦蓉, 等. 鲟鱼皮中二肽基肽酶-Ⅳ抑制肽的分离纯化与鉴定[J]. 食品科学,2022,43(6):195−203. [YIN J, WU R Y, HU J R, et al. Puriflcation and identiflcation of dipeptidyl peptidase IV inhibitory peptide from sturgeon skin collagen[J]. Food Science,2022,43(6):195−203.] doi: 10.7506/spkx1002-6630-20210131-374 YIN J, WU R Y, HU J R, et al. Puriflcation and identiflcation of dipeptidyl peptidase IV inhibitory peptide from sturgeon skin collagen[J]. Food Science, 2022, 43(6): 195−203. doi: 10.7506/spkx1002-6630-20210131-374
[66] LIU H, LI B. Separation and identification of collagen peptides derived from enzymatic hydrolysate of Salmo salar skin and their anti-inflammatory activity in lipopolysaccharide (LPS)-induced RAW264.7 inflammatory model[J]. Journal of Food Biochemistry,2022,46(7):e14122.
[67] MIRZAPOUR-KOUHDASHT A, MOOSAVI-NASAB M, KRISHNASWAMY K, et al. Optimization of gelatin production from barred mackerel by-products:Characterization and hydrolysis using native and commercial proteases[J]. Food Hydrocolloids,2020,108:105970. doi: 10.1016/j.foodhyd.2020.105970
[68] NAJAFIAN L, BABJI A S. A review of fish-derived antioxidant and antimicrobial peptides:Their production, assessment, and applications[J]. Peptides,2012,33(1):178−185. doi: 10.1016/j.peptides.2011.11.013
[69] PALAMUTOĞLU R, KASNAK C. Effect of fish collagen hydrolysate addition to meatballs[J]. Mugla Journal of Science and Technology,2019,5(2):56−61. doi: 10.22531/muglajsci.576757
[70] KUMAR A, ELAVARASAN K, HANJABAM M D, et al. Marine collagen peptide as a fortificant for biscuit:Effects on biscuit attributes[J]. LWT-Food Science and Technology,2019,109:450−456. doi: 10.1016/j.lwt.2019.04.052
[71] CUI P, SHAO T, LIU W, et al. Advanced review on type Ⅱ collagen and peptide:Preparation, functional activities and food industry application[J]. Critical Reviews in Food Science and Nutrition,2023,39(6):3455−3480.
[72] JHAWAR N, WANG J V, SAEDI N. Oral collagen supplementation for skin aging:A fad or the future?[J]. Journal of Cosmetic Dermatology,2020,19(4):910−912. doi: 10.1111/jocd.13096
[73] PAUL C, LESER S, OESSER S. Significant amounts of functional collagen peptides can be incorporated in the diet while maintaining indispensable amino acid balance[J]. Nutrients,2019,11(5):1079.
[74] SONG H, YANG Y, LI B. Tripeptide Hyp-Asp-Gly from collagen peptides inhibited platelet activation via regulation of Pi3k/Akt-Mapk/Erk1/2 signaling pathway[J]. Journal of Food Science,2022,87(7):3279−3293. doi: 10.1111/1750-3841.16215
[75] SONG H, ZHANG L, LUO Y, et al. Effects of collagen peptides intake on skin ageing and platelet release in chronologically aged mice revealed by cytokine array analysis[J]. Journal of Cellular and Molecular Medicine,2018,22(1):277−288. doi: 10.1111/jcmm.13317
[76] SONG H, ZHANG S, ZHANG L, et al. Ingestion of collagen peptides prevents bone loss and improves bone microarchitecture in chronologically aged mice[J]. Journal of Functional Foods,2019,52:1−7. doi: 10.1016/j.jff.2018.10.026
[77] CHOTPHRUETHIPONG L, SUKKETSIRI W, ALUKO R E, et al. Effect of hydrolyzed collagen from defatted Asian sea bass (Lates calcarifer) skin on fibroblast proliferation, migration and antioxidant activities[J]. Journal of Food Science and Technology,2021,58(2):541−551. doi: 10.1007/s13197-020-04566-4
[78] ZHU Y, ZHANG R, WEI Y, et al. Rice peptide and collagen peptide prevented potassium oxonate-induced hyperuricemia and renal damage[J]. Food Bioscience,2021,42:101147. doi: 10.1016/j.fbio.2021.101147
[79] BOLKE L, SCHLIPPE G, GERSS J, et al. A collagen supplement improves skin hydration, elasticity, roughness, and density:Results of a randomized, placebo-controlled, blind study.[J]. Nutrients,2019,11(10):2494. doi: 10.3390/nu11102494
[80] ITO N, SEKI S, UEDA F. Effects of composite supplement containing collagen peptide and ornithine on skin conditions and plasma Igf-1 levels—a randomized, double-blind, placebo-controlled trial[J]. Marine Drugs,2018,16(12):482. doi: 10.3390/md16120482
[81] 李继城, 孔松芝, 李东东, 等. 罗非鱼皮胶原蛋白肽在润肤霜中的应用及性能评价[J]. 食品工业科技,2018,39(5):23−29. [LI J C, KONG S Z, LI D D, et al. Application and properties of collagen peptide from tilapia skinin moisturizing cream[J]. Science and Technology of Food Industry,2018,39(5):23−29.] LI J C, KONG S Z, LI D D, et al. Application and properties of collagen peptide from tilapia skinin moisturizing cream[J]. Science and Technology of Food Industry, 2018, 39(5): 23−29.
[82] LEDWOŃ P, ERRANTE F, PAPINI A M, et al. Peptides as active ingredients:A challenge for cosmeceutical industry[J]. Chemistry & Biodiversity,2021,18(2):e2000833.





 下载:
下载:
 下载:
下载:
