In Vitro Digestion Properties of Tea Polyphenol Fish Sausage and Its Immunomodulatory Effect in Mice
-
摘要: 为探究茶多酚鱼肉香肠体外消化特性,对不同消化时间的食糜进行蛋白质的消化率、粒径大小、游离氨基酸含量、硫代巴比妥酸值和DPPH自由基清除率的研究,并且建立模型与分组进行小鼠免疫调节实验。结果表明,添加0.2%的茶多酚后,茶多酚鱼肉香肠蛋白质的消化率降低,当消化时间为120 min时,对照组和茶多酚组蛋白体外消化率最大值分别为54%和48%。茶多酚组游离氨基酸含量、硫代巴比妥酸值均低于对照组,而粒径和DPPH自由基清除率与对照组相比显著提高(P<0.05)。与模型组相比,喂养茶多酚鱼肉香肠的小鼠脾脏指数、血清中免疫球蛋白IgA和IgG浓度、血清中炎症细胞因子IL-1β、IL-6、TNF-α浓度和肾脏中CAT、T-AOC、GSH-Px和SOD活性均显著升高(P<0.05),MDA含量极显著下降(P<0.01)。鱼肉香肠当中的蛋白质与茶多酚通过相互作用影响蛋白质的消化,同时茶多酚鱼肉香肠能够促进免疫抑制小鼠的免疫调节作用。本研究能更好地了解多酚对蛋白质类食品的影响,以及为新型功能性鱼糜制品的开发提供理论依据。Abstract: In order to investigate the in vitro digestive properties of tea polyphenol fish sausage, protein digestibility, particle size, free amino acid content, thiobarbituric acid value and DPPH radical scavenging rate of surimi with different digestion time were studied, and a model was set up with grouping of mice for immunomodulation experiments. The results showed that the addition of 0.2% of tea polyphenols decreased the digestibility of tea polyphenol fish sausage proteins. When the digestion time was 120 min, the maximum in vitro digestibility of proteins of the control group and tea polyphenol group were 54% and 48%, respectively. The free amino acid content and thiobarbituric acid value of the tea polyphenol group were lower than control group, where the particle size and DPPH radical scavenging rate were significantly higher (P<0.05) than control group. Spleen index, serum immunoglobulin IgA and IgG concentrations, serum inflammatory cytokine IL-1β, IL-6, and TNF-α concentrations, and renal CAT, T-AOC, GSH-Px, and SOD activities were significantly higher (P<0.05) and MDA content was extremely significant lower (P<0.01) in mice fed tea polyphenol fish sausage as compared to the model group. Proteins in fish sausage and tea polyphenols affect protein digestion through interaction, while tea polyphenol fish sausage promotes immunomodulation in immunosuppressed mice. The study provides a better understanding of the effects of polyphenols on protein-based foods and provides a theoretical basis for the development of novel functional surimi products.
-
Keywords:
- tea polyphenols /
- fish sausage /
- in vitro digestion /
- immune regulation
-
鱼肉香肠是常见的鱼糜制品之一,食用方便且营养丰富。漂洗是传统鱼糜制作的工艺之一,鱼糜经漂洗后可以提高鱼糜制品的品质。但漂洗过程中会导致蛋白质、脂肪等营养物质大量流失,降低鱼糜制品的营养价值[1]。未漂洗鱼糜的生产虽解决了上述工艺中存在的问题,但其加工以及贮运过程中易发生脂肪氧化酸败以及蛋白腐败变性等问题,导致鱼糜制品风味品质降低。因此通常选择在鱼糜制品或鱼糜中添加保鲜剂改善品质。近年来,壳聚糖、植物精油和多酚类物质等作为水产保鲜剂已成为研究热点[2]。茶多酚(Tea polyphenols,TP)是一种天然的抗氧化剂,具有多种生物功能,如抗氧化、抗辐射、抗菌、抗肿瘤和抗血栓形成等[3]。茶多酚在水产品当中应用较为广泛,如茶多酚常与低温技术或其他生物保鲜剂复配使用,以抑制水产品微生物的生长,提升贮藏品质,延长货架期[4]。Wu等[5]发现,在罗非鱼鱼糜中添加TP可显著抑制罗非鱼鱼糜中蛋白质的氧化、聚合和降解,并且对其产品持水性和硬度的改善贡献最大。Li等[6]研究了不同浓度TP对肌原纤维蛋白的氧化修饰以及凝胶特性的影响,发现TP可有效地保护肌原纤维蛋白免受氧化并在加工过程中增强鱼糜的凝胶能力。
将酚类物质作为功能因子用于鱼糜制品品质改善,其主要功能性通过两个方面来体现,一方面是抑制鱼糜制品脂质和蛋白质的氧化,另一方面是提高营养健康价值。蛋白质结构以及功能属性会极大影响鱼糜或鱼糜制品营养价值[7]。茶多酚可以和食物中的许多蛋白相互作用,这种相互作用主要包括共价键和非共价键[8]。茶多酚和蛋白质之间的共价键被认为是不可逆的,并导致新的多酚-蛋白质化合物的产生[9]。非共价结合可能包括多酚和蛋白质之间的疏水相互作用、氢键结合和离子键结合,进而影响食品的理化特性以及消化特性[10]。茶多酚鱼肉香肠含有丰富的营养物质,其中蛋白质作为一种重要的食物补充剂,可以有效地缓解免疫抑制[11]。目前,未见有关茶多酚应用于鱼糜制品消化特性变化规律的报道,并且以往的研究大多集中于单一的茶多酚如何减轻小鼠免疫抑制作用,关于茶多酚与鱼糜复合对小鼠免疫调节作用机制尚不清楚。因此,本研究尝试构建一个体外消化模型以及小鼠免疫抑制实验模型,旨在探究茶多酚鱼肉香肠的体外消化特性以及对小鼠免疫调节作用。
1. 材料与方法
1.1 材料与仪器
SPF级小鼠雄性小鼠 32只,5~6周龄,体重16~20 g,实验动物许可证编号为SCXK(浙)2019-0031,浙江省医学科学院,所有实验程序均按照浙江省医学科学院伦理委员会要求进行;冰鲜金线鱼 体重0.5~1 kg,体长10~15 cm,锦州海英水产海鲜店;茶多酚(纯度>98%) 江苏德和生物科技有限公司;山梨糖醇 石家庄瑞雪制药有限公司;蔗糖 广西来宾东糖凤凰有限公司;食盐 大连盐化集团有限公司;尼罗蓝、α-淀粉酶、三氯乙酸 均为分析纯,上海阿拉丁试剂公司;胃蛋白酶(≥2500 U/mg)、胰酶(≥1000 U/mg) 均为分析纯,上海Sigma-Aldrich贸易有限公司;胆盐 分析纯,京沃凯生物科技有限公司;氯化亚铁 分析纯,上海萨恩化学技术有限公司;无水乙醇、2-硫代巴比妥酸、乙二胺四乙酸二钠 均为分析纯,天津市风船化学试剂科技有限公司;环磷酰胺(CTX) 分析纯,恒瑞药业有限公司;丙二醛(MDA)试剂盒 南京建成生物工程研究所;谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、免疫球蛋白IgA、IgM、IgG试剂盒 南京建成生物工程公司;肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、干扰素-γ(IFN-γ)试剂盒 Solarbio公司。
YC200采肉机、XJT-JL200精滤机 诸城市凯成良才食品机械厂;UMC5真空斩拌机 德国Stephan公司;HH-4数显恒温水浴锅 常州国华电器有限公司;DIVHS-I动态人胃模拟消化系统 苏州晓东宜健仪器设备有限公司;FOSS 8400全自动凯氏定氮仪 瑞典FOSS公司;NanoBrook 90 Plus激光粒度仪 美国布鲁克海文仪器公司;FreeZone2.5真空冷冻干燥机 美国Labconco公司;UV-2550紫外可见光分光光度计 苏州岛津仪器有限公司。
1.2 实验方法
1.2.1 鱼肉香肠制备
冷冻鱼糜制备:冰鲜金线鱼→去鳞→去头→去内脏→分割→清洗→采肉→添加抗冻剂(4%山梨糖醇、4%蔗糖)真空包装→−78 ℃冰箱贮藏备用。
冷冻未漂洗金线鱼鱼糜解冻后,切成小块置于真空斩拌机,常压状态下空斩2 min,而后加入2.5%食盐,进行盐斩2 min,最后将0.2%的茶多酚与冰水(调节水分含量至78%)搅匀后加入真空斩拌机,调节真空斩拌机真空度为−0.6 Pa,混合斩拌3 min,整个斩拌过程温度控制在10 ℃以下。斩拌完成后,装袋灌肠。而后进行二段式加热(40 ℃,30 min;90 ℃,20 min)熟化。熟化后冷却,置于4 ℃冰箱备用。
对照组:除不添加茶多酚外,其他原辅料及制作工艺均与上述相同。
1.2.2 体外消化实验
1.2.2.1 体外仿生动态人胃模拟消化
参考Minekus等[12]方法进行体外胃肠道消化模型实验。按照表1分别配制唾液模拟液(SSF)、胃液模拟液(SGF)及肠液模拟液(SIF)的原液。取48 mL唾液模拟液电解质溶液添加300 μL CaCl2、11.7 mL去离子水以及152.8 mg α-淀粉酶(α-淀粉酶在唾液模拟液中的最终浓度为150 U/mL),调节pH至7。取168 mL胃液模拟液电解质溶液添加105 μL CaCl2、41.225 mL去离子水、1292.34 mg胃蛋白酶(胃蛋白酶在胃液模拟液中的最终浓度为4000 U/mL),调节pH至1.6。取280 mL肠液模拟液电解质溶液添加600 μL CaCl2、69.3 mL去离子水以及1090.3 mg胰酶(胰酶在肠液模拟液中的最终浓度为200 U/mL、胆盐20 mmol/L),调节pH至7。
表 1 模拟消化液原液制备Table 1. Preparation of stock solutions of simulated digestion fluids成分 SSF(mmol/L) SGF(mmol/L) SIF(mmol/L) KCl 15.10 6.90 6.80 KH2PO4 3.70 0.90 0.80 NaHCO3 13.60 25.00 85.00 NaCl − 47.20 38.40 MgCl2(H2O)6 0.15 0.10 0.33 (NH4)2CO3 0.06 0.50 − 将210 g鱼肠样品放入食品料理机中,在8档搅拌30 s。而后在200 g搅碎的样品加入80 mL唾液模拟液,混合均匀后放入DIVHS-I体外仿生动态人胃模拟消化系统中的胃模型内,进行2 h胃肠连续消化。消化30、60、90、120 min时分别收集胃十二指肠排出物,在4 ℃、8000×g下离心15 min,分离沉淀和上清液,消化结束后,收集所有的消化样品,−20 ℃冰箱保存。
1.2.2.2 蛋白体外消化率测定
蛋白体外消化率测定参考GB 5009.5-2016 《食品安全国家标准 食品中蛋白质的测定》[13]。
1.2.2.3 粒径测定
取消化后的样品上清液1 mL放入50 mL离心管中,用蒸馏水稀释20倍后混匀,采用Nano-ZS90激光粒度仪测定消化后的样品上清液中蛋白质的平均粒径,测定温度为25 ℃,平衡时间为1 min,每组设6个平行。
1.2.2.4 游离氨基酸分析
消化120 min后进行游离氨基酸的测定。方法参考GB 5009.124-2016 《食品安全国家标准 食品中氨基酸的测定》[14]。
1.2.2.5 硫代巴比妥酸值测定
参考Grotto等[15]的方法稍作修改,取消化后的样液3 mL,加入9 mL混合液(7.5%三氯乙酸、0.1%乙二胺四乙酸二钠),混合均匀,静置过滤后取其上清液备用。将上清液与0.02 mol/L的硫代巴比妥酸溶液等比例混合于离心管中,摇匀后在90 ℃水浴锅中反应40 min。冷却后,在紫外可见光分光光度计532 nm处测定样品吸光值。结果以每千克样品中MDA的毫克数表示,记为mg MDA/kg。
1.2.2.6 DPPH自由基清除率测定
参考李诺等[16]的方法稍作修改,取2 mL的样品待测液与2 mL浓度为0.1 mmol/L的DPPH-乙醇溶液混合,室温下避光反应30 min,在517 nm处测定吸光值。按照下列公式计算DPPH自由基清除率。
DPPH自由基清除率(%)=(1−A1−A2A0)×100 式中:A1为样品与DPPH-乙醇溶液吸光值;A2为样品与乙醇吸光值;A0为DPPH-乙醇溶液吸光值。
1.2.3 小鼠免疫调节实验
1.2.3.1 鱼肉香肠冻干粉的制备
从4 ℃冰箱取出方法1.2.1制备的鱼肉香肠,放入绞肉机中制成糜状,取出均匀涂抹到平板中,厚度约为5 mm,预冻后再用真空冷冻干燥机冻干48 h后取出,研磨成粉,取400 mg与鼠粮一起压片备用。
1.2.3.2 模型建立与分组
参考Yu等[17]方法并稍作修改,将实验前预先喂养7 d的32只SPF级小鼠随机分成4组,每组8只。正常组腹腔注射等量生理盐水1 mL,其余3组分别用CTX 80 mg/kg连续5 d腹腔注射1 mL建立小鼠免疫抑制实验模型。建模成功后,设置4组实验(正常组:正常小鼠,喂食常规鼠粮,以下简称Normal组;模型组:免疫抑制小鼠,喂食常规鼠粮,以下简称Model组;TP(粉末)组:免疫抑制小鼠,喂食由1.50 mg TP粉末与常规鼠粮混匀后压制成片状的含TP的鼠粮,以下简称TP组;鱼肉香肠样品(含TP)组:免疫抑制小鼠,喂食由400 mg经冷冻干燥研磨成粉状的鱼肉香肠样品与常规鼠粮混匀后压制成片状的含鱼肉香肠的鼠粮,以下简称A+TP组),实验期间各组小鼠自由饮水和采食。第28 d喂食24 h后,处死小鼠进行各项指标的测定。
1.2.3.3 脾脏、胸腺指数的测定
第28 d喂食24 h后,精确称量小鼠的体重,处死小鼠,取胸腺和脾脏并称重,计算脏器指数。
1.2.3.4 血清TNF-α、IL-β、IL-6、IFN-γ、IgA、IgM、IgG含量的测定
第28 d喂食24 h后,处死小鼠,摘眼球取血,8000 r/min离心15 min取上清液,按照试剂盒说明书要求操作,测定小鼠血清中TNF-α、IL-β、IL-6、IFN-γ、IgA、IgM、IgG的含量。
1.2.3.5 抗氧化酶测定
小鼠在第28 d喂食实验结束后,处死并取出肾脏,用生理盐水漂洗后称重,制成10%肾脏的匀浆液,根据试剂盒操作要求,测定超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-Px)活性、过氧化氢酶(CAT)活性、MDA含量和总抗氧化能力(T-AOC)。
1.3 数据处理
所有实验重复3次,结果以平均值±标准偏差表示。采用SPSS软件对数据进行Duncan’s法显著性分析;采用Origin 2018软件绘图。
2. 结果与分析
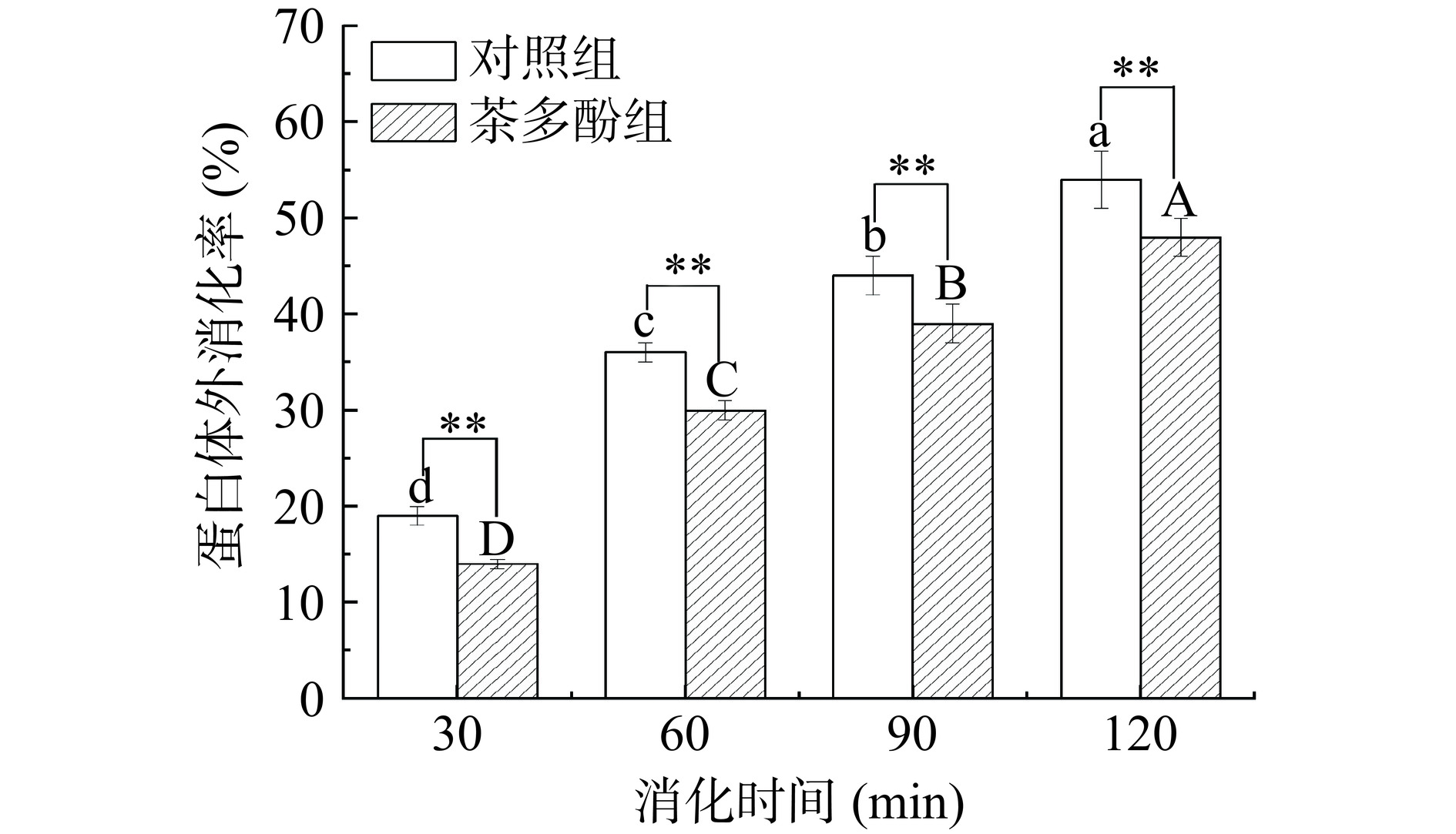
2.1 茶多酚对鱼肉香肠蛋白消化率的影响
消化率是蛋白质在消化过程中被分解的指标之一,同时也是评价食物营养价值的重要指标[18]。由图1可知,随着消化时间的增加,对照组和茶多酚组的蛋白体外消化率逐渐增大。当消化时间为120 min时,对照组和茶多酚组蛋白体外消化率可达到最大值分别为54%和48%,并且对照组的蛋白体外消化率均极显著高于茶多酚组(P<0.01)。这可能是由于茶多酚与蛋白质相互作用的高亲和力,多酚可抑制消化酶活性[19−20]。此外,茶多酚可以诱导鱼糜当中肌原纤维蛋白结构改变,使肌原纤维蛋白的β-折叠增加,其中β-折叠含量和蛋白质的体外消化率呈负相关[21]。
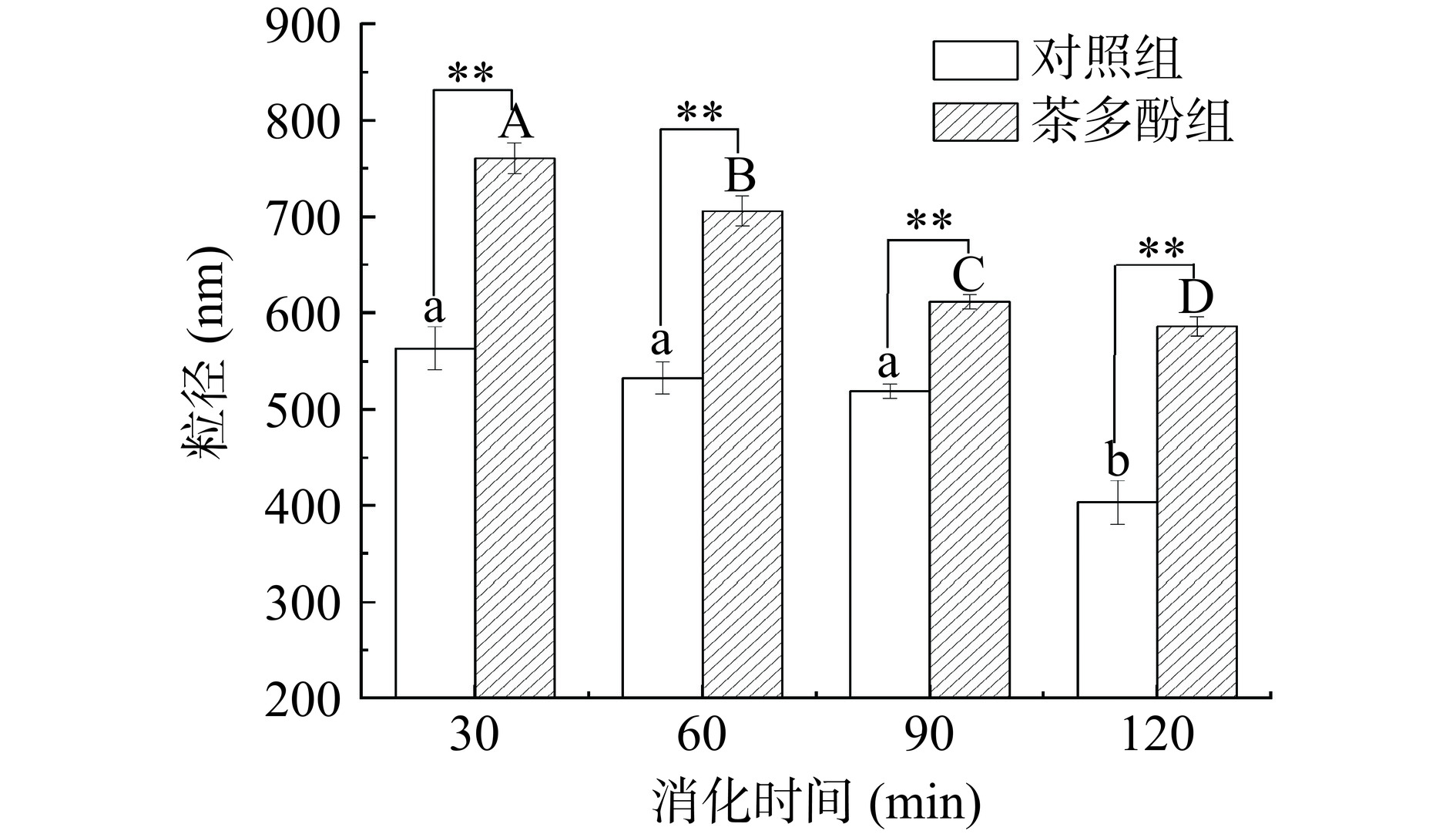
2.2 茶多酚对鱼肉香肠消化后粒径的影响
粒径大小分析是衡量消化产物的重要理化指标之一。由图2可知,不同消化时间对茶多酚组粒径具有显著性影响(P<0.05)。随着消化时间的增加,对照组和茶多酚组粒径呈下降趋势。在不同消化时间茶多酚组的平均粒径均极显著大于对照组(P<0.01),这是因为蛋白质-多酚复合物聚集的形成,阻碍了蛋白质的水解[22−23]。在消化120 min后,茶多酚组与对照组相比仍有较大的粒径,这可能是因为茶多酚会促进水解肽聚集,从而再次形成大颗粒[24]。
2.3 茶多酚对鱼肉香肠消化后游离氨基酸的影响
表2反映的是茶多酚对鱼肉香肠模拟体外消化后游离氨基酸的影响。结果表明,茶多酚降低了鱼肉香肠在消化过程中蛋白质的水解。对照组中检测到14种游离氨基酸,添加茶多酚的鱼肉香肠检测到12种游离氨基酸,消化后样品中均检测到6种人体必需氨基酸。在茶多酚组中并未检测到胱氨酸和酪氨酸,并且其他多种氨基酸含量也降低,说明添加茶多酚可以降低消化液中氨基酸的含量。这可能是因为茶多酚易被氧化成为醌类而提供质子H+,而醌类物质可以与蛋白质肽链的末端氨基、半胱氨酸、赖氨酸、色氨酸以及组氨酸等共价交联,形成具有C-N和C-S键的高度稳定的茶多酚-蛋白质复合物,进而降低蛋白质的水解[25−26]。
表 2 茶多酚鱼肉香肠体外消化120 min后游离氨基酸含量Table 2. Free amino acid content of TP fish sausage after 120 min in vitro digestion氨基酸 对照组(mg/g) 茶多酚处理组(mg/g) 天冬氨酸(Asp) 2.90±0.07 1.00±0.08 苏氨酸*(Thr) 8.10±0.22 1.80±0.09 丝氨酸(Ser) 3.70±0.19 1.50±0.08 谷氨酸(Glu) 18.00±0.34 6.90±0.24 甘氨酸(Gly) 4.30±0.15 1.80±0.06 丙氨酸(Ala) 15.00±0.44 5.20±0.10 胱氨酸(Cys) 0.94±0.05 − 缬氨酸*(Val) 16.00±0.46 6.10±0.12 异亮氨酸*(IIe) 10.00±0.31 3.10±0.09 亮氨酸*(Leu) 30.00±0.62 12.00±0.23 酪氨酸(Tyr) 8.80±0.35 − 苯丙氨酸*(Phe) 21.00±0.48 8.80±0.27 赖氨酸*(Lys) 42.00±0.68 18.00±0.56 精氨酸(Arg) 30.00±0.34 11.00±0.18 注:*表示人体必需氨基酸;−表示未检测出。 2.4 茶多酚对鱼肉香肠消化后硫代巴比妥酸值的影响
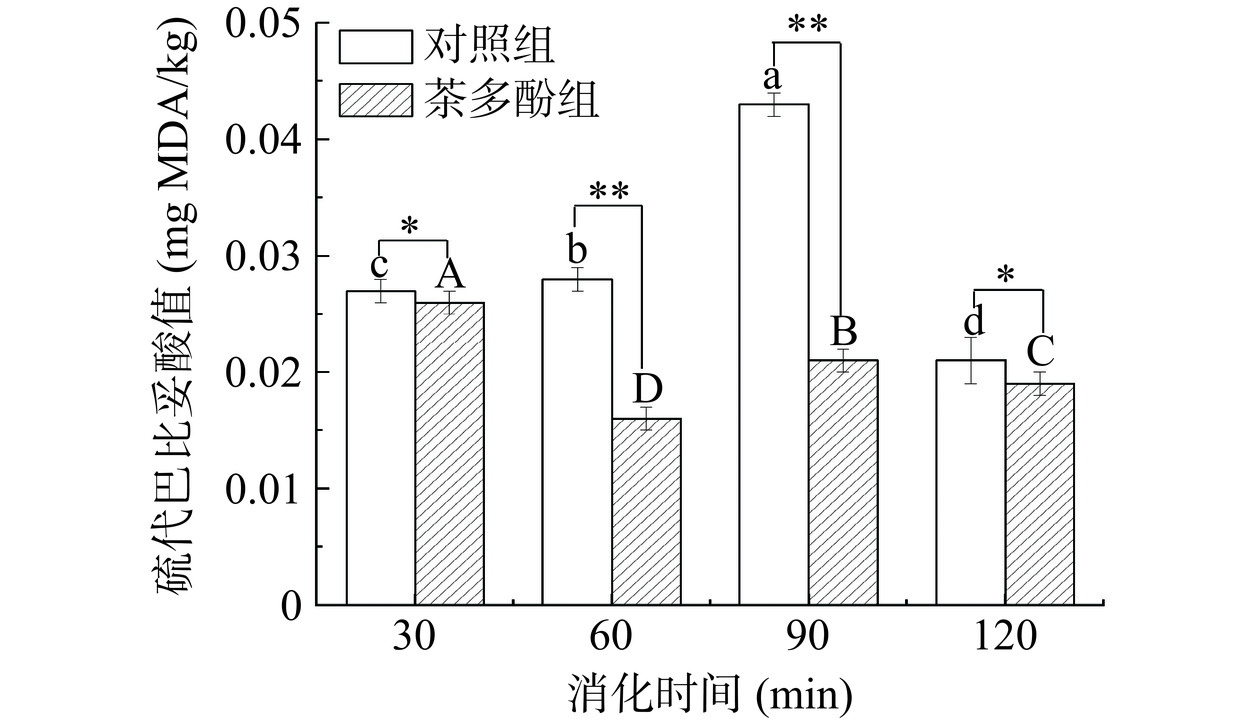
图3反映的是茶多酚对鱼肉香肠模拟体外消化后硫代巴比妥酸值的影响。由图3中硫代巴比妥酸值可知,茶多酚组的硫代巴比妥酸值均显著低于对照组(P<0.05),这是因为茶多酚增强胰脂肪酶对脂肪的抑制作用[27]。茶多酚具有较强的供氢能力,可与脂质氧化物自由基结合,中断脂肪的自由基链式反应,从而降低MDA含量[28]。添加茶多酚的鱼肉香肠当消化时间达到60 min时,与对照组相比硫代巴比妥酸值极显著下降(P<0.01),这可能归因于MDA可与鱼肉中的氨基相互作用生成l-氨基-3-氨基丙烯[29]。Lian等[30]研究也表明茶多酚通过中断脂质二次氧化产物MDA与蛋白质的共价结合来抑制脂肪氧化。
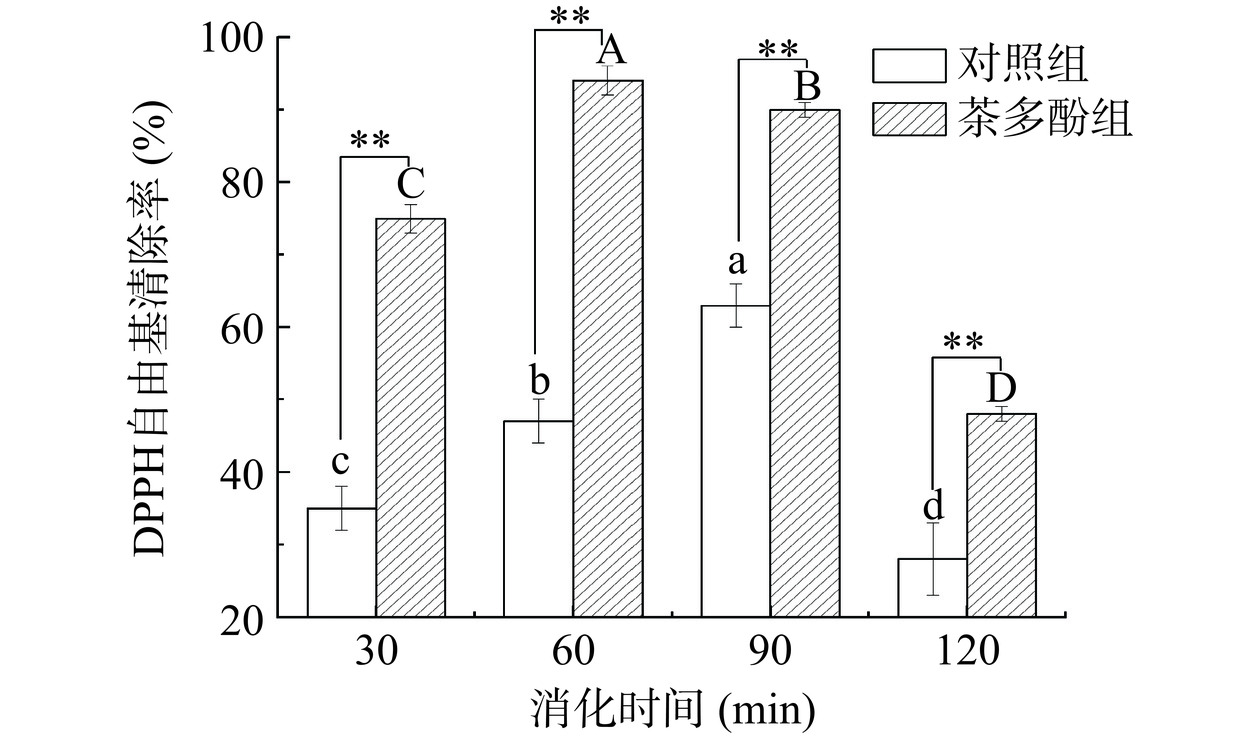
2.5 茶多酚对鱼肉香肠消化后DPPH自由基清除率的影响
由图4可知,在胃肠消化前1 h,添加茶多酚的食糜抗氧化活性呈现出显著增加的趋势。这种增加主要源于蛋白质的水解和活性肽的释放。Martinez等[31]研究指出肉蛋白水解后会释放出一些亲水性的抗氧化肽,如肌肽和鹅肌肽。另一个可能原因是模拟肠消化阶段,伴随着蛋白质的水解,更多酚类物质被释放和降解,有助于抗氧化活性的提高[32]。模拟消化120 min后,添加茶多酚组的DPPH自由基清除率为47.93%,而对照组为28.23%,茶多酚组的抗氧化活性极显著高于对照组(P<0.01)。在整个消化过程中茶多酚组的DPPH自由基清除率均高于对照组,这是因为蛋白质可以与茶多酚通过共价以及非共价键结合以提高蛋白质的抗氧化能力[33−34]。
2.6 茶多酚鱼肉香肠对免疫抑制小鼠脏器指数的影响
胸腺和脾脏都是重要的免疫器官,胸腺和脾脏质量的变化可反映机体内淋巴细胞的数量变化,从而间接反映机体的免疫应答水平[35]。由表3可知,与Normal组相比,Model组免疫抑制小鼠的胸腺指数和脾脏指数显著降低(P<0.05),说明免疫抑制模型建模成功。与Normal组相比,TP组胸腺指数极显著下降(P<0.01),脾脏指数下降但差异不显著(P>0.05)。A+TP组胸腺指数和脾脏指数降低,但均不存在显著性差异(P>0.05),说明茶多酚鱼肉香肠促进免疫抑制小鼠的免疫器官生长。与Model组相比,TP组胸腺指数升高但无显著差异(P>0.05),脾脏指数极显著升高(P<0.01),A+TP组胸腺指数和脾脏指数均显著升高(P<0.05,P<0.01),说明添加茶多酚的鱼肉香肠可以促进免疫抑制小鼠的免疫器官生长。
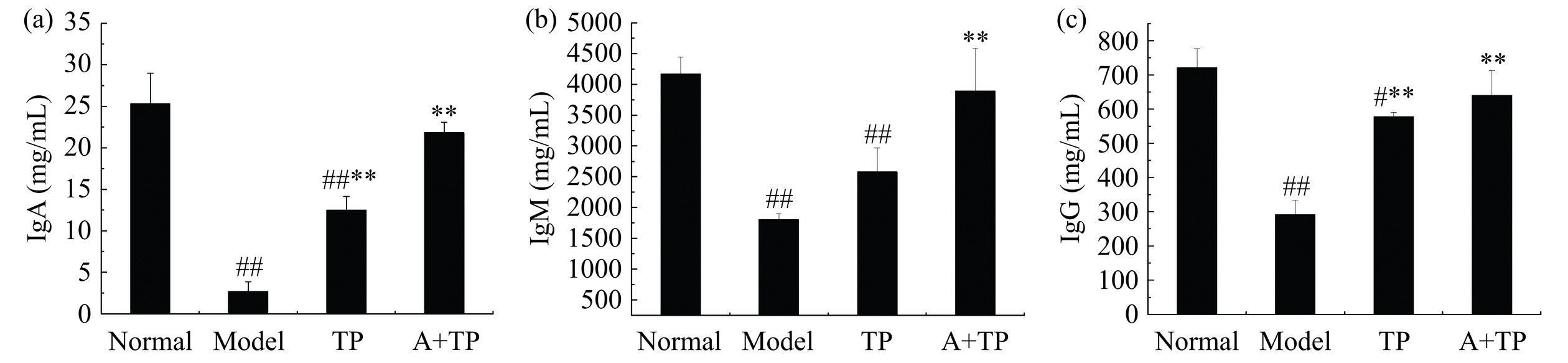
2.7 茶多酚鱼肉香肠对免疫抑制小鼠血清中免疫球蛋白的影响
免疫球蛋白(Immunoglobulin,Ig)是一种昂贵且稀缺的抗体,并且在免疫应答过程中的抗原识别中起重要作用[36]。由图5可知,与Normal组相比,Model组小鼠血清中免疫球蛋白IgA、IgM和IgG浓度极显著降低(P<0.01),说明免疫抑制模型建模成功。TP组小鼠血清中免疫球蛋白IgA、IgM和IgG浓度显著低于Normal组(P<0.05或P<0.01),但A+TP组与Normal组相比无显著差异(P>0.05)。与Model组相比,TP组小鼠血清中免疫球蛋白IgA和IgG浓度极显著提高(P<0.01),A+TP组免疫球蛋白IgA、IgM和IgG浓度均极显著提高(P<0.01),说明茶多酚鱼肉香肠可恢复免疫抑制小鼠血清中IgA、IgM和IgG水平。张建伟等[37]研究发现,小鼠在大强度耐力运动后血清中IgA、IgM和IgG含量显著下降,而灌喂茶多酚组小鼠血清中IgA含量与对照组比较没有显著变化,说明茶多酚可以增加免疫球蛋白含量及活性。
2.8 茶多酚鱼肉香肠对免疫抑制小鼠血清中炎症细胞因子的影响
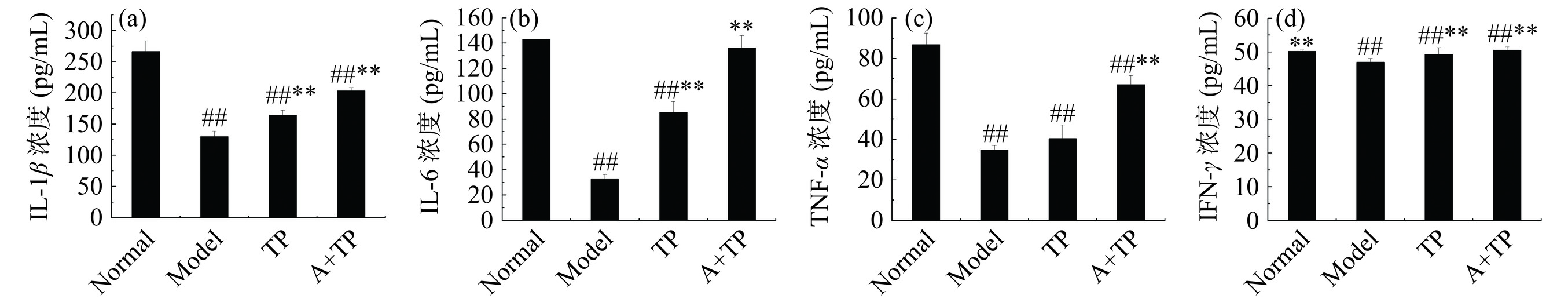
IL-6是具有多重免疫调节的细胞因子,能调节细胞和体液反应,并能抑制促炎性因子TNF-α和IL-1β的分泌,具有抑制机体炎症反应的作用[38]。IL-1β是一种具有双重来源的重要炎症因子,可诱导多种炎症因子的产生及释放[39−40]。促炎性因子TNF-α和IL-1β能抑制抗炎性因子IL-6的产生及释放[41]。IFN-γ是先天性免疫和适应性免疫的最重要调节因子之一,具有抗病毒、抗肿瘤作用以及免疫调节作用[42]。
由图6可知,与Normal组相比,Model组炎症细胞因子IL-1β、IL-6、TNF-α和IFN-γ极显著降低(P<0.01),说明建模成功。与Normal组相比,TP组小鼠血清中炎症细胞因子IL-1β、IL-6、TNF-α和IFN-γ浓度极显著降低(P<0.01)。A+TP组小鼠血清中炎症细胞因子IL-1β、TNF-α和IFN-γ浓度极显著低于Normal组(P<0.01)。与Model组相比,TP组小鼠血清中炎症细胞因子IL-1β、IL-6、IFN-γ浓度极显著升高(P<0.01),TNF-α浓度升高,但无显著性差异(P>0.05)。A+TP组小鼠血清中炎症细胞因子IL-1β、IL-6、TNF-α和IFN- γ浓度极显著高于Model组(P<0.01),说明茶多酚鱼肉香肠可以抑制炎症反应。
2.9 茶多酚鱼肉香肠对免疫抑制小鼠肾脏抗氧化酶活性的影响
过氧化氢酶(CAT)对机体抗氧化防御体系具有重要作用,通过催化电子转移,从而清除氧化应激诱导产生的活性氧[43]。谷胱甘肽过氧化物酶(GSH-Px)在对抗活性氧方面发挥着至关重要的作用,并因其参与免疫反应、生长和发育而被广泛研究[44]。超氧化物歧化酶(SOD)是一种金属酶,可催化消除超氧化物自由基,作为抵抗氧化应激的一线防御机制[45]。MDA含量的高低间接反映机体受自由基的损伤程度。由表4可知,与Normal组相比,Model组CAT、T-AOC、GSH-Px和SOD活性降低,MDA含量升高,且均具有极显著性差异(P<0.01)。与Normal组相比,TP组CAT和SOD活性极显著降低(P<0.01),MDA含量极显著升高(P<0.01),而T-AOC和GSH-Px活性下降,但无显著性差异(P>0.05)。A+TP组SOD活性显著低于Normal组(P<0.05),CAT、GSH-Px活性和MDA含量均升高,但无显著性差异(P>0.05)。与Model组相比,TP组和A+TP组CAT、T-AOC、GSH-Px和SOD活性显著升高,MDA含量显著下降(P<0.05),说明茶多酚鱼肉香肠能够清除小鼠肾脏中氧化产生的自由基,使CAT、T-AOC、GSH-Px和SOD活性得到恢复,并且降低脂质过氧化的产物MDA,对肾脏起到很好的保护作用。李冲等[46]研究也表明白茶多酚降低了免疫抑制小鼠肾脏组织中的丙二醛的含量,增加小鼠肾脏组织中谷胱甘肽过氧化物酶和过氧化氢酶活性。
表 4 茶多酚鱼肉香肠对免疫抑制小鼠肾脏抗氧化酶活性的影响(n=8)Table 4. Effects of TP fish sausage on antioxidant enzyme activity in kidney of immunosuppressed mice (n=8)组别 CAT(U/mL) T-AOC(U/mL) GSH-Px(U/mL) SOD(U/mL) MDA(nmol/mL) Normal 67.50±5.40 3.23±0.30 406.03±0.19 22.44±1.01 23.42±0.95 Model 39.98±0.95## 1.75±0.05## 262.77±31.44## 9.38±1.01## 43.57±1.05## TP 50.77±2.10##** 2.94±0.17* 368.39±57.43* 14.77±1.20##** 32.32±0.60##** A+TP 70.03±3.55** 3.12±0.53* 465.66±19.17** 19.98±0.49#** 25.96±0.78** 3. 结论
本研究在鱼肉香肠当中添加0.2%的茶多酚,探究茶多酚鱼肉香肠体外消化特性以及对小鼠免疫调节作用的影响。体外消化结果表明,一方面茶多酚降低蛋白质的消化率和游离氨基酸含量,使蛋白质的粒径大于对照组;另一方面,茶多酚鱼肉香肠体外消化后提高蛋白质的抗氧化能力,同时也能够显著降低脂质氧化(P<0.05)。小鼠免疫调节实验结果表明,茶多酚鱼肉香肠促进免疫抑制小鼠的免疫器官生长,恢复小鼠血清中IgA、IgM和IgG水平,提高小鼠血清中炎症细胞因子水平。同时也使CAT、T-AOC、GSH-Px和SOD活性得到恢复,并且降低脂质过氧化的产物MDA,对肾脏起到很好的保护作用,说明茶多酚可作为功能因子加入鱼肉香肠中促进免疫调节。
-
表 1 模拟消化液原液制备
Table 1 Preparation of stock solutions of simulated digestion fluids
成分 SSF(mmol/L) SGF(mmol/L) SIF(mmol/L) KCl 15.10 6.90 6.80 KH2PO4 3.70 0.90 0.80 NaHCO3 13.60 25.00 85.00 NaCl − 47.20 38.40 MgCl2(H2O)6 0.15 0.10 0.33 (NH4)2CO3 0.06 0.50 − 表 2 茶多酚鱼肉香肠体外消化120 min后游离氨基酸含量
Table 2 Free amino acid content of TP fish sausage after 120 min in vitro digestion
氨基酸 对照组(mg/g) 茶多酚处理组(mg/g) 天冬氨酸(Asp) 2.90±0.07 1.00±0.08 苏氨酸*(Thr) 8.10±0.22 1.80±0.09 丝氨酸(Ser) 3.70±0.19 1.50±0.08 谷氨酸(Glu) 18.00±0.34 6.90±0.24 甘氨酸(Gly) 4.30±0.15 1.80±0.06 丙氨酸(Ala) 15.00±0.44 5.20±0.10 胱氨酸(Cys) 0.94±0.05 − 缬氨酸*(Val) 16.00±0.46 6.10±0.12 异亮氨酸*(IIe) 10.00±0.31 3.10±0.09 亮氨酸*(Leu) 30.00±0.62 12.00±0.23 酪氨酸(Tyr) 8.80±0.35 − 苯丙氨酸*(Phe) 21.00±0.48 8.80±0.27 赖氨酸*(Lys) 42.00±0.68 18.00±0.56 精氨酸(Arg) 30.00±0.34 11.00±0.18 注:*表示人体必需氨基酸;−表示未检测出。 表 3 茶多酚鱼肉香肠对小鼠脏器指数的影响(n=8)
Table 3 Effects of TP fish sausage on viscera index in mice (n=8)
表 4 茶多酚鱼肉香肠对免疫抑制小鼠肾脏抗氧化酶活性的影响(n=8)
Table 4 Effects of TP fish sausage on antioxidant enzyme activity in kidney of immunosuppressed mice (n=8)
组别 CAT(U/mL) T-AOC(U/mL) GSH-Px(U/mL) SOD(U/mL) MDA(nmol/mL) Normal 67.50±5.40 3.23±0.30 406.03±0.19 22.44±1.01 23.42±0.95 Model 39.98±0.95## 1.75±0.05## 262.77±31.44## 9.38±1.01## 43.57±1.05## TP 50.77±2.10##** 2.94±0.17* 368.39±57.43* 14.77±1.20##** 32.32±0.60##** A+TP 70.03±3.55** 3.12±0.53* 465.66±19.17** 19.98±0.49#** 25.96±0.78** -
[1] 陈瑶, 江彩艳, 郑杰, 等. 非漂洗鱼糜即食食品的加工工艺[J]. 现代食品科技,2022,38(9):215−227. [CHEN Y, JIANG C Y, ZHENG J, et al. Processing technology of non-rinsed surimi instant food[J]. Modern Food Science and Technology,2022,38(9):215−227.] CHEN Y, JIANG C Y, ZHENG J, et al. Processing technology of non-rinsed surimi instant food[J]. Modern Food Science and Technology, 2022, 38(9): 215−227.
[2] 张亚美, 池帅, 李颖畅, 等. 生物保鲜剂在水产品保鲜中的应用及研究进展[J]. 中国食品添加剂,2023,34(11):36−44. [ZHANG Y M, CHI S, LI Y C, et al. Application and research progress of biological preservatives in aquatic products preservation[J]. China Food Additives,2023,34(11):36−44.] ZHANG Y M, CHI S, LI Y C, et al. Application and research progress of biological preservatives in aquatic products preservation[J]. China Food Additives, 2023, 34(11): 36−44.
[3] NAPARLO K, BARTOSZ G, STEFANIUK I, et al. Interaction of catechins with human erythrocytes[J]. Molecules,2020,25(6):1456. doi: 10.3390/molecules25061456
[4] 王芙蓉, 谢中国, 梁丹, 等. 茶多酚的抑菌作用及其在水产品保鲜中的应用[J]. 食品科技,2023,48(3):260−266. [WANG F R, XIE Z G, LIANG D, et al. Antibacterial mechanism and application of tea polyphenols in aquatic products preservation[J]. Food Science and Technology,2023,48(3):260−266.] WANG F R, XIE Z G, LIANG D, et al. Antibacterial mechanism and application of tea polyphenols in aquatic products preservation[J]. Food Science and Technology, 2023, 48(3): 260−266.
[5] WU J, LI C S, LI L H, et al. Improved physicochemical properties and product characteristics of tilapia surimi by tea polyphenols during chilled storage[J]. LWT-Food Science and Technology,2022,167:113822.
[6] LI X P, LIU C K, WANG J X, et al. Tea polyphenols affect oxidative modification and solution stability of myofibrillar protein from grass carp (Ctenopharyngodon idellus)[J]. Food Biophysics,2020,15(4):1−12.
[7] 薛敏. 棉籽浓缩蛋白加工工艺及其在水产饲料中营养价值[J]. 饲料工业,2021,42(12):1−5. [XUE M. Processing of cottonseed protein concentrated and its nutrient values in aquatic feed[J]. Feed Industry,2021,42(12):1−5.] XUE M. Processing of cottonseed protein concentrated and its nutrient values in aquatic feed[J]. Feed Industry, 2021, 42(12): 1−5.
[8] SUN X H, SARTESHNIZI R A, UDENIGWE C C. Recent advances in protein–polyphenol interactions focusing on structural properties related to antioxidant activities[J]. Current Opinion in Food Science,2022,45:100840. doi: 10.1016/j.cofs.2022.100840
[9] 郄雪娇, 程亚, 曾茂茂, 等. 食品多酚与蛋白相互作用及其对多酚生物可利用性影响的研究进展[J]. 食品与发酵工业,2019,45(8):232−237. [QIE X J, CHENG Y, ZENG M M, et al. Interactions between food polyphenols and proteins and their effects on the bioavailability of polyphenols[J]. Food and Fermentation Industries,2019,45(8):232−237.] QIE X J, CHENG Y, ZENG M M, et al. Interactions between food polyphenols and proteins and their effects on the bioavailability of polyphenols[J]. Food and Fermentation Industries, 2019, 45(8): 232−237.
[10] XUE H, ZHANG G W, HAN T F, et al. Improvement of gel properties and digestibility of the water-soluble polymer of tea polyphenol-egg white under thermal treatment[J]. Food Chemistry,2022,372:131319. doi: 10.1016/j.foodchem.2021.131319
[11] MOORE F A, PHILLIPS S M, MCCLAIN S M, et al. Nutrition support for persistent inflammation, immunosuppression, and catabolism syndrome[J]. Nutrition in Clinical Practice,2017,32(1S):121S−127S.
[12] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food-an international consensus[J]. Food Function,2014,5(6):1113−1124. doi: 10.1039/C3FO60702J
[13] 中华人民共和国国家卫生和计划生育委员会. GB 5009.5-2016 食品安全国家标准 食品中蛋白质的测定[S]. 北京:中国标准出版社, 2016:1−3. [China Health and Family Planning Commission. GB 5009.5-2016 National food safety standard Determination of protein in food[S]. Beijing:Standards Press of China, 2016:1−3.] China Health and Family Planning Commission. GB 5009.5-2016 National food safety standard Determination of protein in food[S]. Beijing: Standards Press of China, 2016: 1−3.
[14] 中华人民共和国国家卫生和计划生育委员会. GB 5009.124-2016 食品安全国家标准 食品中氨基酸态氮的测定[S]. 北京:中国标准出版社, 2016:1−3. [China Health and Family Planning Commission. GB 5009.124-2016 National food safety standard Determination of amino acid nitrogen in food[S]. Beijing:Stand-ards Press of China, 2016:1−3.] China Health and Family Planning Commission. GB 5009.124-2016 National food safety standard Determination of amino acid nitrogen in food[S]. Beijing: Stand-ards Press of China, 2016: 1−3.
[15] GROTTO D, SANTA M L, BOEIRA S, et al. Rapid quantification of malondialdehyde in plasma by high performance liquid chromatography-visible detection[J]. Journal of Pharmaceutical and Biomedical Analysis,2007,43(2):619−624. doi: 10.1016/j.jpba.2006.07.030
[16] 李诺, 张东杰, 张桂芳, 等. 体外消化对苦荞酚类物质含量及抗氧化活性的影响[J]. 黑龙江八一农垦大学学报,2023,35(5):43−50. [LI N, ZHANG D J, ZHANG G F, et al. Effects of in vitro digestion on phenolic content and antioxidant activity of tartary buckwheat[J]. Journal of Heilongjiang Bayi Agricultural University,2023,35(5):43−50.] doi: 10.3969/j.issn.1002-2090.2023.05.007 LI N, ZHANG D J, ZHANG G F, et al. Effects of in vitro digestion on phenolic content and antioxidant activity of tartary buckwheat[J]. Journal of Heilongjiang Bayi Agricultural University, 2023, 35(5): 43−50. doi: 10.3969/j.issn.1002-2090.2023.05.007
[17] YU F M, ZHANG Z W, YE S W, et al. Immunoenhancement effects of pentadecapeptide derived from cyclina sinensis on immune-deficient mice induced by cyclophosphamide[J]. Journal of Functional Foods,2019,60:10340.
[18] LIU J Y, HU Y, WEI H H, et al. Effect of glycation on protein structure, amino acid composition and digestibility of silver carp -mince[J]. International Journal of Food Science & Technology,2022,57(4):2487−2497.
[19] DANIEL J G, CECILIA J A, ROBERTO A, et al. Phytochemical characterization of Phoradendron bollanum and Viscum album subs. austriacum as mexican mistletoe plants with antimicrobial activity[J]. Plants,2021,10(7):1299. doi: 10.3390/plants10071299
[20] MARTINEZ-GONZALEZ A I, DIAZ-SANCHEZ A G, ROSA L A, et al. Polyphenolic compounds and digestive enzymes:In vitro non-covalent interactions[J]. Molecules,2017,22(4):669. doi: 10.3390/molecules22040669
[21] GAO M R, XU Q D, ZENG W C. Effect of tea polyphenols on the tenderness of yak meat[J]. Journal of Food Processing and Preservation,2020,44(5):e14433.
[22] DOBREVA M A, FRAZIER R A, MUELLER-HARVEY I, et al. Binding of pentagalloyl glucose to two globular proteins occurs via multiple surface sites[J]. Biomacromolecules,2011,12(3):710−715. doi: 10.1021/bm101341s
[23] LE B C, RENARD C M. Interactions between polyphenols and macromolecules:Quantification methods and mechanisms[J]. Critical Reviews in Food Science and Nutrition,2012,52(3):213−248. doi: 10.1080/10408398.2010.499808
[24] GE G, ZHAO J, ZHENG J B, et al. Pepsin diffusivity and in vitro gastric digestion of soymilk as affected by binding of tea polyphenols to soy proteins[J]. Journal Agriculture Food Chemistry,2021,69(37):11043−11052. doi: 10.1021/acs.jafc.1c04705
[25] YAN Z M, ZHONG Y Z, DUAN Y H, et al. Antioxidant mechanism of tea polyphenols and its impact on health benefits[J]. Animal Nutrition,2020,6(2):115−123. doi: 10.1016/j.aninu.2020.01.001
[26] WANG Y, XIE Y, WANG A D, et al. Insights into interactions between food polyphenols and proteins:An updated overview[J]. Journal of Food Processing and Preservation,2022,46(5):556−567.
[27] NAKAI M, FUKAI Y, ASAMI S, et al. Inhibitory effects of oolong tea polyphenols on pancreatic lipase in vitro[J]. Journal of Agricultural and Food Chemistry,2005,52(11):4593−4598.
[28] 陈小雷, 胡王, 周蓓蓓, 等. 天然抗氧化剂茶多酚对水产品的抗氧化研究[J]. 安徽农业科学,2016,44(1):112−114. [CHEN X L, HU W, ZHOU B B, et al. Study on antioxidation activity of natural antioxidant tea polyphenols in aquatic products[J]. Journal of Anhui Agricultural Sciences,2016,44(1):112−114.] doi: 10.3969/j.issn.0517-6611.2016.01.038 CHEN X L, HU W, ZHOU B B, et al. Study on antioxidation activity of natural antioxidant tea polyphenols in aquatic products[J]. Journal of Anhui Agricultural Sciences, 2016, 44(1): 112−114. doi: 10.3969/j.issn.0517-6611.2016.01.038
[29] AUBOURG S P. Interaction of malondialdehyde with biological molecules-new trends about reactivity and significance[J]. International Journal of Food Science & Technology,1993,28(4):323−335.
[30] LIAN Z H, HAN J H, CAO Y, et al. Epicatechin inhibited lipid oxidation and protein lipoxidation in a fish oil-fortified dairy mimicking system[J]. Foods,2023,12(7):1559. doi: 10.3390/foods12071559
[31] MARTINEZ J, NIETO G, ROS G. Total antioxidant capacity of meat and meat products consumed in a reference ‘Spanish standard diet’[J]. International Journal of Food Science & Technology,2014,49(12):2610−2618.
[32] SELMA M V, ESPIN J C, TOMAS-BARBERAN F A. Interaction between phenolics and gut microbiota:Role in human health[J]. Journal Agriculture Food Chemistry,2009,57(15):6485−6501. doi: 10.1021/jf902107d
[33] ASHWAR B A, GANI A. Noncovalent interactions of sea buckthorn polyphenols with casein and whey proteins:Effect on the stability, antioxidant potential, and bioaccessibility of polyphenols[J]. ACS Food Science & Technology,2021,1(7):1206−1214.
[34] CHENG J R, ZHU M J, LIU X M. Insight into the conformational and functional properties of myofibrillar protein modified by mulberry polyphenols[J]. Food Chemistry,2020,308(C):125592.
[35] 陈非玥, 洪龙胜, 李婉雁, 等. 白术多糖对小鼠胸腺与脾脏指数、组织结构及p38/MAPK信号通路的影响[J]. 动物医学进展,2021,42(12):43−49. [CHEN F Y, HONG L S, LI W Y, et al. Effect of polysaccharide of atractylodes macrocephala koidz on thymus and spleen indexes and tissue structure and p38/MAPK signaling pathway in mice[J]. Advances in Animal Medicine,2021,42(12):43−49.] doi: 10.3969/j.issn.1007-5038.2021.12.008 CHEN F Y, HONG L S, LI W Y, et al. Effect of polysaccharide of atractylodes macrocephala koidz on thymus and spleen indexes and tissue structure and p38/MAPK signaling pathway in mice[J]. Advances in Animal Medicine, 2021, 42(12): 43−49. doi: 10.3969/j.issn.1007-5038.2021.12.008
[36] 童利红. 血清中免疫球蛋白A免疫球蛋白G免疫球蛋白M及β2-微球蛋白预测妊娠期肾病综合征患者妊娠结局的价值[J]. 中国妇幼保健,2022,37(20):3743−3746. [TONG L H. The value of serum immunoglobulin A, immunoglobulin G, immunoglobulin M and β2-microglobulin in predicting pregnancy outcome in patients with nephrotic syndrome in pregnancy[J]. Maternal and Child Health Care in China,2022,37(20):3743−3746.] TONG L H. The value of serum immunoglobulin A, immunoglobulin G, immunoglobulin M and β2-microglobulin in predicting pregnancy outcome in patients with nephrotic syndrome in pregnancy[J]. Maternal and Child Health Care in China, 2022, 37(20): 3743−3746.
[37] 张建伟, 刘海燕, 张淼. 茶多酚对大强度耐力运动小鼠免疫功能的影响[J]. 食品工业科技,2012,33(11):367−369. [ZHANG J W, LIU H Y, ZHANG M. Effect of tea polyphenol on immune functions of great intensity endurance training mice[J]. Science and Technology of Food Industry,2012,33(11):367−369.] ZHANG J W, LIU H Y, ZHANG M. Effect of tea polyphenol on immune functions of great intensity endurance training mice[J]. Science and Technology of Food Industry, 2012, 33(11): 367−369.
[38] 王慧, 谭雨佳, 眭庆梅, 等. 肺复康方对Lewis肺癌小鼠癌因性疲乏及血清IL-6、TNF-α、IL-1β水平的影响[J]. 湖南师范大学学报:医学版,2019,16(4):3−6. [WANG H, TAN Y J, SUI Q M, et al. Effects of Lung Fu Kang Fang on cancer-caused fatigue and serum IL-6, TNF-α and IL-1β levels in Lewis lung cancer mice[J]. Journal of Hunan Normal University (Medical Sciences),2019,16(4):3−6.] WANG H, TAN Y J, SUI Q M, et al. Effects of Lung Fu Kang Fang on cancer-caused fatigue and serum IL-6, TNF-α and IL-1β levels in Lewis lung cancer mice[J]. Journal of Hunan Normal University (Medical Sciences), 2019, 16(4): 3−6.
[39] 李萍, 王青, 李志. 血清降钙素原、白细胞介素6、C反应蛋白在感染性疾病中的诊断价值[J]. 检验医学与临床,2014,11(11):1553−1555. [LI P, WANG Q, LI Z. Diagnostic value of serum calcitoninogen, interleukin 6, and C-reactive protein in infectious diseases[J]. Laboratory Medicine and Clinic,2014,11(11):1553−1555.] doi: 10.3969/j.issn.1672-9455.2014.11.044 LI P, WANG Q, LI Z. Diagnostic value of serum calcitoninogen, interleukin 6, and C-reactive protein in infectious diseases[J]. Laboratory Medicine and Clinic, 2014, 11(11): 1553−1555. doi: 10.3969/j.issn.1672-9455.2014.11.044
[40] 韩小胜, 黄会, 魏小斌. 重症肺炎链球菌感染患儿血清TNF-α、IL-1β、IL-6的表达水平及意义[J]. 国际检验医学杂志,2018,39(9):1068−1070,1073. [HAN X S, HUANG H, WEI X B. Expression levels and significance of serum TNF-α, IL-1β and IL-6 in children with severe Streptococcus pneumoniae infection[J]. International Journal of Laboratory Medicine,2018,39(9):1068−1070,1073.] doi: 10.3969/j.issn.1673-4130.2018.09.013 HAN X S, HUANG H, WEI X B. Expression levels and significance of serum TNF-α, IL-1β and IL-6 in children with severe Streptococcus pneumoniae infection[J]. International Journal of Laboratory Medicine, 2018, 39(9): 1068−1070,1073. doi: 10.3969/j.issn.1673-4130.2018.09.013
[41] PEDERSEN B K, FEBBRAIO M A. Muscle as an endocrine organ:Focus on muscle-derived interleukin-6[J]. Physiological Reviews,2008,88(4):1379−1406. doi: 10.1152/physrev.90100.2007
[42] ROZMAN P, SAVJGER U. The tolerogenic role of IFN-γ[J]. Cytokine & Growth Factor Reviews,2018,40:40−53.
[43] RAGHBENDRA K D, JOON N L, YUNASH M, et al. Catalase-deficient mice induce aging faster through lysosomal dysfunction[J]. Cell Communication and Signaling,2022,20(1):192. doi: 10.1186/s12964-022-00969-2
[44] IMRAN A, GHOSH A. Evolutionary expansion, functional diversification, and transcript profiling of plant glutathione peroxidases[J]. Plant Science,2024,341:111991. doi: 10.1016/j.plantsci.2024.111991
[45] CHUNG W H. Unraveling new functions of superoxide dismutase using yeast model system:Beyond its conventional role in superoxide radical scavenging[J]. Journal of Microbiology,2017,55(6):409−416. doi: 10.1007/s12275-017-6647-5
[46] 李冲, 杨悦, 骞宇, 等. 白茶多酚对D-半乳糖致小鼠肾损伤模型的改善作用[J]. 食品与发酵工业,2022,48(4):226−234. [LI C, YANG Y, QIAN Y, et al. Effect of polyphenols in white tea on kidney injury induced by D-galactose in mice[J]. Food and Fermentation Industries,2022,48(4):226−234.] LI C, YANG Y, QIAN Y, et al. Effect of polyphenols in white tea on kidney injury induced by D-galactose in mice[J]. Food and Fermentation Industries, 2022, 48(4): 226−234.





 下载:
下载:
 下载:
下载:



