Role and Mechanism of 20-Hydroxyecdysone in Oxidative Damage of HepG2 Cells Induced by High Glucose
-
摘要: 目的:探究20-羟基蜕皮激素(20-Hydroxyecdysone,20-HE)对高糖诱导HepG2细胞氧化损伤的保护作用及相关分子机制。方法:利用高糖(50 mmol/L葡萄糖)建立HepG2细胞氧化损伤模型,分别采用CCK-8法、caspase-3活性检测实验、荧光探针法和比色法检测细胞的活力、凋亡、活性氧(Reactive Oxygen Specie,ROS)、超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)和丙二醛(Malondialdehyde,MDA)的水平。基于生物信息学分析的方法对参与20-HE调控作用的相关信号通路进行预测,采用Western blot检测Akt蛋白的磷酸化水平,评价PI3K/Akt信号通路的激活水平,利用PI3K/Akt信号通路的抑制剂(LY294002)验证其是否参与20-HE发挥的调控作用。结果:20-HE的浓度低于20 μmol/L对HepG2细胞没有显著毒性作用;20-HE可以显著提高损伤细胞的活力(P<0.05),显著抑制损伤细胞的凋亡(P<0.05),显著下调损伤细胞的ROS水平(P<0.05),显著提高SOD和CAT的水平(P<0.05),显著下调MDA水平(P<0.05);PI3K/Akt信号通路是20-HE发挥调控作用的潜在下游机制;20-HE可以显著上调损伤细胞中PI3K/Akt信号通路的水平(P<0.05);LY294002可以逆转20-HE对损伤细胞发挥的保护作用。结论:20-HE通过激活PI3K/Akt信号通路发挥对高糖诱导HepG2细胞氧化损伤的保护作用。
-
关键词:
- 20-羟基蜕皮激素 /
- 高糖 /
- HepG2细胞 /
- 氧化应激 /
- PI3K/Akt信号通路
Abstract: Objective: To explore the protective effects of 20-Hydroxyecdysone (20-HE) on high glucose induced HepG2 cells and its related molecular mechanism. Methods: In this study, high glucose (50 mmol/L glucose) was used to establish the oxidative damage model in HepG2 cells. The CCK-8 assay, caspase-3 assay, fluorescent probe method, and colorimetric method were used to assess the levels of cell viability, apoptosis, oxygen species (ROS), superoxide dismutase (SOD), catalase (CAT), and malondialdehyde (MDA), respectively. The signaling pathways involved in the regulation of 20-HE were predicted using bioinformatics analysis. The phosphorylation level of Akt protein was detected by Western blot to evaluate the activation level of the PI3K/Akt signaling pathway. The involvement of the PI3K/Akt signaling pathway in the regulatory effects of 20-HE was verified using the inhibitor LY294002. Results: Treatment with 20-HE had no significant toxic effect on HepG2 cells at concentrations lower than 20 μmol/L. In the injured cells, 20-HE could significantly improve the viability (P<0.05), inhibit the apoptosis (P<0.05), down-regulate the level of ROS, improve the levels of SOD and CAT (P<0.05), and down-regulate the level of MDA (P<0.05). PI3K/Akt signaling pathway was the potential downstream mechanism of regulatory effects exerted by 20-HE. 20-HE could significantly up-regulate the level of PI3K/Akt signaling pathway in the injured cells (P<0.05). LY294002 could reverse the protective effects exerted by 20-HE on the injured cells. Conclusion: 20-HE exerted protective effects on high glucose induced oxidative damage in HepG2 cells by activating the PI3K/Akt signaling pathway.-
Keywords:
- 20-hydroxyecdysone /
- high glucose /
- HepG2 cells /
- oxidative stress /
- PI3K/Akt signaling pathway
-
全球范围内糖尿病的发病率正在逐年递增,而我国已经成为糖尿病患者数量最多的国家。糖尿病及其并发症不仅严重影响了患者的身心健康,也给家庭及社会带来巨大的经济负担[1]。肝脏作为人体的代谢中心是高血糖累积的主要器官之一。高血糖导致的肝损伤会进一步发展为一系列的肝脏病变,包括非酒精性脂肪性肝炎、肝纤维化、肝硬化和肝衰竭[2]。目前对于糖尿病肝损伤仍缺乏令人满意的治疗手段。研究表明这种肝损伤的发病机制与高糖引发的肝细胞氧化损伤密切相关[3]。高糖可以引起肝细胞中活性氧(Reactive Oxygen Specie,ROS)水平的持续升高,进而导致氧化应激相关因子包括超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)和丙二醛(Malondialdehyde,MDA)的失调,使肝细胞发生持续的氧化应激。氧化损伤会抑制肝细胞的活力并促进细胞凋亡。近年来,天然产物对氧化损伤的保护作用逐渐受到研究者们的重视[4]。
20-羟基蜕皮激素(20-Hydroxyecdysone,20-HE;分子式:C27H44O7)是一种自然界中广泛存在的天然类固醇。20-HE是功能性食品藜麦的主要活性成分之一[5]。动物实验结果表明,在饮食中添加20-HE可以有效降低肥胖小鼠的体重、体脂和血糖,并改善胰岛素抵抗[6]。此外,既往的研究还发现20-HE具有抗氧化和抗肿瘤等多种生物学活性[7−8]。这其中20-HE的抗氧化作用受到研究者的广泛关注[9]。但目前20-HE在高糖诱导的肝细胞氧化损伤中的作用及机制并不清楚。
PI3K/Akt信号通路在细胞的增殖、凋亡和氧化应激等多种生物学过程中发挥重要调控作用[10]。在细胞的氧化应激中,PI3K/Akt信号通路的抑制与氧化应激的发生和发展密切相关[11]。Akt蛋白是该信号通路的核心分子,其磷酸化后被激活,磷酸化的Akt通过进一步激发通路下游效应分子从而发挥多种调控功能。Akt蛋白的磷酸化水平反映了PI3K/Akt信号通路的激活水平[12]。在高糖导致的肝细胞损伤中,目前尚无关于20-HE和PI3K/Akt信号通路之间关系的研究报道。
基于上述问题,本研究首先对20-HE在高糖诱导HepG2细胞氧化损伤模型中的作用进行验证。在此基础上,通过生物信息学分析的方法对20-HE发挥调控作用的相关信号通路进行预测。最后通过实验验证PI3K/Akt信号通路是否参与了20-HE对损伤细胞的保护作用。这一研究不仅为20-HE在防治糖尿病肝损伤中的应用提供了理论依据,而且在分子水平阐释了20-HE对氧化损伤细胞发挥保护作用的关键机制。
1. 材料与方法
1.1 材料与仪器
20-HE 纯度:98%,上海源叶生物科技有限公司;人肝癌细胞HepG2细胞系 北京北纳生物公司;DMEM培养基、胎牛血清(FBS)、胰酶、磷酸盐缓冲溶液(PBS)、双抗(青链霉素混合液) Thermo Fisher公司;LY294002 (PI3K/Akt信号通路的抑制剂用于机制验证实验) 纯度:99.92%,MedChemExpress公司;细胞裂解液 生工生物工程股份有限公司;EnzChekRCaspase 3活性/凋亡检测试剂盒、牛血清白蛋白(BSA)、ECL显色试剂盒 Thermo Fisher公司;CCK-8试剂、ROS、SOD、CAT、MDA检测试剂盒、BCA法蛋白浓度测定试剂盒 碧云天公司;SDS-PAGE凝胶配置试剂盒 翌圣生物科技公司;PVDF膜 默克公司;磷酸化Akt(p-Akt)一抗、总Akt(t-Akt)一抗 江苏亲科公司;β-actin一抗、二抗 Proteintech公司。
BBD6220 型CO2培养箱、Varioskan LUX型酶标仪 Thermo Fisher公司;KETA ML型显影仪 威泰克公司。
1.2 实验方法
1.2.1 高糖诱导的细胞氧化损伤模型建立、分组及给药
HepG2细胞在含10% FBS和1%双抗的DMEM培养基中于37 ℃、5%浓度CO2培养箱中进行培养,当细胞融合度达到80%~90%时,用胰酶进行消化,1:3进行传代。
参考Subramaniyan等[13]的研究方法建立高糖诱导的HepG2细胞氧化损伤模型。正常对照组用含5.5 mmol/L葡萄糖的培养基进行培养,模型组用含50 mmol/L浓度葡萄糖的培养基进行培养,给药组根据浓度梯度分为3组,分别加入终浓度为5、10和20 μmol/L的20-HE。在机制验证实验中,20-HE给药终浓度为20 μmol/L,LY294002的给药终浓度为10 μmol/L。培养24 h后收集细胞进行后续实验。
1.2.2 细胞活力检测
采用CCK-8法检测细胞活力。将准备好的HepG2细胞接种于96孔板(4×104/孔),待细胞贴壁后根据分组更换含有特定成分的培养基,开始计时,于37 ℃、5%浓度CO2培养箱中培养24 h后,每孔加入10 μL CCK-8试剂,于37 ℃条件下孵育2 h,用酶标仪于450 nm波长下检测吸光度,并计算细胞存活率以评价细胞活力,计算公式如下:
$$ \mathrm{细}\mathrm{胞}\mathrm{存}\mathrm{活}\mathrm{率}(\text{%})=\frac{\mathrm{吸}\mathrm{光}\mathrm{度}(\mathrm{实}\mathrm{验})-\mathrm{吸}\mathrm{光}\mathrm{度}(\mathrm{空}\mathrm{白})}{\mathrm{吸}\mathrm{光}\mathrm{度}(\mathrm{对}\mathrm{照})-\mathrm{吸}\mathrm{光}\mathrm{度}(\mathrm{空}\mathrm{白})}\times 100 $$ 1.2.3 细胞凋亡检测
采用caspase-3活性检测实验检测细胞凋亡,根据试剂盒说明书进行操作,收集待测细胞,PBS洗涤后加入相应体积的裂解液,收集上清液体,加入试剂盒检测液,用酶标仪于342 nm/441 nm(激发波长/发射波长)条件下检测荧光值,根据荧光数值计算cleaved-caspase-3活性以评价细胞凋亡水平,计算公式如下:
$$ \scriptsize{\mathrm{c}\mathrm{l}\mathrm{e}\mathrm{a}\mathrm{v}\mathrm{ed}\text{-}\mathrm{c}\mathrm{a}\mathrm{s}\mathrm{p}\mathrm{a}\mathrm{se}\text{-}3\mathrm{活}\mathrm{性} = \frac{\mathrm{荧}\mathrm{光}\mathrm{值}(\mathrm{实}\mathrm{验})-\mathrm{荧}\mathrm{光}\mathrm{值}(\mathrm{空}\mathrm{白})}{\mathrm{荧}\mathrm{光}\mathrm{值}(\mathrm{对}\mathrm{照})-\mathrm{荧}\mathrm{光}\mathrm{值}(\mathrm{空}\mathrm{白})}} $$ 1.2.4 氧化应激相关因子检测
采用荧光探针法检测细胞的ROS水平,根据试剂盒说明书,首先配制稀释的DCFH-DA试剂(1:2000)。收集待测细胞,进行细胞计数,调整各样本细胞密度至一致。各样本取等量细胞用准备好的DCFH-DA试剂混匀,37 ℃条件下孵育20 min,期间每5 min重新混匀样本。孵育结束后用无血清培养液洗涤样本细胞,用酶标仪于488 nm/525 nm(激发波长/发射波长)条件下检测荧光值,并计算ROS水平,计算公式如下:
$$ \mathrm{R}\mathrm{O}\mathrm{S}\mathrm{水}\mathrm{平}=\frac{\mathrm{荧}\mathrm{光}\mathrm{值}(\mathrm{实}\mathrm{验})-\mathrm{荧}\mathrm{光}\mathrm{值}(\mathrm{空}\mathrm{白})}{\mathrm{荧}\mathrm{光}\mathrm{值}(\mathrm{对}\mathrm{照})-\mathrm{荧}\mathrm{光}\mathrm{值}(\mathrm{空}\mathrm{白})}$$ 采用比色法检测细胞的SOD水平,根据试剂盒说明书,将收集待测细胞用预冷后的PBS洗涤,加入试剂盒裂解液(SOD样品制备液),充分裂解细胞后,4 ℃离心取上清液作为待测样品,检测蛋白浓度后用裂解液调整所有样品蛋白浓度至一致,分别配制WST-8/酶工作液和反应启动工作液,待检测样品中依次加入以上液体混匀,每个样品设置3个空白体系,空白1含检测缓冲液和两种工作液,空白2含检测缓冲液和WST-8/酶工作液,空白3含同组待测样品、检测缓冲液和WST-8/酶工作液。于37 ℃条件孵育30 min后,用酶标仪于450 nm波长下检测吸光度,并计算SOD水平,计算公式如下:
$${ \rm \mathrm{S}\mathrm{O}\mathrm{D}\mathrm{水}\mathrm{平}=\dfrac{\left[A(\mathrm{空}\mathrm{白}1)-A(\mathrm{空}\mathrm{白}2)\right]-\left[A(\mathrm{实}\mathrm{验})-A(\mathrm{空}\mathrm{白}3\mathrm{实}\mathrm{验})\right]}{\left[A(\mathrm{空}\mathrm{白}1)-A(\mathrm{空}\mathrm{白}2)\right]-\left[A(\mathrm{对}\mathrm{照})-A(\mathrm{空}\mathrm{白}3\mathrm{对}\mathrm{照})\right]} }$$ 采用比色法检测细胞的CAT水平,根据试剂盒说明书,首先通过检测过氧化氢溶液240 nm波长下吸光度计算试剂盒中过氧化氢溶液的准确浓度,配制250 mmol/L过氧化氢溶液和显色工作液。接下来将待检细胞用裂解液充分裂解后,收取上清液,检测蛋白浓度后用裂解液调整所有样品蛋白浓度至一致,样品加入过氧化氢检测缓冲液,混匀后先加入过氧化氢溶液,于25 ℃反应3 min,加入反应终止液,15 min后待测样品加入显色工作液,于25 ℃孵育30 min,用酶标仪于520 nm波长下检测吸光度,并计算CAT水平,计算公式如下:
$$\rm \mathrm{C}\mathrm{A}\mathrm{T}\mathrm{水}\mathrm{平}=\frac{A(\mathrm{空}\mathrm{白})-A(\mathrm{实}\mathrm{验})}{A(\mathrm{空}\mathrm{白})-A(\mathrm{对}\mathrm{照})} $$ 采用比色法检测细胞的MDA水平,根据试剂盒说明书,首先配制MDA检测工作液。接下来将待检细胞用裂解液充分裂解后,收取上清液,检测蛋白浓度后用裂解液调整所有样品蛋白浓度至一致。待测样本加入检测工作液,100 ℃条件下加热15 min,冷却后离心取上清液,用酶标仪于532 nm波长下检测吸光度,并计算MDA水平,计算公式如下:
$$\rm \mathrm{M}\mathrm{D}\mathrm{A}\mathrm{水}\mathrm{平}=\frac{A(\mathrm{实}\mathrm{验})-A(\mathrm{空}\mathrm{白})}{A(\mathrm{对}\mathrm{照})-A(\mathrm{空}\mathrm{白})} $$ 1.2.5 生物信息学分析
通过SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)对20-HE潜在的靶蛋白进行预测,选取Probability值>0的基因进行分析[14]。通过GeneCards数据库(https://www.genecards.org/)获取肝损伤(liver injury)的疾病相关基因,根据Score值选取排名前1000位的基因进行分析[15]。两组基因取交集,结果用Venn图展示(https://bioinfogp.cnb.csic.es/tools/venny/index.html)。KEGG信号通路富集分析用DAVID数据库(https://david.ncifcrf.gov/)完成[16]。利用Cytoscape(3.9.1版)软件构建20-HE-靶点-信号通路网络。氧化应激相关信号通路的富集分析结果用气泡图展示(https://www.bioinformatics.com.cn)[17]。20-HE在PI3K/Akt信号通路中潜在的作用靶点用KEGG数据库中的信号通路图展示[18]。
1.2.6 Western blot检测t-Akt、p-Akt蛋白水平
采用Western blot检测PI3K/Akt信号通路标志蛋白的表达水平[19]。收集待测细胞后用裂解液进行充分裂解,用BCA法蛋白浓度测定试剂盒检测蛋白浓度。蛋白样品进行SDS-PAGE凝胶电泳。电泳后通过湿转法将凝胶上的蛋白转移至PVDF膜上,用5%BSA封闭液室温下孵育1 h,分别用相应一抗进行孵育,4 ℃条件下孵育16 h,洗膜后再孵育相应的二抗,最后用ECL显色液于显影仪中曝光显影,利用ImageJ软件(1.53e版)进行灰度值计算。Akt磷酸化水平用p-Akt/t-Akt的比值评价,β-actin用于评价整体上样体系。
1.3 数据处理
利用Prism软件(8.0.1版)统计分析模块对实验数据进行统计学分析,量化的实验数据用均数±标准差表示,数据正态性检验通过Shapiro-Wilk检验进行,多组数据的组间比较分析通过单因素方差分析(One-way ANOVA)进行,P<0.05表示差异具有统计学意义。
2. 结果与分析
2.1 20-HE对高糖诱导的HepG2细胞活力的影响
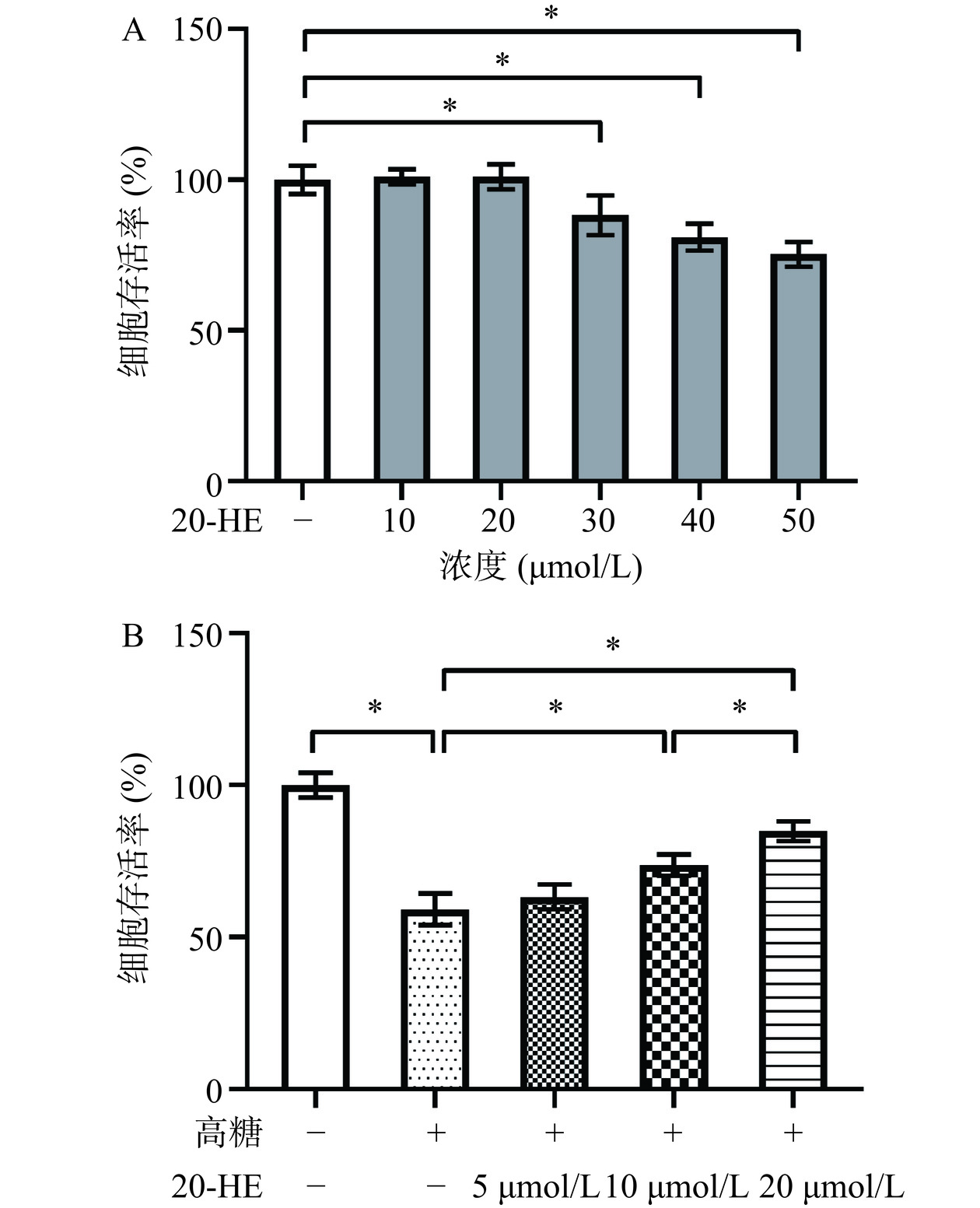
如图1A所示,当20-HE给药浓度在10和20 μmol/L时,各组的细胞存活率没有显著变化(P>0.05)。根据这一结果确定后续实验的20-HE给药浓度为20 μmol/L。如图1B所示,高糖显著降低了HepG2细胞的存活率(P<0.05),适宜浓度的20-HE可以显著提高损伤细胞的存活率(10 μmol/L组,P<0.05;20 μmol/L组,P<0.05),与10 μmol/L浓度组相比,20 μmol/L浓度组的20-HE提高细胞活力的作用更强(P<0.05)。综合以上数据说明,20-HE可以改善高糖诱导HepG2细胞的活力。
2.2 20-HE对高糖诱导的HepG2细胞凋亡的影响
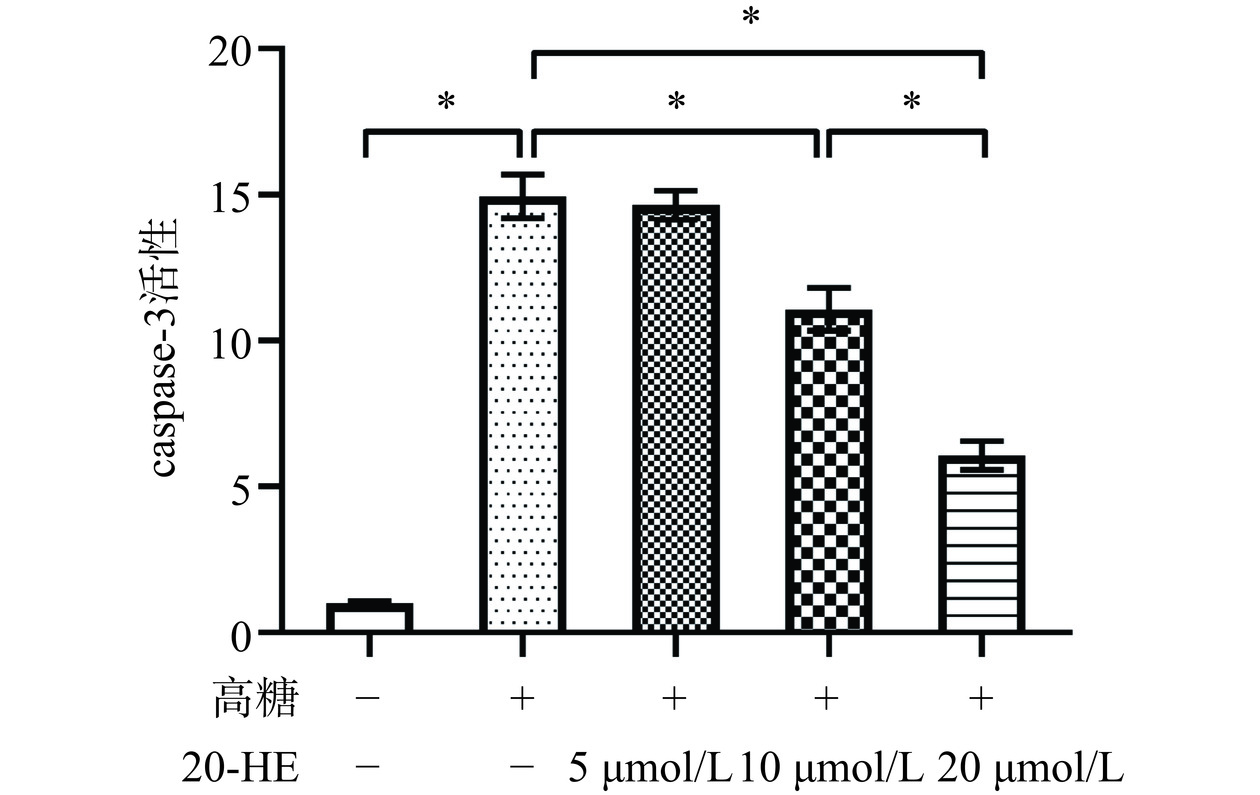
为验证20-HE对高糖诱导的HepG2细胞凋亡的作用,本研究通过caspase-3活性检测实验检测细胞的凋亡水平。如图2所示,高糖处理后,HepG2细胞的凋亡水平显著上升(P<0.05),适宜浓度的20-HE可以显著抑制损伤细胞的凋亡水平(10 μmol/L组,P<0.05;20 μmol/L组,P<0.05),与10 μmol/L浓度组相比,20 μmol/L浓度的20-HE作用更强(P<0.05)。这些数据说明,20-HE可以抑制高糖诱导HepG2细胞的凋亡。
2.3 20-HE对高糖诱导HepG2细胞中氧化应激因子水平的影响
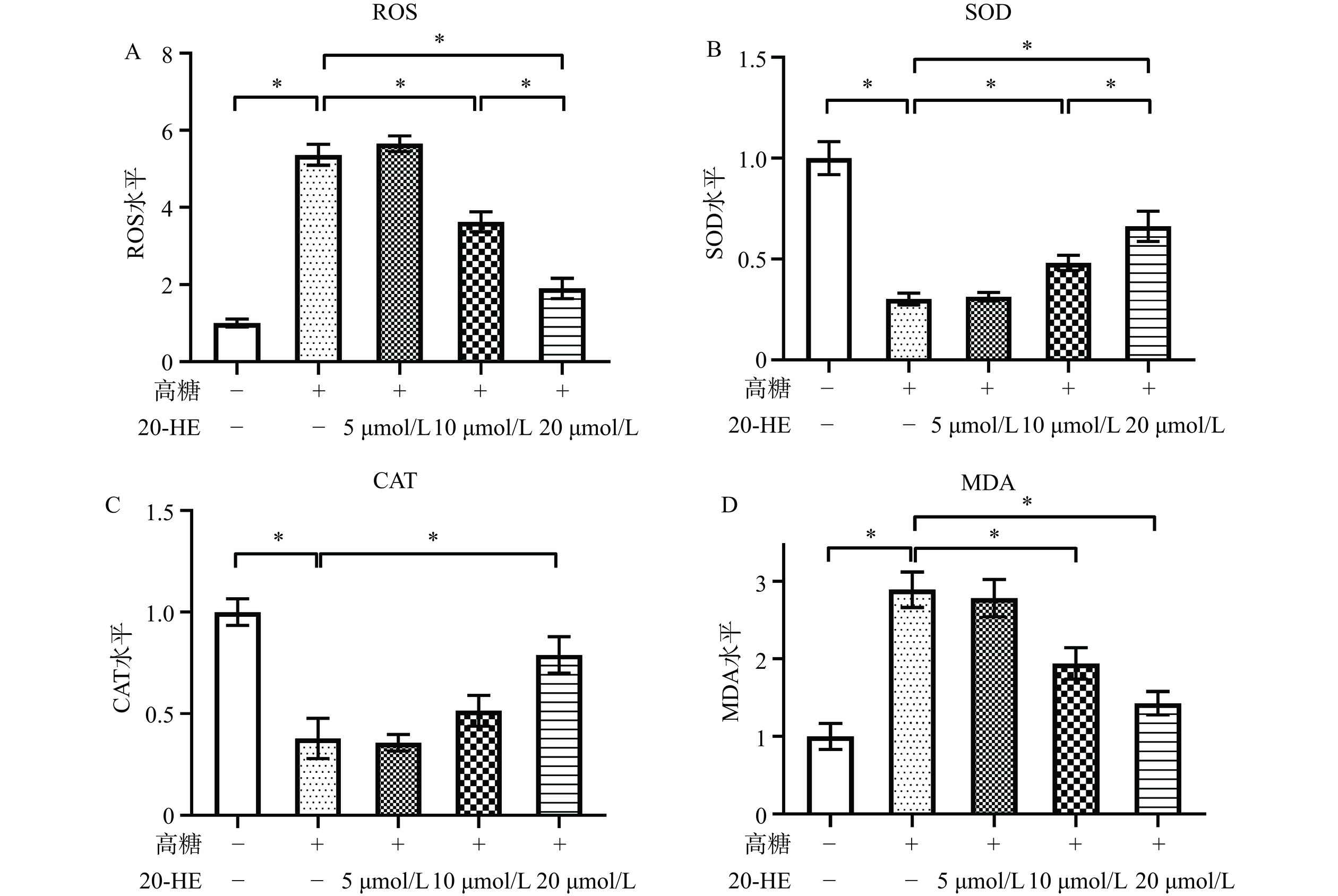
为验证20-HE对损伤细胞中ROS水平的影响,本研究通过荧光探针法检测细胞中ROS水平。如图3A所示,高糖处理显著提高了HepG2细胞的ROS水平(P<0.05),适宜浓度的20-HE可以显著降低损伤细胞的ROS水平(10 μmol/L组,P<0.05;20 μmol/L组,P<0.05),20 μmol/L浓度的20-HE作用更强(10 μmol/L组vs. 20 μmol/L组,P<0.05)。此外,本研究还通过比色法对细胞中SOD、CAT和MDA的水平进行检测。如图3B所示,高糖处理显著抑制了HepG2细胞的SOD水平(P<0.05),适宜浓度的20-HE可以显著提高损伤细胞中的SOD水平(10 μmol/L组,P<0.05;20 μmol/L组,P<0.05),20 μmol/L浓度的20-HE作用更强(10 μmol/L组vs. 20 μmol/L组,P<0.05)。与SOD的结果趋势相似,适宜浓度的20-HE可以显著提高损伤细胞中被抑制的CAT水平(图3C,20 μmol/L组,P<0.05)。MDA的检测结果显示,高糖处理显著提高了HepG2细胞的MDA水平(P<0.05),适宜浓度的20-HE可以显著抑制损伤细胞的MDA水平(图3D,10 μmol/L组,P<0.05;20 μmol/L组,P<0.05)。综合以上数据说明,20-HE可以抑制高糖诱导HepG2细胞的氧化应激。基于以上关于细胞活力、凋亡和氧化应激因子水平的检测结果,选择20 μmol/L浓度20-HE进行后续机制验证实验。
2.4 预测参与20-HE介导的调控作用的潜在信号通路
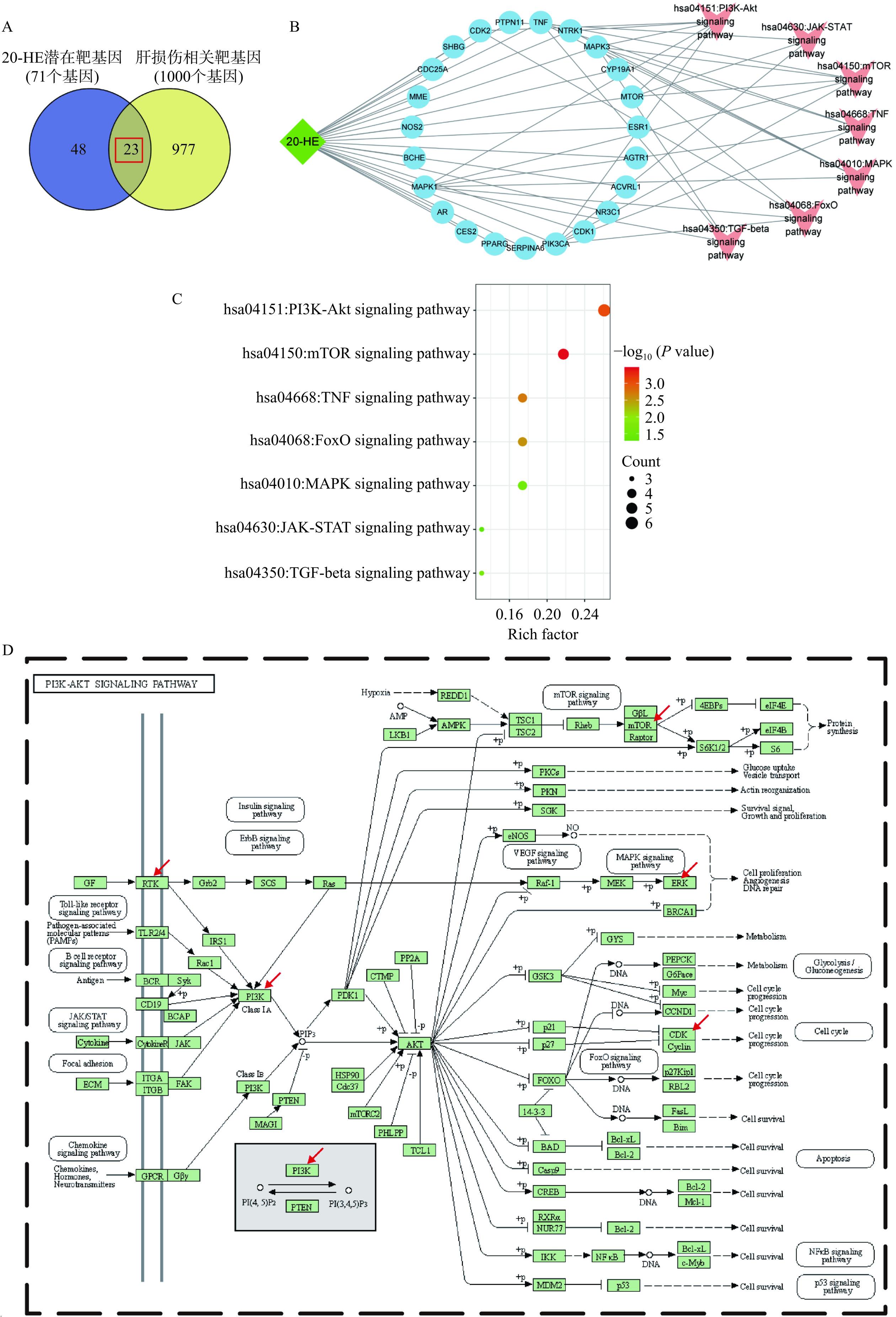
本研究基于生物信息学分析的方法对参与20-HE介导的调控作用的潜在信号通路进行预测。首先,通过SwissTargetPrediction数据库基于20-HE的分子结构对潜在作用靶蛋白进行预测,同时在GeneCards数据库中获取肝损伤相关基因,将两组基因取交集,共筛选得到23个20-HE在肝损伤中的潜在作用靶点(图4A)。接下来通过DAVID数据库对得到的基因进行信号通路相关的KEGG富集分析,筛选氧化应激相关信号通路构建20-HE-靶点-信号通路网络。如图4B所示,网络中共有31个节点,52条边,线条越多的节点代表与20-HE对肝损伤氧化应激的作用关联性越强;其中关联性强的靶点包括MAPK1、MAPK3、PIK3CA等,信号通路包括PI3K/Akt和mTOR信号通路等。如图4C所示,根据Rich factor值对相关富集的信号通路进行排序,PI3K/Akt信号通路的富集程度最高。该信号通路中的RTK和PI3K等关键蛋白可能是20-HE的作用靶点(图4D)。综合以上数据说明,PI3K/Akt信号通路可能参与了20-HE发挥的对损伤细胞的保护作用。
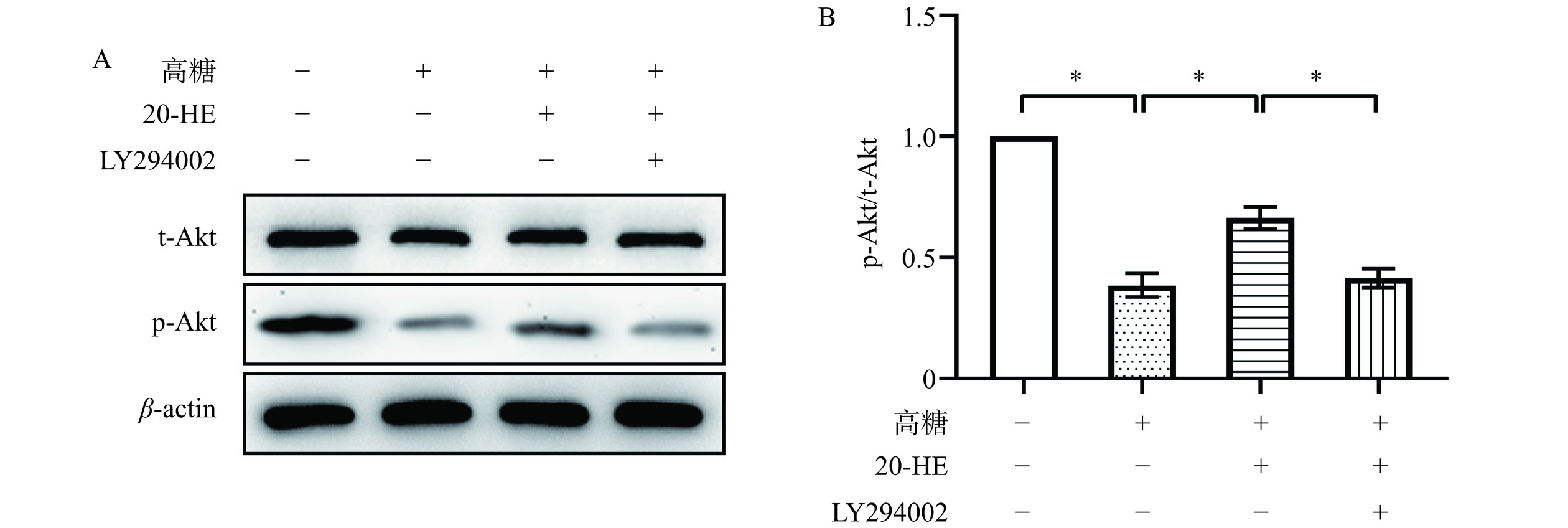
2.5 20-HE对高糖诱导HepG2细胞中PI3K/Akt信号通路的作用
为验证20-HE对损伤细胞中PI3K/Akt信号通路的影响,本研究通过Western blot(图5A)检测t-Akt和p-Akt的表达水平,以p-Akt/t-Akt的比值作为评价PI3K/Akt信号通路激活水平的指标。如图5B所示,高糖处理显著下调了HepG2细胞中p-Akt/t-Akt的比值(P<0.05),20-HE可以显著上调损伤细胞中p-Akt/t-Akt的比值(P<0.05)。这些数据说明,20-HE可以激活损伤细胞中被抑制的PI3K/Akt信号通路。接下来,本研究利用PI3K/Akt信号通路抑制剂(LY294002)进一步验证该信号通路是否参与了20-HE介导的调控作用。如图5B所示,LY294002可以显著抑制PI3K/Akt信号通路的水平(P<0.05),逆转20-HE对损伤细胞中该信号通路的激活。
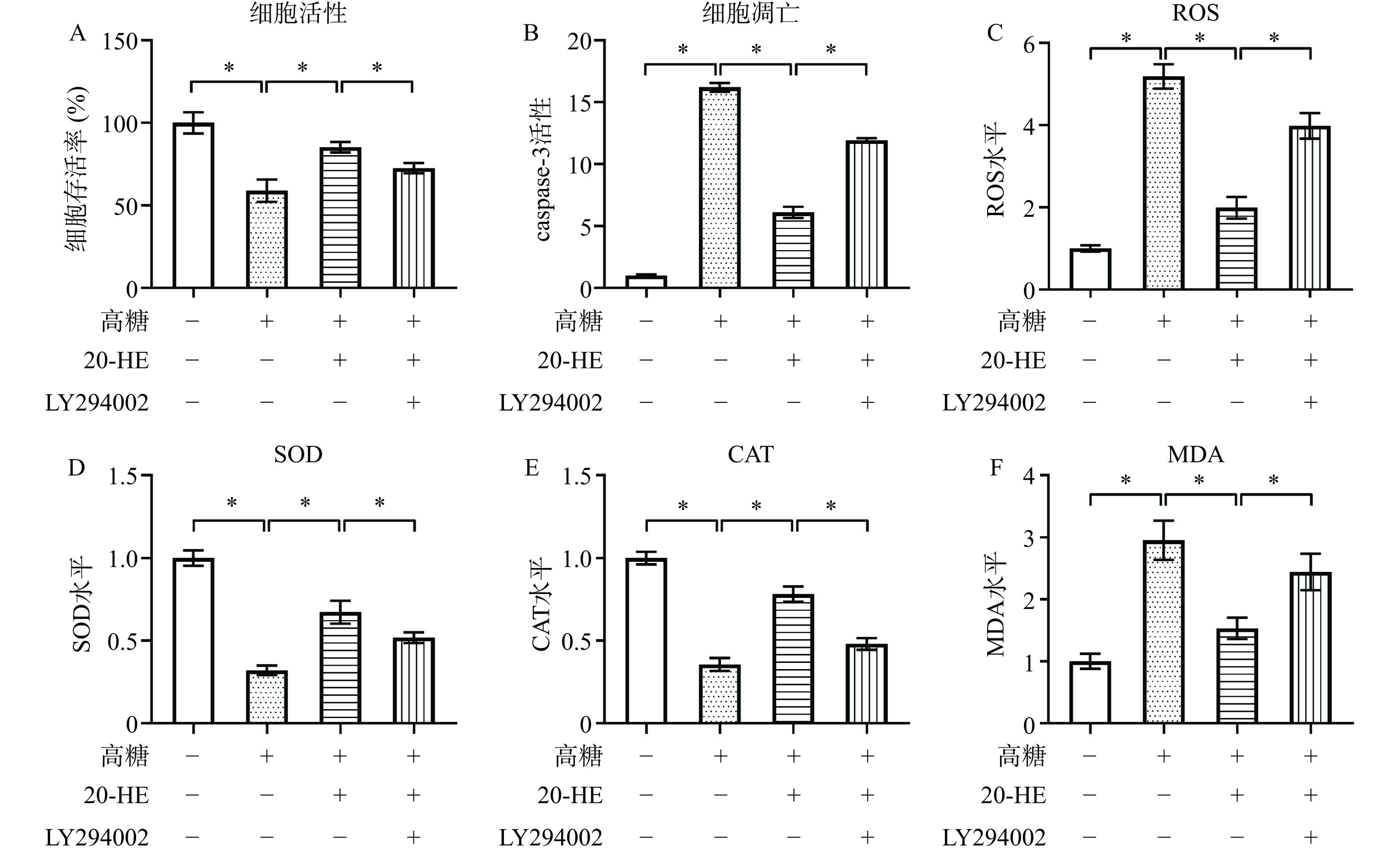
2.6 PI3K/Akt信号通路在20-HE对损伤细胞调控中的作用机制
在细胞活力方面,如图6A所示,LY294002可以显著逆转20-HE对损伤细胞活力的改善(P<0.05)。在细胞凋亡方面,如图6B所示,LY294002可以显著逆转20-HE对损伤细胞凋亡的抑制(P<0.05)。与这些结果趋势相似,在氧化应激相关因子方面,LY294002可以显著逆转20-HE对高糖诱导HepG2细胞中ROS(图6C,P<0.05)、SOD(图6D,P<0.05)、CAT(图6E,P<0.05)和MDA(图6F,P<0.05)水平的调控。综合以上数据说明,20-HE可以通过激活PI3K/Akt信号通路对高糖诱导的HepG2细胞氧化损伤发挥保护作用。
3. 讨论
近年来,越来越多天然活性成分的肝细胞损伤保护作用被不断发现[20−21]。本研究以20-HE作为研究对象,利用高糖诱导建立HepG2细胞氧化损伤模型,用20-HE对损伤细胞进行处理,通过检测细胞活力、凋亡和氧化应激因子(ROS、SOD、CAT和MDA)水平验证20-HE对损伤细胞的保护作用。20-HE对HepG2毒性作用的实验结果表明,20-HE的给药浓度超过30 μmol/L会抑制HepG2细胞的活力。基于这一结果,选择无细胞毒性浓度(5、10和20 μmol/L)进行后续实验的给药。建模的结果显示,高浓度葡萄糖(50 mmol/L)显著抑制了HepG2细胞的活力、促进细胞的凋亡并促进氧化应激反应,高糖诱导HepG2氧化损伤模型建立成功。Subramaniyan等[13]的研究中也发现50 mmol/L浓度的葡萄糖处理24 h可以导致HepG2细胞的存活率的显著下降,同时高糖处理可以上调ROS和MDA的水平。但用于HepG2氧化损伤模型建立的高糖浓度仍存在争议,Ding等[22]在一项探究鞣花酸生物活性的研究中使用30 mmol/L浓度葡萄糖构建HepG2细胞氧化损伤模型,同样得到氧化应激被显著促进的实验结果。推测这些差异可能由于所使用细胞状态的不同所导致,状态良好的细胞对氧化应激的发生、发展以及导致的损伤都具有更强的抵抗能力,因此在具体实验中研究者需要根据所使用细胞的状态和相关表型的检测结果调整高糖的浓度。
本研究结果表明,20-HE在5 μmol/L浓度下对损伤细胞的活力、凋亡和氧化应激因子水平没有显著作用。当20-HE给药浓度提高至10 μmol/L和20 μmol/L,其可以显著改善损伤细胞的活力、凋亡和氧化应激因子水平。细胞活力、凋亡、ROS和SOD水平检测实验结果表明,20 μmol/L浓度的20-HE对损伤细胞的保护作用更强。而CAT水平检测结果表明,只有20 μmol/L浓度20-HE表现出对CAT水平的显著改善作用。因此,如何降低20-HE的有效作用浓度,提高HepG2氧化损伤模型对20-HE的敏感性是未来研究的方向之一。既往的研究表明,20-HE具有抗氧化损伤作用。Li等[23]在小麦幼苗氧化损伤模型中的研究结果表明,20-HE可以抑制氧化应激,降低MDA水平,提高SOD和CAT水平。而Hu等[24]在氧化氢诱导神经元损伤模型中的研究结果表明,20-HE可以抑制损伤神经元的氧化应激,减少ROS和MDA的生成。本研究结果表明,20-HE对高糖诱导HepG2氧化损伤具有保护作用。这些研究结果结提示20-HE可能具有广泛的抗氧化损伤作用。但一项关于家蚕化蛹过程的研究结果表明,20-HE会促进化蛹过程中超氧化物的产生,抑制SOD的水平[25]。分析原因,可能在不同的物种或生物学过程中,20-HE对氧化应激的作用也有所不同。因此,仍需要更广泛的研究验证20-HE对氧化应激的调控作用。
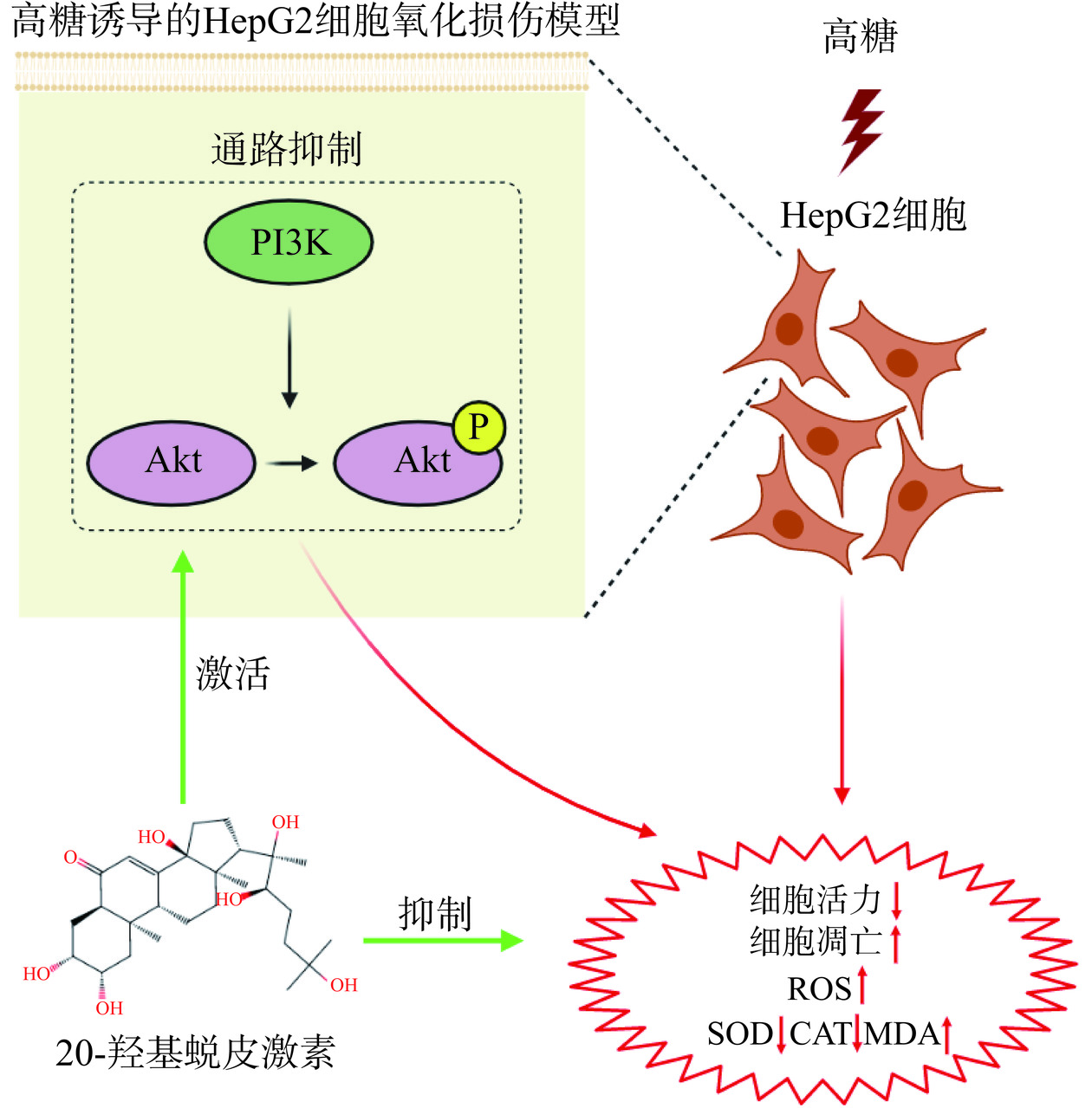
本研究在验证20-HE对高糖诱导HepG2细胞氧化损伤具有保护作用的基础上,进一步通过生物信息学分析的方法对其下游的机制进行预测,氧化应激相关信号通路的富集分析结果表明PI3K/Akt信号通路的富集程度最高,实验结果也表明,20-HE可以激活损伤细胞中被抑制的PI3K/Akt信号通路。既往的一项研究结果也表明,20-HE可以激活胰岛β细胞的PI3K/Akt信号通路[26]。因此,推测20-HE可能对PI3K/Akt信号通路具有广泛的激活作用。PI3K/Akt信号通路的抑制与氧化损伤的发生密切相关。Wang等[27]的研究结果表明PRUNE2可以通过激活PI3K/Akt信号通路抑制缺滋养层细胞损伤模型中的氧化应激。另一项在大鼠脑损伤模型中的研究则表明重组人红细胞生成素可以通过激活PI3K/Akt信号通路增强神经细胞的抗氧化能力,减少神经元的凋亡[28]。本研究结果表明,20-HE通过激活PI3K/Akt信号通路发挥对高糖诱导HepG2细胞氧化损伤的保护作用,改善损伤细胞的活力、凋亡和氧化应激因子水平(图7)。但PI3K/Akt信号通路是否广泛参与不同物种组织细胞的氧化应激反应仍有待实验验证。此外,既往的研究证明20-HE对mTOR[29]、FoxO[30]和MAPK[31]信号通路具有调控作用。本研究结果表明以上信号通路可能参与了20-HE对高糖诱导HepG2细胞氧化损伤的保护作用,但仍需进一步的实验验证。
4. 结论
20-HE通过激活PI3K/Akt信号通路,在高糖环境中对HepG2细胞的氧化损伤起到了显著的保护作用。这些研究结果不仅为糖尿病引发的肝损伤的防治提供了新的思路,还进一步拓展了对20-HE生物活性及其相关分子机制的理解。然而,尽管课题组初步揭示了20-HE的保护机制,但其在高糖诱导的HepG2细胞氧化损伤中的具体作用机制仍需深入研究。这将为全面理解20-HE的潜在治疗价值提供重要依据,为推动相关临床应用的发展提供数据。
-
-
[1] LIU J L, LIU M, CHAI Z L, et al. Projected rapid growth in diabetes disease burden and economic burden in China:A spatio-temporal study from 2020 to 2030[J]. The Lancet Regional Health-Western Pacific,2023,33:100700. doi: 10.1016/j.lanwpc.2023.100700
[2] KUMAR S, DUAN Q H, WU R X, et al. Pathophysiological communication between hepatocytes and non-parenchymal cells in liver injury from NAFLD to liver fibrosis[J]. Advanced Drug Delivery Reviews,2021,176:113869. doi: 10.1016/j.addr.2021.113869
[3] EKTA, GUPTA M, KAUR A, et al. Pathobiological and molecular connections involved in the high fructose and high fat diet induced diabetes associated nonalcoholic fatty liver disease[J]. Inflammation Research,2020,69(9):851−867. doi: 10.1007/s00011-020-01373-7
[4] RAHAMAN M M, HOSSAIN R, HERRERA-BRAVO J, et al. Natural antioxidants from some fruits, seeds, foods, natural products, and associated health benefits:An update[J]. Food Science & Nutrition,2023,11(4):1657−1670.
[5] 胡一晨, 赵钢, 秦培友, 等. 藜麦活性成分研究进展[J]. 作物学报, 2018, 44(11):1579−1591. [HU Y C, ZHAO G, QIN P Y, et al. Research progress on bioactive components of Quinoa (Chenopodium quinoa Willd.) [J]. Acta Agronomica Sinica, 2018, 44(11):1579−1591.] HU Y C, ZHAO G, QIN P Y, et al. Research progress on bioactive components of Quinoa (Chenopodium quinoa Willd.) [J]. Acta Agronomica Sinica, 2018, 44(11): 1579−1591.
[6] KIZELSZTEIN P, GOVORKO D, KOMARNYTSKY S, et al. 20-Hydroxyecdysone decreases weight and hyperglycemia in a diet-induced obesity mice model[J]. American Journal of Physiology-Endocrinology and Metabolism,2009,296(3):E433−E439. doi: 10.1152/ajpendo.90772.2008
[7] PLOTNIKOV M B, ZIBAREVA L N, VASIL'EV A S, et al. Antihyperglycaemic, haemorheological and antioxidant activities of Lychnis chalcedonica L. extract in a streptozotocin-induced rat model of diabetes mellitus[J]. Journal of Complementary & Integrative Medicine,2019,17(2):jcim−2017-0028.
[8] SHUVALOV O, KIRDEEVA Y, FEFILOVA E, et al. 20-Hydroxyecdysone confers antioxidant and antineoplastic properties in human non-small cell lung cancer cells[J]. Metabolites,2023,13(5):656. doi: 10.3390/metabo13050656
[9] SOUZA L, DA FONSECA S, FERRARI A, et al. β-ecdysone content and antioxidant capacity in different organs of Brazilian ginseng[J]. Ciencia Rural,2021,51(5):e20200618. doi: 10.1590/0103-8478cr20200618
[10] WANG J C, HU K L, CAI X Y, et al. Targeting PI3K/AKT signaling for treatment of idiopathic pulmonary fibrosis[J]. Acta Pharmaceutica Sinica B,2022,12(1):18−32. doi: 10.1016/j.apsb.2021.07.023
[11] LIU S H, JIA Y B, MENG S R, et al. Mechanisms of and potential medications for oxidative stress in ovarian granulosa cells:A review[J]. International Journal of Molecular Sciences,2023,24(11):9205. doi: 10.3390/ijms24119205
[12] RAI S N, DILNASHIN H, BIRLA H, et al. The role of PI3K/Akt and ERK in neurodegenerative disorders[J]. Neurotoxicity Research,2019,35(3):775−795. doi: 10.1007/s12640-019-0003-y
[13] SUBRAMANIYAN S D, NATARAJAN A K. Citral, A monoterpene protect against high gucose induced oxidative injury in HepG2 cell in vitro-an experimental study[J]. Journal of Dlinical and Diagnostic Research:JCDR,2017,11(8):BC10−BC15.
[14] DAINA A, MICHIELIN O, ZOETE V. Swiss target prediction:Updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Research,2019,47(W1):W357−W364. doi: 10.1093/nar/gkz382
[15] STELZER G, ROSEN N, PLASCHKES I, et al. The GeneCards suite:From gene data mining to disease genome sequence analyses[J]. Current Protocols in Bioinformatics, 2016, 54:1−33.
[16] SHERMAN B T, HAO M, QIU J, et al. DAVID:a web server for functional enrichment analysis and functional annotation of gene lists (2021 update)[J]. Nucleic Acids Research,2022,50(W1):W216−W221. doi: 10.1093/nar/gkac194
[17] TANG D D, CHEN M J, HUANG X H, et al. SRplot:A free online platform for data visualization and graphing[J]. PloS one,2023,18(11):e0294236. doi: 10.1371/journal.pone.0294236
[18] KANEHISA M, SATO Y. KEGG Mapper for inferring cellular functions from protein sequences[J]. Protein Science,2020,29(1):28−35. doi: 10.1002/pro.3711
[19] LI S L, YI Z J, DENG M H, et al. TSLP protects against liver I/R injury via activation of the PI3K/Akt pathway[J]. Jci Insight,2019,4(22):e129013. doi: 10.1172/jci.insight.129013
[20] 赵悦竹, 金鑫, 张屿楠, 等. 芦荟多糖对D-半乳糖致HepG2细胞氧化损伤的保护作用[J]. 食品工业科技,2023,44(1):405−412. [ZHAO Y Z, JIN X, ZHANG Y N, et al. Protective effect of aloe polysaccharide on oxidative stress injury of HepG2 cells induced by D-galactose[J]. Science and Technology of Food Industry,2023,44(1):405−412.] ZHAO Y Z, JIN X, ZHANG Y N, et al. Protective effect of aloe polysaccharide on oxidative stress injury of HepG2 cells induced by D-galactose[J]. Science and Technology of Food Industry, 2023, 44(1): 405−412.
[21] 鲁亚君, 刘莹, 王益, 等. 莲壳多酚对T-BHP致HepG2氧化应激损伤的保护作用[J]. 食品工业科技,2023,44(12):397−404. [LU Y J, LIU Y, WANG Y, et al. Protective effects of polyphenol of lotus seed epicarp on oxidative stress damage induced by T-BHP[J]. Science and Technology of Food Industry,2023,44(12):397−404.] LU Y J, LIU Y, WANG Y, et al. Protective effects of polyphenol of lotus seed epicarp on oxidative stress damage induced by T-BHP[J]. Science and Technology of Food Industry, 2023, 44(12): 397−404.
[22] DING X Q, JIAN T Y, WU Y X, et al. Ellagic acid ameliorates oxidative stress and insulin resistance in high glucose-treated HepG2 cells via miR-223/keap1-Nrf2 pathway[J]. Biomedicine & Pharmacotherapy,2019,110:85−94.
[23] LI J T, HAN X P, TANG L, et al. 20-Hydroxyecdysone protects wheat seedlings from salt stress[J]. Archives of Biological Sciences,2018,70(2):379−386. doi: 10.2298/ABS170722056L
[24] HU J, LUO C X, CHU W H, et al. 20-Hydroxyecdysone protects against oxidative stress-induced neuronal injury by scavenging free radicals and modulating NF-κB and JNK pathways[J]. PLoS One,2012,7(12):e50764. doi: 10.1371/journal.pone.0050764
[25] NOJIMA Y, BONO H, YOKOYAMA T, et al. Superoxide dismutase down-regulation and the oxidative stress is required to initiate pupation in Bombyx mori[J]. Scientific Reports,2019,9(1):14693. doi: 10.1038/s41598-019-51163-3
[26] HU J N, FENG Y, LI B L, et al. Identification of quality markers for Cyanotis arachnoidea and analysis of its physiological mechanism based on chemical pattern recognition, network pharmacology, and experimental validation[J]. PeerJ,2023,11:e15948. doi: 10.7717/peerj.15948
[27] WANG J, ZHAO Y P. Knockdown of PRUNE2 alleviates hypoxia-induced oxidative stress inhibits cell proliferation in trophoblast cells, and reverses LY294002-induced PI3K/AKT pathway inhibition[J]. Tropical Journal of Pharmaceutical Research,2023,22(2):305−311. doi: 10.4314/tjpr.v22i2.12
[28] WANG H Q, CHEN M, ZHANG T, et al. Recombinant human erythropoietin upregulates PPARγ through the PI3K/Akt pathway to protect neurons in rats subjected to oxidative stress[J]. European Journal of Neuroscience,2022,56(3):4045−4059. doi: 10.1111/ejn.15735
[29] ROMANIUK-DRAPALA A, LISIAK N, TOTON E, et al. Proapoptotic and proautophagic activity of 20-hydroxyecdysone in breast cancer cells in vitro[J]. Chemico-Biological Interactions,2021,342:109479. doi: 10.1016/j.cbi.2021.109479
[30] CAI M J, ZHAO W L, JING Y P, et al. 20-hydroxyecdysone activates Forkhead box O to promote proteolysis during Helicoverpa armigera molting[J]. Development,2016,143(6):1005−1015.
[31] JIAN C X, LIU X F, HU J, et al. 20-hydroxyecdysone-induced bone morphogenetic protein-2-dependent osteogenic differentiation through the ERK pathway in human periodontal ligament stem cells[J]. European Journal of Pharmacology,2013,698(1−3):48−56. doi: 10.1016/j.ejphar.2012.07.044





 下载:
下载:
 下载:
下载:



