Research Progress on the Preparation, Debitterness and Biological Activity of Rice Protein Peptides
-
摘要: 大米蛋白肽因具有高营养价值、高消化率、低过敏性和多种生理调节作用,而受到国内外研究学者的普遍关注。本文结合近年来大米蛋白肽的研究进展,综述了大米蛋白肽的制备方法、分离纯化技术和苦味改善策略等相关研究结果,总结了大米蛋白肽的抗氧化、降血压、免疫调节和降血糖等生物活性,介绍了其在食品领域的应用前景,并对未来的研究方向进行了展望,旨在为大米蛋白肽的开发和实际生产运用提供理论依据。Abstract: Rice protein peptide has been widely concerned by researchers at home and abroad, because of its high nutritional value, high digestibility, hypoallergenicity and various physiological regulation functions. Based on the research progress of rice protein peptides in recent years, this paper reviews the preparation methods, separation and purification techniques and bitter taste improvement strategies of rice protein peptides. And summarizes the biological activities of rice protein peptides such as antioxidant, blood pressure lowering, immunomodulatory and hypoglycemic activities, introduces its application prospect in the field of food, and prospects the future research direction. The aim is to provide theoretical basis for the development and practical production of rice protein peptide.
-
中国是世界上稻谷产量最丰富的国家,据国家统计局统计,中国2023年稻谷产量高达2.066亿吨。大米蛋白是对来自稻谷中的蛋白质的总称,约占稻谷质量的8%,是稻谷中第二丰富的成分,主要来源为大米淀粉加工副产物、大米淀粉糖浆加工副产物和米糠。大米蛋白是一种优质营养的植物蛋白,具有高营养价值、高消化率和低过敏性等特点,其生物价为77,远高于小麦蛋白(67)和玉米蛋白(60)等常见谷类植物蛋白,可以和酪蛋白(73)、乳清蛋白(104)等动物蛋白相媲美[1−3]。另外,赖氨酸作为大米蛋白等谷类植物蛋白的第一限制性氨基酸,其含量高达38 mg/g蛋白质,远超玉米蛋白(25 mg/g蛋白质)和小麦蛋白(23 mg/g蛋白质),这使大米蛋白具有合理的氨基酸配比[1−2]。此外,大米蛋白还具有多种生理调节作用,例如降胆固醇、抗癌变和降血糖等功效[4]。目前,科研学者对大米蛋白展开了一系列研究,使其在食品添加剂、高蛋白营养粉、含蛋白饮品、可食用性涂膜、生物活性肽等方面得到了广泛应用[5]。
2017年,国家发展改革委员会提出鼓励研究开发功能性蛋白和生物活性肽;且在《2023研究前沿》报告中,食物蛋白生物活性肽的结构与功能的研究被评为农业科学、植物学和动物学领域的Top10前沿热点,表明肽的生物活性研究与开发是发展趋势。肽是一类优质蛋白来源,适合多种人群补充蛋白质,其不仅具有易消化吸收、低致敏性、低渗透压和高溶解性等优点,还具有多种生理调节作用。并且在GB 29922-2013《食品安全国家标准 特殊医学用途配方食品通则》和GB 24154-2015《食品安全国家标准 运动营养食品通则》中均指出,肽类可在食品中作为一种蛋白质来源被推荐使用。由此可见,肽类具有较高的实际应用价值。大米蛋白肽是以米渣、米糠或大米蛋白等为原料制成的相对分子质量低于10 kDa的肽混合物,属于高附加值产品,具有高营养、易吸收、抗氧化、降血压、免疫调节和抗疲劳等多种生物活性[6]。为了解近年来大米蛋白肽的研究进展,本文介绍了大米蛋白肽的制备方法、分离纯化技术、苦味改善、生物活性以及在健康食品领域的应用前景,以期为大米蛋白肽的制备和生物活性研究提供一定的借鉴。
1. 大米蛋白肽的制备与分离纯化
1.1 大米蛋白肽的制备
植物源多肽的制备方法主要有直接提取法、化学合成法、酸碱水解法、微生物发酵法和酶水解法。直接提取法存在化学试剂消耗大、污染环境、设备成本高等缺点,同时天然多肽的量较少,提取率低,难以满足人们的需求,故实际生产上应用限制较多[7]。化学合成法虽能定向合成目的肽,但存在成本较高、副反应多、收益率低等问题,通常不应用于实际的工业生产[8]。酸碱水解法不仅反应难以控制,而且会产生致癌性和毒性物质,破坏氨基酸,造成营养损失,故也难以用于实际生产[9]。微生物发酵法制备的多肽具有口感好、成本低、产率高等优点,但也存在发酵时间长和易受微生物污染等安全性问题,对生产环境和工艺要求较高。而酶水解法具有绿色安全、水解易控制、生产条件温和、生产成本低和易规模化生产等特点,故在实际生产和研究中应用最广[10]。因此,在健康食品领域,大米蛋白肽的制备方法主要有酶水解法和微生物发酵法。
1.1.1 酶水解法
酶水解法更适合于大米蛋白肽的工业化生产,是目前生产和研究上最常用的方法。酶水解法制备大米蛋白肽的关键性工艺是酶解,在酶解过程中,蛋白酶按其特异的酶切位点作用于蛋白质分子,将其切割成不同的肽段。故蛋白酶的选择至关重要,不同的酶其酶活化中心、水解专一性不同,酶解形成的肽段长短、序列和功能特性等不同,如胰蛋白酶是一种特异性蛋白酶,可以对精氨酸和赖氨酸的羧基末端进行高效水解[11]。且即便是相同的酶,不同的酶解条件也会导致水解效率不同。
熊尉杰[12]以米渣蛋白为底物,研究了碱性蛋白酶、中性蛋白酶、胃蛋白酶和胰蛋白酶四种酶对其酶解能力,研究结果发现碱性蛋白酶酶解效果最好,蛋白提取率(48.5%)和水解度(9.44%)最高。Onsaard等[13]利用碱性蛋白酶、风味蛋白酶和α-胰凝乳蛋白酶对提取的米糠蛋白进行酶解,发现α-胰凝乳蛋白酶组的酶解度(44%)高于其他蛋白酶组,而碱性蛋白酶组的总必需氨基酸(134.65 mg/kg)含量最高。单独使用一种蛋白酶酶解制备大米蛋白肽,存在酶解时间长、效率低和酶的作用位点单一等缺点。
为了克服单一酶解法的不足,科研学者提出采用两种酶甚至多种酶组合酶解,这一方法不仅能够提高酶解效率,缩短酶解时间,还能提高蛋白肽得率。徐珍珍等[14]采用碱性蛋白酶与蛋白酶B复合来酶解大米蛋白,制备得到蛋白回收率(43.9%)高、肽含量(80.3%)高、风味较好的大米蛋白肽。杨亚强[15]对比了胰蛋白酶、中性蛋白酶和风味蛋白酶三种酶按不同比例复配酶解米渣蛋白制备大米蛋白肽的效果,研究发现胰蛋白酶与中性蛋白酶和风味蛋白酶的复配比例为2:5:1时结果最好,水解度、蛋白回收率和短肽含量分别为15.22%、46.53%、86.00%,氨基酸配比也合理。
另有研究发现,即使是相同的两种酶,不同的酶解路线制备的蛋白肽的性质也会有所差异。目前关于大米蛋白肽的研究较少,李铃东等[16]对双酶不同酶解路线制备的大米蛋白肽进行研究,结果表明不同的酶解路线会影响大米蛋白肽的蛋白回收率、水解度、基本成分、微观结构、肽含量、氨基酸组成、风味和抗氧化活性。而在其他蛋白肽上有较多研究,如宋永康等[17]对豆粕蛋白进行双酶分步和同步酶解,研究发现分步酶解的水解度、蛋白质利用率、多肽得率和寡肽得率高于同步酶解。王宇飞[18]对小麦醇溶蛋白进行双酶不同路线酶解,研究发现同步酶解降低小麦醇溶蛋白致敏性效果更佳。
1.1.2 微生物发酵法
微生物发酵法的实质是微生物生长产生的蛋白酶在起作用,通过微生物蛋白酶的作用将蛋白质水解成长短不一的肽段。与酶水解法相比,微生物发酵法将微生物产酶和酶解合二为一,省去了蛋白酶的分离提纯步骤,降低了成本。微生物发酵法制备大米蛋白肽的关键工艺包括生产菌种、发酵和后提取,其中生产菌种是关键,如何诱变选育高产菌株是重点。
廖卢艳等[19]以米渣为原料,采用枯草芽孢杆菌发酵制备的肽产物具有较强的还原能力,肽产物浓度为1 mg/mL时还原力为1.907。魏明等[20]利用米曲霉对米糠进行发酵制备米糠肽,其多肽含量为128.4 mg/g,且对羟基自由基具有较佳的清除能力,当多肽浓度为2.5 mg/mL时,对羟基自由基的清除率达86.2%。刘颖等[21]采用枯草芽孢杆菌和黑曲霉复合发酵米糠制备ACE抑制肽,制得肽的ACE抑制活性高达64.48%。然而微生物代谢机理复杂,还会产生大量的初级代谢产物和次级代谢产物,使得蛋白质水解产物的分离纯化难度进一步加大[9],因此微生物发酵法的大规模工业化应用面临较大的挑战。
1.2 大米蛋白肽的分离纯化
在大米蛋白肽的制备过程中,将水解得到的肽从溶液体系中分离出来是提高纯度的关键步骤。以酶解法来说,大米蛋白经蛋白酶酶解后,溶液中除含有目标产物肽以外,还有一些未酶解完全的不溶性蛋白和其他不溶性固形物,以及一些可溶性盐。通过简单的离心可以去除溶液中的不溶性蛋白和其他杂质,这一工艺在实验室常用的为落地式离心机,工业生产上常用的有卧式离心机、碟式离心机和管式离心机。离心是大米蛋白肽制备中必不可少的分离技术,实现了大米蛋白肽溶液的粗分离。除了最基础的离心之外,大米蛋白肽的分离纯化技术主要包括膜分离技术和色谱分离技术。
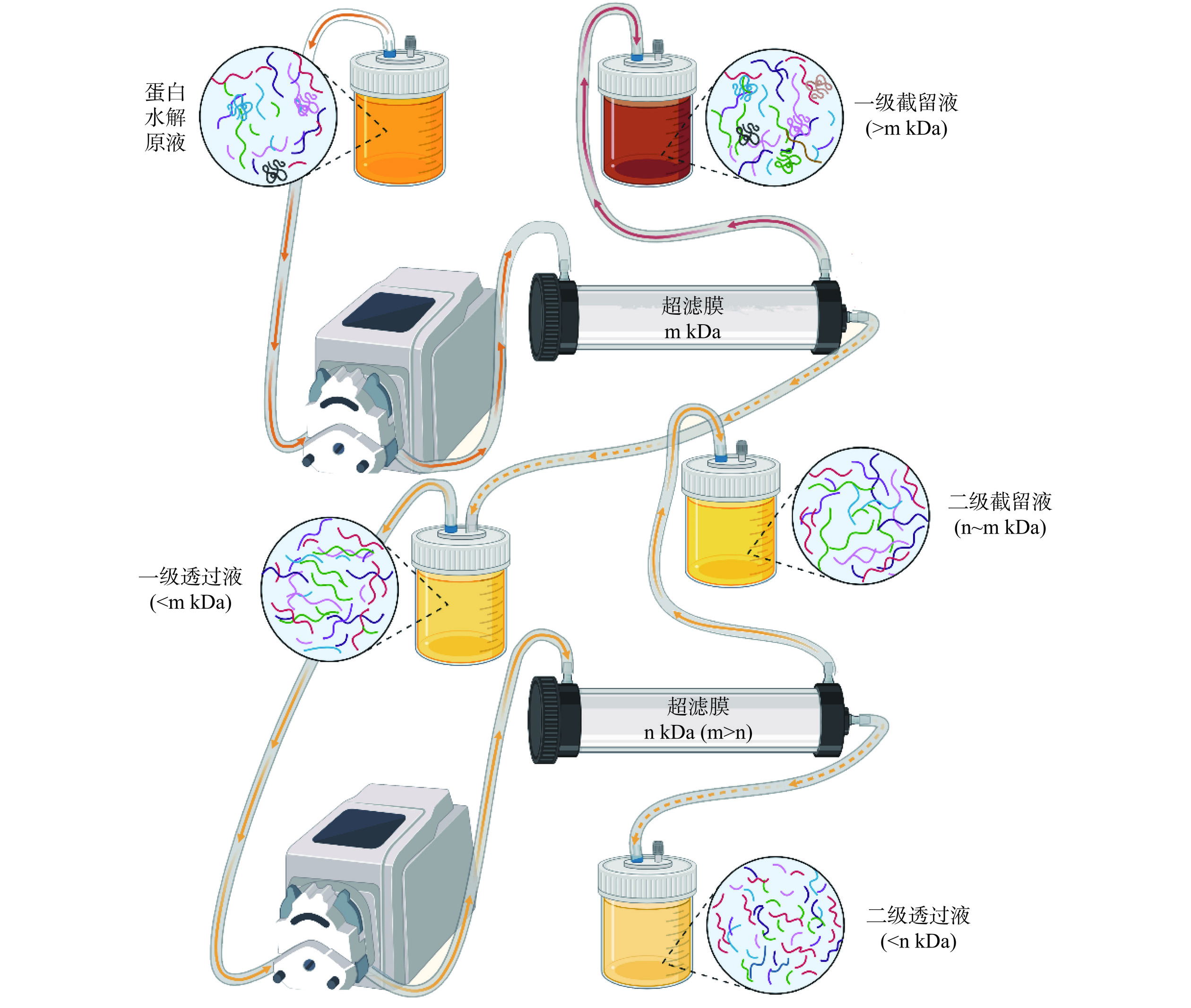
膜分离技术是不同粒径分子的混合物在压力差、浓度差和电位差等外界能量位差推动下通过半透膜,从而使其分离、分级、提纯或富集。按照推动力和分离膜孔径的不同可以将膜分离技术分为:微滤、超滤、纳滤、反渗透和电渗析等。膜分离通常在常温下进行,无相态变化、无化学变化、选择性好、适应性强,因而是一种兼备节能、高效、简单、易于操作等特点的高新技术,被公认为是未来最有发展前景的技术之一[22]。其中,超滤以其操作简单、能耗低、环保的优势被广泛应用于大米蛋白水解物或肽的分离纯化。图1为蛋白酶解产物的超滤分级流程图。在大米蛋白肽的研究中,采用超滤膜对其进行分离纯化的报道较多。蔡俊[23]采用分子截留量为3 kDa和10 kDa的超滤膜分离大米蛋白酶解液,对酶解产物及3种大米肽组分的抗氧化活性进行研究,发现分子量小于3 kDa的组分抗氧化活性最强。谯飞[24]采用分子截留量为1 kDa和3 kDa的超滤膜对大米蛋白肽进行分离,研究发现分子量截留量为1 kDa超滤膜的截留率高达89.29%。Song等[25]采用分子截留量为1 kDa和3 kDa的超滤膜对双酶法制备的大米蛋白肽进行分离,并对大米蛋白肽和各超滤组分的理化性质和体外生物活性展开研究,结果表明大米蛋白肽和各超滤组分均具有抗氧化活性、血管紧张素转换酶抑制活性、α-葡萄糖苷酶抑制活性和乙醇脱氢酶激活活性。
色谱分离技术是基于待分离物质的溶解性、电荷性、疏水性、分子量大小或亲和特异性等方面的差异而使各组分得以分离的方法。常用于大米蛋白肽分离纯化的色谱分离技术有大孔吸附树脂色谱、离子交换色谱、凝胶渗透色谱和反相高效液相色谱等,以上方法的分离纯化机理各不相同,同时也存在不同的优缺点[26]。在实际操作中,往往采用多种色谱联用来达到高度纯化的目的,表1列举了部分常用分离纯化技术的特点。Chen等[27]采用DA201-C大孔吸附树脂对大米蛋白酶解产物进行分离纯化,采用25%、50%、75%和95%的乙醇进行阶段洗脱,发现50%乙醇洗脱组分有较好的ACE抑制活性,其半抑制浓度(IC50)为0.17 mg/mL;刘晶等[28]采用SuperdexTM Peptide 10/300 GL凝胶色谱柱和Zorbax SB-C18反相高效液相色谱柱对米渣肽进行纯化,得到1条具有抗疲劳效果和高抗氧化活性的肽(Gln-Ser-Pro-Glu-Ile)。王戈莎[29]采用D201强阴离子交换树脂为载体进行大米多肽和糖的分离,最终蛋白回收率为98.2%,脱糖率为84.3%。封张萍[30]采用DA201-C大孔树脂脱盐和Sephadex G-25凝胶层析对大米ACE抑制肽进行分离纯化,得到ACE抑制率达87.07%的肽组分。
表 1 常见分离纯化技术的特点Table 1. Characteristics of common separation and purification techniques分离纯化方法 特点 主要适用范围 膜分离技术 效率高,选择性好,处理过程中样品不易失活且回收率高 初级分离,主要用于不同分子量蛋白多肽的分离 离子交换色谱 分辨率高,交换容量高,色谱可选择的条件多,蛋白多肽的回收率高 高效分离,应用广泛,只需样品在溶液中能形成离子状态 凝胶过滤色谱 实验操作简单,分离条件温和,溶质回收率高,分离过程中蛋白多肽不易变性,能根据样品分子体积大小选择填料 高效分离,通常应用在纯化工艺的后续步骤 反相高效液相色谱 分辨率高,速度快,重复性好,适用面广,灵敏度高 主要用于分子量小于5 kDa,尤其是1 kDa以下非极性多肽的分离纯化 2. 大米蛋白肽的苦味及脱除方法
市面上的蛋白肽产品多具有消费者难以接受的苦味,这是由于在加工过程中,产生了一些含有疏水性氨基酸残基的苦味肽,从而导致苦味的产生。为了解决蛋白肽的苦味,许多研究学者对苦味的影响因素展开研究,发现肽的苦味与肽的疏水性、序列、水解度和分子量等[31]有关。Ney[32]提出Q值规则来判断肽是否具有苦味,但无法判断苦味的强弱,且只适用于相对分子质量小于6 kDa的多肽。多肽Q值高于1400 kcal/mol时呈现出苦味,低于1300 kJ/mol时无苦味。更有研究表明,疏水性氨基酸在肽链末端的占比越高,肽的苦味就越强[33]。Adler-Nissen[34]指出肽的苦味与水解度的关系,在低水解度时无苦味,若继续水解,苦味将随着水解度的增加而增加,但达到某一值后,其苦味又会下降,这是因为在深度水解下,苦味肽被进一步水解成低分子量肽段或游离氨基酸,导致苦味降低。Cho等[35]研究表明肽的苦味与分子量有关,在一定范围内,肽的苦味随着分子量的下降而上升,而随着分子量的进一步降低,肽的苦味又会下降,这一结果与Adler-Nissen提出的苦味与水解度的关系一致。
大米蛋白肽作为典型的植物蛋白肽,也具有令人不适的苦味。目前,降低肽苦味的方法主要有选择性分离法、外切酶法、微生物发酵法和包埋掩盖法等[36]。选择性分离法是指采用萃取、吸附、色谱分离、等电点沉淀和超滤分离等方法来去除蛋白水解物中的疏水性苦味肽,但是该方法会去除疏水性多肽和氨基酸,导致多肽的营养价值和生物活性降低[37]。外切酶法是通过氨肽酶或羧肽酶切断多肽链末端的部分疏水性氨基酸残基实现脱苦,但此法会在脱苦的同时产生游离氨基酸[38]。微生物发酵法是通过自然界中的一些微生物来产生肽酶实现脱苦,如细菌、霉菌、酵母等均具有脱苦的效果[39],微生物可提供不同的产酶系统且自身能快速生长,具有高脱苦效率的潜力,目前研究仍在集中寻找和筛选安全合适的菌株[37]。包埋掩盖法是指在蛋白水解物中加入掩盖剂、例如β-环糊精、柠檬酸、苹果酸、甘氨酸、谷氨酸钠等。常用的β-环糊精具有亲水性外表面和疏水性内腔,通过与氨基酸之间形成包合物包裹疏水性苦味肽,以减低苦味[40]。
目前实际生产中包埋掩盖法是消除肽苦味的便捷且常用的方法,因为该方法可直接将苦味物质包埋起来,防止苦味物质溶解,避免与苦味受体相结合,干扰与神经中枢的联系,从而不表现出苦味。胡炜等[41]通过添加β-环糊精改善大米蛋白肽的苦味,研究确定β-环糊精脱苦大米蛋白肽的最佳工艺条件为:每克大米蛋白肽添加β-环糊精0.30 g,反应温度30 ℃,pH 6.0,反应时间70 min。Qin等[42]研究发现来自犬链霉菌T20的氨肽酶(ScAP)对大米肽具有显著的脱苦效果,在最佳条件下(50 ℃下,添加0.048%的ScAP反应6 h),其苦味强度评分降低了49.0%。胡勤玲等[43]利用风味酶、活性炭、β-环状糊精对大米蛋白水解液进行脱苦,研究发现这3种方法都有较好的脱苦效果。
3. 大米蛋白肽的生物活性
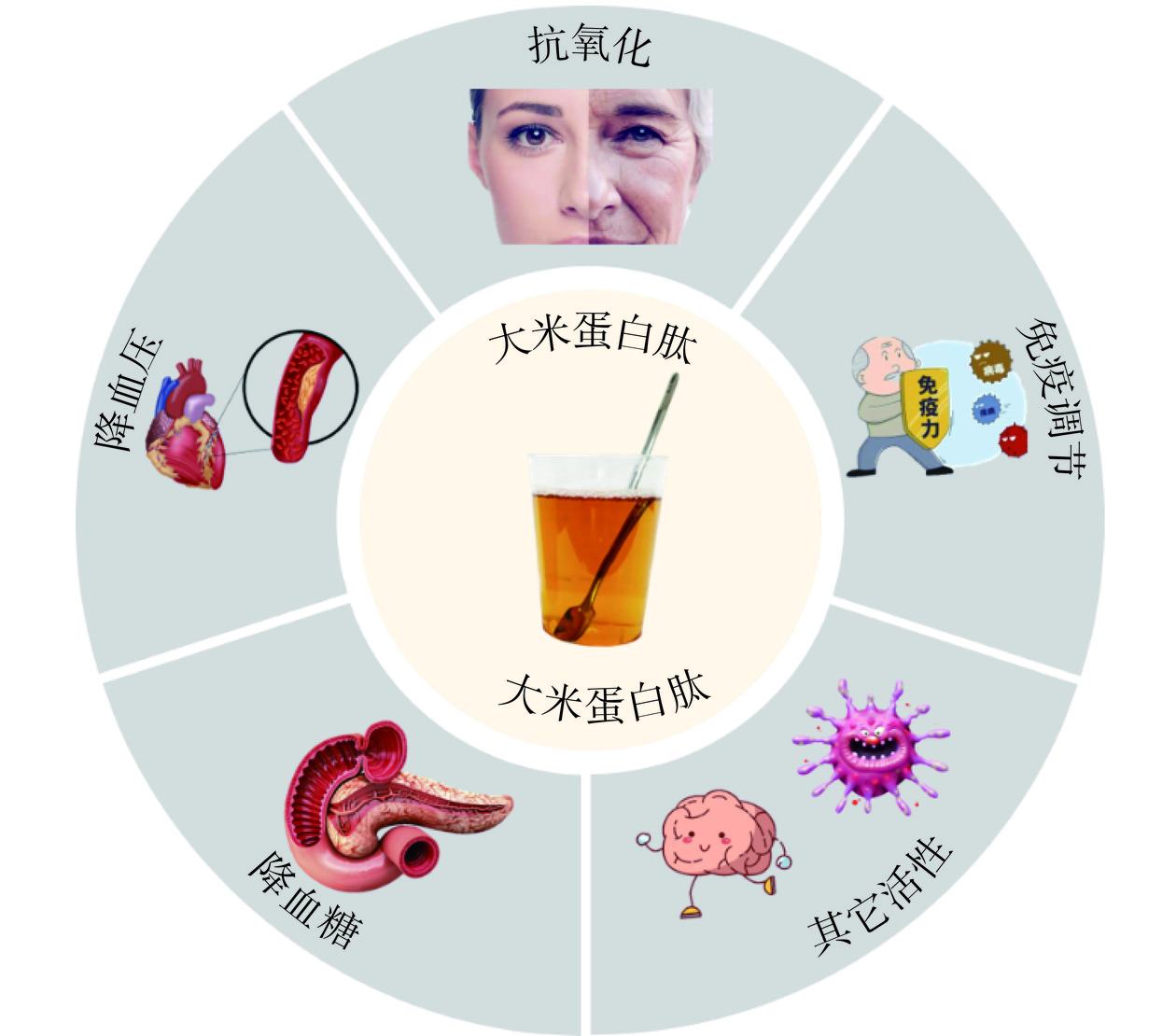
大米蛋白肽不仅能为人体提供营养,而且还具有调节机体免疫、促进矿物质吸收、清除体内过多自由基等作用,为人体预防疾病和维持健康具有重要影响。现有研究表明,大米蛋白肽具有多种生物活性,包括抗氧化、降血压、免疫调节、降血糖、抗疲劳和抗癌变等(图2)。
3.1 抗氧化
当人体自由基产生量大于自身清除自由基能力时,会发生氧化应激反应,过量的自由基会造成氧化损伤,氧化损伤与衰老、癌症、心脑血管疾病、阿尔茨海默氏症等神经性退行疾病息息相关[44]。大量研究表明,大米蛋白肽具有较好的抗氧化能力,能清除自由基和螯合金属离子等。有学者研究了不同来源制备的大米蛋白肽的抗氧化特性,赵佳佳[45]对比三种不同来源的大米蛋白肽的抗氧化活性,发现籼米蛋白肽清除DPPH自由基、超氧阴离子自由基和羟基自由基的IC50值最低,抗氧化活性最高,而糯米蛋白肽清除自由基的IC50值远大于籼米、粳米蛋白肽,抗氧化活性最低。另外关于选用蛋白酶酶解得到的大米蛋白水解物也有较多相关报道,Ren等[46]采用不同蛋白酶酶解米糠蛋白,发现胰蛋白酶酶解产物拥有较高的Fe2+螯合能力(IC50为2.271±0.007 mg/mL)、DPPH和羟基自由基清除能力(IC50为0.191±0.006和1.038±0.034 mg/mL)。Zaky等[47]采用四种不同的蛋白酶对米糠蛋白进行酶解,研究发现风味蛋白酶酶解2 h获得的米糠蛋白水解物具有最高的抗氧化活性。Zhang等[48]采用中性蛋白酶酶解大米蛋白,其酶解产物对DPPH自由基清除活性远高于经碱性蛋白酶、木瓜蛋白酶和风味蛋白酶处理的产物。Song等[25]对胰蛋白酶和碱性蛋白酶复合制备的大米蛋白肽进行超滤分离,研究发现分子量大于3 kDa的组分具有最强的DPPH自由基清除活性。同时研究表明分子量不同对于大米蛋白肽的抗氧化能力有所差异。Chen等[49]探究分子量对大米蛋白水解物抗氧化能力的影响,研究发现分子量小于1 kDa的肽具有更佳的抗氧化活性,其DPPH自由基清除能力的IC50为26.7±1.13 mg/mL。此外,有研究对大米蛋白肽开展动物实验和细胞抗氧化实验,Yue等[50]的研究发现大米蛋白酶解物补充饮食饲养的果蝇具有更高的平均寿命和更高的超氧化物歧化酶和过氧化氢酶活性。王玉倩[51]研究发现大米活性肽可以通过调节细胞内的氧化水平延缓D-半乳糖诱导的小鼠的衰老进程,并且在秀丽隐杆线虫衰老模型中表现出良好的抗衰老功效。Fang等[52]通过细胞抗氧化实验、巨噬细胞增值和吞噬功能测定,发现较高浓度的富硒大米蛋白胰蛋白酶酶解物具有较高的抗氧化和免疫调节活性,且富硒大米蛋白肽的抗氧化活性与其免疫调节活性成正相关。
总体而言,关于大米蛋白肽的抗氧化活性研究一直是较为关注的问题,研究人员从蛋白来源、分子量、酶解路线等方面开展研究。目前关于大米蛋白肽抗氧化活性的原因可能是因为大米蛋白肽中的部分组分是其潜在的主要抗氧化成分,通过清除自由基和螯合金属离子来降低氧化应激水平,提高抗氧化酶活性,同时刺激机体中一系列基因的上调表达以激活受体表面的抗氧化通路,这一方法有可能是通过大米蛋白肽上调通路中相关调控因子的蛋白表达水平实现的。但是大米蛋白肽调控机体的抗氧化机能是一个十分复杂的代谢过程,且在实验开展中体外与体内实验存在一定偏差,这是因为一些大分子肽在进入机体后被胃肠道中的消化酶进一步水解,导致部分肽活性丧失,因此大米蛋白肽的抗氧化活性机理仍需进一步深入解析和阐明。
3.2 降血压
血管紧张素Ⅰ转换酶(ACE)是一种多功能锌金属肽酶,在调节血压方面起着重要的生理作用,主要作用于肾素-血管紧张素系统[53]。ACE能催化血管紧张素从无活性的十肽(血管紧张素I)转化为强效的血管收缩剂八肽(血管紧张素II),并使降压血管扩张剂缓激肽失活[54]。目前,ACE抑制活性被广泛应用于降血压活性的体外评价[55−57]。近年来,大量研究表明大米蛋白肽具有一定的ACE抑制活性,具有作为预防和治疗高血压替代疗法的潜力。
Wang等[58]的研究表明,用胰蛋白酶水解米糠蛋白获得分子量小于4 kDa水解产物的ACE抑制活性(IC50值为300 mg/mL)最强,且可显著降低自发性高血压大鼠收缩压和舒张压。Uraipong等[57]将米糠蛋白按溶解性划分,并分别采用四种蛋白酶进行水解,结果显示米糠蛋白水解物具有明显的ACE抑制活性,其中复合蛋白酶-白蛋白酶解物的ACE抑制活性最高,其IC50值为5.2 mg/mL。封张萍[30]采用胰蛋白酶酶解大米蛋白制备ACE抑制肽,通过分离纯化得到ACE抑制率达87.07%的组分。刘志国等[59]用多种蛋白酶酶解米糠蛋白,发现胃蛋白酶联合胰蛋白酶酶解的组分ACE抑制活性最高。Dong等[60]研究发现大米肽能够降低自发性高血压大鼠的收缩压,且呈时间剂量依赖性,大剂量大米肽可使单次灌胃和长期灌胃后大鼠的收缩压分别降低24.6 mmHg和17.2 mmHg。此外,研究发现大米蛋白肽具有降血压作用可能是因为该多肽序列中氨基酸残基序列符合ACE抑制活性的构效分析[14]。前人研究发现在多肽序列中含有疏水性氨基酸有利于与ACE分子催化活性中心结合,起到ACE抑制作用[61]。邹俊哲等[62]也发现经植物乳杆菌和蛋白酶协同发酵水解得到的大米蛋白水解物具有显著的ACE抑制活性,且该多肽序列中的氨基酸均为疏水性氨基酸。
3.3 免疫调节活性
目前研究大米蛋白肽具有免疫调节活性研究主要集中于对动物和细胞模型的免疫调节效果,并主要从分子量、肽序列等角度分析大米蛋白肽的内在作用机制。王璐[63]通过考察9种蛋白酶酶解制备大米蛋白肽的巨噬细胞增殖指数(SI)值、相对分子量分布及活性肽得率,研究结果表明胰蛋白酶是制备大米免疫活性肽的最佳酶。陈月华[64]通过建立脂多糖(LPS)诱导的RAW 264.7细胞炎症模型,从蛋白和基因双层面阐明大米酶解肽RPHs-C-7-3对炎症因子的抑制作用,证明了其免疫活性,最后从细胞水平阐述了大米酶解肽RPHs-C-7-3的免疫活性机理是通过抑制巨噬细胞内MAPK通路中的EPK的磷酸化作用来影响该通路,最终实现免疫调节功能。Feng等[65]利用胰蛋白酶酶解三种不同类型的富硒糙米蛋白,经过透析和超滤,得到了不同分子量的多肽组分,并采用LPS诱导的RAW264.7细胞模型进行体外实验,结果表明,1.0~3.5 kDa肽段通过抑制NO、PGE2和促炎因子的产生表现出有效的抗炎作用。Xu等[66]采用胰蛋白酶酶解大米蛋白制备免疫调节肽,并用小鼠腹腔巨噬细胞增殖试验验证了其免疫调节活性,并通过大孔吸附树脂、强阳离子交换色谱、凝胶过滤色谱和反相高效液相色谱对活性最高的肽段进行进一步纯化。经高效液相色谱-电喷雾电离四极杆飞行时间质谱仪鉴定得肽序列为Tyr-Gly-Ile-Tyr-Pro-Arg(YGIYPR)。结果表明,YGIYPR在12.5~100 μg/mL范围内均能促进巨噬细胞RAW 264.7的增殖。Fang等[67]同样采用RAW264.7细胞模型,从富硒大米蛋白水解物中筛选出具有免疫调节作用的蛋白肽。
大米蛋白肽的免疫调节是一个复杂的作用机理,目前许多研究仍停留在细胞和分子水平开展研究,对于体内实验仍缺乏大量可靠的数据结果支撑。但是上述的研究结果认为经胰蛋白酶水解后得到的产物中可筛选出具有高免疫活性的蛋白肽,并且该大米免疫活性肽主要是通过增强巨噬细胞活性促进细胞活化和增殖,提高其吞噬、杀伤病原体的能力,同时也会影响巨噬细胞中的通路最终实现免疫调节功能。
3.4 降血糖活性
糖尿病是一种由代谢紊乱引起的慢性疾病,以高血糖为主要特征,其中Ⅱ型糖尿病为最常见类型,占糖尿病患者的90%以上[68]。糖尿病常见的治疗靶点包括二肽基肽酶-IV(DPP-IV)、胰高血糖素样肽-1(GLP-1)、葡萄糖依赖性促胰岛素多肽(GIP)和葡萄糖转运蛋白(GLUTs)。有研究报道机体餐后高血糖比空腹高血糖危害性更高[69],而α-淀粉酶和α-葡萄糖苷酶是调节餐后血糖水平的关键酶,因此也是治疗糖尿病的靶点之一[70]。目前大多数降血糖相关的研究都旨在通过抑制α-淀粉酶、α-葡萄糖苷酶和DPP-IV来延缓或防止血糖的骤然上升。现有研究表明,大米蛋白肽对α-葡萄糖苷酶和DPP-IV有一定抑制作用,具有潜在降血糖活性。
Hatanaka等[71]采用Umamizyme G酶水解脱脂米糠,制备了具备DPP-IV抑制活性的蛋白水解物,并从中鉴定出两种抑制肽:Leu-Pro和Ile-Pro。同时Hatanaka等[72]研究表明大米和米糠蛋白酶解液中的活性肽对α-葡萄糖苷酶无明显的抑制作用,但两者对DPP-IV的IC50分别为1.45和1.28 mg/mL,显著低于酒糟水解物的27.55 mg/mL。而Uraipong等[55]研究发现米糠蛋白体外模拟消化产物具有显著的α-葡萄糖苷酶抑制活性,这可能是与原料蛋白组成的差异以及水解物的制备方法不同有关。Boonloh等[73]通过探究米糠蛋白水解物对高碳水化合物-高脂肪诱导的多发性硬化症大鼠的影响,认为米糠蛋白水解物具有作为一种改善胰岛素抵抗并预防代谢综合征发生的功能性食品潜力。Ishikawa等[74]研究表明大米蛋白肽通过抑制DPP-IV活性增强了GLP-1的分泌,从而有助于降低餐后血糖,但其具体机制尚未明晰。Ina等[75]的研究指出大米蛋白水解物对餐后高血糖的抑制作用可能是高分子量肽对葡萄糖的吸附作用和低分子量肽抑制钠依赖性葡萄糖转运蛋白-1表达的双重作用结果。目前,大米蛋白肽的降血糖作用机制仍未明晰,是否为Ina所猜测的双重作用有待进一步研究。
3.5 其他活性
除上述常见的生物活性外,大米蛋白肽的其他生物活性研究如抗癌活性、抗菌活性、降胆固醇活性、抗皮肤衰老等,在目前的研究中也有少量报道。相关研究表明米糠蛋白水解物显示出潜在的抗癌活性,这主要体现在它们对结肠癌细胞、乳腺癌细胞有较强的生长抑制率[76−77]。并且杨亚强[15]采用复合酶酶解米渣蛋白制备大米蛋白肽,研究发现分子量为3~10 kDa的肽组分对肝癌细胞HepG2的抑制率最高,活性最高。在关于多肽抗菌活性研究方面,Taniguchi等[78]从米糠水解物中纯化出了具有抗菌活性且几乎没有溶血作用的阳离子多肽。另有研究表明以糯米和粳米为原料,采用人造胆汁胶束溶液的方法研究了大米多肽的降胆固醇活性,发现粳米肽的活性约为糯米肽活性的2倍多[29]。同时大米蛋白肽在抗皮肤衰老中表现出较好的前景,李火云等[79]将大米蛋白肽添加到化妆品基质中,研究发现添加量为4.0 g/kg时,连续给受试者使用四周以上,能使脸部皱纹减少11.8%。此外使用糜蛋白酶和胰蛋白酶水解制成的米糠蛋白肽具备一定的酪氨酸酶抑制活性[80]。鞠志远等[81]研究发现YGEGSSEEG可通过抑制细胞凋亡和降低黏附分子表达,发挥对血管内皮细胞的保护作用。Liu等[82]通过碱性蛋白酶水解米渣蛋白,经分离纯化得到分子量小于1 kDa的抗疲劳肽。Song等[25]对胰蛋白酶和碱性蛋白酶复合制备的大米蛋白肽进行超滤分离,研究发现分子量小于1 kDa的组分在低浓度时乙醇脱氢酶激活活性最强。上述研究表明大米蛋白肽在特殊医学用途配方食品和运动营养食品等方面展现出巨大的应用潜力。
4. 总结与展望
2023年9月国家卫生健康委员会和国家市场监督管理总局发布了GB 31611《食品安全国家标准 食品加工用植物蛋白肽》,并将于2024年9月正式实施。在此之前,仅有大豆肽(GB/T 22492)、玉米低聚肽(QB/T 4707)和小麦低聚肽(QB/T 5298)这三种植物蛋白肽发布了标准,而对于植物蛋白肽并没有统一的标准,故GB 31611的制定标志着植物蛋白肽开发与利用即将进入高速发展阶段。
大米蛋白肽具有营养价值高、过敏性低、功能性好和生物活性强等特点,可作为食品主料或配料添加到产品中,深得业界学者的认可和消费者的喜爱,应用前景非常广阔,拥有充足的发展空间。据调研大米蛋白肽的应用前景主要可分为以下几方面:a.高蛋白饮品:得益于大米蛋白肽自身的良好溶解性,可以用于制作高植物蛋白含量饮料。b.保健食品:大米蛋白肽所具备良好的生理活性如抗氧化、降血压、降胆固醇和免疫调节等功效,使其在保健食品加工以及开发新型功能饮品等领域具备重大的潜力。c.特殊医学用途配方食品:大米蛋白肽优异的低过敏性能,使其抗原性比大米蛋白低1/100~1/1000,是食品过敏者的福音;并且由于大米蛋白肽的易消化吸收性,可以将其作为康复期的病人、消化功能未成熟婴幼儿和消化系统衰退老人的食品基料,以开发易被这类特殊人群消化吸收的新食品。d.运动营养食品:大米蛋白肽能够增强体能、抗疲劳,有增强肌肉的效果,可以迅速为机体提供能量,促进脂肪代谢和恢复体力,因此可以用于制作运动员或健身人群食用的蛋白质强化食品和能量补给饮品等。
本文对大米蛋白肽的制备方法、分离纯化技术、苦味改善和生物活性进行了综述。总体而言,大米蛋白肽的制备工艺较为成熟,营养价值高、过敏性低和功能性佳,应用前景广阔。然而大米蛋白肽的研究仍存在诸多不足,一是蛋白酶酶解位点广泛,难以实现靶向酶解;二是目标肽含量较低,构效关系未明晰;三是小分子肽的分离纯化技术大多难以实现工业化生产。未来大米蛋白肽的研究可着重从这三方面考虑。此外,可结合现有生物信息学工具识别大米蛋白肽中的活性肽,预测大米蛋白肽的各种物理化学性质和生物活性,以期能够快速准确地制备或提取目的肽。另从QB/T 4707《玉米低聚肽》和QB/T 5298《小麦低聚肽》中可知,研究者通过分析明确了各自的特征性指标,如《玉米低聚肽》中指出AY(由丙氨酸-酪氨酸)为玉米低聚肽的特征性肽段,《小麦低聚肽》中指出谷氨酰胺为小麦低聚肽的特征性指标。然而大米蛋白肽目前还未制定相应的国家标准或企业标准,因此未来也可深入研究大米蛋白肽的共性,旨在找出能够代表大米蛋白肽的特征性指标,为大米蛋白肽的高质量发展提供理论基础。
-
表 1 常见分离纯化技术的特点
Table 1 Characteristics of common separation and purification techniques
分离纯化方法 特点 主要适用范围 膜分离技术 效率高,选择性好,处理过程中样品不易失活且回收率高 初级分离,主要用于不同分子量蛋白多肽的分离 离子交换色谱 分辨率高,交换容量高,色谱可选择的条件多,蛋白多肽的回收率高 高效分离,应用广泛,只需样品在溶液中能形成离子状态 凝胶过滤色谱 实验操作简单,分离条件温和,溶质回收率高,分离过程中蛋白多肽不易变性,能根据样品分子体积大小选择填料 高效分离,通常应用在纯化工艺的后续步骤 反相高效液相色谱 分辨率高,速度快,重复性好,适用面广,灵敏度高 主要用于分子量小于5 kDa,尤其是1 kDa以下非极性多肽的分离纯化 -
[1] 徐兴凤. 酶解大米谷蛋白性质以及多糖对其影响的研究[D]. 南昌:南昌大学, 2016. [XU X F. Study on the properties of limited enzymatic hydrolysis rice gluten and the effects of polysaccharides on its properties[D]. Nanchang:Nanchang University, 2016.] XU X F. Study on the properties of limited enzymatic hydrolysis rice gluten and the effects of polysaccharides on its properties[D]. Nanchang: Nanchang University, 2016.
[2] 潘敏尧. 大米浓缩蛋白的研制及蛋白质改性的研究[D]. 杭州:浙江大学, 2006. [PAN M Y. Studies on extraction of rice protein concentration and modification of rice protein[D]. Hangzhou:Zhejiang University, 2006.] PAN M Y. Studies on extraction of rice protein concentration and modification of rice protein[D]. Hangzhou: Zhejiang University, 2006.
[3] 杜慧敏. 浓缩乳清蛋白发酵乳制品的制备研究[D]. 长沙:中南林业科技大学, 2021. [DU H M. Study on the preparation of fermented dairy products by concentrated whey protein[D]. Changsha:Central South University of Forestry & Technology, 2021.] DU H M. Study on the preparation of fermented dairy products by concentrated whey protein[D]. Changsha: Central South University of Forestry & Technology, 2021.
[4] YU Y H, GAINE G K, ZHOU L Y, et al. The classical and potential novel healthy functions of rice bran protein and its hydrolysates[J]. Critical Reviews in Food Science and Nutrition,2022,62(30):8454−8466. doi: 10.1080/10408398.2021.1929057
[5] GENG X Q, LONG Z, LIU N. Research progress and application of rice dreg protein modification[J]. Food and Fermentation Industries,2021,47(17):307−314.
[6] 谯飞, 韩雪, 林凯, 等. 大米蛋白肽的生物活性相关研究[J]. 中国甜菜糖业,2016(4):35−39. [QIAO F, HAN X, LIN K, et al. A review on biological active peptides in rice[J]. China Beet & Sugar,2016(4):35−39.] QIAO F, HAN X, LIN K, et al. A review on biological active peptides in rice[J]. China Beet & Sugar, 2016(4): 35−39.
[7] 王彦珺, 李姝承, 关长阁, 等. 天然活性多肽的发掘策略和生产技术[J]. 生物工程学报,2021,37(6):2166−2180. [WANG Y J, LI S C, GUAN C G, et al. Functional discovery and production technology for natural bioactive peptides[J]. Chinese Journal of Biotechnology,2021,37(6):2166−2180.] WANG Y J, LI S C, GUAN C G, et al. Functional discovery and production technology for natural bioactive peptides[J]. Chinese Journal of Biotechnology, 2021, 37(6): 2166−2180.
[8] 郑龙, 田佳鑫, 张泽鹏, 等. 多肽药物制备工艺研究进展[J]. 化工学报,2021,72(7):3538−3550. [ZHENG L, TIAN J X, ZHANG Z P, et al. Progress on pharmaceutical engineering of peptide-based drugs[J]. CIESC Journal,2021,72(7):3538−3550.] doi: 10.11949/0438-1157.20210270 ZHENG L, TIAN J X, ZHANG Z P, et al. Progress on pharmaceutical engineering of peptide-based drugs[J]. CIESC Journal, 2021, 72(7): 3538−3550. doi: 10.11949/0438-1157.20210270
[9] 乔杨波, 庄蕾, 黄伟华, 等. 植物蛋白多肽的研究进展[J]. 中国调味品,2021,46(5):175−178,197. [QIAO Y B, ZHUANG L, HUANG W H, et al. Research progress of plant protein polpeptides[J]. 中国调味品,2021,46(5):175−178,197.] doi: 10.3969/j.issn.1000-9973.2021.05.036 QIAO Y B, ZHUANG L, HUANG W H, et al. Research progress of plant protein polpeptides[J]. 中国调味品, 2021, 46(5): 175−178,197. doi: 10.3969/j.issn.1000-9973.2021.05.036
[10] 张作达, 吴若娜, 王琴飞, 等. 植物源功能活性多肽研究进展[J]. 中国农学通报,2022,38(12):88−94. [ZHANG Z D, WU R N, WANG Q F, et al. Bioactive peptides based on plants:A review[J]. Chinese Agricultural Science Bulletin,2022,38(12):88−94.] doi: 10.11924/j.issn.1000-6850.casb2021-0630 ZHANG Z D, WU R N, WANG Q F, et al. Bioactive peptides based on plants: A review[J]. Chinese Agricultural Science Bulletin, 2022, 38(12): 88−94. doi: 10.11924/j.issn.1000-6850.casb2021-0630
[11] PUI Y P, MARTIN-GONZALEZ M F S, NARSIMHAN G. Effect of hydrolysis of soy β-conglycinin on the oxidative stability of O/W emulsions[J]. Food Hydrocolloids,2014,35:429−443. doi: 10.1016/j.foodhyd.2013.06.024
[12] 熊尉杰. 利用米渣制备大米肽的研究[D]. 长沙:湖南农业大学, 2010. [XIONG W J. The study of using rice residues to produce rice peptides[D]. Changsha:Hunan Agricultural University, 2010.] XIONG W J. The study of using rice residues to produce rice peptides[D]. Changsha: Hunan Agricultural University, 2010.
[13] ONSAARD W, KATE-NGAM S, ONSAARD E. Physicochemical and antioxidant properties of rice bran protein hydroly-sates obtained from different proteases[J]. Journal of Food Measurement and Characterization,2023,17(3):2374−2385. doi: 10.1007/s11694-022-01796-2
[14] 徐珍珍, 于秋生, 陈天祥, 等. 大米蛋白肽的制备与ACE抑制活性分析[J]. 食品与发酵工业,2021,47(3):53−58. [XU Z Z, YU Q S, CHEN T X, et al. Preparation of rice protein peptides and the analysis of ACE inhibitory activity[J]. Food and Fermentation Industries,2021,47(3):53−58.] XU Z Z, YU Q S, CHEN T X, et al. Preparation of rice protein peptides and the analysis of ACE inhibitory activity[J]. Food and Fermentation Industries, 2021, 47(3): 53−58.
[15] 杨亚强. 米渣酶解肽制备与生理活性及其对断奶仔猪生长性能的影响[D]. 南昌:南昌大学, 2018. [YANG Y Q. Study on preparation and physiological activity of rice residue hydrolyzete and its effect on growth performance of weaned piglets[D]. Nanchang:Nanchang University, 2018.] YANG Y Q. Study on preparation and physiological activity of rice residue hydrolyzete and its effect on growth performance of weaned piglets[D]. Nanchang: Nanchang University, 2018.
[16] 李铃东, 陈军, 邓利珍, 等. 不同酶解路线大米蛋白肽的制备、表征及抗氧化活性[J/OL]. 食品工业科技, 1−15. [2024-08-22]. https://doi.org/10.13386/j. issn1002-0306.2023090011 [LI L D, CHEN J, DENG L Z, et al. Preparation, characterization and antioxidant activity of rice protein peptides with different enzymatic hydrolysis routes[J/OL]. Science and Technology of Food Industry 1−15. [2024-08-22]. https://doi.org/10.13386/j.issn1002-0306.2023090011.] LI L D, CHEN J, DENG L Z, et al. Preparation, characterization and antioxidant activity of rice protein peptides with different enzymatic hydrolysis routes[J/OL]. Science and Technology of Food Industry 1−15. [2024-08-22]. https://doi.org/10.13386/j.issn1002-0306.2023090011.
[17] 宋永康, 黄薇, 林虬, 等. 不同酶解法水解豆粕蛋白的比较研究[J]. 农学学报,2012,2(9):51−55. [SONG Y K, HUANG W, LIN Q, et al. Comparative study of soybean protein hydrolysates prepared in different ways[J]. Journal of Agriculture,2012,2(9):51−55.] doi: 10.3969/j.issn.1007-7774.2012.09.012 SONG Y K, HUANG W, LIN Q, et al. Comparative study of soybean protein hydrolysates prepared in different ways[J]. Journal of Agriculture, 2012, 2(9): 51−55. doi: 10.3969/j.issn.1007-7774.2012.09.012
[18] 王宇飞. 小麦醇溶蛋白的分离、改性及其结构与致敏性的研究[D]. 太原:中北大学, 2022. [WANG Y F. Study of isolation and modification of wheat gliadin and its structure and allergenicit[D]. Taiyuan:North University of China, 2022.] WANG Y F. Study of isolation and modification of wheat gliadin and its structure and allergenicit[D]. Taiyuan: North University of China, 2022.
[19] 廖卢艳, 张喻. 枯草芽孢杆菌发酵米渣制备抗氧化肽发酵工艺条件的优化[J]. 激光生物学报,2015,24(4):368−372. [LIAO L Y, ZHANG Y. Optimized fermentation conditions for research on antioxidant peptides prepared from fermented rice residue by using bacillus subtilis[J]. Acta Laser Biology Sinica,2015,24(4):368−372.] LIAO L Y, ZHANG Y. Optimized fermentation conditions for research on antioxidant peptides prepared from fermented rice residue by using bacillus subtilis[J]. Acta Laser Biology Sinica, 2015, 24(4): 368−372.
[20] 魏明, 薛正莲, 赵世光, 等. 米曲霉发酵米糠制取米糠多肽及其抗氧化活性研究[J]. 食品工业科技,2014,35(19):114−118. [WEI M, XUE Z L, ZHAO S G, et al. Study on the preparation of peptides from rice bran and antioxidant activity by aspergillus oryzae fermentation[J]. Science and Technology of Food Industry,2014,35(19):114−118.] WEI M, XUE Z L, ZHAO S G, et al. Study on the preparation of peptides from rice bran and antioxidant activity by aspergillus oryzae fermentation[J]. Science and Technology of Food Industry, 2014, 35(19): 114−118.
[21] 刘颖, 刘显儒, 窦博鑫, 等. 复合菌液态发酵米糠制备ACE抑制肽的预处理[J]. 食品与发酵工业,2013,39(11):129−133. [LIU Y, LIU X R, DOU B X, et al. Pretreatment of rice bran using composite bacteria liquid fermentation to prepare ACE inhibitory peptides[J]. Food and Fermentation Industries,2013,39(11):129−133.] LIU Y, LIU X R, DOU B X, et al. Pretreatment of rice bran using composite bacteria liquid fermentation to prepare ACE inhibitory peptides[J]. Food and Fermentation Industries, 2013, 39(11): 129−133.
[22] MARCEL M. Basic principles of membrane technology[M]. U. S. A. and Canda:Kluwer Academic Publishers, 1996:55−78.
[23] 蔡俊. 大米抗氧化肽的复合酶法制备及理化性质研究[D]. 武汉:武汉轻工大学, 2016. [CAI J. Preparation and physicochemical properties of rice peptide with antioxidant activity using combined proteases[D]. Wuhan:Wuhan Polytechnic University, 2016.] CAI J. Preparation and physicochemical properties of rice peptide with antioxidant activity using combined proteases[D]. Wuhan: Wuhan Polytechnic University, 2016.
[24] 谯飞. 大米蛋白ACE抑制肽制备及其膜高效分离技术的研究[D]. 哈尔滨:哈尔滨工业大学, 2016. [QIAO F. The preparation of rice protein ACE inhibitory peptides and the research on its effective separation by membrane technology[D]. Harbin:Harbin Institute of Technology, 2016.] QIAO F. The preparation of rice protein ACE inhibitory peptides and the research on its effective separation by membrane technology[D]. Harbin: Harbin Institute of Technology, 2016.
[25] SONG R Y, DAI T T, DENG L Z, et al. Ultrafiltration fractionation of rice protein hydrolysates:Physicochemical properties and potential biological activities of different rice protein hydrol-ysate fractions[J]. Food Bioscience,2023,56:103418. doi: 10.1016/j.fbio.2023.103418
[26] 刘铭, 刘玉环, 王允圃, 等. 制备、纯化和鉴定生物活性肽的研究进展及应用[J]. 食品与发酵工业,2016,42(4):244−251. [LIU M, LIU Y H, WANG Y P, et al. Research progress on production, purification and identification of bioactides and its challenges in application[J]. Food and Fermentation Industry,2016,42(4):244−251.] LIU M, LIU Y H, WANG Y P, et al. Research progress on production, purification and identification of bioactides and its challenges in application[J]. Food and Fermentation Industry, 2016, 42(4): 244−251.
[27] CHEN J W, LIU S S, YE R, et al. Angiotensin-I converting enzyme (ACE) inhibitory tripeptides from rice protein hydrolysate:Purification and characterization[J]. Journal of Functional Foods,2013,5(4):1684−1692. doi: 10.1016/j.jff.2013.07.013
[28] 刘晶, 温志英, 韩清波. 米渣肽抗疲劳作用及抗疲劳肽的分离鉴定[J]. 中国粮油学报,2013,28(1):1−5. [LIU J, WEN Z Y, HAN Q B. Anti-fatigue effect of rice residue peptide and separation and identification of anti-fatigue peptide[J]. Journal of the Chinese Cereals and Oils Association,2013,28(1):1−5.] LIU J, WEN Z Y, HAN Q B. Anti-fatigue effect of rice residue peptide and separation and identification of anti-fatigue peptide[J]. Journal of the Chinese Cereals and Oils Association, 2013, 28(1): 1−5.
[29] 王戈莎. 大米多肽的分离纯化及其抗氧化活性的研究[D]. 无锡:江南大学, 2008. [WANG G S. The study of isolation and purification of rice peptide and its antioxidant activity[D]. Wuxi:Jiangnan University, 2008.] WANG G S. The study of isolation and purification of rice peptide and its antioxidant activity[D]. Wuxi: Jiangnan University, 2008.
[30] 封张萍. 大米血管紧张素转换酶抑制肽的制备及其活性评价[D]. 杭州:浙江大学, 2021. [FENG Z P. Preparation and activity evaluation of rice angiotensin converting enzyme inhibitory peptides[D]. Hangzhou:Zhejiang University, 2021.] FENG Z P. Preparation and activity evaluation of rice angiotensin converting enzyme inhibitory peptides[D]. Hangzhou: Zhejiang University, 2021.
[31] 马小刚. 低苦味杏仁蛋白肽水解工艺优化及其特性研究[D]. 阿拉尔:塔里木大学, 2022. [MA X G. Hydrolysis process optimization and characteristics study of low-bitter almond protein peptides[D]. Alaer:Tarim University, 2022.] MA X G. Hydrolysis process optimization and characteristics study of low-bitter almond protein peptides[D]. Alaer: Tarim University, 2022.
[32] NEY K H. Bitterness of peptides:Amino acid composition and chain length[M]. America:American Chemical Society, 1979:149−173.
[33] FITZGERALD R J, O'CUINN G. Enzymatic debittering of food protein hydrolysates[J]. Biotechnology Advances,2006,24(2):234−237. doi: 10.1016/j.biotechadv.2005.11.002
[34] ADLER-NISSEN J. Enzymic hydrolysis of food proteins[M]. New York:Elsevier Applied Science Publishers, 1986:57−69.
[35] CHO M J, UNKLESBAY N, HSIEH F H, et al. Hydrophobicity of bitter peptides from soy protein hydrolysates[J]. Journal of Agricultural and Food Chemistry,2004,52(19):5895−5901. doi: 10.1021/jf0495035
[36] 孙小瑞. 酶解小麦面筋蛋白制备低苦味肽粉的研究[D]. 郑州:河南工业大学, 2023. [SUN X R. Study on enzyme-induced preparation of low bitter peptide powder from wheat gluten[D]. Zhengzhou:Henan University of Technology, 2023.] SUN X R. Study on enzyme-induced preparation of low bitter peptide powder from wheat gluten[D]. Zhengzhou: Henan University of Technology, 2023.
[37] LIU B, LI N, CHEN F, et al. Review on the release mechanism and debittering technology of bitter peptides from protein hydrolysates[J]. Comprehensive Reviews in Food Science and Food Safety,2022,21(6):5153−5170. doi: 10.1111/1541-4337.13050
[38] 黄磊, 周其洋. 大豆水解蛋白中苦味肽的研究进展[J]. 现代食品,2022,28(21):22−24. [HUANG L, ZHOU Q Y. Research progress of bitter peptides in hydrolysed soybean protein[J]. Modern Food,2022,28(21):22−24.] HUANG L, ZHOU Q Y. Research progress of bitter peptides in hydrolysed soybean protein[J]. Modern Food, 2022, 28(21): 22−24.
[39] 郭兴峰, 魏芳, 周祥山, 等. 苦味肽的形成机理及脱苦技术研究进展[J]. 食品研究与开发,2017,38:207−211. [GUO X F, WEI F, ZHOU X S, et al. Review on the formation mechanism and debittering technology of bitter petides[J]. Food Research and Development,2017,38:207−211.] doi: 10.3969/j.issn.1005-6521.2017.21.041 GUO X F, WEI F, ZHOU X S, et al. Review on the formation mechanism and debittering technology of bitter petides[J]. Food Research and Development, 2017, 38: 207−211. doi: 10.3969/j.issn.1005-6521.2017.21.041
[40] 袁帅. 鳕鱼肽的脱苦去腥及其功能活性评价[D]. 无锡:江南大学, 2023. [YUAN S. Debittering and deodorizing of cod peptides and their functional activities evaluation[D]. Wuxi:Jiangnan University, 2023.] YUAN S. Debittering and deodorizing of cod peptides and their functional activities evaluation[D]. Wuxi: Jiangnan University, 2023.
[41] 胡炜, 张吉, 刘鑫, 等. 利用β-环状糊精脱除大米蛋白肽苦味研究[J]. 检验检疫学刊,2018,28(6):29−32. [HU W, ZHANG J, LIU X, et al. Study on using β-cyclodextrin to remove bitter taste of rice protein peptides[J]. Journal of Inspection and Quarantine,2018,28(6):29−32.] HU W, ZHANG J, LIU X, et al. Study on using β-cyclodextrin to remove bitter taste of rice protein peptides[J]. Journal of Inspection and Quarantine, 2018, 28(6): 29−32.
[42] QIN Q, TANG C, WU J, et al. A dual-functional aminopeptidase from streptomyces canus T20 and its application in the preparation of small rice peptides[J]. International Journal of Biological Macromolecules,2021,167:214−222. doi: 10.1016/j.ijbiomac.2020.11.175
[43] 胡勤玲, 郑良清, 王申, 等. 基于电子舌对富含ACE抑制肽大米蛋白水解物的脱苦评价[J]. 食品科学,2014,35(24):24−28. [HU Q L, ZHENG L Q, WANG S, et al. Using electronic tongue evaluate the effect of ACE inhibitory peptide enrichment on debittering rice protein hydrolyzate[J]. Food Science,2014,35(24):24−28.] doi: 10.7506/spkx1002-6630-201424005 HU Q L, ZHENG L Q, WANG S, et al. Using electronic tongue evaluate the effect of ACE inhibitory peptide enrichment on debittering rice protein hydrolyzate[J]. Food Science, 2014, 35(24): 24−28. doi: 10.7506/spkx1002-6630-201424005
[44] BARNHAM K J, MASTERS C L, BUSH A I. Neurodegenerative diseases and oxidative stress[J]. Nature Reviews Drug Discovery,2004,3(3):205−214. doi: 10.1038/nrd1330
[45] 赵佳佳. 3种大米蛋白肽的制备及其抗氧化活性比较[J]. 食品科技,2018,43(12):191−195. [ZHAO J J. Preparation of three rice protein peptides and comparison of antioxidant activities[J]. Food Technology,2018,43(12):191−195.] ZHAO J J. Preparation of three rice protein peptides and comparison of antioxidant activities[J]. Food Technology, 2018, 43(12): 191−195.
[46] REN L K, FAN J, YANG Y, et al. Identification, in silico selection, and mechanism study of novel antioxidant peptides derived from the rice bran protein hydrolysates[J]. Food Chemistry,2023,408:135230. doi: 10.1016/j.foodchem.2022.135230
[47] ZAKY A A, CHEN Z, LIU Y, et al. Preparation and assessment of bioactive extracts having antioxidant activity from rice bran protein hydrolysates[J]. Journal of Food Measurement and Characterization,2019,13(4):2542−2548. doi: 10.1007/s11694-019-00174-9
[48] ZHANG J H, ZHANG H, WANG L, et al. Antioxidant activities of the rice endosperm protein hydrolysate:Identification of the active peptide[J]. European Food Research and Technology,2009,229(4):709−719. doi: 10.1007/s00217-009-1103-3
[49] CHEN H J, DAI F J, CHEN C Y, et al. Effects of molecular weight fraction on antioxidation capacity of rice protein hydrolysates[J]. Scientific Reports,2023,13(1):3464. doi: 10.1038/s41598-022-14314-7
[50] YUE Y, WANG M, FENG Z, et al. Antiaging effects of rice protein hydrolysates on drosophila melanogaster[J]. Journal of Food Biochemistry,2021,45(4):13602.
[51] 王玉倩. 大米活性肽对D-半乳糖致衰老小鼠氧化应激的保护作用[D]. 长沙:中南林业科技大学, 2019. [WANG Y Q. The protective effect of rice bran active peptide on oxidative stress in D-galactose-induced aging mice[D]. Changsha:Central South University of Forestry & Technology, 2019.] WANG Y Q. The protective effect of rice bran active peptide on oxidative stress in D-galactose-induced aging mice[D]. Changsha: Central South University of Forestry & Technology, 2019.
[52] FANG Y, CHEN X, LUO P, et al. The correlation between in vitro antioxidant activity and immunomodulatory activity of enzymatic hydrolysates from selenium-enriched rice protein[J]. Journal of Food Science,2017,82(2):517−522. doi: 10.1111/1750-3841.13595
[53] FUJITA H, YOKOYAMA K, YOSHIKAWA M. Classification and antihypertensive activity of angiotensin I-converting enzyme inhibitory peptides derived from food proteins[J]. Journal of Food Science,2000,65(4):564−569. doi: 10.1111/j.1365-2621.2000.tb16049.x
[54] WANG J P, HU J E, CUI J Z, et al. Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the anti hypertensive effect of hydrolysate in spontaneously hypertensive rats[J]. Food Chemistry,2008,111(2):302−308. doi: 10.1016/j.foodchem.2008.03.059
[55] URAIPONG C, ZHAO J. In vitro digestion of rice bran proteins produces peptides with potent inhibitory effects on-glucosidase and angiotensin I converting enzyme[J]. Journal of the Science of Food and Agriculture,2018,98(2):758−766. doi: 10.1002/jsfa.8523
[56] URAIPONG C, ZHAO J. Identification and functional characterisation of bioactive peptides in rice bran albumin hydrolysates[J]. International Journal of Food Science and Technology,2016,51(10):2201−2208. doi: 10.1111/ijfs.13204
[57] URAIPONG C, ZHAO J. Rice bran protein hydrolysates exhibit strong in vitro-amylase, glucosidase and ACE-inhibition activities[J]. Journal of the Science of Food and Agriculture,2016,96(4):1101−1110. doi: 10.1002/jsfa.7182
[58] WANG X M, CHEN H X, FU X G, et al. A novel antioxidant and ACE inhibitory peptide from rice bran protein:Biochemical characterization and molecular docking study[J]. Lwt-Food Science and Technology,2017,75:93−99. doi: 10.1016/j.lwt.2016.08.047
[59] 刘志国, 吴琼, 吕玲肖, 等. 酶解米糠蛋白分离提取ACE抑制肽及其结构研究[J]. 食品科学,2007(3):223−227. [LIU Z G, WU Q, LÜ L X, et al. Acticity detection and structure analysis of ACE inhibitors derived from rice bran protein[J]. Food Science,2007(3):223−227.] LIU Z G, WU Q, LÜ L X, et al. Acticity detection and structure analysis of ACE inhibitors derived from rice bran protein[J]. Food Science, 2007(3): 223−227.
[60] DONG J J, WANG S, YIN X Y, et al. Angiotensin I converting enzyme (ACE) inhibitory activity and antihypertensive effects of rice peptides[J]. Food Science and Human Wellness,2022,11(6):1539−1543. doi: 10.1016/j.fshw.2022.06.011
[61] WU J P, ALUKO R E, NAKAI S. Structural requirements of angiotensin i-converting enzyme inhibitory peptides:Quantitative structure-activity relationship modeling of peptides containing 4-10 amino acid residues[J]. QSAR & Combinatorial Science,2006,25(10):873−880.
[62] 邹俊哲, 林凯, 杨旭, 等. 植物乳杆菌和蛋白酶协同发酵水解大米蛋白ACE抑制肽高活性组分的氨基酸序列分析[J]. 食品研究与开发,2019,40(8):1−6. [ZOU J Z, LIN K, YANG X, et al. Lactobacillus plantarum coupled with proteinases to remove rice protein for the production of ACE inhibitory peptides[J]. Food Research and Development,2019,40(8):1−6.] doi: 10.3969/j.issn.1005-6521.2019.08.001 ZOU J Z, LIN K, YANG X, et al. Lactobacillus plantarum coupled with proteinases to remove rice protein for the production of ACE inhibitory peptides[J]. Food Research and Development, 2019, 40(8): 1−6. doi: 10.3969/j.issn.1005-6521.2019.08.001
[63] 王璐. 从大米蛋白胰蛋白酶酶解物中分离纯化免疫活性肽[D]. 长沙:长沙理工大学, 2015. [WANG L. Preparation and purification of rice immune active peptide[D]. Changsha:Changsha University of Science & Technology, 2015.] WANG L. Preparation and purification of rice immune active peptide[D]. Changsha: Changsha University of Science & Technology, 2015.
[64] 陈月华. 大米胰酶水解肽在巨噬细胞RAW264.7中的免疫活性研究[D]. 长沙:长沙理工大学, 2016. [CHEN Y H. Studies on immunoactivities of trypsinized rice peptides in RAW264.7 macrophages[D]. Changsha:Changsha University of Science & Technology, 2016.] CHEN Y H. Studies on immunoactivities of trypsinized rice peptides in RAW264.7 macrophages[D]. Changsha: Changsha University of Science & Technology, 2016.
[65] FENG M J, WANG X Y, XIONG H, et al. Anti-inflammatory effects of three selenium-enriched brown rice protein hydrolysates in LPS-induced RAW264.7 macrophages via NF-κB/MAPKs signaling pathways[J]. Journal of Functional Foods,2021,76:104320. doi: 10.1016/j.jff.2020.104320
[66] XU Z, MAO T M, HUANG L, et al. Purification and identification immunomodulatory peptide from rice protein hydrolysates[J]. Food and Agricultural Immunology,2019,30(1):150−162. doi: 10.1080/09540105.2018.1553938
[67] FANG Y, PAN X, ZHAO E, et al. Isolation and identification of immunomodulatory selenium-containing peptides from selenium-enriched rice protein hydrolysates[J]. Food Chemistry,2019,275:696−702. doi: 10.1016/j.foodchem.2018.09.115
[68] VALENZUELA ZAMUDIO F, SEGURA CAMPOS M R. Amaranth, quinoa and chia bioactive peptides:A comprehensive review on three ancient grains and their potential role in management and prevention of Type 2 diabetes[J]. Critical Reviews in Food Science and Nutrition,2022,62(10):2707−2721. doi: 10.1080/10408398.2020.1857683
[69] HIYOSHI T, FUJIWARA M, YAO Z. Postprandial hyperglycemia and postprandial hypertriglyceridemia in type 2 diabetes[J]. Journal of Biomedical Research,2017,33(1):1−16.
[70] JAGADEESAN G, MUNIYANDI K, MANOHARAN A L, et al. Understanding the bioaccessibility, α-amylase and α-glucosidase enzyme inhibition kinetics of Allmania nodiflora (L.) R. Br. ex wight polyphenols during in vitro simulated digestion[J]. Food Chemistry,2022,372:131294. doi: 10.1016/j.foodchem.2021.131294
[71] HATANAKA T, INOUE Y, ARIMA J, et al. Production of dipeptidyl peptidase IV inhibitory peptides from defatted rice bran[J]. Food Chemistry,2012,134(2):797−802. doi: 10.1016/j.foodchem.2012.02.183
[72] HATANAKA T, URAJI M, FUJITA A, et al. Anti-oxidation activities of rice-derived peptides and their inhibitory effects on dipeptidylpeptidase-IV[J]. International Journal of Peptide Research and Therapeutics,2015,21(4):479−485. doi: 10.1007/s10989-015-9478-4
[73] BOONLOH K, KUKONGVIRIYAPAN V, KONGYINGYOES B, et al. Rice bran protein hydrolysates improve insulin resistance and decrease pro-inflammatory cytokine gene expression in rats fed a high carbohydrate-high fat diet[J]. Nutrients,2015,7(8):6313−6329. doi: 10.3390/nu7085292
[74] ISHIKAWA Y, HIRA T, INOUE D, et al. Rice protein hydrolysates stimulate GLP-1 secretion, reduce GLP-1 degradation, and lower the glycemic response in rats[J]. Food & Function,2015,6(8):2525−2534.
[75] INA S, HAMADA A, NAKAMURA H, et al. Rice (Oryza sativa japonica) albumin hydrolysates suppress postprandial blood glucose elevation by adsorbing glucose and inhibiting Na+-D-glucose cotransporter SGLT1 expression[J]. Journal of Functional Foods,2020,64:103603. doi: 10.1016/j.jff.2019.103603
[76] KANNAN A, HETTIARACHCHY N, JOHNSON M G, et al. Human colon and liver cancer cell proliferation inhibition by peptide hydrolysates derived from heat-stabilized defatted rice bran[J]. Journal of Agricultural and Food Chemistry,2008,56(24):11643−11647. doi: 10.1021/jf802558v
[77] KANNAN A, HETTIARACHCHY N S, LAY J O, et al. Human cancer cell proliferation inhibition by a pentapeptide isolated and characterized from rice bran[J]. Peptides,2010,31(9):1629−1634. doi: 10.1016/j.peptides.2010.05.018
[78] TANIGUCHI M, KAMEDA M, NAMAE T, et al. Identification and characterization of multifunctional cationic peptides derived from peptic hydrolysates of rice bran protein[J]. Journal of Functional Foods,2017,34:287−296. doi: 10.1016/j.jff.2017.04.046
[79] 李火云, 万岳鹏, 曾茜, 等. 大米多肽抗衰老功效研究[J]. 香料香精化妆品,2015(6):37−40. [LI H Y, WAN Y P, ZENG X, et al. Study on the anti-aging effects of rice-protein polypeptides[J]. Flavour Fragrance Cosmetics,2015(6):37−40.] LI H Y, WAN Y P, ZENG X, et al. Study on the anti-aging effects of rice-protein polypeptides[J]. Flavour Fragrance Cosmetics, 2015(6): 37−40.
[80] OCHIAI A, TANAKA S, TANAKA T, et al. Rice bran protein as a potent source of antimelanogenic peptides with tyrosinase inhibitory activity[J]. Journal of Natural Products,2016,79(10):2545−2551. doi: 10.1021/acs.jnatprod.6b00449
[81] 鞠志远, 王丽丽, 刘丽娅, 等. 大米α-球蛋白肽YGEGSSEEG对TNF-α诱导的血管内皮细胞损伤的影响[J]. 中国药理学通报,2018,34(4):501−507. [JU Z Y, WANG L L, LIU L Y, et al. Effects of rice peptide YGEGSSEEG on improving endothelial cell injury induced by tumor necrosis factor[J]. Chinese Pharmacological Bulletin,2018,34(4):501−507.] JU Z Y, WANG L L, LIU L Y, et al. Effects of rice peptide YGEGSSEEG on improving endothelial cell injury induced by tumor necrosis factor[J]. Chinese Pharmacological Bulletin, 2018, 34(4): 501−507.
[82] LIU J, WEN Z, HAN Q. Anti-fatigue effect of rice residue peptide and isolation and identification of anti-fatigue peptide[J]. Journal of the Chinese Cereals and Oils Association,2013,28(1):1−5.





 下载:
下载:
 下载:
下载:



