Effects of Steam Explosion Pretreatment on the Physicochemical Properties and Regulating Intestinal Flora of Polysaccharides from Hericium erinaceus Fruit Body Residues
-
摘要: 为了研究蒸汽爆破(Steam Explosion,SE)预处理对猴头菇子实体残渣粗多糖理化性质及调节肠道菌群的影响,以猴头菇水提残渣为原料,采用常规粉碎和蒸汽爆破两种方式进行处理制备获得粗多糖并进行得率、成分含量、单糖组成、分子量及消化和发酵特性的比较。结果显示,经SE处理所得多糖组分(HCQ)的得率、多糖和β-葡聚糖含量分别达到了13.36%、58.20%和47.93%,是常规粉碎处理所得多糖组分(HCW)的2.18、1.57和1.59倍,表明SE能显著(P<0.05)促进残渣中多糖组分的释放。SE还降低了HCQ的分子量并释放出小分子组分,同时提高了单糖组成中的葡萄糖摩尔百分比。在模拟体外人体粪便发酵过程中,与HCW相比,HCQ明显地(P<0.05)提高了有益菌(如厚壁菌门)的丰度和短链脂肪酸的产量,同时降低有害细菌(如埃希氏-志贺氏菌)的丰度,从而有益于机体健康。该研究为蒸汽爆破技术在猴头菇多糖提取中的应用及HCQ多糖作为潜在益生元发挥调节肠道菌群作用提供依据。Abstract: To investigate the effects of steam explosion (SE) pretreatment on the extraction, physicochemical properties of polysaccharides from Hericium erinaceus residue and their in vitro gut microbiota fermentability characteristics, water-extracted residues of Hericium erinaceus fruit bodies were treated by conventional crushing and SE to prepare crude polysaccharide fractions. Results showed that the yield, polysaccharide and β-glucan content of SE pretreated fraction (HCQ) reached 13.36%, 58.20% and 47.93%, respectively, which were 2.18, 1.57 and 1.59 times that of HCW obtained by conventional crushing treatment, suggesting that SE could significantly (P<0.05) promote the release of polysaccharide components from the residues. SE also reduced the molecular weight of HCQ and released small molecular fractions, while increasing the molar ratio of glucose in monosaccharide composition. During in vitro fermentation by human feces process, HCQ could obviously (P<0.05) improve the abundance of beneficial bacteria (such as Firmicutes) and the production of short-chain fatty acids, while reducing the abundance of harmful bacteria (such as Escherichia-Shigella) than HCW, which could be beneficial to human body health. This research provides a basis for the application of SE in the preparation of polysaccharides from Hericium erinaceus residues and the potential role of HCQ as prebiotics in positively regulating gut microbiota.
-
猴头菇(Hericium erinaceus),又名刺猬菌、猴头菌等,在中国及其它亚洲国家应用已经有两千多年的历史,也是我国传统的药食两用真菌[1]。猴头菇营养价值丰富,含有多糖、蛋白质、维生素等多种生物活性成分,具有很高的药用价值。其中,多糖作为最重要且研究最多的功能成分之一,对胃炎和胃溃疡等消化系统疾病有治疗作用[2],特别是猴头菇中的β-葡聚糖具有增强免疫力[3]、抗衰老[4]及降血糖[5]等生物活性,是潜在的安全且高效的成分。
目前,猴头菇多糖的提取多以传统的方式如热水浸提为主,该方法提取得率较低,剩余的大量猴头菇水提残渣主要用作肥料或直接废弃,利用率不高,造成资源浪费[6]。研究发现,猴头菇子实体的剩余残渣部分多为细胞壁多糖,有研究采用超声提取或酸碱提取等方式[1]促进残渣中多糖的释放,但还存在能耗高及提取效率不高等问题,需要进一步开发高效提取猴头菇残渣多糖的方法。
蒸汽爆破技术因可将原料细胞壁中的不溶性物质转化为可溶性成分从而提高功能性成分的提取率而受到关注[7]。其原理是利用高温饱和蒸汽渗透到原料内部的组织孔隙中形成高压,然后瞬间释放压力导致细胞壁表面产生微孔和裂缝,进而有利于细胞中可溶性多糖的释放[8]。该技术已被用于谷物、水果和蔬菜等加工[9],也有应用于提取食用菌多糖的报道,如采用蒸汽爆破预处理的灵芝多糖得率为5.9%,是未处理组(0.56%)的10倍[10];茯苓多糖的提取得率1.01%,是未处理组(0.067%)的15倍[11]。然而,利用蒸汽爆破技术在猴头菇残渣多糖的提取中未见报道,本研究为了提高猴头菇残渣多糖的提取效率,采用蒸汽爆破技术对猴头菇子实体水提残渣进行预处理,然后结合水提醇沉法提取多糖,并利用体外发酵模型研究残渣多糖对肠道菌群的调节作用及对代谢产物短链脂肪酸的影响,为其作为潜在益生元的应用提供思路。
1. 材料与方法
1.1 材料与仪器
沪猴3号猴头菇子实体 上海沛元农业发展有限公司提供;α-淀粉酶(100 U/mg)、胃蛋白酶(3000 U/g)、胰酶(4000 U/g) 美国西格玛奥德里奇公司;BCA蛋白浓度测定试剂盒、可溶性淀粉、猪胆盐 北京索莱宝公司;酵母β-葡聚糖检测试剂盒 爱尔兰Megazyme公司;硬葡聚糖标准品(SG) 上海西宝生物科技有限公司;短链脂肪酸(SCFAs)包括乙酸、丙酸、正丁酸 上海麦克林公司;DNAzol基因组DNA快速提取试剂盒 上海美吉逾华生物医药科技有限公司;其他试剂 国药化学试剂有限公司。
HW24型电热恒温水浴锅 上海一恒科学仪器有限公司;QBS-200B型蒸汽爆破装置 中国鹤壁生物能源有限公司;LRH-250型生化培养箱 上海一恒科技有限公司;LDP-200型粉碎机 上海淀久公司;Synergy HT型多功能酶标仪 美国 Bio-Tek 公司;FE-28型pH计 上海梅特勒-托利多仪器有限公司;5415D型台式高速大容量离心机、alpha 2-4 Ldplus型冻干机 德国 Eppendorf 公司;XW-80 A型漩涡混匀仪 江苏海门市其林贝尔仪器制造有限公司;AL 204型电子天平 瑞士Mettle Toledo公司;HPSEC-MALLS-RI型高效凝胶尺寸排阻色谱-多角度激光仪散射-示差折光检测仪 美国Waters和Wyatt公司; SK-GEL系列的PWXL4000和PWXL6000(7.8 mm×300 mm)凝胶过滤柱 日本TOSOH公司;ICS-5000+型离子色谱仪 美国Thermo公司;e2695型高效液相色谱仪 美国Waters公司;VS-8401型超净工作台 上海博讯实业有限公司;MDF-1156型超低温冰箱 三洋机电有限公司。
1.2 实验方法
1.2.1 猴头菇子实体残渣蒸汽爆破预处理
猴头菇子实体水提残渣的制备,将猴头菇子实体粉末与蒸馏水按照1:20的料液比,沸水提取2 h后用滤布过滤,再将滤后的猴头菇子实体残渣重复提取1次,水提2次过滤后的子实体残渣部分60 ℃烘干后粉碎过40目筛备用(常规粉碎)。
称取上述过常规粉碎的猴头菇水提残渣粉末150~200 g,于蒸汽爆破装置中并在2 MPa的压力下处理60 s,随后在60 ℃烘箱中烘干,并粉碎过40目筛,收集备用。
1.2.2 粗多糖的提取及粗多糖得率的计算
分别称取上述蒸汽爆破预处理和常规粉碎的猴头菇子实体残渣粉末各100 g,按照料液比1:20(g:mL)加入蒸馏水,在煮沸条件下浸提两次,每次2 h,常温下离心(4000×g,20 min),合并两次上清液,在60 ℃下旋蒸浓缩至1~2 L,添加无水乙醇至溶液中乙醇的体积浓度为75%,保存于4 ℃冰箱,醇沉24 h后离心(4000×g,20 min,4 ℃),取离心后的沉淀,加入蒸馏水挥醇后冷冻干燥分别得到蒸汽爆破残渣粗多糖(HCQ)和常规粉碎的残渣粗多糖(HCW)。计算两种残渣粗多糖的得率,取三次平行的平均值,计算公式如下:
Y1(%)=M1M×100 式中:Y1为残渣粗多糖得率,%;M1为冷冻干燥后的残渣粗多糖的质量,g;M为称取的猴头菇子实体残渣原料的质量,g。
1.2.3 化学组成分析
分别称取HCQ和HCW粗多糖10 mg,于蒸馏水中溶解,配制成1 mg/mL的样品溶液。总糖含量采用苯酚-硫酸法测定[12],还原糖含量使用3,5-二硝基水杨酸(DNS)法[13]测定,多糖含量=总糖含量-还原糖含量;蛋白质含量由BCA蛋白质定量试剂盒测定[14];β-葡聚糖含量由酵母β-葡聚糖试剂盒测定[15];总酚的含量用福林酚法测定,称取 2.5 mg 的 样品并置于离心管中,加入 1 mL 蒸馏水,60 ℃搅拌溶解,以没食子酸为标准品,在λ = 760 nm 处测定吸光值。分别根据总糖的标准曲线y=10.597x+0.0441(R2=0.9992)、还原糖的标准曲线y=0.7114x+0.0324(R2=0.9973)、蛋白含量的标准曲线y=1.0185x+0.0918(R2=0.9975)和总酚含量的标准曲线y=0.0018x+0.0558(R2=0.9985)计算其含量。
1.2.4 单糖组成测定
分别称取HCQ和HCW粗多糖2 mg于V-型瓶中,加入3 mL的TFA(2 mol/L)于110 ℃油浴锅中,水解4 h,冷却至室温,将反应瓶置于氮气下吹干以除去TFA,再向瓶中加入3 mL甲醇,氮气吹干,重复4~5次至无酸味后,以超纯水溶解后定容至50 mL的容量瓶中,然后稀释至合适浓度,经0.45 μm滤膜过滤后采用阴离子色谱仪分析HCQ和HCW的单糖组成[16]。其测定条件:CarboPac PA20(150 mm×3 mm)阴离子交换分析柱;流动相为2 mmol/L的氢氧化钠淋洗液,流速为0.4 mL/min,柱温25 ℃,进样量25 μL,时间30 min。
1.2.5 分子量分布特征分析
分别称取HCQ和HCW粗多糖溶解在1.5 mL的蒸馏水中,然后通过0.45 μm的水相微孔膜过滤后备用。采用HPSEC-MALLS-RI联用系统分析测定残渣多糖组分的重均分子量[17],根据色谱柱的检测范围,将TSK-GEL系列的PWXL4000和PWXL6000(7.8 mm×300 mm)的凝胶过滤柱进行串联。设置流速为0.5 mL/min,柱温为35 ℃,进样体积为100 μL。使用ASTRA软件(版本6.1.1)进行数据收集和分析。
1.2.6 体外模拟消化实验
体外模拟唾液、胃和小肠消化液三个阶段消化模型参考文献[18]的方法,并略作修改。
模拟唾液消化:用1 mol/L的盐酸将唾液消化液的pH调至7.0,在37 ℃水浴中预热15 min后,分别将HCQ和HCW多糖溶液(5.0 mg/mL,4 mL)、CaCl2溶液(0.3 mol/L,0.025 mL)和α-淀粉酶溶液(75 U/mL,0.4 mL)加入到3.2 mL唾液消化液中。加入蒸馏水将溶液补充至8.0 mL,在37℃下孵育5 min。分别收集2.0 mL体外消化0和5 min的样品。最后,将剩余模拟唾液的消化液用1 mol/L的盐酸调节pH至3.0。
模拟胃消化:将胃液消化液在37 ℃水浴中预热15 min后,加入上一阶段剩余的4.0 mL唾液消化液中,再分别加入胃蛋白酶溶液(2000 U/mL,0.2 mL),CaCl2溶液(0.3 mol/L,0.005 mL)、加入蒸馏水将溶液补充至8 mL,在37 ℃下孵育4 h。分别在体外胃消化的0、2和4 h各收集1.0、1.0和2.0 mL消化样品。最后,用1 mol/L的氢氧化钠将剩余的胃消化液pH调至7.0。
模拟小肠消化:将肠液消化液在37 ℃水浴中预热15 min后,加入上一阶段剩余的4.0 mL胃消化液,再分别加入胆盐溶液(10 mmol/L,0.1 mL)、CaCl2溶液(0.3 mol/L,0.008 mL)、胰酶溶液(100 U/mL,0.1 mL),加入蒸馏水将其补充至8.0 mL。在37 ℃下分别孵育0、2、4和6 h,并收集各时间段1.0 mL的消化样品。
最后,将唾液-胃-小肠三个阶段不同消化时间的样品进行总糖和还原糖含量的测定。方法同1.2.3。
1.2.7 体外模拟人体粪便发酵实验
体外模拟发酵实验的方法参考文献[19]并对其方法进行一定的改进。以不添加碳源的基本培养基作空白对照,命名为CON;以0.1%的浓度来称取HCQ样品与按0.9%的淀粉样品混合,使其终浓度为1%(w/v)来作为基础碳源,用基本培养基溶解后命名为HCQ;以0.1%的浓度来称取HCW样品与按0.9%的淀粉样品混合,使其终浓度为1%(w/v)来作为基础碳源,用基本培养基溶解后命名为HCW;添加1%(w/v)淀粉作阳性对照,用基本培养基溶解后命名为AmY。并用1 mol/L HCl分别将上述配制好的四组样品培养基CON、HCQ、HCW和AmY组的pH调至7.0,于121 ℃条件下灭菌15 min。随后以1:9(v:v)的接种量接入粪便悬浮液,于37 ℃厌氧培养箱内进行培养,每组实验5个平行。分别在发酵的0、12、24和48 h四个时间段进行取样,离心(4000×g,10 min)后,上清液用于测定pH(pH计测定)、总糖、还原糖含量,将离心后的48 h的沉淀物储存在−80 ℃超低温冰箱中,进一步对肠道菌群进行分析。
1.2.8 肠道菌群分析
取1.2.7中储存的48 h离心后的沉淀物,使用DNAzol基因组DNA快速提取试剂盒提取沉淀物中的肠道微生物中的DNA,在1%琼脂糖凝胶电泳上可见。随后将提取合格的样品送至上海美吉生物有限公司检测,测序操作在在Illumina Miseq平台上进行(www..majorbio.com)。
1.2.9 短链脂肪酸(SCFAs)检测
短链脂肪酸(SCFAs)的测定参考文献[20]的方法并稍作修改。高效液相色谱条件:Green ODS-AQ C18的色谱柱;流动相A为20 mmol/L KH2PO4缓冲盐,用磷酸将pH调为2.8,并经0.22 μm滤膜过滤除去不溶物,流动相B为乙腈。按A泵(80%)与B泵(20%)的比例进行等浓度洗脱,柱温为30 ℃,流速为1.0 mL/min,检测波长为210 nm,进样量100 μL,时间20 min。
样品液中SCFAs的提取制备:将0、12、24和48 h四个时间点的发酵溶液离心(4000 g,10 min),取离心后的上清液加入100 μL的浓盐酸酸化,加入2 mL无水乙醚萃取20 min,并于10 ℃下离心(4000×g,5 min),取上清液后加入500 μL 1 mol/L NaOH,等待20 min后离心(4000×g,5 min),去除上层溶液,留沉淀物,并向沉淀物中加入100 μL的浓盐酸得到样品溶液,使用0.22 μm滤膜过滤后,滤液按照上述条件进行检测。
标准曲线的绘制:分别精密称取乙酸、丙酸、丁酸、戊酸和异戊酸0.1 g溶于5 mL蒸馏水中,制成标准贮备母液。将配制好的标准贮备母液用超纯水溶液混合稀释成2000、1500、1000、750、500、250 μg/mL的系列混标溶液,使用0.22 μm滤膜过滤后,滤液按照上述条件进行检测。
1.3 数据处理
所有实验设三次平行,数据以用平均值±标准差表示。基于P<0.05的显著性水平,使用SPSS 26.0软件(美国IBM公司)进行统计分析。使用单向方差分析(ANOVA),然后用5%置信水平的Tukey检验来计算显著性差异。Origin软件版本2023(OriginLab Corporation,USA)用来绘制图片。
2. 结果与分析
2.1 蒸汽爆破预处理残渣粗多糖的得率及理化特征对比分析
2.1.1 得率及含量分析
由表1可知,蒸汽爆破预处理所得HCQ粗多糖的得率以及多糖、β-葡聚糖和总酚含量分别达到了13.36%、58.20%、47.93%和3.17%,均显著(P<0.05)高于常规粉碎的HCW粗多糖,是其2.18、1.57、1.59和2.06倍,相反地,蒸汽爆破预处理降低了猴头菇子实体水提残渣中的蛋白含量,这可能是由于剧烈的操作条件导致猴头菇内在结构被破坏,使得多糖含量占比提高,而蛋白含量占比相对降低[21]。这说明采用蒸汽爆破预处理可显著提高残渣多糖的提取得率及其他成分的含量。而多糖含量增加的原因可能是由于蒸汽爆破预处理使细胞壁紧密的结构变得疏松多孔,从而使原本与细胞壁紧密结合的一些物质如多糖等被释放[22]。
表 1 两种不同处理的猴头菇水提残渣粗多糖得率及化学成分含量对比Table 1. Comparison on yield and chemical compositions content of crude polysaccharides from two different pretreated Hericium erinaceus water extracted residues前处理方法 得率(%) 多糖含量(%) β-葡聚糖含量(%) 蛋白含量(%) 总酚含量(%) HCW 6.12±0.63b 37.05±1.06b 30.09±0.71b 13.24±0.01a 1.52±0.08b HCQ 13.36±0.96a 58.20±1.77a 47.93±0.37a 9.26±0.02b 3.17±0.15a 注:不同字母表示每组的不同处理方式的差异显著分析,P<0.05。 2.1.2 单糖组成分析
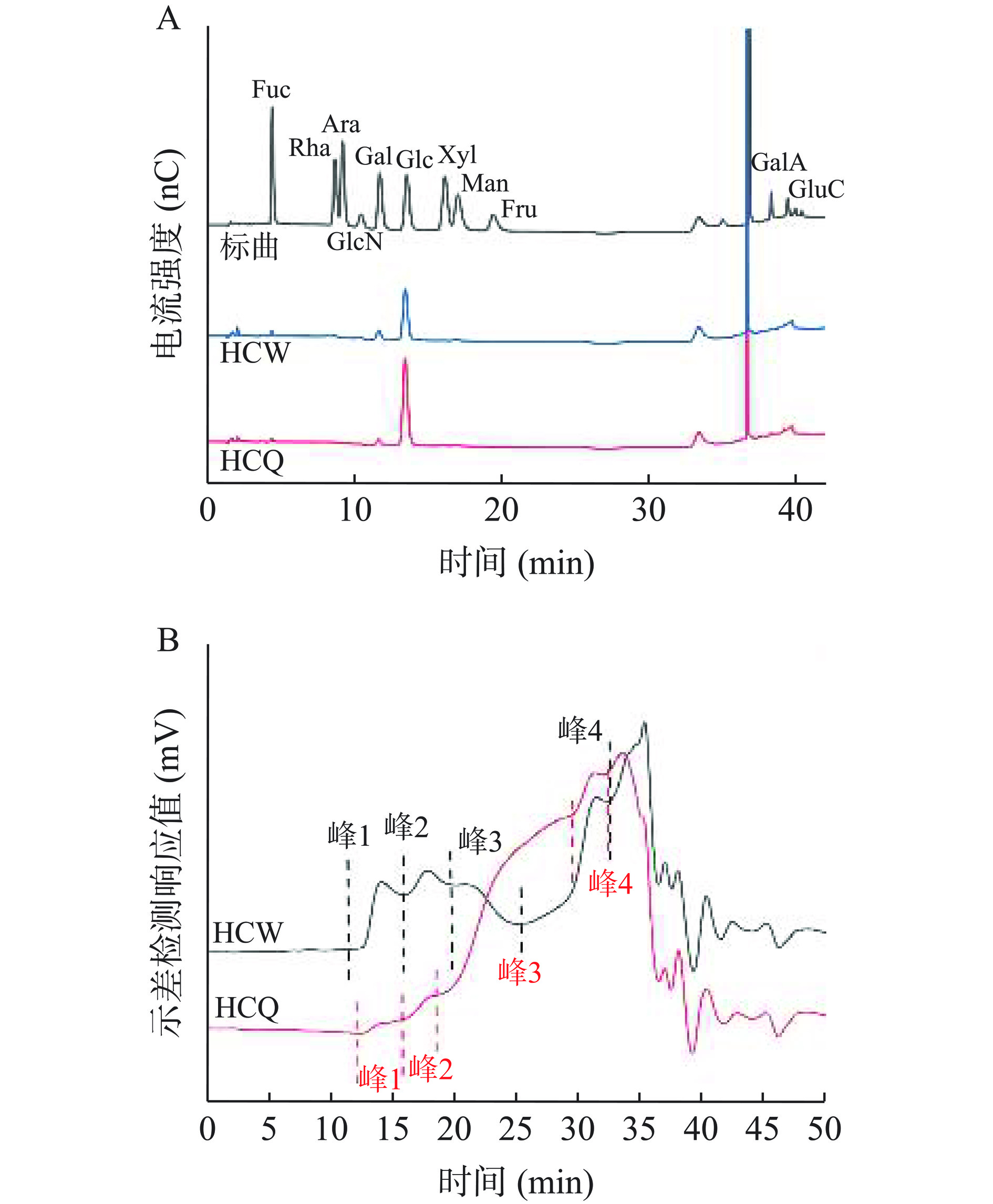
单糖组成是了解多糖结构的基本信息,如图1A所示,将HCQ和HCW的单糖组成与标准品的出峰时间进行对比,HCQ粗多糖主要由葡萄糖(90.86%)、半乳糖(4.86%)、岩藻糖(2.19%)和甘露糖(2.09%)组成;HCW粗多糖主要由葡萄糖(80.78%)、半乳糖(12.54%)、岩藻糖(4.48%)和甘露糖(2.19%)组成,蒸汽爆破预处理前后的单糖组成种类与传统的水提和碱提得到的猴头菇多糖大致相似[6,23],但单糖组成的比例发生明显变化,蒸汽爆破预处理所得HCQ的葡萄糖相对摩尔百分比由常规粉碎HCW的80.78%明显提高到90.86%,这可能是由于剧烈的蒸汽爆破操作条件能促进细胞壁中的葡聚糖释放。
![]() 图 1 两种不同处理的猴头菇水提残渣粗多糖的单糖组成和分子量注:Fuc-岩藻糖;Rha-鼠李糖;Ara-阿拉伯糖;GlcN-葡萄糖胺;Gal-半乳糖;Glc-葡萄糖;Xyl-木糖;Man-甘露糖;Fru-果糖;GalA-半乳糖醛酸;GlcA-葡萄糖醛酸。Figure 1. Monosaccharide compositions and molecular weight distributions of crude polysaccharides from two different pretreated Hericium erinaceus water extracted residues
图 1 两种不同处理的猴头菇水提残渣粗多糖的单糖组成和分子量注:Fuc-岩藻糖;Rha-鼠李糖;Ara-阿拉伯糖;GlcN-葡萄糖胺;Gal-半乳糖;Glc-葡萄糖;Xyl-木糖;Man-甘露糖;Fru-果糖;GalA-半乳糖醛酸;GlcA-葡萄糖醛酸。Figure 1. Monosaccharide compositions and molecular weight distributions of crude polysaccharides from two different pretreated Hericium erinaceus water extracted residues2.1.3 分子量测定
由HCQ和HCW的分子量分布特征的分析结果(图1B和表2)可知,各组分的色谱洗脱峰主要出现在18~35 min,经过蒸汽爆破预处理后的样品,其分子量的变化较为明显。相对于常规粉碎HCW的组分,蒸汽爆破预处理的HCQ中保留时间为10~15 min的峰1所占比例降低,但分子量有一定的提高,由5.529×106 g/mol提高到2.189×107 g/mol;而蒸汽爆破的剧烈条件使峰2、峰3和峰4的分子量发生明显降低且促进了这部分组分的释放。有文献报道经过蒸汽爆破的预处理,会导致其分子量略有下降,说明部分高分子量多糖逐渐被降解为低分子量多糖和低聚糖[21]。说明经过蒸汽爆破预处理可促进HCQ多糖组分的释放,也进一步提高了目的产物残渣多糖的得率和含量。
表 2 两种不同处理的猴头菇水提残渣粗多糖分子量分析对比Table 2. Comparison on molecular weights of crude polysaccharides from two different pretreated Hericium erinaceus water extracted residues样品 峰 1 峰 2 峰 3 峰 4 HCW 5.529×106 2.689×107 6.307×106 6.946×105 HCQ 2.189×107 1.738×106 1.809×105 1.128×105 2.2 体外消化特性
总糖和还原糖含量的变化可以反映多糖是否可以在唾液-胃-小肠内被消化,从表3可以看出,在模拟消化的每个阶段过程中,HCQ和HCW的总糖和还原糖含量均无显著变化(P>0.05),但是在模拟胃消化阶段中,其还原糖含量相对于唾液消化有一定程度的提高,这可能是由于在胃消化酸性条件下造成的多糖链中部分糖苷键断裂导致还原端暴露[19]。这也进一步表明,HCQ和HCW多糖化学组成在唾液-胃-小肠的消化条件下是相对稳定的,具有一定的抗消化特性,可以被导向至结肠中被肠道微生物所利用和发酵。
表 3 不同消化时间内的总糖和还原糖含量变化Table 3. Changes of total sugar and reducing sugar content in different digestion times模拟消化 时间 总糖含量(mg/mL) 还原糖含量(mg/mL) HCQ HCW HCQ HCW 唾液消化 0 min 1.536±0.003a 1.037±0.002a 0.022±0.004a 0.027±0.000a 5 min 1.420±0.007a 1.050±0.009a 0.027±0.012a 0.030±0.003a 胃液消化 0 h 0.862±0.010a 0.712±0.004a 0.063±0.044a 0.066±0.007a 2 h 0.898±0.011a 0.670±0.005a 0.059±0.011a 0.063±0.005a 4 h 0.829±0.005a 0.625±0.003a 0.056±0.008a 0.068±0.002a 小肠消化 0 h 0.529±0.016a 0.281±0.021a 0.025±0.018a 0.049±0.003a 2 h 0.480±0.007a 0.330±0.007a 0.027±0.013a 0.053±0.002a 4 h 0.509±0.004a 0.335±0.013a 0.026±0.019a 0.050±0.003a 6 h 0.485±0.008a 0.353±0.010a 0.028±0.009a 0.040±0.003a 注:字母表示样品在每个消化阶段不同时间点的组内差异显著分析,P<0.05。 2.3 体外模拟人体粪便发酵特性
2.3.1 发酵过程中不同时间点的pH、还原糖和总糖含量的变化
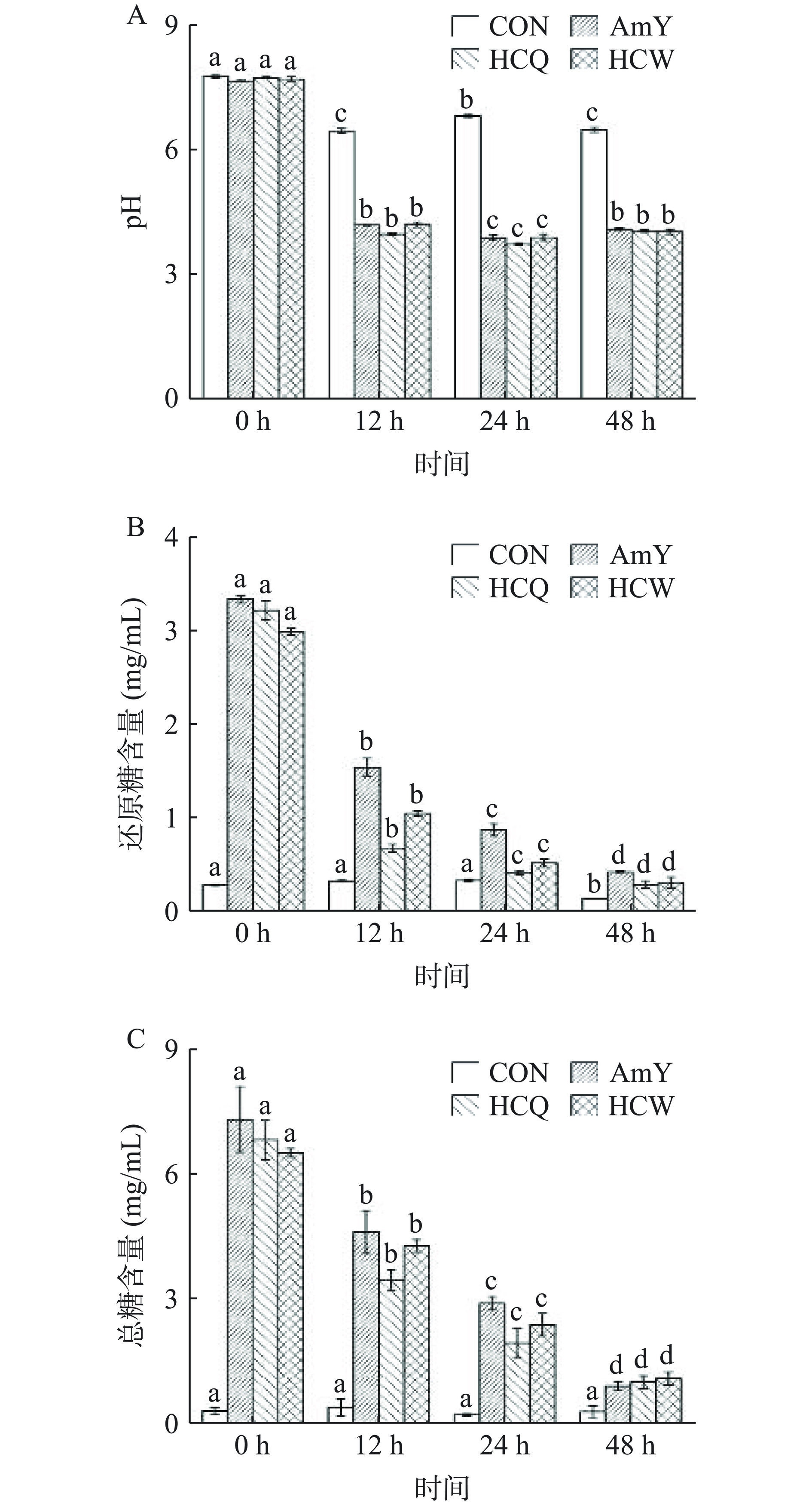
研究表明,不被消化系统所降解的碳水化合物可被结肠中的肠道微生物所发酵,可产生有益的代谢产物如有机酸(SCFAs)等,可降低结肠环境的pH以改变肠道的酸碱度,维持生理平衡,对机体产生有益影响[24]。本研究通过利用体外粪便厌氧发酵模型,进一步探究蒸汽爆破预处理后的HCQ和常规粉碎后的HCW多糖分别在调节肠道菌群的功能活性方面的优势。其发酵的不同时间内的pH、还原糖和总糖含量结果如图2A、2B和2C所示。
在发酵的过程中,pH是反映发酵是否正常的重要检测指标之一。在发酵的0~48 h内,空白对照组CON的pH相较其他组变化不明显,而碳源组AmY、HCQ 和 HCW 的 pH 在发酵的前 12 h 内显著(P<0.05)下降,后趋于稳定。而在发酵的0~48 h内,其三个碳源组AmY、HCQ和HCW的还原糖和总糖含量显著(P<0.05)被消耗,表明在此期间肠道微生物能够利用所加入的多糖碳源来维持其自身的生长和发育,而发酵液的pH降低可能是由于肠道微生物产生有机酸、SCFAs等代谢产物引起的。这些结果均可表明,HCQ和HCW碳源的加入能够被肠道微生物所利用。
2.3.2 体外发酵过程中肠道菌群的α及β多样性分析
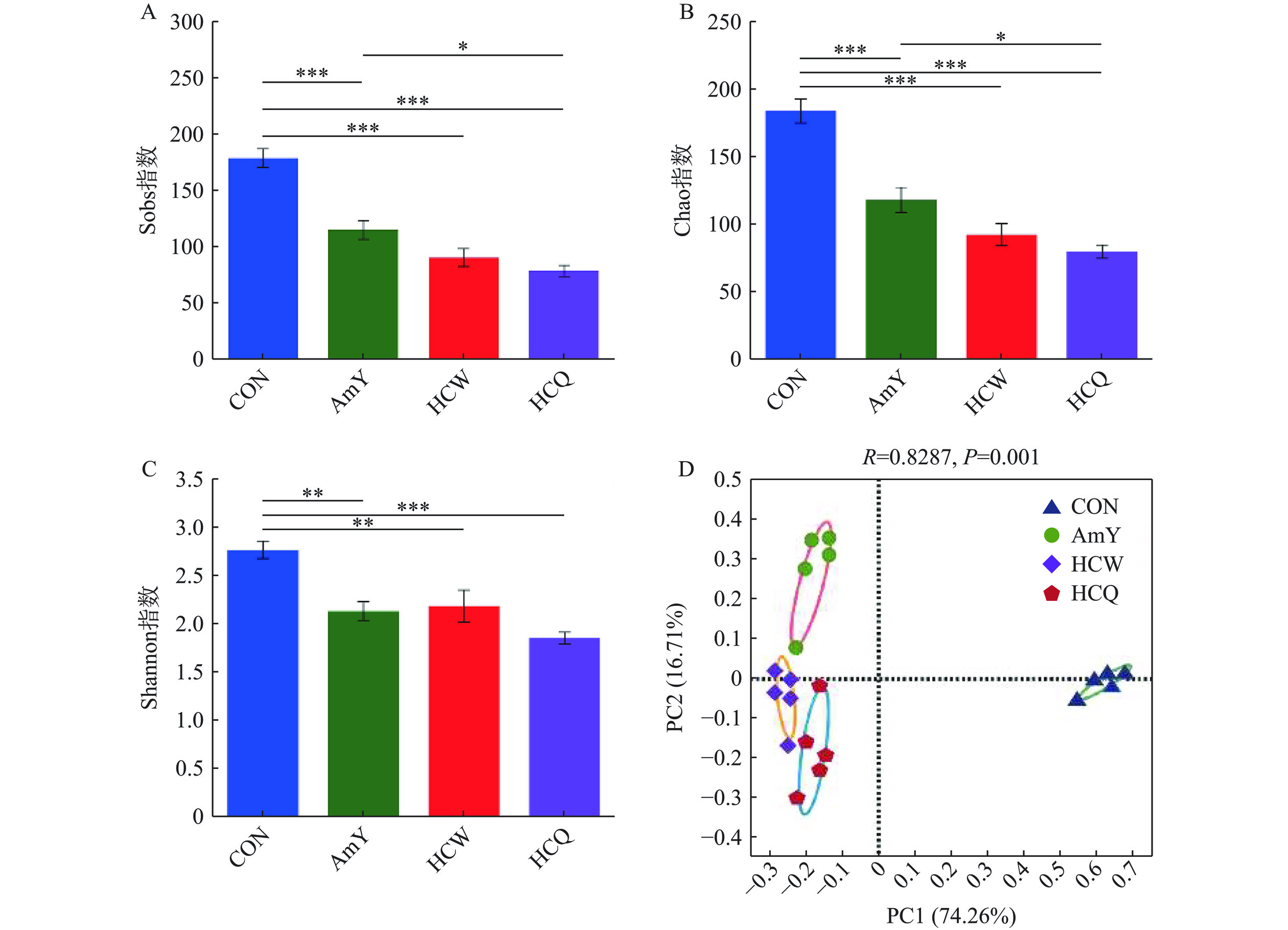
在本研究中,利用16S 多样性测序技术对粪便发酵48 h后的样品进行高通量测序分析,以揭示难消化的HCQ和HCW多糖对微生物组成的影响。α-多样性分析可以表明肠道微生物的多样性和丰富度,其中,Sobs和Chao指数均反映肠道微生物的丰富度,而Shannon指数反映的是肠道微生物的多样性[25]。如图3A~C所示,与空白组CON相比,添加了HCW和HCQ碳源组均降低了Sobs、Chao和Shannon指数,说明碳源的加入对肠道菌群的整体组成和结构有显著的影响(P<0.05)。主坐标分析(PCoA)为β-多样性分析方法中的一种,可反映不同样品组中肠道菌群的差异性,如图3D所示,肠道微生物明显被分为四个区域,HCQ和HCW组的肠道微生物分布的位置较近,这表明两者对肠道微生物的区系分布及调控作用虽然有所差异但具有较大的相似性。这也与之前报道过的文献,在模拟发酵过程中加入多糖碳源可改变肠道微生物的组成[19,25],也进一步表明HCQ和HCW多糖可以作为一种潜在的益生元,可改善人体的健康。
2.3.3 体外发酵过程中对肠道菌群结构的分析
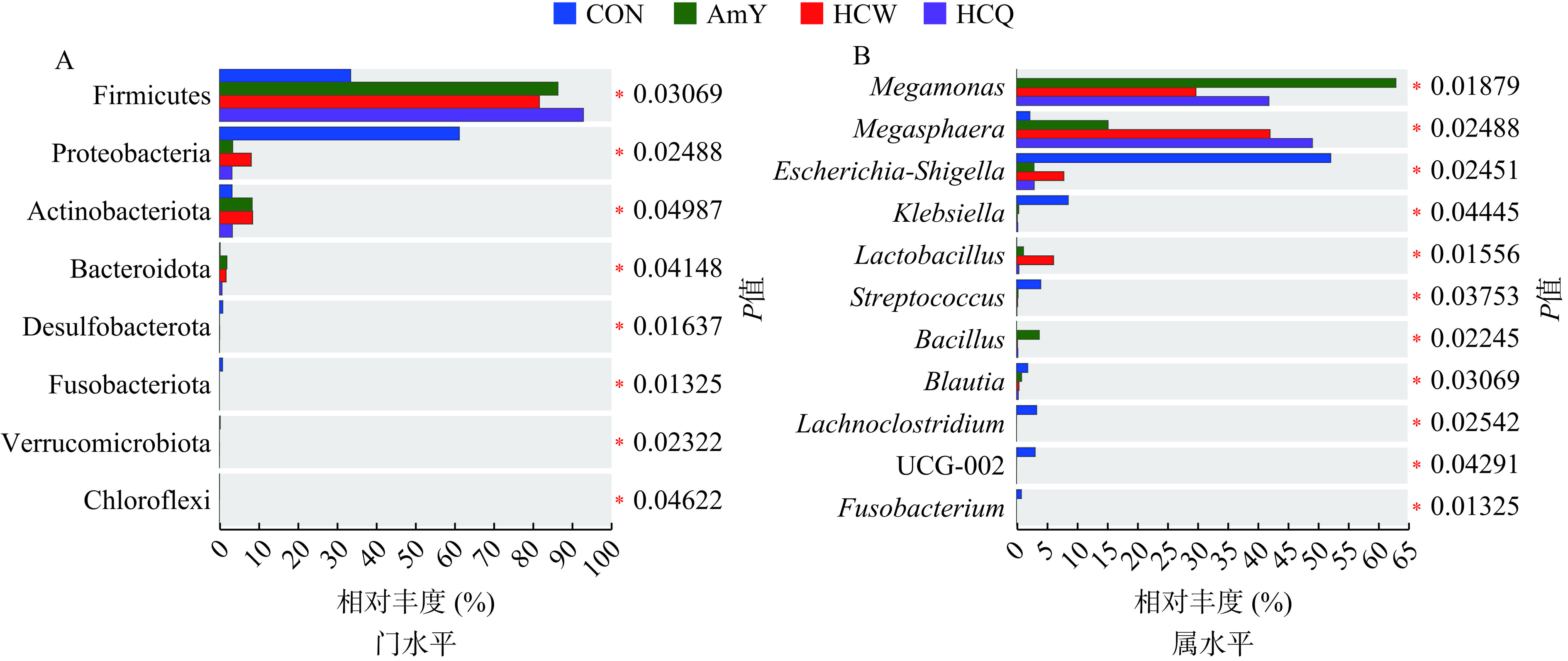
图4A显示了发酵48 h的肠道菌群在门水平上的组成结构。在门水平上,相比于空白CON组,添加了HCW和HCQ碳源组均显著(P<0.05)提高了有益菌厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和放线菌门(Actinobacteriota)的相对丰度,结肠环境中的厚壁菌门可以通过消耗碳水化合物来产生SCFAs对宿主健康有积极的调节作用[26];拟杆菌门可通过刺激产生多种碳水化合物活性酶(如糖苷酶和裂解酶)来降解和利用难消化的多糖并生成SCFAs[27];而放线菌门中,主要包含乳酸杆菌和双歧杆菌等有益菌,能够产生乳酸和乙酸盐等发酵产物,提高肠道免疫力,发挥抗肿瘤作用[28]。另外,与CON相比,HCQ和HCW均显著(P<0.05)降低有害菌变形菌门(Proteobacteria)的相对丰度,变形菌门丰度的增加会导致肠道微生物失调,并提高致病菌的丰度,进而影响宿主的健康[29],但两者侧重点不一样,HCW可选择性提高放线菌门的丰度,而HCQ主要提高厚壁菌门的丰度,也有文献表明,具有调节肠道菌群活性的多糖的单糖组成中其葡萄糖摩尔占比越高,其益生菌如厚壁菌门的活性就越强[30]。
图4B显示了发酵48 h的肠道菌群在属水平上的组成结构。在属水平上,与CON对比,HCW和HCQ均显著(P<0.05)降低了有害菌埃希氏-志贺氏菌(Escherichia-Shigella)、梭杆菌属(Fusobacterium)和克雷伯氏菌属(Klebsiella)的丰度;与CON对比,HCQ和HCW在调节肠道菌群种类和丰度侧重点不一样,HCQ显著(P<0.05)提高了有益菌巨球菌属(Megasphaera)和巨单胞菌属(Megamonas)的丰度,而HCW显著(P<0.05)提高了巨球菌属、巨单胞菌属和乳酸杆菌属(Lactobacillus)。而巨球菌属可以使高乳酸产生正常化并刺激丁酸的产生[31];巨单胞菌属的增殖可以通过竞争碳水化合物的摄入来抑制有害菌的生长,其主要代谢产物为乙酸和丙酸[32];乳酸杆菌能够通过促进碳水化合物的降解,促进SCFAs的产生,并可抑制有害菌大肠杆菌的生长,降低机体被病原体感染的风险[33]。综上所述,蒸汽爆破预处理后得到的HCQ和常规粉碎的HCW多糖均能够促进有益菌的增殖,并改善肠道环境发挥出益生元活性。
2.3.4 体外发酵过程中短链脂肪酸含量的变化
短链脂肪酸(SCFAs)主要是由结肠内的菌群利用未消化的碳水化合物进行发酵的代谢产物,具有调节肠道微生物区系的平衡、维持和改善肠道功能[24]。其中乙酸、丙酸和丁酸的总含量占总的短链脂肪酸含量的95%,对人体健康方面起到关键作用[34]。
由表4可以看出,在发酵12~24 h期间,HCW和HCQ组中的丁酸含量产生较少,这可能与大分子糖不易被消化有关,但在体外发酵48 h后,两组的丁酸含量显著(P<0.05)高于CON和AmY组,这可能与巨球菌属和普雷沃氏菌属丰度的增加有关,该类菌可产丁酸盐[31,33]。而丁酸作为肠道细胞的重要能量来源,其含量的提高也进一步表明肠道中相应的有益菌丰度的提高,具有保护肠粘膜屏障,并抑制结肠癌细胞[35]。与CON相比,HCW显著(P<0.05)提高丁酸的含量,而HCQ显著(P<0.05)提高乙酸和丙酸的含量,这可能是由于巨单胞菌属在HCQ组中为优势菌群,而巨单胞菌属可消耗碳水化合物来产生乙酸和丙酸[32]。此外,HCW和HCQ均显著(P<0.05)提高了总SCFAs的含量,但HCQ提高的更加明显,这可能与蒸汽爆破预处理后的葡萄糖含量明显提高有关。由于肠道菌群主要通过代谢产物SCFAs来调节机体中的糖代谢,而丙酸和丁酸在葡萄糖代谢和能量平衡的稳态方面具有重要意义[36],产生的SCFAs可降低肠道环境的pH,有利于肠道中有益菌的生长[24]。
表 4 体外模拟发酵过程中短链脂肪酸含量的变化Table 4. Changes the content of SCFAs during in vitro fermentationSCFAs
(mmol/L)时间
(h)CON AmY HCW HCQ 乙酸 0 ND ND ND ND 12 3.54±0.01b,C 14.84±0.38c,B 21.40±0.86a,A 22.35±0.43b,A 24 6.49±0.61a,B 20.19±0.70b,A 22.66±1.27a,A 23.98±0.59b,A 48 9.08±1.12a,D 24.10±1.38a,B 19.00±0.60a,C 28.85±1.35a,A 丙酸 0 ND 3.28±1.61c,A ND ND 12 2.40±0.04b,D 13.67±0.84b,B 5.82±1.29b,C 18.60±1.38b,A 24 6.25±0.64a,B 13.10±1.11b,A 3.17±0.37b,C 12.51±0.01c,A 48 8.34±1.28a,C 30.52±0.65a,A 19.93±1.53a,B 32.25±0.35a,A 丁酸 0 0.36±0.03c,A ND 0.23±0.03c,A 0.09±0.05c,A 12 0.38±0.03c,A ND 0.20±0.02c,A 0.37±0.03c,A 24 2.06±0.54b,A 0.53±0.04b,B 0.92±0.08b,A 1.15±0.13b,A 48 9.98±0.95a,C 11.30±1.41a,C 41.35±0.65a,A 30.71±1.33a,B 总酸 0 0.36±0.03d,B 3.28±0.20d,A 0.23±0.03c,B 0.34±0.23d,B 12 6.46±0.22c,C 28.58±1.11c,B 27.42±0.72b,B 41.87±1.61b,A 24 14.79±0.90b,D 33.81±0.26b,B 26.75±0.51b,C 37.64±0.65c,A 48 27.40±0.19a,D 65.92±0.61a,C 81.23±0.06a,B 92.69±0.54a,A 注:不同小写字母表示同一组内不同时间差异显著(P<0.05),不同大写字母表示同一时间不同组间差异显著(P<0.05),ND-未检测到含量。 3. 结论
本研究证明,蒸汽爆破预处理相对于常规粉碎可以显著提高猴头菇子实体水提残渣多糖的得率以及多糖和β-葡聚糖含量。通过模拟唾液-胃-小肠消化,发现两种处理所得多糖均具有抗消化特性,使其能够到达结肠被肠道菌群进一步发酵和利用。HCQ可以提高厚壁菌门如巨球菌属等有益菌丰度,而HCW则提高放线菌门如乳酸杆菌属等有益菌的丰度,两种不同处理的多糖均可显著降低变形杆菌门如埃希氏-志贺氏菌等有害菌的丰度。另外,添加两种多糖均能明显提高代谢产物SCFAs的产量,HCW组丁酸产量更高,HCQ组乙酸和丙酸的产量更高,但HCQ组总SCFAs的产量高于HCW组。本研究为蒸汽爆破技术在高效提取制备食用菌残渣多糖中的应用提供了参考,也为蒸汽爆破所得多糖组分(HCQ)在益生元或功能性食品开发领域的应用提供依据。
-
图 1 两种不同处理的猴头菇水提残渣粗多糖的单糖组成和分子量
注:Fuc-岩藻糖;Rha-鼠李糖;Ara-阿拉伯糖;GlcN-葡萄糖胺;Gal-半乳糖;Glc-葡萄糖;Xyl-木糖;Man-甘露糖;Fru-果糖;GalA-半乳糖醛酸;GlcA-葡萄糖醛酸。
Figure 1. Monosaccharide compositions and molecular weight distributions of crude polysaccharides from two different pretreated Hericium erinaceus water extracted residues
表 1 两种不同处理的猴头菇水提残渣粗多糖得率及化学成分含量对比
Table 1 Comparison on yield and chemical compositions content of crude polysaccharides from two different pretreated Hericium erinaceus water extracted residues
前处理方法 得率(%) 多糖含量(%) β-葡聚糖含量(%) 蛋白含量(%) 总酚含量(%) HCW 6.12±0.63b 37.05±1.06b 30.09±0.71b 13.24±0.01a 1.52±0.08b HCQ 13.36±0.96a 58.20±1.77a 47.93±0.37a 9.26±0.02b 3.17±0.15a 注:不同字母表示每组的不同处理方式的差异显著分析,P<0.05。 表 2 两种不同处理的猴头菇水提残渣粗多糖分子量分析对比
Table 2 Comparison on molecular weights of crude polysaccharides from two different pretreated Hericium erinaceus water extracted residues
样品 峰 1 峰 2 峰 3 峰 4 HCW 5.529×106 2.689×107 6.307×106 6.946×105 HCQ 2.189×107 1.738×106 1.809×105 1.128×105 表 3 不同消化时间内的总糖和还原糖含量变化
Table 3 Changes of total sugar and reducing sugar content in different digestion times
模拟消化 时间 总糖含量(mg/mL) 还原糖含量(mg/mL) HCQ HCW HCQ HCW 唾液消化 0 min 1.536±0.003a 1.037±0.002a 0.022±0.004a 0.027±0.000a 5 min 1.420±0.007a 1.050±0.009a 0.027±0.012a 0.030±0.003a 胃液消化 0 h 0.862±0.010a 0.712±0.004a 0.063±0.044a 0.066±0.007a 2 h 0.898±0.011a 0.670±0.005a 0.059±0.011a 0.063±0.005a 4 h 0.829±0.005a 0.625±0.003a 0.056±0.008a 0.068±0.002a 小肠消化 0 h 0.529±0.016a 0.281±0.021a 0.025±0.018a 0.049±0.003a 2 h 0.480±0.007a 0.330±0.007a 0.027±0.013a 0.053±0.002a 4 h 0.509±0.004a 0.335±0.013a 0.026±0.019a 0.050±0.003a 6 h 0.485±0.008a 0.353±0.010a 0.028±0.009a 0.040±0.003a 注:字母表示样品在每个消化阶段不同时间点的组内差异显著分析,P<0.05。 表 4 体外模拟发酵过程中短链脂肪酸含量的变化
Table 4 Changes the content of SCFAs during in vitro fermentation
SCFAs
(mmol/L)时间
(h)CON AmY HCW HCQ 乙酸 0 ND ND ND ND 12 3.54±0.01b,C 14.84±0.38c,B 21.40±0.86a,A 22.35±0.43b,A 24 6.49±0.61a,B 20.19±0.70b,A 22.66±1.27a,A 23.98±0.59b,A 48 9.08±1.12a,D 24.10±1.38a,B 19.00±0.60a,C 28.85±1.35a,A 丙酸 0 ND 3.28±1.61c,A ND ND 12 2.40±0.04b,D 13.67±0.84b,B 5.82±1.29b,C 18.60±1.38b,A 24 6.25±0.64a,B 13.10±1.11b,A 3.17±0.37b,C 12.51±0.01c,A 48 8.34±1.28a,C 30.52±0.65a,A 19.93±1.53a,B 32.25±0.35a,A 丁酸 0 0.36±0.03c,A ND 0.23±0.03c,A 0.09±0.05c,A 12 0.38±0.03c,A ND 0.20±0.02c,A 0.37±0.03c,A 24 2.06±0.54b,A 0.53±0.04b,B 0.92±0.08b,A 1.15±0.13b,A 48 9.98±0.95a,C 11.30±1.41a,C 41.35±0.65a,A 30.71±1.33a,B 总酸 0 0.36±0.03d,B 3.28±0.20d,A 0.23±0.03c,B 0.34±0.23d,B 12 6.46±0.22c,C 28.58±1.11c,B 27.42±0.72b,B 41.87±1.61b,A 24 14.79±0.90b,D 33.81±0.26b,B 26.75±0.51b,C 37.64±0.65c,A 48 27.40±0.19a,D 65.92±0.61a,C 81.23±0.06a,B 92.69±0.54a,A 注:不同小写字母表示同一组内不同时间差异显著(P<0.05),不同大写字母表示同一时间不同组间差异显著(P<0.05),ND-未检测到含量。 -
[1] 黄越, 周春晖, 黄惠华. 不同提取方法猴头菇粗多糖的表征及其抗氧化活性的比较[J]. 食品工业科技,2017,38(3):80−86. [HUANG Yue, ZHOU Chunhui, HUANG Huihua. Characterization and antioxidant activity analysis on the crude Hericium erinaceus polysaccharides extracted by different methods[J]. Science and Technology of Food Industry,2017,38(3):80−86.] HUANG Yue, ZHOU Chunhui, HUANG Huihua. Characterization and antioxidant activity analysis on the crude Hericium erinaceus polysaccharides extracted by different methods[J]. Science and Technology of Food Industry, 2017, 38(3): 80−86.
[2] WANG M X, GAO Y, XU D D, et al. A polysaccharide from cultured mycelium of Hericium erinaceus and its anti-chronic atrophic gastritis activity[J]. International Journal of Biological Macromolecules,2015,81:656−661. doi: 10.1016/j.ijbiomac.2015.08.043
[3] PARK Y S, LEE H S, WON M H, et al. Effect of an exo-polysaccharide from the culture broth Hericium erinaceus on enhancement of growth and differentiation of rat adrenal nerve cells[J]. Cytotechnology,2003,39(3):155−162.
[4] LI X Y, WANG Z Y, WANG L, et al. In vitro antioxidant and anti-proliferation activities of polysaccharides from various extracts of different mushrooms[J]. International Journal of Molecular Sciences,2012,13(5):5801−5817. doi: 10.3390/ijms13055801
[5] WANG J C, HU S H, WANG J T, et al. Hypoglycemic effect of extract of Hericium erinaceus[J]. Journal of the Science of Food and Agriculture,2005,85(4):641−646. doi: 10.1002/jsfa.1928
[6] 林华娟, 秦小明. 猴头菇子实体碱溶性葡聚糖的分离纯化[J]. 食用菌学报,2006,13(2):65−68. [LIN Huajuan, QIN Xiaoming. Isolation and purification of alkali-soluble dextran from fruit body of Hericium erinaceus[J]. Acta Edulis Fungi,2006,13(2):65−68.] doi: 10.3969/j.issn.1005-9873.2006.02.008 LIN Huajuan, QIN Xiaoming. Isolation and purification of alkali-soluble dextran from fruit body of Hericium erinaceus[J]. Acta Edulis Fungi, 2006, 13(2): 65−68. doi: 10.3969/j.issn.1005-9873.2006.02.008
[7] SUI W J, XIE X, LIU R, et al. Effect of wheat bran modification by steam explosion on structural characteristics and rheological properties of wheat flour dough[J]. Food Hydrocolloids,2018,84:571−580. doi: 10.1016/j.foodhyd.2018.06.027
[8] LIU C Y, SUN Y Y, JIA Y Q, et al. Effect of steam explosion pretreatment on the structure and bioactivity of Ampelopsis grossedentata polysaccharides[J]. International Journal of Biological Macromolecules,2021,185:194−205. doi: 10.1016/j.ijbiomac.2021.06.002
[9] 张博华, 马超, 张明, 等. 蒸汽爆破技术应用现状研究[J]. 中国果菜,2020,40(7):31−34,38. [ZHANG Bohua, MA Chao, ZHANG Ming, et al. The application status of steam explosion technology[J]. China Fruit & Vegetable,2020,40(7):31−34,38.] ZHANG Bohua, MA Chao, ZHANG Ming, et al. The application status of steam explosion technology[J]. China Fruit & Vegetable, 2020, 40(7): 31−34,38.
[10] 石敏, 汪何雅, 成玉梁, 等. 蒸汽爆破法预处理制取的灵芝粗提物安全性评价初步研究[J]. 食品工业科技,2014(6):338−342. [SHI Min, WANG Heya, CHENG Yuliang, et al. Study on primary safety evaluation of extractive from Ganoderma lucidum pretreatmented by steam explosion[J]. Science and Technology of Food Industry,2014(6):338−342.] SHI Min, WANG Heya, CHENG Yuliang, et al. Study on primary safety evaluation of extractive from Ganoderma lucidum pretreatmented by steam explosion[J]. Science and Technology of Food Industry, 2014(6): 338−342.
[11] 梁结桦, 杜冰. 蒸汽爆破茯苓多糖提取工艺优化[J]. 粮食与油脂,2021,34(12):73−77. [LIANG Jiehua, DU Bing. Optimization of extraction process of Poria cocos polysaccharide by steam explosion[J]. Cereals & Oils,2021,34(12):73−77.] doi: 10.3969/j.issn.1008-9578.2021.12.018 LIANG Jiehua, DU Bing. Optimization of extraction process of Poria cocos polysaccharide by steam explosion[J]. Cereals & Oils, 2021, 34(12): 73−77. doi: 10.3969/j.issn.1008-9578.2021.12.018
[12] DUBOIS M G K. A colorimetric method for the determination of sugars[J]. Nature,1951,168:167.
[13] 曾志恒, 曾辉, 程翊, 等. 双孢蘑菇发酵液还原糖和总糖的含量测定[J]. 中国食用菌,2018,37(6):40−43. [ZENG Zhiheng, ZENG Hui, CHENG Yi, et al. Determination of reducing sugar and total sugar content in fermentation liquid of Agaricus bisporus[J]. Edible Fungi of China,2018,37(6):40−43.] ZENG Zhiheng, ZENG Hui, CHENG Yi, et al. Determination of reducing sugar and total sugar content in fermentation liquid of Agaricus bisporus[J]. Edible Fungi of China, 2018, 37(6): 40−43.
[14] CORTES-RIOS J, ZARATE A M, FIGUEROA J D, et al. Protein quantification by bicinchoninic acid (BCA) assay follows complex kinetics and can be performed at short incubation times[J]. Analytical Biochemistry,2020,608:113904. doi: 10.1016/j.ab.2020.113904
[15] 刘艳芳, 唐庆九, 张劲松, 等. 灵芝提取物β-1,3-葡聚糖含量测定及多糖成分分析[J]. 菌物学报,2018,37(11):1525−1531. [LIU Yanfang, TANG Qingjiu, ZHANG Jingsong, et al. Determination of β-1,3-glucan content and analysis of polysaccharide composition from Ganoderma lingzhi extract[J]. Mycosystema,2018,37(11):1525−1531.] LIU Yanfang, TANG Qingjiu, ZHANG Jingsong, et al. Determination of β-1,3-glucan content and analysis of polysaccharide composition from Ganoderma lingzhi extract[J]. Mycosystema, 2018, 37(11): 1525−1531.
[16] 颜梦秋, 刘艳芳, 唐庆九, 等. 紫芝子实体细胞壁多糖的特征分析[J]. 上海农业学报,2019,35(6):24−28. [YAN Mengqiu, LIU Yanfang, TANG Qingjiu, et al. Characterization of cell wall polysaccharides from Ganoderma sinense fruit bodies[J]. Acta Agriculturae Shanghai,2019,35(6):24−28.] YAN Mengqiu, LIU Yanfang, TANG Qingjiu, et al. Characterization of cell wall polysaccharides from Ganoderma sinense fruit bodies[J]. Acta Agriculturae Shanghai, 2019, 35(6): 24−28.
[17] LIU Y F, ZHAO Y, YANG Y, et al. Structural characteristics and hypoglycemic activity of polysaccharides from Coprinus comatus[J]. Bioactive Carbohydrates and Dietary Fibre,2013,2(2):164−169. doi: 10.1016/j.bcdf.2013.10.001
[18] BRODKORB A, EGGER L, ALMINGER M, et al. INFOGEST static in vitro simulation of gastrointestinal food digestion[J]. Nature Protocols,2019,14(4):991−1014. doi: 10.1038/s41596-018-0119-1
[19] ZHANG F F, XIAO Y, PAN L, et al. Effects of polysaccharides from Lyophyllum decastes (Fr.) Singer on gut microbiota via in vitro-simulated digestion and fermentation[J]. Frontiers in Microbiology,2023,14:1083917. doi: 10.3389/fmicb.2023.1083917
[20] 陈和地, 任怡琳, 耿燕, 等. 基于超高效液相色谱法快速测定短链脂肪酸方法的建立[J]. 生物加工过程,2019,17(4):365−371. [CHEN Hedi, REN Yilin, GENG Yan, et al. Analysis of short chain fatty acids by ultra-performance liquid chromatography[J]. Chinese Journal of Bioprocess Engineering,2019,17(4):365−371.] doi: 10.3969/j.issn.1672-3678.2019.04.006 CHEN Hedi, REN Yilin, GENG Yan, et al. Analysis of short chain fatty acids by ultra-performance liquid chromatography[J]. Chinese Journal of Bioprocess Engineering, 2019, 17(4): 365−371. doi: 10.3969/j.issn.1672-3678.2019.04.006
[21] LI B, YANG W, NIE Y Y, et al. Effect of steam explosion on dietary fiber, polysaccharide, protein and physicochemical properties of okara[J]. Food Hydrocolloids,2019,94:48−56. doi: 10.1016/j.foodhyd.2019.02.042
[22] GONG L X, HUANG L L, ZHANG Y. Effect of steam explosion treatment on barley bran phenolic compounds and antioxidant capacity[J]. Journal of Agricultural and Food Chemistry,2012,60(29):7177−7184. doi: 10.1021/jf301599a
[23] REN Y L, SUN Q G, GAO R N, et al. Low weight polysaccharide of Hericium erinaceus ameliorates colitis via inhibiting the NLRP3 inflammasome activation in association with gut microbiota modulation[J]. Nutrients,2023,15(3):739. doi: 10.3390/nu15030739
[24] KRAUTKRAMER K A, FAN J, BÄCKHED F, et al. Gut microbial metabolites as multi-kingdom intermediates[J]. Nature Reviews Microbiology,2021,19(2):77−94. doi: 10.1038/s41579-020-0438-4
[25] MA Y Y, JIANG S S, ZENG M Y. In vitro simulated digestion and fermentation characteristics of polysaccharide from oyster (Crassostrea gigas), and its effects on the gut microbiota[J]. Food Research International,2021,149:110646. doi: 10.1016/j.foodres.2021.110646
[26] WU D T, FU Y, GUO H, et al. In vitro simulated digestion and fecal fermentation of polysaccharides from loquat leaves:Dynamic changes in physicochemical properties and impacts on human gut microbiota[J]. International Journal of Biological Macromolecules,2021,168:733−742. doi: 10.1016/j.ijbiomac.2020.11.130
[27] LIU C, DU P, CHENG Y L, et al. Study on fecal fermentation characteristics of aloe polysaccharides in vitro and their predictive modeling[J]. Carbohydrate Polymers,2021,256:117571. doi: 10.1016/j.carbpol.2020.117571
[28] VENTURA M, TURRONI F, SINDEREN V. Bifidobacteria of the human gut:Our special friends[M]. Diet-Microbe Interactions in the Gut, 2015, 41−51.
[29] SHIN N R, WHON T W, BAE J W. Proteobacteria:microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology,2015,33(9):496−503. doi: 10.1016/j.tibtech.2015.06.011
[30] 黄媛媛, 陈华国, 谢文, 等. 多糖与肠道菌群相互作用及其构效关系研究进展[J]. 微生物学通报,2022,49(6):2325−2346. [HUANG Yuanyuan, CHEN Huaguo, XIE Wen, et al. Interaction between polysaccharide and intestinal flora and its structure-effect relationship:A review[J]. Microbiology China,2022,49(6):2325−2346.] HUANG Yuanyuan, CHEN Huaguo, XIE Wen, et al. Interaction between polysaccharide and intestinal flora and its structure-effect relationship: A review[J]. Microbiology China, 2022, 49(6): 2325−2346.
[31] HASHIZUME K, TSUKAHARA T, YAMADA K, et al. Megasphaera elsdenii JCM1772T normalizes hyperlactate production in the large intestine of fructooligosaccharide-fed rats by stimulating butyrate production[J]. The Journal of Nutrition,2003,133(10):3187−3190. doi: 10.1093/jn/133.10.3187
[32] ZHOU J L, ZHANG Q, ZHAO Y Z, et al. The relationship of Megamonas species with nonalcoholic fatty liver disease in children and adolescents revealed by metagenomics of gut microbiota[J]. Scientific Reports,2022,12(1):22001. doi: 10.1038/s41598-022-25140-2
[33] ZHANG S T, WANG C F, SUN Y, et al. Xylanase and fermented polysaccharide of Hericium caputmedusae reduce pathogenic infection of broilers by improving antioxidant and anti-inflammatory properties[J]. Oxidative Medicine and Cellular Longevity,2018,2018:1−11.
[34] XU S Y, AWEYA J J, LI N, et al. Microbial catabolism of Porphyra haitanensis polysaccharides by human gut microbiota[J]. Food Chemistry,2019,289:177−186. doi: 10.1016/j.foodchem.2019.03.050
[35] CHEN Y Q, LIU Y Y, SARKER M M R, et al. Structural characterization and antidiabetic potential of a novel heteropolysaccharide from Grifola frondosa via IRS1/PI3K-JNK signaling pathways[J]. Carbohydrate Polymers,2018,198:452−461. doi: 10.1016/j.carbpol.2018.06.077
[36] 王轶帆, 邓媛元, 张雁, 等. 龙眼多糖与燕麦多糖的结构特征及其益生活性比较[J]. 中国食品学报,2020,20(12):62−71. [WANG Yifan, DENG Yuanyuan, ZHANG Yan, et al. Comparison of structure characteristics and probiotic activity of longan polysaccharides and oat polysaccharides[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(12):62−71.] WANG Yifan, DENG Yuanyuan, ZHANG Yan, et al. Comparison of structure characteristics and probiotic activity of longan polysaccharides and oat polysaccharides[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(12): 62−71.





 下载:
下载:
 下载:
下载:



