Combined Inhibitory Effects of Procyanidins and Protocatechuic Acid on Starch Digestive Enzymes
-
摘要: 淀粉是人体获取能量主要来源,原花青素(Procyanidin,PC)和原儿茶酸(protocatechuic acid,PCA)等天然产物能够控制淀粉的消化,从而达到降低餐后血糖的效果。本文通过抑制率测定、Lineweaver-Burk双倒数图法、紫外光谱、荧光淬灭、等效线图解法和傅里叶红外光谱研究了PC和PCA对α-淀粉酶和α-葡萄糖苷酶的抑制效果。结果表明:PC对α-淀粉酶和α-葡萄糖苷酶抑制的IC50值分别为0.0524和0.0106 mg/mL,PCA分别为1.9426和1.0667 mg/mL,PCA表现出更好的抑制能力;Lineweaver-Burk双倒数图法表明PC和PCA对α-淀粉酶的抑制为混合型抑制,对α-葡萄糖苷酶的抑制分别为非竞争性抑制和竞争性抑制。与α-淀粉酶和α-葡萄糖苷酶的结合主要依靠疏水键和氢键,通过改变酶氨基酸残基微环境,进一步改变酶结构。复配比例为1:21时对α-葡萄糖苷酶的抑制效果最优,1:37时对α-淀粉酶的抑制效果最优。两物质复配比例为1:21时CI小于1,对α-葡萄糖苷酶表现出协同抑制作用;复配比例为1:37时CI小于1,对α-淀粉酶表现出协同抑制作用。本研究揭示了PC和PCA复合使用对淀粉消化酶的抑制作用机制,为开发天然降糖膳食补充剂作为健康食品辅料或药物开发提供一定理论基础。Abstract: Starch is the main source of energy for the human body. Natural products such as procyanidin (PC) and protocatechuic acid (PCA) can reduce postp'ran'dial blood sugar by controlling the digestion of starch. The inhibition effects of PC and PCA on α-amylase and α-glucosidase were studied using inhibition rate determination, Lineweaver-Burk double reciprocal diagram, ultraviolet spectroscopy, fluorescence quenching, equivalent mapping, and Fourier transform infrared spectroscopy. The results showed that the IC50 values of PC for α-amylase and α-glucosidase inhibition were 0.0524 and 0.0106 mg/mL, respectively, and those of PCA were 1.9426 and 1.0667 mg/mL respectively, which showed that PCA had better inhibition ability. The Lineweaver-Burk double reciprocal diagram showed that the inhibition of PC and PCA on α-amylase was a mixed inhibition, and the inhibition on α-glucosidase was non-competitive inhibition and competitive inhibition, respectively. The Binding of PC and PCA with α-amylase and α-glucosidase mainly depended on hydrophobic and hydrogen bonds, and further altered the enzyme structure by changing the microenvironment of amino acid residues. The inhibitory effects on α-glucosidase were the best when the ratio of PC and PCA was 1:21, and the inhibitory effects on α-amylase were optimal at 1:37. When the ratio of PC and PCA was 1:21, CI was less than 1, which showed a synergistic inhibitory effect on α-glucosidase. When the compounding ratio was 1:37, CI was less than 1, which showed a synergistic inhibitory effect on α-amylase. This study revealed the inhibitory mechanism of the combined use of PC and PCA on starch-digesting enzymes and would provide a theoretical basis for the development of natural hypoglycemic dietary supplements as health food excipients or drugs.
-
Keywords:
- procyanidins /
- proceccatechuic acid /
- α-amylase /
- α-glucosidase /
- inhibition
-
随着居民膳食消费水平的提升,膳食结构也进一步升级,居民饮食更加多样化[1]。膳食结构的不合理会导致各种慢性病的发生,而餐后血糖水平的管理对于降低胰岛素的损伤、保持人体健康具有重要作用。淀粉类食物作为主食,其消化代谢是机体获取能量的重要途径,其消化速率影响着餐后血糖水平。淀粉的消化过程分为三个阶段:酶向淀粉扩散,酶向淀粉吸附(即形成酶-淀粉复合物)和淀粉水解[2]。淀粉首先被唾液淀粉酶部分水解,然后被胰腺α-淀粉酶水解为麦芽糖和麦芽三糖,接着在肠细胞刷状缘的表面膜上被α-葡萄糖苷酶水解为葡萄糖,通过葡萄糖转运蛋白进入血液,被运送到目标器官供身体吸收[3]。α-淀粉酶水解糖链中的α-D-(1-4)-糖苷键从而产生麦芽糖、麦芽糖三糖、麦芽糖四糖、麦芽糖糊精和葡萄糖,α-葡萄糖苷酶催化双糖水解为单糖[4]。在淀粉的整个消化过程中,α-葡萄糖苷酶和α-淀粉酶发挥着关键的作用。因此,对上述两种淀粉消化酶的活性进行抑制,能够降低淀粉的消化速率和生物体对葡萄糖的利用度,进而减缓餐后血糖的上升速度,餐后血糖升高异常会导致机体乏力、眩晕,长期会导致心脑血管疾病的患病率增加[5]。
目前临床上降血糖常用的药物是阿卡波糖,作为一种复合低聚糖,阿卡波糖具有与寡糖类似的结构,这种结构使得其能与寡糖共同争夺位点,并能与部分淀粉消化酶发生可逆性结合,使十二指肠和空肠上部的单糖吸收缓慢,从而起到降低血糖的作用[6]。但这种药物通常会引起胃肠道反应,与某些药物共同服用时,还可能存在药物间相互作用,引起血糖紊乱[3]。因此,基于天然产物开发的抑制剂则更加安全。
天然产物中的多酚类、黄酮类和磷脂酸类已被证明能够抑制上述两种淀粉消化酶的活性,因此在降低血糖方面发挥着重要作用,如多酚类物质可以抑制口腔及肠道中α-淀粉酶的活性,通过降低餐后血糖浓度发挥降血糖等功能[7−8]。原花青素(Procyanidin,PC)作为一种由黄烷醇聚合而成的多酚类物质[9],其分布广泛,存在于许多植物的一些部位中,例如植物的叶、花瓣中。研究表明蔓越莓、葡萄籽、高粱等植物中PC对于α-淀粉酶的活性均有一定的抑制作用[10−11]。此外,多酚类聚合物、黄酮类化合物、多糖化合物以及生物活性肽亦被证明能够作为α-葡萄糖苷酶抑制剂(AGI)的天然物质[12−13]。原儿茶酸(Proccatechuic acid,PCA)即3,4-二羟基苯甲酸,是一种酚酸物质,天然存在于许多蔬菜、水果以及某些植物的叶中,是许多中药的有效活性成分,具有抗氧化、抗肿瘤和神经保护作用[7]。但上述两种物质对淀粉消化酶的联合抑制作用尚未见报道。
基于此,本研究通过抑制率测定、Lineweaver-Burk双倒数图法、紫外光谱、荧光淬灭、等效线图解法和傅里叶红外光谱等研究PC和PCA对α-淀粉酶和α-葡萄糖苷酶的联合抑制作用,为天然降糖膳食补充剂开发提供一定理论基础。
1. 材料与方法
1.1 材料与仪器
PC、PCA、α-淀粉酶(50 U/mg)、4-硝基苯基-α-D-吡喃葡糖苷(PNPG)、α-葡萄糖苷酶(250 U/9.5 mg)、阿卡波糖 上海源叶生物科技有限公司;玉米淀粉 佛山市海天调味食品股份有限公司;3,5-二硝基水杨酸、酒石酸钾钠、亚硫酸钠、苯酚、碳酸钠、磷酸盐缓冲液、乙醇 国产分析纯。
Cary 60紫外可见分光光度计 安捷伦科技有限公司;EX10202电子分析天平 奥豪斯仪器有限公司;HH-B8数显恒温水浴锅 上海辰邦西仪器科技有限公司;BRUKER TENSOR27傅里叶红外光谱仪、Varioskan Flash 全波长扫描式多功能读数仪 赛默飞世尔科技公司。
1.2 实验方法
1.2.1 PC和PCA对α-葡萄糖苷酶和α-淀粉酶抑制效果测定
在测定样品对消化酶的抑制率时,通过预实验,确定了溶剂和浓度梯度的范围选择。α-葡萄糖苷酶抑制活性测定按照曹俊伟[14]方法稍作改变。将PC、PCA和阿卡波糖浓度配制为0.03125、0.0625、0.125、0.25、0.5 mg/mL,在405 nm处测定其吸光度。
α-淀粉酶抑制活性测定参考黄克愁等[15]的方法,并做适当修改。将PC、PCA和阿卡波糖浓度配制为0.05、0.1、0.2、0.4、0.8 mg/mL。使用酶标仪于540 nm处测定吸光值。实验分组为样品组即添加淀粉消化酶,对照组即向抑制剂中添加PBS缓冲液。空白组及其对照组向其中加入蒸馏水而不是PC和PCA。用阿卡波糖作为参照分析。
酶抑制率(%)=[1−(A1−A2)(A3−A4)]×100 (1) 其中:A1、A2、A3、A4分别为样品组、样品对照组、空白组和空白对照组的吸光度值。
1.2.2 PC和PCA对α-葡萄糖苷酶抑制动力学
将PC和PCA均配制成浓度为0、0.2、0.4、0.6、0.8 mg/mL的溶液,α-葡萄糖苷酶溶液设置为0.1、0.2、0.3、0.4 U/mL。在405 nm波长下测吸光值,通过葡萄糖标准曲线算出反应的速率,对反应速率与α-葡萄糖苷酶浓度的关系进行分析。
将pNPG配制成1、1.5、2、2.5、3 mg/mL,计算不同底物浓度和不同浓度PC与PCA下的酶促反应速率。使用Lineweaver-Burk方程确定PC和PCA对α-葡萄糖苷酶的抑制方式。
1.2.3 PC和PCA对α-淀粉酶抑制动力学
将PC和PCA均配制成浓度为0、0.2、0.4、0.6、0.8 mg/mL的溶液,α-淀粉酶溶液设置为0.5、1、1.5、2 U/mL。按上述方法来测540 nm的吸光值,根据麦芽糖标准曲线来算速率。根据Lineweaver-Burk双倒数曲线图,分析确定PC与PCA对α-淀粉酶的抑制类型。
Lineweaver-Burk方程:
1V=1Vmax+KmVmax×1[S] (2) 其中,[S]指淀粉浓度(mg/mL);V指反应速率(mol/mL·s−1);1/[S]当作坐标横轴,1/V为坐标纵轴,即可做出Lineweaver-Burk双倒数图。不同抑制剂浓度下的双倒数直线得出斜率和截距,竞争抑制常数Ki可根据斜率和[I]作图得到,非竞争性抑制常数Kis由截距和[I]作图得出。公式如下:
斜率=KmVmax+Km[I]VmaxKi (3) 截距=1Vmax+[I]VmaxKis (4) 竞争性抑制公式:
1V=KmVmax(1+[I]Ki)1[S]+1Vmax (5) 非竞争性抑制公式:
1V=KmVmax(1+[I]Ki)1[S]+1Vmax(1+[I]Kis) (6) 其中,V指速率;Vmax为最大反应速率(mol/mL·s−1);[S]指底物浓度(mg/mL);[I]为PC及PCA浓度(mg/mL);Km为米氏常数,Ki和Kis分别为抑制剂与酶和酶-底物复合物结合的平衡常数。
1.2.4 PC和PCA对α-葡萄糖苷酶和α-淀粉酶的紫外光谱分析
将1 mL α-淀粉酶溶液(7 U/mL)、α-葡萄糖苷酶浓度(0.1 U/mL)分别与100 μL不同浓度0.6、0.4、0.2、0.1、0.08 mg/mL的PC溶液和不同浓度0.2、0.15、0.1、0.08、0.05 mg/mL PCA溶液混匀进行反应,在200~800 nm范围内进行紫外吸收光谱扫描。
1.2.5 PC和PCA对α-葡萄糖苷酶和α-淀粉酶的荧光光谱测定
在500 μL的α-淀粉酶(7 U/mL)的溶液中加入50 μL不同浓度0.6、0.4、0.2、0.1、0.08、0 mg/mL的原花青素溶液和不同浓度0.2、0.15、0.1、0.08、0.05、0 mg/mL原儿茶酸溶液,根据0浓度的混合溶液分析研究,在电脑上设置发射波长290 nm,激发波长270 nm,波长范围在290~500 nm内对其扫描。
荧光猝灭常数表示为Ksv,可由Stern-Volmer方程计算得出,以此判定PC、PCA对酶的淬灭机理,公式如下:
F0F=1+Kqτ0[Q]=1+Ksv[Q] (7) 式中,F0和F分别为α-淀粉酶和α-葡萄糖苷酶在不添加或添加PC和PCA时的荧光强度;[Q]为两种抑制剂的浓度(mg/mL);τ0为荧光团的平均寿命;Kq为猝灭速率常数;Ksv为猝灭常数。
1.2.6 PC和PCA对淀粉消化酶的联合抑制作用
参照林海生等[13]的方法。测定对α-葡萄糖苷酶和α-淀粉酶的IC50值。通过原花青素和原儿茶酸单独抑制效率测定计算出对α-葡萄糖苷酶和α-淀粉酶的IC50值。根据两种物质的IC50值进行复配。对于α-葡萄糖苷酶抑制率的测定,将原花青素、原儿茶酸配制成0.03125、0.0625、0.125、0.25、0.5 mg/mL溶液;对于α-淀粉酶抑制率的测定,将原花青素、原儿茶酸配制成0.05、0.1、0.2、0.4、0.8 mg/mL溶液,参照1.2.1的方法进行联合抑制试验,通过Chou-Talalay药物联合指数CI进行评价。通过CI值的数值大小,可以定量判断药物间相互作用的强度以及性质(CI>1为拮抗作用,CI=1为相加作用,0.7<CI<1为轻微协同作用,0.3<CI<0.7为协同作用,C<0.3为强协同作用),CI公式如下:
CI=(D)1(Dx)1+(D)2(Dx)2 (8) 其中,(D)1和(D)2是复配系统中产生一定抑制水平的抑制剂的剂量(mol/L);(Dx)1和(Dx)2是添加单个物质导致相同抑制水平的剂量(mol/L)。
1.2.7 PC和PCA对α-葡萄糖苷酶和α-淀粉酶的傅里叶红外光谱的影响
向100 μL 0.6 mg/mL的PC与0.2 mg/mL PCA溶液分别加入1 mL 0.1 U/mL的α-葡萄糖苷酶溶液;向100 μL 0.6 mg/mL的PC与0.2 mg/mL PCA溶液分别加入1 mL 7 U/mL的α-淀粉酶溶液。取适量干燥的溴化钾,钨光灯下在玛瑙研钵中研磨至细粉直到看不见晶体为止,取适量的粉末用压片机压成透明均匀薄片,滴入1滴待测样液,进行红外光谱全波段扫描(400~4000 cm−1),得到PC对α-淀粉酶的红外光谱图。与上述方法相同得到PC对α-葡萄糖苷酶、PCA对α-淀粉酶、PCA对α-葡萄糖苷酶的红外光谱图。
1.3 数据处理
实验重复三次。使用Origin 2022、GraphPad Prism 5软件绘图,使用SPSS 27软件进行数据分析,实验结果表示为平均值±标准偏差,P<0.05被认为是显著差异。
2. 结果与分析
2.1 PC和PCA对α-葡萄糖苷酶和α-淀粉酶抑制效果测定
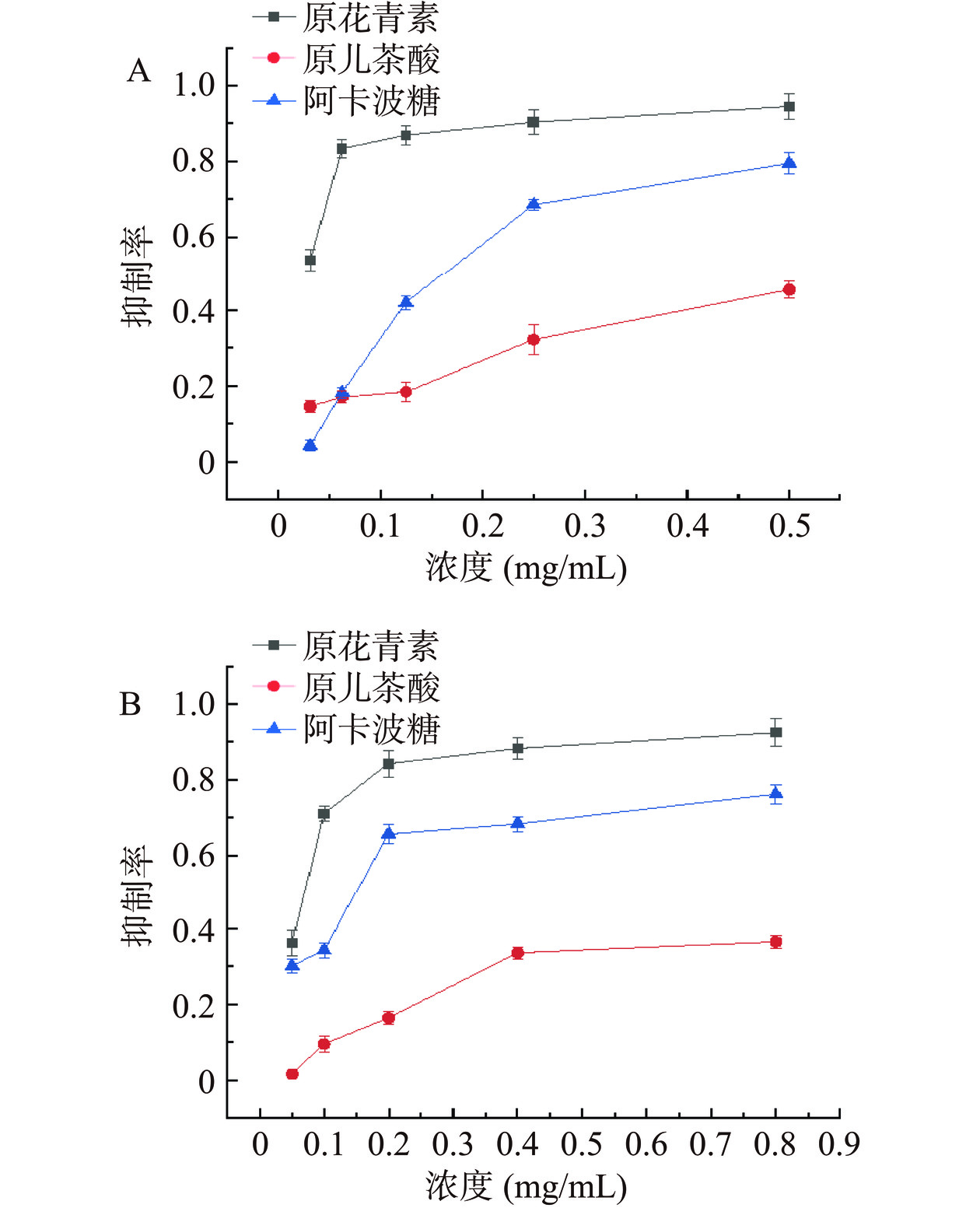
以阿卡波糖为阳性对照,不同浓度梯度的PC和PCA对α-葡萄糖苷酶和α-淀粉酶的抑制能力如图1所示。由图1可知,PC对淀粉消化酶的抑制效果最强,PCA相较于其他两种物质对两种酶的抑制作用最小。PC和PCA均随着浓度的增加而对淀粉消化酶的抑制作用增强,这说明PC和PCA对酶活性的抑制表现出剂量依赖性。IC50值可以量化PC和PCA对淀粉消化酶的抑制能力。运用GraphPad Prism 5软件,以lgC为横坐标,抑制率为纵坐标作图,得到不同抑制剂对两种酶的IC50。通过计算作图进行线性拟合,由图1A可知PC与PCA对α-葡萄糖苷酶的IC50值分别为0.0106和1.0667 mg/mL;由图1B可知,PC和PCA对α-淀粉酶的IC50值分别为0.0524和1.9426 mg/mL。
2.2 PC和PCA对α-葡萄糖苷酶的抑制类型
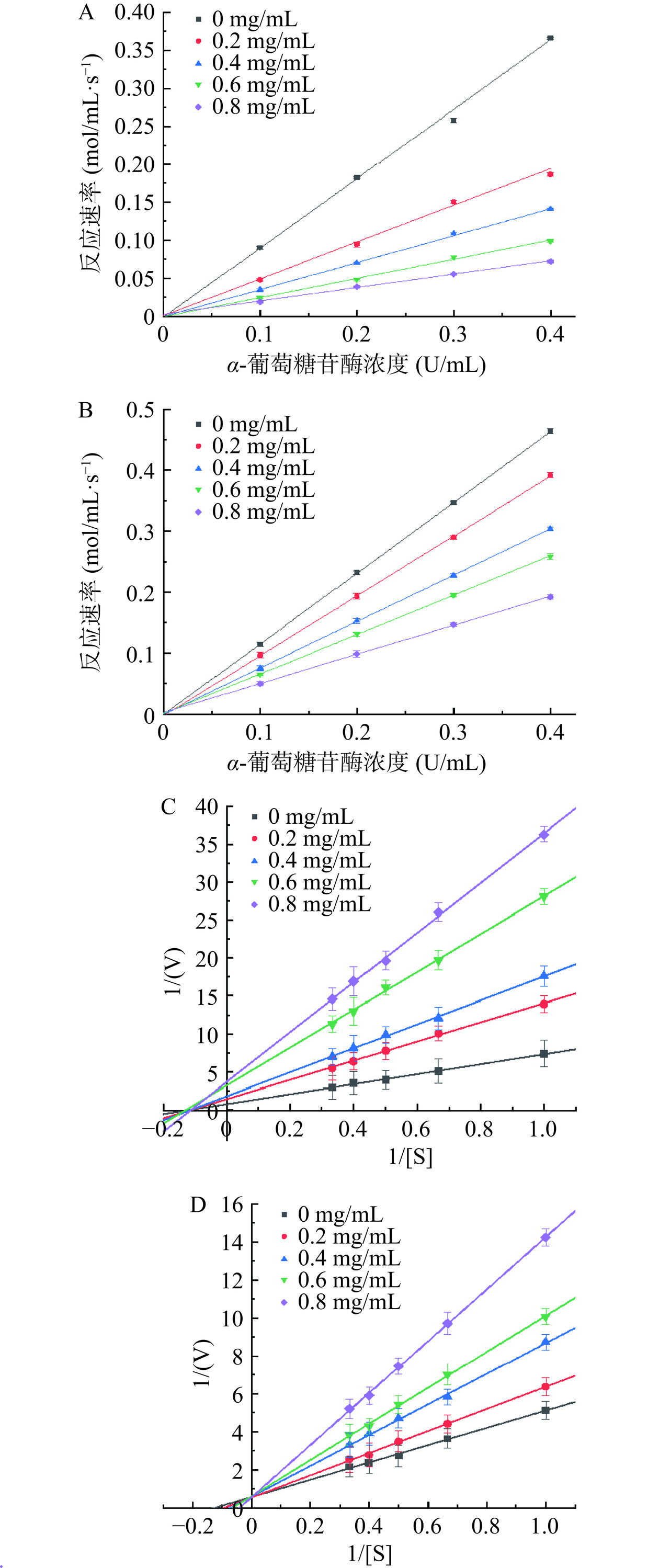
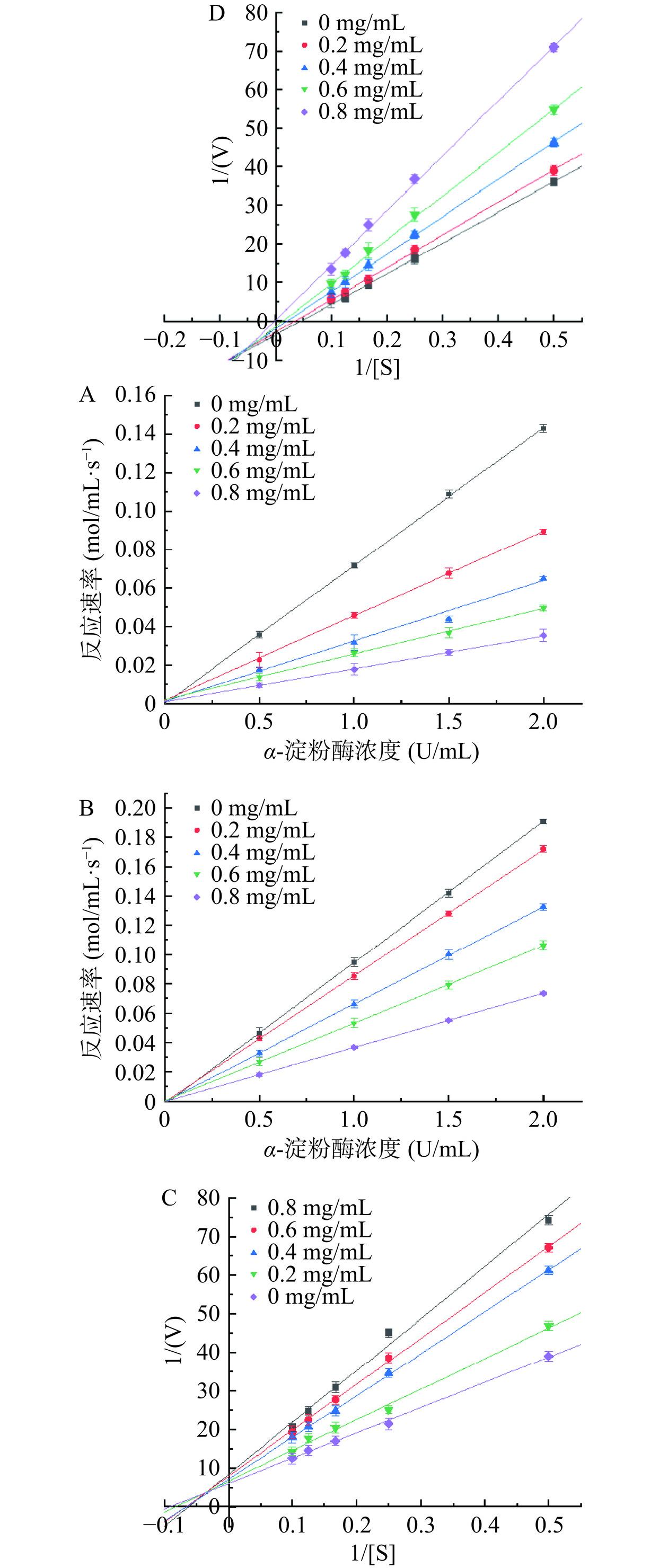
抑制剂可根据与酶结合位点的方式将其分成可逆性和不可逆性两种。测定不同浓度下的酶活力,以α-葡萄糖苷酶浓度为横坐标,反应速率为纵坐标,从图2A和图2B可以看出PC和PCA的不同浓度均过原点,随着抑制剂浓度的增加,其斜率逐渐减小,说明两种物质均为可逆性抑制剂。
为了进一步了解抑制剂对淀粉消化酶的抑制机理,1/[S]作为坐标的横轴,1/v作为坐标的纵轴,得出的Lineweaver-Burk图中直线的斜率表示为Km/Vmax。直线与y轴的交点即为1/Vmax。由图2中可以看出PC和PCA不同浓度下曲线的分布情况,由此确定出两种不同抑制剂对α-葡萄糖苷酶的抑制类型。根据图2C可知,PC不同浓度的直线均相交于x负半轴一点,Km值不随PC浓度的改变而改变,直线与y轴的交点值即截距增加能够知道最大反应速率Vmax减小。由此可知PC对α-葡萄糖苷酶的抑制类型为非竞争性抑制。根据图2D可知,不同浓度PCA的直线均与y轴相交于一点也就是Vmax保持不变,其斜率随着不同浓度PCA的增大而增大即Km/Vmax增大,分析出Km值增大。可以看出PCA对α-葡萄糖苷酶的抑制作用类型属于竞争性抑制。
2.3 PC和PCA对α-淀粉酶的抑制类型
图3A和图3B是以酶促反应速率为纵坐标对α-淀粉酶的浓度做出的图,不同浓度下的PC和PCA经拟合的直线均过原点,且随着两种物质浓度的增加,直线斜率逐渐下降,由此说明PC对α-淀粉酶的抑制作用也是可逆性的。根据图3C和图3D可知,PC和PCA的双倒数曲线分别相交于第二象限和第三象限,随着两种抑制剂浓度的增加,Km值与Vmax均随之改变,说明符合竞争性和非竞争性结合的混合性抑制。
PC对α-葡萄糖苷酶的抑制类型为非竞争性抑制,分析其抑制方式为PC与pNPG之间不存在竞争关系,能够结合酶的非活性中心位点。PCA对α-葡萄糖苷酶的抑制作用类型属于竞争性抑制,其与酶的结合部位和底物与酶的复合物结合部位相似,因此与底物共同竞争酶的活性位点。PC和PCA对α-淀粉酶符合混合性抑制,其抑制剂的结构与底物结构具有一定的相似性,既可以竞争底物与α-淀粉酶的活性位点形成复合产物,从而降低了酶的活性;也可以与酶的非活性位点结合,同样能够降低酶的活性,从而抑制α-淀粉酶与底物淀粉结合生成葡萄糖[16]。
2.4 PC和PCA对α-葡萄糖苷酶和α-淀粉酶的紫外光谱分析
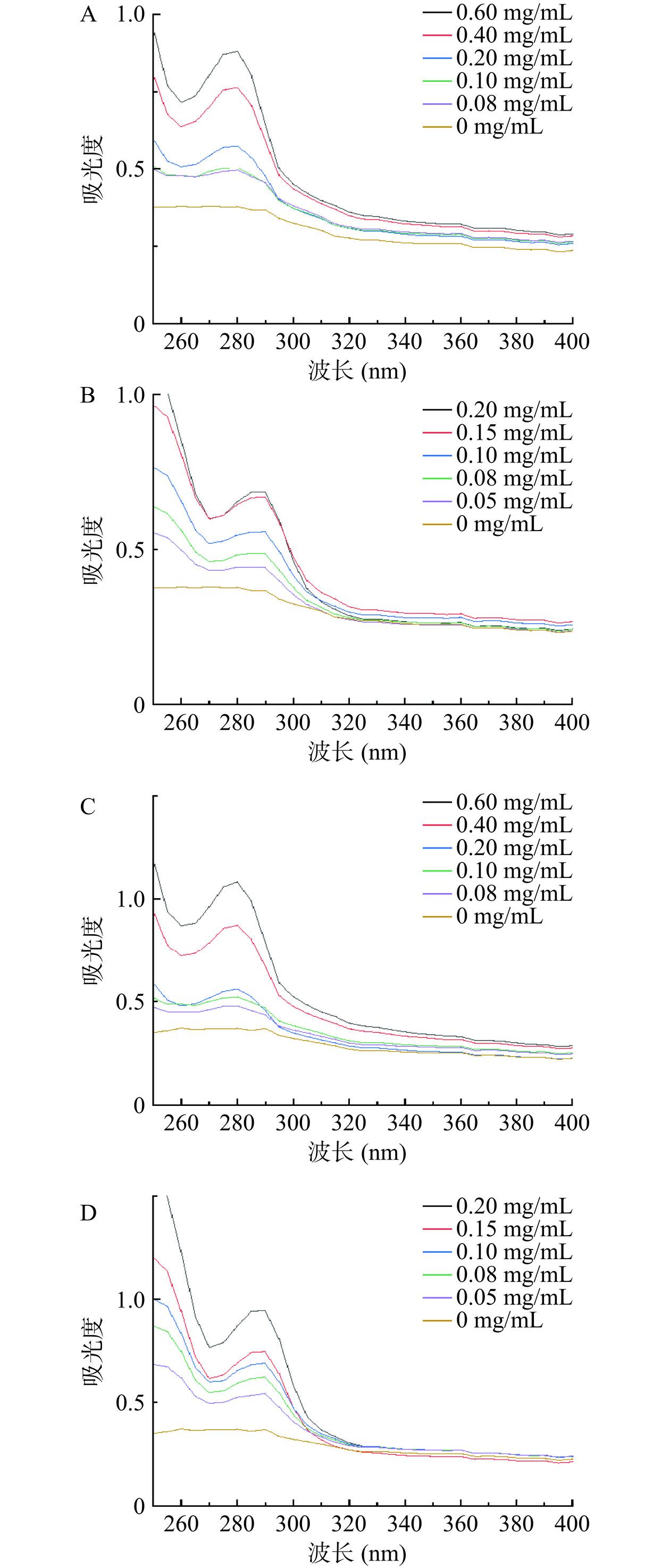
通过观察紫外光谱可以有效地分析抑制剂与酶的活性位点相互作用的过程,了解酶的结构如何发生变化[17]。如图4所示,PC和PCA对α-葡萄糖苷酶和α-淀粉酶的最大吸收峰随着抑制剂浓度的增大发生明显的蓝移现象。且随着两种抑制剂物质浓度的增加,两种淀粉消化酶的吸收峰强度增大。
研究分析紫外光谱表明吸收峰强度具有一定的依赖性,由于氨基酸残基色氨酸(Trp)和酪氨酸(Tyr)的存在,α-淀粉酶在280 nm附近有一个紫外吸收峰,这主要是α-淀粉酶的B吸收带中C=О键的π-π*跃迁引起的[18]。有研究表明,抑制剂与α-淀粉酶发生相互作用,改变了α-淀粉酶氨基酸残基所处的微环境,从而使其肽链延长,氨基酸残基暴露,亲水性增强,引起吸收波长和吸收强度发生变化[19],改变了氨基酸残基周围的微环境,致使酶的构象发生变化[20−23]。
2.5 PC和PCA对α-葡萄糖苷酶和α-淀粉酶荧光淬灭作用
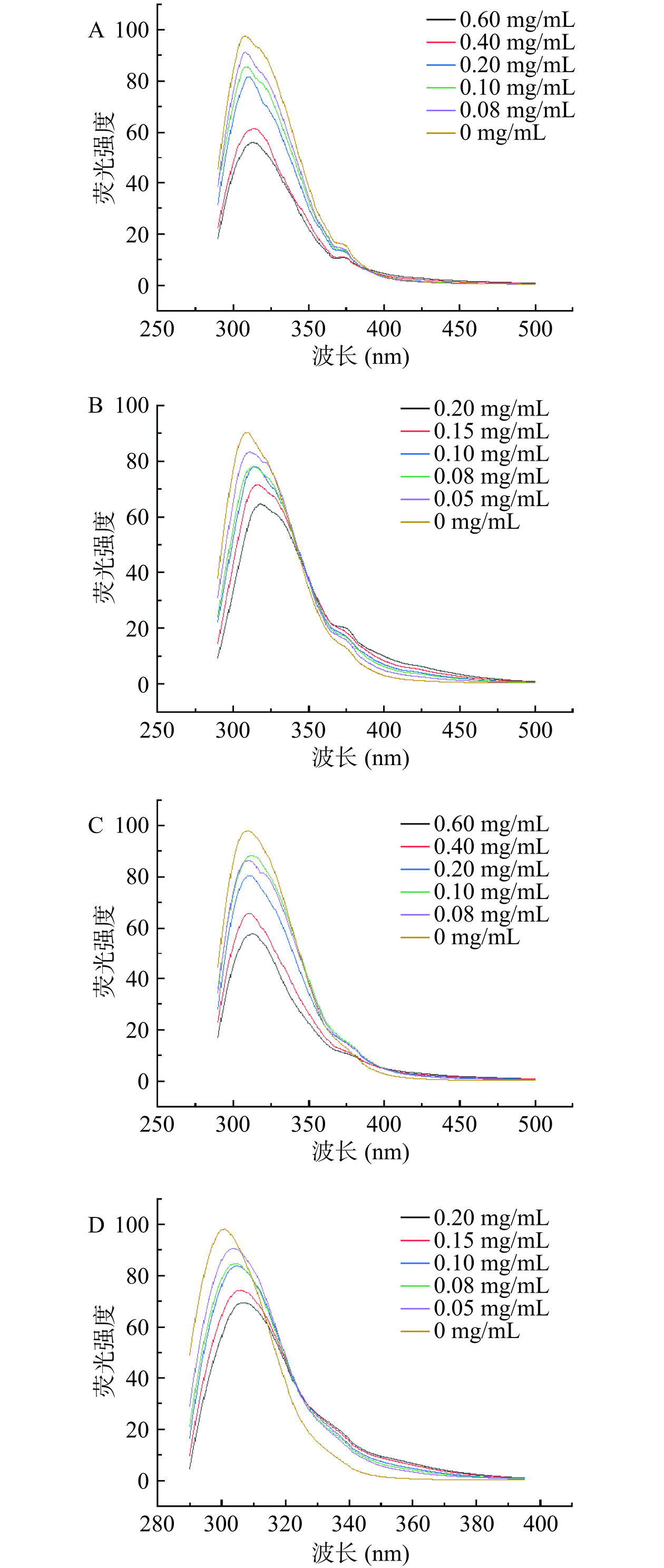
α-葡萄糖苷酶或者α-淀粉酶中色氨酸残基的变化可通过荧光强度和最大发射波长的变化进行分析。淀粉消化酶的构象可以在激发波长270 nm下检测,进而反映两种抑制剂在不同浓度下对酶荧光强度的淬灭作用[24]。
图5A和图5B表示在不同浓度下的PC以及PCA对α-葡萄糖苷酶的荧光淬灭图。可以看出α-葡萄糖苷酶的荧光强度有依赖性,随着抑制剂浓度的增加,荧光强度随之降低,且最大荧光波长发生了明显的红移。图5C和图5D表示在不同浓度下的PC和PCA对α-淀粉酶的荧光淬灭图,同样可以看出其浓度增加,荧光强度随之降低,最大荧光波长同样表现出了明显的红移。荧光光谱说明PC和PCA与酶结合能够淬灭淀粉消化酶的荧光,进一步证明其结合部位上色氨酸残基的环境发生了变化[25−26]。两种抑制剂通过氢键及疏水作用力对淀粉消化酶发生相互作用[27]。
2.6 PC和PCA对淀粉消化酶的联合抑制作用
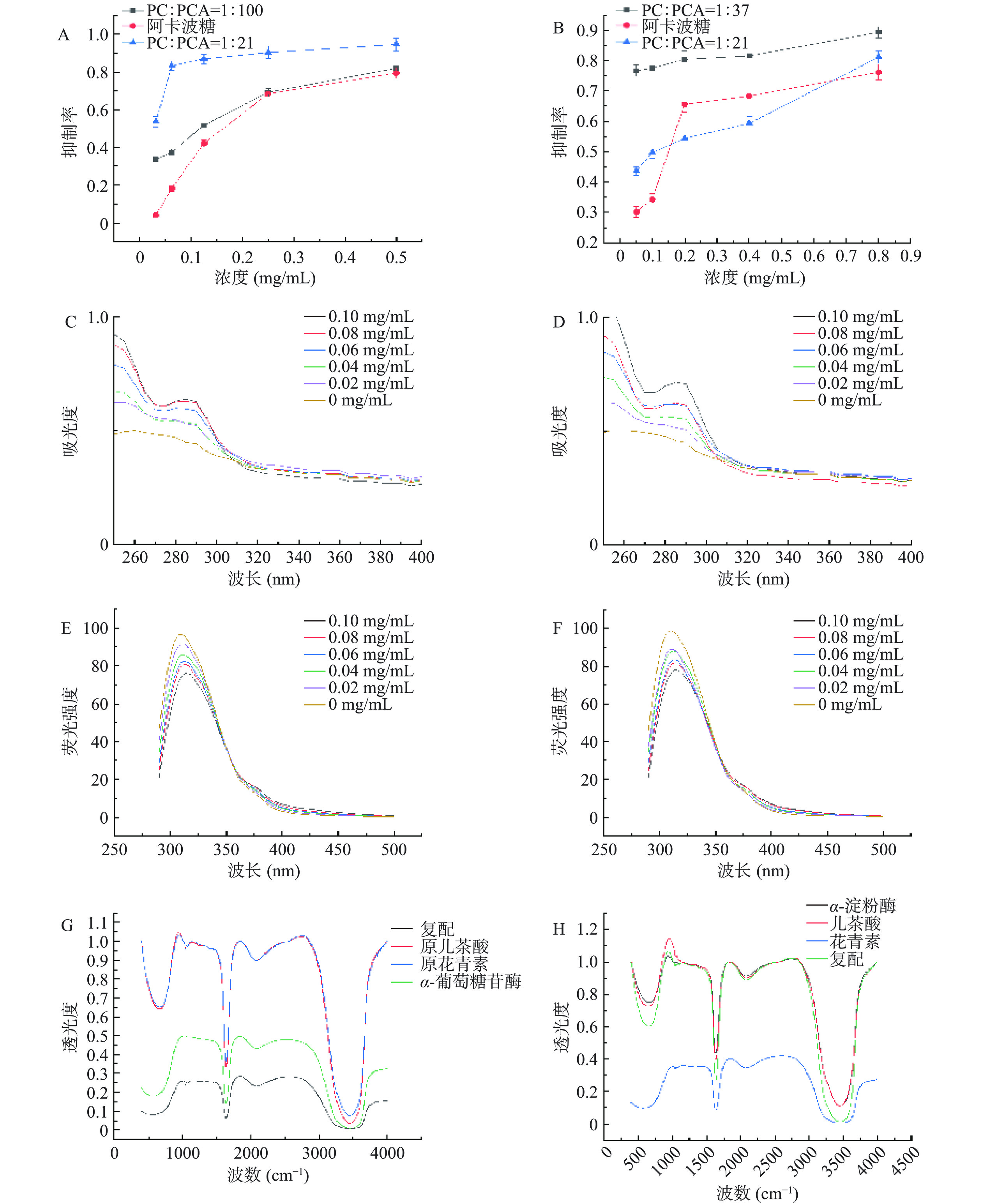
根据图6A可知,不同比例的PC和PCA的联合使用对α-葡萄糖苷酶的抑制效果均要强于阿卡波糖的抑制效果。根据单个物质的IC50值确定原花青素和原儿茶酸对α-葡萄糖苷酶的联合抑制比例为1:100;对α-淀粉酶的联合抑制比例为1:37。两种浓度为1:21联合作用时的抑制效果要比单个物质的抑制效果较好。根据图6B可知,在PC和PCA物质浓度比为1:37时对α-淀粉酶的抑制效果强于阿卡波糖。
![]() 图 6 PC和PCA联合作用研究注:A. PC与PCA联合对α-葡萄糖苷酶的抑制曲线;B. PC与PCA联合作用对α-淀粉酶的抑制曲线;C. PC与PCA联合对α-葡萄糖苷酶的紫外吸收光谱研究;D. PC与PCA联合对α-淀粉酶的紫外吸收光谱;E. PC与PCA联合对α-葡萄糖苷酶的荧光光谱;F. PC和PCA联合作用下α-淀粉的荧光光谱;G. PC与PCA联合对α-葡萄糖苷酶的红外光谱;H. PC与PCA联合对α-淀粉酶的红外光谱。Figure 6. Inhibitory effect of procyanidins and PCA on starch digestive enzymes
图 6 PC和PCA联合作用研究注:A. PC与PCA联合对α-葡萄糖苷酶的抑制曲线;B. PC与PCA联合作用对α-淀粉酶的抑制曲线;C. PC与PCA联合对α-葡萄糖苷酶的紫外吸收光谱研究;D. PC与PCA联合对α-淀粉酶的紫外吸收光谱;E. PC与PCA联合对α-葡萄糖苷酶的荧光光谱;F. PC和PCA联合作用下α-淀粉的荧光光谱;G. PC与PCA联合对α-葡萄糖苷酶的红外光谱;H. PC与PCA联合对α-淀粉酶的红外光谱。Figure 6. Inhibitory effect of procyanidins and PCA on starch digestive enzymes根据图6C~图6D所示,PC和PCA联合作用对α-葡萄糖苷酶和α-淀粉酶的最大吸收峰值随着抑制剂浓度的增大发生明显的蓝移现象,且随着两种复配抑制剂物质浓度的增加,对α-葡萄糖苷酶和α-淀粉酶的吸光度增大。通过测量联合物质的荧光强度来分析两种物质联合作用下在不同浓度下对酶荧光强度的淬灭作用。由紫外光谱分析可知复配抑制剂与两种淀粉消化酶之间相互作用,推测两种淀粉消化酶的肽键基团发生了跃迁,致使酶的构象发生变化[28−31]。
图6E表示在不同浓度下的PC和PCA联合作用对α-葡萄糖苷酶的荧光光谱图。随着复合抑制剂浓度的增加,荧光强度随之降低,说明荧光光谱发生明显的淬灭现象。且最大荧光波长发生了明显的红移,α-葡萄糖苷酶的荧光强度呈一定的依赖性。图6F表示在不同浓度下的PC和PCA联合作用对α-淀粉酶的荧光光谱图。随着抑制剂浓度的增加,荧光强度同样随之降低,最大荧光波长也发生了明显的红移。荧光光谱说明两种物质联合作用使得α-葡萄糖苷酶与α-淀粉酶上的疏水键断裂,使氨基酸残基暴露出来,导致酶的结构发生变化[28]。
由图6G~图6H可以看出第一个吸收峰波长范围为1500~2000 cm−1,该范围主要存在C=N键,C=O键等。第二个吸收峰波长范围为2500~4000 cm−1,该区域通常称为“氢键区”。由红外光谱分析推测PC与PCA以及联合物质对α-葡萄糖苷酶和α-淀粉酶主要作用于C=N键,C=O键等。在3400 nm处的吸收峰的宽度改变推测抑制剂使酶的结构发生了变化[32]。
2.7 PC和PCA对淀粉消化酶的联合抑制作用评价
由2.6可知PC:PCA=1:100时,α-葡萄糖苷酶的IC50值为0.097 mg/mL,PC:PCA=1:21时,IC50值为0.00099 mg/mL;PC:PCA=1:37时,α-淀粉酶的IC50值为0.00012 mg/mL,PC:PCA=1:21时值为0.10686 mg/mL。
根据药物联合指数公式求得PC与PCA浓度之比为1:100时CI为9.242,1:21时CI为0.094;PC与PCA浓度之比为1:37时CI为0.002,1:21时CI为2.094。
由2.1和2.6得出不同抑制剂对α-葡萄糖苷酶和α-淀粉酶的IC50值见于上表1。比较IC50值可知,PC:PCA=1:21时的抑制效果要比单个物质的抑制效果较好;PC:PCA=1:37时的抑制效果强于单个物质的抑制效果。分析可能是1:21比值下两种物质联合作用更利于与α-葡萄糖苷酶上的氨基酸残基结合,提高了抑制剂与酶复合物的稳定性。PC与PCA浓度之比为1:37时CI小于1,对α-淀粉酶表现出协同抑制作用;两物质浓度之比为1:21时CI大于1,对α-淀粉酶表现出拮抗作用。
表 1 不同抑制剂对淀粉消化酶的IC50值Table 1. IC50 values of different inhibitors on starch-digesting enzymes样品 α-葡萄糖苷酶
IC50(mg/mL)样品 α-淀粉酶
IC50(mg/mL)PC 0.0106 PC 0.0524 PCA 1.0667 PCA 1.9426 PC:PCA=1:100 0.097 PC:PCA=1:37 0.00012 PC:PCA=1:21 0.00099 PC:PCA=1:21 0.10686 3. 结论
本文主要分析PC和PCA对淀粉消化酶的联合作用,通过联合抑制实验可知,联合作用的抑制效果优于单个物质。复配比例为1:21时对α-葡萄糖苷酶的抑制效果最优;1:37时对α-淀粉酶的抑制效果最优。两物质复配比例为1:21时CI小于1,对α-葡萄糖苷酶表现出协同抑制作用;复配比例为1:37时CI小于1,对α-淀粉酶表现出协同抑制作用。结果为此两种物质联合使用的效果提供了理论依据,为开发天然降糖膳食补充剂提供了新思路。
-
图 6 PC和PCA联合作用研究
注:A. PC与PCA联合对α-葡萄糖苷酶的抑制曲线;B. PC与PCA联合作用对α-淀粉酶的抑制曲线;C. PC与PCA联合对α-葡萄糖苷酶的紫外吸收光谱研究;D. PC与PCA联合对α-淀粉酶的紫外吸收光谱;E. PC与PCA联合对α-葡萄糖苷酶的荧光光谱;F. PC和PCA联合作用下α-淀粉的荧光光谱;G. PC与PCA联合对α-葡萄糖苷酶的红外光谱;H. PC与PCA联合对α-淀粉酶的红外光谱。
Figure 6. Inhibitory effect of procyanidins and PCA on starch digestive enzymes
表 1 不同抑制剂对淀粉消化酶的IC50值
Table 1 IC50 values of different inhibitors on starch-digesting enzymes
样品 α-葡萄糖苷酶
IC50(mg/mL)样品 α-淀粉酶
IC50(mg/mL)PC 0.0106 PC 0.0524 PCA 1.0667 PCA 1.9426 PC:PCA=1:100 0.097 PC:PCA=1:37 0.00012 PC:PCA=1:21 0.00099 PC:PCA=1:21 0.10686 -
[1] CHEN J G, WU S F, ZHANG Q F, et al. α-glucosidase inhibitory effect of anthocyanins from Cinnamomum camphora fruit:Inhibition kinetics and mechanistic insights through in vitro and in silico studies[J]. International Journal of Biological Macromolecules,2019,143(9):696−703.
[2] 蒋晴怡. 苦荞中淀粉-槲皮素低消化体形成机制的研究[D]. 上海:上海应用技术大学,2021. [JIANG YQ. Study on the formation mechanism of low digestibility of starch quercetin in tartary bubkwheat[D]. Shanghai:Shanghai Institute of Technology,2021.] JIANG YQ. Study on the formation mechanism of low digestibility of starch quercetin in tartary bubkwheat[D]. Shanghai: Shanghai Institute of Technology, 2021.
[3] SUN L J, MIAO M. Dietary polyphenols modulate starch digestion and glycaemic level:A review[J]. Critical Reviews in Food Science and Nutrition,2022,60(4):541−555.
[4] 杨继晨. 黄酮类化合物对α-淀粉酶/α-葡萄糖苷酶的抑制机制及其构效关系研究[D]. 天津:天津大学, 2021. [YANG J C. Study on the inhibitory mechanism of flavonoids on α-amylase/α-glucosidase and its structure-activity relationship[D]. Tianjin:Tianjin University, 2021.] YANG J C. Study on the inhibitory mechanism of flavonoids on α-amylase/α-glucosidase and its structure-activity relationship[D]. Tianjin: Tianjin University, 2021.
[5] TAN Y, CHANG S K, ZHANG Y. Comparison of α-amylase, α-glucosidase and lipase inhibitory activity of the phenolic substances in two black legumes of different genera[J]. Food Chemistry,2017,214:259−268. doi: 10.1016/j.foodchem.2016.06.100
[6] HE Xiaofeng, ZHANG Xuke, GENG Changan, et al. Tsaokopyranols A-M, 2, 6-epoxydiarylheptanoids from Amomum tsao-ko and their α-glucosidase inhibitory activity[J]. Bioorganic Chemistry,2020,96:103638. doi: 10.1016/j.bioorg.2020.103638
[7] WANG Shujun, LI Caili, COPELAND L, et al. Starch retrogradation:A comprehensive review[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(5).
[8] 马艳丽, 让一峰, 赵伟, 等. 白芸豆α-淀粉酶抑制剂对α-淀粉酶抑制特性的研究[J]. 食品工业科技,2017,38(12):109−112. [MA Yanli,RANG Yifeng,ZHAO Wei, et al. Study on the inhibitory properties of α-amylase inhibitor from white kidney beans[J]. Science and Technology of Food Industry,2017,38(12):109−112.] MA Yanli, RANG Yifeng, ZHAO Wei, et al. Study on the inhibitory properties of α-amylase inhibitor from white kidney beans[J]. Science and Technology of Food Industry, 2017, 38(12): 109−112.
[9] GU L, KELM M, HAMMERSTONE J F, et al. Fractionation of polymeric procyanidins from lowbush blueberry and quanitification of procyanidins in selected foods with an optimized normal-phase HPLC-MS fluorescent detection method[J]. Journal of Agricultural and Food Chemistry,2002,50(17):4852−4860. doi: 10.1021/jf020214v
[10] BARRETT A, NDOU T, HUGHEY C A, et al. Inhibition of α-amylase and glucoamylase by tannins extracted from cocoa, pomegranates, cranberries, and grapes[J]. Journal of Agricultural and Food Chemistry,2013,61(7):1477−1486. doi: 10.1021/jf304876g
[11] 刘睿, 潘思轶, 刘亮, 等. 高粱PC对α-淀粉酶活力抑制动力学的研究[J]. 食品科学,2005(9):171−174. [LIU Rui, PAN Siyi, LIU Liang, et al. Research of inhibition kinetics for activity of α-amylase by SPC[J]. Food Science,2005(9):171−174.] LIU Rui, PAN Siyi, LIU Liang, et al. Research of inhibition kinetics for activity of α-amylase by SPC[J]. Food Science, 2005(9): 171−174.
[12] 金斐, 朱丽云, 高永生, 等. 植物源活性成分降血糖作用及其机理研究进展[J]. 食品科学,2021,42(21):322−330. [JIN Fei, ZHU Liyun, GAO Yongsheng, et al. Progress in research on the hypoglycemic effect and mechanism of plant-derived active ingredients[J]. Food Science,2021,42(21):322−330.] JIN Fei, ZHU Liyun, GAO Yongsheng, et al. Progress in research on the hypoglycemic effect and mechanism of plant-derived active ingredients[J]. Food Science, 2021, 42(21): 322−330.
[13] 林海生, 廖津, 秦小明, 等. 华贵栉孔扇贝闭壳肌酶解物的辅助降血糖功能活性评价[J]. 上海海洋大学学报,2023,32(4):865−873. [LIN Haisheng, LIAO Jin, QIN Xiaoming,et al. Evaluation on the auxiliary hypoglycemic function of enzymatic hydrolysate from Chlamys farreri adductor muscle[J]. Journal of Shanghai Ocean University,2023,32(4):865−873.] LIN Haisheng, LIAO Jin, QIN Xiaoming, et al. Evaluation on the auxiliary hypoglycemic function of enzymatic hydrolysate from Chlamys farreri adductor muscle[J]. Journal of Shanghai Ocean University, 2023, 32(4): 865−873.
[14] 曹俊伟. 没食子酸酯基多酚对淀粉消化酶的抑制作用[D]. 咸阳:西北农林科技大学,2021. [Cao Junwei. The inhibitory effects of galloyl-based polyphenols on the enzymes for starch digestion[D]. Xianyang:Northwest A&F University,2021.] Cao Junwei. The inhibitory effects of galloyl-based polyphenols on the enzymes for starch digestion[D]. Xianyang: Northwest A&F University, 2021.
[15] 黄克愁, 黄澳, 黄奕瑜, 等. 糙米多酚对淀粉消化酶的抑制作用及机理[J]. 食品工业科技,2019,40(19):104−109,116. [HUANG Kechou, HUANG Ao, HUANG Yiyu, et al. Inhibition and mechanism of brown rice polyphenols on starch digestive enzymes[J]. Science and Technology of Food Industry,2019,40(19):104−109,116.] HUANG Kechou, HUANG Ao, HUANG Yiyu, et al. Inhibition and mechanism of brown rice polyphenols on starch digestive enzymes[J]. Science and Technology of Food Industry, 2019, 40(19): 104−109,116.
[16] 周一鸣, 马思佳, 蒋晴怡, 等. 苦荞中芦丁和槲皮素对淀粉消化酶的抑制能力[J]. 食品科学,2022,43(18):30−37. [ZHOU Yiming, MA Sijia, JIANG Qingyi, et al. Inhibition of starch-digesting enzymes by rutin and quercetin in tartary buckwheat[J]. Food Science,2022,43(18):30−37.] ZHOU Yiming, MA Sijia, JIANG Qingyi, et al. Inhibition of starch-digesting enzymes by rutin and quercetin in tartary buckwheat[J]. Food Science, 2022, 43(18): 30−37.
[17] SHEN Heyu, WANG Jun, AO Jingfang, et al. The inhibitory mechanism of pentacyclic triterpenoid acids on pancreatic lipase and cholesterol esterase[J]. Food Bioscience,2023,51:102341. doi: 10.1016/j.fbio.2022.102341
[18] 赵一灵. 不同黄酮类化合物对α-淀粉酶的抑制作用机制及蒲公英果冻的开发[D]. 南昌:南昌大学,2022. [ZHAO Y L. The inhibition mechanism of different flavonoids on α-amylase and the development of dandelion jelly[D]. Nanchang:Nanchang University,2022.] ZHAO Y L. The inhibition mechanism of different flavonoids on α-amylase and the development of dandelion jelly[D]. Nanchang: Nanchang University, 2022.
[19] HUI X D, WU GHAN D, et al. The effects of bioactive compounds from blueberry and blackcurrant powders onthe inhibitory activities of oat bran pastes against o-amylase and o-glucosidase linked to type 2 diabetes[J]. Food Research International,2020,138:109756. doi: 10.1016/j.foodres.2020.109756
[20] 袁向华, 周艳玲, 勾洵, 等. 阿卡波糖对胰α-淀粉酶的抑制动力学研究[J]. 世界科技研究与发展,2016(1):117−121. [YUAN Xianghua, ZHOU Yanling, et al. Researches on inhibition kinetics of pancreatic α-amylase by acarbose[J]. World Sci-Tech R&D,2016(1):117−121.] YUAN Xianghua, ZHOU Yanling, et al. Researches on inhibition kinetics of pancreatic α-amylase by acarbose[J]. World Sci-Tech R&D, 2016(1): 117−121.
[21] OBOH G, ADEMOSUN A O, AYENI P O, et al. Comparative effect of quercetin and rutin on α-amylase, α-glucosidase, and some pro-oxidant-induced lipid peroxidation in rat pancreas[J]. Comp Clin Pathol,2014,24:1103−1110.
[22] ULUSOY H G, SANLIER N. A minireview of quercetin:From its metabolism to possible mechanisms of its biological activities[J]. Crit Rev Food Sci Nutr,2019,60:3290−3303.
[23] LIM J, FERRUZZI M G, HAMAKER B R. Structural requirements of flavonoids for the selective inhibition of alpha-amylase versus alpha-glucosidase[J]. Food Chem,2022,370:130981. doi: 10.1016/j.foodchem.2021.130981
[24] ZHU H, LIU S, YAO L, et al. Free and bound phenolics of buckwheat varieties:HPLC characterization, antioxidant activity, and inhibitory potency towards alpha-glucosidase with molecular docking analysis[J]. Antioxidants,2019,8:606. doi: 10.3390/antiox8120606
[25] ZHANG H L, WU Q X, QIN X M. Camellia nittdissima Chi flower extracts inhibit α-amylase and α-glucosidase:In vitro by analysis of optimization of addition methods, inhibitory kinetics and mechanisms[J]. Process Biochemistry,2019,86:177−185. doi: 10.1016/j.procbio.2019.07.009
[26] ZHAO J, HUANG L, SUN C, et al. Studies on the structure-activity relationship and interaction mechanism of flavonoids and xanthine oxidase through enzyme kinetics, spectroscopy methods and molecular simulations[J]. Food Chem,2020,323:126807. doi: 10.1016/j.foodchem.2020.126807
[27] SKRT M, BENEDIK E, PODLIPNIK C, et al. Interactions of different polyphenols with bovine serum albumin using fluorescence quenching and molecular docking[J]. Food Chem,2012,135:2418−2424. doi: 10.1016/j.foodchem.2012.06.114
[28] JOYE I J, DAVIDOV-PARDO G, LUDESCHER R D, et al. Fluorescence quenching study of resveratrol binding to zein and gliadin:Towards a more rational approach to resveratrol encapsulation using water-insoluble proteins[J]. Food Chem,2015,185:261−267. doi: 10.1016/j.foodchem.2015.03.128
[29] ZHENG Y, TIAN J, YANG W, et al. Inhibition mechanism of ferulic acid against alpha-amylase and alpha-glucosidase[J]. Food Chem,2020,317:126346. doi: 10.1016/j.foodchem.2020.126346
[30] KAYUKAWA C T M, DE O M A S, KASPCHAK E, et al. Effect of tannic acid on the structure and activity of Kluyveromyces lactis beta-galactosidase[J]. Food Chem,2019,275:346−353. doi: 10.1016/j.foodchem.2018.09.107
[31] YUKSEL Z, AVCI E, ERDEM Y K. Characterization of binding interactions between green tea flavanoids and milk proteins[J]. Food Chem,2010,121:450−456. doi: 10.1016/j.foodchem.2009.12.064
[32] ZHANG J, DING W, TANG Z, et al. Identification of the effective alpha-amylase inhibitors from Dalbergia odorifera:Virtual screening, spectroscopy, molecular docking, and molecular dynamic simulation[J]. Spectrochim Acta A Mol Biomol Spectrosc,2022,280:121448. doi: 10.1016/j.saa.2022.121448
-
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:
 下载:
下载:



