Effects of Grafting Methods on the Physicochemical Properties of Gluten-Curcumin Conjugate and Its Application in Frozen Dough
-
摘要: 本文分别采用碱法、超声波法和酶法来制备面筋蛋白-姜黄素共价复合物,同时探讨姜黄素共价修饰方法对面筋蛋白理化性质、冷冻面团流变学特性以及面包品质的影响。结果显示,三种方法诱导的共价交联使得面筋蛋白的游离氨基含量降低了26.98%~28.74%,游离巯基含量降低了10.80%~14.52%,并且共价交联破坏了分子内氢键,改变了蛋白质的二级、三级结构以及表面疏水性,增加了蛋白质的粒径和热稳定性。姜黄素共价修饰还可以改善冷冻面团的复合模量、蠕变恢复率以及硬度,并且同样可以改善冷冻面团面包的比容和硬度。这些结果说明,姜黄素共价修饰可以改善由面筋蛋白劣变所导致的冷冻面团品质下降。此外,与碱法和酶法制备的共价复合物相比较,超声波法制备的共价复合物在改善冷冻面团品质方面具有更好的效果。Abstract: In this study, the conjugate of curcumin and gluten were prepared through alkaline, ultrasonic, and enzymatic methods. The effects of grafting methods on physicochemical properties of gluten, rheology properties of frozen dough and the quality of resulted bread were evaluated. The results showed that the conjugation induced by alkaline, ultrasound, and enzyme led to the decreasing of free amino group content in the range of 26.98%~28.74%, and free sulfhydryl group content in the range of 10.80%~14.52%, respectively. The conjugation also resulted in the disrupture of intramolecular hydrogen bonding, changes of the secondary, tertiary structure and surface hydrophobicity, as well as increasing of particle size and thermal stability. The frozen dough with curcumin-gluten conjugate exhibited higher complex modulus, creep recovery and hardness than those without the conjugate. Furthermore, the incorporation of curcumin-gluten conjugate into frozen dough also helped to improve the loaf volume and the hardness of resulted bread. These results indicated that the conjugation between curcumin and gluten could prevent the deterioration of frozen dough. In addition, as compared with conjugate prepared from alkaline and enzymatic methods, the conjugate prepared from ultrasonic method showed the better ability in improving the quality of frozen dough.
-
Keywords:
- gluten /
- curcumin /
- alkaline /
- ultrasonic /
- enzymatic /
- frozen dough
-
面包作为一种受欢迎的方便食品,在全球范围内广泛销售,然而,其易老化和货架期短的特点制约了其运输和销售的范围[1]。冷冻面团技术不仅可有效解决面制品保质期短、运输不便和冷藏不易等难题,还能够有助于实现面包产业的标准化[2]。然而,在冻藏过程中,由于面团网络结构的劣变,水分的重新分布,酵母细胞的死亡,会导致面团的发酵时间增加,面筋网络结构减弱,面包体积下降,硬度增加,口感变差等问题[3−5]。因此,目前有很多研究致力于改善冷冻面团性质,使其能更好地投入工业生产。Liu等[6]通过加入阿拉伯胶、海藻酸钠和Sesbania这三种亲水胶体,增加了法式长棍面包的水分,延缓了水分迁移,阻碍了冰晶的生长,改善了面包的持气性,并降低了面包的硬度。Tang等[7]的研究发现,添加α-淀粉酶能够提高面团的持气能力,增加面包比体积,并且降低面包屑硬度和老化率。
面筋蛋白作为面团的骨架结构,是决定面制品质量的重要因素。然而研究表明,面筋蛋白在冷冻过程中发生解聚,从而造成面团品质下降[8],粘弹性下降[9]。因此,可以通过对面筋蛋白进行改性,增强其网络结构强度,减少其在冻藏过程中的解聚,从而改善冷冻面团质量。据报道,多酚可以与面筋蛋白形成交联,并增加面筋网络的强度[10]。然而,多酚与面筋的交联主要是通过疏水相互作用、静电作用等非共价作用,前人的研究发现,多酚与蛋白质的共价交联产物比非共价交联产物具有更好的热稳定性、乳化性以及凝胶性,可以提高食品的功能性质和质量[11]。然而,关于面筋蛋白和多酚之间共价交联能否改善面筋蛋白的功能特性尚不清楚。
通常,多酚在碱性条件或者多酚氧化酶的催化下,会氧化成醌,攻击蛋白质的氨基或巯基,与之形成共价交联[12−13]。近年来,超声技术也被运用于诱导多酚和蛋白共价交联[14−15],与碱/酶法不同,超声波的空化作用可以产生H·或HO·,接着促发蛋白质自由基,从而与多酚形成共价交联。超声波技术不但可以诱导多酚和蛋白质共价交联,还可以诱导蛋白质展开,进一步促进蛋白质和多酚的相互作用[16]。然而,关于制备方法对蛋白功能特性的影响尚不可知。
姜黄素是一种从姜黄根茎中提取的天然多酚化合物,由于其独特的味道,被广泛用作食用香料[17−18]。由于姜黄素的结构中存在共轭双键,是一种有效的电子供体,在氧化还原反应中与活性氧反应,具有很强的抗氧化性[19]。此外,姜黄素还具有抑菌[20]、抗癌[21]、抗炎症[22]、降血脂[23]等生物活性,因此在食品医学领域常被用于膳食补充剂、天然着色剂以及抑菌剂[24]。
综上所述,本研究将姜黄素与面筋蛋白通过碱、超声和酶三种方法进行共价交联,通过测定共价复合物的游离氨基、游离巯基、表面疏水性、二级结构、粒径等理化性质,探讨姜黄素共价修饰面筋蛋白的分子机制。此外,通过研究姜黄素-面筋蛋白共价复合物对冷冻面团流变学特性和面包品质的影响,明确姜黄素共价修饰防止冷冻面团劣变的作用机制,以期为冷冻面团品质改良提供理论依据和技术支撑。
1. 材料与方法
1.1 材料与仪器
小麦淀粉、漆酶、姜黄素(≥98%) 上海源叶生物有限公司;邻苯二甲醛、β-硫基乙醇、1-苯胺-8 -萘磺酸钠、磷酸盐缓冲液、四硼酸钠、溴化钾 阿拉丁生物生化科技有限公司;十二烷基硫酸钠 国药集团化学试剂有限公司;总巯基含量测定试剂盒 南京建成生物有限公司;大豆油 山东鲁花集团有限公司;高筋面粉、白砂糖、盐、奶粉 南京金盛田永辉超市;干酵母、面包改良剂 安琪酵母股份有限公司;其中所有化学药品均为分析纯。
UV-1900紫外分光光度计 日本岛津株式会社;F-4700荧光分光光度计 日本日立高新技术科学株式会社;BS124S电子分析天平 德国Sartorius公司;NICOLET 380傅里叶红外光谱仪 美国热电子公司;PHS-3C pH计 上海精密科学仪器有限公司;T25 D S25均质机 艾卡(广州)仪器设备有限公司;BILON-650E超声破碎仪 上海比朗仪器有限公司;香山EK280DR烘焙秤 广东香山衡器集团股份有限公司;SM2-523电烤炉 新麦机械(中国)有限公司;SJJ-B10W5厨师机 小熊电器股份有限公司;JMTY型面包体积测定仪 杭州大吉光电仪器有限公司;TMS-Pilot质构仪 北京盈盛恒泰科技有限责任公司;Malvern3000激光粒度仪 英国马尔文仪器有限公司;HR-1流变仪、TA Q20差示扫描量热仪 英国TA仪器有限公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 面筋蛋白制备
根据国标GB 5506.1-2008制备湿面筋,将所得湿面筋冷冻干燥后用研磨机粉碎,置于干燥器中保存,凯氏定氮法测得蛋白含量为77.68%,面筋蛋白命名为G。
1.2.2 样品制备
通过碱法、超声波法和酶法制备三种面筋蛋白-姜黄素共价复合物及对应方法处理的面筋蛋白,作为对照,同时制备了面筋蛋白-姜黄素混合物。
1.2.2.1 碱处理法
将4%(w/v)的面筋蛋白和0.08%(w/v)的姜黄素分散在水中,用1 mol/L的NaOH将pH调节至9.0后,用均质机以20000 r/min的速度处理分散液2 min,在25 ℃下连续搅拌24 h。反应结束后将pH调至中性,冷冻干燥,置于干燥器中保存,将该样品命名为GcuA。作为对照,在同样的条件下处理面筋蛋白,得到的样品命名为GA。
1.2.2.2 超声波法
将4%(w/v)的面筋蛋白和0.08%(w/v)的姜黄素分散在水中,用1 mol/L的NaOH将pH调节至7.0后,用均质机以20000 r/min的速度处理分散液2 min,均质结束后,用超声细胞破碎仪在外接冰水浴的条件下处理分散液20 min:将探头(Φ6 mm)浸入液面以下1 cm处,超声处理的脉冲持续时间为开启2 s,关闭2 s,功率为400 W。最后,将样品冷冻干燥,置于干燥器中保存,该样品命名为GcuU。作为对照,在相同条件下处理面筋蛋白,得到的样品命名为GU。
1.2.2.3 酶催化法
将4%(w/v)的面筋蛋白和0.08%(w/v)的姜黄素分散在水中,用1 mol/L的NaOH将pH调节至7.0后,用均质机以20000 r/min的速度处理分散液2 min,加入漆酶(60 U/g),在25 ℃下连续搅拌24 h。反应结束后,将样品冷冻干燥,并置于干燥器中保存,该样品命名为GcuE。作为对照,在相同条件下处理面筋蛋白,得到的样品命名为GE。
1.2.2.4 混合物
将4%(w/v)的面筋蛋白和0.08%(w/v)的姜黄素分散在水中,用1 mol/L的NaOH将pH调节至7.0后,用均质机以20000 r/min的速度处理分散液2 min,在25 ℃下连续搅拌24 h。反应结束后,将样品冷冻干燥,置于干燥器中保存,将该样品命名为Gcu。
1.2.3 游离氨基含量测定
采用邻苯二甲醛法测定样品中的游离氨基含量[25]。准确称取40 mg邻苯二甲醛(OPA)溶解于l mL甲醇中,分别加入20%(w/v)的SDS溶液2.5 mL、0.1 mol/L的硼砂溶液25 mL、100 μL β-巯基乙醇,最后用蒸馏水定容至50 mL,此为OPA试剂。测定时,取OPA试剂 4 mL于试管中,分别注入200 μL(1 mg/mL)样品液,混匀后反应2 min,在340 nm下测其吸光值,以在OPA试剂中加入200 μL水作为空白。以L-亮氨酸绘制标准曲线,计算样品中游离氨基的含量。标准曲线公式(1)和游离氨基含量计算公式(2)如下:
Y=0.00055X−0.0403 (1) 式中,Y代表L-亮氨酸在340 nm处吸光度;X代表L-亮氨酸中游离氨基含量(nmol/g);决定系数R2为0.999。
Ma=A340+0.04030.00055 (2) 式中,Ma代表样品游离氨基含量(nmol/g);A340代表蛋白样品在340 nm处的吸光度。
1.2.4 游离巯基含量测定
为测定游离巯基的含量,将样品分散液(1 mg/mL,pH8.0缓冲液)孵育24 h(25 ℃,100 r/min),之后与2-硝基苯甲酸试剂(DTNB)混合,根据试剂盒制造商的说明,在405 nm处测量其吸光度,并根据公式(3)计算游离巯基含量。
MS=A测定−A对照A标准−A空白×C标准/Cp (3) 式中,Ms代表样品中游离巯基的含量(μmol/g),A测定代表样品(加入DTNB)在405 nm处的吸光度,A对照代表样品(未加入DTNB)在405 nm处的吸光度,A标准代表标准品在405 nm处的吸光度,A空白代表空白对照在405 nm处的吸光度,C标准代表标准品浓度,本实验为500 μmol/L,Cp代表样品浓度,本实验为1 g/L。
1.2.5 红外与二级结构测定
根据Wang等[26]的方法,将1.0 mg冻干样品与30 mg溴化钾粉末混合,然后用直径10 mm的不锈钢杯压制成1 mm厚的薄片。在室温下,将制备好的样品薄片,在500~4000 cm−1的范围,以4 cm−1的分辨率记录红外光谱(32次扫描),每个样品重复测量三次。用Peakfit软件对样品酰胺I带(1600~1700 cm−1)进行分析,计算样品的二级结构含量。
1.2.6 表面疏水性测定
按照Zhao等[27]所述的方法,用1-苯胺基萘-8-磺酸(ANS)作为荧光探针,测定面筋蛋白的表面疏水性。将冻干后的样品配制浓度为2 mg/mL的溶液,用0.01 mol/L,pH7.2~7.4的磷酸盐缓冲液分别稀释为0.05、0.1、0.2、0.5、1 mg/mL五个浓度梯度,每个浓度的样品溶液分别取4 mL并加入50 µL ANS,避光反应15 min。在390 nm激发波长和470 nm发射波长下记录各样品溶液的荧光强度,激发和发射狭缝宽度均设定为5 nm。以荧光强度对样品浓度作图,曲线的初始斜率即为蛋白质的表面疏水性(H0)。
1.2.7 内源荧光测定
根据Xue等[28]描述的方法稍作修改后进行荧光光谱的测量。用磷酸盐缓冲液(0.01 mol/L,pH7.2~7.4)配制0.1 mg/mL的样品溶液。在激发波长为290 nm,发射波长为300~500 nm,激发和发射狭缝宽度为5 nm的条件下记录样品的荧光光谱。
1.2.8 粒径测定
将1 mg冷冻干燥样品分散在10 g水中,然后用激光粒度仪测量样品的粒径。
1.2.9 DSC的测定
根据Xue等[29]报道的方法略作修改后进行测定。利用差示扫描量热仪测量样品的热稳定性,称量样品3~6 mg,置于密封的铝坩埚中,从30 ℃加热至200 ℃,加热速率为10 ℃/min。
1.2.10 冷冻面团和新鲜面团的制备
将85 g小麦淀粉、每种样品各15 g混合得到面粉。然后在揉面机中加入50 g水,搅拌5 min,得到光滑的面团。将面团单独包装在聚乙烯袋中,并在−18 ℃下冷冻14 d。随后,将冷冻面团在4 ℃下解冻。解冻的面团(G-F、Gcu-F、GA-F、GcuA-F、GU-F、GcuU-F、GE-F、GcuE-F)和新鲜面团(G-N、Gcu-N、GA-N、GcuA-N、GU-N、GcuU-N、GE-N、GcuE-N)一并用于后续实验[30]。
1.2.11 冷冻面团和新鲜面团的流变学性质测定
用HR-1流变仪安装平行板(直径25mm,间隙1 mm)对面团进行流变学测量。在0.1~10 Hz范围内进行恒定应力扫描(1 Pa,25 ℃),记录储能模量(G′)和损耗模量(G″)的变化曲线,复合模量(G*)由G′和G′′计算,公式为:G*=[(G′)2+(G′′)2]1/2。在25 ℃、250 Pa的剪切应力下进行蠕变和恢复试验,记录在恒定应力下的应变300 s,去除压力后,再记录300 s的恢复应变[30]。
1.2.12 冷冻面团面包和新鲜面团面包的制备
面包配方为95 g小麦粉,分别加入5 g样品, 60 g水、3 g干酵母、8 g糖、2 g奶粉、1 g盐和0.5 g面包改良剂。所有原料在厨师机中先低速搅拌3 min,然后高速搅拌至面筋网络充分形成,同样将面团在−18 ℃下冷冻14 d,而后在4 ℃下解冻。随后,解冻的和新鲜的面团在37 ℃、85%的相对湿度的条件下发酵60 min,然后在上火190 ℃、下火210 ℃ 的烤箱中烘烤20 min,面包在室温下冷却1 h后进行后续测量[31]。
1.2.13 冷冻面团面包和新鲜面团面包的比容测定
面包的体积根据油菜籽置换法由面包体积仪测量,比容用体积与重量之比表示[32]。
1.2.14 面团和面包的硬度测定
使用质构仪对面团和面包进行形变测试,用直径为20 mm的不锈钢圆柱探头,以1 mm/s的交叉速度将面团或面包压缩至原来高度的70%,记录面团和面包的硬度[33]。
1.3 数据处理
所有实验结果重复三次,采用SPSS软件进行数据统计,进行单因素方差分析(ANOVA)和LSD显著性差异检验,P<0.05具有统计学意义。所有图像均由Origin软件绘制。
2. 结果与分析
2.1 姜黄素修饰对面筋蛋白侧链基团的影响
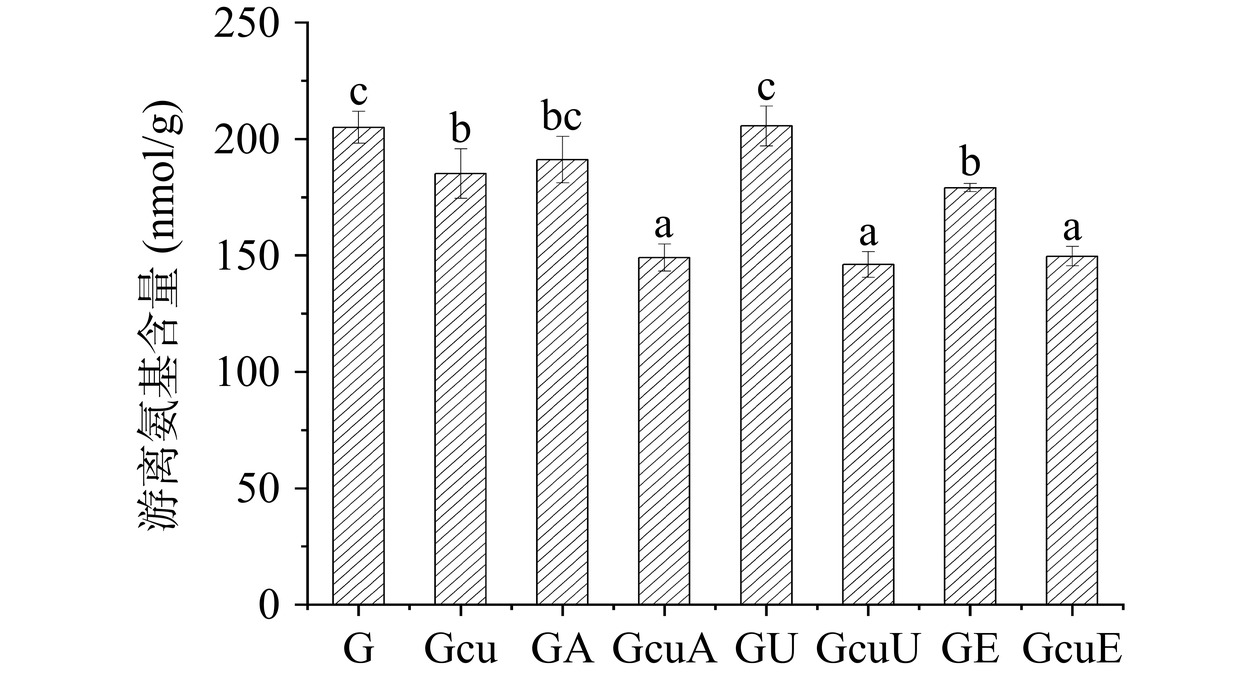
2.1.1 游离氨基含量
如图1所示,与天然面筋蛋白相比较,超声波处理和碱处理均未显著影响面筋蛋白中游离氨基的含量(P>0.05)。然而,添加漆酶却使得面筋蛋白中游离氨基的含量下降了12.61%。此外,添加姜黄素同样使得面筋蛋白中游离氨基的含量下降了9.68%。这可能是因为姜黄素与面筋蛋白之间存在非共价相互作用力(例如:氢键、疏水相互作用、离子键等),从而诱导蛋白质形成聚集体,继而降低了游离氨基的含量[34]。当采用碱法、超声波法和酶法诱导面筋蛋白与姜黄素形成共价复合物以后,面筋蛋白中的游离氨基含量分别下降了27.28%、28.74%和26.98%,这说明姜黄素与面筋蛋白之间的共价交联发生在游离氨基和酚羟基之间[35]。前人关于米糠蛋白[36]、大豆蛋白[28]和乳铁蛋白[37]的研究同样发现,利用碱法、超声波法和酶法可以诱导蛋白质与多酚发生共价交联。
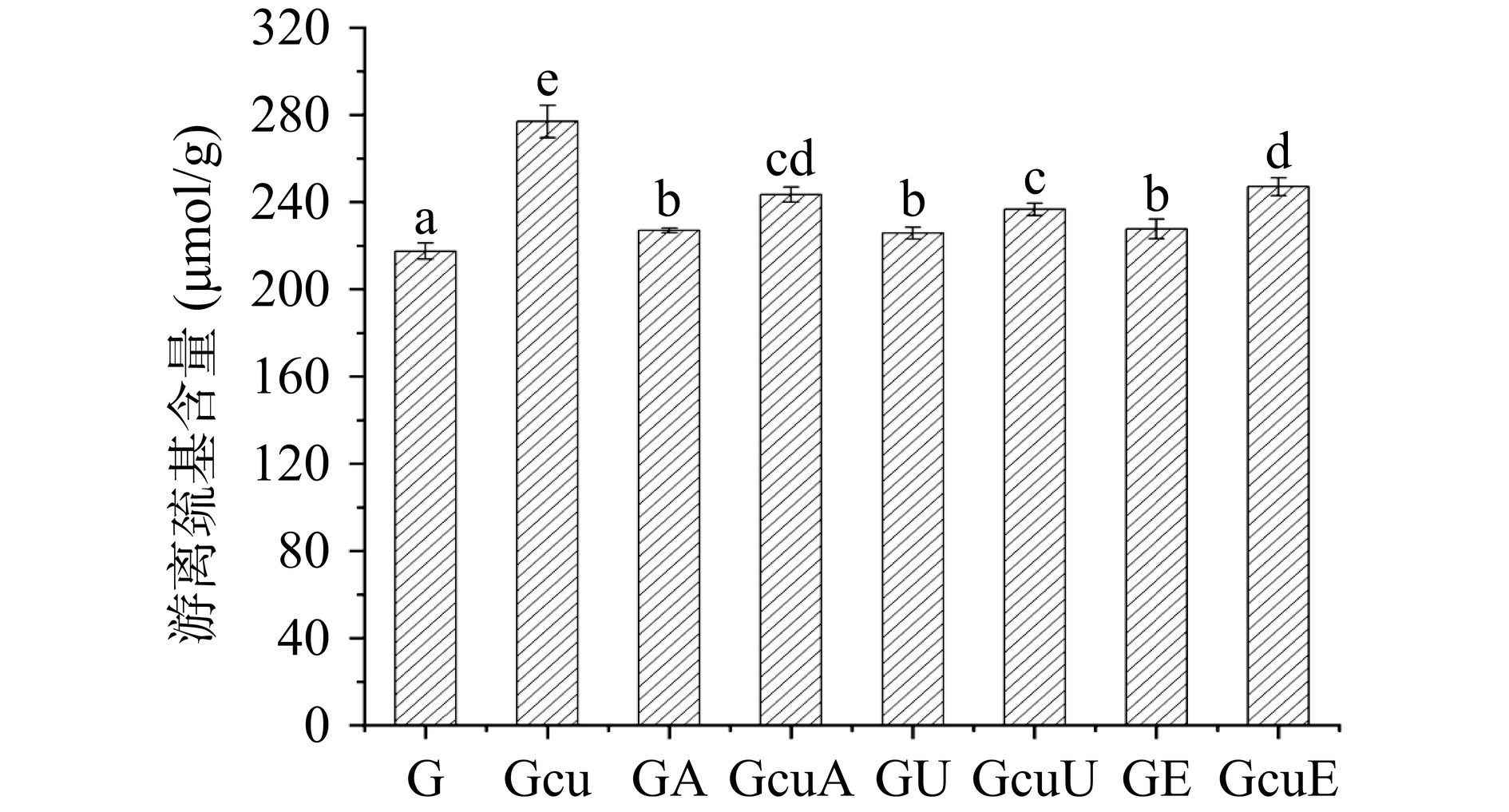
2.1.2 游离巯基含量
如图2所示,与天然面筋蛋白相比较,碱处理、超声波处理以及酶处理均使面筋蛋白中游离巯基的含量分别增加了4.40%、3.81%和4.75%。这可能与碱处理、超声波处理诱导蛋白质发生去折叠化,从而使得分子内部游离巯基暴露有关[38]。而酶处理所导致的游离巯基含量增加可能是因为漆酶本身可以氧化蛋白质,导致蛋白质结构被破坏,从而暴露更多的游离巯基[39]。此外,添加姜黄素使得面筋蛋白中游离巯基的含量显著增加27.36%(P<0.05),这可能是因为姜黄素本身作为还原剂可以诱导蛋白质中的二硫键被还原成游离巯基[40]。当采用碱法、超声波法和酶法诱导面筋蛋白与姜黄素形成共价复合物以后,共价复合物中游离巯基的含量与面筋蛋白与姜黄素的混合物相比分别下降了12.08%、14.52%和10.80%,而游离巯基含量的下降主要是因为姜黄素与面筋蛋白之间的共价交联发生在游离巯基和酚羟基之间。前人关于大豆蛋白的研究同样发现,花青素共价修饰可以显著降低蛋白质中游离巯基的含量[41]。
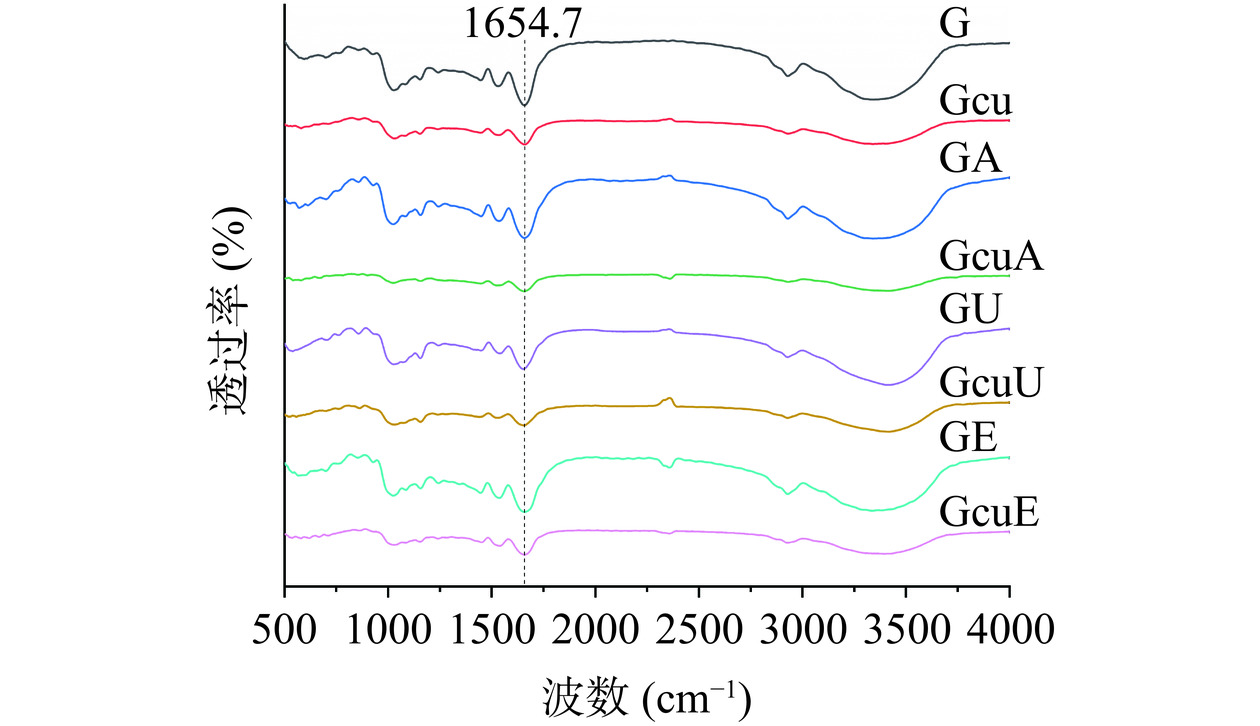
2.1.3 红外光谱
如图3所示,与天然面筋蛋白相比,碱处理、超声波处理以及酶处理均未显著影响面筋蛋白的红外光谱图。然而,添加姜黄素却可以显著降低面筋蛋白在酰胺A带(3400~3500 cm−1)处的吸收强度,这可能是因为姜黄素与面筋蛋白之间的非共价相互作用力破坏了面筋蛋白之间的氢键[30]。此外,碱处理、超声波处理以及酶处理所诱导的共价复合物不仅可以降低面筋蛋白在酰胺A带处的吸收强度,同时还可以降低面筋蛋白在酰胺I(1600~1700 cm−1)带处的吸收强度。这一结果可以进一步证实姜黄素和面筋蛋白之间可以通过C-N键形成共价交联[42]。
2.2 姜黄素修饰对面筋蛋白结构的影响
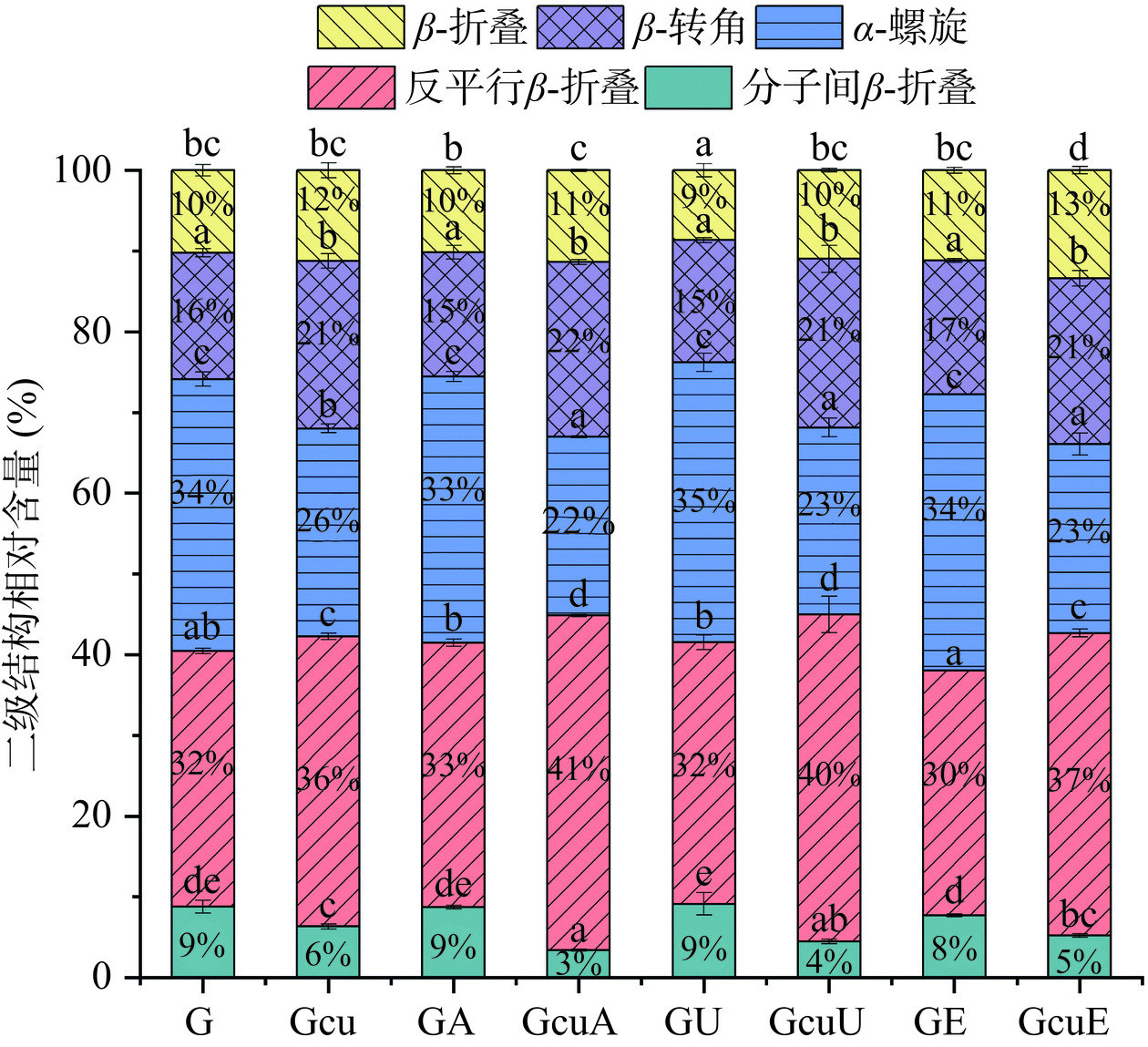
2.2.1 二级结构
对于面筋蛋白而言,1650~1660 cm−1 的区域代表α-螺旋,而1660~1675 cm−1则表示β-转角,位于1612~1614、1618~1644和1675~1695 cm−1的区域分别属于分子间β-折叠、反平行β-折叠和β-折叠[43]。通过去卷积处理和高斯拟合得到各二级结构占比如图4所示,其中天然面筋蛋白的主要结构为反平行β-折叠和α-螺旋,分别占比32%和34%,而β-转角、分子间β-折叠和β-折叠分别占16%、9%和10%,与Liu等[44]的研究结果较为接近。如图4所示,与天然面筋蛋白相比较,碱处理、超声波处理以及酶处理均未明显影响面筋蛋白的二级结构。而添加姜黄素却使面筋蛋白中分子间β-折叠和α-螺旋的相对含量分别降低了27.72%和23.52%,同时β-折叠、β-转角和反平行β-折叠的相对含量分别增加了10.10%、32.43%和13.38%。这可能是因为姜黄素破坏了面筋蛋白分子内的氢键,从而导致二级结构的变化。前人关于用高浓度柿子单宁改性面筋蛋白[45]和用绿原酸改性谷蛋白[46]的研究发现添加多酚导致面筋蛋白/谷蛋白的α-螺旋相对含量下降和β-折叠相对含量上升,这与本文的研究结果一致。此外,碱处理、超声波处理以及酶处理所诱导的共价交联使面筋蛋白分子间β-折叠相对含量下降了61.02%、48.96%、40.41%;以及α-螺旋的相对含量下降了34.29%、31.21%、30.59%。这一结果说明,共价交联可以进一步破坏面筋蛋白分子内相互作用力,从而使得面筋蛋白的结构更加松散。
2.2.2 表面疏水性
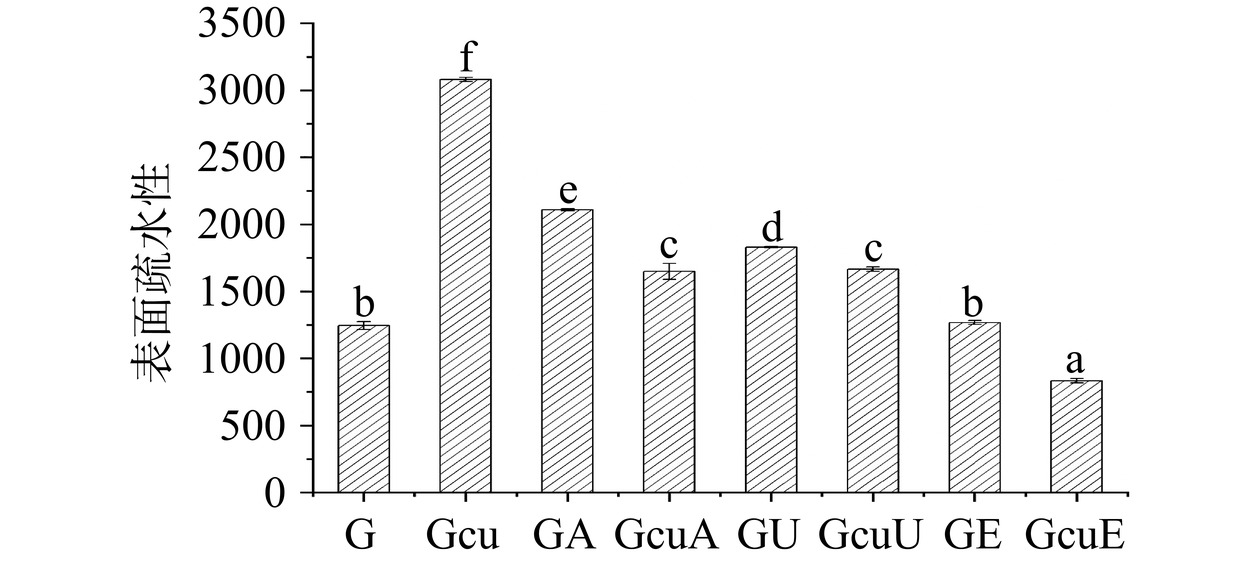
如图5所示,与天然面筋蛋白相比较,碱处理和超声波处理使面筋蛋白的表面疏水性分别增加了69.23%和46.93%,这可能是因为碱处理和超声波处理可以诱导蛋白质分子发生去折叠化,从而导致内部疏水基团的暴露[30]。而姜黄素的添加同样使得面筋蛋白的表面疏水性增加了147.23%,这可能与姜黄素对面筋蛋白分子内氢键和二硫键的破坏有关。当维持蛋白质内部结构的分子间相互作用力减弱时,会导致埋藏在内部的大量疏水基团暴露,从而使得蛋白质具有较高的表面疏水性[30]。此外,与三种不同方法处理的面筋蛋白相比较,碱处理、超声波处理以及酶处理所诱导的共价复合物的表面疏水性分别下降了21.74%、8.98%和34.25%。这一结果与前人关于大豆蛋白的研究相一致,即多酚共价修饰可以显著降低蛋白质的表面疏水性[28]。
2.2.3 内源荧光
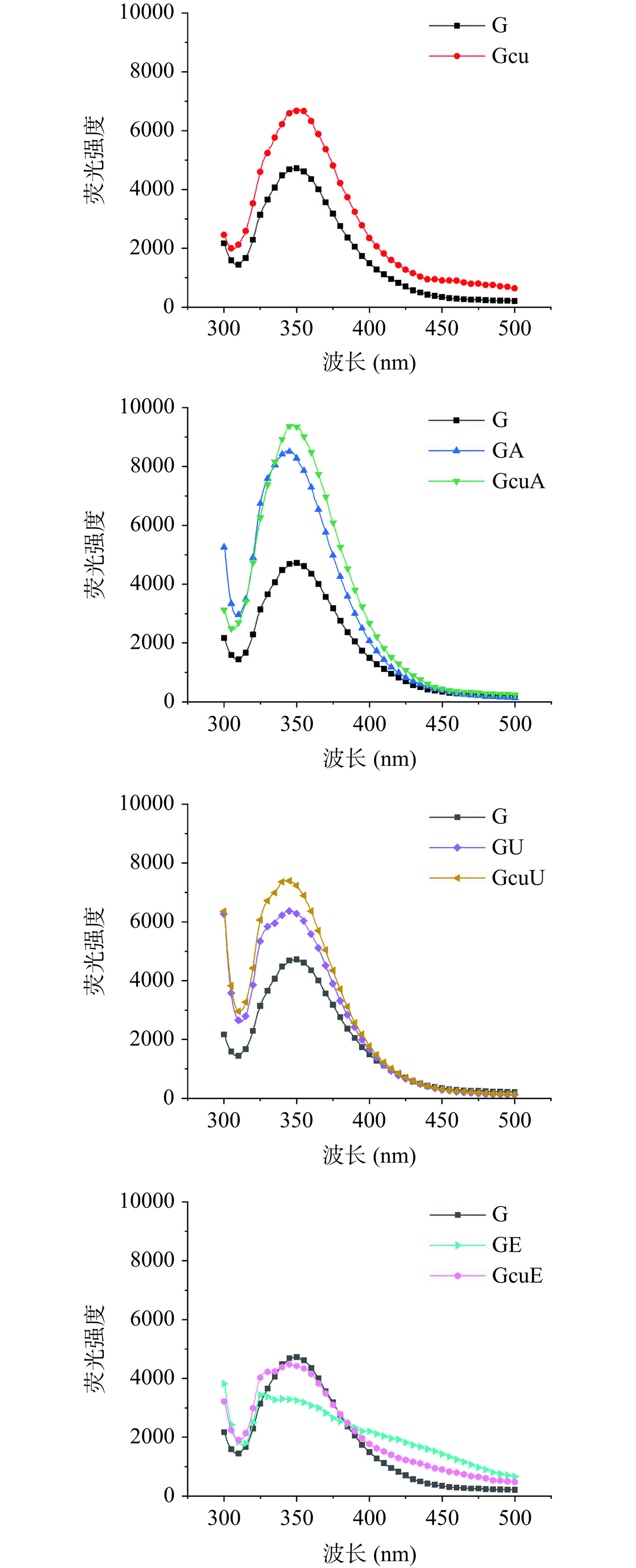
如图6所示,与天然面筋蛋白相比较,碱处理和超声波处理使面筋蛋白的内源荧光强度分别增加了81.33%和39.06%,可能原因是碱处理和超声波处理促使面筋蛋白内部酪氨酸、色氨酸和苯丙氨酸残基的暴露[13,28]。而酶处理却导致面筋蛋白的内源荧光强度降低了33.62%,这可能是因为酶诱导的酪氨酸交联具有荧光猝灭作用[47]。此外,姜黄素的添加同样导致面筋蛋白内源荧光强度增加了55.51%,这可能与酪氨酸、色氨酸和苯丙氨酸残基的暴露有关[30]。与面筋蛋白/姜黄素混合物相比较,碱处理和超声波处理诱导的共价复合物促使面筋蛋白的内源荧光强度分别增加了34.78%和12.26%,这一结果说明这两种交联方式形成的共价复合物具有更加松散的结构。
2.3 姜黄素修饰对面筋蛋白粒径的影响
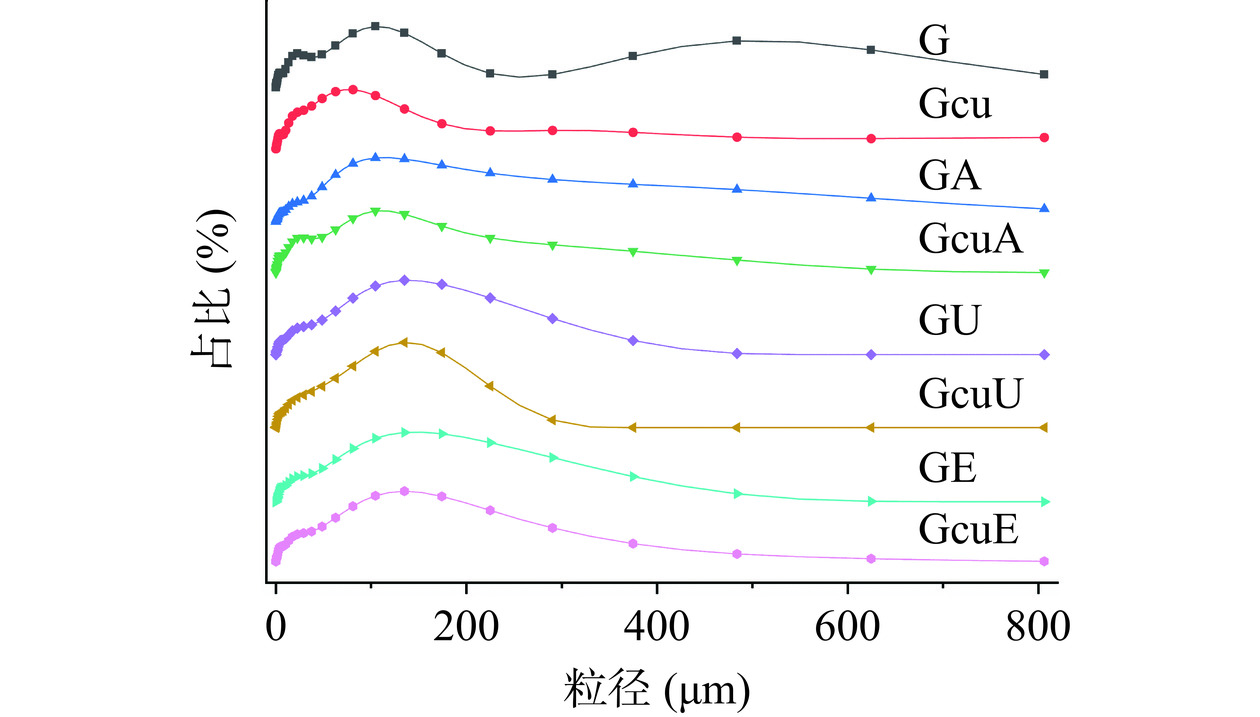
如图7所示,天然面筋蛋白的粒径呈现多峰分布,主要峰分别出现在500 μm和100 μm处,前一个峰的出现可能与面筋蛋白聚集的产生有关。而碱处理、超声处理和酶处理可以导致500 μm处的峰消失,这说明三种处理均可以防止面筋蛋白聚集体的产生。姜黄素的添加同样导致500 μm处的峰消失,这一结果说明姜黄素也可以降低面筋蛋白聚集体的产生。前人关于大豆蛋白的研究发现,花青素的添加可以防止蛋白质聚集体的出现[28]。与面筋蛋白/姜黄素混合物相比较,碱处理、超声处理和酶处理所制备的共价复合物具有更大的粒径,这可能是因为共价交联诱导蛋白质-姜黄素-蛋白质产物的形成。前人的研究发现,儿茶素可以诱导大豆蛋白质之间的共价交联,形成蛋白质-儿茶素-蛋白质交联产物,从而导致蛋白质粒径的增加[48]。
2.4 姜黄素修饰对面筋蛋白热稳定性的影响
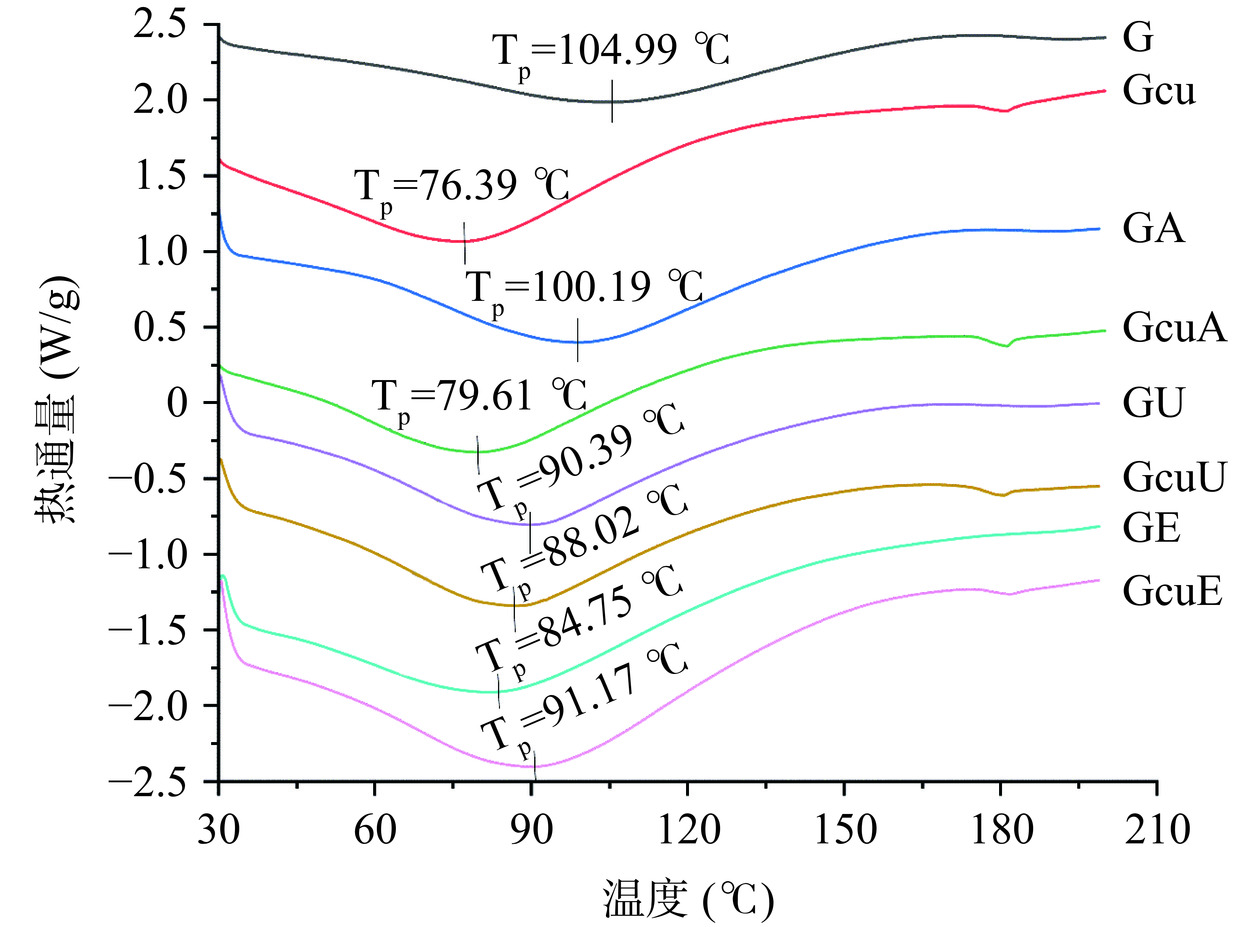
如图8所示,与天然面筋蛋白相比较,三种处理(碱处理、超声处理和酶处理)以及姜黄素的添加均导致面筋蛋白变性温度下降,这可能与三种处理以及姜黄素添加导致面筋蛋白去折叠化有关[49],而蛋白质去折叠化可以由二级结构组成、内源荧光强度以及表面疏水性的改变可知。与面筋蛋白/姜黄素混合物相比较,三种处理诱导的共价复合物可以增加面筋蛋白的热稳定性,这可能与共价键的形成有关[50]。
2.5 姜黄素-面筋蛋白共价复合物对冷冻面团性能的影响
2.5.1 粘弹性
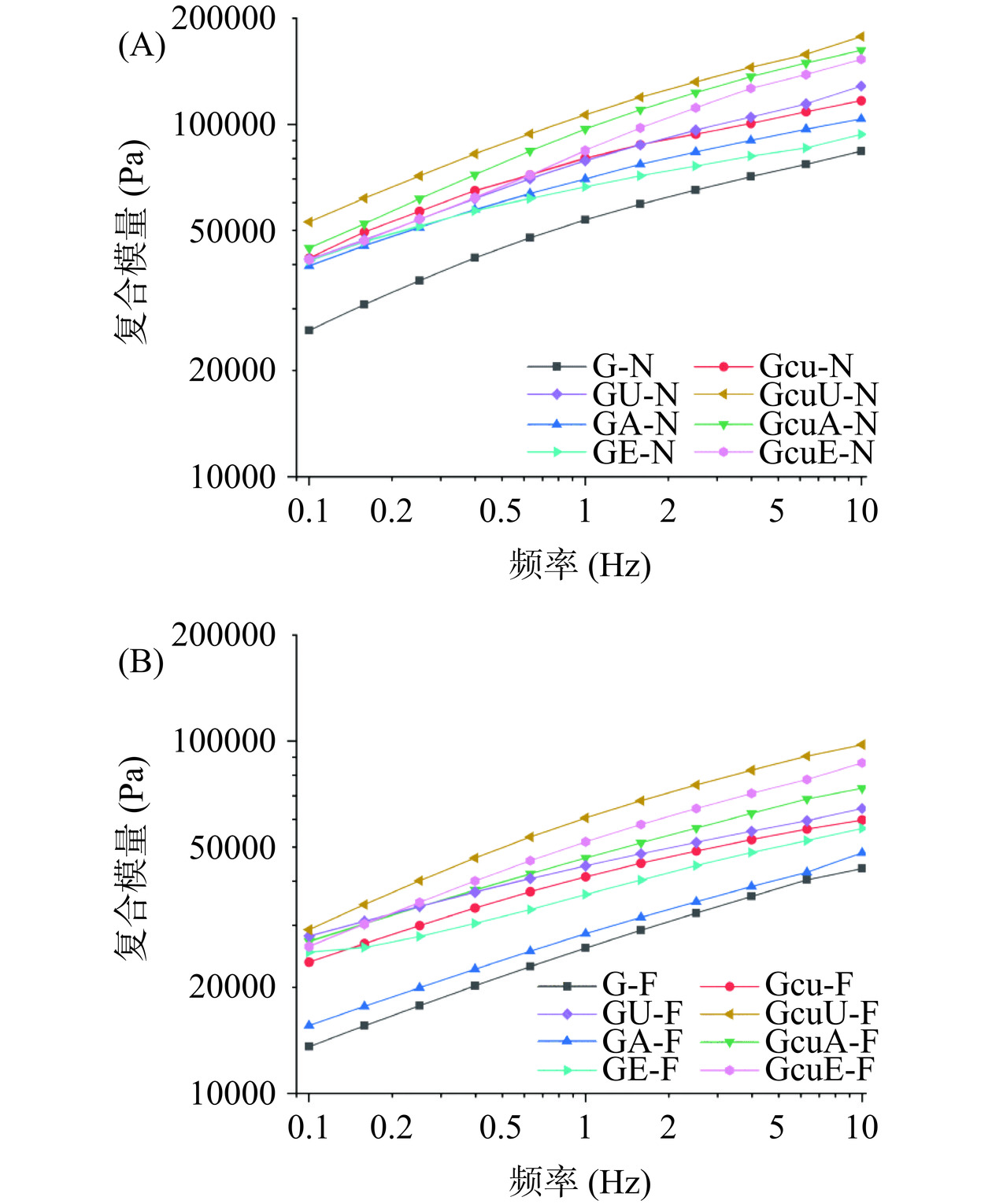
复合模量(G*)可以反映面团的强度,一般来说,面团的G*值越大,面团的强度越大[51]。如图9A所示,与天然面筋蛋白相比较,三种处理(碱处理、超声处理和酶处理)以及姜黄素的添加均使得面团的G*值增大,这说明三种处理以及姜黄素添加可以促使面筋蛋白的交联,从而导致面团强度的增加[52]。面筋蛋白-姜黄素共价复合物的加入,可以进一步增加面团的G*值,这可能是因为共价交联导致更多的功能基团暴露,从而促使面筋蛋白进一步交联[53]。在三种交联方式中,添加超声波诱导的面筋蛋白-姜黄素共价复合物的面团具有更高的G*值,这可能是因为超声波本身就有改善面筋蛋白凝胶特性的作用。而采用超声波诱导的蛋白质-姜黄素共价交联则可以使得超声波效应和多酚共价修饰进行有机的结合,从而最大程度地提高了面筋蛋白之间的交联。此外,与新鲜面团相比较,冷冻面团的G*值均发生了下降(图9B)。这主要是因为在冷冻过程中,由于冰晶的不断生长,破坏了面筋的网状结构,从而导致面团的粘弹性下降[54]。在冷冻面团样品中,面筋蛋白-姜黄素共价复合物的添加均可以改善冷冻面团的粘弹性,其中添加了超声波诱导的面筋蛋白-姜黄素共价复合物的冷冻面团具有较高的G*值。这一结果说明在改善冷冻面团劣变方面,超声波诱导的面筋蛋白-姜黄素共价复合物的添加效果最好。
2.5.2 蠕变和恢复
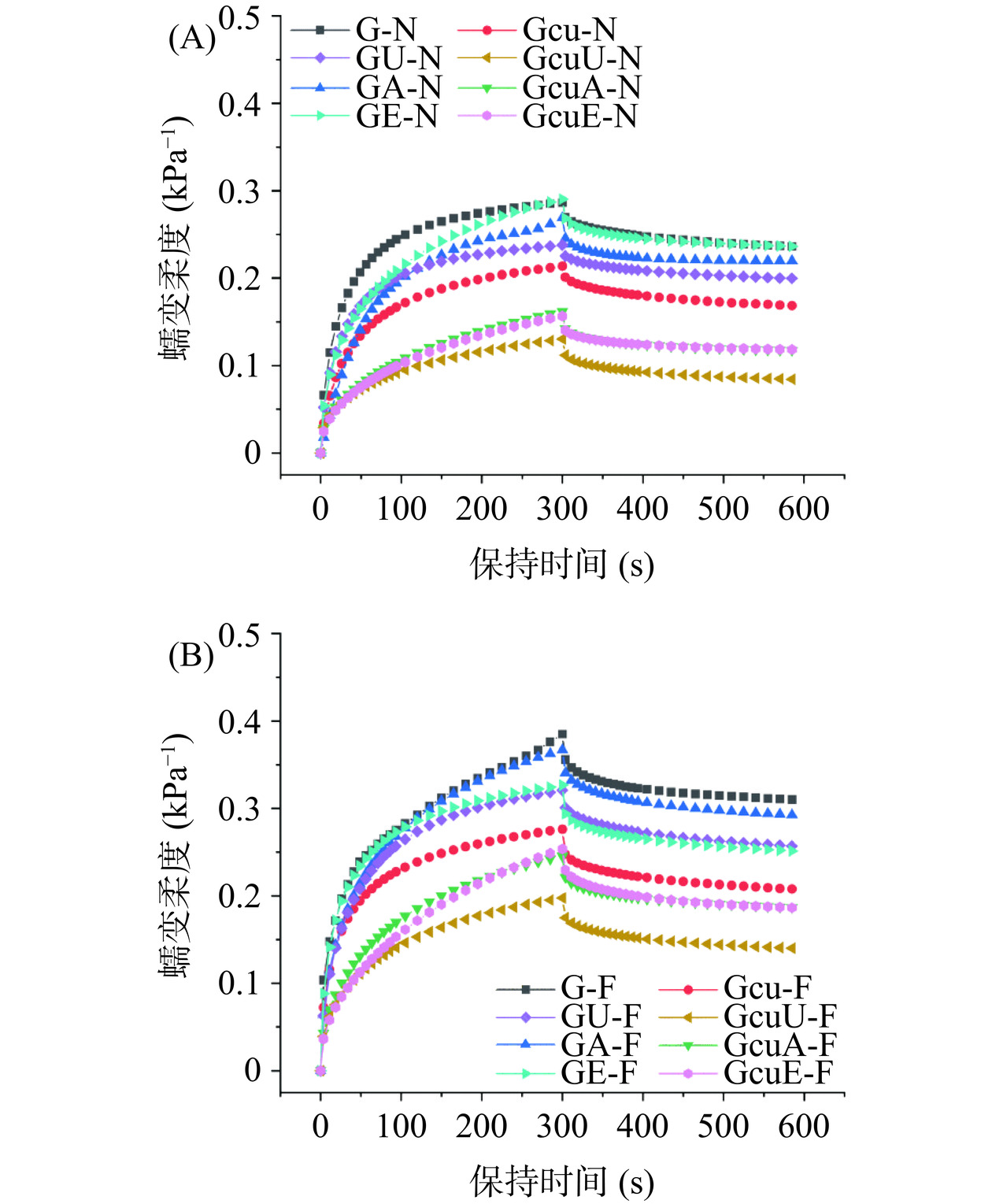
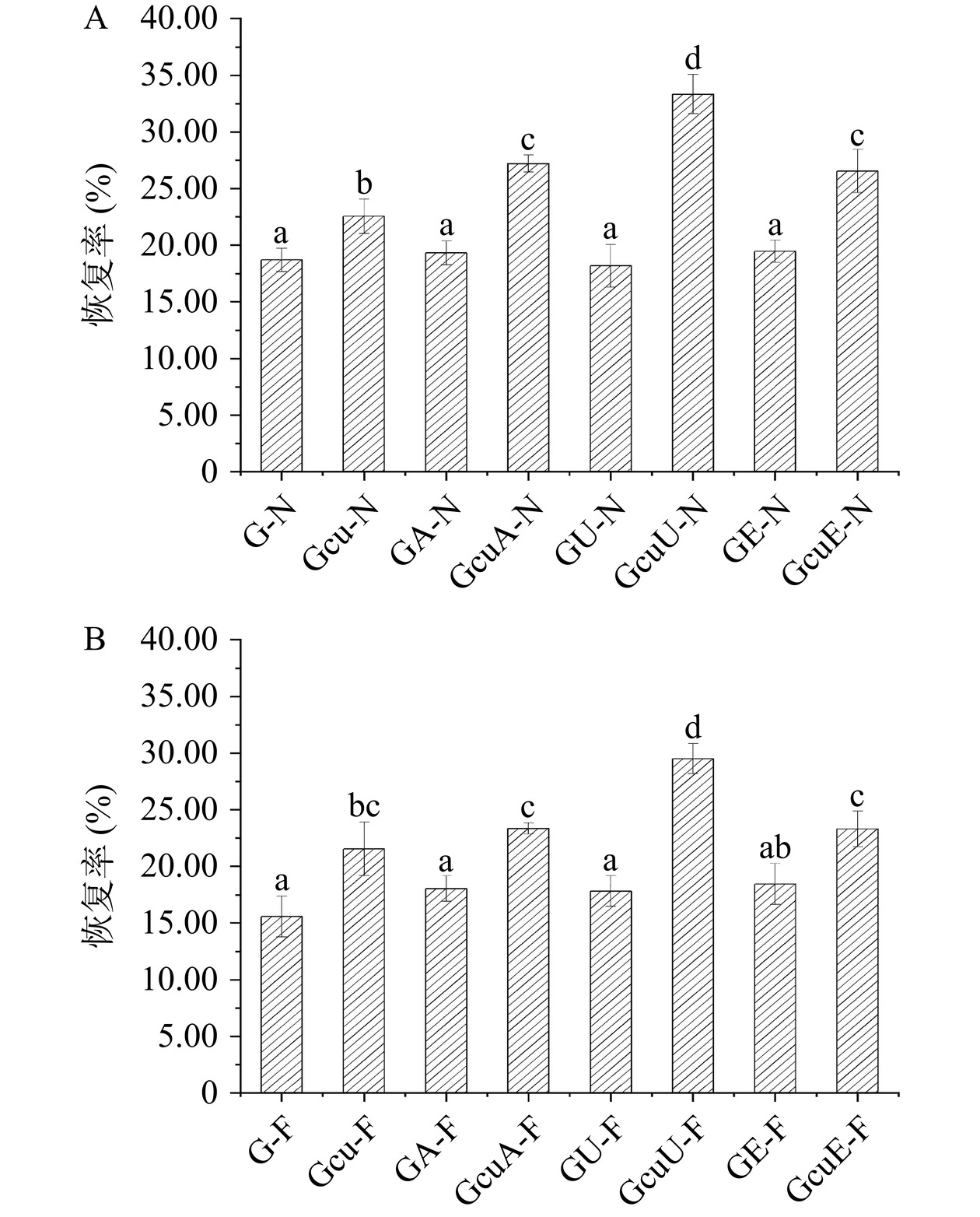
蠕变恢复试验可用于研究面团的粘弹性,一般来说,蠕变恢复程度越高,则说明面团的粘弹特性更好[55]。如图10和图11所示,与天然面筋蛋白相比较,碱处理和酶处理使得面团的恢复率分别增加了3.27%和4.02%,而超声处理使面团的恢复率减少了2.81%。添加了姜黄素的碱处理、超声处理和酶处理使面筋蛋白-姜黄素共价复合物的面团恢复率分别增加了45.41%、78.16%和41.81%,这说明三种处理以及面筋蛋白-姜黄素共价复合物的添加可以促使面筋蛋白网络结构的形成[29],且超声波诱导的面筋蛋白-姜黄素共价复合物在改善面团粘弹特性方面优于其他两种方法。此外,与新鲜面团相比较,冷冻面团的恢复率下降了16.74%。而添加了姜黄素的三种处理方法使面筋蛋白-姜黄素共价复合物的冷冻面团的恢复率分别下降了14.18%、11.18%和12.18%,这说明共价复合物的添加可以明显防止冷冻面团品质劣变,且超声波诱导的面筋蛋白-姜黄素共价复合物的添加在改善冷冻面团恢复率方面优于其他两种方法。
2.5.3 硬度
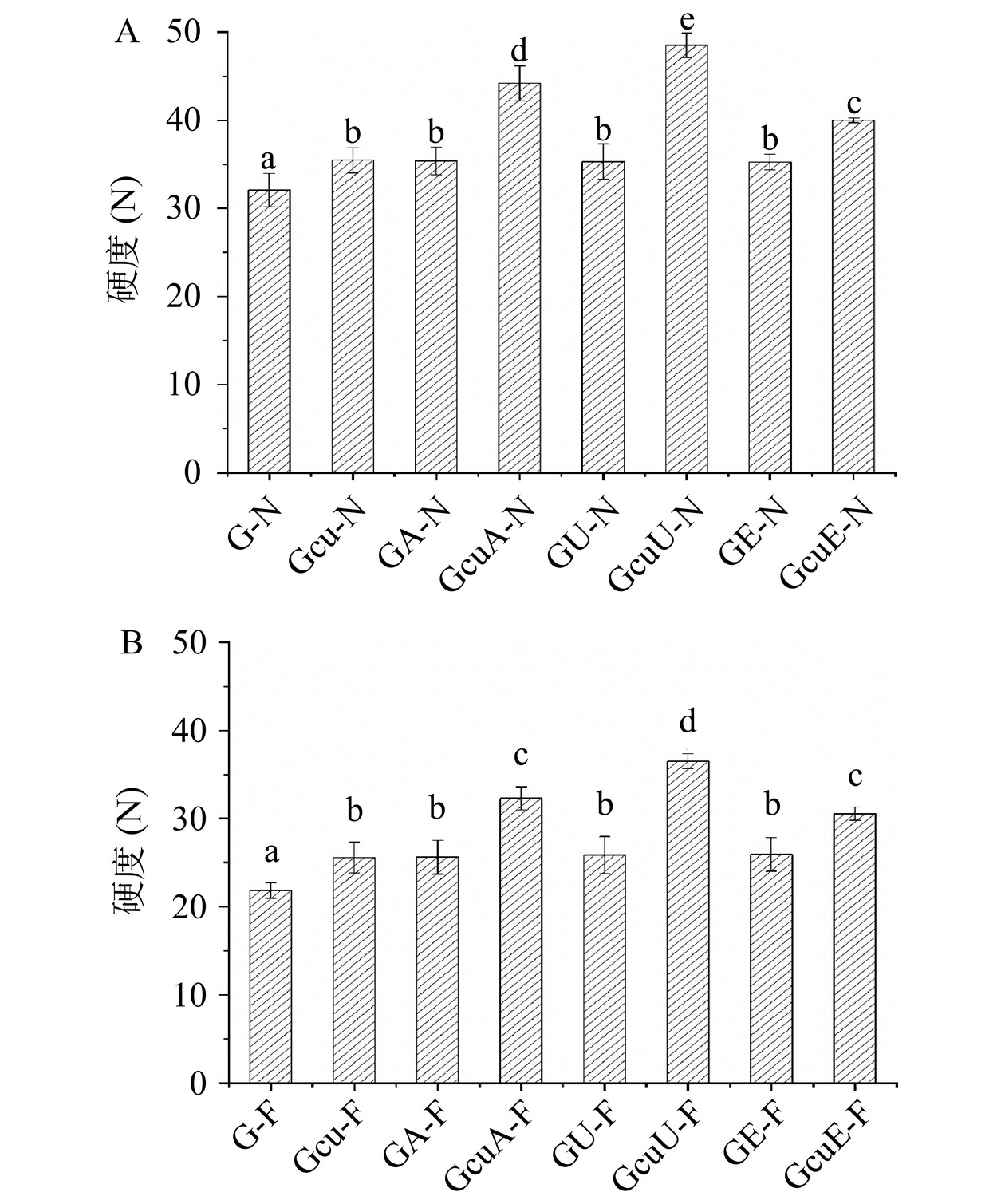
如图12所示,与天然面筋蛋白相比较,三种处理(碱处理、超声处理和酶处理)使得面团的硬度分别增加了10.35%、10.10%和9.91%。三种方法诱导的面筋蛋白-姜黄素共价复合物的面团硬度分别增加了37.79%、51.24%和24.66%。这说明三种处理以及姜黄素的添加均可以在一定程度上促使面筋蛋白网络结构的形成,且超声波诱导的面筋蛋白-姜黄素共价复合物在改善面团硬度方面优于其他两种方法。此外,与新鲜面团相比较,冷冻面团的硬度下降了35.56%。由三种方法诱导的面筋蛋白-姜黄素共价复合物的冷冻面团的硬度分别下降了23.35%、24.14%和24.40%,这说明共价复合物的添加可以显著防止冷冻面团品质劣变,且超声波诱导的面筋蛋白-姜黄素共价复合物的添加在改善冷冻面团硬度方面优于其他两种方法。
2.6 姜黄素修饰对冷冻面团制备的面包品质的影响
2.6.1 面包的比容
如表1所示,与新鲜面团相比较,由冷冻之后的面团所制备的面包比容下降了5.47%,这说明冻融过程在一定程度上破坏了面筋蛋白网络结构[56]。由三种方法诱导的面筋蛋白-姜黄素共价复合物的冷冻面团面所制备的面包比容分别下降了3.85%、3.30%和4.97%,这说明共价复合物的添加可以明显改善冷冻面团的品质,且超声波诱导的面筋蛋白-姜黄素共价复合物的添加在改善冷冻面团所制备的面包比容方面优于其他两种方法。
表 1 姜黄素共价复合物对面包比容和硬度的影响Table 1. Effect of gluten-curcumin conjugate on loaf volume and hardness of bread样品种类 新鲜面团制
备的面包比容
(mL/g)冷冻面团制备
的面包比容
(mL/g)新鲜面团制备
的面包硬度
(N)冷冻面团制备
的面包硬度
(N)G 2.74±0.04a 2.59±0.02a 21.53±0.46d 30.17±1.38f Gcu 2.91±0.05c 2.75±0.02c 19.01±0.92c 22.62±0.47d GA 2.92±0.01c 2.74±0.03c 19.33±0.84c 24.18±1.15d GcuA 3.12±0.02e 3.00±0.03e 15.11±0.44b 16.75±0.21b GU 2.91±0.01c 2.79±0.02c 19.13±1.31c 23.39±0.66d GcuU 3.33±0.05f 3.22±0.03f 12.43±1.49a 13.76±1.41a GE 2.83±0.01b 2.66±0.01b 19.94±0.67cd 27.05±0.89e GcuE 3.02±0.02d 2.87±0.03d 16.02±0.65b 19.12±2.04c 注:同列不同字母表示差异显著(P<0.05)。 2.6.2 面包的硬度
面包的硬度是反映面包网络结构和粘弹特性的重要指标,与面团的硬度相反,当制作面包的面团具有较好的网络结构时,其形成的面包同样会具有较好的网络结构,并在面包内部形成均匀的气孔,从而使得面包具有较低的硬度。如表1所示,与新鲜面团相比较,由冷冻面团所制备的面包硬度增加了40.13 %,这说明冻融过程导致面包结构变得致密。由三种方法诱导的面筋蛋白-姜黄素共价复合物的冷冻面团所制备的面包硬度分别增加了10.85%、10.70%和19.35%,这说明共价复合物的添加可以明显改善冷冻面团的品质,且超声波诱导的面筋蛋白-姜黄素共价复合物的添加在改善冷冻面团所制备的面包硬度方面优于其他两种方法。
3. 结论
采用碱法、超声波法和酶法共价交联姜黄素能够使面筋蛋白中的游离氨基的含量下降27.28%、28.74%和26.98%,以及游离巯基含量下降12.08%、14.52%和10.80%,说明这三种方法均可以诱导面筋蛋白与姜黄素之间发生共价交联。共价交联使得面筋蛋白的分子间β-折叠相对含量下降了61.02%、48.96%和40.41%,以及α-螺旋的相对含量下降了34.29%、31.21%和30.59%,说明共价复合物拥有更加松散的结构。添加面筋蛋白-姜黄素共价复合物后,冷冻面团的复合模量增加,蠕变恢复率以及硬度较未添加时分别增加了54.48%、90.10%、41.51%和37.79%、51.24%、24.66%,且由添加了共价复合物的冷冻面团所制备的面包的比容较未添加时增加,硬度较未添加时减小,这说明面筋蛋白与姜黄素的共价交联,可以改善冷冻面团在冻融过程中由于面筋蛋白劣变而导致的品质下降。本研究从分子层面探讨了姜黄素共价修饰面筋蛋白,改善冷冻面团加工品质的分子机制,并明确了共价修饰方式与冷冻面团品质改良之间的内在联系,可以为冷冻面团品质改良提供新的理论支撑和技术支持。
-
表 1 姜黄素共价复合物对面包比容和硬度的影响
Table 1 Effect of gluten-curcumin conjugate on loaf volume and hardness of bread
样品种类 新鲜面团制
备的面包比容
(mL/g)冷冻面团制备
的面包比容
(mL/g)新鲜面团制备
的面包硬度
(N)冷冻面团制备
的面包硬度
(N)G 2.74±0.04a 2.59±0.02a 21.53±0.46d 30.17±1.38f Gcu 2.91±0.05c 2.75±0.02c 19.01±0.92c 22.62±0.47d GA 2.92±0.01c 2.74±0.03c 19.33±0.84c 24.18±1.15d GcuA 3.12±0.02e 3.00±0.03e 15.11±0.44b 16.75±0.21b GU 2.91±0.01c 2.79±0.02c 19.13±1.31c 23.39±0.66d GcuU 3.33±0.05f 3.22±0.03f 12.43±1.49a 13.76±1.41a GE 2.83±0.01b 2.66±0.01b 19.94±0.67cd 27.05±0.89e GcuE 3.02±0.02d 2.87±0.03d 16.02±0.65b 19.12±2.04c 注:同列不同字母表示差异显著(P<0.05)。 -
[1] BIGNE F, FERRERO C, PUPPO M C. Effect of freezing and frozen storage on mesquite–wheat dough for Panettone-like breads[J]. Journal of Food Measurement and Characterization,2019,13(4):2853−2861. doi: 10.1007/s11694-019-00206-4
[2] KE Y, WANG Y, DING W, et al. Effects of inulin on protein in frozen dough during frozen storage[J]. Food & Function,2020,11(9):7775−7783.
[3] RASHIDI A, HADINEZHAD M, RAJABZADEH N, et al. Frozen baguette bread dough I. Rheological behavior during storage[J]. Journal of Cereal Science,2016,72:24−29. doi: 10.1016/j.jcs.2016.08.014
[4] BAN C, YOON S, HAN J, et al. Effects of freezing rate and terminal freezing temperature on frozen croissant dough quality[J]. Lwt,2016,73:219−225. doi: 10.1016/j.lwt.2016.05.045
[5] SILVAS-GARCÍA M I, RAMÍREZ-WONG B, TORRES-CHÁVEZ P I, et al. Effect of freezing rate and storage on the rheological, thermal and structural properties of frozen wheat dough starch[J]. Starch-Stärke,2016,68(11-12):1103−1110.
[6] LIU Y, ZHANG X, DING B, et al. Effect of hydrocolloids on physical, thermal and microstructure properties of par-baked baguette during frozen storage[J]. International Journal of Biological Macromolecules,2020,163:1866−1874. doi: 10.1016/j.ijbiomac.2020.09.122
[7] TANG X, WANG F, HUANG W, et al. The combination of Rhizopus chinensis lipase and transglutaminase affects the rheology and glutenin macropolymer properties of frozen dough[J]. Cereal Chemistry,2016,93(4):377−385. doi: 10.1094/CCHEM-08-15-0179-R
[8] WANG P, YANG R, GU Z, et al. Comparative study of deterioration procedure in chemical-leavened steamed bread dough under frozen storage and freeze/thaw condition[J]. Food Chemistry,2017,229:464−471. doi: 10.1016/j.foodchem.2017.02.122
[9] FRAUENLOB J, MORIANO M E, INNERKOFLER U, et al. Effect of physicochemical and empirical rheological wheat flour properties on quality parameters of bread made from pre-fermented frozen dough[J]. Journal of Cereal Science,2017,77:58−65. doi: 10.1016/j.jcs.2017.06.021
[10] TIAN C, ZHEN T, MA M, et al. Contribution of catechin monomers in tea polyphenols to the structure and physicochemical properties of wheat gluten and its sub-fractions[J]. Journal of Cereal Science,2021,101:103306. doi: 10.1016/j.jcs.2021.103306
[11] QUAN T H, BENJAKUL S, SAE-LEAW T, et al. Protein–polyphenol conjugates:Antioxidant property, functionalities and their applications[J]. Trends in Food Science & Technology,2019,91:507−517.
[12] PAN X, FAN F, DING J, et al. Altering functional properties of rice protein hydrolysates by covalent conjugation with chlorogenic acid[J]. Food Chemistry:X,2022,14:100352.
[13] REN G, SHI J, HUANG S, et al. The fabrication of novel zein and resveratrol covalent conjugates:Enhanced thermal stability, emulsifying and antioxidant properties[J]. Food Chemistry,2022,374:131612. doi: 10.1016/j.foodchem.2021.131612
[14] OOMS N, DELCOUR J A. How to impact gluten protein network formation during wheat flour dough making[J]. Current Opinion in Food Science,2019,25:88−97. doi: 10.1016/j.cofs.2019.04.001
[15] SUN J, ZHANG F, LIU T, et al. Ultrasound-enhanced egg white proteins conjugated with polyphenols:The structure of the polyphenols on their functional properties[J]. LWT,2022,164:113600. doi: 10.1016/j.lwt.2022.113600
[16] XUE F, WU Z, TONG J, et al. Effect of combination of high-intensity ultrasound treatment and dextran glycosylation on structural and interfacial properties of buckwheat protein isolates[J]. Biosci Biotechnol Biochem,2017,81(10):1891−1898. doi: 10.1080/09168451.2017.1361805
[17] ZHENG D, HUANG C, HUANG H, et al. Antibacterial mechanism of curcumin:A review[J]. Chemistry & Biodiversity,2020,17:e2000171.
[18] SCAZZOCCHIO B, MINGHETTI L, D’ARCHIVIO M. Interaction between gut microbiota and curcumin:A new key of understanding for the health effects of curcumin[J]. Nutrients,2020,12:2499. doi: 10.3390/nu12092499
[19] CHIKARA S, NAGAPRASHANTHA L D, SINGHAL J, et al. Oxidative stress and dietary phytochemicals:Role in cancer chemoprevention and treatment[J]. Cancer Letters,2018,413:122−134. doi: 10.1016/j.canlet.2017.11.002
[20] REDA F M, EL-SAADONY M T, ELNESR S S, et al. Effect of dietary supplementation of biological curcumin nanoparticles on growth and carcass traits, antioxidant status, immunity and caecal microbiota of Japanese quails[J]. Animals,2020,10(5):754−767. doi: 10.3390/ani10050754
[21] CELIK H, AYDIN T, SOLAK K, et al. Curcumin on the "flying carpets" to modulate different signal transduction cascades in cancers:Next-generation approach to bridge translational gaps[J]. Journal of Cellular Biochemistry,2018,119(6):4293−4303. doi: 10.1002/jcb.26749
[22] AKBIK D, GHADIRI M, CHRZANOWSKI W. Curcumin as a wound healing agent[J]. Life Sciences,2014,116:1−7. doi: 10.1016/j.lfs.2014.08.016
[23] GUPTA S C, PATCHVA S, KOH W, et al. Discovery of curcumin, a component of golden spice, and its miraculous biological activities[J]. Clinical and Experimental Pharmacology and Physiology,2012,39(3):283−299. doi: 10.1111/j.1440-1681.2011.05648.x
[24] ABD EL-HACK M E, EL-SAADONY M T, SWELUM A A, et al. Curcumin, the active substance of turmeric:Its effects on health and ways to improve its bioavailability[J]. Journal of the Science of Food and Agriculture,2021,101(14):5747−5762. doi: 10.1002/jsfa.11372
[25] LIU F, SUN C, YANG W, et al. Structural characterization and functional evaluation of lactoferrin–polyphenol conjugates formed by free-radical graft copolymerization[J]. RSC Advances,2015,5(20):15641−15651. doi: 10.1039/C4RA10802G
[26] WANG Q, LI W, LIU P, et al. A glycated whey protein isolate–epigallocatechin gallate nanocomplex enhances the stability of emulsion delivery of β-carotene during simulated digestion[J]. Food Function,2019,10(10):6829−6839. doi: 10.1039/C9FO01605H
[27] ZHAO Q L, WANG L F, HONG X, et al. Structural and functional properties of Perilla protein isolate extracted from oilseed residues and its utilization in Pickering emulsions[J]. Food Hydrocolloids,2021,113:106412. doi: 10.1016/j.foodhyd.2020.106412
[28] XUE F, LI C, ADHIKARI B. Physicochemical properties of soy protein isolates-cyanidin-3-galactoside conjugates produced using free radicals induced by ultrasound[J]. Ultrasonics Sonochemistry,2020,64:104990. doi: 10.1016/j.ultsonch.2020.104990
[29] XUE F, LI C, WANG S. Effects of high-intensity ultrasound treatment on physiochemical properties of caseins-cyanidin-3-galactoside conjugates[J]. International Journal of Food Science & Technology,2021,56(7):3378−3387.
[30] XUE F, XIE Y, LI C, et al. Prevention of frozen-dough from deterioration with incorporation of glutenin-polyphenols conjugates prepared by ultrasound[J]. LWT,2021,151:112141. doi: 10.1016/j.lwt.2021.112141
[31] FU Y, LIU X, XIE Q, et al. Effects of Laminaria japonica polysaccharides on the texture, retrogradation, and structure performances in frozen dough bread[J]. LWT,2021,151:112239. doi: 10.1016/j.lwt.2021.112239
[32] ZHANG B, WENDAN Y, WANG F, et al. Use of Kluyveromyces marxianus prefermented wheat bran as a source of enzyme mixture to improve dough performance and bread biochemical properties[J]. Cereal Chemistry,2019,96(1):142−153. doi: 10.1002/cche.10125
[33] SU T C, DU W K, DENG B Y, et al. Effects of sodium carboxymethyl cellulose on storage stability and qualities of different frozen dough[J]. Heliyon,2023,9:e18545. doi: 10.1016/j.heliyon.2023.e18545
[34] CUI L, WANG P, FAN X, et al. Laccase-mediated enhancement of the properties of regenerated fibers from wheat gliadin[J]. Journal of Cereal Science,2020,96:103129. doi: 10.1016/j.jcs.2020.103129
[35] TEMDEE W, BENJAKUL S. Effect of phenolic compounds and bark/wood extracts oxidised by laccase on properties of cuttlefish (Sepia pharaonis) skin gelatin gel[J]. International Food Research Journal,2015,22(1):246−253.
[36] WANG S, LI X, ZHU J, et al. Covalent interaction between high hydrostatic pressure-pretreated rice bran protein hydrolysates and ferulic acid:Focus on antioxidant activities and emulsifying properties[J]. Journal of Agricultural and Food Chemistry,2021,69(27):7777−7785. doi: 10.1021/acs.jafc.1c01949
[37] LI X, LI M, ZHANG T, et al. Enzymatic and nonenzymatic conjugates of lactoferrin and (−)-epigallocatechin gallate:Formation, structure, functionality, and allergenicity[J]. Journal of Agricultural and Food Chemistry,2021,69(22):6291−6302. doi: 10.1021/acs.jafc.1c01167
[38] MALIK M A, SHARMA H K, SAINI C S. High intensity ultrasound treatment of protein isolate extracted from dephenolized sunflower meal:Effect on physicochemical and functional properties[J]. Ultrason Sonochem,2017,39:511−519. doi: 10.1016/j.ultsonch.2017.05.026
[39] MATIZA RUZENGWE F, AMONSOU E O, KUDANGA T. Gelation profile of laccase-crosslinked Bambara groundnut (Vigna subterranea) protein isolate[J]. Food Research International,2023,163:112171 . doi: 10.1016/j.foodres.2022.112171
[40] XU Y, WEI Z, XUE C, et al. Covalent modification of zein with polyphenols:A feasible strategy to improve antioxidant activity and solubility[J]. Journal of Food Science,2022,87(7):2965−2979. doi: 10.1111/1750-3841.16203
[41] SUI X, SUN H, QI B, et al. Functional and conformational changes to soy proteins accompanying anthocyanins:Focus on covalent and non-covalent interactions[J]. Food Chemistry,2018,245:871−878. doi: 10.1016/j.foodchem.2017.11.090
[42] LIU X, SONG Q, LI X, et al. Effects of different dietary polyphenols on conformational changes and functional properties of protein–polyphenol covalent complexes[J]. Food Chemistry,2021,361:130071. doi: 10.1016/j.foodchem.2021.130071
[43] WANG P, XU L, NIKOO M, et al. Effect of frozen storage on the conformational, thermal and microscopic properties of gluten:Comparative studies on gluten-, glutenin- and gliadin-rich fractions[J]. Food Hydrocolloids,2014,35:238−246. doi: 10.1016/j.foodhyd.2013.05.015
[44] LIU M, LIANG Y, WANG Y, et al. Effects of recombinant carrot antifreeze protein from Pichia pastoris GS115 on the physicochemical properties of hydrated gluten during freeze-thawed cycles[J]. Journal of Cereal Science,2018,83:245−251. doi: 10.1016/j.jcs.2018.08.016
[45] DU J, DANG M, KHALIFA I, et al. Persimmon tannin changes the properties and the morphology of wheat gluten by altering the cross-linking, and the secondary structure in a dose-dependent manner[J]. Food Research International,2020,137:109536. doi: 10.1016/j.foodres.2020.109536
[46] ZHANG K, WEN Q, LI T, et al. Comparison of interaction mechanism between chlorogenic acid/luteolin and glutenin/gliadin by multi-spectroscopic and thermodynamic methods[J]. Journal of Molecular Structure,2021,1246:131219. doi: 10.1016/j.molstruc.2021.131219
[47] FAN J X, GUO X N, ZHU K X. Impact of laccase-induced protein cross-linking on the in vitro starch digestion of black highland barley noodles[J]. Food Hydrocolloids,2022,124:107298. doi: 10.1016/j.foodhyd.2021.107298
[48] ZHOU S D, HUANG L, MENG L, et al. Soy protein isolate -(-)-epigallocatechin gallate conjugate:Covalent binding sites identification and IgE binding ability evaluation[J]. Food Chemistry,2020,333:127400. doi: 10.1016/j.foodchem.2020.127400
[49] JIANG L, WANG J, LI Y, et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J]. Food Research International,2014,62:595−601. doi: 10.1016/j.foodres.2014.04.022
[50] LIU F, WANG D, SUN C, et al. Utilization of interfacial engineering to improve physicochemical stability of β-carotene emulsions:Multilayer coatings formed using protein and protein–polyphenol conjugates[J]. Food Chemistry,2016,205:129−139. doi: 10.1016/j.foodchem.2016.02.155
[51] TUNCIL Y E, JONDIKO T, CASTELL-PEREZ M E, et al. Small deformation rheological properties of dough are useful tool to predict the effects of modest sodium reduction on flour tortilla quality[J]. LWT-Food Science and Technology,2016,68:329−333. doi: 10.1016/j.lwt.2015.12.033
[52] GIRARD A L, CASTELL-PEREZ M E, BEAN S R, et al. Effect of condensed tannin profile on wheat flour dough rheology[J]. Journal of Agricultural and Food Chemistry,2016,64(39):7348−7356. doi: 10.1021/acs.jafc.6b02601
[53] PAN J, LIAN H, JIA H, et al. Ultrasound treatment modified the functional mode of gallic acid on properties of fish myofibrillar protein[J]. Food Chem,2020,320:126637. doi: 10.1016/j.foodchem.2020.126637
[54] FENG W, MA S, WANG X. Quality deterioration and improvement of wheat gluten protein in frozen dough[J]. Grain & Oil Science and Technology,2020,3(1):29−37.
[55] HUANG J, ZENG S, XIONG S, et al. Steady, dynamic, and creep-recovery rheological properties of myofibrillar protein from grass carp muscle[J]. Food Hydrocolloids,2016,61:48−56. doi: 10.1016/j.foodhyd.2016.04.043
[56] CAO H, ZHENG X, LIU H, et al. Cryo-protective effect of ice-binding peptides derived from collagen hydrolysates on the frozen dough and its ice-binding mechanisms[J]. LWT,2020,131:109678. doi: 10.1016/j.lwt.2020.109678





 下载:
下载:
 下载:
下载:



