Systematic Analysis of Anti-inflammatory Active Components in Diospyros lotus Fruit Using UPLC-Q-TOF/MS Combined with Network Pharmacology
-
摘要: 目的:初步阐明君迁子果实中抗炎的活性成分及其作用机制。方法:采用超高效液相色谱-串联四级杆-飞行时间质谱(UPLC-Q-TOF/MS)技术测定分析君迁子果实的化学成分,结合网络药理学探究潜在的抗炎活性成分及其作用机制,用分子对接验证网络预测结果。结果:在负离子模式下,依据分子离子峰及二级质谱裂解特征从君迁子果实中共鉴定出26个黄酮化合物,包括杨梅素衍生物10个、槲皮素衍生物7个、山奈酚衍生物4个、芹菜素衍生物2个、其他黄酮化合物3个,其中12种化合物为首次在君迁子果实中报道。网络药理学分析显示化合物杨梅素-3-桑布双糖苷、杨梅素-3-(2G-鼠李糖基)-芸香糖甙、桑色素、杨梅素-3-鼠李糖基-(1->2)-鼠李糖苷、异鼠李素-3-O-葡萄糖苷、杨梅素、槲皮素、柚皮素、芹菜素、山柰酚具有潜在的抗炎活性,且发挥抗炎作用主要与PI3K-Akt、EGFR络氨酸激酶抑制性耐药和癌症信号通路有关。分子对接显示活性成分与核心靶点对接稳定,且结果与网络药理学预测一致。结论:君迁子提取物中黄酮类化合物具有潜在的抗炎作用,对炎症疾病具有一定的辅助预防作用。
-
关键词:
- 君迁子 /
- 抗炎成分 /
- 超高效液相色谱-串联四级杆-飞行时间质谱 /
- 网络药理
Abstract: Objective: It was elucidated the anti-inflammatory active components and their mechanisms of action in the fruits of Diospyros lotus. Methods: Ultra-performance liquid chromatography-tandem quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF-MS) was used to qualitatively analyze the chemical constituents of Diospyros lotus fruits, and combined with network pharmacology to explore the potential anti-inflammatory active components and their mechanisms of action, and validated the results by molecular docking. Results: A total of 26 flavonoid compounds, including 10 myricetin derivatives, 7 quercetin derivatives, 4 kaempferol derivatives, 2 apigenin derivatives, and 3 other flavonoid compounds, were identified from extract of D. lotus fruits based on molecular ion peaks and mass spectrometry cleavage characteristics in negative ion mode, among which 12 compounds were reported for the first time in the fruits. Network pharmacological analysis showed that compounds myricetin 3-sambubioside, myricetin 3-(2G-rhamnosylrutinoside), morin, myricetin 3-rhamnosyl-(1->2)-rhamnoside, isorhamnetin-3-O-glucoside, myricetin, quercetin, naringenin, apigenin and kaempferol had potential anti-inflammatory activities and exerted anti-inflammatory effects mainly related to PI3K-Akt, EGFR tyrosine kinase inhibitor resistance and cancer signaling pathway. Molecular docking showed that the active components stably docked with the key targets, and the results were consistent with the network pharmacological predictions. Conclusion: Flavonoids in D. lotus extracts have potential anti-inflammatory effects and are useful as adjunctive preventive agents in inflammatory diseases. -
君迁子(Diospyros lotus L.),俗称黑枣,是柿树科落叶乔木的果实,广泛分布于河北、山西、山东等北方山区[1]。在河北省涉县栽培历史悠久,2017年获得了国家地理标志保护产品的称号,是传统"黑五类"补肾食品配方之一。君迁子果实经脱涩处理后可鲜食,或可用于酿酒、制醋、发酵果饮以及营养保健产品[2]。古代医书记载君迁子能入脾胃经,具有祛痰、止渴、补中养气、安神及明目的功效。适量食用君迁子对贫血、血小板减少、肝炎、乏力、失眠等症状有一定的疗效,但过量食用可能会导致胃胀[3]。现代科学发现,君迁子果实中含有山柰酚、槲皮素、杨梅素等多种黄酮类成分[4−5],这些成分具有良好的抗氧化、抗炎、抗肿瘤、镇静和抑制HIV-1病毒等生理活性[6−9]。Gao等[10]通过HPLC-ECD分析发现,杨梅素类物质是君迁子果实中主要的黄酮类成分,含量在2.75~5.28 μg/g之间。无核君迁子果实因其独特的食疗保健价值而深受消费者喜爱,然而,关于君迁子果实中抗炎活性成分的报道却不多,为了深入了解涉县无核君迁子果实的药效物质基础,有必要对其果实中的抗炎活性成分进行系统分析。
君迁子果实中成分丰富多样,利用传统分离、鉴定方法步骤繁琐、耗时耗力,UPLC-Q-TOF/MS技术在功能食品活性成分结构解析、药效物质基础研究等方面显示出独特的优势,可以快速鉴定其中化合物的结构[11]。网络药理学是通过系统生物学的研究方法,借助统计学、复杂网络等多种手段,在分子水平上诠释功能食品中活性成分的理化和生物学性质,为探索功能食品复杂作用模式提供新的视角[12]。
本研究采用UPLC-Q-TOF/MS技术结合网络药理学策略对君迁子果实中的抗炎活性成分及其作用机制进行系统分析,并采用分子对接技术对核心成分和关键靶点基因进行验证分析,以期为无核君迁子在功能食品领域的深入开发利用提供参考。
1. 材料与方法
1.1 材料与仪器
无核君迁子 涉县君迁酒庄有限公司,3~5 ℃冷藏放置备用;乙腈、甲酸 色谱级,美国Fisher公司;石油醚、乙醇 分析纯,天津奥普升化工有限公司;LX-38植提树脂 上海一基实业有限公司。
ACQUITY UPLC I-Class/Xevo G2-XS QTOF超高效液相色谱仪 美国Waters公司;N-1200BV-W型旋转蒸发仪 济南凯尼自动化科技有限公司;Milli-Q Reference超纯水仪 默瑞(上海)生物科技有限公司;DFY-500A高速万能粉碎机 上海比朗仪器制造有限公司。
1.2 实验方法
1.2.1 君迁子成分分析
1.2.1.1 样品制备
将君迁子在45 ℃真空干燥,并粉碎至20~40目,用3 L质量分数80%的乙醇萃取君迁子粉(100 g)3次,萃取温度45 ℃,每次1.5 h。萃取液合并过滤,真空浓缩至水悬液,浓缩温度40~45 ℃。石油醚与水悬液体积比1:1萃取3次脱脂,脱脂后水液采用LX-38植提树脂分离,并用85%乙醇解吸得到解吸液,解吸液在40~45 ℃旋转蒸发仪负压条件下浓缩至无醇状态,将浓缩液冷冻干燥,得君迁子提取物粉末4.6 g。分析前用适量甲醇溶解,溶液过0.22 μm微孔过滤器,转移到自动进样瓶中待测。
1.2.1.2 色谱条件
Waters BEH Amide(100 mm×2.1 mm,1.7 μm)色谱柱,柱温选择40 ℃;流动相由A和B两相组成,A相为0.1%甲酸乙腈溶液,B相为0.1%甲酸水溶液,梯度如下:0~5 min:10%~100% A,5~25 min:100% A,25~25.1 min:100%~10% A,25.1~30 min:10% A;流速0.2 mL/min;进样量10 μL。
1.2.1.3 质谱条件
通过比较正、负离子2种扫描模式,发现在负离子模式下质谱响应更强,故本实验采用电喷雾离子源(ESI)负离子模式下定性分析,参数如下:毛细管电压:3.0 kV;锥孔电压:40 V;离子源温度:100 ℃;锥孔气流速:50 L/h;脱溶剂温度:450 ℃;脱溶剂气(N2)流速:800 L/h;扫描范围:m/z 50~1200。
1.2.2 君迁子抗炎靶点预测
1.2.2.1 活性成分抗炎靶点筛选
鉴定出的化合物在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中查询Canonical SMILES号,未查询到的化合物利用Chem Draw绘制其结构式保存为SDF格式,通过Open Babel转换获得Canonical SMILES号。将获得的SMILES号上传至Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)获取作用靶点,筛选标准为Probability>0。同时,在Gene Cards数据库(https://www.genecards.org/)中检索抗炎疾病靶点。将化合物作用靶点与抗炎靶点采用Venny(http://www.liuxiaoyuyuan.cn/)构建韦恩图,得到君迁子活性成分抗炎作用靶点。
1.2.2.2 抗炎作用靶点PPI网络分析
将君迁子活性成分潜在抗炎作用靶点导入STRING数据库(http://www.string-db.org/),选择“Multiple Protein”,物种选择“Homo Spaiens”,以P<0.05为筛选条件,获得潜在靶点的相互作用关系,采用Cytoscape 3.8.0软件可视化构建靶点蛋白互作网络图。
1.2.2.3 GO和KEGG富集分析
DAVID数据库(https://david.ncifcrf.gov/summary.jsp)用于基因本体(GO)和京都基因与基因组百科全书(KEGG)通路富集分析,以P<0.05为筛选条件,获得分析结果。
1.2.2.4 活性成分-靶点-信号通路分析
基于Cytoscape 3.8.0软件构建“君迁子活性成分-靶点”和“活性成分-靶点-通路”网络,得到君迁子抗炎的主要活性成分和重要通路。活性成分、靶点和通路用节点来表示,边表示活性成分与靶点、炎症与靶点之间的相互关系。
1.2.3 核心成分和关键靶点的分子对接
对君迁子中筛选出来的潜在活性成分与关键靶点进行分子对接验证。在PDB数据库(https://www.rcsb.org/)输入蛋白质uniport的entry号查找3D结构,下载并保存。利用Chem 3D对主要活性成分进行优化,即能量最小化计算。运用PyMOL、Autodock软件对蛋白进行去水、去配体、配体可选转键和表面电荷获取等预处理操作。使用Autodock Vina完成分子对接,并在CMD命令符下运行,用PyMOL软件进行分子的可视化处理。
1.3 数据处理
采用Mass Lynx V4.1软件对各成分的分子离子峰和MS2质谱裂解碎片及特征碎片进行分析,并结合PubChem数据库和相关文献报道鉴定化合物结构。
2. 结果与分析
2.1 君迁子提取物的化学成分
2.1.1 成分分析
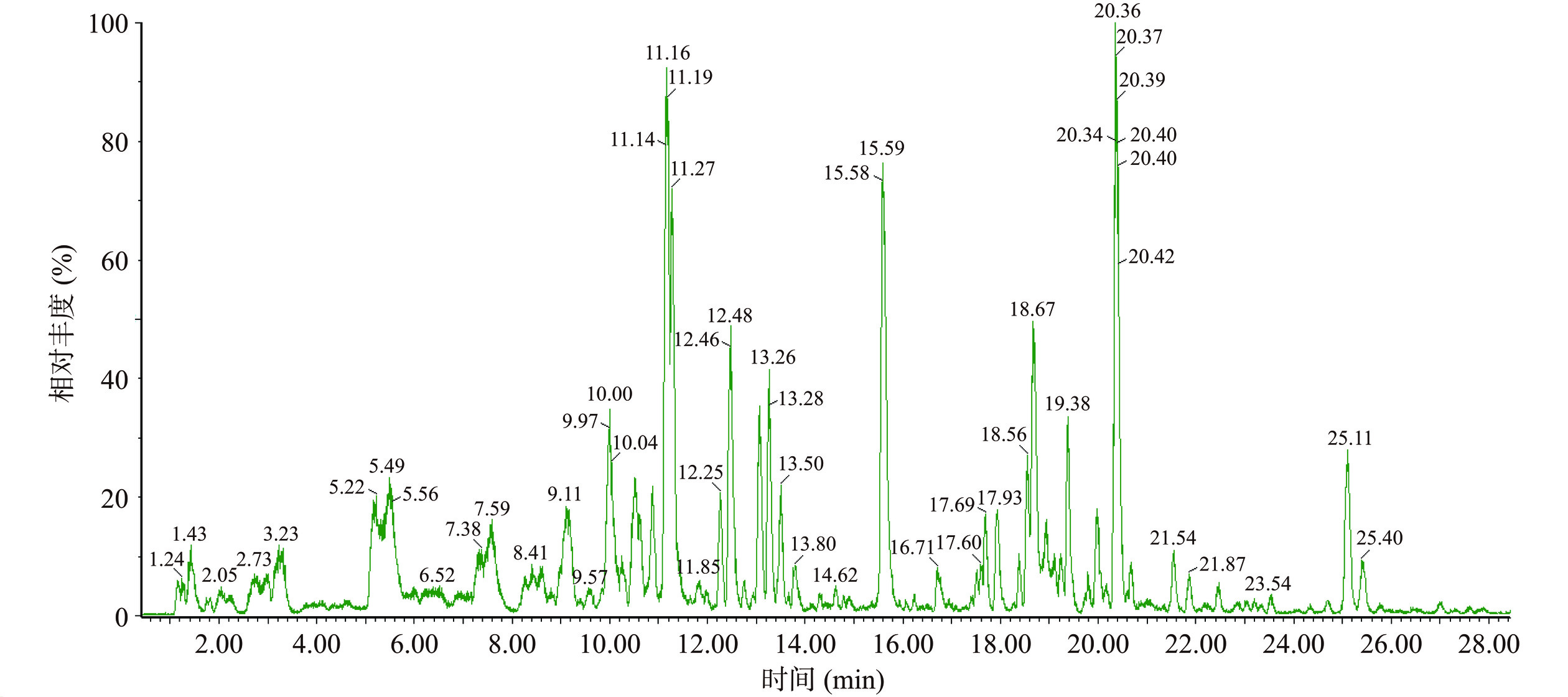
采用UPLC-Q-TOF/MS负离子模式下系统分析涉县无核君迁子提取物的化学成分,总离子基峰色谱图如图1所示,采集样品数据并用Mass Lynx V4.1软件分析,结合文献报道和在线数据库,共鉴定出26个黄酮类化合物,包括杨梅素衍生物10个、槲皮素衍生物7个、山奈酚衍生物4个、芹菜素衍生物2个、其他黄酮化合物3个,鉴定结果详细信息见表1所示,其中12种化合物为首次在君迁子果实中报道。
表 1 君迁子果实中化学成分的鉴定结果Table 1. Identification results of chemical constituents from Diospyros lotus fruit序号 出峰时间tR(min) 分子式 分子离子(m/z) 特征离子(m/z) 化合物 1* 3.23 C26H28O17 611.1968 317.1377 杨梅素-3-桑布双糖苷Myricetin-3-sambubioside 2* 5.22 C27H28O19 655.1411 317.0283 杨梅素-3-葡萄糖醛酸-8-葡萄糖苷Myricetin-3-glucuronide-8-glucoside 3* 7.59 C33H40O21 771.2378 317.0392 杨梅素-3-(2G-鼠李糖基)-芸香糖甙Myricetin-3-(2G-rhamnosylrutinoside) 4 8.82 C27H30O17 625.1686 316.0449 杨梅素-3-O-芸香糖苷Myricetin-3-O-rutinoside 5 9.11 C21H20O13 479.1057 316.0376 杨梅素-3-O-葡萄糖苷Myricetin-3-O-glucoside 6* 9.57 C26H28O16 595.1684 317.0101 杨梅素-7-木糖基-(1->2)-鼠李糖苷Myricetin-7-xylosyl-(1->2)-rhamnoside 7 10.00 C15H10O7 301.0153 301.0153 桑色素Morin 8 10.24 C27H30O16 609.1741 300.0358 槲皮素-3-O-芸香糖苷Quercetin-3-O-rutinoside 9* 10.52 C27H30O16 609.1791 317.0247 杨梅素-3-鼠李糖基-(1->2)-鼠李糖苷Myricetin-3-rhamnosyl-(1->2)-rhamnoside 10 10.61 C21H20O12 463.0827 317.0320 杨梅素-3-O-鼠李糖苷Myricetin-3-O-rhamnoside 11 10.88 C21H20O12 463.1100 300.0429 槲皮素-3-O-葡萄糖苷Quercetin-3-O-glucoside 12* 11.27 C22H22O12 477.1629 315.0994 异鼠李素-3-O-葡萄糖苷Isorhamnetin-3-O-glucoside 13* 11.66 C23H22O13 505.1256 300.0429 槲皮素-3-O(6''-乙酰基-葡萄糖苷)Quercetin-3-O-(6''-acetyl-glucoside) 14 12.25 C21H20O11 447.1174 300.0429 槲皮素-3-O-鼠李糖苷Quercetin-3-O-rhamnoside 15* 12.48 C21H18O14 493.0837 317.0465 杨梅素-7-O-葡萄糖醛酸苷Myricetin-7-O-glucuronide 16 13.06 C15H10O8 317.0465 317.0465 杨梅素Myricetin 17 13.50 C21H20O12 463.1100 301.0437 槲皮素-7-O-葡萄糖苷Quercetin-7-O-glucoside 18 13.67 C21H20O10 431.1211 285.0543 山奈酚-7-O-鼠李糖苷Kaempferol-7-O-rhamnoside 19* 14.31 C21H20O12 463.2377 299.9968 槲皮素-3'-O-葡萄糖苷Quercetin-3'-O-glucoside 20* 14.62 C21H18O11 445.1025 269.0576 芹菜素-7-O-葡萄糖苷酸Apigenin-7-O-glucuronide 21* 14.79 C24H22O14 533.3359 284.1183 山奈酚-3-O-6-丙二酰基葡萄糖苷Kaempferol-3-O-(6-malonyl-glucoside) 22 15.59 C15H10O7 301.0327 301.0327 槲皮素Quercetin 23 17.51 C15H12O5 271.0761 271.0761 柚皮素Naringenin 24 17.60 C15H10O5 269.1483 269.1483 芹菜素Apigenin 25 17.93 C15H10O6 285.0543 285.0543 山柰酚Kaempferol 26* 21.54 C21H18O12 461.2395 285.2236 山柰酚-3-O-葡萄糖醛酸苷Kaempferol-3-O-glucuronide 注:*表示君迁子果实中首次发现。 2.1.2 成分鉴定
在ESI-MS负离子模式下,君迁子黄酮化合物产生[M-H]−分子离子峰,主要苷元包括杨梅素、槲皮素,糖链由葡萄糖、鼠李糖等1~3个糖组成,糖基位置多为苷元的3位或7位。
DL1:分子离子峰m/z 611.1968 [M-H]−,MS2谱中连续失去分子量120 Da碎片产生离子m/z 491.1536 [M-H]−、m/z 371.0860 [M-H]−,离子m/z 491.1536进一步失去CH2O产生碎片m/z 461.1076,推测该化合物连接2分子己糖,同时产生碎片m/z 317.1377,并进一步失去中性分子CO产生强吸收碎片m/z 289.0046,母核发生RDA裂解产生m/z 151.0086离子,查阅PubMed数据库,鉴定化合物为杨梅素-3-桑布双糖苷(Myricetin-3-sambubioside)。
DL2:分子离子峰m/z 655.1411 [M-H]−,该化合物的MS2谱中出现明显的离子m/z 479.1012,即与分子离子峰相差1分子葡萄糖苷酸(176 Da),进一步失去1分子葡萄糖苷(162 Da)产生离子m/z 317.0283,母核继续失去中性分子CO和CO2产生碎片m/z 289.0499、245.0512,母核发生RDA裂解产生碎片m/z 179.0083、151.0137、125.0336、107.0158,参考文献报道[13],鉴定该成分为杨梅素-3-葡萄糖醛酸-8-葡萄糖苷(Myricetin-3-glucuronide-8-glucoside)。
DL3:分子离子峰m/z 771.2378 [M-H]−,MS2谱中产生碎片m/z 479.1057,进一步失水产生碎片m/z 461.1472,m/z 479.1057失去碎片(120 Da)产生强吸收碎片m/z 359.1671,同时产生m/z 317.0392、289.0464,母核发生RDA裂解产生m/z 151.0137、125.0291、107.0137典型碎片离子,参考相关报道[14],鉴定化合物为杨梅素-3-(2G-鼠李糖基)-芸香糖苷[Myricetin-3-(2G-rhamnosylrutinoside)]。
DL4:分子离子峰m/z 625.1686 [M-H]−,MS2谱中失去1分子鼠李糖苷(146 Da)产生碎片m/z 479.1012,继续失去1分子葡萄糖苷(162 Da)得到特征碎片m/z 316.0449、m/z 317.0429,且相对丰度m/z 316.0449明显高于m/z 317.0429,说明糖苷键主要以均裂方式断裂,鉴定为3-O糖基取代,参照相关报道[15]鉴定化合物为杨梅素-3-O-芸香糖苷(Myricetin-3-O-rutinoside)。
DL5:分子离子峰m/z 479.1057 [M-H]−,MS2谱中失去1分子葡萄糖苷(162 Da)产生显著的特征离子m/z 316.0376、m/z 317.0429,且相对丰度m/z 316.0376明显高于m/z 317.0429,推测糖苷位置为3-O糖基取代,参考相关报道[16]鉴定该化合物为杨梅素-3-O-葡萄糖苷(Myricetin-3-O-glucoside)。
DL6:分子离子峰m/z 595.1684 [M-H]−,MS2谱中分别失去1分子木糖苷(132 Da)和1分子鼠李糖苷(146 Da)产生离子m/z 463.1056和m/z 317.0101、m/z 316.1869,且相对丰度m/z 317.0101明显高于m/z 316.1869,推测糖苷位置为7-O糖基取代,查阅PubMed数据库,鉴定该成分为杨梅素-7-木糖基-(1->2)-鼠李糖苷(Myricetin-7-xylosyl-(1->2)-rhamnoside)。
DL7:分子离子峰m/z 301.0153 [M-H]−,MS2谱中连续失去中性分子CO或CO2产生离子m/z 284.0045[M-H2O]−、273.0177[M-H-CO]−、257.0226[M-H-CO2]−、245.0162[M-H-2CO]−、229.0266[M-H-CO2-CO]−,母核发生RDA裂解产生黄酮特征碎片m/z 179.0111、151.0086,且m/z 179.0111相对丰度较弱,参考文献[17],推测其为桑色素(Morin)。
DL8:分子离子峰m/z 609.1741 [M-H]−,MS2谱中分子离子失去1分子鼠李糖苷(146 Da)产生碎片m/z 463.1011,进一步失去1分子葡萄糖苷(162 Da)得到特征苷元离子m/z 301.0153和m/z 300.0358,且m/z 300.0358的相对丰度强于m/z 301.0153,说明糖苷键主要以均裂方式断裂,参照有关报道[18]鉴定化合物为槲皮素-3-O-芸香糖苷(Quercetin-3-O-rutinoside)。
DL9:分子离子峰m/z 609.1791 [M-H]−,发现MS2谱中失去2分子鼠李糖苷(146 Da)产生离子m/z 463.1011和m/z 317.0247,母核进一步裂解产生碎片 m/z 301.0437、283.0428、273.0380、255.0408、209.0029、179.0083、151.0137、125.0291,该化合物的2个糖基相同,无法确定糖的连接方式,但碎片离子463.1011的丰度较弱,推测2个鼠李糖基可能连接在一起,查阅PubMed数据库,鉴定其为杨梅素-3-鼠李糖基-(1->2)-鼠李糖苷(Myricetin-3-rhamnosyl-(1->2)-rhamnoside)。
DL10:分子离子峰m/z 463.0827,MS2谱中产生明显的特征碎片m/z 317.0320、301.0544、285.0543、273.0746、255.0441,RDA裂解产生m/z 179.0056、151.0086、125.0291,参考文献[4]鉴定化合物为杨梅素-3-O-鼠李糖苷(Myricetin-3-O-rhamnoside)。
DL11:分子离子峰m/z 463.1100,MS2谱中产生m/z 300.0429和m/z 301.0437明显的特征碎片,其中m/z 300.0429明显强于m/z 301.0437,推测糖苷键主要以均裂方式断裂,参考相关报道[19]鉴定为槲皮素-3-O-葡萄糖苷(Quercetin-3-O-glucoside)。
DL12:分子离子峰m/z 477.1629 [M-H]−,MS2谱中产生离子m/z 357.0994 [M-H-120Da]−以及糖环的交叉环切除反应产生离子m/z 387.1287,失去1分子葡萄糖(162 Da)得到特征碎片m/z 315.0994,进一步裂解产生碎片m/z 151.0086、107.0518。查阅文献[19]鉴定化合物为异鼠李素-3-O-葡萄糖苷(Isorhamnetin-3-O-glucoside)
DL13:分子离子峰m/z 505.1256 [M-H]−,MS2谱中失去1分子乙酰基(42 Da)产生离子m/z 463.1011,进一步失去1分子葡萄糖(162 Da)产生m/z 300.0429、301.0437特征碎片,且丰度m/z 300.0429强于m/z 301.0437,查阅数据库PubMed并参照文献[20],鉴定化合物为槲皮素-3-O(6''-乙酰基-葡萄糖苷)[Quercetin-3-O-(6''-acetyl-glucoside)]。
DL14:分子离子峰m/z 447.1174 [M-H]−,MS2谱中失去1分子鼠李糖苷(146 Da)产生明显的特征碎片m/z 300.0429和m/z 301.0508,且相对丰度m/z 300.0429强于m/z 301.0508,母核进一步裂解产生碎片m/z 271.0357、219.0776、151.0086,结合文献[21],鉴定化合物为槲皮素-3-O-鼠李糖苷(Quercetin-3-O-rhamnoside)。
DL15:分子离子峰m/z 493.0837 [M-H]−,MS2谱中失去1分子葡萄糖醛酸苷(176 Da)产生显著特征苷元碎片m/z 317.0465,并进一步裂解产生m/z 299.0296、273.0515、255.0376、245.0611、227.0451,参考文献[22]鉴定化合物为杨梅素-7-O-葡萄糖醛酸苷(Myricetin-7-O-glucuronide)。
DL16:分子离子峰m/z 317.0465 [M-H]−,MS2谱失去1分子羟基和CO分别产生碎片m/z 300.0394、273.0481,母核发生C环跨环开裂产生离子m/z 179.0083,进而失去中性分子CO得到离子m/z 151.0086,连续失去CO和CO2后产生离子m/z 107.0539,查阅数据库并参考文献[4],鉴定化合物为杨梅素(Myricetin)。
DL17:分子离子峰m/z 463.1100 [M-H]−,MS2谱失去1分子葡萄糖苷(162 Da)产生m/z 301.0437,槲皮素RDA裂解产生碎片m/z 179.0056、151.0086,根据以上信息鉴定化合物为槲皮素-7-O-葡萄糖苷(Quercetin-7-O-glucoside)。
DL18:分子离子峰m/z 431.1211 [M-H]−,MS2谱失去1分子鼠李糖苷(146 Da)产生m/z 285.0543、m/z 284.0493,且相对丰度m/z 285.0543>m/z 284.0493,山奈酚母核裂解产生碎片m/z 151.0061,根据以上信息鉴定化合物为山奈酚-7-O-鼠李糖苷(Kaempferol-7-O-rhamnoside)。
DL19:分子离子峰m/z 463.2377 [M-H]−,MS2谱分子离子峰失去1分子葡萄糖苷(162 Da)产生m/z 299.9968和m/z 301.0544,其中m/z 299.9968相对丰度明显高于m/z 301.0544,说明C环的糖苷键主要以均裂方式断裂。根据以上信息并参照文献报道[23],鉴定化合物为槲皮素-3'-O-葡萄糖苷(Quercetin-3'-O-glucoside)。
DL20:分子离子峰m/z 445.1025 [M-H]−,MS2谱分子离子峰失去1分子葡萄糖苷酸(176 Da)产生明显的特征离子m/z 269.0576 [M-H-glucuronide]−,母核进一步失去中性分子CO和CO2产生碎片m/z 241.0620和m/z 225.1243,根据以上信息并参照文献[22]鉴定化合物为芹菜素-7-O-葡萄糖苷酸(Apigenin-7-O-glucuronide)。
DL21:分子离子峰m/z 533.3359 [M-H]−,MS2谱分子离子峰失去1分子丙二酰基(86 Da)和1分子葡萄糖苷(162 Da)产生明显的特征离子m/z 285.0543和m/z 284.1183,相对丰度m/z 284.1183高于m/z 285.0543,母核进一步失去羟基产生碎片m/z 269.0979,根据以上信息参照相关报道[22],鉴定化合物为山奈酚-3-O-6-丙二酰基葡萄糖苷[Kaempferol-3-O-(6-malonyl-glucoside)]。
DL22:分子离子峰m/z 301.0327 [M-H]−,MS2产生m/z 273.0549 [M-H-CO]−、257.0555 [M-H-CO2]−、245.0579 [M-H-2CO]−、229.0638 [M-H-CO2-CO]−,C环跨环开裂产生明显离子m/z 179.0083、151.0111、107.0200,根据以上信息并参照相关报道[4],鉴定化合物为槲皮素(Quercetin)。
DL23:分子离子峰m/z 271.0761 [M-H]−,MS2谱中产生m/z 243.1867 [M-H-CO]−、227.1407 [M-H-CO2]−,母核开裂产生明显离子m/z 151.0137、107.0158,根据以上信息并参照相关报道[24],鉴定化合物为柚皮素(Naringenin)。
DL24:分子离子峰m/z 269.1483 [M-H]−,MS2谱产生离子m/z 251.1392 [M-H-H2O]−,分子离子失去中性分子CO和CO2产生碎片m/z 241.0620和m/z 225.1611,C环裂解产生离子m/z 151.0162,根据以上信息并参考相关报道[25],鉴定化合物为芹菜素(Apigenin)。
DL25:分子离子基峰m/z 285.0543 [M-H]−,MS2谱通过基峰C环脱掉CO产生m/z 257.0653,进一步失去水和CO后形成m/z 239.0447、229.0607;山奈酚母核发生RDA裂解产生丰度较低碎片m/z 151.0111、107.0158,参照相关报道[26],鉴定化合物为山柰酚(Kaempferol)。
DL26:分子离子峰m/z 461.2395 [M-H]−,MS2谱分子离子峰失去1分子葡萄糖酸(176 Da)产生典型碎片离子m/z 285.2236,根据质谱裂解特征并参考相关报道[27],鉴定为山柰酚-3-O-葡萄糖醛酸苷(Kaempferol-3-O-glucuronide)。
2.2 活性成分网络药理分析
2.2.1 活性成分靶点预测
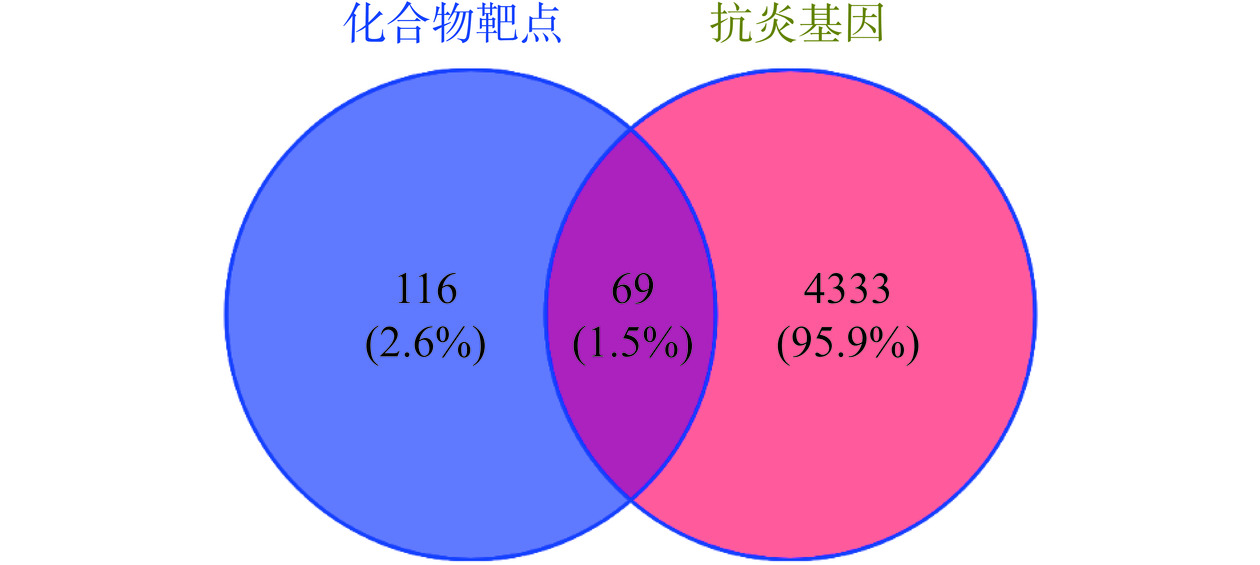
利用Swiss Target Prediction数据库对鉴定出的26个化合物进行靶点预测,得到924个抗炎靶点基因,进一步与人类基因库对比筛选去重之后,得到185个活性成分靶点基因。将活性成分靶点基因与Gene Cards数据库里筛选得到的4402个抗炎靶点基因进行交集并创建韦恩图,见图2所示,交集得到69个君迁子活性成分潜在的抗炎作用靶点。
2.2.2 活性成分-炎症靶点PPI互作网络构建
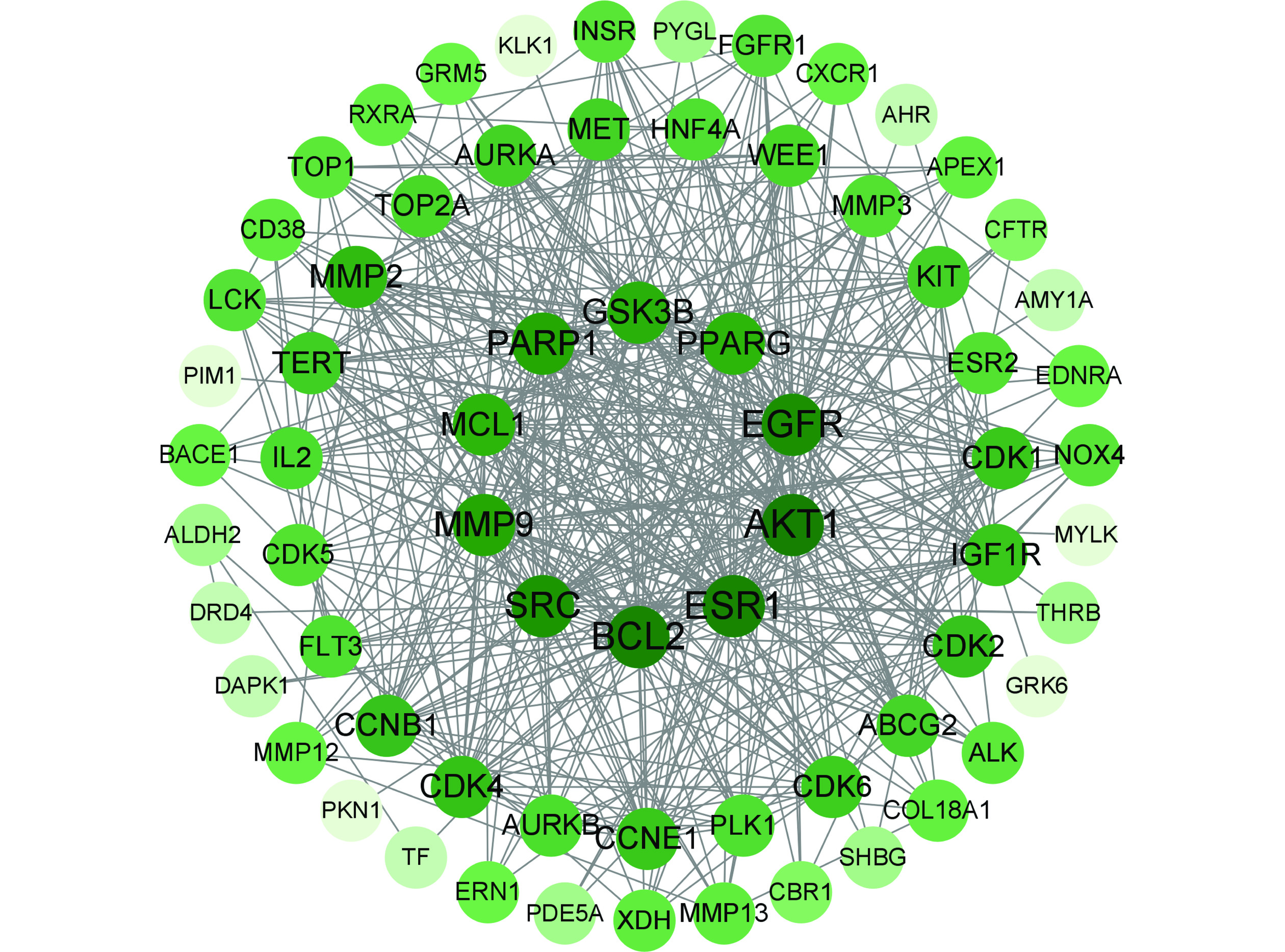
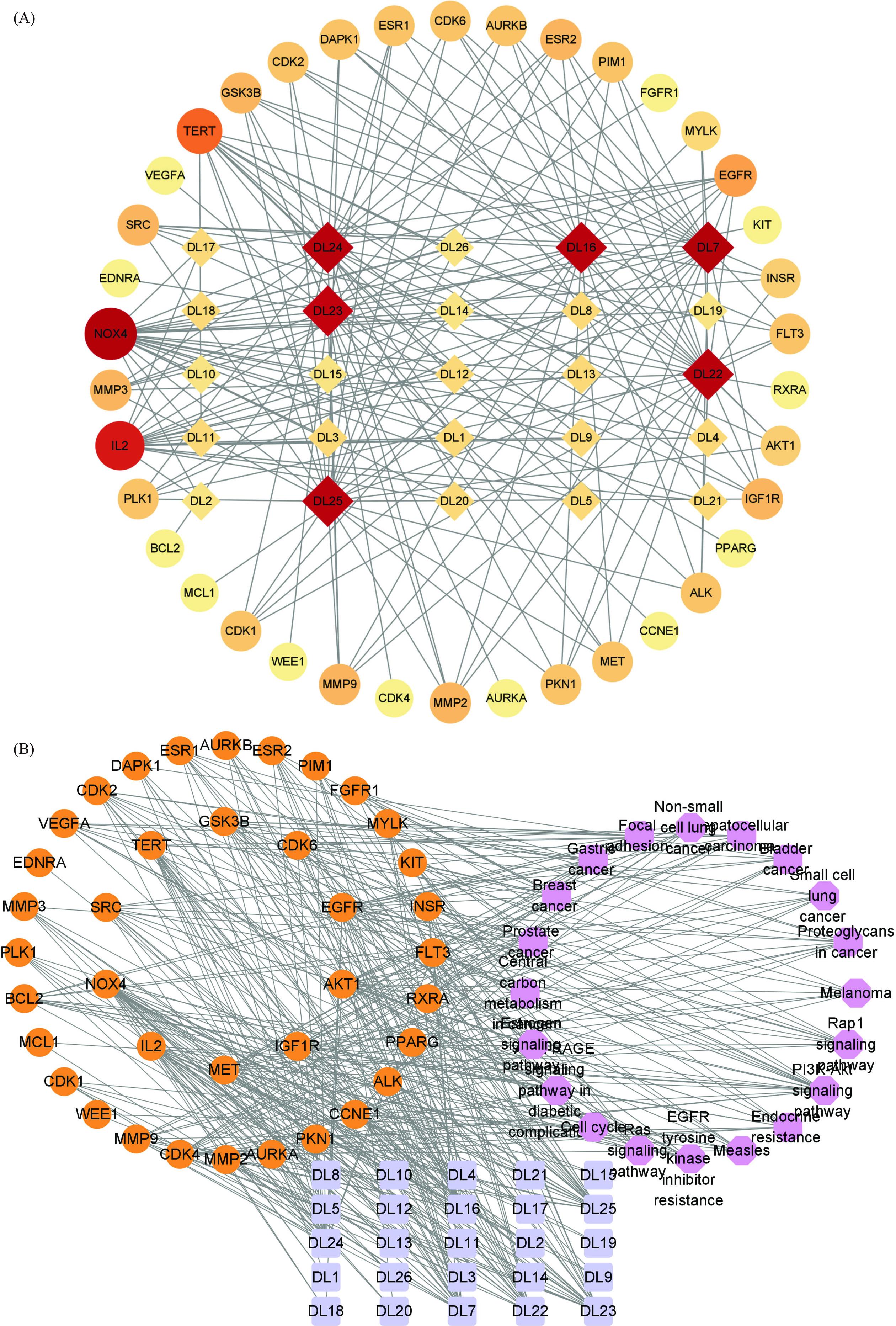
通过构建基于STRING数据库的蛋白质互作网络(PPI),并使用Cytoscape软件可视化分析并绘制蛋白质网络关系图。见图3,网络包含69个节点和487条边,平均节点度为14.1,平均介数为0.658。其中度值前10的关键靶点基因分别为AKT1、ESR1、BCL2、EGFR、SRC、MMP9、PARP1、GSK3B、MCL1、PPARG。
2.2.3 GO和KEGG富集分析
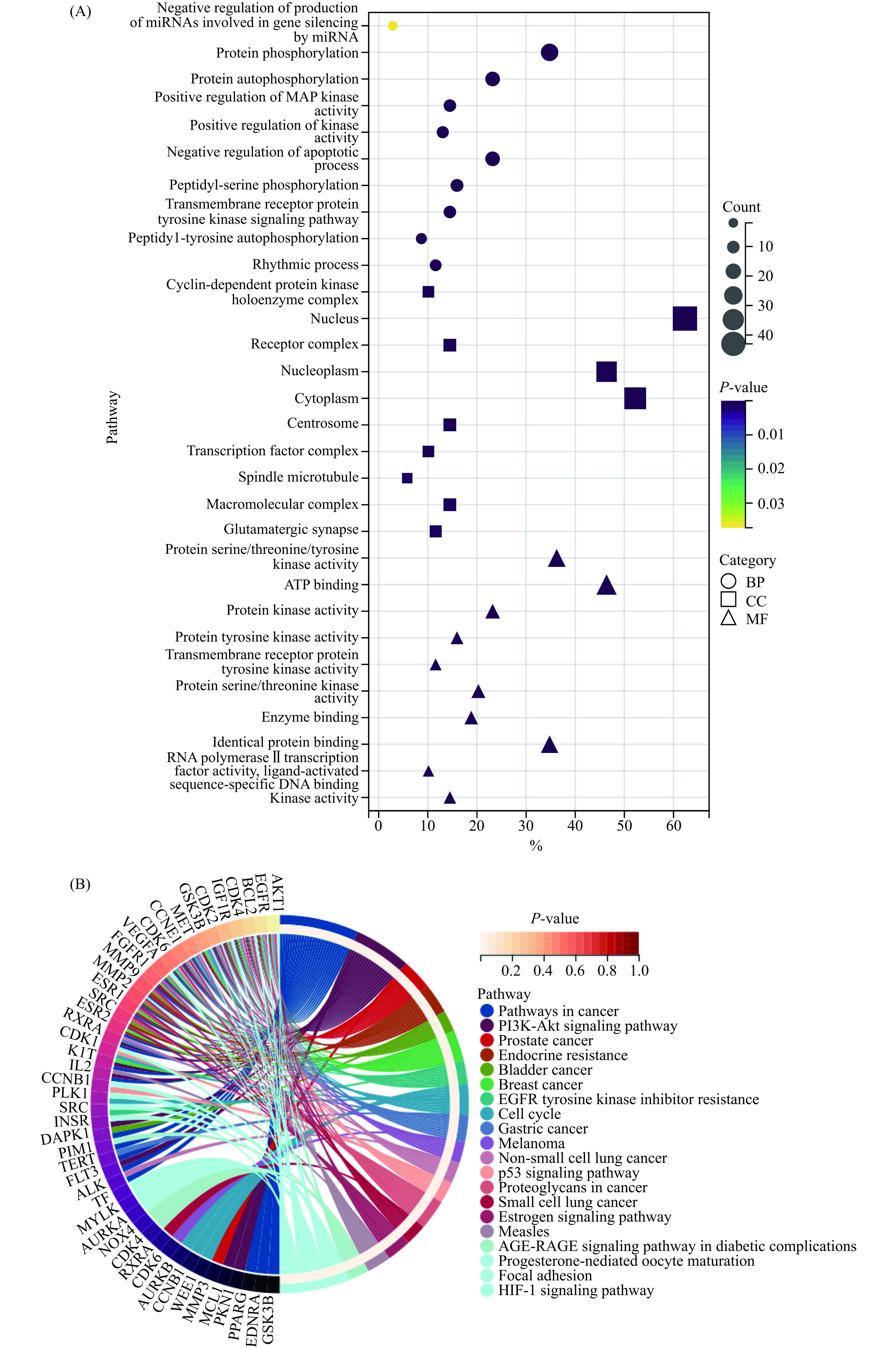
为解释君迁子黄酮化合物抗炎所涉及的过程,将69个潜在靶点导入DAVID数据库进行GO和KEGG富集分析。GO分析发现265个明显的生物结果,主要包括167个生物过程(BP)、37个细胞组分(CC)、61个分子功能(MF)。分别取排名前10的结果绘制气泡图,如图4A所示。在生物过程中主要涉及蛋白磷酸化(Protein phosphorylation)、蛋白自身磷酸化(Protein autophosphorylation)、细胞凋亡过程负向调控(Negative regulation of apoptotic process)等;细胞组分中,主要包括受体复合物(Receptor complex)、细胞质(Cytoplasm)、细胞周期蛋白依赖性蛋白激酶全酶复合物(Cyclin-dependent protein kinase holoenzyme complex)、大分子复合物(Macromolecular complex)等;分子功能主要与蛋白丝氨酸/苏氨酸/络氨酸激酶活性(Protein serine/threonine/tyrosine kinase activity)、ATP结合(ATP binding)、蛋白络氨酸激酶活性(Protein tyrosine kinase activity)、蛋白激酶活性(Protein kinase activity)、相同蛋白的结合(Identical protein binding)等相关。
KEGG通路富集分析得到72条潜在的信号通路,选取排名靠前的输出圆图进行分析,如图4B所示。结果显示君迁子黄酮化合物抗炎作用明显富集的信号通路主要包括PI3K-Akt信号通路(PI3K-Akt signaling pathway)和癌症通路(Pathways in cancer),这两者占比最大,GSK3B、EDNRA、PPARG、PKN1、MCL1是其主要基因。
2.2.4 构建成分-靶点与成分-靶点-通路网络图
采用Cytoscape软件构建君迁子的成分-靶点和成分-靶点-信号通路,其中“方形”表示化学成分,“圆形”表示抗炎作用靶点,“六边形”表示通路,由图5A可知,成分-靶点网络包括63个节点、189条边,平均介数值为6.000,其中杨梅素-7-木糖基-(1->2)-鼠李糖苷(DL6)与炎症靶点没有节点。通过比较成分-靶点网络中各成分的度值,杨梅素-3-桑布双糖苷(DL1)、杨梅素-3-(2G-鼠李糖基)-芸香糖甙(DL3)、桑色素(DL7)、杨梅素-3-鼠李糖基-(1->2)-鼠李糖苷(DL9)、异鼠李素-3-O-葡萄糖苷(DL12)、杨梅素(DL16)、槲皮素(DL22)、柚皮素(DL23)、芹菜素(DL24)、山柰酚(DL25)节点较大,可视为抗炎的重要活性成分。AKT1、EGFR、ESR1、BCL2、SRC、MMP9、MCL1、GSK3B、PPARG等靶点基因节点较大,可以视作抗炎的重要靶点。成分-靶点-信号通路网络包括83个节点、366条边,平均介数值为8.819,见图5B所示,包括25种成分、38个靶点,20条通路,其中PI3K-Akt信号通路(PI3K-Akt signaling pathway)、EGFR络氨酸激酶抑制性耐药(EGFR tyrosine kinase inhibitor resistance)和癌症通路(Pathways in cancer)可以视作抗炎的重要通路。
2.3 分子对接验证
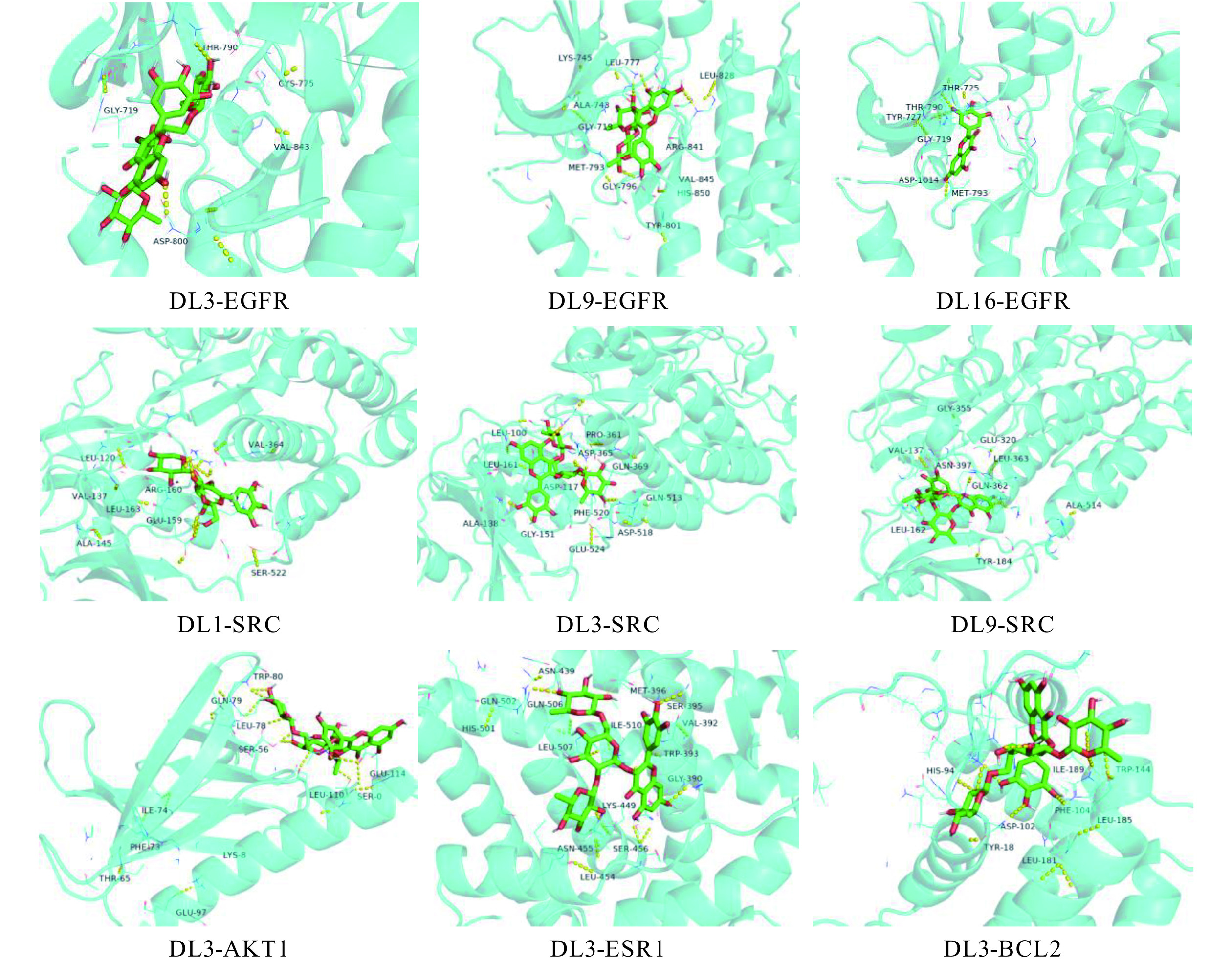
将10个核心化合物杨梅素-3-桑布双糖苷(DL1)、杨梅素-3-(2G-鼠李糖基)-芸香糖甙(DL3)、桑色素(DL7)、杨梅素-3-鼠李糖基-(1->2)-鼠李糖苷(DL9)、异鼠李素-3-O-葡萄糖苷(DL12)、杨梅素(DL16)、槲皮素(DL22)、柚皮素(DL23)、芹菜素(DL24)、山柰酚(DL25)与5种关键靶点EGFR(PDB ID:1INO)、SRC(PDB ID:1O43)、AKT1(PDB ID:1UNM)、ESR1(PDB ID:1BYQ)、BCL2(PDB ID:1G5M)进行分子对接验证,蛋白质与化合物缔合的紧密程度可以用结合能来表示,较低的结合能将导致更稳定的结合构象和更可能的相互作用。一般认为活性成分与靶蛋白的结合能小于−5.0 kcal/mol表明结合能力良好,而小于−7.0 kcal/mol视作有较强的结合作用[28]。对接结果显示,关键靶点均可自发结合,且核心成分与关键靶点的结合活性较好,构象稳定,结合能见表2所示,所有核心化合物与关键靶点结合能均小于−5.0 kcal/mol,对接的功能基团是相应碳链上的羧基、羟基及酯基。用PyMOL软件进行分子的可视化处理,部分结果见图6,其中杨梅素-3-(2G-鼠李糖基)-芸香糖甙(DL3)与 EGFR、SRC、AKT1、ESR1、BCL2结合最为稳定。同时杨梅素-3-鼠李糖基-(1->2)-鼠李糖苷(DL9)与EGFR、杨梅素-3-鼠李糖基-(1->2)-鼠李糖苷(DL9)与SRC、杨梅素(DL16)与EGFR、杨梅素-3-桑布双糖苷(DL1)与SRC结合能值较低,匹配的稳定性较高。根据分子对接结果,推测君迁子是通过多种成分共同作用于核心靶点发挥抗炎作用,尤其是杨梅素及其衍生物在抗炎活性方面发挥更为重要的作用。
表 2 核心化合物与关键靶点的分子对接结合能结果Table 2. Molecular docking binding energy results between core compounds and key targets化合物 结合能 (kcal/mol) EGFR SRC AKT1 ESR1 BCL2 DL1 −8.7 −8.9 −7.0 −7.5 −7.1 DL3 −9.0 −9.9 −7.2 −8.2 −9.0 DL7 −8.6 −8.1 −6.4 −7.5 −8.2 DL9 −9.0 −9.0 −7.1 −7.4 −8.7 DL12 −8.7 −7.8 −6.0 −5.9 −6.8 DL16 −9.1 −8.0 −6.5 −8.0 −8.1 DL22 −8.9 −8.3 −6.2 −7.3 −7.9 DL23 −8.4 −7.9 −6.2 −7.4 −8.1 DL24 −8.7 −8.0 −6.2 −6.2 −8.0 DL25 −7.6 −7.9 −6.3 −7.3 −7.2 众多研究[29−31]发现杨梅素及其苷类化合物具有较强的抗氧化、抗炎及心脏保护功能,通过减少细胞凋亡来预防心肌炎疾病的发生,槲皮素类成分一般具有不同程度的保肝、抗炎、抗氧化等多种药理活性,同时发现槲皮素和苷类化合物的抗炎活性主要是B环和C环上的OH基团贡献较大。
3. 结论
本研究采用超高效液相色谱-四级杆-飞行时间质谱对涉县君迁子果实中的黄酮化合物进行了系统分析,共从君迁子果实中鉴定出26个黄酮化合物,结合网络药理学预测了君迁子提取物抗炎的活性成分,发现杨梅素-3-桑布双糖苷、杨梅素-3-(2G-鼠李糖基)-芸香糖甙、桑色素、杨梅素-3-鼠李糖基-(1->2)-鼠李糖苷、异鼠李素-3-O-葡萄糖苷、杨梅素、槲皮素、柚皮素、芹菜素、山柰酚具有潜在的抗炎活性,EGFR、SRC、AKT1、ESR1、BCL2可能是其中发挥抗炎作用的关键靶点,且通过PI3K-Akt信号通路、EGFR络氨酸激酶抑制性耐药和癌症通路等关键信号通路发挥抗炎作用。将核心靶点与活性化合物进行了分子对接,发现核心靶点与君迁子中多种化合物结合良好,特别是杨梅素及其苷类化合物,结合程度更为稳定。但因时间有限以上预测结果尚未通过体内及分子水平的验证,后续将进一步完善。本研究探究无核君迁子的抗炎成分及其作用机制的预测结果,为君迁子果实的抗炎药效物质基础及在功能食品开发利用方面提供理论依据。
-
表 1 君迁子果实中化学成分的鉴定结果
Table 1 Identification results of chemical constituents from Diospyros lotus fruit
序号 出峰时间tR(min) 分子式 分子离子(m/z) 特征离子(m/z) 化合物 1* 3.23 C26H28O17 611.1968 317.1377 杨梅素-3-桑布双糖苷Myricetin-3-sambubioside 2* 5.22 C27H28O19 655.1411 317.0283 杨梅素-3-葡萄糖醛酸-8-葡萄糖苷Myricetin-3-glucuronide-8-glucoside 3* 7.59 C33H40O21 771.2378 317.0392 杨梅素-3-(2G-鼠李糖基)-芸香糖甙Myricetin-3-(2G-rhamnosylrutinoside) 4 8.82 C27H30O17 625.1686 316.0449 杨梅素-3-O-芸香糖苷Myricetin-3-O-rutinoside 5 9.11 C21H20O13 479.1057 316.0376 杨梅素-3-O-葡萄糖苷Myricetin-3-O-glucoside 6* 9.57 C26H28O16 595.1684 317.0101 杨梅素-7-木糖基-(1->2)-鼠李糖苷Myricetin-7-xylosyl-(1->2)-rhamnoside 7 10.00 C15H10O7 301.0153 301.0153 桑色素Morin 8 10.24 C27H30O16 609.1741 300.0358 槲皮素-3-O-芸香糖苷Quercetin-3-O-rutinoside 9* 10.52 C27H30O16 609.1791 317.0247 杨梅素-3-鼠李糖基-(1->2)-鼠李糖苷Myricetin-3-rhamnosyl-(1->2)-rhamnoside 10 10.61 C21H20O12 463.0827 317.0320 杨梅素-3-O-鼠李糖苷Myricetin-3-O-rhamnoside 11 10.88 C21H20O12 463.1100 300.0429 槲皮素-3-O-葡萄糖苷Quercetin-3-O-glucoside 12* 11.27 C22H22O12 477.1629 315.0994 异鼠李素-3-O-葡萄糖苷Isorhamnetin-3-O-glucoside 13* 11.66 C23H22O13 505.1256 300.0429 槲皮素-3-O(6''-乙酰基-葡萄糖苷)Quercetin-3-O-(6''-acetyl-glucoside) 14 12.25 C21H20O11 447.1174 300.0429 槲皮素-3-O-鼠李糖苷Quercetin-3-O-rhamnoside 15* 12.48 C21H18O14 493.0837 317.0465 杨梅素-7-O-葡萄糖醛酸苷Myricetin-7-O-glucuronide 16 13.06 C15H10O8 317.0465 317.0465 杨梅素Myricetin 17 13.50 C21H20O12 463.1100 301.0437 槲皮素-7-O-葡萄糖苷Quercetin-7-O-glucoside 18 13.67 C21H20O10 431.1211 285.0543 山奈酚-7-O-鼠李糖苷Kaempferol-7-O-rhamnoside 19* 14.31 C21H20O12 463.2377 299.9968 槲皮素-3'-O-葡萄糖苷Quercetin-3'-O-glucoside 20* 14.62 C21H18O11 445.1025 269.0576 芹菜素-7-O-葡萄糖苷酸Apigenin-7-O-glucuronide 21* 14.79 C24H22O14 533.3359 284.1183 山奈酚-3-O-6-丙二酰基葡萄糖苷Kaempferol-3-O-(6-malonyl-glucoside) 22 15.59 C15H10O7 301.0327 301.0327 槲皮素Quercetin 23 17.51 C15H12O5 271.0761 271.0761 柚皮素Naringenin 24 17.60 C15H10O5 269.1483 269.1483 芹菜素Apigenin 25 17.93 C15H10O6 285.0543 285.0543 山柰酚Kaempferol 26* 21.54 C21H18O12 461.2395 285.2236 山柰酚-3-O-葡萄糖醛酸苷Kaempferol-3-O-glucuronide 注:*表示君迁子果实中首次发现。 表 2 核心化合物与关键靶点的分子对接结合能结果
Table 2 Molecular docking binding energy results between core compounds and key targets
化合物 结合能 (kcal/mol) EGFR SRC AKT1 ESR1 BCL2 DL1 −8.7 −8.9 −7.0 −7.5 −7.1 DL3 −9.0 −9.9 −7.2 −8.2 −9.0 DL7 −8.6 −8.1 −6.4 −7.5 −8.2 DL9 −9.0 −9.0 −7.1 −7.4 −8.7 DL12 −8.7 −7.8 −6.0 −5.9 −6.8 DL16 −9.1 −8.0 −6.5 −8.0 −8.1 DL22 −8.9 −8.3 −6.2 −7.3 −7.9 DL23 −8.4 −7.9 −6.2 −7.4 −8.1 DL24 −8.7 −8.0 −6.2 −6.2 −8.0 DL25 −7.6 −7.9 −6.3 −7.3 −7.2 -
[1] YANG Y, YANG T T, JING Z B, et al. Genetic diversity and taxonomic studies of date plum (Diospyros lotus L.) using morphological traits and SCoT markers[J]. Biochem Syst Ecol,2015,61:253−259.
[2] LI X H, JIANG Z Y, SHEN Y Y, et al. In vitro regeneration and agrobacterium tumefaciens-mediated genetic transformation of D. lotus (Diospyros lotus L.)[J]. Sci Hortic-amsterdam,2018,236:229−237.
[3] 滕宁宁, 王明, 吴一飞, 等. 君迁子药学研究概况[J]. 辽宁中医药大学学报,2010,12(9):81−82. [TENG N N, WANG M, WU Y F, et al. Overview of pharmacological research of Diospyros lotus L J]. LiaoNing Univ of TCM,2010,12(9):81−82.
[4] LOIZZO M R, SAID A, TUNDIS R, et al. Antioxidant and antiproliferative activity of Diospyros lotus L. extract and isolated compounds[J]. Plant Foods Hum Nutr,2009,64(4):264−270.
[5] UDDIN G, RAUF A, SIDDIQUI B S, et al. Anti-nociceptive, anti-inflammatory and sedative activities of the extracts and chemical constituents of Diospyros lotus L.[J]. Phytomedicine,2014,21(7):954−959.
[6] RAUF A, UDDIN G, KHAN H, et al. Anti-tumour-promoting and thermal-induced protein denaturation inhibitory activities of β-sitosterol and lupeol isolated from Diospyros lotus L.[J]. Nat Prod Res,2016,30(10):1205−1207.
[7] ZHANG Z P, MA J, HE Y Y, et al. Antioxidant and hypoglycemic effects of Diospyros lotus fruit fermented with Microbacterium flavum and Lactobacillus plantarum[J]. Biosci Bioeng,2018,125(6):682−687.
[8] RASHED K, ZHANG X J, LUO M T, et al. Anti-HIV-1 activity of phenolic compounds isolated from Diospyros lotus fruits[J]. Phytopharmacology,2012,3(2):199−207.
[9] RAUF A, UDDIN G, SIDDIQUI B S, et al. Bioassay-guided isolation of novel and selective urease inhibitors from Diospyros lotus[J]. Chin J Nat Medicines,2017,15(11):865−870.
[10] GAO H, CHENG N, ZHOU J, et al. Antioxidant activities and phenolic compounds of date plum persimmon (Diospyros lotus L.) fruits[J]. Food Sci & Tech,2014,51(5):950−956.
[11] LIN S, YUE X, OUYANG D, et al. The profiling and identification of chemical components, prototypes and metabolites of Run-zao-zhi-yang capsule in rat plasma, urine and bile by an UPLC-Q-TOF/MSE-based high-throughput strategy[J]. Biomed Chromatogr,2018,12:e4261.
[12] YU G, WANG W, WANG X, et al. Network pharmacology-based strategy to investigate pharmacological mechanisms of Zuojinwan for treatment of gastritis[J]. BMC Complement Altern Med,2018,18:292.
[13] ROSSO M D, PANIGHEL A, VEDOVA A D, et al. Characterization of non-anthocyanic flavonoids in some hybrid red grape extracts potentially interesting for industrial uses.[J]. Molecules,2015,20(10):18095−18106.
[14] MANGURO L O A, WAGAI S O, LEMMEN P. Flavonol and iridoid glycosides of Ajuga remota aerial parts[J]. Phytochem,2006,67(8):830−837.
[15] ZDUNIC G, GODEVAC D, ŠAVIKIN K, et al. Isolation and identification of phenolic compounds from Hypericum richeri Vill. and their antioxidant capacity[J]. Nat Prod Res,2011,25(3):175−187.
[16] ZHOU Z, LI N, ZHANG H F, et al. Simultaneous quantitative analysis of 11 flavonoid derivatives with a single marker in persimmon leaf extraction and evaluation of their myocardium protection activity[J]. Nat Med,2019,73(2):404−418.
[17] CHEN W P, HU P F, BAO J P, et al. Morin exerts antiosteoarthritic properties:An in vitro and in vivo study[J]. Exp Biol Med (Maywood),2012,237(4):380−386.
[18] CAO J G, XIA X, CHEN X F, et al. Characterization of flavonoids from Dryopteris erythrosora and evaluation of their antioxidant, anticancer and acetylcholinesterase inhibition activities[J]. Food Chem Toxicol,2013,51:242−250.
[19] WEI Y, XIE Q Q, FISHER D, et al. Separation of patuletin-3-O-glucoside, astragalin, quercetin, kaempferol and isorhamnetin from Flaveria bidentis (L.) Kuntze by elution-pump-out high-performance counter-current chromatography[J]. Chromatogr A,2011,1218(36):6206−6211.
[20] YOO S K, KIM J M, LEE U, et al. Immature persimmon suppresses amyloid beta (Aβ) mediated cognitive dysfunction via tau pathology in ICR mice[J]. Curr Issues Mol Biol,2021,43(1):405−422.
[21] ELLOUMI W, MAHMOUDI A, ORTIZ S, et al. Wound healing potential of quercetin-3-O-rhamnoside and myricetin-3-O-rhamnoside isolated from Pistacia lentiscus distilled leaves in rats model[J]. Biomed Pharmacother,2022,146:112574.
[22] FUAD A R, SALEH A L, JEHAD A, et al. Analysis of phenolic and flavonoids of wild Ephedra alata pant extracts by LC/PDA and LC/MS and their antioxidant activity[J]. Afr J Tradit Complement Altern Med,2017,14(2):130−141.
[23] 梁永红, 侯奕, 姚慧莹, 等. 三脉菝葜抗肿瘤活性组分化学成分研究[J]. 中华中医药杂志,2022,27(3):1704−1709. [LIANG R H, HOU Y, YAO H Y, et al. Study on chemical constituents of antitumor active components of Smilax chinensis L[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2022,27(3):1704−1709.] LIANG R H, HOU Y, YAO H Y, et al. Study on chemical constituents of antitumor active components of Smilax chinensis L[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2022, 27(3): 1704−1709.
[24] WANG Q Y, OU Y J, HU G M, et al. Naringenin attenuates non-alcoholic fatty liver disease by down-regulating the NLRP3/NF-κB pathway in mice[J]. Br J Pharmacol,2020,177(8):1806−1821.
[25] WANG M Q, FIRRMAN J, LIU L S, et al. A review on flavonoid apigenin:Dietary intake, ADME, antimicrobial effects, and interactions with human gut microbiota[J]. Biomed Res Int,2019,2019:1−18.
[26] KLUSKA M, JUSZCZAK M, ŻUCHOWSKI J, et al. Kaempferol and its glycoside derivatives as modulators of etoposide activity in HL-60 cells[J]. Int J Mol Sci,2021,22(7):3520.
[27] 昝立峰, 杨香瑜, 郭海燕, 等. 基于 UPLC-Q-TOF-MS 技术分析黄刺玫果的化学成分[J]. 食品工业科技,2021,42(23):251−258. [ZAN L F, YANG X Y, GUO H Y, et al. Characterization of chemical constituents from fruits of Rosa xanthina by UPLC-Q-TOF-MS[J]. Science and Technology of Food Industry,2021,42(23):251−258.] ZAN L F, YANG X Y, GUO H Y, et al. Characterization of chemical constituents from fruits of Rosa xanthina by UPLC-Q-TOF-MS[J]. Science and Technology of Food Industry, 2021, 42(23): 251−258.
[28] HUANG Z Z, DU X, MA C D, et al. Identification of antitumor active constituents in Polygonatum sibiricum flower by UPLC-Q-TOF-MSE and network pharmacology[J]. ACS Omega,2020,5(46):29755−29764.
[29] MARQUARDT P, SEIDE R, VISSIENNON C, et al. Phytochemical characterization and in vitro anti-inflammatory, antioxidant and antimicrobial activity of Combretum collinum fresen leaves extracts from Benin[J]. Molecules,2020,25(2):288.
[30] LI H G, CHEN J X, XIONG J H, et al. Myricetin exhibits anti-glioma potential by inducing mitochondrial-mediated apoptosis, cell cycle arrest, inhibition of cell migration and ROS generation[J]. BUON,2016,21(1):182−190.
[31] ZHENG Y Z, DENG G, LIANG Q, et al. Antioxidant activity of quercetin and its glucosides from Propolis:A theoretical study[J]. Sci Rep,2017,7(1):7543.





 下载:
下载:
 下载:
下载:
