Physical and Chemical Properties of an Enzymolysis Peptide of Peony Flower and Beneficial Effect on Skin Health
-
摘要: 为进一步促进牡丹花的开发利用,本研究以酶解的牡丹花酶解肽为研究对象,分析了其分子量分布与氨基酸组成,通过测定体外酪氨酸酶抑制率、抗糖化活性、透明质酸酶抑制率以及抗氧化活性研究其促进皮肤健康的功效,并进一步利用斑马鱼黑色素沉积模型进行验证。结果表明,牡丹花酶解肽是由15种氨基酸组成的平均分子量为644 Da的小分子肽,当浓度为10 mg/mL时,体外酪氨酸酶抑制率为88.96%,晚期糖基化终末产物(AGEs)抑制率为90.50%,透明质酸酶抑制率为60.43%,DPPH自由基清除率和羟自由基清除率分别为74.77%和94.74%。同时,斑马鱼模型的结果表明牡丹花酶解肽可有效抑制斑马鱼头部黑色素沉积,当样品浓度为1000 μg/mL时,黑色素抑制率达到40.59%。总之,体内外研究结果初步证明牡丹花酶解肽具有良好的促进皮肤健康的潜力。Abstract: The enzymolysis peptide of peony flower was studied herein to promote the development and utilization of this flower. The molecular weight distribution and amino acid composition of the peptide were analyzed, and the beneficial effects of the peptide were studied by assessing their ability to inhibit tyrosinase activity, advanced glycation end products (AGEs) formation, and hyaluronidase in vitro. The in vitro results were further verified in a zebrafish melanin accumulation model, results indicated that the active peptide was a small molecule comprising 15 amino acids, with an average molecular weight of 644 Da. At 10 mg/mL, the respective in vitro inhibition rates for tyrosinase activity, AGEs formation, and hyaluronidase were 88.96%, 90.50%, and 60.43%, respectively. The respective DPPH (2,2-diphenyl-1-picrylhydrazyl) and hydroxyl free radical scavenging rates were 74.77% and 94.74%, respectively. The zebrafish model studies revealed a melanin inhibition rate of 40.59% when the sample concentration was 1000 μg/mL. In conclusion, the results of these in vivo and in vitro studies preliminarily indicate that the peony flower enzymolysis peptide can potentially improve skin health.
-
Keywords:
- peony flower enzymolysis peptide /
- whitening effect /
- healthy skin /
- anti-oxidation /
- zebrafish
-
作为人体最大的器官,随着年龄的增长和紫外线、环境污染等外界因素的影响,皮肤的胶原蛋白逐渐流失,并出现变黑、暗沉、干燥等皮肤衰老现象[1−2]。近年来,饮食干预被认为是一种改善皮肤健康状态的有效方式。特别是食源性多肽以其安全、易吸收、高效等特点,受到人们的广泛关注。已有研究表明,核桃肽[3]、沙丁鱼蛋白多肽[4]以及豌豆肽[5]具有明显的美白活性,而天然胶原多肽表现出保湿抗衰等功效,均可在针对皮肤健康的功能性食品或护肤品中有良好的应用[6]。
牡丹花色泽艳丽,营养丰富,不仅含有丰富的蛋白质、脂肪、维生素以及矿物质等营养成分[7−8],还包含紫云英苷和芍药花苷等具有多种生理活性的黄酮类化合物,是一种天然优质的功能性原料[9−10]。2013年,丹凤牡丹花被纳入新资源食品行列,其营养价值和生物活性也被越来越多的学者报道。目前,对于丹凤牡丹花的研究集中于多酚、黄酮类活性成分的提取,以及这些活性成分在抗糖化[11]、抗氧化[12]、降血糖[13]方面的作用。此外,针对牡丹花中蛋白质资源的研究表明,牡丹花肽具有降血压[14]、降低胆固醇[15]、抗氧化[16]以及提高免疫力等活性。研究表明由丹凤牡丹籽制备的生物肽具有酪氨酸酶抑制功效[17],而利用丹凤牡丹花为原料制备生物肽及其在促进皮肤健康功效方面的研究未见报道。
因此,为了验证牡丹花酶解肽对皮肤健康的促进作用,本研究首先对酶解的牡丹花肽进行理化指标分析,然后通过测定其对酪氨酸酶和透明质酸酶的抑制作用,以及抗糖基化终末产物(Advanced Glycation End Products,AGEs)生成活性和抗氧化活性等指标,评价牡丹花肽对皮肤健康的促进作用,最终在斑马鱼模型上验证其对黑色素生成的抑制作用。相关研究结果可为牡丹花酶解肽在食品和化妆品中的开发和应用提供理论基础。
1. 材料与方法
1.1 材料与仪器
丹凤牡丹花 肽度科技(厦门)有限公司;斑马鱼 杭州环特生物科技股份有限公司;胰岛素、杆菌肽、甘氨酰-甘氨酰-酪氨酰-精氨酸、甘氨酰-甘氨酰-甘氨酸 中国计量科学研究院;17种氨基酸混合标准品 阿尔塔科技有限公司;黑色素细胞刺激素 上海源叶生物科技有限公司;酪氨酸酶(≥500 U/mg) 北京华迈科生物技术有限责任公司;甲基纤维素、乙腈、三氟乙酸、L-左旋多巴 上海阿拉丁生化科技股份有限公司;谷胱甘肽、维生素C、曲酸、氨基胍、色苷酸钠、1,1-二苯基-2-苦肼基自由基(DPPH) 上海麦克林生化科技有限公司;葡萄糖 西陇科学股份有限公司;过氧化氢、D-果糖 国药集团化学试剂有限公司;牛血清白蛋白 成都西亚化工股份有限公司;其他试剂均为国产分析纯。
LC-16高效液相色谱仪(配有紫外检测器及GPC处理系统) 日本岛津公司;HH-4B磁力搅拌恒温水浴锅 国华(常州)仪器制造;UV-5100型紫外可见分光光度计 上海元析仪器有限公司;MULTISKAN SPECTRUM型酶标仪 美国赛默飞世尔科技公司;HC-3016型高速冷冻离心机 安徽中科中佳科学仪器有限公司;SZX7型解剖显微镜 日本奥林巴斯株式会社;IM300型显微注射仪、PC-10型拉针仪 日本Narishige公司。
1.2 实验方法
1.2.1 牡丹花酶解肽的制备
将丹凤牡丹花干花加水粉碎打浆,用NaOH调节pH至9.0左右,接着充分搅拌1 h ,用稀盐酸调节pH至4.5左右,分离得到沉淀。将沉淀溶于纯水中,调节pH至8.0左右,加入1%碱性蛋白酶,酶解4 h,酶解结束后进行灭酶处理。冷却至室温后,酶解液分别经硅藻土、超滤膜过滤,得到分子量<3000 Da的牡丹花多肽,进一步纳滤浓缩(脱盐脱水)后冷冻干燥,即为牡丹花酶解肽粉。
1.2.2 牡丹花酶解肽的理化指标测定
1.2.2.1 蛋白含量测定
按照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》中第一法的凯氏定氮法测定牡丹花酶解肽的蛋白质含量。
1.2.2.2 相对分子质量分布测定
参照GB/T 22492-2008《大豆肽粉附录A 肽相对分子质量分布的测定方法》的高效液相凝胶色谱方法。凝胶色谱柱:TSKgel G2000SWxl(300 mm×7.8 mm,5 μm);流动相为乙睛:水:三氟乙酸=20:80:0.1(体积比);检测时间:等度洗脱30 min;流速:0.5 mL/min;检测波长:220 nm;进样体积:10 μL。
1.2.2.3 氨基酸组成测定
参考GB 5009. 124-2016《食品安全国家标准 食品中氨基酸的测定》的反相高效液相色谱法进行氨基酸组成测定。色谱柱:GL InertSustain C18(4.6 mm×150 mm,3 μm);流动相:A相为40 mmol/磷酸盐缓冲液(pH7.0),B相为乙腈/甲醇/水=45:45:10,梯度洗脱(0~1.00 min,10%~12% B;1.00~2.50 min,12%B;2.50~2.51 min,12%~16% B;2.51~13.00 min,13%~36% B;13.00~13.01 min,36%~38% B;13.01~25.00 min,38%~100% B;25.00~28.00 min,100% B;28.00~28.01 min,100%~10% B;28.01~35.00 min,10% B);柱温40 ℃;体积流量1.1 mL/min;检测波长338 nm;进样量10 μL。
1.2.3 体外促进皮肤健康功效研究
1.2.3.1 酪氨酸酶抑制率测定
根据文献[18]的方法对牡丹花酶解肽的酪氨酸酶抑制率进行测定。于样品管(T)中加入1.0 mL样品溶液和0.5 mL酪氨酸酶溶液,在样品本底管(T0)中分别加入1.0 mL样品溶液和0.5 mL缓冲液,在酶反应管(C)中加入1.0 mL缓冲液和0.5 mL酪氨酸酶溶液,在溶剂本底管(C0)中加入1.5 mL缓冲液。接着置于37 ℃水浴孵育10 min后,均加入2.0 mL的左旋多巴溶液。室温反应5 min后,于475 nm处的测定吸光度。本实验方法以曲酸作为阳性对照。根据以下公式计算酪氨酸酶抑制率(%):
酪氨酸酶抑制率(%)=(1−T−T0C−C0)×100 式中:T表示样品组的吸光度;T0表示样品本底组的吸光度;C表示酶反应组的吸光度;C0表示溶剂本底组的吸光度。
1.2.3.2 AGEs抑制率测定
参照周慧吉等[19]报道的BSA/还原糖体系模型测定牡丹花酶解肽的抗糖化活性。首先配制pH7.4磷酸盐缓冲溶液、4.0 mg/mL牛血清白蛋白BSA溶液、0.5 mol/L葡萄糖/D-果糖溶液和2.0 mmol/L氨基胍溶液,接着过膜处理。在样品组F1中加入100 μL BSA、100 μL葡萄糖/D-果糖溶液和100 μL多肽样品,在样品对照组F2中加入100 μL PBS、100 μL葡萄糖/D-果糖溶液和100 μL多肽样品,在空白组F3中加入100 μL BSA、100 μL葡萄糖/D-果糖溶液和100 μL样品溶剂溶液,在空白对照组F4中加入100 μL PBS、100 μL葡萄糖/D-果糖溶液和100 μL样品溶剂溶液。用2.0 mmol/L氨基胍(AG)溶液用作阳性对照。加完样品后,于37 ℃培养箱下孵育7 d。测定其经360 nm激发光激发后,在453 nm处的荧光强度,激发和发射狭缝宽度为5 nm。本实验方法以氨基胍作为阳性对照。根据以下公式计算AGEs生成抑制率(%):
AGEs抑制率(%)=(1−F1−F2F3−F4)×100 式中:F1表示样品组的吸光度;F2表示样品对照组的吸光度;F3表示空白组的吸光度;F4表示空白对照组的吸光度。
1.2.3.3 透明质酸酶抑制率测定
参考文献[20]报道的方法测定牡丹花酶解肽的透明质酸酶抑制率。于离心管中加入50 μL待测样品溶液,4.85 mL 0.2 mol/L乙酸乙酸钠缓冲液和50 μL 1.0 mg/mL透明质酸酶溶液,充分摇匀并加入50 μL 3.44 mg/mL透明质酸钠溶液,37 ℃反应15 min后,测定溶液在400 nm波长下的吸光度,记为A1,将酶液替换为缓冲液测得的吸光度记为样品对照Ac1,空白对照是用缓冲液代替酶液和样品溶液,测得吸光度为Ac2,而将样品替换为缓冲液测得的吸光度记为A0。本实验方法以色苷酸钠作为阳性对照。按以下公式计算透明质酸酶活性抑制率(%):
透明质酸酶抑制率(%)=(1−Ac1−A1Ac2−A0)×100 式中:Ac1表示样品对照组的吸光度;A1表示样品组的吸光度;Ac2表示空白对照组的吸光度;A0表示空白组的吸光度。
1.2.4 体外抗氧化活性分析
1.2.4.1 DPPH自由基清除率测定
依据《GB/T 39100-2020多肽抗氧化测定 DPPH法和ABTS法》中的DPPH法测定牡丹花酶解肽的DPPH自由基清除率。首先配制50 μg/mL DPPH溶液,接着在A1管中加3.0 mL DPPH溶液和1.0 mL样品;在A0管中加3.0 mL无水乙醇溶液和1.0 mL样品;在A2管中加3.0 mL DPPH溶液和1.0 mL样品溶剂(水)溶液;分别充分混合均匀,室温避光反应30 min,于波长517 nm条件下用紫外分光光度计吸光度(用蒸馏水调零校准)。本实验方法以谷胱甘肽作为阳性对照。按以下公式计算DPPH自由基清除率(%):
DPPH自由基清除率(%)=(1−A1−A0A2)×100 式中:A1表示样品组的吸光度;A0表示样品对照组的吸光度;A2表示空白组的吸光度。
1.2.4.2 羟自由基清除率测定
根据文献[21]的方法测定牡丹花酶解肽的羟自由基清除率。首先配制8.8 mmol/L H2O2 1.0 mL、9.0 mmol/L FeSO4 1.0 mL和9.0 mmol/L水杨酸-乙醇溶液。接着在A0组,A00组,A01组和A1组中分别加入1.0 mL FeSO4溶液和1.0 mL水杨酸-乙醇溶液。在A01和A1中分别加入1.0 mL的样品溶液,在A0和A01中分别加入1.0 mL的样品溶剂,在A00中加入2.0 mL的样品溶剂,最后在A0和A1中加入1.0 mL H2O2启动反应,37 ℃反应30 min后测定各组在510 nm下的吸光度。本实验方法以维生素C作为阳性对照。按下式计算羟自由基清除率:
羟自由基清除率(%)=(1−A1−A01A0−A00)×100 式中:A1表示样品组的吸光度;A01表示样品对照组的吸光度;A0表示空白组的吸光度;A00表示空白对照组的吸光度。
1.2.5 基于斑马鱼模型的黑色素抑制率测定
1.2.5.1 最大耐受浓度(Maximum Tolerated Concentration,MTC)测定
随机选取3 dpf野生型AB品系斑马鱼于6孔板中,每孔含有30尾斑马鱼。水溶给予样品(表3),每孔体积为3.0 mL。除正常对照组外,模型对照组和样品组均卵黄囊注射黑素细胞刺激素,建立斑马鱼黑色素增加模型。接着在28 ℃处理24 h后,测定斑马鱼对于样品的MTC。
表 3 牡丹花酶解肽对斑马鱼的毒性测试结果(n=30)Table 3. Toxicity test results of peony flower enzymolysis peptide to zebrafish (n=30)组别 浓度
(μg/mL)死亡数
(尾)死亡率
(%)表型 正常对照组 − 0 0 未见明显异常 模型对照组 − 0 0 未见明显异常 牡丹花酶解肽 125 0 0 与模型对照组状态相似 250 0 0 与模型对照组状态相似 500 0 0 与模型对照组状态相似 1000 0 0 与模型对照组状态相似 2000 0 0 较模型对照组状态严重 1.2.5.2 黑色素抑制率测定
随机选取3 dpf野生型AB品系斑马鱼于6孔板中,每孔含有30尾斑马鱼。水溶给予样品(表4),每孔体积为3.0 mL。除正常对照组外,模型对照组和样品组均卵黄囊注射黑素细胞刺激素,建立斑马鱼黑色素增加模型。接着在28 ℃处理24 h后,每组随机选取10尾斑马鱼置于解剖显微镜下拍照,用Image J图像处理软件计算斑马鱼头部黑色素信号强度(S)。黑色素抑制率计算公式如下:
表 4 牡丹花酶解肽抑制斑马鱼头部黑色素生成的实验结果(n=10)Table 4. Inhibition of melanin production in head of zebrafish by peony flower enzymolysis peptide (n=10)组别 浓度(μg/mL) 头部黑色素信号强度
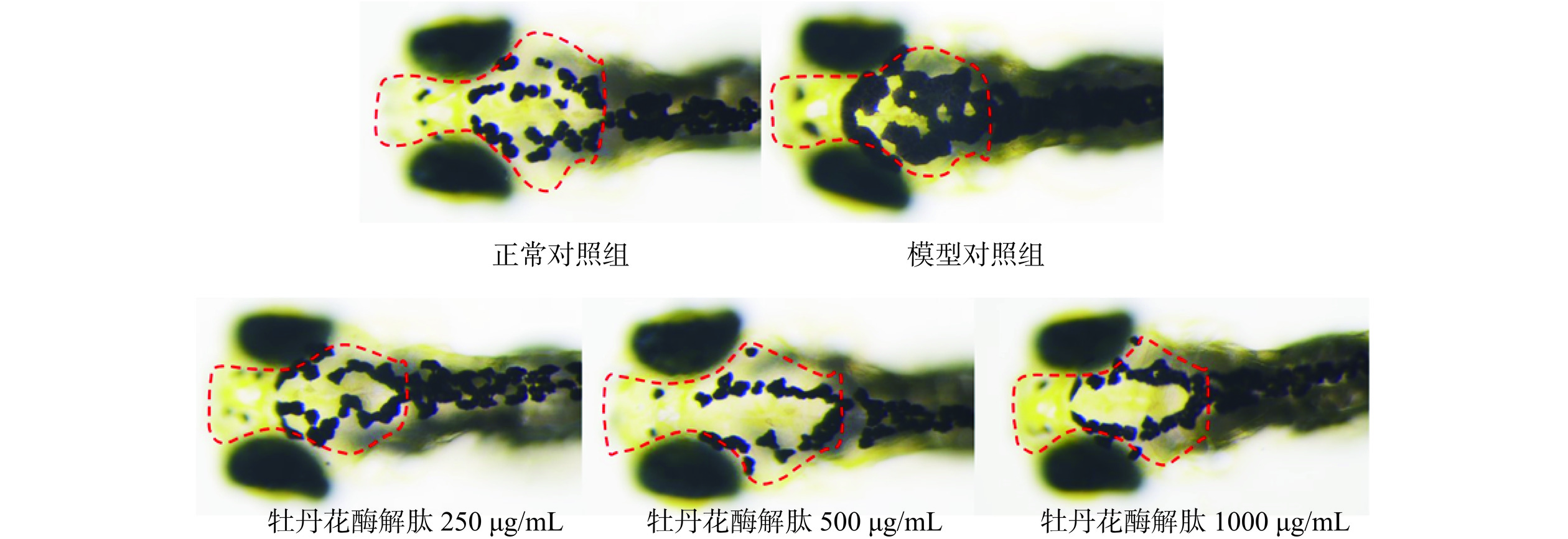
(像素,mean±SE)黑色素抑制率(%) 正常对照组 − 70854±3260*** − 模型对照组 − 118200±4349 − 牡丹花酶解肽 250 71800±3718** 39.26 500 70538±4473*** 40.32 1000 70225±4093*** 40.59 注:与模型对照组比较,**P<0.01,***P<0.001。 黑色素抑制率(%)=S1−S0S1×100 式中:S1表示模型对照组的头部黑色素信号强度,像素;S0表示样品组的头部黑色素信号强度,像素。
1.3 数据处理
用SPSS26.0软件对实验数据进行统计学分析,实验结果表示为平均数±标准误差,根据单因素方差分析和Tukey检验标注各组间的统计学差异,其中P<0.05时认为在统计学上具备显著差异。
2. 结果与分析
2.1 牡丹花酶解肽的理化指标
2.1.1 分子量分布
由表1可知,牡丹花酶解肽的平均分子量为644 Da,且分子量<1000 Da的肽段占比高达97.82%,该结果说明牡丹花蛋白几乎全部被水解成小分子肽段。由于小分子肽段具有吸收率快、利用率高等优点,牡丹花酶解肽中高比例的小分子肽段预示其具有良好的生物活性[22]。
表 1 牡丹花酶解肽的分子量分布结果Table 1. Molecular weight distribution of peony flower enzymolysis peptide分子量范围 数均分子量
(Mn)重均分子量
(Mn)峰面积百分比
(波长220 nm,%)>10000 0 0 0 10000~5000 0 0 0 5000~3000 3536 3582 0.13 3000~2000 2437 2464 0.27 2000~1000 1280 1289 1.78 <1000 618 623 97.82 相对分子质量一万
以下所占比例100 2.1.2 蛋白质含量和氨基酸组成
经测定,牡丹花酶解肽的蛋白质含量为44.93%±2.92%(以干基计)。由表2可知,牡丹花酶解肽由15种氨基酸组成,总氨基酸含量为18.1440 g/100 g,包括成人必需的7种氨基酸(色氨酸未测)和儿童所需的组氨酸。通过计算支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)与芳香族氨基酸(苯丙氨酸和酪氨酸)的比值得到F值为2.74,接近玉米肽的指标(F值3.0~3.5),说明牡丹花酶解肽具有潜在的生物活性[23]。此外,牡丹花酶解肽的天冬氨酸的含量最高,为3.16 g/100 g,其次是谷氨酸,为1.97 g/100 g,较高的天冬氨酸和谷氨酸水平可通过转氨基和脱羧基等作用转化为其他物质,具有维持肠道健康、缓解氧化应激等作用[24−25]。牡丹花酶解肽中还含有一定水平的赖氨酸,约为氨基酸总量的4.8%,可作为赖氨酸缺乏的谷物的膳食补充剂。同时,赖氨酸还具有促进食欲、生长发育和治疗贫血等功能[26]。因此,牡丹花酶解肽是一种较好的氨基酸来源,可应用于多种功能性食品。
表 2 牡丹花酶解肽的氨基酸组成Table 2. Amino acid composition of peony flower enzymolysis peptide氨基酸名称 含量(g/100 g) 天冬氨酸 3.60±0.18g 谷氨酸 1.97±0.06f 丝氨酸 0.57±0.03a 组氨酸 0.72±0.08b 甘氨酸 1.22±0.05c 苏氨酸 0.50±0.05a 精氨酸 0.42±0.06a 丙氨酸 1.82±0.12ef 酪氨酸 0.74±0.03b 脯氨酸 ND 胱氨酸 ND 缬氨酸 1.38±0.10d 甲硫氨酸 0.48±0.04a 苯丙氨酸 0.86±0.06b 异亮氨酸 1.29±0.15cd 亮氨酸 1.70±0.09e 赖氨酸 0.88±0.06b 总氨基酸含量 18.14±1.25 F值 2.74 注:ND表示未检测出;不同字母表示各个氨基酸之间存在显著性差异,P<0.05。 2.2 牡丹花酶解肽的体外促进皮肤健康作用
2.2.1 对酪氨酸酶活性的影响
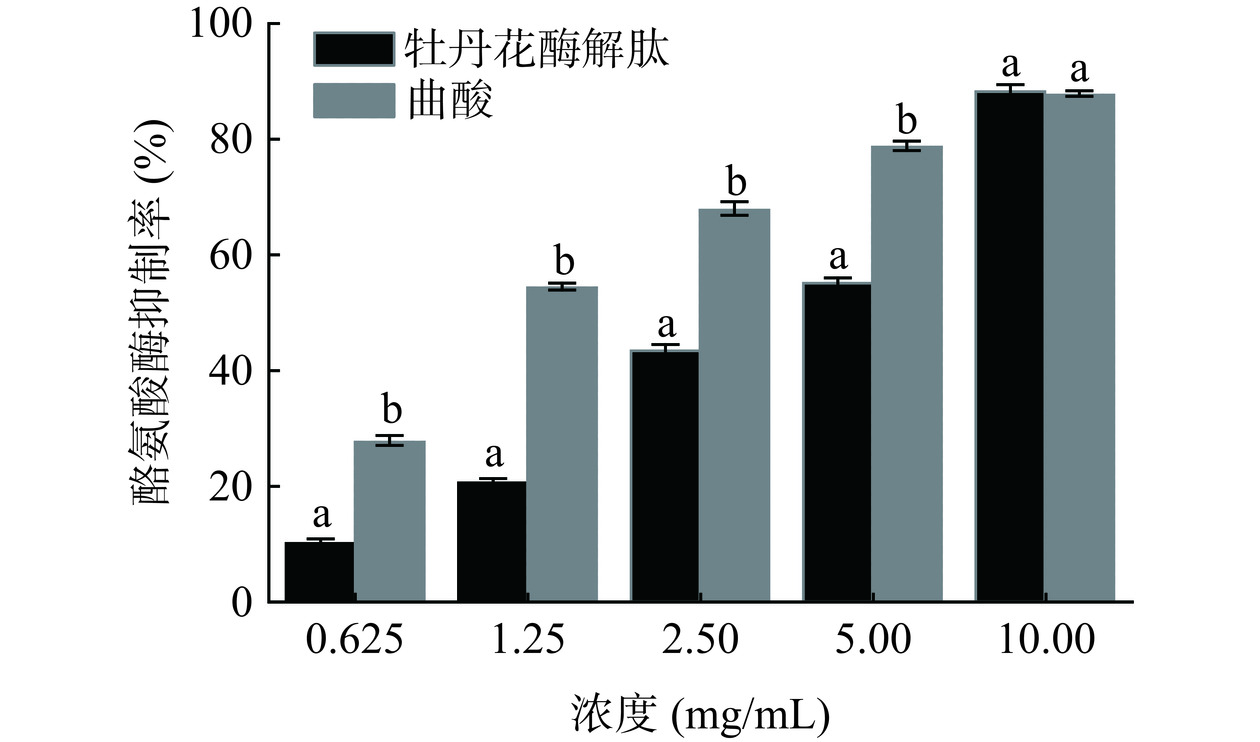
酪氨酸酶作为黑色素合成过程的关键酶,催化底物生成L-多巴,并进一步转化为L-多巴醌,最终形成黑色素。因此,通过测定牡丹花酶解肽对酪氨酸酶活性的抑制作用,可用于评估其抑制黑色素生成的能力,即美白活性[27]。由图1可知,浓度为0.625~10 mg/mL时,牡丹花酶解肽的酪氨酸酶抑制率介于10.14%和88.96%,并且随着浓度升高呈剂量效应。在浓度为10 mg/mL,牡丹花酶解肽的酪氨酸酶抑制率与阳性对照曲酸处于同一水平,说明牡丹花酶解肽具有良好的美白功效。同时,有研究表明多肽可作为美白类产品的重要原料,罗非鱼皮以及珍珠贝肉来源的活性肽均具有显著的酪氨酸酶抑制活性[28−29]。
2.2.2 对AGEs生成的影响
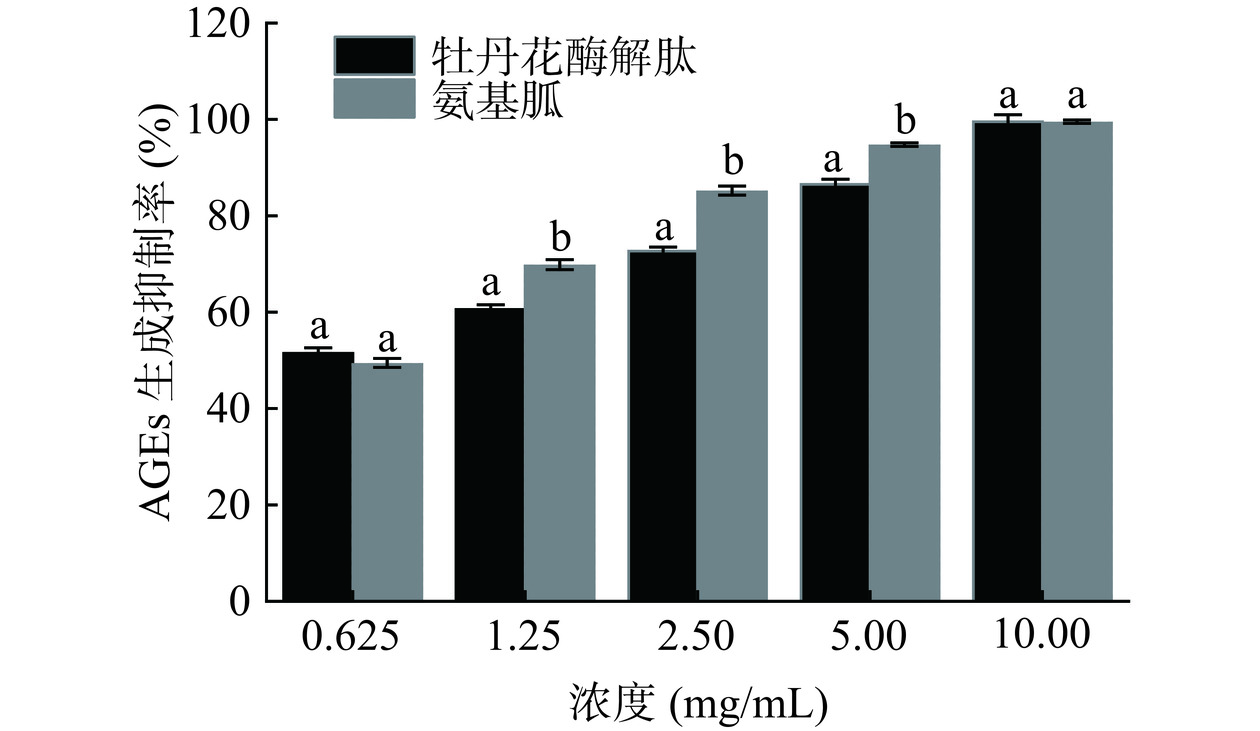
人体内过多的糖会与皮肤上的胶原蛋白和弹性蛋白产生美拉德反应,生成晚期糖基化终末产物(AGEs),造成皮肤变黄、暗沉,最终导致皮肤衰老,产生皱纹[30]。因此,通过测定牡丹花酶解肽对于AGEs生成的抑制效果,可以反映样品的抗皮肤衰老的活性。由图2可知,牡丹花酶解肽的AGEs生成的抑制活性随着浓度升高几乎呈线性增加,在10 mg/mL的浓度下,AGEs生成的抑制率高达99.50%,与阳性对照氨基胍不存在显著性差异,说明牡丹花酶解肽具有较高的抗糖化活性,在抗衰老产品中有很好的应用潜力。
2.2.3 对透明质酸酶活性的影响
透明质酸在皮肤中有强大的保水性能,而透明质酸酶是一种用于降解透明质酸的酶,从而使皮肤水分减少,导致皮肤出现弹性减少、皱纹增多等衰老现象[31−32]。从图3可知,牡丹花酶解肽的透明质酸酶抑制率较高,在10 mg/mL时达到60.43%,同时在0.625~10 mg/mL范围内呈浓度效应,且与同浓度的阳性对照色苷酸钠相比,表现出更显著的透明质酸酶抑制活性,说明牡丹花酶解肽在保湿类产品的应用方面有很大的开发价值和市场前景。
2.3 牡丹花酶解肽的体外抗氧化活性研究
2.3.1 对DPPH自由基清除能力的影响
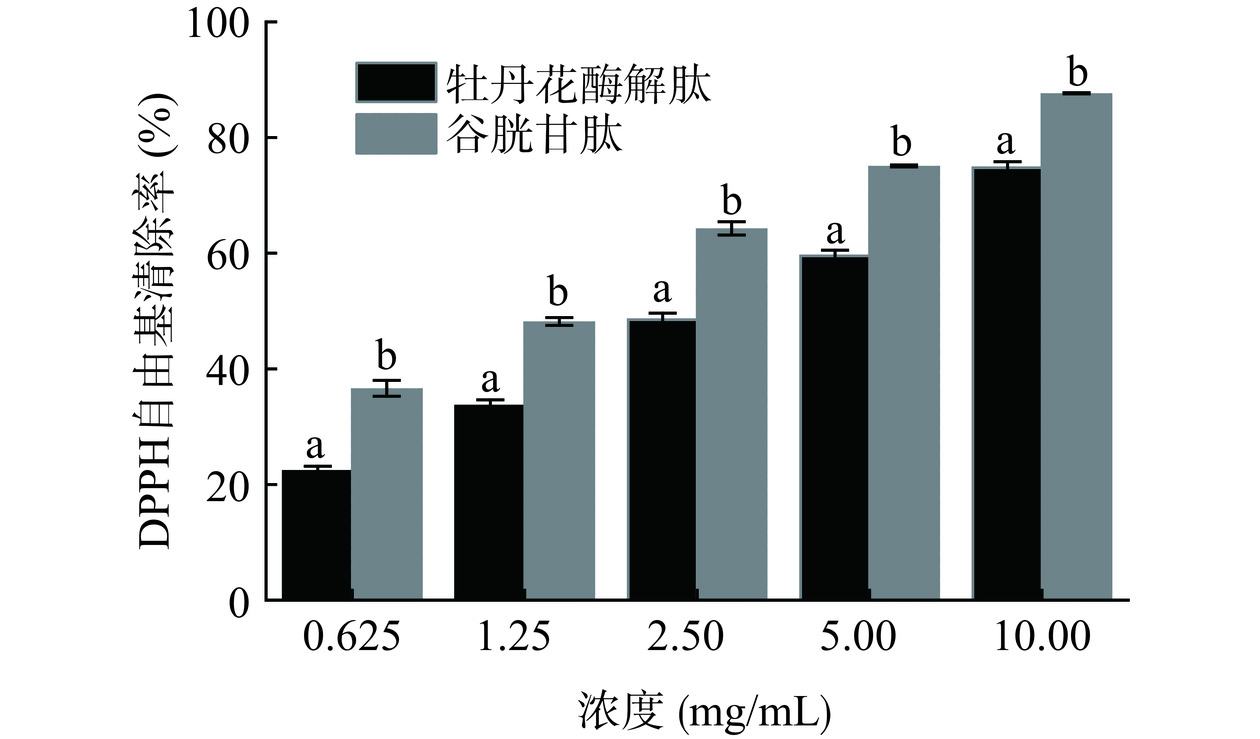
DPPH自由基可与抗氧化物质结合,降低其在517 nm处的吸收,因而常作为体外抗氧化活性的评价指标[33]。由图4可知,牡丹花酶解肽的DPPH自由基清除率与浓度的变化呈正相关,在10 mg/mL浓度下的清除率高达74.77%,且IC50值为4.32 mg/mL。而阳性对照谷胱甘肽的DPPH自由基清除率的IC50值为1.42 mg/mL。有研究称,多肽对于DPPH自由基的清除能力与疏水性氨基酸的多少有关[34]。而牡丹花酶解肽中含有较高水平的疏水性氨基酸,如亮氨酸和缬氨酸,解释了牡丹花酶解肽具有较高DPPH自由基清除率的原因。
2.3.2 对羟自由基清除能力的影响
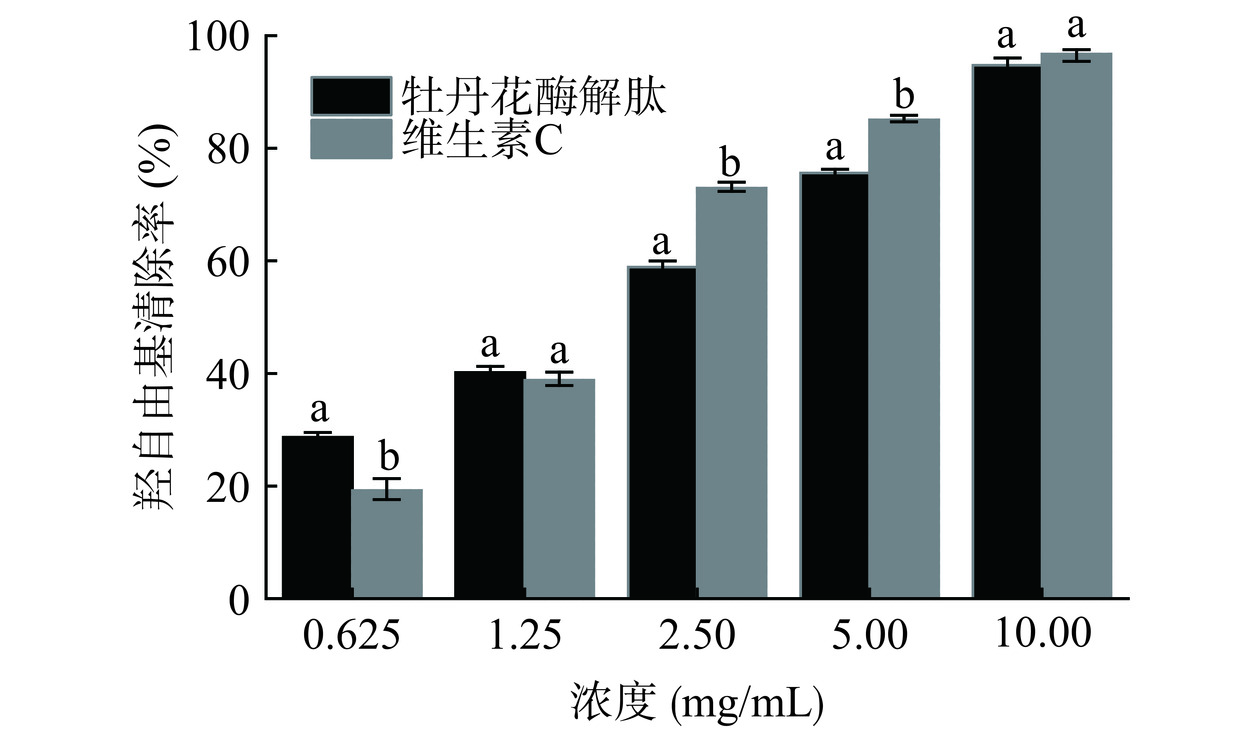
在众多自由基中,羟自由基的氧化性最强,因此对机体伤害最大,加快衰老过程。通过有效清除羟自由基,可维持机体正常生理活动[35]。由图5可知,牡丹花酶解肽的羟自由基清除率随浓度的增加而增强,且IC50值为2.43 mg/mL,而阳性对照组维生素C的IC50值为2.16 mg/mL,说明牡丹花酶解肽具有较高的羟自由基清除活性。有研究者发现多肽中亮氨酸、缬氨酸等疏水性氨基酸的增加,会导致多肽的羟自由基清除能力增强[36]。因此,牡丹花酶解肽的高羟自由基清除率可能与氨基酸组成中富含的亮氨酸和缬氨酸有关。
2.4 牡丹花酶解肽基于斑马鱼模型的黑色素抑制率测定
2.4.1 MTC结果
由表3可知,在本实验条件下,牡丹花酶解肽口服最大毒性剂量(MTC)为1000 μg/mL。因此,后续动物实验的浓度设置为250、500和1000 μg/mL。
2.4.2 对斑马鱼头部黑色素生成的影响
在明确了斑马鱼对于牡丹花酶解肽样品的最大耐受浓度后,进一步利用黑色素细胞刺激素诱导斑马鱼建立黑色素增加模型[37],以评估样品的口服美白功效。由表4和图6可知,在本实验条件下,与模型对照组相比,正常对照组的斑马鱼头部黑色素信号强度显著降低(P<0.001),说明造模成功。而当斑马鱼干预了不同浓度的牡丹花酶解肽后,斑马鱼头部黑色素沉积明显降低,且黑色素抑制率随着样品浓度的增加而增大,当样品浓度为1000 μg/mL时,黑色素抑制率达到40.59%。该结果说明牡丹花酶解肽具有良好的口服美白功效。斑马鱼与人体的基因有87%的同源性,且皮肤结构与人体相似,用于评价样品的美白活性具有较大优势[38]。此外,斑马鱼幼鱼透明,可在显微镜下直接观察其头部黑色素沉积,用于评估样品美白功效,简单直观[39]。
3. 结论
本研究通过对牡丹花酶解肽的体外酪氨酸酶抑制率(美白活性)、AGEs生成抑制率(抗糖化活性)、透明质酸酶抑制率以及抗氧化活性(DPPH自由基清除活性和羟自由基清除活性)进行测定,评估其促皮肤健康功效的影响。结果显示,牡丹花酶解肽在皮肤健康方面的促进作用与样品浓度呈正相关,当样品浓度为10 mg/mL时,酪氨酸酶抑制率为88.96%,AGEs生成抑制率为90.50%,透明质酸酶抑制率为60.43%,DPPH自由基清除率和羟自由基清除率分别为74.77%和94.74%。斑马鱼头部黑色素沉积模型结果表明,牡丹花酶解肽可有效抑制斑马鱼头部黑色素含量,且黑色素生成抑制率随着浓度增加而升高。当样品浓度为1000 μg/mL时,黑色素抑制率达到40.59%。因此,牡丹花酶解肽在美白、抗糖化、保湿以及抗氧化方面具有良好功效,有望作为化妆品或美容类食品的功能性原料。
-
表 3 牡丹花酶解肽对斑马鱼的毒性测试结果(n=30)
Table 3 Toxicity test results of peony flower enzymolysis peptide to zebrafish (n=30)
组别 浓度
(μg/mL)死亡数
(尾)死亡率
(%)表型 正常对照组 − 0 0 未见明显异常 模型对照组 − 0 0 未见明显异常 牡丹花酶解肽 125 0 0 与模型对照组状态相似 250 0 0 与模型对照组状态相似 500 0 0 与模型对照组状态相似 1000 0 0 与模型对照组状态相似 2000 0 0 较模型对照组状态严重 表 4 牡丹花酶解肽抑制斑马鱼头部黑色素生成的实验结果(n=10)
Table 4 Inhibition of melanin production in head of zebrafish by peony flower enzymolysis peptide (n=10)
组别 浓度(μg/mL) 头部黑色素信号强度
(像素,mean±SE)黑色素抑制率(%) 正常对照组 − 70854±3260*** − 模型对照组 − 118200±4349 − 牡丹花酶解肽 250 71800±3718** 39.26 500 70538±4473*** 40.32 1000 70225±4093*** 40.59 注:与模型对照组比较,**P<0.01,***P<0.001。 表 1 牡丹花酶解肽的分子量分布结果
Table 1 Molecular weight distribution of peony flower enzymolysis peptide
分子量范围 数均分子量
(Mn)重均分子量
(Mn)峰面积百分比
(波长220 nm,%)>10000 0 0 0 10000~5000 0 0 0 5000~3000 3536 3582 0.13 3000~2000 2437 2464 0.27 2000~1000 1280 1289 1.78 <1000 618 623 97.82 相对分子质量一万
以下所占比例100 表 2 牡丹花酶解肽的氨基酸组成
Table 2 Amino acid composition of peony flower enzymolysis peptide
氨基酸名称 含量(g/100 g) 天冬氨酸 3.60±0.18g 谷氨酸 1.97±0.06f 丝氨酸 0.57±0.03a 组氨酸 0.72±0.08b 甘氨酸 1.22±0.05c 苏氨酸 0.50±0.05a 精氨酸 0.42±0.06a 丙氨酸 1.82±0.12ef 酪氨酸 0.74±0.03b 脯氨酸 ND 胱氨酸 ND 缬氨酸 1.38±0.10d 甲硫氨酸 0.48±0.04a 苯丙氨酸 0.86±0.06b 异亮氨酸 1.29±0.15cd 亮氨酸 1.70±0.09e 赖氨酸 0.88±0.06b 总氨基酸含量 18.14±1.25 F值 2.74 注:ND表示未检测出;不同字母表示各个氨基酸之间存在显著性差异,P<0.05。 -
[1] 蔄茂强. 皮肤是健康的守护者[J]. 皮肤科学通报,2023,40(5):525−526. [MAN Maoqiang. Skin is the guardian of health[J]. Dermatology Bulletin,2023,40(5):525−526.] MAN Maoqiang. Skin is the guardian of health[J]. Dermatology Bulletin, 2023, 40(5): 525−526.
[2] 雷锐, 吴金峰. 皮肤衰老的特征与机制[J]. 实用老年医学,2023,37(10):978−983. [LEI Rui, WU Jinfeng. Characteristics and mechanisms of skin aging[J]. Practical Geriatrics,2023,37(10):978−983.] LEI Rui, WU Jinfeng. Characteristics and mechanisms of skin aging[J]. Practical Geriatrics, 2023, 37(10): 978−983.
[3] 陈佳欣. 核桃粕酪氨酸酶抑制肽制备、结构鉴定及其活性研究[D]. 北京:北京林业大学, 2019. [CHEN Jiaxin. Preparation, identification and activities of tyrosinase inhibitory peptide from walnut residue[D]. Beijing:Beijing Forestry University, 2019.] CHEN Jiaxin. Preparation, identification and activities of tyrosinase inhibitory peptide from walnut residue[D]. Beijing: Beijing Forestry University, 2019.
[4] 李亚会, 吉薇, 吉宏武, 等. 远东拟沙丁鱼蛋白多肽 (Sardinops sagax polypeptide) 的制备及其对酪氨酸酶的抑制作用[J]. 食品工业科技,2016,37(3):58−62,68. [LI Yahui, JI Wei, JI Hongwu, et al. Preparation of polypeptide from Sardinops sagax and its tyrosinase inhibitory activities[J]. Science and Technology of Food Industry,2016,37(3):58−62,68.] LI Yahui, JI Wei, JI Hongwu, et al. Preparation of polypeptide from Sardinops sagax and its tyrosinase inhibitory activities[J]. Science and Technology of Food Industry, 2016, 37(3): 58−62,68.
[5] 徐梅, 赵大洲, 王常青, 等. 具有酪氨酸酶抑制作用的豌豆多肽酶解工艺研究[J]. 食品工程,2022(3):30−34. [XU Mei, ZHAO Dazhou, WANG Changqing, et al. Study on enzymolysis process of pea polypeptide with tyrosinase inhibition[J]. Food Engineering,2022(3):30−34.] XU Mei, ZHAO Dazhou, WANG Changqing, et al. Study on enzymolysis process of pea polypeptide with tyrosinase inhibition[J]. Food Engineering, 2022(3): 30−34.
[6] 武亚琪, 琚海燕, 吕永钢. 天然胶原多肽及其护肤功效的研究进展[J]. 生物医学工程学杂志, 2022, 39(6):1254-1262. [WU Yaqi, JU Haiyan, LÜ Yonggang. Research progress of natural collagen peptides and its skincare efficacy[J]. 2022, 39(6):1254-1262.] WU Yaqi, JU Haiyan, LÜ Yonggang. Research progress of natural collagen peptides and its skincare efficacy[J]. 2022, 39(6): 1254-1262.
[7] 吕燕妮, 江志杰, 郭玉东. 丹凤牡丹花功能性成分及急性毒性的研究[J]. 食品安全质量检测学报,2018,9(9):2041−2044. [LÜ Yanni, JIANG Zhijie, GUO Yudong. Study on functional ingredients and acute toxicity of peony Danfeng[J]. Journal of Food Safety & Quality,2018,9(9):2041−2044.] LÜ Yanni, JIANG Zhijie, GUO Yudong. Study on functional ingredients and acute toxicity of peony Danfeng[J]. Journal of Food Safety & Quality, 2018, 9(9): 2041−2044.
[8] ZHAO M, WU S P. A review of the ethnobotany, phytochemistry and pharmacology of tree peony (Sect. Moutan)[J]. South African Journal of Botany,2019,124:556−563. doi: 10.1016/j.sajb.2019.05.018
[9] 关炳峰, 王法云, 周莉, 等. ‘香玉’牡丹花营养成分和抗氧化活性的分析与评价[J]. 中国食品添加剂,2022,33(8):180−188. [GUAN Bingfeng, WANG Fayun, ZHOU Li, et al. Analysis and evaluation of nutrient components and antioxidant activity in peony flower of 'Xiangyu'[J]. China Food Additives,2022,33(8):180−188.] GUAN Bingfeng, WANG Fayun, ZHOU Li, et al. Analysis and evaluation of nutrient components and antioxidant activity in peony flower of 'Xiangyu'[J]. China Food Additives, 2022, 33(8): 180−188.
[10] 李佩璇, 陈法志, 李秀丽, 等. 不同干燥方法对凤丹牡丹花营养成分含量及抗氧化活性的影响[J]. 湖北农业科学,2021,60(17):111−115,129. [LI Peixuan, CHEN Fazhi, LI Xiuli, et al. The effects of different drying methods on nutrient content and antioxidant activity of paeonia ostia ‘Fengdan’ flowers[J]. Hubei Agricultural Sciences,2021,60(17):111−115,129.] LI Peixuan, CHEN Fazhi, LI Xiuli, et al. The effects of different drying methods on nutrient content and antioxidant activity of paeonia ostia ‘Fengdan’ flowers[J]. Hubei Agricultural Sciences, 2021, 60(17): 111−115,129.
[11] 王建成. 丹凤牡丹花提取物及其制备方法和应用:中国, 202310499181.6[P]. 2023-07-28. [WANG Jiancheng. Danfeng peony flower extract, and its preparation method and application:China, 202310499181.6[P]. 2023-07-28.] WANG Jiancheng. Danfeng peony flower extract, and its preparation method and application: China, 202310499181.6[P]. 2023-07-28.
[12] 陈晨, 张焕新, 王海波, 等. 牡丹籽粕总黄酮提取工艺及其抗氧化活性研究[J]. 食品安全导刊,2022(34):121−125. [CHEN Chen, ZHANG Huanxin, WANG Haibo, et al. Study on extraction technology and antioxidant activity of total flavonoids from Peony seed meal[J]. China Food Safety,2022(34):121−125.] CHEN Chen, ZHANG Huanxin, WANG Haibo, et al. Study on extraction technology and antioxidant activity of total flavonoids from Peony seed meal[J]. China Food Safety, 2022(34): 121−125.
[13] 王俊朋, 张立攀, 胡桂芳, 等. 牡丹花黄酮的提取及对α-淀粉酶的抑制作用[J]. 食品科技,2022,47(1):196−202. [WANG Junpeng, ZHANG Lipan, HU Guifang, et al. Extraction and effect on inhibition of α-amylase of flavonoids from Peony flower[J]. Food Science and Technology,2022,47(1):196−202.] WANG Junpeng, ZHANG Lipan, HU Guifang, et al. Extraction and effect on inhibition of α-amylase of flavonoids from Peony flower[J]. Food Science and Technology, 2022, 47(1): 196−202.
[14] 赵海明, 闫乃芳. 一种牡丹花粉蛋白多肽及其制备方法与应用:中国,202211341265.9[P]. 2022-11-25. [ZHAO Haiming, YAN Naifang. The peony pollen protein polypeptide, and its preparation method and application:China,202211341265.9[P]. 2022-11-25.] ZHAO Haiming, YAN Naifang. The peony pollen protein polypeptide, and its preparation method and application: China, 202211341265.9[P]. 2022-11-25.
[15] 李杰, 胡良富. 牡丹多肽及制备方法和应用:中国, CN201410185874.9[P]. 2014-07-23. [LI Jie, HU Liangfu. Peony polypeptide, and its preparation method and application:China, CN201410185874.9[P]. 2014-07-23.] LI Jie, HU Liangfu. Peony polypeptide, and its preparation method and application: China, CN201410185874.9[P]. 2014-07-23.
[16] 刘淑芸, 申传龙, 孙汉巨, 等. 牡丹籽粕多肽的酶解制备工艺及其抗氧化性[J]. 食品与营养科学,2022(4):255−268. [LIU Shuyun, SHEN Chuanlong, SUN Hanjü, et al. Study on preparation process and antioxidant activity of polypetide prepared by enzymes from Peony seed meal[J]. Journal of Food and Nutrition Science,2022(4):255−268.] LIU Shuyun, SHEN Chuanlong, SUN Hanjü, et al. Study on preparation process and antioxidant activity of polypetide prepared by enzymes from Peony seed meal[J]. Journal of Food and Nutrition Science, 2022(4): 255−268.
[17] 胡大强, 侯丽娜, 傅若秋, 等. 白芷提取分离物体外对酪氨酸酶的抑制作用[J]. 中国药师,2012,15(4):457−459. [HU Daqiang, HOU Lina, FU Ruoqiu, et al. Inhibit on extracts from angelica dahurica on tyrosinase in vitro[J]. China Pharmacist,2012,15(4):457−459.] HU Daqiang, HOU Lina, FU Ruoqiu, et al. Inhibit on extracts from angelica dahurica on tyrosinase in vitro[J]. China Pharmacist, 2012, 15(4): 457−459.
[18] ZHAO Y, ZHANG T R, NING Y Z, et al. Identification and molecular mechanism of novel tyrosinase inhibitory peptides from the hydrolysate of 'Fengdan' peony (Paeonia ostii) seed meal proteins:Peptidomics and in silico analysis[J]. LWT- Food Science & Technology,2023(180):114695.
[19] 周慧吉, 李廷钊, 李波. 多模型评价槐花水提物的抗糖化作用及其活性成分研究[J]. 食品工业科技,2023,44(5):371−379. [ZHOU Huiji, LI Tingzhao, LI Bo. Multi-model evaluation of anti-glycation effects of Sophora japonica flowers aqueous extract and its active components analysis[J]. Science and Technology of Food Industry,2023,44(5):371−379.] ZHOU Huiji, LI Tingzhao, LI Bo. Multi-model evaluation of anti-glycation effects of Sophora japonica flowers aqueous extract and its active components analysis[J]. Science and Technology of Food Industry, 2023, 44(5): 371−379.
[20] 刘丽君, 岳虹, 宁月莲, 等. 分光光度法测定原料中透明质酸钠的含量[J]. 饮料工业,2023,26(1):18−21. [LIU Lijun, YUE Hong, NING Yuelian, et al. Determination of sodium hyaluronate in raw materials by spectrophotometry[J]. Beverage Industry,2023,26(1):18−21.] LIU Lijun, YUE Hong, NING Yuelian, et al. Determination of sodium hyaluronate in raw materials by spectrophotometry[J]. Beverage Industry, 2023, 26(1): 18−21.
[21] SHEN JY, XU J H, YE S B, et al. Hydroxyl radical-scavenging activity-guided extraction of peptides from oviductus ranae[J]. American Journal of Biochemistry and Biotechnolog,2021,17(4):361−372. doi: 10.3844/ajbbsp.2021.361.372
[22] SHIMIZU J, ASAMI N, KATAOKA A, et al. Oral collagen-derived dipeptides, prolyl-hydroxyproline and hydroxyprolyl-glycine, ameliorate skin barrier dysfunction and alter gene expression profiles in the skin[J]. Biochem Biophys Res Commun,2015,456(2):626−630. doi: 10.1016/j.bbrc.2014.12.006
[23] 黄百祺, 黄创成, 吴巨贤, 等. 4种龟肉酶解液的氨基酸及呈味特性比较[J]. 食品研究与开发,2021,42(8):12−17. [HUANG Baiqi, HUANG Chuangcheng, WU Jüxian, et al. Comparison of amino acids and taste characteristics in four kinds of emydidae meat enzymatic hydrolysate[J]. Food Research and Development,2021,42(8):12−17.] HUANG Baiqi, HUANG Chuangcheng, WU Jüxian, et al. Comparison of amino acids and taste characteristics in four kinds of emydidae meat enzymatic hydrolysate[J]. Food Research and Development, 2021, 42(8): 12−17.
[24] DENG Y K, CHENG H, LI J Y, et al. Effects of glutamine, glutamate, and aspartate on intestinal barrier integrity and amino acid pool of the small intestine in piglets with normal or low energy die[J]. Frontiers in Veterinary Scienc,2023,10:1202369. doi: 10.3389/fvets.2023.1202369
[25] CHEN S, WU X, DUAN J L, et al. Low-protein diets supplemented with glutamic acid or aspartic acid ameliorate intestinal damage in weaned piglets challenged with hydrogen peroxide[J]. Animal Nutrition,2021,7(2):356−364. doi: 10.1016/j.aninu.2020.12.005
[26] 田颖, 时明慧. 赖氨酸生理功能的研究进展[J]. 美食研究,2014,31(3):60−64. [TIAN Ying, SHI Minghui. Research progress on physiological functions of lysine[J]. Journal of Researches on Dietetic Science and Culture,2014,31(3):60−64.] TIAN Ying, SHI Minghui. Research progress on physiological functions of lysine[J]. Journal of Researches on Dietetic Science and Culture, 2014, 31(3): 60−64.
[27] YU Q, FAN L P, DUAN Z H. Five individual polyphenols as tyrosinase inhibitors:Inhibitory activity, synergistic effect, action mechanism, and molecular docking[J]. Food Chemistry,2019,297:124910. doi: 10.1016/j.foodchem.2019.05.184
[28] 宋玉琼, 胡晓, 相欢, 等. 罗非鱼皮胶原肽的酪氨酸酶抑制活性与铜离子结合活性研究[J]. 南方水产科学, 2023, 19(1):155−164. [SONG Yuqiong, HU Xiao, XIANG Huan, et al. Study on tyrosinase inhibitory activity and Cu2+ binding activity of tilapia.skin peptides[J]. South China Fisheries Science, 2023, 19(1):155−164.] SONG Yuqiong, HU Xiao, XIANG Huan, et al. Study on tyrosinase inhibitory activity and Cu2+ binding activity of tilapia.skin peptides[J]. South China Fisheries Science, 2023, 19(1): 155−164.
[29] 黄潘钿, 陈冰冰, 沈金鹏, 等. 珍珠贝肉抗氧化肽制备工艺优化及其对酪氨酸酶的抑制活性[J]. 现代食品科技, 2022, 38(4):52−61. [HUANG Pantian, CHEN Bingbing, SHEN Jinpeng, et al. Preparation process optimization for the antioxidant peptide from Pinctada martensii meat and its tyrosinase inhibitory activity[J]. Modern Food Science and Technology, 2022, 38(4):52−61.] HUANG Pantian, CHEN Bingbing, SHEN Jinpeng, et al. Preparation process optimization for the antioxidant peptide from Pinctada martensii meat and its tyrosinase inhibitory activity[J]. Modern Food Science and Technology, 2022, 38(4): 52−61.
[30] LEE K H, NG Y P, CHEAH P S, et al. Molecular characterization of glycation-associated skin ageing:an alternative skin model to study in vitro antiglycation activity of topical cosmeceutical and pharmaceutical formulations[J]. British Journal of Dermatology,2017,176(1):159−167. doi: 10.1111/bjd.14832
[31] SONG J H, AN E J, SUNG C Y, et al. A comparative study on a biodegradable hyaluronic acid microneedle patch with a needleless patch for dry skin in atopic dermatitis:A single-blinded, split-body, randomized controlled trial[J]. Archives of Dermatological Research,2023,315(3):569−581.
[32] RATAJCZAK P, MACIEJAK O, KOPCIUCH D, et al. Directions of hyaluronic acid application in cosmetology[J]. 2023, 22(3):862−871.
[33] ENDRIS M H, SISAY A E. In vitro antioxidant and free-radical scavenging activities of polar leaf extracts of Vernonia amygdalina[J]. BMC Complementary Medicine and Therapies,2023,23(1):146. doi: 10.1186/s12906-023-03923-y
[34] 于丽娜, 孙杰, 刘少芳, 等. 花生抗氧化水解产物制备及其抗氧化活性研究[J]. 核农学报,2013(2):188−196. [YU Linna, SUN Jie, LIU Shaofang, et al. Preparation and antioxidant activities of peanut antioxidant hydrolysate[J]. Journal of Nuclear Agricultural Sciences,2013(2):188−196.] YU Linna, SUN Jie, LIU Shaofang, et al. Preparation and antioxidant activities of peanut antioxidant hydrolysate[J]. Journal of Nuclear Agricultural Sciences, 2013(2): 188−196.
[35] XIA S T, WEI Z Y, KONG X N, et al. Antioxidative properties of bayberry tannins with different mean degrees of polymerization:Controlled degradation based on hydroxyl radicals[J]. Food Research International,2022,162:112078. doi: 10.1016/j.foodres.2022.112078
[36] 包怡红, 李雪龙, 徐思源, 等. 乳清蛋白肽的制备及羟自由基的清除作用[J]. 中国乳品工业,2006(8):23−26. [BAO Yihong, LI Xuelong, XU Siyuan, et al. Preparation of whey polypeptides and its effects on scavenging hydroxyl radicals[J]. China Dairy Industry,2006(8):23−26.] BAO Yihong, LI Xuelong, XU Siyuan, et al. Preparation of whey polypeptides and its effects on scavenging hydroxyl radicals[J]. China Dairy Industry, 2006(8): 23−26.
[37] 郑丹阳, 徐梦漪, 李淑敏, 等. 斑马鱼模型在化妆品功效评价研究中的应用进展[J]. 中国实验动物学报,2023,31(4):541−548. [ZHENG Danyang, XU Mengyi, LI Shumin, et al. Progress of the application of zebrafish models in the study of the efficacy of functional cosmetics[J]. Acta Laboratorium Animalis Scientia Sinica,2023,31(4):541−548.] ZHENG Danyang, XU Mengyi, LI Shumin, et al. Progress of the application of zebrafish models in the study of the efficacy of functional cosmetics[J]. Acta Laboratorium Animalis Scientia Sinica, 2023, 31(4): 541−548.
[38] 王奇, 延在昊, 何泉泉. 斑马鱼模型在化妆品研究中的应用[J]. 日用化学品科学,2014,37(12):29−33. [WANG Qi, YAN Zaihao, HE Quanquan. Application of zebrafish in the research of cosmetic[J]. Detergent & Cosmetics,2014,37(12):29−33.] WANG Qi, YAN Zaihao, HE Quanquan. Application of zebrafish in the research of cosmetic[J]. Detergent & Cosmetics, 2014, 37(12): 29−33.
[39] 郭胜亚, 朱晓宇, 周佳丽, 等. 斑马鱼在功能性食品研究中的应用进展[J]. 中国实验动物学报,2020,28(1):143−147. [GUO Shengya, ZHU Xiaoyu, ZHOU Jiali, et al. Application of zebrafish in functional food research[J]. Acta Laboratorium Animalis Scientia Sinica,2020,28(1):143−147.] GUO Shengya, ZHU Xiaoyu, ZHOU Jiali, et al. Application of zebrafish in functional food research[J]. Acta Laboratorium Animalis Scientia Sinica, 2020, 28(1): 143−147.





 下载:
下载:

 下载:
下载:



