Antigenicity, Solubility and Digestibility of β-Lactoglobulin Combined with Different Plant Polyphenols
-
摘要: 为开发低致敏乳蛋白新型加工技术,基于植物多酚与蛋白互作机制,探究了多酚结合对消减β-乳球蛋白致敏性的生物学作用,初步分析其在低敏乳蛋白制备上的潜在应用性。研究选择了茶叶渣、桑椹果渣、龙眼壳、龙眼核、葡萄籽、葡萄果渣6种农副产品原料,分别提取多酚,并采用不同的结合方式(非共价、碱法、酶法)与β-乳球蛋白构建复合物。体外致敏检测(酶联免疫吸附试验、蛋白印迹试验)结果表明,6种植物多酚在碱法和酶法条件下均能一定程度消减β-乳球蛋白的抗原性,其中基于碱法的龙眼壳、龙眼核多酚抑制效果最好,抗原性抑制率均值分别为:76.8%、77.2%。经液质联用分析,在龙眼壳/核多酚中,柯里拉京、鞣花酸等没食子类单宁是优势单体多酚。此外,通过凝胶电泳试验观察到,6种植物多酚会引发蛋白间不同程度的交联聚合现象,形成二聚体或多聚体。除茶渣多酚外,酶法结合所得其余5种多酚-β-LG复合物的水溶解度均低于其各自的碱法和非共价结合复合物。除碱法条件下的葡萄果渣多酚,其余多酚在不同反应条件下并未显著改变原始蛋白的总体消化性。综合判断,龙眼壳/核多酚是适用于β-乳球蛋白致敏消减的植物多酚类型。Abstract: Plant polyphenols were exploited in this research to reduce the antigenicity of β-lactoglobulin based on their mutual interaction (physical combination), in an effort to evaluate its potential on the application of new technics to fabricate hypoallergenic lactoproteins. In this study, non-covalent, alkaline, and enzymatic methods, were adopted to construct the complex or conjugated compounds of β-lactoglobulin combined by plant phenolic extracts from tea residue, mulberry pomace, longan pericarp, longan seed, grape seed and grape pomace. By means of the determination of allergenicity in vitro (through enzyme linked immunosorbent assay and immunoblotting), the six kind of plant polyphenols extracts could reduce the antigenicity (specific IgG binding capacity) of β-lactoglobulin to different extents (under alkaline and enzymatic treatment), in which longan pericarp and seed polyphenols exhibited the best (the mean of antigenic inhibition rate: 76.8%, 77.2%, respectively). Meanwhile, liquid chromatography coupled with tandem mass spectrometry indicated that gallic acid unit-based tannins (or acids), such as corilagin and ellagic acid, were dominant polyphenols in longan pericarp/seed extracts. In addition, gel electrophoresis revealed that six extracts induced aggregation between proteins, forming dimers or polymers. The solubility of the complexes or adducts constructed via enzymatic catalytic process was lower than the corresponding compounds built by non-covalent or alkaline methods (except for tea residue polyphenols group). Nonetheless, most of the extracts did not apparently affect the in vitro global digestibility of the protein, apart from the grape pomace treatment under alkaline condition. Taken the results of desensitization efficiency and functionality and digestibility into account, this study could preliminarily conclude that phenols stemmed from longan pericarp and seed might be the suitable materials in suppressing the allergenicity of β-lactoglobulin.
-
Keywords:
- plant polyphenols /
- β-lactoglobulin /
- desensitization /
- solubility /
- digestibility /
- polyphenol composition
-
乳蛋白过敏(cow milk protein allergy,CMPA)是食品安全中的重要风险因素之一,近20年的流行性病学调查显示国内2岁以下幼儿的CMPA发病率已从1.6%上升至5.7%[1]。另外,仍有少量青少年和成人对乳蛋白会产生过敏反应。在乳蛋白组分中,β-乳球蛋白(β-LG)是最主要的致敏原,约有82%的CMPA体质者对β-LG易感[2]。除避食、诱导免疫耐受等方式,在乳品工业生产中更多是采用对乳蛋白作改性处理,如酶解搭配超滤膜过滤、高温、高压、糖基化/聚乙二醇修饰等[3−4],破坏/改变其抗原表位,进而削弱致敏蛋白的免疫反应性。但这些加工方法可能衍生出一些负面效果,例如:营养价值损失、风味以及功能特性变化、热副产物的潜在毒性问题等[5]。近些年来,植物多酚与食物营养互作逐渐成为研究热点。因其绿色、安全、健康等优势特征,被认为在乳品加工学领域有广泛的应用价值。
现今有关植物多酚发挥降敏或抗敏的作用大体可分为两个途径:多酚通过调节免疫程序或控制应答水平实现抗过敏的生物效果;多酚通过屏蔽/改变核心表位实现对抗原致敏性的消减。前者,倾向于食物过敏发生后的免疫治疗或症状缓解[6−8];后者,则是从源头阻断过敏反应的发生以确保食源安全性。因此,相关的食物脱敏研究大多围绕多酚与致敏蛋白的互作使两者形成复合物而展开。其中,最常使用的单体多酚包括酚酸类(咖啡酸、绿原酸、阿魏酸等)、黄酮类(花青素及糖苷、槲皮素、儿茶素及衍生物等)、单宁类(水解单宁、原花青素)[9],以及使用水果(如:蔓越莓、蓝莓、樱桃、苹果等)[10−13]和茶叶的多酚提取物[14]。植物多酚既可以在体内降低sIgE或sIgG的血清相对浓度[15],也可以在体外试验中抑制特异性抗体与抗原蛋白的结合[9−14]。然而,也不乏有试验呈现相反的数据结果,即多酚的络合会提高原始蛋白的抗原性[16]。这可能是源于检测方法的差异,还有可能是酚类选择、结合方式或反应条件的不同。
本研究选择了农副产品作为多酚(总酚)提取来源。经对比,茶叶渣、桑椹果渣、龙眼壳、龙眼核、葡萄籽和葡萄果渣因多酚含量较高,且多酚化合物类型各有差异[17−18],故而被初定为本试验不同的植物原料。在此基础上,系统性比较不同结合方式(非共价、碱法、酶法)所构建的酚-β-LG复合物的体外致敏性,并结合水溶性和模拟胃肠消化度试验,以期初步筛选出适用于有效降低β-LG抗原性的植物源多酚类型。同时,对上述6种植物多酚进行组分鉴定,为验证和明确发挥致敏消减作用的主效单体酚提供前期试验基础。
1. 材料与方法
1.1 材料与仪器
β-乳球蛋白(β-LG)(纯度≥90%)、胃蛋白酶(≥250 U/mg)、漆酶(≥0.5 U/mg) 购自美国Sigma公司;重组霍乱毒素B亚基(CT)、特超敏ECL化学发光试剂盒、TMB显色液 购自碧云天生物技术有限公司;没食子酸标准品(GAE)、AB-8大孔树脂 购自上海源叶生物科技有限公司;胰酶(美国药典) 购自BBI生命科学有限公司;二抗(羊抗小鼠IgG) 购自北京博奥森生物技术有限公司;三氯乙酸(TCA) 购自天津市大茂化学试剂厂;新鲜水果(“大十”果桑、“红提”葡萄、“泰国”龙眼)、茶叶(“龙井”绿茶) 市购;健康雌性BALB/c小鼠 85只,3周龄,SPF级,体重16.4±1.41 g,购买于南方医科大学(许可证号:SYXK粤2020-0149,动物福利伦理审查批文号:2022-SC-11)。
Kjeltec8400蛋白质分析仪 丹麦Foss公司;Gel Doc Go凝胶成像仪、Universal Hood II多功能成像仪 美国BioRad公司;Synergy H1酶标仪 美国BioTek仪器有限公司;SCIEX TripleTOF® 6600+质谱仪 美国SCIEX公司。
1.2 实验方法
1.2.1 样品处理
将果桑、葡萄分别榨汁收集果渣获取桑椹果渣、葡萄果渣;葡萄、龙眼分别手剥获取葡萄籽、龙眼核、龙眼壳;茶叶泡开6 h后收集茶渣。将获取的原料进行冷冻干燥后打粉,备用。
1.2.2 多酚粗提液的制备
参照范智义等[19]、Rangkadilok等[20]方法,通过以下步骤分别粗提不同样品的多酚粗提液:
桑椹果渣粉末→料液比(70%乙醇溶液)1:20(w:v)→200 W超声浸提→抽滤→浸提液真空旋转蒸发浓缩→桑椹果渣多酚粗提液。
葡萄果渣粉末→料液比(60%乙醇溶液)1:20(w:v)→220 W超声浸提→抽滤→浸提液真空旋转蒸发浓缩→葡萄果渣多酚粗提液。
葡萄籽粉末→石油醚按10:1(L/g)的液料比进行浸提脱脂→料液比(60%乙醇溶液)1:10(w:v)→220 W超声浸提→抽滤→浸提液真空旋转蒸发浓缩→葡萄籽多酚粗提液。
龙眼壳、龙眼核粉末→料液比(40%乙醇溶液)1:10(w:v)→230 W超声浸提→抽滤→浸提液真空旋转蒸发浓缩→龙眼壳、龙眼核多酚粗提液。
茶渣粉末→料液比(70%乙醇溶液)1:20(w:v)→200 W超声浸提→抽滤→浸提液真空旋转蒸发浓缩→茶渣多酚粗提液。
1.2.3 多酚纯化
树脂预处理:用95%乙醇浸泡活化AB-8大孔树脂24 h,活化后的大孔树脂填柱,并用去离子水冲洗大孔树脂至无醇味,然后分别用酸碱各浸泡8 h,再用去离子水洗至滤液pH为中性,备用。
样品制备:把6种多酚粗提液倒入上述大孔树脂柱中,用去离子水冲洗去除多糖等杂质,最后用80%乙醇洗脱,并以50 ℃旋蒸挥发乙醇。采用30 kD超滤后收集滤过液,即为本试验中使用的多酚提取液。
1.2.4 总酚含量的测定
参照许海棠等[21]的测定方法,采用福林酚法测定样品中的总酚含量:首先以没食子酸作为标准品制作标准曲线(浓度为0.004、0.008、0.012、0.016、0.020、0.024 mg GAE/mL),然后用紫外分光光度计在765 nm波长下测定标品和上述6种植物多酚提取液样品的吸光值。计算出6种植物多酚含量(mg GAE/g),没食子酸标准曲线方程:y=34.955x+0.0015,R2=0. 9997,并用超纯水将其终浓度调为一致。
总酚含量(mgGAE/g)=c×V×Nm 式中,c:根据标准曲线算出的样品浓度(mg/mL);V:样品稀释体积(mL);N:稀释倍数;m:原料干重质量(g)。
1.2.5 UPLC-Q-TOF-MS鉴定植物多酚单体组分
色谱条件:Waters ACQUITY UPLC BEH C18柱,PDA检测器,波长为280 nm,柱温35 ℃,进样体积为3 μL,流速0.3 mL/min,流动相A为体积分数0.1%甲酸,流动相B为甲醇。梯度洗脱条件:0~3 min(A:95%~80%),3~8 min(A:80%),8~12 min(A:80%~70%),12~13 min(A:70%~60%),13~15 min(A:60%),15~17 min(A:60%~50%),17~19 min(A:50%~20%),19~22 min(A:20%~95%)[22]。
质谱条件:离子方式ESI−,离子源喷雾气55 psi,离子源辅助加热气55 psi,离子源气帘气35 psi,离子源温度550 ℃,离子化电压−4500 V,扫描范围m/z 100~1000。使用SCIEX OS软件Analytics工作模块选择Non-targeted screening,搜索Naturral Products HR-MSMS Spectral Library 1.1 with License 进行数据分析。
1.2.6 致敏小鼠模型建立及抗体效价检测
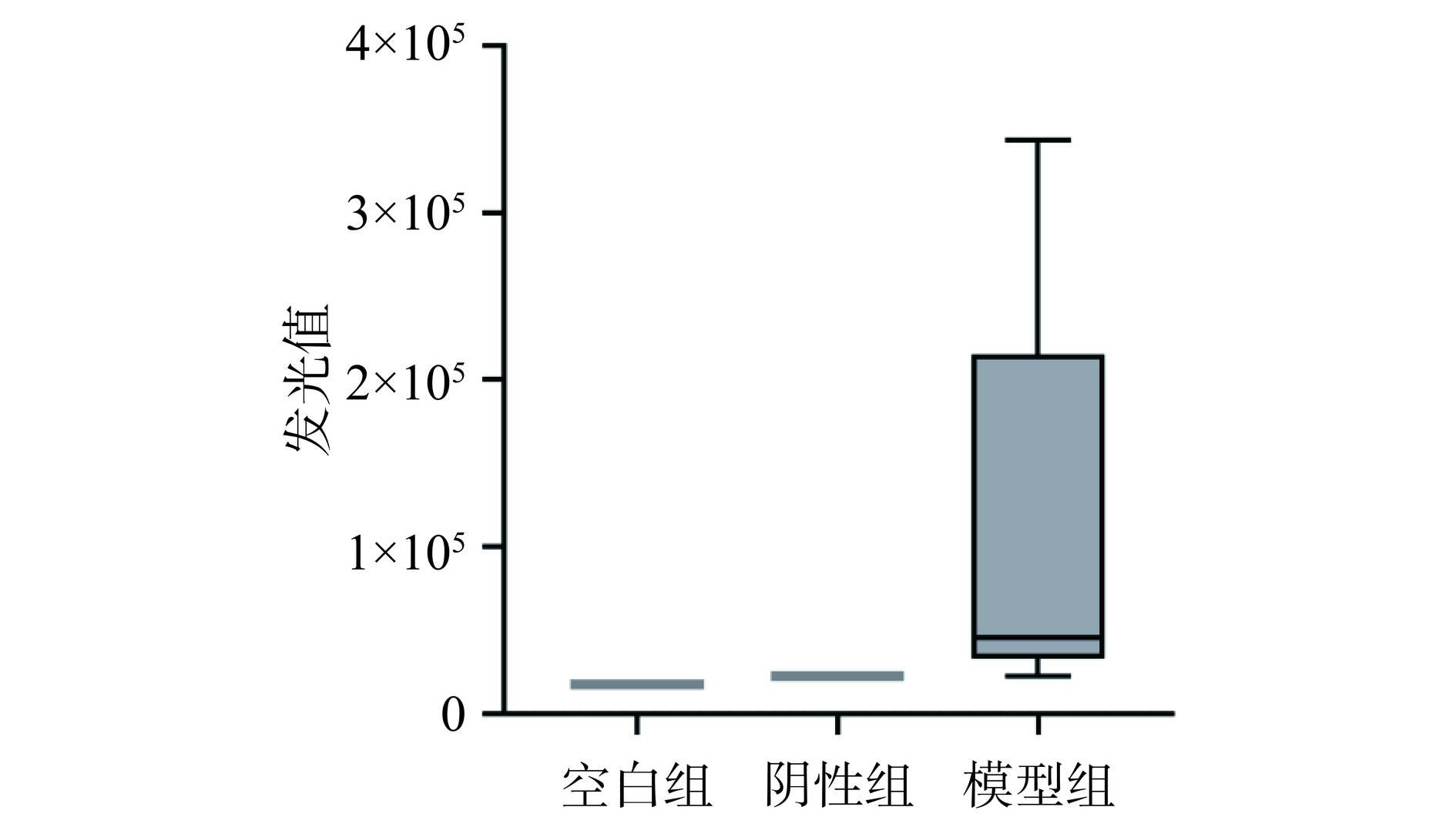
参照Smith等[23]的建模方法采取随机分组方法,将小鼠分设空白组(6只)、阴性组(6只)和模型组(73只)。模型组BALB/c小鼠在第1 d腹腔注射1 mg β-LG(0.2 mL);之后以7 d为间隔灌胃1 mg β-LG(0.2 mL),共4次,使其基础致敏。阴性组只灌胃10 μg CT(0.2 mL,灌胃频次与模型组相同)。空白组只灌胃0.2 mL的生理盐水(灌胃频次与模型组相同)。到42 d时,将每只小鼠都灌胃50 mg β-LG(0.2 mL)。然后在0.5 h内处死小鼠,采集血液并分离血清,备用。空白组、阴性组分别是实验的对照组,由于这两组的小鼠数量少,因此将同组别的小鼠血清混合使用,检测其抗体效价。
采用间接ELISA方法检测样品血清中β-LG-sIgG的含量,每孔加入100 μL β-LG蛋白溶液(30 μg/mL)包板(使用ELISA包被液),放4 ℃过夜;洗板,接着加封闭液,室温封闭1 h,结束后吸去封闭液。每孔加入小鼠血清100 μL,室温孵育1.5 h,洗板。加入稀释的羊抗小鼠IgG-HRP 100 μL,室温孵育1.5 h,洗板。加化学发光显色工作液100 μL,在室温下避光1 min,使用多功能酶标仪在425 nm波长下记录读数,即为抗体效价(发光值越大,特异血清多抗含量越高,体现为小鼠的过敏反应越强烈)。
1.2.7 多酚-β-LG复合物的制备
1.2.7.1 非共价结合
将不同植物多酚分别按照摩尔比2:1的比例与β-LG溶液(2 mg/mL)混合,pH7.0,30 ℃水浴振荡孵育16 h,8 kD透析3次,4 ℃备用。
1.2.7.2 碱法结合
将不同植物多酚分别按照摩尔比2:1的比例与β-LG溶液(2 mg/mL)混合,并将pH调至8.0,30 ℃水浴振荡孵育16 h,8 kD透析3次,4 ℃备用。
1.2.7.3 酶法结合
将不同植物多酚溶液分别与漆酶混合(漆酶终活力浓度为15 U/mL),预先室温反应2 h;然后,将上述样品按照酚/蛋白摩尔比2:1与β-LG溶液(2 mg/mL)混合,把pH调至6.0,30 ℃水浴振荡14 h,8 kD透析3次,4 ℃备用。
1.2.8 蛋白印迹试验(Western Blotting,WB)
上述制备的6种植物多酚-β-LG复合物样品溶液与非变性非还原性蛋白上样缓冲液(4:1)混合,进行非变性聚丙烯酰胺凝胶电泳(native PAGE)。电泳结束后,将分离胶上的蛋白通过湿转法转移到0.2 μm孔径的聚偏二氟乙烯(PVDF)膜上。转膜结束后,用封闭液封闭1.5 h。加入过敏小鼠血清(1:1500稀释),置于摇床室温孵育1 h 45 min;用洗涤液洗4遍(75 r/min)。接着用HRP标记的“羊抗小鼠IgG”二抗(1:20000稀释),置于摇床室温孵育1 h;洗涤液洗4遍(75 r/min)。最后使用特超敏ECL化学发光试剂盒制备发光工作液,在多功能成像仪进行曝光检测。使用Image J 1.52软件分析条带灰度,并计算多酚对β-LG抗原性抑制率(%)。
多酚对β-LG抗原性抑制率(%)=(1−酚蛋白复合物条带灰度纯蛋白条带灰度)×100 1.2.9 酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)
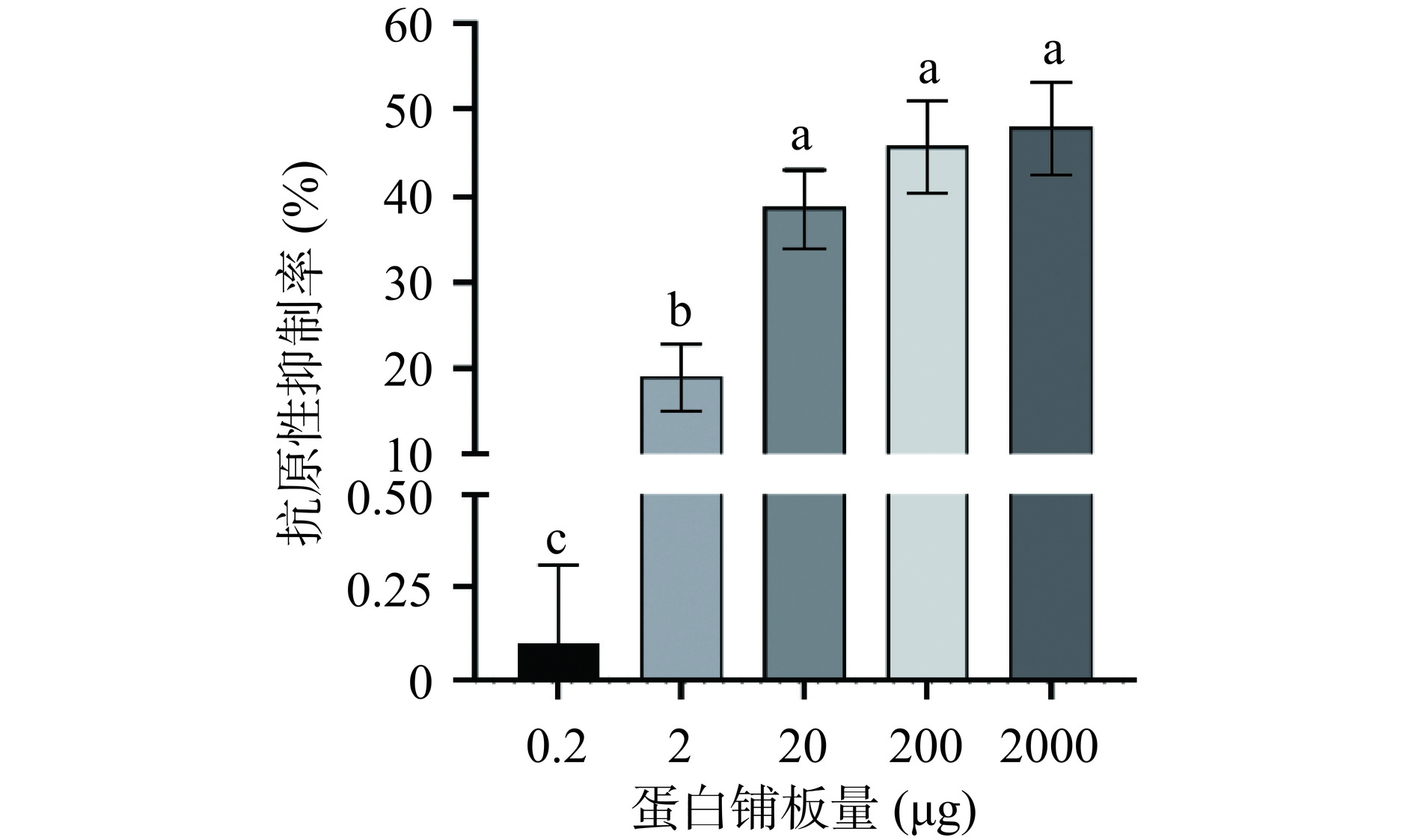
采用间接法ELISA测定多酚对β-LG抗原性的影响。摸索β-LG合适的包板量(0.2、2、20、200和2000 μg)。
确定β-LG铺板量为20 μg后,将100 μL的0.2 mg/mL β-LG蛋白溶液包被铺板;4 ℃过夜孵育后洗板3次。而后各组的酶标板孔内加入不同的多酚溶液150 μL,其中碱法先将酚溶液pH调至8.0,酶法则先将酚与漆酶室温反应2 h(pH6.0)并离心取上清后加入孔内,多酚:蛋白摩尔比为2:1,室温孵育3 h。洗板3次,加入封闭液孵育1 h。结束后吸去封闭液,每孔加入小鼠血清100 μL,室温孵育1.5 h,洗板。加入稀释的羊抗小鼠IgG-HRP 100 μL,室温孵育1.5 h,洗板。每孔加TMB底物显色工作液200 μL,在室温下避光孵育10 min,使用多功能酶标仪在370 nm处记录吸光值,并计算多酚对β-LG抗原性抑制率(%)。
多酚对β-LG抗原性抑制率(%)=(1−酚蛋白复合物OD值/孔纯蛋白OD值/孔)×100 1.2.10 6种植物多酚结合对蛋白理化性质的影响
1.2.10.1 非变性聚丙烯酰胺凝胶电泳(PAGE)和变性聚丙烯酰胺凝胶电泳(SDS-PAGE)
分别采用非变性非还原PAGE和变性还原PAGE对酚-蛋白复合物样品进行电泳。结束后取出凝胶,去除浓缩胶,用常规法考马斯亮蓝染色6 h,然后用脱色液脱色至凝胶背景无色,再采用凝胶成像仪进行扫描拍照并分析。
1.2.10.2 水溶性测定
将上述3种方法制备的样品溶液,分别离心10 min(6000 r/min),用凯氏定氮仪测定离心前后上清液中的总氮含量,并计算溶解度。
溶解度(%)=样品上清液总氮含量(mgN)样品原始溶液总氮含量(mgN)×100 1.2.11 体外胃肠消化率测定
首先,参考Brodkorb等[24]文献,用血红蛋白和甲苯磺酰基-L-精氨酸甲酯(TAME)分别作为胃蛋白酶和胰酶的底物,测试其比活力。
考虑到多酚可能会影响消化酶活力[25],故先将制备的样品进行透析(透析袋截留分子量8 kD),去除大部分游离酚。然后,将样品溶液pH调至3.0,加入胃蛋白酶(酶在溶液中的活力浓度950 U/mL)进行消化,37 ℃水浴振荡1 h。接着再用2 mol/L NaOH把pH调至7.0,加入胰酶(胰蛋白酶在溶液中的活力浓度80 U TAME/mL),继续37 ℃水浴振荡1 h。结束后,加TCA(使TCA终浓度为10%质量分数),用以沉淀未消化的蛋白并离心10 min(8000 r/min);采用凯氏定氮测定上清液中非蛋白氮(NPN)含量,按照公式计算消化率(%)。
消化率(%)=消化后NPN−消化前NPN蛋白总N−消化前NPN×100 最后,以纯蛋白组的消化率作为基础对照,计算每种酚-蛋白复合物消化率与对照组的相对比值(%)。
1.3 数据处理
采用 Graphpad Prism 9.5 软件(GraphPad Software公司,美国)进行数据作图。Western blotting灰度结果通过SPSS 27(IBM,美国)的单因素方差分析(ANOVA)与Duncan多重比较进行显著性分析,P<0.05视为显著,P<0.01视为极显著。
2. 结果与分析
2.1 不同植物多酚提取液的多酚含量
原始酚提取溶液的pH在3.7~4.2之间。采用福林酚法测定总酚含量,结果如表1所示。同样干重质量的龙眼壳/核和葡萄籽的多酚总含量要高于茶叶渣、桑椹果渣和葡萄果渣。多酚提取液通过大孔树脂分离纯化,由于吸附和洗脱过程中的损失,6种植物总酚浓度均降低。
表 1 不同植物提取液的多酚含量Table 1. Cencentrations of phenolic compounds in different plant extracts指标 茶渣 桑椹果渣 龙眼壳 龙眼核 葡萄籽 葡萄果渣 总酚含量(mg GAE/g) 26.00±0.20 22.50±0.16 55.33±0.18 54.66±0.24 59.00±0.33 14.66±0.21 纯化前总酚浓度(mg GAE/mL) 1.56±0.17 1.35±0.30 3.32±0.22 3.28±0.12 3.54±0.23 0.88±0.15 纯化后总酚浓度(mg GAE/mL) 1.41±0.14 1.26±0.23 3.03±0.33 3.00±0.26 3.41±0.34 0.80±0.19 2.2 sIgG抗体效价
血清中β-LG-sIgG的含量水平与I、II、III型超敏反应均可能相关[26]。流调学报告显示,在儿童和成人群体中,非IgE介导的过敏反应则占据主导[27]。考虑到多酚类物质作为食源性组分更适合于青年与成年人,故而本试验主要是以干预β-LG-sIgG为目的来开展试验。
通过间接法ELISA检测所获得的小鼠sIgG抗体效价(图1)。模型组sIgG相比于空白组、阴性组,其血清抗体浓度有所提高,但个体间差异较大。前人研究表明,食源性蛋白过敏模型是否构建成功与动物品种的选择和蛋白类型(及给药方式)密切相关。多篇试验结果提示[28−29],β-LG蛋白在口服灌胃的致敏造模试验中,虽然可以一定程度升高血清的sIgG浓度以及轻微升高sIgE浓度,但并不易激发BALB/c小鼠发生高强度的过敏反应,这与本试验的结果发现基本吻合。考虑到本研究73只模型组小鼠中有11只小鼠的sIgG含量显著(P<0.05)提高,故而将这些小鼠的血清进行混池处理,作为后续WB试验的抗血清来源。
2.3 6种植物多酚对β-LG抗原性的影响及分析
2.3.1 不同结合方式条件下多酚对β-LG致敏性的影响
2.3.1.1 ELISA与WB试验条件摸索
本试验前期发现,由于游离酚会继续与孔底部包被的蛋白结合,透析截留液中残留的微量或少量多酚会对竞争ELISA显色结果造成系统性偏差。因此,采用间接法ELISA,使用β-LG蛋白先铺板包被,而后将酚与蛋白在孔内固相表面进行互作反应,待两者结合后充分洗去每孔的游离酚。另外,试验前期还考虑到了β-LG蛋白的铺板量,如图2所示,20 μg的蛋白量基本达到与孔底表面的结合上限,故而被选择为蛋白铺板浓度。
此外,WB试验中选择天然PAGE分离蛋白,是考虑到变性PAGE中使用的高温预处理和SDS等变性剂可能会改变β-LG及酚-蛋白复合物的原有结构,不能真实反映多酚化合物单独对β-LG致敏性的影响。最后,比较WB和ELISA试验结果的一致性,以筛选出较为稳定和高效的多酚类型。
2.3.1.2 WB试验
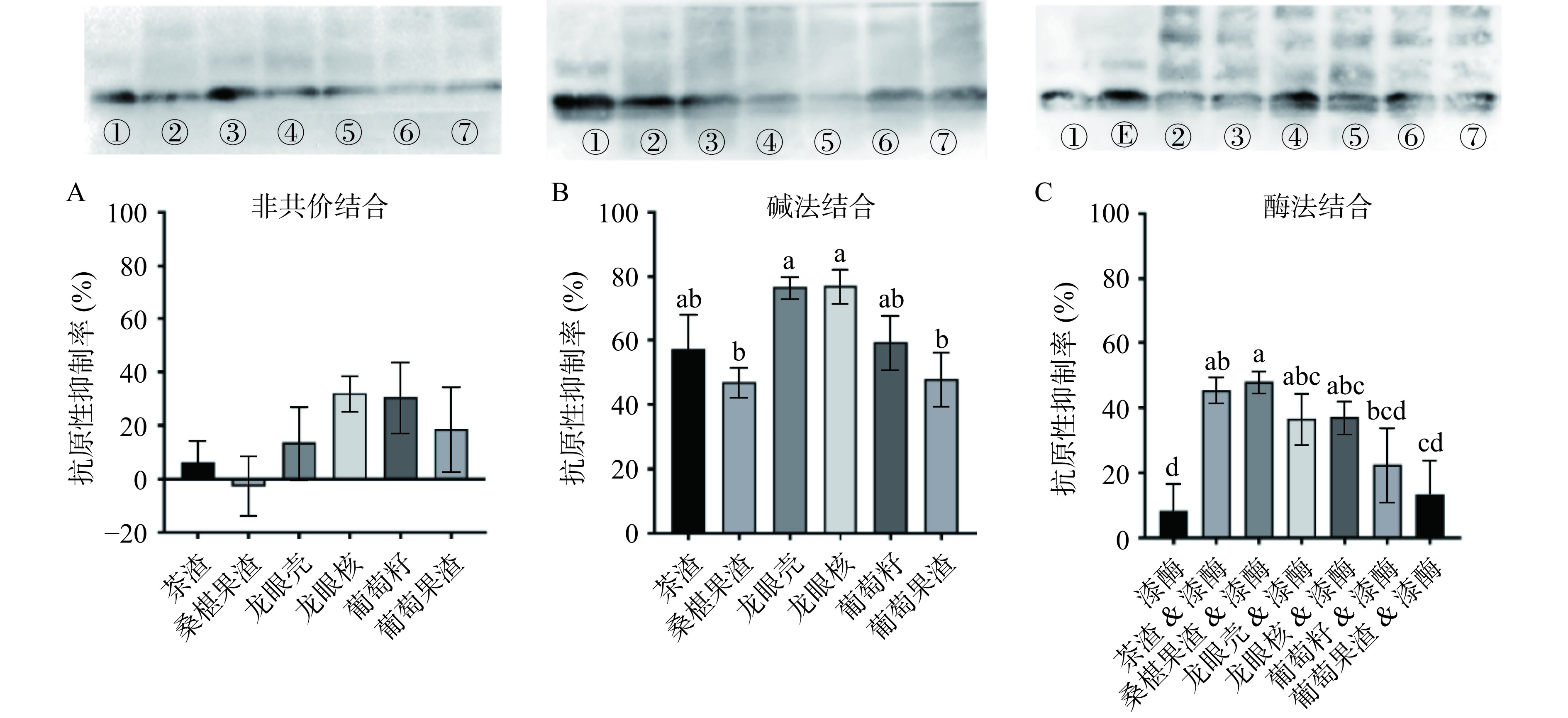
由图3可知,非共价结合的各组间没有显著差异,并且组内的试验稳定性较低。而碱法和酶法比非共价方法效果好,且组间的结果相对稳定。在碱法条件下,6种植物多酚均能够明显抑制蛋白的抗原性,其中龙眼壳、龙眼核多酚的效果较好,平均抑制率分别为76.8%、77.2%。酶法结合,茶渣多酚和桑椹果渣多酚对抗原的抑制较好,平均抑制率分别为45.3%、48%,但龙眼壳和龙眼核多酚的抑制率相比碱法有所降低。
![]() 图 3 不同结合方式条件下植物多酚对β-LG表面抗原性的抑制率(WB试验)注:图A与图B上方电泳图内泳道标注如下:①纯蛋白,②茶渣-β-LG复合物,③桑椹果渣-β-LG复合物,④龙眼壳-β-LG复合物,⑤龙眼核-β-LG复合物,⑥葡萄籽-β-LG复合物,⑦葡萄果渣-β-LG复合物;图C上方电泳图内泳道中酚-蛋白复合物均在漆酶催化条件下形成(除纯β-LG蛋白组①),
图 3 不同结合方式条件下植物多酚对β-LG表面抗原性的抑制率(WB试验)注:图A与图B上方电泳图内泳道标注如下:①纯蛋白,②茶渣-β-LG复合物,③桑椹果渣-β-LG复合物,④龙眼壳-β-LG复合物,⑤龙眼核-β-LG复合物,⑥葡萄籽-β-LG复合物,⑦葡萄果渣-β-LG复合物;图C上方电泳图内泳道中酚-蛋白复合物均在漆酶催化条件下形成(除纯β-LG蛋白组①),2.3.1.3 ELISA试验
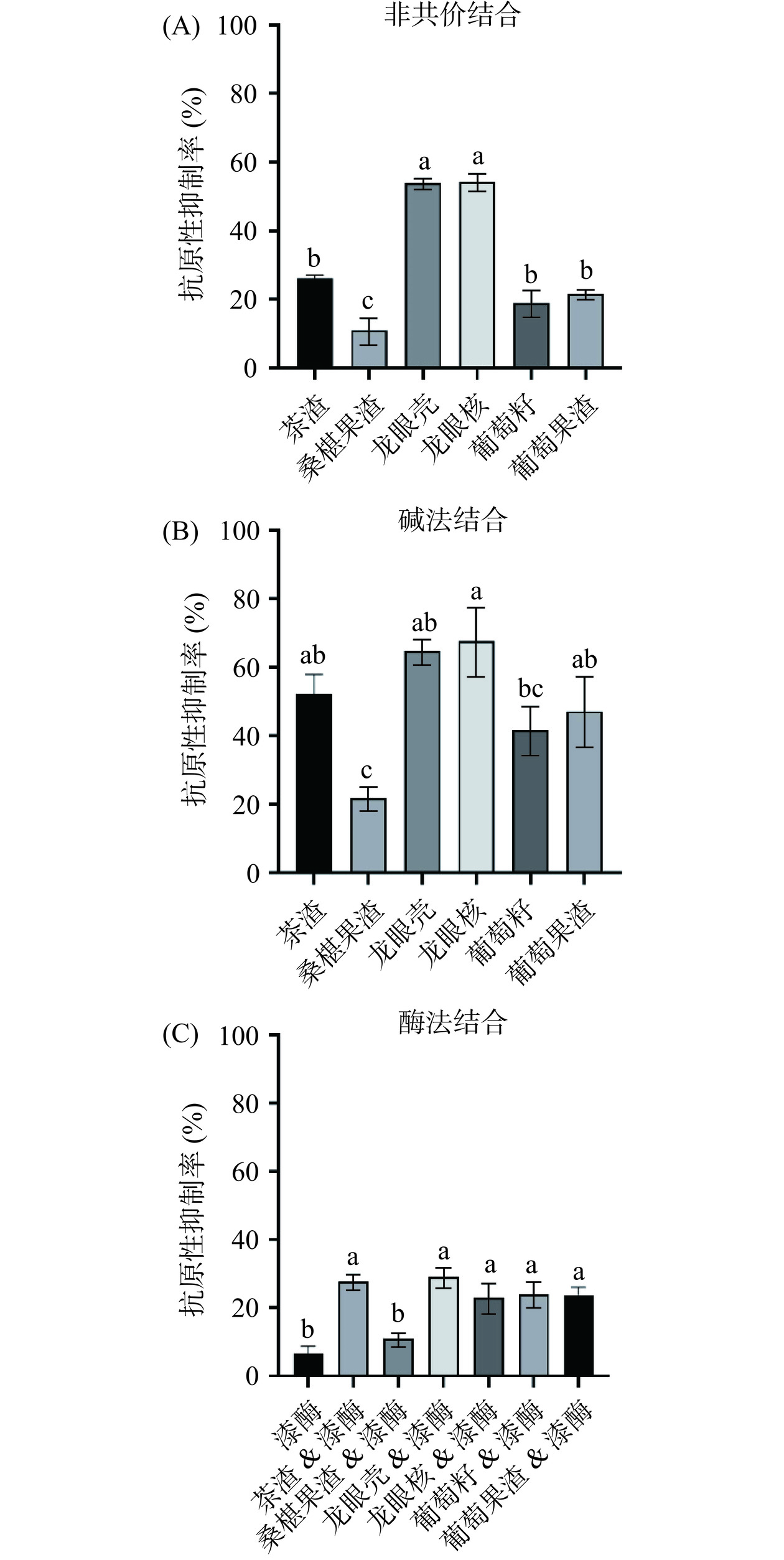
由图4可知,非共价结合与碱法结合的试验结果较为相似,但后者对β-LG抗原性的消减作用强于前者。在非共价结合与碱法结合中,龙眼壳、龙眼核多酚相比于其它组别表现出更高的抑制效率,其次为茶渣多酚、葡萄果渣多酚和葡萄籽多酚,桑椹果渣多酚效果最弱。此外,碱法的ELISA结果与WB试验总体趋势基本一致,但酶法在两种检测方法间存在较大差异,且多数组别的抑制效果相比WB结果有一定程度的降低。这有可能是由于在ELISA测试中,漆酶介导的蛋白偶联反应受到乳蛋白被固相化的影响,而WB试验的样品来源是在离心管溶液中混合自由反应产物。
非共价的结合方式,主要是依靠酚化合物与蛋白之间形成的氢键、疏水作用以及范德华力和静电相互作用,其结合强度比共价结合要低1~2个数量级,是可逆的反应方式[30]。在碱性与含氧环境中,多酚易发生自动氧化成为亲电性质的醌类,从而与赖氨酸、半胱氨酸、色氨酸侧位的亚氨基和巯基等亲核基团发生加成反应,结合较为稳定[31]。这与多酚氧化酶(PPO)中的酪氨酸酶的作用原理有些相似,后者也是催化酪氨酸的酚羟基或多酚物质成为醌类,活跃的醌官能团与氨基酸等侧链发生亲核加成。但作为PPO家族中另一种蛋白酶,漆酶的作用机理和上述有所不同,是将酚类等底物催化为苯氧自由基中间体,进而引发酚自身或与蛋白之间的氧化偶联反应。因此,本试验中选择使用漆酶进行酚-蛋白互作体系构建。从试验结果整体来看,醌类加成比自由基加成的效果更好,并且通过pH调节酚-蛋白的偶联相比于使用固定化漆酶更为简便。此外,β-LG在酶法和碱法所处的pH不同(6.0和8.0)。研究表明β-LG在偏中性环境常以二聚体形式存在于溶液中,而在pH<3.5或pH>7.5则更多是以单体形式存在[32]。在碱性条件下,β-LG的花萼入口“EF环”结构较为松散,有更多的巯基暴露机会,这也为酚与蛋白之间的结合提供了可能[33]。此外,在非共价和碱法、酶法共价反应中,两种反应形式往往同时存在,产物类型也较为多变和复杂,包括蛋白与酚的单一复合物、乳蛋白自身交联产物以及以多酚为“嫁接”的复合物交联产物。因此,要充分解析不同植物多酚消减β-LG表面抗原性的内在原因,后续还需要对结合后的反应产物进行分离鉴定。
2.3.2 不同植物多酚的单体酚比较与分析
6种植物多酚对β-LG致敏性的抑制效率有所差异,与其各自含有的不同单体酚类型和相对含量有关,以及与单体酚在与表位结合时的协同或竞争性有关。本研究使用液质联用技术,非靶定性分析了上述6种多酚提取液中存在的主要单体酚,并综合文献进行了对比,见表2。由表2可知,龙眼壳和龙眼核的单体酚组成较为相似,都含有较高丰度的鞣花酸、柯里拉京和没食子酸衍生类。其中,鞣花酸和柯里拉京在其它4种植物多酚中的存在均较低,推测可能是龙眼壳/核抑制β-LG抗原性的关键单体酚。从结构属性看,鞣花酸和柯里拉京分属水解单宁类(及其降解/衍生物),具有两亲性特点,含有类似的基础结构单元(鞣花酸:没食子酸通过氧化偶联形成的反式二聚衍生物;柯里拉京:没食子酸通过缩酚酸键所形成)[34−35]。有试验表明,多酚中没食子酰基和酚羟基的位置和数量会影响其与蛋白的互作形式[36],这可能关系到柯里拉京、鞣花酸等与表位的结合特征。先前有关鞣花酸、柯里拉京等单宁(酸)的文献报道,更多是围绕提取、合成、分离和活性分析来开展[37−38]。也有试验表明单宁(酸)可以通过调节NK-κB、MAPK等信号通路或炎性因子的表达参与抑制肥大细胞的脱颗粒、内容物介质释放[39−40]。尽管一些单体酚(如:EGCG、儿茶素、咖啡酸、绿原酸、阿魏酸等)在乳蛋白和其它致敏蛋白的互作脱敏试验中已有较多的探讨[9],但关于鞣花酸、柯里拉京却鲜有文献提及。此外,Mao等[41]发现鞣花酸、柯里拉京和没食子酸常同时存在于大戟科植物的多酚提取物中,但其在Caco-2细胞模型中的表观渗透(利用)率很低。已有试验证实,乳蛋白(如:α-乳白蛋白、β-LG等)能够作为鞣花酸等单宁酸的载体[36]。由此可见,通过β-LG互作来提高多酚的生物利用度也是一种促进发挥降敏功效的可能方式。
表 2 6种植物多酚中的主要单体酚种类Table 2. Main monomeric phenolic species in 6 plant polyphenols种类 文献中主要单体酚[42−47] 本次测定的单体酚 茶渣多酚 EGCG、儿茶素、表儿茶素、ECG、EGC、山奈酚 山奈酚、槲皮素、儿茶素、没食子酸、ECG、EGC、EGCG 桑椹多酚 山奈酚、新绿原酸、芦丁、矢车菊素、天竺葵素 槲皮素、绿原酸、儿茶酚、金色草素、矢车菊素、
咖啡酸、花旗松素、香橙素龙眼壳多酚 柯里拉京、鞣花酸、没食子酸 柯里拉京、鞣花酸、没食子酸乙酯、原花青素B2、
表儿茶素、扁蓄苷、老鹳草素、槲皮素龙眼核多酚 柯里拉京、没食子酸乙酯、鞣花酸、没食子酸 柯里拉京、没食子酸乙酯、鞣花酸、没食子酸、
原花青素B2、表儿茶素、扁蓄苷、根皮苷、槲皮苷葡萄籽多酚 儿茶素、没食子酸、表儿茶素、原花青素 没食子酸、表儿茶素、原花青素B2、原花青素B1、ECG 葡萄果渣多酚 儿茶素、表儿茶素、芦丁、没食子酸、槲皮素 表儿茶素、槲皮素、原花青素 B2、山奈酚、ECG、金丝桃苷、山柰酚 注:EGCG:表没食子酸儿茶素没食子酸酯;EGC:表没食子儿茶素;ECG:表儿茶素没食子酸酯。 2.4 理化性质
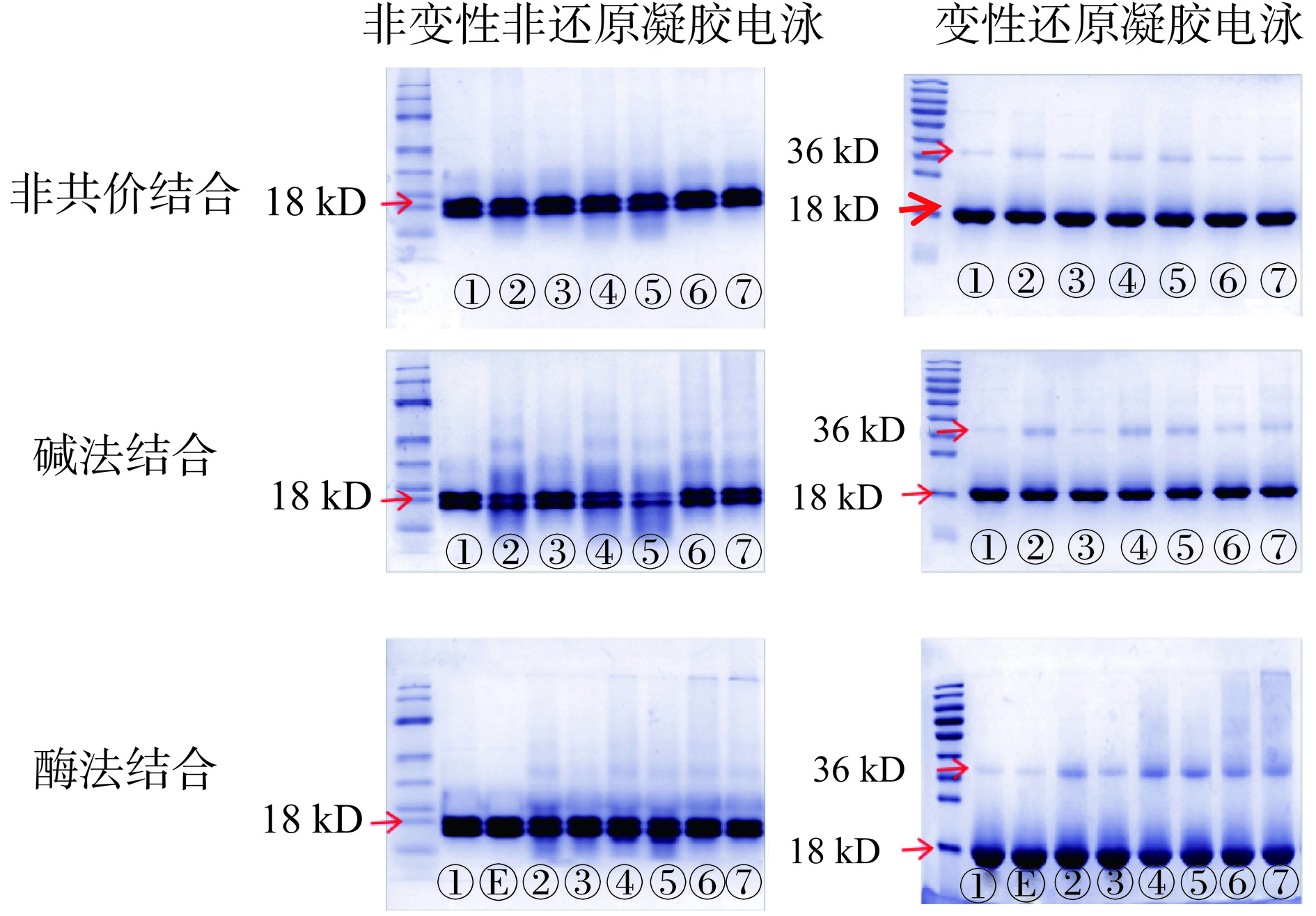
2.4.1 6种植物多酚结合对β-LG蛋白分子量的影响
基于非变性非还原、变性还原PAGE两种方法,不同结合方式制备的酚-蛋白复合物凝胶电泳图如图5所示。由于β-LG有两个主要变体A和B,两者都由162个氨基酸组成,其中A-和B-变体仅在两个位置有所不同(A-64:天冬氨酸,B-64:甘氨酸;A-118:缬氨酸,B-118:丙氨酸),蛋白所带的电荷存在差异[48]。因此,天然PAGE中出现了2条分子量相近的条带;而变性还原PAGE由于上样缓冲液均匀了蛋白的表面电荷,则只显出1条带,单纯反映蛋白间的分子量差异。
天然凝胶电泳中,碱法结合的茶渣多酚-β-LG、龙眼壳多酚-β-LG和龙眼核多酚-β-LG目标位置条带附近出现了较为明显的“拖带”现象;非共价结合呈现与碱法相似的电泳结果,但“拖尾”不明显。如前所述,天然PAGE受到蛋白表面电荷和分子量的双重影响,“拖带”可能与酚在β-LG上的结合数量和位点有关;同时,也可能是以上这3种植物多酚较大程度改变了β-LG的结构,从而改变蛋白的表面电荷[49]。此外,从碱法的变性PAGE胶中可以发现,酚-蛋白结合会部分导致蛋白交联,尤其是茶渣多酚、龙眼壳多酚和龙眼核多酚与β-LG所形成的3种复合物的二聚体条带更深。酶法试验中,漆酶的单独作用并不会引发蛋白间的交联,这是由于紧致的球状蛋白不是漆酶的良好作用底物;但是在漆酶、氧和多酚三者的共同作用下,β-LG蛋白之间形成了二聚体及多聚体,其中葡萄籽和葡萄果渣多酚的聚合作用更为突出。多项研究表明,构建交联(如:β-酪蛋白、β-LG、大豆蛋白、花生蛋白)可以一定程度削弱蛋白原有的致敏性[42],特别是酚与原始蛋白形成胶体颗粒或不可溶沉淀,但也有少数试验认为蛋白聚合后会提高其致敏性[29,50]。本试验中,非共价和碱法结合衍生的β-LG二聚体深浅与抗原性抑制率呈现较强的正相关;但酶法却似乎表明聚合分子量并非越大越好(例如:葡萄果渣多酚的前后对比结果)。因此,多酚脱敏的关键在于β-LG内源表位的屏蔽或改变,且不宜形成新的抗原表位。
2.4.2 6种植物多酚结合对β-LG蛋白水溶性的影响
蛋白的水溶性是其功能属性中的重要指标,直接影响到其作为主基料或辅料的食品感官质量。不同植物多酚与β-LG复合物的水溶性情况如表3所示。其中,非共价结合对β-LG溶解度影响较小,而碱法中茶渣多酚、葡萄籽多酚溶解度显著降低(P<0.05),酶法中的龙眼壳/核多酚、葡萄籽/果渣多酚也都显著降低β-LG蛋白的溶解度(P<0.05,P<0.01)。从趋势来看,除茶渣多酚组,其它酶法复合物的溶解性均低于其各自用碱法或非共价所构建的产物。不同研究者曾使用植物多酚或单体酚与蛋白结合,结果差异较大,多酚可以显著提高、降低或者不影响蛋白的溶解度,并认为这与多酚/蛋白类型、pH条件、结合方式等密切相关[9,51]。蛋白在水中的状态,无论是胶体、分散的溶质分子或颗粒沉淀,其本质上是表面分布电荷、表面疏水性与分子间斥力等综合作用的结果。多酚类物质与蛋白的结合,既引入了亲水的酚羟基,可中和赖氨酸等正电氨基酸,使蛋白表面整体带负电荷;同时带入了苯环芳烃,增强了表面疏水性[51];还可改变球状蛋白自有的空间结构,使内部疏水色氨酸、脯氨酸等暴露。另外,由多酚引导的蛋白间交联也可能会影响β-LG在溶液中的粒径和稳定性。Cui[25]等提到许多酚化合物与蛋白之间的互作发展走向是先形成可溶的复合物,而后继续聚合形成不溶性沉淀。本试验结合上述电泳染色结果,可初步判断复合物的多聚体形式可能会降低蛋白的溶解性,但是由哪种单体酚在其中起到关键的桥联作用,以及蛋白的结构变化等信息,尚需被继续深入解析。
表 3 6种植物多酚结合对β-LG蛋白水溶性的影响(%)Table 3. Effects of binding interaction by six plant phenolic extracts on the solubility of β-LG (%)结合方式 对照组 茶渣多酚 桑椹果渣多酚 龙眼壳多酚 龙眼核多酚 葡萄籽多酚 葡萄果渣多酚 非共价 98.5±2.5 97.4±2.4 107.2±4.9 104.7±2.2 93.6±5.3 110.3±8.7 109.4±5.4 碱法结合 100.0±3.5 89.4±5.3* 93.3±2.7# 93.3±3.8# 94.4±3.0 88.9±5.6*# 92.9±2.3# 酶法结合 101.1±3.6 97.3±4.1 90.0±6.6## 85.3±4.6*## 75.3±8.7*# 76.0±7.3**## 80.0±8.2**## 注:*、**表示在同一结合方式下(不同多酚类型)的统计学差异显著(P<0.05,P<0.01);#、##表示(同一类多酚组)在不同结合方式条件下的统计学差异显著(P<0.05,P<0.01)。 2.5 6种植物多酚对β-LG体外胃肠消化率的影响
如前节试验所示,6种植物多酚与β-LG可形成不同程度的交联二聚体或多聚体,这是否会影响到蛋白的胃肠降解率,值得进一步测定分析。由表4可知,除碱法条件下的葡萄果渣多酚外(P<0.05),其它结合方式的6类植物多酚均未显著降低β-LG的体外消化率(P>0.05)。对比其它试验结果,不同多酚可以提高或降低不同类型蛋白的消化率。例如:Jiang等[52]探究绿原酸与乳清蛋白和酪蛋白的非共价相互作用对体外蛋白消化率的影响,发现绿原酸诱导蛋白质结构发生变化,从而提高了蛋白的消化率;而Wang等[53]研究分离乳清蛋白(WPI)与玫瑰花青素在pH7.0和pH9.0条件下相互作用,发现复合物的消化率显著低于WPI(P<0.05)。研究者认为这些结果的差异可能主要源于酚类化合物修饰或改变了蛋白一级或高级空间构象,从而遮蔽或暴露消化酶在蛋白上的酶切位点;也有分析认为酚降低蛋白的消化率,是由于多酚在消化过程中被重新解离释放,大量与消化酶结合后抑制其活力。
表 4 6种植物多酚结合对β-LG蛋白相对消化率的影响(%)Table 4. Effects of binding interaction by six plant phenolic extracts on the relative digestibility of β-LG (%)结合方式 对照组 茶渣多酚 桑椹果渣多酚 龙眼壳多酚 龙眼核多酚 葡萄籽多酚 葡萄果渣多酚 非共价 100.0±1.6 98.2±1.4 99.0±2.6 98.6±1.7 100.4±4.2 100.0±1.3 97.2±3.3 碱法结合 100.0±2.6 95.0±3.8 96.8±3.2 97.9±1.3 96.8±3.4 95.4±3.9 92.9±1.9* 酶法结合 100.0±1.8 97.7±2.8 95.3±2.0 93.9±5.0 101.8±1.4 98.0±2.2 98.7±1.7 注:*表示与对照组统计学差异显著(P<0.05)。 蛋白的胃肠消化性直接关系到蛋白作为营养物的生物吸收与利用,且与蛋白在体内所表现的致敏程度紧密关联。研究表明,β-LG具有一定的消化抗性,过胃蛋白可以完整形式(如:经由膜受体LIMR介导[54])进入肠刷状缘细胞或经M细胞转移给抗原呈递细胞[55],引发CMPA患者体内的过敏反应。因此,应尽可能在降低β-LG抗原性的基础上,保留/提高其内源消化度。本试验中,尽管大部分植物多酚并不干扰β-LG的总体消化性,但根据De等[56]的发现,提示多酚-β-LG消化产物的肽段组分(序列、分子量大小)与原始蛋白消化产物可能会有所不同,并且会影响β-LG的营养特性和抗原性。再根据Villas-Boas等[57]的发现,抗原表位Tyr42-Leu54在改性β-LG的消化液中依然存在,即抗原性可能仍有所保留。因此,消化产物鉴定和消化产物致敏性评估这两个问题需要得到更深入的解析,以确保多酚-β-LG复合物的质量安全性。
3. 结论
本研究基于植物多酚与蛋白互作机制,使用了6种来源的植物多酚与β-LG构建不同类别的复合物。综合蛋白的抗原性、水溶性和消化性等分析结果,初步判断龙眼壳/核多酚是适用于β-LG致敏性消减的植物多酚类型。同时,鉴定出柯里拉京、鞣花酸等是龙眼壳/核共有且富含的单体酚种类。下一步,将考虑优化龙眼壳/核多酚在碱法条件下与β-LG的结合参数(pH、温度、浓度摩尔比等)。继而,由定量方法筛选出主要单体酚,并对其进行逐一的致敏表型验证,尝试寻找到发挥主效应作用的多酚类型,并分析不同酚化合物在与β-LG表位结合过程中是否存在统计学意义的交互作用。在此基础上,从三个维度“酚-蛋白结合位点”“酚-蛋白结合产物的分离鉴定”和“酚-蛋白的消化产物”分别开展试验,明确关键单体酚屏蔽/改变β-LG抗原性的核心机制。这将为针对性地富集提取副产物中的降敏多酚提供参考依据,也为新型乳蛋白脱敏策略乃至生产转化铺垫理论和数据基础。
-
图 3 不同结合方式条件下植物多酚对β-LG表面抗原性的抑制率(WB试验)
注:图A与图B上方电泳图内泳道标注如下:①纯蛋白,②茶渣-β-LG复合物,③桑椹果渣-β-LG复合物,④龙眼壳-β-LG复合物,⑤龙眼核-β-LG复合物,⑥葡萄籽-β-LG复合物,⑦葡萄果渣-β-LG复合物;图C上方电泳图内泳道中酚-蛋白复合物均在漆酶催化条件下形成(除纯β-LG蛋白组①),
Figure 3. Inhibition rate of plant phenolic extracts on surface antigenicity of β-LG via different combination manners (WB test)
表 1 不同植物提取液的多酚含量
Table 1 Cencentrations of phenolic compounds in different plant extracts
指标 茶渣 桑椹果渣 龙眼壳 龙眼核 葡萄籽 葡萄果渣 总酚含量(mg GAE/g) 26.00±0.20 22.50±0.16 55.33±0.18 54.66±0.24 59.00±0.33 14.66±0.21 纯化前总酚浓度(mg GAE/mL) 1.56±0.17 1.35±0.30 3.32±0.22 3.28±0.12 3.54±0.23 0.88±0.15 纯化后总酚浓度(mg GAE/mL) 1.41±0.14 1.26±0.23 3.03±0.33 3.00±0.26 3.41±0.34 0.80±0.19 表 2 6种植物多酚中的主要单体酚种类
Table 2 Main monomeric phenolic species in 6 plant polyphenols
种类 文献中主要单体酚[42−47] 本次测定的单体酚 茶渣多酚 EGCG、儿茶素、表儿茶素、ECG、EGC、山奈酚 山奈酚、槲皮素、儿茶素、没食子酸、ECG、EGC、EGCG 桑椹多酚 山奈酚、新绿原酸、芦丁、矢车菊素、天竺葵素 槲皮素、绿原酸、儿茶酚、金色草素、矢车菊素、
咖啡酸、花旗松素、香橙素龙眼壳多酚 柯里拉京、鞣花酸、没食子酸 柯里拉京、鞣花酸、没食子酸乙酯、原花青素B2、
表儿茶素、扁蓄苷、老鹳草素、槲皮素龙眼核多酚 柯里拉京、没食子酸乙酯、鞣花酸、没食子酸 柯里拉京、没食子酸乙酯、鞣花酸、没食子酸、
原花青素B2、表儿茶素、扁蓄苷、根皮苷、槲皮苷葡萄籽多酚 儿茶素、没食子酸、表儿茶素、原花青素 没食子酸、表儿茶素、原花青素B2、原花青素B1、ECG 葡萄果渣多酚 儿茶素、表儿茶素、芦丁、没食子酸、槲皮素 表儿茶素、槲皮素、原花青素 B2、山奈酚、ECG、金丝桃苷、山柰酚 注:EGCG:表没食子酸儿茶素没食子酸酯;EGC:表没食子儿茶素;ECG:表儿茶素没食子酸酯。 表 3 6种植物多酚结合对β-LG蛋白水溶性的影响(%)
Table 3 Effects of binding interaction by six plant phenolic extracts on the solubility of β-LG (%)
结合方式 对照组 茶渣多酚 桑椹果渣多酚 龙眼壳多酚 龙眼核多酚 葡萄籽多酚 葡萄果渣多酚 非共价 98.5±2.5 97.4±2.4 107.2±4.9 104.7±2.2 93.6±5.3 110.3±8.7 109.4±5.4 碱法结合 100.0±3.5 89.4±5.3* 93.3±2.7# 93.3±3.8# 94.4±3.0 88.9±5.6*# 92.9±2.3# 酶法结合 101.1±3.6 97.3±4.1 90.0±6.6## 85.3±4.6*## 75.3±8.7*# 76.0±7.3**## 80.0±8.2**## 注:*、**表示在同一结合方式下(不同多酚类型)的统计学差异显著(P<0.05,P<0.01);#、##表示(同一类多酚组)在不同结合方式条件下的统计学差异显著(P<0.05,P<0.01)。 表 4 6种植物多酚结合对β-LG蛋白相对消化率的影响(%)
Table 4 Effects of binding interaction by six plant phenolic extracts on the relative digestibility of β-LG (%)
结合方式 对照组 茶渣多酚 桑椹果渣多酚 龙眼壳多酚 龙眼核多酚 葡萄籽多酚 葡萄果渣多酚 非共价 100.0±1.6 98.2±1.4 99.0±2.6 98.6±1.7 100.4±4.2 100.0±1.3 97.2±3.3 碱法结合 100.0±2.6 95.0±3.8 96.8±3.2 97.9±1.3 96.8±3.4 95.4±3.9 92.9±1.9* 酶法结合 100.0±1.8 97.7±2.8 95.3±2.0 93.9±5.0 101.8±1.4 98.0±2.2 98.7±1.7 注:*表示与对照组统计学差异显著(P<0.05)。 -
[1] MA Z, CHEN L, XIAN R L, et al. Time trends of childhood food allergy in China:Three cross-sectional surveys in 1999, 2009, and 2019[J]. Pediatric Allergy and Immunology,2021,32(5):1073−1079. doi: 10.1111/pai.13490
[2] 陆玉琴. 牛乳β-乳球蛋白与植物多酚共价结合对蛋白致敏性影响的初步研究[D]. 深圳:深圳大学, 2019. [LU Y Q. Preliminary investigation of the allergenic capacity of β-lactoglobulin by covalent conjugation with plant polyphenols[D]. Shenzhen:Shenzhen University, 2019.] LU Y Q. Preliminary investigation of the allergenic capacity of β-lactoglobulin by covalent conjugation with plant polyphenols[D]. Shenzhen: Shenzhen University, 2019.
[3] SHAO Y H, ZHANG Y, ZHU M F, et al. Glycation of β-lactoglobulin combined by sonication pretreatment reduce its allergenic potential[J]. International Journal of Biological Macromolecules,2020,164:1527−1535. doi: 10.1016/j.ijbiomac.2020.07.223
[4] KLEBER N, MAIER S, HINRICHS J. Antigenic response of bovine β-lactoglobulin influenced by ultra-high pressure treatment and temperature[J]. Innovative Food Science & Emerging Technologies,2007,8(1):39−45.
[5] VERHOECKX K C M, VISSERS Y M, BAUMERT J L, et al. Food processing and allergenicity[J]. Food and Chemical Toxicology,2015,80:223−240. doi: 10.1016/j.fct.2015.03.005
[6] ZUERCHER A W, HOLVOET S, WEISS M, et al. Polyphenol‐enriched apple extract attenuates food allergy in mice[J]. Clinical & Experimental Allergy,2010,40(6):942−950.
[7] TOKURA T, NAKANO N, ITO T, et al. Inhibitory effect of polyphenol-enriched apple extracts on mast cell degranulation in vitro targeting the binding between IgE and FcεRI[J]. Bioscience, Biotechnology, and Biochemistry,2005,69(10):1974−1977.
[8] 潘增烽, 周园, 阮岩, 等. 儿茶素抑制NF-κB-TSLP通路缓解过敏性哮喘小鼠炎症反应[J]. 中国药理学通报,2018,34(2):207−212. [PAN Z F, ZHOU Y, RUAN Y, et al. Catechin remits the inflammation in allergic asthma mice by suppressing NF-κB-TSLP signal pathway[J]. Chinese Pharmacological Bulletin,2018,34(2):207−212.] doi: 10.3969/j.issn.1001-1978.2018.02.013 PAN Z F, ZHOU Y, RUAN Y, et al. Catechin remits the inflammation in allergic asthma mice by suppressing NF-κB-TSLP signal pathway[J]. Chinese Pharmacological Bulletin, 2018, 34(2): 207−212. doi: 10.3969/j.issn.1001-1978.2018.02.013
[9] OZDAL T, CAPANOGLU E, ALTAY F. A review on protein–phenolic interactions and associated changes[J]. Food Research International,2013,51(2):954−970. doi: 10.1016/j.foodres.2013.02.009
[10] PLUNDRICH N J, BANSODE R R, FOEGEDING E A, et al. Protein-bound Vaccinium fruit polyphenols decrease IgE binding to peanut allergens and RBL-2H3 mast cell degranulation in vitro[J]. Food & Function,2017,8(4):1611−1621.
[11] LILA M A, SCHNEIDER M, DEVLIN A, et al. Polyphenol-enriched berry extracts naturally modulate reactive proteins in model foods[J]. Food & Function,2017,8(12):4760−4767.
[12] SUN S, JIANG T, GU Y, ET AL. CONTRIbution of five major apple polyphenols in reducing peanut protein sensitization and alleviating allergencitiy of peanut by changing allergen structure[J]. Food Research International,2023,164:112297. doi: 10.1016/j.foodres.2022.112297
[13] TANTOUSH Z, STANIC D, STOJADINOVIC M, et al. Digestibility and allergenicity of β-lactoglobulin following laccase-mediated cross-linking in the presence of sour cherry phenolics[J]. Food Chemistry,2011,125(1):84−91. doi: 10.1016/j.foodchem.2010.08.040
[14] 焦瑶瑶, 张卫兵, 杨敏, 等. 茶多酚与牛乳蛋白相互作用对乳制品功能特性和生物学效应影响的研究进展[J]. 乳业科学与技术,2018,41(6):42−47. [JIAO Y Y, ZHANG W B, YANG M, et al. Advances in research on effects of interaction between tea polyphenols and milk proteins on functional properties and bioavailability of dairy products[J]. Journal of Dairy Science and Technology,2018,41(6):42−47.] JIAO Y Y, ZHANG W B, YANG M, et al. Advances in research on effects of interaction between tea polyphenols and milk proteins on functional properties and bioavailability of dairy products[J]. Journal of Dairy Science and Technology, 2018, 41(6): 42−47.
[15] BANSODE R R, RANDOLPH P D, PLUNDRICH N J, et al. Peanut protein-polyphenol aggregate complexation suppresses allergic sensitization to peanut by reducing peanut-specific IgE in C3H/HeJ mice[J]. Food Chemistry,2019,299:125025. doi: 10.1016/j.foodchem.2019.125025
[16] 姚文俊. 四种儿茶素与牛乳β-乳球蛋白共价物的研究[D]. 南昌:南昌大学, 2020. [YAO W J. Study on the covalents of four catechins and milk β-lactoglobulin[D]. Nanchang:Nanchang University, 2020.] YAO W J. Study on the covalents of four catechins and milk β-lactoglobulin[D]. Nanchang: Nanchang University, 2020.
[17] HAN J, ChANG Y, BRITTEN M, et al. Interactions of phenolic compounds with milk proteins[J]. European Food Research and Technology,2019,245:1881−1888.
[18] ZhANG X, GUO S, HO C T, et al. Phytochemical constituents and biological activities of longan (Dimocarpus longan Lour.) fruit:A review[J]. Food Science and Human Wellness,2020,9(2):95−102. doi: 10.1016/j.fshw.2020.03.001
[19] 范智义, 李晓琳, 李巨秀. 桑椹提取物中酚类化合物的抗氧化及抗糖基化活性分析[J]. 食品科学,2016,37(17):19−26. [FAN Z Y, LI X L, LI J X. Antioxidant and antiglycation activities of phenolic compounds extracted from mulberry fruits[J]. Food Science,2016,37(17):19−26.] doi: 10.7506/spkx1002-6630-201617004 FAN Z Y, LI X L, LI J X. Antioxidant and antiglycation activities of phenolic compounds extracted from mulberry fruits[J]. Food Science, 2016, 37(17): 19−26. doi: 10.7506/spkx1002-6630-201617004
[20] RANGKADILOK N, WORASUTTAYANGKURN L, BENNETT R N, et al. Identification and quantification of polyphenolic compounds in Longan (Euphoria longana Lam.) fruit[J]. Journal of Agricultural and Food Chemistry,2005,53(5):1387−1392. doi: 10.1021/jf0403484
[21] 许海棠, 田程飘, 赵彦芝, 等. 百香果叶总酚的提取工艺优化、抗氧化活性及其抑制α-葡萄糖苷酶活性[J]. 食品工业科技,2019,40(20):223−227,236. [XU H T, TIAN C P, ZHAO Y Z, et al. Optimization extraction processing, antioxidant activity and inhibition of α-glucosidase activity of total polyphenols from leaves of passiflora edulis[J]. Science and Technology of Food Industry,2019,40(20):223−227,236.] XU H T, TIAN C P, ZHAO Y Z, et al. Optimization extraction processing, antioxidant activity and inhibition of α-glucosidase activity of total polyphenols from leaves of passiflora edulis[J]. Science and Technology of Food Industry, 2019, 40(20): 223−227,236.
[22] 孙少忆, 马露, 刘军, 等. 葡萄酒渣多酚类物质超声波辅助提取工艺优化及其抗氧化活性研究[J]. 河南农业大学学报, 2021, 55(2):328−337. [SUN S Y, MA L, LIU J, et al. Optimization of ultrasonic assisted extraction of polyphenols from grape wine residue and its antioxidant activity[J]. Journal of Henan Agricultural University, 2021, 55(2):328−337.] SUN S Y, MA L, LIU J, et al. Optimization of ultrasonic assisted extraction of polyphenols from grape wine residue and its antioxidant activity[J]. Journal of Henan Agricultural University, 2021, 55(2): 328−337.
[23] SMITH N A, NAGAMOTO-COMBS K. Induction of hypersensitivity with purified β-lactoglobulin as a mouse model of cow's milk allergy[J]. Methods in Molecular Biology,2021,2223:67−78.
[24] BRODKORB A, EGGER L, ALMINGER M, et al. Infogest static in vitro simulation of gastrointestinal food digestion[J]. Nature Protocols,2019,14(4):991−1014.
[25] CUI F C, YANG K C, LI Y Q. Investigate the binding of catechins to trypsin using docking and molecular dynamics simulation[J]. Plos One,2015,10(5):e0125848. doi: 10.1371/journal.pone.0125848
[26] ZHANG S L, SICHERER S, BERIN M C, et al. Pathophysiology of Non-IgE-Mediated food allergy[J]. ImmunoTargets and Therapy,2021,10:431−446. doi: 10.2147/ITT.S284821
[27] 李欣, 程剑锋, 文学方, 等. 免疫耐受在牛乳过敏中的研究进展[J]. 食品与生物技术学报,2021,40(5):1−11. [LI X, CHENG J F, WEN X F, et al. Research advances in immune tolerance in cow’s milk allergy[J]. Journal of Food Science and Biotechnology,2021,40(5):1−11.] doi: 10.3969/j.issn.1673-1689.2021.05.001 LI X, CHENG J F, WEN X F, et al. Research advances in immune tolerance in cow’s milk allergy[J]. Journal of Food Science and Biotechnology, 2021, 40(5): 1−11. doi: 10.3969/j.issn.1673-1689.2021.05.001
[28] CHEN C, LU L H, SU N N, et al. Development of a BALB/c mouse model for food allergy:Comparison of allergy-related responses to peanut agglutinin, β-lactoglobulin and potato acid phosphatase[J]. Toxicology Research,2017,6(2):251−261. doi: 10.1039/C6TX00371K
[29] STOJADINOVIC M, PIETERS R, SMIT J, et al. Cross-linking of β-lactoglobulin enhances allergic sensitization through changes in cellular uptake and processing[J]. Toxicological Sciences,2014,140(1):224−235.
[30] SHAHIDI F, DISSANAYAKA C S. Phenolic-protein interactions:Insight from in-silico analyses-a review[J]. Food Production, Processing and Nutrition,2023,5(1):1−21. doi: 10.1186/s43014-022-00115-y
[31] LI X Q, LI M T T, ZHANG T T, et al. Enzymatic and nonenzymatic conjugates of lactoferrin and (-)-Epigallocatechin gallate:Formation, structure, functionality, and allergenicity[J]. Journal of Agricultural and Food Chemistry,2021,69(22):6291−6302. doi: 10.1021/acs.jafc.1c01167
[32] 武涌. 牛乳β-乳球蛋白构象性表位定位及结构特征研究[D]. 南昌:南昌大学, 2012. [WU C. Identification and structural characterization of conformational epitopes on bovine β-lactoglobumin[D]. Nanchang:Nanchang University, 2012.] WU C. Identification and structural characterization of conformational epitopes on bovine β-lactoglobumin[D]. Nanchang: Nanchang University, 2012.
[33] KURPIEWSKA K, BIELA A, LOCH J I, et al. Towards understanding the effect of high pressure on food protein allergenicity:β-Lactoglobulin structural studies[J]. Food Chemistry,2019,270:315−321.
[34] LI X, DENG Y, ZHENG Z Z, et al. Corilagin, a promising medicinal herbal agent[J]. Biomed Pharmacother,2018,99:43−50. doi: 10.1016/j.biopha.2018.01.030
[35] SHARIFI-RAD J, QUISPE C, CASTILLO C M S, et al. Ellagic acid:A review on its natural sources, chemical stability, and therapeutic potential[J]. Oxidative Medicine and Cellular Longevity, 2022:3848084.
[36] DOBREVA M A, GREEN R J, MUELLER-HARVEY I, et al. Size and molecular flexibility affect the binding of ellagitannins to bovine serum albumin[J]. Journal of Agricultural and Food Chemistry,2014,62(37):9186−9194. doi: 10.1021/jf502174r
[37] 林靖怡. 纤梗叶下珠柯里拉京的制备工艺及其化学成分的研究[D]. 泉州:华侨大学, 2017. [LIN J Y. Studies on the preparation technology of corilagin and chemical constituents of Phyllanthus tenellus Roxb[D]. Quanzhou:Huaqiao University, 2017.] LIN J Y. Studies on the preparation technology of corilagin and chemical constituents of Phyllanthus tenellus Roxb[D]. Quanzhou: Huaqiao University, 2017.
[38] YAN C, ZHOU Z. Ellagic acid can act as a chaperone and suppress the heat-induced amyloid-like aggregation of ovalbumin[J]. Food Hydrocolloids,2020,100:105408. doi: 10.1016/j.foodhyd.2019.105408
[39] BANSODE R R, PLUNDRICH N J, RANDOLPH P D, et al. Peanut flour aggregation with polyphenolic extracts derived from peanut skin inhibits IgE binding capacity and attenuates RBL-2H3 cells degranulation via MAPK signaling pathway[J]. Food Chemistry,2018,263:307−314.
[40] PAN T G, WU Y N , HE S D, et al. Food allergenic protein conjugation with plant polyphenols for allergenicity reduction[J]. Current Opinion in Food Science, 2022, 43:36−42.
[41] MAO X, WU L F, ZHAO H J, et al. Transport of corilagin, gallic acid, and ellagic acid from fructus phyllanthi tannin fraction in Caco-2 cell monolayers[J]. Evidence-Based Complementary and Alternative Medicine, 2016:9205379.
[42] RIIHIMÄKI L H, VAINIO M J, HEIKURA J M, et al. Binding of phenolic compounds and their derivatives to bovine and reindeer β-lactoglobulin[J]. Journal of Agricultural and Food Chemistry,2008,56(17):7721−7729. doi: 10.1021/jf801120a
[43] HE G, HOU X, HAN M, et al. Discrimination and polyphenol compositions of green teas with seasonal variations based on UPLC-QTOF/MS combined with chemometrics[J]. Journal of Food Composition and Analysis,2022,105:104267. doi: 10.1016/j.jfca.2021.104267
[44] HUO J W, NI Y N, LI D L, et al. Comprehensive structural analysis of polyphenols and their enzymatic inhibition activities and antioxidant capacity of black mulberry (Morus nigra L.)[J]. Food Chemistry,2023,427:136605.
[45] TANG Y Y, HE X M, SUN J, et al. Polyphenols and alkaloids in byproducts of longan fruits (Dimocarpus longan Lour.) and their bioactivities[J]. Molecules,2019,24(6):1186. doi: 10.3390/molecules24061186
[46] TSENG H C, WU W T, HUANG H S, et al. Antimicrobial activities of various fractions of longan (Dimocarpus longan Lour. Fen Ke) seed extract[J]. International Journal of Food Sciences and Nutrition,2014,65(5):589−593. doi: 10.3109/09637486.2014.886181
[47] GODJEVAC D, TESEVIC V, VELICKOVIC M, et al. Polyphenolic compounds in seeds from some grape cultivars grown in Serbia[J]. Journal of the Serbian Chemical Society,2010,75(12):1641−1652.
[48] QIN B Y, BEWLEY M C, CREAMER L K, et al. Functional implications of structural differences between variants A and B of bovine β-lactoglobulin[J]. Protein Science,1999,8(1):75−83. doi: 10.1110/ps.8.1.75
[49] WU X, LU Y, XU H, et al. Reducing the allergenic capacity of β-lactoglobulin by covalent conjugation with dietary polyphenols[J]. Food Chemistry,2018,256:427−434. doi: 10.1016/j.foodchem.2018.02.158
[50] PALOSUO K, VARJONEN E, NURKKALA J, et al. Transglutaminase-mediated cross-linking of a peptic fraction of omega-5 gliadin enhances IgE reactivity in wheat-dependent, exercise-induced anaphylaxis[J]. Journal of Allergy and Clinical Immunology,2003,111(6):1386−1392.
[51] HUAANG X, YAN C J, LIN M, et al. The effects of conjugation of walnut protein isolate with polyphenols on protein solubility, antioxidant activity, and emulsifying properties[J]. Food Research International,2022,161:111910. doi: 10.1016/j.foodres.2022.111910
[52] JIANG J, ZHANG Z, ZHAO J, et al. The effect of non-covalent interaction of chlorogenic acid with whey protein and casein on physicochemical and radical-scavenging activity of in vitro protein digests[J]. Food Chemistry,2018,268:334−341.
[53] WANG Y, YANG C, ZHANG J, et al. Interaction between whey protein isolate and rose anthocyanin extracts at different pHs:Structure, emulsification and digestibility of complexes[J]. Food Bioscience,2022,49:101888. doi: 10.1016/j.fbio.2022.101888
[54] FLUCKINGER M, MERSCHAK P, HERMANN M, et al. Lipocalin-interacting-membrane-receptor (LIMR) mediates cellular internalization of β-lactoglobulin[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes,2008,1778(1):342−347. doi: 10.1016/j.bbamem.2007.10.010
[55] PRIOULT G, NAGLER-ANDERSON C J I R. Mucosal immunity and allergic responses:Lack of regulation and/or lack of microbial stimulation?[J]. Immunological Reviews,2005,206(1):204−218. doi: 10.1111/j.0105-2896.2005.00277.x
[56] DE M F P R, PESSATO T B, RODRIGUES E, et al. Whey protein and phenolic compound complexation:Effects on antioxidant capacity before and after in vitro digestion[J]. Food Research International,2020,133:109104. doi: 10.1016/j.foodres.2020.109104
[57] VILLAS-BOAS M B, BENEDE S, ZOLLNER R D L, et al. Epitopes resistance to the simulated gastrointestinal digestion of β-lactoglobulin submitted to two-step enzymatic modification[J]. Food Research International,2015,72:191−197. doi: 10.1016/j.foodres.2015.03.044





 下载:
下载:
 下载:
下载:



