Mechanism of Rosmarinic Acid in Alleviating Food Allergy Based on Network Pharmacology and Lipidomics
-
摘要: 为研究迷迭香酸缓解食物过敏的效应机制,利用网络药理学和分子对接以及脂质组学探究迷迭香酸(Rosmarinic acid,RA)缓解食物过敏的效应机制。利用数据库分析平台(TCMSP)、Swiss Target Prediction、Pharm Mapper、Super Pred和Gene Cards等获得RA的潜在效应靶点。通过软件Cytoscape和String数据库构建“活性成分-靶点”蛋白互作(PPI)网络,并采用AutoDockTools软件进行分子对接验证。进一步通过建立卵清蛋白(Ovalbumin,OVA)食物过敏小鼠模型验证RA缓解食物过敏的效应,并基于高分辨质谱对小鼠血清进行脂质代谢分析。结果表明,网络药理分析共筛选到关联靶点46个。基因本体(Geno ontology,GO)富集分析表明RA主要通过对蛋白质磷酸化、鞘糖脂、磷脂和类固醇等的结合发挥作用。京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析表明关联靶点主要富集在Th1和Th2细胞分化通路、脂代谢和炎症性肠病通路等。动物实验结果显示RA干预可以显著(P<0.05,P<0.01,P<0.001)抑制OVA致敏引起的小鼠血清过敏反应介质上升,且RA干预组小鼠血清总胆固醇(Total Cholesterol,T-CHO)和甘油三酯(Triglyceride,TG)水平下降。脂质组学分析中,在正/负离子模式下分别筛选出25/36种潜在差异脂质代谢物。对脂质差异代谢物的富集分析表明,小鼠的血清脂质代谢影响甘油磷脂代谢和鞘脂代谢通路。因此,本研究表明RA主要通过调节脂质代谢和机体炎症反应发挥缓解食物过敏的作用。Abstract: To investigate the mechanism of rosmarinic acid in alleviating food allergy, an integrated approach, involving network pharmacology, molecular docking and lipid-omics were employed to investigate the potential mechanism of rosmarinic acid (RA) in alleviating food allergy. To obtain potential therapeutic targets for RA, database analysis platform such as database and analysis platform (TCMSP), Swiss Target Prediction, Pharm Mapper, Super Pred and Gene Cards were employed. The ''active ingredient-target'' protein-protein (PPI) network was constructed using Cytoscape software and the String database. The validation of molecular docking was performed using AutoDockTools software. Furthermore, a food allergy mouse model using ovalbumin (OVA) and lipid metabolism studies on mouse serum based on high-resolution mass spectrometry were applied to investigate the antiallergic effect of RA and the underling mechanism. Results showed that, through the network pharmacology analysis, a total of 46 associated target proteins were identified. The geno ontology (GO) enrichment analysis of the target proteins indicated that RA primarily exerted its effects through modulation of protein phosphorylation and the binding between glycosphingolipids, phospholipids and steroids. The kyoto encyclopedia of genes and genomes (KEGG) analysis indicated that the associated targets were mainly enriched in the Th1/Th2 cell differentiation pathways, lipid metabolism and inflammatory bowel disease pathways. The results indicated that RA intervention could significantly suppress the elevation of allergic mediators in the serum of mice sensitizes with OVA. In addition, the RA intervention group showed a decrease in the levels of total cholesterol and triglycerides in the mouse serum. In lipidomics analysis, 25 and 36 differentially expressed lipid metabolites were screened in positive and negative ion modes, respectively. Enrichment analysis of the differentially expressed lipid metabolites indicated that the serum lipid metabolism in mice affected glycerophospholipid metabolism and sphingolipid metabolic pathways. Therefore, this study demonstrated that RA primarily exerted its alleviating effect on food allergies by regulating lipid metabolism and the body's inflammatory response.
-
Keywords:
- food allergy /
- rosmarinic acid /
- anti-allergy /
- network pharmacology /
- lipidomics
-
食物过敏是指机体摄入含有某种致敏成分的食物而引发的不良变态免疫反应[1−2]。食物过敏反应症状复杂多样,可导致呼吸道、皮肤、胃肠道等多个系统受到损害,甚至引起过敏性休克,严重时会威胁人类的生命健康[2−3]。近年来,世界范围内食物过敏的发病率呈逐年上升趋势,已成为全球广泛关注的公共卫生问题[3−4]。根据世界卫生组织和联合国粮食与农业组织的统计,90%以上的食物过敏反应是由牛乳、鸡蛋、大豆、花生、小麦、坚果、鱼类和甲壳类动物这8类食物及其相应制品引发[5]。目前,主要用一些抗过敏类药物治疗食物过敏,该类药物存在副作用大及易复发等缺点。因此,挖掘无毒无副作用的缓解食物过敏的膳食活性成分至关重要。
植物是一类重要的食药同源资源,当前报道具有抗过敏活性的物质大部分存在于食药用植物中。迷迭香酸(Rosmarinic acid,RA)是一种咖啡酸酯天然多酚类化合物,主要存在于芳香植物中,具有多种生物活性,如抗氧化性、保护肝脏、抗炎和抗过敏等[6−7]。RA对过敏性炎症的缓解也逐渐被报道,如RA可通过抑制小鼠双微体基因MDM2和胸腺基质淋巴细胞生成素,从而降低TSLP诱导的HMC-1细胞TNF-α,IL-6和IL-1等过敏炎性因子的表达[8]。RA对卵清蛋白诱导的肠道食物过敏小鼠肝脏的氧化应激和炎症的稳态调节起到保护肝脏的作用[9]。在过敏性鼻炎和过敏性皮炎中,RA也被广泛报道对过敏炎症具有缓解作用[10−12],这些报道为RA缓解食物过敏提供了理论支持,但未对其基于脂质代谢的潜在途径和效应机制进行研究。
网络药理学采用“网络靶点、多组分”模式评估药物的合理性和兼容性,对新药物的发现提供理论支持[13]。分子对接是采用计算机技术研究蛋白受体和药物分子配体的结合位点和亲和力的一种理论模拟方法,已广泛应用于天然功能活性成分的筛选[14]。而组学是指用先进的高通量技术研究分子和细胞之间的相互作用和关系。本研究采用网络药理学和分子对接方法预测RA缓解食物过敏的潜在途径和机制。进一步建立OVA诱导的食物肠道过敏模型,探究RA对食物过敏的缓解效应,并利用非靶脂质组学的方法探讨RA缓解食物过敏的潜在效应机制。
1. 材料与方法
1.1 材料与仪器
无特定病原体级雌性BALB/c小鼠 6~8周,20~24 g,30只,北京斯贝福生物技术有限公司(SCXK(京)2019-0010);小鼠垫料、小鼠维持饲料 湖北贝恩特生物科技有限公司;迷迭香酸 纯度>97%,上海阿拉丁生化有限公司;Ovalbumin 纯度>97%,美国Sigma公司;铝佐剂 美国赛默飞世尔公司;OVA特异性抗体、组胺、单核细胞趋化蛋白-1(mMCP-1)试剂盒 武汉Finetest生物公司;T-CHO、TG试剂盒 南京建成生物工程研究所;甲醇、异丙醇、乙腈、甲酸铵、甲酸、叔丁基甲醚 色谱纯,美国赛默飞世尔公司。
Vanquish UHPLC-Orbitrap Exploris 120高分辨质谱仪 美国赛默飞世尔公司;T3色谱柱(2.1 mm×100 mm,1.7 µmol/L) 美国沃特世公司。
1.2 实验方法
1.2.1 RA信息和靶点获取
将RA输入Pubchem化合物数据库进行检索,获取RA的二维、三维结构和SMILES式。再将RA输入TCMSP,二维结构或三维结构导入Swiss Target Prediction和Pharm Mapper数据库;SMILES式输入Super Pred数据库,选择人类蛋白质类型;筛选Swiss Target Prediction数据库中适配度(fit score)>3分,Pharm Mapper数据库中可能性(probability)>0,Super Pred数据库中可能性(probability)≥80%,模型精准度(Model accuracy)≥85%的潜在靶点。将以上四个数据库得到的潜在靶点合并去重,使用String数据库将其潜在靶点转换为人类基因标准名。
1.2.2 食物过敏靶点获取
利用Gene Cards、TTD和CTD数据库,以食物过敏为关键词获得疾病的潜在靶点。筛选Gene Cards数据库中score>10分,CTD数据库中score>10分的潜在靶点。对以上3个数据库的靶点合并去重且转换为人类基因标准名。同时将靶点和1.2.1获得的RA的潜在靶点交互得到共同靶点。
1.2.3 蛋白质互作网络构建
将1.2.2交互得到的共同靶点导入STRING在线分析数据库,选择“HOMO sapiens”得到PPI关系图,选择score>0.4的数据,绘制最终的PPI关系图。
1.2.4 富集分析
利用注释、可视化和集成发现数据库(database for annotation visualization and integrated discovery,DAVID)对PPI关系图中的交集基因进行基GO富集和KEGG分析,了解RA缓解食物过敏的可能的生物功能和信号途径,同时在KEGG mapper进行通路的分析。
1.2.5 分子对接验证
选择关键靶点蛋白进行分子对接验证。在PDB数据库下载关键靶点蛋白的3D结构,对小分子和蛋白质进行加氢、去水等,最后利用AutoDockTools软件进行分子对接。
1.2.6 动物模型建立
动物实验遵守国家科学和技术委员会《实验动物护理和使用指南》和华中科技大学同济医学院动物伦理委员会规章,且均在华中科技大学同济医学院动物实验屏障房内操作(SYXK(鄂)2021-0057);动物实验条件:光照12 h亮和12 h暗交替,温度(23±2 ℃),湿度(50%~70%)。参照Liu等[15]的方法,以BALB/c小鼠为实验对象,OVA为过敏原,建立食物过敏模型。30只BALB/c小鼠随机分为5组(6只/组)。分别在第0 d和14 d PBS阴性组小鼠腹腔注射PBS:铝佐剂=1:1的混合液200 µL/只,对OVA模型组和样品组腹腔注射OVA(5 mg/kg):PBS:铝佐剂=2:1:1的混合液200 µL/只。第27 d起,每天对小鼠进行灌胃处理,阴性组和模型组小鼠灌胃200 µL/20 g的PBS作为对照,样品组小鼠灌胃200 µL/20 g RA,浓度分别为30 mg/kg(低剂量), 90 mg/kg(中剂量) 和270 mg/kg(高剂量)。同时每3 d进行1次过敏挑战,在每次过敏挑战前小鼠禁食不禁水1 h,模型组和RA剂量组小鼠灌胃200 µL/20 g的OVA(2.5 g/kg,PBS为溶剂),Control组小鼠灌胃200 µL/20 g的PBS作为对照,共进行五次过敏挑战。在第5次过敏挑战后,1 h内收集小鼠尾静脉血清,−80 ℃下保存备用。在第41 d,收集小鼠的眼球血清。
1.2.7 血清学检测
小鼠血清中的OVA特异性抗体、组胺和mMCP-1含量的检测根据Finetest的ELISA试剂盒说明书进行检测。根据南京建成试剂盒说明书检测T-CHO、TG含量。
1.2.8 血清样本前处理
吸取小鼠血清50 µL加入300 µL甲醇,涡旋10 min。再加入1 mL的甲基叔丁基醚(Methyl tert-butyl ether,MTBE)室温涡旋30 min。加入200 µL的水涡旋后静置10 min,收集上清液于新离心管中,重复3~5次,充分提取后在4 ℃,10000×g的条件下离心15 min,收集上清液于新离心管中氮吹至近干。吹干后的样品加入1 mL乙腈-异丙醇(v/v,7:3)溶液复溶,涡旋混匀后于4 ℃,10000×g离心15 min,吸取上清液待用。每个样本各取150 µL混匀作为质控样,上机检测时,每检测6个样品,进行一次质控检测。
1.2.9 分离检测条件
1.2.9.1 液相条件
流动相:A相:乙腈-水-甲醇(1:1:1,v/v/v)含有0.05%甲酸和10 mmol/L 甲酸铵;B相:异丙醇;流速:0.3 mL/min;柱温:45 ℃;进样量:10 μL。流动相洗脱程序见表1。
表 1 流动相洗脱梯度Table 1. Mobile phase elution gradient时间(min) A(%) B(%) 流速 (mL/min) 0 80 20 0.3 1.5 70 30 0.3 3.5 60 40 0.3 7 40 60 0.3 8 40 60 0.3 9 30 70 0.3 11 20 80 0.3 13.5 10 90 0.3 18 10 90 0.3 18.1 80 20 0.3 20 80 20 0.3 1.2.9.2 质谱条件
质谱仪:赛默飞Orbitrap Exploris 120高分辨质谱仪;离子模式:分别采用正离子模式和负离子模式的全扫描检测方式。Orbitrap-MS参数如下:电离源H-ESI/H+ESI;喷雾电压-3000 V/3500 V;鞘气体压力30 arb;辅助气压力10 arb;离子迁移管温度320 ℃;蒸发温度400 ℃;采集范围200~1700 m/z;射频70%;累计时间0.5 s;动态排除时间5 s。Orbitrap-MS/MS参数如下:采集范围75~1800 m/z;碰撞能量模式Stepped;碰撞能量25 eV,30 eV;累计时间0.54 s。
1.3 数据处理
数据采用SPSS 21.0软件进行数据分析,均以平均数±标准差表示,使用 GraphPad Prime 9.0软件制作图片,组间比较采用单因素方差分析,P<0.05具有统计学意义。组学数据采用MS-DIAL软件对原始数据进行峰过滤、峰识别、峰对齐、归一化、标准化以及化合物的鉴定。采用Metabo Analyst 5.0和LIPEA线上平台对标准化的数据进行多元统计分析和代谢通路分析。
2. 结果与分析
2.1 RA缓解食物过敏的潜在靶点的获取
RA的Pubchem CID是5281792,在Pubchem数据库中检索到的RA二维和三维结构如图1A~图1B,且SMILES编码为C1=CC(=C(C=C1C[C@H](C(=O)O) OC(=O)/C=C/C2=CC(=C(C=C2)O)O)O)O。通过TCMSP、Swiss Target Prediction、Pharm Mapper和Super Pred数据库分析,分别得到33、100、404、109个靶点,删除重复值后得到604个RA的靶点,其中符合Swiss Target Prediction数据库中适配度(fit score)>3分,Pharm Mapper数据库中可能性(probability)>0,Super Pred数据库中可能性(probability)≥80%,模型精准度(Model accuracy)≥85%的潜在靶点有418个,这些靶点可以用来评估RA的药理活性机制。
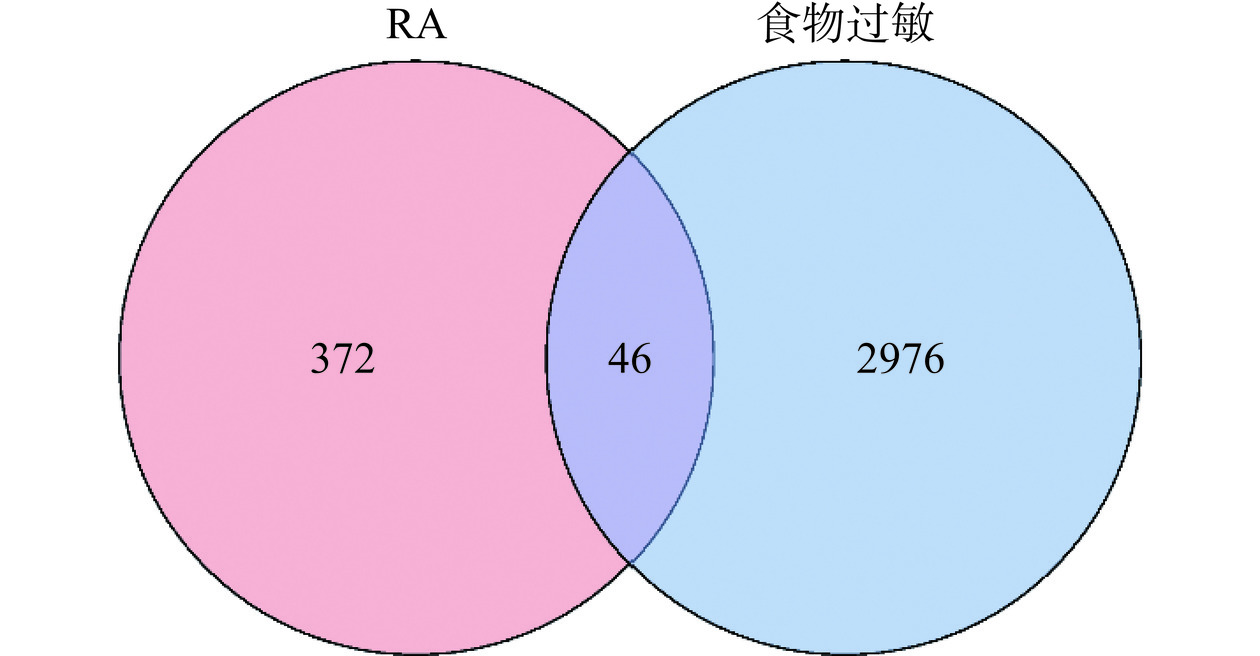
利用Gene Cards、TTD和CTD数据库,以食物过敏为关键词分别获得1657、43、27020个靶点,删除重复值后符合筛选条件Gene Cards数据库中score>10分,CTD数据库中score>10分的靶点有3302个。将RA和食物过敏的靶点交互得到46个关联靶点,这些靶点初步确定为RA缓解食物过敏症状的关键靶点。
2.2 PPI构建分析
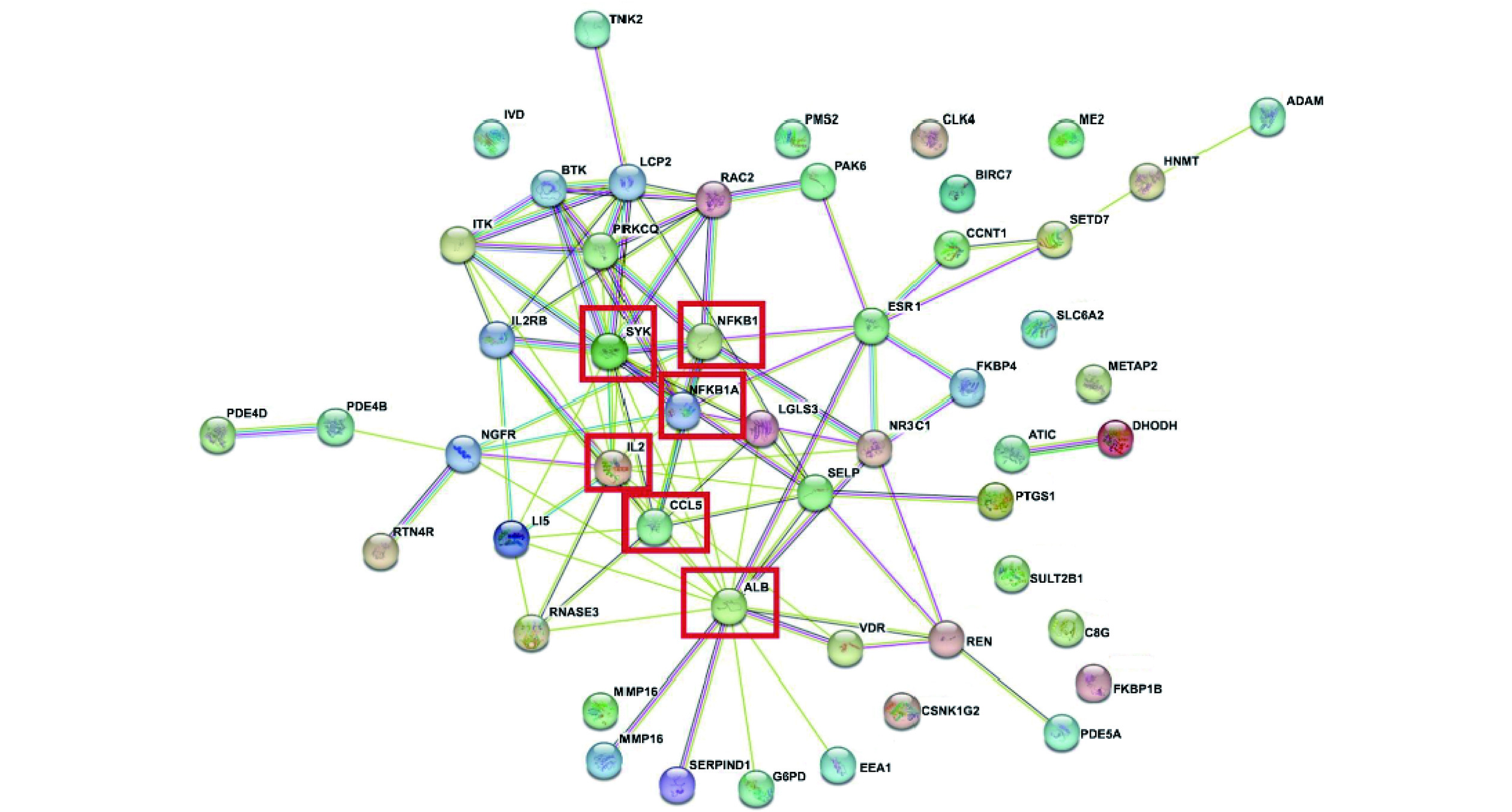
使用STRING数据库对图2交互得到的46共同靶点进行了PPI分析,判定score>0.4,获得PPI网络如图3,图中共有50个节点,其中11个节点属于游离节点,线条代表蛋白之间存在的联系,共有194条,线条交互值前六的蛋白分别是ALB、IL-2、SYK、CCL5、NFKBIA和NFKB1,说明这些蛋白在该PPI网络中较重要,这些靶点可判断为是RA缓解食物过敏的潜在靶点。
2.3 生物学过程及通路富集分析
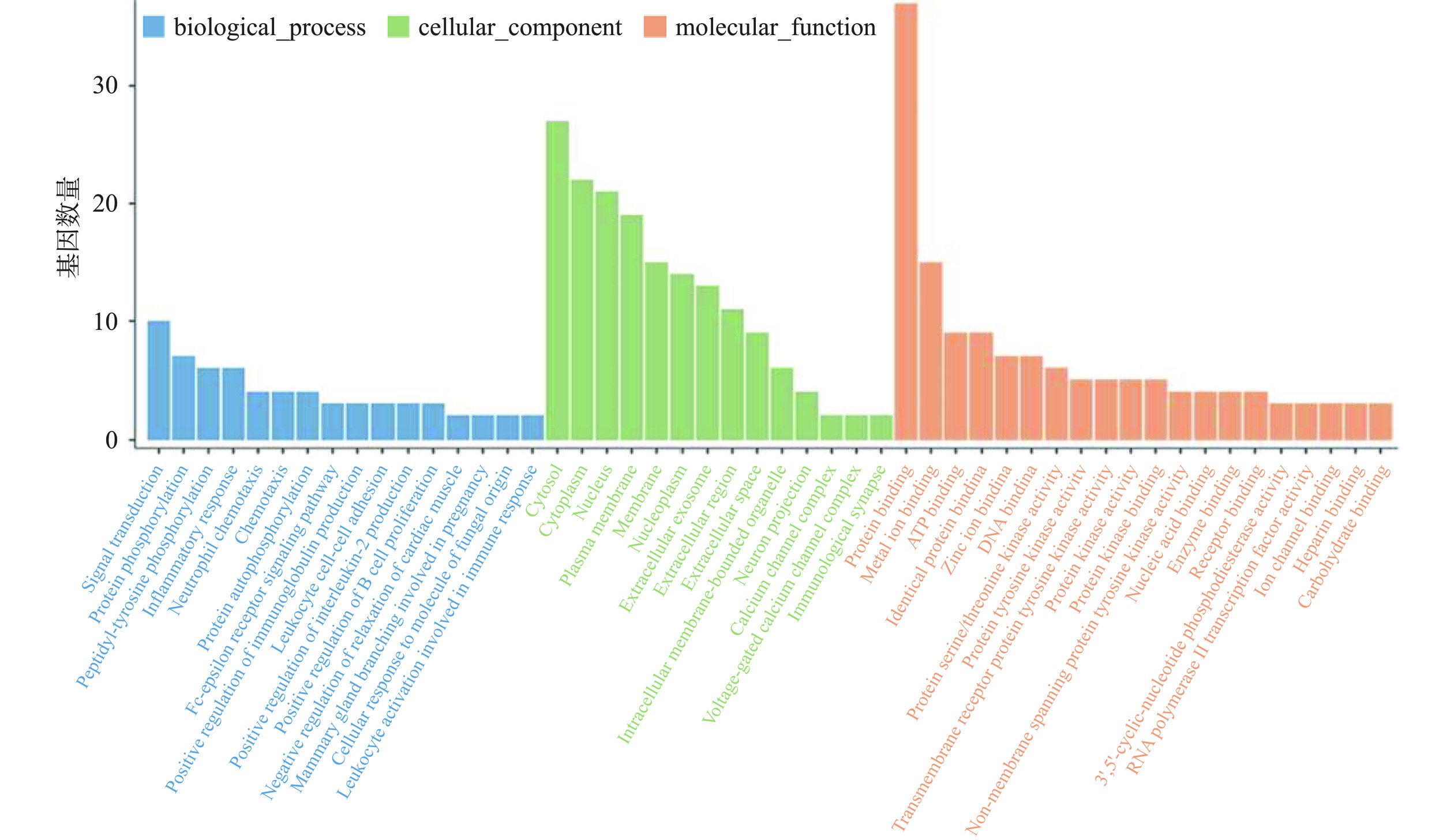
在David数据库中将获得的RA缓解食物过敏的靶点进行GO富集分析,共获得103个富集结果。如图4所示,GO富集结果包括56个生物过程(GO Biological Process:GO-BP),其中16条-log P≥2,主要为Fc epsilon RI signalig pathway (FcεRI) 通路、蛋白质磷酸化(protein phosphorylation)、炎症反应(inflammatory response)、免疫球蛋白产生的正向调节(positive regulation of immunoglobulin production)、中性粒细胞趋化(neutrophil chemotaxis)、信号传导(signal transduction)和B细胞增殖的正向调节(positive regulation of B cell proliferation)等。其中FcεRI信号通路是食物过敏发生的主要通路,为RA缓解食物过敏提供了生物过程的支撑;GO富集结果显示,14个GO Cellular Component (GO-CC)主要集中在细胞外区域、细胞质膜、钙离子复合通道和免疫突触。钙离子细胞内流是引起食物过敏中效应细胞脱颗粒的关键因素,GO-CC结果中靶标蛋白在钙离子复合通道的富集,为从细胞角度研究RA缓解食物过敏的机制提供了理论依据;GO富集中共有33个GO Molecular Function(GO-MF),其中20个结果P<0.05,主要参与分子功能的蛋白、金属离子、受体、离子通道、鞘糖脂、磷脂和类固醇等的结合,为RA缓解食物过敏提供了生物学的理论依据。
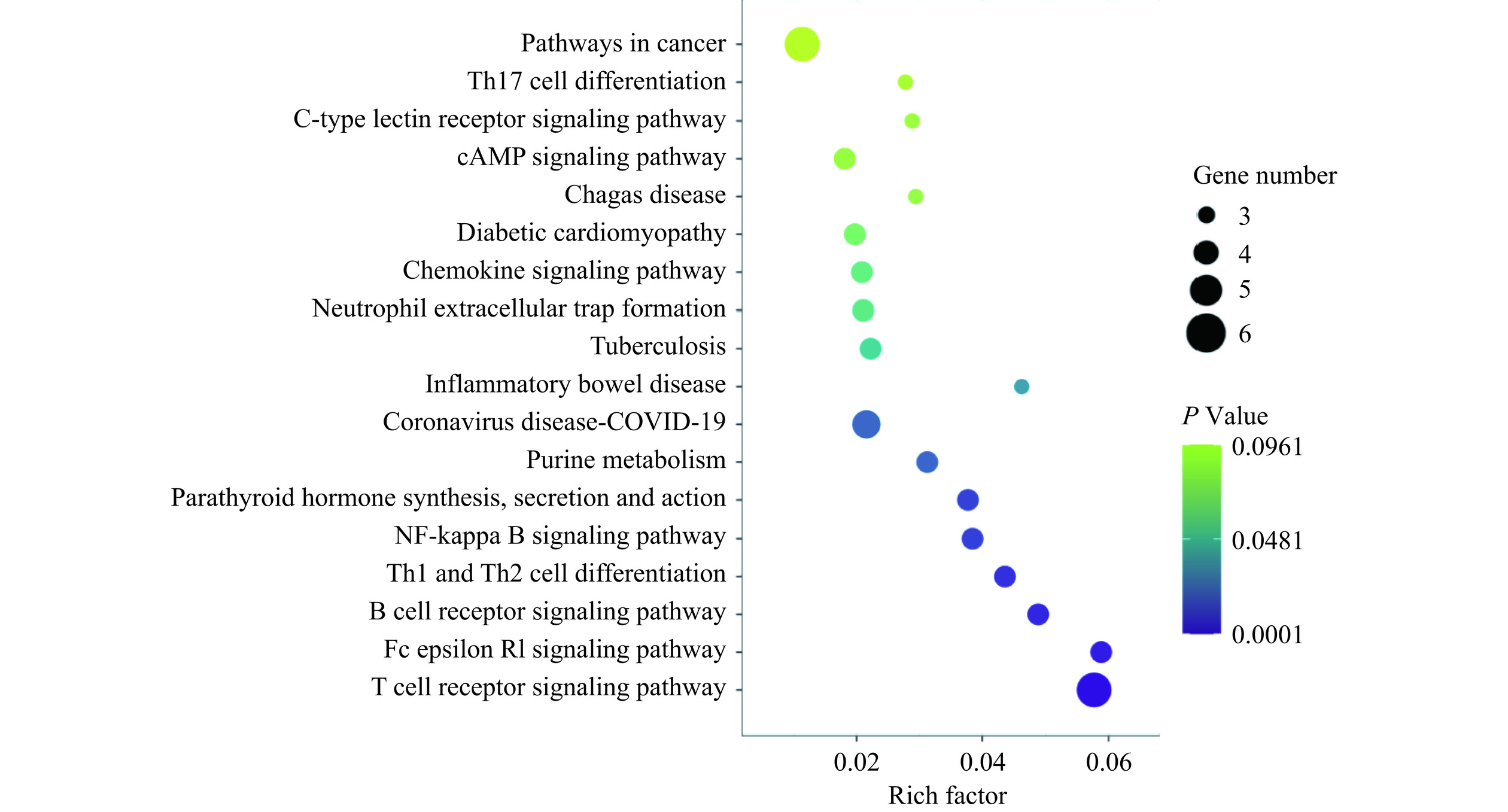
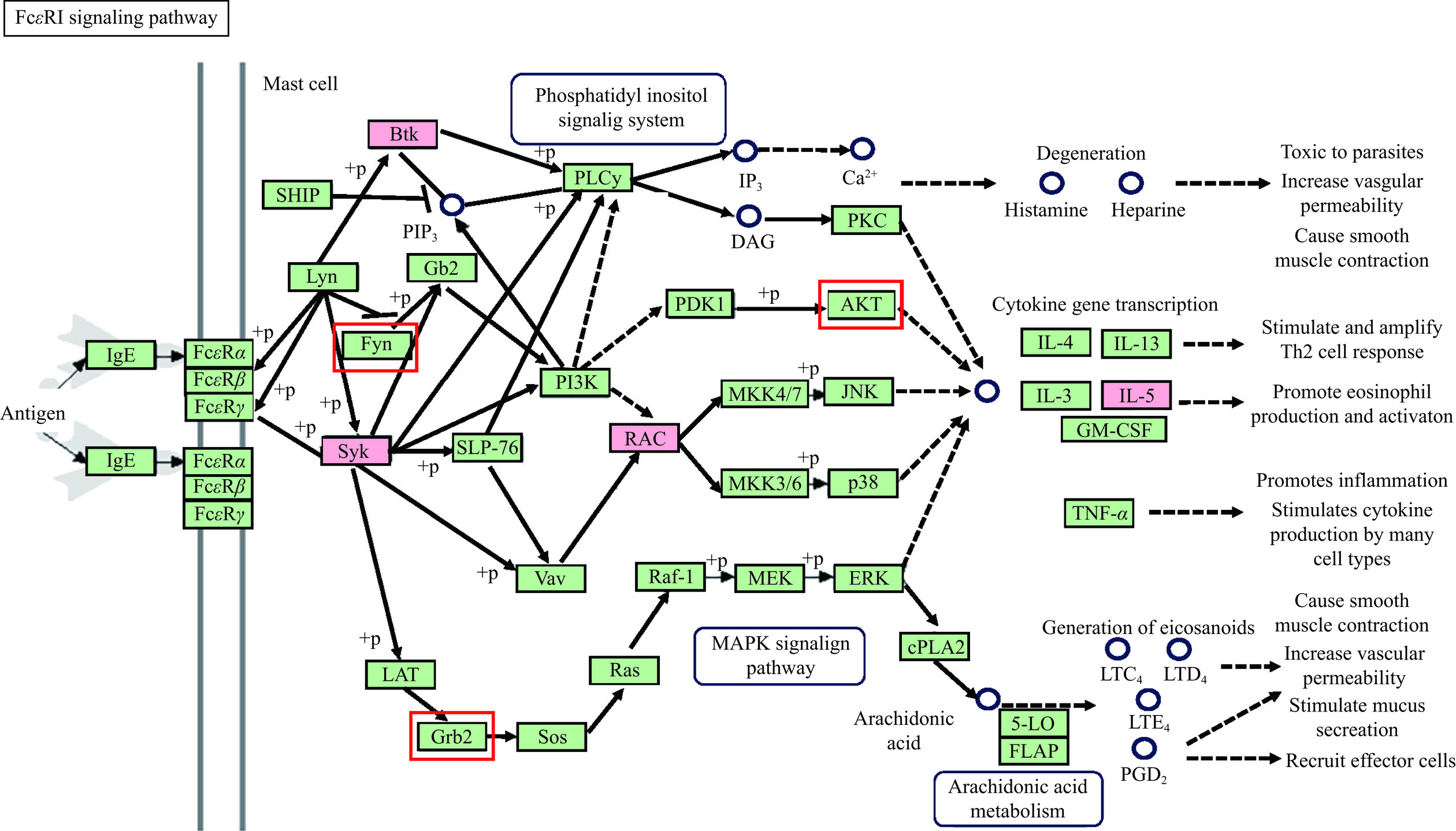
通过KEGG分析得到18条相关通路(图5),关联蛋白主要富集(P<0.05)的通路有:T细胞受体信号通路、Th1和Th2细胞分化通路、FcεRI通路、B细胞通路(B cell receptor signaling pathway)、NF-κB通路(NF-kappa B signaling pathway)、和炎症性肠病通路(Inflammatory bowel disease)。RA缓解食物过敏可能和以上通路相关,因为FcεR I通路和食物过敏发生的关系密切,通过KEGG数据库进行KEGG Mapper可视化分析(图6),RA的Fyn、Grb2、AKT 3个靶点和RA和食物过敏的共同靶点Btk、Syk、RAC、IL-5 4个重要靶点都分布在FcεRI通路上。
2.4 分子对接结果
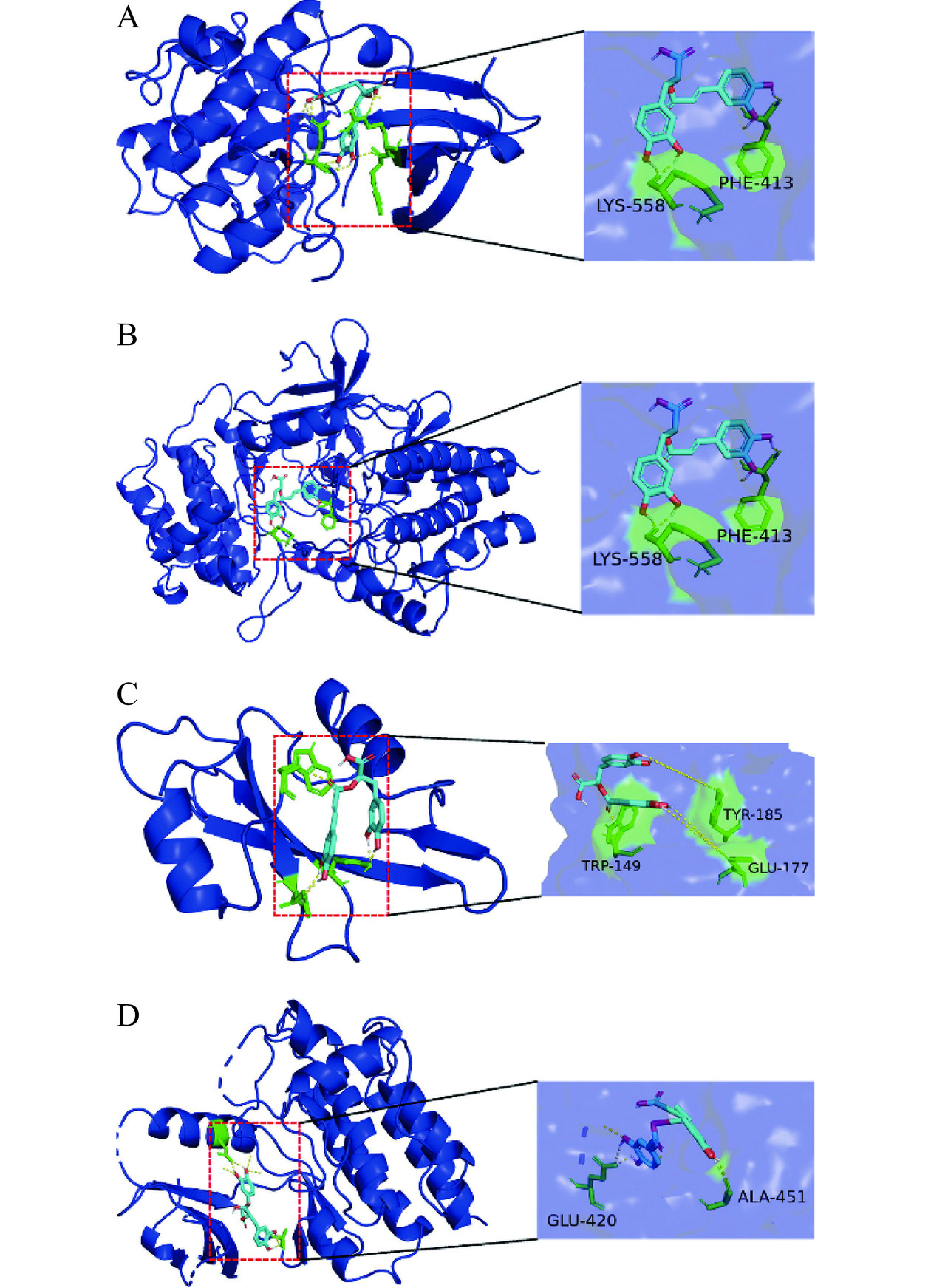
根据文献查阅和KEGG通路分析,FcεRI通路和食物过敏发生的关系密切,选用此通路的相关靶点AKT、Btk、Fyn、Syk与RA进行分子对接,结果见表2。同时,对结果进行可视化作图,并显示氢键和蛋白氨基酸残基的位置,结果如图7所示。RA与上述靶点蛋白的结合能力均小于−4 kJ/mol,表明RA与FcεRI通路靶点蛋白有一定的结合能力。分子对接结果表明,结合能越小,活性成分与蛋白质之间的结合越稳定[16]。RA与FcεRI通路核心靶点与RA表现出不同的结合能力,其中与AKT的结合最为紧密。分子对接结果验证了RA可缓解食物过敏的可能性。
表 2 RA与蛋白靶点分子对接结果Table 2. RA docking results with protein target molecules蛋白靶点 结合能力(kJ/mol) AKT −6.58 Btk −5.17 Fyn −4.01 Syk −5.9 2.5 RA对致敏小鼠过敏介质的影响
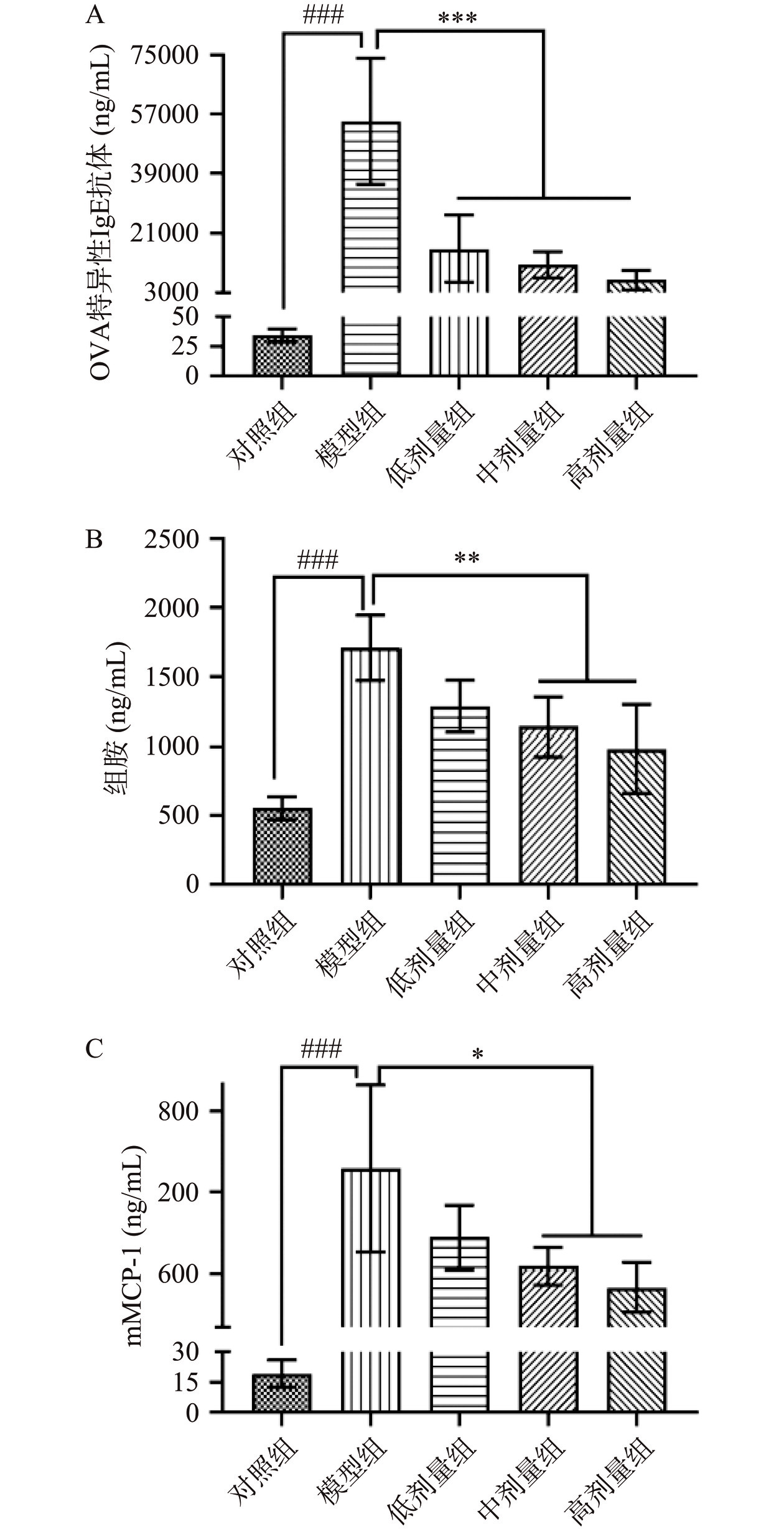
血清中致敏原特异性IgE水平的上升是食物过敏的重要标志[1]。利用OVA特异性抗体ELISA试剂盒检测RA对小鼠血清的OVA特异性IgE抗体水平的影响。结果表明,与对照组相比,模型组小鼠血清中OVA特异性IgE抗体含量极显著升高(P<0.001),达到54799.9 ng/mL(图8A),说明OVA诱导的食物过敏小鼠模型建立成功。进一步与模型相比,RA低、中和高剂量干预组的小鼠血清中的OVA特异性IgE抗体含量分别显著降低至16265.9、11568.5、6892.33 ng/mL(P<0.001)(图8A),表明RA灌胃处理能够呈剂量依赖性降低过敏小鼠血清中食物抗原特异性IgE抗体的含量。
肥大细胞激活后,会释放组胺、mMCP-1等介质,导致血管通透性增强,平滑肌收缩和腺体分泌增加,进而引发特应性皮炎、哮喘、致敏性肠胃炎,甚至休克等过敏反应症状[17]。因此,血清中组胺及mMCP-1等过敏介质的升高,是食物过敏的重要血清指标。如图8B,与对照组相比,模型组小鼠血清中的组胺含量显著升高(P<0.001),达到1709.1 ng/mL。与模型组相比,经RA低、中和高剂量干预组的小鼠血清中组胺含量分别显著(P<0.01)降低至1285.02、1139.95、981.43 ng/mL。如图8C,与对照组相比,模型组小鼠血清中的mMCP-1含量显著(P<0.001)升高,达到1372.1 pg/mL。与模型组相比,经RA低、中和高剂量干预组的小鼠的血清中的mMCP-1含量分别显著(P<0.05)降低至861.18、649.83、492.94 pg/mL,说明RA灌胃处理呈剂量依懒性降低过敏小鼠血清中组胺和mMCP-1的含量。
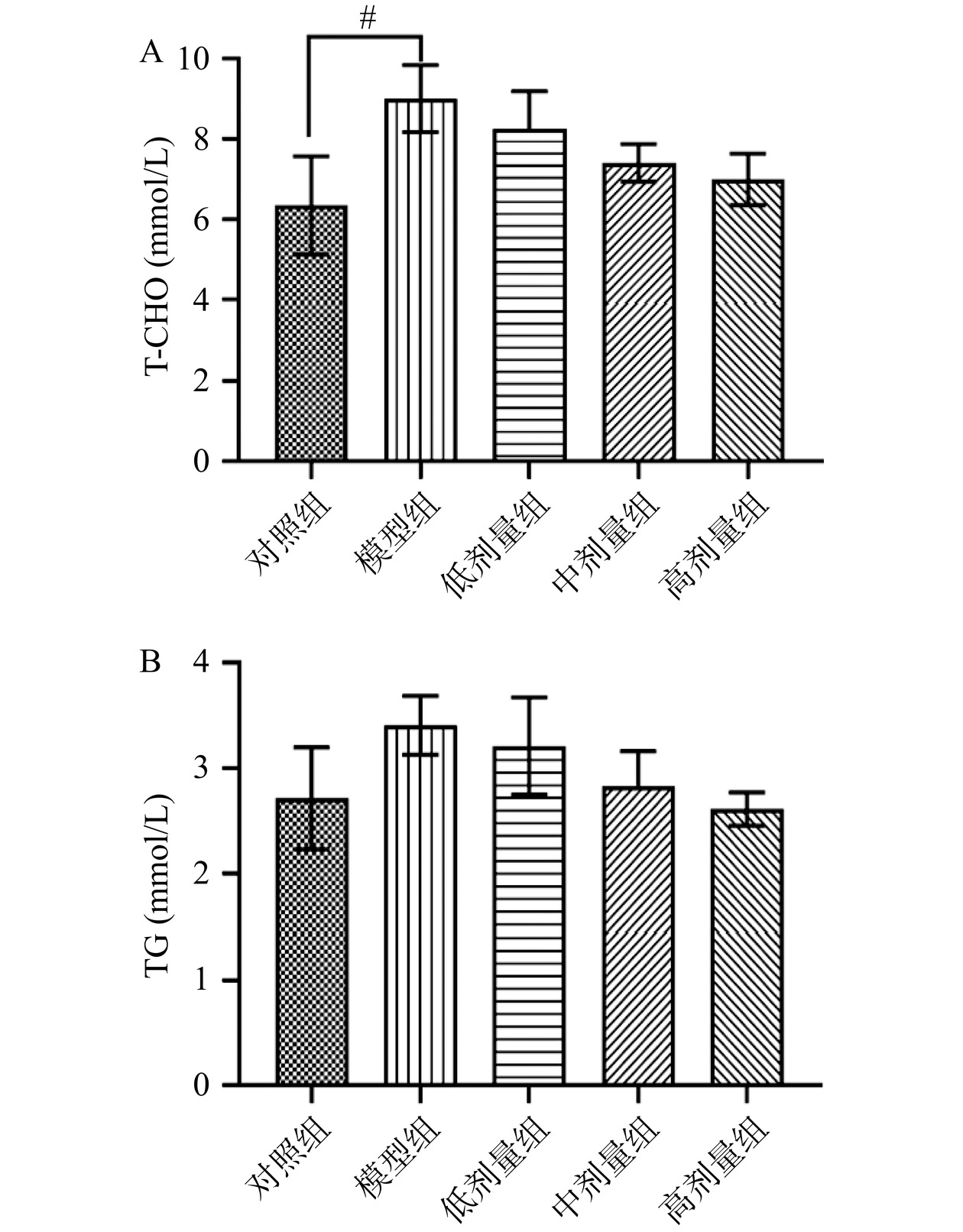
2.6 RA对致敏小鼠血清T-CHO、TG的影响
总胆固醇是指血液中所有脂蛋白所含胆固醇的总和,包括游离胆固醇和胆固醇酯。如图9A,与对照相比,模型组的T-CHO含量显著(P<0.05)增加,RA处理组与模型组差异不显著(P>0.05),但成剂量依赖性减少。如图9B,与对照组相比,模型组TG含量增加,RA处理组与模型组相比,减少不显著(P>0.05),但有一定的剂量依赖性。
2.7 代谢物主成分分析
主成分分析是一种对数据集进行简化的技术,通过数据分析,观察对照组、模型组和RA低、中和高剂量处理组质控样本的数据,并观察组间分布和离群数据,剔除离群数据后得到PCA图(图10),质控样本分布集中,说明仪器检测时响应稳定,检测结果可靠。图10A是正离子模式,图10B是负离子模式,在两个模式下,模型组和对照组及RA低、中和高剂量组代谢物明显分开,说明模型组与对照组及RA剂量组中脂质代谢存在差异。
同时进行OPLS-DA进行分析和200次置换检验,对模型进行验证以确定未过拟合分析。如表3,在正模式下,四个模型的R2X分别是0.806、0.575、0.719和0.807,R2Y分别是0.999、0.987、0.994和0.997,Q2分别是0.989、0.939、0.972和0.985。如表4,在负离子模式下,四个模型的R2X分别是0.697、0.65、0.637和0.66,R2Y分别是0.999、1、1和0.998,Q2分别是0.98、0.901、0.978和0.969。在四个模型中R2X和R2Y均大于0.4,说明四个模型对自变量和因变量的解释较好,且Q2大于0.9,说明四个模型的预测能力极好可用于后续差异成分的筛选。
表 3 正模式OPLS-DA置换检验Table 3. Displacement test of OPLS-DA in positive ion mode正模式 R2X R2Y Q2 模型组VS对照组 0.806 0.999 0.989 模型组VS低剂量组 0.575 0.987 0.939 模型组VS中剂量组 0.719 0.994 0.972 模型组VS高剂量组 0.807 0.997 0.985 表 4 负模式OPLS-DA置换检验Table 4. Displacement test of OPLS-DA in negative ion mode正模式 R2X R2Y Q2 模型组VS对照组 0.697 0.999 0.98 模型组VS低剂量组 0.65 1 0.901 模型组VS中剂量组 0.637 1 0.978 模型组VS高剂量组 0.66 0.998 0.969 2.8 潜在差异脂质代谢物的筛选
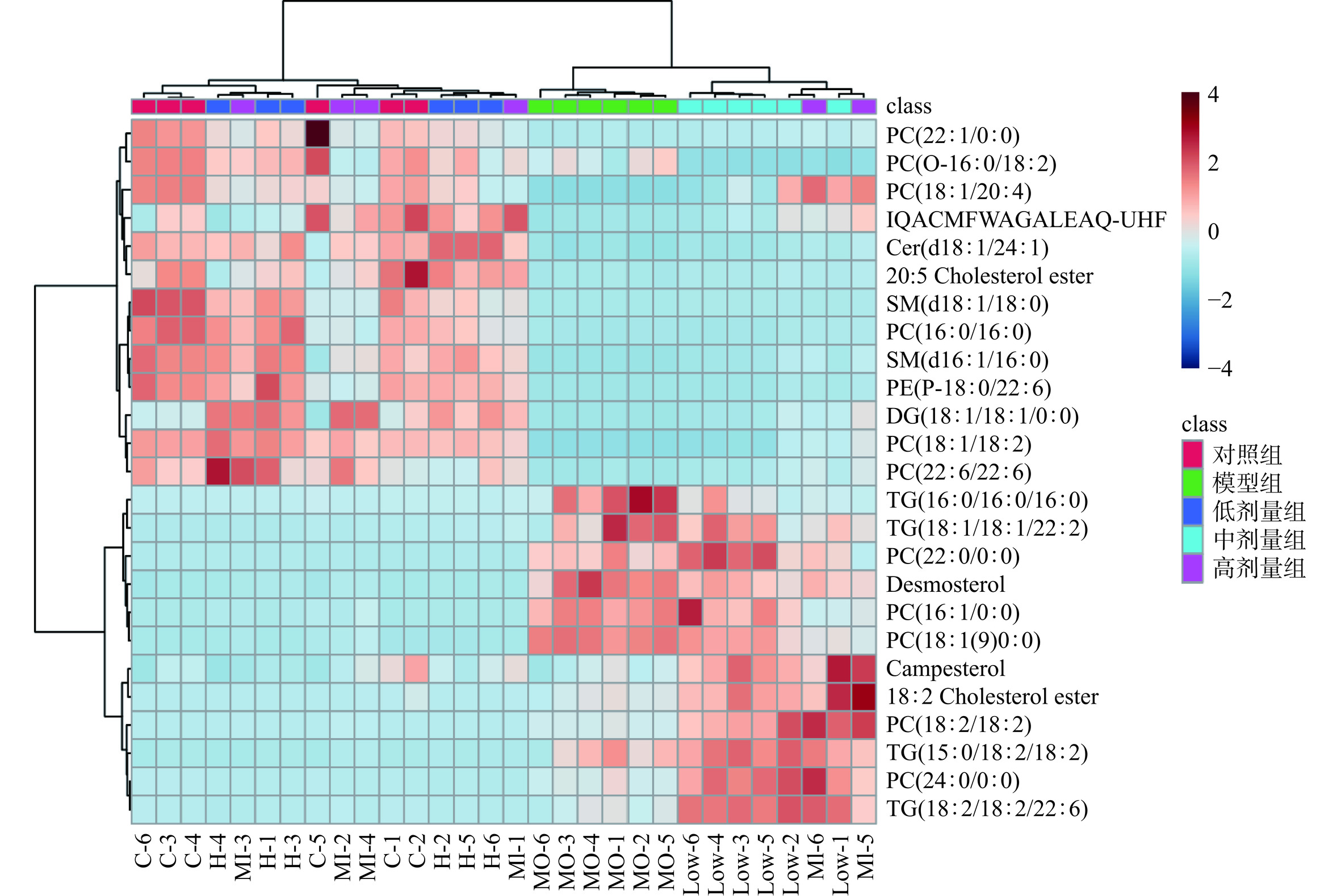
根据S-plot的横坐标X绝对值>0.05和纵坐标Y绝对值>0.1,VIP值>1,变异倍数分析FC大于1.5或小于0.5和T检验的P<0.05的原则筛选潜在差异代谢物。通过化合物鉴定和去重,在正离子模式下共筛选出25个差异代谢物。使用Metabo Analyst 5.0对差异脂质代谢物进行聚类分析,结果如图11,红色部分代表对应的差异化合物的上调,蓝色部分代表差异化合物的下调。与其他组相比,模型组下调的脂质化合物鞘磷脂(Sphingomyelin,SM)(d18:1/18:0)、磷脂酰胆碱(Phosphatidylcholine,PC)(16:0/16:0)、鞘磷脂SM(d16:1/16:0)、磷脂酰乙醇胺(Phosphatidylethanolamine,PE)(P-18:0/22:6)、甘油二酯(Diacylglycerol,DG)(18:1/18:1/0:0)、神经酰胺(Ceramide,Cer)(d18:1/24:1)、磷脂酰胆碱PC(18:1/18:2)、磷脂酰胆碱PC(22:1/0:0)、磷脂酰胆碱PC(O-16:0/18:2)、磷脂酰胆碱PC(18:1/20:4)、20:5 胆固醇酯(Cholesterol ester)、甘油三酯(Triglyceride,TG)(18:2/18:2/22:6)。
![]() 图 11 正离子模式差异脂质化合物的聚类热图注:C1~C6代表对照组; MO1~MO6代表模型组; Low1~Low6代表低剂量组; MI11~MI6代表中剂量组;H1~H6代表高剂量组;图12同。Figure 11. Clustering heat map of lipid compounds with positive ion mode differences
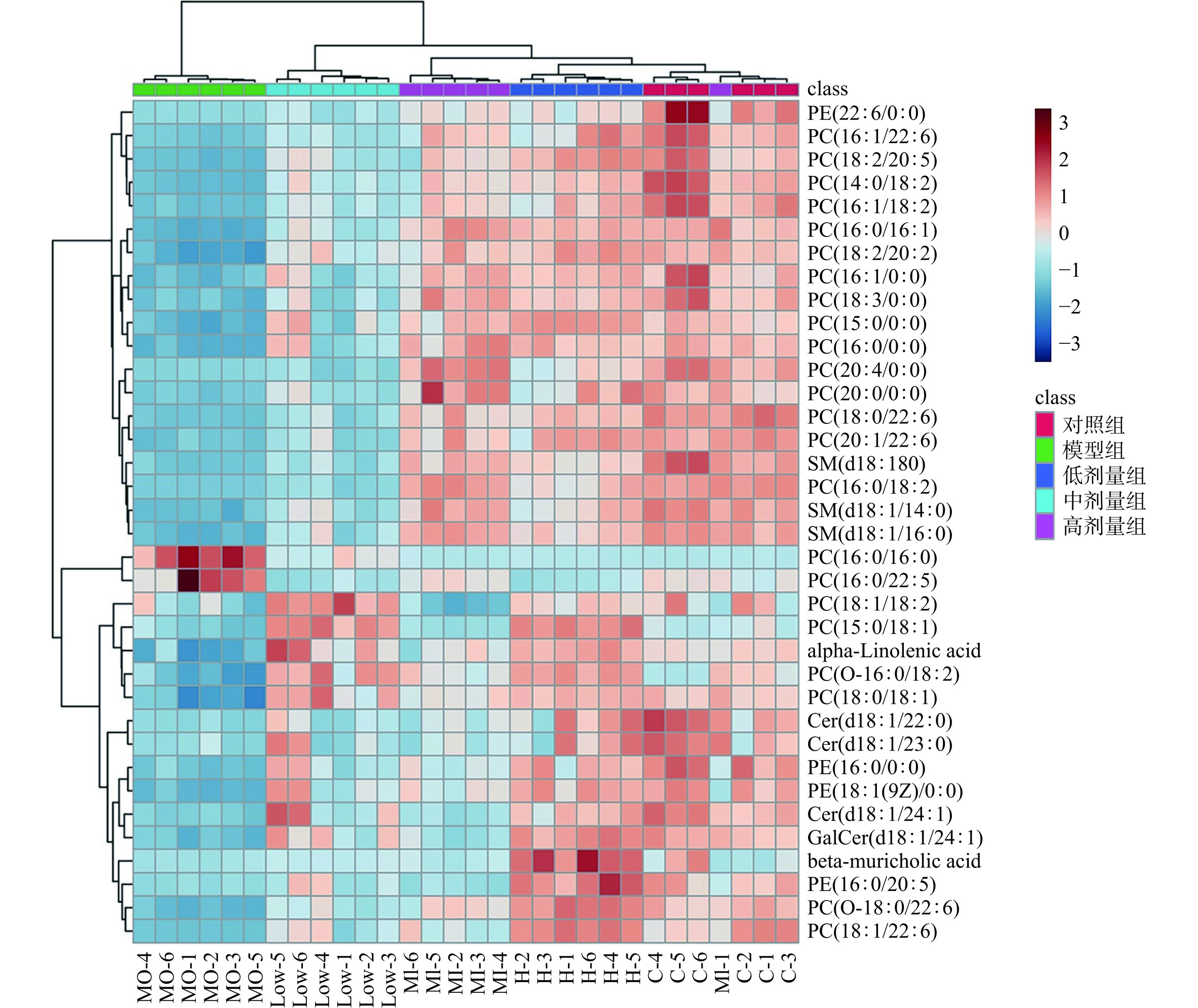
图 11 正离子模式差异脂质化合物的聚类热图注:C1~C6代表对照组; MO1~MO6代表模型组; Low1~Low6代表低剂量组; MI11~MI6代表中剂量组;H1~H6代表高剂量组;图12同。Figure 11. Clustering heat map of lipid compounds with positive ion mode differences通过化合物鉴定和去重,在负离子模式下一共筛选出36个差异代谢物。用Metabo Analyst 5.0对差异脂质代谢物进行聚类分析,结果如图12,与其他组相比,模型组的部分脂质化合物呈下调,经RA干预后脂质化合物有上调趋势,其中RA高剂量组上调明显。
2.9 潜在差异代谢物的代谢通路分析
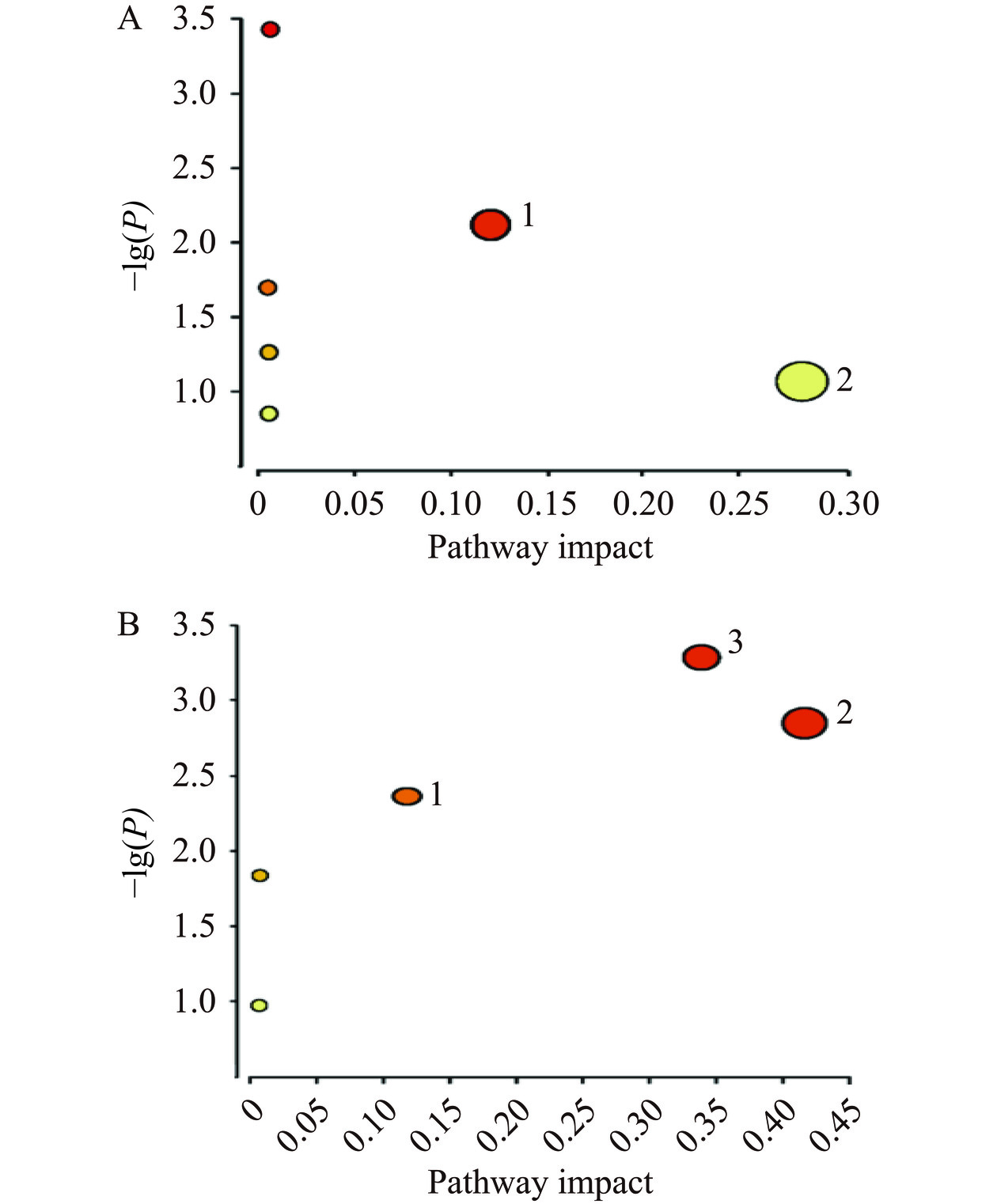
将61个差异脂质化合物通过Metabo Analyst 5.0进行通路富集分析,得到的脂质代谢通路拓扑图如图13,其中通路的影响分数Impact>0.1,P<0.05为有意义的通路。如图13A是正离子模式的脂质代谢通路,影响较大的通路是甘油磷脂代谢(Impact=0.11182,P=0.0074218)。如图13B是负离子模式的脂质代谢通路,影响较大的是甘油磷脂通路(Impact=0.11182,P=0.0050211)、鞘脂代谢通路(Impact=0.40974,P=0.0017067)和α-亚麻酸通路(Impact=0.3333,P=0.0006405)。
3. 讨论与结论
网络药理学是融合了系统生物学和计算机技术,为复杂中药的机制研究提供新方向的一门学科[18]。其特点是可对中药的多种成分、多种疾病进行多靶点的关联分析。研究人员可以利用蛋白网络分析模型快速地确定药物核心靶点,再进行生物信息学分析,确定药物对疾病的作用机制[14]。本研究通过网络药理学预测出RA的潜在作用靶点418个、食物过敏疾病相关靶点3022个,分析得到药物-疾病共有靶点46个。其中主要靶点有ALB、NFKB1、NFBB1A、IL-2、SYK、CCL5、Fyn、AKT、Btk、Grb2、RAC、IL-5,这些靶点通过对T细胞受体信号通路、Th1和Th2细胞分化通路、FcεRI通路、B细胞通路、NF-κB通路、脂代谢和炎症性肠病通路的调节发挥缓解食物过敏的作用。
IgE介导的超敏反应是食物过敏的主要机制,分为致敏阶段和效应阶段。致敏阶段,食物致敏原的初次暴露导致机体Th1/Th2免疫应答失衡,向Th2倾斜。Th2细胞进而分泌IL-4等细胞因子诱导激活B细胞发生抗体分泌类别转换,合成并分泌特异性IgE抗体。IgE抗体可与靶细胞(肥大细胞或噬碱性粒细胞)表面的FcεRI结合,使靶细胞处于致敏状态[19−20]。效应阶段,致敏原再次暴露通过与引起FcεRI交联性聚集,激活受体近端酪氨酸激酶,启动下游级联促进各种关键蛋白的磷酸化,导致钙离子的内流,最终引起效应细胞发生脱颗粒反应[19,21]。Sun等[22]发现藿香正气液可以通过FcεRI通路调节食物过敏症状。本研究中网络药理分析结果表明,RA和FcεRI有AKT、Btk、Fyn、Syk 4共同的作用靶点。RA与上述靶点蛋白的结合能力均小于−4 kJ/mol,表明RA与靶点蛋白有一定的结合能力,验证了RA治疗食物过敏的可能性。因此,网络药理和分析对接结果表明,对FcεRI通路的抑制,是RA缓解食物过敏的一种潜在机制。
大量脂质代谢研究表明食物过敏患者脂肪酸代谢通路发生改变[23−25],因此代谢通路的调控为食物过敏的诊断和食疗提供了新的思路。本研究结果表面,甘油磷脂和鞘脂类在RA诱导的脂代谢调节中起着重要作用。甘油磷脂类包括磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)、磷脂酰甘油(phosphatidylglycerol,PG)等,PC和PE是生物膜中含量最高的磷脂,作为细胞膜主要组成成分不仅能作为细胞支架,也能作为细胞的屏障。当细胞膜被破坏时,脂质的组成和含量发生改变,导致细胞信号转到异常[26]。食物过敏过程中,效应细胞的脱颗粒会导致PC和PE的胞外释放,随后被转化为白三烯和血小板等免疫介质,引起平滑肌收缩、血管通透性增高和腺体分泌增强等,进而引起皮疹、腹泻甚至休克等过敏反应症状[27]。白三烯是由花生四烯酸产生的脂质介质,花生四烯酸的聚集是引发过敏反应的重要事件[28]。血小板活化因子是活化巨噬细胞的产物,能够引起支气管收缩、血管通透性增加、嗜酸性粒细胞和中性粒细胞趋化和脱颗粒。血小板活化因子增加会导致其本身和1-花生四烯酸-甘油-3-磷酸胆碱的积聚,从而引发过敏反应的信号事件[25,29−30]。据报道,食物过敏原诱导的嗜碱性粒细胞活化可诱导血小板活化和嗜碱性粒-血小板复合物的形成[31]。本研究结果表明,甘油磷脂通路的部分PC、PE化合物的下调可导致白三烯和血小板活化因子的增加,是OVA诱导食物过敏的潜在机制,而RA处理,可显著抑制PC和PE化合物的下调。
鞘脂类包括神经酰胺(ceramide,CER)和鞘磷脂(sphingomyelin,SM)类,其代谢紊乱与炎症的发生有关。CER和SM是肥大细胞活化的阴性调节因子,当神经酰胺和鞘磷脂类减少,肥大细胞活化,引起过敏反应[32−33]。神经酰胺和鞘磷脂类减少是因为神经酰胺转化酶和鞘磷脂合成酶的功能下降,这两种酶在控制Th17细胞分化中扮演关键角色,同时Th17细胞在肠道炎症中又很重要,它们反应的紊乱可能有助于炎症疾病的发生[34−35]。因此,酶功能的改变可能暗示该途径的免疫调节作用的改变,导致Th17反应的系统性、非过敏原特异性扰动[36−37]。食物过敏的患者,尤其是过敏反应阳性史的患者的粪便中以及血液中可以观察到鞘磷脂和神经酰胺的水平降低[38]。
综上所述,RA干预可有效抑制OVA致敏诱导的小鼠血清中OVA特异性IgE水平上升,组胺和mMCP-1过敏介质的释放,表明RA具有缓解食物过敏的效应。通过网络药理学和分子对接初步说明RA缓解食物过敏的机制可能作用于ALB、NFKB1、NFBB1A、IL-2、SYK、CCL5、Fyn、AKT、Btk、Grb2、RAC和IL-5等关键靶点,通过对T细胞受体信号通路、Th1和Th2细胞分化通路、FcεRI通路、B细胞通路、NF-κB通路、脂代谢和炎症性肠病通路等通路的调节发挥缓解食物过敏的作用。基于脂质代谢组学分析,RA对甘油磷脂和鞘脂代谢通路的影响,是RA发挥缓解食物过敏的重要潜在机制。
-
图 11 正离子模式差异脂质化合物的聚类热图
注:C1~C6代表对照组; MO1~MO6代表模型组; Low1~Low6代表低剂量组; MI11~MI6代表中剂量组;H1~H6代表高剂量组;图12同。
Figure 11. Clustering heat map of lipid compounds with positive ion mode differences
表 1 流动相洗脱梯度
Table 1 Mobile phase elution gradient
时间(min) A(%) B(%) 流速 (mL/min) 0 80 20 0.3 1.5 70 30 0.3 3.5 60 40 0.3 7 40 60 0.3 8 40 60 0.3 9 30 70 0.3 11 20 80 0.3 13.5 10 90 0.3 18 10 90 0.3 18.1 80 20 0.3 20 80 20 0.3 表 2 RA与蛋白靶点分子对接结果
Table 2 RA docking results with protein target molecules
蛋白靶点 结合能力(kJ/mol) AKT −6.58 Btk −5.17 Fyn −4.01 Syk −5.9 表 3 正模式OPLS-DA置换检验
Table 3 Displacement test of OPLS-DA in positive ion mode
正模式 R2X R2Y Q2 模型组VS对照组 0.806 0.999 0.989 模型组VS低剂量组 0.575 0.987 0.939 模型组VS中剂量组 0.719 0.994 0.972 模型组VS高剂量组 0.807 0.997 0.985 表 4 负模式OPLS-DA置换检验
Table 4 Displacement test of OPLS-DA in negative ion mode
正模式 R2X R2Y Q2 模型组VS对照组 0.697 0.999 0.98 模型组VS低剂量组 0.65 1 0.901 模型组VS中剂量组 0.637 1 0.978 模型组VS高剂量组 0.66 0.998 0.969 -
[1] YU W, FREELAND D M H, NADEAU K C. Food allergy:Immune mechanisms, diagnosis and immunotherapy[J]. Nature Reviews Immunology,2016,16(12):751−765. doi: 10.1038/nri.2016.111
[2] GUPTA R S, WARREN C M, SMITH B M, et al. Prevalence and severity of food allergies among US adults[J]. JAMA Network Open,2019,2(1):185630−185643. doi: 10.1001/jamanetworkopen.2018.5630
[3] SAMPATH V, ABRAMS E M, ADLOU B, et al. Food allergy across the globe[J]. Journal of Allergy and Clinical Immunology,2021,148(6):1347−1364. doi: 10.1016/j.jaci.2021.10.018
[4] PETERS R L, KRAWIEC M, KOPLIN J J, et al. Update on food allergy[J]. Pediatric Allergy and Immunology,2022,32(4):647−657.
[5] 宁亚维, 杨正, 马梦戈, 等. 食品中常见过敏原及检测技术研究进展[J]. 食品科学,2021,26(15):319−328. [NING Y W, YANG Z, MA M G, et al. Progress in common food allergens and technologies for their detection[J]. Food Science,2021,26(15):319−328.] doi: 10.7506/spkx1002-6630-20200614-191 NING Y W, YANG Z, MA M G, et al. Progress in common food allergens and technologies for their detection[J]. Food Science, 2021, 26(15): 319−328. doi: 10.7506/spkx1002-6630-20200614-191
[6] NOOR S, MOHAMMAD T, RUB M A, et al. Biomedical features and therapeutic potential of rosmarinic acid[J]. Archives of Pharmacal Research,2022,45(4):205−228. doi: 10.1007/s12272-022-01378-2
[7] DAHCHOUR A. Anxiolytic and antidepressive potentials of rosmarinic acid:A review with a focus on antioxidant and anti-inflammatory effects[J]. Pharmacological Research,2022,184:106421−106444. doi: 10.1016/j.phrs.2022.106421
[8] STANSBURY J. Rosmarinic acid as a novel agent in the treatment of allergies and asthma[J]. Journal of Restorative Medicine,2014,3(1):121−126. doi: 10.14200/jrm.2014.3.0109
[9] JIA B M, SHANG J L, ZENG H L, et al. Hepatoprotective effects of Rosmarinic Acid on Ovalbumin-induced intestinal food allergy mouse model[J]. Molecules,2023,28(2):788−799. doi: 10.3390/molecules28020788
[10] LIANG Z M, NIE H Y, XU Y F, et al. Therapeutic effects of rosmarinic acid on airway responses in a murine model of asthma[J]. International Immunopharmacology,2016,41:90−97. doi: 10.1016/j.intimp.2016.10.010
[11] HO T Y, LO H Y, LIU I C, et al. Rosmarinic acid ameliorated psoriatic skin inflammation in mice through the novel inhibition of the interleukin-17A/interleukin-17A receptor interaction[J]. Food & Function,2022,13(12):6802−6812.
[12] ZHOU L L, HUANG Y, HAN Z J, et al. Effects of rosmarinic acid on the inflammatory response in allergic rhinitis rat models after PM2.5 exposure[J]. Journal of Clinical Laboratory Analysis,2022,36(4):24316−24324. doi: 10.1002/jcla.24316
[13] 王子怡, 王鑫, 张岱岩, 等. 中医药网络药理学:《指南》引领下的新时代发展[J]. 中国中药杂志,2022,47(1):7−17. [WANG Z Y, WANG X, ZHANG D Y, et al. Traditional Chinese medicine network pharmacology:development in new era under guidance of network pharmacology evaluation method guidance[J]. Chinese Journal of Chinese Materia Medica,2022,47(1):7−17.] WANG Z Y, WANG X, ZHANG D Y, et al. Traditional Chinese medicine network pharmacology: development in new era under guidance of network pharmacology evaluation method guidance[J]. Chinese Journal of Chinese Materia Medica, 2022, 47(1): 7−17.
[14] LUO T T, LU Y, YAN S K, et al. Network pharmacology in research of Chinese medicine formula:Methodology, application and prospective[J]. Chinese Journal of Integrative Medicine,2020,26(1):72−80. doi: 10.1007/s11655-019-3064-0
[15] LIU Q M, ZHOU Y, GAO Y Y, et al. Degraded porphyrahaitanensis sulfated polysaccharide relieves ovalbumin-induced food allergic response by restoring the balance of T helper cell differentiation[J]. Food & Function,2021,12(10):4707−4719.
[16] 姜玉, 林海生, 秦小明, 等. 分子对接技术筛选菲律宾蛤仔抗炎肽[J]. 食品与发酵工业,2023,49(13):144−151. [JIANG Y, LIN H S, QIN X M, et al. Screening of anti-inflammatory peptides from Ruditapes philippinarum by molecular docking[J]. Food and Fermentation Industries,2023,49(13):144−151.] JIANG Y, LIN H S, QIN X M, et al. Screening of anti-inflammatory peptides from Ruditapes philippinarum by molecular docking[J]. Food and Fermentation Industries, 2023, 49(13): 144−151.
[17] SUBER J, IWEALA O I. Strategies for mast cell inhibition in food allergy[J]. Yale Journal of Biology and Medicine,2020,93(5):719−731.
[18] 马伟, 孙嘉莹, 任伟超, 等. 网络药理学—中医药研究开发的新技术[J]. 世界中医药,2023,18(3):412−415. [MA W, SUN J Y, REN W C, et al. Network pharmacology-a new technology for the research and development of traditional Chinese medicine[J]. World Chinese Medicine,2023,18(3):412−415.] MA W, SUN J Y, REN W C, et al. Network pharmacology-a new technology for the research and development of traditional Chinese medicine[J]. World Chinese Medicine, 2023, 18(3): 412−415.
[19] ANVARI S, MILLER J, YEH C Y, et al. IgE-mediated food allergy[J]. Clinical Reviews in Allergy & Immunology,2019,57(2):244−260.
[20] MICHELET M, BALBINO B, GUILLEMINAULT L, et al. IgE in the pathophysiology and therapy of food allergy[J]. European Journal of Immunology,2021,51(3):531−543. doi: 10.1002/eji.202048833
[21] RAMSEY N, BERIN M C. Pathogenesis of IgE-mediated food allergy and implications for future immunotherapeutics[J]. Pediatric Allergy and Immunology,2021,32(7):1416−1425. doi: 10.1111/pai.13501
[22] SUN J B, HUANG S X, QIN Y, et al. Anti-allergic actions of a Chinese patent medicine, huoxiangzhengqi oral liquid in RBL-2H3 cells and in mice[J]. Pharmaceutical Biology,2021,59(1):672−682.
[23] 陈力嘉, 王晓艳, 王洪田, 等. 代谢组学在食物过敏研究中的应用进展[J]. 标记免疫分析与临床,2023,30(5):893−897. [CHEN L J, WANG X Y, WANG H T, et al. Advances in the study of metabolomics in food Allergy[J]. Labeled Immunoassays and Clinical Medicine,2023,30(5):893−897.] CHEN L J, WANG X Y, WANG H T, et al. Advances in the study of metabolomics in food Allergy[J]. Labeled Immunoassays and Clinical Medicine, 2023, 30(5): 893−897.
[24] JANG H, KIM E G, KIM M, et al. Metabolomic profiling revealed altered lipid metabolite levels in childhood food allergy[J]. Journal of Allergy and Clinical Immunology,2022,149(5):1722−1731. doi: 10.1016/j.jaci.2021.10.034
[25] CHALCRAFT K R, KONG J, WASERMAN S, et al. Comprehensive metabolomic analysis of peanut-induced anaphylaxis in a murine model[J]. Metabolomics,2014,10(3):452−460. doi: 10.1007/s11306-013-0589-7
[26] MAAN M, PETERS J M, DUTTA M, et al. Lipid metabolism and lipophagy in cancer[J]. Biochemical and Biophysical Research Communications,2018,504(3):582−589. doi: 10.1016/j.bbrc.2018.02.097
[27] SCHMIECHEN Z C, WEISSLER KA, FRISCHMEYER-GUERRERIO P A. Recent developments in understanding the mechanisms of food allergy[J]. Current Opinion in Pediatrics,2019,31(6):807−814. doi: 10.1097/MOP.0000000000000806
[28] MILES E A, CHILDS C E, CALDER P C. Long-chain Polyunsaturated Fatty Acids (LCPUFAs) and the developing immune system:a narrative review[J]. Nutrients,2021,13(1):247−267. doi: 10.3390/nu13010247
[29] VADAS P. The platelet-activating factor pathway in food allergy and anaphylaxis[J]. Annals of Allergy Asthma & Immunology,2016,117(5):455−457.
[30] PAŁGAN K, TRETYN A. Platelet-activating factor as an endogenous cofactor of food anaphylaxis[J]. Biofactors,2023,49(5):976−983. doi: 10.1002/biof.1956
[31] VADAS P, 文利平. 血小板活化因子(PAF), 血小板活化因子乙酰水解酶(PAFA)和严重变态反应(A)(英文)[J]. 中华临床免疫和变态反应杂志,2008,2(2):165−166. [VADAS P, WEN L P. Platelet-activation factor (PAF), PAF acetylhydrolase (PAFA), severe anaphylaxis (A)[J]. China Academic Journal Electronic Publishing House,2008,2(2):165−166.] VADAS P, WEN L P. Platelet-activation factor (PAF), PAF acetylhydrolase (PAFA), severe anaphylaxis (A)[J]. China Academic Journal Electronic Publishing House, 2008, 2(2): 165−166.
[32] JAMES B N, OYENIRAN C, STURGILL J L, et al. Ceramide in apoptosis and oxidative stress in allergic inflammation and asthma[J]. Journal of Allergy and Clinical Immunology,2021,147(5):1936−1948. doi: 10.1016/j.jaci.2020.10.024
[33] JIANG T C, DAI L L, LI P F, et al. Lipid metabolism and identification of biomarkers in asthma by lipidomic analysis[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids,2021,1866(2):158853−158860. doi: 10.1016/j.bbalip.2020.158853
[34] OBOKI K, OHNO T, SAITO H, et al. Th17 and Allergy[J]. Allergology International,2008,57(2):121−134. doi: 10.2332/allergolint.R-07-160
[35] YAN X M, YAN J B, XIANG Q W, et al. Fructooligosaccharides protect against OVA-induced food allergy in mice by regulating the Th17/Treg cell balance using tryptophan metabolites[J]. Food & Function,2021,12(7):3191−3205.
[36] BAI A, MOSS A, KOKKOTOU E, et al. CD39 and CD161 modulate T helper type 17 responses in Crohn's disease[J]. Journal of Immunology,2014,193(7):3366−3377. doi: 10.4049/jimmunol.1400346
[37] SUGAYA M. The role of Th17-Related Cytokines in Atopic Dermatitis[J]. International Journal of Molecular Sciences,2020,21(4):1314. doi: 10.3390/ijms21041314
[38] CRESTANI E, HARB H, CHARBONNIER L M, et al. Untargeted metabolomic profiling identifies disease-specific signatures in food allergy and asthma[J]. Journal of Allergy and Clinical Immunology,2020,145(3):897−906. doi: 10.1016/j.jaci.2019.10.014





 下载:
下载:

 下载:
下载:
