Sequential Extraction and Physicochemical Property Analysis of Cell Wall Polysaccharides from the Passion Fruit Peels
-
摘要: 本文采用水、反式-1,2-环己二胺四乙酸(CDTA)、Na2CO3和不同浓度的NaOH溶剂从百香果皮中依次提取出5种细胞壁多糖,并分析其组成、结构和物理特性。结果表明,水提取多糖得率最高,占果皮醇不溶物干重的9.04%。其次为4 mol/L NaOH提取多糖(8.15%)、0.05 mol/L CDTA提取多糖(7.38%)、0.05 mol/L Na2CO3提取多糖(5.36%)和1 mol/L NaOH提取多糖(3.89%)。水提取多糖和0.05 mol/L CDTA提取多糖为以同型半乳糖醛酸聚糖为主的果胶类多糖,其分子量分别为198.46 kDa和73.67 kDa。而0.05 mol/L Na2CO3提取多糖具有高的鼠李半乳糖醛酸聚糖占比(53.47%)和最低的分子量(30.29 kDa)。1 mol/L NaOH提取多糖和4 mol/L NaOH提取多糖属于木糖、葡萄糖、甘露糖和半乳糖等组成的半纤维素类多糖。五种多糖溶液均呈现出剪切稀化特征,其中0.05 mol/L Na2CO3提取多糖表现出最高的表观粘度,并呈现弹性行为,其弹性模量G′大于粘性模量G″。水提取多糖和0.05 mol/L CDTA提取多糖分别在角频率1.10和0.43 rad/s附近出现凝胶向溶胶的转变。此外,0.05 mol/L Na2CO3提取多糖展现出卓越的乳化能力和稳定性。半纤维素类多糖具有较低的粘度和更高的热稳定性。综上,百香果皮含有丰富的细胞壁多糖,且不同多糖在制备乳液和改善食品质构方面展示出不同的潜力。该研究为深度提取和开发果皮多糖提供参考。Abstract: This study sequentially extracted five cell wall polysaccharides from passion fruit peels using water, cyclohexane-trans-1,2-diamine tetra-acetate (CDTA), Na2CO3, and NaOH at varying concentrations. The composition, structure, and physical properties of these polysaccharides were investigated. The results demonstrated that water-extracted polysaccharides yielded the highest content, accounting for 9.04% of the dry weight of the peel's alcohol-insoluble residue. This was followed by polysaccharides extracted with 4 mol/L NaOH (8.15%), 0.05 mol/L CDTA (7.38%), 0.05 mol/L Na2CO3 (5.36%), and 1 mol/L NaOH (3.89%). Water-extracted and 0.05 mol/L CDTA-extracted polysaccharides were dominated by homogalacturonan, with molecular weights of 198.46 kDa and 73.67 kDa, respectively. The 0.05 mol/L Na2CO3-extracted polysaccharides had a high percentage of rhamnogalacturonan (53.47%) and the most negligible molecular weight (30.29 kDa). The polysaccharides extracted with 1 mol/L NaOH and 4 mol/L NaOH were hemicellulosic in nature, primarily composed of xylose, glucose, mannose, and galactose. All polysaccharides exhibited shear-thinning flow behaviors in aqueous solutions. The 0.05 mol/L Na2CO3-extracted polysaccharides showed the highest apparent viscosity and demonstrated elastic behavior, with the elastic modulus G′ exceeding the viscous modulus G″. The water-extracted polysaccharides and the 0.05 mol/L CDTA-extracted polysaccharides exhibited a gel-to-sol transition at angular frequencies near 1.10 and 0.43 rad/s, respectively. The 0.05 mol/L Na2CO3-extracted polysaccharides displayed relatively excellent emulsifying ability and emulsion stability. Hemicellulosic polysaccharides exhibited lower viscosity and higher thermal stability. Thus, passion fruit peels contained abundant cell wall polysaccharides, with different polysaccharides showing varied potential for emulsification and food texture improvement. This study provides valuable insights for the in-depth development of the extraction and use of peel polysaccharide fractions.
-
Keywords:
- passion fruit peel /
- cell wall polysaccharides /
- pectin /
- hemicellulose /
- physicochemical property
-
百香果(Passiflora edulis f. edulis)是一种营养丰富且风味独特的热带水果,主要用于鲜食、调味和生产果汁饮料等[1]。百香果皮占鲜果质量约50%以上,含有大量的碳水化合物等生物活性物质。然而,百香果汁加工产业中,大量果皮被丢弃,给环境带来巨大压力,同时造成资源浪费。百香果皮富含细胞壁多糖,其中果胶、半纤维素和纤维素是果皮中主要的膳食纤维成分[2]。果胶具有强大的保水、形成凝胶能力,在商业上常被用作增稠稳定剂和胶凝剂[3]。已有研究表明果胶和纤维素不仅是维持细胞壁机械强度的重要组分,也是影响食品质地和流变特性的主要成分[4]。因此,百香果皮既可作为生产果胶的新来源,也可用于开发新的富含膳食纤维的功能食品配料。
果胶、半纤维素和纤维素是果蔬初级细胞壁中最主要的多糖聚合物。其中,纤维素含量最高,为1,4-β-D-吡喃葡萄糖单元连接而成的均质多糖[5]。果胶是以半乳糖醛酸为主的异质大分子多糖,主要由同型半乳糖醛酸聚糖(homogalacturonan,HG)、鼠李半乳糖醛酸聚糖Ⅰ(rhamnogalacturonan Ⅰ,RG-Ⅰ)和鼠李半乳糖醛酸聚糖Ⅱ(rhamnogalacturonan Ⅱ,RG-Ⅱ)等结构域组成[6]。半纤维素是主要由葡甘露聚糖和木聚糖组成的短支链杂多糖,通过氢键或共价键与纤维素、果胶等紧密结合构成细胞壁骨架,又通过阿魏酸与木质素交联形成结构复杂且有抗性的木质纤维素[7]。因此,传统单一的酸或碱提取不能将细胞壁多糖分离完全。通常先采用水、螯合剂(如1,2-环己二胺四乙酸(CDTA)等)和弱碱(如Na2CO3)等不同溶剂系统依次分离出与细胞壁基质多糖不同程度结合的果胶,再以不同浓度的强碱破坏半纤维素和纤维素之间的强氢键,以溶解出堆积在纤维素微纤维表面的半纤维素类聚糖[8]。顺序提取是研究细胞壁多糖原始状态的常用方法,也是研究不同细胞壁多糖组分功能及应用的途径。目前,采用顺序提取已成功分离出番茄渣[9]和笋壳[10]等副产物中的细胞壁多糖,这为进一步探究不同细胞壁多糖组分在结构和理化特性方面的优势提供了参考。
现有研究已利用超声、微波、高速剪切等技术,改善了百香果皮多糖的提取率[11],但果皮中不同细胞壁多糖组成和结构及其可能带来的理化特性差异尚未可知。因此,本文采用顺序提取从百香果皮中分离出水提取多糖、0.05 mol/L CDTA提取多糖、0.05 mol/L Na2CO3提取多糖、1 mol/L NaOH提取多糖和4 mol/L NaOH提取多糖5种细胞壁多糖组分,分析其基本组成和结构特征,并对其流变性、乳化性和热稳定性能等物化特性进行表征,为百香果皮多糖在食品加工中的应用提供理论基础,也为其他果蔬副产物细胞壁多糖开发利用提供参考。
1. 材料与方法
1.1 材料与仪器
紫皮百香果皮 广西和谊食品有限公司;金龙鱼玉米胚芽油 益海嘉里有限公司;单糖标准品 优级纯,扬州市博瑞糖生物公司;葡聚糖标准品 优级纯,日本SHOWA DENKO公司;1,2-环己二胺四乙酸(CDTA)、硼氢化钠 分析纯,上海源叶生物科技有限公司;间羟基联苯、半乳糖醛酸、牛血清白蛋白 分析纯,北京索莱宝科技有限公司;其他试剂均为国产分析纯。
ICS5000离子色谱仪、Nicolet™ iS™ 10傅里叶变换红外光谱仪 赛默飞公司;LC-10A高效液相色谱仪 日本岛津公司;Zetasizer Nano ZS90纳米粒度仪 英国马尔文仪器公司;Bettersize 2600激光粒度分析仪 丹东百特仪器公司;STA 449F5 TGA / DTA同步热分析仪 德国NETZSCH公司;Discovery HR20混合型流变仪 杭州汉泽仪器有限公司。
1.2 实验方法
1.2.1 果皮多糖含量测定
1.2.1.1 醇不溶物的制备
百香果皮清洗干净后经55 ℃热风干燥24 h,粉碎后过80目筛得到果皮粉(passion fruit peel,PFP),其水分含量为6.22%±0.45%。将PFP按1:20(w/v)与70%乙醇混合,室温静置1 h,真空抽滤收集不溶物,以70%乙醇重复洗涤6次后,经55 ℃干燥得到醇不溶物(alcohol insoluble residues,AIR)。参考Xu等[12]的方法测定果皮总果胶、半纤维素和纤维素含量。
1.2.1.2 总果胶含量测定
10 mg AIR均匀分散于4 mL水中,加入8 mL浓硫酸,冰浴搅拌1 h,用100 mL去离子水稀释,离心,收集上清定容。取0.4 mL上清与5 mL的0.125 mol/L四硼酸钠-硫酸溶液混合,沸水浴10 min后迅速冷却,加入75 μL 0.15 g/100 mL间羟基联苯(溶于0.5 g/100 mL NaOH溶液),混匀,测定520 nm处吸光度。以不同浓度半乳糖醛酸(2~100 μg/mL)绘制标准曲线,采用间羟基联苯法测定上清中半乳糖醛酸含量,果皮总果胶结果以g/100 g AIR表示。
1.2.1.3 半纤维素含量测定
20 mg AIR分散在20 mL 100 mmol/L磷酸钠缓冲液(含20 mmol/L EDTA,pH6.5),煮沸1 h,过滤,沉淀洗涤洗两次后,分散在20 mL 4 mol/L NaOH(含有20 mmol/L NaB4),室温下放置24 h,过滤,收集滤液。以半乳糖为标准品,采用蒽酮-硫酸法(620 nm)测定滤液中半纤维素的含量,结果以g/100 g AIR表示。
1.2.1.4 纤维素含量测定
20 mg AIR与10 mL乙酸:硝酸:去离子水(4:1:2,v/v/v)混合煮沸1 h,6000 r/min离心20 min。沉淀溶解在10 mL的67%硫酸中,在室温下放置24 h,离心,收集滤液。以葡萄糖为标准品,采用蒽酮-硫酸法(620 nm)测定滤液中纤维素的含量,结果以g/100 g AIR表示。
1.2.1.5 木质素含量测定
果皮粉与石油醚置于索式抽提器中抽提6 h,60 ℃烘12 h后得预处理果皮粉。取1 g预处理果皮粉置于560 ℃的马弗炉中灼烧至恒重,计算灰分的质量分数X。采用Hao等[13]的方法测定木质素含量。1 g预处理果皮粉与12 mL 70%的H2SO4溶液混匀,40 ℃水解1 h,加入水198 mL,100 ℃回流1 h。混合液用已恒重的砂芯漏斗(M0)过滤,不溶物于60 ℃条件下干燥至恒重(M1)。再按式(1)计算木质素的质量分数。
木质素含量(%)=(M1−M0M)×100−X (1) 式中,M:果皮粉质量,g;M0:恒重砂芯漏斗质量,g;M1:砂芯漏斗和不溶物恒重后质量,g;X,果皮粉中灰分质量分数。
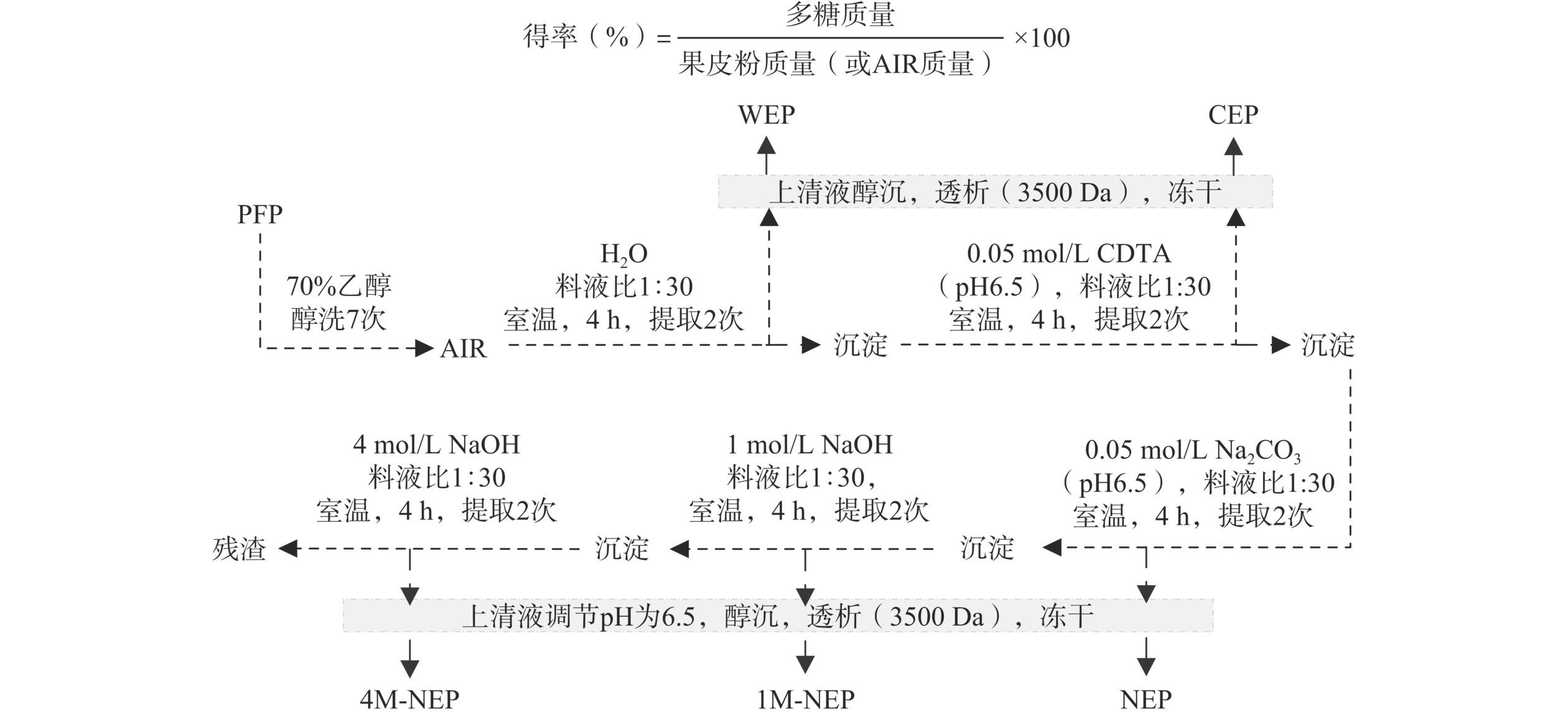
1.2.2 果皮细胞壁多糖的顺序提取
参考Yu等[14]的方法,并稍作修改。如图1所示,将10 g AIR和300 mL去离子水混匀,室温下磁力搅拌4 h,并提取两次,6000×g离心10 min,收集两次上清液即为水提取多糖(water-soluble polysaccharides,WEP)粗提液。
提取WEP后的沉淀加入0.05 mol/L CDTA溶液(含0.1 mol/L乙酸钠,pH6.5),用于分离CDTA提取多糖(CDTA-extracted polysaccharides,CEP)。提取CEP后的沉淀加入0.05 mol/L Na2CO3(含有0.025 mol/L NaBH4),4 ℃放置4 h后,提取两次,取出,于室温下分离Na2CO3提取多糖(Na2CO3-extracted polysaccharides,NEP)。
提取NEP后的沉淀加入1.0 mol/L NaOH(含0.025 mol/L NaBH4),用于分离1.0 mol/L NaOH提取多糖(1 mol/L NaOH-extracted polysaccharides,1M-NEP)。提取1M-NEP后的沉淀加入4.0 mol/L NaOH(含0.025 mol/L NaBH4),用于分离4.0 mol/L NaOH提取多糖(4 mol/L NaOH-extracted polysaccharides,4M-NEP)。最终的残渣经去离子水洗涤至中性后,冻干保存。
调节所有多糖上清液的pH至6.5后,加入3倍体积的95%乙醇进行醇沉。收集多糖沉淀,并用无水乙醇洗涤两次,以去离子水进行复溶。除CEP以外的组分,经透析(3500 Da)48 h后,采用55 ℃旋蒸减压浓缩,通过冻干得到各多糖组分。而CEP复溶后,先用0.1 mol/L NaCl溶液透析(3500 Da)24 h,再用去离子水透析24 h,再浓缩,冻干。多糖的得率通过式(2)计算:
得率(%)=多糖质量果皮粉质量(或AIR 质量)×100 (2) 1.2.3 五种细胞壁多糖基本组成测定
1.2.3.1 化学组成测定
分别采用考马斯亮蓝法、间羟基联苯法和苯酚-硫酸法[15]测定细胞壁多糖中蛋白质、半乳糖醛酸和中性糖的含量,并以牛血清白蛋白、半乳糖醛酸、葡萄糖分别为各测定方法的标准品。
1.2.3.2 酯化度测定
0.1 g WEP、CEP和NEP溶于100 mL新煮沸并冷却的水,加5滴酚酞,0.02 mol/L NaOH溶液滴定至粉红色,记录初始滴定所用0.02 mol/L NaOH溶液体积V1。向样液中加入20 mL 0.1 mol/L的NaOH溶液皂化15 min,加入20 mL 0.1 mol/L的HCl溶液混匀,再用0.02 mol/L NaOH溶液滴定至粉红色,记录消耗的0.02 mol/L NaOH溶液体积V2[16]。酯化度的计算公式如下:
酯化度(%)=V2V1+V2×100 (3) 式中,V1,初始滴定所用0.02 mol/L NaOH溶液体积,mL;V2,第2次滴定所用0.02 mol/L NaOH溶液体积,mL。
1.2.4 单糖组成测定
参考Peng等[10]的方法测定样品中单糖组成。5 mg多糖与2 mL 3 mol/L三氟乙酸混匀,120 ℃环境下水解3 h。经氮气吹干,加入5 mL超纯水并涡旋混匀。再次加水稀释20倍后,12000 r/min离心5 min,取上清液进行分析。采用Dionex CarbopacTM PA20(3 mm×150 mm)色谱柱。流动相:A:H2O;B:15 mmol/L NaOH;C:15 mmol/L NaOH和100 mmol/L NaOAc。流速为0.3 mL/min,进样量为25 µL,柱温为30 ℃,检测器为电化学检测。洗脱梯度:0~20 min,A-98.8%,B-1.2%;20~30 min,A-50%,B-50%;30.1~46.1 min,C-100%;46.1~50.1 min,B-100%;50.1~80 min,A-98.8%,B-1.2%。
1.2.5 分子量测定
采用HPGPC测定多糖分子量[10],并稍作修改。配制2 mg/mL多糖溶液,过0.22 μm的水系微孔滤膜后进行分析。色谱条件:流动相:0.05 mol/L NaCl溶液(WEP);0.2 mol/L NaOH-NaCl溶液(CEP、NEP、1M-NEP、4M-NEP);色谱柱:BRT105-103-101串联凝胶柱(8 mm×300 mm);流速:0.8 mL/min;柱温:40 ℃;进样量:25 μL;检测器:示差检测器RID-10A;分析时间:60 min。
1.2.6 红外光谱测定
将多糖与KBr以1:100(w/w)混合,充分研磨后压制成片,并进行红外光谱扫描,扫描参数如下:500 cm−1至4000 cm−1,分辨率为4 cm−1,扫描32次。
1.2.7 流变特性测定
配制2%(w/v)的多糖水溶液,4 ℃放置过夜,使其充分溶胀水合。使用流变仪测定多糖在0.1~1000 s−1的静态流动行为,并利用Ostwald-de Waele模型式(4)进行拟合,计算K和n。通过应变扫描确定多糖的线性粘弹区。在线性黏弹区内,角频率为0.1~200 rad/s,分别设置1%(WEP、NEP、CEP)和0.5%(1M-NEP、4M-NEP)的应变测定多糖的动态流变特性[17]。
τ=Kγn (4) 式中,τ为剪切应力,Pa;K为稠度系数,Pa·sn;γ为剪切速率,s−1;n为流动指数。
1.2.8 乳化能力和乳化稳定性测定
参考Zhang等[18]的方法制备多糖的乳液,并稍作修改。7 mL玉米胚芽油与14 mL 2%(w/v)多糖水溶液混合,高速剪切分散机以10000 r/min均质2 min后,75 W超声2 min,然后室温下4600×g离心5 min,分别记录离心前后乳化层体积V0和V1。将乳液在80 ℃下孵育1 h,在室温下以4600×g离心5 min,记录乳液原始体积V2和离心后乳化层体积V3。多糖的乳化能力和乳化稳定性分别按照式(5)和(6)计算。
乳化能力(%)=V1V0×100 (5) 乳化稳定性(%)=V3V2×100 (6) 式中,V0、V1分别为离心前后乳化层的体积,mL;V2:乳液原始体积,mL;V3为加热离心后乳化层的体积,mL;
1.2.9 乳液粒径及Zeta电位测定
用激光粒度分布仪测定1.2.8制备乳液的粒径,记录乳液体积加权平均直径D4,3和D3,2。H2O和油相的折射率分别为1.33和1.47。用去离子水将1.2.8处五种多糖及其制备的乳液稀释100倍后,测定其Zeta电位。
1.2.10 热稳定性测定
称取5 mg样品,使用同步热分析仪评估其热稳定性。温度范围50~600 ℃;加热速率10 ℃/min;使用氮气作为吹扫气体,流速为30 mL/min[18]。
1.3 数据处理
所有实验重复三次。运用Excel 2019分析数据的平均值和方差,SPSS 27.0.1进行差异显著性检验(P<0.05)。Origin2023b作图。
2. 结果与分析
2.1 百香果皮多糖含量分析
如 表1 所示,100 g果皮粉经过70%乙醇洗涤除去可溶性糖和色素等物质后,获得73.53 g AIR。果胶是PFP最主要的可溶性多糖,其总含量为27.05 g/100 g AIR。不溶性膳食纤维中,纤维素的含量为45.72 g/100 g AIR,其次是半纤维素(16.88 g/100 g AIR)和木质素(13.26 g/100 g AIR),这与陈良云[19]和Yapo等[2]的研究结果相近。与副产物柑橘皮来源的主要商业果胶(其果胶、半纤维素、纤维素和木质素含量分别为23.02%~34.00%、10.20%~11.04%、25.10%~37.10%和4.30%~7.52%)[20]相比,百香果皮中果胶占比低,纤维素与木质素占比相对较高。木质素与其他细胞壁多糖通过共价键交联形成木质素-碳水化合物复合体,阻碍细胞壁多糖的溶出[21]。
表 1 PFP的多糖含量Table 1. Polysaccharides content of PFP醇不溶物
(g/100 g干果皮)PFP的多糖含量(g/100 g AIR) 总果胶 半纤维素 纤维素 木质素 73.53±1.16 27.05±1.95 16.88±0.28 45.72±2.42 13.26±0.49 2.2 PFP细胞壁多糖的提取结果与理化性质分析
2.2.1 顺序提取结果及其基本组成
通过顺序提取从AIR中分离出五种细胞壁多糖。如图2所示,以醇不溶物(AIR)干重计算,WEP得率最高(9.04%),呈片层状;而4M-NEP得率次之(8.15%),为质地棉软的粉末状。CEP、NEP和1M-NEP呈现质地较硬的不规则小碎片状,得率分别是7.38%、5.36%和3.89%,其余为果皮残渣(45.33%)。与茶枝柑皮顺序提取结果[22]相似,且WEP和4M-NEP是PFP中顺序提取得率相对较高的多糖。由表2可知,WEP、CEP、NEP半乳糖醛酸含量均大于65%,其中WEP和CEP的酯化度分别为88.57%和61.72%,属于高酯果胶。五种多糖可分为富含半乳糖醛酸的果胶类多糖(WEP、CEP、NEP)和富含中性糖的半纤维素类多糖(1M-NEP、4M-NEP),且两类多糖的总得率分别为21.78%和12.04%,分别低于果皮中总果胶和半纤维素含量,这种偏差的出现可能是部分多糖在多次分离提取过程中产生损失,以及紧密结合在残余果皮残渣上未被提取出来[23]。相对于4M-NEP,1M-NEP中的糖醛酸和蛋白质含量更高,可能是1 mol/L NaOH破坏半纤维素与其他细胞壁成分之间的共价键和氢键以及离子和疏水相互作用,从而使细胞壁中的果胶和蛋白质共提取出来[22]。
表 2 PFP细胞壁多糖的基本组成Table 2. Basic components of PFP cell wall polysaccharides指标 WEP CEP NEP 1M-NEP 4M-NEP 得率(% AIR) 9.04±0.45a 7.38±0.68b 5.36±0.08c 3.89±0.07d 8.15±1.12b 得率(% PFP) 6.65±0.33a 5.43±0.01b 3.94±0.06c 1.65±0.16d 5.18±0.01b 半乳糖醛酸含量(% DW) 74.96±1.86ab 77.92±2.49a 66.57±5.92c 6.00±0.62d 1.82±0.11e 中性糖含量(% DW,以葡萄糖计) 26.61±1.90c 24.37±1.34c 23.54±1.80c 66.20±0.25b 84.37±1.21a 蛋白质含量(% DW) 5.01±0.45d 6.69±0.30c 7.46±0.20c 21.53±0.49a 9.77±0.59b 酯化度(%) 88.57±1.92a 61.72±1.00b − − − 注:“−”,表示未检测到;同一指标的不同小写字母代表有显著性(P<0.05)差异。 2.2.2 单糖组成分析
采用不同的溶剂提取可能获得具有不同单糖组成和结构的多糖。如表3所示,GalA、Rha、Gal和Ara是WEP、CEP和NEP中最主要的单糖(累计分别占三种多糖总单糖的92.8%、93.75%和94.32%)。这说明WEP、CEP和NEP是以半乳糖醛酸为主的果胶类多糖,且主要由同型半乳糖醛酸(HG)和鼠李糖半乳糖醛酸聚糖Ⅰ(RG-Ⅰ)两大结构域组成。此外,少量Fuc和Man的存在说明这三种多糖中可能还含有鼠李半乳糖醛酸聚糖Ⅱ(RG-Ⅱ)结构域[24]。除了Rha外,Gal和Ara是NEP中最丰富的中性糖,且NEP中RG-Ⅰ结构域占比达53.47%。因此NEP中可能含有丰富的半乳聚糖、阿拉伯聚糖或阿拉伯半乳聚糖侧链,这可能是在碱性条件下提取破坏了果胶HG区,留下大量的中性糖侧链附着在RG-Ⅰ骨架上所致[25]。GalA-Rha和2Rha+Gal+Ara可以推测HG和RG-Ⅰ在果胶多糖中的占比,Rha/Gal、(Ara+Gal)/Rha和GalA/(Fuc+Rha+Ara+Gal+Xyl)分别表示果胶支链分支程度、RG-Ⅰ的分支程度和果胶主链的分支程度[26]。WEP和CEP的HG占比分别为78.59%和67.72%,即HG结构域占主要部分,而NEP中RG-Ⅰ占比最高。WEP、CEP和NEP中GalA含量逐渐降低,中性糖含量依次增高,且HG、(Ara+Gal)/Rha和GalA/(Fuc+Rha+Ara+Gal+Xyl)值依次减小,同时RG-Ⅰ和Rha/GalA依次增大。这说明随着顺序提取的进行,得到的果胶类多糖组分含有更多的RG-Ⅰ结构域,主链分支程度降低,侧链分支程度升高。因此WEP可能是具有主链长、分支度高和侧链短等特点,且酯化度高的HG果胶;NEP可能是RG-Ⅰ侧链长且分支程度高的RG果胶;而CEP是居于两者之间的HG果胶。
表 3 PFP细胞壁多糖的单糖组成摩尔比(%)Table 3. Monosaccharide molecular ratio of PFP cell wall polysaccharides (%)单糖摩尔比 WEP CEP NEP 1M-NEP 4M-NEP 半乳糖醛酸(GalA) 81.19 74.81 56.32 2.17 0.66 葡萄糖醛酸(GlcA) 0.96 1.34 1.02 0.35 0.13 鼠李糖(Rha) 2.60 7.10 15.47 1.60 0.38 阿拉伯糖(Ara) 3.84 5.82 9.28 2.93 0.22 半乳糖(Gal) 5.17 6.02 13.25 14.23 14.61 葡萄糖(Glc) 3.21 2.02 1.70 31.33 31.83 木糖(Xyl) 1.42 1.24 1.26 34.88 23.72 甘露糖(Man) 1.12 0.67 0.57 9.14 26.93 岩藻糖(Fuc) 0.41 0.73 0.78 3.31 1.53 盐酸氨基葡萄糖(GlcN) 0.07 0.25 0.35 0.05 − 糖率比 HG 78.59 67.72 40.85 − − RG-Ⅰ 14.21 26.03 53.47 − − Rha/GalA 0.03 0.09 0.27 − − (Ara+Gal)/Rha 3.47 1.67 1.46 − − GalA/(Fuc+Rha+Ara+Gal+Xyl) 6.04 3.58 1.41 − − Man/Xyl − − − 0.26 1.14 注:“−”,表示未检出;HG=GalA-Rha:推测HG结构域的占比;RG-Ⅰ=2Rha+Gal+Ara:推测RG-Ⅰ结构域的占比;Rha/Gal、(Ara+Gal)/Rha和GalA/(Fuc+Rha+Ara+Gal+Xyl)分别表示果胶支链分支程度、RG-I的分支程度和果胶主链的分支程度。 Glc、Xyl、Man和Gal是1M-NEP和4M-NEP中主要的单糖,并分别累积占总单糖的89.59%和97.08%。强碱提取多糖中可能含有木葡聚糖、木聚糖和甘露聚糖[27]等结构单元。Yapo等[2]认为,果皮中半纤维素组分主要由木葡聚糖和葡甘露聚糖组成。Man/Xyl表示甘露聚糖在半纤维素中的贡献[27]。1M-NEP的Man/Xyl值为0.26,小于4M-NEP的1.14,且Man在4M-NEP中的占比更高。此外,1M-NEP中含有少量的GalA(2.17%)、Ara(2.93%)和Rha(1.60%),即1M-NEP中有少量的果胶共存,这可能来自果胶中与半纤维素共价结合的RG-Ⅰ侧链部分[27],这可能也是果胶提取结果小于分析结果的原因。
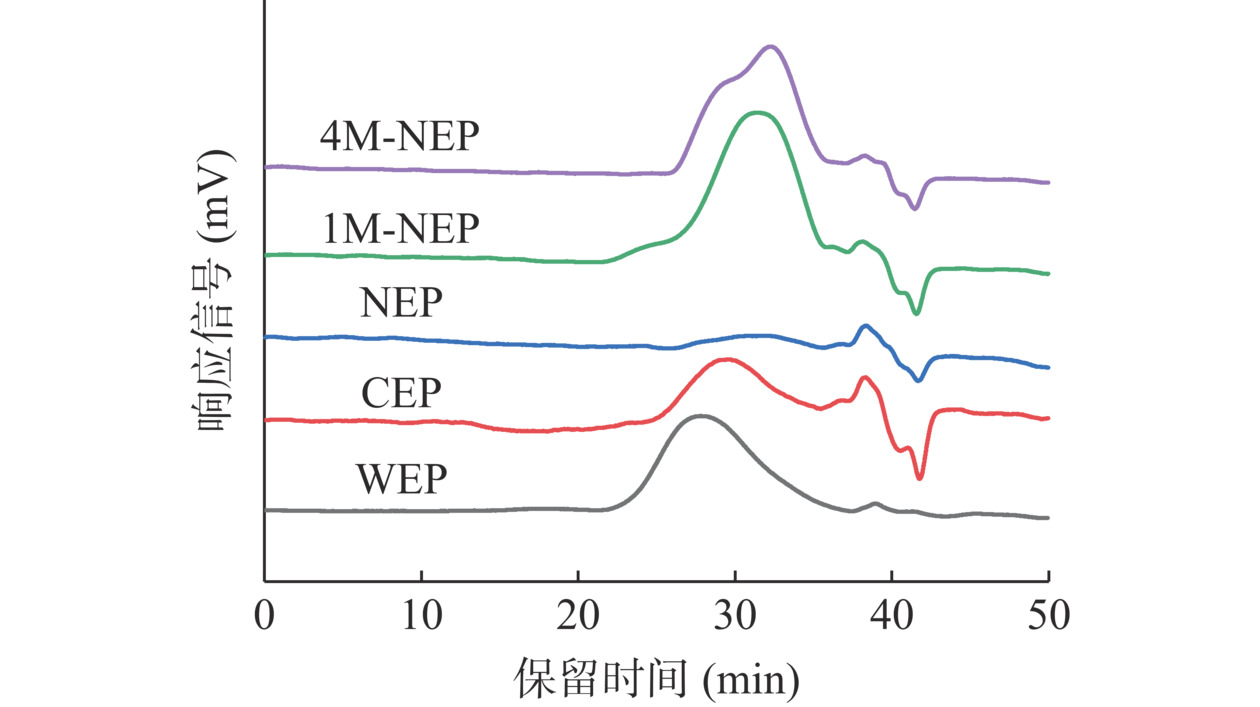
2.2.3 果皮细胞壁多糖的分子量分布
如图3所示(39 min及41 min处的峰为流动相峰,即NaCl和NaOH峰),不同溶剂提取下的多糖峰形和出峰时间不同。除4M-NEP外,其他四种多糖均呈现对称峰形。随着顺序提取的进行,果胶类多糖重均分子量逐渐减小,WEP、CEP和NEP的重均分子量依次约为198.46、73.67和30.29 kDa。半纤维素类多糖1M-NEP和4M-NEP的重均分子量分别为31.76和21.28 kDa,1M-NEP分子量较为集中,而4M-NEP在53.00 kDa处有一个肩峰(峰面积占比为35.44%)。这可能是高浓度的碱有助于从细胞壁中释放分子量更大的半纤维素聚合物[22]。结合单糖组成分析,WEP和CEP是以半乳糖醛酸为主的线性大分子果胶多糖,NEP是富含长的中性糖侧链的较小分子量果胶多糖。
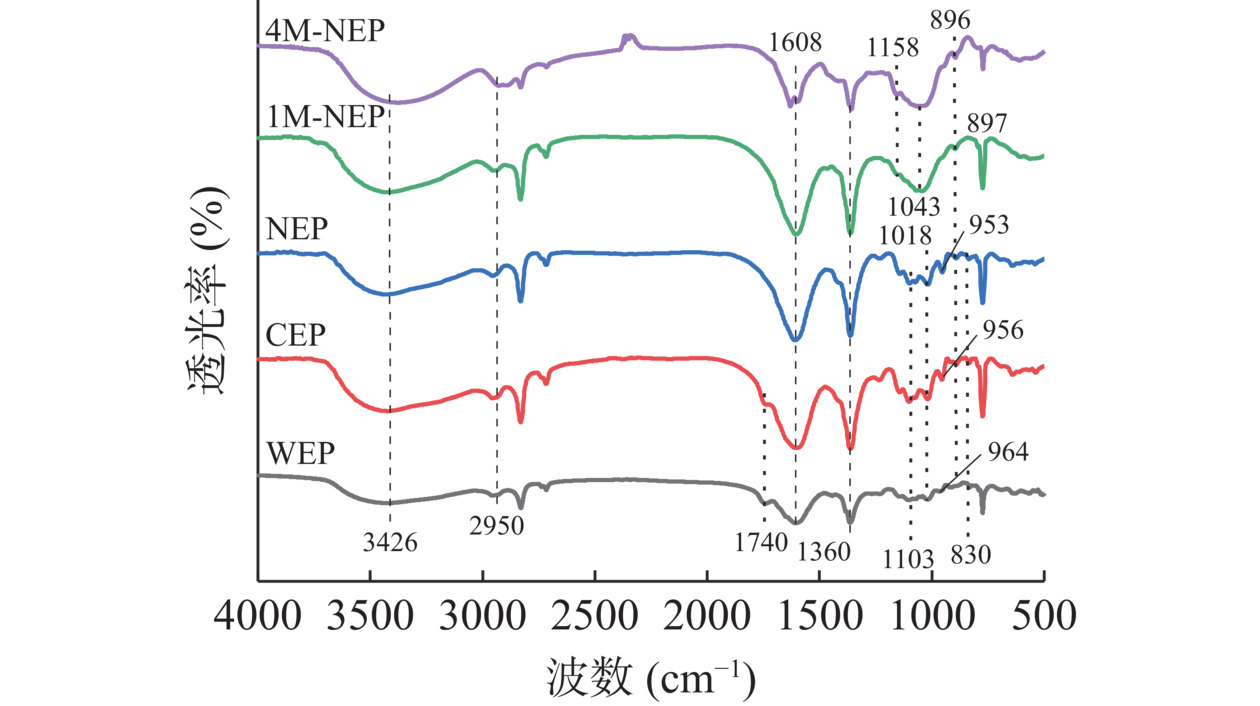
2.2.4 红外光谱分析
如图4所示,五种多糖在3426 cm−1呈现出宽的吸收峰表明存在氢键拉伸振动[22],而在2950和1360 cm−1附近的吸收峰表明存在C–H拉伸振动[28]。在1800~400 cm−1内特定光谱波数可以区分细胞壁不同多糖成分[29]。WEP和CEP在1740 cm−1附近有吸收峰,是果胶质子化羧基中酯化羰基(C=O)的拉伸振动[30]。在弱碱性条件下,NEP可能发生脱酯化,从而导致吸收峰的减弱或消失。在1103和1018 cm−1附近为果胶中半乳糖醛酸羧基特征拉伸振动,其中较强的信号表明GalA含量相对较高[31]。Guo等[31]的研究中,在970~950 cm−1之间的峰是果胶中RG-I的特征吸收带。WEP、CEP和NEP分别在964、956和953 cm−1都有特征吸收峰,且峰强度为NEP>CEP>WEP,这与表3中RG-Ⅰ占比结果相对应。
1M-NEP和4M-NEP在1200~1000 cm−1处具有特定的宽且大的吸收带,其主要由糖苷键(C-O-C)振动和侧基(C-OH)的拉伸振动重叠,其中两个条带位于1158和1043 cm−1处,是典型的木聚糖糖苷键(C-O-C)吸收带[32],也是区别于其他三种果胶多糖的吸收峰之一。另外,不同多糖间在糖苷键上略有差异,WEP、CEP和NEP在896和830 cm−1附近的红外吸收峰分别对应果胶多糖β-糖苷键和半乳糖醛酸之间α-糖苷键的吸收[33]。在897和896 cm−1处的小尖峰分别是来自半纤维素1M-NEP和4M-NEP中连接吡喃木糖单元之间的β-糖苷键[34]。以上说明,1M-NEP和4M-NEP是区别于其他三种果胶的半纤维素类多糖。
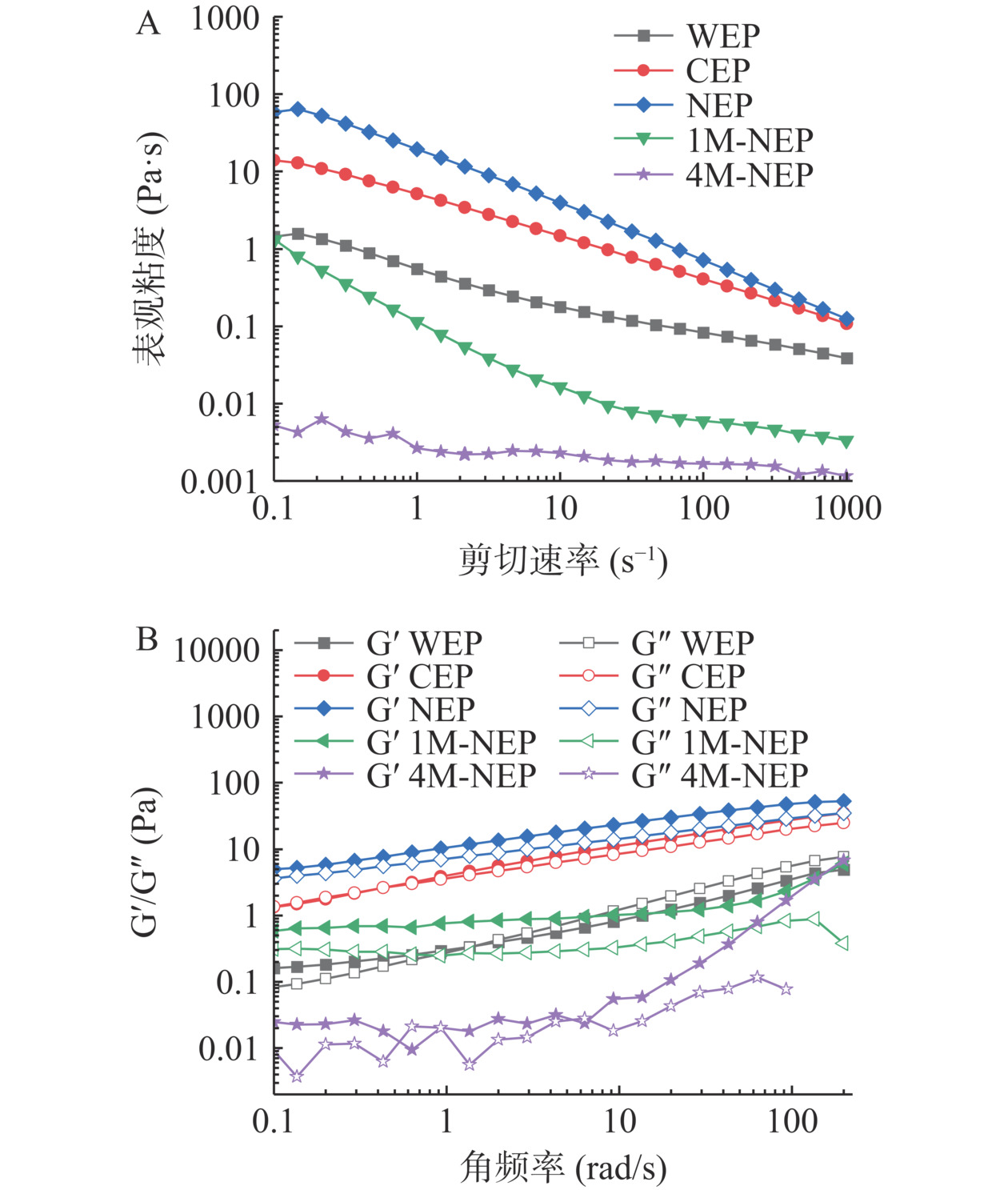
2.2.5 流变特性分析
图5A显示了在稳定剪切条件下,2%(w/v)浓度多糖的流变行为。五种多糖水溶液的表观粘度随剪切速率的增加而降低,均表现出假塑性流体特征。随着剪切力的增大,多糖大分子之间相互作用和链间纠缠被破环,并与流动方向趋向一致,从而导致多糖粘度降低[4]。NEP初始表观粘度最高,约是CEP和WEP的4倍和40倍。随着顺序提取的进行,果胶的线性度RG-Ⅰ主链分支程度变小,但中性糖含量更高,从而侧链更长,及果胶链之间的键合作用和分子间的相互作用力增强[26],果胶类多糖的粘弹性得以改善。1M-NEP与WEP有相似的初始粘度,但粘度随着剪切速率增大反而急速下降;4M-NEP粘度最低,且随剪切速率变化很小,可能是半纤维素中大分子之间相互作用弱且果胶的含量很低,从而无法产生增稠效果[8]。五种多糖表观粘度大小顺序为NEP>CEP>WEP>1M-NEP>4M-NEP,且1M-NEP和4M-NEP粘度远低于果胶类多糖,这与茶枝柑果皮多糖[22]和黄精多糖[15]相似。将流动曲线数据拟合到幂律流变模型中,五种多糖的流动指数n值均小于1(表4)且R2具有高回归系数的值(≥0.99)。n值越小,多糖聚合物的假塑性越强;稠度系数K值越大,黏稠度更大[17]。NEP的n值最小,K值最大,表明其假塑性最强,因此具有应用做果冻等凝胶类食品的潜力,而有较高黏稠性的CEP和WEP可用作增稠稳定剂。
表 4 五种多糖表观粘度的幂律方程参数Table 4. Ostwald de Waele equation parameters of the apparent viscosity of five polysaccharides参数 WEP CEP NEP 1M-NEP 4M-NEP K(Pa·sn) 0.1443 2.1057 28.7809 0.0102 0.0016 n 0.7136 0.4652 0.2762 0.7662 0.8891 R2 0.9983 0.9998 0.9924 0.9980 0.9987 多糖是粘弹性物质,通过动态振荡扫描可以表征多糖溶液的动态流变学行为(图5B)。在0.1至100 rad/s内,五种多糖的弹性模量G′和粘性模量G″随角频率的增大。NEP和1M-NEP的G′都高于G″,表明两者在2%(w/v)浓度下以弹性为主,属于凝胶。相对于WEP,虽然NEP和CEP的分子量小,但粘度和弹性更强,这可能跟低线性度和高RG-Ⅰ占比(表3)有关[35],即RG-Ⅰ中丰富的中性糖侧链可以增加聚合物链的缠结和相互作用,从而增强果胶的粘弹性[36]。WEP和CEP在低角频率下,G′高于G″,保持弱凝胶状;在角频率为1.10和0.43 rad/s附近,WEP和CEP出现G′和G″模量的交叉,即存在凝胶-溶胶过渡点,这与柑橘果胶[37]相似。增大角频率,果胶中分子链间的氢键和疏水相互作用不足以抵抗高频率振荡作用[38],胶体内部结构崩塌,从而由粘弹性固体向液体转化,WEP和CEP呈现粘行为。这种行为表明WEP和CEP具有良好的粘弹性,有助于食品工业流体运输和食物在摄入过程中的顺利下咽。
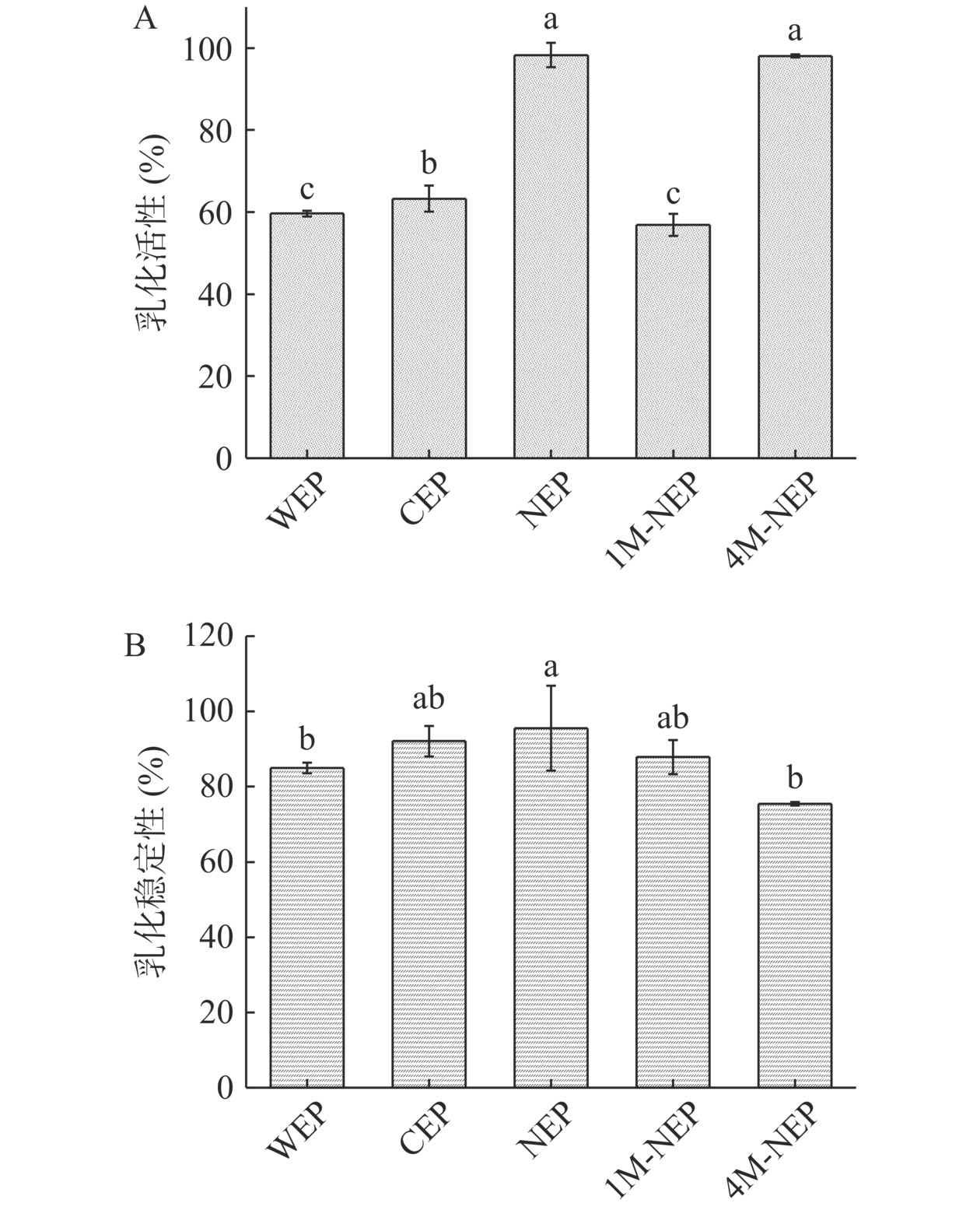
2.2.6 多糖乳液乳化活性和乳化稳定性分析
在2%(w/v)浓度下的果胶类多糖水溶液具有弱凝胶性状,特别是CEP和NEP溶液较粘稠,制备乳液时易形成乳凝胶[39]。而1M-NEP和4M-NEP由于无法完全溶解(图7B小瓶中显示1M-NEP和4M-NEP稀释至1%(w/v)浓度时,底部仍分别有黄褐色和灰白色不溶物),因此可能部分形成Pickering乳液。NEP和4M-NEP有相似的乳化能力,且均显著强于其他三种多糖乳化能力(如图6A、B)。与樱桃果胶[18]相似,果胶类多糖乳活性和乳化稳定性依次为NEP>CEP>WEP,这可能与果胶的粘度和结构有关。连续相粘度的增加会抑制油滴的流动,阻碍油滴的聚集与融合,从而维持乳液的长期稳定[40]。同时,高度支链化的RG-I结构通过氢键和分子缠绕形成界面膜,形成的空间位阻效应可以阻碍液滴聚结并减缓乳化[41]。NEP的粘度和RG-Ⅰ占比均大于CEP,因此乳液更稳定。
![]() 图 6 五种PFP多糖乳液的乳化活性和乳化稳定性注:同一指标的不同字母代表显著性(P<0.05)差异;图7同。Figure 6. Emulsifying activity and emulsion stability of five PFP polysaccharide emulsions
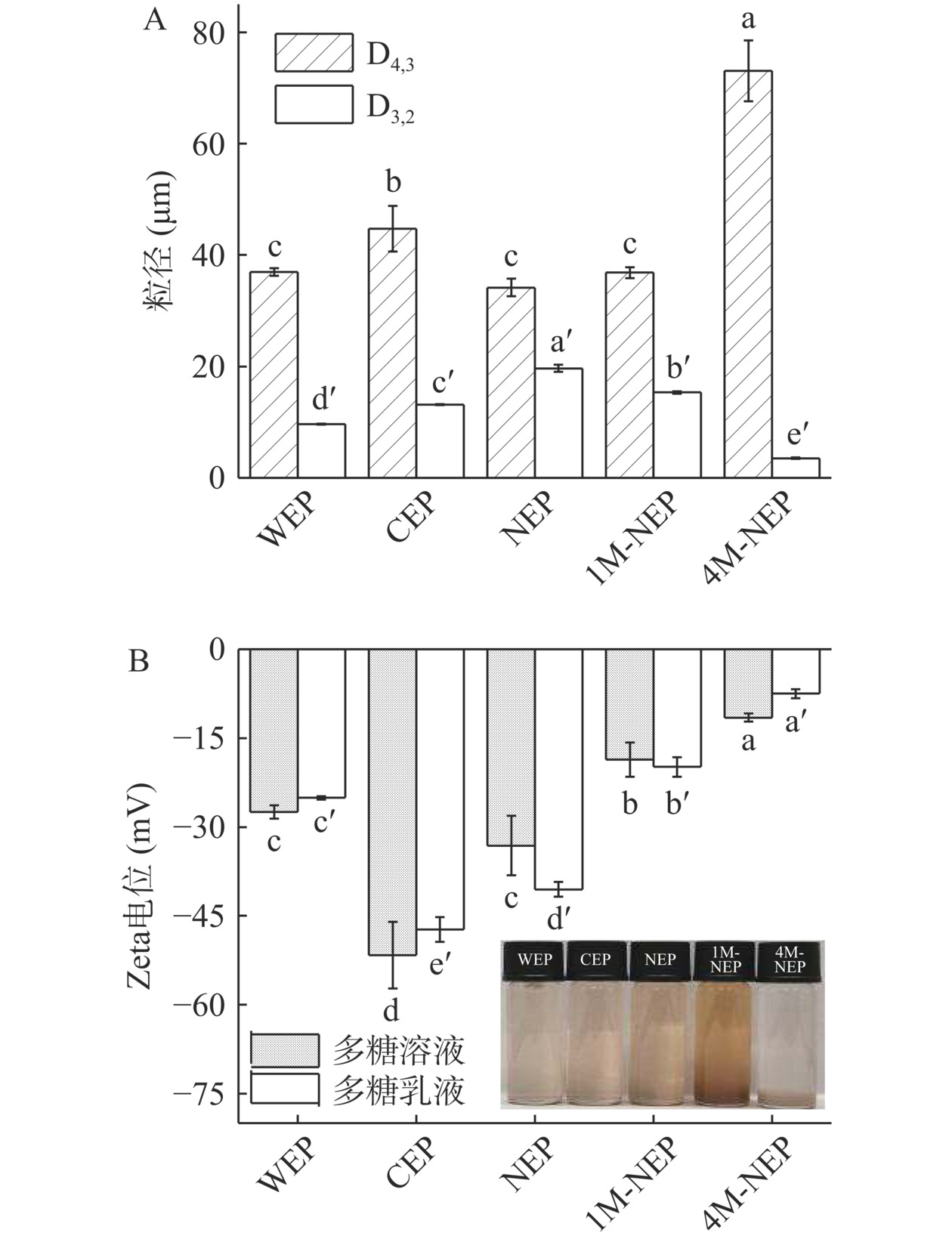
图 6 五种PFP多糖乳液的乳化活性和乳化稳定性注:同一指标的不同字母代表显著性(P<0.05)差异;图7同。Figure 6. Emulsifying activity and emulsion stability of five PFP polysaccharide emulsions2.2.7 多糖乳液的粒径及Zeta电位分析
NEP乳液的积加权平均直径D4,3和面积加权平均直径D3,2值(图7A)相差最小且D4,3值最小,说明NEP乳液颗粒的小且粒度分布集中,因此越趋于稳定,而4M-NSP乳液与其相反,这与乳化稳定性结果相对应。相对4M-NEP乳液,1M-NEP乳液的粒径较小,可能与其较高的蛋白质含量有关,高的水溶性蛋白有助于降低界面活性[42]。越大的Zeta电位绝对值意味着胶体之间的静电排斥力更大,其分散性越好,溶液更稳定。4M-NEP溶液及其乳液Zeta电位绝对值最小,其稳定性最差。WEP乳液的Zeta电位绝对值小于CEP和NEP(图7B),可能是酸性多糖的乳液在电位绝对值小于30 mV时倾向于凝结或絮凝,从而难以维持稳定的乳液体系[41],这也可能导致WEP的乳化稳定性低于CEP和NEP。
2.2.8 热稳定性分析
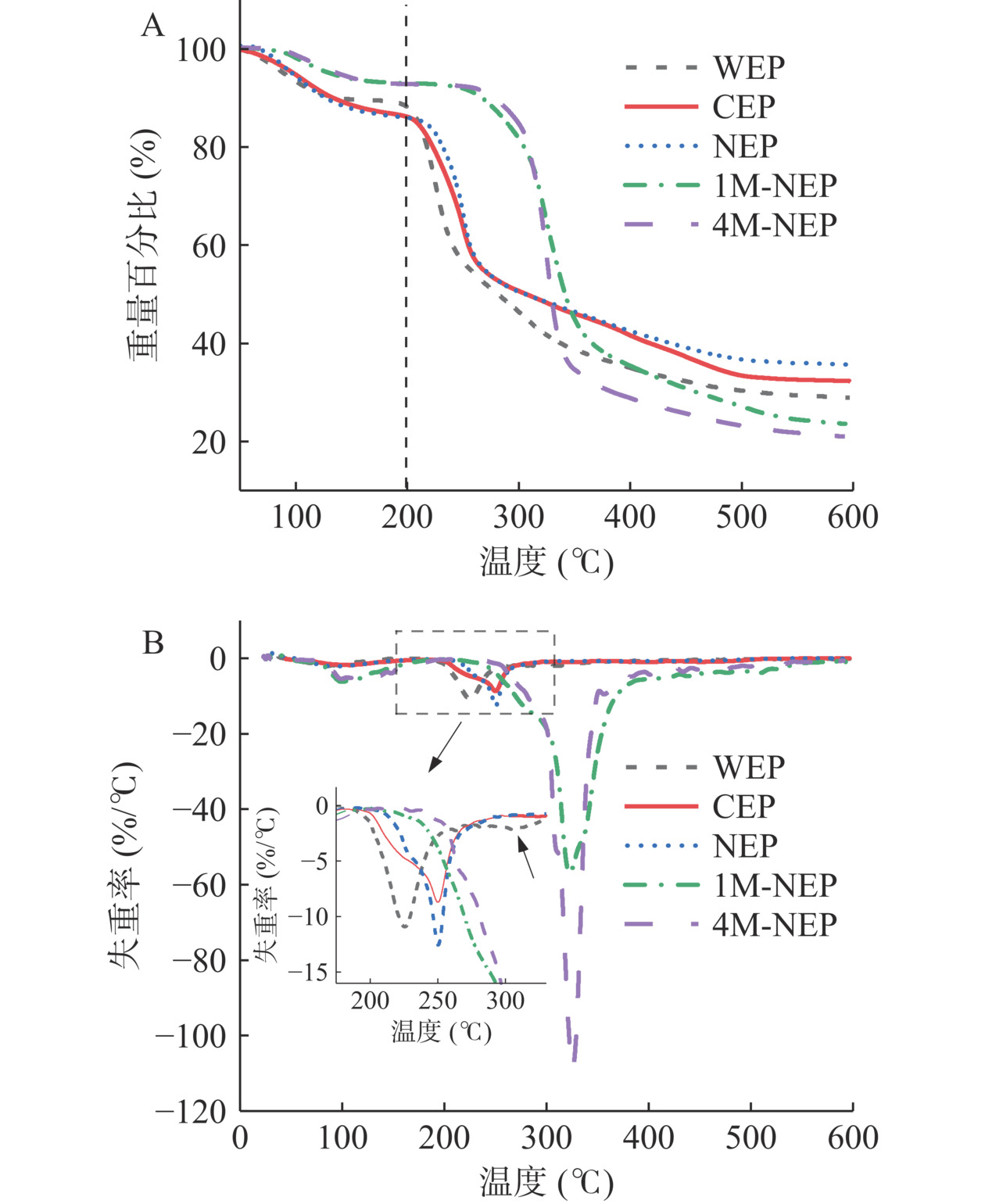
多糖在食品加工的应用与热性能息息相关。热重(thermogravimetric,TG)曲线中(图8A),五种多糖在50~200 ℃和200~400 ℃两个出现明显的失重阶段,分别对应多糖中水分的挥发以及多糖的热解[43]。在第一阶段,五种多糖的重量损失为NEP>CEP>WEP>1M-NEP>4M-NEP,可能是果胶类多糖具有更强的保水能力。差示热重(differential thermogtavimetric,DTG)曲线中(图8B),CEP和NEP在250 ℃附近呈现出最大的失重,温度高于WEP(225 ℃),且此时剩余多糖重量同样高于WEP,这可能是较高的RG-Ⅰ占比和果胶主链分支程度增强了其热稳定性[41]。在325 ℃附近,多糖迅速分解导致1M-NEP和4M-NEP出现最大失重率。此时,WEP出现第二个分解峰,可能是高分子量果胶降解所致[28]。高于550 ℃后,五种果皮多糖重量变化趋向于平缓和稳定,并进入生物质碳化阶段,最终WEP、CEP、NEP、1M-NEP和4M-NEP的残余重量分别为26.10%、32.31%、35.64%、23.59%和21.00%。五种多糖的不同组成和结构可能导致其在热解过程中表现出不同的热力学特性[28]。基于最高失重温度,半纤维素类多糖热稳定高于果胶类多糖。综合水分损失和灼烧后的残余量分析,NEP稳定性最佳。
3. 结论
百香果皮是富含纤维素和果胶类细胞壁多糖的副产物。通过顺序提取从果皮中分离出富含半乳糖醛酸的果胶类多糖(WEP、CEP和NEP)和高中性糖含量的半纤维素类多糖(1M-NEP和4M-NEP)。低剪切速率下,果胶中分子链的纠缠和分子间氢键的相互作用使得WEP、CEP和NEP表现出高粘度状态;WEP和CEP是具有较高线性HG的大分子量多糖,可形成弱凝胶。相对于WEP,丰富的RG-Ⅰ结构域和长的侧链使得较低分子量的CEP和NEP形成更强的凝胶网络。在五种多糖中,NEP呈现相对较好的乳化活性和乳化稳定性。1M-NEP和4M-NEP具有较低粘度和制备乳液的潜力。不同多糖在结构和物理特性存在差异,但其基础结构与功能特性之间的关系有待进一步探究。
-
图 6 五种PFP多糖乳液的乳化活性和乳化稳定性
注:同一指标的不同字母代表显著性(P<0.05)差异;图7同。
Figure 6. Emulsifying activity and emulsion stability of five PFP polysaccharide emulsions
表 1 PFP的多糖含量
Table 1 Polysaccharides content of PFP
醇不溶物
(g/100 g干果皮)PFP的多糖含量(g/100 g AIR) 总果胶 半纤维素 纤维素 木质素 73.53±1.16 27.05±1.95 16.88±0.28 45.72±2.42 13.26±0.49 表 2 PFP细胞壁多糖的基本组成
Table 2 Basic components of PFP cell wall polysaccharides
指标 WEP CEP NEP 1M-NEP 4M-NEP 得率(% AIR) 9.04±0.45a 7.38±0.68b 5.36±0.08c 3.89±0.07d 8.15±1.12b 得率(% PFP) 6.65±0.33a 5.43±0.01b 3.94±0.06c 1.65±0.16d 5.18±0.01b 半乳糖醛酸含量(% DW) 74.96±1.86ab 77.92±2.49a 66.57±5.92c 6.00±0.62d 1.82±0.11e 中性糖含量(% DW,以葡萄糖计) 26.61±1.90c 24.37±1.34c 23.54±1.80c 66.20±0.25b 84.37±1.21a 蛋白质含量(% DW) 5.01±0.45d 6.69±0.30c 7.46±0.20c 21.53±0.49a 9.77±0.59b 酯化度(%) 88.57±1.92a 61.72±1.00b − − − 注:“−”,表示未检测到;同一指标的不同小写字母代表有显著性(P<0.05)差异。 表 3 PFP细胞壁多糖的单糖组成摩尔比(%)
Table 3 Monosaccharide molecular ratio of PFP cell wall polysaccharides (%)
单糖摩尔比 WEP CEP NEP 1M-NEP 4M-NEP 半乳糖醛酸(GalA) 81.19 74.81 56.32 2.17 0.66 葡萄糖醛酸(GlcA) 0.96 1.34 1.02 0.35 0.13 鼠李糖(Rha) 2.60 7.10 15.47 1.60 0.38 阿拉伯糖(Ara) 3.84 5.82 9.28 2.93 0.22 半乳糖(Gal) 5.17 6.02 13.25 14.23 14.61 葡萄糖(Glc) 3.21 2.02 1.70 31.33 31.83 木糖(Xyl) 1.42 1.24 1.26 34.88 23.72 甘露糖(Man) 1.12 0.67 0.57 9.14 26.93 岩藻糖(Fuc) 0.41 0.73 0.78 3.31 1.53 盐酸氨基葡萄糖(GlcN) 0.07 0.25 0.35 0.05 − 糖率比 HG 78.59 67.72 40.85 − − RG-Ⅰ 14.21 26.03 53.47 − − Rha/GalA 0.03 0.09 0.27 − − (Ara+Gal)/Rha 3.47 1.67 1.46 − − GalA/(Fuc+Rha+Ara+Gal+Xyl) 6.04 3.58 1.41 − − Man/Xyl − − − 0.26 1.14 注:“−”,表示未检出;HG=GalA-Rha:推测HG结构域的占比;RG-Ⅰ=2Rha+Gal+Ara:推测RG-Ⅰ结构域的占比;Rha/Gal、(Ara+Gal)/Rha和GalA/(Fuc+Rha+Ara+Gal+Xyl)分别表示果胶支链分支程度、RG-I的分支程度和果胶主链的分支程度。 表 4 五种多糖表观粘度的幂律方程参数
Table 4 Ostwald de Waele equation parameters of the apparent viscosity of five polysaccharides
参数 WEP CEP NEP 1M-NEP 4M-NEP K(Pa·sn) 0.1443 2.1057 28.7809 0.0102 0.0016 n 0.7136 0.4652 0.2762 0.7662 0.8891 R2 0.9983 0.9998 0.9924 0.9980 0.9987 -
[1] FONSECA A M A, GERALDI M V, JUNIOR M R M, et al. Purple passion fruit (Passiflora edulis f. edulis):A comprehensive review on the nutritional value, phytochemical profile and associated health effects[J]. Food Research International,2022,160:111665. doi: 10.1016/j.foodres.2022.111665
[2] YAPO B M, KOFFI K L. The polysaccharide composition of yellow passion fruit rind cell wall:Chemical and macromolecular features of extracted pectins and hemicellulosic polysaccharides[J]. Journal of the Science of Food and Agriculture,2008,88(12):2125−2133. doi: 10.1002/jsfa.3323
[3] LIU J, BI J, MCCLEMENTS D J, et al. Impacts of thermal and non-thermal processing on structure and functionality of pectin in fruit-and vegetable-based products:A review[J]. Carbohydrate Polymers,2020,250:116890. doi: 10.1016/j.carbpol.2020.116890
[4] XU Q X, SHI J J, ZHANG J G, et al. Thermal, emulsifying and rheological properties of polysaccharides sequentially extracted from Vaccinium bracteatum Thunb leaves[J]. International Journal of Biological Macromolecules,2016,93:1240−1252. doi: 10.1016/j.ijbiomac.2016.09.098
[5] ZAINAL S H, MOHD N H, SUHAILI N, et al. Preparation of cellulose-based hydrogel:A review[J]. Journal of Materials Research and Technology,2021,10:935−952. doi: 10.1016/j.jmrt.2020.12.012
[6] CUI J, ZHAO C, FENG L, et al. Pectins from fruits:Relationships between extraction methods, structural characteristics, and functional properties[J]. Trends in Food Science & Technology,2021,110:39−54.
[7] PENG P, PENG F, BIAN J, et al. Isolation and structural characterization of hemicelluloses from the bamboo species Phyllostachys incarnata Wen[J]. Carbohydrate Polymers,2011,86(2):883−890. doi: 10.1016/j.carbpol.2011.05.038
[8] VILLARREAL M R, NAVARRO D A, PONCE N M A, et al. Perennial halophyte Salicornia neei Lag. cell wall composition and functional properties of its biopolymers[J]. Food Chemistry,2021,350:128659. doi: 10.1016/j.foodchem.2020.128659
[9] LI Q, LI J, LI H, et al. Physicochemical properties and functional bioactivities of different bonding state polysaccharides extracted from tomato fruit[J]. Carbohydrate Polymers,2019,219:181−190. doi: 10.1016/j.carbpol.2019.05.020
[10] PENG X, LIU J, TANG N, et al. Sequential extraction, structural characterization, and antioxidant activity of polysaccharides from Dendrocalamus brandisii bamboo shoot shell[J]. Food Chemistry:X,2023,17:100621.
[11] ZHAO L, WU L, LI L, et al. Physicochemical, structural, and rheological characteristics of pectic polysaccharides from fresh passion fruit (Passiflora edulis f. flavicarpa L.) peel[J]. Food Hydrocolloids,2023,136:108301. doi: 10.1016/j.foodhyd.2022.108301
[12] XU C, LI Y. Correlation of viscoelastic behavior with water state and ultrastructure in hot air-dried carrots[J]. Food Control,2015,50:23−30. doi: 10.1016/j.foodcont.2014.08.020
[13] HAO Y, CHEN F, WU G, et al. Impact of postharvest nitric oxide treatment on lignin biosynthesis-related genes in wax apple (Syzygium samarangense) fruit[J]. Journal of Agricultural and Food Chemistry,2016,64(45):8483−8490. doi: 10.1021/acs.jafc.6b03281
[14] YU C, AHMADI S, SHEN S, et al. Structure and fermentation characteristics of five polysaccharides sequentially extracted from sugar beet pulp by different methods[J]. Food Hydrocolloids,2022,126:107462. doi: 10.1016/j.foodhyd.2021.107462
[15] LI L, LIAO B Y, THAKUR K, et al. The rheological behavior of polysaccharides sequential extracted from Polygonatum cyrtonema Hua[J]. International Journal of Biological Macromolecules,2018,109:761−771. doi: 10.1016/j.ijbiomac.2017.11.063
[16] 丁宁, 艾连中, 赖凤羲, 等. 百香果皮果胶的分子特征及Ca2+与Zn2+致流变变化的研究[J]. 食品与发酵工业,2020,46(14):77−84. [DING N, AI L Z, LAI F X, et al. Study on molecular properties and Ca2+ and Zn2+ induced rheological changes of passion fruit peel pectin[J]. Food and Fermentation Industries,2020,46(14):77−84.] DING N, AI L Z, LAI F X, et al. Study on molecular properties and Ca2+ and Zn2+ induced rheological changes of passion fruit peel pectin[J]. Food and Fermentation Industries, 2020, 46(14): 77−84.
[17] 段瑞冰, 李洁, 刘纪红, 等. 两种不同质地的莲藕碱溶性果胶组分热降解规律及流变学差异[J]. 食品科学,2022,43(24):7−15. [DUAN R B, LI J, LIU J H, et al. Differences in thermal degradation and rheological properties of alkali-soluble pectin fraction in two kinds of lotus rhizome with different textures[J]. Food Science,2022,43(24):7−15.] doi: 10.7506/spkx1002-6630-20220301-002 DUAN R B, LI J, LIU J H, et al. Differences in thermal degradation and rheological properties of alkali-soluble pectin fraction in two kinds of lotus rhizome with different textures[J]. Food Science, 2022, 43(24): 7−15. doi: 10.7506/spkx1002-6630-20220301-002
[18] ZHANG S K, INWATERHOUSE G, CUI T T, et al. Pectin fractions extracted sequentially from Cerasus humilis:Their compositions, structures, functional properties and antioxidant activities[J]. Food Science and Human Wellness,2023,12(2):564−574. doi: 10.1016/j.fshw.2022.07.059
[19] 陈良云. 紫果西番莲果皮膳食纤维制备工艺及其性质研究[D]. 广州:华南理工大学, 2014. [CHEN L Y. Study on preparation and properties of dietary fiber of the peel of Passiflora edulis Sims[D]. Guangzhou:South China University of Technology, 2014.] CHEN L Y. Study on preparation and properties of dietary fiber of the peel of Passiflora edulis Sims[D]. Guangzhou: South China University of Technology, 2014.
[20] SURI S, SINGH A, NEMA P K. Recent advances in valorization of citrus fruits processing waste:A way forward towards environmental sustainability[J]. Food Science and Biotechnology,2023,30:1601−1626.
[21] 韦亚楠. 木瓜果多糖分离过程中细胞壁骨架成分的结构变化研究[D]. 郑州:河南工业大学, 2023. [WEI Y N. The structural changes of cell wall skeleton components during the isolation of polysaccharide from Chinese quince fruits[D]. Zhengzhou:Henan University of Technology, 2023].] WEI Y N. The structural changes of cell wall skeleton components during the isolation of polysaccharide from Chinese quince fruits[D]. Zhengzhou: Henan University of Technology, 2023].
[22] PENG Z, TIAN S, LI H, et al. Extraction, characterization, and antioxidant properties of cell wall polysaccharides from the pericarp of Citrus reticulata cv. Chachiensis[J]. Food Hydrocolloids,2023,136:108237. doi: 10.1016/j.foodhyd.2022.108237
[23] PENG J, BI J, YI J, et al. Characterization of tissue specific differences in cell wall pectic polysaccharides of carrot root[J]. Journal of Food Processing and Preservation,2021,45(4):e15331.
[24] YU M, XIA Y D, ZHOU M P, et al. Effects of different extraction methods on structural and physicochemical properties of pectins from finger citron pomace[J]. Carbohydrate Polymers,2021,258:117662. doi: 10.1016/j.carbpol.2021.117662
[25] CUI J, REN W, ZHAO C, et al. The structure-property relationships of acid-and alkali-extracted grapefruit peel pectins[J]. Carbohydrate Polymers,2020,229:115524. doi: 10.1016/j.carbpol.2019.115524
[26] LIN Y, AN F, HE H, et al. Structural and rheological characterization of pectin from passion fruit (Passiflora edulis f. flavicarpa) peel extracted by high-speed shearing[J]. Food Hydrocolloids,2021,114:106555. doi: 10.1016/j.foodhyd.2020.106555
[27] HOUBEN K, JOLIE R P, FRAEYE I, et al. Comparative study of the cell wall composition of broccoli, carrot, and tomato:Structural characterization of the extractable pectins and hemicelluloses[J]. Carbohydrate Research,2011,346(9):1105−1111. doi: 10.1016/j.carres.2011.04.014
[28] QIN Z, LIU H M, LV T T, et al. Structure, rheological, thermal and antioxidant properties of cell wall polysaccharides from Chinese quince fruits[J]. International Journal of Biological Macromolecules,2020,147:1146−1155. doi: 10.1016/j.ijbiomac.2019.10.083
[29] SZYMANSKA-CHARGOT M, ZDUNEK A. Use of FT-IR spectra and PCA to the bulk characterization of cell wall residues of fruits and vegetables along a fraction process[J]. Food Biophysics,2013,8:29−42. doi: 10.1007/s11483-012-9279-7
[30] TENG H, HE Z, LI X, et al. Chemical structure, antioxidant and anti-inflammatory activities of two novel pectin polysaccharides from purple passion fruit (Passiflora edulia Sims) peel[J]. Journal of Molecular Structure,2022,1264:133309. doi: 10.1016/j.molstruc.2022.133309
[31] GUO R, TIAN S, LI X, et al. Pectic polysaccharides from purple passion fruit peel:A comprehensive study in macromolecular and conformational characterizations[J]. Carbohydrate Polymers,2019,229:115406.
[32] XU F, GENG Z C, SUN J X, et al. Fractional and structural characterization of hemicelluloses from perennial ryegrass (Lolium perenne) and cocksfoot grass (Dactylis glomerata)[J]. Carbohydrate Research,2006,341(12):2073−2082. doi: 10.1016/j.carres.2006.04.033
[33] ZHANG X X, NI Z J, ZHANG F, et al. Physicochemical and antioxidant properties of Lycium barbarum seed dreg polysaccharides prepared by continuous extraction[J]. Food Chemistry:X,2022,14:100282.
[34] BIAN J, PENG F, PENG P, et al. Isolation and fractionation of hemicelluloses by graded ethanol precipitation from Caragana korshinskii[J]. Carbohydrate Research,2010,345(6):802−809. doi: 10.1016/j.carres.2010.01.014
[35] ZHANG H, CHEN J, LI J, et al. Extraction and characterization of RG-I enriched pectic polysaccharides from mandarin citrus peel[J]. Food Hydrocolloids,2018,79:579−586. doi: 10.1016/j.foodhyd.2017.12.002
[36] NGOUÉMAZONG D E, KABUYE G, FRAEYE I, et al. Effect of debranching on the rheological properties of Ca2+-pectin gels[J]. Food Hydrocolloids,2012,26(1):44−53. doi: 10.1016/j.foodhyd.2011.04.009
[37] YAN J K, WANG C, QIU W Y, et al. Ultrasonic treatment at different pH values affects the macromolecular, structural, and rheological characteristics of citrus pectin[J]. Food Chemistry,2021,341:128216. doi: 10.1016/j.foodchem.2020.128216
[38] MORALES-CONTRERAS B E, WICKER L, ROSAS-FLORES W, et al. Apple pomace from variety "Blanca de Asturias" as sustainable source of pectin:Composition, rheological, and thermal properties[J]. LWT,2020,117:108641. doi: 10.1016/j.lwt.2019.108641
[39] KAVYA M, RANJIT JACOB A, NISHA P. Pectin emulsions and emulgels:Bridging the correlation between rheology and microstructure[J]. Food Hydrocolloids,2023,143:108868. doi: 10.1016/j.foodhyd.2023.108868
[40] JIA Y, DU J, LI K, et al. Emulsification mechanism of persimmon pectin with promising emulsification capability and stability[J]. Food Hydrocolloids,2022,131:107727. doi: 10.1016/j.foodhyd.2022.107727
[41] DENG Z, PAN Y, CHEN W, et al. Effects of cultivar and growth region on the structural, emulsifying and rheological characteristic of mango peel pectin[J]. Food Hydrocolloids,2020,103:105707. doi: 10.1016/j.foodhyd.2020.105707
[42] ZHANG W, FAN X, GU X, et al. Emulsifying properties of pectic polysaccharides obtained by sequential extraction from black tomato pomace[J]. Food Hydrocolloids,2020,100:105454. doi: 10.1016/j.foodhyd.2019.105454
[43] PAN X, ZHAO W, WANG Y, et al. Physicochemical and structural properties of three pectin fractions from muskmelon (Cucumis melo) and their correlation with juice cloud stability[J]. Food Hydrocolloids,2022,124:107313. doi: 10.1016/j.foodhyd.2021.107313





 下载:
下载:

 下载:
下载:



