Spectroscopic Method Combined with Molecular Docking Technique to Study the Interaction of Limonin with Bovine Serum Albumin
-
摘要: 为研究柠檬苦素(Limonin,LM)与牛血清白蛋白(Bovine serum albumin,BSA)相互作用,本文采用紫外光谱法、荧光光谱法及分子对接技术研究LM与BSA的相互作用机制。结果表明:LM能有效淬灭BSA的内源荧光,其淬灭类型为静态淬灭;两者发生相互作用可形成1个结合位点,分子间作用力主要为氢键和范德华力,该相互作用过程为自发反应;紫外光谱及同步荧光光谱表明,LM与BSA发生相互作用后,可以增加BSA上酪氨酸(Tyr)、色氨酸(Trp)残基微环境的疏水性;通过竞争位点实验及分子对接,发现LM与BSA的结合位点在siteⅠ附近,LM可以与BSA上的Trp-213形成氢键,与Tyr-340/451等残基之间存在范德华力。Abstract: In order to study the interaction between limonin (LM) and bovine serum albumin (BSA), in this paper, the interaction mechanism between LM and BSA was explored by ultraviolet (UV) spectroscopy, fluorescence spectroscopy and molecular docking technology. The results showed that LM could significantly quench the endogenous fluorescence of BSA, displaying a static quenching type. In addition, LM formed a binding site with BSA by hydrogen bonding and van der Waals forces, demonstrating a spontaneous interaction mechanism. Meanwhile, UV spectroscopy and synchronous fluorescence spectroscopy showed that the interaction between LM and BSA could increase the hydrophobicity of tyrosine (Tyr) and tryptophan (Trp) residue microenvironment on BSA. Through competition site experiments and molecular docking, it was found that the binding site between LM and BSA was near site Ⅰ, and LM could form hydrogen bonds with Trp-213 on BSA, and there were van der Waals forces between LM and Tyr-340/451 residues.
-
Keywords:
- limonin /
- bovine serum albumin /
- interaction /
- fluorescence spectrum /
- molecular docking
-
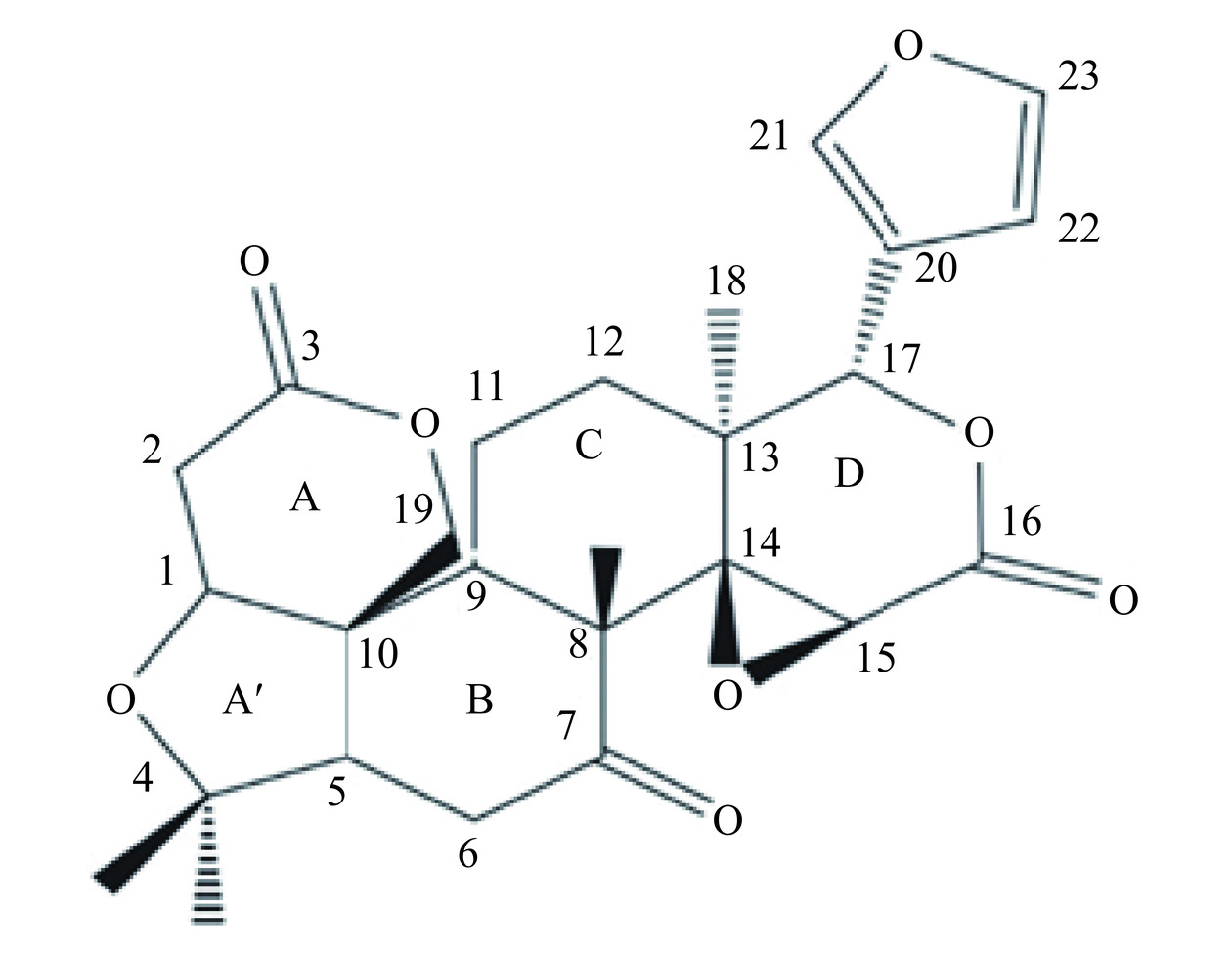
柠檬苦素(Limonin,LM)亦被称为黄柏内酯或吴茱萸内酯,是主要存在于芸香科(Rutaceae)及楝科(Meliaceae Juss.)等植物中的四环三萜类化合物,同时也是植物中重要的次生代谢产物之一。LM结构中含有4,4,8-三甲基-17-呋喃基甾体特征骨架,其中C-3、C-4、C-7、C-16和C-17上连有含氧的官能团,C-14和C-15位上均有氧桥环[1],其结构如图1所示。大量动物临床研究表明,LM具有多种生理活性功能,如抗肿瘤、抗病毒、抗氧化、抗肥胖、镇痛消炎、抗焦虑、镇静及改善睡眠等[2],但是LM水溶性较差并且其结构易受环境因素影响发生不同程度的降解[3],大大限制了LM的进一步应用和开发。目前关于LM的研究主要集中在生理活性研究上,但是其在人体内如何转运及其与相关载体蛋白的相互作用的研究较少。
人血清白蛋白(Human serum albumin,HSA)是血液中的多功能转运蛋白,能可逆结合小分子物质并将其运送到人体需要的各个部位[4],是人体重要的转运载体蛋白之一。牛血清白蛋白(Bovine serum albumin,BSA)在序列和构象上与HSA具有高度同源性和相似性,且来源丰富、获取成本低、溶解性好,因此被广泛应用于小分子物质与血清蛋白的研究中[4−5]。BSA由3个同源结构域(Ⅰ~Ⅲ)构成,每个结构域包含2个结构亚域A和B,其中结构亚域ⅡA和ⅢA的疏水空腔中有结合位点Sudlow’s sites Ⅰ和Ⅱ [6]。紫外光谱法和荧光光谱法是研究蛋白与小分子物质相互作用的重要手段,而随着计算机模拟技术的高速发展,分子对接技术也逐步被应用在蛋白与小分子相互作用机制的研究中。因此,本实验应用紫外光谱法、荧光光谱法以及分子对接技术来研究LM与BSA之间的相互作用机制,有助于了解LM在人体内如何转运、分布及消除等情况,同时还能为构建LM的蛋白基递送载体研究提供理论基础。
1. 材料与方法
1.1 材料与仪器
BSA(纯度≥98 %,低脂肪酸)、华法林(纯度≥98 %) 上海麦克林生化科技股份有限公司;LM(纯度≥98 %)、布洛芬(纯度≥98 %) 上海源叶生物科技有限公司;二甲基亚砜(DMSO)、磷酸氢二钠、磷酸二氢钠 均为AR,上海麦克林生化科技股份有限公司。
DF-101S集热式恒温加热磁力搅拌器 郑州长城科工贸有限公司;HH-4数显恒温水浴锅 常州普天仪器制造有限公司;Evolution 201型紫外-可见分光光度计、Lumina 型荧光分光光度计 美国赛默飞世尔公司。
1.2 实验方法
1.2.1 溶液配制
将BSA溶于PBS缓冲液(0.01 mol/L,pH7.4)中,配成浓度为1×10−5 mol/L的BSA储备液;将LM溶于DMSO中,配制成浓度为1×10−3 mol/L的LM储备液,置于棕色玻璃瓶中;用PBS缓冲液配制浓度为5×10−4 mol/L的华法林和布洛芬储备液;储备液均是当天配当天用。
1.2.2 紫外光谱测定
参考李琳等[7]研究方法,并稍加改进。准确吸取3 mL PBS缓冲液和1 mL BSA储备液置于5 mL棕色玻璃瓶中,然后加入LM储备液,再用PBS缓冲液补足至5 mL并混合均匀,最终混合液中BSA浓度均为2×10−6 mol/L,LM的浓度分别为0、4×10−5 、8×10−5 、12×10−5 、16×10−5 、20×10−5 mol/L,将混合液置于298 K水浴锅中反应30 min,使用紫外-可见光分光光度计进行紫外光谱扫描,扫描范围为200~400 nm,波长间隔为1 nm。
1.2.3 荧光光谱测定
样品制备与1.2.2一致,将混合液置于298、304、310 K水浴锅中反应30 min。荧光分光光度计的参数设置如下:激发波长为280 nm,PMT电压为500 V,激发和发射狭缝宽度均为5 nm,扫描范围为300~450 nm。
1.2.4 判断荧光淬灭类型
荧光淬灭过程可分为静态淬灭和动态淬灭等,其中静态淬灭是指淬灭剂与蛋白之间形成不发光的基态配合物,使其荧光强度减弱,蛋白分子结构会发生改变,当温度升高时,复合物稳定性减弱,淬灭常数就会下降;而动态淬灭是指淬灭剂与蛋白之间相互碰撞,使其荧光强度减弱,蛋白分子结构不会发生改变,若温度上调,碰撞数目的有效离子增加,增强电子转移,淬灭常数就会升高。为了确定LM对BSA的荧光淬灭类型,可以通过Stern-Volmer方程[8]公式(1)计算淬灭常数的变化,以判断其淬灭类型。
F0F=1+Kqτ0[Q]=1+Ksv[Q] (1) 式中:F0和F分别为无LM和有LM存在时BSA的荧光强度;Kq为淬灭速率常数(L/(mol·s));τ0为荧光寿命,在没有淬灭剂的情况下,BSA的荧光寿命值为10−8 s;[Q]为LM的浓度(mol/L);Ksv为淬灭常数(L/mol)。
1.2.5 结合常数及结合位点计算
采用双对数方程公式(2)计算LM和BSA相互作用的结合常数Ka(L/mol)和结合位点数n[9]。
lg(F0−FF)=lgKa+nlg[Q] (2) 1.2.6 热力学性质和作用力判断
研究表明,小分子与蛋白发生相互作用的主要作用力包括氢键、静电相互作用力、范德华相互作用力和疏水相互作用等,可根据Van’t Hoff 方程(3)和热力学公式(4)计算LM与BSA相互作用的热力学性质及相互作用力类型[10]。
lnKa=−ΔHRT+ΔSR (3) ΔG=ΔH−TΔS (4) 式中:∆H为焓变(kJ/mol);∆S为熵变(J/(mol·K));∆G为吉布斯自由能(kJ/mol);T为温度(K);R为理想气体常数,8.314 J/(mol·K)。
1.2.7 同步荧光测定
样品制备与1.2.2一致,然后将混合液置于298 K水浴锅中反应30 min,荧光分光光度计的参数设置如下:PMT电压均为500 V,激发和发射狭缝宽度均为5 nm,激发波长与发射波长差(Δλ)为15 nm时,扫描范围为250~350 nm;激发波长与发射波长差为60 nm时,扫描为300~400 nm。
1.2.8 竞争结合位点实验
a.样品制备与1.2.2一致,然后将混合液置于298 K水浴锅中反应30 min,荧光分光光度计的参数设置如下:激发波长为295 nm,PMT电压为500 V,激发和发射狭缝宽度均为5 nm,扫描范围为300~450 nm[11−12]。b.取1 mL BSA储备液置于5 mL棕色玻璃瓶中,先加入20 μL华法林/布洛芬储备液进行反应;后续操作和1.2.2一致,按照测定内源荧光光谱的参数测定该体系的内源荧光光谱并利用公式(2)计算该体系中的Ka值[13−14]。
1.2.9 分子对接
LM与BSA的分子对接用Autodock 4.2软件进行。LM的三维结构从Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取,其结构优化按Autodock软件默认要求进行并保存成PDBQT文件。BSA晶体结构从PDB数据库(https://www.rcsb.org/)获取,其ID为:4F5S,先使用PyMol软件对BSA晶体结构进行去除杂分子和水分子,然后再使用Autodock 4.2软件对BSA进行加氢原子、计算电荷、设置原子类型并保存成PDBQT文件。在Autodock 4.2软件的Grid版块进行预测整个蛋白中的活性位点;设置对接时,将BSA选为刚性,LM为柔性,通过Genetic Algorithm Parameters算法进行分子对接;对接结束后,选择结合自由能最低的构象,使用PyMol软件对蛋白与受体的相互作用力分析[15]。
1.3 数据处理
利用数据处理软件Origin 2021和Excel 2016进行数据统计及图表绘制;分子对接结果可视化用PyMol软件和Discovery Studio软件。
2. 结果与分析
2.1 紫外光谱分析
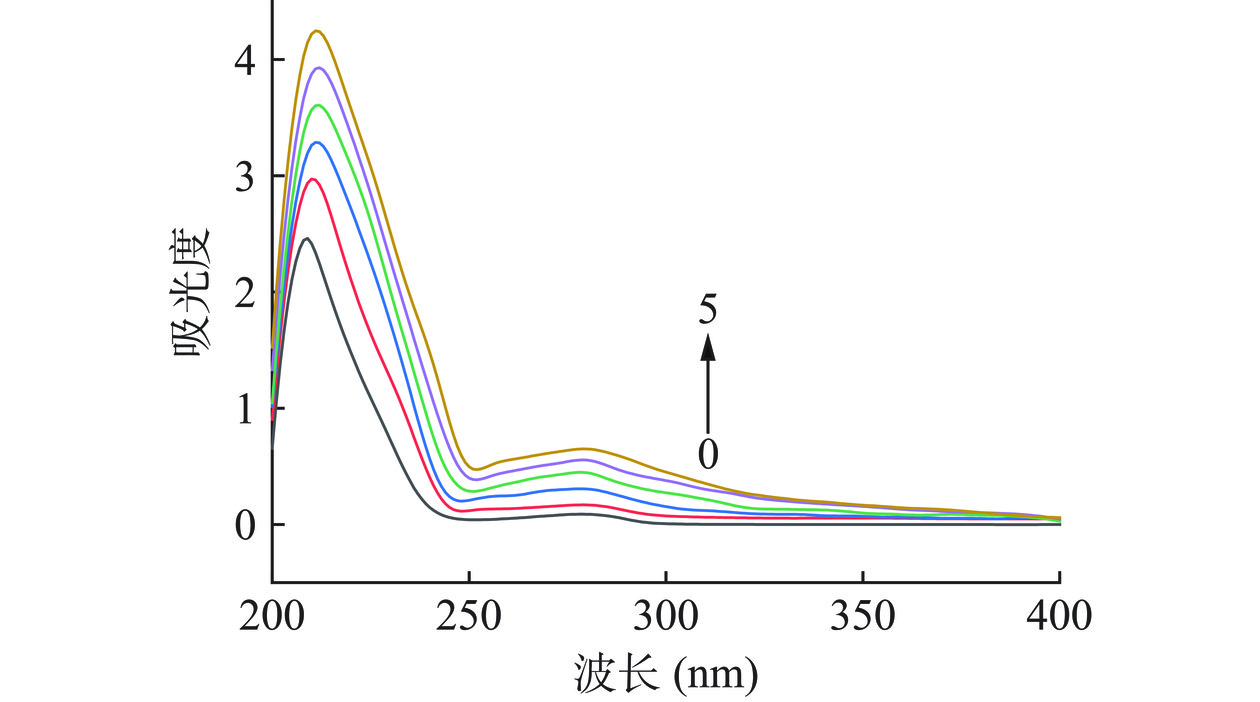
BSA分子构象的改变导致其微环境的变化,从而导致紫外吸收光谱的变化,包括吸收光谱中的红移或蓝移[16]。BSA在紫外吸收光谱中主要表现为两个特征吸收峰,其中208 nm附近的强烈特征吸收峰反映BSA的肽链骨架信息,而278 nm附近的特征吸收峰是由BSA的酪氨酸(Tyrosine,Tyr)和色氨酸(Tryptophan,Trp)等残基的苯环π→π*跃迁产生[17]。LM在紫外吸收光谱上,仅在200 nm附近有末端吸收峰,而最大吸收波长出现在210 nm附近,常将210 nm作为检测波长,采用高效液相色谱法对LM进行定量分析等[18−19]。不同浓度LM与BSA相互作用的紫外吸收光谱结果如图2所示,随着LM浓度的不断增加,BSA的特征吸收峰强度逐渐增加,表明LM与BSA发生了相互作用;而BSA特征吸收峰发生红移(208-213 nm,278-280 nm),可能是疏水性的LM与BSA发生相互作用后,诱导BSA构象发生变化,BSA上Tyr残基和Trp残基周围微环境极性下降,疏水性增强所导致[20]。研究表明,动态猝灭不引起蛋白质吸收峰波长改变,而静态猝灭则会导致吸收峰波长改变[4,21],因此,初步判断LM对BSA的淬灭过程为静态淬灭。
2.2 荧光光谱分析
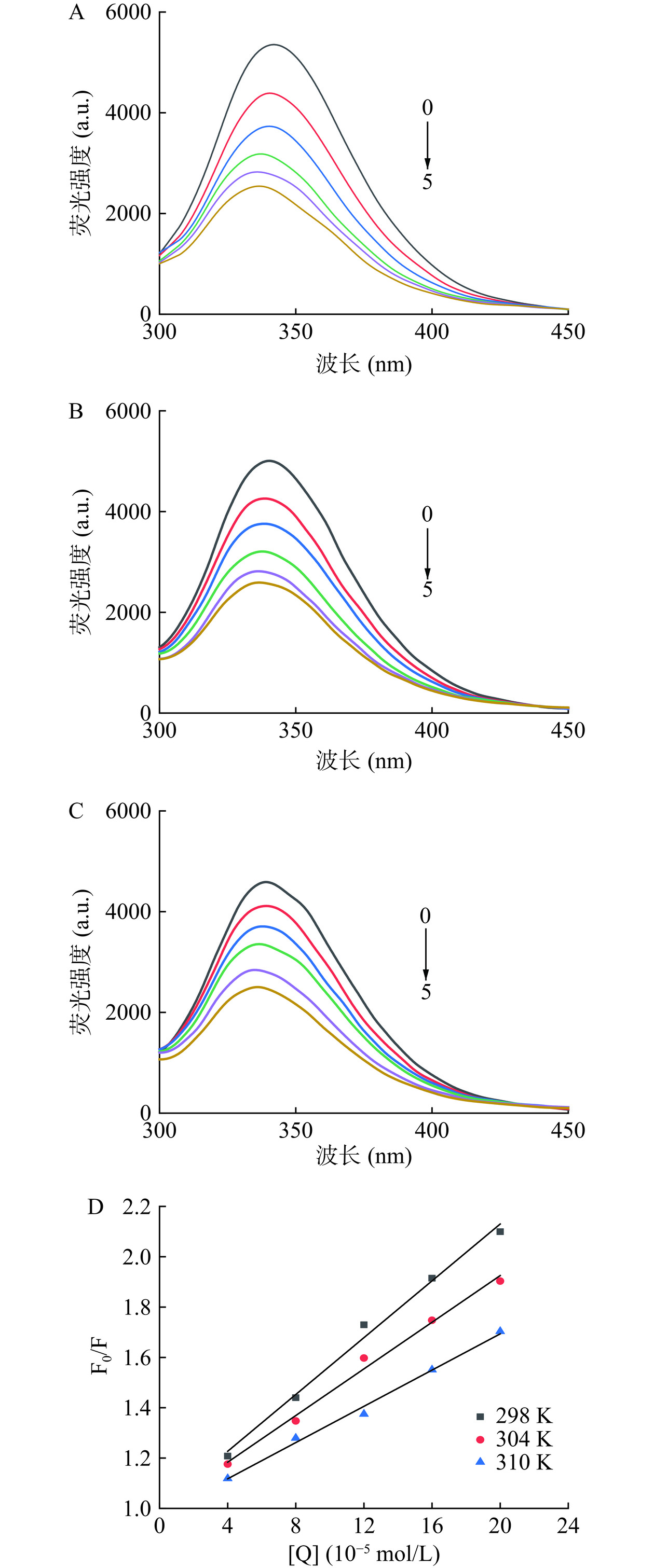
荧光光谱技术已经被广泛应用于蛋白-小分子配体之间相互作用的研究中,而BSA分子中的内源性荧光大部分来自Trp和Tyr等[22]。298、304、310 K时,不同浓度的LM与BSA相互作用的内源荧光光谱如图3所示,BSA在342 nm处有强烈的荧光发射峰,随着LM浓度的不断增加,BSA的荧光强度逐渐降低并且出现蓝移(342-337 nm),这表明LM与BSA发生相互作用可使BSA的内源荧光发生淬灭,并且导致BSA的构象发生改变,荧光团周围微环境的极性降低,疏水性增强,这与前面紫外光谱结果一致;含有三萜类物质的大叶冬青提取物[23]以及苦丁茶冬青提取物[24]在与BSA相互作用研究中也发生了相似的内源荧光光谱变化。此外,不同温度下添加同一浓度的LM对BSA的淬灭率也不同,当固定LM添加浓度为8×10−5 mol/L时,298 K下的淬灭率为44%、304 K下的淬灭率为34%、310 K下的淬灭率为27%,表明环境温度升高不利于LM与BSA的结合。
2.2.1 荧光淬灭类型分析
不同温度下LM与BSA相互作用的Stern-Volmer曲线如图3D所示,所有曲线均呈线性,即淬灭剂LM的加入可促使BSA的荧光强度均匀淬灭,据此可初步判断猝灭剂LM与BSA之间只存在一种结合类型[25]。不同温度下LM与BSA相互作用的淬灭速率常数及淬灭常数如表1所示,不同温度下的Kq均大于各类剂对生物大分子最大扩散控制的碰撞猝灭速率常数2.0×1010 L/(mol·s)[26],并且随着温度的升高,Ksv逐渐降低,表明LM与BSA之间的淬灭过程为静态淬灭,即淬灭剂LM与大分子BSA形成了稳定的复合物。
表 1 不同温度下LM与BSA相互作用的淬灭速率常数及淬灭常数Table 1. Quenching rate constants and quenching constants of the interaction between LM and BSA at different temperaturesT(K) Kq(1011 L·mol−1·s−1) Ksv(103 L·mol−1) R2 298 5.652 5.652 0.9918 304 4.622 4.622 0.9915 310 3.420 3.420 0.9901 2.2.2 结合常数及结合位点计算
研究表明,当Ka的范围在105~107 L·mol−1时,表明小分子物质与蛋白之间存在较强的结合力;当Ka的范围在102~104 L·mol−1时,表明小分子物质与蛋白之间存在低到中等的结合力[27]。由表2可知,不同温度下LM与BSA的Ka均在103~104 L·mol−1之间,表明LM与BSA之间存在中等的结合力。随着温度升高,Ka随之降低,表明LM与BSA之间的稳定性受温度控制,再次证实LM与BSA之间的淬灭过程为静态淬灭。而不同温度下,LM与BSA的n值均等于1,表明两者之间有一个结合位点,即LM与BSA相互作用形成的复合物为1:1型。此外,结合位点n值随着温度的上升而下降,表明在结合过程中温度的影响非常重要[28],这与前面温度升高不利于LM对BSA荧光淬灭的结果一致。
表 2 不同温度下LM与BSA的结合常数及结合位点Table 2. Binding constants and binding sites of LM and BSA at different temperaturesT(K) Ka(103 L·mol−1) n R2 298 9.007 1.053 0.9944 304 6.823 1.039 0.9948 310 5.739 1.004 0.9894 2.2.3 热力学性质分析和作用力类型
研究表明,可以根据吉布斯自由能∆G、焓变∆H和熵变∆S的大小判断小分子与蛋白的结合过程及小分子与蛋白之间的主要作用力,当∆G小于零时,表明该结合过程是自发的;当∆H和∆S均大于零时,主要作用力表现为疏水相互作用,当∆H和∆S均小于零时,主要作用力表现为氢键或范德华力等[29]。由表3可知,LM与BSA之间的∆G均小于零,并且∆H和∆S也均小于零,表明LM与BSA之间的结合是自发的,结合过程为放热反应,范德华力和氢键作用是结合过程中的主要作用力。
表 3 不同温度下LM与BSA相互作用的热力学参数Table 3. Thermodynamic parameters of the interaction between LM and BSA at different temperaturesT(K) ∆H(kJ·mol−1) ∆S(J·mol−1·K−1) ∆G(kJ·mol−1) 298 −28.94 −21.62 −22.49 304 −22.36 310 −22.23 2.2.4 同步荧光光谱分析
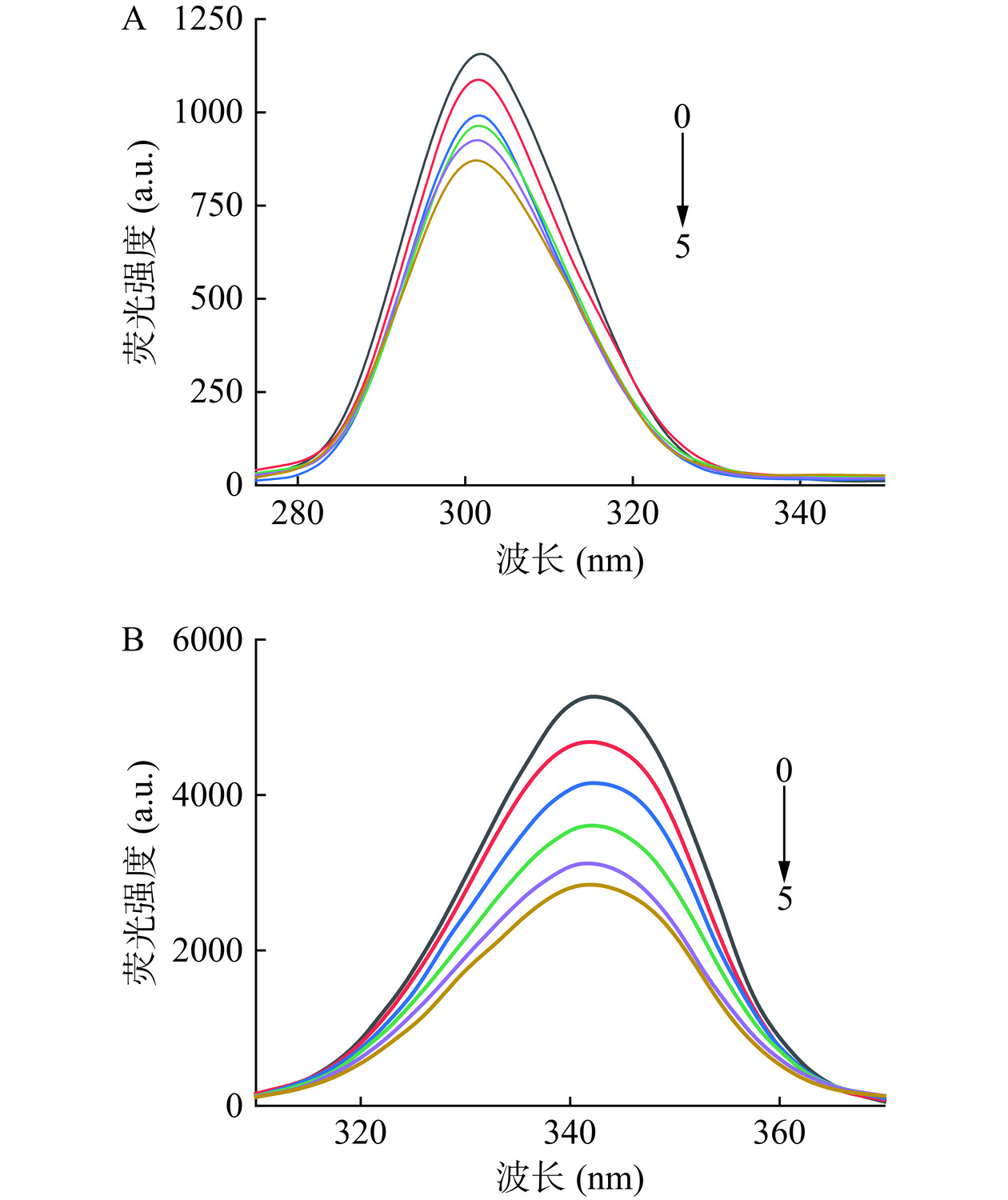
同步荧光光谱可以更清晰地反映小分子结合对蛋白质氨基酸残基微环境的影响,其中Δλ=15 nm和Δλ=60 nm时,分别表示Tyr和Trp残基的特征信息[30]。由图4可知,BSA中的Tyr和Trp残基分别在302、343 nm处有最大特征吸收峰,随着LM的加入,BSA上的Tyr和Trp残基荧光均发生淬灭,并且最大特征吸收峰都发生轻微蓝移,表明LM的加入可导致BSA上的Tyr和Trp残基周围微环境的极性下降,疏水性上升,和前面紫外光谱、内源荧光光谱结论一致。此外,随着LM浓度的升高,Trp残基荧光淬灭效率远比Tyr残基荧光淬灭效率大,初步判断LM导致BSA发生荧光淬灭的主要原因可能是Trp残基的荧光发生了淬灭。
2.3 竞争位点试验分析
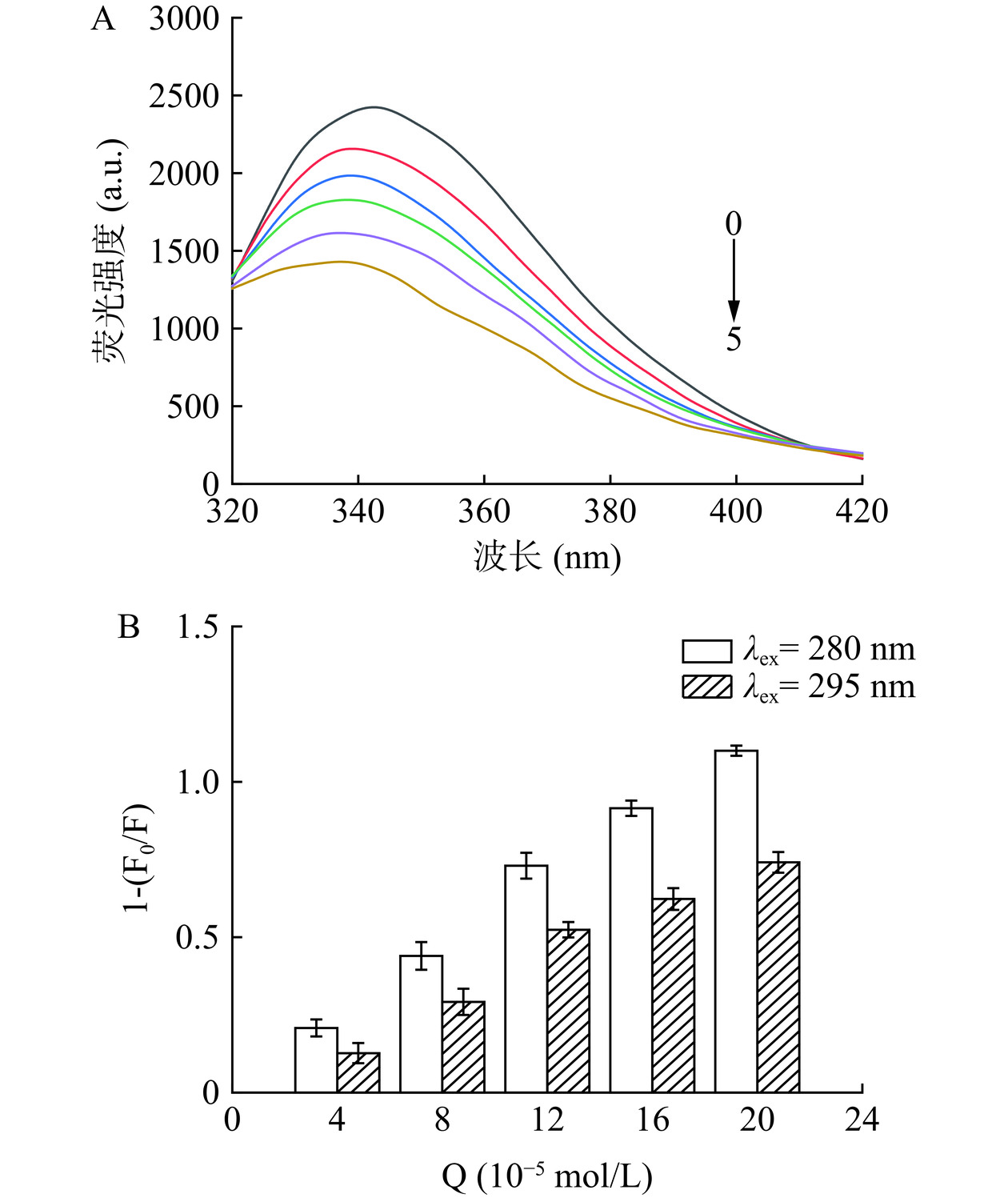
研究表明,BSA的结合位点sites Ⅰ中含有Trp残基和Tyr残基,而结合位点sites Ⅱ中只含有Tyr残基[6,11−12],当激发波长为280 nm时,BSA中的Trp和Tyr残基均被激发,而在激发波长为295 nm时,仅有Trp残基被激发,因此可利用这一特性,比较不同激发波长下LM对BSA的内源荧光光谱,进而初步判断LM与BSA的结合位点。由图5(A)可知,当激发波长为295 nm时,随着LM浓度的升高,BSA的荧光强度逐渐降低,并且出现蓝移,和前面同步荧光光谱结论一致。由图5(B)可知,LM导致BSA发生荧光淬灭,主要是LM导致BSA中的Trp残基发生淬灭,并且初步判断LM与BSA相互作用的结合位点在sites Ⅰ附近。
为了进一步验证LM与BSA的结合位点在sites I附近,选用荧光探针华法林和布洛芬进行验证,其中华法林可以与结合位点sitesⅠ特异性结合,布洛芬可与结合位点sites Ⅱ特异性结合[31−32]。由表4可知,加入荧光探针华法林后,该体系的Ka为6.173×103 L·mol−1,而加入荧光探针布洛芬后,该体系的Ka为9.013×103 L·mol−1,表明荧光探针华法林对LM与BSA的相互作用产生较大影响,即LM与BSA的结合位点在sitesⅠ附近。
表 4 荧光探针对结合体系结合常数的影响Table 4. Effect of fluorescent probe on binding constants of the binding system荧光探针 Ka(103 L·mol−1) R2 空白 9.007 0.9944 华法林 6.173 0.9883 布洛芬 9.013 0.9906 2.4 分子对接结果分析
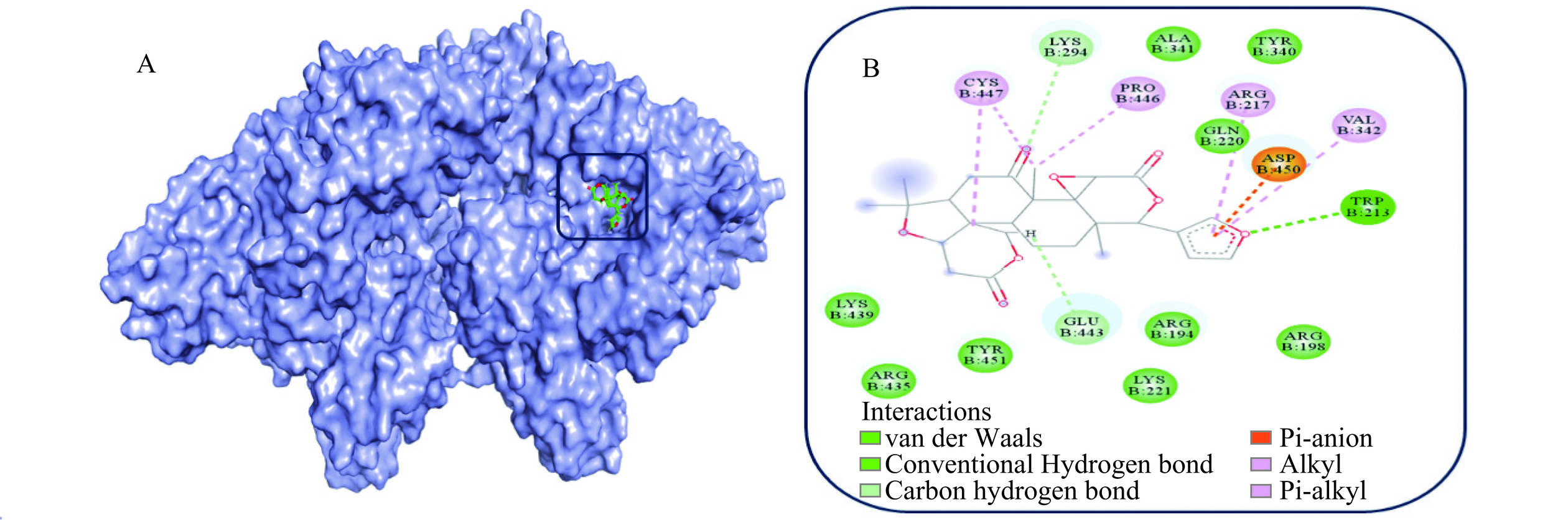
分子对接技术可以弥补光谱法的不足,能更直观、充分地认识小分子与大分子间的结合特性[33]。研究表明,分子对接结果的结合能量越低,大分子与小分子之间的结合越紧密[34],分子对接结果显示LM与BSA的最低结合能量为−5.36 kJ/mol,表明LM可以与BSA紧密结合。运用PyMol软件及Discovery Studio软件对最低结合能下的分子对接结果进行可视化,由图6可知,LM上的呋喃环与BSA上的Trp-213形成了一个常规氢键;LM在C-7上的含氧官能团及在C-19上的氢原子与BSA上的Lys-294、Glu-443形成了两个较弱的碳氢键;LM与BSA上的Arg-194、Lys-221和Tyr-340/451等9个残基之间存在范德华力,表明范德华力和氢键参与了LM与BSA的相互作用,这与前面热力学分析结果一致。此外,还发现LM能与BSA上的Arg-217、Val-342、Pro-446、Cys-447及Asp-450等残基之间形成Alkyl键、Pi-Alkyl键、Pi-Anion键等。其中Trp-213、Tyr-340/451等残基位于BSA的结构亚域ⅡA中,即分子对接结果再次证明LM与BSA的结合位点位于sitesⅠ附近。
3. 结论
本文采用了紫外光谱法、荧光光谱法及分子对接技术研究了LM与BSA的相互作用。紫外光谱结果表明,LM与BSA发生相互作用后,BSA在紫外光谱上的特征吸收峰发生了红移(208-213 nm,278-280 nm)。荧光光谱结果表明,LM导致BSA发生荧光淬灭,淬灭类型为静态淬灭,而LM与BSA发生相互作用是自发反应过程,该过程的主要作用力是范德华力和氢键,并且两者只有一个结合位点。同步荧光光谱结果表明,LM与BSA发生相互作用后,增加了BSA中Tyr和Trp残基微环境的疏水性,并且Trp的荧光猝灭效率大于Tyr的荧光猝灭效率。竞争位点实验及分子对接结果表明,LM与BSA的结合位点在siteⅠ附近,LM可以与BSA上的Trp-213形成氢键,与Tyr-340/451等残基之间存在范德华力,在分子水平上揭示了LM与BSA的相互作用。
-
表 1 不同温度下LM与BSA相互作用的淬灭速率常数及淬灭常数
Table 1 Quenching rate constants and quenching constants of the interaction between LM and BSA at different temperatures
T(K) Kq(1011 L·mol−1·s−1) Ksv(103 L·mol−1) R2 298 5.652 5.652 0.9918 304 4.622 4.622 0.9915 310 3.420 3.420 0.9901 表 2 不同温度下LM与BSA的结合常数及结合位点
Table 2 Binding constants and binding sites of LM and BSA at different temperatures
T(K) Ka(103 L·mol−1) n R2 298 9.007 1.053 0.9944 304 6.823 1.039 0.9948 310 5.739 1.004 0.9894 表 3 不同温度下LM与BSA相互作用的热力学参数
Table 3 Thermodynamic parameters of the interaction between LM and BSA at different temperatures
T(K) ∆H(kJ·mol−1) ∆S(J·mol−1·K−1) ∆G(kJ·mol−1) 298 −28.94 −21.62 −22.49 304 −22.36 310 −22.23 表 4 荧光探针对结合体系结合常数的影响
Table 4 Effect of fluorescent probe on binding constants of the binding system
荧光探针 Ka(103 L·mol−1) R2 空白 9.007 0.9944 华法林 6.173 0.9883 布洛芬 9.013 0.9906 -
[1] 晏敏, 周宇, 贺肖寒, 等. 柑橘籽中柠檬苦素及类似物的生物活性研究进展[J]. 食品与发酵工业,2018,44(2):290−296. [YAN M, ZHOU Y, HE X H, et al. Research progress on the biological activity of limonin and its analogues in citrus seeds[J]. Food and Fermentation Industry,2018,44(2):290−296.] YAN M, ZHOU Y, HE X H, et al. Research progress on the biological activity of limonin and its analogues in citrus seeds[J]. Food and Fermentation Industry, 2018, 44(2): 290−296.
[2] 李韶静, 汤建华. 木果楝属柠檬苦素类似物及其生物活性的研究进展[J]. 中草药,2022,53(10):3178−3194. [LI S J, TANG J H. Research progress on limonin analogues of the genus Melia and their biological activities[J]. Chinese Herbal Medicine,2022,53(10):3178−3194.] doi: 10.7501/j.issn.0253-2670.2022.10.029 LI S J, TANG J H. Research progress on limonin analogues of the genus Melia and their biological activities[J]. Chinese Herbal Medicine, 2022, 53(10): 3178−3194. doi: 10.7501/j.issn.0253-2670.2022.10.029
[3] 罗喜荣, 任荣, 钱志瑶, 等. HPLC法测定柠檬苦素的平衡溶解度和表观油水分配系数[J]. 药物分析杂志,2013,33(10):1711−1714. [LUO X R, REN R, QIAN Z Y, et al. HPLC determination of equilibrium solubility and apparent oil/water partition coefficient of limonin[J]. Chinese Journal of Pharmaceutical Analysis,2013,33(10):1711−1714.] LUO X R, REN R, QIAN Z Y, et al. HPLC determination of equilibrium solubility and apparent oil/water partition coefficient of limonin[J]. Chinese Journal of Pharmaceutical Analysis, 2013, 33(10): 1711−1714.
[4] 吕艳芳, 梁倩倩, 郭雨晴, 等. 分子对接和光谱法研究原儿茶醛和阿魏酸与牛血清白蛋白的互作机理[J]. 食品科学,2021,42(14):24−31. [LÜ Y F, LIANG Q Q, GUO Y Q, et al. Molecular docking and spectroscopic studies on the interaction mechanism between protocatechualdehyde and ferulic acid with bovine serum albumin[J]. Food Science,2021,42(14):24−31.] doi: 10.7506/spkx1002-6630-20200618-251 LÜ Y F, LIANG Q Q, GUO Y Q, et al. Molecular docking and spectroscopic studies on the interaction mechanism between protocatechualdehyde and ferulic acid with bovine serum albumin[J]. Food Science, 2021, 42(14): 24−31. doi: 10.7506/spkx1002-6630-20200618-251
[5] GELAMO E L, SILVA C H T P, IMASATO H, et al. Interaction of bovine (BSA) and human (HSA) serum albumins with ionic surfactants:Spectroscopy and modelling[J]. Biochimica et Biophysica Acta,2002,1594(1):84−99. doi: 10.1016/S0167-4838(01)00287-4
[6] MARUYAMA T, LIN C C, YAMASAKI K, et al. Binding of suprofen to human serum albumin. Role of the suprofen carboxyl group[J]. Biochem Pharmacol,1993,45(5):1017−1026. doi: 10.1016/0006-2952(93)90245-R
[7] 李琳, 婺鸣, 李冰, 等. 杂环胺与牛血清白蛋白的相互作用研究[J]. 华南理工大学学报(自然科学版),2020,48(11):123−130. [LI L, WU M, LI B, et al. Interaction studies between heterocyclic amines and bovine serum albumin[J]. Journal of South China University of Technology (Natural Science Edition),2020,48(11):123−130.] doi: 10.12141/j.issn.1000-565X.200285 LI L, WU M, LI B, et al. Interaction studies between heterocyclic amines and bovine serum albumin[J]. Journal of South China University of Technology (Natural Science Edition), 2020, 48(11): 123−130. doi: 10.12141/j.issn.1000-565X.200285
[8] KUMARI M, MAURYA J K, TASLEEM M, et al. Probing HSA-ionic liquid interactions by spectroscopic and molecular docking methods[J]. Journal of Photochemistry and Photobiology B:Biology,2014,138:27−35. doi: 10.1016/j.jphotobiol.2014.05.009
[9] ZHANG Z, YANG M, YI J, et al. Comprehensive insights into the interactions of two emerging bromophenolic DBPs with human serum albumin by multispectroscopy and molecular docking[J]. ACS Omega,2019,4(1):563−572. doi: 10.1021/acsomega.8b03116
[10] LI T, HU P, DAI T, et al. Comparing the binding interaction between beta-lactoglobulin and flavonoids with different structure by multi-spectroscopy analysis and molecular docking[J]. Spectrochim Acta A Mol Biomol Spectrosc,2018,201:197−206. doi: 10.1016/j.saa.2018.05.011
[11] 王会镇, 赵雨, 姚小军, 等. 1-(4-甲氧基苯基)-3-(2-噻吩基)-2-丙烯酮与牛血清白蛋白的相互作用研究[J]. 化学试剂,2021,43(11):1569−1574. [WANG H Z, ZHAO Y, YAO X J, et al. Interaction of 1-(4-methoxyphenyl)-3-(2-thienyl)-2-propenone with bovine serum albumin[J]. Chemical Reagents,2021,43(11):1569−1574.] WANG H Z, ZHAO Y, YAO X J, et al. Interaction of 1-(4-methoxyphenyl)-3-(2-thienyl)-2-propenone with bovine serum albumin[J]. Chemical Reagents, 2021, 43(11): 1569−1574.
[12] 吴明火, 李尚春, 王丽梅, 等. 邻苯二甲酸二环己酯与牛血清白蛋白相互作用研究[J]. 分析科学学报,2022,38(3):321−326. [WU M H, LI S C, WANG L M, et al. Study on the interaction between dicyclohexyl phthalate and bovine serum albumin[J]. Journal of Analytical Science,2022,38(3):321−326.] WU M H, LI S C, WANG L M, et al. Study on the interaction between dicyclohexyl phthalate and bovine serum albumin[J]. Journal of Analytical Science, 2022, 38(3): 321−326.
[13] RAHMAN N, KHALIL N. Characterization of sulfasalazine-bovine serum albumin and human serum albumin interaction by spectroscopic and theoretical approach[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2023,300:122865. doi: 10.1016/j.saa.2023.122865
[14] ABUBAKAR M, KANDANDAPANI S, MOHAMED S B, et al. Shedding light on the molecular interaction between the Hepatitis B virus inhibitor, clevudine, and human serum albumin:Thermodynamic, spectroscopic, microscopic, and in silico analyses[J]. Journal of Molecular Liquids,2022,368:120737. doi: 10.1016/j.molliq.2022.120737
[15] 吕艳芳, 张紫卿, 梁倩倩, 等. 光谱法和分子对接研究高儿茶酚与牛血清白蛋白的相互作用[J]. 中国食品学报,2022,22(12):72−81. [LÜ Y F, ZHANG Z Q, LIANG Q Q, et al. Spectroscopy and molecular docking to study the interaction of catechols with bovine serum albumin[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(12):72−81.] LÜ Y F, ZHANG Z Q, LIANG Q Q, et al. Spectroscopy and molecular docking to study the interaction of catechols with bovine serum albumin[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(12): 72−81.
[16] HU Y, LIU Y, ZHAO R, et al. Spectroscopic studies on the interaction between methylene blue and bovine serum albumin[J]. Journal of Photochemistry and Photobiology A:Chemistry,2006,179(3):324−329. doi: 10.1016/j.jphotochem.2005.08.037
[17] POLET H, STEINHARDT J. Binding-induced alterations in ultraviolet absorption of native serum albumin[J]. Biochemistry (Easton),1968,7(4):1348−1356. doi: 10.1021/bi00844a015
[18] 李阳, 安琪, 宋悦, 等. HPLC法测定不同产地柑橘第一次生理落果中活性成分的含量[J]. 食品工业科技,2022,43(19):364−371. [LI Y, AN Q, SONG Y, et al. HPLC was used to determine the content of active ingredients in the first physiological fruit drop of citrus from different origins[J]. Science and Technology of Food Industry,2022,43(19):364−371.] LI Y, AN Q, SONG Y, et al. HPLC was used to determine the content of active ingredients in the first physiological fruit drop of citrus from different origins[J]. Science and Technology of Food Industry, 2022, 43(19): 364−371.
[19] 孟鹏, 郑宝东. 超高效液相色谱法快速并同时检测金柑中柠檬苦素和诺米林[J]. 中国食品学报,2013,13(2):177−181. [MENG P, ZHENG B D. Ultra-performance liquid chromatography (UPLC) was used for the rapid and simultaneous detection of limonin and nomiline in kumquats[J]. Journal of Chinese Institute of Food Science and Technology,2013,13(2):177−181.] MENG P, ZHENG B D. Ultra-performance liquid chromatography (UPLC) was used for the rapid and simultaneous detection of limonin and nomiline in kumquats[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(2): 177−181.
[20] 顾佳丽, 王思宇, 杨丹, 等. 光谱法研究甲苯达唑与牛血清白蛋白的相互作用[J]. 分析科学学报,2020,36(6):857−862. [GU J L, WANG S Y, YANG D, et al. The interaction between mebendazole and bovine serum albumin was studied by spectroscopy[J]. Journal of Analytical Science,2020,36(6):857−862.] GU J L, WANG S Y, YANG D, et al. The interaction between mebendazole and bovine serum albumin was studied by spectroscopy[J]. Journal of Analytical Science, 2020, 36(6): 857−862.
[21] LIU B, XUE C, WANG J, et al. Study on the competitive reaction between bovine serum albumin and neomycin with ponceau S as fluorescence probe[J]. Journal of Luminescence,2010,130(11):1999−2003. doi: 10.1016/j.jlumin.2010.05.017
[22] GU J, LIU H, HUANG X, et al. Investigation of the separate and simultaneous bindings of warfarin and fenofibrate to bovine serum albumin[J]. International Journal of Biological Macromolecules,2023,236:123978. doi: 10.1016/j.ijbiomac.2023.123978
[23] 焦安妮, 于敏, 关玥, 等. 大叶冬青皂苷与牛血清蛋白的相互作用研究[J]. 食品工业科技,2021,42(19):8−14. [JIAO A N, YU M, GUANG Y, et al. Study on the interaction between saponins from Ilex magnolia and bovine serum proteins[J]. Science and Technology of Food Industry,2021,42(19):8−14.] JIAO A N, YU M, GUANG Y, et al. Study on the interaction between saponins from Ilex magnolia and bovine serum proteins[J]. Science and Technology of Food Industry, 2021, 42(19): 8−14.
[24] 胡夏恬, 倪帅帅, 焦安妮, 等. 苦丁皂苷L、苦丁皂苷N与牛血清白蛋白的相互作用研究[J]. 食品工业科技,2020,41(9):55−60. [HU X T, NI S S, JIAO A N, et al. Study on the interaction between kudingsaponin L, kudingsaponin N and bovine serum albumin[J]. Science and Technology of Food Industry,2020,41(9):55−60.] HU X T, NI S S, JIAO A N, et al. Study on the interaction between kudingsaponin L, kudingsaponin N and bovine serum albumin[J]. Science and Technology of Food Industry, 2020, 41(9): 55−60.
[25] 韩忠保, 吴雨杭, 米媛媛, 等. 荧光光谱法结合分子对接研究人血清白蛋白对齐墩果酸与熊果酸的异构体识别作用[J]. 光谱学与光谱分析,2019,39(7):2190−2195. [HAN Z B, WU Y H, MI Y Y, et al. Fluorescence spectroscopy combined with molecular docking study on the recognition of isomers of oleanolic acid and ursolic acid by human serum albumin[J]. Spectroscopy and Spectral Analysis,2019,39(7):2190−2195.] HAN Z B, WU Y H, MI Y Y, et al. Fluorescence spectroscopy combined with molecular docking study on the recognition of isomers of oleanolic acid and ursolic acid by human serum albumin[J]. Spectroscopy and Spectral Analysis, 2019, 39(7): 2190−2195.
[26] WARE W R. Oxygen quenching of fluorescence in solution:An experimental study of the diffusion process[J]. Journal of Physical Chemistry (1952),1962,66(3):455−458. doi: 10.1021/j100809a020
[27] 杨雯雁, 马秀兰, 张宇. 荧光光谱法结合分子对接研究邻苯二甲酸单环己酯与牛血清白蛋白的相互作用[J]. 分析试验室,2023,42(9):1236−1241. [YANG Y W, MA X L, ZHANG Y. Fluorescence spectroscopy combined with molecular docking study on the interaction between monocyclohexyl phthalate and bovine serum albumin[J]. Analysis Laboratory,2023,42(9):1236−1241.] YANG Y W, MA X L, ZHANG Y. Fluorescence spectroscopy combined with molecular docking study on the interaction between monocyclohexyl phthalate and bovine serum albumin[J]. Analysis Laboratory, 2023, 42(9): 1236−1241.
[28] HU Y, OUYANG Y, DAI C, et al. Site-selective binding of human serum albumin by palmatine:Spectroscopic approach[J]. Biomacromolecules,2010,11(1):106−112. doi: 10.1021/bm900961e
[29] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions:Forces contributing to stability[J]. Biochemistry,1981,20(11):3096−3102. doi: 10.1021/bi00514a017
[30] AZIMI O, EMAMI Z, SALARI H, et al. Probing the interaction of human serum albumin with norfloxacin in the presence of high-frequency electromagnetic fields:Fluorescence spectroscopy and circular dichroism investigations[J]. Molecules,2011,16(12):9792−9818. doi: 10.3390/molecules16129792
[31] 赵旭红, 夏彩芬, 周紫薇, 等. 花青素对牛血清白蛋白的光谱特性及构象的影响[J]. 食品工业科技,2021,42(7):57−62. [ZHAO X H, XIA C F, ZHOU Z W, et al. Effect of anthocyanins on the spectral characteristics and conformation of bovine serum albumin[J]. Science and Technology of Food Industry,2021,42(7):57−62.] ZHAO X H, XIA C F, ZHOU Z W, et al. Effect of anthocyanins on the spectral characteristics and conformation of bovine serum albumin[J]. Science and Technology of Food Industry, 2021, 42(7): 57−62.
[32] 刘晓娟, 邓培渊, 范春丽, 等. 环氧虫啶与人血清白蛋白的相互作用[J]. 农药学学报,2024,26(1):160−167. [LIU X J, DENG P Y, FAN C L, et al. Studies of the interaction between cycloxaprid and human serum albumin[J]. Chinese Journal of Pesticide Science,2024,26(1):160−167.] LIU X J, DENG P Y, FAN C L, et al. Studies of the interaction between cycloxaprid and human serum albumin[J]. Chinese Journal of Pesticide Science, 2024, 26(1): 160−167.
[33] WANG T, WANG N, YU Y, et al. Study of soybean protein isolate-tannic acid non-covalent complexes by multi-spectroscopic analysis, molecular docking, and interfacial adsorption kinetics[J]. Food Hydrocolloids,2023,137:108330. doi: 10.1016/j.foodhyd.2022.108330
[34] HU Y, XU S, ZHU X, et al. Study on the interaction between methyl violet and bovine serum albumin by spectral analyses[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2009,74(2):526−531. doi: 10.1016/j.saa.2009.06.054
-
期刊类型引用(1)
1. 孙燕,严丽俊,张洁雪,王如意,刘浩. 光谱法研究苯烯莫德与血清白蛋白的作用机制. 中国医药导报. 2025(01): 18-25+37 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



