Antimicrobial Activity of Extracts from Different Parts of Lonicera japonica Thunb. and Their Antibacterial Properties against Alicyclobacillus acidoterrestris
-
摘要: 本研究探究了忍冬(Lonicera japonica Thunb.)不同部位提取液的生物活性物质含量及其对12株供试菌株的抑菌活性。首先,分别测定了忍冬叶、金银花和忍冬藤中的总酚、总黄酮和绿原酸含量,并分析了它们的提取液对12株菌株的抑菌效果。然后,进一步研究了金银花和忍冬叶提取液对酸土脂环酸芽孢杆菌(Alicyclobacillus acidoterrestris)的最小抑菌浓度(MIC)、最小杀菌浓度(MBC)、生长曲线、生物膜形成和细胞形态的影响。结果显示,忍冬叶和金银花中的总酚、总黄酮和绿原酸含量均显著高于忍冬藤(P<0.05)。此外,忍冬叶的总黄酮含量显著高于金银花(P<0.05)。三种提取液对A. acidoterrestris、金黄色葡萄球菌、无乳链球菌、单增李斯特氏菌、枯草芽孢杆菌、大肠埃希菌和沙门氏杆菌均具有一定的抑菌效果,且忍冬叶和金银花提取液的抑菌效果优于忍冬藤。忍冬叶和金银花提取液对A. acidoterrestris的抑菌效果最显著,MIC值均为3.91 mg/mL,MBC值均为31.25 mg/mL。此外,忍冬叶和金银花提取液能有效抑制A. acidoterrestris生长和生物膜的形成,破坏其菌体形态,抑菌效果随提取液浓度的增加而增强。本研究为阐明忍冬抑制A. acidoterrestris的机制奠定了坚实基础,同时也为开发安全高效的新型食品抑菌剂提供了新思路。Abstract: This study investigated the bioactive substance contents within extracts derived from different parts of Lonicera japonica Thunb. and assessed their bacterial inhibitory activities against 12 test strains. Initially, the concentrations of total phenols, total flavonoids, and chlorogenic acid were determined in Lonicera japonica leaves, Lonicerae japonica Flos, and Lonicera japonica caulis. Subsequently, the bacterial inhibition profiles of their extracts against 12 test strains were analyzed. Building upon this analysis, the effects of Lonicerae japonica Flos and Lonicera japonica leaves extracts on minimum inhibitory concentration (MIC), minimum bactericidal concentration (MBC), growth curve, biofilm formation, and cell morphology of Alicyclobacillus acidoterrestris were further investigated. Results revealed that the concentrations of total phenols, total flavonoids, and chlorogenic acid in L. japonica leaves and L. japonica Flos were significantly higher than those from L. japonica caulis (P<0.05). Moreover, the total flavonoids content in L. japonica leaves was notably higher than that in L. japonica Flos (P<0.05). Three extracts exhibited varying degrees of bacteriostatic effects against A. acidoterrestris, Staphylococcus aureus, Streptococcus agalactiae, Listeria monocytogenes, Bacillus subtilis, Escherichia coli and Salmonella. Notably, extracts of L. japonica leaves and L. japonica Flos displayed superior bacteriostatic effects compared to L. japonica caulis. Extracts of L. japonica leaves and L. japonica Flos exhibited the most significant bacteriostatic effects against A. acidoterrestris, with MIC of 3.91 mg/mL and MBC of 31.25 mg/mL. Furthermore, extracts from L. japonica leaves and L. japonica Flos effectively inhibited the growth and biofilm formation of A. acidoterrestris, causing disruptions to their organism morphology. Notably, the inhibitory effects were augmented with the increase of extract concentrations. This study lays a robust foundation for understanding the mechanisms behind L. japonica inhibition of A. acidoterrestris and offers insights for developing safe and efficient new food bacteriostatic agents.
-
酸土脂环酸芽孢杆菌(Alicyclobacillus acidoterrestris)、单增李斯特菌(Listeria monocytogenes)和金黄色葡萄球菌(Staphylococcus aureus)等细菌在自然环境中广泛存在,是最常见的致病微生物,食用被这些细菌污染的食品后可能会引起呕吐和中毒等不良症状,所以在食品加工和储藏过程中常常要用化学防腐剂抑制有害微生物的生长[1−2]。目前,工业生产中常用苯甲酸、柠檬酸和山梨酸等防腐剂,然而化学防腐剂乱用或滥用可能会对人体造成不同程度的危害[3]。因此,迫切需要开发安全且有效的新型天然防腐剂。据文献报道,植物中存在促进人体健康且具有抑菌和杀菌作用的天然活性成分,如多酚、黄酮类和有机酸等[4−6]。因此,寻找和利用有效抑菌成分含量丰富的植物具有重要意义。
忍冬(Lonicera japonica Thunb.)为忍冬科忍冬属半常绿藤木,其干燥花蕾或带初开的花为金银花[7]。国内外研究证实,金银花、忍冬叶和忍冬藤均含有黄酮类、有机酸类、挥发油类和环烯醚萜类等多种天然活性成分[8−9],具有抗菌消炎[10]、清热解毒[11]、抗氧化[12]、保肝利胆[13]和降血糖[14]等作用。Li等[15]研究发现,金银花中的酚酸和黄酮类化合物等活性成分可在不同程度上抑制金黄色葡萄球菌、大肠杆菌(Escherichia coli)和铜绿假单胞菌(Pseudomonas aeruginosa)。Rahman等[16]研究了忍冬叶提取物和金银花精油对体外食源性细菌的抑菌作用,结果表明忍冬叶对金黄色葡萄球菌的抑菌活性更强。马艳妮等[17]研究了忍冬叶总黄酮对金黄色葡萄球菌、大肠杆菌和鼠伤寒沙门氏菌(Salmonella typhimurium)等9种常见病原菌的体外抑菌活性,结果表明忍冬叶总黄酮具有较好的抗菌活性。但忍冬在抑制酸土脂环酸芽孢杆菌作用等抑菌活性方面鲜有报道。
忍冬叶和忍冬藤的产量远高于金银花[18]。然而,目前对忍冬叶和忍冬藤的开发利用较少。因此,研究忍冬不同部位生物活性成分及功能特性,对提高忍冬的综合利用价值具有重要意义。本文以金银花、忍冬叶和忍冬藤为原料,研究忍冬不同部位生物活性成分及对12株供试菌的体外抑菌活性,并测定对抑制酸土脂环酸芽孢杆菌效果较强的金银花和忍冬叶提取液的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)以及对金银花和忍冬叶提取液对酸土脂环酸芽孢杆菌生长曲线、细胞形态和生物膜形成能力的影响进行研究。本研究为进一步开发利用忍冬,开发新型食品抑菌剂提供参考。
1. 材料与方法
1.1 材料与仪器
金银花、忍冬叶和忍冬藤 来自河南省新乡市河南科技学院金银花试验基地;嗜酸乳杆菌(L. acidophilus zrx02 GenBank No.MF804413)、植物乳杆菌(L. plantarum zrx03 GenBank No.MN784485)、鼠李糖乳杆菌(L. rhamnosus zrx01 GenBank No.KY348290、酸土脂环酸芽孢杆菌(A. acidoterrestris DSM 3922T)、无乳链球菌(S. agalactiae CICC 10465)、单增李斯特氏菌(L. monocytogenes CICC 21633)、金黄色葡萄球菌(S. aureus ATCC 25923)、枯草芽孢杆菌(B. subtilis CICC 10002)、大肠杆菌(E. coli JM109 ATCC 67387)、沙门氏杆菌(Salmonella CMCC 541)、空肠弯曲杆菌(C. jejuni CICC 22936)、马克斯克鲁维酵母(K. marxianus) 均为河南科技学院食品研究所保藏菌株;MRS肉汤培养基、AAM培养基、BHI培养基、牛肉膏蛋白胨培养基、LB培养基、布氏肉汤培养基、YPD培养基 青岛高科技工业园区海博生物技术有限公司;没食子酸 成都曼斯特有限公司;芦丁、福林酚、结晶紫 北京索莱宝有限公司;绿原酸 美国Sigma-Aldrich公司;戊二醛 天津市科密欧化学试剂有限公司;甲酸、甲醇 色谱纯,西陇科学股份有限公司;其他试剂均为分析纯。
Varioskan Flash全波长酶标仪 美国Thermofisher公司;e2695-2489高效液相色谱仪 美国Waters公司;WFJ 7200可见分光光度计 尤尼柯(上海)仪器有限公司;H2050R冷冻离心机 湖南湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 忍冬不同部位总酚、总黄酮和绿原酸含量测定
1.2.1.1 忍冬不同部位总酚、总黄酮和绿原酸的提取
将金银花、忍冬叶和忍冬藤60 ℃热风干燥至恒重,粉碎后过50目筛,备用。称取1 g样品,加入15 mL 60%乙醇,60 ℃、200 W超声水浴提取30 min。在4 ℃下10000 r/min离心10 min,收集上清液,过0.22 μm滤膜,于4 ℃冰箱保存。
1.2.1.2 总酚含量的测定
采用Folin-Ciocalteu法[19],将1 mL样品与5 mL Folin-Ciocalteu混合,反应5 min,加入4 mL 7.5% Na2CO3溶液,避光反应60 min,在765 nm下测定。根据没食子酸标准曲线的线性回归方程(y=0.0067x−0.0781,R2=0.9979)计算总酚含量,结果以每g样品的没食子酸当量mg表示(mg GAE/g)。
1.2.1.3 总黄酮含量的测定
采用AlCl3比色法[20],将1 mL样品与0.5 mL 5% NaNO2溶液混合,反应5 min,加入1 mL 5% AlCl3溶液反应5 min,加入2 mL 8% NaOH溶液反应10 min,在510 nm下测定。根据芦丁标准曲线的线性回归方程(y=0.0026x−0.0399,R2=0.9991)计算总黄酮含量,结果以每g样品的芦丁当量mg表示(mg RE/g)。
1.2.1.4 绿原酸含量的测定
采用高效液相色谱法[21],色谱柱:Agilent TC-C18(250 mm×4.6 mm,5 μm);色谱条件:温度30 ℃;检测波长320 nm;进样体积20 μL;体积流量0.6 mL/min;流动相为甲醇(A)-0.1%甲酸水(B);梯度洗脱条件为0~10 min,5%~30% A;10~25 min,30%~50% A;25~35 min,50%~70% A;35~40 min,70%~5% A。以绿原酸浓度(mg/mL)为横坐标(x),色谱峰面积为纵坐标(y),绘制标准曲线。根据绿原酸标准曲线的线性回归方程(y=30726x−688902,R2=0.9996)计算绿原酸含量,结果以每g样品的绿原酸当量mg表示(mg CGA/g)。
1.2.2 忍冬不同部位提取液抑菌谱的测定
1.2.2.1 菌株的活化与培养
菌株培养基的选择与制备:L. acidophilus、L. plantarum、L. rhamnosus选用MRS肉汤培养基;A. acidoterrestris选用AAM培养基;S. agalactiae、L. monocytogenes选用BHI培养基;S. aureus、B. subtilis选用牛肉膏蛋白胨培养基;E. coli、Salmonella选用LB培养基;C. jejuni选用布氏肉汤培养基;K. marxianus选用YPD培养基。固体培养基均在液体培养基的基础上加入2%的琼脂粉,在121 ℃下高压灭菌15 min。菌株的活化:将冻藏菌株分别接种于相应液体培养基中,然后在37 ℃、250 r/min条件下振荡培养24 h(A. acidoterrestris培养温度为45 ℃),然后将菌液稀释涂布,静置培养18 h。菌株的培养:从各菌株平板上挑取一个单菌落,接种至10 mL培养基,过夜培养,然后以1.0%体积比转接至50 mL培养基中培养至对数期,最后稀释成1×106 CFU/mL的菌悬液,备用。
1.2.2.2 忍冬不同部位提取液的制备
称取10 g样品,加入100 mL 60%乙醇,60 ℃、200 W超声水浴提取30 min,10000 r/min离心10 min,收集上清液,向沉淀中再次加入100 mL乙醇,超声水浴30 min后离心,重复3次。合并上清液,旋转蒸发浓缩至10 mL,即得浓度为1 g/mL的提取液。
1.2.2.3 抑菌谱的测定
采用牛津杯法[22],将100 μL菌悬液均匀涂布于固体培养基平板上,用牛津杯在平板上打孔,然后加入提取液100 μL,于恒温箱中培养至肉眼观察到透明圈为止,无菌水作空白对照,用十字交叉法测定抑菌圈直径。
1.2.3 忍冬不同部位提取液MIC和MBC的测定
采用二倍稀释法[23],用液体培养基对提取液进行二倍稀释,得到浓度为1000、500、250、125、62.5、31.25、15.63、7.81、3.91、1.95 mg/mL的忍冬提取液。分别将100 μL各浓度忍冬提取液加入100 μL菌悬液,混匀后培养24 h,以澄清无浑浊的最低浓度为最小抑菌浓度(MIC)。培养基作对照,用于验证细菌正常生长,记为CK1;加入提取液而不加菌液,用于验证提取液是否受污染,记为CK2。在MIC的基础上,取培养液100 μL均匀涂布于固体平板上培养48 h,以无活菌存在的最低浓度为最小杀菌浓度(MBC)[24]。
1.2.4 忍冬不同部位提取液对酸土脂环酸芽孢杆菌生长曲线的影响
参考Cui等[25]的方法,向菌悬液中加入金银花和忍冬叶提取液,至终浓度为1 MIC、2 MIC和MBC,不加提取液的作为对照组,45 ℃、250 r/min恒温振荡培养,每隔2 h取样测定OD600 nm值,绘制生长曲线。
1.2.5 忍冬不同部位提取液对酸土脂环酸芽孢杆菌细胞形态的影响
采用扫描电子显微镜(SEM)法[26],向菌悬液加入金银花和忍冬叶提取液,至终浓度为1 MIC、2 MIC和4 MIC,不加提取液的作为对照组,45 ℃、250 r/min培养8 h。4000 r/min,离心10 min,弃上清液,用无菌PBS清洗2次,用1 mL 2.5%戊二醇固定细胞形态。用PBS(0.1 mol/L,pH7.0)洗涤3次,然后使用一系列梯度浓度的乙醇(30%、50%、80%、90%和95%)进行脱水,每种浓度进行2次,每次15 min。脱水后在−20 ℃下预冻2 h,然后真空冷冻干燥。干燥完全后溅射镀金,在扫描电镜下观察。
1.2.6 忍冬不同部位提取液对酸土脂环酸芽孢杆菌生物膜形成能力的影响
采用结晶紫染色法[27],将200 μL菌悬液置于96孔板中,加入金银花和忍冬叶提取液,至终浓度为1 MIC、2 MIC、4 MIC,不加提取液的作为对照组,45 ℃静置培养24 h。吸出培养液,用200 μL无菌PBS(0.03 mol/L,pH7.2)洗涤3次,加入100 μL甲醇,固定15 min后吸出。加入100 μL 1%结晶紫溶液,染色15 min,将结晶紫溶液吸出,用PBS将颜色冲洗干净。加入100 μL 33% CH3COOH溶液,用酶标仪测定OD590 nm值。
1.3 数据处理
每组均进行3次平行实验,结果均以平均值±标准差表示。采用SPSS 23.0进行数据分析,Origin 9.0进行绘图。
2. 结果与分析
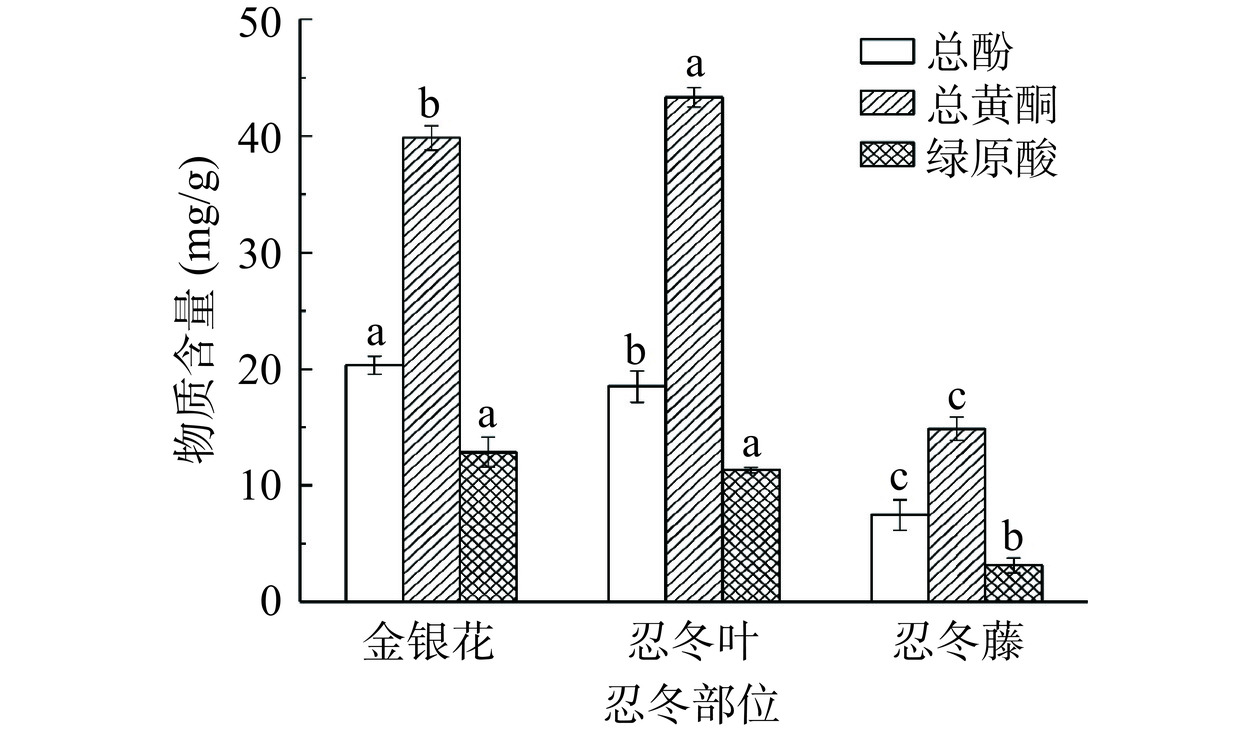
2.1 忍冬不同部位总酚、总黄酮和绿原酸含量
对金银花、忍冬叶和忍冬藤的总酚、总黄酮和绿原酸含量进行测定,结果表明忍冬叶和金银花生物活性成分含量相接近,但忍冬藤中活性成分显著低于金银花和忍冬叶(P<0.05,图1)。忍冬不同部位总酚含量依次为金银花>忍冬叶>忍冬藤,金银花总酚含量为20.29 mg/g,是忍冬叶和忍冬藤含量的109.68%、272.72%;忍冬不同部位总黄酮含量依次为忍冬叶>金银花>忍冬藤,忍冬叶总黄酮含量为43.32 mg/g,是金银花和忍冬藤的108.81%、291.13%;金银花绿原酸含量与忍冬叶无显著差异(P>0.05),分别为12.86、11.29 mg/g,但均显著高于忍冬藤绿原酸含量(P<0.05)。章艳玲[28]比较了忍冬不同部位中黄酮类化合物含量,表明忍冬叶的黄酮类化合物最多,其次是金银花,忍冬藤含量最少;路俊仙等[29]在测定忍冬不同部位化学成分含量时也发现金银花和忍冬叶中绿原酸含量高于忍冬藤;这些研究与本研究结果相一致。另外,有文献报道,忍冬藤提取物对脂多糖诱导的RAW 264.7细胞分泌的炎症因子具有显著的抑制作用,促进骨折愈合,并具有较好的抗炎效果[30−31]。因此,进一步对忍冬藤生物活性成分挖掘对开发忍冬资源具有重要意义。由此可见,研究金银花、忍冬叶和忍冬藤中活性成分对提高忍冬附加值具有重要意义。
2.2 忍冬不同部位提取液抑菌谱
金银花、忍冬叶和忍冬藤提取液具有广谱的抗菌性,对革兰氏阳性菌和革兰氏阴性菌均有一定的抑菌效果(表1)。金银花和忍冬叶提取液对A. acidoterrestris、S. agalactiae、L. monocytogenes、S. aureu、B. subtilis、E. coli和Salmonella均有一定的抑制作用。其中对A. acidoterrestris的抑制效果最强;对S. agalactiae、L. monocytogenes和S. aureus亦为敏感;对B. subtilis、E. coli和Salmonella也显示出一定的抑制作用,且忍冬叶对A. acidoterrestris的抑制作用与金银花无显著性差异(P>0.05)。忍冬藤提取液对A. acidoterrestris的抑菌效果略差于金银花和忍冬叶,对S. agalactiae、L. monocytogenes、S. aureus和E. coli显示出一定的抑菌特性,但抑菌效果低于金银花和忍冬叶。Xiong等[10]研究表明,忍冬叶对S. aureus和E. coli有显著的抗菌活性,且对S. aureus的抑菌效果更强,与本研究结果一致。本研究结果表明忍冬不同部位提取液对A. acidoterrestris抑菌效果较强,尤其是金银花和忍冬叶提取液。但忍冬提取物对A. acidoterrestris的抑菌特性鲜有报道。因此,本文接下来进一步研究金银花和忍冬叶提取液对A. acidoterrestris的抑菌特性。
表 1 忍冬不同部位提取液抑菌圈直径Table 1. Diameter of bacteriostatic circle of extracts from different parts of L. japonica菌种性质 菌株 不同部位抑菌圈直径(mm) 金银花 忍冬叶 忍冬藤 G+ L. acidophilus 6.00±0.00Ga 6.00±0.00Ga 6.00±0.00Ea L. plantarum 6.00±0.00Ga 6.00±0.00Ga 6.00±0.00Ea L. rhamnosus 6.00±0.00Ga 6.00±0.00Ga 6.00±0.00Ea A. acidoterrestris 17.17±0.29Aa 17.17±0.58Aa 12.67±0.29Ab S. agalactiae 14.83±0.29Ba 14.43±0.12Ba 10.73±0.25Bb L. monocytogenes 14.00±0.20Ca 13.40±0.36Cb 9.60±0.17Cc S. aureus 12.17±0.06Da 11.90±0.10Da 7.33±0.29Db B. subtilis 10.40±0.17Fa 10.00±0.20Fb 6.00±0.00Ec G− E. coli 11.23±0.15Ea 10.77±0.25Eb 7.03±0.15Dc Salmonella 10.13±0.31Fa 9.47±0.31Fb 6.00±0.00Ec C. jejuni 6.00±0.00Ga 6.00±0.00Ga 6.00±0.00Ea 其他 K. marxianus 6.00±0.00Ga 6.00±0.00Ga 6.00±0.00Ea 注:L. acidophilus、L. plantarum、L. rhamnosus、A. acidoterrestris、S. agalactiae、L. monocytogenes、S. aureus、B. subtilis为革兰氏阳性菌(G+);E. coli、Salmonella、C. jejuni为革兰氏阴性菌(G−)。抑菌圈打孔直径为6 mm,在抑菌圈直径=6 mm时,表示抑菌作用实际为0;抑菌圈直径>12 mm为菌种对药物高敏感;9~12 mm为中敏感;6~9 mm为低敏感;=6 mm为不敏感。不同大写字母表示同一部位不同菌株间差异显著(P<0.05),不同小写字母表示不同部位同一菌株间差异显著(P<0.05)。 忍冬不同部位提取液对菌株抑菌作用具有差异性的研究亦有报道。Yan等[32]研究表明忍冬藤提取液对S. aureus的抑菌效果比金银花和忍冬叶提取液弱;任敏等[33]发现忍冬藤提取物对S. aureus的抑菌作用最弱,这与本研究结果一致。金银花、忍冬叶和忍冬藤的抑菌效果存在差异,可能是因为忍冬不同部位主要生物活性物质不同,虽然金银花和忍冬叶均含一定量的多酚、黄酮和绿原酸类活性物质,但其单体化合物存在差异,导致其对菌株的敏感性不同。有文献报道,金银花中的化学成分种类更多,其中芦丁和异绿原酸B只在金银花中检测到,而金银花和忍冬叶中均含有绿原酸、异绿原酸A和异绿原酸C,但忍冬藤中异绿原酸A和异绿原酸C含量较低[29]。异绿原酸A具有比绿原酸更强的杀菌活性,原因是疏水相互作用和氢键都有助于异绿原酸A插入POPG脂双层,并且奎宁酸部分是异绿原酸A中与POPG脂双分子层形成氢键的关键结构[34]。因此,金银花和忍冬叶提取液中较高含量的多酚、黄酮和绿原酸等生物活性成分,使得其抑菌能力高于忍冬藤。
另外,忍冬提取液虽然对革兰氏阳性菌敏感,但对L. acidophilus、L. plantarum和L. rhamnosus这三株益生菌均无抑制特性,这对忍冬精深加工及药物开发具有重要意义,其机理特性有待于进一步研究。
2.3 忍冬不同部位提取液对酸土脂环酸芽孢杆菌的MIC和MBC
金银花和忍冬叶提取液对A. acidoterrestris均有较强的抑制作用,但抑制效果随浓度的降低而减弱(表2)。当提取液浓度为3.91 mg/mL时,仍表现出抑制作用,培养液仍澄清透明。因此,金银花和忍冬叶提取液对A. acidoterrestris的MIC均为3.91 mg/mL。在MIC值的基础上,测定了金银花和忍冬叶提取液对A. acidoterrestris的MBC值。结果表明,金银花与忍冬叶提取液对A. acidoterrestris的杀菌效果相同,当提取液浓度为31.25 mg/mL时,仍无活菌存在,金银花和忍冬叶提取液对A. acidoterrestris的MBC值均为31.25 mg/mL。
表 2 忍冬不同部位提取液对酸土脂环酸芽孢杆菌的MIC和MBCTable 2. MIC and MBC of extracts from different parts of L. japonica on A. acidoterrestris忍冬部位 提取液浓度(mg/mL) 1000 500 250 125 62.5 31.25 15.63 7.81 3.91 1.95 CK1 CK2 MIC 金银花 − − − − − − − − − + + − 忍冬叶 − − − − − − − − − + + − MBC 金银花 − − − − − − + + + + + − 忍冬叶 − − − − − − + + + + + − 注:“−”表示无菌生长;“+”表示有菌生长;CK1为不加提取液的对照;CK2为不加菌液的对照。 2.4 忍冬不同部位提取液对酸土脂环酸芽孢杆菌生长曲线的影响
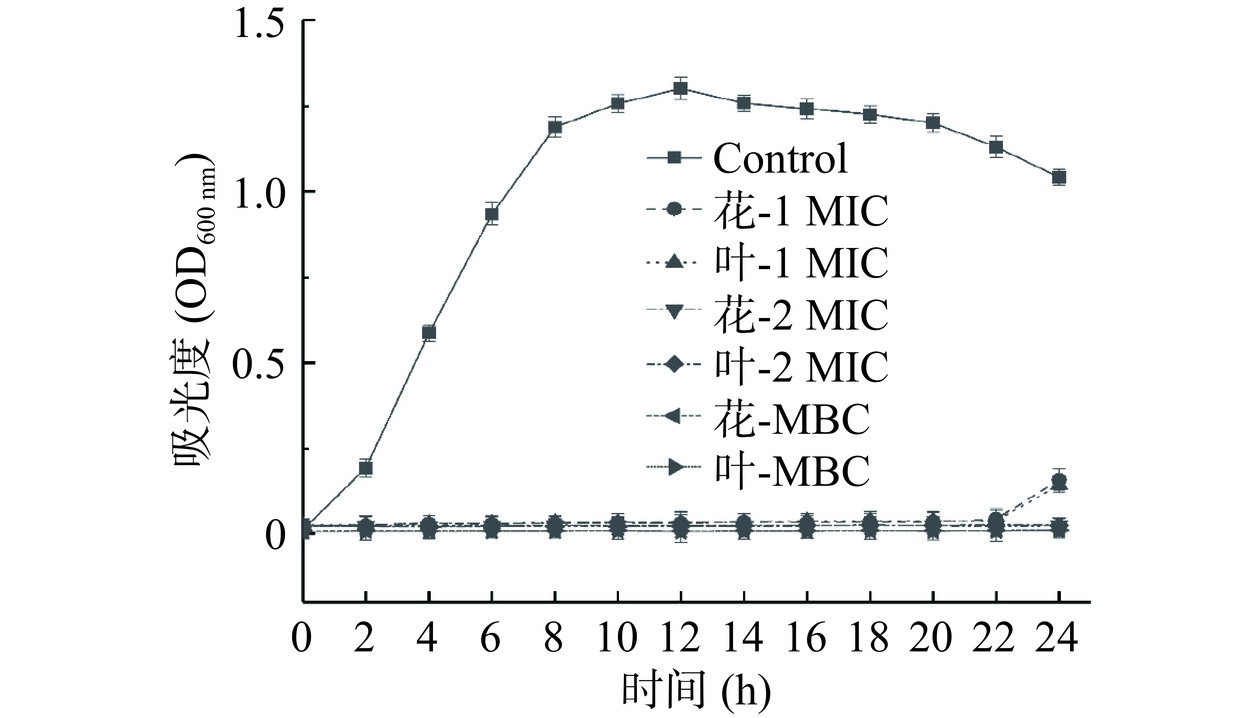
微生物生长过程中,菌液浓度往往与OD600 nm下的吸光度呈正相关,因此可通过测定A. acidoterrestris相应培养时间与A. acidoterrestris菌液吸光度之间的变化来判定A. acidoterrestris的生长状况。测定不同浓度的金银花和忍冬叶提取液对A. acidoterrestris生长曲线的影响以进一步探究其抑菌作用(图2)。对照组的A. acidoterrestris正常生长,迟缓期为2 h,随后进入对数期,在12 h时A. acidoterrestris菌液密度最高,其吸光度达到(1.301±0.032),随后进入生长稳定期。当花和叶抑菌浓度为1 MIC时,菌体生长被抑制,直至24 h时,菌体开始生长,吸光度分别为0.159±0.032和0.144±0.021,两者抑菌效果无显著性差异(P>0.05)。当浓度达到2 MIC时,A. acidoterrestris的生长明显被抑制,24 h内菌液的吸光度均无明显变化。随着提取液浓度继续增大到MBC时,A. acidoterrestris无生长迹象。结果表明,金银花和忍冬叶提取液对A. acidoterrestris的抑菌效果相同,并随着浓度的增大,抑菌效果更明显。
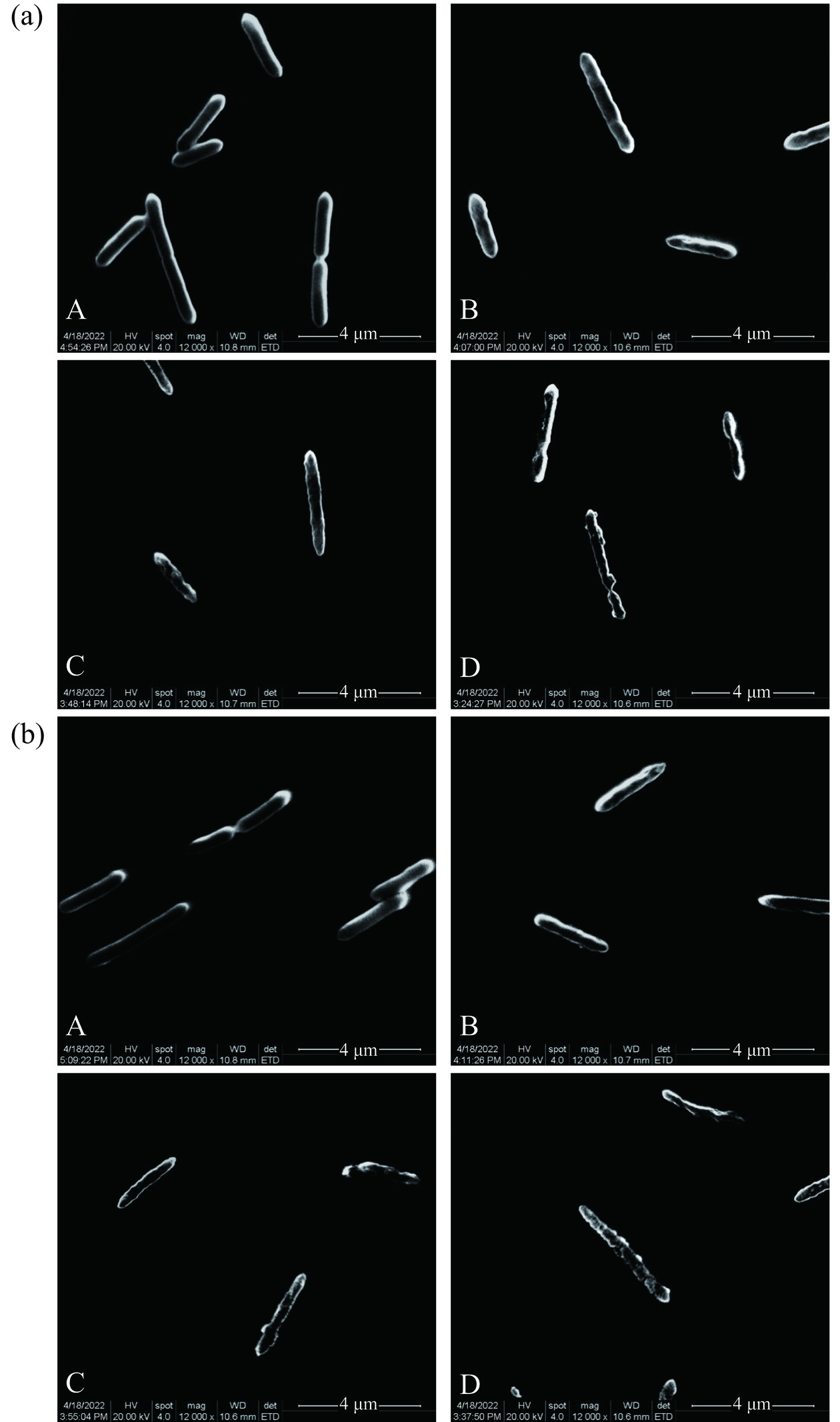
2.5 忍冬不同部位提取液对酸土脂环酸芽孢杆菌细胞形态的影响
对照组A. acidoterrestris呈现杆状,菌体形态完好,表面光滑,未观察到细胞破损或内容物溢出等现象(图3)。随着金银花和忍冬叶提取液浓度的增大,A. acidoterrestris的菌体形态发生不同程度的变化。当浓度为1 MIC时,A. acidoterrestris的菌体表面变得粗糙,出现褶皱和凹陷现象。浓度为2 MIC时,A. acidoterrestris的菌体损伤更明显,呈凹凸不平的无规则形态,细胞界限变得模糊,表面出现孔洞,细胞基质出现外泄现象。在4 MIC浓度下,A. acidoterrestris的菌体被严重破坏,内容物溶出,细胞膜几乎完全破裂,难以维持正常形态。Cai等[35]使用绿原酸和肉桂酸处理A. acidoterrestris,研究发现绿原酸和肉桂酸对A. acidoterrestris的抑菌作用机制归因于对菌体细胞膜的破坏,导致细胞膜发生破裂,进而导致蛋白质和核酸的泄漏。Li等[36]研究发现,对香豆酸对A. acidoterrestris的作用机制是由于对香豆酸的作用导致细胞内ATP减少,对香豆酸可以与DNA相互作用,干扰正常的细胞功能,A. acidoterrestris细胞膜完整性受损,细胞形态出现畸变。综上所述,忍冬提取液对A. acidoterrestris的抑制作用可能是忍冬中丰富的绿原酸、多酚和黄酮等活性成分严重破坏了A. acidoterrestris的细胞膜结构,致使菌体形态发生变化,细胞基质外泄,难以正常生长。
2.6 忍冬不同部位提取液对酸土脂环酸芽孢杆菌生物膜形成能力的影响
如图4(a)所示,经忍冬不同部位提取液处理后,A. acidoterrestris的生物膜量显著低于对照组(P<0.05),且随着金银花和忍冬叶提取液浓度的增大,染色液OD590 nm值整体呈现逐渐降低的趋势,与之对应的96孔板颜色逐渐变浅(图4(b))。当提取液浓度为4 MIC时,OD590 nm值最小,其对应培养孔的颜色与AAM培养基颜色相近。金银花提取液对A. acidoterrestris的生物膜的形成有较大的影响,低浓度条件下可有效减少生物膜生成量,高浓度时可完全抑制生物膜的生成,且忍冬叶提取液对A. acidoterrestris的生物膜形成能力的影响与金银花提取液无显著性差异(P>0.05),这与其对A. acidoterrestris生长曲线的影响结果是相同的(图2)。细菌的生物膜形成能力代表着细菌处于适宜条件下通过分泌胞外多糖从而达到形成细菌菌落的能力,而生物膜形成能力越强的菌体表面越浑浊,吸光度越大,细胞膜形成能力明显降低,表明金银花和忍冬叶提取液能抑制生物膜的形成,对生物被膜具有清除作用[37]。菌体生物被膜主要包括胞外多糖和蛋白质[38],忍冬提取液对A. acidoterrestris生物膜的抑制作用,可能是提取液中的绿原酸等生物活性成分影响了A. acidoterrestris分泌胞外多糖,菌体内蛋白质组分出现损失,从而使得OD值降低。
3. 结论
忍冬叶和金银花中的总酚、总黄酮和绿原酸含量均显著高于忍冬藤(P<0.05)。三个部位提取液对A. acidoterrestris、S. agalactiae、L. monocytogenes、S. aureus、B. subtilis、E. coli和Salmonella均具有一定的抑制效果,且忍冬叶和金银花提取液的抑菌效果优于忍冬藤。此外,忍冬叶和金银花提取液对A. acidoterrestris的抑菌效果最明显,MIC值均为3.91 mg/mL,MBC值均为31.25 mg/mL,且抑制效果随提取液浓度的增加而增强。忍冬叶和金银花提取液能有效抑制A. acidoterrestris菌体生物膜的形成。扫描电镜结果显示,忍冬叶和金银花提取液处理后的A. acidoterrestris菌体形态发生畸变,胞内基质发生泄露。本研究为阐明忍冬抑制A. acidoterrestris的机制奠定了坚实基础,忍冬有望成为果汁生产中抑制A. acidoterrestris污染的新型高效抑菌剂。但细菌的生物被膜形成能力与营养条件、环境等多种因素有关,因此忍冬对A. acidoterrestris生物膜形成的影响机制还需进一步研究。
-
表 1 忍冬不同部位提取液抑菌圈直径
Table 1 Diameter of bacteriostatic circle of extracts from different parts of L. japonica
菌种性质 菌株 不同部位抑菌圈直径(mm) 金银花 忍冬叶 忍冬藤 G+ L. acidophilus 6.00±0.00Ga 6.00±0.00Ga 6.00±0.00Ea L. plantarum 6.00±0.00Ga 6.00±0.00Ga 6.00±0.00Ea L. rhamnosus 6.00±0.00Ga 6.00±0.00Ga 6.00±0.00Ea A. acidoterrestris 17.17±0.29Aa 17.17±0.58Aa 12.67±0.29Ab S. agalactiae 14.83±0.29Ba 14.43±0.12Ba 10.73±0.25Bb L. monocytogenes 14.00±0.20Ca 13.40±0.36Cb 9.60±0.17Cc S. aureus 12.17±0.06Da 11.90±0.10Da 7.33±0.29Db B. subtilis 10.40±0.17Fa 10.00±0.20Fb 6.00±0.00Ec G− E. coli 11.23±0.15Ea 10.77±0.25Eb 7.03±0.15Dc Salmonella 10.13±0.31Fa 9.47±0.31Fb 6.00±0.00Ec C. jejuni 6.00±0.00Ga 6.00±0.00Ga 6.00±0.00Ea 其他 K. marxianus 6.00±0.00Ga 6.00±0.00Ga 6.00±0.00Ea 注:L. acidophilus、L. plantarum、L. rhamnosus、A. acidoterrestris、S. agalactiae、L. monocytogenes、S. aureus、B. subtilis为革兰氏阳性菌(G+);E. coli、Salmonella、C. jejuni为革兰氏阴性菌(G−)。抑菌圈打孔直径为6 mm,在抑菌圈直径=6 mm时,表示抑菌作用实际为0;抑菌圈直径>12 mm为菌种对药物高敏感;9~12 mm为中敏感;6~9 mm为低敏感;=6 mm为不敏感。不同大写字母表示同一部位不同菌株间差异显著(P<0.05),不同小写字母表示不同部位同一菌株间差异显著(P<0.05)。 表 2 忍冬不同部位提取液对酸土脂环酸芽孢杆菌的MIC和MBC
Table 2 MIC and MBC of extracts from different parts of L. japonica on A. acidoterrestris
忍冬部位 提取液浓度(mg/mL) 1000 500 250 125 62.5 31.25 15.63 7.81 3.91 1.95 CK1 CK2 MIC 金银花 − − − − − − − − − + + − 忍冬叶 − − − − − − − − − + + − MBC 金银花 − − − − − − + + + + + − 忍冬叶 − − − − − − + + + + + − 注:“−”表示无菌生长;“+”表示有菌生长;CK1为不加提取液的对照;CK2为不加菌液的对照。 -
[1] OSOPALE A B, ADEWUMI A G, WITTHUHN C R, et al. A review of innovative techniques for rapid detection and enrichment of Alicyclobacillus during industrial processing of fruit juices and concentrates[J]. Food Control,2019,99:146−157. doi: 10.1016/j.foodcont.2018.12.032
[2] CAI R, YUAN Y, WANG Z, et al. Effects of preservatives on Alicyclobacillus acidoterrestris growth and guaiacol production[J]. International Journal of Food Microbiology,2015,214:145−150. doi: 10.1016/j.ijfoodmicro.2015.08.013
[3] PORNPUKDEEWATTANA S, JINDAPRASERT A, MASSA S. Alicyclobacillus spoilage and control-a review[J]. Critical Reviews in Food Science and Nutrition,2020,60(1):108−122. doi: 10.1080/10408398.2018.1516190
[4] JOVANOVIĆ A A, DJORDJEVIĆ V B, PETROVIĆ P M, et al. The influence of different extraction conditions on polyphenol content, antioxidant and antimicrobial activities of wild thyme[J]. Journal of Applied Research on Medicinal and Aromatic Plants,2021,25:100328. doi: 10.1016/j.jarmap.2021.100328
[5] DIARRA M S, HASSAN Y I, BLOCK G S, et al. Antibacterial activities of a polyphenolic-rich extract prepared from American cranberry (Vaccinium macrocarpon) fruit pomace against Listeria spp.[J]. LWT-Food Science and Technology,2020,123:109056. doi: 10.1016/j.lwt.2020.109056
[6] CUI S M, LI T, LIANG H Y, et al. Antibacterial activities and mechanisms of vine tea extract and 2R, 3R-dihydromyricetin on Escherichia coli[J]. LWT-Food Science and Technology,2021,146(1):111393.
[7] SHANG X, PAN H, LI M, et al. Lonicera japonica Thunb.:Ethnopharmacology, phytochemistry and pharmacology of an important traditional Chinese medicine[J]. Journal of Ethnopharmacology,2011,138(1):1−21. doi: 10.1016/j.jep.2011.08.016
[8] LI Y, XIE L, LIU K, et al. Bioactive components and beneficial bioactivities of flowers, stems, leaves of Lonicera japonica Thunberg:A review[J]. Biochemical Systematics and Ecology,2023,106:104570. doi: 10.1016/j.bse.2022.104570
[9] YE J, SU J, CHEN K, et al. Comparative investigation on chemical constituents of flower bud, stem and leaf of Lonicera japonica Thunb. by HPLC-DAD-ESI-MS/MSn and GC-MS[J]. Journal of Analytical Chemistry,2014,69:777−784. doi: 10.1134/S1061934814080036
[10] XIONG J, LI S, WANG W, et al. Screening and identification of the antibacterial bioactive compounds from Lonicera japonica Thunb. leaves[J]. Food Chemistry,2013,138(1):327−333. doi: 10.1016/j.foodchem.2012.10.127
[11] 赵媛媛, 杨倩茹, 郝江波, 等. 金银花与忍冬藤及叶药理作用差异的研究进展[J]. 中国中药杂志,2016,41(13):2422−2427. [ZHAO Y Y, YANG Q R, HAO J B, et al. Research progress on pharmacological effects and their differences among the flowers, stems and leaves of Lonicera japonica[J]. China Journal of Chinese Materia Medica,2016,41(13):2422−2427.] ZHAO Y Y, YANG Q R, HAO J B, et al. Research progress on pharmacological effects and their differences among the flowers, stems and leaves of Lonicera japonica[J]. China Journal of Chinese Materia Medica, 2016, 41(13): 2422−2427.
[12] FAN Z L, LI L, BAI X L, et al. Extraction optimization, antioxidant activity, and tyrosinase inhibitory capacity of polyphenols from Lonicera japonica[J]. Food Science & Nutrition,2019,7(5):1786−1794.
[13] GE L, LI J, WAN H, et al. Novel flavonoids from Lonicera japonica flower buds and validation of their anti-hepatoma and hepatoprotective activity in vitro studies[J]. Industrial Crops and Products,2018,125:114−122. doi: 10.1016/j.indcrop.2018.08.073
[14] WANG D, ZHAO X, LIU Y. Hypoglycemic and hypolipidemic effects of a polysaccharide from flower buds of Lonicera japonica in streptozotocin-induced diabetic rats[J]. International Journal of Biological Macromolecules,2017,102:396−404. doi: 10.1016/j.ijbiomac.2017.04.056
[15] LI Y, CAI W, WENG X, et al. Lonicera japonica Flos and Lonicerae Flos:A systematic pharmacology review[J]. Evidence-Based Complementary and Alternative Medicine,2015,12:905063.
[16] RAHMAN A, KANG S C. In vitro control of food-borne and food spoilage bacteria by essential oil and ethanol extracts of Lonicera japonica Thunb.[J]. Food Chemistry,2009,116(3):670−675. doi: 10.1016/j.foodchem.2009.03.014
[17] 马艳妮, 王志尧, 郭展展, 等. 忍冬叶总黄酮的测定及其体外抗菌活性[J]. 中国实验方剂学杂志,2017,23(6):55−59. [MA Y N, WANG Z Y, GUO Z Z, et al. Determination of total flavonoids of Lonicera japonica leaves and their in vitro antibacterial activity[J]. Chinese Journal of Experimental Traditional Medical Formulae,2017,23(6):55−59.] MA Y N, WANG Z Y, GUO Z Z, et al. Determination of total flavonoids of Lonicera japonica leaves and their in vitro antibacterial activity[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(6): 55−59.
[18] 李磊, 谭政委, 余永亮, 等. 金银花种质资源及品种选育研究进展[J]. 安徽农业科学,2022,50(17):1−4. [LI L, TAN Z W, YU Y L, et al. Research progress on germplasm resources and breeding of Lonicera japonica Thunb doi: 10.3969/j.issn.0517-6611.2022.17.001 J]. Journal of Anhui Agricultural Sciences,2022,50(17):1−4. doi: 10.3969/j.issn.0517-6611.2022.17.001
[19] HSU H F, HSIAO P C, KUO T C, et al. Antioxidant and anti-inflammatory activities of Lonicera japonica Thunb. var. sempervillosa Hayata flower bud extracts prepared by water, ethanol and supercritical fluid extraction techniques[J]. Industrial Crops & Products,2016,89:543−549.
[20] KWAW E, MA Y, TCHABO W, et al. Effect of Lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid fermented mulberry juice[J]. Food Chemistry,2018,250:148−154. doi: 10.1016/j.foodchem.2018.01.009
[21] OTEEF M D Y. Comparison of different extraction techniques and conditions for optimizing an HPLC-DAD method for the routine determination of the content of chlorogenic acids in green coffee beans[J]. Separations,2022,9(12):396. doi: 10.3390/separations9120396
[22] YANG Y J, LIN M Y, FENG S Y, et al. Chemical composition, antibacterial activity, and mechanism of action of essential oil from Litsea cubeba against foodborne bacteria[J]. Journal of Food Processing and Preservation,2020,44(9):e14724.
[23] BĄCZEK K B, KOSAKOWSKA O, PRZYBYŁ, J L, et al. Antibacterial and antioxidant activity of essential oils and extracts from costmary (Tanacetum balsamita L.) and tansy (Tanacetum vulgare L.)[J]. Industrial Crops & Products,2017,102:154−163.
[24] LIN L, AGYEMANG K, ABDEL-SAMIE M A S, et al. Antibacterial mechanism of Tetrapleura tetraptera extract against Escherichia coli and Staphylococcus aureus and its application in pork[J]. Journal of Food Safety,2019,39(6):e12693. doi: 10.1111/jfs.12693
[25] CUI H Y, ZHOU H, LIN L. The specific antibacterial effect of the Salvia oil nanoliposomes against Staphylococcus aureus biofilms on milk container[J]. Food Control,2016,61:92−98. doi: 10.1016/j.foodcont.2015.09.034
[26] CHEN M, ZHAO Z, MENG H, et al. The antibiotic activity and mechanisms of sugar beet (Beta vulgaris) molasses polyphenols against selected food-borne pathogens[J]. LWT-Food Science and Technology,2017,82:354−360. doi: 10.1016/j.lwt.2017.04.063
[27] GHADERI L, ALIAHMADI A, EBRAHIMI S N, et al. Effective inhibition and eradication of Pseudomonas aeruginosa biofilms by Satureja khuzistanica essential oil nanoemulsion[J]. Journal of Drug Delivery Science and Technology,2020,61:102260.
[28] 章艳玲. 金银花不同部位化学成分的比较研究[J]. 农学学报,2019,9(1):59−61. [ZHANG Y L. A comparison of chemical constituents in different parts of honeysuckle[J]. Journal of Agriculture,2019,9(1):59−61.] doi: 10.11923/j.issn.2095-4050.cjas18030005 ZHANG Y L. A comparison of chemical constituents in different parts of honeysuckle[J]. Journal of Agriculture, 2019, 9(1): 59−61. doi: 10.11923/j.issn.2095-4050.cjas18030005
[29] 路俊仙, 吕凌, 张才波. 忍冬4个药用部位中11种化学成分的含量测定[J]. 中药材,2019,42(5):1085−1089. [LU J X, LÜ L, ZHANG C B. Determination of 11 chemical constituents in 4 medicinal parts of Lonicera japonica Thunb J]. Journal of Chinese Medicinal Materials,2019,42(5):1085−1089.
[30] 贾海燕, 滕旭东, 王慧, 等. 复方忍冬藤提取物促进骨折愈合及抗炎作用研究[J]. 中国畜牧兽医,2017,44(1):275−281. [JIA H Y, TENG X D, WANG H, et al. Effects of mixed caulis Lonicerae japonicae extracts on fracture healing and anti-inflammation[J]. China Animal Husbandry & Veterinary Medicine,2017,44(1):275−281.] JIA H Y, TENG X D, WANG H, et al. Effects of mixed caulis Lonicerae japonicae extracts on fracture healing and anti-inflammation[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(1): 275−281.
[31] 范帅帅. 忍冬不同部位含量测定和指纹图谱结合化学模式识别的研究[D]. 石家庄:河北中医学院, 2019. [FAN S S. Study on content determination of different parts of Lonicera japonica and fingerprint combined with chemical pattern recognition[D]. Shijiazhuang:Hebei University of Chinese Medicine, 2019.] FAN S S. Study on content determination of different parts of Lonicera japonica and fingerprint combined with chemical pattern recognition[D]. Shijiazhuang: Hebei University of Chinese Medicine, 2019.
[32] YAN L, XIE Y, WANG Y, et al. Variation in contents of active components and antibacterial activity in different parts of Lonicera japonica Thunb.[J]. Asian Biomedicine,2020,14(1):19−26. doi: 10.1515/abm-2020-0004
[33] 任敏, 金振锐, 徐小博, 等. 金银花不同器官提取物抑菌作用研究[J]. 安徽农学通报,2019,29(9):41−42. [REN M, JIN Z R, XU X B, et al. Study on bacteriostasis of extracts from different organs of Lonicera japonica Thunb doi: 10.3969/j.issn.1007-7731.2019.09.014 J]. Anhui Agricultural Science Bulletin,2019,29(9):41−42. doi: 10.3969/j.issn.1007-7731.2019.09.014
[34] NIE R Z, DANG M Z, GE Z Z, et al. Interactions of chlorogenic acid and isochlorogenic acid A with model lipid bilayer membranes:Insights from molecular dynamics simulations[J]. Chemistry and Physics of Lipids,2021,240:105136. doi: 10.1016/j.chemphyslip.2021.105136
[35] CAI R, MIAO M, YUE T, et al. Antibacterial activity and mechanism of cinnamic acid and chlorogenic acid against Alicyclobacillus acidoterrestris vegetative cells in apple juice[J]. International Journal of Food Science & Technology,2019,54(5):1697−1705.
[36] LI J, ZHAO N, XU R, et al. Deciphering the antibacterial activity and mechanism of p-coumaric acid against Alicyclobacillus acidoterrestris and its application in apple juice[J]. International Journal of Food Microbiology,2022,378:109822. doi: 10.1016/j.ijfoodmicro.2022.109822
[37] STEPANOVIĆ S, VUKOVIĆ D, HOLA V, et al. Quantification of biofilm in microtiter plates:Overview of testing conditions and practical recommendations for assessment of biofilm production by Staphylococci[J]. Apmis,2007,115(8):891−899. doi: 10.1111/j.1600-0463.2007.apm_630.x
[38] JUNG J H, CHOI N Y, LEE S Y. Biofilm formation and exopolysaccharide (EPS) production by Cronobacter sakazakii depending on environmental conditions[J]. Food Microbiology,2013,34(1):70−80. doi: 10.1016/j.fm.2012.11.008





 下载:
下载:

 下载:
下载:
