Optimisation of the Extraction Process and Compositional Analysis of Lipase-inhibiting Components from Morus alba L. Leaves
-
摘要: 本文在单因素实验的基础上,结合响应面分析法考察原料质量浓度、乙醇体积分数、超声功率、提取温度和提取时间等因素对桑叶提取物抑制脂肪酶活性的影响,优化桑叶抑制脂肪酶活性组分的超声波辅助提取工艺,并采用超高效液相色谱-四级杆-飞行时间高分辨质谱技术(Ultra-high Performance Liquid Chromatography-Quadrupole-Time of Flight High Resolution Mass Spectrometry,UPLC-Q-TOF HRMS)对桑叶提取物活性成分进行检测分析。结果表明,桑叶抑制脂肪酶活性组分的最佳提取工艺参数为原料质量浓度0.05 g/mL、乙醇体积分数70%、超声功率195 W、提取温度31 ℃、提取时间40 min,在此条件下测得桑叶提取物脂肪酶抑制率为39.68%。共鉴定出了1067种化合物,其中黄酮和酚酸类占比最高,分别含有203和201种化合物,这些化合物可能是桑叶提取物抑制脂肪酶活性的物质基础。本研究优化桑叶超声波辅助提取工艺,针对性地提高桑叶抑制脂肪酶活性组分的提取效率,并分析桑叶抑制脂肪酶活性的主要成分,可为桑叶在改善脂质代谢方面的功能性应用及健康食品研发提供参考。Abstract: In this study, on the basis of single factor experiments, the effects of raw material mass concentration, ethanol volume fraction, ultrasonic power, extraction temperature, and extraction time on the lipase inhibition activity of mulberry leaves extract were investigated in combination with response surface methodology to optimize the ultrasonic-assisted extraction process of the lipase-inhibiting components of mulberry leaves. Meanwhile, the active ingredients of mulberry leaves extract were analyzed by UPLC-Q-TOF HRMS. The results showed that the optimal extraction process parameters for the lipase-inhibiting components of mulberry leaves were as follows: The mass concentration of raw material was 0.05 g/mL, volume fraction of ethanol was 70%, ultrasonic power was 195 W, extraction temperature was 31 ℃ and the extraction time was 40 min. Under these conditions, the lipase inhibition rate of mulberry leaves extract was 39.68%. A total of 1067 compounds were identified. Flavonoids and phenolic acids accounted for the highest proportion, containing 203 and 201 compounds, respectively. These compounds might be the material basis for the lipase inhibiting activity of mulberry leaves extract. In this study, the ultrasonic-assisted extraction process of mulberry leaves was optimized to improve the extraction efficiency of the lipase-inhibiting active components, and the main active ingredients were analyzed. The results may provide a reference for the functional application of mulberry leaves in improving lipid metabolism and the development of health food.
-
Keywords:
- mulberry leaves /
- lipase activity /
- response surface methodology /
- ultrasonic /
- process optimization
-
非酒精性脂肪肝(Non-alcoholic Fatty Liver Disease,NAFLD)是一种以肝脏实质脂肪过度堆积(>5%的肝细胞)为主要特征的代谢疾病,其在全球范围的患病率不断提高,并呈现低龄化趋势[1]。NAFLD发病机制复杂,越来越多证据表明,其对人体的影响不仅限于肝脏,还可能引发多种肝外并发症,如Ⅱ型糖尿病、心血管疾病等,并且会进一步发展成为非酒精性脂肪肝炎或肝细胞癌,严重威胁着公众生命健康[2−3]。寻找有效的代谢酶抑制剂是改善NAFLD的有效方法之一。脂肪酶是胰腺分泌的一种水溶性酶,其可将膳食脂肪(如甘油三酯、胆固醇酯和磷脂)水解为单甘油酯、游离脂肪酸等脂解产物[4]。因此,抑制脂肪酶活性以减少膳食脂肪的消化和吸收,已成为预防和改善NAFLD的研究热点之一[5−6]。奥利司他作为一种已上市销售的脂肪酶抑制剂,可降低高脂饮食引起的肥胖及与肥胖相关疾病的发病率,如高胆固醇血症、NAFLD、高血压等,但服用该药物后会产生诸如腹泻、头痛和疲乏等不良反应[7−8]。因此,需要寻找更安全有效的方法来缓解NAFLD。
植物天然产物来源广泛、结构丰富、活性多样,能多靶点、多机制改善复杂疾病,其中一些还具有药食两用价值,可作为功能性食品来预防和改善各种疾病[9−10]。因此,越来越多的研究开始聚焦于从天然植物中寻找更安全有效的脂肪酶抑制剂以调节脂质代谢、缓解NAFLD[11−12]。桑树在我国的栽培历史悠久,是重要的经济和生态树种。桑叶既是传统中药材,也是国家公布的“既是食品又是药品”资源。传统中医认为桑叶具有祛风清热、益肝明目等功效[13]。现代医药学研究发现,桑叶中富含黄酮、多酚、生物碱、多糖和有机酸等营养活性组分,具有降血糖、降血脂、抗炎、抗动脉粥样硬化和增强免疫力等多种生理活性,特别是在调节糖脂代谢,改善NAFLD等代谢疾病方面具有独特优势[14−17]。目前,桑叶提取物的研究仍主要聚焦于某一类成分,如黄酮、生物碱、多糖等的提取[18−20]。而关于桑叶抑制脂肪酶活性组分的研究还相对匮乏,提取工艺对桑叶抑制脂肪酶活性的影响尚不明确。因此寻找一种能够针对性地提高桑叶抑制脂肪酶活性组分提取效率的工艺,对桑叶功能性食品、药品的研发具有重要意义。
超声波辅助提取是一种绿色高效的提取方法,与传统热回流提取相比,不仅可缩短提取时间,还提高提取效率,能耗成本明显降低[21]。近年来,高效液相色谱与高分辨质谱联用技术在天然产物成分的鉴定方面显现出极大的优势。液质联用技术具有高效、灵敏、快速、用量少、样品处理简单等特点,展现出广泛的应用前景。
本研究以桑叶作为原料,以脂肪酶抑制率作为响应值,考察原料质量浓度、乙醇体积分数、超声功率、提取温度和提取时间等因素对桑叶提取物脂肪酶抑制率的影响。根据单因素实验结果和BoxBehnken设计三因素三水平响应面试验方案,优化桑叶提取工艺,针对性地提高桑叶抑制脂肪酶活性组分的提取效率,并进一步采用UPLC-Q-TOF HRMS分析桑叶提取物抑制脂肪酶活性的物质基础,为桑叶的功能性应用和健康食品研发提供参考。
1. 材料与方法
1.1 材料与仪器
桑叶 伦40品种,广东桑,2023年3月采自广东省农业科学院蚕业与农产品加工研究所自有桑园。新鲜桑叶于60 ℃热风干燥至恒重,粉碎过60目筛,备用;无水乙醇、柠檬酸钠、无水氯化钙 分析纯,天津市大茂化学试剂厂;氯化钠 分析纯,福晨(天津)化学试剂有限公司;盐酸 分析纯,广州化学试剂厂;脂肪酶(100 U/mg) 上海麦克林生化科技股份有限公司;三羟甲基氨基甲烷(Tris)、4-甲基伞形酮油酸酯(纯度≥95%) 广州齐云生物技术有限公司;甲醇、乙腈、甲酸 均为质谱级,Thermo Scientific;实验用水均为超纯水。
DF-101S集热式恒温加热磁力搅拌器 巩义市孝义合众仪器;FE28 pH计 梅特勒-托利多仪器(上海)有限公司;TECAN infinite 200型酶标仪 瑞士TECAN;BS124S型分析天平(精度0.1 mg) 德国赛多利斯科学仪器公司;OSB-2100型旋转蒸发仪 日本东京理化器械株式会社;SB25-12DTD超声仪 宁波新艺生物科技股份有限公司;Triple TOF®5600液质联用仪 美国SCIEX公司。
1.2 实验方法
1.2.1 桑叶提取物制备
精确称取10.0 g桑叶粉,加入70%的乙醇溶液使原料质量浓度为0.04 g/mL,在温度为40 ℃,功率为200 W的条件下超声30 min,过滤,重复上述步骤2次,将滤液合并,减压浓缩后定容至20 mL,即为样品待测液。
1.2.2 单因素实验
在预实验的基础上,以桑叶提取物对脂肪酶抑制活性为考察指标,考察各单因素对脂肪酶抑制效果的影响[22]。采用1.2.1实验方法,对原料质量浓度、乙醇体积分数、超声功率、提取温度和提取时间5个因素进行单因素实验。其中原料质量浓度分别设0.02、0.03、0.04、0.05、0.06 g/mL;乙醇体积分数分别设50%、60%、70%、80%、90%;超声功率分别设100、150、200、250、300 W;提取温度分别设20、30、40、50、60 ℃;提取时间分别设10、20、30、40、50 min。结果均为3次重复实验平均值。
1.2.3 响应面试验设计
综合单因素实验的结果,以原料质量浓度、超声功率和提取温度3个提取条件为自变量,以脂肪酶抑制率为响应值,使用Box-Behnken响应面设计法在三因素三水平上优化提取工艺。试验因素水平见表1。
表 1 响应面试验因素水平设计Table 1. Factors and levels of response surface methodology水平 因素 A:原料质量浓度
(g/mL)B:超声功率
(W)C:提取温度
(℃)−1 0.04 150 20 0 0.05 200 30 1 0.06 250 40 1.2.4 脂肪酶反应体系的建立
参考并优化Zhang等[23]的方法,建立脂肪酶抑制剂活性筛选模型对桑叶提取物进行活性测试。Tris缓冲液由13 mmol/L Tris-HCl、150 mmol/L NaCl和1.3 mmol/L CaCl2配制而成,用盐酸调节pH至8.0。在黑色96孔板中加入25 μL脂肪酶溶液(50 U/mL)和25 μL样品,孵育5 min后加入50 μL 4-甲基伞形酮油酸酯,30 min后加入100 μL 0.1 mol/L柠檬酸钠溶液,在355 nm激发波长和460 nm发射波长下测定荧光强度。样品对照组用Tris缓冲液代替脂肪酶溶液;空白组用纯水代替样品;空白对照组用纯水代替样品、缓冲液代替脂肪酶溶液。脂肪酶抑制率计算公式如下:
脂肪酶抑制率(%)=(1−A样品−A样品对照A空白−A空白对照)×100 式中:A样品为样品组荧光强度;A样品对照为样品对照组荧光强度;A空白为空白组荧光强度;A空白对照为空白对照组荧光强度。
1.2.5 提取物成分分析
参考杨代晓等[24]的方法进行液质联用分析。液相色谱条件:SB-Aq色谱柱(2.1 mm×100 mm,1.8 μm),乙腈(A)-水(0.1%甲酸)(B)为流动相,洗脱梯度为:0~5 min,0%~5%A;5~20 min,5%~15%A;20~30 min,15%~30%A;30~45 min,30%~60%A;45~50 min,60%A;50~60 min,60%~0%A;60~65 min,0%A;进样量3 μL;洗脱流速0.2 mL/min;柱温40 ℃;检测波长280 nm。质谱条件:扫描模式为正离子和负离子电喷雾模式,离子源温度500 ℃,正离子模式下质谱电压5500 V,负离子模式下质谱电压−4500 V,离子源气体GS1为50 psi,GS2为50 psi,质荷比扫描范围为100~1000 m/z。按上述方法测定桑叶乙醇提取物溶液中的化学成分,根据保留时间、准分子离子特点、裂解规律以及对比二级质谱信息,并结合数据库提供的化学成分信息,对样品进行定性分析。
1.3 数据处理
所有实验重复3次取平均值,采用SPSS 21.0软件进行单因素方差和Duncan's多重差异显著分析,显著性水平P<0.05。采用Design Expert 11.0进行响应面试验设计。
2. 结果与分析
2.1 不同提取条件对桑叶提取物脂肪酶抑制活性的影响
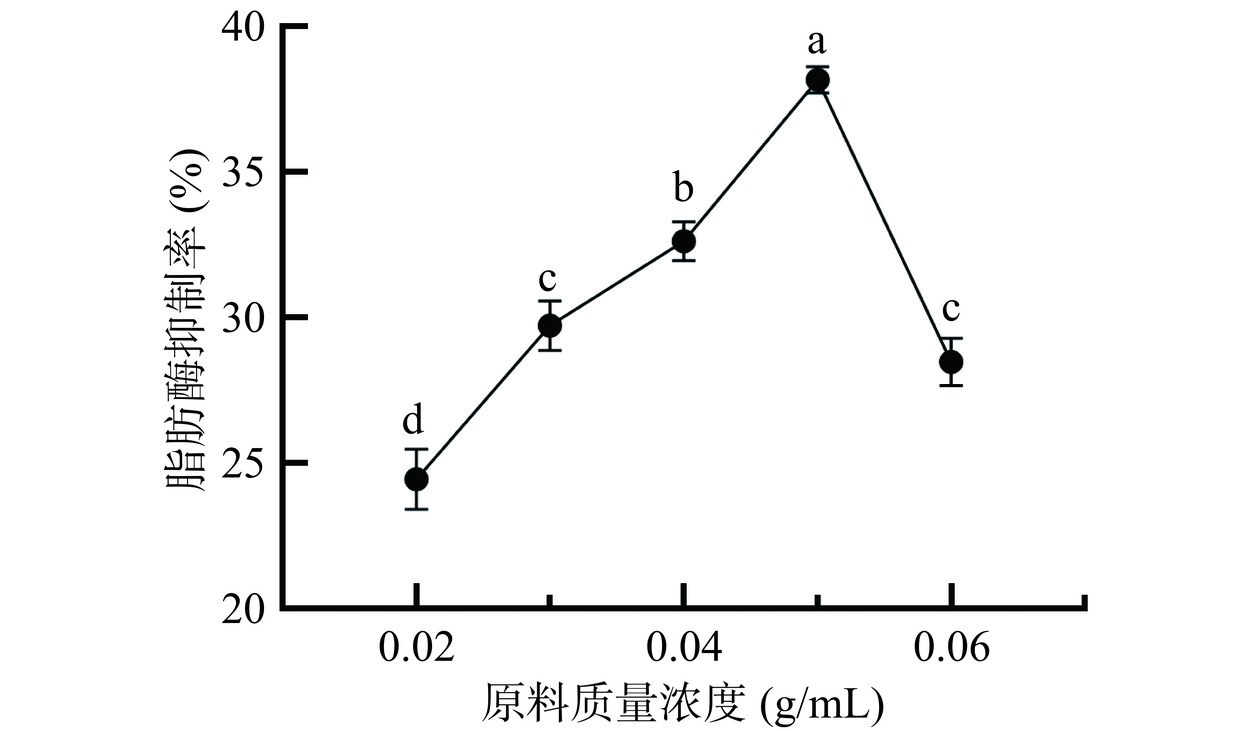
2.1.1 原料质量浓度
由图1可知,随着桑叶原料质量浓度的增加,提取物对脂肪酶的抑制活性呈先升高后降低的趋势。当桑叶原料质量浓度为0.02 g/mL时,提取物对脂肪酶的抑制率最低,究其原因可能是此条件下提取溶剂用量过大,超声波衰弱程度较大,难以作用于所有物料,导致桑叶活性组分提取效果不佳,故而脂肪酶抑制率也相对较低。当桑叶原料质量浓度为0.05 g/mL时,抑制率达到最高,为38.18%。而当原料质量浓度提高到0.06 g/mL时,抑制率下降趋势明显,可能是因为提取体系中桑叶粉浓度过大,提取溶剂对桑叶粉的浸润不够充分,导致桑叶中活性组分释放不够完全,故而抑制率降低[25]。因此,适宜的原料质量浓度为0.05 g/mL。
2.1.2 乙醇体积分数
图2中结果表明,随着乙醇体积分数的增大,桑叶提取物对脂肪酶的抑制率呈现先上升后下降的总体趋势,当乙醇体积分数为70%时,提取物对脂肪酶的抑制率最高,为37.92%。桑叶中含有多酚、黄酮类等化合物,这些物质易溶于乙醇,而有研究报道这些化合物对脂肪酶具有一定的抑制作用[26]。乙醇是一种极性溶剂,可有效溶解多种植物中的活性成分,且其具有较好的渗透性,可迅速渗透植物细胞,与目标物质充分接触从而进行提取。当乙醇体积分数较小时,不利于多酚、黄酮从细胞壁上解吸下来。随着乙醇体积分数增大,多酚、黄酮类化合物溶出量亦增大[27]。而当乙醇体积分数过大时,一些醇溶性杂质的溶出量增多,易造成桑叶组织内部孔隙的堵塞,影响活性组分提取[28]。因此,适宜的乙醇体积分数为70%。
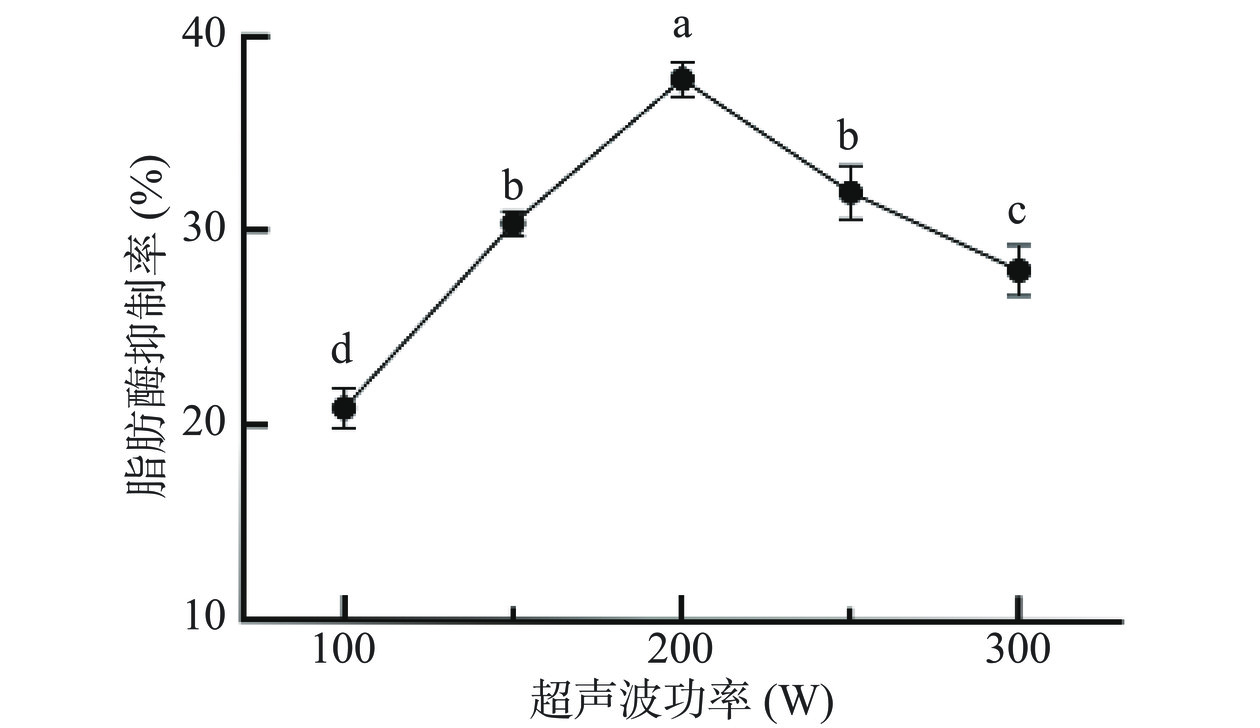
2.1.3 超声波功率
从图3结果可以看出,超声波功率在100~300 W范围内,桑叶提取物对脂肪酶的抑制率随超声波功率的增强先升高后降低。在超声波功率为200 W时,提取物对脂肪酶的抑制率最高,为37.84%。当超声波功率超过200 W时,提取物对脂肪酶的抑制率逐渐降低。使用超声波辅助提取可以加速桑叶细胞壁的破裂,释放出更多胞内活性组分,导致提取物对脂肪酶的抑制率升高;但当超声功率过大时,体系空化作用增强,可能引发桑叶提取物聚集并被局部高温破坏,导致提取物对脂肪酶的抑制率反而有所降低[29]。综上所述,适宜的超声波功率为200 W。
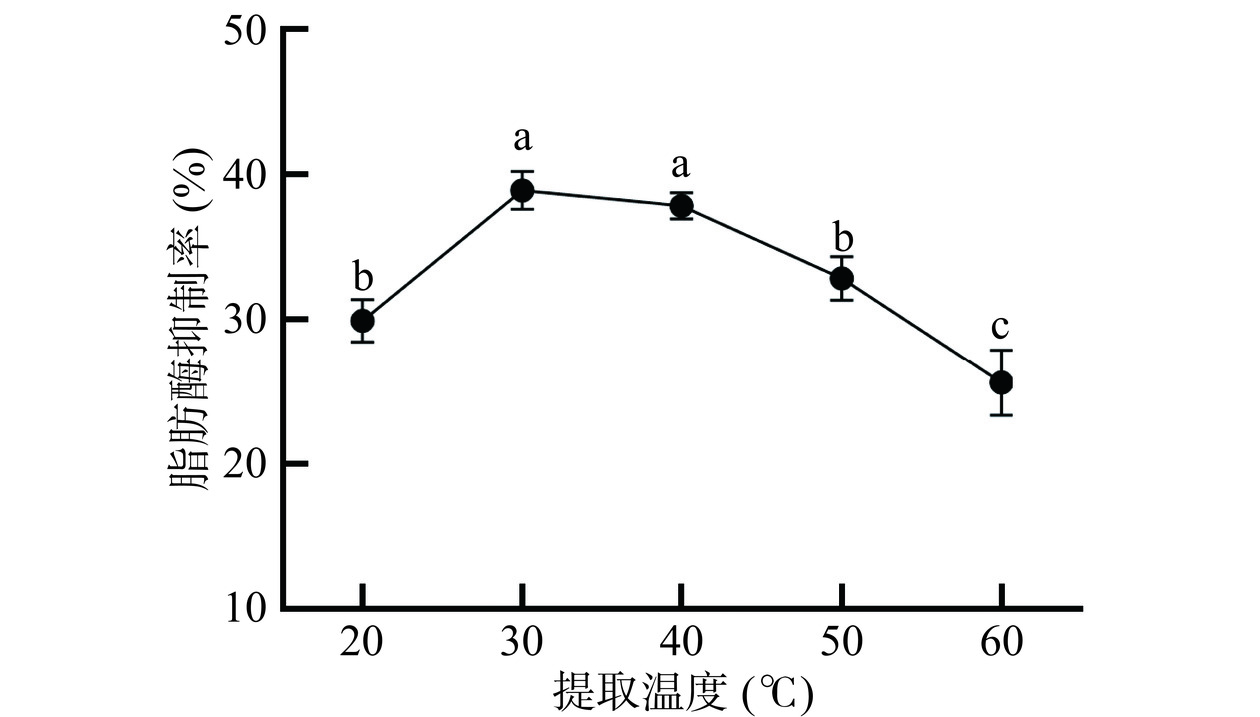
2.1.4 提取温度
由图4可知,桑叶提取物对脂肪酶的抑制率随提取温度的增加先升高后迅速降低,在30 ℃时出现最大值,为38.91%。这可能是由于提取温度升高能增加桑叶细胞的通透性,导致分子扩散运动加快,有利于活性组分从细胞内渗透出来。但是当提取温度超过一定范围后,一方面,更多的化合物从桑叶中渗透出来,其中一些杂质会与活性组分竞争,影响提取物对脂肪酶的抑制率;另一方面,温度升高后,一些活性组分可能因热稳定性不够,发生结构改变而影响其脂肪酶抑制活性。因此,适宜的提取温度为30 ℃。
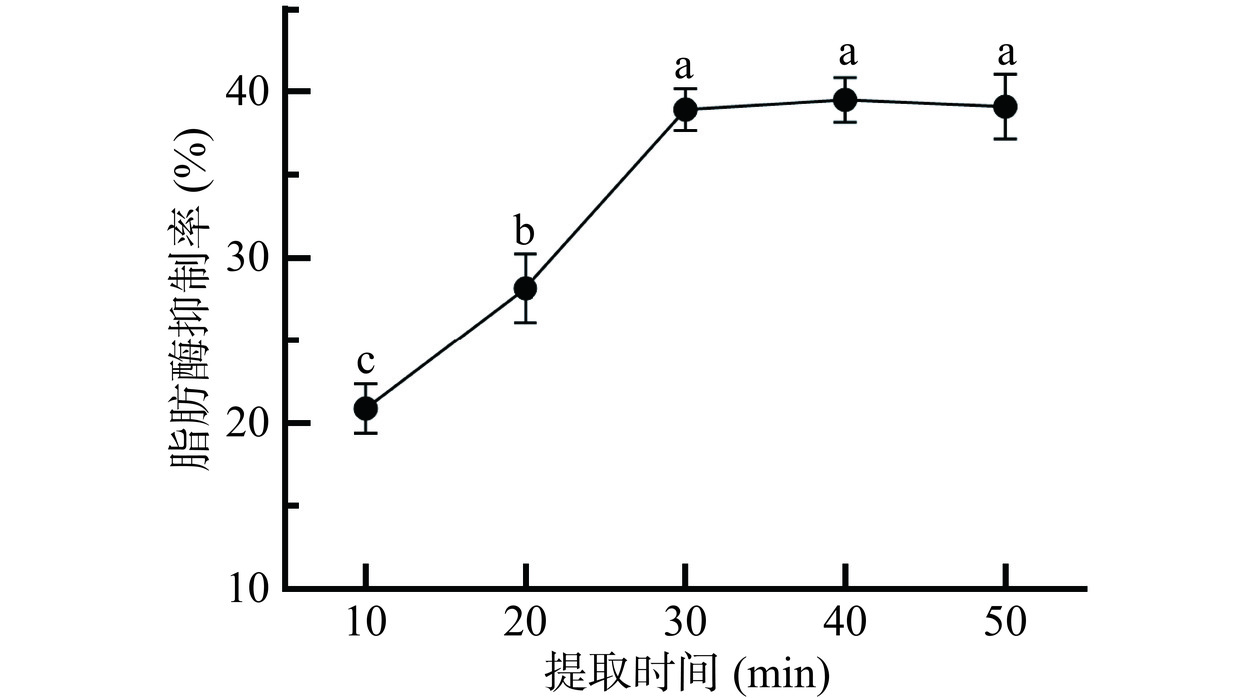
2.1.5 提取时间
从图5可看出,提取时间在10~40 min的区间,桑叶提取物对脂肪酶的抑制率呈上升趋势。当提取时间为40 min时,提取物对脂肪酶的抑制率最高,为39.50%;继续延长提取时间,提取物对脂肪酶抑制率略有下降。这可能是由于超声波处理时间过短不利于桑叶活性组分的充分释放,适当延长超声波处理时间后,能使更多活性组分被提取并扩散到溶剂体系中。桑叶原料经超声波处理40 min后,大部分活性组分已充分溶出,继续延长超声波提取时间对桑叶活性组分的提取效果贡献不大,反而可能溶出更多的杂质,而且超声波提取时间过长还可能会导致活性分子结构受到破坏,进而影响提取物对脂肪酶的抑制活性[30]。因此,适宜的提取时间为40 min。
2.2 响应面试验结果
单因素实验结果证明70%体积分数的乙醇对桑叶提取效果最好,继续增加乙醇体积分数后,提取效果反而变差,考虑到经济成本问题,选择70%作为后续实验的乙醇体积分数。当提取时间为40 min时,桑叶提取物对脂肪酶的抑制率达到峰值,继续延长提取时间对提取效果影响较小,为节约时间成本,选定40 min作为后续实验的固定提取时间。同时选定原料质量浓度0.05 g/mL、超声功率200 W、提取温度30 ℃为响应面Box-Behnken试验的中心点,以脂肪酶抑制率为响应值进行优化,响应面试验设计及结果如表2。
表 2 Box-Behnken 试验设计及响应值Table 2. Design and response value of Box-Behnken experiment试验号 A:原料质量浓度 B:超声功率 C:提取温度 Y:脂肪酶抑制率(%) 1 0 −1 −1 25.43 2 −1 −1 0 18.94 3 1 −1 0 27.03 4 0 −1 1 31.06 5 1 0 −1 28.17 6 0 1 1 22.85 7 −1 0 1 30.42 8 0 1 −1 27.85 9 0 0 0 41.96 10 1 0 1 24.14 11 1 1 0 21.35 12 −1 0 −1 16.39 13 0 0 0 37.92 14 0 0 0 37.65 15 −1 1 0 21.19 16 0 0 0 40.88 17 0 0 0 40.43 2.2.1 回归模型及方差分析
通过Design-Expert 11.0软件对表2中的相关数据进行多元二次回归拟合,得到回归方程为:
Y=39.77+1.72A−1.15B+1.33C−1.98AB−4.52AC−2.66BC−9.83A2−7.81B2−5.16C2。
该回归模型的方差分析结果如表3所示,模型中脂肪酶抑制率与各变量之间回归关系极显著(P<0.0001),失拟项P=0.4253>0.05,不显著,说明模型成立。模型的决定系数R2=0.9745,校正决定系数R2adj=0.9418,模型拟合度较好,置信度较高,可以用此模型来预测桑叶抑制脂肪酶活性组分的提取工艺。
表 3 回归模型的方差分析Table 3. Variance analysis of response surface model来源 平方和 自由度 均方 F值 P值 显著性 模型项 1033.18 9 114.8 29.77 <0.0001 ** A:原料质量浓度 23.63 1 23.63 6.13 0.0425 * B:超声功率 10.63 1 10.63 2.76 0.1409 C:提取温度 14.12 1 14.12 3.66 0.0972 AB 15.72 1 15.72 4.08 0.0833 AC 81.54 1 81.54 21.14 0.0025 ** BC 28.25 1 28.25 7.32 0.0304 * A² 406.78 1 406.78 105.47 <0.0001 ** B² 256.92 1 256.92 66.62 <0.0001 ** C² 112.06 1 112.06 29.06 0.001 ** 残差 27 7 3.86 失拟项 12.62 3 4.21 1.17 0.4253 不显著 误差 14.38 4 3.6 总和 1060.18 16 决定系数R2 0.9745 校正决定系数R2adj 0.9418 注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01。 该回归模型中的一次项A(P<0.05)显著、二次项A2、B2、C2(P<0.01)达极显著水平。由三因素的F值可知,其对抑制率的影响大小依次为A(原料质量浓度)>C(提取温度)>B(超声功率)。模型交互项中AC(P<0.01)和BC(P<0.05)达显著水平,说明原料质量浓度和提取温度、超声功率和提取温度之间交互作用显著。交互项AB的P值大于0.05,说明原料质量浓度和超声功率之间交互作用不显著。
2.2.2 响应面分析
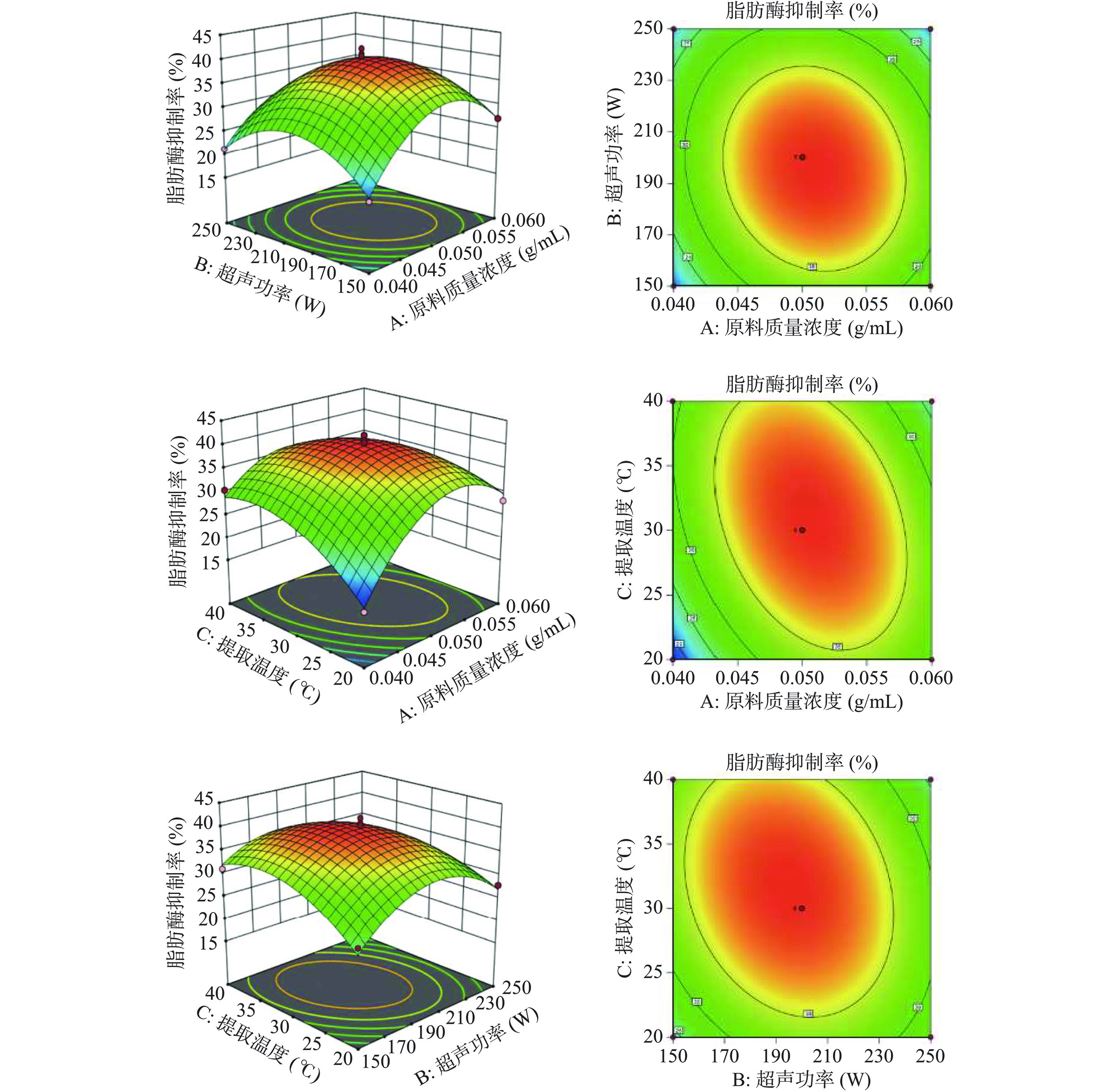
对A、B、C三个因素的交互作用进行分析,通过AB、AC、BC三组响应面图和等高线图,直观表示所选因素对响应值Y(脂肪酶抑制率)的交互影响[31]。响应面坡度越陡峭,表示该因素更容易受到其他因素的影响,对响应值的影响越大,反之越小[32]。两因素交互作用的显著程度可由等高线图来直观反映,若两因素间交互作用显著,则等高线图呈椭圆形,若两因素间交互作用不显著,则等高线图接近圆形[33]。图6为利用Design-Expert 11.0软件做出的响应面图与等高线图,显示三个变量中任取一个变量为0水平时,其余两个变量同时变化对响应值Y(脂肪酶抑制率)的影响。
由图6可知,当反应温度为30 ℃固定不变时,响应面坡度较平缓,等高线全局分部较均匀,等高线图接近圆形,说明A、B之间交互作用对桑叶提取物脂肪酶抑制率的影响不明显;而当超声功率维持200 W不变时,在A小于0.05 g/mL,C小于30 ℃区域,等高线密集分布,等高线图呈明显椭圆形,响应面图坡度陡峭,表明A、C之间交互作用对桑叶提取物脂肪酶抑制率的影响显著;当固定原料质量浓度为0.05 g/mL时,在B小于200 W,C小于30 ℃区域,等高线相对密集,表明B、C之间交互作用对桑叶提取物脂肪酶抑制率的影响显著。以上结果与表3中方差分析结果一致。
2.2.3 验证实验
对响应面试验所获得的多元二次回归模型进行分析,其结果显示,桑叶抑制脂肪酶活性组分提取最佳工艺为:原料质量浓度0.051 g/mL,超声功率194.82 W,提取温度31.26 ℃,在此工艺下,桑叶提取物脂肪酶抑制率的预测值为39.97%。为了验证响应面结果的准确性,采用上述提取工艺进行实验。为方便实际操作,将工艺参数进行微调:原料质量浓度0.05 g/mL,超声功率195 W,提取温度31 ℃,测定提取物的脂肪酶抑制率,重复三次,实际测得脂肪酶抑制率为39.68%±0.49%,与理论预测值接近,实验结果与模型契合度较好,表明此响应面法所获得的桑叶抑制脂肪酶活性组分提取工艺准确可靠。
2.3 桑叶抑制脂肪酶活性提取物组分分析
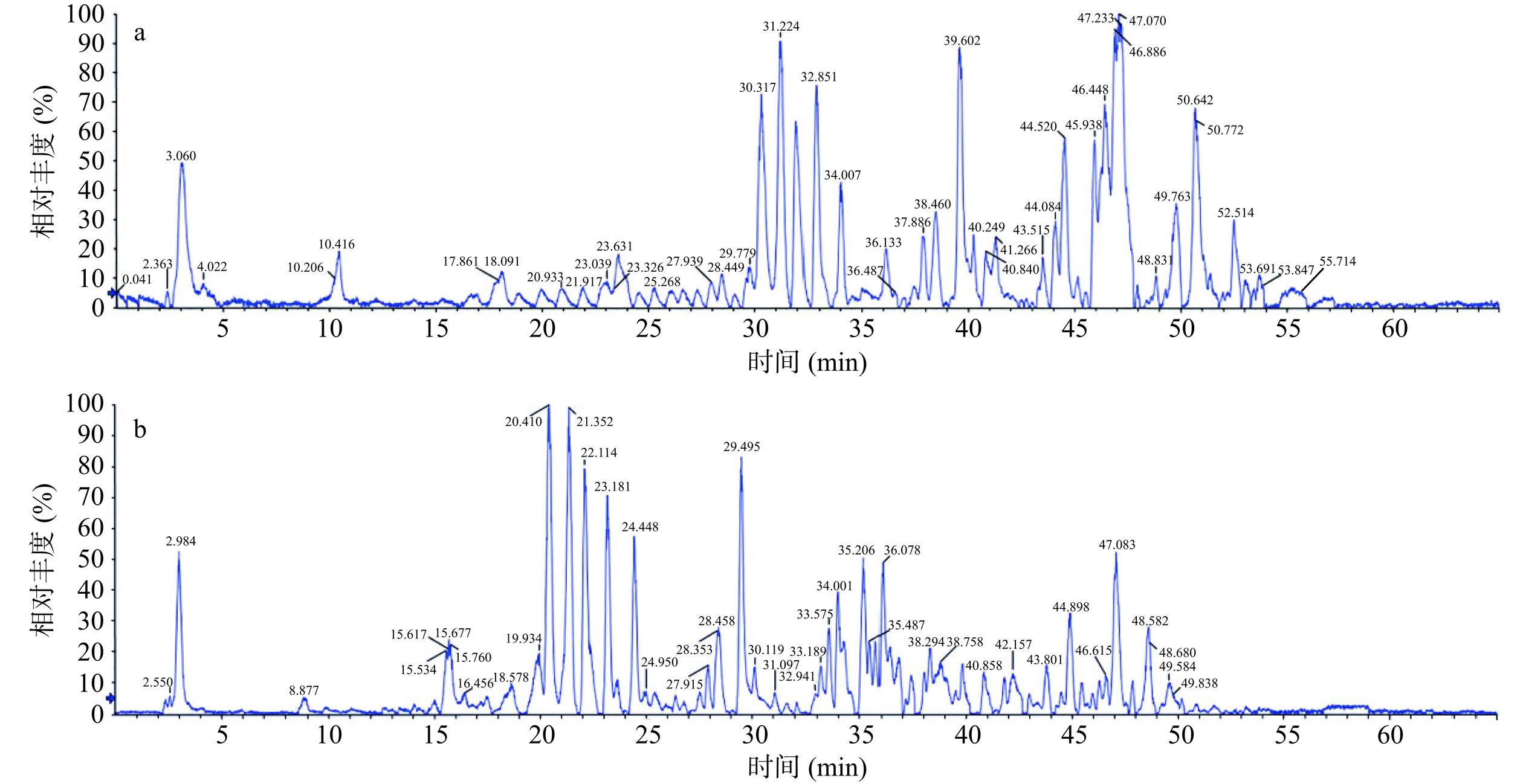
利用UPLC-Q-TOF HRMS技术,分别在正、负离子模式下分析桑叶抑制脂肪酶活性提取物组分,得到总离子流图如图7所示。利用软件对原始数据进行处理,通过与专业数据库的一级和二级质谱数据比对,共鉴定出1067种化合物。对所有组分进行分类,结果如表4所示。桑叶抑制脂肪酶活性提取物中黄酮类和酚酸类化合物的数量占比最高,总数多达404种。据文献报道,很多黄酮类、酚酸类化合物都具有良好地改善脂质代谢的能力[34−36]。进一步对鉴定结果进行分析,发现相对丰度高于20%的黄酮和酚酸类化合物主要有金丝桃苷、2',3',4',5,7-五羟基黄酮、矢车菊素-3-O-葡萄糖苷、山奈酚、绿原酸、飞燕草素-3-O-(6'-O-α-鼠李吡喃糖基-β-吡喃葡糖苷)、异槲皮素和紫云英苷等(表5)。有研究表明金丝桃苷、矢车菊素-3-O-葡萄糖苷、山奈酚、绿原酸和异槲皮素等具有抑制脂肪酶活性、改善肥胖的能力[37−42],其可能是桑叶抑制脂肪酶活性的重要物质基础。
表 4 桑叶抑制脂肪酶活性提取物主要组分类别Table 4. Categories of compounds in lipase inhibiting activity extract from mulberry leaves类别 黄酮类 酚酸类 氨基酸及其衍生物 生物碱 有机酸 脂质 萜类 核苷酸及其衍生物 其他 数量 203 201 165 149 87 85 61 51 65 表 5 桑叶抑制脂肪酶活性提取物中主要黄酮和酚酸类化合物Table 5. Major flavonoids and phenolic acids in lipase inhibiting activity extract from mulberry leaves序号 化合物 保留时间
(min)母离子
(m/z)特征碎片离子
(m/z)分子量 分子式 离子模式 1 金丝桃苷 30.32 465.10 [M+H]+ 303.05 464.09736 C21H20O12 正离子 2 2',3',4',5,7-五羟基黄酮 31.22 303.05 [M+H]+ 257.05,229.05,153.02 302.04447 C15H10O7 正离子 3 矢车菊素-3-O-葡萄糖苷 31.93 449.10 [M+H]+ 287.06 448.10261 C21H20O11 正离子 4 山奈酚 32.85 287.06 [M+H]+ 153.02 286.04982 C15H10O6 正离子 5 绿原酸 15.68 399.09 [M+FA-H]− 191.03 354.09321 C16H18O9 负离子 6 飞燕草素-3-O-(6'-O-α-吡喃鼠李糖基-β-吡喃葡萄糖苷) 20.41 609.15 [M-H]− 301.03 610.15509 C27H30O16 负离子 7 异槲皮素 21.35 463.09 [M-H]− 301.03,271.02,243.03 464.09574 C21H20O12 负离子 8 紫云英苷 23.18 447.09 [M-H]− 285.04,255.03,227.03 448.10046 C21H20O11 负离子 3. 结论
本研究在单因素实验的基础上,以脂肪酶抑制率为响应值,对桑叶抑制脂肪酶活性组分提取工艺进行优化,建立了响应值和各个因素之间的数学模型,并利用UPLC-Q-TOF HRMS技术分析了桑叶提取物的主要活性组分。结果表明,所建模型能较好地预测桑叶提取物对脂肪酶的抑制率,得到桑叶抑制脂肪酶活性组分提取最佳工艺:原料质量浓度0.05 g/mL;超声功率195 W;提取温度31 ℃。在此条件下,实际测得桑叶提取物脂肪酶抑制率为39.68%±0.49%。优化后的工艺参数具有可行性,提高了桑叶抑制脂肪酶活性组分的提取效率。利用UPLC-Q-TOF HRMS共分析鉴定出桑叶提取物中1067种化合物,黄酮和酚酸类化合物最为丰富,其中金丝桃苷、2',3',4',5,7-五羟基黄酮、矢车菊素-3-O-葡萄糖苷、山奈酚、绿原酸、飞燕草素-3-O-(6'-O-α-鼠李吡喃糖基-β-吡喃葡糖苷)、异槲皮素和紫云英苷等化合物含量较高,这些化合物可能是桑叶抑制脂肪酶活性的重要物质基础。研究结果可为桑叶活性组分的提取提供新的视角,提高桑叶等药食资源的整体利用率,为桑叶的功能性应用和健康食品研发提供一定的数据参考。本研究对桑叶提取物抑制脂肪酶活性成分还缺乏深入研究,后续将进一步明确桑叶抑制脂肪酶活性的物质基础和作用机制。
-
表 1 响应面试验因素水平设计
Table 1 Factors and levels of response surface methodology
水平 因素 A:原料质量浓度
(g/mL)B:超声功率
(W)C:提取温度
(℃)−1 0.04 150 20 0 0.05 200 30 1 0.06 250 40 表 2 Box-Behnken 试验设计及响应值
Table 2 Design and response value of Box-Behnken experiment
试验号 A:原料质量浓度 B:超声功率 C:提取温度 Y:脂肪酶抑制率(%) 1 0 −1 −1 25.43 2 −1 −1 0 18.94 3 1 −1 0 27.03 4 0 −1 1 31.06 5 1 0 −1 28.17 6 0 1 1 22.85 7 −1 0 1 30.42 8 0 1 −1 27.85 9 0 0 0 41.96 10 1 0 1 24.14 11 1 1 0 21.35 12 −1 0 −1 16.39 13 0 0 0 37.92 14 0 0 0 37.65 15 −1 1 0 21.19 16 0 0 0 40.88 17 0 0 0 40.43 表 3 回归模型的方差分析
Table 3 Variance analysis of response surface model
来源 平方和 自由度 均方 F值 P值 显著性 模型项 1033.18 9 114.8 29.77 <0.0001 ** A:原料质量浓度 23.63 1 23.63 6.13 0.0425 * B:超声功率 10.63 1 10.63 2.76 0.1409 C:提取温度 14.12 1 14.12 3.66 0.0972 AB 15.72 1 15.72 4.08 0.0833 AC 81.54 1 81.54 21.14 0.0025 ** BC 28.25 1 28.25 7.32 0.0304 * A² 406.78 1 406.78 105.47 <0.0001 ** B² 256.92 1 256.92 66.62 <0.0001 ** C² 112.06 1 112.06 29.06 0.001 ** 残差 27 7 3.86 失拟项 12.62 3 4.21 1.17 0.4253 不显著 误差 14.38 4 3.6 总和 1060.18 16 决定系数R2 0.9745 校正决定系数R2adj 0.9418 注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01。 表 4 桑叶抑制脂肪酶活性提取物主要组分类别
Table 4 Categories of compounds in lipase inhibiting activity extract from mulberry leaves
类别 黄酮类 酚酸类 氨基酸及其衍生物 生物碱 有机酸 脂质 萜类 核苷酸及其衍生物 其他 数量 203 201 165 149 87 85 61 51 65 表 5 桑叶抑制脂肪酶活性提取物中主要黄酮和酚酸类化合物
Table 5 Major flavonoids and phenolic acids in lipase inhibiting activity extract from mulberry leaves
序号 化合物 保留时间
(min)母离子
(m/z)特征碎片离子
(m/z)分子量 分子式 离子模式 1 金丝桃苷 30.32 465.10 [M+H]+ 303.05 464.09736 C21H20O12 正离子 2 2',3',4',5,7-五羟基黄酮 31.22 303.05 [M+H]+ 257.05,229.05,153.02 302.04447 C15H10O7 正离子 3 矢车菊素-3-O-葡萄糖苷 31.93 449.10 [M+H]+ 287.06 448.10261 C21H20O11 正离子 4 山奈酚 32.85 287.06 [M+H]+ 153.02 286.04982 C15H10O6 正离子 5 绿原酸 15.68 399.09 [M+FA-H]− 191.03 354.09321 C16H18O9 负离子 6 飞燕草素-3-O-(6'-O-α-吡喃鼠李糖基-β-吡喃葡萄糖苷) 20.41 609.15 [M-H]− 301.03 610.15509 C27H30O16 负离子 7 异槲皮素 21.35 463.09 [M-H]− 301.03,271.02,243.03 464.09574 C21H20O12 负离子 8 紫云英苷 23.18 447.09 [M-H]− 285.04,255.03,227.03 448.10046 C21H20O11 负离子 -
[1] YOUNOSSI Z M, KOENIG A B, ABDELATIF D, et al. Global epidemiology of nonalcoholic fatty liver disease-meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology,2016,64(1):73−84. doi: 10.1002/hep.28431
[2] TARGHER G, BYRNE C D, TILG H. NAFLD and increased risk of cardiovascular disease:Clinical associations, pathophysiological mechanisms and pharmacological implications[J]. Gut,2020,69(9):1691−705. doi: 10.1136/gutjnl-2020-320622
[3] DING L, OLIGSCHLAEGER Y, SHIRI-SVERDLOV R, et al. Nonalcoholic fatty liver disease[J]. Handb Exp Pharmacol,2022,270:233−69.
[4] LIM S Y, STEINER J M, CRIDGE H. Lipases:It's not just pancreatic lipase![J]. Am J Vet Res,2022,83(8):80−92.
[5] LI X, LI R, WANG X, et al. Effects and mechanism of action of chrysanthemum morifolium (Jinsi Huangju) on hyperlipidemia and non-alcoholic fatty liver disease[J]. Eur J Med Chem,2023,255:115391−115403. doi: 10.1016/j.ejmech.2023.115391
[6] KIM J, KIM C S, JO K, et al. POCU1b, the n-butanol soluble fraction of polygoni cuspidati rhizoma et radix, attenuates obesity, non-alcoholic fatty liver, and insulin resistance via inhibitions of pancreatic lipase, cAMP-dependent PDE activity, AMPK activation, and SOCS-3 suppression[J]. Nutrients,2020,12(12):3612−3624. doi: 10.3390/nu12123612
[7] LIU T T, LIU X T, CHEN Q X, et al. Lipase inhibitors for obesity:A review[J]. Biomed Pharmacother,2020,128:110314−110323. doi: 10.1016/j.biopha.2020.110314
[8] ALI KHAN R, KAPUR P, JAIN A, et al. Effect of orlistat on periostin, adiponectin, inflammatory markers and ultrasound grades of fatty liver in obese NAFLD patients[J]. Ther Clin Risk Manag,2017,13:139−49. doi: 10.2147/TCRM.S124621
[9] ATANASOV A G, WALTENBERGER B, PFERSCHY-WENZIG E M, et al. Discovery and resupply of pharmacologically active plant-derived natural products:A review[J]. Biotechnol Adv,2015,33(8):1582−1614. doi: 10.1016/j.biotechadv.2015.08.001
[10] THOMFORD N E, SENTHEBANE D A, ROWE A, et al. Natural products for drug discovery in the 21st century:Innovations for novel drug discovery[J]. Int J Mol Sci,2018,19(6):1578−1596. doi: 10.3390/ijms19061578
[11] AL ZARZOUR R H, AHMAD M, ASMAWI M Z, et al. Phyllanthus niruri standardized extract alleviates the progression of non-alcoholic fatty liver disease and decreases atherosclerotic risk in sprague-dawley rats[J]. Nutrients,2017,9(7):766−779. doi: 10.3390/nu9070766
[12] RAJAN L, PALANISWAMY D, MOHANKUMAR S K. Targeting obesity with plant-derived pancreatic lipase inhibitors:A comprehensive review[J]. Pharmacol Res,2020,155:104681−104699. doi: 10.1016/j.phrs.2020.104681
[13] 朱林, 唐荷, 安仁波, 等. 桑叶中主要活性成分、药理作用及其提取工艺的研究进展[J]. 吉林医药学院学报,2023,44(2):144−146. [ZHU Lin, TANG He, AN Renbo, et al. Research progress on the main active ingredients, pharmacological effects, and extraction process of mulberry leaves[J]. Journal of Jilin Medical University,2023,44(2):144−146.] ZHU Lin, TANG He, AN Renbo, et al. Research progress on the main active ingredients, pharmacological effects, and extraction process of mulberry leaves[J]. Journal of Jilin Medical University, 2023, 44(2): 144−146.
[14] LI J S, JI T, SU S L, et al. Mulberry leaves ameliorate diabetes via regulating metabolic profiling and AGEs/RAGE and p38 MAPK/NF-κB pathway[J]. J Ethnopharmacol,2022,283:114713−114724. doi: 10.1016/j.jep.2021.114713
[15] KIM S Y, GAO J J, LEE W C, et al. Antioxidative flavonoids from the leaves of Morus alba[J]. Arch Pharm Res,1999,22(1):81−85. doi: 10.1007/BF02976442
[16] HE L, XING Y, REN X, et al. Mulberry leaf extract improves metabolic syndrome by alleviating lipid accumulation in vitro and in vivo[J]. Molecules,2022,27(16):5111−5131. doi: 10.3390/molecules27165111
[17] ANN J Y, EO H, LIM Y. Mulberry leaves (Morus alba L.) ameliorate obesity-induced hepatic lipogenesis, fibrosis, and oxidative stress in high-fat diet-fed mice[J]. Genes Nutr,2015,10(6):46. doi: 10.1007/s12263-015-0495-x
[18] 张华, 孟博, 王莉, 等. 桑叶多糖超声-微波协同提取工艺优化及其抗氧化活性[J]. 中成药,2020,42(8):1972−1977. [ZHANG Hua, MENG Bo, WANG Li, el al. Ultrasonic-microwave synergistic extraction process optimization and anti-oxidant activity for polysaccharides from Mori folium[J]. Chinese Traditional Patent Medicine,2020,42(8):1972−1977.] doi: 10.3969/j.issn.1001-1528.2020.08.002 ZHANG Hua, MENG Bo, WANG Li, el al. Ultrasonic-microwave synergistic extraction process optimization and anti-oxidant activity for polysaccharides from Mori folium[J]. Chinese Traditional Patent Medicine, 2020, 42(8): 1972−1977. doi: 10.3969/j.issn.1001-1528.2020.08.002
[19] 祁伟亮, 阮梅, 冯鸿, 等. 桑叶多酚提取工艺优化及品种筛选[J]. 生物化工,2018,4(2):53−54,60. [QI Weiliang, RUAN Mei, FENG Hong, et al. Optimization of mulberry leaf polyphenol extraction process and variety selection[J]. Biological Chemical Engineering,2018,4(2):53−54,60.] doi: 10.3969/j.issn.2096-0387.2018.02.014 QI Weiliang, RUAN Mei, FENG Hong, et al. Optimization of mulberry leaf polyphenol extraction process and variety selection[J]. Biological Chemical Engineering, 2018, 4(2): 53−54,60. doi: 10.3969/j.issn.2096-0387.2018.02.014
[20] 吴雅茹, 陈贵茹, 雷建都, 等. 桑叶蛋白超声提取联合超滤纯化工艺优化及其营养评价[J]. 食品工业科技,2023,44(16):236−245. [WU Yaru, CHEN Guiru, LEI Jiandu, et al. Optimization of ultrasonic extraction combined with ultrafiltration for purification of mulberry leaf protein and its nutritional evaluation[J]. Science and Technology of Food Industry,2023,44(16):236−245.] WU Yaru, CHEN Guiru, LEI Jiandu, et al. Optimization of ultrasonic extraction combined with ultrafiltration for purification of mulberry leaf protein and its nutritional evaluation[J]. Science and Technology of Food Industry, 2023, 44(16): 236−245.
[21] LI J, CHEN Z, SHI H, et al. Ultrasound-assisted extraction and properties of polysaccharide from Ginkgo biloba leaves[J]. Ultrason Sonochem,2023,93:106295. doi: 10.1016/j.ultsonch.2023.106295
[22] ZHANG L, ZHENG J, MA M, et al. Drug-guided screening for pancreatic lipase inhibitors in functional foods[J]. Food Funct,2021,12(10):4644−4653. doi: 10.1039/D0FO03366A
[23] 萨日那. 山丹花鳞茎醇提物对小鼠脂肪酶的抑制作用研究[D]. 锦州:锦州医科大学, 2021. [SA Rina. Study on the inhibitory effect of alcohol extract from Shandan flower bulb on mouse lipase[D]. Jinzhou:Jinzhou Medical University, 2021.] SA Rina. Study on the inhibitory effect of alcohol extract from Shandan flower bulb on mouse lipase[D]. Jinzhou: Jinzhou Medical University, 2021.
[24] 杨代晓, 陈晓静, 胡秋菊, 等. 液相色谱—质谱联用法分析葡萄籽提取物中的5种多酚类成分[J]. 药物分析杂志,2016,36(8):1330−1337. [YANG Daixiao, CHEN Xiaojing, HU Qiuju, et al. LC-MS method for determination of 5 kinds of polyphenols in grape seed extract[J]. Chinese Journal of Pharmaceutical Analysis,2016,36(8):1330−1337.] YANG Daixiao, CHEN Xiaojing, HU Qiuju, et al. LC-MS method for determination of 5 kinds of polyphenols in grape seed extract[J]. Chinese Journal of Pharmaceutical Analysis, 2016, 36(8): 1330−1337.
[25] 王博, 姚伦广, 鲁云风. 山楂皮渣中果胶超声波辅助提取工艺优化与抗氧化性研究[J]. 粮油食品科技,2023,31(4):78−86. [WANG Bo, YAO Lunguang, LU Yunfeng. Ultrasonic-assisted extraction process optimization and antioxidant activity of pectin from hawthorn peel dregs[J]. Science and Technology of Cereals, Oils and Foods,2023,31(4):78−86.] WANG Bo, YAO Lunguang, LU Yunfeng. Ultrasonic-assisted extraction process optimization and antioxidant activity of pectin from hawthorn peel dregs[J]. Science and Technology of Cereals, Oils and Foods, 2023, 31(4): 78−86.
[26] BIALECKA-FLORJANCZYK E, FABISZEWSKA A U, KRZYCZKOWSKA J, et al. Synthetic and natural lipase inhibitors[J]. Mini Rev Med Chem,2018,18(8):672−83. doi: 10.2174/1389557516666160630123356
[27] 汪建红. 减压内部沸腾法提取荸荠皮黄酮的工艺优化[J]. 食品工业科技,2019,40(23):172−176. [WANG Jianhong. Optimization of extraction technology of flavonoids from elecharis tuberosa peel by decompression internal ebullition[J]. Science and Technology of Food Industry,2019,40(23):172−176.] WANG Jianhong. Optimization of extraction technology of flavonoids from elecharis tuberosa peel by decompression internal ebullition[J]. Science and Technology of Food Industry, 2019, 40(23): 172−176.
[28] 汪建红. 双水相辅助内部沸腾法提取桂花叶黄酮[J]. 食品研究与开发,2022,43(4):22−28. [WANG Jianhong. Extraction of flavonoids from osmanthus fragrans leaves by dual aqueous phase assisted internal boiling method[J]. Food Research and Development,2022,43(4):22−28.] doi: 10.12161/j.issn.1005-6521.2022.04.004 WANG Jianhong. Extraction of flavonoids from osmanthus fragrans leaves by dual aqueous phase assisted internal boiling method[J]. Food Research and Development, 2022, 43(4): 22−28. doi: 10.12161/j.issn.1005-6521.2022.04.004
[29] 田筱璇, 冼丽清, 李佳媛, 等. 波罗蜜籽果胶提取工艺优化及抗氧化活性研究[J]. 食品科技,2023,48(7):191−197. [TIAN Xiaoxuan, XIAN Liqing, LI Jiayuan, et al. Optimization of extraction technology and antioxidant activity of pectin from jackfruit seed[J]. Food Science and Technology,2023,48(7):191−197.] TIAN Xiaoxuan, XIAN Liqing, LI Jiayuan, et al. Optimization of extraction technology and antioxidant activity of pectin from jackfruit seed[J]. Food Science and Technology, 2023, 48(7): 191−197.
[30] 汪建红. 减压内部沸腾法提取血橙皮中黄酮[J]. 中国食品添加剂,2019,30(8):41−47. [WANG Jianhong. Extraction of flavonoids from blood orange peel by decompression internal boiling method[J]. China Food Additives,2019,30(8):41−47.] doi: 10.3969/j.issn.1006-2513.2019.08.001 WANG Jianhong. Extraction of flavonoids from blood orange peel by decompression internal boiling method[J]. China Food Additives, 2019, 30(8): 41−47. doi: 10.3969/j.issn.1006-2513.2019.08.001
[31] 黄琳翔, 施乐乐, 蔡志, 等. 黑木耳中抑制胰脂肪酶活性物质的提取工艺及体外抑制效果[J]. 菌物学报,2020,39(2):441−451. [HUANG Linxiang, SHI Lele, CAI Zhiying, et al. Extraction technology and inhibitory effects in vitro of substances inhibiting pancreatic lipase activities from fruiting body of auricaria heimuer[J]. Mycosystema,2020,39(2):441−451.] HUANG Linxiang, SHI Lele, CAI Zhiying, et al. Extraction technology and inhibitory effects in vitro of substances inhibiting pancreatic lipase activities from fruiting body of auricaria heimuer[J]. Mycosystema, 2020, 39(2): 441−451.
[32] 李利华. 鱼腥草多酚的超声波辅助提取及抗氧化性能研究[J]. 食品工业科技,2016,37(8):295−298,312. [LI Lihua. Ultrasonic assisted extraction and antioxidant properties of polyphenols from Houttuynia cordata[J]. Science and Technology of Food Industry,2016,37(8):295−298,312.] LI Lihua. Ultrasonic assisted extraction and antioxidant properties of polyphenols from Houttuynia cordata[J]. Science and Technology of Food Industry, 2016, 37(8): 295−298,312.
[33] 田强, 吴子健, 黄道荣, 等, 葡萄籽中胰脂肪酶抑制物提取工艺[J]. 食品研究与开发, 2010, 31(4):41-44. [TIAN Qiang, WU Zijian, HUANG Daorong, et al. Optimizing conditions for the isolation of pancreatic lipase inhibitive substance from grape seeds[J]. Food Research and Development, 2010, 31(4):41-44.] TIAN Qiang, WU Zijian, HUANG Daorong, et al. Optimizing conditions for the isolation of pancreatic lipase inhibitive substance from grape seeds[J]. Food Research and Development, 2010, 31(4): 41-44.
[34] ASSINI J M, MULVIHILL E E, HUFF M W. Citrus flavonoids and lipid metabolism[J]. Curr Opin Lipidol,2013,24(1):34−40. doi: 10.1097/MOL.0b013e32835c07fd
[35] RODRÍGUEZ-PÉREZ C, SEGURA-CARRETERO A, DEL MAR CONTRERAS M. Phenolic compounds as natural and multifunctional anti-obesity agents:A review[J]. Crit Rev Food Sci Nutr,2019,59(8):1212−1229. doi: 10.1080/10408398.2017.1399859
[36] BUCHHOLZ T, MELZIG M F. Polyphenolic compounds as pancreatic lipase inhibitors[J]. Planta Med,2015,81(10):771−783. doi: 10.1055/s-0035-1546173
[37] ZHANG X, LI D, WANG K, et al. Hyperoside inhibits pancreatic lipase activity in vitro and reduces fat accumulation in vivo[J]. Food Funct,2023,14(10):4763−4776. doi: 10.1039/D2FO03219H
[38] WANG Y, CHEN L, LIU H, et al. Characterization of the synergistic inhibitory effect of cyanidin-3-O-glucoside and catechin on pancreatic lipase[J]. Food Chem, 2023, 404(Pt B):134672−80.
[39] 王婵. 荷叶中具有脂肪酶抑制活性成分的分离与鉴定[D]. 上海:上海中医药大学, 2020. [WANG Chan. Separation and identification of lipase inhibiting activity components in Nelumbinis folium[D]. Shanghai:Shanghai University of Traditional Chinese Medicine, 2020.] WANG Chan. Separation and identification of lipase inhibiting activity components in Nelumbinis folium[D]. Shanghai: Shanghai University of Traditional Chinese Medicine, 2020.
[40] CHEN J, WU X, ZHOU Y, et al. Camellia nitidissima Chi leaf as pancreatic lipase inhibitors:Inhibition potentials and mechanism[J]. J Food Biochem,2021,45(9):e13837−50.
[41] 郭盼. 绿原酸和EGCG对胰脂肪酶的抑制作用及减脂产品研发[D]. 南昌:南昌大学, 2023. [GUO Pan. The inhibition mechanism of chlorogenic acid and EGCG on pancreatic lipase and development of fat reduction product[D]. Nanchang:Nanchang University, 2023.] GUO Pan. The inhibition mechanism of chlorogenic acid and EGCG on pancreatic lipase and development of fat reduction product[D]. Nanchang: Nanchang University, 2023.
[42] 杨鹏, 李艳琴. 荞麦黄酮和荞麦糖醇对胰脂肪酶的抑制作用[J]. 食品科学,2015,36(11):60−63. [YANG Peng, LI Yanqin. Inhibitory effect of flavonoids and fagopyritols from buckwheat on pancreatic lipase[J]. Food Science,2015,36(11):60−63.] doi: 10.7506/spkx1002-6630-201511012 YANG Peng, LI Yanqin. Inhibitory effect of flavonoids and fagopyritols from buckwheat on pancreatic lipase[J]. Food Science, 2015, 36(11): 60−63. doi: 10.7506/spkx1002-6630-201511012





 下载:
下载:

 下载:
下载:



