Stability of Differently Modified Lutein Nanostructured Lipid Carriers During Colonic Digestion and Their Interaction with Feces Microbiota
-
摘要: 目的:在构建叶黄素脂质体(Lutein nanostructured lipid carriers,LNLs)的基础上,利用壳聚糖(chitosan,CS)、壳聚糖-表没食子儿茶素没食子酸酯共价(Chitosan epigallocatechin gallate covalent,C-CS-EGCG)/非共价复合物(Chitosan epigallocatechin gallate ester non covalent,Non-C-CS-EGCG),结合高压微射流技术,制备不同修饰类型的叶黄素纳米脂质体。方法:通过建立模拟结肠消化模型,探明三种不同修饰类型叶黄素纳米脂质体在结肠消化过程中的稳定性以及与肠道菌群相互作用关系。结果表明:经24 h模拟体外结肠发酵后,CS-LNLs中叶黄素含量较其他处理组显著(P<0.05)降低;除叶黄素(Lutein,LUT)以及CS-LNLs外,其他处理组发酵后发酵液中总糖含量均显著下降(P<0.05),C-CS-EGCG-LNLs和Non-C-CS-EGCG-LNLs中总多酚含量变化呈现相反趋势;经24 h发酵后,除LUT组外,各处理组中乙酸和丙酸的产生量均显著增加(P<0.05),C-CS-EGCG-LNLs组乙酸浓度达到17.18±0.60 mmol/L;乳酸浓度达到2.87±0.05 mmol/L,显著(P<0.05)高于空白组(Blank Control Group,BLK)7.55倍;三种不同修饰类型叶黄素纳米脂质体对肠道菌群结构均产生显著影响,其中,CS-LNLs、C-CS-EGCG-LNLs和Non-C-CS-EGCG-LNLs中拟杆菌属、小杆菌属以及粪杆菌属相对丰度显著增加(P<0.05),而C-CS-EGCG-LNLs中富集了较多的韦永氏球菌属(Veillonella)。结论:在结肠消化阶段,与其他修饰组纳米脂质体相比,C-CS-EGCG-LNLs具有显著的肠道微生物结构差异性。Abstract: To prepare different types of lutein nanostructured lipid carriers (LNLs) using chitosan (CS), chitosan-epigallocatechin gallate covalent (C-CS-EGCG), and chitosan-epigallocatechin gallate ester non-covalent (Non-C-CS-EGCG) modifications combined with high-pressure microfluidization. A simulated colonic digestion model was established to investigate the stability and interaction with gut microbiota of these modified lutein nanostructured lipid carriers. Results showed that after 24 hours of simulated in vitro colonic fermentation, the lutein content in CS-LNLs significantly decreased (P<0.05) compared to other treatment groups. Except for lutein and CS-LNLs, the total sugar content in the fermentation supernatant significantly decreased (P<0.05) in other treatment groups, while the total polyphenol content in C-CS-EGCG-LNLs and Non-C-CS-EGCG-LNLs showed an opposite trend. After 24 hours of fermentation, the production of acetic acid and propionic acid significantly increased (P<0.05) in all treatment groups except the LUT group, with the acetic acid concentration reaching 17.18±0.60 mmol/L in the C-CS-EGCG-LNLs group. The lactic acid concentration reached 2.87±0.05 mmol/L, significantly higher (P<0.05) than the blank control group (BLK) by 7.55 times. The three different types of modified lutein nanostructured lipid carriers had a significant impact on the gut microbiota structure. The relative abundance of Bacteroides, Bifidobacterium, and Faecalibacterium significantly increased (P<0.05) in CS-LNLs, C-CS-EGCG-LNLs, and Non-C-CS-EGCG-LNLs, while C-CS-EGCG-LNLs enriched more Veillonella. Conclusion: Compared to other modification groups, C-CS-EGCG-LNLs had significant intestinal microbial structural differentiation in the colon digestive phase of nanoliposomes.
-
Keywords:
- lutein /
- nanoliposomes /
- covalent modification /
- colonic digestion /
- intestinal microbiota
-
叶黄素是一种疏水性类胡萝卜素[1],广泛存在于蔬菜中,尤其是菠菜和羽衣甘蓝等深绿色绿叶蔬菜,具有较强的生物活性[2−3]。叶黄素可以吸收蓝紫光,防止视网膜损伤,具有较强的护眼功能[4];可以还原氧和自由基,抑制ROS活性,增强机体免疫力[5];叶黄素能通过防止脂蛋白中脂质的氧化减少巨噬细胞对氧化脂质的摄取,预防心血管疾病[6]。此外,多项研究表明,叶黄素还具有预防癌症、保护神经等多种生理功能[7]。但是,人体无法自我合成叶黄素,只能从饮食中获取。且叶黄素含有多不饱和双键,结构极不稳定,易发生异构化、氧化和降解,严重限制了叶黄素的生物利用[8]。
纳米载体可以穿过肠道屏障,提高营养素体内稳定性。构建纳米载体已成为提高叶黄素等疏水性营养素生物利用度的关键手段[9]。与单一叶黄素胶束相比,叶黄素纳米脂质载体(Lutein nanostructured lipid carriers,LNLs)具有更高的稳定性、分散性和渗透率,释放速率更加缓慢,包封效率更高[10]。同时,为了改善脂质体体系在生产以及应用中存在的聚集、絮凝等问题,利用一些生物大分子如多糖、蛋白质对脂质体表面进行修饰逐渐成为相关研究领域的热点[11]。常见的修饰类型主要有多糖、多酚以及多糖-多酚复合物,多糖和多酚具有一些共同的生物活性,包括抗炎、抗糖尿病、抗氧化和抗心血管疾病[12]。近年来,多糖-多酚相互作用后的产物因其在整个食品系统的功能和健康益处方面的重要性而受到越来越多的关注[13]。前期以叶黄素、大豆卵磷脂为原料,以脱氧胆酸钠为表面活性剂,结合高压微射流技术制备LNLs,并通过在LNLs表面修饰壳聚糖(Chitosan,CS)、壳聚糖-表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)共价/非共价复合物,构建了三种不同修饰类型的LNLs。其中,壳聚糖-表没食子儿茶素没食子酸酯共价修饰型叶黄素纳米脂质体(C-CS-EGCG-LNLs)表现出较好的稳定性和生物可及性,体外模拟胃肠消化显示小肠消化阶段C-CS-EGCG-LNLs生物可给率显著增加至33%[14]。但仍有大量未被胃肠消化的LNLs进入结肠。
结肠中栖居着大量微生物,它们与纳米脂质体可以相互作用,增加营养素的利用并改善肠道微生物的多样性和丰富度。如通过体内外丁香酚纳米颗粒与大肠杆菌共培养发现,与单一丁香酚组相比,丁香酚纳米脂质体抑菌效果更加显著[15];酪蛋白纳米颗粒饲喂高脂诱导的小鼠,其干预效果更加明显,可以增加有益菌的相对丰度,降低有害菌的相对丰度,对肥胖具有明显的预防作用[16];Xu等[17]通过DSS诱导结肠炎实验发现,与叶黄素组相比,叶黄素纳米颗粒组可以显著增加Rikenellaceae和Erysipelotrichaceae等的相对丰度改善肠道菌群从而有效缓解结肠炎症。但关于多糖-多酚共价/非共价修饰型脂质体的制备以及对于该修饰类型脂质体在结肠消化阶段的研究鲜见报道。因此,本实验在前期工作基础上继续探究基于三种不同修饰类型的叶黄素纳米脂质体在模拟结肠消化过程中叶黄素、短链脂肪酸(short-chain fatty acid,SCFAs)以及总糖、总多酚含量的变化。并结合IlluminaMiSeq高通量测序技术以及生物信息学手段,探明三种不同修饰类型叶黄素纳米脂质体在模拟结肠消化过程中与粪便菌群相互作用关系。
1. 材料与方法
1.1 材料与仪器
叶黄素(纯度≥80%)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、猪胆盐、胰脂肪酶(250 U/mg)、胃蛋白酶(3000 U/mg) 上海源叶生物科技有限公司;大豆卵磷脂(磷脂酰胆碱纯度>90%)、脱氧胆酸钠、壳聚糖(chitosan,CS) 上海阿拉丁生化科技股份有限公司;甲醇(色谱级)、甲基叔丁基醚(methyl tert-butyl ether, MTBE)(色谱级) Tedia公司;二水合磷酸二氢钠、十二水合磷酸氢二钠、过氧化氢(30%)、L-抗坏血酸 南京化学试剂股份有限公司;发酵液DNA提取试剂盒QiAamp Fast DNA Stool Mini Kit 德国Qiagen公司;盐酸、氢氧化钠、正己烷、丙酮、甲苯 均为分析纯,购自国药集团化学试剂有限公司;MGC AnaeroPack®-Anaero厌氧盒、产气包、氧气指示剂 日本三菱(Mitsubishi)公司。
Agilent1260高效液相色谱仪、6890N气相色谱系统 美国安捷伦科技有限公司;LM20微射流纳米均质机 美国微射流均质机有限公司;85-2A数显测速恒温磁力搅拌器 常州金坛华伟仪器厂;BS-224-S电子分析天平 北京赛多利斯科学仪器公司;SHZ-D(Ⅲ)循环水式真空泵 上海东玺制冷仪器设备有限公司;D10氮气吹扫仪 杭州奥盛仪器有限公司;TG16-WS台式高速离心机 湖南湘仪离心机仪器有限公司;BHC-1300IIA/B2超净工作台 苏州净化设备有限公司;HZQ-F100全温度振荡培养箱 太仓市华美生化仪器厂;IMJ-78P全自动高压蒸汽灭菌锅 上海施都凯仪器设备有限公司。
1.2 实验方法
1.2.1 叶黄素纳米脂质体制备
采用薄膜分散法制备LNLs[18],称取适量叶黄素、大豆卵磷脂和脱氧胆酸钠溶解于165 mL氯仿/甲醇(v/v,2:1)混合有机溶剂中,将该溶液旋转蒸发至形成均匀薄膜,放置过夜;随后加入220 mL pH7.4 磷酸盐缓冲液,于37 ℃超声水合5 h,得黄色混悬液;利用均质机在11000 Pa条件下均质10 min,再经过高压微射流(20000 psi,循环4次),最终得到LNLs。
1.2.2 CS-EGCG复合物制备
1.2.2.1 CS-EGCG共价复合物制备
参考文献[19−20]使用自由基诱导法进行制备,即称取1 g壳聚糖加入100 mL的1%冰醋酸溶液,后加入1 mL H2O2(5 mmol/L)和0.25 g L-抗坏血酸于常温条件下反应2 h,再加入0.35 mmol/L EGCG反应24 h得到淡黄色C-CS-EGCG。
CS-EGCG非共价复合物制备:CS-EGCG非共价复合物(Non-C-CS-EGCG)的制备过程除不加入H2O2与抗坏血酸氧化还原对外,其余步骤均与上述方法相同,最终得到紫色Non-C-CS-EGCG。
1.2.2.2 CS、CS-EGCG复合修饰型叶黄素纳米脂质体的制备
分别取50 mL的CS、C-CS-EGCG和Non-C-CS-EGCG溶液与50 mL LNLs,并按照CS/C-CS-EGCG/Non-C-CS-EGCG:LNLs(1:1,v/v),分别将LNLs溶液逐滴滴入到CS、C-CS-EGCG以及Non-C-CS-EGCG分散液中,并搅拌均匀后室温静置1 h让体系稳定,最后置于4 ℃冰箱中以备后续实验使用。
1.2.2.3 体外模拟结肠发酵
体外模拟结肠发酵根据参考文献[21−22]的方法并略作修改。基础培养基配制:将10 g葡萄糖、2 g蛋白胨、2 g酵母提取物、0.5 g L-半胱氨酸盐酸盐、0.5 g猪胆盐、2 g NaHCO3、0.02 g 氯化血红素、0.1 g NaCl、0.04 g K2HPO4、0.01 g MgSO4、0.01 g CaCl2、0.04 g KH2PO4、1 mg刃天青、2 mL吐温80和10 μL维生素K1溶于1000 mL蒸馏水中,调节pH为7.0,高压蒸汽灭菌后待用。
粪便菌群来源:体外厌氧发酵中所需粪便样本由六名健康志愿者提供,志愿者无肠道疾病且生活习惯良好[23]。将粪便样品与改性生理盐水(含有0.5 g/L L-半胱氨酸盐酸盐,9.0 g/L NaCl)涡旋混匀,得到10%(w/v)粪便悬液,合并所有志愿者的粪便悬液待用。
将粪便悬浮液按1:9(v/v)加至灭菌的基础培养基中,分别设置单一叶黄素组(LUT)、叶黄素纳米脂质体组(LNLs)、CS修饰型叶黄素纳米脂质体组(CS-LNLs)、CS-EGCG共价修饰型叶黄素纳米脂质体组(C-CS-EGCG-LNLs)和非共价修饰型叶黄素纳米脂质体组(Non-C-CS-EGCG-LNLs),并将不同修饰类型叶黄素纳米脂质体加入到含有粪便悬液的基础培养基中并进行充分混合,随后将各处理组样品置于厌氧盒中模拟厌氧培养。在厌氧发酵过程中,分别在0、6、12和24 h取样用于进一步分析。以ORI(Original Group)表示0 h组。
1.2.3 叶黄素含量测定
取1 mL不同时间发酵液置于避光条件下,加入1 mL三氯甲烷:甲醇(2:1,v/v)混合提取液,涡旋混匀1 min后加入2 mL正己烷,在4 ℃、3000 r/min条件下离心5 min,取上清液。重复2次,合并上清液,N2吹干,1 mL甲醇复溶,过0.45 μm有机膜后待HPLC分析。
叶黄素高效液相色谱条件根据文献[24]做出修改。检验色谱柱为YMC-C30(4.6 mm×250 mm,5 μm)色谱柱;柱温:25 ℃;二极管阵列检测器,波长450 nm;流动相:A:水:MTBE:甲醇(5:25:70,v/v/v);B:水:MTBE:甲醇(5:85:10,v/v/v);进样量:20 μL;线性梯度洗脱,流速:0.6 mL/min;梯度洗脱程序:0~4.5 min,95%→80% A;4.5~12.5 min,80%→50% A;12.5~18 min,50%→25% A;18~24 min,25%→5% A;24~30 min,5%→95% A。
1.2.4 总糖、总酚含量测定
采用苯酚-硫酸法测定总多糖含量[25]。根据所绘制葡萄糖-总糖标准曲线(y=0.0777x−0.0056,R2=0.9991)测定样液中总多糖的含量。
总糖含量(mg/gd.w.)=m1×V1×N×10−3m2×V2×(1−ω) 式中:m1—从标准曲线上查得样品测定液中的含量,μg;m2—样品质量,g;V1—样品定容体积,mL;V2—比色测定时所移取样品测定液的体积,mL;N—稀释倍数;ω—样品含水率,%。
采用Folin-Denis法测定总多酚含量[26]。根据所绘制没食子酸标准曲线(y=0.0578x−0.0101,R2=0.999)测定样液中总多酚的含量。
总酚含量(mgGAE/gd.w.)=m1×V1×N×10−3m2×V2×(1−ω) 式中:m1—从标准曲线上查得样品测定液中的含量,μg;m2—样品质量,g;V1—样品定容体积,mL;V2—比色测定时所移取样品测定液的体积,mL;N—稀释倍数;ω—样品含水率,%。
1.2.5 SCFAs测定
SCFAs含量的测定参考文献[27]的方法并略作修改,乳酸采用商用试剂盒检测。取1 mL发酵液、5 mL生理盐水在12000 r/min下离心5 min并移取上清液,将上清液和标准品溶液与等体积的2-乙基丁酸(内标,25 mmol/L)混合,过0.22 μm有机膜待测。毛细血管柱为HP-Innowax柱(30 m×0.25 mm×0.25 μm),N2作为载气,流速为19.0 mL/min,空气、H2和N2补充气体的流速分别为260、30和30 mL/min。柱温程序:初始柱温在100 ℃维持1 min,然后以5 ℃/min的速度升至180 ℃,并保持4 min。
1.2.6 肠道菌群测序分析
对样本中粪便微生物总RNA用QiAamp Fast DNA Stool Mini Kit试剂盒进行提取,并扩增16S rRNA基因的V3~V4区,扩增引物为Primer F:ACTCCTACGGGAGGCAGCA和Primer R:GGACTACHVGGGTWTCTAAT,测序由上海派森诺生物科技有限公司在Illumina MiSeq平台上进行。首先进行去引物,质量过滤,去噪等步骤,对高通量测序的原始数据根据序列质量进行初步筛查,对问题样本进行重测、补测;接着通过质量初筛的原始序列按照index和Barcode信息,进行文库和样本划分,并去除barcode序列,并按照QIIME2 dada2分析流程或Vsearch软件的分析流程进行序列去噪或OUT聚类,最后对各样本(组)在不同物种分类学水平的具体组成进行展示,了解整体概况。样品稀释曲线和α多样性(包括Chao1,Pielou-e和Simpson指数)利用QIIME2软件进行计算。β多样性基于Bray-Curtis距离非加权进行,聚类分析、PCA和PCoA分析根据R软件的Vegan包进行分析。
1.3 数据处理
所有实验重复不少于3次,实验结果以平均值±标准差(SD)表示。用SPSS 20软件(IBM)进行统计学分析,使用Duncan进行多重比较,使用Origin 2018作图。P<0.05说明该结果有显著性差异。
2. 结果与分析
2.1 不同修饰类型叶黄素纳米脂质体对结肠发酵阶段叶黄素含量变化的影响
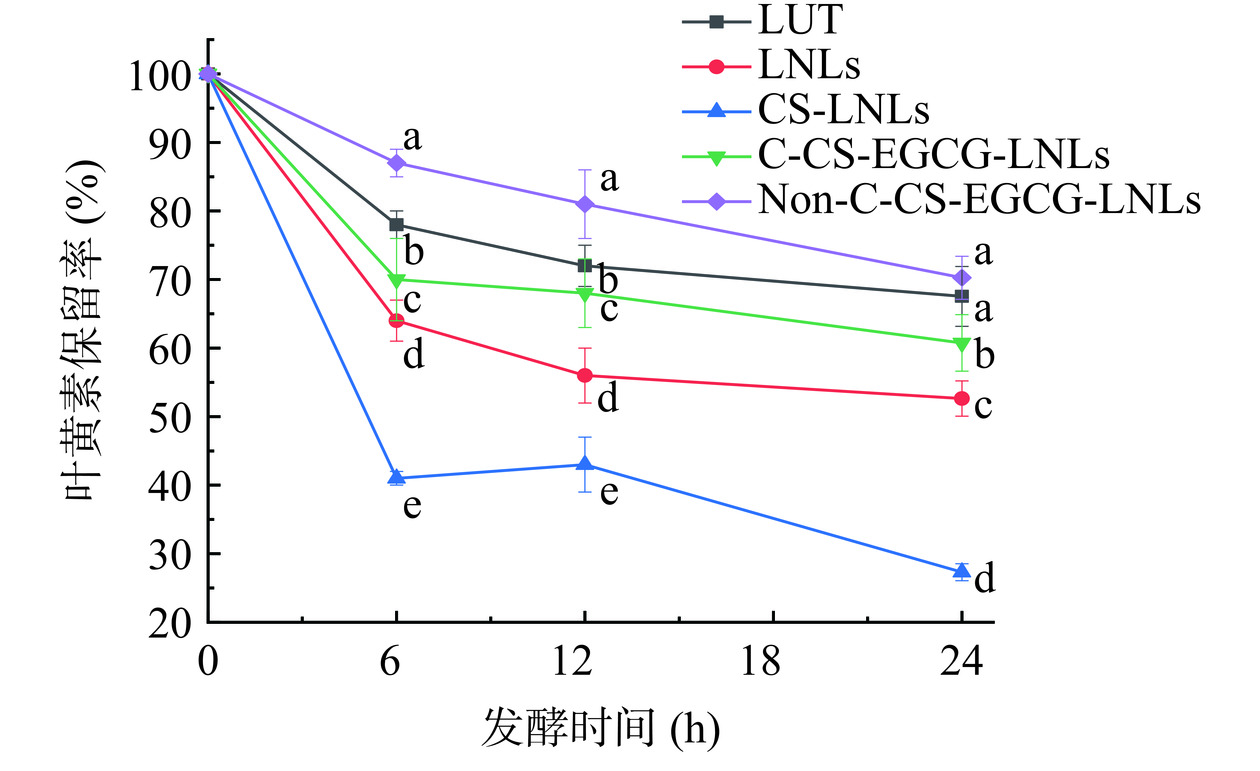
经肠道菌群厌氧发酵24 h后,LUT、LNLs、CS-LNLs、C-CS-EGCG-LNLs和Non-C-CS-EGCG-LNLs处理组中叶黄素保留率如图1所示。其中,CS-LNLs、C-CS-EGCG-LNLs组经24 h体外发酵后,叶黄素保留率较LUT组显著降低(P<0.05)。这可能是由于壳聚糖更容易被肠道中某种菌群利用,从而促进叶黄素的释放,进一步使叶黄素与肠道菌群相互作用。Mrázek等[28]曾报道,通过胶囊补充壳聚糖会显著影响每个受试者的粪便微生物群丰度,并且添加壳聚糖组粪便中拟杆菌的含量高于对照组,说明拟杆菌对壳聚糖充分利用。Chen等[29]以羧甲基壳聚糖为对象,探究其经过体外结肠发酵后肠道菌群丰度变化,研究发现随着壳聚糖含量降低,有益菌群相对丰度增加,这证明肠道中的有益菌群可以有效利用壳聚糖。
2.2 不同修饰类型叶黄素纳米脂质体对总糖、总酚含量变化的影响
研究表明,肠道微生物可以产生相应的碳水化合物酶,破坏糖苷键,然后逐渐利用所产生的寡糖,导致发酵液中总糖含量降低[30−31]。如表1所示,经过模拟结肠消化24 h后,发酵液中总糖含量除LUT以及CS-LNLs外,均显著下降(P<0.05),其中,与LUT相比,LNLs发酵24 h时较发酵6 h时降低1.33倍,这可能是因为LNLs具有更好的释放性能,改变了粪菌结构,促进了粪菌对多糖的利用;发酵24 h后,C-CS-EGCG-LNLs组总糖含量为4.43±0.34 mg/mL,较发酵6 h时降低1.33倍。
表 1 发酵液中总糖、总酚含量Table 1. Contents of total polysaccharide and total polyphenol in fermentation样品 发酵时间(h) 总糖含量(mg/mL) 总酚含量(mg/mL) BLK 6 4.51±0.17c 7.22±0.03a 12 3.98±0.19d 7.61±0.63a 24 4.31±0.24b 7.59±0.07a LUT 6 3.90±0.14e 6.78±0.14c 12 3.55±0.14e 6.97±0.03bc 24 4.83±0.13a 7.31±0.09b LNLs 6 4.19±0.08de 6.99±0.13b 12 3.68±0.13e 6.95±0.13bcd 24 2.81±0.11c 6.96±0.14c CS-LNLs 6 4.42±0.33cd 6.20±0.10e 12 6.23±0.27a 6.64±0.12cd 24 4.87±0.03a 7.04±0.12c C-CS-EGCG-
LNLs6 5.89±0.04b 6.97±0.12b 12 4.52±0.02c 7.30±0.10ab 24 4.43±0.34b 6.58±0.14d Non-C-CS-
EGCG-LNLs6 6.94±0.21a 6.49±0.06d 12 5.36±0.03b 6.49±0.07d 24 4.28±0.26b 6.71±0.17d 注:同列肩标字母表示不同发酵时间下,不同修饰类型叶黄素纳米脂质体总糖、总酚含量具有显著性差异(P<0.05)。 同时,经过模拟结肠消化24 h后,C-CS-EGCG-LNLs和Non-C-CS-EGCG-LNLs中总多酚含量变化呈现相反趋势。其中,C-CS-EGCG-LNLs中总多酚含量在24 h内结肠消化过程中呈现先上升后下降的趋势,Non-C-CS-EGCG-LNLs中总多酚含量在结肠消化6~24 h后并无显著差异(P>0.05),而在发酵24 h后,总酚含量稍有增加但变化并不显著,这可能与结肠消化过程中会持续产生酚类物质有关。根据Zhang等[32]报道,游离酚类物质在发酵5 h内已完成代谢,而大多数以结合形式存在的酚类物质自结肠消化12 h会在粪菌的作用下开始连续而缓慢的释放。
2.3 不同修饰类型叶黄素纳米脂质体对SCFAs含量变化的影响
如表2所示,各处理组中SCFAs主要为乙酸、丙酸和乳酸,三种不同修饰类型叶黄素纳米脂质体经24 h体外发酵后,除LUT组外,各处理组中乙酸和丙酸的产生量均显著增加(P<0.05),且在三种不同修饰类型叶黄素纳米脂质体中,C-CS-EGCG-LNLs经24 h体外发酵后产生的乙酸量高于CS-LNLs和Non-C-CS-EGCG-LNLs。且发酵24h后,三种修饰型叶黄素纳米脂质体处理组乳酸的产生量均低于LUT组但显著高于BLK组(P<0.05),并且,发酵24 h后,C-CS-EGCG-LNLs组乳酸浓度达到2.87±0.05 mmol/L,显著高于BLK组7.55倍(P<0.05)。SCFAs的增加可能与CS和EGCG与肠道菌群相互作用有关。有研究发现肠道微生物可将多糖转化为SCFAs等有益代谢产物[33],且随着EGCG浓度升高,SCFAs含量也在增加[34]。
表 2 厌氧发酵体系不同处理组不同时间SCFAs生成量Table 2. Concentrations of SCFAs in different treatments during the anaerobic fermentation system样品 乙酸(mmol/L) 丙酸(mmol/L) 乳酸(mmol/L) 6 h 12 h 24 h 6 h 12 h 24 h 6 h 12 h 24 h BLK 8.37±0.21a 11.19±1.04ab 16.88±0.58a 0.60±0.01b 1.26±0.12a 1.43±0.05b 7.69±0.35a 11.34±0.53a 0.38±0.43a LUT 8.00±0.16a 11.22±1.16ab 8.27±0.22c 0.54±0.01c 1.11±0.18a 0.82±0.16c 7.04±0.29b 10.86±0.53a 10.56±0.56a LNLs 7.93±0.07a 12.34±0.02a 17.24±0.26a 0.53±0.03c 1.28±0.01a 1.33±0.01b 7.78±0.48a 11.09±0.38a 9.87±0.66a CS-LNLs 7.57±0.71a 11.13±0.24ab 12.26±0.31b 0 0.72±0.01b 1.41±0.03b 1.32±0.13c 1.61±0.11c 7.61±0.32b C-CS-EGCG-LNLs 5.35±0.17c 6.32±0.41c 17.18±0.60a 0 0 1.30±0.05b 0.13±0.06d 0.18±0.06d 2.87±0.05d Non-C-CS-EGCG-LNLs 6.17±0.91b 9.99±1.13b 12.52±0.36b 0 0 1.46±0.24b 0.53±0.07d 2.24±0.28b 5.02±0.19c 注:同列肩标字母表示相同发酵时间下,不同修饰类型叶黄素纳米脂质体对SCFAs含量具有显著性差异(P<0.05)。 2.4 不同修饰类型叶黄素纳米脂质体对肠道菌群的影响
2.4.1 菌群Alpha多样性分析
Alpha多样性常用Chao1表征物种丰富度,以Simpson表征物种多样性,以Pielou-e表征均匀度[35]。不同修饰类型叶黄素纳米脂质体对肠道菌群Alpha多样性如表3所示。结果显示,修饰后的叶黄素纳米脂质体Shannon指数和Pielou-e较未修饰对照组显著提高(P<0.05),表明不同修饰类型叶黄素纳米脂质体可以显著提高肠道微生物的丰富度和多样性。
表 3 不同处理组肠道菌群的α多样性Table 3. Alpha-diversity of gut microbiota in different treatments组别 α多样性指数 Chao1 Simpson Pielou-e ORI 375.02±73.50a 0.97±0.01a 0.77±0.02a BLK 124.57±27.73c 0.86±0.01d 0.57±0.00b LUT 123.03±17.09c 0.86±0.00d 0.57±0.00 b LNLs 97.88±20.85c 0.86±0.01d 0.58±0.00 b CS-LNLs 220.25±15.11b 0.91±0.01c 0.67±0.02 c C-CS-EGCG-LNLs 231.59±71.70b 0.93±0.01b 0.67±0.00 c Non-C-CS-EGCG-LNLs 253.85±35.18b 0.92±0.01bc 0.68±0.02 c 注:同列肩标字母表示不同修饰类型叶黄素纳米脂质体肠道菌群的α多样性具有显著差异(P<0.05)。 2.4.2 菌群Beta多样性分析
通过高通量测序,本文中7个组(21个样本)共获得1353971个Clean reads,平均测序两为64475个Clean reads。共鉴定到784个OTUs,7个处理组共有36个共同的OTUs,各个组特有的 OTUs 数分别为:BLK组24个,ORI组237个,LUT组38个,LNLs组38个,CS-LNLs组80个,C-CS-EGCG-LNLs组229个,Non-C-CS-EGCG-LNLs组102个。
采用Beta多样性分析物种复杂性。结果如图2所示,样品聚类结果表明,三种不同修饰类型的叶黄素纳米脂质体的三个平行均聚在同一个分支上,说明体外实验重复性较好,三种不同修饰类型叶黄素纳米脂质体间菌群微生物结构差异明显。结果表明,不同修饰类型的叶黄素纳米脂质体在一定程度上会影响肠道菌群的结构,其中,CS-LNLs组与Non-C-CS-EGCG-LNLs组表现出更多的相似性。
2.5 不同修饰类型叶黄素纳米脂质体对肠道菌群物种组成的影响
2.5.1 门水平及属水平物种组成分析
通过微生物物种组成进一步探究不同修饰类型叶黄素纳米脂质体肠道菌群组成的影响。图3A和图3B为各处理组肠道菌群在门和属水平上的分布情况。在门水平上,肠道菌群主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)以及放线菌门(Actinobacteria)的微生物构成。与BLK组相比,各组修饰型叶黄素纳米脂质体处理组中Bacteroidetes和Firmicutes门的微生物的相对丰度显著增加,而Actinobacteria门的微生物的相对丰度显著降低(P<0.05)。
在物种属水平上,与BLK组相比,LUT及LNLs组 Bifidobacterium 含量显著增加(P<0.05),分别增加了4.67%和4.33%;CS-LNLs、C-CS-EGCG-LNLs及Non-C-CS-EGCG-LNLs Dialister和Bacteroides含量均显著增加(P<0.05);此外,C-CS-EGCG-LNLs显著增加了Veillonella相对丰度(P<0.05),占比为46.71%;CS-LNLs和Non-C-CS-EGCG-LNLs显著增加了Roseburia相对丰度(P<0.05)占比分别为3.97%和3.20%。Bacteroides和Dialister含有多个多糖水解酶基因及多糖利用位点,可以降解多糖并促进SCFAs产生[36]。同时,C-CS-EGCG-LNLs组中,富集了较多的韦永氏球菌属(Veillonella)。Veillonella是一种革兰氏阴性细菌,能发酵丙酮酸、乳酸等代谢较强、非挥发性的酸代谢产生乙酸和丙酸等挥发性较强的酸[37]。有研究发现,在小鼠体内定植可以减少炎症因子的相对表达量[38]。一般而言,Veillonella相对丰度增加表明肠道菌群开始发酵丙酮酸产生乙酸和丙酸等,在本研究中,C-CS-EGCG-LNLs显著促进了Veillonella的相对丰度,丙酸、丁酸的含量显著提高,这与发酵液中SCFAs含量变化一致。这些结果表明,不同修饰型叶黄素纳米脂质体对肠道菌群有明显的调节作用[38]。
2.5.2 Lefse分析
通过Lefse进一步分析与不同修饰类型叶黄素纳米脂质体响应相关菌株。如图4A、图4B和图4C所示,CS-LNLs和C-CS-EGCG-LNLs组中的关键细菌类群分别有5个和4个,其中,CS-LNLs组中的关键菌属为小杆菌属(Dialister)、链球菌属(Streptococcus)、蜜蜂球菌属(Melissococcus)和肠球菌属(Enterococcus);C-CS-EGCG-LNLs组中的优势菌属为韦永氏球菌属(Veillonelia)。关键菌属的不同是各处理组间菌群差异的主要原因。
3. 结论
本实验对不同修饰类型的纳米脂质体进行了研究,结果表明经模拟结肠消化后,CS-LNLs、C-CS-EGCG-LNLs中叶黄素保留率显著低于LUT组,且C-CS-EGCG-LNLs组叶黄素保留率最低,较LUT组显著降低2.24倍(P<0.05),总糖含量显著降低,总多酚含量先上升后下降,发酵液中乙酸量高于CS-LNLs和Non-C-CS-EGCG-LNLs,乳酸含量显著高于BLK组7.55倍;三种不同修饰类型叶黄素纳米脂质体均可以显著提高肠道菌群结构的丰富度和多样性,且C-CS-EGCG-LNLs组菌群组成与CS-LNLs和Non-C-CS-EGCG-LNLs差异显著,并富集了较多的Veillonella。本研究解析了三种不同修饰类型叶黄素纳米脂质体在模拟结肠消化过程中与粪便中微生物的相互作用关系,对叶黄素吸收利用有一定的积极意义,有利于叶黄素产品的进一步开发。
-
表 1 发酵液中总糖、总酚含量
Table 1 Contents of total polysaccharide and total polyphenol in fermentation
样品 发酵时间(h) 总糖含量(mg/mL) 总酚含量(mg/mL) BLK 6 4.51±0.17c 7.22±0.03a 12 3.98±0.19d 7.61±0.63a 24 4.31±0.24b 7.59±0.07a LUT 6 3.90±0.14e 6.78±0.14c 12 3.55±0.14e 6.97±0.03bc 24 4.83±0.13a 7.31±0.09b LNLs 6 4.19±0.08de 6.99±0.13b 12 3.68±0.13e 6.95±0.13bcd 24 2.81±0.11c 6.96±0.14c CS-LNLs 6 4.42±0.33cd 6.20±0.10e 12 6.23±0.27a 6.64±0.12cd 24 4.87±0.03a 7.04±0.12c C-CS-EGCG-
LNLs6 5.89±0.04b 6.97±0.12b 12 4.52±0.02c 7.30±0.10ab 24 4.43±0.34b 6.58±0.14d Non-C-CS-
EGCG-LNLs6 6.94±0.21a 6.49±0.06d 12 5.36±0.03b 6.49±0.07d 24 4.28±0.26b 6.71±0.17d 注:同列肩标字母表示不同发酵时间下,不同修饰类型叶黄素纳米脂质体总糖、总酚含量具有显著性差异(P<0.05)。 表 2 厌氧发酵体系不同处理组不同时间SCFAs生成量
Table 2 Concentrations of SCFAs in different treatments during the anaerobic fermentation system
样品 乙酸(mmol/L) 丙酸(mmol/L) 乳酸(mmol/L) 6 h 12 h 24 h 6 h 12 h 24 h 6 h 12 h 24 h BLK 8.37±0.21a 11.19±1.04ab 16.88±0.58a 0.60±0.01b 1.26±0.12a 1.43±0.05b 7.69±0.35a 11.34±0.53a 0.38±0.43a LUT 8.00±0.16a 11.22±1.16ab 8.27±0.22c 0.54±0.01c 1.11±0.18a 0.82±0.16c 7.04±0.29b 10.86±0.53a 10.56±0.56a LNLs 7.93±0.07a 12.34±0.02a 17.24±0.26a 0.53±0.03c 1.28±0.01a 1.33±0.01b 7.78±0.48a 11.09±0.38a 9.87±0.66a CS-LNLs 7.57±0.71a 11.13±0.24ab 12.26±0.31b 0 0.72±0.01b 1.41±0.03b 1.32±0.13c 1.61±0.11c 7.61±0.32b C-CS-EGCG-LNLs 5.35±0.17c 6.32±0.41c 17.18±0.60a 0 0 1.30±0.05b 0.13±0.06d 0.18±0.06d 2.87±0.05d Non-C-CS-EGCG-LNLs 6.17±0.91b 9.99±1.13b 12.52±0.36b 0 0 1.46±0.24b 0.53±0.07d 2.24±0.28b 5.02±0.19c 注:同列肩标字母表示相同发酵时间下,不同修饰类型叶黄素纳米脂质体对SCFAs含量具有显著性差异(P<0.05)。 表 3 不同处理组肠道菌群的α多样性
Table 3 Alpha-diversity of gut microbiota in different treatments
组别 α多样性指数 Chao1 Simpson Pielou-e ORI 375.02±73.50a 0.97±0.01a 0.77±0.02a BLK 124.57±27.73c 0.86±0.01d 0.57±0.00b LUT 123.03±17.09c 0.86±0.00d 0.57±0.00 b LNLs 97.88±20.85c 0.86±0.01d 0.58±0.00 b CS-LNLs 220.25±15.11b 0.91±0.01c 0.67±0.02 c C-CS-EGCG-LNLs 231.59±71.70b 0.93±0.01b 0.67±0.00 c Non-C-CS-EGCG-LNLs 253.85±35.18b 0.92±0.01bc 0.68±0.02 c 注:同列肩标字母表示不同修饰类型叶黄素纳米脂质体肠道菌群的α多样性具有显著差异(P<0.05)。 -
[1] YANG C, MAIKE F, CHRIS K, et al. Bioaccessibility, cellular uptake and transport of luteins and assessment of their antioxidant activities[J]. Food Chemistry,2018,249:66−76. doi: 10.1016/j.foodchem.2017.12.055
[2] ALI S D, NEGIN A, HAJAR A, et al. Nano-lipid carriers stabilized by hydrophobically modified starch or sucrose stearate for the delivery of lutein as a nutraceutical beverage model[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2020,605:125349.
[3] LIENAU A, GLASER T, TANG G W, et al. Bioavailability of lutein in humans from intrinsically labeled vegetables determined by LC-APCI-MS[J]. The Journal of Nutritional Biochemistry,2003,14(11):663−670. doi: 10.1016/j.jnutbio.2003.08.004
[4] DAI Z Q, SONG J F, CHEN Y, et al. Study on the bioavailability of stevioside-encapsulized lutein and its mechanism[J]. Food Chemistry,2021,354:129528. doi: 10.1016/j.foodchem.2021.129528
[5] MANTOVANI R A, XAVIER A A O, TAVARES G M, et al. Lutein bioaccessibility in casein-stabilized emulsions is influenced by the free to acylated carotenoid ratio, but not by the casein aggregation state[J]. Food Research International,2022,161:111778. doi: 10.1016/j.foodres.2022.111778
[6] HUANG W Y, YAN Z, LI D J, et al. Antioxidant and anti-inflammatory effects of blueberry anthocyanins on high glucose-induced human retinal capillary endothelial cells[J]. Oxidative Medicine and Cellular Longevity,2018,2018:1862462.
[7] 肖亚茹, 张钟元, 聂梅梅, 等. 基于不同消化阶段探究多酚对叶黄素吸收的促进作用[J]. 食品科学,2022,43(21):137−143. [XIAO Y R, ZHANG Z Y, NIE M M, et al. Exploring the promoting effect of polyphenols on lutein absorption based on different digestion stages[J]. Food Science,2022,43(21):137−143.] doi: 10.7506/spkx1002-6630-20211220-228 XIAO Y R, ZHANG Z Y, NIE M M, et al. Exploring the promoting effect of polyphenols on lutein absorption based on different digestion stages[J]. Food Science, 2022, 43(21): 137−143. doi: 10.7506/spkx1002-6630-20211220-228
[8] 肖亚茹. 多酚在不同消化阶段对叶黄素肠道吸收的影响[D]. 镇江:江苏大学, 2022. [XIAO Y R. The effect of polyphenols on the intestinal absorption of lutein at different digestion stages[D]. Zhenjiang:Jiangsu University, 2022.] XIAO Y R. The effect of polyphenols on the intestinal absorption of lutein at different digestion stages[D]. Zhenjiang: Jiangsu University, 2022.
[9] GU L P, SU Y J, ZHANG M Q, et al. Protection of β-carotene from chemical degradation in emulsion-based delivery systems using antioxidant interfacial complexes:Catechin-egg white protein conjugates[J]. Food Research International,2017,96:84−93. doi: 10.1016/j.foodres.2017.03.015
[10] VEERESH T, NAVEEN J, Muthukumar S P, et al. Biodegradable chitosan-sodium alginate-oleic acid nanocarrier promotes bioavailability and target delivery of lutein in rat model with no toxicity[J]. Food Chemistry,2020,330:127195. doi: 10.1016/j.foodchem.2020.127195
[11] KANTAPPA H, JONGHWI L. Functional hyaluronic acid conjugates based on natural polyphenols exhibit antioxidant, adhesive, gelation, and self-healing properties[J]. Journal of Industrial and Engineering Chemistry,2017,54:44−51. doi: 10.1016/j.jiec.2017.04.018
[12] DAS A K, NANDA P K, MADANE P, et al. A comprehensive review on antioxidant dietary fibre enriched meat-based functional foods[J]. Trends in Food Science & Technology,2020,99:323−336.
[13] LIU Y J, LIU D D, ZHU L, et al. Temperature-dependent structure stability and in vitro release of chitosan-coated curcumin liposome[J]. Food Research International,2015,74:97−105. doi: 10.1016/j.foodres.2015.04.024
[14] YAN H X, XU Y Y, DAI Z Q, et al. Comparative study of the properties of lutein nanoliposomes coated with chitosan/ (−) -epigallocatechin- 3-gallate (EGCG) complexes[J]. Journal of the Science of Food & Agriculture,2023,103:3306−3314.
[15] 许书雅. 丁香酚纳米脂质体的制备及其抗大肠杆菌的作用研究[D]. 扬州:扬州大学, 2023. [XU S Y. Preparation of eugenol nanoliposomes and their anti-Escherichia coli effects[D]. Yangzhou:Yangzhou University, 2023.] XU S Y. Preparation of eugenol nanoliposomes and their anti-Escherichia coli effects[D]. Yangzhou: Yangzhou University, 2023.
[16] LYU Q Y, DENG H T, WANG S X, et al. Dietary supplementation with casein/cyanidin-3-O-glucoside nanoparticles alters the gut microbiota in high-fat fed C57BL/6 mice[J]. Food Chemistry,2023,412:135494. doi: 10.1016/j.foodchem.2023.135494
[17] XU P X, LUO S W, SONG J F, et al. Effect of sodium alginate-based hydrogel loaded with lutein on gut microbiota and inflammatory response in DSS-induced colitis mice[J]. Food Science and Human Wellness,2023,12(6):2428−2439. doi: 10.1016/j.fshw.2023.03.010
[18] BANGHAM A D, HILL M W, MILLER N G A. Preparation and use of liposomes as models of biological membranes[J]. Methods in Membrane Biology, 1974:1-68.
[19] MANUELA C, FRANCESCO P, FRANCESCA I, et al. Covalent insertion of antioxidant molecules on chitosan by a free radical grafting procedure[J]. Journal of Agricultural and Food Chemistry,2009,57(13):5933−5938. doi: 10.1021/jf900778u
[20] UMILE G S, FRANCESCA I, FRANCESCO P, et al. Synthesis of antioxidant polymers by grafting of gallic acid and catechin on gelatin[J]. Biomacromolecules,2009,10(7):1923−1930. doi: 10.1021/bm900325t
[21] TYSSANDIER V, REBOUL E, DUMAS J F, et al. Processing of vegetable-borne carotenoids in the human stomach and duodenum[J]. Am J Physiol Gastrointest Liver Physiol,2003,284(6):G913−G923. doi: 10.1152/ajpgi.00410.2002
[22] CHEN D, CHEN G J, DING Y, et al. Polysaccharides from the flowers of tea (Camellia sinensis L.) modulate gut health and ameliorate cyclophosphamide-induced immunosuppression[J]. Journal of Functional Foods,2019,61:103470. doi: 10.1016/j.jff.2019.103470
[23] LI W, WANG K Q, SUN Y, et al. Influences of structures of galactooligosaccharides and fructooligosaccharides on the fermentation in vitro by human intestinal microbiota[J]. Journal of Functional Foods,2015,13:158−168. doi: 10.1016/j.jff.2014.12.044
[24] 李大婧, 刘春菊, 肖亚冬, 等. 叶黄素及其顺式异构体的快速检测[J]. 食品科学,2016,37(4):206−211. [LI D J, LIU C J, XIAO Y D, et al. Rapid detection of lutein and its cis isomers[J]. Food Science,2016,37(4):206−211.] LI D J, LIU C J, XIAO Y D, et al. Rapid detection of lutein and its cis isomers[J]. Food Science, 2016, 37(4): 206−211.
[25] 郭金龙, 陈有君, 孙国琴, 等. 苯酚-硫酸法测定杏鲍菇多糖方法的研究[J]. 食品科学,2008,29(12):555−558. [GUO J L, CHEN Y J, SUN G Q, et al. Study on the phenol-sulfuric acid method for the determination of polysaccharides in pleurotus eryngii[J]. Food Science,2008,29(12):555−558.] doi: 10.3321/j.issn:1002-6630.2008.12.129 GUO J L, CHEN Y J, SUN G Q, et al. Study on the phenol-sulfuric acid method for the determination of polysaccharides in pleurotus eryngii[J]. Food Science, 2008, 29(12): 555−558. doi: 10.3321/j.issn:1002-6630.2008.12.129
[26] 肖纯, 张凯农. Folin─Denis试剂测定茶中酚类化合物[J]. 茶叶通讯,1996(4):27−29. [XIAO C, ZHANG K N. Determination of phenolic compounds in tea using Folin-Denis reagent[J]. Tea Communication,1996(4):27−29.] XIAO C, ZHANG K N. Determination of phenolic compounds in tea using Folin-Denis reagent[J]. Tea Communication, 1996(4): 27−29.
[27] TIAN L M, SCHOLTE J, BOREWICZ K, et al. Effects of pectin supplementation on the fermentation patterns of different structural carbohydrates in rats[J]. Molecular Nutrition & Food Research,2016,60(10):2256−2266.
[28] MRÁZEK J, KOPPOVÁ I, KOPEČNÝ J. PCR-DGGE-based study of fecal microbial stability during the long-term chitosan supplementation of humans[J]. Folia Microbiologica,2010,55(4):7.
[29] CHEN D, BAI R Y, YONG H M, et al. Improving the digestive stability and prebiotic effect of carboxymethyl chitosan by grafting with gallic acid:In vitro gastrointestinal digestion and colonic fermentation evaluation[J]. International Journal of Biological Macromolecules,2022,214:685−696. doi: 10.1016/j.ijbiomac.2022.06.170
[30] HUANG F, HONG R Y, YI Y, et al. In vitro digestion and human gut microbiota fermentation of longan pulp polysaccharides as affected by Lactobacillus fermentum fermentation[J]. International Journal of Biological Macromolecules,2020,147:363−368. doi: 10.1016/j.ijbiomac.2020.01.059
[31] FU Y S, ZHANG J N, CHEN K N, et al. An in vitro fermentation study on the effects of Dendrobium officinale polysaccharides on human intestinal microbiota from fecal microbiota transplantation donors[J]. Journal of Functional Foods,2019,53:44−53. doi: 10.1016/j.jff.2018.12.005
[32] ZHANG X W, ZHANG M W, DONG L H, et al. Phytochemical profile, bioactivity, and prebiotic potential of bound phenolics released from rice bran dietary fiber during in vitro gastrointestinal digestion and colonic fermentation[J]. Journal of Agricultural and Food Chemistry,2019,67(46):12796−12805. doi: 10.1021/acs.jafc.9b06477
[33] PETRA C K, SAHAR E A, GERTJAN V D. The role of supplemental complex dietary carbohydrates and gut microbiota in promoting cardiometabolic and immunological health in obesity:Lessons from healthy non-obese individuals[J]. Frontiers in Nutrition,2017,4:34. doi: 10.3389/fnut.2017.00034
[34] ZHU M Z, ZHOU F, OUYANG J, et al. Combined use of epigallocatechin-3-gallate (EGCG) and caffeine in low doses exhibits marked anti-obesity synergy through regulation of gut microbiota and bile acid metabolism[J]. Food & Function,2021,12(9):4105−4116.
[35] VALDES A M, WALTER J, SEGAL E, et al. Role of the gut microbiota in nutrition and health[J]. BMJ, 2018,13:2179.
[36] 田雨, 郭莹莹, 李娜, 等. 体外消化和结肠发酵对不同采收期坛紫菜中酚类物质生物可及性和肠道菌群的影响[J]. 食品科学,2022,43(20):157−164. [TIAN Y, GUO Y Y, LI N, et al. Effects of in vitro digestion and colonic fermentation on the bioavailability of phenolic substances and gut microbiota in Porphyra haitanensis at different harvesting periods[J]. Food Science,2022,43(20):157−164.] doi: 10.7506/spkx1002-6630-20211119-240 TIAN Y, GUO Y Y, LI N, et al. Effects of in vitro digestion and colonic fermentation on the bioavailability of phenolic substances and gut microbiota in Porphyra haitanensis at different harvesting periods[J]. Food Science, 2022, 43(20): 157−164. doi: 10.7506/spkx1002-6630-20211119-240
[37] 林秀燕, 石宏. 双歧杆菌、韦荣球菌、奈瑟氏菌生物学特点及其在低龄儿童龋发生发展中的作用和作用机制研究进展[J]. 山东医药,2023,63(18):94−98. [LIN X Y, SHI H. Research progress on the biological characteristics of Bifidobacterium, Veillonella and Neisseria, and their roles and mechanisms in the occurrence and development of dental caries in young children[J]. Shandong Medical Journal,2023,63(18):94−98.] doi: 10.3969/j.issn.1002-266X.2023.18.024 LIN X Y, SHI H. Research progress on the biological characteristics of Bifidobacterium, Veillonella and Neisseria, and their roles and mechanisms in the occurrence and development of dental caries in young children[J]. Shandong Medical Journal, 2023, 63(18): 94−98. doi: 10.3969/j.issn.1002-266X.2023.18.024
[38] JULIE E B, CASEY M C, ABIGAIL L R, et al. Precision modulation of dysbiotic adult microbiomes with a human-milk-derived synbiotic reshapes gut microbial composition and metabolites[J]. Cell Host & Microbe,2023,31:1523−1538.
-
期刊类型引用(3)
1. 王喜庆,李成凤,郭丽,赵洪波,马雪,李杨,苏适,郭齐. 创新创业背景下“食品营养学”课程思政教学改革与实践. 食品与发酵科技. 2025(01): 188-192 .  百度学术
百度学术
2. 隋晓楠,张妍,黄国,付昳丹,梁香玉,赵尚清,王思琦,杨爱峥,霍俊伟,江连洲. 省一流专业引领下“粮油加工副产物综合利用”课程创新创业元素的设计与实践. 食品工业科技. 2024(13): 308-314 .  本站查看
本站查看
3. 李晓东,刘璐,李嘉钰,张秀秀,郑冬梅,崔立雪,张宏伟. 《乳品工艺学》课程思政教育的改革与实践. 食品工业科技. 2024(19): 376-382 .  本站查看
本站查看
4. 罗港. 高职院校思政元素融入Premiere课程的研究与探索. 辽宁师专学报(社会科学版). 2023(02): 70-72 .  百度学术
百度学术
5. 桂亚,马栎,李逸鹤,田林双. 高职院校粮食工程专业劳动教育的实践探究. 现代面粉工业. 2023(05): 36-39 .  百度学术
百度学术
6. 贺光祖,叶惠慧,李逢振,王治昕,魏莎,李静. 食品类专业实践教学体系化微课的创新路径. 现代畜牧科技. 2023(11): 157-159 .  百度学术
百度学术
1. 杨攀平,李惠侠,胡亚美. 盐池滩羊肉品质特性及其潜在调控机理探讨. 草业学报. 2025(04): 223-232 .  百度学术
百度学术
2. 吕玲燕,胡湘云,刘明君,顾国才,汪燕玲,韦明松,刘庆友,王献伟. 茉莉花渣对隆林黑山羊养分表观消化率、生长性能、屠宰性能、肉品质及血清生化指标的影响. 饲料研究. 2025(03): 12-17 .  百度学术
百度学术
3. 刘嘉东,韩晓娟,张桂杰,黄帅. 柠条青贮替代全株玉米青贮对滩羊生长性能、脂肪沉积和肉品质的影响. 动物营养学报. 2023(09): 5827-5836 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:



 下载:
下载:



