Preparation and Characterization of Chitinase from Marine Bacteria Aeromonas sp. YS-54
-
摘要: 为实现甲壳类原料的高效降解与N-乙酰氨基寡糖的绿色制备,本研究以青岛近海土壤中筛选的菌株YS-54为材料,使用60%硫酸铵沉淀、Sephadex G-100凝胶过滤层析制备几丁质酶;对几丁质酶的最适温度、最适pH、底物偏好性等性质进行表征;使用质谱技术确认了酶解产物的聚合度。结果表明,菌株YS-54为Aeromonas属,该菌株来源几丁质酶比活力为23.44 U/mg,分子量为63与75 kDa。几丁质酶在40 ℃和pH为5.0条件下具有良好的稳定性,Ba2+、Co2+、Mg2+与TritonX-100显著促进了几丁质酶活力(P<0.05),而Fe3+、Cu2+、SDS对酶活力起抑制作用。几丁质酶对α-几丁质的比活力为7.99 U/mg,为水解胶体几丁质比活力的34.09%。几丁质酶对胶体几丁质与α-几丁质的酶解产物聚合度分别为1~4与1~3。Aeromonas sp. YS-54来源几丁质酶在较宽的温度与pH范围内保持稳定,同时对α-几丁质具有良好的水解能力,可为甲壳类废弃物的高效综合利用提供技术支持。
-
关键词:
- 几丁质酶 /
- 酶学性质 /
- 底物偏好性 /
- N-乙酰氨基寡糖 /
- 海洋菌株Aeromonas sp.
Abstract: To achieve efficient degradation of crustacean raw materials and eco-preparation of N-acetyl-oligosaccharides, YS-54 strain screened from offshore soil in Qingdao was used for chitinase preparation in the present study. Chitinase was prepared through 60% ammonium sulfate precipitation and Sephadex G-100 gel filtration chromatography. Enzymatic properties such as optimal temperature, optimal pH, and substrate specificity were characterized. Mass spectrometry was used to determine the polymerization degree of enzymatic products. The 16S rRNA identification result showed that YS-54 strain belonged to the Aeromonas species. Chitinase from Aeromonas sp. YS-54 showed a specific activity of 23.44 U/mg. The molecular weights of chitinase were 63 and 75 kDa as shown by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE). Chitinase was stable under the condition of 40 ℃ and pH5.0. The enzymatic activity was significantly activated by Ba2+, Co2+, Mg2+ and TritonX-100 (P<0.05), while inhibited by Fe3+, Cu2+ and SDS. The specific activity of chitinase toward α-chitin was 7.99 U/mg, 34.09% of that toward colloidal chitin. The polymerization degree of enzymatic hydrolysis products from colloidal chitin and α-chitin were 1~4 and 1~3, respectively. Chitinase from Aeromonas sp. YS-54 was stable in broad range of temperature and pH, meanwhile showed high catalytic efficiency toward α-chitin. The hydrolysis characteristics of chitinase from Aeromonas sp. YS-54 would provide technical support for the comprehensive utilization of crustacean waste. -
我国甲壳类生物资源丰富,其中虾蟹类在水产品加工领域占据重要地位[1]。据报道,虾蟹类加工每年约产生600~800万吨废弃物,其中几丁质占比介于20%~58%[2]。几丁质是自然界中唯一一类带正电荷的多糖,主要存在于海洋甲壳类动物的外骨骼、真菌的细胞壁和昆虫的角质层中[3−5]。几丁质的降解产物N-乙酰氨基寡糖具有抗氧化、抑菌、抗肿瘤等生物活性,其良好的生物相容性与安全性,在膳食补充剂、骨关节炎保健、化妆品等领域具有应用价值[6−8]。N-乙酰氨基寡糖现有的制备工艺以酸碱法为主,首先使用酸碱去除原料中的钙和蛋白质获得几丁质,随后经热碱脱乙酰处理与酸水解获得终产物[9]。化学法制备的寡糖通常纯度不高且结构遭到破坏,同时引发环境污染等问题[10]。酶解法制备N-乙酰氨基寡糖反应条件温和,无杂质和副产物产生,寡糖片段聚合度可控,不产生污染,符合我国提倡的绿色可持续发展理念,是N-乙酰氨基寡糖现制备工艺的有效替代方案[11]。
几丁质酶是一种糖苷水解酶,广泛分布在微生物、植物与动物中[12−13]。大多数几丁质酶被归类为糖苷水解酶GH18和GH19两大家族,其中GH18家族几丁质酶的催化机制为底物辅助保留机制,此类酶的催化氨基酸基序为Asp-X-Asp-X-Glu,中间位置的Asp与底物结合,底物充当亲核试剂,被Glu质子化断裂β-1,4糖苷键,完成一次催化过程[14]。GH19家族几丁质酶的催化机制为酸碱催化,此类酶的催化氨基酸基序为Glu-X-Glu-X-Ser/Thr,其中第一个Glu为催化酸,提供质子;第二个Glu为催化碱,亲核攻击底物糖苷键完成一次催化过程[15]。已报道分泌几丁质酶的菌株主要包括Aeromonas、Bacillus、Chitiniphilus、Exiguobacterium、Lysobacter、Pseudomonas、Serratia等属[16−22],如Halder等[23−24]报道A. hydrophila来源的几丁质酶,酶活力为21.48 U/mL,最适反应条件为40 ℃和pH7.0,酶解产物为N-乙酰氨基葡萄糖GlcNAc和二糖(GlcNAc)2;Wang等[25]报道C. meiyuanensis来源几丁质酶的酶活力为4.1 U/mg,最适反应条件为50 ℃和pH6.0,酶解产物为(GlcNAc)2;Fu等[19]报道E. antarcticum来源几丁质酶的酶活力为7.3 U/mg,最适反应条件为30 ℃和pH5.0,酶解产物为GlcNAc、(GlcNAc)2与(GlcNAc)3。
然而,几丁质高结晶度和稳定的结构特性是几丁质酶水解的关键瓶颈,已报道的几丁质酶几乎难以有效降解α-几丁质[26−28]。为提升酶解效率,α-几丁质需经过强酸预处理制备胶体几丁质,在充分降低其结晶度的前提下方可作为酶解底物进行反应[29]。因此,挖掘可高效水解α-几丁质的几丁质酶,实现酶的制备与性质研究,在水产品加工与综合利用领域具有较高应用潜力。本研究以前期筛选的可降解几丁质的海洋细菌Aeromonas sp. YS-54为研究对象,使用菌株发酵、硫酸铵沉淀、凝胶过滤层析方法实现几丁质酶的制备;同时研究几丁质酶的最适温度、最适pH等酶学性质,阐明底物偏好性与酶解产物组成。其结果完善了海洋来源Aeromonas属菌株几丁质酶的报道,该酶对α-几丁质良好的水解特性有望为甲壳类废弃物的高效降解与酶制剂的规模化制备提供技术支撑。
1. 材料与方法
1.1 材料与仪器
Aeromonas sp. YS-54菌株 筛选自青岛沿海土壤,现保藏于中国水产科学院黄海水产研究所;几丁质、壳聚糖 分析纯,上海阿拉丁生化科技股份有限公司;琼脂、D-氨基葡萄糖、3,5-二硝基水杨酸试剂、十二烷基硫酸钠(SDS)(分析纯)、Lowry法蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒 北京索莱宝科技有限公司;Sephadex G-100 北京瑞达恒辉科技发展有限公司;基因组提取试剂盒、PCRMix 北京擎科生物科技有限公司;磷酸氢二钾、磷酸二氢钾、氯化钠等 分析纯,国药集团化学试剂有限公司;菌株富集/种子/发酵培养基:α-几丁质4 g/L、硫酸铵2 g/L、磷酸氢二钾0.7 g/L、磷酸二氢钾0.3 g/L、硫酸镁0.5 g/L、氯化钠10 g/L。
LDZF-50L-II型立式高压蒸汽灭菌器 上海申安医疗器械厂;SPX-80BSH-II型生化培养箱 上海新苗医疗器械制造有限公司;ZQTY-90S型振荡培养箱 上海知楚仪器有限公司;Neofuge15R型高速冷冻离心机 上海力申科学仪器有限公司;UV1-102II型紫外/可见分光光度计 上海天美科学仪器有限公司;ST3100型pH计 奥豪斯仪器(常州)有限公司;DYY-6C型电泳仪 北京六一生物科技有限公司。
1.2 实验方法
1.2.1 菌株YS-54鉴定
对YS-54发酵液菌体的基因组DNA进行提取并作为模板,使用通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)与1492R(5’-GGTTCCTTGTTACGACTT-3’)进行PCR扩增。扩增体系(50 μL)包括:PCR Mix 46 μL,上下游引物各1.0 μL,模板2.0 μL。PCR扩增程序:98 ℃预变性3 min;98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸20 s;72 ℃终延伸2 min,循环次数35次。PCR产物送至擎科生物科技有限公司进行测序,使用BLAST工具进行序列的同源性比对,使用MEGA 11软件完成多序列比对与系统发生树构建。
1.2.2 Aeromonas sp. YS-54来源几丁质酶的制备
1.2.2.1 菌株YS-54发酵
将YS-54菌液涂布于富集培养基,于30 ℃培养箱中培养3~4 d,挑取单菌落接种于种子培养基,在30 ℃、140 r/min振荡培养箱中培养3 d后,以5%接种量接种于发酵培养基中,在相同条件下培养3 d。发酵液置于高速冷冻离心机中离心10 min,制得的上清液即为粗酶液。
1.2.2.2 硫酸铵盐析
硫酸铵一级沉淀:取粗酶液依次加入硫酸铵粉末使溶液的饱和度分别为20%至90%,在冰浴中缓慢搅拌至硫酸铵全部溶解后,于4 ℃静置过夜。溶液经8000 r/min离心10 min,以pH5.0的50 mmol/L磷酸缓冲液复溶沉淀,测定酶的比活力,绘制硫酸铵一级沉淀曲线。
硫酸铵分级沉淀:取适量粗酶液,加入硫酸铵粉末使其初始饱和度为20%,在冰浴中缓慢搅拌至硫酸铵全部溶解后,于4 ℃静置过夜。8000 r/min离心10 min保留沉淀,采用相同步骤,在上清液中继续加入固体硫酸铵粉末使其饱和度为30%至90%,获得经不同饱和度硫酸铵纯化后的酶溶液。分别测定酶的比活力,绘制硫酸铵分级沉淀曲线。比较几丁质酶的比活力、纯化倍数与回收率,选取适宜的盐析方案,用于几丁质酶的进一步制备。
1.2.2.3 Sephadex G-100凝胶过滤层析
使用1.6×100 cm的层析柱纯化几丁质酶,设定上样量为2.5 mL,使用pH6.0的磷酸盐缓冲液洗脱,流速0.5 mL/min,分别测定收集液的酶活力,合并收集酶活力最高的组分进行超滤浓缩,评估几丁质酶的纯化倍数与回收率。
1.2.3 几丁质酶电泳分析
对凝胶过滤层析制备的酶溶液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测,电泳分离胶浓度为10%,浓缩胶浓度为4%。电泳胶经考马斯亮蓝G-250染色与脱色后,表征几丁质酶的分子量。
1.2.4 胶体几丁质的制备
将8 g α-几丁质缓慢加入至240 mL磷酸中搅拌4 h,期间进行超声助溶,待几丁质完全溶解后,加入预冷的1200 mL 50%乙醇溶液搅拌,静置过夜。离心后将沉淀水洗至中性,定容制备1%的胶体几丁质。
1.2.5 几丁质酶活力测定
几丁质酶的酶活力采用3,5-二硝基水杨酸(DNS)法测定。取100 μL酶液,添加1 mL pH5.0的1%胶体几丁质,40 ℃水浴反应1 h后,向体系中加入1 mL DNS试剂,混匀并置于沸水浴中反应5 min后,立即冷却后稀释至10 mL,测定上清液在540 nm处的光密度。酶活力单位(U)定义为:在40 ℃反应温度下,每分钟催化几丁质底物产生1 μmol N-乙酰氨基葡萄糖所需的酶量。
蛋白质含量使用Lowry法蛋白测定试剂盒完成,依次加入适当稀释的蛋白样品与Folin酚甲试剂,混匀并静置10 min后加入Folin酚乙试剂,于37 ℃反应30 min,在650 nm处测定光密度值,计算几丁质酶溶液中的蛋白含量。
几丁质酶制备过程中纯化倍数与回收率计算公式如下:
总活力=酶活力单位数酶液体积×总体积 (1) 比活力=总活力总蛋白 (2) 纯化倍数=纯化后比活力纯化前比活力 (3) 回收率(%)=纯化后总活力纯化前总活力×100 (4) 式中:总活力单位:U;酶液体积单位:mL;总体积单位:mL;比活力单位:U/mg;总蛋白单位:mg;回收率单位:%。
1.2.6 Aeromonas sp. YS-54来源几丁质酶的性质研究
1.2.6.1 最适反应温度与热稳定性
在pH为6.0的条件下,分别测定几丁质酶在30 ℃至60 ℃的酶活力,以酶活力的最高值为依据,计算不同条件下酶的相对活力,确认酶的最适反应温度。将酶溶液依次置于40、45、50、55 ℃中保温0~3 h,每隔0.5 h测定一次酶活力,计算不同环境下酶的相对活力,确定酶在不同温度下的稳定性。
1.2.6.2 最适反应pH与pH稳定性
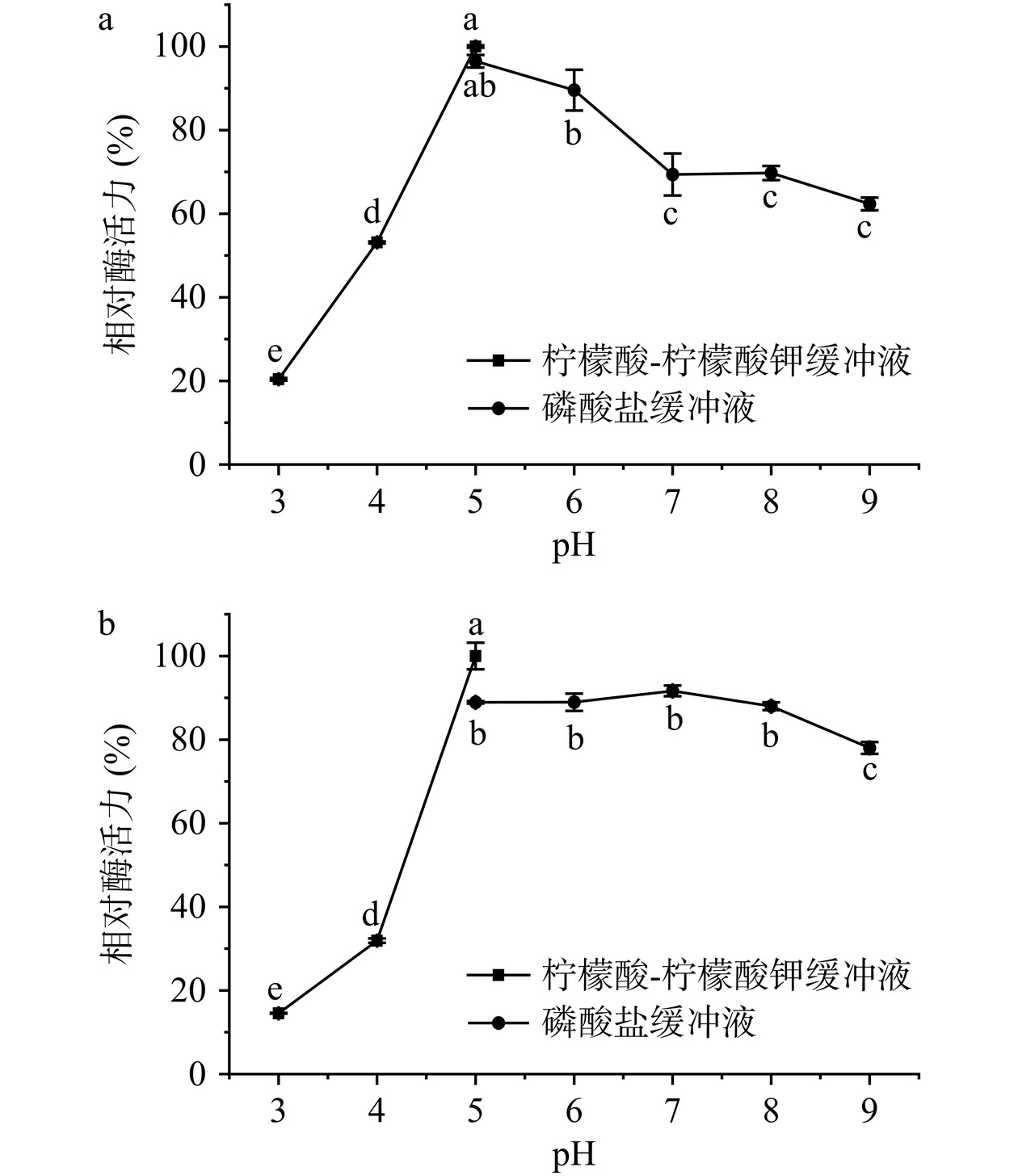
在40 ℃下,分别测定几丁质酶在不同pH环境中的酶活力,缓冲体系分别选用50 mmol/L的柠檬酸-柠檬酸钾缓冲液(pH 3.0~5.0)和磷酸二氢钾-磷酸氢二钾缓冲液(pH 5.0~9.0),计算不同环境下酶的相对活力,确认酶的最适反应pH。将酶液分别置于pH3.0~9.0的缓冲体系下室温静置2 h,在40 ℃温度下完成酶解,计算酶的相对活力,确认酶的pH稳定性。
1.2.6.3 金属离子与生化试剂对Aeromonas sp. YS-54来源几丁质酶活力的影响
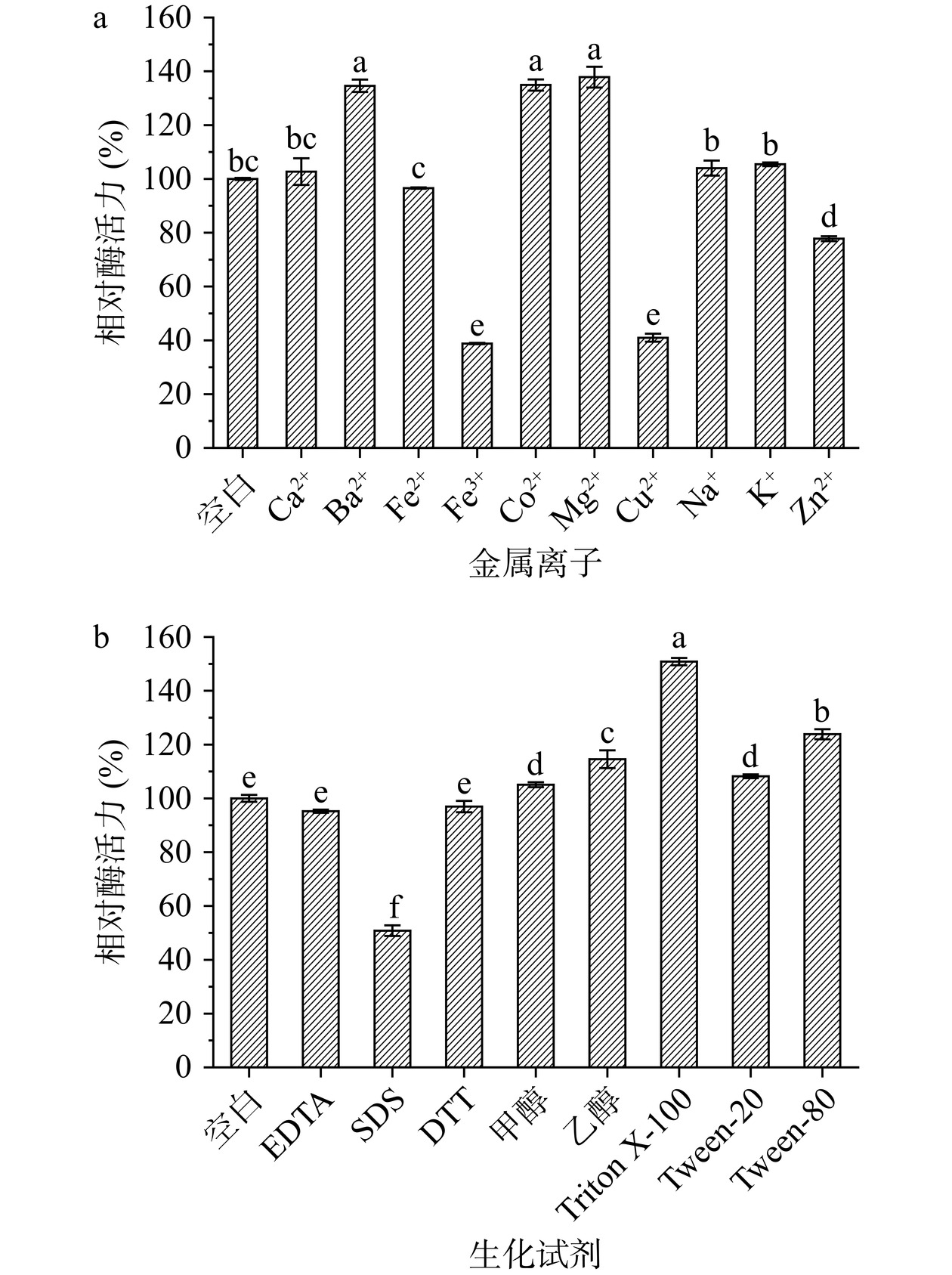
在温度为40 ℃、pH5.0的反应体系中分别加入浓度为5 mmol/L的Ca2+、Ba2+、Fe2+、Fe3+、Co2+、Mg2+、Cu2+、Na+、K+、Zn2+,以及5 mmol/L的乙二胺四乙酸(EDTA)、十二烷基硫酸钠(SDS)、二硫苏糖醇(DTT)、甲醇、乙醇和1%的Triton X-100、Tween-20、Tween-80,计算不同反应体系中酶的相对活力,探究不同金属离子对几丁质酶酶活力的影响。
1.2.6.4 底物偏好性分析
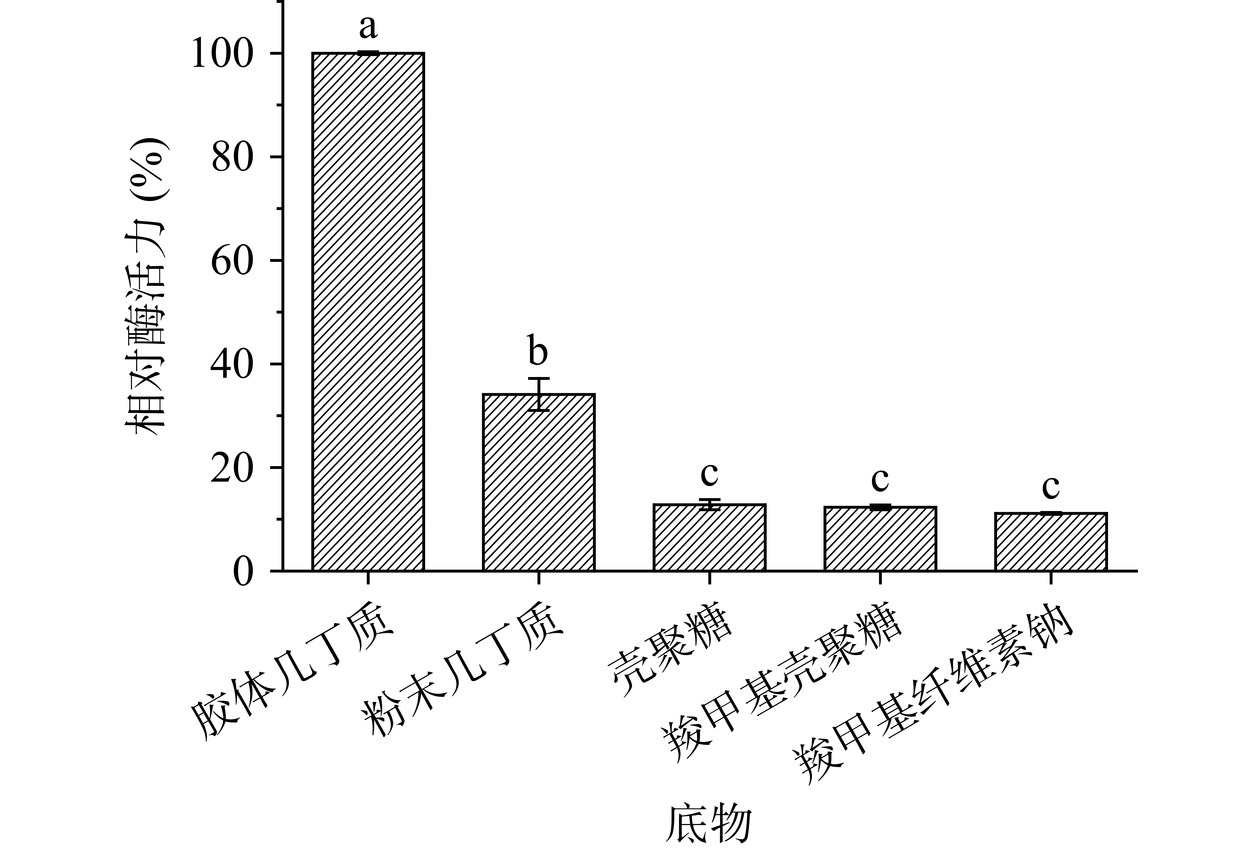
为探究Aeromonas sp. YS-54来源几丁质酶的底物偏好性,分别以1 g/100 mL胶体几丁质、α-几丁质、壳聚糖、羧甲基纤维素钠、羧甲基壳聚糖为酶解反应底物,在温度为40 ℃、pH5.0的反应体系中进行酶解,计算酶的相对活力。
1.2.6.5 几丁质酶酶解产物分析
将酶解产物溶解于70%甲醇溶液,经0.22 μm滤膜过滤后通过质谱仪的离子源进行离子化,完成质谱分析。质谱条件:正离子ESI模式;质量扫描范围m/z 100~1200;吹干与喷雾气体:N2。
1.3 数据处理
几丁质酶的制备与性质研究实验均设置三个平行,数据采集与分析使用Origin 2021软件完成,显著性分析使用SPSS 27软件完成,P<0.05代表差异显著。
2. 结果与分析
2.1 菌株YS-54的16S rRNA鉴定
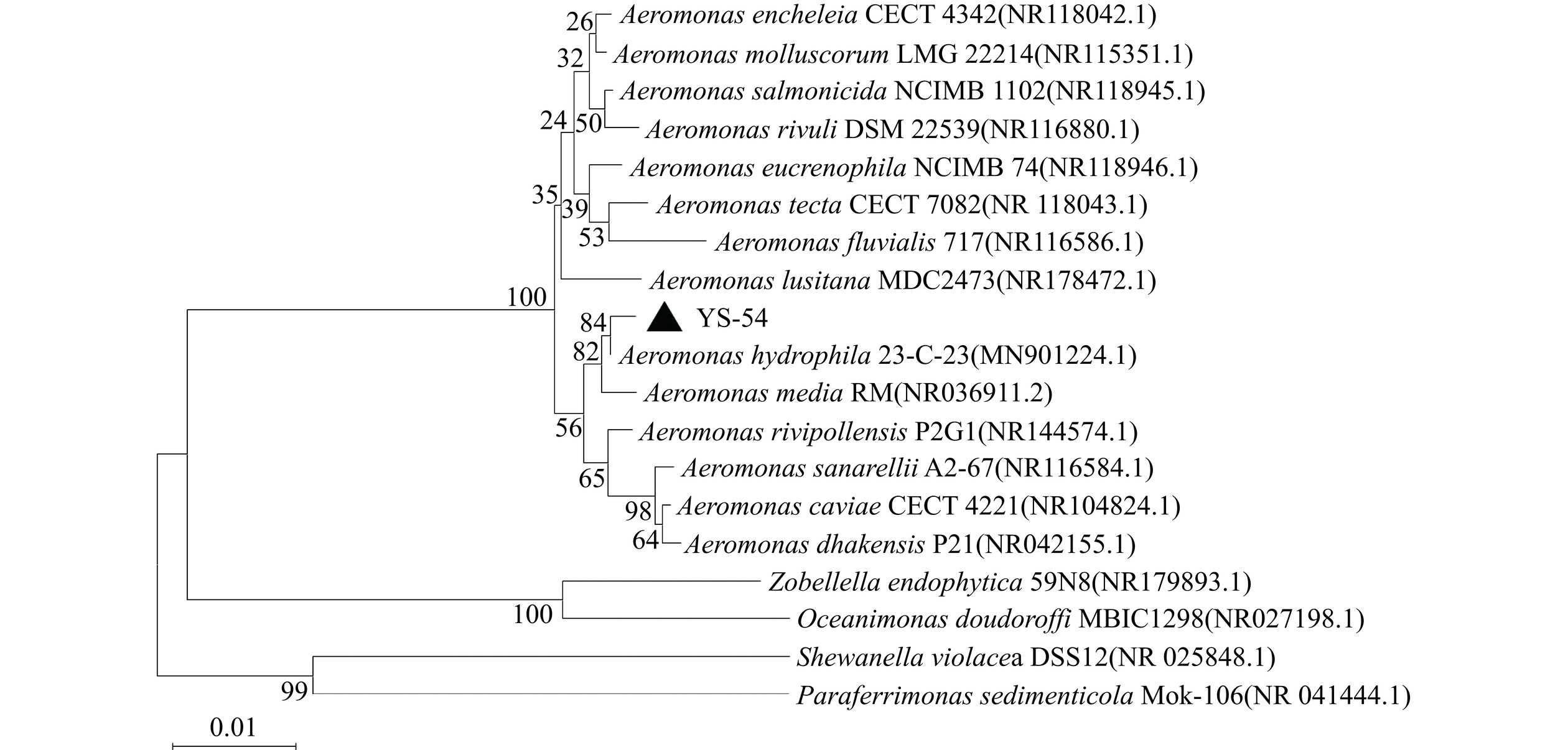
通过YS-54菌株基因组扩增的16S rRNA产物片段长度为1439 bp,将测序所得序列使用BLAST功能进行同源性比对,依据比对结果,选取18种菌株的rRNA序列与YS-54菌株进行多序列比对,构建系统发育树,结果如图1所示。菌株YS-54与Aeromonas属菌株亲缘关系最接近,其中与A. hydrophila的相似度为99.72%,与A. media的相似度为99.37%,与A. rivipollensis的相似度为99.15%,从而确定该菌株为Aeromonas属。
2.2 Aeromonas sp. YS-54来源几丁质酶的制备
2.2.1 硫酸铵盐析
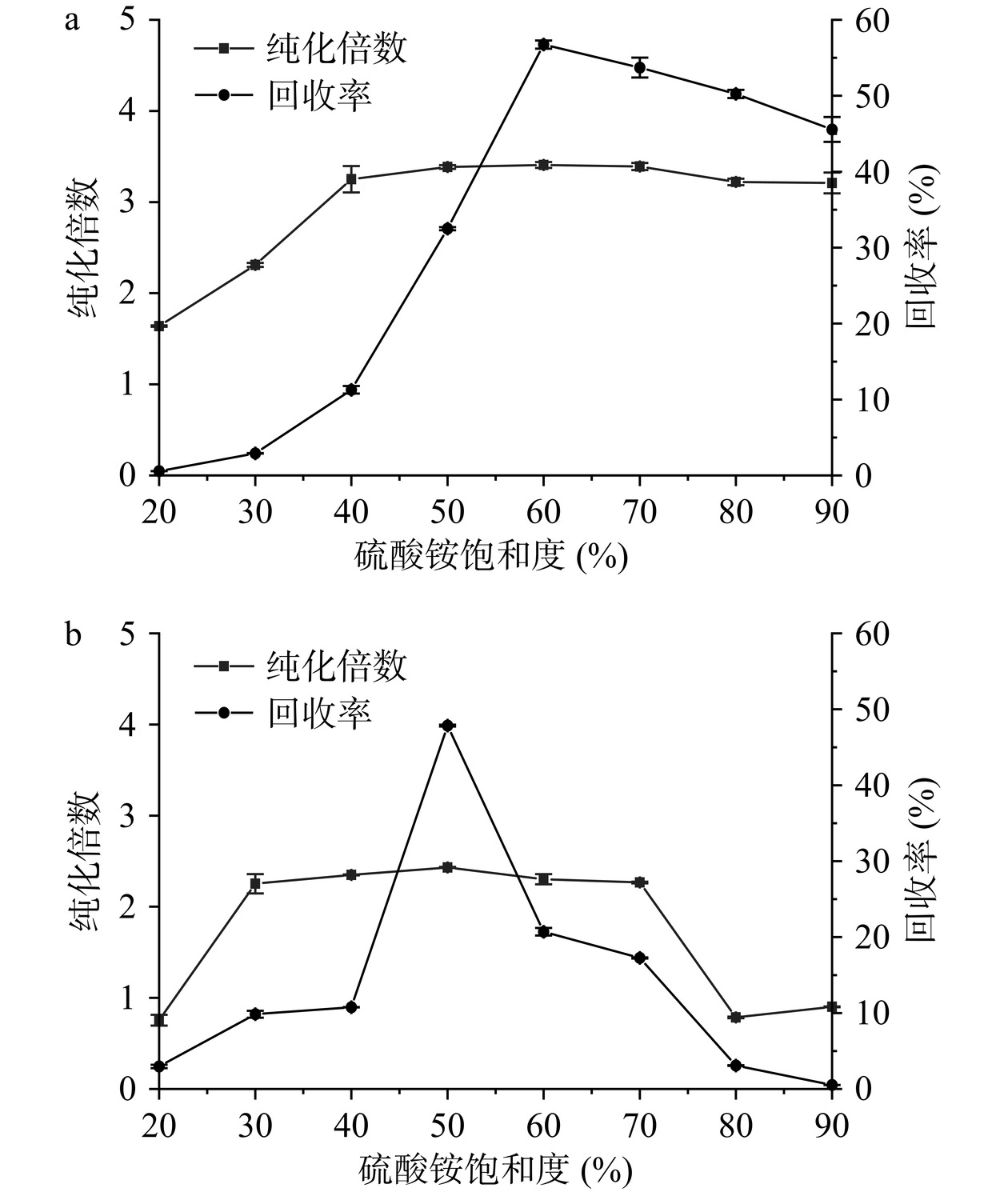
在一定饱和度的硫酸铵溶液中,几丁质酶会在疏水作用下聚集形成沉淀,从而达到纯化和浓缩粗酶液的目的[30]。本实验探究了两种硫酸铵盐析方法,确定达到最佳纯化效率所需的硫酸铵溶液饱和度。硫酸铵一级沉淀的结果如图2a所示,当硫酸铵饱和度为20%~40%时,纯化倍数与回收率均逐步提升,表明部分杂蛋白和几丁质酶已析出;当硫酸铵饱和度为60%时,几丁质酶的纯化倍数为3.41倍,回收率为56.74%,均达到最大值。随着硫酸铵饱和度继续升高,几丁质酶的回收率呈下降趋势,当硫酸铵饱和度为70%时,几丁质酶的纯化倍数为3.39倍,回收率为53.71%,略低于60%硫酸铵沉淀效果,因此确认一级沉淀过程中最佳的硫酸铵饱和度为60%。
硫酸铵分级沉淀结果如图2b所示,当硫酸铵饱和度为50%时,几丁质酶的纯化倍数和回收率达到最大值,分别为2.43倍和47.86%;当硫酸铵饱和度高于50%时,纯化倍数与回收率逐渐降低,纯化效果下降。经分级沉淀获得的几丁质酶,其纯化倍数与回收率低于一级沉淀,表明分级沉淀方案造成酶蛋白的损失,不利于后续制备。陈茜文等[31]的报道采用硫酸铵分级沉淀对克氏原螯虾来源几丁质酶进行纯化,纯化倍数和回收率分别为1.50倍和51.21%。本研究中使用60%硫酸铵溶液一级沉淀制备几丁质酶的纯化倍数与回收率高于上述纯化结果,因此后续使用该条件完成几丁质酶的盐析制备。
2.2.2 凝胶过滤层析
采用Sephadex G-100对60%硫酸铵盐析后的酶溶液进一步纯化,结果表明酶活力变化曲线呈现单一峰,峰值酶活力为1.83 U/mL,对应的洗脱体积为56 mL,保存该组分,经超滤浓缩后,进行后续的SDS-PAGE与酶学性质分析。
对粗酶液、60%硫酸铵沉淀、凝胶过滤层析获得的几丁质酶的比活力进行评估,结果如表1所示。几丁质酶经硫酸铵沉淀和凝胶过滤层析后,总活力为47.58 U,比活力为23.44 U/mg,纯化倍数为7.61倍,回收率为17.29%。已报道的B. thuringiensis来源几丁质酶经硫酸铵分级沉淀和凝胶过滤层析后,纯化倍数为3.21倍,回收率为15.52%[32]。本研究中几丁质酶的纯化倍数与回收率更理想,表明硫酸铵一级沉淀与凝胶过滤层析方案适用于Aeromonas sp. YS-54来源几丁质酶的制备。
表 1 Aeromonas sp. YS-54来源几丁质酶纯化效果Table 1. Purification effects on chitinase from Aeromonas sp. YS-54制备步骤 总活力
(U)总蛋白
(mg)比活力
(U/mg)纯化倍数 回收率
(%)粗酶液 275.25 89.39 3.08 1.00 100.00 60%硫酸铵沉淀 155.37 15.13 10.27 3.33 56.45 凝胶过滤层析 47.58 2.03 23.44 7.61 17.29 2.2.3 几丁质酶电泳分析
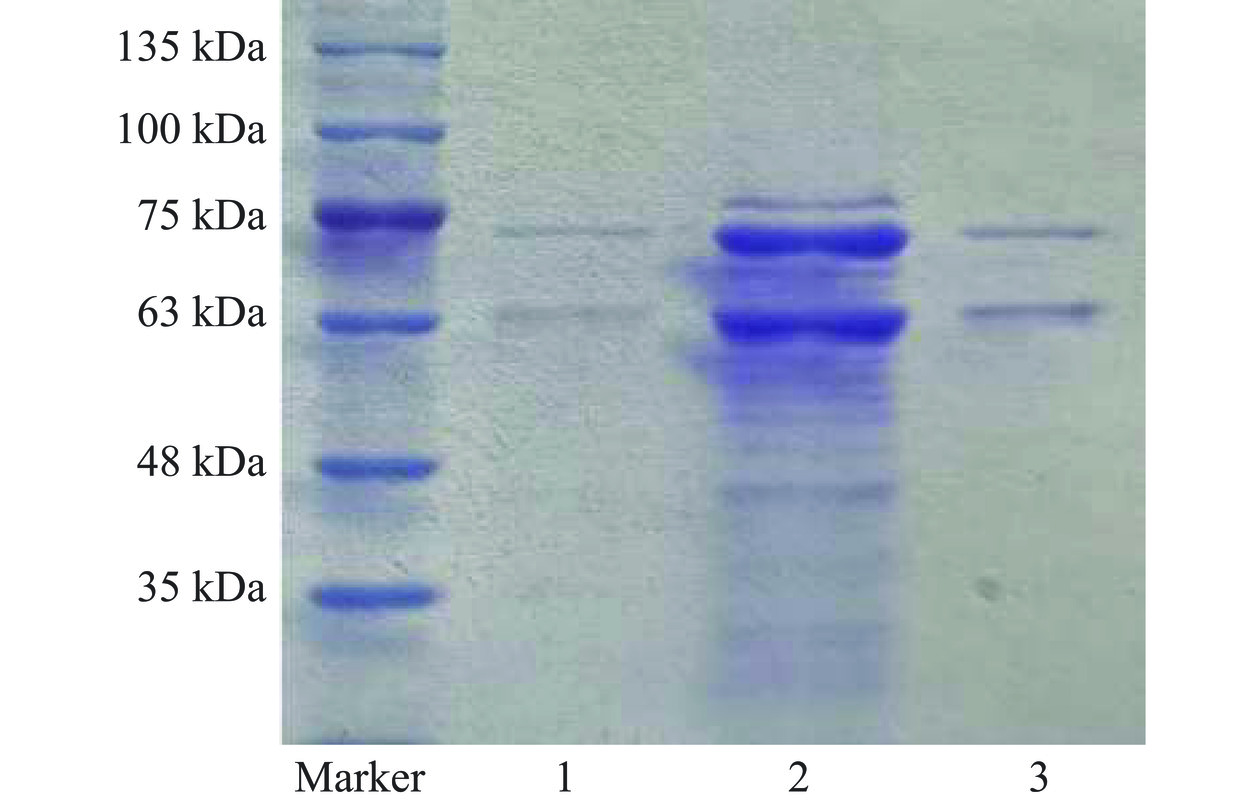
Aeromonas sp. YS-54来源几丁质酶SDS-PAGE电泳分析结果如图3所示,粗酶液经硫酸铵沉淀和凝胶过滤层析后,电泳条带显示分子量约63与75 kDa的两种组分,介于多数几丁质酶20~100 kDa分子量的报道范围[33]。不过,已报道的Aeromonas属来源的几丁质酶分子量差异较大,如来源于Aeromonas sp. DYU Too7、A. schubertii、A. hydrophila subsp. anaerogens A52几丁质酶分子量分别为36、75、110 kDa[23]。本研究中,Aeromonas sp. YS-54来源几丁质酶经硫酸铵沉淀与凝胶过滤层析即获得纯度较高的组分,表明Aeromonas sp. YS-54分泌的杂蛋白较少,有利于该菌株来源几丁质酶的规模化制备。
2.3 Aeromonas sp. YS-54来源几丁质酶的性质研究
2.3.1 最适反应温度和热稳定性
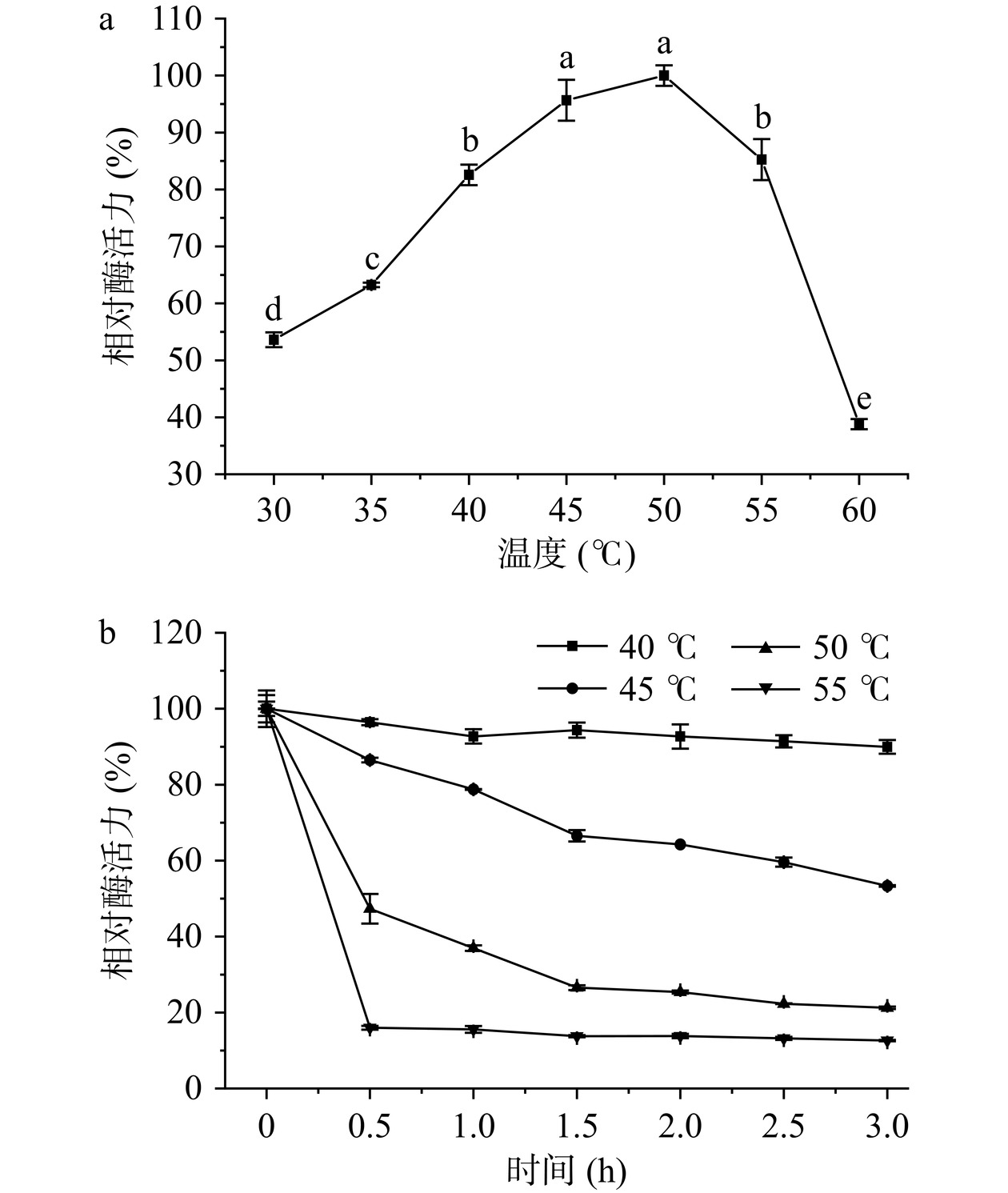
Aeromonas sp. YS-54来源几丁质酶在不同温度下的相对酶活力如图4a所示。随着反应温度的上升,几丁质酶活力呈现先增加后降低趋势,在45~50 ℃达到最高;在40和55 ℃时,几丁质酶的相对酶活力分别为82.56%和85.25%,表明几丁质酶在该温度范围内均保持较高活力。当反应温度高于50 ℃,酶活力呈现显著降低趋势(P<0.05),温度达到60 ℃时,几丁质酶的相对酶活力降至38.81%。本研究中,几丁质酶的最适温度介于Acinetobacter sp. CZW011来源几丁质酶(35 ℃)[34]与V. parahaemolyticus Y-8来源几丁质酶(55 ℃)之间[35]。
几丁质酶在不同温度环境中的热稳定性如图4b所示。几丁质酶在40 ℃保温3 h时的相对酶活力为90.50%,表明酶在40 ℃下具有良好的热稳定性。当几丁质酶在45和50 ℃反应体系中保温1 h,相对酶活力即分别降至78.75%和15.57%,表明在环境温度高于40 ℃时,几丁质酶的稳定性已无法保持。几丁质酶的热稳定性与其结构密切相关,酶的一级结构对热稳定性起决定性作用[36];高温环境不会导致酶二级结构的明显损失,虽保留了整体的球形结构,但酶的三级结构遭到破坏,从而导致酶活力的丧失[27]。根据热稳定性结果,后续研究中使用40 ℃作为Aeromonas sp. YS-54来源几丁质酶的酶解反应温度。
2.3.2 最适反应pH和pH稳定性
Aeromonas sp. YS-54来源几丁质酶在不同反应pH下的酶活力如图5a所示。几丁质酶在pH为5.0的柠檬酸-柠檬酸钾与磷酸盐缓冲液中的相对酶活力均保持最高水平,表明该酶的最适pH为5.0。该几丁质酶在pH9.0的相对酶活力为62.32%,在pH5.0~9.0范围内均具有较高活性;在pH3.0的相对酶活力仅为20.39%,显著低于pH9.0时的酶活力(P<0.05)。Aeromonas sp. YS-54来源几丁质酶在不同pH条件下的稳定性如图5b所示。该几丁质酶在pH5.0条件下保持最高的稳定性,在pH9.0的环境中静置2 h的相对酶活力为78.00%,表明几丁质酶在pH5.0~9.0范围具有较强的环境适应性;而酶在pH3.0条件下静置2 h后,相对酶活力为14.54%,在pH3.0~4.0的环境中难以保持稳定。
Aeromonas sp. YS-54来源几丁质酶的最适pH介于已报道的几丁质酶4.0~8.0的最适pH区间,如P. xylanexedens来源几丁质酶(pH4.5)[28]、C. meiyuanensis来源几丁质酶(pH6.5)[37]、C. shinanonensis来源几丁质酶(pH7.0)[6]。本研究中几丁质酶的最适pH为5.0,推测与酶的催化氨基酸有关。根据报道,几丁质酶催化基序中的Glu解离常数为4.25,弱酸环境可促进Glu对几丁质底物的质子化,从而提升催化效率[38]。
2.3.3 金属离子和生化试剂对几丁质酶活力的影响
金属离子和生化试剂对Aeromonas sp. YS-54来源几丁质酶活力的影响结果如图6a与图6b所示。Ba2+、Co2+、Mg2+对几丁质酶活力具有显著促进作用(P<0.05),分别使几丁质酶的酶活力提升至134.62%、134.90%、137.83%;Fe3+、Cu2+对该几丁质酶活力的抑制作用显著(P<0.05),分别使酶活力降低至38.80%、40.96%;Zn2+的添加使几丁质酶的酶活力降至77.79%;EDTA对几丁质酶活力无明显抑制作用,相对酶活力为95.23%;TritonX-100对几丁质酶活力的促进作用显著(P<0.05),提升至150.87%;SDS显著抑制几丁质酶的酶活力至50.81%(P<0.05),其余金属离子与生化试剂对几丁质酶的酶活力影响不显著。
本研究结果与之类似,Fe3+、Cu2+是大多数几丁质酶的抑制剂,其原因与重金属离子破坏酶蛋白的结构致使其变性有关[12]。部分金属离子对不同来源的几丁质酶活力的影响差异较大,比如本研究中Co2+使几丁质酶酶活力提升至134.90%,而Co2+是Bacillus sp.来源几丁质酶的强抑制剂,酶活力降至原始酶的一半[39];Zn2+使几丁质酶活力降低至77.97%,类似地,Zn2+显著抑制C. meiyuanensis来源几丁质酶的活力至48.57%[37](P<0.05),但对E. antarcticum来源几丁质酶有促进作用,使其酶活力提升至132.00%[19]。EDTA对该几丁质酶活力无明显抑制作用,表明本研究中的几丁质酶不是金属依赖酶[40],因此,添加适宜的金属离子可进一步提升几丁质酶的催化效率。
2.3.4 底物偏好性
Aeromonas sp. YS-54来源几丁质酶对不同底物的偏好性如图7所示,几丁质酶对胶体几丁质的酶活力最高,其次是α-几丁质,对壳聚糖、羧甲基纤维素钠、羧甲基壳聚糖三种底物基本无活性,表明几丁质酶具有较严格的底物特异性。其中,酶解α-几丁质的比活力为7.99 U/mg,为酶解胶体几丁质的34.09%,展现Aeromonas sp. YS-54来源几丁质酶对α-几丁质良好的水解效率。
目前已报道的几丁质酶对α-几丁质酶解效率较低,如A. fumigatus[26]、C. shinanonensis[27]、P. xylanexedens[28]来源几丁质酶对α-几丁质的催化活力分别为0.01、0.18、0.40 U/mg,远低于对胶体几丁质的催化活力。α-几丁质稳定的结晶结构使得其难以被酶解,意味着α-几丁质须通过强酸预处理等化学法手段制备胶体几丁质,使底物结晶度充分降低,形成无定形的结构,方可被几丁质酶降解[41]。但胶体几丁质繁琐的制备过程以及潜在的环境污染隐患,与我国倡导的绿色可持续发展理念相悖。
部分几丁质酶存在几丁质结合域,该结合域特异性识别结晶几丁质并锚定于其表面,破坏几丁质链之间的非共价相互作用,降低底物的结晶度[42]。目前已有引入几丁质结合域实现几丁质酶对α-几丁质活力提升的报道,如向T. atroviride来源不含几丁质结合域的几丁质酶引入S. marcescens来源的几丁质结合域,融合酶对α-几丁质的比活力提升5.50倍[43];向S. albolongus来源几丁质酶引入B. circulans来源的几丁质结合域,融合酶对α-几丁质的催化比活力提升54.00%[29]。本研究中Aeromonas sp. YS-54来源几丁质酶对α-几丁质具有较高的催化活力,推测几丁质酶中含有几丁质结合域,从而有效提升酶对α-几丁质的水解效率。
2.3.5 酶解产物分析
几丁质酶水解胶体几丁质与α-几丁质的酶解产物使用ESI正离子质谱分析,如图8a、图8b所示。结果表明,几丁质酶水解胶体几丁质的产物峰中,四个加钠峰(m/z 243.7、446.6、650.1、853.5)与加钾峰(m/z 260.0、463.0、666.4、871.3)的丰度较高,表明酶解产物的聚合度为1~4。酶解α-几丁质的产物峰中,三个加钠峰(m/z 244.3、447.3、650.2)与加钾峰(m/z 260.1、462.9、668.2)的丰度较高,表明酶解产物的聚合度为1~3。根据报道,C. shinanonensis[6]与P. xylanexedens[37]分泌的外切几丁质酶,酶解产物为(GlcNAc)2;C. meiyuanensis[2]与S. alfalfa[44]分泌的内切几丁质酶,酶解产物的聚合度超过3。因此,Aeromonas sp. YS-54来源几丁质酶兼具内切酶与外切酶的水解特性。
3. 结论
本研究对一株海洋几丁质酶产生菌YS-54进行16S rRNA鉴定、多序列比对与系统进化树的构建,确定该菌株为Aeromonas属。通过Aeromonas sp. YS-54菌株发酵、60%硫酸铵盐析、Sephadex G-100凝胶过滤层析制备的几丁质酶比活力为23.44 U/mg,纯化倍数为7.61倍,回收率为17.29%;SDS-PAGE确定几丁质酶的分子质量为63与75 kDa。Aeromonas sp. YS-54来源几丁质酶最适反应温度为45~50 ℃,最适pH为5.0,在不高于40 ℃与pH5.0~9.0的环境中保持良好的稳定性。Ba2+、Co2+、Mg2+和TritonX-100对几丁质酶活力起到显著促进作用,Fe3+、Cu2+、SDS显著抑制了几丁质酶活力(P<0.05)。几丁质酶对胶体几丁质与α-几丁质均有良好的催化活力,具有较严格的底物特异性,其中催化α-几丁质的比活力为7.99 U/mg。几丁质酶水解胶体几丁质的产物聚合度为1~4,水解α-几丁质的产物聚合度为1~3,酶解方式兼具内切与外切。
综上,Aeromonas sp. YS-54来源几丁质酶在较宽的温度和pH范围内保持稳定,同时对α-几丁质具有良好的水解能力,将为海洋来源酶的规模化开发与甲壳类废弃物的综合利用提供理论依据与技术支撑。
-
表 1 Aeromonas sp. YS-54来源几丁质酶纯化效果
Table 1 Purification effects on chitinase from Aeromonas sp. YS-54
制备步骤 总活力
(U)总蛋白
(mg)比活力
(U/mg)纯化倍数 回收率
(%)粗酶液 275.25 89.39 3.08 1.00 100.00 60%硫酸铵沉淀 155.37 15.13 10.27 3.33 56.45 凝胶过滤层析 47.58 2.03 23.44 7.61 17.29 -
[1] 刘宇, 方国宏, 戎素红, 等. 虾、蟹壳利用的研究进展[J]. 食品安全质量检测学报,2018,9(3):461−466. [LIU Y, FANG G H, RONG S H, et al. Research progress on the utilization of shrimp and crab shells[J]. Journal of Food Safety and Quality,2018,9(3):461−466.] doi: 10.3969/j.issn.2095-0381.2018.03.001 LIU Y, FANG G H, RONG S H, et al. Research progress on the utilization of shrimp and crab shells[J]. Journal of Food Safety and Quality, 2018, 9(3): 461−466. doi: 10.3969/j.issn.2095-0381.2018.03.001
[2] ZHANG A L, HE Y M, WEI G G, et al. Molecular characterization of a novel chitinase CmChi1 from Chitinolyticbacter meiyuanensis SYBC-H1 and its use in N-acetyl-D-glucosamine production[J]. Biotechnology for Biofuels,2018,11:179. doi: 10.1186/s13068-018-1169-x
[3] RAHAYU A P, ISLAMI A F, SAPUTRA E, et al. The impact of the different types of acid solution on the extraction and adsorption performance of chitin from shrimp shell waste[J]. International Journal of Biological Macromolecules,2022,194:843−850. doi: 10.1016/j.ijbiomac.2021.11.137
[4] SEBASTIAN J, ROUISSI T, BRAR S K, et al. Microwave-assisted extraction of chitosan from Rhizopus oryzae NRRL 1526 biomass[J]. Carbohydrate Polymers,2019,219:431−440. doi: 10.1016/j.carbpol.2019.05.047
[5] LUCAS A J D S, ORESTE E Q, COSTA H L G, et al. Extraction, physicochemical characterization, and morphological properties of chitin and chitosan from cuticles of edible insects[J]. Food Chemistry,2021,343:128550. doi: 10.1016/j.foodchem.2020.128550
[6] RANI T S, MADHUPRAKASH J, PODILE A R. Chitinase-E from Chitiniphilus shinanonensis generates chitobiose from chitin flakes[J]. International Journal of Biological Macromolecules,2020,163:1037−1043. doi: 10.1016/j.ijbiomac.2020.07.052
[7] 刘力睿, 潘杰, 李猛, 等. 微生物几丁质酶的研究进展、应用及展望[J]. 生物资源,2020,42(5):494−504. [LIU L R, PAN J, LI M, et al. Research progress, application and prospects of microbial chitinase[J]. Biotic Resources,2020,42(5):494−504.] LIU L R, PAN J, LI M, et al. Research progress, application and prospects of microbial chitinase[J]. Biotic Resources, 2020, 42(5): 494−504.
[8] PATEL S, GOYAL A. Chitin and chitinase:Role in pathogenicity, allergenicity and health[J]. International Journal of Biological Macromolecules,2017,97:331−338. doi: 10.1016/j.ijbiomac.2017.01.042
[9] MA X, GÖZAYDIN G, YANG H, et al. Upcycling chitin-containing waste into organonitrogen chemicals via an integrated process[J]. Proceedings of the National Academy of Sciences of the United States of America,2020,117(14):7719−7728.
[10] 赵沙, 颜子娟, 张舒, 等. 细菌几丁质酶结构、功能及分子设计的研究进展[J]. 生物化学与生物物理进展,2022,49(7):1179−1191. [ZHAO S, YAN Z J, ZHANG S, et al. Research progress on structure, function and molecular design of bacterial chitinase[J]. Progress in Biochemistry and Biophysics,2022,49(7):1179−1191.] ZHAO S, YAN Z J, ZHANG S, et al. Research progress on structure, function and molecular design of bacterial chitinase[J]. Progress in Biochemistry and Biophysics, 2022, 49(7): 1179−1191.
[11] 周玉玲, 蒋思婧, 贺妮莎, 等. 微生物几丁质酶研究进展及其在N-乙酰氨基葡萄糖制备中的应用[J]. 微生物学报,2021,61(8):2192−2204. [ZHOU Y L, JIANG S J, HE N S, et al. Research progress of microbial chitinase and its application in the preparation of N-acetylglucosamine[J]. Acta Microbiologica Sinica,2021,61(8):2192−2204.] ZHOU Y L, JIANG S J, HE N S, et al. Research progress of microbial chitinase and its application in the preparation of N-acetylglucosamine[J]. Acta Microbiologica Sinica, 2021, 61(8): 2192−2204.
[12] LÜ J R, ZHANG Y M, MA M H, et al. Characterization of chitinase from Exiguobacterium antarcticum and its bioconversion of crayfish shell into chitin oligosaccharides[J]. Food Research International,2022,158:111517. doi: 10.1016/j.foodres.2022.111517
[13] 高兆建, 丁飞鸿, 陈欢, 等. 产黄青霉抗真菌几丁质酶的纯化及特性分析[J]. 食品科学,2021,42(14):129−136. [GAO Z J, DING F H, CHEN H, et al. Purification and characterization of antifungal chitinase from Penicillium chrysogenum[J]. Food Science,2021,42(14):129−136.] doi: 10.7506/spkx1002-6630-20200229-329 GAO Z J, DING F H, CHEN H, et al. Purification and characterization of antifungal chitinase from Penicillium chrysogenum[J]. Food Science, 2021, 42(14): 129−136. doi: 10.7506/spkx1002-6630-20200229-329
[14] CHEN W, JIANG X, YANG Q. Glycoside hydrolase family 18 chitinases:The known and the unknown[J]. Biotechnology Advances,2020,43:107553. doi: 10.1016/j.biotechadv.2020.107553
[15] OLIVERIRA S T, AZEVEDO M I G, CUNHA R M S, et al. Structural and functional features of a class VI chitinase from cashew (Anacardium occidentale L.) with antifungal properties[J]. Phytochemistry,2020,180:112527. doi: 10.1016/j.phytochem.2020.112527
[16] HALDER S K, MAITY C, JANA A, et al. Chitinases biosynthesis by immobilized Aeromonas hydrophila SBK1 by prawn shells valorization and application of enzyme cocktail for fungal protoplast preparation[J]. Journal of Bioscience and Bioengineering,2014,117(2):170−177. doi: 10.1016/j.jbiosc.2013.07.011
[17] AKEED Y, ATRASH F, NAFFAA W. Partial purification and characterization of chitinase produced by Bacillus licheniformis B307[J]. Heliyon,2020,6(5):E03858. doi: 10.1016/j.heliyon.2020.e03858
[18] BHUVANACHANDRA B, PODILE A R. A transglycosylating chitinase from Chitiniphilus shinanonensis (CsChiL) hydrolyzes chitin in a processive manner[J]. International Journal of Biological Macromolecules,2020,145:1−10. doi: 10.1016/j.ijbiomac.2019.12.134
[19] FU X, GUO Y X, JIN Y G, et al. Bioconversion of chitin waste using a cold-adapted chitinase to produce chitin oligosaccharides[J]. LWT,2020,133:109863. doi: 10.1016/j.lwt.2020.109863
[20] YANO S, KANNO H, TSUHAKO H, et al. Cloning, expression, and characterization of a GH 19-type chitinase with antifungal activity from Lysobacter sp. MK9-1[J]. Journal of Bioscience and Bioengineering,2021,131(4):348−355. doi: 10.1016/j.jbiosc.2020.11.005
[21] LEE Y S, KIM K Y. Statistical optimization of medium components for chitinase production by Pseudomonas fluorescens strain HN1205:role of chitinase on egg hatching inhibition of root-knot nematode[J]. Biotechnology & Biotechnological Equipment,2015,29(3):470−478.
[22] WANG S L, LIN C L, LIANG T W, et al. Conversion of squid pen by Serratia ureilytica for the production of enzymes and antioxidants[J]. Bioresource Technology,2009,100(1):316−323. doi: 10.1016/j.biortech.2008.06.026
[23] HALDER S K, JANA A, PAUL T et al. Purification and biochemical characterization of chitinase of Aeromonas hydrophila SBK1 biosynthesized using crustacean shell[J]. Biocatalysis and Agricultural Biotechnology,2016,5:211−218. doi: 10.1016/j.bcab.2015.11.003
[24] HALDER S K, MAITY C, JANA A, et al. Proficient biodegradation of shrimp shell waste by Aeromonas hydrophila SBK1 for the concomitant production of antifungal chitinase and antioxidant chitosaccharides[J]. International Biodeterioration & Biodegradation,2013,79:88−97.
[25] WANG C Y, CHEN X M, ZHOU N, et al. Property and function of a novel chitinase containing dual catalytic domains capable of converting chitin into N-acetyl-D-glucosamine[J]. Frontiers in Microbiology,2022,13:790301. doi: 10.3389/fmicb.2022.790301
[26] WU Y L, WANG S, YANG D F, et al. The discovery, enzymatic characterization and functional analysis of a newly isolated chitinase from marine-derived fungus Aspergillus fumigatus df347[J]. Marine Drugs,2022,20(8):520. doi: 10.3390/md20080520
[27] BHVANACHANDRA B, SIVARAMAKRISHNA D, ALIM S, et al. Deciphering the thermotolerance of chitinase O from Chitiniphilus shinanonensis by in vitro and in silico studies[J]. International Journal of Biological Macromolecules,2022,210:44−52. doi: 10.1016/j.ijbiomac.2022.05.013
[28] ZHANG W J, MA J W, YAN Q J, et al. Biochemical characterization of a novel acidic chitinase with antifungal activity from Paenibacillus xylanexedens Z2-4[J]. International Journal of Biological Macromolecules,2021,182:1528−1536. doi: 10.1016/j.ijbiomac.2021.05.111
[29] SU H P, GAO L, SUN J N, et al. Engineering a carbohydrate binding module to enhance chitinase catalytic efficiency on insoluble chitinous substrate[J]. Food Chemistry,2021,355:129462. doi: 10.1016/j.foodchem.2021.129462
[30] 王燕, 赵力超, 陈洁兰, 等. 菠萝蛋白酶工业化提取工艺的改良及酶学性质研究[J]. 食品工业科技,2011,32(10):353−357. [WANG Y, ZHAO L C, CHEN J L, et al. Study on improvement of industrial extraction of bromelain and its enzymology characterization[J]. Science and Technology of Food Industry,2011,32(10):353−357.] WANG Y, ZHAO L C, CHEN J L, et al. Study on improvement of industrial extraction of bromelain and its enzymology characterization[J]. Science and Technology of Food Industry, 2011, 32(10): 353−357.
[31] 陈茜文, 王佳丽, 许春雨. 克氏原螯虾壳膜几丁质酶的分离纯化[J]. 食品工业科技,2018,39(23):159−163. [CHEN Q W, WANG J L, XU C Y. Isolation and purification of chitinase from shellfish of Procambarus clarkia[J]. Science and Technology of Food Industry,2018,39(23):159−163.] CHEN Q W, WANG J L, XU C Y. Isolation and purification of chitinase from shellfish of Procambarus clarkia[J]. Science and Technology of Food Industry, 2018, 39(23): 159−163.
[32] 徐勤茜, 朱国威, 赵梓伶, 等. 酸橙内生菌Bacillus thuringiensis Bt028几丁质酶的分离纯化及其酶学性质[J]. 食品工业科技,2022,43(11):159−166. [XU Q Q, ZHU G W, ZHAO Z L, et al. Separation, purification and characterization of chitinase of the endophytic bacterium Bacillus thuringiensis Bt028 isolated from sour orange[J]. Science and Technology of Food Industry,2022,43(11):159−166.] XU Q Q, ZHU G W, ZHAO Z L, et al. Separation, purification and characterization of chitinase of the endophytic bacterium Bacillus thuringiensis Bt028 isolated from sour orange[J]. Science and Technology of Food Industry, 2022, 43(11): 159−166.
[33] QIU S T, ZHOU S P, TAN Y, et al. Biodegradation and prospect of polysaccharide from crustaceans[J]. Marine Drugs,2022,20(5):310. doi: 10.3390/md20050310
[34] 宋阳, 陈梦, 吴新财, 等. 产几丁质酶菌株Acinetobacter sp. CZW011的筛选鉴定与酶学性质研究[J]. 中国食品添加剂,2022,33(11):1−8. [SONG Y, CHEN M, WU X C, et al. Screening, identification and enzymatic properties of Acinetobacter sp. CZW011 strain produced by chitinase[J]. China Food Additives,2022,33(11):1−8.] SONG Y, CHEN M, WU X C, et al. Screening, identification and enzymatic properties of Acinetobacter sp. CZW011 strain produced by chitinase[J]. China Food Additives, 2022, 33(11): 1−8.
[35] 严佳佳, 尤田, 张雪梅, 等. 一种海洋几丁质酶产生菌的筛选及酶学性质研究[J]. 食品与发酵工业,2023,49(13):40−48. [YAN J J, YOU T, ZHANG X M, et al. Screening of a marine chitinase-producing bacterium and its enzymatic properties[J]. Food and Fermentation Industry,2023,49(13):40−48.] YAN J J, YOU T, ZHANG X M, et al. Screening of a marine chitinase-producing bacterium and its enzymatic properties[J]. Food and Fermentation Industry, 2023, 49(13): 40−48.
[36] MATHEW G, MADHAVAN A, ARUN K B, et al. Thermophilic chitinases:Structural, functional and engineering attributes for industrial applications[J]. Applied Biochemistry and Biotechnology,2021,193:142−164. doi: 10.1007/s12010-020-03416-5
[37] HAO Z K, WU H G, YANG M L, et al. Cloning, expression and 3D structure prediction of chitinase from Chitinolyticbacter meiyuanensis SYBC-H1[J]. International Journal of Molecular Sciences,2016,17:825. doi: 10.3390/ijms17060825
[38] YU G Q, LIU G H, LIU T Y, et al. Activities of family 18 chitinases on amorphous regenerated chitin thin films and dissolved chitin oligosaccharides:Comparison with family 19 chitinases[J]. Biomacromolecules 2023, 24(2):566−575.
[39] BHUSHAN B, HOONDAL G S. Isolation, purification and properties of a thermostable chitinase from an alkalophilic Bacillus sp. BG-11[J]. Biotechnology Letters,1998,20:157−159. doi: 10.1023/A:1005328508227
[40] ZHANG A L, MO X F, ZHOU N, et al. A novel bacterial β-N-acetyl glucosaminidase from Chitinolyticbacter meiyuanensis possessing transglycosylation and reverse hydrolysis activities[J]. Biotechnology for Biofuels,2020,13:115. doi: 10.1186/s13068-020-01754-4
[41] SUN B, ZHAO X C, XU B R, et al. Discovering and designing a chimeric hyperthermophilic chitinase for crystalline chitin degradation[J]. ACS Sustainable Chemistry & Engineering,2023,11(12):4690−4698.
[42] KITAOKU Y, TAIRA T, NUMATA T, et al. Structure, mechanism, and phylogeny of LysM-chitinase conjugates specifically found in fern plants[J]. Plant Science,2022,321:111310. doi: 10.1016/j.plantsci.2022.111310
[43] MATROODI S, MOTALLEBI M, ZAMANI M, et al. Designing a new chitinase with more chitin binding and antifungal activity[J]. World Journal of Microbiology & Biotechnology,2013,29:1517−1523.
[44] LÜ C Y, GU T Y, MA R, et al. Biochemical characterization of a GH19 chitinase from Streptomyces alfalfae and its applications in crystalline chitin conversion and biocontrol[J]. International Journal of Biological Macromolecules,2021,167:193−201. doi: 10.1016/j.ijbiomac.2020.11.178





 下载:
下载:

 下载:
下载:



