Preparation of Porcine Small Intestinal Heparin by High Hydrostatic Pressure Enzymatic Hydrolysis and Its Stability
-
摘要: 本研究以猪小肠粘膜为原料,通过响应面试验优化高静压酶解法提取肝素(Heparin,Hep)的最佳工艺,研究大孔树脂纯化Hep吸附条件,并探讨Hep的稳定性(pH、温度、光照)。结果表明:最佳酶解工艺为选取碱性蛋白酶,时间3.1 h,温度55 ℃,pH9.5,压力100 MPa,酶底物比9%,盐浓度2.0%,测得Hep实际平均浓度为11.56±0.12 U/mL;利用D958树脂纯化Hep,上样流速1.5 BV/h,洗脱液浓度4 mol/L NaCl,洗脱流速1.5 BV/h,纯化后Hep纯度可达68.75%,即达到电泳纯;在稳定性研究中,Hep在pH为7.5时稳定性最好,温度在40 ℃时具有较好稳定性,光照对Hep稳定性没有影响。本研究可大幅度提升Hep的提取效果,为猪小肠高值化加工利用提供理论和技术支持。Abstract: In this study, the mucosa of porcine small intestine was used as the raw material to optimize the optimal process for the extraction of heparin (Hep) by high hydrostatic pressure enzymatic hydrolysis by response surface test, to study the adsorption conditions of Hep purified by macroporous resin, and to explore the stability of Hep (pH, temperature, and light). The results showed that the optimal enzymatic process was alkaline protease, 3.1 h, 55 ℃, pH9.5, pressure 100 MPa, enzyme addition 9%, salt concentration 2.0%, the actual average concentration of Hep was measured to be 11.56±0.12 U/mL. The purification of Hep was carried out by using the D958 resin, with the up-sampling flow rate of 1.5 BV/h, the concentration of the eluent of 4 mol/L NaCl, and the elution flow rate of 1.5 BV/h, the purity of Hep could reach 68.75% after purification, and the electrophoretic purity achieved. In the stability study, Hep had the best stability at pH7.5, better stability at 40 ℃, and light had no effect on the stability of Hep. This study can greatly improve the extraction effect of Hep and provide theoretical and technical support for the high value processing and utilization of pig small intestine.
-
肝素(Heparin,Hep)是由动物结缔组织肥大细胞产生的不同分子长度的粘多糖,其自身具备天然的抗凝血性质[1−2]。肝素多糖最常见的结构是与钠离子结合形成肝素钠,此种结构具备优异的储存性,可以长时间保证肝素的活性及药效,其功能结构部位仍然是肝素阴离子[3−4]。Hep的主要药物功能包括:作为抗凝剂预防血液凝固;血栓、肺栓塞等血液疾病的预防及治疗;作为溶血栓的维持药剂;透析、人工心肺时的血液抗凝药物;各种疾病早期的血液并发症的预防治疗等[5−8]。
生物体内Hep以糖蛋白的结构形式存在,目前常用提取方法包括酶解法、碱性盐析法和超声辅助提取法等[9−10]。其中酶解法为Hep提取最常用的方法,因为蛋白酶的特异性能够准确破坏Hep与蛋白结合的共价键,从而使Hep释放出来,该方法能够最大程度保留Hep的结构,但是存在产物杂质多,酶解效率低等问题[11−12]。近年来,高静压技术在多糖提取领域中有着广泛的应用[13−14],由于高压(100~1000 MPa)会破坏细胞壁,导致细胞渗透性增加,提高传质速率和目标物质的溶解度,从而提高生产效率[15]。此外,高静压技术还可与酶解工艺结合提取多糖。De等[16]利用高静压(200~600 MPa)联合纤维素酶处理苹果渣,得到低分子量可溶性多糖,并且使其保水能力、持油能力和乳化活性提高了8倍多。Perez-Lopez等[17]使用食品级酶Viscozyme (R) L和高静压同时进行酶解豆渣,增加豆渣中可溶性膳食纤维,开发其潜在的益生作用。由此可见,采用高静压酶解法技术不仅提高多糖提取效率,还能增强其生物活性。
因此,本文利用高静压酶解技术提取猪小肠中Hep,采用树脂吸附技术对Hep粗品进行分离纯化,通过单因素实验和响应面试验优化高静压酶解工艺和纯化工艺,并对Hep的稳定性(pH、温度、光照)进行评价,以期可提升产品品质与附加值,为畜产品副产物高值化加工利用提供理论与技术的支持。
1. 材料与方法
1.1 材料与仪器
猪小肠 东北农业大学三花猪;大孔树脂D958、D254、D208 郑州勤实科技有限公司;树脂D312 新乡赛普瑞特有限公司提供;肝素标准品、碱性蛋白酶(18000 U/g)、木瓜蛋白酶(52000 U/g)、胃蛋白酶(14000 U/g)、Protamex复合蛋白酶(13200 U/g) Sigma公司;肝素试剂盒 上海梵太生物科技有限公司;吐温20、Tris-HCl、HCl、NaOH、醋酸钡 北京索莱宝科技有限公司。
L-100-1S-1恒流蠕动泵 兰格恒流泵有限公司;SHZ-28A水浴振荡器 哈东联电子技术开发有限公司;XQ-FD-10N冻干机 北京博医康试验仪器有限公司;TG-600酶标仪 Thermo Fisher科技公司;L-539超微分子压缩仪 沈阳人和机电工程设备有限公司;Power Pac HC电泳仪 BioRad公司。
1.2 实验方法
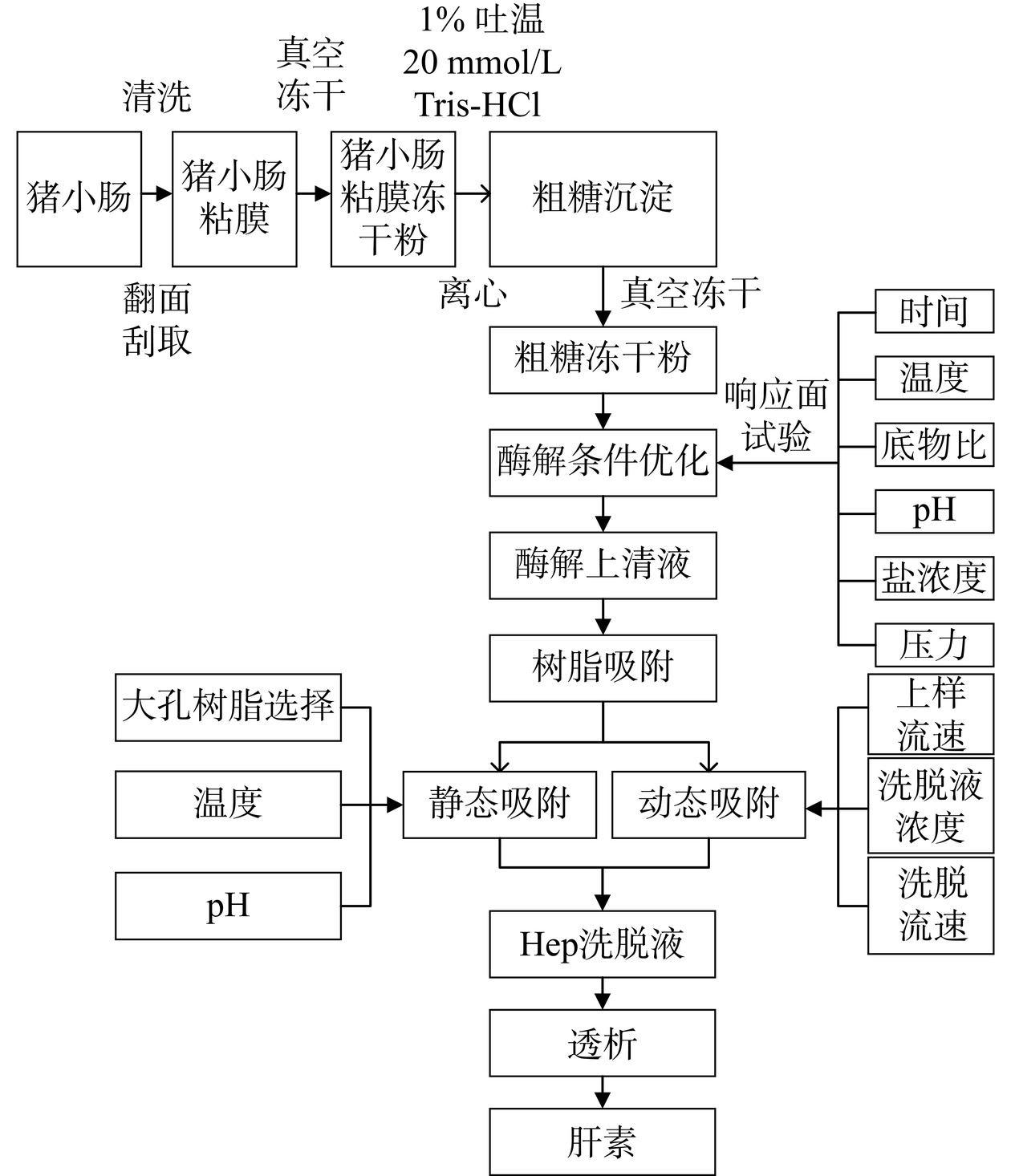
1.2.1 实验流程
本实验整体流程如图1所示。
1.2.2 原料预处理
参照杨红等[18]方法略作改动。将猪小肠清洗、翻面,刮取猪肠内表面粘膜,真空冷冻干燥后精细研磨,过100目筛。将猪小肠粘膜冻干粉按1:100(m/v)比例溶于pH8.5含1%吐温20 mmol/L Tris-HCl中,在4 ℃、10000 r/min离心20 min,沉淀收集冻干过100目筛得到粗糖冻干粉,于4 ℃保存备用。
1.2.3 猪小肠粘膜冻干粉基本成分测定
水分含量测定参考GB 5009.3-2016,采用直接干燥法[19];脂肪含量测定参考GB 5009.6-2016,采用索氏抽提法[20];灰分含量测定参考GB 5009.4-2016,采用马福炉高温灰化法[21];总蛋白含量测定参考GB 5009.5-2016,采用分光光度法[22];总糖含量测定参考GB 5009.8-2016,采用酸水解法[23]。
1.2.4 高静压酶解法提取猪小肠肝素工艺优化
1.2.4.1 最佳用酶选择
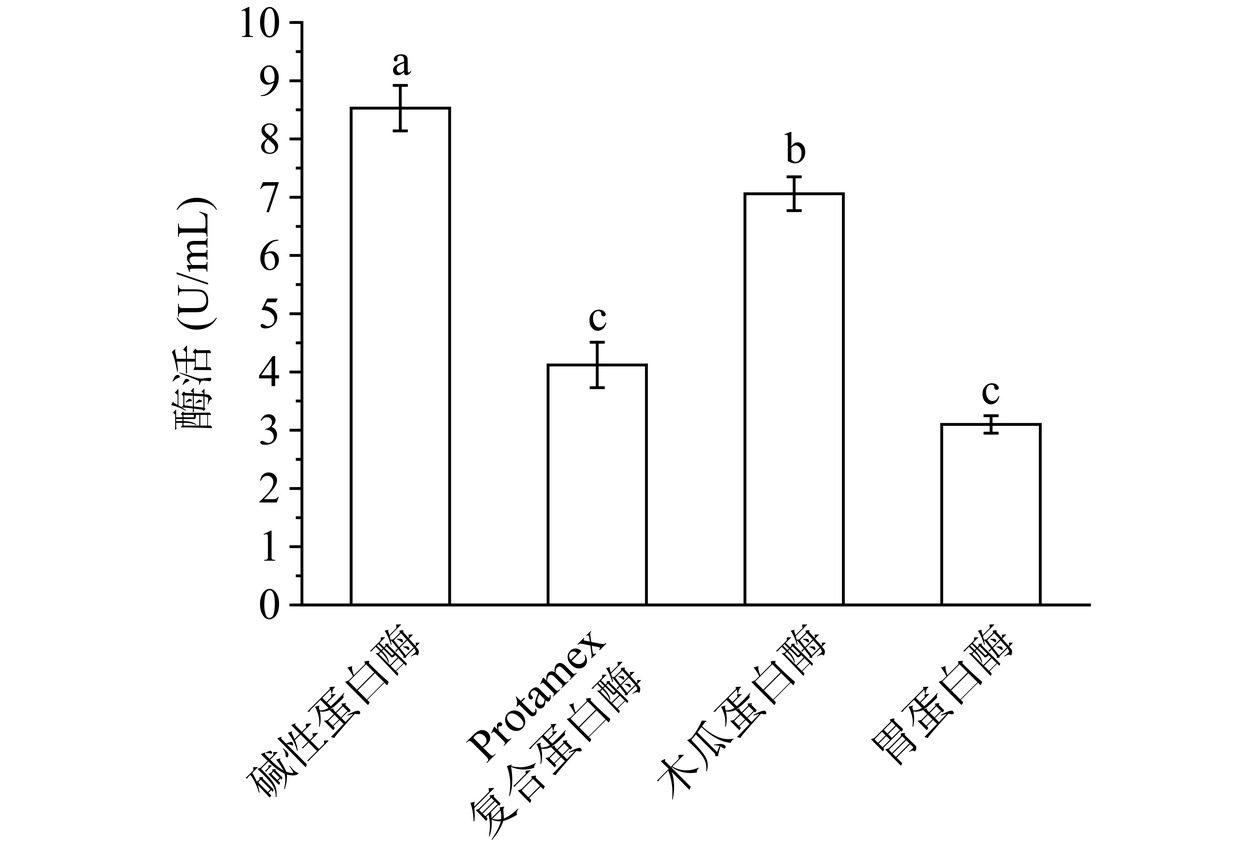
准确称取1 g粗糖冻干粉溶解于50 mL去离子水中,调节NaCl盐浓度1.5%,选取碱性蛋白酶、Protamex复合蛋白酶、木瓜蛋白酶和胃蛋白酶,在各自最适条件下(表1)分别置于水浴锅中水解3 h,在4 ℃条件下以8000 r/min转速离心10 min,检测酶解液中Hep浓度。
表 1 酶最佳反应条件Table 1. Optimum reaction condition of enzyme蛋白酶种类 pH 温度(℃) 添加酶活(U/g) 碱性蛋白酶 9.0 45 18000 Protamex复合蛋白酶 7.5 45 13200 木瓜蛋白酶 7.0 55 52000 胃蛋白酶 3.0 37 14000 Hep浓度测定方法如下:参照Hep试剂盒说明书。采用天青A比色法,将待测样品与天青A显色液按体积比1:1加入试管中,混匀后检测505 nm处吸光度并根据标准曲线公式(1)计算Hep浓度。
Y=0.2271x−0.0007(R2=0.9991) (1) 1.2.4.2 单因素实验
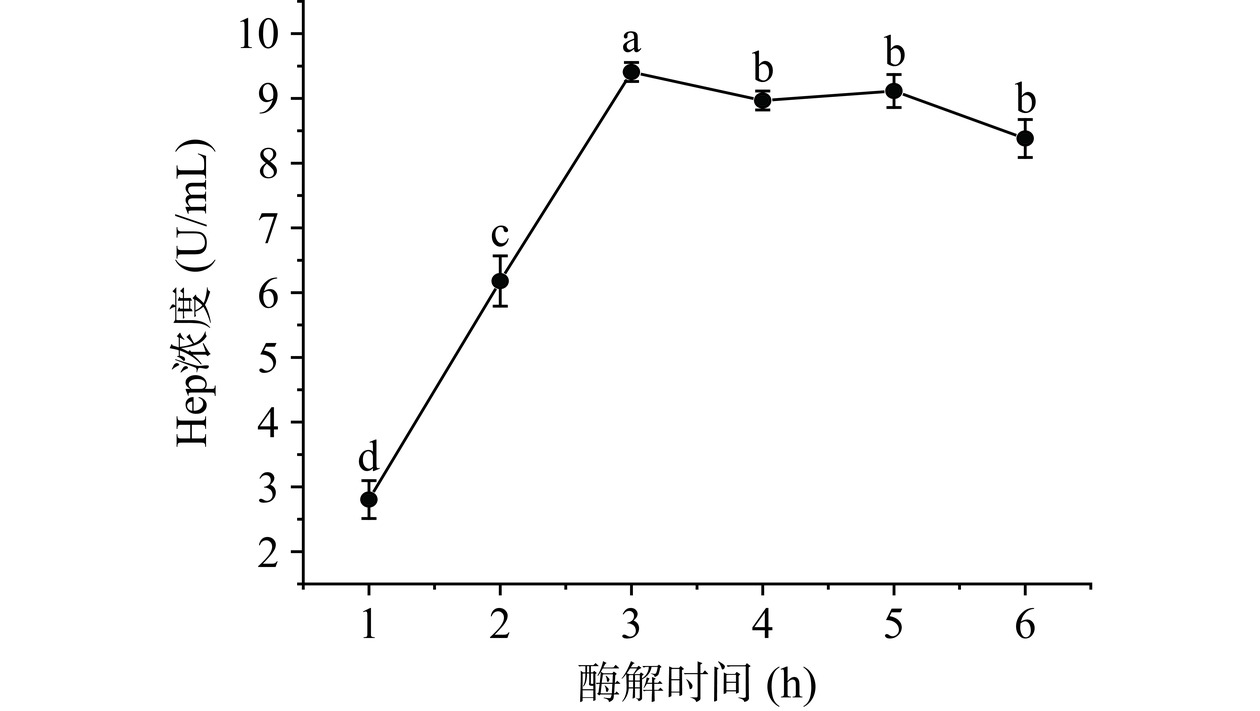
a. 酶解时间对Hep浓度影响:准确称取1 g粗糖冻干粉溶解于50 mL去离子水中,调节盐浓度1.5%,碱性蛋白酶与底物比9%,压力为100 MPa,pH8.0,温度45 ℃,分别酶解1、2、3、4、5、6 h后,80 ℃灭活10 min后,离心取上清液测定Hep浓度。
b. 酶解温度对Hep浓度影响:准确称取1 g粗糖冻干粉溶解于50 mL去离子水中,调节盐浓度1.5%,碱性蛋白酶与底物比9%,压力100 MPa,pH8.0,分别以45、50、55、60 ℃酶解3 h后,80 ℃灭活10 min,离心取上清液测定Hep浓度。
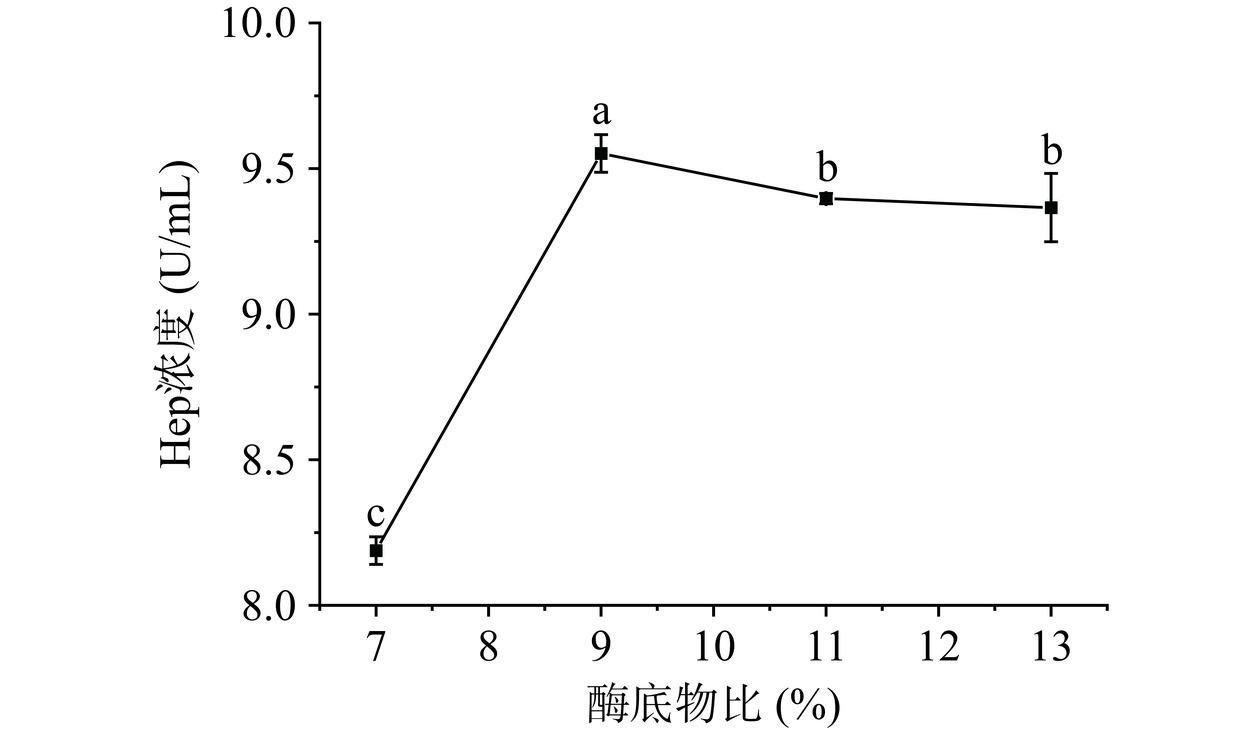
c. 酶底物比对Hep浓度影响:准确称取1 g粗糖冻干粉溶解于50 mL去离子水中,调节盐浓度1.5%,分别以酶底物比7%、9%、11%、13%添加碱性蛋白酶,压力100 MPa,温度45 ℃,pH8.0,酶解3 h后,80 ℃灭活10 min,离心取上清液测定Hep浓度。
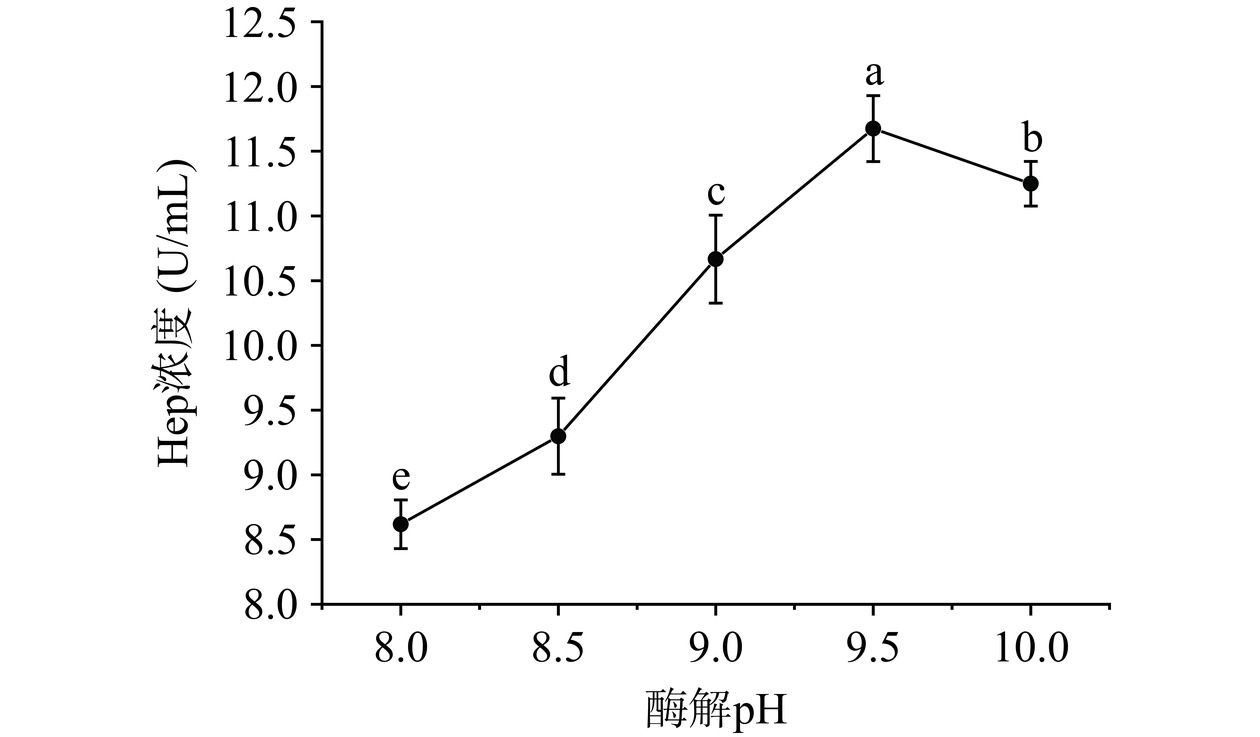
d. 酶解pH对Hep浓度影响:准确称取1 g粗糖冻干粉溶解于50 mL去离子水中,调节盐浓度1.5%,碱性蛋白酶与底物比9%,压力100 MPa,温度45 ℃,分别调节pH为8.0、8.5、9.0、9.5、10.0并酶解3 h后,80 ℃灭活10 min,离心取上清液测定Hep浓度。
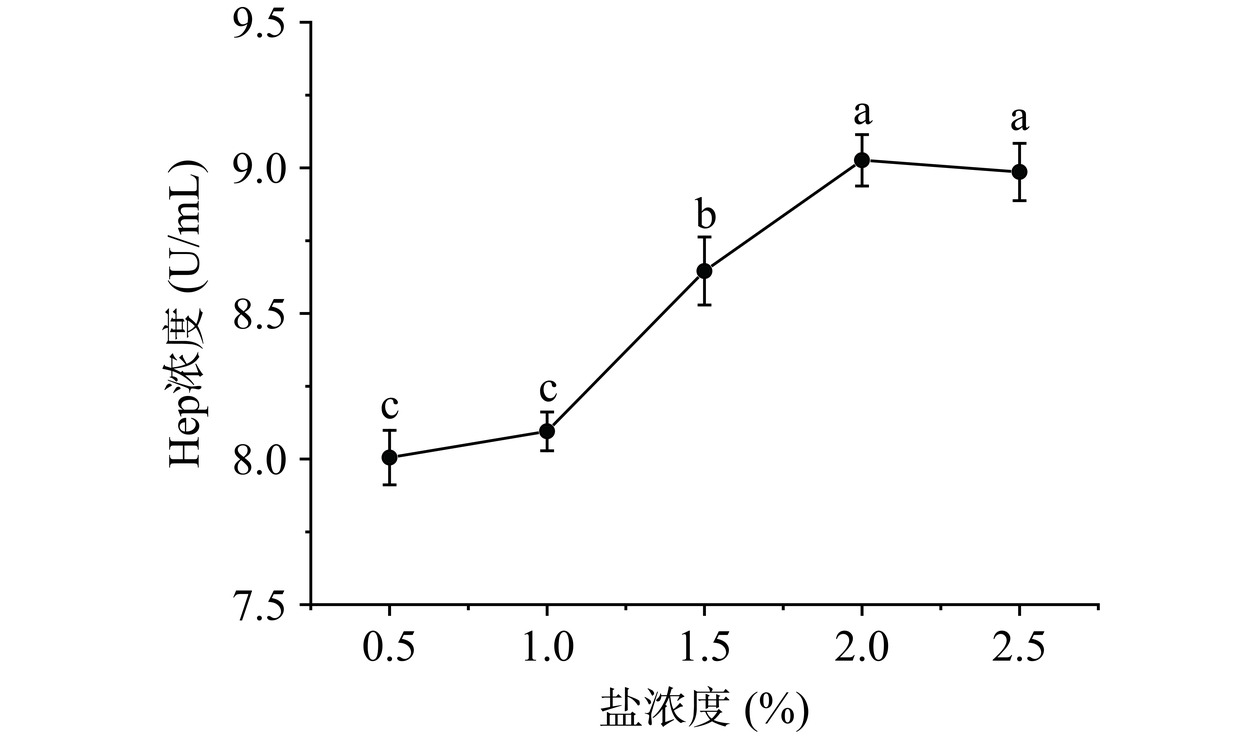
e. 盐浓度对Hep浓度影响:准确称取1 g粗糖冻干粉溶解于50 mL去离子水中,调节pH8.0,碱性蛋白酶酶底物比9%,压力100 MPa,温度45 ℃,分别调节盐浓度为0.5%、1.0%、1.5%、2.0%、2.5%,酶解3 h后,80 ℃灭活10 min,离心取上清液测定Hep浓度。
f. 酶解压力对Hep浓度影响:准确称取1 g粗糖冻干粉溶解于50 mL去离子水中,调节盐浓度1.5%,pH8.0,碱性蛋白酶与酶底物比9%,温度45 ℃,分别调节压力为0.1、50、100、150、200 MPa酶解3 h后,80 ℃灭活10 min,离心取上清液测定Hep浓度。
1.2.4.3 响应面优化试验
根据单因素实验结果选取最具影响力四个因素(时间、温度、pH、压力),分别选择适宜水平,采用Design Expert软件利用Box-Behnken法,设计四因素三水平响应面试验,试验因素水平如表2。
表 2 响应面试验因素水平Table 2. Response surface test factor level因素 水平 −1 0 1 A 酶解时间(h) 2 3 4 B 酶解温度(℃) 50 55 60 C 酶解pH 9.0 9.5 10.0 D 酶解压力(MPa) 50 100 150 1.2.5 大孔树脂分离纯化猪小肠肝素工艺优化
1.2.5.1 大孔树脂预处理
参照Zhao等[24]方法略作改动。称取适量D958、D254、D312、D208大孔树脂,置于3倍体积去离子水中浸泡24 h后,以去离子水平衡至透过液澄清,先后用4% HCl和4% NaOH溶液冲洗树脂柱4 h,去离子水冲洗至透过液为中性,置于4 ℃去离子水中备用。
1.2.5.2 静态吸附参数筛选
a. 大孔树脂选择:称取10 g上述已预处理大孔吸附树脂置于具塞三角瓶中,加入150 mL酶解液,40 ℃水浴振荡吸附24 h,测定吸附前后溶液中Hep浓度。吸附饱和后先以去离子水清洗,随后利用4 mol/L NaCl溶液进行解吸24 h,测定解吸后溶液中Hep浓度。根据吸附量qe、E(%)吸附率和解吸率D(%)选择适宜的大孔树脂,计算公式如下:
qe=(C0−Ce)×Vi (2) E(%)=(C0−Ce)/C0×100 (3) D(%)=CdVd/Vi(C0−Ce)×100 (4) 式中,qe:平衡吸附量(U);Vi:样液体积(mL);C0:肝素初始浓度(U/mL);Ce:透过液中肝素浓度(U/mL);Cd:解吸液中肝素浓度(U/mL);Vd:解吸液体积(mL)。
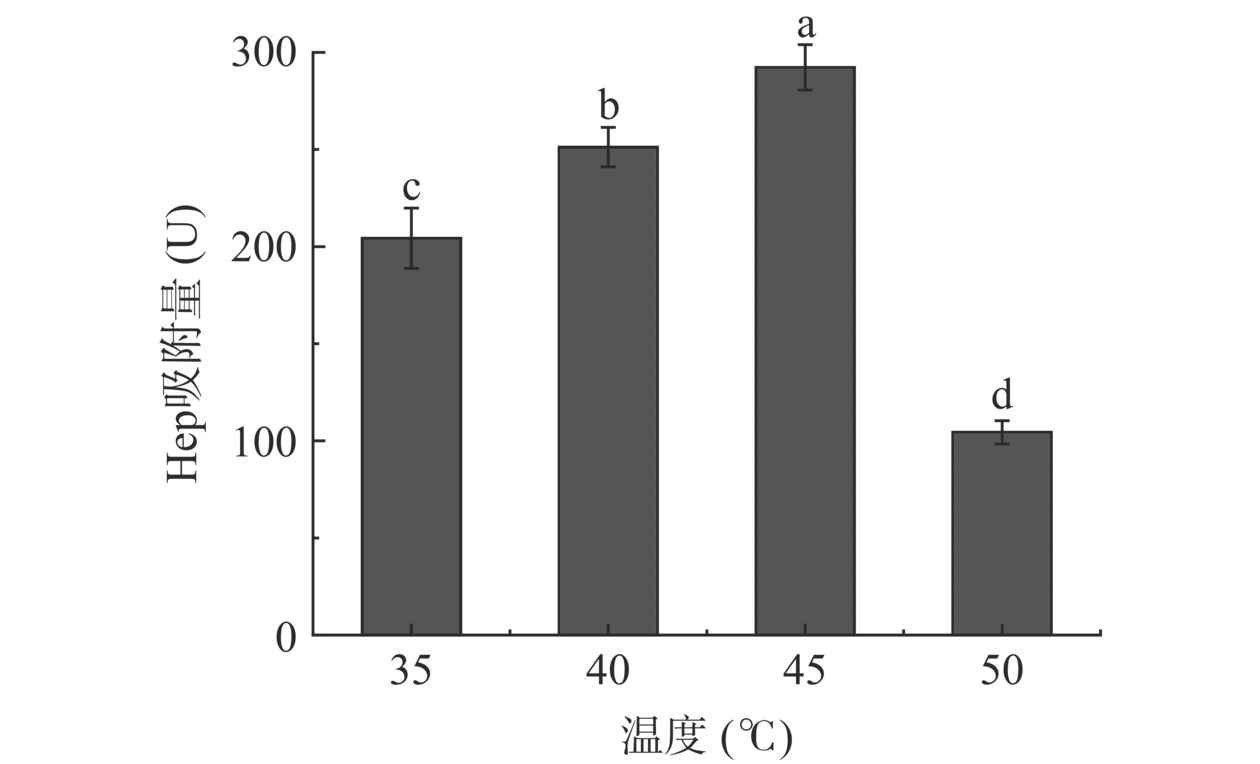
b. 温度对树脂吸附影响:称取10 g D958树脂于三角瓶中,加入40 mL酶解液,Hep浓度为11.87 U/mL,调节溶液pH为8.5,温度分别为35、40、45、50 ℃吸附过夜,测定树脂对Hep吸附量。
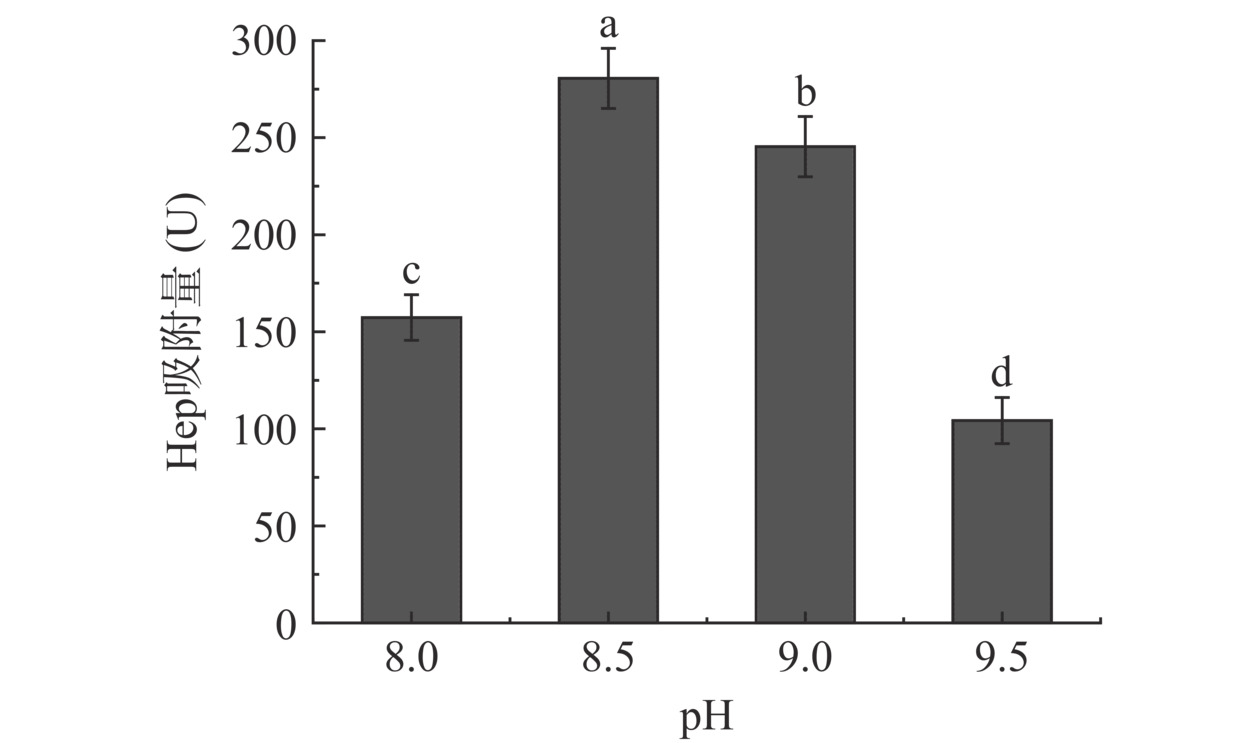
c. pH对树脂吸附影响:称取10 g D958树脂于三角瓶中,加入40 mL酶解液,Hep浓度为11.87 U/mL,调节溶液温度为45 ℃,溶液pH为8.0、8.5、9.0、9.5吸附过夜,测定树脂对Hep吸附量。
1.2.5.3 动态吸附参数筛选
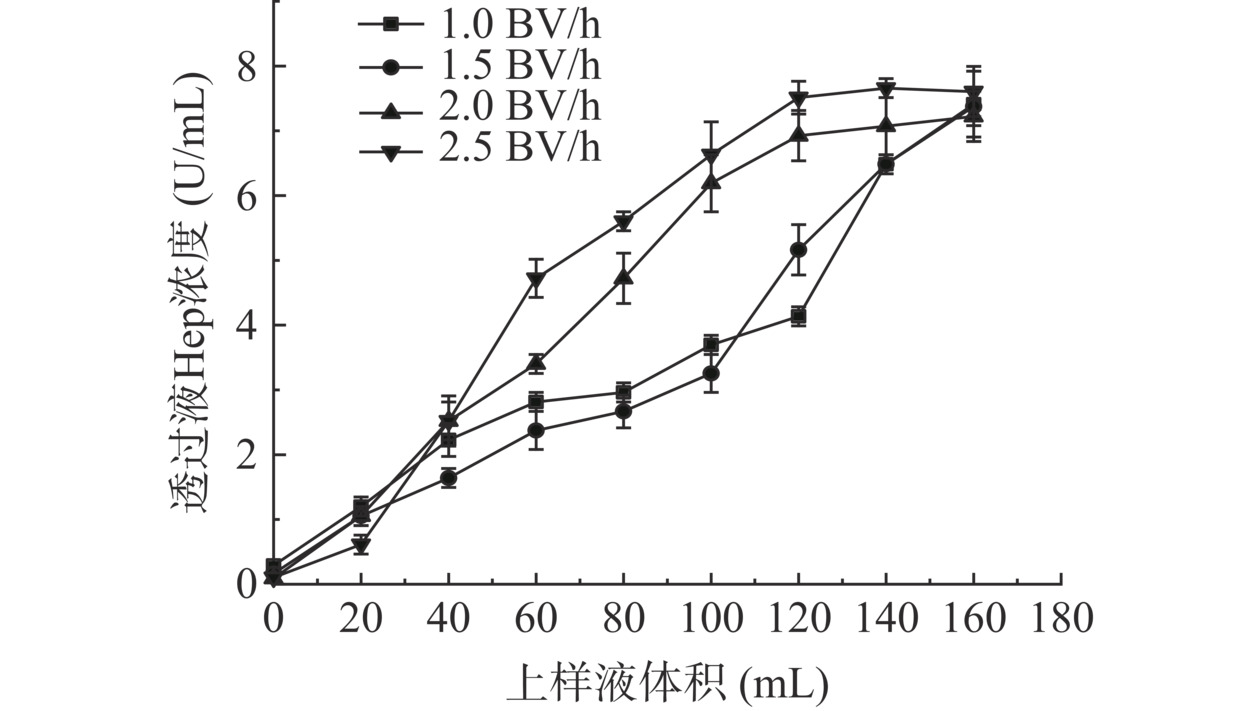
a. 上样流速对树脂吸附影响:取Hep溶液分别以1.0、1.5、2.0、2.5 BV/h上样流速通过D958树脂柱,温度为45 ℃,pH为8.5,柱体积70 mL,每隔固定20 mL收集透过液并测定Hep浓度,考察上样流速对树脂吸附的影响。
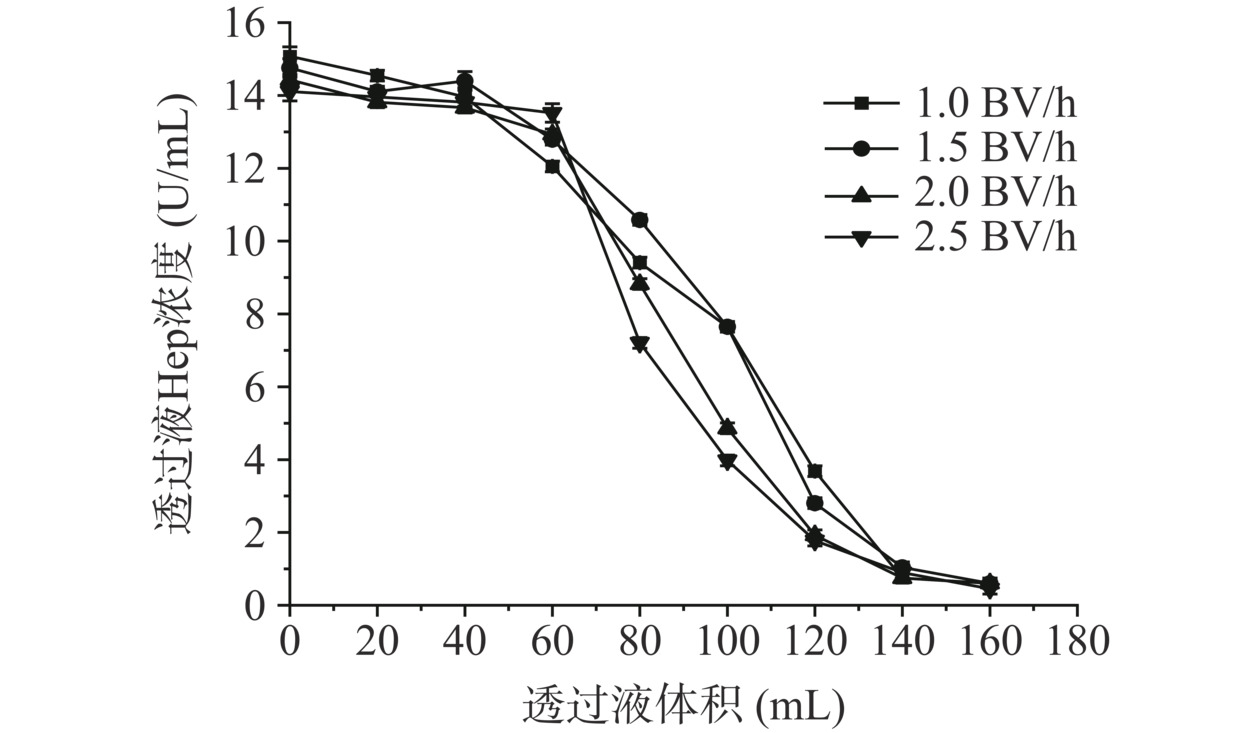
b. 洗脱液浓度对树脂解吸影响:取Hep溶液以1.5 BV/h上样至树脂饱和后,先以去离子水1 BV冲洗掉树脂上附着的蛋白质等大分子杂质,然后依次使用3.0、3.5、4.0、4.5 mol/L浓度NaCl以0.5 BV/h洗脱D958树脂,温度为45 ℃,pH为8.5,每20 mL收集透过液并测定Hep浓度,浓度趋于稳定后停止洗脱,考察各洗脱剂不同浓度解吸效果。
c. 洗脱流速对树脂解吸影响:采用4.0 mol/L NaCl分别以1.0、1.5、2.0、2.5 BV/h流速冲洗饱和D958树脂、温度为45 ℃,pH为8.5,每20 mL收集透过液并测定Hep与DS浓度,浓度趋于稳定后停止洗脱,考察洗脱流速对树脂解吸的影响。
1.2.5.4 透析脱盐
收集上述最佳条件所得洗脱液,采用截留分子量为500~1000 Da的透析袋,4 ℃下透析4 d,每6 h换一次水,结束后加3倍体积乙醇进行醇沉,经真空浓缩、真空冷冻干燥分别得到Hep样品。
1.2.5.5 Hep纯度测定
a. 高效凝胶渗透色谱:肝素标准品和Hep待测样品分别用0.2 mol/L无水硫酸钠溶液配制成浓度为5 mg/mL的溶液。色谱条件:色谱柱Ultrahydrogel Linear(7.8×300 mm,Waters),流动相0.2 mol/L无水硫酸钠溶液,流速1.2 mL/min,柱温30 ℃,进样量20 μL,Aglent 1200示差折光检测器检测。记录Hep标准品和待测样品的保留时间并进行数据处理[25]。
b. 醋酸纤维素薄膜电泳:醋酸纤维素薄膜先用硼酸-硼砂缓冲液浸泡5 min,然后用滤纸吸干,取10 μL Hep标准品和待测样品5 mg/mL溶液于装样器小孔中,用点样器点样,点样端置于负极方向,添加0.1 mol/L醋酸钡缓冲液没过纸桥下端1 cm,连接电极,在100 V、4 mA条件下电泳3 h后用0.1%甲苯胺蓝溶液染色0.5 h,2%醋酸溶液洗涤脱色至背景无色、观察、拍照。
1.2.6 猪小肠肝素物理性质及稳定性研究
1.2.6.1 物理性质研究
将分离纯化得到Hep样品分别溶解于去离子水、甲醇、乙醇、乙醚、丙酮观察溶解性。
1.2.6.2 稳定性研究
a. pH对Hep稳定性影响:将1 mg Hep样品分别溶于pH为6.5、7.0、7.5、8.0的20 mL去离子水中静置。每20 min检测Hep浓度。
b. 温度对Hep稳定性影响:将四份等量(1 mg)Hep分别溶于20 mL去离子水中,在温度分别为40、50、60、70 ℃条件下放置。每2 d检测Hep浓度。
c. 光照对Hep稳定性影响:将1 mg Hep分别溶于20 mL去离子水中,在有光照与避光条件下放置。每2 d检测Hep浓度变化。
1.3 数据处理
本研究所涉及实验均平行重复三次,数据统计采用Origin 2019进行数据处理拟合绘图,SPSS 20进行显著性分析,P<0.05和P<0.01分别表示差异显著及极显著,响应曲面试验用Design-Expert 13软件进行设计和结果统计分析。
2. 结果与分析
2.1 猪小肠粘膜冻干粉基本成分测定
猪小肠粘膜冻干粉中基本组成含量,结果如表3所示。猪小肠粘膜冻干粉中蛋白质含量最高,占总体49.00%±0.11%,脂肪为20.36%±0.09%,灰分和水分别为11.2%±0.04%和11.07%±0.05%。总糖含量最低,仅为4.05%±0.05%。
表 3 猪小肠粘膜冻干粉中主要化学成分Table 3. Main chemical components in the lyophilized powder of the mucosa of pig intestine成分 总蛋白 总糖 脂肪 水分 灰分 其他 含量(%) 49.00±0.11 4.05±0.05 20.36±0.09 11.07±0.05 11.2±0.04 12.32±0.07 2.2 高静压酶解法提取猪小肠肝素工艺优化
2.2.1 最佳用酶选择
利用高压酶解法提取猪小肠肝素过程中,选择适宜的酶至关重要。不同蛋白酶对酶解后溶液中Hep浓度影响如图2所示。试验结果表明:不同蛋白酶显著影响酶解液中Hep浓度(P<0.05)。原料经不同蛋白酶处理后,酶解液Hep浓度由高到低依次为:碱性蛋白酶>木瓜蛋白酶>Protamex复合蛋白酶>胃蛋白酶。因此,选取碱性蛋白酶作为后续试验用酶。此结果与徐俊涛等[26]结果一致。
2.2.2 酶解时间对Hep浓度影响
从图3中可知,酶解液中Hep浓度在0~3 h阶段内不断显著增加(P<0.05),超过3 h后,Hep浓度略有下降。这可能是因为酶解效果与时间相关性较大,时间短时酶解不充分,时间过长时Hep结构可能发生变化导致活性略有下降[27]。考虑到Hep酶解效果与成本,可选择2、3、4 h作为响应面水平。
2.2.3 酶解温度对Hep浓度影响
从图4中可以看出,酶解液中Hep浓度随温度升高不断显著增加(P<0.05),在55 ℃时效果最好,但随温度进一步升高,Hep浓度呈现出下降趋势。这说明温度升高能够增加蛋白酶活性,对酶解具有一定促进作用,但过高温度反而会导致酶在一定程度失活,从而使Hep得率下降。因此,综合酶解效果与生产成本等因素,可选择50、55、60 ℃作为响应面水平。
2.2.4 酶底物比对Hep浓度影响
图5可见,酶解液中Hep浓度随酶底物比增加而不断显著增大(P<0.05),当酶底物比为9%时,Hep浓度最大,当酶底物比超过9%之后,Hep浓度呈下降趋势。这可能是因为过量酶相互附着,降低了酶与底物传质效率,反而降低了反应效率[28]。因此可选择酶底物比为9%较为适宜。
2.2.5 酶解pH对Hep浓度影响
从图6中可以看出,酶解液中Hep浓度随pH增加而显著增大(P<0.05),当pH为9.5时,Hep浓度达最大,当pH继续增大,Hep浓度均出现明显下降趋势。过酸或过碱条件都改变酶空间结构,抑制酶活性[29],降低Hep酶解效果。因此,最终选择pH为9.0、9.5、10.0为响应面水平。
2.2.6 盐浓度对Hep浓度影响
图7可见,在酶解过程中,酶解液Hep浓度随盐浓度变化而变化,在0.5%~2.0%范围内,酶解液Hep浓度随盐浓度升高而显著升高(P<0.05),当盐浓度超过2.0%,Hep浓度开始降低。这是因为适当盐浓度可以使蛋白部分变性,更有利于蛋白酶的催化结合,使得Hep从蛋白上解离;但是过高浓度会影响酶活性,甚至产生盐析现象,降低Hep整体含量[30]。综合Hep提取指标,可选择盐浓度为2.0%。
2.2.7 酶解压力对Hep浓度影响
从图8可以看出,随着压力增加,Hep浓度先增后降。当压力为100 MPa时,Hep浓度达最大值。这说明适度压力能够有效增强酶活性,提高酶解液中Hep浓度,但过高压力反而会抑制酶活性。综合考虑两者酶解效果,可选择50、100、150 MPa作为响应面水平。
2.2.8 响应面优化试验结果
对酶解反应中影响Hep浓度因素做进一步优化试验,根据Box-Behnken设计原理,综合单因素实验结果,选取对Hep浓度影响较大的酶解时间、温度、pH和压力四种因素为作用因素,固定因素酶底物比9%,盐浓度2.0%,以Hep浓度为响应值,采用Design-Expert进行试验设计与结果分析,试验结果见表4。
表 4 响应面试验设计及结果Table 4. Experimental design and results of response surface实验号 因素 Hep浓度
(U/mL)酶解时间(A) 酶解温度(B) 酶解pH(C) D酶解压力(D) 1 −1 −1 0 0 9.94 2 1 −1 0 0 10.21 3 0 0 0 0 11.30 4 −1 1 0 0 9.29 5 1 1 0 0 9.53 6 0 0 −1 −1 10.34 7 0 0 1 −1 10.45 8 0 0 0 0 11.33 9 0 0 −1 1 8.99 10 0 0 1 1 8.36 11 −1 0 0 −1 10.76 12 0 0 0 0 11.77 13 1 0 0 −1 9.73 14 −1 0 0 1 9.63 15 1 0 0 1 9.18 16 0 −1 −1 0 9.07 17 0 1 −1 0 9.28 18 0 −1 1 0 9.21 19 0 1 1 0 7.69 20 0 0 0 0 11.64 21 −1 0 −1 0 9.53 22 0 0 0 0 11.55 23 1 0 −1 0 9.59 24 −1 0 1 0 9.02 25 1 0 1 0 9.22 26 0 −1 0 −1 9.78 27 0 1 0 −1 10.70 28 0 −1 0 1 9.79 29 0 1 0 1 7.78 对表4进行试验数据的多元回归拟合,得到Hep浓度(Y)关于时间(A)、温度(B)、pH(C)及压力(D)回归方程:
Y=11.52−0.0598A−0.3108B−0.2379C−0.6687D−0.0085AB−0.0361AC+0.1464AD−0.4318BC−0.7315BD−0.1833CD−0.7669A2−1.19B2−1.38C2−0.7829D2
对回归方程进行方差分析及显著性检验,酶解液Hep浓度回归方程分析结果见表5。该模型回归显著(P<0.0001),失拟项不显著(P>0.05),R2=0.9463,R2Adj=0.8927,说明该模型与试验拟合良好。由表5可见,B、D、BD、A2、B2、C2、D2对Hep浓度影响极显著(P<0.01),C、BC影响显著(P<0.05),AB、AC、AD、CD影响不显著(P>0.05)。各因素对Hep浓度影响主次关系为:酶解压力>酶解温度>酶解pH>酶解时间。
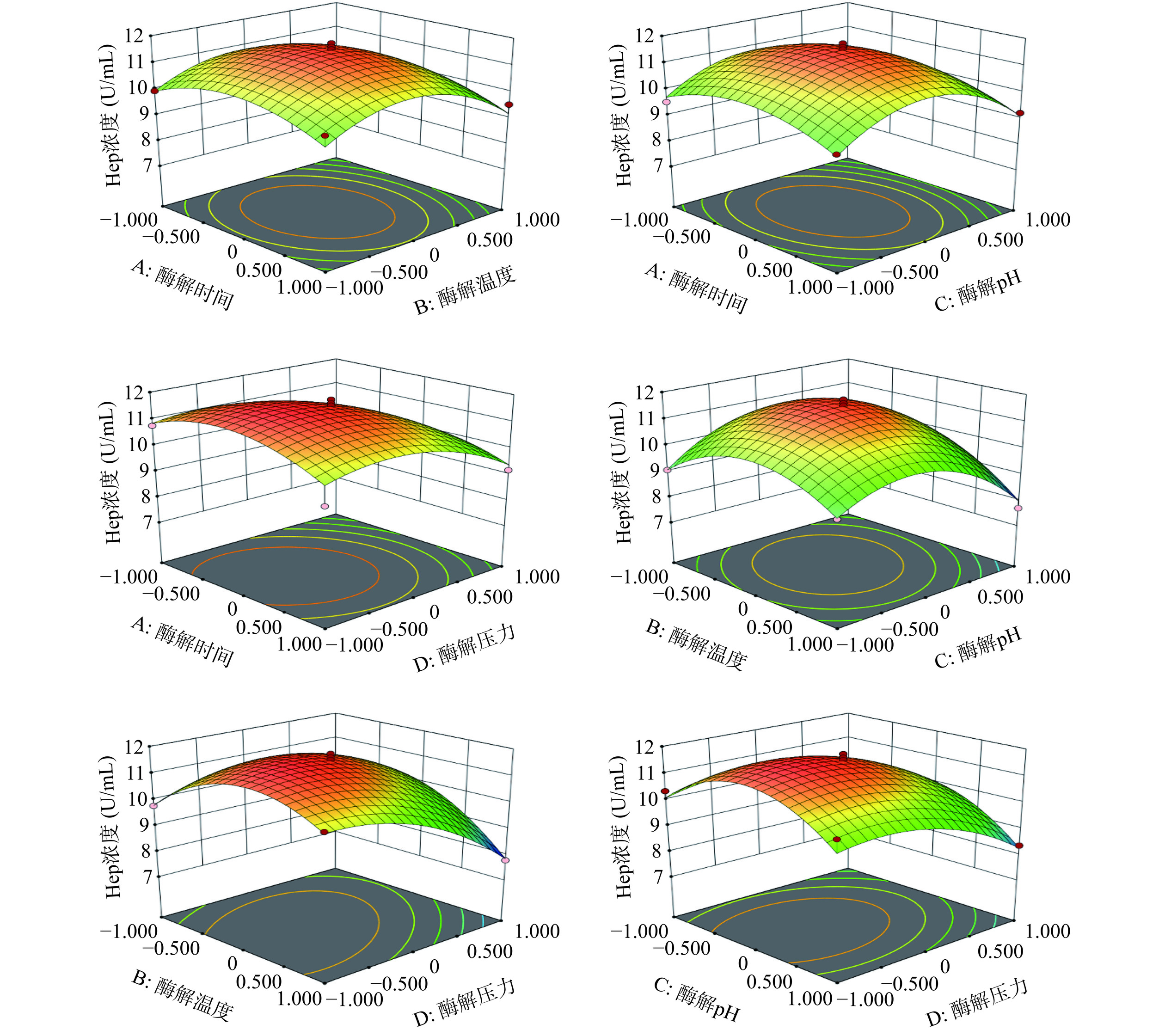
表 5 Hep浓度回归方程显著性检验及方差分析Table 5. Significance and variance analysis of the Hep concentration来源 平方和 自由度 均方 F值 P值 模型 30.06 14 2.15 17.64 < 0.0001** A 0.0429 1 0.0429 0.3525 0.5622 B 1.16 1 1.16 9.52 0.0081** C 0.679 1 0.679 5.58 0.0332* D 5.37 1 5.37 44.08 < 0.0001** AB 0.0003 1 0.0003 0.0024 0.9619 AC 0.0052 1 0.0052 0.0427 0.8392 AD 0.0857 1 0.0857 0.7039 0.4156 BC 0.7459 1 0.7459 6.13 0.0267* BD 2.14 1 2.14 17.58 0.0009** CD 0.1344 1 0.1344 1.1 0.3111 A² 3.81 1 3.81 31.34 < 0.0001** B² 9.13 1 9.13 75.04 < 0.0001** C² 12.29 1 12.29 100.95 < 0.0001** D² 3.98 1 3.98 32.66 < 0.0001** 残差 1.7 14 0.1217 失拟项 1.54 10 0.1539 3.74 0.1077 纯误差 0.1647 4 0.0412 总和 31.76 28 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 当某因素被固定在中心点水平时,交互作用对Hep浓度影响的响应面见图9。酶解温度和酶解压力交互作用对Hep浓度的影响极显著(P<0.01),酶解温度和酶解pH交互作用对Hep浓度的影响显著(P<0.05)。
经Design Expert 13软件优化组合得到高静压酶解Hep最佳提取条件为:酶解时间3.1 h,酶解温度54.6 ℃,pH为9.52,压力99.27 MPa,此条件下酶解Hep预测浓度为11.614 U/mL。在优化得到最佳条件下进行验证试验以确定回归方程的可靠性,同时考虑到操作可行性,实际试验中采用酶解时间3.1 h,酶解温度55 ℃,酶解pH9.5,酶解压力100 MPa,测得实际Hep平均浓度为11.56±0.12 U/mL。与预测值接近,说明该模型适用于拟合Hep高静压酶解提取方法,得到最佳条件在Hep提取中作为实际应用。
2.3 大孔树脂分离纯化猪小肠肝素工艺优化
2.3.1 静态吸附参数筛选
2.3.1.1 大孔树脂选择
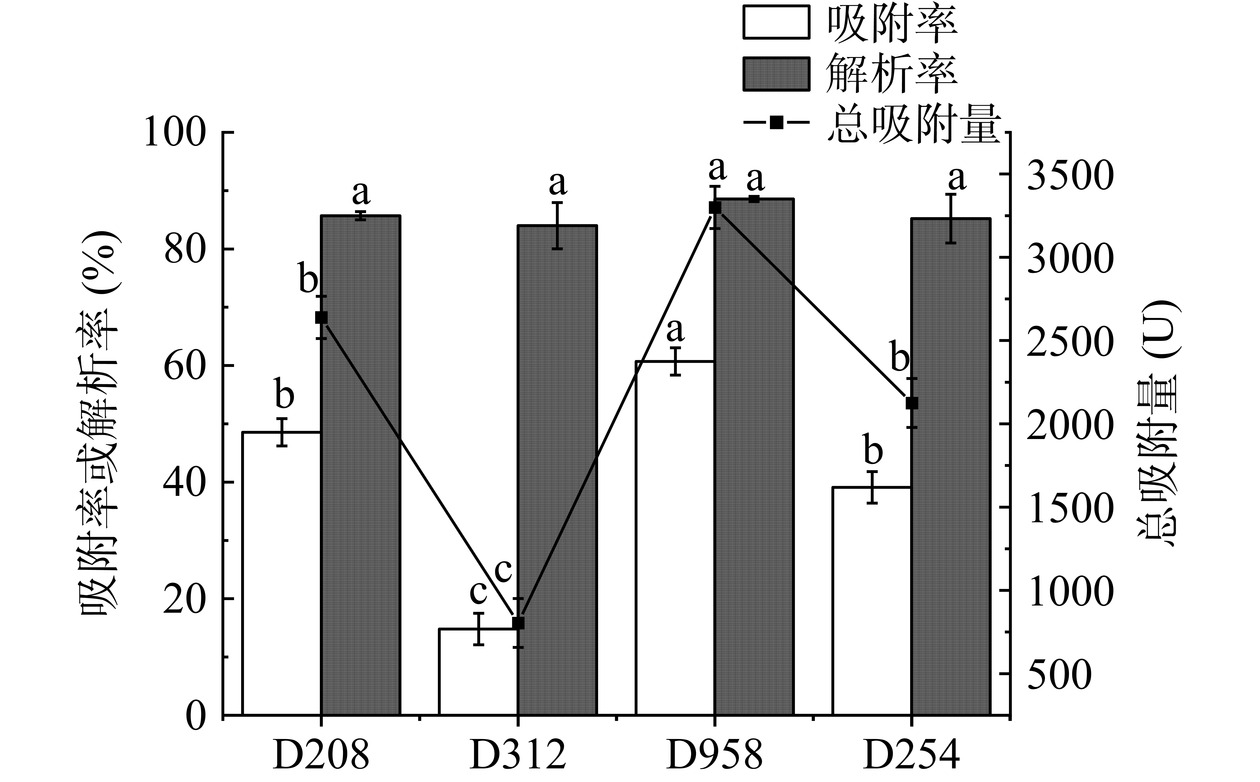
Hep作为具备一定极性聚阴离子化合物,选择D958、D254、D312、D208四种弱极性大孔吸附树脂进行试验。
四种大孔树脂静态吸附解吸试验结果如图10。所选树脂对Hep解吸率较高,均具备良好解吸能力,但吸附能力差异较大,其中Hep吸附能力强弱次序为:D958>D208>D254>D312,且D958树脂的吸附率和解析率乘积最大。因此,选择D958树脂吸附Hep。
2.3.1.2 温度对树脂吸附影响
图11表明,随着溶液温度升高,D958树脂对Hep吸附量逐渐增大,温度为45 ℃时吸附量达到最大值。当温度继续升高,树脂吸附效果反而变差,这说明适宜温度可以有效增加树脂交换能力,但过高温度会降低树脂交换容量,同时维持较高温度也会相应增加成本,综合考虑选择45 ℃进行Hep树脂吸附。
2.3.1.3 pH对树脂吸附影响
图12可见,随着溶液pH增高,树脂对Hep吸附量也升高,在pH8.5条件下,D958树脂对Hep吸附量为最大值,为280.5 U,pH9.5时,吸附量只有104.2 U。随着pH继续增高,吸附量反而降低。这是因为当pH升高,溶液中增加OH−会更易与阳离子结合,使得多糖阴离子更易被阴离子吸附树脂吸附,但过高pH反而会抑制树脂交换基解离,减弱树脂吸附能力。综合考虑选取D958树脂吸附pH为8.5。
2.3.2 动态吸附参数筛选
2.3.2.1 上样流速对树脂吸附影响
由图13可知,各曲线均为增长型,流速通过影响溶质在树脂表面扩散从而影响吸附效果,曲线与横坐标截面越小,透过液中Hep含量越小,即树脂吸附量越大。随着流速增加,Hep在树脂上平衡点逐渐提前,2.5 BV/h曲线该现象表现最为突出,说明树脂对Hep饱和吸附量有所下降,反之,流速越慢树脂对Hep饱和吸附量增加,但所需时间越长。综合考虑时间成本与吸附量,1.5 BV/h比起2.0、2.5 BV/h吸附量更大,比起1.0 BV/h更快,因此D958树脂选择以1.5 BV/h流速上样。
2.3.2.2 洗脱液浓度对树脂解吸影响
由图14可知,随着洗脱液体积增加,Hep浓度逐渐下降,洗脱液浓度较低(3.0、3.5 mol/L)时,与横坐标轴截面积较大,说明洗脱效果好,但平衡所需洗脱液体积大,时间成本高;洗脱液浓度较高(4.5 mol/L)时,峰值持续时间长,说明此段时间内洗脱效果优异,但随后Hep浓度迅速下降,且有轻微的拖尾现象,时间成本增加。综合考虑时间及洗脱效果,选择4.0 mol/L NaCl作为D958树脂洗脱剂。
2.3.2.3 洗脱流速对树脂解吸影响
由图15可知,Hep在D958树脂上以4% NaCl为洗脱剂条件下,随流速逐渐增加,峰值出现逐渐靠后且下降速度变快,即洗脱流速越快,前60 mL洗脱液洗脱效果越好,但迅速下降造成了材料浪费。较低洗脱流速曲线与横坐标截面大,整体洗脱效果更好,但所需时间成本更高。1.5 BV/h较2.0、2.5 BV/h洗脱速度更快,较1.0 BV/h洗脱效果更好。综合考虑,选择1.5 BV/h洗脱流速对D958树脂进行洗脱160 mL。
2.3.3 Hep纯度测定
2.3.3.1 高效凝胶渗透色谱
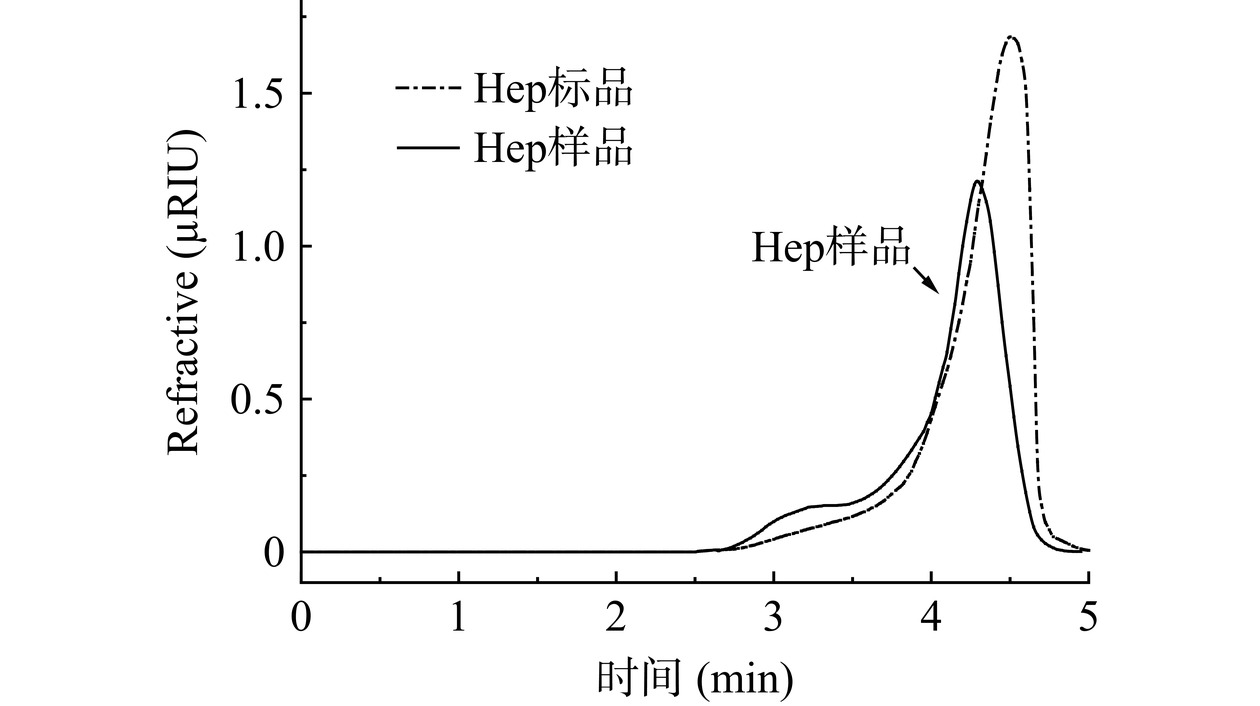
经高压酶解提取、树脂吸附纯化得到Hep样品,通过液相分析得到液相色谱图,结果见图16。从图中可以看出,Hep样品峰形较为对称,且出峰时间与标准品重叠。可证实经纯化后样品为Hep,经检测纯度可达68.75%。
2.3.3.2 醋酸纤维素薄膜电泳
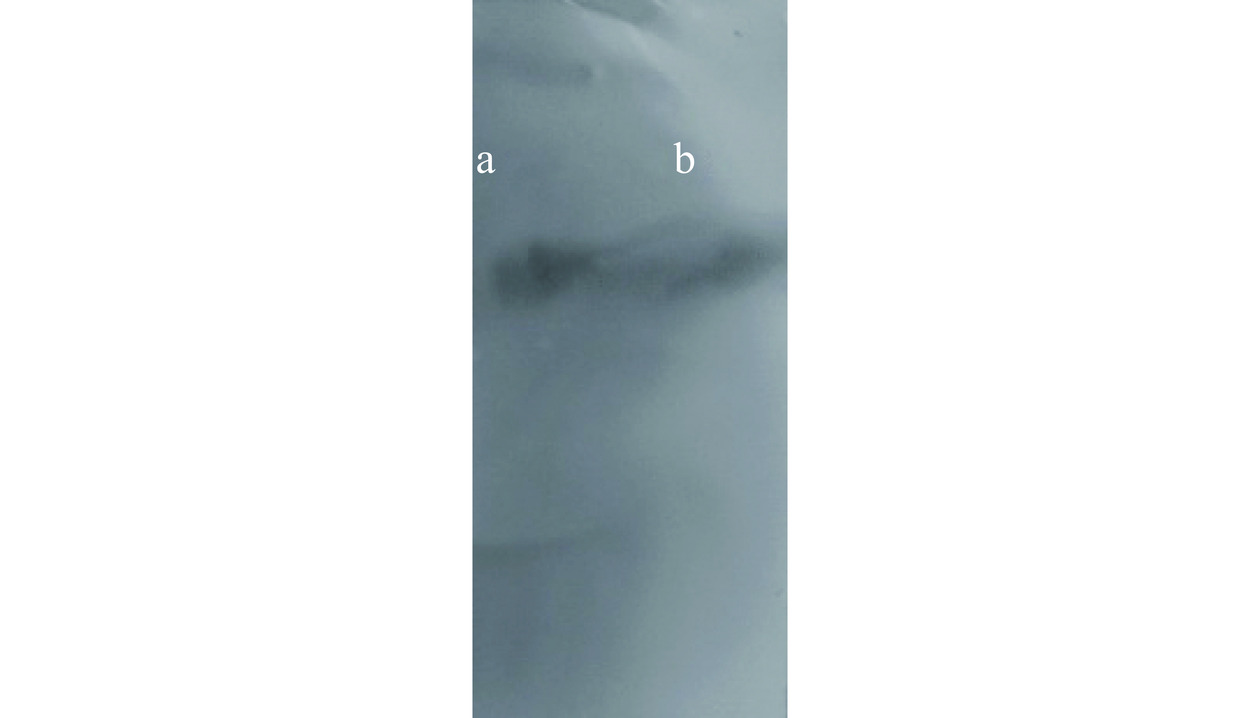
试验经过纯化后多糖经过液相分析可知Hep纯度为68.75%,对二者进行醋酸纤维素薄膜电泳分析,电泳图17,由图可知,本试验所制备Hep均为单一条带,达到电泳纯。
2.4 猪小肠肝素物理性质及稳定性研究
2.4.1 物理性质研究
产品Hep呈白色粉末状,无毒无味,具有一定吸湿性,在不同溶剂中溶解性如表6所示。
表 6 Hep在不同溶剂中的溶解性Table 6. Solubility of Hep in different solvents溶解性 去离子水 甲醇 乙醇 乙醚 丙酮 Hep 溶解 不溶 不溶 不溶 不溶 2.4.2 稳定性研究
2.4.2.1 pH对Hep稳定性影响
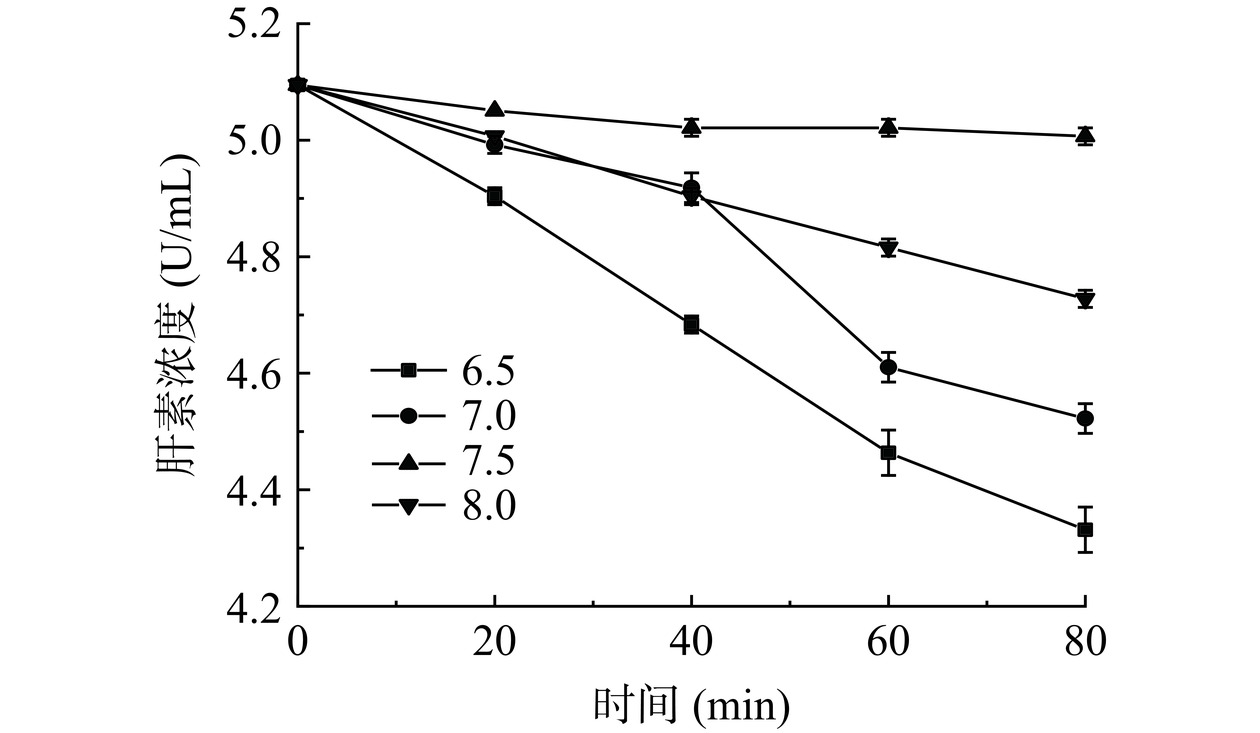
由图18可知,在pH为6.5时,Hep浓度随时间延长降低最快,可能是因为Hep表面电荷被破坏,在此条件下Hep活性损失最大。在pH为7.5时,肝素浓度损失速度明显低于pH为6.5、7.0、8.0情况。由此可知当pH为7.5时,Hep浓度损失最慢,稳定性最好。
2.4.2.2 温度对Hep稳定性影响
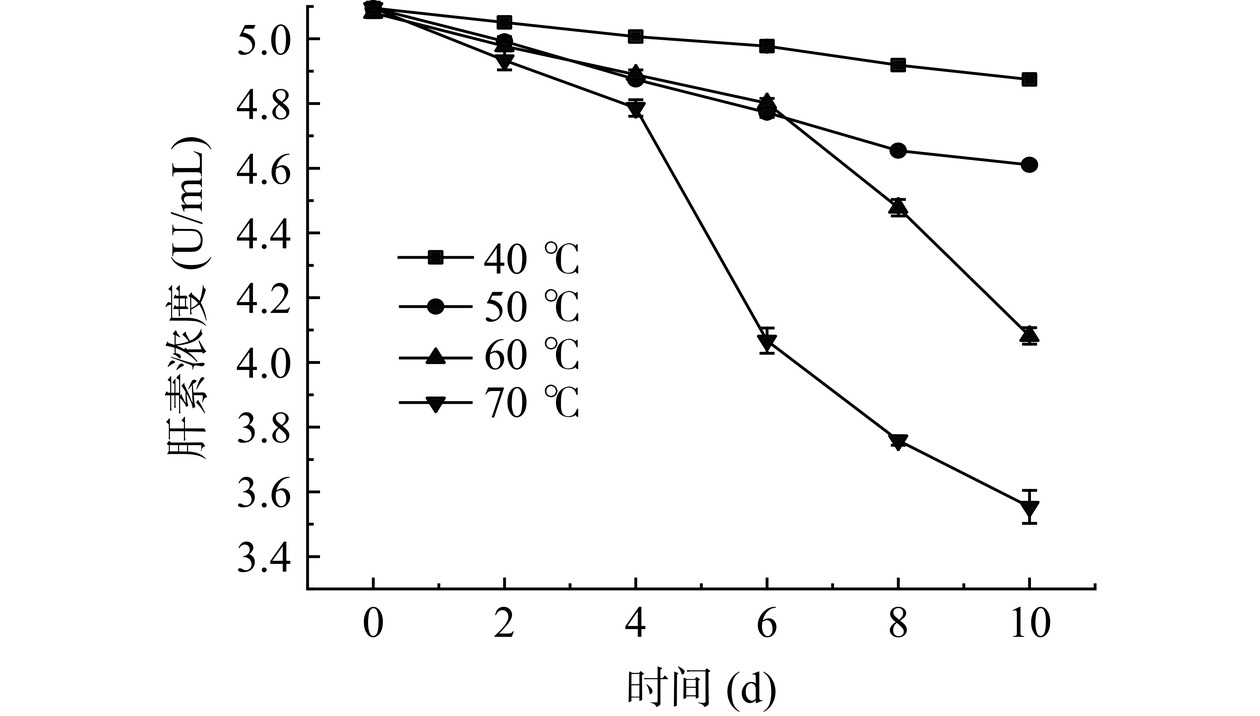
由图19可知,随着时间推移,四种温度条件下Hep浓度均呈下降趋势,70 ℃最为明显,10 d后由5.09 U/mL下降至3.55 U/mL;在40、50 ℃时损失均较小。可见Hep溶液浓度降低幅度随时间推移加剧,即Hep在40 ℃以上稳定性较差,降解速度快。所以,在Hep生产过程中,温度可控制在40℃以下,综合考虑成本,室温即可。
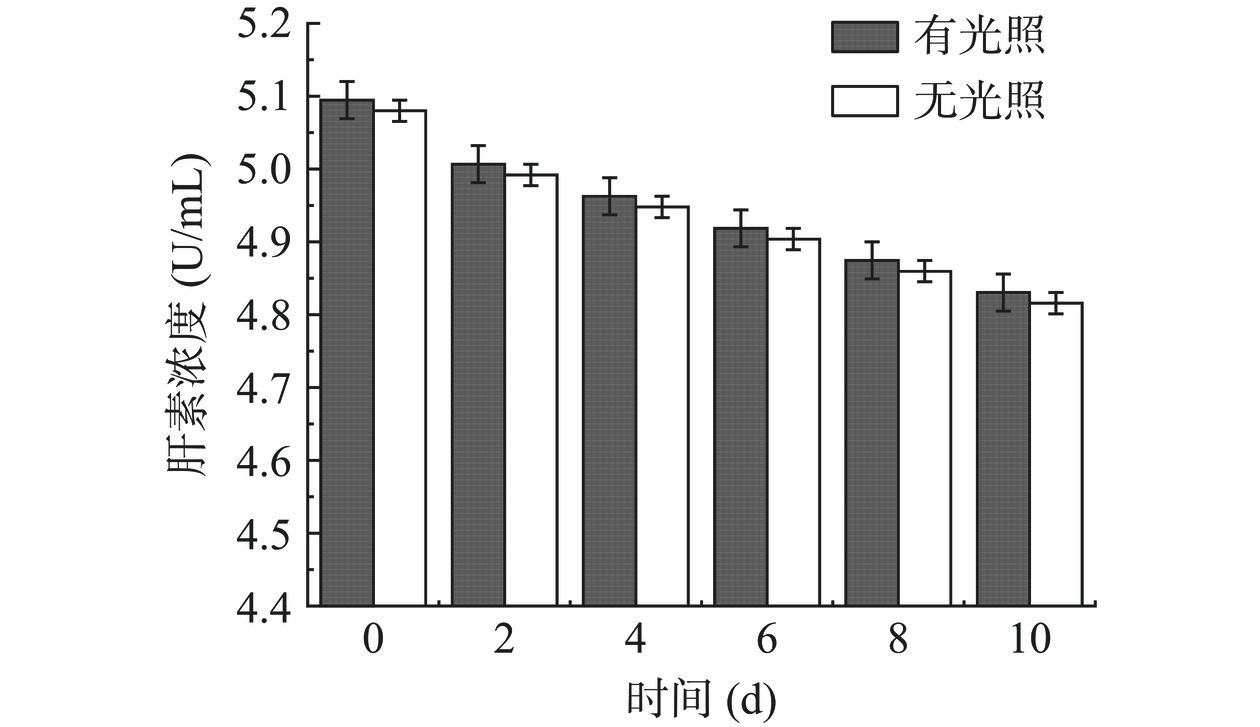
2.4.2.3 光照对Hep稳定性影响
图20可知,在不同天数取样检测Hep浓度,溶液在有、无光照条件下浓度降低幅度接近,即Hep与DS对光照不敏感。
综上所述,Hep在储存制作运输过程中,条件控制不宜极易导致多糖降解失活,可见Hep对环境比较敏感。因此,在Hep生产、制作、储存和运输过程中,需考虑环境各种因素对多糖稳定性的影响,以保证Hep生物活性[31]。
3. 结论
本研究采用高静压酶解结合树脂纯化技术提取猪小肠Hep,通过单因素实验和响应面试验优化最佳酶解工艺和树脂吸附条件,探讨了Hep的稳定性。最佳酶解工艺为选取碱性蛋白酶,时间3.1 h,温度55 ℃,pH9.5,压力100 MPa,酶底物比9%,盐浓度2.0%,测得Hep实际平均浓度为11.56±0.12 U/mL。利用D958树脂纯化Hep,上样流速1.5 BV/h,洗脱液浓度4 mol/L NaCl,洗脱流速1.5 BV/h,纯化后Hep纯度可达68.75%,即达到电泳纯。在稳定性研究中,Hep在pH7.5时稳定性最好,温度在40 ℃时具有较好稳定性,光照对Hep稳定性没有影响。本研究采用高静压酶解工艺,大大提升了Hep的提取效果,然而Hep纯度仍有待提高,后续需进一步探究高纯度Hep纯化方法并鉴定其多糖结构,为Hep产品开发利用提供理论参考与数据支撑,对畜产品副产业加工行业发展具有重大意义。
-
表 1 酶最佳反应条件
Table 1 Optimum reaction condition of enzyme
蛋白酶种类 pH 温度(℃) 添加酶活(U/g) 碱性蛋白酶 9.0 45 18000 Protamex复合蛋白酶 7.5 45 13200 木瓜蛋白酶 7.0 55 52000 胃蛋白酶 3.0 37 14000 表 2 响应面试验因素水平
Table 2 Response surface test factor level
因素 水平 −1 0 1 A 酶解时间(h) 2 3 4 B 酶解温度(℃) 50 55 60 C 酶解pH 9.0 9.5 10.0 D 酶解压力(MPa) 50 100 150 表 3 猪小肠粘膜冻干粉中主要化学成分
Table 3 Main chemical components in the lyophilized powder of the mucosa of pig intestine
成分 总蛋白 总糖 脂肪 水分 灰分 其他 含量(%) 49.00±0.11 4.05±0.05 20.36±0.09 11.07±0.05 11.2±0.04 12.32±0.07 表 4 响应面试验设计及结果
Table 4 Experimental design and results of response surface
实验号 因素 Hep浓度
(U/mL)酶解时间(A) 酶解温度(B) 酶解pH(C) D酶解压力(D) 1 −1 −1 0 0 9.94 2 1 −1 0 0 10.21 3 0 0 0 0 11.30 4 −1 1 0 0 9.29 5 1 1 0 0 9.53 6 0 0 −1 −1 10.34 7 0 0 1 −1 10.45 8 0 0 0 0 11.33 9 0 0 −1 1 8.99 10 0 0 1 1 8.36 11 −1 0 0 −1 10.76 12 0 0 0 0 11.77 13 1 0 0 −1 9.73 14 −1 0 0 1 9.63 15 1 0 0 1 9.18 16 0 −1 −1 0 9.07 17 0 1 −1 0 9.28 18 0 −1 1 0 9.21 19 0 1 1 0 7.69 20 0 0 0 0 11.64 21 −1 0 −1 0 9.53 22 0 0 0 0 11.55 23 1 0 −1 0 9.59 24 −1 0 1 0 9.02 25 1 0 1 0 9.22 26 0 −1 0 −1 9.78 27 0 1 0 −1 10.70 28 0 −1 0 1 9.79 29 0 1 0 1 7.78 表 5 Hep浓度回归方程显著性检验及方差分析
Table 5 Significance and variance analysis of the Hep concentration
来源 平方和 自由度 均方 F值 P值 模型 30.06 14 2.15 17.64 < 0.0001** A 0.0429 1 0.0429 0.3525 0.5622 B 1.16 1 1.16 9.52 0.0081** C 0.679 1 0.679 5.58 0.0332* D 5.37 1 5.37 44.08 < 0.0001** AB 0.0003 1 0.0003 0.0024 0.9619 AC 0.0052 1 0.0052 0.0427 0.8392 AD 0.0857 1 0.0857 0.7039 0.4156 BC 0.7459 1 0.7459 6.13 0.0267* BD 2.14 1 2.14 17.58 0.0009** CD 0.1344 1 0.1344 1.1 0.3111 A² 3.81 1 3.81 31.34 < 0.0001** B² 9.13 1 9.13 75.04 < 0.0001** C² 12.29 1 12.29 100.95 < 0.0001** D² 3.98 1 3.98 32.66 < 0.0001** 残差 1.7 14 0.1217 失拟项 1.54 10 0.1539 3.74 0.1077 纯误差 0.1647 4 0.0412 总和 31.76 28 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 表 6 Hep在不同溶剂中的溶解性
Table 6 Solubility of Hep in different solvents
溶解性 去离子水 甲醇 乙醇 乙醚 丙酮 Hep 溶解 不溶 不溶 不溶 不溶 -
[1] EZIAFA O, ROBERT L, SUSAN S. Heparin:past, present, and future[J]. Pharmaceuticals,2016,9(3):38. doi: 10.3390/ph9030038
[2] 李华, 张天民. 肝素组分的研究进展[J]. 中国生化药物杂志,1983(1):38−41. [LI H, ZHANG T M. Research progress of heparin components[J]. Chinese Journal of Biochemical and Pharmaceuticals,1983(1):38−41.] LI H, ZHANG T M. Research progress of heparin components[J]. Chinese Journal of Biochemical and Pharmaceuticals, 1983(1): 38−41.
[3] NACHTMANN F, ATZL G, ROTH W D. Heparin sodium[J]. Analytical Profiles of Drug Substances,1983,12(April):215−276.
[4] SONG Q, CHEN X G, ZHOU W Z, et al. Application of a spiral symmetric stream anaerobic bioreactor for treating saline heparin sodium pharmaceutical wastewater:Reactor operating characteristics, organics degradation pathway and salt tolerance mechanism[J]. Water Res,2021,12(205):117671.
[5] MARK G PAPICH, MARK G PAPICH. Saunders handbook of veterinary drugs[M]. Philadelphia:W. B. Saunders, 2016:374−376.
[6] BONINA F P, MONTENRGRO L. Penetration enhancer effects on in vitro percutaneous absorption of heparin sodium salt[J]. International Journal of Pharmaceutics,1992,82(3):171−177. doi: 10.1016/0378-5173(92)90172-X
[7] ZANG L X, ZHU H M, WANG K, et al. Not just anticoagulation-new and old applications of heparin[J]. Molecules,2022,27(20):6968. doi: 10.3390/molecules27206968
[8] ZHANG F, YANG Y Y, LI L Z, et al. Heparin-induced thrombocytopenia after switching from unfractionated heparin to low-molecular-weight heparin:A case report and literature review[J]. Clinical Nephrology,2023,100(1):37−40. doi: 10.5414/CN110947
[9] 方井晋. 肝素钠有关物质检测方法学研究及效价的快速测定[D]. 杭州:浙江大学, 2012. [FANG J J. Methodological research for analysis of heparin sodium and rapid potency determination[D]. Hangzhou:Zhejiang University, 2012.] FANG J J. Methodological research for analysis of heparin sodium and rapid potency determination[D]. Hangzhou: Zhejiang University, 2012.
[10] ZHANG C Y, QI S J, MENG J, et al. Selective and efficient extraction of heparin by arginine-functionalized flowered mesoporous silica nanoparticles with high capacity[J]. Separation and Purification Technology,2021,276(7):119321.
[11] PLANCKEN I, LOEY A V, HENDRICKX M E. Kinetic study on the combined effect of high pressure and temperature on the physico-chemical properties of egg white proteins[J]. Journal of Food Engineering,2007,78(1):206−216. doi: 10.1016/j.jfoodeng.2005.09.018
[12] VAN D M J-Y, KELLENBACH E, VAN D B L J. From farm to pharma:An overview of industrial heparin manufacturing methods[J]. Molecules,2017,22(6):1025. doi: 10.3390/molecules22061025
[13] JIN X, HUANG L, WANG H. Optimization of high hydrostatic pressure-assisted extraction of polysaccharides from Lycium ruthenicum murr. by response surface methodology and their antioxidant activity[J]. Journal of Biobased Materials and Bioenergy,2022,16(5):715−20. doi: 10.1166/jbmb.2022.2223
[14] HU X X, YU C X, AHMADI S, et al. Optimization of high-pressure processing-assisted extraction of pectic polysaccharides from three berries[J]. Food Quality and Safety, 2022, 6.
[15] LI X L, ZHANG Z H, QI X H, et al. Application of nonthermal processing technologies in extracting and modifying polysaccharides:A critical review[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20(5):4367−4389. doi: 10.1111/1541-4337.12820
[16] DE LA PENA-ARMADA R, VILLANUEVA-SUAREZ M J, MOLINA-GARCIA A D, et al. Novel rich-in-soluble dietary fiber apple ingredient obtained from the synergistic effect of high hydrostatic pressure aided by Celluclast®[J]. LWT-Food Science and Technology, 2021, 146.
[17] PEREA-LOPEZ E, MATEOS-APARICIO I, RUPEREZ P. Low molecular weight carbohydrates released from Okara by enzymatic treatment under high hydrostatic pressure[J]. Innovative Food Science & Emerging Technologies,2016,38:76−82.
[18] 杨红, 谢智鑫, 刘丹怡, 等. 猪小肠粘膜碱性磷酸酶的分离纯化及性质研究[J]. 食品工业科技,2020,41(20):6. [YANG Hong, XIE Zhixin, LIU Danyi, et al. Purification and characterization of alkaline phosphatase in porcine intestinal mucosa[J]. Science and Technology of Food Industry,2020,41(20):6.] YANG Hong, XIE Zhixin, LIU Danyi, et al. Purification and characterization of alkaline phosphatase in porcine intestinal mucosa[J]. Science and Technology of Food Industry, 2020, 41(20): 6.
[19] 国家卫生和计划生育委员会. GB5009.3-2016. 食品中水分的测定[S]. 北京:中国标准出版社, 2017. [National Health and Family Planning Commission. GB5009.3-2016. Determination of moisture in foods[S]. Beijing:China Standards Press, 2017.] National Health and Family Planning Commission. GB5009.3-2016. Determination of moisture in foods[S]. Beijing: China Standards Press, 2017.
[20] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. GB 5009.6-2016. 食品中脂肪的测定[S]. 北京:中国标准出版社, 2017. [State Food and Drug Administration, National Health and Family Planning Commission. GB 5009.6-2016. Determination of fat in foods[S]. Beijing:China Standards Press, 2017.] State Food and Drug Administration, National Health and Family Planning Commission. GB 5009.6-2016. Determination of fat in foods[S]. Beijing: China Standards Press, 2017.
[21] 国家卫生和计划生育委员会. GB 5009.4-2016. 食品中灰分的测定[S]. 北京:中国标准出版社, 2017. [National Health and Family Planning Commission. GB 5009.4-2016. Determination of ash in foods[S]. Beijing:China Standards Press, 2017.] National Health and Family Planning Commission. GB 5009.4-2016. Determination of ash in foods[S]. Beijing: China Standards Press, 2017.
[22] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. GB 5009.5-2016. 食品中蛋白质的测定[S]. 北京:中国标准出版社, 2017. [State Food and Drug Administration, National Health and Family Planning Commission. GB 5009.5-2016. Determination of protein in foods[S]. Beijing:China Standards Press, 2017.] State Food and Drug Administration, National Health and Family Planning Commission. GB 5009.5-2016. Determination of protein in foods[S]. Beijing: China Standards Press, 2017.
[23] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.8-2016. 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定[S]. 北京:中国标准出版社, 2017. [State Food and Drug Administration, National Health and Family Planning Commission. GB 5009.8-2016. Determination of fructose, glucose, sucrose, maltose and lactose in foods[S]. Beijing:China Standards Press, 2017.] State Food and Drug Administration, National Health and Family Planning Commission. GB 5009.8-2016. Determination of fructose, glucose, sucrose, maltose and lactose in foods[S]. Beijing: China Standards Press, 2017.
[24] ZHAO Z W, ZHANG J L, CHEN X Y, et al. Separation of tungsten and molybdenum using macroporous resin:Equilibrium adsorption for single and binary systems[J]. Hydrometallurgy,2013,140:120−127. doi: 10.1016/j.hydromet.2013.09.014
[25] 陈菁. 虾头类肝素化合物的制备、结构表征及抗血栓活性评价[D]. 湛江:广东海洋大学, 2021. [CHRN J. Preparation, characterization and antithrombotic activity evaluation of heparinoids from shrimp head[D]. Zhanjiang:Guangdong Ocan University, 2021.] CHRN J. Preparation, characterization and antithrombotic activity evaluation of heparinoids from shrimp head[D]. Zhanjiang: Guangdong Ocan University, 2021.
[26] 徐俊涛. 酶解法制备肝素钠关键工艺技术研究[D]. 郑州:河南农业大学, 2012. [XU Juntao. Study on enzymatic preparation of heparin sodium critical technology[D]. Zhengzhou:Henan Agricultural University, 2012.] XU Juntao. Study on enzymatic preparation of heparin sodium critical technology[D]. Zhengzhou: Henan Agricultural University, 2012.
[27] 步营, 王飞, 胡显杰, 等. 蓝蛤超高压辅助酶解工艺研究[J]. 中国调味品,2021,46(1):57−62. [BU Ying, WANG Fei, HU Xianjie, et al. Study on ultra-high pressure assisted enzymatic hydrolysis process of Aloididae aloidi[J]. China Condiment,2021,46(1):57−62.] doi: 10.3969/j.issn.1000-9973.2021.01.011 BU Ying, WANG Fei, HU Xianjie, et al. Study on ultra-high pressure assisted enzymatic hydrolysis process of Aloididae aloidi[J]. China Condiment, 2021, 46(1): 57−62. doi: 10.3969/j.issn.1000-9973.2021.01.011
[28] SUN Y, YUAN H Y, HAO L L, et al. Enrichment and antioxidant properties of flavone C-glycosides from trollflowers using macroporous resin[J]. Food Chemistry,2013,141(1):533−541. doi: 10.1016/j.foodchem.2013.03.030
[29] 伍勇, 潘映萍, 刘润佳. 温度、酸碱度对酶促反应影响的教学设计[J]. 科教导刊,2012(33):2. [WU Y, PAN Y P, LIU R J. Instructional design for the effect of temperature and pH on enzymatic reactions[J]. The Guide of Science & Education,2012(33):2.] doi: 10.3969/j.issn.1674-6813.2012.33.065 WU Y, PAN Y P, LIU R J. Instructional design for the effect of temperature and pH on enzymatic reactions[J]. The Guide of Science & Education, 2012(33): 2. doi: 10.3969/j.issn.1674-6813.2012.33.065
[30] 赵阳, 刘娜, 王园, 等. 蒲公英多糖酶解辅助提取工艺优化及其单糖组成分析[J]. 食品工业科技,2021,42(16):199−206. [ZHAO Yang, LIU Na, WANG Yuan, et al. Optimization of enzymolysis assisted extraction process of dandelion polysaccharide and its monosaccharide composition analysis[J]. Science and Technology of Food Industry,2021,42(16):199−206.] ZHAO Yang, LIU Na, WANG Yuan, et al. Optimization of enzymolysis assisted extraction process of dandelion polysaccharide and its monosaccharide composition analysis[J]. Science and Technology of Food Industry, 2021, 42(16): 199−206.
[31] 张惟杰. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社, 1999:94−208. [ZHANG Weijie. Techniques for biochemical studies of glycoconjugates[M]. Hangzhou:Zhejiang University Press, 1999:94−208.] ZHANG Weijie. Techniques for biochemical studies of glycoconjugates[M]. Hangzhou: Zhejiang University Press, 1999: 94−208.





 下载:
下载:



 下载:
下载:



