Preparation, Characterization and Antioxidant Activity of Rice Protein Peptides with Different Enzymatic Hydrolysis Routes
-
摘要: 为探究双酶不同酶解路线制得大米蛋白肽的性质差异,研究采用胰蛋白酶(A)和碱性蛋白酶(B)按不同酶解路线对大米蛋白进行酶解,制备了5种大米蛋白肽(A1B1、A1B2、A2B1、A1*B2、A2B1*),对其水解度、基本成分、氨基酸组成、微观结构、二级结构、分子量分布、风味和体外抗氧化活性等进行分析。结果表明,A2B1组的蛋白含量最高达到90.69%,肽含量高达72.73%;各路线的水解度大于17.60%,水解较为完全;微观结构均由不规则块状变为球体状,A1B2组和A1*B2组球体壁较厚,A2B1组和A2B1*组球体壁较薄,A1B1组为球体碎片;各路线的必需氨基酸含量比大米蛋白低,A1B2组必需氨基酸含量最高;二级结构以多种构象并存,各路线二级结构均以β-转角为主,占二级结构的44.62%~47.18%;各路线酶解产物多为低分子量的多肽,分子量低于5 kDa的多肽占92.09%~93.71%;A1B2样品鲜味最强,涩味最弱,A2B1样品咸味和苦味最弱;相比于A1B1组、A1B2组和A1*B2组,A2B1组和A2B1*组的抗氧化活性更强。通过对双酶不同酶解路线大米蛋白肽的性质研究,综合基本成分、肽含量、氨基酸组成、风味和抗氧化活性评价,A2B1组的品质最佳。Abstract: In order to explore the properties differences of rice protein peptides prepared using different enzymatic hydrolysis routes of double enzymes, rice protein was enzymatically hydrolyzed by trypsin (A) and alkaline protease (B) according to different enzymatic hydrolysis routes to obtain five rice protein peptides (A1B1, A1B2, A2B1, A1*B2, A2B1*). The properties of protein peptides including the hydrolysis, basic components, amino acid composition, microstructure, secondary structure, molecular weight distribution, flavor and antioxidant activity in vitro were analyzed. The results indicated that the protein content of A2B1 group was the highest, reaching 90.69% and the peptide content was 72.73%. The hydrolysis degree of five rice protein peptides was greater than 17.60%, the degree of hydrolysis was relatively high, and the microstructure changed from irregular block to sphere. The A1B2 group and A1*B2 group had thicker spheroid walls, A2B1 group and A2B1* group had thinner spheroid walls, and A1B1 group was spheroid fragments. The essential amino acid content of five rice protein peptides was lower than that of rice protein, and the A1B2 group had the highest essential amino acid content. The secondary structure coexisted with a variety of conformations, and the secondary structures of five rice protein peptides were mainly β-turn, and it accounted for 44.62%~47.18%. Most of the enzymatic hydrolysates of five rice protein peptides were polypeptides with low molecular weight, and the polypeptides with molecular weight less than 5 kDa accounted for 92.09%~93.71%. A1B2 samples had the strongest umami and the weakest astringency, and A2B1 samples had the weakest saltiness and bitterness. Compared with A1B1, A1B2 and A1*B2, A2B1 and A2B1* groups had stronger antioxidant activity. Taking together, the quality of A2B1 group was the best based on the evaluation of basic components, peptide content, amino acid composition, flavor and antioxidant activity.
-
中国是世界上稻谷产量最丰富的国家,据国家统计局统计,中国2022年稻谷产量高达2.085亿吨。大米蛋白(rice protein,RP)是稻谷中第二丰富的成分,约占稻谷质量的8%。作为公认优质营养的植物蛋白,RP具有高消化率、高生物价、低过敏性和合理的氨基酸配比等优点[1−2],营养价值远高于其他谷类植物蛋白[3],可以与动物蛋白相媲美[4]。因此,RP是一种极具开发价值的植物蛋白资源,具有广阔的应用前景。蛋白肽作为蛋白的高附加值产品,不仅营养价值高,易被人体消化吸收,而且还具有抗氧化、降血压、降血糖、降血脂、降胆固醇和免疫调节等多种生物活性[5]。所以将优质营养的RP制备成高附加值产品大米蛋白肽具有重大研究意义和发展前景。
将蛋白转化为肽的方法主要有微生物发酵法、水解法和酶法。其中微生物发酵法存在发酵时间长和易受微生物感染等安全性问题;酸碱水解法不仅反应难以控制,而且会产生致癌性和毒性物质,破坏氨基酸,造成营养损失;而酶法没有上述缺点,同时具有安全性高、反应条件温和、重复性好和成本低等特点[6]。因此,酶法是制备蛋白肽的常用方法。目前,许多科研学者对酶水解RP制备大米蛋白肽的工艺和大米蛋白肽的生物活性开展了大量研究,发现大米蛋白肽具有更好的溶解性、乳化性和起泡性等功能特性[7−8],以及良好的抗氧化、降血压和抗疲劳等生物活性[9−11]。且现有研究表明,双酶水解法比单酶水解法效率高、效果好[12−13],不过双酶水解法不同的酶解路线制备的蛋白肽的性质会有所差异[14−15]。然而双酶不同酶解路线制备的大米蛋白肽的性质差异研究尚未见报道。
因此,本研究以RP为原料,经双酶不同酶解路线酶解制得大米蛋白肽,对其水解度、基本成分、肽含量、氨基酸组成、微观结构、二级结构、分子量分布、电子舌、体外抗氧化活性等进行分析,以明晰双酶不同酶解路线制备的大米蛋白肽的组成、结构和抗氧化活性差异。
1. 材料与方法
1.1 材料与仪器
大米蛋白(蛋白含量≥85%) 江西恒顶食品有限公司;胰蛋白酶(A)(200 U/mg) 合肥博美生物科技有限公司;碱性蛋白酶(B)(200 U/mg) 宁夏夏盛实业集团有限公司;0.1 mol/L盐酸标准液、0.1 mol/L氢氧化钠标准液、1-苯胺-8-萘磺酸(ANS) Sigma试剂有限公司;DPPH(1,1-二苯基-2-三硝基苯肼)、FeCl3、三氯乙酸 上海阿拉丁生化科技股份有限公司;高效凯氏定氮催化剂片 郑州和顺电子科技有限公司;其他试剂 分析纯,均购自上海麦克林生化有限公司。
K9860全自动凯氏定氮仪 济南海能未来技术有限公司;PAL-1数字折光仪 日本爱拓;916型恒定pH电位滴定仪 瑞士Metrohm仪器公司;DELTA320 pH计 上海梅特勒-托利多仪器有限公司;HH-6数显恒温水浴锅 常州聚辉仪器制造有限公司;L-8900全自动氨基酸分析仪 日本日立公司;TU-1901紫外分光光度计 北京普析通用仪器有限责任公司;F-7000荧光分光光度计 日本Hitachi公司;Quanta200F场发射扫描电子显微镜 德国卡塞尔公司;GPC-20A凝胶渗透色谱仪 日本岛津公司;Nicolet-5700傅里叶变换红外光谱仪 美国Thermo公司;MDRP-5离心式喷雾干燥塔 无锡现代喷雾干燥设备有限公司;SA402B电子舌 日本INSENT公司。
1.2 实验方法
1.2.1 大米蛋白肽的制备
以RP为原料,用纯净水配制10%(m/m)浓度的RP溶液,电动搅拌器搅拌分散均匀,55 ℃水浴搅拌30 min,然后根据不同酶解路线酶的加入顺序将胰蛋白酶(A)和碱性蛋白酶(B)加入RP溶液中。根据前期预实验结果,确定了双酶不同酶解路线的酶解条件,各路线酶解过程中控制双酶的总添加量(2%)、添加比例(A酶:B酶=2:1)和酶解温度(55 ℃)不变,不同酶解路线大米蛋白肽的具体制备方法如下:
A1B1组:调节pH至8.0,添加2%的组合酶,酶解反应5 h。
A1B2组:调节pH至8.0,添加1.33%的A酶,酶解反应4 h;再将pH调至8.5,加入0.67%的B酶,酶解反应1 h。
A2B1组:调节pH至8.5,添加0.67%的B酶,酶解反应1 h;再将pH调至8.0,加入1.33%的A酶,酶解反应4 h。
A1*B2组:调节pH至8.0,添加1.33%的A酶,酶解反应4 h;将温度迅速升至95 ℃,灭酶10 min,立刻冷却至55 ℃,再调节pH至8.5,加入0.67%的B酶,酶解反应1 h。
A2B1*组:调节pH至8.5,添加0.67%的B酶,酶解反应1 h;将温度迅速升至95 ℃,灭酶10 min,立刻冷却至55 ℃,再调节pH至8.0,加入1.33%的A酶,酶解反应4 h。
各组酶解反应完成后,先进行灭酶处理(95 ℃水浴10 min),然后离心(4800 r/min、20 min),取上清液喷雾干燥成粉,制得不同酶解路线大米蛋白肽。
1.2.2 蛋白回收率的测定
参照GB 5009.5-2016,采用凯氏定氮法分别测定RP和制备的蛋白酶解上清液中总蛋白质质量,按公式(1)计算蛋白回收率。
蛋白回收率(%)=A0A×100 (1) 式中:A0为RP酶解上清液中总蛋白质质量,g;A为RP中总蛋白质质量,g。
1.2.3 水解度的测定
采用甲醛滴定法测定蛋白水解度[16],取蛋白酶解上清液5 mL于烧杯中,加入60 mL蒸馏水,用0.1 mol/L NaOH标准溶液滴定至pH8.2,加入20 mL甲醛溶液(pH8.2),记录将其pH滴至9.2时所消耗的NaOH标准溶液的体积,用蒸馏水做空白对照,按公式(2)计算蛋白水解度。
DH(\%)=C×(V1−V2)×V5×M×N×htot×100 (2) 式中:DH为蛋白水解度,%;C为氢氧化钠标准溶液浓度,0.1 mol/L;V1为样品溶液滴定所消耗的NaOH标准溶液的体积,mL;V2为空白溶液滴定所消耗的NaOH标准溶液的体积,mL;V为酶解上清液的总体积,mL;5为取样体积,mL;M为样品质量,g;N为原料中蛋白质含量,%;htot为每克底物蛋白质肽键的毫摩尔数,这通常是一个经验值,RP的htot值为7.40 mmol/g[17]。
1.2.4 基本成分
根据GB 5009.3-2016的直接干燥法测定水分含量;根据GB 5009.4-2016的第一法(食品中总灰分的测定)测定灰分含量;根据GB 5009.5-2016的凯氏定氮法测定蛋白质含量;根据GB 5009.6-2016的索氏抽提法测定脂肪含量。
1.2.5 溶解性的测定
称取1.000 g样品溶于20 mL PBS溶液(10 mmol/L)中,调整溶液pH至7.0,室温搅拌30 min后离心(4800 r/min、20 min),取上清液待用。使用凯氏定氮仪测定上清液中蛋白的含量。蛋白的溶解性采用氮溶指数(NSI)表示,按公式(3)进行计算[18]。
NSI(%)=m1m0×100 (3) 式中:NSI为氮溶指数,%;m0为样品中蛋白质质量,g;m1为上清液中蛋白质质量,g。
1.2.6 微观结构的测定
取少量样品于双面导电胶上,除去多余样品,使其均匀分布、呈现稀薄一层,用离子溅射仪在样品上喷金1 min,形成导电层,然后置于电子扫描显微镜中观察样品的形貌,在加速电压为5.0 kV的条件下,在500倍和1000倍的放大倍数下对样品进行拍照观察[19]。
1.2.7 可溶性固形物含量的测定
使用数字折光仪测定蛋白酶解液的可溶性固形物含量。
1.2.8 肽含量的测定
参照胡武瑶等[20]的方法做适当调整。准确称取0.5 g样品,加入10 mL 15%三氯乙酸(TCA)溶液,混匀静置以沉淀其中的蛋白质,4000 r/min离心10 min,收集上清液备用,采用凯氏定氮法测定上清液中蛋白质含量。检验结果根据样品的干燥失重,折算成干基,即为酸溶蛋白的含量。
称取0.02~0.03 g样品,精确至0.0001 g,采用3.5%磺基水杨酸溶液将样品溶解均匀。随后将样品溶液转移至50 mL容量瓶中,并采用蒸馏水定容。将样品溶液离心(4000 r/min,5 min),取上清液过0.45 μm滤膜,将滤液转移至50 mL容量瓶中,采用蒸馏水定容,并摇匀。然后按照GB/T 5009.124-2016规定的方法,采用全自动氨基酸分析仪测定样品中游离氨基酸的含量。
肽含量按公式(4)进行计算[20]。
肽含量(%)=A1−A2 (4) 式中:A1为样品中酸溶蛋白的含量,%;A2为样品中游离氨基酸的含量,%。
1.2.9 氨基酸组成的测定
根据Xie等[21]的方法对样品氨基酸组成进行分析。将1.0 g样品、10 mL盐酸溶液(6 mol/L)和1.0 g苯酚加入密封管中,氮气处理15 min,封口。在110 ℃的电热鼓风恒温箱内水解24 h,取出冷却至室温。打开密封管,将水解后的样品转移到一个50 mL的容量瓶中,采用蒸馏水定容,经滤纸过滤。取1.0 mL过滤后的样品,在60 ℃水浴中蒸发至干燥,然后用3~5 mL盐酸溶液(0.02 mol/L)稀释干燥样品。稀释后的样品用0.22 μm滤膜过滤,然后使用全自动氨基酸分析仪进行分析。
1.2.10 表面疏水性的测定
根据Yang等[10]的方法稍作修改,以8-苯胺基-1-奈磺酸(ANS)为荧光探针,采用日立F7000荧光光谱仪进行分析。将样品溶于PBS溶液(10 mmol/L)中配制成浓度在0.05~2.00 mg/mL的溶液。取3 mL样品,向其中加入20 μL ANS溶液(8 mmol/L)后进行测定。激发波长为390 nm,发射波长为400~600 nm,激发狭缝5.0 nm,发射狭缝5.0 nm。以最大荧光强度为纵坐标,蛋白浓度(mg/mL)为横坐标绘图,初始斜率即为蛋白质的表面疏水性。
1.2.11 内源荧光光谱的测定
根据黄金梅[22]的方法,采用日立F7000荧光光谱仪对蛋白内源荧光进行分析。将样品溶于PBS溶液(10 mmol/L)配制成浓度为0.1 mg/mL的溶液进行测量。荧光的关键参数为:激发波长290 nm,发射波长300~500 nm。
1.2.12 二级结构的测定
称取约1 mg样品和140 mg干燥的溴化钾置于玛瑙研钵中混合研磨均匀,放入锭剂成型器中,加压处理得到一定直径及厚度的透明薄片,采用傅里叶红外光谱仪测定波数范围4000~400 cm−1内的吸收光谱,分辨率4 cm−1,扫描次数32次。红外吸收曲线用OMNIC 8.0和PeakFitv 4.12软件进行分析[9]。
1.2.13 分子量分布的测定
根据Liu等[23]描述的方法进行适当修改,通过使用凝胶色谱系统(GPC)、TSK gel GMPWXL水相凝胶色谱柱(柱温35 ℃)、RID-20示差折光检测器来分析蛋白质的分子量分布,标准样品采用窄分步聚乙二醇(PEO)。首先将蛋白溶解在0.2 mol/L NaNO3(含0.05%NaN3)的流动相中,充分水化,蛋白浓度稀释至10 mg/mL左右,过0.45 μm的滤膜,以0.6 mL/min的恒定流速洗脱滤液。
1.2.14 电子舌分析
采用电子舌智能味觉分析系统,客观评价样品的苦味、咸味、鲜味和涩味[24]。分别称取0.5 g样品,用30 mL去离子水充分溶解后转移到容量瓶定容到100 mL,定容后样品为电子舌待测液。数据采集前,对电子舌进行传感器活化,Sensor check自检等操作,确保传感器的稳定性和检测数据的可靠性与稳定性。将100 mL待测液置于电子舌专用容器中,选择合适的传感器和测试模式。每个样品测定4次后,选取3次稳定的电子舌响应值进行后续分析。电子舌参数:检测温度25 ℃,pH在2至8之间,检测时间30 s。
1.2.15 抗氧化活性的测定
1.2.15.1 DPPH自由基清除能力的测定
根据赵佳佳[25]的方法测定样品的DPPH自由基清除率,并稍作修改。取1 mL不同浓度的样品溶液加入到3 mL DPPH溶液(50 μg/mL,用95%乙醇配制)中,涡旋振荡5 s,室温下避光静置30 min,在517 nm下测定样品体系吸光度值。以谷胱甘肽做阳性对照,样品对DPPH自由基的清除率按公式(5)计算。
DPPH自由基清除率(%)=(1−A1−A2A3)×100 (5) 式中:A1为样品溶液与DPPH溶液体系的吸光度值;A2为样品溶液与95%乙醇体系的吸光度值;A3为水与DPPH溶液体系的吸光度值。
1.2.15.2 还原能力的测定
根据卢知浩等[26]的方法测定样品的还原能力。取1 mL不同浓度的样品溶液,依次加入2.5 mL 0.2 mol/L PBS溶液(pH6.6)和2.5 mL 1%铁氰化钾溶液混匀,50 ℃下反应20 min,冰水浴冷却加入2.5 mL 10%三氯乙酸溶液,静置沉淀10 min。取上清液2.5 mL,加入0.5 mL 0.1%三氯化铁溶液和2.5 mL去离子水混匀,50 ℃下水浴10 min,以蒸馏水调零并在700 nm下测定吸光度。以蒸馏水作空白对照,谷胱甘肽作阳性对照。
1.3 数据处理
所有试验平行进行3次,试验结果以平均值±标准差表示。利用IBM SPSS Statistics 25和Origin 2021进行数据分析和图表绘制。
2. 结果与分析
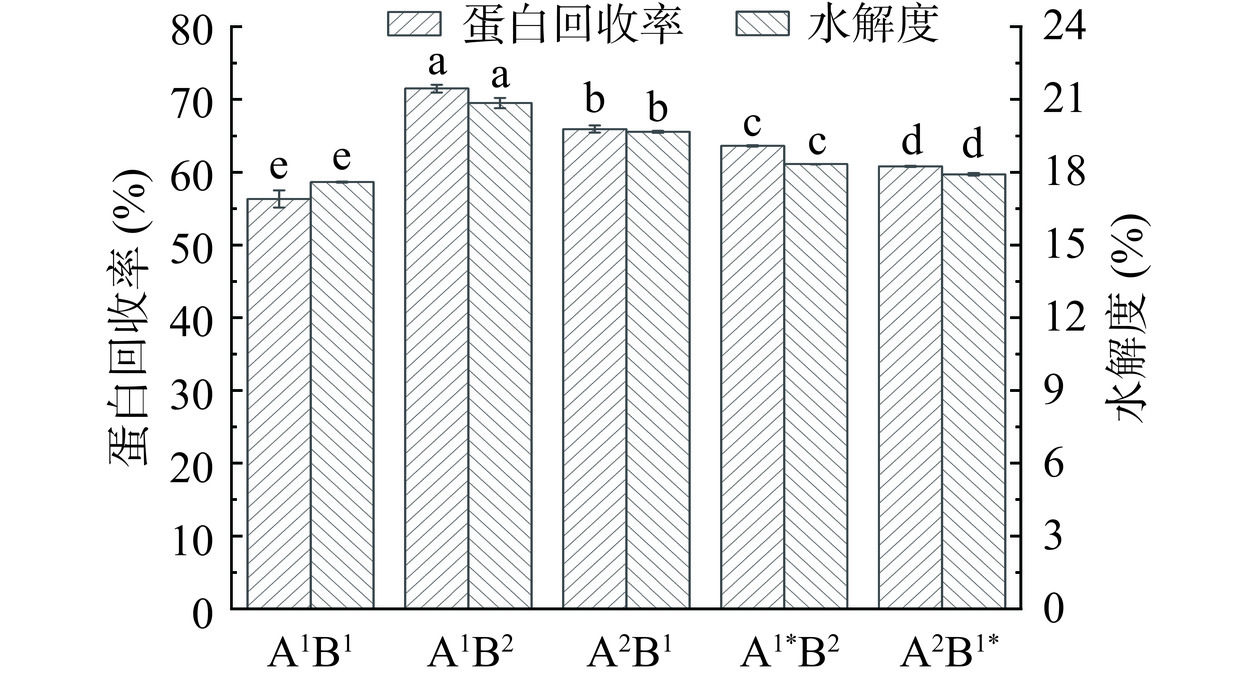
2.1 蛋白的回收率和水解度
由图1可知,酶解路线不同,制备的大米蛋白肽的蛋白回收率和水解度不同,不同酶解路线的蛋白回收率与水解度呈正相关,水解度越大,蛋白回收率越高,此结果与高瑞[27]的研究一致。蛋白回收率和水解度从大到小依次为A1B2﹥A2B1﹥A1*B2﹥A2B1*﹥A1B1。A1B2组蛋白回收率和水解度最高,分别为71.50%和20.85%;A1B1组蛋白回收率和水解度最低,分别为56.32%和17.60%。A1B2组和A2B1组的蛋白回收率和水解度高于A1*B2组和A2B1*组,这可能是因为A1B2组和A2B1组酶解过程中无灭酶操作,使得第一种酶仍能在加入第二种酶后的酶解阶段起作用,促使RP被水解得更为彻底。A1B2组和A1*B2组的蛋白回收率和水解度分别高于A2B1组和A2B1*组,这可能是RP在酶解之初裸露的A酶作用位点比B酶多,RP经A酶先作用后,暴露出更多有利于B酶的作用位点。A1B1组蛋白回收率和水解度最低,这可能是由于两种酶同时存在造成酶之间相互限制,例如竞争同一作用位点或者两种酶的作用位点靠近时由于空间位阻使得一种酶不能及时发挥作用,导致两种酶均不能充分发挥作用。夏易玄[24]的研究也显示双酶分步酶解的蛋白回收率比双酶同步酶解高。从生产经济上考虑,A1B2组工艺最佳,其次为A2B1组。
2.2 基本成分
由表1可知,不同酶解路线大米蛋白肽的基本成分不同。RP经酶解后蛋白质和脂肪含量基本降低,水分和灰分含量增加。蛋白质含量是评判大米蛋白肽品质的重要指标,蛋白质含量越高,大米蛋白肽品质越好[20]。以蛋白质含量为指标来评价,A2B1组品质最佳,蛋白质含量高达90.69%。A1B2组和A1*B2组蛋白质含量显著低于其他组(P<0.05),灰分含量高于6%,这可能是因为在第一酶解阶段,A酶比B酶更易作用于RP,使得溶液的pH下降幅度更大,而为了达到第二酶解阶段酶的作用pH,加入的酸碱溶液差值大于第一阶段,也就是说A1B2组和A1*B2组在酶解过程中加入了更多的酸碱溶液,使得大米蛋白肽中灰分含量上升,同时导致蛋白含量下降。
表 1 RP及不同酶解路线大米蛋白肽的基本成分Table 1. Basic components of rice protein and rice protein peptides with different enzymatic hydrolysis routes样品 成分(%) 蛋白质(以干基计) 水分 灰分 脂肪 RP 89.80±0.27a 4.05±0.05f 2.24±0.06f 0.79±0.08a A1B1 87.10±1.04b 5.91±0.02e 2.80±0.08e 0.12±0.02bc A1B2 80.67±0.26c 6.07±0.04d 7.95±0.10b 0.06±0.01c A2B1 90.69±0.68a 7.59±0.02a 3.15±0.01d 0.16±0.03bc A1*B2 78.54±0.27d 6.95±0.05b 8.83±0.16a 0.14±0.01bc A2B1* 88.44±0.52b 6.73±0.05c 3.50±0.05c 0.13±0.02bc 注:表中数据为平均值±标准差,同一列不同小写字母表示数据间具有显著性(P<0.05);表2、表4同。 2.3 溶解性
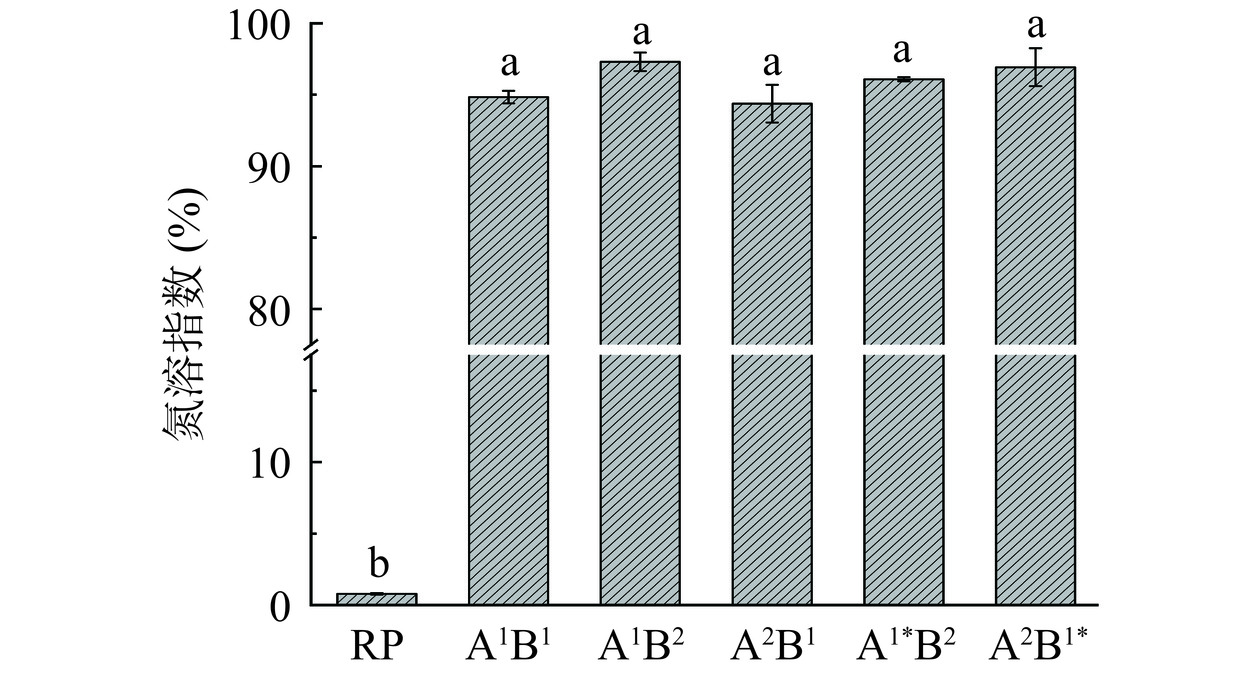
蛋白的溶解性在食品加工中具有重要意义,溶解性的好坏影响着蛋白质的其他功能性质,如凝胶性、起泡性和乳化性等[28]。由图2可知,未经酶解的RP的氮溶指数极低(约1%),溶解性很差,这正是其多种功能性质较差的主要原因。经酶水解后,大米蛋白肽的氮溶指数明显增加,不同酶解路线大米蛋白肽的氮溶指数均在95%左右,各组之间无显著性差异(P>0.05)。这一结果说明各路线的水解程度较高,RP水解比较彻底,水解得到的肽段均能较好地溶于水中,继续酶解只是作用于原本能溶的肽段生成也能溶解的小肽,溶解性并不会增加。由此可知,当蛋白水解程度较高时,酶解路线的不同不会对大米蛋白肽的溶解性造成影响。
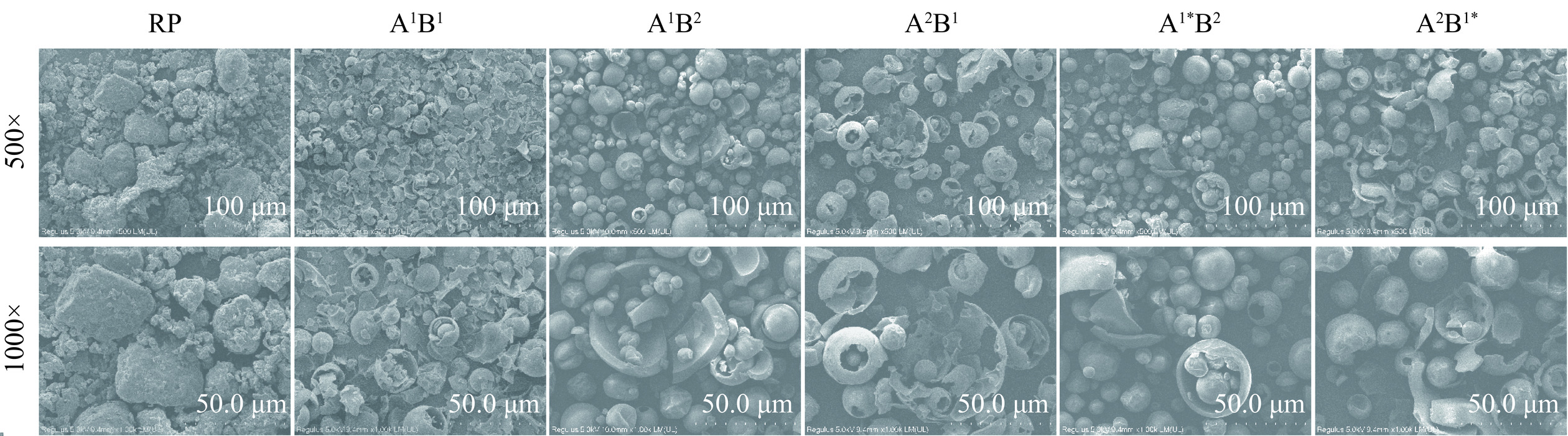
2.4 微观结构
由图3可知,RP为不规则块状,且颗粒大小差别较大,经酶水解后,不规则块状的RP变为了球体状的大米蛋白肽,颗粒体积显著减小,且大小分布也更为均一。不同酶解路线大米蛋白肽的微观形貌与RP截然不同,这可能是因为加工方式不同所致,RP为气流干燥后粉碎所得,不同酶解路线大米蛋白肽为喷雾干燥所得。A1B2组和A1*B2组球体壁较厚,A2B1组和A2B1*组球体壁较薄,而A1B1组基本为碎片和破碎球,颗粒大小最为均一,这可能是因为喷雾前各路线酶解溶液的固形物含量不同所致,固形物含量越高,粉体比重越大,体现在微观形貌上即为球体壁越厚,A1B1、A1B2、A2B1、A1*B2和A2B1*酶解溶液的固形物含量依次为7.9%、9.8%、8.7%、9.2%和8.7%。由此可知,A1B2组和A1*B2组的粉体性质更好,A2B1组和A2B1*组其次,A1B1组最差。此外,蛋白分子变小,会使得蛋白分子与水分子接触位点变多,有利于蛋白在溶液中溶解,导致溶解性增加[29]。此结论与溶解性的结果相符合。
2.5 肽含量
肽含量是评价大米蛋白肽品质的关键指标,肽含量越高,大米蛋白肽品质越好[20]。由表2可知,不同的酶解路线会影响大米蛋白肽的品质。肽含量结果表明,不同酶解路线大米蛋白肽的肽含量在70%左右。以肽含量为指标来评价,A2B1组品质最佳,肽含量高达72.73%,其次为A2B1*组和A1B1组。通过对比表1蛋白质含量可知,各路线大米蛋白肽的酸溶蛋白超过总蛋白的93.57%,这说明RP经酶水解后多为小分子酸溶性肽。因为大分子蛋白在酸性条件下易沉淀,而小分子蛋白水解物易溶于酸性溶液[30]。游离氨基酸结果表明,不同酶解路线大米蛋白肽的游离氨基酸含量在10.55%~14.35%之间,而RP中几乎没有游离氨基酸(0.011%)存在,这说明RP经酶水解产生了大量游离氨基酸。
表 2 不同酶解路线大米蛋白肽的肽含量Table 2. Peptide content of rice protein peptides with different enzymatic hydrolysis routes样品 含量(%) 酸溶蛋白 游离氨基酸 肽含量 A1B1 84.16±0.94a 14.35±2.18a 69.81±1.24ab A1B2 79.37±0.20b 11.31±1.70a 68.06±1.49b A2B1 84.86±0.52a 12.13±2.06a 72.73±1.54a A1*B2 77.74±0.84b 10.55±1.71a 67.19±0.88b A2B1* 83.57±0.39a 12.82±2.02a 70.76±1.63ab 2.6 氨基酸组成
由表3可知,RP和不同酶解路线大米蛋白肽具有相似的氨基酸组成和含量,其中天冬氨酸、谷氨酸和精氨酸含量较高,占总氨基酸含量的35.44%~38.35%,是RP和不同酶解路线大米蛋白肽的主要氨基酸。不同酶解路线的必需氨基酸含量比RP低,A1B2组必需氨基酸含量为32.03%,营养价值最高,其次为A2B1*组、A2B1组和A1*B2组。限制性氨基酸(赖氨酸)含量增加,更接近于婴儿配方食品中赖氨酸的推荐值(395 mg/g N),使其有望成为婴幼儿食品中的蛋白替代物。不同酶解路线的疏水性氨基酸含量有所降低,降幅在4.8%~9.6%之间。有研究表明,肽的抗氧化活性与疏水氨基酸含量有关,疏水性氨基酸含量越高,抗氧化能力越强[31]。
表 3 RP及不同酶解路线大米蛋白肽的氨基酸组成Table 3. Amino acid composition of rice protein and rice protein peptides with different enzymatic hydrolysis routes氨基酸 含量(g/100 g蛋白) RP A1B1 A1B2 A2B1 A1*B2 A2B1* Asp(天冬氨酸) 8.81±0.02d 10.48±0.07a 9.94±0.02c 10.44±0.09a 10.26±0.05b 10.27±0.03b Thr(苏氨酸) 3.55±0.08a 3.62±0.04a 3.63±0.10a 3.68±0.04a 3.61±0.06a 3.69±0.10a Ser(丝氨酸) 5.01±0.05b 5.19±0.06a 5.06±0.07ab 5.18±0.11ab 5.13±0.12ab 5.20±0.03a Glu(谷氨酸) 18.29±0.01e 18.56±0.02c 18.47±0.02d 19.29±0.06a 19.00±0.10b 19.14±0.14ab Gly(甘氨酸) 4.34±0.03c 5.25±0.04a 4.92±0.06b 5.31±0.04a 5.30±0.02a 5.27±0.07a Ala(丙胺酸) 5.58±0.03b 5.80±0.06a 5.66±0.05b 5.86±0.08a 5.81±0.03a 5.88±0.09a Cys(半胱氨酸) 3.75±0.07a 2.92±0.07c 3.17±0.06bc 3.25±0.05b 3.29±0.04b 3.10±0.11bc Val(缬氨酸) 6.05±0.04c 6.23±0.03b 6.28±0.05ab 6.36±0.04a 6.22±0.05b 6.36±0.02a Met(蛋氨酸) 2.33±0.12a 1.63±0.10bc 1.80±0.03b 1.76±0.09b 1.70±0.05bc 1.82±0.06b Ile(异亮氨酸) 4.27±0.07ab 4.20±0.03b 4.35±0.08a 4.41±0.08a 4.31±0.07a 4.32±0.05a Leu(亮氨酸) 8.22±0.01a 6.97±0.05c 7.45±0.05b 7.06±0.05c 7.10±0.05c 7.12±0.09c Tyr(酪氨酸) 5.88±0.01a 4.49±0.09c 4.92±0.09b 4.32±0.08d 4.46±0.06c 4.47±0.02c Phe(苯丙氨酸) 5.89±0.07a 4.45±0.04d 5.02±0.03b 4.57±0.07d 4.77±0.08c 4.59±0.11cd Lys(赖氨酸) 2.85±0.09c 3.72±0.07a 3.48±0.04b 3.59±0.03a 3.67±0.09a 3.56±0.07a His(组氨酸) 2.24±0.02a 2.25±0.02a 2.26±0.04a 2.29±0.03a 2.28±0.02a 2.32±0.09a Arg(精氨酸) 8.34±0.02c 9.31±0.02a 8.72±0.06b 7.46±0.10f 8.02±0.06d 7.78±0.07e Pro(脯氨酸) 4.60±0.02c 4.94±0.02b 4.86±0.07b 5.18±0.08a 5.08±0.02a 5.11±0.05a 必需氨基酸(%) 33.17±0.07a 30.81±0.05d 32.03±0.05b 31.43±0.06c 31.38±0.06c 31.47±0.07c 疏水氨基酸(%) 37.13±0.05a 34.77±0.06c 35.33±0.06b 33.57±0.07f 34.17±0.05d 33.88±0.07e 注:表中数据为平均值±标准差,同一行不同小写字母表示数据间具有显著性(P<0.05)。 2.7 表面疏水性
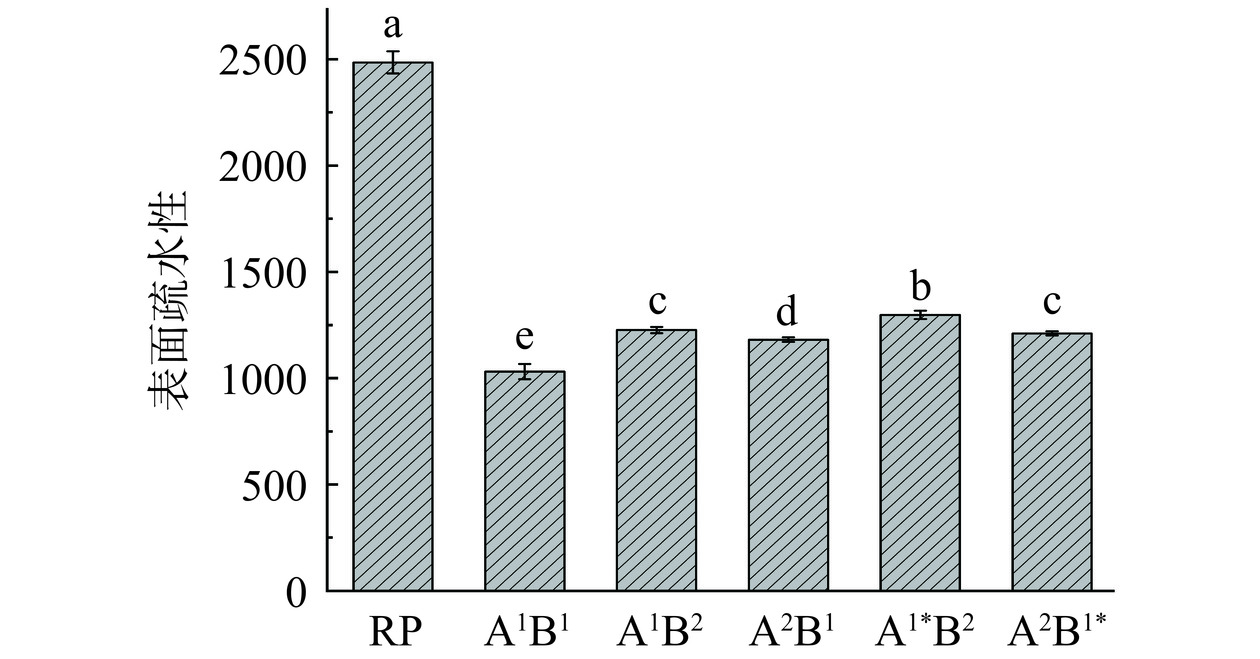
由图4可知,不同酶解路线大米蛋白肽的表面疏水性比RP低,A1B1组表面疏水性最低,其次为A2B1组。结合图1可知,不同酶解路线的表面疏水性随先水解度的增加而增加,这可能是随着水解度的增加,蛋白结构被逐渐展开,疏水基团逐渐暴露。但当水解度达到一定程度后,表面疏水性随水解度的增加反而下降,A1B2和A2B1呈现的就是这一现象,这可能是在进一步酶解过程中,蛋白酶作用于外露的疏水基团,使得蛋白表面疏水性降低[22];同时,酶解后的产物可能由于疏水相互作用而发生聚集,使得暴露在水环境中的疏水基团量降低,蛋白表面疏水性下降[32]。
2.8 内源荧光
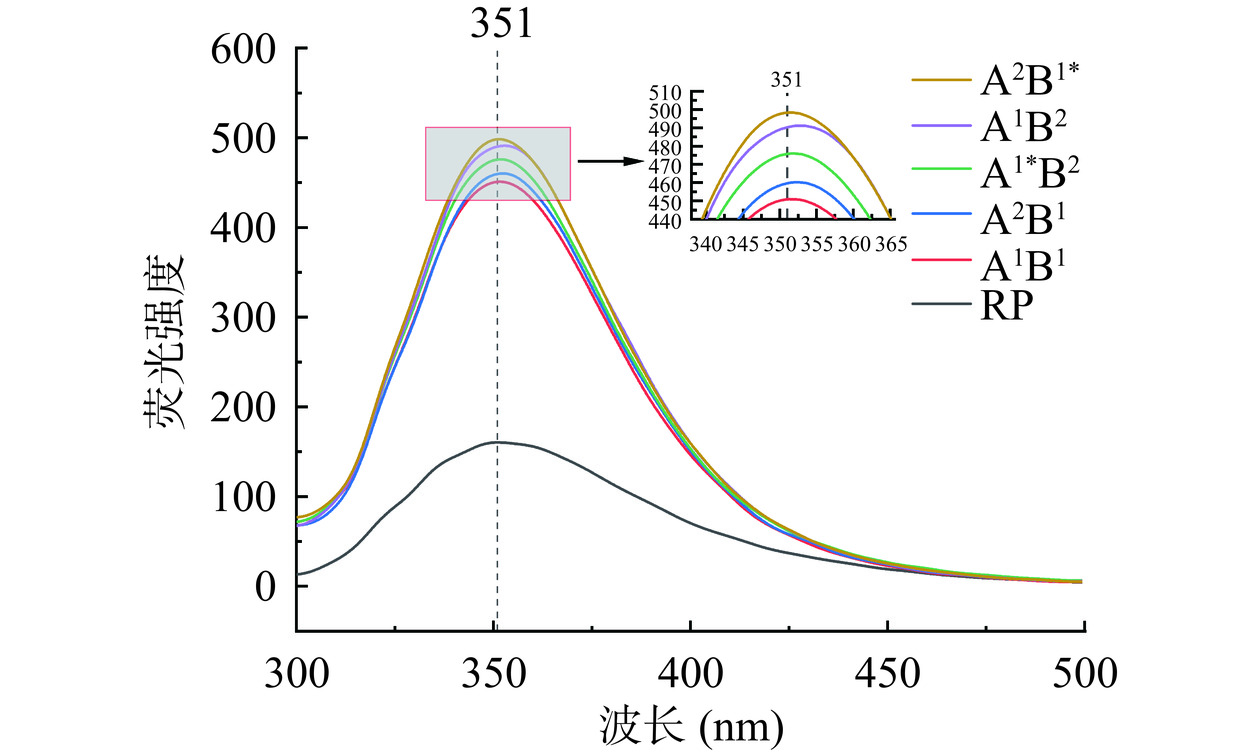
蛋白分子中的芳香族氨基酸(色氨酸Trp、酪氨酸Tyr和苯丙氨酸Phe)残基是产生荧光的天然发生团,这三种氨基酸残基的内源荧光对其所处微环境非常敏感[33]。因此,可以通过观察蛋白的最大荧光强度和最大吸收波长来判断蛋白质三级结构的变化。RP和不同酶解路线大米蛋白肽的内源荧光光谱如图5所示,与RP相比,不同酶解路线大米蛋白肽的荧光强度都明显增大,这说明RP经酶水解,使得更多的芳香族氨基酸残基暴露在溶剂中[34]。不同酶解路线大米蛋白肽之间的荧光强度存在明显差异,荧光强度从小到大依次为RP、A1B1、A2B1、A1*B2、A1B2、A2B1*。相比于RP,不同酶解路线大米蛋白肽的最大吸收波长发生了不同程度的红移,这说明RP经酶水解后,芳香族氨基酸所处微环境的极性增加[35]。以上结果说明RP经酶水解后其三级结构发生了改变。A1B1组对蛋白三级结构的影响最小,其次为A2B1组,这归因于酶解后芳香族氨基酸残基的含量和所处微环境不同。
2.9 二级结构
傅里叶红外光谱中1600~1700 cm−1为酰胺I区,主要是C=O的伸缩振动,常用来反映蛋白质的二级结构,其中1610~1640 cm−1为β-折叠,1640~1650 cm−1为无规则卷曲,1650~1660 cm−1为α-螺旋,1660~1695 cm−1为β-转角[36]。由表4可知,RP经酶水解后β-折叠和无规则卷曲的相对含量下降,α-螺旋和β-转角的相对含量上升,这说明RP经酶水解后,蛋白质结构展开,有序稳定的β-折叠结构被破坏,转变成为相对灵活和舒展的β-转角结构。不同酶解路线大米蛋白肽的二级结构以β-转角为主,占二级结构的44.62%~47.18%,各路线之间无显著差异(P>0.05)。二级结构组成结果说明不同的酶解路线会影响大米蛋白肽的二级结构,β-折叠和β-转角结构受影响较大,α-螺旋和无规则卷曲结构受影响较小,且各二级结构之间变化趋势不一,马晓雨[37]的研究结果也呈现这一现象。
表 4 RP及不同酶解路线大米蛋白肽的二级结构变化Table 4. Secondary structure changes of rice protein and rice protein peptides with different enzymatic hydrolysis routes样品 二级结构组成(%) α-螺旋 β-折叠 β-转角 无规则卷曲 RP 20.77±0.18c 31.62±0.49a 27.41±0.67b 20.21±0.97a A1B1 24.21±0.31ab 12.41±0.68c 47.16±0.93a 17.69±0.15b A1B2 22.60±0.61b 15.71±0.27b 45.57±1.37a 16.12±1.70b A2B1 23.29±0.27ab 16.12±0.17b 44.62±0.62a 15.98±0.18b A1*B2 24.99±0.03a 11.97±0.07c 47.18±0.04a 15.86±0.00b A2B1* 24.73±1.34ab 12.20±1.23c 45.64±2.38a 17.42±0.18b 2.10 分子量分布
现有研究表明,分子量越小的肽,越容易被人体消化吸收,同时可能具有更高的生物活性[38]。由图6(a)可知,不同酶解路线大米蛋白肽的峰型相似,峰较宽,这说明得到的大米蛋白肽分子量分布相近,包含分子量大小不等的多肽。由图6(b)可知,不同酶解路线大米蛋白肽中分子量小于5 kDa的多肽占92.09%~93.71%,分子量小于2 kDa的多肽占58.18%~61.81%,这说明RP经酶水解得比较彻底。总体而言,不同酶解路线大米蛋白肽的分子量分布和多肽占比相似度较高,这可能是因为各路线水解程度较高,RP水解产物组成高度相似所致。
2.11 电子舌
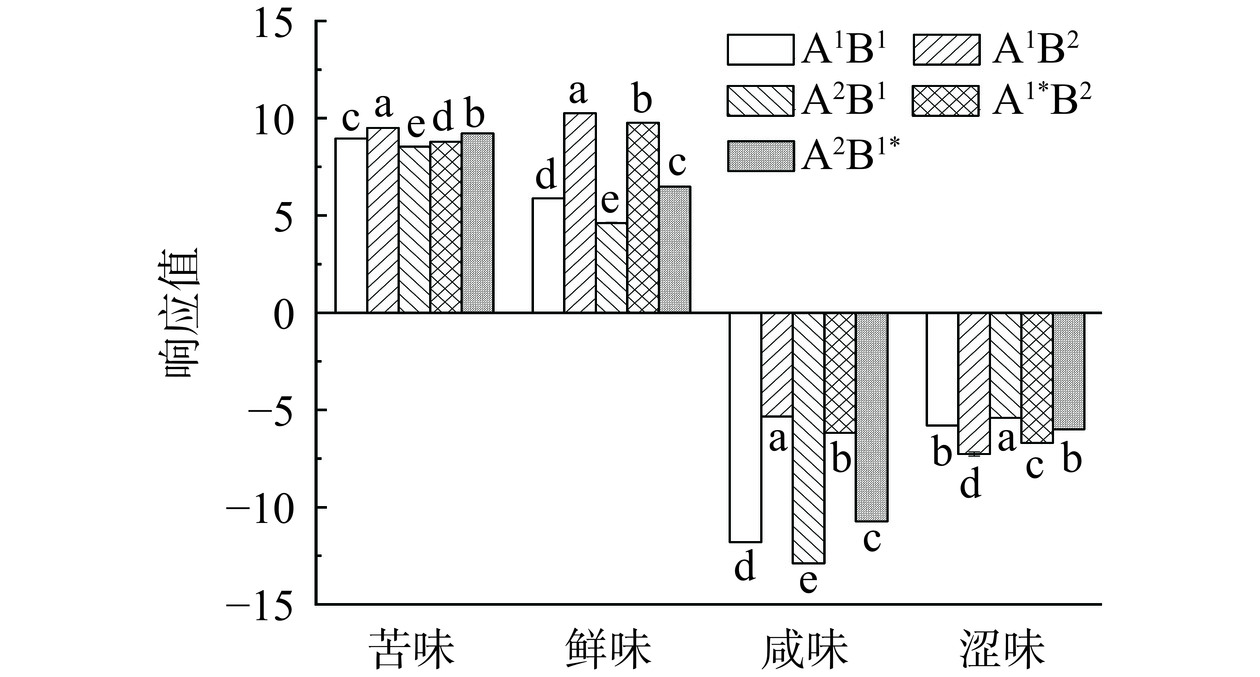
传统的味觉评价主要采用感官评价法,易受主观、环境等因素影响;而电子舌分析能够将检测到的味觉信号转换为味觉测定值,具有客观、准确、重现性好等优势[39]。风味强弱根据响应值大小来评判,响应值越大,风味越强。由图7可知,不同酶解路线大米蛋白肽的苦味、鲜味、咸味和涩味均有明显区别。不同酶解路线大米蛋白肽之间苦味和涩味的响应值变化较小,口感上区别甚微,这可能是各路线RP水解产物中苦味肽和涩味肽含量相近。不同酶解路线大米蛋白肽之间鲜味和咸味的响应值变化较大,A1B2组和A1*B2组鲜味和咸味显著强于其他组,这说明RP先经A酶水解,再经B酶水解能够产生更多的鲜味肽和咸味肽。考虑人们对苦味、咸味和涩味比较敏感,所以从风味上来评价,A2B1组大米蛋白肽应更易被消费者所接受。
2.12 抗氧化活性
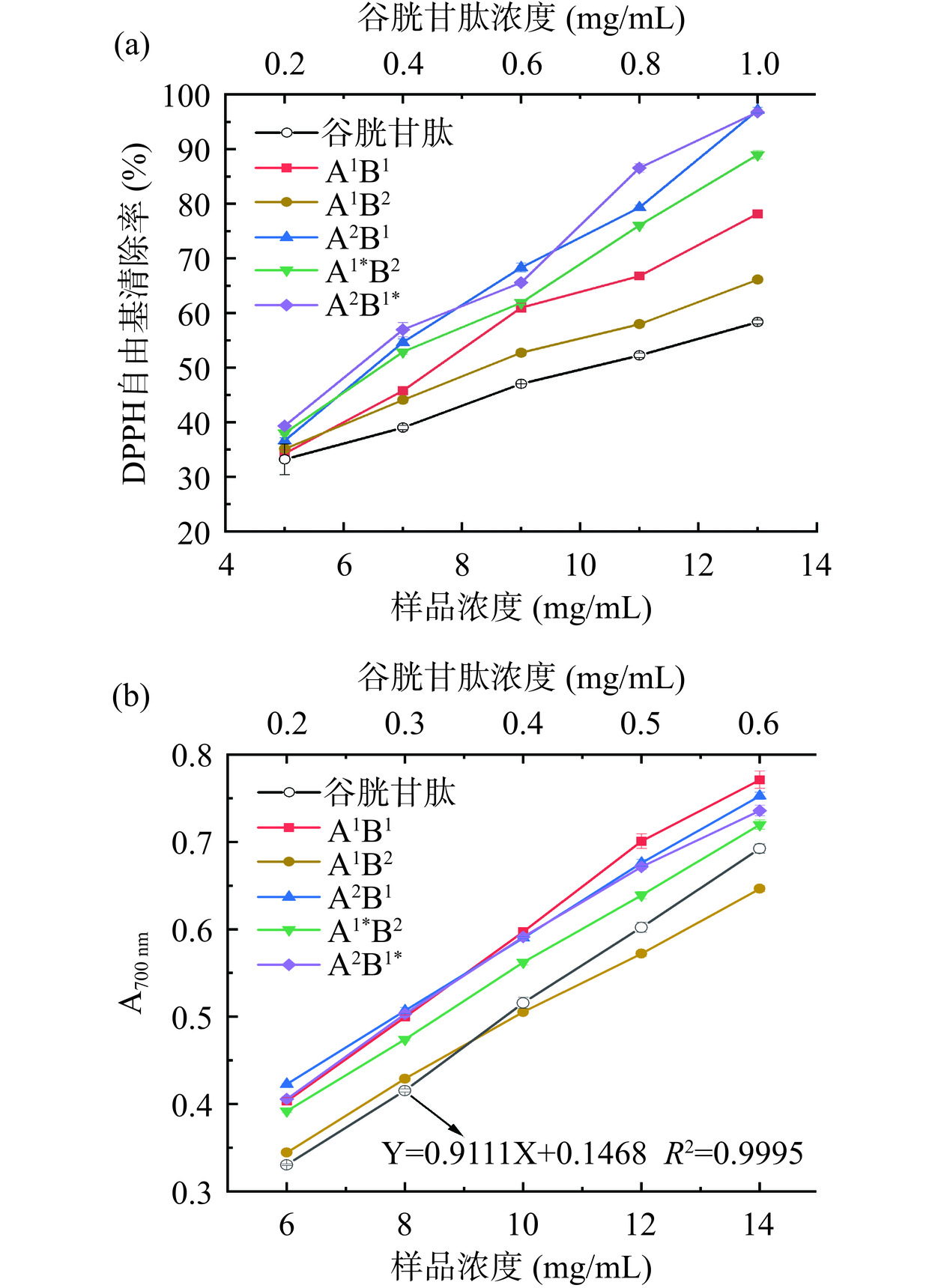
由图8(a)可知,随着肽浓度的增加,DPPH自由基清除率呈现上升趋势。通过计算可知谷胱甘肽、A1B1、A1B2、A2B1、A1*B2和A2B1*的IC50依次为0.7、7.6、8.7、6.6、6.8和6.4 mg/mL,不同酶解路线大米蛋白肽的DPPH自由基清除能力远低于谷胱甘肽。由图8(b)可知,不同酶解路线大米蛋白肽和谷胱甘肽的吸光度值随浓度的增加而增加。同一吸光度值下,样品浓度越低,还原能力越强。当吸光度值为0.5时,谷胱甘肽、A1B1、A1B2、A2B1、A1*B2和A2B1*的浓度依次为0.4、8.0、10.0、7.8、8.6和8.0 mg/mL。结合上述两个结果可知,A2B1组和A2B1*组的抗氧化活性较强,这说明RP先经B酶水解,再经A酶水解得到的大米蛋白肽具有较好的抗氧化活性。柳芬芬[40]研究指出蛋白质中的疏水性氨基酸含量与抗氧化活性有关,疏水性氨基酸含量越高,抗氧化活性越强。本研究结果显示各样品的抗氧化活性与其疏水性氨基酸含量无明显关系,说明肽的抗氧化活性不仅与疏水性氨基酸含量有关,可能还与肽的序列有关[41]。
3. 结论
胰蛋白酶(A)和碱性蛋白酶(B)不同酶解路线会影响大米蛋白肽的蛋白回收率、水解度、基本成分、微观结构、肽含量、氨基酸组成、表面疏水性、二级结构、三级结构、风味和抗氧化活性,对溶解性和分子量分布无显著影响。从基本成分、肽含量、氨基酸组成、风味和抗氧化活性综合评价,A2B1组大米蛋白肽品质最好。各路线的微观结构存在明显区别,A1B2组和A1*B2组球体壁较厚,A2B1组和A2B1*组球体壁较薄,A1B1组基本为碎片和破碎球,较为均一。各路线的二级结构以β-转角为主,占二级结构的44.62%~47.18%;三级结构差异显著,A1B1组对蛋白三级结构的影响最小,其次为A2B1组。根据电子舌结果可知,A2B1组咸味和苦味最弱,更容易被人们所接受。结合DPPH自由基清除能力和还原能力分析,A2B1组和A2B1*组的抗氧化活性最强。本研究为不同品质大米蛋白肽的酶解路线选择提供了理论依据和数据参考。今后可深层次探究不同酶解路线对大米蛋白肽序列和生物活性的影响。
-
表 1 RP及不同酶解路线大米蛋白肽的基本成分
Table 1 Basic components of rice protein and rice protein peptides with different enzymatic hydrolysis routes
样品 成分(%) 蛋白质(以干基计) 水分 灰分 脂肪 RP 89.80±0.27a 4.05±0.05f 2.24±0.06f 0.79±0.08a A1B1 87.10±1.04b 5.91±0.02e 2.80±0.08e 0.12±0.02bc A1B2 80.67±0.26c 6.07±0.04d 7.95±0.10b 0.06±0.01c A2B1 90.69±0.68a 7.59±0.02a 3.15±0.01d 0.16±0.03bc A1*B2 78.54±0.27d 6.95±0.05b 8.83±0.16a 0.14±0.01bc A2B1* 88.44±0.52b 6.73±0.05c 3.50±0.05c 0.13±0.02bc 注:表中数据为平均值±标准差,同一列不同小写字母表示数据间具有显著性(P<0.05);表2、表4同。 表 2 不同酶解路线大米蛋白肽的肽含量
Table 2 Peptide content of rice protein peptides with different enzymatic hydrolysis routes
样品 含量(%) 酸溶蛋白 游离氨基酸 肽含量 A1B1 84.16±0.94a 14.35±2.18a 69.81±1.24ab A1B2 79.37±0.20b 11.31±1.70a 68.06±1.49b A2B1 84.86±0.52a 12.13±2.06a 72.73±1.54a A1*B2 77.74±0.84b 10.55±1.71a 67.19±0.88b A2B1* 83.57±0.39a 12.82±2.02a 70.76±1.63ab 表 3 RP及不同酶解路线大米蛋白肽的氨基酸组成
Table 3 Amino acid composition of rice protein and rice protein peptides with different enzymatic hydrolysis routes
氨基酸 含量(g/100 g蛋白) RP A1B1 A1B2 A2B1 A1*B2 A2B1* Asp(天冬氨酸) 8.81±0.02d 10.48±0.07a 9.94±0.02c 10.44±0.09a 10.26±0.05b 10.27±0.03b Thr(苏氨酸) 3.55±0.08a 3.62±0.04a 3.63±0.10a 3.68±0.04a 3.61±0.06a 3.69±0.10a Ser(丝氨酸) 5.01±0.05b 5.19±0.06a 5.06±0.07ab 5.18±0.11ab 5.13±0.12ab 5.20±0.03a Glu(谷氨酸) 18.29±0.01e 18.56±0.02c 18.47±0.02d 19.29±0.06a 19.00±0.10b 19.14±0.14ab Gly(甘氨酸) 4.34±0.03c 5.25±0.04a 4.92±0.06b 5.31±0.04a 5.30±0.02a 5.27±0.07a Ala(丙胺酸) 5.58±0.03b 5.80±0.06a 5.66±0.05b 5.86±0.08a 5.81±0.03a 5.88±0.09a Cys(半胱氨酸) 3.75±0.07a 2.92±0.07c 3.17±0.06bc 3.25±0.05b 3.29±0.04b 3.10±0.11bc Val(缬氨酸) 6.05±0.04c 6.23±0.03b 6.28±0.05ab 6.36±0.04a 6.22±0.05b 6.36±0.02a Met(蛋氨酸) 2.33±0.12a 1.63±0.10bc 1.80±0.03b 1.76±0.09b 1.70±0.05bc 1.82±0.06b Ile(异亮氨酸) 4.27±0.07ab 4.20±0.03b 4.35±0.08a 4.41±0.08a 4.31±0.07a 4.32±0.05a Leu(亮氨酸) 8.22±0.01a 6.97±0.05c 7.45±0.05b 7.06±0.05c 7.10±0.05c 7.12±0.09c Tyr(酪氨酸) 5.88±0.01a 4.49±0.09c 4.92±0.09b 4.32±0.08d 4.46±0.06c 4.47±0.02c Phe(苯丙氨酸) 5.89±0.07a 4.45±0.04d 5.02±0.03b 4.57±0.07d 4.77±0.08c 4.59±0.11cd Lys(赖氨酸) 2.85±0.09c 3.72±0.07a 3.48±0.04b 3.59±0.03a 3.67±0.09a 3.56±0.07a His(组氨酸) 2.24±0.02a 2.25±0.02a 2.26±0.04a 2.29±0.03a 2.28±0.02a 2.32±0.09a Arg(精氨酸) 8.34±0.02c 9.31±0.02a 8.72±0.06b 7.46±0.10f 8.02±0.06d 7.78±0.07e Pro(脯氨酸) 4.60±0.02c 4.94±0.02b 4.86±0.07b 5.18±0.08a 5.08±0.02a 5.11±0.05a 必需氨基酸(%) 33.17±0.07a 30.81±0.05d 32.03±0.05b 31.43±0.06c 31.38±0.06c 31.47±0.07c 疏水氨基酸(%) 37.13±0.05a 34.77±0.06c 35.33±0.06b 33.57±0.07f 34.17±0.05d 33.88±0.07e 注:表中数据为平均值±标准差,同一行不同小写字母表示数据间具有显著性(P<0.05)。 表 4 RP及不同酶解路线大米蛋白肽的二级结构变化
Table 4 Secondary structure changes of rice protein and rice protein peptides with different enzymatic hydrolysis routes
样品 二级结构组成(%) α-螺旋 β-折叠 β-转角 无规则卷曲 RP 20.77±0.18c 31.62±0.49a 27.41±0.67b 20.21±0.97a A1B1 24.21±0.31ab 12.41±0.68c 47.16±0.93a 17.69±0.15b A1B2 22.60±0.61b 15.71±0.27b 45.57±1.37a 16.12±1.70b A2B1 23.29±0.27ab 16.12±0.17b 44.62±0.62a 15.98±0.18b A1*B2 24.99±0.03a 11.97±0.07c 47.18±0.04a 15.86±0.00b A2B1* 24.73±1.34ab 12.20±1.23c 45.64±2.38a 17.42±0.18b -
[1] LIU K L, ZHENG J B, CHEN F S. Heat-induced changes in the physicochemical properties and in vitro digestibility of rice protein fractions[J]. Journal of Food Science and Technology-Mysore,2021,58(4):1368−1377. doi: 10.1007/s13197-020-04648-3
[2] JAYAPRAKASH G, BAINS A, CHAWLA P, et al. A narrative review on rice proteins:Current scenario and food industrial application[J]. Polymers,2022,14(15):3003. doi: 10.3390/polym14153003
[3] YANG J J, MENG D, WU Z J, et al. Modification and solubility enhancement of rice protein and its application in food processing:A review[J]. Molecules,2023,28(10):4078. doi: 10.3390/molecules28104078
[4] 徐兴凤. 酶解大米谷蛋白性质以及多糖对其影响的研究[D]. 南昌:南昌大学, 2016. [XU X F. Study on the properties of limited enzymatic hydrolysis rice gluten and the effects of polysaccharides on its properties[D]. Nanchang:Nanchang University, 2016.] XU X F. Study on the properties of limited enzymatic hydrolysis rice gluten and the effects of polysaccharides on its properties[D]. Nanchang: Nanchang University, 2016.
[5] ASHAOLU T J, SUTTIKHANA I. Plant-based bioactive peptides:A review of their relevant production strategies, in vivo bioactivities, action mechanisms and bioaccessibility[J]. International Journal of Food Science and Technology,2023,58(5):2228−2235. doi: 10.1111/ijfs.16384
[6] WEN C T, ZHANG J X, ZHANG H H, et al. Plant protein-derived antioxidant peptides:Isolation, identification, mechanism of action and application in food systems:A review[J]. Trends in Food Science & Technology,2020,105:308−322.
[7] 唐诚业, 秦琴, 颜正飞, 等. 产大米蛋白水解酶的菌株筛选、酶学性质及制备大米寡肽[J]. 微生物学报,2021,61(5):1200−1210. [TANG C Y, QIN Q, YAN Z F, et al. Screening of rice proteolytic protease-producing strain for preparing ricee oligopeptides[J]. Acta Microbiologica Sinica,2021,61(5):1200−1210.] TANG C Y, QIN Q, YAN Z F, et al. Screening of rice proteolytic protease-producing strain for preparing ricee oligopeptides[J]. Acta Microbiologica Sinica, 2021, 61(5): 1200−1210.
[8] 李颖慧. 碎米酶联微滤制备淀粉糖、大米蛋白、大米肽的研究及工艺优化[D]. 济南:齐鲁工业大学, 2021. [LI Y H. Study on the preparation of starch sugar, rice protein and rice peptide by enzyme-linked microfiltration from broken rice and its optimization[D]. Jinan:Qilu University of Technology, 2021.] LI Y H. Study on the preparation of starch sugar, rice protein and rice peptide by enzyme-linked microfiltration from broken rice and its optimization[D]. Jinan: Qilu University of Technology, 2021.
[9] ONSAARD W, KATE-NGAM S, ONSAARD E. Physicochemical and antioxidant properties of rice bran protein hydrolysates obtained from different proteases[J]. Journal of Food Measurement and Characterization,2023,17(3):2374−2385. doi: 10.1007/s11694-022-01796-2
[10] YANG X, WANG L L, ZHANG F Y, et al. Effects of multi-mode S-type ultrasound pretreatment on the preparation of ACE inhibitory peptide from rice protein[J]. Food Chemistry,2020,331:127216. doi: 10.1016/j.foodchem.2020.127216
[11] MAESTRI E, MARMIROLI M, MARMIROLI N. Bioactive peptides in plant-derived foodstuffs[J]. Journal of Proteomics,2016,147:140−155. doi: 10.1016/j.jprot.2016.03.048
[12] 宋明洋, 刘晓兰. 双酶法制备豌豆肽及其抗氧化活性[J]. 食品工业,2020,41(4):108−112. [SONG M Y, LIU X L. Preparation and antioxidant activity of pea peptides by two-stage enzymatic hydrolysis[J]. Food Industry,2020,41(4):108−112.] SONG M Y, LIU X L. Preparation and antioxidant activity of pea peptides by two-stage enzymatic hydrolysis[J]. Food Industry, 2020, 41(4): 108−112.
[13] 赵婉宏. 玉米降血糖活性肽制备及其对糖尿病斑马鱼体内糖脂代谢影响[D]. 大庆:黑龙江八一农垦大学, 2022. [ZHAO W H. Preparation of corn hypoglycemic active peptide and its effect on glucose and lipid metabolism in diabetic zebrafish[D]. Daqing:Heilongjiang Bayi Agricultural University, 2022.] ZHAO W H. Preparation of corn hypoglycemic active peptide and its effect on glucose and lipid metabolism in diabetic zebrafish[D]. Daqing: Heilongjiang Bayi Agricultural University, 2022.
[14] 刘铭, 刘玉环, 王允圃, 等. 制备、纯化和鉴定生物活性肽的研究进展及应用[J]. 食品与发酵工业,2016,42(4):244−251. [LIU M, LIU Y H, WANG Y P, et al. Research progress on production, purification and identification of bioactides and its challenges in application[J]. Food and Fermentation Industry,2016,42(4):244−251.] LIU M, LIU Y H, WANG Y P, et al. Research progress on production, purification and identification of bioactides and its challenges in application[J]. Food and Fermentation Industry, 2016, 42(4): 244−251.
[15] 王宇飞. 小麦醇溶蛋白的分离、改性及其结构与致敏性的研究[D]. 太原:中北大学, 2022. [WANG Y F. Study of isolation and modification of wheat gliadin and its structure and allergenicit[D]. Taiyuan:North University of China, 2022.] WANG Y F. Study of isolation and modification of wheat gliadin and its structure and allergenicit[D]. Taiyuan: North University of China, 2022.
[16] 徐珊珊. 小麦面筋蛋白美拉德肽的制备及风味特性研究[D]. 无锡:江南大学, 2018. [XU S S. Preparation and flavor characteristics of maillard peptides derived from wheat gluten[D]. Wuxi:Jiangnan University, 2018.] XU S S. Preparation and flavor characteristics of maillard peptides derived from wheat gluten[D]. Wuxi: Jiangnan University, 2018.
[17] LI X, XIONG H, YANG K W, et al. Optimization of the biological processing of rice dregs into nutritional peptides with the aid of trypsin[J]. Journal of Food Science and Technology-Mysore,2012,49(5):537−546. doi: 10.1007/s13197-011-0303-6
[18] SHAHBAL N, JING X, BHANDARI B, et al. Effect of enzymatic hydrolysis on solubility and surface properties of pea, rice, hemp, and oat proteins:Implication on high protein concentrations[J]. Food Bioscience,2023,53:102515. doi: 10.1016/j.fbio.2023.102515
[19] 刘文颖, 冯晓文, 程青丽, 等. 大米低聚肽的制备和结构表征及体外抗氧化作用[J]. 华南理工大学学报(自然科学版),2021,49(11):47−56. [LIU W Y, FENG X W, CHENG Q L, et al. Preparation, structure characterization and in vitro antioxidant activity of rice oligopeptides[J]. Journal of South China University of Technology (Natural Science Edition),2021,49(11):47−56.] LIU W Y, FENG X W, CHENG Q L, et al. Preparation, structure characterization and in vitro antioxidant activity of rice oligopeptides[J]. Journal of South China University of Technology (Natural Science Edition), 2021, 49(11): 47−56.
[20] 胡武瑶, 黄晶, 黄莹, 等. 基于主要成分分析不同大米肽的品质与综合评价[J]. 食品工业,2023,44(1):289−295. [HU W Y, HUANG J, HUANG Y, et al. Quality and comprehensive evaluation of different rice peptides based on main component analysis[J]. Food Industry,2023,44(1):289−295.] HU W Y, HUANG J, HUANG Y, et al. Quality and comprehensive evaluation of different rice peptides based on main component analysis[J]. Food Industry, 2023, 44(1): 289−295.
[21] XIE H X, HUANG J M, WOO M W, et al. Effect of cold and hot enzyme deactivation on the structural and functional properties of rice dreg protein hydrolysates[J]. Food Chemistry,2021,345(10):128784.
[22] 黄金梅. 米渣分步酶解过程变化及米渣肽抗氧化稳定性研究[D]. 南昌:南昌大学, 2019. [HUANG J M. Study on the changes of rice dreg by double step enzymatic hydrolysis and antioxidant stability of rice dreg peptide[D]. Nanchang:Nanchang University, 2019.] HUANG J M. Study on the changes of rice dreg by double step enzymatic hydrolysis and antioxidant stability of rice dreg peptide[D]. Nanchang: Nanchang University, 2019.
[23] LIU W Y, LU J, GAO F, et al. Preparation, characterization and identification of calcium-chelating atlantic salmon (Salmo salar L.) ossein oligopeptides[J]. European Food Research and Technology,2015,241(6):851−860. doi: 10.1007/s00217-015-2510-2
[24] 夏易玄. 豌豆肽的制备、脱苦及抗氧化活性研究[D]. 无锡:江南大学, 2022. [XIA Y X. The study of preparation, debittering and antioxidant activity of pea peptides[D]. Wuxi:Jiangnan University, 2022.] XIA Y X. The study of preparation, debittering and antioxidant activity of pea peptides[D]. Wuxi: Jiangnan University, 2022.
[25] 赵佳佳. 3种大米蛋白肽的制备及其抗氧化活性比较[J]. 食品科技,2018,43(12):191−195. [ZHAO J J. Preparation of three rice protein peptides and comparison of antioxidant activities[J]. Food Technology,2018,43(12):191−195.] ZHAO J J. Preparation of three rice protein peptides and comparison of antioxidant activities[J]. Food Technology, 2018, 43(12): 191−195.
[26] 卢知浩, 赵晓涵, 裴晨皓, 等. 玉米低聚肽和小麦低聚肽及其金属螯合物的抗氧化和抗过敏活性[J]. 食品与发酵工业,2023,49(14):35−40. [LU Z H, ZHAO X H, PEI C H, et al. Antioxidant effect and antiallergic activity of corn oligopeptides, wheat oligopeptides and their mineral chelate[J]. Food and Fermentation Industry,2023,49(14):35−40.] LU Z H, ZHAO X H, PEI C H, et al. Antioxidant effect and antiallergic activity of corn oligopeptides, wheat oligopeptides and their mineral chelate[J]. Food and Fermentation Industry, 2023, 49(14): 35−40.
[27] 高瑞. 大米酒糟蛋白的提取及改性研究[D]. 广州:华南理工大学, 2022. [GAO R. Study on extraction and modification of rice wine lees protein[D]. Guangzhou:South China University of Technology, 2022.] GAO R. Study on extraction and modification of rice wine lees protein[D]. Guangzhou: South China University of Technology, 2022.
[28] AL-DOURY M K W, HETTIARACHCHY N S, HORAX R. Rice-endosperm and rice-bran proteins:A review[J]. Journal of the American Oil Chemists Society,2018,95(8):943−956. doi: 10.1002/aocs.12110
[29] 崔沙沙. 低水解度的大米蛋白溶解性与结构变化的关系[D]. 南昌:南昌大学, 2016. [CUI S S. The relationship between solubility and structural of low degree of hydrolysis's rice protein[D]. Nanchang:Nanchang University, 2016.] CUI S S. The relationship between solubility and structural of low degree of hydrolysis's rice protein[D]. Nanchang: Nanchang University, 2016.
[30] 寇茜茜, 韩坤, 岳远瑞, 等. 发酵豆粕质量评价的综合分析[J]. 饲料研究,2023,46(8):130−134. [KOU X X, HAN K, YUE Y R, et al. Comprehensive analysis of quality assessment of fermented soybean meal[J]. Feed Research,2023,46(8):130−134.] KOU X X, HAN K, YUE Y R, et al. Comprehensive analysis of quality assessment of fermented soybean meal[J]. Feed Research, 2023, 46(8): 130−134.
[31] 谷红, 王远丽, 毛绍春, 等. 不同酶制备豌豆蛋白水解物及其抗氧化活性研究[J]. 食品科技,2023,48(5):231−236. [GU H, WANG Y L, MAO S C, et al. Preparation of pea protein hydrolysate with different enzymes and its antioxidant activity[J]. Food Technology,2023,48(5):231−236.] GU H, WANG Y L, MAO S C, et al. Preparation of pea protein hydrolysate with different enzymes and its antioxidant activity[J]. Food Technology, 2023, 48(5): 231−236.
[32] AVRAMENKO N A, LOW N H, NICKERSON M T. The effects of limited enzymatic hydrolysis on the physicochemical and emulsifying properties of a lentil protein isolate[J]. Food Research International,2013,51(1):162−169. doi: 10.1016/j.foodres.2012.11.020
[33] VERA A, VALENZUELA M A, YAZDANI-PEDRAM M, et al. Conformational and physicochemical properties of quinoa proteins affected by different conditions of high-intensity ultrasound treatments[J]. Ultrasonics Sonochemistry,2019,51:186−196. doi: 10.1016/j.ultsonch.2018.10.026
[34] SPONTON O E, PEREZ A A, CARRARA C, et al. Effect of limited enzymatic hydrolysis on linoleic acid binding properties of beta-lactoglobulin[J]. Food Chemistry,2014,146:577−582. doi: 10.1016/j.foodchem.2013.09.089
[35] WANG Y Y, WANG C Y, WANG S T, et al. Physicochemical properties and antioxidant activities of tree peony (Paeonia suffruticosa Andr.) seed protein hydrolysates obtained with different proteases[J]. Food Chemistry,2021,345(9):128765.
[36] TANG S Q, DU Q H, FU Z. Ultrasonic treatment on physicochemical properties of water-soluble protein from Moringa oleifera seed[J]. Ultrasonics Sonochemistry,2021,71:105357. doi: 10.1016/j.ultsonch.2020.105357
[37] 马晓雨. 基于大米蛋白酶解物构建的叶黄素纳米输送体系的制备及性质研究[D]. 南昌:南昌大学, 2019. [MA X Y. Fabrication and characterization of lutein nano-delivery system based on rice protein hydrolysate[D]. Nanchang:Nanchang University, 2019.] MA X Y. Fabrication and characterization of lutein nano-delivery system based on rice protein hydrolysate[D]. Nanchang: Nanchang University, 2019.
[38] SINGH B P, VIJ S, HATI S. Functional significance of bioactive peptides derived from soybean[J]. Peptides,2014,54:171−179. doi: 10.1016/j.peptides.2014.01.022
[39] HUANG J L, HUANG B H, ZUO S S, et al. Taste evaluation of various sweeteners by electronic tongue[J]. Food Science,2020,41(20):227−233.
[40] 柳芬芳. 绿豆蛋白及水解物的理化、功能及抗氧化特性研究[D]. 济南:齐鲁工业大学, 2022. [LIU F F. Study on physicochemical, functional and antioxidant properties of mung bean protein and its hydrolysate [D]. Jinan:Qilu University of Technology, 2022.] LIU F F. Study on physicochemical, functional and antioxidant properties of mung bean protein and its hydrolysate [D]. Jinan: Qilu University of Technology, 2022.
[41] ALEMAN A, GIMENEZ B, PEREZ-SANTIN E, et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J]. Food Chemistry,2011,125(2):334−341. doi: 10.1016/j.foodchem.2010.08.058
-
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:

 下载:
下载:



