Preparation Process Optimization and Stability Study of Loquat Flower Flavonoid Nanoparticles
-
摘要: 为提高枇杷花黄酮的稳定性,本文采用反溶剂沉淀法制备枇杷花黄酮/玉米醇溶蛋白/果胶复合纳米颗粒(Loquat flower flavonoids/Zein/Pectin Nanoparticles,LF/Z/P Nps)。以包埋率、粒径和Zeta电位为指标,探究多糖种类、黄酮浓度、玉米醇溶蛋白浓度、醇水比及果胶浓度对纳米颗粒制备的影响,通过响应面试验优化纳米颗粒制备工艺,并对纳米颗粒的特性进行研究。结果表明,纳米颗粒最佳制备工艺为:枇杷花黄酮浓度0.135 mg/mL,玉米醇溶蛋白浓度2.2 mg/mL,醇水比1:4,果胶浓度0.78 mg/mL。此条件下纳米颗粒包埋率为86.20%±0.91%,平均粒径为132.13±1.31 nm,多分散指数(PDI)为0.16±0.01,Zeta电位为−33.97±1.46 mV。该纳米颗粒对pH和Na+较为敏感,但可有效保持枇杷花黄酮抗氧化性及稳定性。本研究通过反溶剂沉淀法制备了稳定性较好的LF/Z/P Nps,为枇杷花黄酮类物质的加工适应性提升奠定了一定理论基础。Abstract: In order to improve the stability of loquat flower flavonoids, loquat flower flavonoids/zein/pectin nanoparticles (LF/Z/P Nps) were prepared by anti-solvent precipitation method. Taking the embedding rate, particle size and Zeta potential as indicators, the effects of polysaccharide species, flavonoids concentration, zein concentration, alcohol-to-water ratio and pectin concentration on the preparation of nanoparticles were explored. The preparation process of nanoparticles was optimized by response surface experiment, and the characteristics of nanoparticles were studied. The results showed that the optimal preparation conditions were determined as follows: Loquat flower flavonoids concentration of 0.135 mg/mL, zein concentration of 2.2 mg/mL, alcohol-to-water ratio of 1:4, and pectin concentration of 0.78 mg/mL. Under these conditions, the embedding rate of nanoparticles was 86.20%±0.91%, the average particle size was 132.13±1.31 nm, the PDI was 0.16±0.01, and the Zeta potential was −33.97±1.46 mV. The nanoparticles were sensitive to pH and Na+, but could effectively maintain the antioxidant and stability of loquat flower flavonoids. In this study, LF/Z/P Nps with good stability were prepared by reverse-solvent precipitation method, which laid a certain theoretical basis for improving the processing adaptability of loquat flower flavonoids.
-
Keywords:
- loquat flower flavonoids /
- nanoparticles /
- antioxidant activity /
- stability
-
枇杷花作为药食两用资源富含多种活性成分,黄酮类化合物是其中主要成分之一。研究表明黄酮类化合物具有抗氧化、止咳、抗炎、抗肿瘤等多种生物活性[1−2],同时可以预防心血管疾病和糖尿病等[3],因此广泛应用于食品、药品、化妆品等行业[4−5]。然而,黄酮类物质的结构特点决定了其存在稳定性及溶解性差、生物利用度低等问题,很大程度上限制其在各行业中的应用[6−7]。纳米封装是解决以上问题的有效途径,常用方法有纳米乳液、纳米颗粒、水凝胶和纳米脂质体等[8−11]。玉米醇溶蛋白具有良好的生物相容性、生物降解性和独特的自组装能力,是制备纳米颗粒常用壁材[12−13]。但玉米醇溶蛋白纳米颗粒,在水中再分散性差,对环境因素敏感,易聚集[14],而多糖和玉米醇溶蛋白的静电吸附可有效改善这一问题[15],因此,广泛应用蛋白/多糖为载体构建纳米颗粒体系,来提高黄酮稳定性和生物利用度。
目前对枇杷花的研究主要集中在化学成分、提取工艺和生物学活性研究上[16−17],对枇杷花活性成分稳态化研究较少,枇杷花黄酮纳米颗粒的制备鲜见报道;同时,鉴于纳米颗粒制备过程复杂,芯材差异性可能会带来载体适配度等问题,有必要探讨枇杷花黄酮纳米颗粒制备过程并优化其工艺,以提高枇杷花黄酮的稳定性及加工适用性。因此,本文以枇杷花黄酮提取物为芯材,筛选适用多糖,以玉米醇溶蛋白和多糖为载体,采用反溶剂沉淀法制备枇杷花黄酮纳米颗粒,以包埋率、粒径和Zeta电位为指标,优化纳米颗粒制备工艺,并探究纳米颗粒的抗氧化活性及稳定性,以期为黄酮等活性成分的包封提供一定参考。
1. 材料与方法
1.1 材料与仪器
枇杷花黄酮提取物 实验室自制,其主要成分为金丝桃苷和芦丁[18];玉米醇溶蛋白(BR,92%)、κ-卡拉胶 购自上海源叶生物科技有限公司;柑橘果胶(半乳糖醛酸≥74.0%) 购自上海阿拉丁生化科技股份有限公司;羧甲基纤维素钠 购自生工生物工程(上海)股份有限公司;阿拉伯胶、2,2-联苯基-1-苦基肼基(DPPH)、2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS) 购自上海麦克林生化科技有限公司;其他化学试剂均为分析纯 购自国药集团化学试剂有限公司。
90-3型双向定时恒温磁力搅拌器 上海沪西分析仪器厂有限公司;RE 2000旋转蒸发仪 上海亚荣生化;Nano-ZS 90激光粒度仪 英国Malvern;5804R高速冷冻离心机 德国Eppendorf。
1.2 实验方法
1.2.1 枇杷花黄酮纳米颗粒的制备
参考Liang等[19]的方法稍作修改,称取一定量玉米醇溶蛋白溶于100 mL 70%乙醇溶液中,搅拌(700 r/min,30 min)后加入一定量枇杷花黄酮提取物,继续搅拌(700 r/min,30 min)后离心(5000 r/min,10 min)取上清液,与去离子水(pH5.0)按一定比例快速混合并不断搅拌(700 r/min,10 min),经减压蒸发除去乙醇后用去离子水(pH5.0)定容至原体积,即得枇杷花黄酮/玉米醇溶蛋白纳米颗粒分散液(LF/Z Nps)。
以1:1的比例将LF/Z Nps加至多糖溶液中,搅拌(900 r/min,10 min)后离心(5000 r/min,10 min),得到枇杷花黄酮/玉米醇溶蛋白/多糖纳米颗粒分散液(LF/Z/PS Nps)。
1.2.1.1 不同多糖对纳米颗粒制备效果的影响
玉米醇溶蛋白浓度为2 mg/mL,枇杷花黄酮浓度为0.15 mg/mL,醇水比为1:4,制备LF/Z Nps。然后,分别按1:1比例加入不同pH(2.0、3.0、4.0、5.0、6.0、7.0)的1 mg/mL阿拉伯胶、果胶、κ-卡拉胶、羧甲基纤维素钠溶液,制得LF/Z/PS Nps,计算包埋率,并测定粒径及Zeta电位,以评价多糖种类对纳米颗粒制备效果的影响。
1.2.1.2 枇杷花黄酮浓度对纳米颗粒制备效果的影响
玉米醇溶蛋白浓度为2 mg/mL,枇杷花黄酮浓度分别为0.05、0.10、0.15、0.20、0.25 mg/mL,醇水比为1:4,果胶浓度为1 mg/mL,制备纳米颗粒后计算包埋率,并测定粒径及Zeta电位。
1.2.1.3 玉米醇溶蛋白浓度对纳米颗粒制备效果的影响
玉米醇溶蛋白浓度分别为1.0、1.5、2.0、2.5、3.0 mg/mL,枇杷花黄酮浓度为0.15 mg/mL,醇水比为1:4,果胶浓度为1 mg/mL,制备纳米颗粒后计算包埋率,并测定粒径及Zeta电位。
1.2.1.4 醇水比对纳米颗粒制备效果的影响
玉米醇溶蛋白浓度为2 mg/mL,枇杷花黄酮浓度为0.15 mg/mL,醇水比分别为1:1、1:2、1:3、1:4、1:5,果胶浓度为1 mg/mL,制备纳米颗粒后计算包埋率,并测定粒径及Zeta电位。
1.2.1.5 果胶浓度对纳米颗粒制备效果的影响
玉米醇溶蛋白浓度为2 mg/mL,枇杷花黄酮浓度为0.15 mg/mL,醇水比为1:4,果胶浓度分别为0、0.05、0.10、0.25、0.50、0.75、1.0、1.5 mg/mL,制备纳米颗粒后计算包埋率,并测定粒径及Zeta电位。
1.2.1.6 制备工艺优化
以枇杷花黄酮质量浓度(A)、玉米醇溶蛋白质量浓度(B)、醇水比(C)、果胶浓度(D)为考察因素,包埋率为响应值进行响应面设计,试验设计见表1。
表 1 响应面试验因素与水平Table 1. Factors and levels of response surface test水平 因素 A(mg/mL) B(mg/mL) C D(mg/mL) −1 0.10 1.50 1:3 0.50 0 0.15 2.00 1:4 0.75 1 0.20 2.50 1:5 1.00 1.2.2 粒径、电位和分散系数的测定
参考Wang等[20]方法进行测定,取一定量纳米颗粒分散液,利用电泳和动态光散射法测定其表面Zeta电位、平均粒径(Z-average)和多分散性指数(PDI)。为了获得足够强的光散射信号,同时避免多次散射,所有样品在分析前都用去离子水(pH5.0)稀释。
1.2.3 包埋率的计算
取一定量纳米颗粒分散液至超滤浓缩离心管中,4 ℃下离心(8000 r/min,10 min),取超滤膜透过液,测其黄酮含量即为游离黄酮含量A1,制备纳米颗粒所用黄酮含量即为总黄酮含量A0。采用亚硝酸钠-硝酸铝比色法[21]测定黄酮含量,以芦丁为标准品,建立标准曲线:y=0.0243x+0.0014(R2=0.9998)。根据公式(1)计算包埋率。
包埋率(%)=A0−A1A0×100 (1) 1.2.4 抗氧化活性分析
1.2.4.1 DPPH自由基清除活性
参考Zhang等[22]方法进行实验,将样品与DPPH-乙醇溶液(0.1 mmol/mL)等体积充分混匀,避光反应30 min后于517 nm处测定吸光度为A1,以乙醇替代样品,测得吸光度为A0,样品和乙醇的吸光度为A2。以VC为阳性对照,根据公式(2)计算DPPH自由基清除率。
清除率(%)=A0−A1+A2A0×100 (2) 1.2.4.2 ABTS+自由基清除活性
参考Agrawal等[23]方法稍作修改,将20 μL样品与200 μL ABTS+·溶液混合,30 ℃避光反应 6 min后,在734 nm处测定吸光度为A1,以PBS代替样品,测得吸光度为A0。以VC为阳性对照,根据公式(3)计算样品的清除能力。
清除率(%)=A0−A1A0×100 (3) 1.2.5 稳定性分析
1.2.5.1 pH稳定性
纳米颗粒分散液与不同pH磷酸盐-柠檬酸盐缓冲液(10 mmol/mL)等体积混合,使混合液最终pH为3.0、4.0、5.0、6.0、7.0、8.0,测定溶液粒径及分散系数(PDI)。
1.2.5.2 离子稳定性
纳米颗粒分散液与不同浓度NaCl溶液等体积混合,使混合液中NaCl终浓度分别为0、10、20、30、40、50 mmol/L,测定混合溶液粒径及PDI。
1.2.5.3 热稳定性
纳米颗粒分散液在90 ℃下分别加热0、30、60、90、120 min,测定纳米颗粒分散液粒径及PDI。
1.2.5.4 储藏稳定性
纳米颗粒分散液在4 ℃下避光保存,分别在0、6、12、18、24、30 d时测定混合溶液粒径及PDI。
1.3 数据处理
以上所有实验重复三次,实验数据,采用Graphpad Prism 8.0软件作图,IBM SPSS Statistics 26软件进行差异显著性分析(P<0.05),Design-Expert 12.0进行响应面试验设计。
2. 结果及分析
2.1 枇杷花黄酮纳米颗粒的制备
2.1.1 多糖对纳米颗粒制备效果的影响
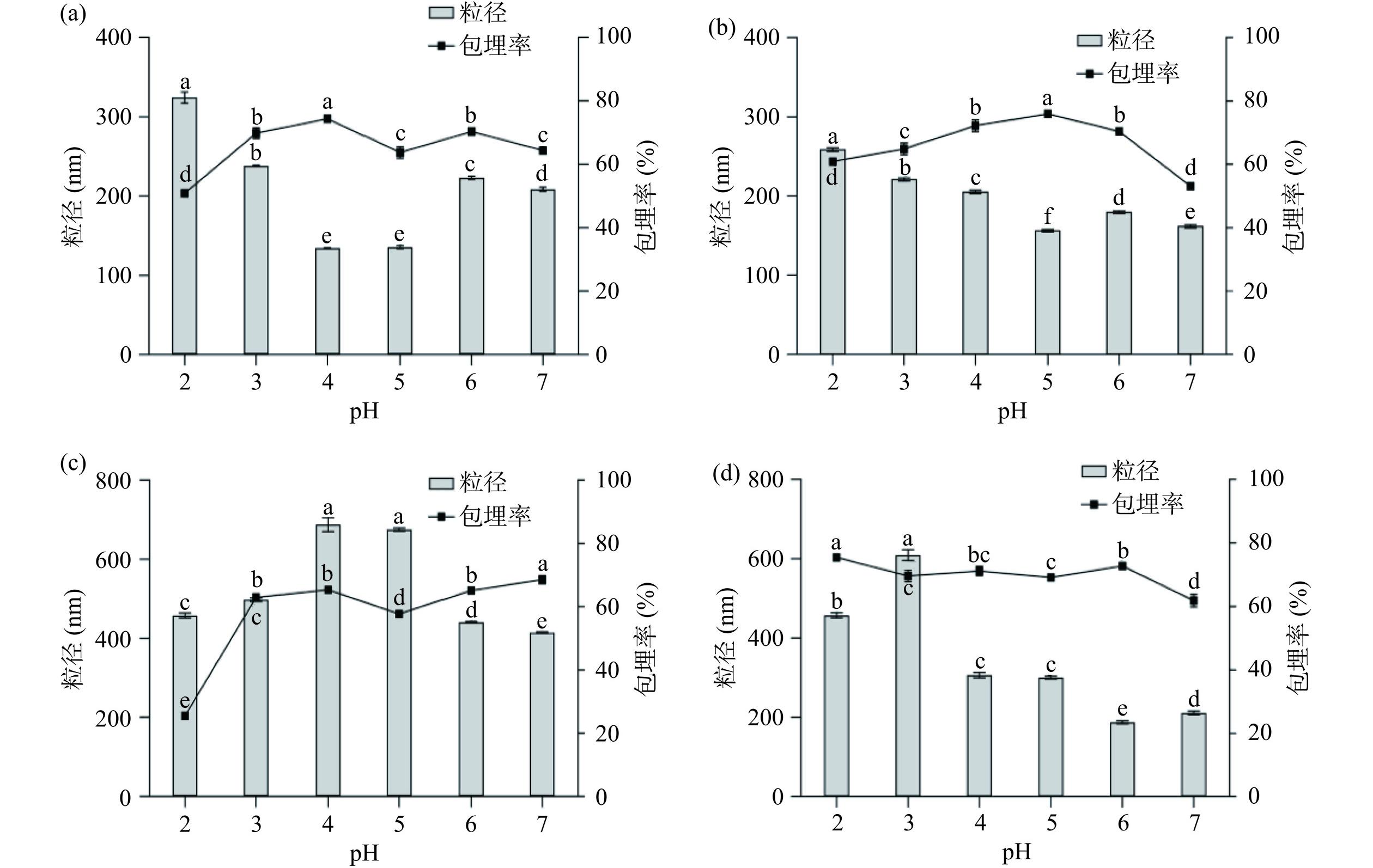
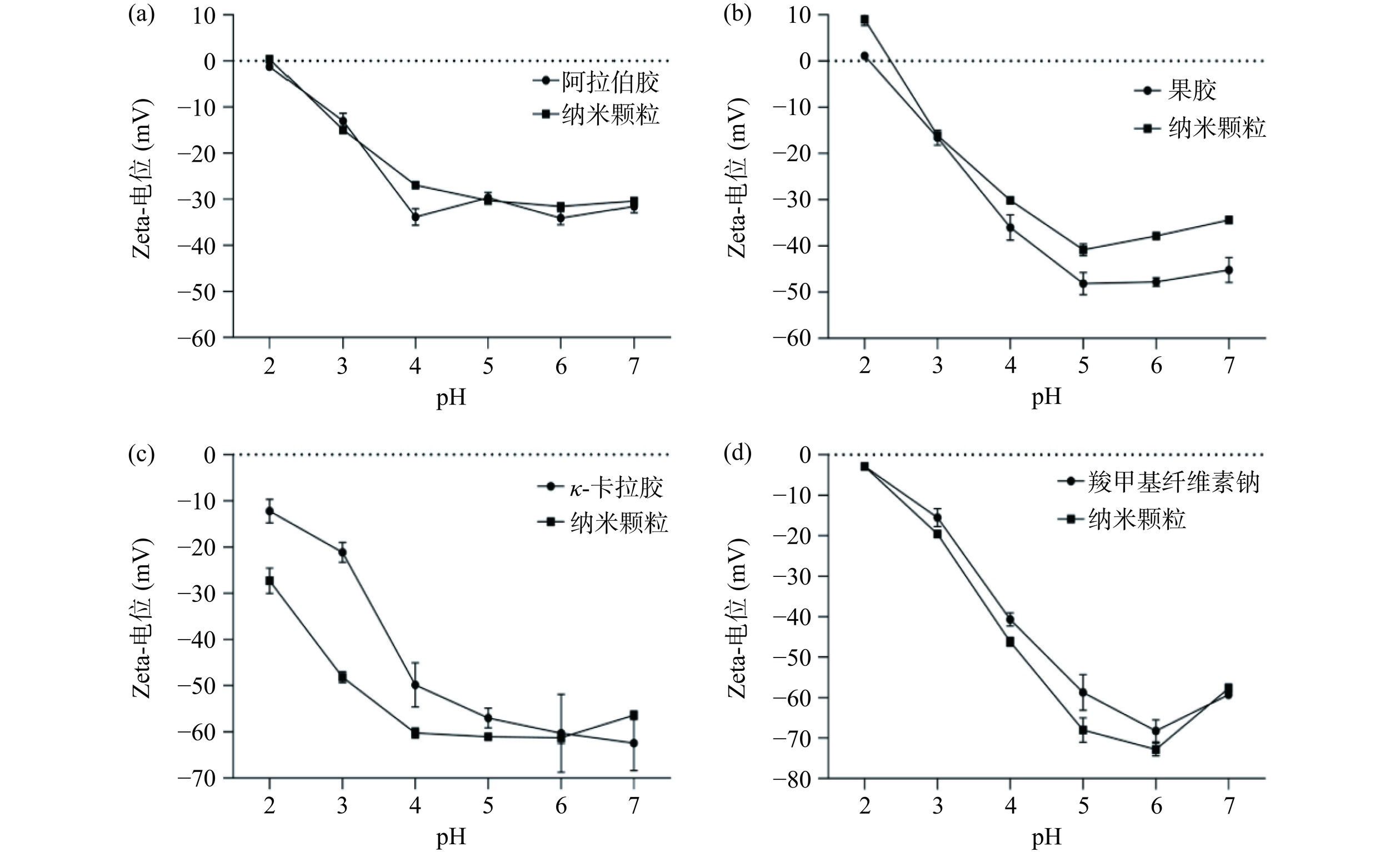
由图1可知,κ-卡拉胶和羧甲基纤维素钠吸附的纳米颗粒在各pH条件下粒径均较大(基本>200 nm)。pH4.0时阿拉伯胶负载的纳米颗粒粒径最小,为134.23 nm,此时包埋率也最高。但由图2可知阿拉伯胶所带负电荷绝对值较小,静电吸附作用弱,纳米颗粒在pH2.0及蛋白等电点(pH6.2)附近时粒径明显增大,出现肉眼可见的絮状沉淀。梁晓等[24]制备负载单宁酸的玉米醇溶蛋白/阿拉伯胶纳米颗粒时亦出现相似结果,该纳米颗粒在pH3.0、6.0、7.0时出现明显絮状沉淀。果胶负载的纳米颗粒粒径在pH5.0时达到最小,包埋率最大,且果胶所带负电荷绝对值较大,静电吸附作用强,在pH2.0及蛋白等点附近时粒径虽增大但未出现明显沉淀,分散液在pH2.0~7.0范围内均能保持稳定。综合考虑粒径及分散稳定性,后续实验选取果胶为负载多糖,在pH5.0的条件下制备LF/Z/P Nps。
2.1.2 枇杷花黄酮浓度对纳米颗粒制备效果的影响
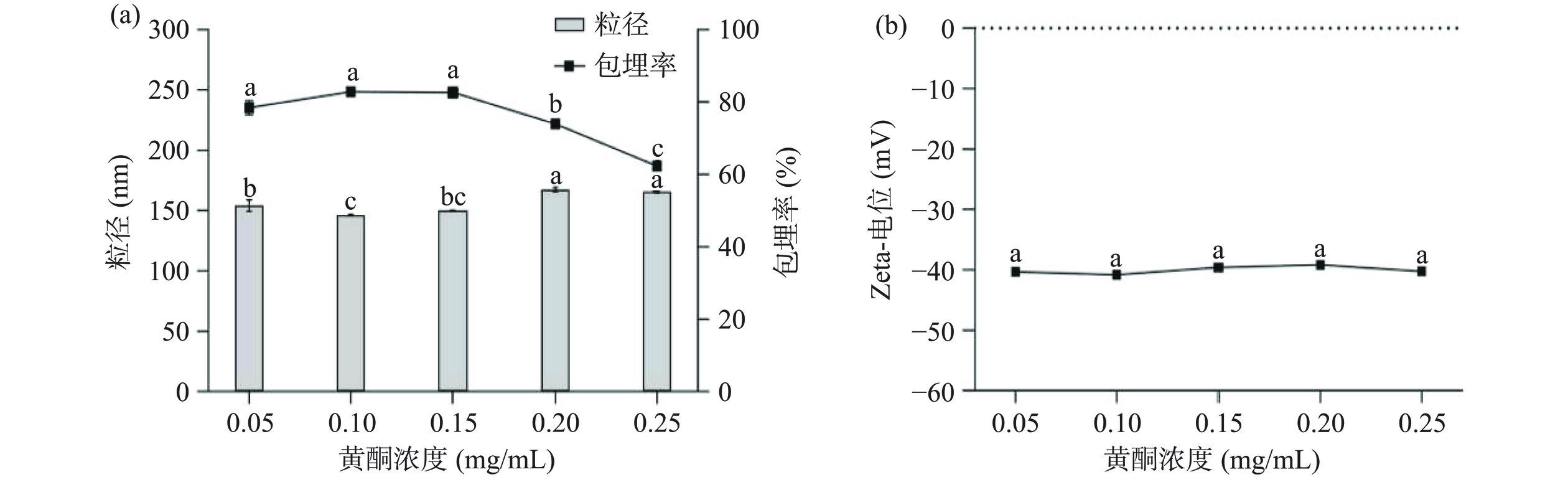
由图3a可知,当枇杷花黄酮浓度在0.05~0.15 mg/mL时纳米颗粒的包埋率无显著变化(P>0.05),当浓度继续增大时纳米颗粒包埋率开始下降,其原因可能是当黄酮浓度过高时,蛋白出现负载饱和的状态,游离芯材增加,从而导致包埋率下降[25]。由图3b可知枇杷花黄酮浓度改变对纳米颗粒电位没有显著性影响(P>0.05)。Liu等[26]在制备姜黄素/玉米醇溶蛋白/酪蛋白酸盐/海藻酸钠纳米颗粒时也得到类似结果,随着姜黄素添加量增加,纳米颗粒电位无显著变化,而包埋率则明显降低。因此,选择枇杷花黄酮浓度0.15 mg/mL时较为适宜。
2.1.3 玉米醇溶蛋白浓度对纳米颗粒制备效果的影响
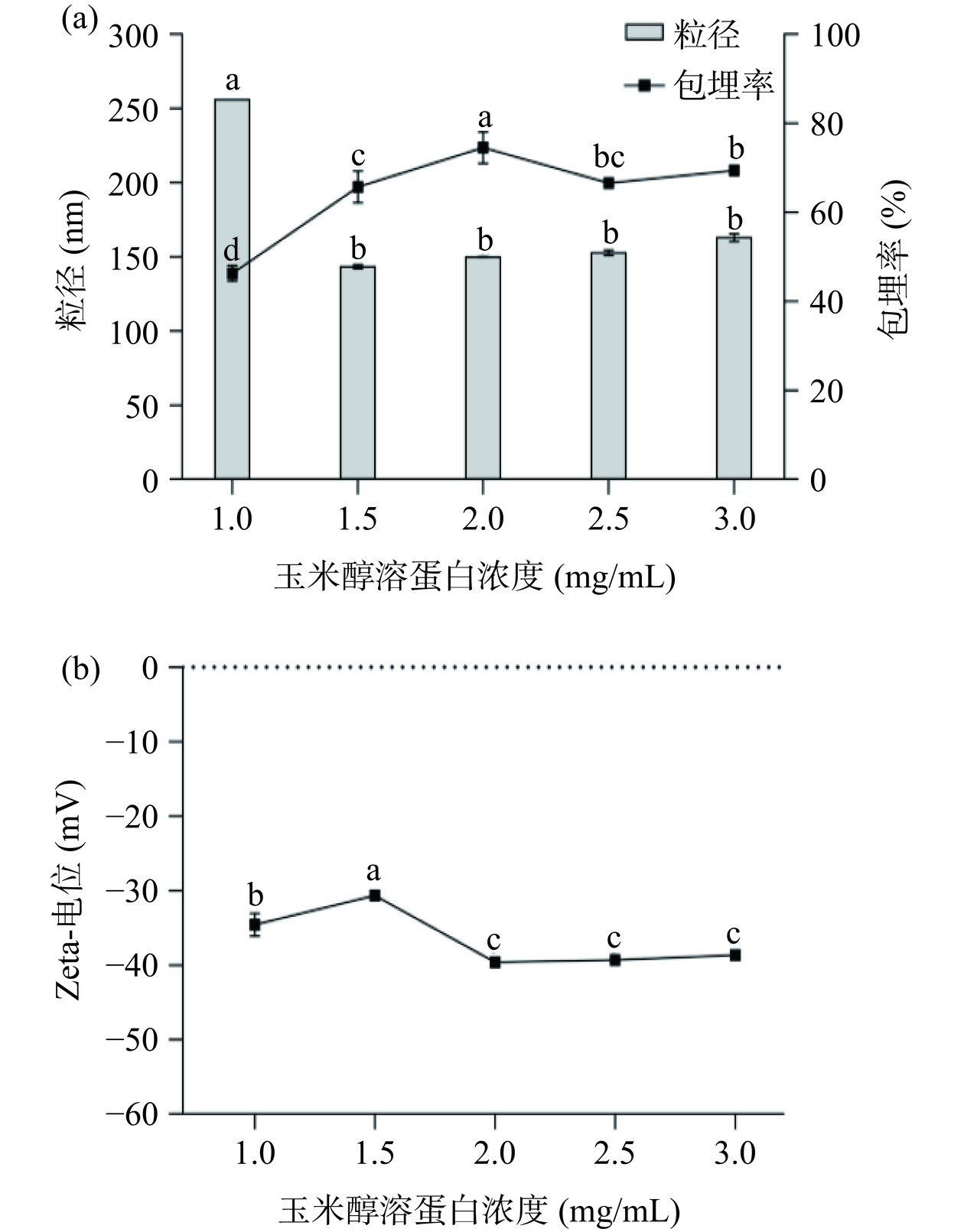
如图4a所示,随着玉米醇溶蛋白浓度的增加包埋率先增加后下降,当浓度为2 mg/mL时包埋率达到最大;玉米醇溶蛋白浓度大于1 mg/mL时粒径显著下降(P<0.05),1.5 mg/mL时最小,之后粒径变化不显著(P>0.05)。有研究表明,当玉米醇溶蛋白浓度低于一定值时,其在反溶剂中无法形成致密的纳米颗粒,反而形成不连续的膜结构,致使粒径较大,包埋率较低,而玉米醇溶蛋白浓度过大则会导致溶液黏度增加,黄酮容易负载在纳米颗粒表面,引起包埋率下降,且粒径增大[27]。图4b显示当玉米醇溶蛋白浓度2 mg/mL时纳米颗粒电位绝对值达到最大,表明此浓度下体系具有较好的稳定性。综上所述,选择玉米醇溶蛋白浓度2 mg/mL较为适宜。
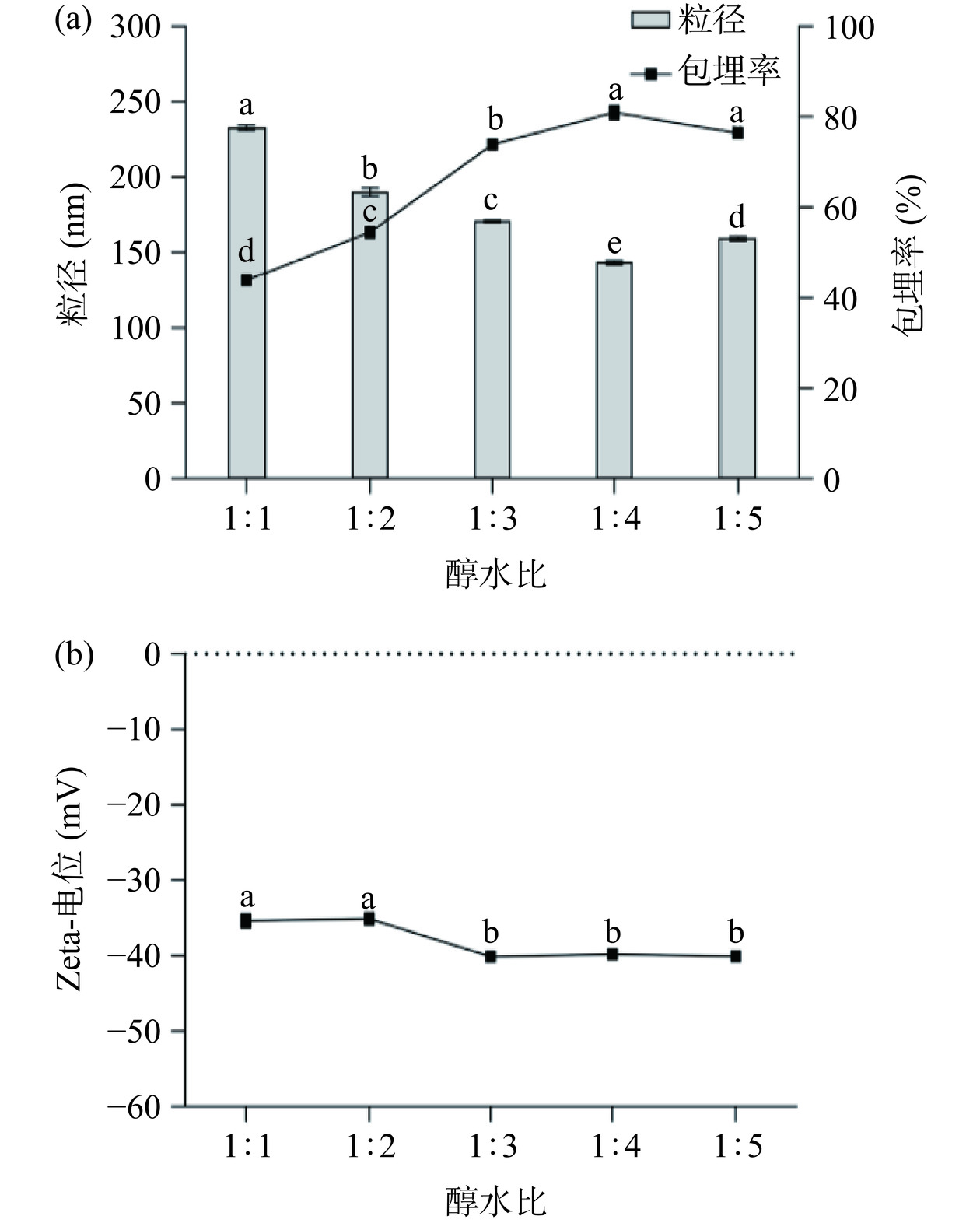
2.1.4 醇水比对纳米颗粒制备效果的影响
醇水比通过改变玉米醇溶蛋白在醇相中的分布影响纳米颗粒的形成。由图5a可知,醇水比为1:1时粒径最大,随着反溶剂含量增加,粒径逐渐减小,在醇水比1:4时达到最小,而包埋率变化则相反,在1:4时达到最大。图5b表明纳米颗粒电位绝对值在醇水比1:3时达到最大,然后趋于平稳。研究表明,这可能是因为分散液中反溶剂水的比例较低时,纳米颗粒在水中反复多层成核,分散液呈过饱和状态,易出现粒径增大、分布不匀一的现象[28]。因此,选择醇水比1:4较为适宜。
2.1.5 果胶浓度对纳米颗粒制备效果的影响
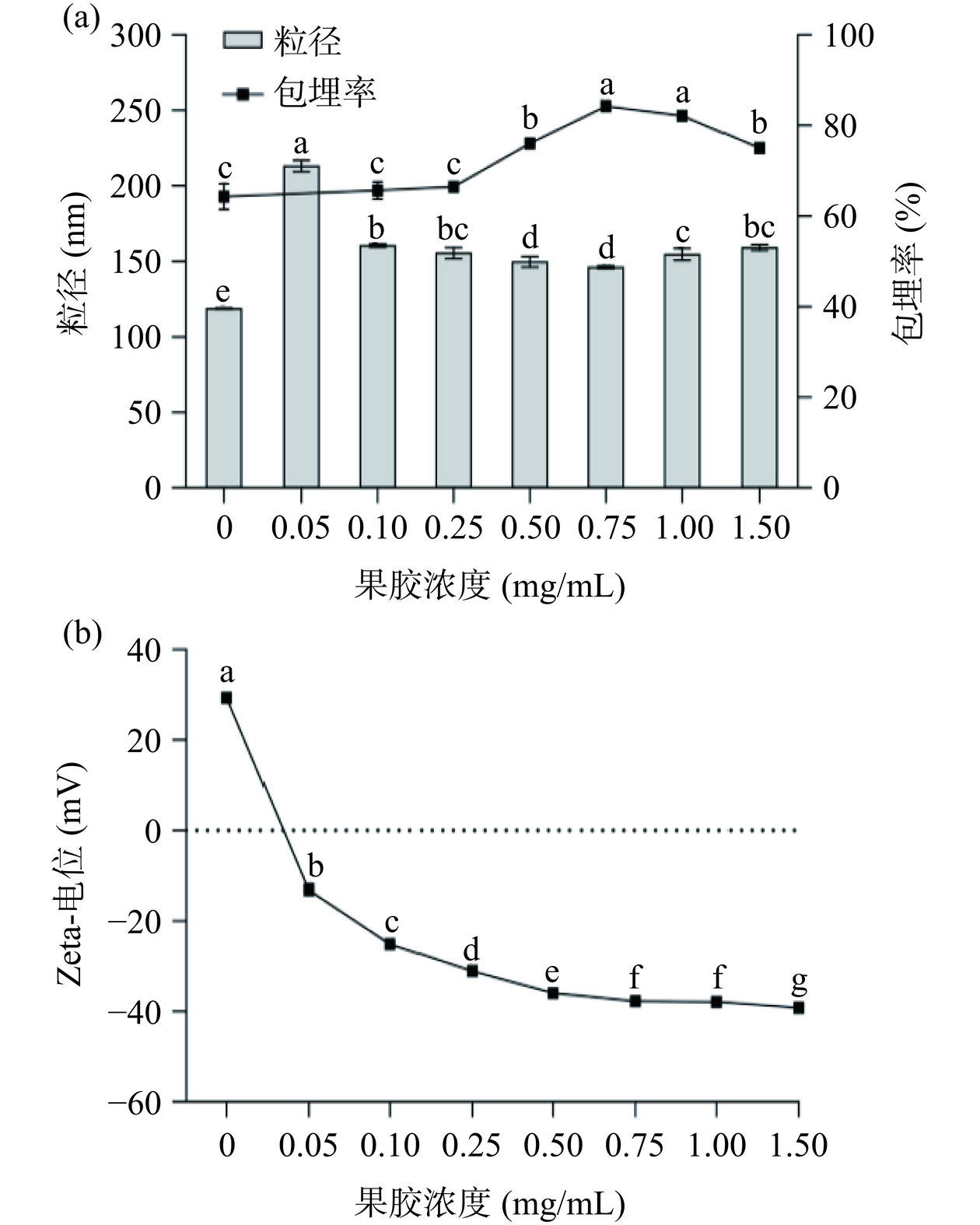
果胶是一种常见的羧基多糖,在中酸性环境中会解离出氢离子,从而表现出强电负性[29−30]。由图6可知未添加果胶的纳米颗粒带正电荷,粒径最小。添加果胶后电位急剧下降为负电荷,当果胶浓度为0.05 mg/mL时,纳米颗粒表面仅吸附少量果胶,由于颗粒之间静电斥力较小,易发生聚集,纳米颗粒出现絮状沉淀。随着果胶浓度增加,纳米颗粒电位绝对值变大,在果胶浓度为0.75 mg/mL时电位达到−37.8 mV,与pH5.0果胶溶液电位(−48.17 mV)接近(图2b),表明此时果胶完全覆盖在纳米颗粒表面,其所带的负电荷阻止纳米颗粒的聚集,分散液体系达到稳定。纳米颗粒包埋率随果胶浓度增加先增加后下降,在0.75 mg/mL时达到最大(果胶浓度0.05 mg/mL时,因制备的纳米颗粒产生大量絮状沉淀,包埋率无法测定)。Khan等[31]在制备玉米醇溶蛋白/海藻酸钠纳米颗粒时也出现类似结果,其在玉米醇溶蛋白纳米分散液中添加0.005%或0.01%海藻酸钠后,分散液因电中和而出现大量沉淀,当添加量增大到0.02%时分散液粒径明显下降,分散体系保持稳定。因此,选择果胶浓度0.75 mg/mL较为适宜。
2.1.6 制备工艺的优化
利用Design-Expert 12.0软件进行多元回归分析,响应面分析试验设计与结果如表2所示 ,得到包埋率与四因素自变量的二次多项回归方程:Y=85.21−2.68A+1.95B+0.8925C+1.5D+0.3250AB−0.1375AC−0.0275AD−0.3935BC−1.67BD+0.0925CD−4.42A2−2.34B2−5.09C2−3.52D2。
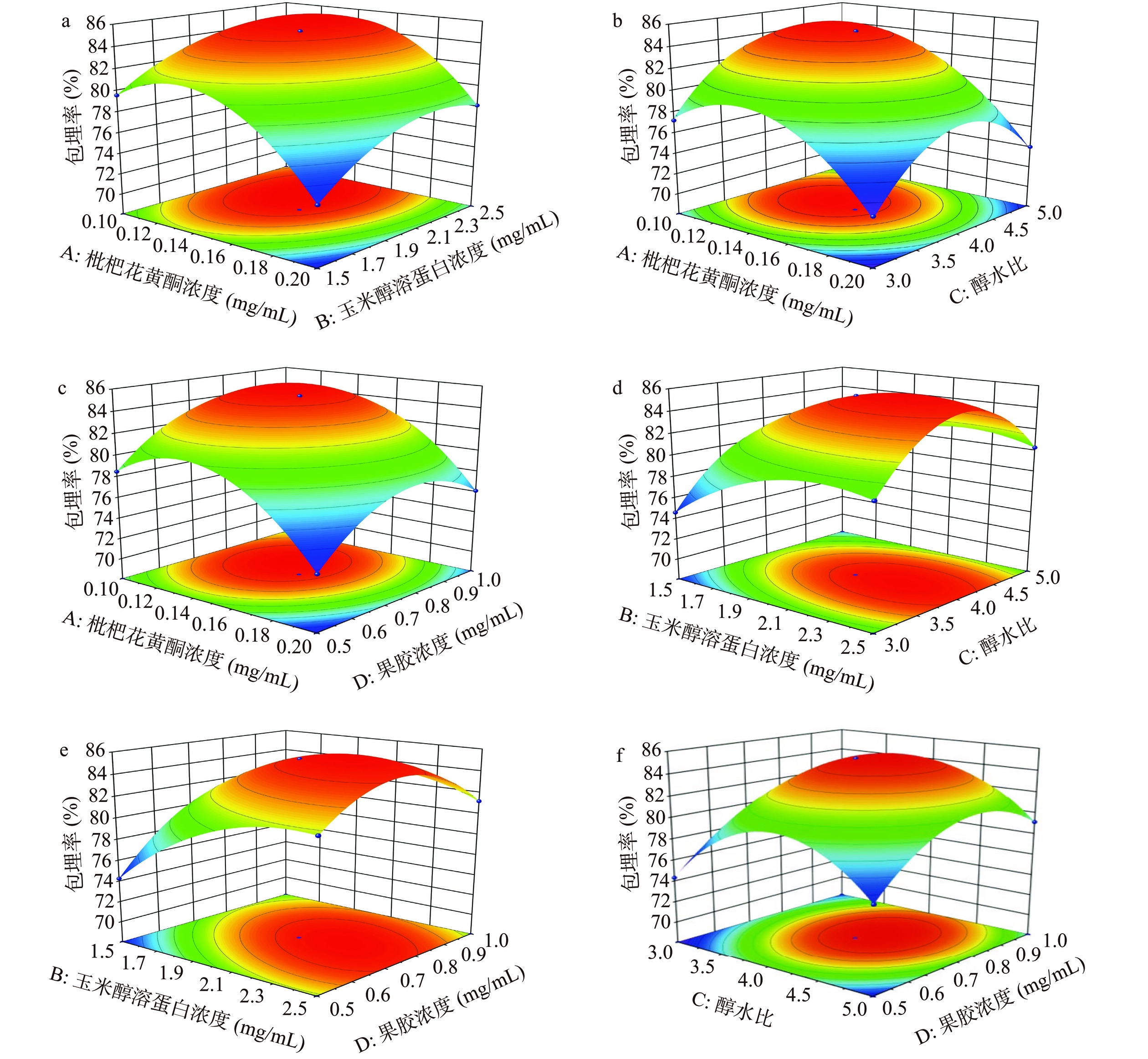
表 2 响应面试验设计与结果Table 2. Design and results of response surface test试验号 A B C D 包埋率(%) 1 −1 −1 0 0 80.99 2 −1 0 1 0 78.15 3 −1 0 0 1 81.6 4 −1 1 0 0 83.54 5 −1 0 −1 0 76.1 6 −1 0 0 −1 78.44 7 0 0 1 −1 76.9 8 0 0 0 0 85.21 9 0 1 −1 0 80.10 10 0 0 −1 −1 73.69 11 0 1 0 −1 81.64 12 0 −1 0 −1 73.61 13 0 1 1 0 79.49 14 0 −1 0 1 79.41 15 0 −1 1 0 76.43 16 0 0 1 1 80.51 17 0 1 0 1 80.75 18 0 0 0 0 83.87 19 0 0 0 0 86.10 20 0 0 −1 1 76.89 21 0 0 0 0 85.21 22 0 −1 −1 0 75.47 23 0 0 0 0 85.66 24 1 −1 0 0 73.53 25 1 0 −1 0 72.51 26 1 0 0 1 76.23 27 1 1 0 0 77.38 28 1 0 1 0 73.98 29 1 0 0 −1 73.15 表3为回归模型与方差分析结果,由表可知该模型P值<0.0001说明该模型极显著,失拟项为0.2491大于0.05没有达到显著水平,且该模型R2=0.9636、R2adj=0.9272、C.V.%=1.41,表明该模型可信度及实际情况的拟合度高,进一步说明该方案可进行枇杷花黄酮纳米颗粒包埋率最佳的工艺探究。同时变量A、B、D和A2、B2、C2、D2对包埋率影响存在极显著差异(P<0.01),C对包埋率影响存在显著差异(P<0.05),表明这四个因素都是影响纳米颗粒包埋率的重要因素。图7为四个因素两两交互作用对纳米颗粒包埋率影响的响应面图,由图可以看出玉米醇溶蛋白浓度和果胶浓度两个因素交互等高线图呈现明显的椭圆状,表明这两者之间交互作用差异极显著(P<0.01),这与表3结果一致。
表 3 回归模型与方差分析Table 3. Regression model and analysis of variance方差来源 平方和 自由度 均方 F值 P值 显著性 模型 459.07 14 32.79 26.46 <0.0001 ** A 85.87 1 85.87 69.28 <0.0001 ** B 45.86 1 45.86 37.00 <0.0001 ** C 9.56 1 9.56 7.71 0.0148 * D 26.85 1 26.85 21.66 0.0004 ** AB 0.4225 1 0.4225 0.3409 0.5686 AC 0.0756 1 0.0756 0.0610 0.8085 AD 0.0030 1 0.0030 0.0024 0.9613 BC 0.6162 1 0.6162 0.4972 0.4923 BD 11.19 1 11.19 9.03 0.0095 ** CD 0.0342 1 0.0342 0.0276 0.8704 A² 126.84 1 126.84 102.34 <0.0001 ** B² 35.43 1 35.43 28.58 0.0001 ** C² 168.27 1 168.27 135.76 <0.0001 ** D² 80.29 1 80.29 64.78 <0.0001 ** 残差 17.35 14 1.24 失拟项 14.56 10 1.46 2.09 0.2491 纯误差 2.79 4 0.6975 总误差 476.42 28 R2=0.9636 R2adj=0.9272 C.V.%=1.41 注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。 回归模型预测的最佳制备工艺为:枇杷花黄酮浓度0.135 mg/mL,玉米醇溶蛋白浓度2.172 mg/mL,醇水比1:4.079,果胶浓度0.78 mg/mL,此工艺下包埋率为86.07%。结合实际情况,调整工艺为:枇杷花黄酮浓度0.135 mg/mL,玉米醇溶蛋白浓度2.2 mg/mL,醇水比调整为1:4,果胶浓度0.78 mg/mL,在此工艺下进行验证实验,得到纳米颗粒平均包埋率为86.20%±0.91%,与预测值相近,说明该模型具有一定准确性,可用于优化枇杷花黄酮纳米颗粒的制备。
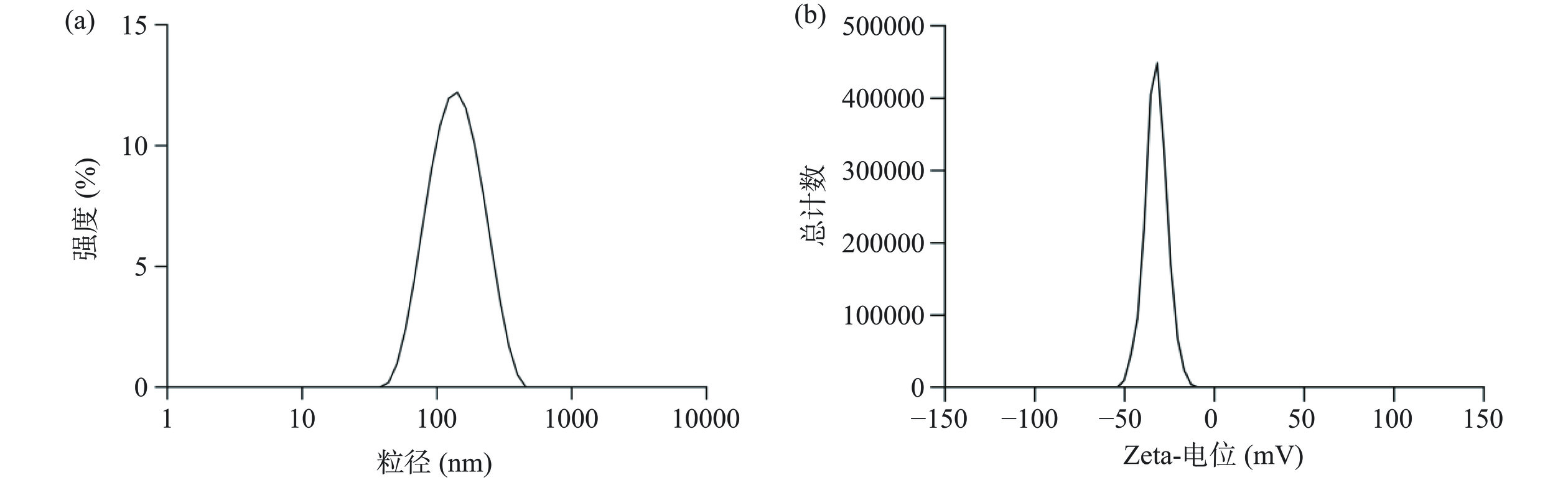
最佳工艺下制备得到的枇杷花黄酮纳米颗粒粒径及电位如图8所示,粒径和电位均只有一个峰值,说明该分散体系均一稳定,此时该纳米颗粒平均粒径为132.13±1.31 nm,PDI为0.16±0.01,Zeta电位为−33.97±1.46 mV。
2.2 枇杷花黄酮纳米颗粒的抗氧化活性
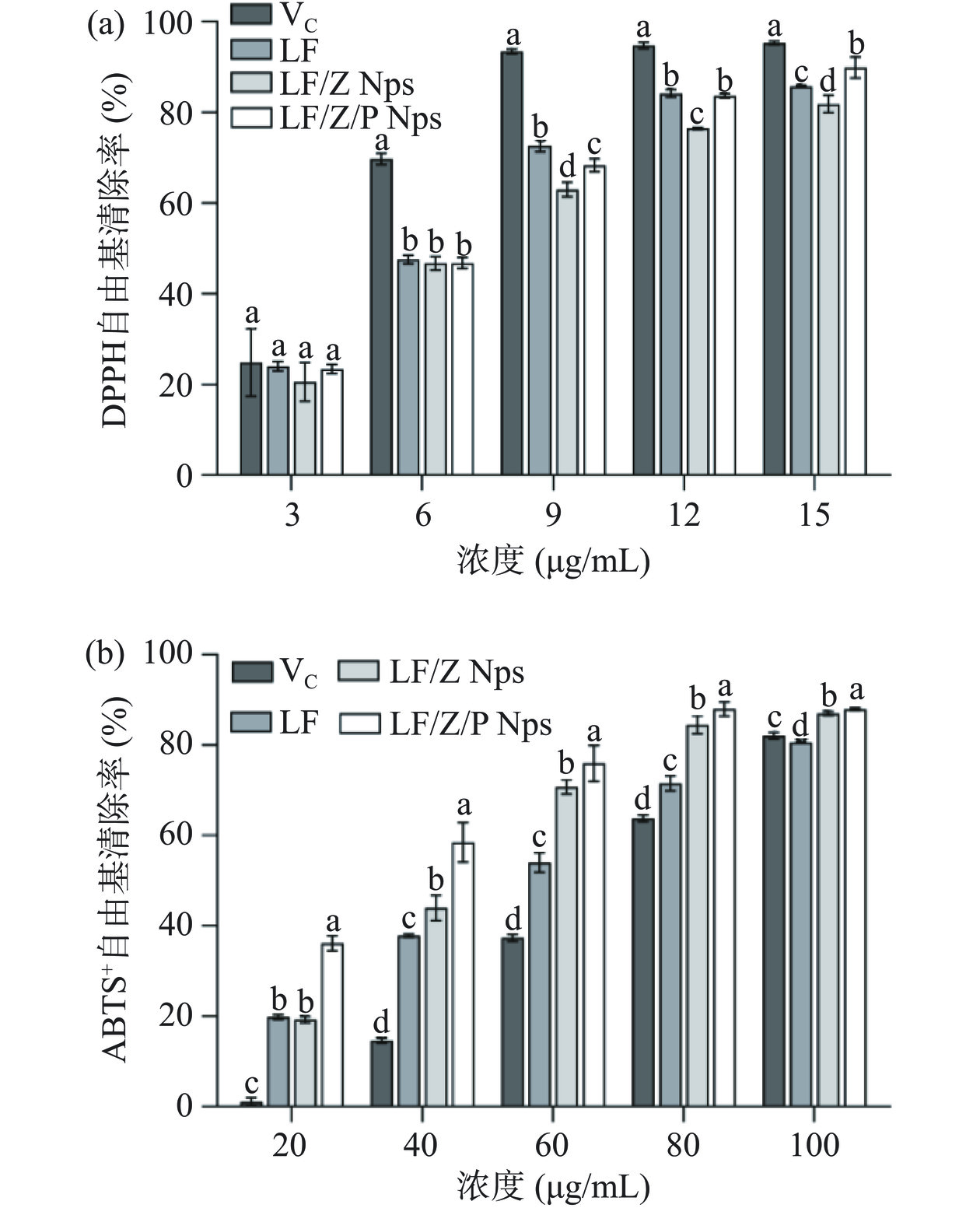
枇杷花黄酮封装前后抗氧化活性变化如图9所示,LF、LF/Z Nps和LF/Z/P Nps均具有一定的DPPH自由基清除能力,三者IC50值分别为5.73、6.41、5.85 μg/mL,略高于VC(4.44 μg/mL)。LF、LF/Z Nps、LF/Z/P Nps清除ABTS+自由基的IC50值分别为48.52、40.77、29.76 μg/mL,均低于VC(63.86 μg/mL);当浓度为80 μg/mL时,LF/Z Nps和LF/Z/P Nps对ABTS+自由基清除率分别为84.47%和87.97%,远高于LF(71.5%)。结果表明,封装不会导致枇杷花黄酮抗氧化活性的降低,甚至可能因为纳米封装提高了枇杷花黄酮的表面积和分散性,从而促进黄酮类物质与自由基的反应,使其清除自由基能力提升[20]。
2.3 枇杷花黄酮纳米颗粒稳定性
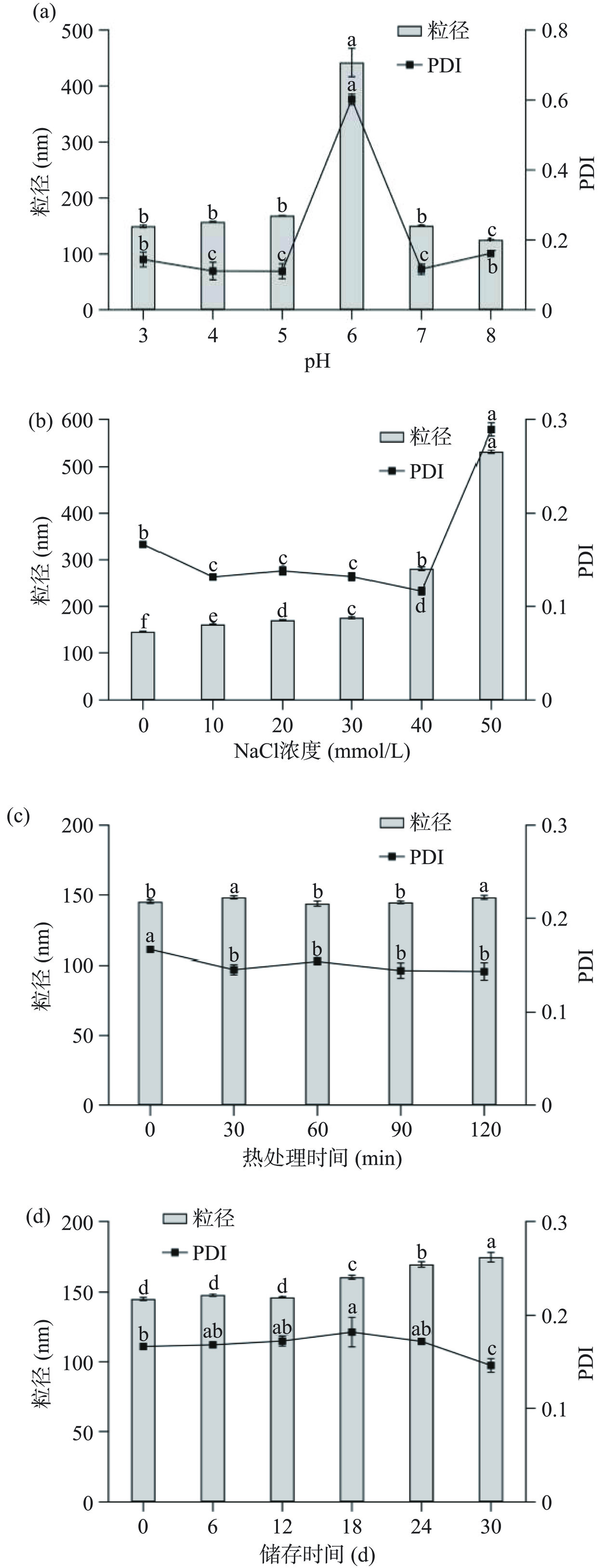
LF/Z/P Nps对pH、NaCl浓度、热处理、贮藏时间的稳定性如图10所示。LF/Z/P Nps在pH3.0~5.0范围内纳米颗粒粒径及PDI均较小,此时纳米颗粒分散体系具有较高稳定性。在pH6.0条件下,纳米颗粒粒径和PDI急剧增加,体系稳定性下降,这是由于玉米醇溶蛋白在等电点附近所带电荷几乎为0,果胶与蛋白之间的静电吸附作用减弱,蛋白易发生疏水相互作用导致纳米颗粒聚集[13]。在pH7.0~8.0条件下,玉米醇溶蛋白带负电荷,与果胶间静电吸附作用较弱,部分果胶开始脱落,纳米颗粒粒径变小,此时纳米颗粒通过玉米醇溶蛋白之间静电斥力来维持分散体系的稳定。
LF/Z/P Nps对NaCl浓度较为敏感,NaCl浓度低于40 mmol/L时,纳米颗粒粒径变化较小,PDI随NaCl的添加而降低,纳米分散体系稳定均一。当浓度大于40 mmol/L时粒径增至200 nm以上,PDI急剧增加,体系趋于不稳定。研究表明盐离子加入会使果胶或者蛋白发生电中和反应,从而降低两者之间的静电吸附作用[15];同时,盐离子可能降低纳米颗粒间的静电斥力,因此当盐离子浓度达到一定值时纳米颗粒会因为聚集产生沉淀[32]。
LF/Z/P Nps在90 ℃加热120 min后,纳米颗粒粒径仍然保持在200 nm以下,PDI在加热30 min后有所下降,但加热时间延长对纳米颗粒PDI没有显著影响(P>0.05),表明热处理对纳米颗粒分散体系影响较小。Liang等[33]研究表明80 ℃加热120 min其纳米颗粒粒径和PDI未发生显著性变化。LF/Z/P Nps经4 ℃储藏后粒径逐渐增加,PDI先增加后减小。当贮藏时间达到30 d时,纳米颗粒粒径显著增大(P<0.05),但仍保持在200 nm以下,同时PDI减小为0.15±0.01,此时纳米颗粒分散液未出现明显混浊,分散体系均一稳定。
3. 结论
本文采用反溶剂沉淀和静电吸附作用相结合的方法制备了LF/Z/P Nps,其最佳制备工艺为:枇杷花黄酮浓度0.135 mg/mL,玉米醇溶蛋白浓度2.2 mg/mL,醇水比1:4,果胶浓度0.78 mg/mL。此工艺下制备的纳米颗粒包埋率为86.20%±0.91%,平均粒径为132.13±1.31 nm,PDI为0.16±0.01,Zeta电位为−33.97±1.46 mV,该纳米颗粒的封装有效保持了枇杷花黄酮的抗氧化活性。研究结果表明,90 ℃热处理120 min和4 ℃储藏30 d后分散液粒径仍保持在200 nm以下,分散体系稳定;但在玉米醇溶蛋白等电点附近,以及NaCl浓度大于40 mmol/L时粒径和PDI明显增大。该研究为枇杷花黄酮稳态化及产品开发提供一定理论依据,且对黄酮等其他活性成分封装具有借鉴意义。
-
表 1 响应面试验因素与水平
Table 1 Factors and levels of response surface test
水平 因素 A(mg/mL) B(mg/mL) C D(mg/mL) −1 0.10 1.50 1:3 0.50 0 0.15 2.00 1:4 0.75 1 0.20 2.50 1:5 1.00 表 2 响应面试验设计与结果
Table 2 Design and results of response surface test
试验号 A B C D 包埋率(%) 1 −1 −1 0 0 80.99 2 −1 0 1 0 78.15 3 −1 0 0 1 81.6 4 −1 1 0 0 83.54 5 −1 0 −1 0 76.1 6 −1 0 0 −1 78.44 7 0 0 1 −1 76.9 8 0 0 0 0 85.21 9 0 1 −1 0 80.10 10 0 0 −1 −1 73.69 11 0 1 0 −1 81.64 12 0 −1 0 −1 73.61 13 0 1 1 0 79.49 14 0 −1 0 1 79.41 15 0 −1 1 0 76.43 16 0 0 1 1 80.51 17 0 1 0 1 80.75 18 0 0 0 0 83.87 19 0 0 0 0 86.10 20 0 0 −1 1 76.89 21 0 0 0 0 85.21 22 0 −1 −1 0 75.47 23 0 0 0 0 85.66 24 1 −1 0 0 73.53 25 1 0 −1 0 72.51 26 1 0 0 1 76.23 27 1 1 0 0 77.38 28 1 0 1 0 73.98 29 1 0 0 −1 73.15 表 3 回归模型与方差分析
Table 3 Regression model and analysis of variance
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 459.07 14 32.79 26.46 <0.0001 ** A 85.87 1 85.87 69.28 <0.0001 ** B 45.86 1 45.86 37.00 <0.0001 ** C 9.56 1 9.56 7.71 0.0148 * D 26.85 1 26.85 21.66 0.0004 ** AB 0.4225 1 0.4225 0.3409 0.5686 AC 0.0756 1 0.0756 0.0610 0.8085 AD 0.0030 1 0.0030 0.0024 0.9613 BC 0.6162 1 0.6162 0.4972 0.4923 BD 11.19 1 11.19 9.03 0.0095 ** CD 0.0342 1 0.0342 0.0276 0.8704 A² 126.84 1 126.84 102.34 <0.0001 ** B² 35.43 1 35.43 28.58 0.0001 ** C² 168.27 1 168.27 135.76 <0.0001 ** D² 80.29 1 80.29 64.78 <0.0001 ** 残差 17.35 14 1.24 失拟项 14.56 10 1.46 2.09 0.2491 纯误差 2.79 4 0.6975 总误差 476.42 28 R2=0.9636 R2adj=0.9272 C.V.%=1.41 注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。 -
[1] CHAGAS M D S S, BEHRENS M D, MORAGAS-TELLIS C J, et al. Flavonols and flavones as potential anti-inflammatory, antioxidant, and antibacterial compounds[J]. Oxidative Medicine and Cellular Longevity,2022,2022:9966750.
[2] KOOLAJI N, SHAMMUGASAMY B, SCHINDELER A, et al. Citrus peel flavonoids as potential cancer prevention agents[J]. Current Developments in Nutrition,2020,4(5):nzaa025. doi: 10.1093/cdn/nzaa025
[3] ZEKA K, RUPARELIA K, ARROO R J, et al. Flavonoids and their metabolites:Prevention in cardiovascular diseases and diabetes[J]. Diseases,2017,5(3):19. doi: 10.3390/diseases5030019
[4] CARMELA G, GIOVANNA G. Flavonoids from plants to foods:From green extraction to healthy food ingredient[J]. Molecules,2022,27(9):2633. doi: 10.3390/molecules27092633
[5] WEN K M, FANG X C, YANG J L, et al. Recent research on flavonoids and their biomedical applications[J]. Current Medicinal Chemistry,2021,28(5):1042−1066.
[6] AYALA-FUENTES J C, CHAVEZ-SANTOSCOY R A. Nanotechnology as a key to enhance the benefits and improve the bioavailability of flavonoids in the food Industry[J]. Foods,2021,10(11):2701. doi: 10.3390/foods10112701
[7] NAEEM A, MING Y, PENGYI H, et al. The fate of flavonoids after oral administration:A comprehensive overview of its bioavailability[J]. Critical Reviews in Food Science and Nutrition,2021,62(22):6169−6186.
[8] MA Q M, DAVIDSON P M, ZHONG Q X. Nanoemulsions of thymol and eugenol co-emulsified by lauric arginate and lecithin[J]. Food Chemistry,2016,206:167−173. doi: 10.1016/j.foodchem.2016.03.065
[9] ZHANG S L, HAN Y. Preparation, characterisation and antioxidant activities of rutin-loaded zein-sodium caseinate nanoparticles[J]. Plos One,2018,13(3):e0194951. doi: 10.1371/journal.pone.0194951
[10] ABREU F, OLIVEIRA E F, PAULA H, et al. Chitosan/cashew gum nanogels for essential oil encapsulation[J]. Carbohydr Polym,2012,89(4):1277−1282. doi: 10.1016/j.carbpol.2012.04.048
[11] WANG Y L, YU J, LI D, et al. Paclitaxel derivative-based liposomal nanoplatform for potentiated chemo-immunotherapy[J]. Journal of Controlled Release:Official Journal of the Controlled Release Society,2022,341:812−827. doi: 10.1016/j.jconrel.2021.12.023
[12] YAN X J, LI M T, XU X F, et al. Zein-based nano-delivery systems for encapsulation and protection of hydrophobic bioactives:A review[J]. Frontiers in Nutrition,2022,9:999373. doi: 10.3389/fnut.2022.999373
[13] DE MARCO I. Zein microparticles and nanoparticles as drug delivery systems[J]. Polymers -Basel,2022,14(11):2172. doi: 10.3390/polym14112172
[14] TAPIA-HERNÁNDEZ J A, RODRÍGUEZ-FELIX F, JUÁREZ-ONOFRE J E, et al. Zein-polysaccharide nanoparticles as matrices for antioxidant compounds:A strategy for prevention of chronic degenerative diseases[J]. Food Res Int,2018,111:451−471. doi: 10.1016/j.foodres.2018.05.036
[15] LIU Q Y, QIN Y, JIANG B, et al. Development of self-assembled zein-fucoidan complex nanoparticles as a delivery system for resveratrol[J]. Colloids Surf B Biointerfaces,2022,216:112529. doi: 10.1016/j.colsurfb.2022.112529
[16] HUANG G L, MA J J, SUI S Y, et al. Optimization of extraction of loquat flowers polyphenolics and its antioxidant and anti-polyphenol oxidase properties[J]. Bioengineered,2020,11(1):281−290. doi: 10.1080/21655979.2020.1735604
[17] 李臣, 周超. 枇杷花的生物活性及食品开发利用研究进展[J]. 现代食品,2021(24):45−48. [LI C, ZHOU C. Research progress on the biological activity and food development and utilization of loquat flower[J]. Modern Food,2021(24):45−48.] LI C, ZHOU C. Research progress on the biological activity and food development and utilization of loquat flower[J]. Modern Food, 2021(24): 45−48.
[18] 毕云华, 黄佳婷, 章鸿彬, 等. 枇杷花抗炎活性物质的制备及成分分析[J/OL]. 食品与发酵工业:1−10[2023-12-08]. https://doi.org/10.13995/j.cnki.11-1802/ts.035869. [BI Y H, HUANG J T, ZHANG H B, et al. Preparation and analysis of anti-inflammatory substances from loquat flowers[J/OL]. Food and Fermentation Industries, 1−10[2023-12-08].https://doi.org/10.13995/j.cnki.11-1802/ts.035869.] BI Y H, HUANG J T, ZHANG H B, et al. Preparation and analysis of anti-inflammatory substances from loquat flowers[J/OL]. Food and Fermentation Industries, 1−10[2023-12-08].https://doi.org/10.13995/j.cnki.11-1802/ts.035869.
[19] LIANG X, CAO K X, LI W, et al. Tannic acid-fortified zein-pectin nanoparticles:Stability, properties, antioxidant activity, and in vitro digestion[J]. Food Research International,2021,145(5):110425.
[20] WANG X J, PENG F, LIU F G, et al. Zein-pectin composite nanoparticles as an efficient hyperoside delivery system:Fabrication, characterization, and in vitro release property[J]. LWT-Food Science & Technology,2020,133(1):109869.
[21] 王振帅, 陈善敏, 信思悦, 等. 朝鲜蓟花苞汁总酚、总黄酮、抗氧化性比较及体外模拟胃肠消化特性[J]. 食品科学,2019,40(19):136−142. [WANG Z S, CHEN S M, XING S Y, et al. Total phenols and flavonoids and antioxidant activity of artichoke (Cynara scolymus L.) bud juices before and aftergastrointestinal digestion in vitro[J]. Food Science,2019,40(19):136−142.] WANG Z S, CHEN S M, XING S Y, et al. Total phenols and flavonoids and antioxidant activity of artichoke (Cynara scolymus L.) bud juices before and aftergastrointestinal digestion in vitro[J]. Food Science, 2019, 40(19): 136−142.
[22] ZHANG Z H, LI X J, SANG S Y, et al. Preparation, properties and interaction of curcumin loaded zein/HP-β-CD nanoparticles based on electrostatic interactions by antisolvent co-precipitation[J]. Food Chemistry,2023,403:134344. doi: 10.1016/j.foodchem.2022.134344
[23] AGRAWAL H, JOSHI R, GUPTA M. Isolation, purification and characterization of antioxidative peptide of pearl millet (Pennisetum glaucum) protein hydrolysate[J]. Food Chemistry,2016,204:365−372. doi: 10.1016/j.foodchem.2016.02.127
[24] 梁晓, 胡勇, 徐金瑞, 等. 不同电荷阴离子多糖对负载单宁酸的玉米醇溶蛋白纳米颗粒的稳定作用[J]. 现代食品科技,2022,38(5):174−182. [LIANG X, HU Y, XU J R, et al. Stabilization of tannic acid-loaded zein nanoparticles by anionic polysaccharides with different charge[J]. Modern Food Science and Technology,2022,38(5):174−182.] LIANG X, HU Y, XU J R, et al. Stabilization of tannic acid-loaded zein nanoparticles by anionic polysaccharides with different charge[J]. Modern Food Science and Technology, 2022, 38(5): 174−182.
[25] 石泽栋. 苹果渣多酚的提取及其纳米胶囊的制备与表征[D]. 淄博:山东理工大学, 2022. [SHI Z D. Extraction of apple pomace polyphenols and its nanocapsules preparation and characterization[D]. Zibo:Shandong University of Technology, 2022.] SHI Z D. Extraction of apple pomace polyphenols and its nanocapsules preparation and characterization[D]. Zibo: Shandong University of Technology, 2022.
[26] LIU Q, JING Y, HAN C, et al. Encapsulation of curcumin in zein/ caseinate/sodium alginate nanoparticles with improved physicochemical and controlled release properties[J]. Food Hydrocolloids,2019,93(AUG.):432−442.
[27] DA ROSA C G, PAULA Z D M A, SGANZERRLA W G, et al. Application in situ of zein nanocapsules loaded with Origanum vulgare Linneus and thymus vulgaris as a preservative in bread[J]. Food Hydrocolloids,2020,99:105339. doi: 10.1016/j.foodhyd.2019.105339
[28] FENG L, YAN C, LIU S B, et al. Size-controlled fabrication of zein nano/microparticles by modified anti-solvent precipitation with/without sodium caseinate[J]. International Journal of Nanomedicine,2017,12:8197−8209. doi: 10.2147/IJN.S143733
[29] ZHANG Y Q, WANG B, WU Y, et al. Fabrication and characterization of zein composite particles coated by caseinate-pectin electrostatic complexes with improved structural stability in acidic aqueous environments[J]. Molecules (Basel, Switzerland),2019,24(14):2535. doi: 10.3390/molecules24142535
[30] ROSALES T K O, FABI J P. Pectin-based nanoencapsulation strategy to improve the bioavailability of bioactive compounds[J]. Int J Biol Macromol,2023,229:11−21. doi: 10.1016/j.ijbiomac.2022.12.292
[31] KHAN M A, YUE C, FANG Z, et al. Alginate/chitosan-coated zein nanoparticles for the delivery of resveratrol[J]. Journal of Food Engineering,2019,258(OCT.):45−53.
[32] HU K, HUANG X X, GAO Y Q, et al. Core-shell biopolymer nanoparticle delivery systems:Synthesis and characterization of curcumin fortified zein-pectin nanoparticles[J]. Food Chemistry,2015,182:275−281. doi: 10.1016/j.foodchem.2015.03.009
[33] LIANG X, CHENG W T, LIANG Z H, et al. Co-encapsulation of tannic acid and resveratrol in zein/pectin nanoparticles:Stability, antioxidant activity, and bioaccessibility[J]. Foods,2022,11(21):3478. doi: 10.3390/foods11213478
-
期刊类型引用(2)
1. 王爽,王欣雨,吕重宁,关颖丽,秦汝兰. 罗布麻叶中黄酮的稳定性研究. 人参研究. 2025(01): 47-51 .  百度学术
百度学术
2. 周立稳,彭效明,居瑞军,杨思敏,严晓强,管洁. 不同溶剂对枇杷果提取物抗氧化活性和多酚稳定性的影响. 食品与生物技术学报. 2024(09): 107-115 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



