Puerarin-Hericium Insoluble Dietary Fiber Compound Preparation of Microcapsule and Study of the Physical and Chemical Properties
-
摘要: 目的:旨在制备葛根素-猴头菇不溶性膳食纤维复合微胶囊,通过提高其包埋率、抗氧化特性和生物可及性,进而促进葛根素相关产品的研发。方法:采用2.0%卡拉胶、3.0%海藻酸钠、0.5 g猴头菇不溶性膳食纤维、10.0 mg葛根素、5.0%的CaCl2溶液制得葛根素微胶囊(以不添加不溶性膳食纤维作为对照组),计算其包埋率、抗氧化特性、模拟体内消化释放率、生物可及性,并通过扫描电子显微镜(SEM)、X 射线衍射(XRD)、傅里 叶变换红外光谱(FT-IR)观察其微观结构。结果:猴头菇不溶性膳食纤维能够作为葛根素微胶囊的壁材,且包埋率均高于75.8%,最高可达94.66%,葛根素的承载量由空白组的0.60%增加到添加膳食纤维最高可达1.37%;消化前后DPPH、ABTS+两种自由基的清除能力显著低于未添加猴头菇不溶性膳食纤维的葛根素微胶囊(P<0.05),能够达到延缓抗氧化特性的作用;模拟体内消化的研究发现猴头菇不溶性膳食纤维包埋的葛根素(最低为9.46%)相对于游离的葛根素(17.46%)在胃中能够缓慢的释放,在进入肠道后迅速释放出来并大量溶于模拟肠道液中,使得葛根素肠道中的释放率从游离的22.93%增加到添加不溶性膳食纤维的最高可达92.59%,实现肠道的精准释放,显著提高了葛根素的生物可及性,是游离葛根素的2.9~3.9倍;SEM、FT-IR、XRD从微观层面证实超声辅助提取法所得猴头菇不溶性膳食纤维作为葛根素微胶囊的壁材,能够改善对照组微胶囊将葛根素裸露的缺点,使得微胶囊质地更紧密,也证实猴头菇不溶性膳食纤维的包埋使得葛根素的结晶度降低或消失以及葛根素的特征衍射峰发生偏移或减弱,达到良好的包埋效果。结论:添加猴头菇不溶性膳食纤维能够提高葛根素的溶出速率,延缓葛根素抗氧化的时长,实现其在肠道中的定点释放,提高葛根素的生物可及性和生物利用率,可以作为葛根素微胶囊的壁材。
-
关键词:
- 葛根素 /
- 猴头菇不溶性膳食纤维 /
- 微胶囊 /
- 生物利用率 /
- 缓释
Abstract: Objective: To prepare puerarin-Hericium insoluble dietary fiber composite microcapsules, and promote the research and development of puerarin related products by improving its embedding rate, antioxidant properties and bioaccessibility. Methods: Puerarin microcapsules were prepared with 2.0% carrageenan, 3.0% sodium alginate, 0.5 g insoluble dietary fiber, 10.0 mg puerarin, and 5.0% CaCl2 solution (with no insoluble dietary fiber added as the control group). The embedding rate, antioxidant properties, simulated digestion and release rate in vivo, and bioaccessibility were calculated. The microstructure was observed by scanning electron microscope (SEM), X-ray diffraction (XRD) and Fourier transform infrared spectroscopy (FT-IR). Results: Hericium insoluble dietary fiber could be used as puerarin microcapsule wall material, and the embedding rate was higher than 75.8%, the highest could amount to 94.66%, the bearing capacity of puerarin by blank group increased to 0.60% of the top add dietary fiber was 1.37%. Before and after digestion, the scavenging ability of DPPH and ABTS+ were significantly lower than those of puerarin microcapsules without soluble dietary fiber, which could achieve the effect of delaying antioxidant properties. The study of in vivo digestion showed that puerarin embedded in hericium insoluble dietary fiber (minimum 9.46%) could be released slowly in the stomach compared with free puerarin (17.46%). After entering the intestine, puerarin was released rapidly and dissolved in a large amount in the simulated intestinal fluid. The release rate of puerarin in the intestine increased from 22.93% of free puerarin to up to 92.59% of hericium insoluble dietary fiber, achieving accurate intestinal release and significantly improving the bioaccessibility of puerarin, which was 2.9~3.9 times that of free puerarin. SEM, FT-IR and XRD confirm that the hericium insoluble dietary fiber obtained by ultrasonic-assisted extraction could be used as the wall material of puerarin microcapsules, which could improve the shortcomings of exposing puerarin in the control group microcapsules and make the microcapsules more compact in texture. It was also confirmed that the hericium insoluble dietary fiber made the crystallinity of puerarin decrease or disappear and the characteristic diffraction peak of puerarin shift or weaken, which achieved a good embedding effect. Conclusion: Adding hericium insoluble dietary fiber could enhance the dissolution rate of puerarin, delay the antioxidant time of puerarin combined with sibelium, achieve the fixed-point release in the intestine, raise the biological availability and biological utilization ratio of puerarin, which can be used as puerarin microcapsule wall material.-
Keywords:
- puerarin /
- Hericium insoluble dietary fiber /
- microcapsule /
- bioavailability /
- sustained release
-
葛是一种天然的药食同源植物,葛根(Pueraria lobata)作为其主要组成部分,素有“南方人参”和“南葛北参”之称,关于葛根药用价值的记载可追溯到《神农本草经》及《本草纲目》[1]。葛根素(Puerarin,PUE)作为葛根主要的异黄酮成分,具有保护神经器官和细胞免受损伤等作用[2−3],此外,葛根素对2型糖尿病[4]、病理性心脏重构[5]和脑疾病[6]等慢性代谢性疾病具有明显治疗改善作用。然而,由于葛根素的水溶性及脂溶性低,进而导致其生物利用率也随之降低,研究发现口服葛根素的生物利用率仅为7%[7]。目前,葛根素注射剂是提高其生物利用率的唯一成熟的并应用到市场的方法[8],但因葛根素的半衰期较短,需频繁和高剂量注射进而引起严重不良反应,加之其水溶性差亦会降低其系统吸收率及分子疗效,限制其临床应用[9−10]。基于此,如何提高葛根素的生物利用率已成为研究者们关注的问题。
据报道,提高药物或食物口服后生物利用度的策略主要包括纳米技术和各种制备技术,如纳米分散体[11]、聚合物胶束[12]、纳米乳剂[13]和自乳化药物传递系统[14]等。于葛根素而言,微乳剂、纳米颗粒及纳米晶体等新型药物传递系统已被初步应用于提高葛根素的生物利用率[15],其中纳米晶体是较常用的载体,其主要优点为增加水不溶性药物的溶解度及溶出速率,同时伴有更高的载药量[16],微胶囊技术作为纳米晶体常见的制备方法,可利用天然或合成的高分子材料对固、液、气体等核心物质进行有效包埋进而提高不溶性产品的水溶性和生物利用率,其中,绿色环保材料所制备的微胶囊已在食品、医学等相关领域广泛应用[17]。
膳食纤维(Dietary Fiber,DF)是天然的环保材料,亦可作为大多植物性食品与膳食补充剂的主要成分,其主要包括细胞壁多糖、纤维素及酚类化合物等[18]。大量研究表明,膳食纤维在肠道健康中起着重要作用,并且能够降低糖尿病、肥胖和癌症等疾病风险[19]。膳食纤维可分为可溶性膳食纤维(Soluble Dietary Fiber,SDF)和不可溶性膳食纤维(Insoluble Dietary Fiber,IDF),研究表明,不溶性膳食纤维与多种膳食抗氧化剂有关,由于不溶性膳食纤维具有疏松多孔结构及粗糙表面,抗氧化剂可通过吸附或包埋等形式附在不溶性膳食纤维上[20],因此不溶性膳食纤维可以作为抗氧化剂的载体[21]。抗氧化剂能够在不溶性膳食纤维的保护下延长在胃肠道中储存时长,同时,在肠道微生物群作用下,从纤维基质中缓慢连续释放,进而延长其作用特性。因此,不溶性膳食纤维可作为构建抗氧化剂稳定体系的惰性基质。
猴头菇作为我国重要的药食同源食用菌,富含丰富的不溶性膳食纤维[22],但因适口性差而常被忽视,或成为猴头菇萜类[23]等活性成分提取的副产物,甚至被当作发酵底物[24]。因此,对猴头菇不溶性膳食纤维的研究开发不仅能做到物尽其用、减少资源浪费,同时也能拓宽猴头菇的应用领域及市场效益。当前,国内外还未有猴头菇不溶性膳食纤维制备葛根素微胶囊相关研究。
本研究采用葛根素、猴头菇不溶性膳食纤维等为原材料制备葛根素微胶囊,以期弥补猴头菇不溶性膳食纤维制备葛根素微胶囊的研究空缺,为猴头菇不溶性膳食纤维及葛根素研究开发提供参考。
1. 材料与方法
1.1 材料和仪器
葛根素(纯度98%)、卡拉胶 上海麦克林生化科技股份有限公司;葛根素标准品、海藻酸钠、95%无水乙醇、DPPH自由基清除试剂盒 北京索莱宝科技有限公司;猴头菇不溶性膳食纤维 课题组实验室前期提取,分别采用碱提取法、复合酶提取法、超声辅助提取法制得;5%的CaCl2溶液 无水CaCl2配制;模拟口腔液 东莞市创威检测仪器有限公司;模拟胃液、模拟肠液 北京雷根生物技术有限公司。
HWS-28冷冻干燥机 上海-恒科学仪器有限公司;SS-1022粉碎机 武义海纳电器有限公司;KQ-500DE超声波清洗机 昆山市超声仪器有限公司;HS5C磁力搅拌器 浙江科学仪器有限公司;Multiskan GO多功能酶标仪、Nicolet 670傅里叶红外光谱仪(FTIR) 赛默飞世尔科技(中国)有限公司;Sigma500、Supra55扫描电子显微镜 卡尔蔡司光学(中国)有限公司;TDL-5000bR高速冷冻离心机 上海安亭科学仪器厂;BrukerAXS D8 Advance X-射线衍射仪 德国布鲁克AXS公司。
1.2 实验方法
1.2.1 葛根素微胶囊的制备
根据颜洁[25]的研究略作修改。A液:准确称取0.1 g卡拉胶(Carrageenan,Car)、0.15 g海藻酸钠(Sodium Alginate,SA)、0.5 g猴头菇不溶性膳食纤维(碱法提取的A-IDF、复合酶法提取的E-IDF、超声辅助酶法提取的U-IDF)溶于5.0 mL去离子水中,于磁力搅拌器上搅拌均匀(450 r/min,30 min)。B液:准确称量10.0 mg葛根素溶于5.0 mL的5.0%乙醇溶液中,经过常温超声(100 W,5 min)助溶,再将A液和B液混合,通过磁力搅拌器(450 r/min,30 min)搅拌均匀之后,加入10.0 mL 5.0%的CaCl2溶液进行搅拌(450 r/min,30 min),制得均匀水胶体,再用真空冷冻干燥机进行冻干,冻干后研磨成粉,得到干的微胶囊。
1.2.2 葛根素标准曲线的绘制
称取20.0 mg葛根素标准品,置于烧杯中,用95%乙醇溶解后转移到50.0 mL容量瓶中,再用95%乙醇进行定容,得到4.0 mg/mL的储备液。分别制备0、0.002、0.004、0.008、0.012、0.016、0.02 mg/mL标准溶液。用95%乙醇做空白对照,分别于250 nm测吸光度。以浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线y=2.7398x+3.4432,R2=0.9975>0.99[26]。
1.2.3 葛根素微胶囊的包埋率和包埋效率的测定
葛根素微胶囊的质量由初始加入的葛根素的质量减去游离葛根素的质量计算得出[27]。50.0 mg的微胶囊溶于1.0 mL的95%乙醇中,经过超声提取(100 W)40 min,离心10 min(4000 r/min,4 ℃),取上清液备用。取所提上清液于250 nm测吸光度,根据标准曲线计算上清液中葛根素的浓度,包埋率和包埋效率的计算公式如下:
包埋率(%)=M0−M1M2×100 (1) 葛根素承载量(%)=M0−M1M0×100 (2) 其中,M0为葛根素的总质量,mg;M1游离葛根素的质量,mg;M2为微胶囊的质量,mg。
1.2.4 扫描电镜分析
采用扫描电子显微镜(Scanning Electron Microscope,SEM)观察并拍摄样品的微观形貌。以PUE、U-IDF、Car、SA、微胶囊(不添加猴头菇膳食纤维的葛根素微胶囊CON-PUE,超声辅助提取所得的猴头菇膳食纤维包埋的葛根素微胶囊UDF-PUE)为样品,分别取少量固定于带有特殊的导电双面胶的样品台上,经离子溅射仪喷金后进行拍摄,加速电压设为电压10.0 kV,放大倍数为1500~2500[28]。
1.2.5 X射线衍射(X-ray Diffraction,XRD)分析
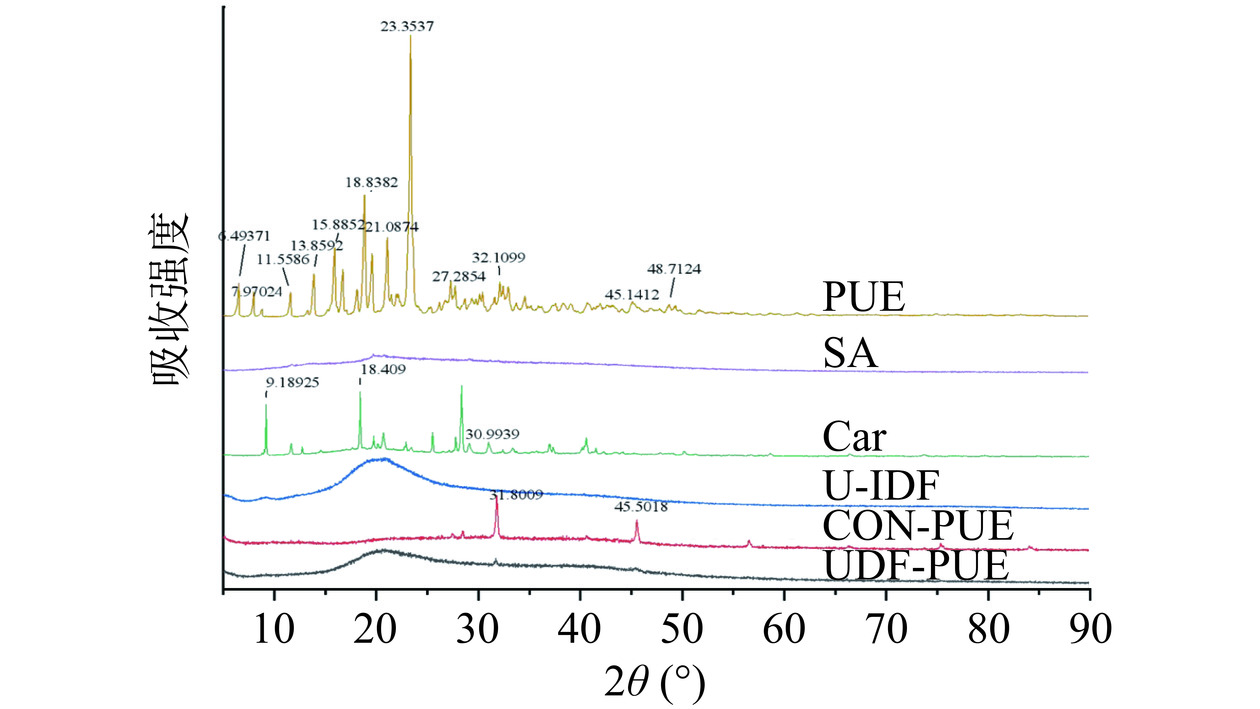
采用Kα射线衍射仪在2°~50°内测定了葛根素PUE、U-IDF、卡拉胶Car、海藻酸钠SA、微胶囊(CON-PUE、UDF-PUE)样品的XRD图谱[10]。
1.2.6 傅里叶变换红外光谱(Fourier Transform Infrared Spectroscopy,FT-IR)分析
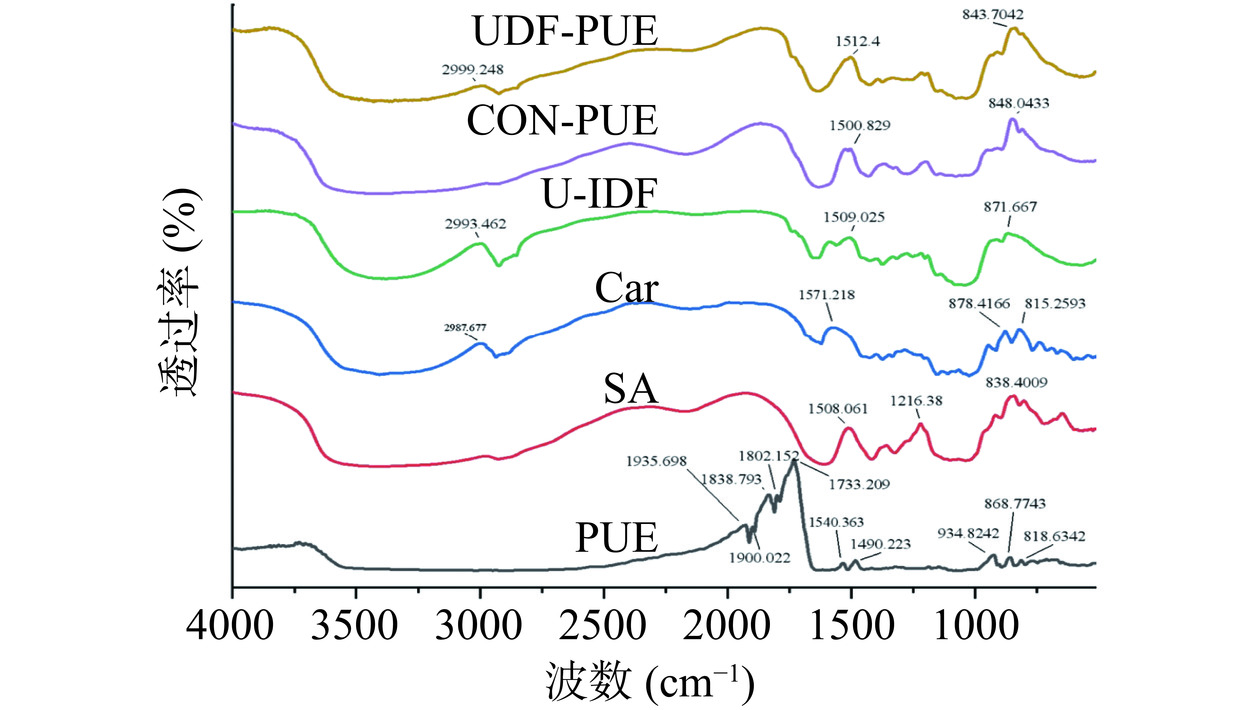
通过FT-IR观察猴头菇不溶性膳食纤维-葛根素相互作用后猴头菇不溶性膳食纤维-葛根素二级结构的变化。使用真空冷冻干燥机将样品冷冻干燥。将2.0 mg样品(葛根素PUE、超声辅助酶法提取的猴头菇不溶性膳食纤维U-IDF、卡拉胶Car、海藻酸钠SA、微胶囊(CON-PUE、UDF-PUE))与200.0 mg溴化钾混合,并在玛瑙研钵中研磨制备透明样薄片,压片后进行测定,使用溴化钾作为空白对照。扫描条件设置为:扫描范围为400~4000 cm−1,分辨率4 cm−1,扫描次数为16次[28]。
1.2.7 模拟口腔、胃肠道消化实验
基于Minekus等[29]的方法,采用静态体外胃肠道模型评估了葛根素和葛根素微胶囊的体外生物可及性,并进行了一些修改。本实验中使用的模拟口腔液、模拟胃液和模拟小肠液都需要进行预热至37 ℃。
口服相:将100.0 mg样品固体粉末加入到预热后的模拟口腔液(10.0 mL)中,混合物在37 ℃,pH7.0下孵育5 min,恒温摇床的振荡速率设置为100 r/min。
胃相:在结束口腔消化后,使用1.0 mol/L的HCl将pH调节至2.0后加入10.0 mL预热至37 ℃的模拟胃液,在37 ℃恒温摇床100 r/min消化时间2 h。
肠相:将胃糜用1.0 mol/L的NaOH调至pH为7.0,后加入10.0 mL预热至37 ℃的模拟胃液,在37 ℃恒温摇床100 r/min消化时间2 h。
葛根素释放率/生物可及性的测定:葛根素的体外生物可及性被认为是胃肠道液体中在混合胶束中溶解的部分。将通过模拟消化液的混合物在4000 r/min下离心10 min,取上清液待测。将上清液在250 nm下测定胶束中葛根素的含量。葛根素释放率/生物可及性表示为:
葛根素的释放率/生物可及性(%)=MbMa×100 (3) 其中Mb为葛根素溶出量,mg,Ma为葛根素的添加量,mg。
1.2.8 葛根素微胶囊的抗氧化特性分析
样品对DPPH自由基的清除率参照文献[30]的方法稍加修改。根1.2.3和1.2.7所得的样品提取液和样品消化液,取100 μL样品液加入300 μL DPPH乙醇溶液(0.04 mg/mL),摇匀。暗处孵育30 min后,4000 r/min离心10 min。取上清液于517 nm处测其吸光度。DPPH自由基清除率按照公式计算:
DPPH自由基清除率(%)=(1−A−A0A1)×100 (4) 其中,A指样品吸光度;A0指未加DPPH对照溶液吸光度;A1指不加样品的空白对照吸光度。
参考文献[31]等的方法,稍作修改。先按试剂盒将ABTS配成工作液,暗处放置16 h。然后用1×Pbs(pH=7.0)将其稀释至734 nm处吸光度为0.70±0.02的ABTS工作液。将1.2.3和1.2.7所得的样品提取液和样品消化液加入到3.0 mL的ABTS工作液中,混匀,静置30 min,于734 nm处测定其吸光度。相同体积1×PBS(pH=7.0)与ABTS工作液混合,放置30 min,测定空白吸光度A0。ABTS+自由基清除率按下式计算:
ABTS+自由基清除率(%)=(A0−A1)A0×100 (5) 式中,A0为未加入样品时测得的吸光度;A1为加入样品时测得的吸光度。同样,样品的ABTS+自由基清除能力计算为Trolox等效抗氧化活性,结果表示以与DPPH测定相同的方式表示。
1.3 数据处理
所有实验均进行3次独立重复实验,实验数据采用SPSS19.0软件进行单因素方差及显著性分析,其中P<0.05视为显著,图像采用GraphPad Prism9进行绘制。
2. 结果与分析
2.1 葛根素-猴头菇不溶性膳食纤维复合微胶囊的制备
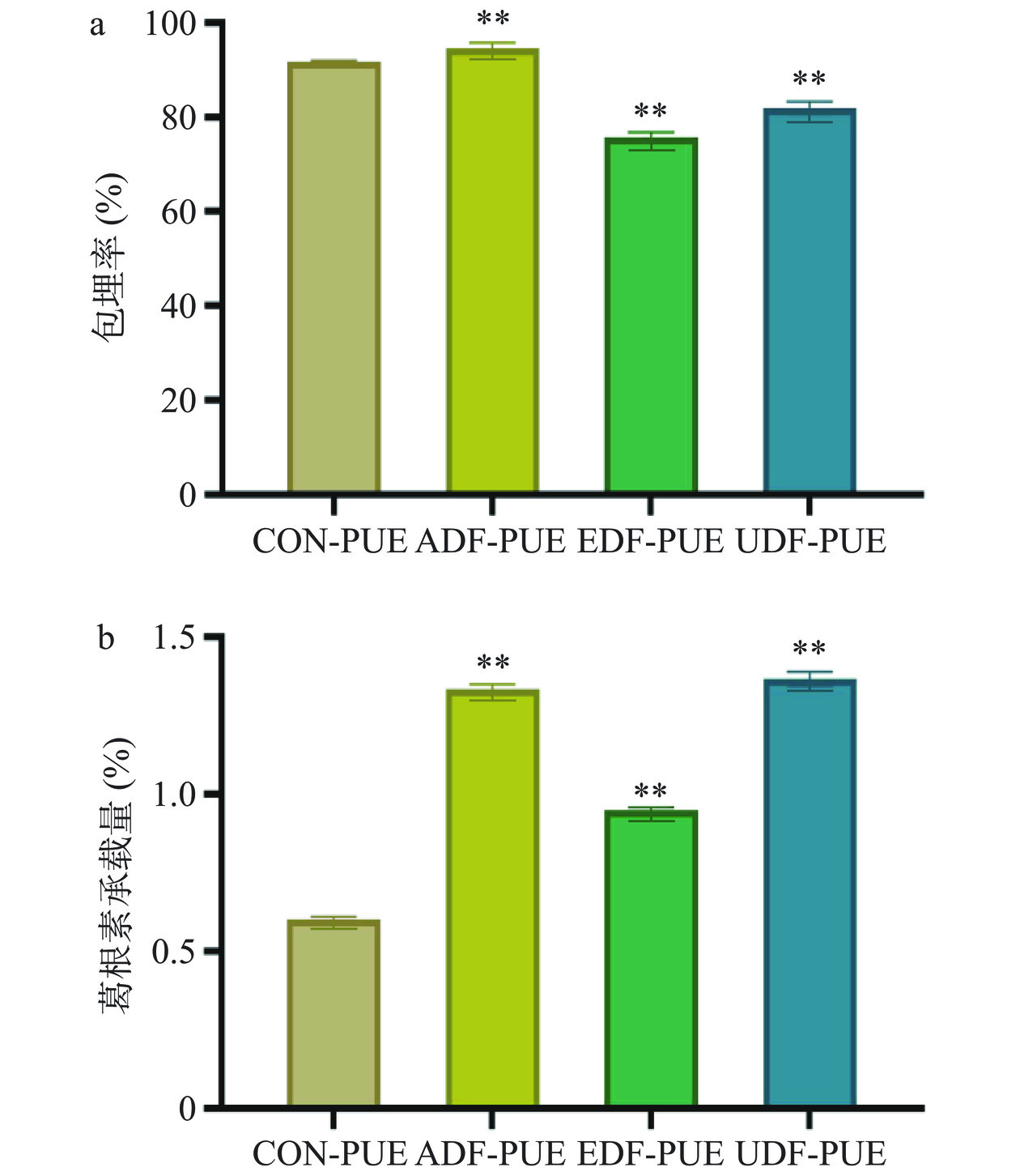
由标准曲线可知,葛根素在0~0.02 mg/mL范围内具有可行度和良好的线性关系。包埋效率决定了壁面材料保持小生物活性分子在其中空结构内的保留能力。如图1a显示了不同方法提取的猴头菇不溶性膳食纤维制备葛根素-猴头菇不溶性膳食纤维复合微胶囊葛根素的包埋率。所有组的包埋率值均大于75.81%,其中碱提取法所得的猴头菇膳食纤维包埋组达到最高为94.66%,显著高于对照组(P<0.05),其次是超声辅助提取法所得猴头菇膳食纤维包埋组达81.96%,说明猴头菇不溶性膳食纤维具有良好的包封性能。图1b显示了不同方法提取的猴头菇不溶性膳食纤维包埋葛根素的葛根素承载量,其中超声辅助酶法提取所得的猴头菇不溶性膳食纤维的葛根素微胶囊的葛根素承载量最高,达到1.37%,显著高于不添加猴头菇不溶性膳食纤维的葛根素微胶囊的0.60%(P<0.05)。这与Ji等[10]研究所得出的水不溶性DF(RS)制备的复合材料具有较高的包埋率和包埋效率的结果一致。这一现象可能是因为膳食纤维可以在形成复合物过程中为芯材的吸附和固定化提供固体表面[32]。
2.2 葛根素-猴头菇不溶性膳食纤维复合微胶囊对葛根素抗氧化作用的缓释效果
自由基是一类含有未配对电子的高活性化学基团,包括活性氧(ROS)、加氧自由基和脂质过氧化物[33]。一旦体内的自由基平衡遭到了破坏,就会对机体造成重大的损害,如脂质过氧化损伤、酶、蛋白质和氨基酸的氧化损伤,并对免疫系统造成破坏。
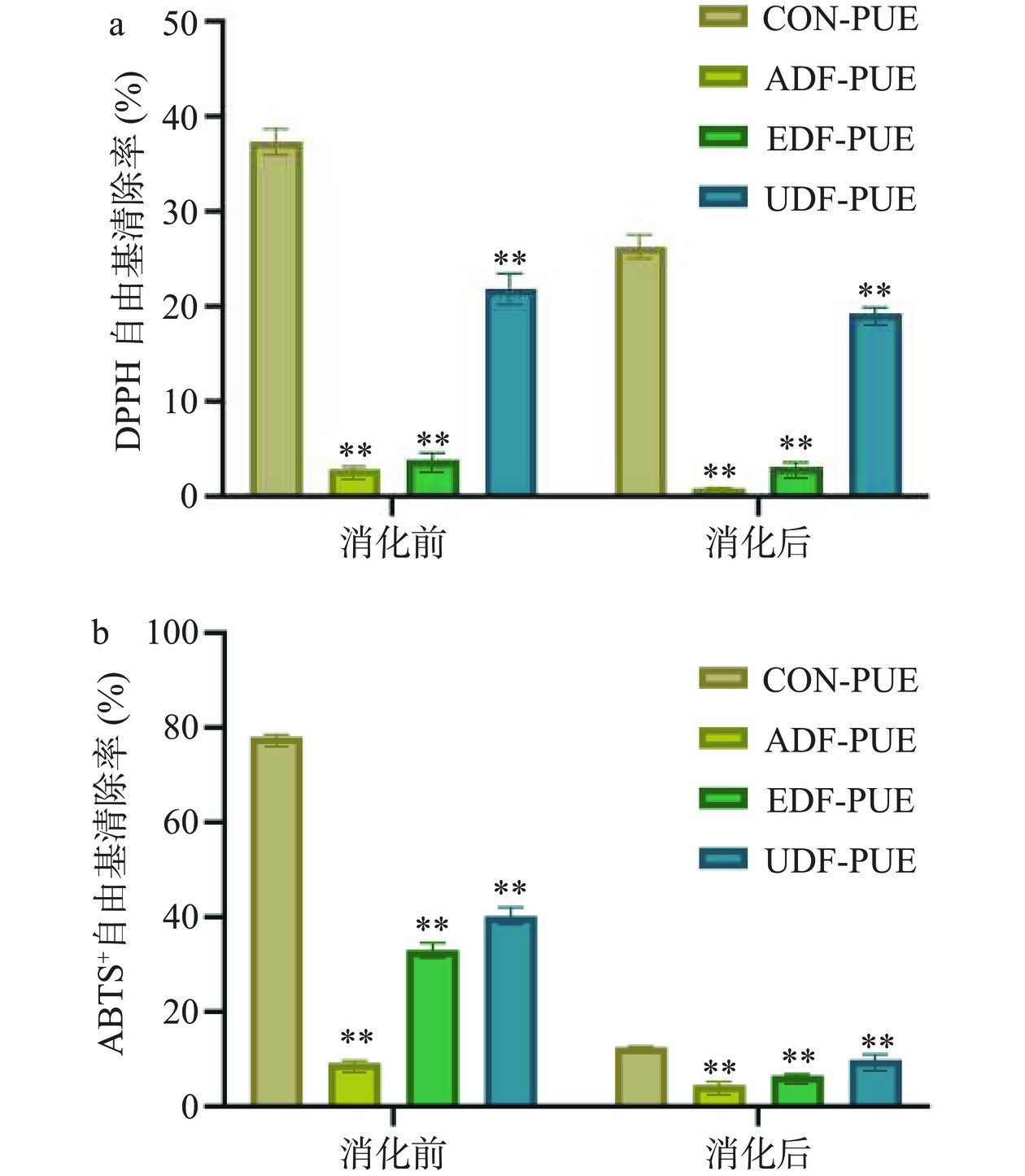
该研究通过DPPH自由基清除和ABTS+自由基清除能力来评价添加和未添加不溶性膳食纤维所制备的葛根素微胶囊的抗氧化性能。实验结果如图2所示,葛根素微胶囊的抗氧化活性于消化前和消化后均存在显著性差异(P<0.05),消化前,与不添加不溶性的膳食纤维的抗氧化性相比,添加了不溶性膳食纤维的几个组的抗氧化能力均明显降低,其中DPPH自由基清除率由对照组的37.34%下降了62.96%~92.96%,ABTS+自由基清除率由对照组的78.08%下降了65.52%~89.47%。这可能是由于部分葛根素被猴头菇不溶性膳食纤维紧密包裹,进入不溶性膳食纤维的片层状结构和孔隙中,在制备样液时未能通过研磨将葛根素完全暴露出来溶解于溶剂中,导致测量时抗氧化活性降低。
消化后,不添加膳食纤维的葛根素微胶囊比添加了膳食纤维的葛根素微胶囊的抗氧化活性高,其中DPPH自由基的清除率,对照组(26.30%)比膳食纤维组高1.7~13.2倍,ABTS+自由基清除率,空白对照组(12.52%)比膳食纤维组高1.4~32.5倍。这有可能与不溶性膳食纤维的存在有关系,这与之前唐玉妹[31]的研究结果一致,说明不溶性膳食纤维的添加能够避免了葛根素过早释放并且暴露在胃肠消化环境中,使得其酚羟基接受质子的能力下降,进而导致其自由基清除能力的下降。
2.3 葛根素-猴头菇不溶性膳食纤维复合微胶囊对葛根素的体内释放率的影响
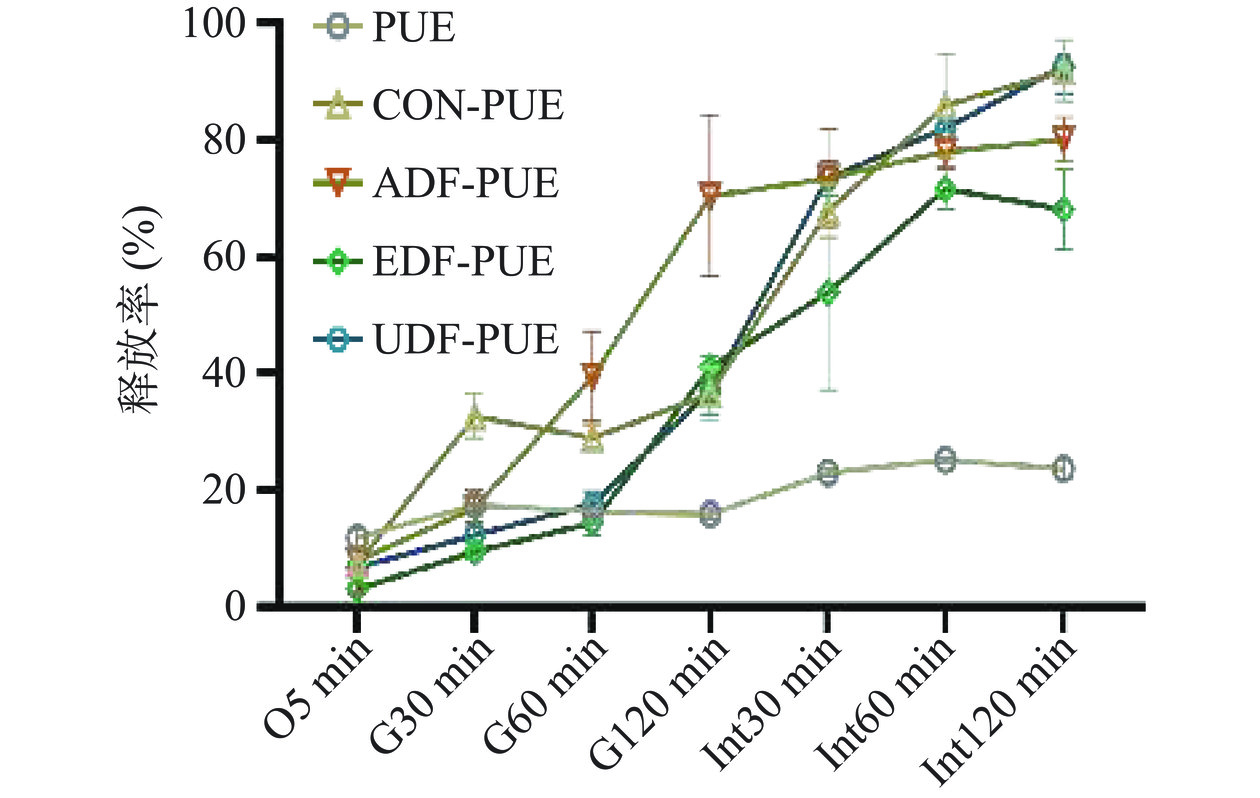
包埋的目的是保护葛根素免受胃酸的降解和与体内其他成分的相互作用,直到其顺利到达肠道吸收部位。该实验将包埋的葛根素置于模拟口腔、胃和肠消化条件下,研究其从包埋基质中的释放行为以及研究当葛根素暴露于口腔、胃、肠道消化过程中是如何从包埋结构中释放的。图3描述了每100.0 mg粉末样品通过口腔、胃和肠道消化过程转运时释放的葛根素的含量,从微胶囊的释放曲线来看,在胃液中,葛根素的释放分为两个阶段,第一个阶段:葛根素被迅速释放,大约17.46%的葛根素被释放出,其中不添加膳食纤维的葛根素微胶囊的葛根素释放率甚至达到了约32.64%,这是因为部分葛根素只是吸附在微胶囊的表面,而不是进入纳米颗粒的内部疏水核心[34],实验开始后这部分葛根素迅速溶于模拟胃液中。第二阶段:葛根素缓慢释放于胃液中,吸附在表面的葛根素已经被完全释放,由于微胶囊内外葛根素浓度的差异,包裹在微胶囊内部的葛根素会随着微胶囊自身结构的溶解而逐渐溶解。此外,葛根素是一种弱酸,其溶解度依赖于pH;溶解度随着pH的增加而增加。Wang等[35]研究发现,葛根素在pH为7.4的时候溶解度显著高于pH为1.2时的溶解度,能够在高pH中迅速达到饱和,所以由于在酸性条件下,葛根素溶解度较低的原因,导致微胶囊内部的葛根素在胃液中的溶解速度较慢,却能够在肠液中迅速释放达到饱和。又因为膳食纤维基体对葛根素的释放有影响,游离的葛根素在口腔、胃肠道中溶解率较低,葛根素-不溶性膳食纤维所制备的葛根素微胶囊在胃中前60 min时的释放率要明显的低于未用不溶性膳食纤维包埋的葛根素微胶囊对照组。
在模拟肠液中,药物会从微胶囊中被突然释放,相对于游离的葛根素(22.93%~25.21%)而言,微胶囊中的葛根素在2 h内几乎能完全释放(53.89%~92.59%)。这可能是因为微胶囊壁材和芯材间的氢键断裂,导致葛根素被迅速释放于模拟肠液中。从本实验可以看出,加有不溶性膳食纤维的葛根素微胶囊中的葛根素能够抵抗胃液的损害快速在肠道中释放并迅速达到平衡,显著高于游离葛根素,这种现象可能是由于功效分子和基体之间氢键结合强度所致[10,36]。此外,膳食纤维可以增加葛根素的溶解速率,这是由于分子与载体的相互作用可能会阻碍分子再结晶,导致快速溶解[37],由于口服化合物必须溶解在消化液中[38],游离的葛根素并不能够完全溶于模拟口腔液、胃液、甚至是肠液中,而微胶囊可以提高葛根素在肠道中的溶出率。同时,比表面积的增加也可能是溶解性提高的一个原因,与后续电镜扫描所得的结果一致。
2.4 葛根素-猴头菇不溶性膳食纤维复合微胶囊对葛根素的生物可及性的影响
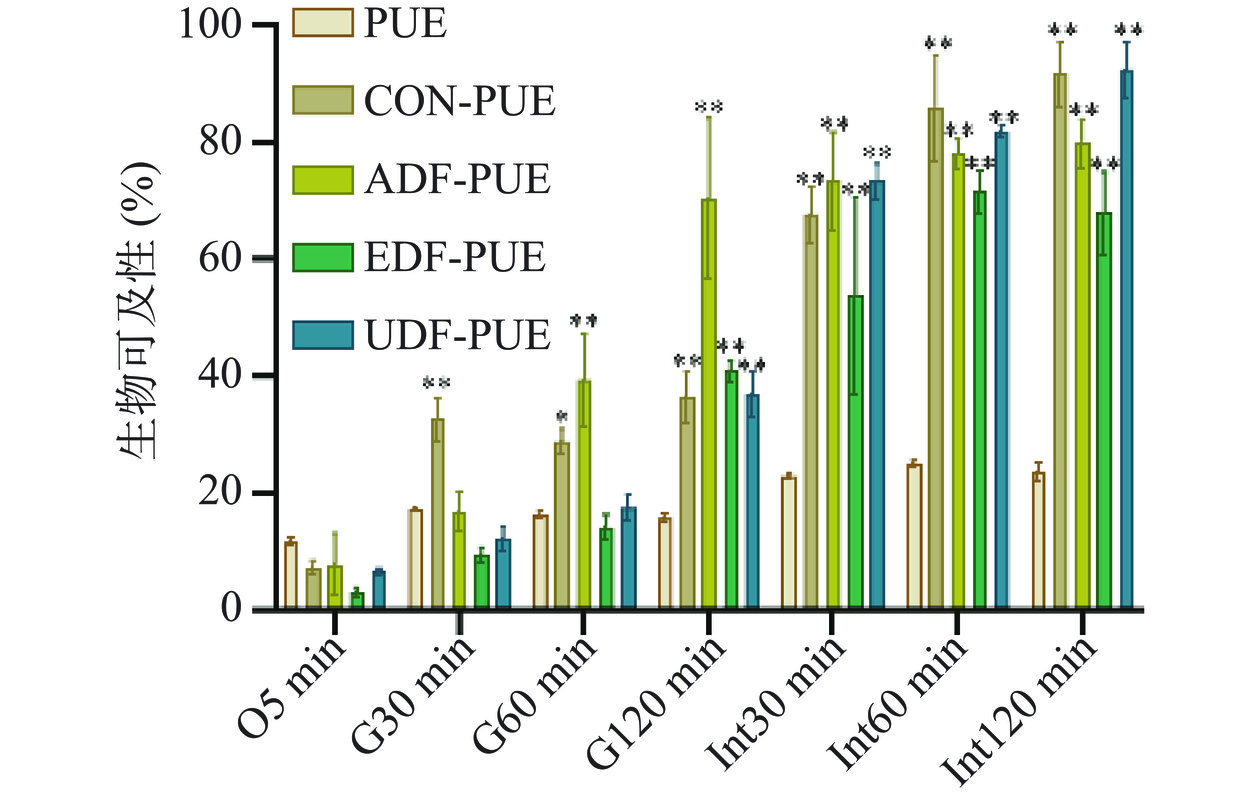
消化过程是吸收和代谢前的第一步,生物可及性是通过体外模拟消化方法评估可用于肠道吸收的化合物的数量,可以通过改变天然活性成分的生物可及性来调节其生物利用率[39]。同时,利用体外胃肠消化模型评估天然活性化合物的生物可及性也是食品技术研究的标准工具。有研究表明:基于纳米颗粒的配方,可以保护活性化合物,直到它们被吸收[40]。本研究基于猴头菇不溶性膳食纤维对葛根素微胶囊包埋技术中葛根素的生物可及性进行测定,如图4所示,葛根素微胶囊中葛根素在肠道中的生物可及性(超声辅助提取法所得猴头菇不溶性膳食纤维制备的葛根素微胶囊的葛根素的生物可及性最高可达92.59%)显著高于游离葛根素(23.64%)(P<0.05),是游离葛根素的2.9~3.9倍,可提高葛根素的生物利用率。任何化合物只有在肠道消化过程结束时保持其生物活性,才能发挥其有益作用,Lyu等[41]证实了微胶囊包埋能够保护类黄酮的降解,同时提高其在肠道内的生物可及性,进而提高类黄酮的生物利用率和有益作用。Noor等[42]也证实了纳米包埋能够提高多酚的生物可及性,以及多酚在小肠中的生物利用度。
2.5 葛根素-猴头菇不溶性膳食纤维复合微胶囊对葛根素的表观影响
通过扫描电镜分别对游离葛根素、海藻酸钠、卡拉胶、游离的猴头菇不溶性膳食纤维和两种微胶囊的表面形貌进行了表征,如图5所示。图5A和图5B展示游离葛根素呈大小不规则颗粒,表面光滑的片状晶体,图5G和图5H显示游离的超声辅助提取法所得的不溶性膳食纤维呈晶体不规则,表面粗糙,片层状的特殊结构。相较于游离葛根素,在不添加不溶性膳食纤维的微胶囊(图5I和图5G)中,不添加膳食纤维的葛根素微胶囊有片状葛根素颗粒,呈现表面折叠的大小不规则球形物质漂浮在表面。而添加了不溶性膳食纤维的微胶囊(图5K和图5L),表面光滑,残留少许游离不溶性膳食纤维的孔隙。添加不溶性膳食纤维的微胶囊形态发生明显变化,与游离的葛根素、不溶性膳食纤维、卡拉胶以及海藻酸钠不同,说明芯材和壁材的相互作用可能改变了未加工的材料的物理形式,证明微胶囊的形成[43]。
葛根素的加载对膳食纤维的形貌和葛根素的结构都有显著的影响,微胶囊让原始葛根素的晶体状结构消失。这与之前研究报道水不溶性纤维素纤维和抗性淀粉不仅减少了干燥引起的团聚,而且可以在悬浮液中作为物理屏障,缓解纳米颗粒的团聚/生长的结果一致[44]。同时,也可能是因为该实验选取的不溶性膳食纤维是通过超声辅助酶法提取所得的,而超声辅助提取过程中酶的水解对其淀粉和蛋白质的降解作用进而导致不溶性膳食纤维具有疏松、片层状的网络结构,其内部折叠结构被打开[45],使得不溶性膳食纤维的比表面积增大,能够更好地与葛根素结合,增强葛根素的包埋效果。使得其能够更好地与葛根素紧密结合,让游离的葛根素的嵌入不溶性膳食纤维的片层状结构和孔隙中,增加葛根素与不溶性膳食纤维的接触面积,使得不溶性膳食纤维包埋效果得以增强[46]。
2.6 葛根素-猴头菇不溶性膳食纤维复合微胶囊傅里叶变换红外光谱(FT-IR)的结构表征
傅里叶红外光谱可以研究壁材与芯材之间的相互作用,以及壁材与壁材之间的相互作用。图6列出了葛根素、卡拉胶、海藻酸钠、猴头菇不溶性膳食纤维、以及微胶囊的光谱图。818.63~934.82、1490.22、1540.36 cm−1为芳香环骨架伸缩振动峰,1733.209、1838.79 cm−1为C=O伸缩振动峰[47−49]为葛根素的特征峰。在微胶囊中葛根素特征峰发生了偏移且减弱,葛根素在指纹区的一些特征峰消失(1490.22、1540.36、1733.209、1838.79 cm−1),说明葛根素在微胶囊之间没有生成新的化学键,形成的是微胶囊而不是新的化合物,从指纹区特征峰的变化可以推测葛根素与微胶囊材料之间可能有氢键的形成[47]。此外,在含葛根素的微胶囊中,没有明显的特征峰变化,也没有出现新的峰,说明葛根素与基质具有良好的相容性,且它们之间不存在化学相互作用[50],这可能是由于电荷传递作用,葛根素与不溶性膳食纤维极性端定性结合,使葛根素和微胶囊材料处于高度分散的状态,自身的晶体特征被抑制,衍射峰完全消失,故而微胶囊没有显示出晶体特征。这与Wegiel等[51]研究的膳食纤维能够通过与白藜芦醇形成复合物,进而抑制白藜芦醇的特征峰的表达,通过两者之间形成的氢键降低白藜芦醇的结晶度的结果一致。表明晶体结构中的分子通过分子间的相互作用(氢键、范德华力、离子和静电相互作用)结合在一起。分子间相互作用构成的高晶格能导致水溶性较差,从而限制了其生物利用度。当结晶物质被纳入聚合物中,通过强氢相互作用形成非晶体系,使得其分子之间的原始相互作用可能被破坏[52]。也有研究表明,氢键是酚类化合物与淀粉等聚合物壁材料之间的主要相互作用[36]。
2.7 葛根素-猴头菇不溶性膳食纤维复合微胶囊XRD晶体学分析
分别对游离葛根素、海藻酸钠、卡拉胶、游离的猴头菇不溶性膳食纤维和两种微胶囊进行XRD分析,各自的XRD模式如图7所示。葛根素在5°~35°范围内2θ值为6.46°、11.64°、18.99°、19.62°、23.39°处显示出多个尖锐的和特征性的强衍射峰[53],表明游离葛根素处于高度结晶状态。而猴头菇不溶性膳食纤维则表现为无衍射峰的宽频带聚合物,表明其为无定形的化合物。葛根素的特征峰在含有不溶性膳食纤维的葛根素微胶囊中几乎消失,说明葛根素在不溶性膳食纤维的葛根素微胶囊中含有葛根素或葛根素的无晶化,形成了典型的无定形X射线衍射图谱。相比之下,不添加猴头菇不溶性膳食纤维的葛根素微胶囊则保留了一定的葛根素晶体衍射峰,表明葛根素可能未被完全包封。
疏水化合物的非晶型比结晶形式具有更高的溶解速率、溶解度和生物可及性[54],用膳食纤维制备的葛根素微胶囊破坏了葛根素晶体,导致葛根素的晶格能的降低,进而提高了葛根素的溶解度,因此膳食纤维具有较高的表面无序度可能是使晶体物质结晶度降低和饱和溶解度升高原因[55]。相应晶体的非晶结构引起的化学势增加也可能是其溶解度提高的原因之一,在溶解过程中,不发生相变的非晶固体比晶体形式具有更高的瞬态溶解度[56],微囊化使得葛根素从其高度结晶的晶体结构向非晶体结构转变,进而使得包埋后的葛根素的溶解度增强,这与模拟体内释放中肠道释放的结果一致。具有晶体形式的功效成分在胃肠道液体中的溶解度较低,这通常会导致其口服生物利用率较低[57],而复合材料中结晶度的降低增加了其溶解度,进而提高了该功效化合物的生物可及性,这与生物可及性的结果一致。
3. 结论
猴头菇不溶性膳食纤维能够作为葛根素微胶囊的包埋载体,具有较好的包埋效果,延长葛根素的抗氧化特性,能够避免葛根素过早的在胃中被消化降解,进而进入肠道,实现定点释放。同时能够通过减弱葛根素的晶体结构和促进与猴头菇不溶性膳食纤维之间的氢键的形成来提高葛根素在肠道中的溶解率,使得葛根素的生物可及性提高。综上,猴头菇不溶性膳食纤维可作为葛根素微胶囊包埋壁材的选择,能够提高葛根素生物可及性和生物利用率,这为葛根作为一种保健产品的研究和开发提供了思路。
-
-
[1] 国家药典委员会. 中华人民共和国药典. 一部[M]. 北京:中国医药科技出版社, 2020. [State Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing:China Medical Science and Technology Press, 2020.] State Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Medical Science and Technology Press, 2020.
[2] WANG S, SHI X, FENG M, et al. Puerarin protects against CCl4 -induced liver fibrosis in mice:possible role of PARP-1 inhibition[J]. International Immunopharmacology,2016,38:238−245. doi: 10.1016/j.intimp.2016.06.008
[3] ZHU X, WANG K, ZHANG K, et al. Puerarin protects human neuroblastoma SH-SY5Y cells against glutamate-induced oxidative stress and mitochondrial dysfunction[J]. Journal of Biochemical and Molecular Toxicology,2016,30(1):22−28. doi: 10.1002/jbt.21736
[4] WANG Z J, DU H, PENG W Q, et al. Efficacy and mechanism of pueraria lobata and pueraria thomsonii polysaccharides in the treatment of type 2 diabetes[J]. Nutrients,2022,14(19):3926. doi: 10.3390/nu14193926
[5] LÜ J Y, SHI S Q, ZHANG B X, et al. Role of puerarin in pathological cardiac remodeling:A review[J]. Pharmacol Res,2022,178:106152. doi: 10.1016/j.phrs.2022.106152
[6] LIU T, SU K, CAI W Y, et al. Therapeutic potential of puerarin against cerebral diseases:from bench to bedside[J]. Eur J Pharmacol,2023,953:175695. doi: 10.1016/j.ejphar.2023.175695
[7] LÜ Y Q, TAN T W, Modeling and prediction of the mixed-mode retention mechanisms for puerarin and its analogues on n-octylamine modified poly (glycidyl methacrylate-co-ethylene glycol dimethacrylate) monoliths[J]. Process Biochemistry, 2009, 44:1225−1230.
[8] XIE B C, WANG Q H, ZHOU C H, et al. Efficacy and safety of the injection of the traditional Chinese medicine puerarin for the treatment of diabetic peripheral neuropathy:A systematic review and meta-analysis of 53 randomized controlled trials[J]. Evid Based Complement Alternat Med,2018,2018:2834650.
[9] ZHANG L. Pharmacokinetics and drug delivery systems for puerarin, a bioactive flavone from traditional Chinese medicine[J]. Drug Deliv, 2019, 26(1):860-869.
[10] JI S P, JIA C S, CAO D D, et al. Formation, characterization and properties of resveratrol-dietary fiber composites:release behavior, bioaccessibility and long-term storage stability[J]. LWT,2020,129(2020):109556.
[11] KARADAG A, YANG X, OZCELIK B, et al. Optimization of preparation conditions for quercetin nanoemulsions using response surface methodology[J]. J Agric Food Chem,2013,61(9):2130−2139. doi: 10.1021/jf3040463
[12] DIAN L, YU E J, CHEN X N, et al. Enhancing oral bioavailability of quercetin using novel soluplus polymeric micelles[J]. Nanoscale Research Letters,2014,9(1):2406.
[13] DARIO F M, SANTOS C S M, VIANA S A, et al. A high loaded cationic nanoemulsion for quercetin delivery obtained by sub-PIT method[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2016,489:256−264.
[14] TING Y W, JIANG Y K, HO C T, et al. Common delivery systems for enhancing in vivo bioavailability and biological efficacy of nutraceuticals[J]. Journal of Functional Foods,2014,7:112−128. doi: 10.1016/j.jff.2013.12.010
[15] ZHANG Y, YANG X, GE X H, et al. Puerarin attenuates neurological deficits via Bcl-2/Bax/cleaved caspase-3 and Sirt3/SOD2 apoptotic pathways in subarachnoid hemorrhage mice[J]. Biomedicine & Pharmacotherapy,2019,109:726−733.
[16] CHAN H K. Nanodrug particles and nanoformulations for drug delivery[J]. Advanced Drug Delivery Reviews,2011,63(6):405. doi: 10.1016/j.addr.2011.05.006
[17] 冯慧渝, 许瀛引, 张志远, 等. 姜黄素微胶囊的制备及其对小鼠腹泻干预效果的研究[J]. 食品工业科技, 2023, 44(17):231−241. [FENG H Y, XU Y Y, ZHANG Z Y, et al. Study on the preparation of curcumin microcapsules and its intervention effect on diarrhea in mice[J]. Food Industry Science and Technology, 2023, 44(17):231−241.] FENG H Y, XU Y Y, ZHANG Z Y, et al. Study on the preparation of curcumin microcapsules and its intervention effect on diarrhea in mice[J]. Food Industry Science and Technology, 2023, 44(17): 231−241.
[18] VITAGLIONE P, NAPOLITANO A, FOGLIANO V. Cereal dietary fibre:A natural functional ingredient to deliver phenolic compounds into the gut[J]. Trends in Food Science & Technology,2008,19(9):451−463.
[19] ZHAO G H, ZHANG R F, DONG L H, et al. A comparison of the chemical composition, in vitro bioaccessibility and antioxidant activity of phenolic compounds from rice bran and its dietary fibres[J]. Molecules,2018,23(1):202. doi: 10.3390/molecules23010202
[20] ZHENG Y F, WANG Q, HUANG J Q, et al. Hypoglycemic effect of dietary fibers from bamboo shoot shell:An in vitro and in vivo study[J]. Food and Chemical Toxicology,2019,127:120−126. doi: 10.1016/j.fct.2019.03.008
[21] ÇELIK E E, GOKMEN V, SKIBSTED L H. Synergism between soluble and dietary fiber bound antioxidants[J]. Journal of Agricultural and Food Chemistry,2015,63(8):2338−2343. doi: 10.1021/acs.jafc.5b00009
[22] 谭佳媛, 王栩俊, 王星丽, 等. 猴头菇的养生保健价值(综述)[J]. 食药用菌,2015,23(3):188−193. [TAN J Y, WANG X J, WANG X L, et al. Health care value of Hericium hericium (review)[J]. Edible and Medicinal Fungi,2015,23(3):188−193.] TAN J Y, WANG X J, WANG X L, et al. Health care value of Hericium hericium (review)[J]. Edible and Medicinal Fungi, 2015, 23(3): 188−193.
[23] 李英迪, 曹艳, 夏其乐, 等. 猴头菇三萜提取工艺优化及其抗氧化活性分析[J]. 食品工业科技, 2021, 42(22):153−159. [LI Y D, CAO Y, XIA Q L, et al. Hericium terpene extraction process optimization and its antioxidant activity analysis[J]. Journal of Food Industry Science and Technology, 2021, 42(22):153−159.] LI Y D, CAO Y, XIA Q L, et al. Hericium terpene extraction process optimization and its antioxidant activity analysis[J]. Journal of Food Industry Science and Technology, 2021, 42(22): 153−159.
[24] 赵宇楠, 贾丹丹, 蔡丹, 等. 食用菌发酵对人参不溶性膳食纤维结构及功能特性的影响[J]. 食品科学,2023,44(22):80−88. [ZHAO Y N, JIA D D, CAI D, et al. Edible fungus fermentation of ginseng insoluble dietary fiber structure and functional characteristics of impact[J]. Food Science,2023,44(22):80−88.] doi: 10.7506/spkx1002-6630-20221111-131 ZHAO Y N, JIA D D, CAI D, et al. Edible fungus fermentation of ginseng insoluble dietary fiber structure and functional characteristics of impact[J]. Food Science, 2023, 44(22): 80−88. doi: 10.7506/spkx1002-6630-20221111-131
[25] 颜洁. 葛根素壳聚糖口服纳米粒的制备及体内外评价研究[D]. 南昌:江西中医药大学, 2020. [YAN J. Preparation of puerarin chitosan oral nanoparticlesand its in vivo and in vitro evaluation studies[D]. Nanchang:Jiangxi University of Chinese Medicine, 2020.] YAN J. Preparation of puerarin chitosan oral nanoparticlesand its in vivo and in vitro evaluation studies[D]. Nanchang: Jiangxi University of Chinese Medicine, 2020.
[26] 郭延生. 葛根有效成分葛根素的提取、分离及结构改造[D]. 兰州:甘肃农业大学, 2004. [GUO Y S. Extraction, isolation and structure modfication of puerarin from pueraria[D]. Lanzhou:Gansu Agricultural University, 2004.] GUO Y S. Extraction, isolation and structure modfication of puerarin from pueraria[D]. Lanzhou: Gansu Agricultural University, 2004.
[27] 冼莹莹, 刘小玲. 葛粉工业废水葛根素含量测定方法的比较[J]. 南方农业学报,2013,44(6):1004−1007. [XIAN Y Y, LIU X L. Comparison on content determination of puerarin in radix puerariae starch industrial waste water[J]. Journal of Southern Agriculture,2013,44(6):1004−1007.] doi: 10.3969/j:issn.2095-1191.2013.6.1004 XIAN Y Y, LIU X L. Comparison on content determination of puerarin in radix puerariae starch industrial waste water[J]. Journal of Southern Agriculture, 2013, 44(6): 1004−1007. doi: 10.3969/j:issn.2095-1191.2013.6.1004
[28] 于海飞. 类黄酮—蛋白质复合体系的制备、表征及应用[D]. 南昌:南昌大学, 2022. [YU H F. Preparation, characterization and application of flavonoid-protein complex system[D]. Nanchang:Nanchang University, 2022.] YU H F. Preparation, characterization and application of flavonoid-protein complex system[D]. Nanchang: Nanchang University, 2022.
[29] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food-an international consensus[J]. Food Funct,2014,5:1113−1124. doi: 10.1039/C3FO60702J
[30] 孙国玉. 铁蛋白—芦丁包埋物的制备与理化性质的研究[D]. 天津:天津科技大学, 2017. [SUN G Y. Preparation and physicochemical property analysis of ferritin-rutin composites[D]. Tianjin:Tianjin University of Science and Technology, 2017.] SUN G Y. Preparation and physicochemical property analysis of ferritin-rutin composites[D]. Tianjin: Tianjin University of Science and Technology, 2017.
[31] 唐玉妹. 竹笋膳食纤维-多酚复合物的构建及其性能的研究[D]. 长沙:中南林业科技大学, 2022. [TANG Y M. The study on the construction and performance of bamboo shoots dietary fibers-polyphenol complex[D]. Changsha:Central South University of Forestry and Technology, 2022.] TANG Y M. The study on the construction and performance of bamboo shoots dietary fibers-polyphenol complex[D]. Changsha: Central South University of Forestry and Technology, 2022.
[32] KHOR M C, NG K W, CHAN P K, et al. Preparation and characterization of quercetin/dietary fiber nanoformulations[J]. Carbohydrate Polymers,2017,161:109−117. doi: 10.1016/j.carbpol.2016.12.059
[33] GAO S, LI X M, YANG G, et al. Antibacterial perillaldehyde/hydroxypropyl-γ-cyclodextrin inclusion complex electrospun polymer-free nanofiber:Improved water solubility, thermostability, and antioxidant activity[J]. Industrial Crops & Products,2022,176:114300.
[34] CHAWLA J S, AMIJI M M. Biodegradable poly(epsilon-caprolactone) nanoparticles for tumor-targeted delivery of tamoxifen[J]. Int J Pharm,2002,249(1-2):127−138. doi: 10.1016/S0378-5173(02)00483-0
[35] WANG Y C, MA Y, MA Y Y, et al. Formulation and pharmacokinetics evaluation of puerarin nanocrystals for intravenous delivery[J]. Journal of Nanoscience and Nanotechnology,2012,12(8):6176−6184. doi: 10.1166/jnn.2012.6436
[36] LI J L, SHIN G H, LEE W I, et al. Soluble starch formulated nanocomposite increases water solubility and stability of curcumin[J]. Food Hydrocolloids,2016,56:41−49. doi: 10.1016/j.foodhyd.2015.11.024
[37] TAKEUCHI H, NAGIRA S, YAMAMOTO H, et al. Solid dispersion particles of tolbutamide prepared with fine silica particles by the spray-drying method[J]. Powder Technology,2004,141(3):187−195. doi: 10.1016/j.powtec.2004.03.007
[38] SZABO Z I, ORBAN G, BORBAS E, et al. Inclusion complexation of the anticancer drug pomalidomide with cyclodextrins:fast dissolution and improved solubility[J]. Heliyon,2021,7(7):e07581. doi: 10.1016/j.heliyon.2021.e07581
[39] SCALBERT A, WILLIAMSON G. Dietary intake and bioavailability of polyphenols[J]. The Journal of Nutrition,2000,130(8):2073S−2085S. doi: 10.1093/jn/130.8.2073S
[40] MACEDO J A, BATTESTIN V, RIBEIRO M L, et al. Increasing the antioxidant power of tea extracts by biotransformation of polyphenols[J]. Food Chemistry,2011,126(2):491−497. doi: 10.1021/acs.jafc.1c07198
[41] LYU X G, WANG X, WANG Q L, et al. Encapsulation of sea buckthorn (Hippophae rhamnoides L.) leaf extract via an electrohydrodynamic method[J]. Food Chemistry, 2021, 365.
[42] NOOR A, AI M, MURAD A, et al. Alginate based encapsulation of polyphenols of Piper betel leaves:Development, stability, bio-accessibility and biological activities[J]. Food Bioscience, 2022, 47.
[43] SRINIVASAN K, STALIN T. Study of inclusion complex between 2, 6-dinitrobenzoic acid and beta-cyclodextrin by 1H NMR, 2D 1H NMR (ROESY), FT-IR, XRD, SEM and photophysical methods[J]. Spectrochim Acta A Mol Biomol Spectrosc,2014,130:105−115. doi: 10.1016/j.saa.2014.03.106
[44] DONG Y, NG W K, HU J, et al. Clay as a matrix former for spray drying of drug nanosuspensions[J]. Int J Pharm,2014,465(1−2):83−89. doi: 10.1016/j.ijpharm.2014.02.025
[45] WANG S, SUN W, SWALLAH M S, et al. Preparation and characterization of soybean insoluble dietary fiber and its prebiotic effect on dyslipidemia and hepatic steatosis in high fat-fed C57BL/6J mice[J]. Food & Function,2021,12(18):8760−8773.
[46] AUVINEN V V, VIRTANEN J, MERIVAARA A, et al. Modulating sustained drug release from nanocellulose hydrogel by adjusting the inner geometry of implantable capsules[J]. Journal of Drug Delivery Science and Technology,2020,57:101625. doi: 10.1016/j.jddst.2020.101625
[47] WANG Y C, YANG M, QIN J J, et al. Interactions between puerarin/daidzein and micellar casein[J]. Journal of Food Biochemistry,2022,46:e14048.
[48] XU S Q, DU Y N, ZHANG Z J, et al. Gel properties and interactions of hydrogels constructed with low acyl gellan gum and puerarin[J]. Carbohydrate Polymers,2024,326:121594. doi: 10.1016/j.carbpol.2023.121594
[49] ZHAO S Y, ZHANG J B, QIU M Y, et al. Mucoadhesive and thermosensitive Bletilla striata polysaccharide/chitosan hydrogel loaded nanoparticles for rectal drug delivery in ulcerative colitis[J]. International Journal of Biological Macromolecules,2024,254:127761. doi: 10.1016/j.ijbiomac.2023.127761
[50] SHU X, ZHANG L, LIAO W Y, et al. Nanostructured lipid carriers (NLCs) stabilized by natural or synthetic emulsifiers for lutein delivery:Improved physicochemical stability, antioxidant activity, and bioaccessibility[J]. Food Chem,2023,403:134465. doi: 10.1016/j.foodchem.2022.134465
[51] WEGIEL L A, MAUER L J, EDGAR K J, et al. Crystallization of amorphous solid dispersions of resveratrol during preparation and storage-Impact of different polymers[J]. J Pharm Sci,2013,102(1):171−84. doi: 10.1002/jps.23358
[52] WANG B, WANG D D, ZHAO S, et al. Evaluate the ability of PVP to inhibit crystallization of amorphous solid dispersions by density functional theory and experimental verify[J]. Eur J Pharm Sci,2017,96:45−52. doi: 10.1016/j.ejps.2016.08.046
[53] 张琳琳, 李小芳, 宋佳文, 等. 甘草酸为稳定剂的葛根素纳米乳冻干粉的制备及体外评价[J]. 中草药,2020,51(11):2929−2936. [ZHANG L L, LI X F, SONG J W, et al. Preparation and in vitro evaluation of Puerarin nanoemulsion lyophilized powder with glycyrrhizic acid as stabilizer[J]. Chinese Herbal Medicine,2020,51(11):2929−2936.] ZHANG L L, LI X F, SONG J W, et al. Preparation and in vitro evaluation of Puerarin nanoemulsion lyophilized powder with glycyrrhizic acid as stabilizer[J]. Chinese Herbal Medicine, 2020, 51(11): 2929−2936.
[54] VARSHOSAZ J, GHASSAMI E, AHMADIPOUR S. Crystal engineering for enhanced solubility and bioavailability of poorly soluble drugs[J]. Current Pharmaceutical Design,2018,24(21):2473−2496. doi: 10.2174/1381612824666180712104447
[55] KIM, S, NG, W K, DONG, Y, et al. Preparation and physicochemical characterization of trans-resveratrol nanoparticles by temperature-controlled antisolvent precipitation[J]. Journal of Food Engineering,2012,108(1):37−42. doi: 10.1016/j.jfoodeng.2011.07.034
[56] LI N, TAYLOR L S. Tailoring supersaturation from amorphous solid dispersions[J]. J Control Release,2018,279:114−125. doi: 10.1016/j.jconrel.2018.04.014
[57] LORON A, GARDRAT C, TABARY N, et al. Tetrahydrocurcumin encapsulation in cyclodextrins for water solubility improvement:Synthesis, characterization and antifungal activity as a new biofungicide[J]. Carbohydrate Polymer Technologies and Applications,2021,2:100113. doi: 10.1016/j.carpta.2021.100113





 下载:
下载:

 下载:
下载:



