Optimization of Liquid Culture Conditions for Phenolic Substances Produced by Hericium erinaceus and Its Influence on the Growth of Lactic Acid Bacteria
-
摘要: 目的:用猴头菌纯菌株进行液态菌丝培养,优化培养基以提高猴头菌丝体酚类提取物的含量,分析猴头菌丝体酚类提取物的组成,并研究猴头菌丝体酚类提取物对乳酸菌的影响。方法:采用正交试验设计,研究对液态菌丝中总酚含量的影响,并用HPD-826大孔吸附树脂对其进行纯化,再以液质联用(High performance liquid chromatography-mass spectrometry,HPLC-MS)检测分析其组成。最后,将纯化物添加到乳酸菌培养基中,检测其对乳酸菌活菌数与产酸能力的影响。结果:在碳源马铃薯14%、氮源蛋白胨2%、无机盐MgSO4 0.3%时,猴头菌丝体总酚含量达到0.783 mg/g;从猴头菌丝体酚类提取物中鉴定出16个单体酚,占比88.27%,主要单体酚为没食子酸-O-葡萄糖苷、对香豆酸-O-没食子酰葡萄糖苷、阿魏酸、儿茶素苄硫醚、没食子酸和咖啡酸。在干酪乳杆菌(Lactobacilluscasei)、嗜酸乳杆菌(Lactobacillus acidophilus)、肠膜串珠菌(Streptococcus intestinalis)的MRS培养基中加入猴头菌丝体酚类提取溶液,可以使3种乳酸菌活菌数均增加。结论:猴头菌丝体酚类提取物对乳酸菌的生长具有促生作用,为功能食品提供了新资源原料。Abstract: Objetive: Culturing liquid hyphae with Hericium erinaceus pure strain. The medium was optimized to increase the content of Hericium erinaceus mycelium phenolic extracts. The composition of Hericium erinaceus mycelium phenolic extracts was analyzed, and the effects of phenolic extracts from Hericium erinaceus mycelium on lactic acid bacteria were also studied. Methods: Orthogonal design was used to study the effect on the total phenol content in liquid mycelium, and HPD-826 macroporous adsorption resin was used to purify it, and then HPLC-MS was used to determine its composition. Finally, adding the purified product to the lactic acid bacteria culture mediumm, and detected the effect on the number of viable lactic acid bacteria and its acid-production ability. Results: When the carbon source potato was 14%, nitrogen source peptone was 2% and inorganic salt MgSO4 was 0.3%, the total phenol content of Hericium erinaceus mycelium reached 0.783 mg/g. Sixteen monomeric phenols were identified from the phenolic extract of Hericium erinaceus mycelium, accounting for 88.27%. The main monomeric phenols were gallic acid-O-glucoside, p-coumaric acid-O-gallic acid glucoside, ferulic acid, catechin benzyl sulfide, gallic acid and caffeic acid. Adding phenol extraction solution from Hericium erinaceus mycelium to MRS medium of Lactobacilluscasei, Lactobacillus acidophilus and Streptococcus intestinalis could increase the number of viable bacteria of three kinds of lactic acid bacteria. Conclusion: Phenolic extract from Hericium erinaceus mycelium can promote the growth of lactic acid bacteria and provide new resource raw materials for functional food.
-
多酚(Polyphenol)是一种以苯环为基础的多羟基结构的酚类化合物,根据化学结构分为类黄酮类和非类黄酮类[1−2]。近年来,以植物体内次生代谢相关的多酚类物质的研究较为深入,但越来越多的研究表明,来源于大型真菌的多酚类物质,具有抑菌、抗癌、抗老化和降低胆固醇等功效,对多种慢性疾病具有良好的预防与治疗作用[3−4]。多酚类物质在机体内的消化吸收可以决定其生物利用率,多酚与肠道微生物之间的相互作用,使多酚类物质能够抵抗胃肠消化并几乎完整地到 达结肠,发挥相关生理活性。目前,多酚类物质在胃肠道中的变化及其健康效 应已成为研究热点。
猴头菌(Hericium erinaceus)也被称为猴头蘑、猴头菇等,是一种高营养价值的食药用菌[5−6]。据文献报道猴头菌子实体的主要化学成分有:脂肪酸、甾体、多糖及Hericenones A-H(猴头菌酮A-H)、Erinacerins A and B(猴头菌素A和B)、Hericenone I(猴头烯酮I)、Hericene D(猴头烷酮D)等酚性化合物[7−9]。Mizunoeatal等[10]从猴头菌子实体、菌丝体中分别分离出木糖、葡萄糖、甘露糖及少量蛋白质的杂多糖等成分,研究发现这些猴头菌多糖具有抗肿瘤作用。Kim等[11]对化合物Hericerin I(猴头菌碱I)进行活性研究,发现具有促进合成神经生长因子(NGF)的功能。Yong等[12]对桦褐孔菌粗多酚的抗氧化性进行研究,得到多酚能够防止人角化细胞HaCaT被H2O2的氧化,说明食用菌多酚对这种细胞具有保护作用。Sandrina等[13]对19种食用菌进行多酚提取,并对其化学抗氧化活性进行比较,结果表明,猴头菌多酚具有较好的抗氧化活性,仅次于灵芝;多酚体内的生物活性与肠道菌群代谢密切相关,一般需经过肠道微生物转化为活性较高的小分子,才能被吸收利用,发挥其抗氧化作用[14]。经过口服摄入的膳食多酚被肠道菌群代谢的同时,也对肠道菌群结构起到重塑作用[15]。但目前对于猴头菌丝体酚类提取物的组成研究报道较少。
野生猴头菌资源少,受地理位置与采摘季节的影响产量低。以人工分离纯菌株进行液态培养猴头菌菌丝体,优化培养基高效富集多酚类代谢产物,可解决野生资源不足的问题,以实现功能产品产业化,为新资源功能食品的开发提供了原料[16−17]。研究猴头菌丝体酚类提取物对肠道益生乳酸菌的影响,探讨猴头菌丝体酚类提取物与乳酸菌共同生长代谢,得到对乳酸菌生长与活性的影响规律,为猴头菌酚类物质综合利用提供理论基础,为生物活性物质开发提供了新的资源。
1. 材料与方法
1.1 材料与仪器
猴头菌(Hericiumerinaceus)母体纯菌株 实验室自主分离并鉴定保藏;肠膜串珠菌(Streptococcus intestinalis)、嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacilluscasei) 中国微生物菌种保藏中心CICC;葡萄糖 分析纯,天津市科密欧化学试剂有限公司;蛋白胨 分析纯,北京奥博星生物技术有限公司;福林酚 分析纯,上海麦克林生化科技有限公司;无水碳酸钠、尿素 分析纯,天津致远化学试剂;没食子酸 分析纯,山东优索化工科技有限公司;硫酸镁 分析纯,天津天力化学试剂有限公司;磷酸二氢钾 分析纯,天津凯通化学试剂有限公司;酵母粉(Y017FC)、豆粕粉(Y030A) 北京鸿润宝顺科技有限公司;HPD-826大孔树脂 郑州艾诺化工科技有限公司。
SW-CJ-1FD超净工作台 苏州净化设备有限公司;R-201旋转蒸发仪 上海申胜生物科技有限公司;722紫外分光光度计 上海精密科学仪器有限公司;HNY-100B恒温培养振荡器 天津市欧诺仪器仪表股份有限公司;PHS-3C pH计 上海仪科学仪器股份有限公司;DHG-9203A干燥箱、HZQ-F160A恒温振荡培养箱 上海一恒科学仪器有限公司;HI1650-W离心机 湖南湘仪实验室仪器开发有限公司;LC1290-6490高效液相色谱串联质谱联用仪 美国Agilent公司。
1.2 实验方法
1.2.1 猴头菌固体平板菌种培养
以马铃薯200.0 g,葡萄糖20.0 g,KH2PO4 3.0 g,MgSO4·7H2O 1.5 g,琼脂20.0 g,维生素B1 1.0 mg,加1000 mL水配制固体培养基。在超净台内分装到平板中,点植猴头菌母体纯菌株。在26 ℃恒温培养箱中倒置培养7 d,使其长满菌丝。
1.2.2 猴头菌液态菌丝培养
从长满菌丝的平板中用手术刀切取面积大小为0.5 cm2的菌丝接种到液体培养基中,摇床温度为26 ℃,转速为150 r/min,培养15 d,4000 r/min离心收集菌丝体。
1.2.3 培养基组成的单因素实验
液态培养基:以葡萄糖30.0 g/L,蛋白胨30.0 g/L,MgSO4·7H2O 1.0 g/L,KH2PO4 1.5 g/L,维生素B1 0.01 g/L为基础培养基,改变碳源、氮源、无机盐种类与浓度,分别以马铃薯、蔗糖、葡萄糖、可溶性淀粉、麦芽糖5种物质为碳源,浓度梯度均为10%、12%、14%、16%、18%;分别以蛋白胨、酵母粉、尿素、豆粕粉、牛肉粉5种物质为氮源,浓度梯度为1%、2%、3%、4%、5%;分别以KH2PO4、KCl、MgSO4、K2HPO4、CaCl2 5种物质为无机盐,浓度梯度为0.1%、0.2%、0.3%、0.4%、0.5%。配制成100.0 mL培养基,调节pH5.5,121 ℃灭菌20 min,设置3组平行。研究培养基组成对猴头菌丝体产酚类物质的影响。
1.2.4 正交试验优化培养基组分
以总酚含量为指标,采用四因素三水平的正交试验方法进行试验,试验方案的因素水平见表1。
表 1 L9(33)正交试验因素水平设计Table 1. L9(33) orthogonal experimental design factor level table水平 马铃薯(%) 蛋白胨(%) MgSO4(%) 空列 1 12 1 0.2 1 2 14 2 0.3 2 3 16 3 0.4 3 1.2.5 猴头菌丝体酚类提取物的检测与分离方法
1.2.5.1 总酚的测定方法
取不同浓度梯度下的没食子酸溶液各加入1 mL福林酚稀释液,摇晃均匀,放置6 min,加入1 mL 10% Na2CO3溶液,充分震荡,放置反应30 min,显色后760 nm下测量吸光度,以没食子酸浓度为横坐标,以吸光度为纵坐标绘制标准曲线。在0~100 μg/mL范围内与吸光度呈现良好的线性关系,回归方程为Y=0.0199X+0.1314,决定系数R2=0.9879。
根据标准曲线计算样液中多酚含量,结果表示为每克提取物样品中含有相当没食子酸的毫克数[18]。计算公式如下:
多酚含量(X)=C×V1×V2×/M×V3 式中:X-多酚含量 (mg/g);C-标曲算的浓度(mg/mL);V1-稀释体积(mL);V2-样品液体积(mL);V3-取样体积(mL);M-样品重量(g)。
1.2.5.2 HPD-826大孔树脂分离方法
将不同条件培养得到的猴头菌培养液抽滤,收集菌丝体,并在50 ℃干燥5 h,研磨得菌丝体粉末。称取菌丝体粉末4.0 g于蒸馏瓶中,用浓度为75%的乙醇,料液比1:25 g/mL,水浴温度70 ℃,在加热回流提取装置中浸提1 h,再将浸提液置于4000 r/min离心机中离心20 min,收集上清液,将其在55 ℃下旋转蒸发,得到浓缩液态菌丝提取液。再进一步将提取液过HPD-826大孔树脂填料柱,采用3倍于浓缩液的超纯水洗涤柱子,然后用95%乙醇溶液洗脱提取液多酚,收集有机相洗脱液,在55 ℃下旋转蒸发浓缩,得到纯化后的猴头菌丝体酚类提取物浓缩液。
1.2.5.3 HPLC-MS定性分析猴头菌总酚组成
用高效液相色谱串联质谱联用仪,并配备Eclipse Plus C18柱(2.1 mm×100 mm,1.8 µm),运行负离子模式,分析鉴定纯化后菌丝体提取物中单体酚组成。参数设置如下:电离电压为4500 V,流速为0.4 mL/min,柱温为35 ℃;离子源温度500 ℃;进样体积为4 µL。流动相A为0.4%甲酸水溶液,流动相B为乙腈。梯度洗脱程序为:0~16 min,5%~25% B;16~18 min,25%~35% B;18~20 min,35%~50% B。扫描离子强度扫描范围为100~1000 m/z。
1.2.5.4 乳酸菌菌液的培养
MRS培养基:蛋白胨10.0 g/L,葡萄糖20.0 g/L,乙酸钠5.0 g/L,MgSO4 0.2 g/L,MnSO4 0.05 g/L,牛肉粉5.0 g/L,酵母粉4.0 g/L,KH2PO4 2.0 g/L,柠檬酸三铵2.0 g/L,吐温80 1 mL,121 ℃灭菌20 min,在无菌超净台里挑取1 环乳酸菌菌种接到MRS培养基中,37 ℃培养48 h。
1.2.5.5 猴头菌丝体酚类提取物对乳酸菌生长的影响
设置猴头菌丝体酚类提取物组和空白对照组。在8 mL MRS培养基中分别加入1 mL猴头菌丝体酚类提取液(浓度为10 mg/mL)与PBS溶液。121 ℃灭菌20 min,37 ℃培养48 h,并在0、6、12、24和48 h取样进行活菌计数及产酸pH测定,设置3组平行。
1.2.5.6 活菌数的检测方法
在9 mL的灭菌PBS缓冲剂中加入1 mL摇晃后的培养液搅拌,得到10倍稀释后的菌悬液。吸取20 μL,涂布在固体培养基上。37 ℃,培养48 h。通过细菌活菌平板计数法对3种乳酸菌进行培养计数。
1.3 数据处理
各组试验重复测定3次,取平均值,数据用平均值±标准差表示。利用Excel 2007和Origin 2018对生物学特性实验进行数据处理,差异显著水平为P<0.05。
2. 结果与分析
2.1 猴头菌总酚培养基单因素实验结果
2.1.1 碳源对猴头菌总酚的影响
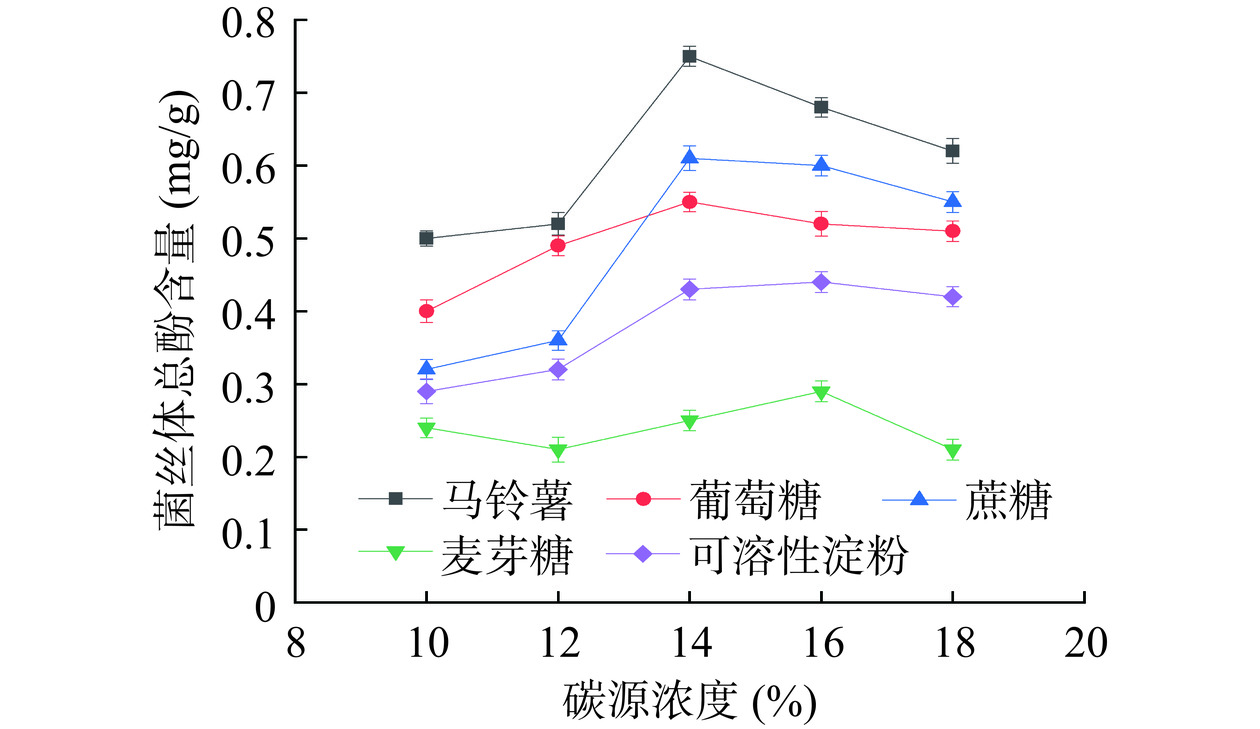
研究不同种类与浓度的碳源对液态培养猴头菌总酚含量的影响,选取马铃薯、葡萄糖、蔗糖、麦芽糖、可溶性淀粉为碳源,150 r/min、26 ℃、培养15 d收集菌丝体,测其总酚含量结果,如图1所示。
作为碳源的物质除了作为微生物所需碳元素的主要来源外,又是诱导物的主要来源。由图1可知,不同的碳源对猴头菌总酚含量的影响具有明显差异。随着碳源浓度的升高,猴头菌总酚含量均呈先升后降的趋势,其中,马铃薯做碳源的菌丝体总酚含量最佳。当马铃薯浓度为10%~14%时,对猴头菌总酚含量起促进作用。当马铃薯浓度为14%时,猴头菌总酚量最高可达0.783 mg/g。继续增加马铃薯浓度,总酚含量下降,这是由于马铃薯浓度过高,抑制了相关酶的活性,使其不能完全被菌体利用[19]。由于马铃薯培养基含有多种碳水化合物,适合猴头菌生长。从实验结果及成本考虑选择马铃薯为碳源。
2.1.2 氮源对猴头菌总酚的影响
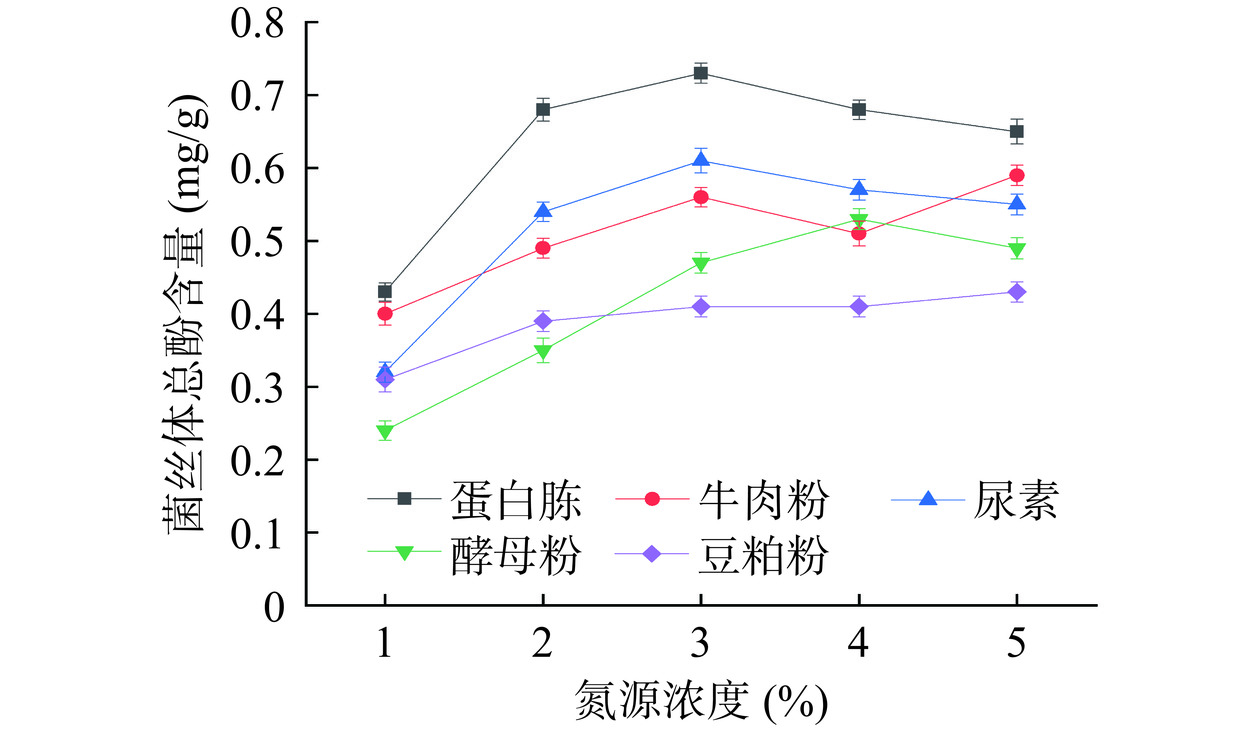
分别用不同浓度的蛋白胨、牛肉粉、尿素、酵母粉、豆粕粉为氮源,对猴头菌液态菌丝体进行发酵培养。培养一定时间后测得其总酚含量如图2所示。
在微生物生长代谢过程中,氮源主要被转化为核酸、氨基酸以及构成细胞壁的成分,是微生物生长的主要营养。不同氮源对猴头菌产酚类物质也有一定的影响,由图2可知,氮源为蛋白胨时,菌丝体总酚含量较高。随着氮源浓度的升高,猴头菌总酚含量均呈先升后降的趋势。当蛋白胨的浓度为3%时,猴头菌总酚量为最高可达0.73 mg/g。此浓度下,氮源为豆粕粉时,总酚含量最低为0.4 mg/g,由于蛋白胨是蛋白质的水解产物,菌丝利用率高,菌丝产量高,从而使得猴头菌总酚含量高。其他氮源对总酚含量的影响顺序为尿素>牛肉粉>酵母粉,因此选择蛋白胨为氮源[20]。
2.1.3 无机盐对猴头菌总酚的影响
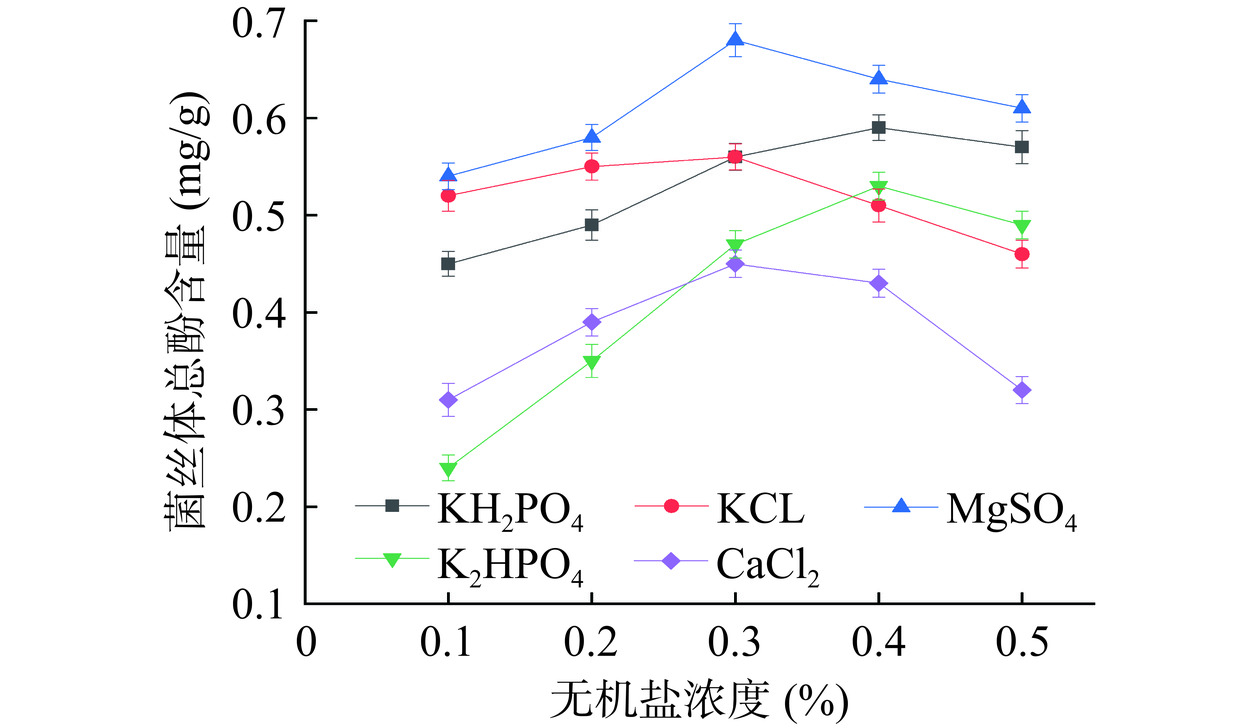
分别用不同浓度的K2HPO4、KCl、MgSO4、K2HPO4、CaCl2为无机盐,对猴头菌液态菌丝体进行发酵培养。培养一定时间后测得其总酚含量如图3所示。
无机盐会影响培养液的电位差、渗透压及pH变化,过高或过低的无机盐添加量不利于菌丝体生长以及代谢产物积累[21]。由图3可知,随着无机盐浓度的升高,猴头菌总酚含量均呈先升后降的趋势。其中,MgSO4做无机盐的菌丝体总酚含量最佳。当MgSO4浓度为0.1%~0.3%时,对猴头菌总酚含量起促进作用。当MgSO4浓度为0.3%时,猴头菌总酚量最高可达0.68 mg/g。但是随着浓度的增加,其总酚含量逐渐减少,因为过高的无机盐浓度会使培养液的渗透压增加,抑制菌丝体生长,从而减少猴头菌总酚含量[22]。
2.1.4 正交试验优化结果
在单因素实验基础上选择马铃薯(A)、蛋白胨(B)、MgSO4(C)、空列(D)4因素,各取3水平进行L9(34)的正交试验,确定液态培养的最佳条件,结果见表2。
表 2 正交试验设计及结果Table 2. Orthogonal test design and results实验号 A B C D 总酚含量
(mg/g)马铃薯(%) 蛋白胨(%) MgSO4(%) 空列 1 1(12) 1(1) 1(0.2) 1 0.465±0.01 2 1 2(2) 2(0.3) 2 0.730±0.03 3 1 3(3) 3(0.4) 3 0.535±0.02 4 2(14) 1 2 3 0.746±0.02 5 2 2 3 1 0.783±0.01 6 2 3 1 2 0.603±0.04 7 3(16) 1 3 2 0.492±0.03 8 3 2 1 3 0.539±0.02 9 3 3 2 1 0.589±0.03 K1 1.799 1.773 1.677 1.809 K2 2.202 2.122 2.135 1.895 K3 1.598 1.797 1.879 1.049 R 1.323 1.159 1.269 0.239 优水平 A2 B2 C2 因素主次 A>C>B 优方案 A2B2C2 由表2和表3分析可知,液态培养基中的马铃薯、蛋白胨、MgSO4均对猴头菌总酚含量有影响,各因素作用主次顺序依次为:马铃薯>MgSO4>蛋白胨。选取这3个因素的正交数据做方差分析,结果如表3所示,正交试验所选取的马铃薯、蛋白胨、MgSO4水平对猴头菌总酚产量影响显著(P<0.05)。得出最优液态培养条件组合为A2B2C2,即马铃薯浓度14%,蛋白胨浓度2%,MgSO4浓度0.3%。按照选定的条件组合A2B2C2重复实验3次,得到总酚含量分别为0.781、0.785、0.783 mg/g。3次多酚含量平均值为0.783 mg/g,与正交试验5号结果基本一致,说明上述工艺条件是合理的。由此得出最优条件为马铃薯浓度14%,蛋白胨浓度2.0%,MgSO4浓度0.3%,此时猴头菌菌丝体总酚含量为0.783±0.01 mg/g。
表 3 方差分析结果Table 3. Variance analysis方差来源 偏差平方和 自由度 均方 F值 显著性 马铃薯 0.048 2 0.024 951.633 P<0.05 蛋白胨 0.025 2 0.013 497.821 P<0.05 MgSO4 0.035 2 0.018 689.952 P<0.05 2.2 猴头菌丝体酚类提取物对乳酸菌生长的影响
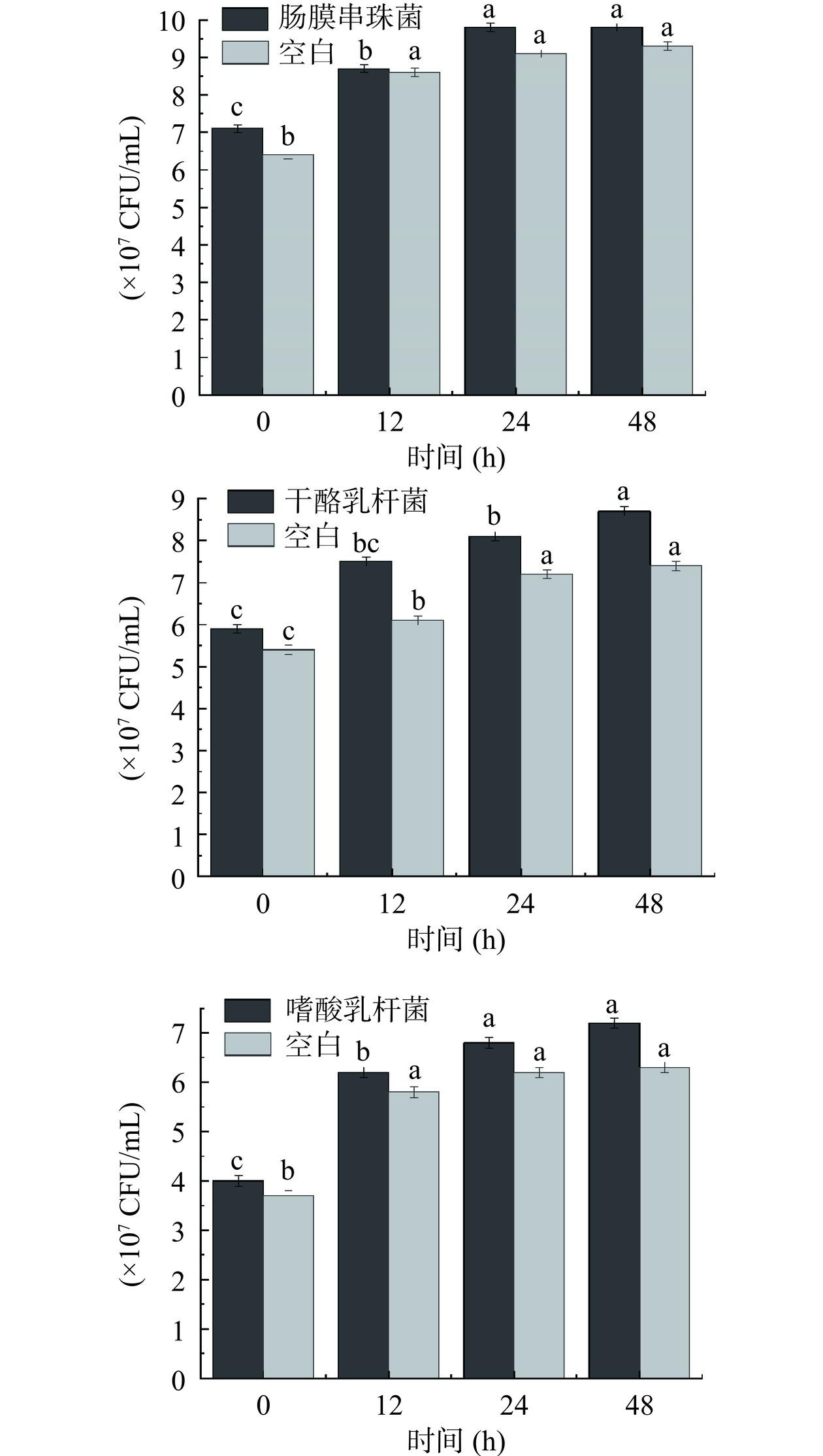
为了明确菌丝体酚类提取物对干酪乳杆菌、嗜酸乳杆菌、肠膜串珠菌的促增殖效应,对3种菌发酵前后(0 h和48 h)活菌数进行测定,结果如图4。对于同一菌种培养物,发酵前菌丝体酚类提取物组和空白组的活菌数没有显著差异(P>0.05)。各菌种培养物发酵前活菌数在4.1~7.1×107(CFU/mL)之间。添加菌丝体酚类提取物后,3种菌的活菌数均显著增加(P<0.05),干酪乳杆菌(Lactobacillus casei)活菌数由5.9×107 CFU/mL到8.6×107 CFU/mL;嗜酸乳杆菌(Lactobacillus acidophilus)的活菌数从4.1×107 CFU/mL到7.1×107 CFU/mL;肠膜串珠菌(Streptococcus intestinalis)的活菌数从7.2×107 CFU/mL到9.7×107 CFU/mL。说明菌丝体酚类提取物促进了益生菌的生长和代谢,增加了肠道益生菌的活性[23−24]。
![]() 图 4 猴头菌丝体酚类提取物对乳酸菌生长的影响注:不同字母表示差异显著(P<0.05),图5同。Figure 4. Effects of phenolic extracts from Hericium erinaceus mycelium on the growth of lactic acid bacteria
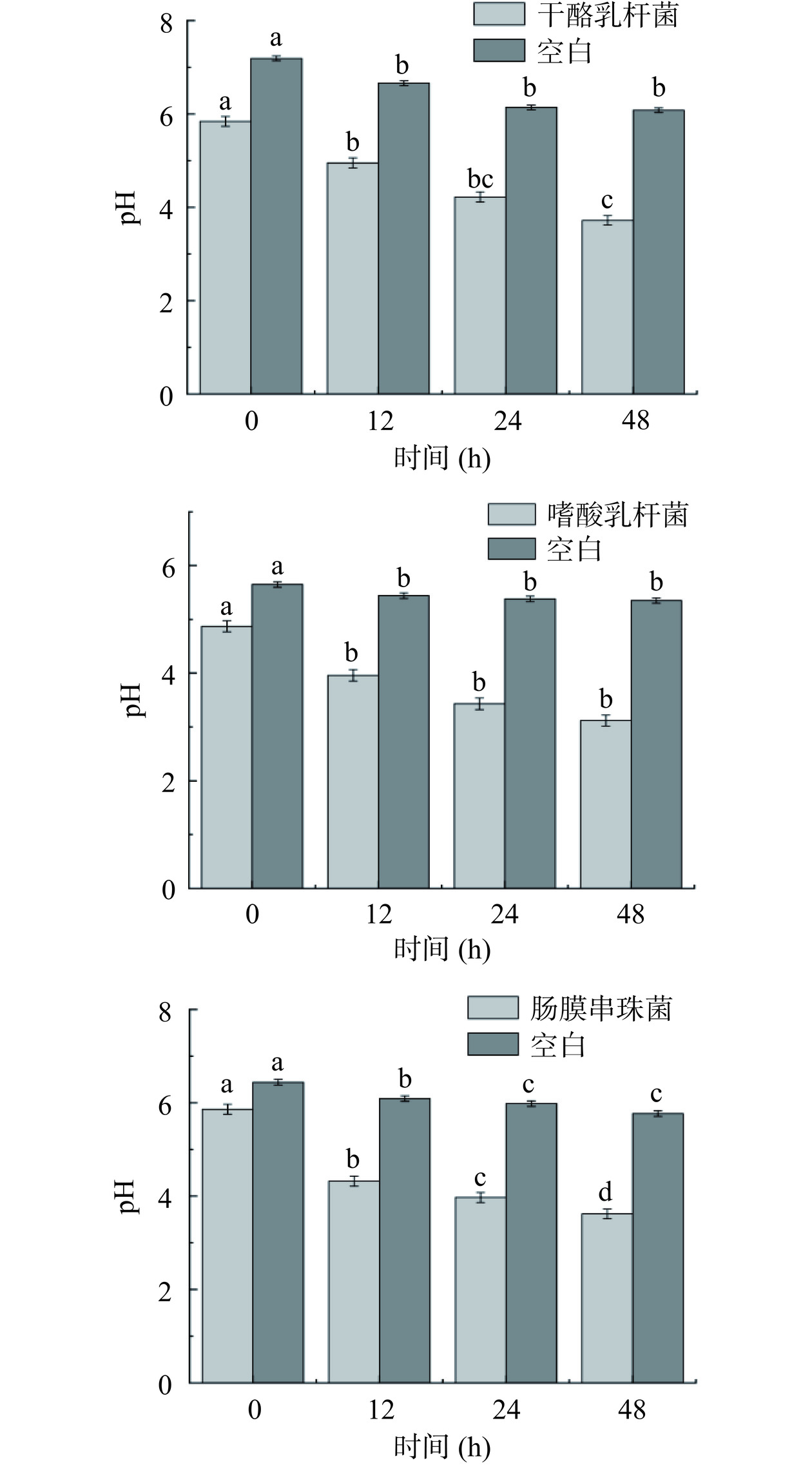
图 4 猴头菌丝体酚类提取物对乳酸菌生长的影响注:不同字母表示差异显著(P<0.05),图5同。Figure 4. Effects of phenolic extracts from Hericium erinaceus mycelium on the growth of lactic acid bacteria进一步明确猴头菌丝体酚类提取物对主要代谢产物乳酸产量的影响,对3种菌发酵前后(0 h和48 h)产酸进行测定,结果见图5。由图5可知,随着培养时间的延长,pH均呈显著(P<0.05)下降的趋势。酸碱度的变化会对乳酸菌的活性产生影响,随着乳酸菌持续产酸,与未加菌丝体酚类提取物的空白相比,添加菌丝体酚类提取物的培养物在48 h时pH均显著(P<0.05)降低,干酪乳杆菌(Lactobacillus casei)pH由5.9到3.82;嗜酸乳杆菌(Lactobacillus acidophilus)pH由4.97到3.12;肠膜串珠菌(Streptococcus intestinalis)pH由5.86到3.62。未添加菌丝体酚类提取物组的pH在发酵12 h后不再降低,产酸结束。pH的整体变化随着培养时间的增加呈递减趋势,乳酸菌增长需要营养物质,快速增长过程中会消耗碳水化合物。因此,菌株产生乳酸等各类代谢物导致pH值的降低。说明菌丝体酚类提取物不仅促进乳酸菌的生长,还加速乳酸产物的生成[25−27]。
2.3 HPLC-MS猴头菌总酚类物质检测与分析结果
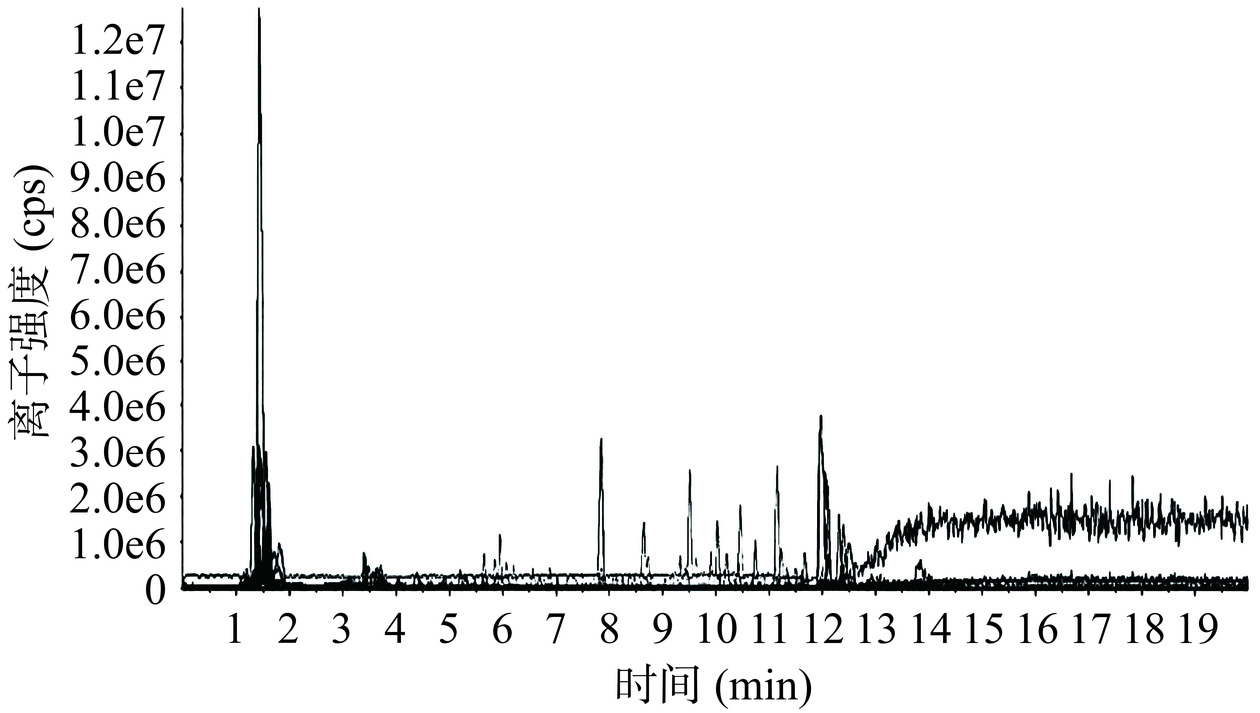
经过HPLC-MS对猴头菌液态菌丝体提取物进行检测,所得总离子流图(TIC)如图6所示,共检测到919个化合物。所得质谱数据采用Peakview进行查阅,经化源网(https://www.chemsrc.com/)、Pubchem(https://pubchem.ncbi.nlm.nih.gov/)、Chemspider(http://www.chemspider.com/)数据库中化学式、分子量、结构、色谱行为,天然产物植物化学词典数据库(DNP)检索和文献查阅等相关信息比对确定单体酚结构。进一步解析出猴头菌酚浓缩液中有35个化合物,其中除猴头菌酚类物质外,检测还存在二萜类、黄酮类、香豆素类、酚酸类、生物碱等物质,这可能是由于未进行多级纯化而导致。
由表4可知,其中检测出16种单体酚,占比为88.27%,其中阿魏酸占比29.55%,除单体酚外还包括3种生物碱类化合物,9种二萜类化合物,1种黄酮类化合物,1种色原酮类化合物,5种酚酸类化合物,共35种化合物。
表 4 猴头菌液态菌丝总酚鉴定结果Table 4. Identification results of total phenols in liquid mycelium of Hericium erinaceus序号 名称 化学式 保留时间
(min)加合离子 前体(Q1)质量
(Da)峰面积 离子碎片 峰面积占比
(%)1 Hericenal A C13H16O6 1.28 [M-H]− 267.08741 1853000 266.9786、151.0611、149.0449 2.58 2 猴头菌酮 A C19H22O5 7.62 [M-H]− 329.13945 6179400 329.0997、211.1345、171.1030 8.61 3 冬青生菌素 C27H31NO4 11.59 [M-H]− 432.21803 946500 432.2168、362.1393、137.0972 1.32 4 猴头菌酮 F C35H54O6 10.37 [M-H]− 569.38476 275000 568.1812、568.2541 0.38 5 猴头菌酮 E C37H54O6 10.42 [M-H]− 593.38476 238800 592.3303、209.0457 0.33 6 猴头菌酮 I C37H56O5 7.84 [M-H]− 579.4055 376400 576.2225 0.52 7 猴头菌酮 K C19H24O6 8.79 [M-H]− 347.15001 970800 346.2286、259.1684、217.1579 1.35 8 猴头菌酮 D C37H56O6 11.81 [M-H]− 595.40041 19940000 595.2846、333.0580、279.2312 27.81 9 猴头菌素A C35H56O5 7.47 [M-H]− 555.4055 109400 524.1296、339.2008、255.2330 0.15 10 柚皮素-O-芸香糖苷 C37H58O5 12.11 [M-H]− 581.42115 693900 504.3054、433.2359、219.2326 0.97 11 猴头菌素C C37H60O5 9.55 [M-H]− 583.4368 343000 583.2857、305.0627、295.2277 0.47 12 呋喃酮甲醚 C7H10O3 8.21 [M-H]− 141.05572 149700 141.0635、140.1078、70.0166 0.21 13 咖啡酸 C9H8O4 1.42 [M-H]− 179.0341 1417000 135.0481、149.0240 1.98 14 没食子酸 C7H6O5 9.33 [M-H]− 169.05063 1135000 125.0975、169.0157 1.58 15 东莨菪内酯 C10H8O4 1.58 [M-H]− 191.03498 5990100 178、150、133、122 8.35 16 阿魏酸 C10H10O4 1.48 [M-H]− 193.05063 2119000000 131.0346、175.0237 29.55 17 Erinaceolactone C C12H13ClO5 1.39 [M-H]− 271.03787 261200 271.2279、253.2164、225.2224 0.36 18 没食子酸-O-葡萄糖苷 C13H16O10 3.58 [M-H]− 331.1551 1417000 271.0447、159.0663、129.0557 1.98 19 猴头菌酮 J C19H24O4 6.04 [M-H]− 315.16018 109600 315.1042、167.0544、129.0560 0.15 20 3-羧基 猴头菌酮 F C35H54O7 7.90 [M-H]− 585.37968 886700 479.2588、113.0251 1.24 21 萘并吡喃 C27H33NO3 1.11 [M-H]- 418.23877 282600 418.8891、304.9150、174.9554 0.39 22 猴头菌碱 C29H39NO 8.12 [M-H]- 416.29589 359100 416.1772、372.1830、176.0364 0.05 23 丝氨酸蛋白酶 C C18H22NO4 6.04 [M-H]- 315.14761 109600 129.0560、167.0544 0.15 24 Cytha-3(18),12-diene C20H32 1.39 [M-H]- 271.24312 521800 271.0462、271.2270 0.73 25 儿茶素苄硫醚 C20H32O 5.13 [M-H]− 289.23804 222300 139.0651、171.0685 0.31 26 11-O-acetylcyathinA3 C22H32O4 3.66 [M-H]− 359.22278 318300 359.0590、179.0349 0.44 27 猴头菌素多醇 A C25H36O6 1.40 [M-H]− 431.24391 803400 431.2415、395.2213、176.0461 1.12 28 猴头菌素多醇 C C25H38O6 3.64 [M-H]− 433.25956 151100 253.0365、165.0540 0.21 29 对香豆酸-O-没食子酰-
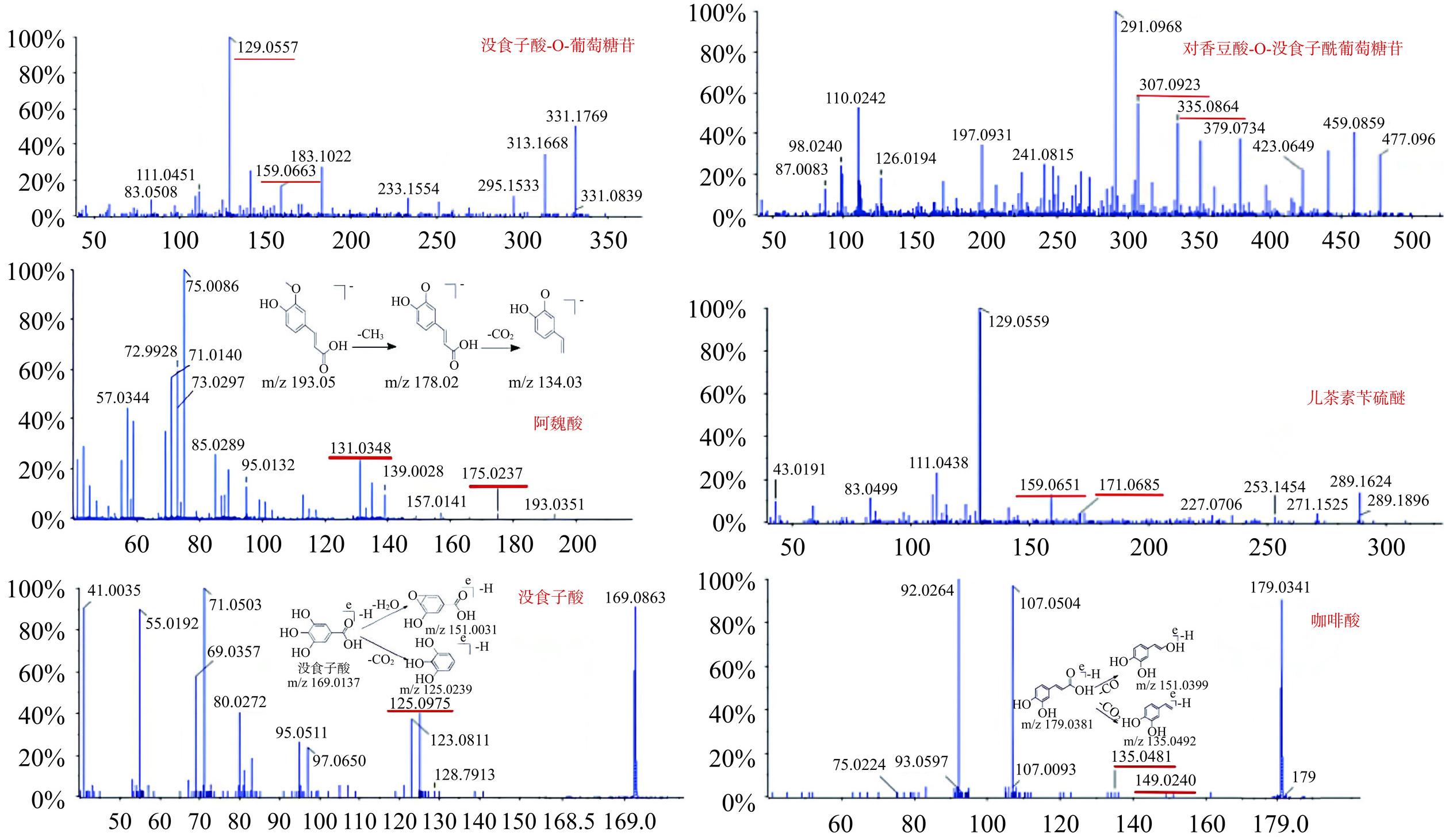
葡萄糖苷C22H22O12 1.61 [M-H]− 477.28578 2119000 307.0923、335.0664、126.0194 2.96 30 1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷 C29H26O15 7.95 [M-H]− 463.23374 965500 313.0551、169.0114 1.34 31 猴头菌素多醇 C25H35NaO7 5.87 [M-H]− 447.23883 299880 285.041、283.0329 0.42 32 猴头菌素多醇 G C25H38O8 8.71 [M-H]− 465.24939 638700 331.2379、171.0069 0.89 33 猴头菌素多醇 K C27H42O8 8.39 [M-H]− 493.28069 149700 493.2016、447.2374 0.21 34 猴头菌素多醇 P C27H40O8 3.70 [M-H]− 491.26504 181900 311.0771、267.0870、171.0671 0.25 35 猴头菌素多醇 R C27H38O9 11.09 [M-H]− 505.24431 97960 505.2338、461.2436、121.0639 0.14 化合物C19H24O5母离子[M-H]− m/z 331.1551,并产生m/z 159.0663,129.0557没食子酸的特征碎片离子。因此推测化合物为没食子酸-O-葡萄糖苷。化合物C27H42O7的母离子[M-H]−为m/z 477.0932,由碎片[M-H]− m/z 335.0864和[M-H]− m/z 307.0923推测对香豆酸和葡萄糖均连接在没食子酸的羟基(-OH)上。由相似的质谱碎片信息推测化合物为对香豆酸-O-没食子酰葡萄糖苷[28−29]。化合物C10H10O4母离子[M-H]− m/z 193.0351,碎片m/z 175.0237[M-H-Glc-CH2]−和m/z 131.0348[M-H-Glc-CH3]−均为阿魏酸的特征离子,因此,推测该化合物为阿魏酸。化合物C20H32O母离子为m/z 289.23804[M-H]−,为连续失去2个苄硫醇分子所得,其碎片离子m/z 229.0494[M-H-H2O-C2H2O]−和159.0447[M-H-H2O-C6H6O2]−由母核丢失1分子H2O后所产生,m/z 205.0499由母核丢失2分子C2H2O产生,m/z 171.0805由母核丢失B环产生,m/z 137.0238由C环1,4键断裂产生。苄硫醇不仅能攻击黄烷-3-醇的C4位置,导致黄烷醇单元间的连接键断裂,还可攻击C2位置,导致杂环断裂[30−32]。综合上述分析,此化合物为(表4)儿茶素苄硫醚的杂环裂解产物,经推测该物质为儿茶素苄硫醚。化合物C8H10O4产生碎片m/z 169.0863、125.0975,符合没食子酸结构,经推测该物质为没食子酸。保留时间为4.97 min,说明极性较大,负离子模式下的准分子离子[M-H]− 179.0341,分子式为C9H8O4,碎片离子m/z 149.0240比准分子离子少30 Da,推测为丢失一分子NO所得,碎片离子m/z 135.0481比准分子离子少44 Da,推测为丢失一分子CO2所得,推测该物质为酚酸类物质,结合分子式和精确分子量鉴定为咖啡酸[33]。
根据准分子离子[M-H]−或加合离子[M+CT]信息判断并得到的一级质谱精确相对分子质量,并根据产生的二级质谱碎片离子信息,通过与对照品或文献数据比对,并在线检索中医药百科全书数据库(http://www.ehbio.com/ETCM/),对共有峰进行成分鉴定质谱图,如图7所示。
对主要6种单体酚进行推测结果为:没食子酸-O-葡萄糖苷、对香豆酸-O-没食子酰葡萄糖苷、阿魏酸、儿茶素苄硫醚、没食子酸、咖啡酸。有研究发现猴头菌丝体酚类提取物具有一定的益生元特性,能在一定条件下促进乳酸菌生长[34]。多酚类物质在肠道诸多菌群的作用下代谢加速,包括儿茶素、没食子酸和咖啡酸等,产生菌群可利用的芳香族代谢物,可抑制食源性致病菌的生长及毒素的产生,促进益生菌生长[35]。随着发酵过程的进行,咖啡酸代谢为间香豆酸,间香豆酸又进一步代谢生成其他酚酸类化合物导致肠道pH呈现先下降后上升趋势,抑制肠道有害菌的增殖[36]。乳酸菌产生的酶可以破坏酯键,水解β-糖苷键,释放与抗氧化有关的对香豆酸,可以有效抑制酪氨酸酶活性。阿魏酸酯可以水解肠道中的酯化物质,在黏膜细胞代谢过程中,容易产生超氧化物质,造成粘膜损伤,增强肠黏膜屏障,调节肠道微生物结构,对维护肠道菌群平衡发挥了较大作用[37]。
3. 结论
膳食中的益生元物质可以改善肠道中有益菌的生长增殖情况,促进有益菌的代谢活动,产生对人体有益的代谢物,促进人体健康。猴头菌酚类提取物与肠道菌群具有双向协同,共同调节机体健康的作用。本研究采用人工分离的猴头菌纯菌株,对其液态深层培养获得猴头菌菌丝体产酚类物质的培养基进行了优化,从猴头菌丝体酚类提取物中分离并鉴定出没食子酸-O-葡萄糖苷、对香豆酸-O-没食子酰葡萄糖苷、阿魏酸、儿茶素苄硫醚、没食子酸、咖啡酸。没食子酸(GA)对乳酸菌生长起促进作用,能够影响乳酸菌的生长,存在着抑制-促进的双向调节作用,具有浓度依赖特性。乳杆菌可以将猴头菌丝体酚类提取物进行生物转化,提高多酚的生物利用度,添加猴头菌丝体多酚提取物进行培养乳酸菌,对乳酸菌生长具有促生作用。为解决猴头菌野生资源不足、挖掘新资源功能化合物提供了理论基础。猴头菌丝体酚类提取物具有多种生物活性,有助于改善肠道微生态环境,调节肠道菌群,对促进肠道健康具有积极的作用,在食品加工中可作为膳食补充剂。
-
图 4 猴头菌丝体酚类提取物对乳酸菌生长的影响
注:不同字母表示差异显著(P<0.05),图5同。
Figure 4. Effects of phenolic extracts from Hericium erinaceus mycelium on the growth of lactic acid bacteria
表 1 L9(33)正交试验因素水平设计
Table 1 L9(33) orthogonal experimental design factor level table
水平 马铃薯(%) 蛋白胨(%) MgSO4(%) 空列 1 12 1 0.2 1 2 14 2 0.3 2 3 16 3 0.4 3 表 2 正交试验设计及结果
Table 2 Orthogonal test design and results
实验号 A B C D 总酚含量
(mg/g)马铃薯(%) 蛋白胨(%) MgSO4(%) 空列 1 1(12) 1(1) 1(0.2) 1 0.465±0.01 2 1 2(2) 2(0.3) 2 0.730±0.03 3 1 3(3) 3(0.4) 3 0.535±0.02 4 2(14) 1 2 3 0.746±0.02 5 2 2 3 1 0.783±0.01 6 2 3 1 2 0.603±0.04 7 3(16) 1 3 2 0.492±0.03 8 3 2 1 3 0.539±0.02 9 3 3 2 1 0.589±0.03 K1 1.799 1.773 1.677 1.809 K2 2.202 2.122 2.135 1.895 K3 1.598 1.797 1.879 1.049 R 1.323 1.159 1.269 0.239 优水平 A2 B2 C2 因素主次 A>C>B 优方案 A2B2C2 表 3 方差分析结果
Table 3 Variance analysis
方差来源 偏差平方和 自由度 均方 F值 显著性 马铃薯 0.048 2 0.024 951.633 P<0.05 蛋白胨 0.025 2 0.013 497.821 P<0.05 MgSO4 0.035 2 0.018 689.952 P<0.05 表 4 猴头菌液态菌丝总酚鉴定结果
Table 4 Identification results of total phenols in liquid mycelium of Hericium erinaceus
序号 名称 化学式 保留时间
(min)加合离子 前体(Q1)质量
(Da)峰面积 离子碎片 峰面积占比
(%)1 Hericenal A C13H16O6 1.28 [M-H]− 267.08741 1853000 266.9786、151.0611、149.0449 2.58 2 猴头菌酮 A C19H22O5 7.62 [M-H]− 329.13945 6179400 329.0997、211.1345、171.1030 8.61 3 冬青生菌素 C27H31NO4 11.59 [M-H]− 432.21803 946500 432.2168、362.1393、137.0972 1.32 4 猴头菌酮 F C35H54O6 10.37 [M-H]− 569.38476 275000 568.1812、568.2541 0.38 5 猴头菌酮 E C37H54O6 10.42 [M-H]− 593.38476 238800 592.3303、209.0457 0.33 6 猴头菌酮 I C37H56O5 7.84 [M-H]− 579.4055 376400 576.2225 0.52 7 猴头菌酮 K C19H24O6 8.79 [M-H]− 347.15001 970800 346.2286、259.1684、217.1579 1.35 8 猴头菌酮 D C37H56O6 11.81 [M-H]− 595.40041 19940000 595.2846、333.0580、279.2312 27.81 9 猴头菌素A C35H56O5 7.47 [M-H]− 555.4055 109400 524.1296、339.2008、255.2330 0.15 10 柚皮素-O-芸香糖苷 C37H58O5 12.11 [M-H]− 581.42115 693900 504.3054、433.2359、219.2326 0.97 11 猴头菌素C C37H60O5 9.55 [M-H]− 583.4368 343000 583.2857、305.0627、295.2277 0.47 12 呋喃酮甲醚 C7H10O3 8.21 [M-H]− 141.05572 149700 141.0635、140.1078、70.0166 0.21 13 咖啡酸 C9H8O4 1.42 [M-H]− 179.0341 1417000 135.0481、149.0240 1.98 14 没食子酸 C7H6O5 9.33 [M-H]− 169.05063 1135000 125.0975、169.0157 1.58 15 东莨菪内酯 C10H8O4 1.58 [M-H]− 191.03498 5990100 178、150、133、122 8.35 16 阿魏酸 C10H10O4 1.48 [M-H]− 193.05063 2119000000 131.0346、175.0237 29.55 17 Erinaceolactone C C12H13ClO5 1.39 [M-H]− 271.03787 261200 271.2279、253.2164、225.2224 0.36 18 没食子酸-O-葡萄糖苷 C13H16O10 3.58 [M-H]− 331.1551 1417000 271.0447、159.0663、129.0557 1.98 19 猴头菌酮 J C19H24O4 6.04 [M-H]− 315.16018 109600 315.1042、167.0544、129.0560 0.15 20 3-羧基 猴头菌酮 F C35H54O7 7.90 [M-H]− 585.37968 886700 479.2588、113.0251 1.24 21 萘并吡喃 C27H33NO3 1.11 [M-H]- 418.23877 282600 418.8891、304.9150、174.9554 0.39 22 猴头菌碱 C29H39NO 8.12 [M-H]- 416.29589 359100 416.1772、372.1830、176.0364 0.05 23 丝氨酸蛋白酶 C C18H22NO4 6.04 [M-H]- 315.14761 109600 129.0560、167.0544 0.15 24 Cytha-3(18),12-diene C20H32 1.39 [M-H]- 271.24312 521800 271.0462、271.2270 0.73 25 儿茶素苄硫醚 C20H32O 5.13 [M-H]− 289.23804 222300 139.0651、171.0685 0.31 26 11-O-acetylcyathinA3 C22H32O4 3.66 [M-H]− 359.22278 318300 359.0590、179.0349 0.44 27 猴头菌素多醇 A C25H36O6 1.40 [M-H]− 431.24391 803400 431.2415、395.2213、176.0461 1.12 28 猴头菌素多醇 C C25H38O6 3.64 [M-H]− 433.25956 151100 253.0365、165.0540 0.21 29 对香豆酸-O-没食子酰-
葡萄糖苷C22H22O12 1.61 [M-H]− 477.28578 2119000 307.0923、335.0664、126.0194 2.96 30 1-O-没食子酰基-2-O-肉桂酰基-β-D-葡萄糖苷 C29H26O15 7.95 [M-H]− 463.23374 965500 313.0551、169.0114 1.34 31 猴头菌素多醇 C25H35NaO7 5.87 [M-H]− 447.23883 299880 285.041、283.0329 0.42 32 猴头菌素多醇 G C25H38O8 8.71 [M-H]− 465.24939 638700 331.2379、171.0069 0.89 33 猴头菌素多醇 K C27H42O8 8.39 [M-H]− 493.28069 149700 493.2016、447.2374 0.21 34 猴头菌素多醇 P C27H40O8 3.70 [M-H]− 491.26504 181900 311.0771、267.0870、171.0671 0.25 35 猴头菌素多醇 R C27H38O9 11.09 [M-H]− 505.24431 97960 505.2338、461.2436、121.0639 0.14 -
[1] 鞠正福, 周巨川, 董国秀. 猴头菌菌丝体发酵条件优化研究[J]. 食用菌,2022,44(3):16−18. [JU Z Z, ZHOU J C, DONG G X. Optimization of fermentation conditions[J]. Edible Fungi,2022,44(3):16−18.] doi: 10.3969/j.issn.1000-8357.2022.03.005 JU Z Z, ZHOU J C, DONG G X. Optimization of fermentation conditions[J]. Edible Fungi, 2022, 44(3): 16−18. doi: 10.3969/j.issn.1000-8357.2022.03.005
[2] 刘灵霞. 猴头菌液体深层发酵环境条件研究[J]. 陇东学院学报,2013,24(1):52−55. [LIU L X. Study on environmental conditions of liquid deep fermentation[J]. Journal of Longdong College,2013,24(1):52−55.] doi: 10.3969/j.issn.1674-1730.2013.01.017 LIU L X. Study on environmental conditions of liquid deep fermentation[J]. Journal of Longdong College, 2013, 24(1): 52−55. doi: 10.3969/j.issn.1674-1730.2013.01.017
[3] 刘晓鹏, 姜宁, 夏冬冬, 等. 猴头菌液体发酵培养基及工艺优化的研究[J]. 广东农业科学,2014(18):79−82. [LIU X P, JIANG N, XIA D D, et al. Study on liquid fermentation medium and process optimization of Hermonium[J]. Guangdong Agricultural Science,2014(18):79−82.] doi: 10.3969/j.issn.1004-874X.2014.18.020 LIU X P, JIANG N, XIA D D, et al. Study on liquid fermentation medium and process optimization of Hermonium[J]. Guangdong Agricultural Science, 2014(18): 79−82. doi: 10.3969/j.issn.1004-874X.2014.18.020
[4] 信文娟, 肖毓, 董调亚, 等. 猴头菌深层发酵培养基筛选[J]. 食品与发酵技术,2019,55(3):64−67. [XIN W J, XIAO Y, DONG D Y, et al. Screening of deep fermentation medium for Hericium erinaceus[J]. Food and Fermentation Technology,2019,55(3):64−67.] XIN W J, XIAO Y, DONG D Y, et al. Screening of deep fermentation medium for Hericium erinaceus[J]. Food and Fermentation Technology, 2019, 55(3): 64−67.
[5] 王瑞琦, 王植朔, 那治国, 等. 猴头菌子实体与液态发酵菌丝体活性成分差异及其在改善胃部疾病中的应用进展[J]. 食品安全质量检测学报, 2023, 14(4):239−248. [WANG R Q, WANG Z S, NA Z G. et al. Difference of active ingredients between fruit bodies and liquid fermentation mycelium of monkey head fungus and its application in ameliorating gastric diseases[J]. Journal of Food Safety and Quality Inspection, 2019, 14(4):239−248.] WANG R Q, WANG Z S, NA Z G. et al. Difference of active ingredients between fruit bodies and liquid fermentation mycelium of monkey head fungus and its application in ameliorating gastric diseases[J]. Journal of Food Safety and Quality Inspection, 2019, 14(4): 239−248.
[6] 庄海宁, 向情儒, 刘玉荞, 等. 猴头菌抗氧化肽的分离纯化[J]. 食用菌学报,2022,29(6):59−66. [ZHUANG H N, XIANG Q R, LIU Y Q. et al. Isolation and purification of antioxidant peptides from Hericium erinaceus[J]. Chinese Journal of Edible Fungi,2022,29(6):59−66.] ZHUANG H N, XIANG Q R, LIU Y Q. et al. Isolation and purification of antioxidant peptides from Hericium erinaceus[J]. Chinese Journal of Edible Fungi, 2022, 29(6): 59−66.
[7] 陆顺, 杨璇, 冯雨菡, 等. 抗抑郁食药用真菌及其活性成分研究进展[J]. 食用菌学报,2022,29(3):101−110. [LU S, YANG X, FENG Y H. et al. Research progress of antidepressant edible medicinal fungi and their active constituents[J]. Journal of Edible Fungi,2022,29(3):101−110.] LU S, YANG X, FENG Y H. et al. Research progress of antidepressant edible medicinal fungi and their active constituents[J]. Journal of Edible Fungi, 2022, 29(3): 101−110.
[8] 郭杨昪, 杜笑, 刘畅, 等. 模拟胃肠消化过程中猴头菌多酚类物质及其抗氧化活性的变化规律[J]. 菌物学报,2012,42(5):1151−1162. [GUO Y S, DU X, LIU C. et al. Changes of polyphenols and antioxidant activities of Hericium ericium during simulated gastrointestinal digestion[J]. Chinese Journal of Bacteriology,2012,42(5):1151−1162.] GUO Y S, DU X, LIU C. et al. Changes of polyphenols and antioxidant activities of Hericium ericium during simulated gastrointestinal digestion[J]. Chinese Journal of Bacteriology, 2012, 42(5): 1151−1162.
[9] 唐敏, 冷悦, 王淑敏, 等. 猴头菌与人参双向固体发酵菌质体外抗氧化活性分析[J]. 食品工业科技,2023,44(1):154−161. [TANG M, LENG Y, WANG S M. et al. Analysis of extracapsular antioxidant activity in bidirectional solid fermentation of Hericium ericium and ginseng[J]. Science and Technology of Food Industry,2023,44(1):154−161.] TANG M, LENG Y, WANG S M. et al. Analysis of extracapsular antioxidant activity in bidirectional solid fermentation of Hericium ericium and ginseng[J]. Science and Technology of Food Industry, 2023, 44(1): 154−161.
[10] MIZUNOEATAL T, TETSUYA W, HITOSHI L, et al. Antitumor activepolysaccha-rides isolated from the fruiting body of Heicium erinaceus, an edible and medical mushroom called yamabushi-take or houtou[J]. Bioscience Biochem,1992,56(2):347−348.
[11] KIM S P, KANG M Y, KIM J H, et al. Composition and mechanism of antitumor effects of Hericium erinaceus mushroom extracts in tumor-bearing mice[J]. J Agric Food Chem,2011,59(18):9861−9869. doi: 10.1021/jf201944n
[12] YONG C, DONG-SEOK K, KYONG-CHAN P. Antioxidant effect of inonotus obliquus[J]. Journal of Ethnopharmacology,2005,96(1):279−285.
[13] SANDRINA, A, HELENO. Chemical composition, antioxidant activity and bioaccessibility studies in phenolic extracts of two Hericium wild edible species[J]. LWT Food Science & Technology,2015,3(7):409−412.
[14] 杜笑. 猴头菌子实体多酚抗炎活性及其对斑马鱼溃疡性结肠炎的作用效果分析[D]. 太原:山西农业大学, 2022. [DU X. Anti-inflammatory activity of polyphenols from Hericium erinaceus fruiting body and its effect on zebrafish ulcerative colitis[D]. Taiyuan:Shanxi Agricultural University, 2022.] DU X. Anti-inflammatory activity of polyphenols from Hericium erinaceus fruiting body and its effect on zebrafish ulcerative colitis[D]. Taiyuan: Shanxi Agricultural University, 2022.
[15] 许灿华. 荔枝果肉多酚促进肠道菌种共培养增殖体外相互作用研究[D]. 广州:广州大学, 2023. [XU C H. Study on the in vitro interaction of litchi pulp polyphenols in promoting the co-culture and proliferation of intestinal bacteria[D]. Guangzhou:Guangzhou University, 2023.] XU C H. Study on the in vitro interaction of litchi pulp polyphenols in promoting the co-culture and proliferation of intestinal bacteria[D]. Guangzhou: Guangzhou University, 2023.
[16] 于成功, 徐肇敏, 祝其凯, 等. 猴头菌对实验大鼠胃黏膜保护作用的研究[J]. 胃肠病学,1999,4(2):93−96. [YU C G, XU J M, ZHU Q K, et al. Protection of the gastric mucosa of experimental rats[J]. Gastrointestinal Gastroenterology,1999,4(2):93−96.] YU C G, XU J M, ZHU Q K, et al. Protection of the gastric mucosa of experimental rats[J]. Gastrointestinal Gastroenterology, 1999, 4(2): 93−96.
[17] 王振丽, 李书华, 闫泽华. 猴头菌丝多糖提取工艺的研究[J]. 农产品加工,2022(8):41−42,46. [WANG Z L, LI S H, YAN Z H. Study on extraction technology of polysaccharide from monkey head mycelia[J]. Agricultural Products Processing,2022(8):41−42,46.] WANG Z L, LI S H, YAN Z H. Study on extraction technology of polysaccharide from monkey head mycelia[J]. Agricultural Products Processing, 2022(8): 41−42,46.
[18] 黄桂涛. 荔枝果肉多酚的肠道菌群体内外代谢研究[D]. 广州:广州大学, 2023. [HUANG G T. Study on the metabolism of polyphenols in litchi pulp in and out of intestinal bacteria population[D]. Guangzhou:Guangzhou University, 2023.] HUANG G T. Study on the metabolism of polyphenols in litchi pulp in and out of intestinal bacteria population[D]. Guangzhou: Guangzhou University, 2023.
[19] 万宁威, 雷帮星, 何劲, 等. 猴头菌液体发酵产多糖、核苷、萜类工艺优化及其抗氧化活性[J]. 食品工业科技,2022,43(2):233−240. [WAN N W, LEI B X, HE J. et al. Optimization of polysaccharide, nucleoside and terpene production by liquid fermentation and their antioxidant activities[J]. Science and Technology of Food Industry,2022,43(2):233−240.] WAN N W, LEI B X, HE J. et al. Optimization of polysaccharide, nucleoside and terpene production by liquid fermentation and their antioxidant activities[J]. Science and Technology of Food Industry, 2022, 43(2): 233−240.
[20] LI Q Y, YU X H, MAO M J. et al. Correlation analysis of antioxidant activity in vitro and anthraquinone content of traditional Chinese medicine containing anthraquinones[J]. Chin J Tradit Chin Med Pharm,2020,35:5743−5747.
[21] CHEN A Z, SUN L, YUAN H, et al. Simultaneous qualitative and quantitative analysis of 11 active compounds in rhubarb using two reference substances by UHPLC[J]. Sep Sci,2018,41(19):3686−3696. doi: 10.1002/jssc.201800479
[22] 马强, 杨焱, 张忠, 等. 猴头菌子实体粉的复合酶解及其功能特性[J]. 食用菌学报,2022,29(2):54−64. [MA Q, YANG Y, ZHANG Z. et al. Complex enzymatic hydrolysis and functional properties of fruiting body powder of Monkey head fungus[J]. Chinese Journal of Edible Fungi,2022,29(2):54−64.] MA Q, YANG Y, ZHANG Z. et al. Complex enzymatic hydrolysis and functional properties of fruiting body powder of Monkey head fungus[J]. Chinese Journal of Edible Fungi, 2022, 29(2): 54−64.
[23] 严涛, 陈珂可, 程文, 等. 乳酸菌菌粉定量计数方法研究[J]. 食品工业科技,2023,44(3):148−153. [YAN T, CHEN K K, CHENG W, et al. Study on quantitative counting method of lactic acid bacteria powder[J]. Food Industry Science and Technology,2023,44(3):148−153.] YAN T, CHEN K K, CHENG W, et al. Study on quantitative counting method of lactic acid bacteria powder[J]. Food Industry Science and Technology, 2023, 44(3): 148−153.
[24] 刘颖, 张彬彬, 孙冰玉, 等. 枯草芽孢杆菌高产中性蛋白酶发酵条件的优化[J]. 食品科学,2014,35(13):166−170. [LIU Y, ZHANG B B, SUN B Y et al. Optimization of fermentation conditions for high-yield neutral protease by Bacillus subtilis[J]. Food Science,2014,35(13):166−170.] doi: 10.7506/spkx1002-6630-201413032 LIU Y, ZHANG B B, SUN B Y et al. Optimization of fermentation conditions for high-yield neutral protease by Bacillus subtilis[J]. Food Science, 2014, 35(13): 166−170. doi: 10.7506/spkx1002-6630-201413032
[25] 秦雅莉, 赵笑颍, 沈圆圆, 等. 酸笋中具有抗炎活性乳酸菌的筛选及鉴定[J]. 食品科学,2022,43(8):121−127. [QIN Y L, ZHAO X Y, SHEN Y Y, et al. Screening and identification of lactic acid bacteria with anti-inflammatory activity in sour bamboo shoots[J]. Food Science,2022,43(8):121−127.] QIN Y L, ZHAO X Y, SHEN Y Y, et al. Screening and identification of lactic acid bacteria with anti-inflammatory activity in sour bamboo shoots[J]. Food Science, 2022, 43(8): 121−127.
[26] CHO T M, KIM W J, MOON S K. AKT signaling is involved infucoidan-induced inhibition of growth and migration of human bladder cancer cells[J]. Food Chem Toxicol,2014,64(2):344−352.
[27] 周晓, 王晔恺, 周吉航, 等. 表没食子儿茶素没食子酸酯对Hela细胞的诱导凋亡作用及靶点蛋白质研究[J]. 中华中医药学刊,2012,30(1):194. [ZHOU X, WANG Y K, ZHOU J H, et al. Study on apoptosis-inducing effect of epigallocatechin gallate on Hela cells and its target protein[J]. Chinese Journal of Traditional Chinese Medicine,2012,30(1):194.] ZHOU X, WANG Y K, ZHOU J H, et al. Study on apoptosis-inducing effect of epigallocatechin gallate on Hela cells and its target protein[J]. Chinese Journal of Traditional Chinese Medicine, 2012, 30(1): 194.
[28] 谭喜莹, 陆红柳, 赵陆华, 等. 高效液相色谱法测定菟丝子中对-香豆酸含量[J]. 中国现代应用药学,2006,23(9):918−920. [TAN X Y, LU H L, ZHAO L H, et al. Determination of p-coumaric acid in semen cuscuta by high performance liquid chromatography[J]. Chinese Journal of Modern Applied Pharmacy,2006,23(9):918−920.] TAN X Y, LU H L, ZHAO L H, et al. Determination of p-coumaric acid in semen cuscuta by high performance liquid chromatography[J]. Chinese Journal of Modern Applied Pharmacy, 2006, 23(9): 918−920.
[29] 贾玉梅, 王君明, 崔瑛. 基于二苯乙烯类为主要活性成分的虎杖药理作用研究进展[J]. 中国实验方剂学杂志,2011,17(9):263. [JIA Y M, WANG M J, CUI Y. et al. Research progress on pharmacological effects of Polygonum cuspidatum based on stilbenes as main active ingredients[J]. Chinese Journal of Experimental Formulae,2011,17(9):263.] doi: 10.3969/j.issn.1005-9903.2011.09.077 JIA Y M, WANG M J, CUI Y. et al. Research progress on pharmacological effects of Polygonum cuspidatum based on stilbenes as main active ingredients[J]. Chinese Journal of Experimental Formulae, 2011, 17(9): 263. doi: 10.3969/j.issn.1005-9903.2011.09.077
[30] 黄思雨. 绿茶、桑叶和臭黄荆叶细粉抗氧化、抗炎及肠道益生性探究[D]. 重庆:西南大学, 2020. [HUANG S Y. Study on anti-oxidation, anti-inflammatory and intestinal probiotic of the powders of green tea, mulberry leafand premna leaf[D]. Chongqing:Southwest University, 2020.] HUANG S Y. Study on anti-oxidation, anti-inflammatory and intestinal probiotic of the powders of green tea, mulberry leafand premna leaf[D]. Chongqing: Southwest University, 2020.
[31] 林洁鑫. 福安红茶和尤溪红茶滋味品质特征及其指纹图谱研究[D]. 福州:福建农林大学, 2022. [LIN J X. Study on the taste and quality characteristics of Fuan black tea and Youxi black tea and their fingerprints[D]. Fuzhou:Fujian Agriculture and Forestry University, 2022.] LIN J X. Study on the taste and quality characteristics of Fuan black tea and Youxi black tea and their fingerprints[D]. Fuzhou: Fujian Agriculture and Forestry University, 2022.
[32] 郝建秦, 张晶晶, 薛洁, 等. 啤酒花中多酚类化合物指纹图谱及化学计量学分析[J]. 中外酒业,2022(9):1−7. [HAO J Q, ZHANG J J, XUE J, et al. Fingerprint and chemometric analysis of polyphenols in hops[J]. Chinese and Foreign Wine Industry,2022(9):1−7.] HAO J Q, ZHANG J J, XUE J, et al. Fingerprint and chemometric analysis of polyphenols in hops[J]. Chinese and Foreign Wine Industry, 2022(9): 1−7.
[33] 周新茹, 王志辉, 龙雨青, 等. 基于高效液相指纹图谱及网络药理学预测分析山银花质量标志物[J]. 天然产物研究与开发,2023,35(2):208−220,241. [ZHOU X R, WANG Z H, LONG Y Q, et al. Prediction and analysis of quality markers of Flos Lonicerae based on HPLC fingerprint and netwrk pharmacology[J]. Research and Development of Natural Products,2023,35(2):208−220,241.] ZHOU X R, WANG Z H, LONG Y Q, et al. Prediction and analysis of quality markers of Flos Lonicerae based on HPLC fingerprint and netwrk pharmacology[J]. Research and Development of Natural Products, 2023, 35(2): 208−220,241.
[34] BARBARA K, JOLANTA W, MALGORZATA P, et al. Antibiofilm activity of trans-cinnamaldehyde, ρ-coumaric, and ferulic acids on uropathogenic Escherichia coli[J]. Turk J Med Sci,2015,45(12):919−924.
[35] SRINIVASAN M, SUDHEER A R, PILLAI K R, et al. Influence of ferulic acid on γ-radiation induced DNA damage, lipid peroxidation and antioxidant status in primary culture of isolated rat hepatocytes[J]. Toxicology,2006,228(2/3):249−258.
[36] 江福林, 卢云浩, 何强. 茶多酚对植物乳杆菌、金黄色葡萄球菌和大肠杆菌生长的双向调节作用[J]. 食品工业科技,2023,44(22):152−159. [JIANG F L, LU Y H, HE Q. Bidirectional regulation of tea polyphenols on the growth of Lactobacillus plantarum, Staphylococcus aureus and Escherichia coli[J]. Food Industry Science and Technology,2023,44(22):152−159.] JIANG F L, LU Y H, HE Q. Bidirectional regulation of tea polyphenols on the growth of Lactobacillus plantarum, Staphylococcus aureus and Escherichia coli[J]. Food Industry Science and Technology, 2023, 44(22): 152−159.
[37] DAN S, SHAOTONG M, XIANGFEI L, et al. Effect of lactobacillus with feruloyl esterase-producing ability on dextran sodium sulfate-induced ulcerative colitis in mice[J]. Journal of Agricultural and Food Chemistry, 2022, 70(47):14817−14830.
-
期刊类型引用(0)
其他类型引用(2)





 下载:
下载:
 下载:
下载:



