Purification and Structural Analysis of Anthocyanins from Black Wolfberry and Mulberry
-
摘要: 为研究富集、纯化黑枸杞和桑葚中花色苷的有效方法,以及鉴定花色苷结构。采用大孔树脂对黑枸杞和桑葚提取物进行纯化。比较了不同种类的大孔树脂对花色苷的吸附和解吸能力,筛选出LX-20SS大孔树脂为纯化黑枸杞花色苷的最佳树脂,纯化条件为:大孔树脂与黑枸杞花色苷粗粉的质量比为10:1、乙醇洗脱浓度为70%、洗脱流速为3 mL/min,纯化后花色苷含量为144.18±3.40 mg/g。选用DM-21大孔树脂为纯化桑葚花色苷的大孔树脂,纯化条件为:大孔树脂与桑葚花色苷粗粉的质量比为20:3、乙醇洗脱浓度为30%、洗脱流速为1 mL/min,纯化后花色苷含量为112.44±2.24 mg/g。高效液相色谱与质谱联用分析黑枸杞与桑葚中花色苷的结构显示,黑枸杞中主要含有的花色苷为矮牵牛色素-3-O-芸香糖(香豆酰基)-5-O-葡萄糖苷,占总花色苷比例的95%以上。桑葚中花色苷主要有两种,分别为矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷,分别占总花色苷的63.58%和36.42%,为黑枸杞和桑葚的应用提供参考。Abstract: In order to study the effective method of the enrichment and purification of anthocyanin in black wolfberry and mulberry, and identify the structure of anthocyanin, the black wolfberry and mulberry extracts were purified by macroporous resins. The adsorption and desorption abilities of different types of the resins for anthocyanins were compared. LX-20SS was optimized as the resin for the purification of anthocyanins from black wolfberry. The purification conditions were as follows: The mass ratio of resin to crude anthocyanin powder of black wolfberry was at 10:1, and the elution concentration of ethanol was 70%, and the flow rate was 3 mL/min. After the purification, the content of anthocyanin reached 144.18±3.40 mg/g. DM-21 was optimized as the resin for the purification of mulberry anthocyanin. The purification conditions were as follows: The mass ratio of resin to crude anthocyanin powder of mulberry was at 20:3, and the elution concentration of ethanol was 30%, and the flow rate was 1 mL/min. The content of anthocyanin reached 112.44±2.24 mg/g after purification. High performance liquid chromatography tandem mass spectrometry (HPLC-MS/MS) analysis for anthocyanin structures in black wolfberry and mulberry showed that the main anthocyanin in black wolfberry was petunidin-3-O-rutinose (p-coumaroyl)-5-O-glucoside, which accounted for more than 95% of the total anthocyanin. In addition, there are two main types of anthocyanins in mulberry, corresponding to cyanidin-3-glucoside and cyanidin-3-rutinoside, which accounted for 63.58% and 36.42% of the total anthocyanins respectively. The results provided references for the development of black wolfberry and mulberry.
-
Keywords:
- black wolfberry /
- mulberry /
- anthocyanin /
- purification /
- structural identification
-
黑枸杞(Lycium ruthenicum)为茄科,枸杞属多棘刺灌木。黑枸杞成熟的浆果呈黑色,花色苷含量丰富,在民间被誉为“花青素之王”[1]。桑葚(Morus nigra)又称桑椹、桑果等,是桑科桑属植物桑树的果实,内含丰富的花青素,花色苷含量是蓝莓的二倍[2]。但是黑枸杞和桑葚鲜果不易保存,干果应用范围有限,因此可用来做花色苷的提取原料。根据报道,黑枸杞发现的花色苷主要有:锦葵色素-3-O-(6-O-对香豆酰-3-O-乙酰)-5-O-二葡萄糖苷、矮牵牛素-3-O-(6-O-对香豆酰)芸香糖苷-5-O-葡萄糖苷、以及锦葵色素-3,5-二葡萄糖苷[3]。桑葚中含有的花色苷主要为矢车菊素-3-葡萄糖苷和矢车菊-3-芸香糖苷[4]。花色苷属于多酚类化合物,是一种天然的植物色素,广泛存在于自然界不同的植物中,使植物呈现出红、蓝、紫等不同颜色[5]。花色苷具有多种生理功能,如抗氧化[6−7]、抗炎症[8−9]、抗癌症[10−11]、降低血脂降血糖[12−13]、保护神经[14−15]、保护心脑血管[16]、减少脂肪生成[17]等功能。由于花色苷具有在不同环境下呈现出不同颜色的特性,以及花色苷有益于健康的生理功能,花色苷被广泛用于食品[18]、保健品[19]、化妆品[20]中,花色苷的研究吸引了众多学者的目光。
目前市面上销售的花色苷多为粗提物,其提取方法常采用溶剂提取法、超声辅助提取法、微波辅助提取法,以及连续逆流提取方法等。张琼月等[21]用连续逆流提取方法提取紫薯中的花色苷,与最适条件下的超声波提取试验比较,花色苷提取量提高了1.2倍。栾连军等[22]采用多级动态罐组式逆流提取葡萄籽中的原花青素,与单罐提取相比提取时间降低33%,溶剂消耗量降低75%。由此可见,将连续逆流提取运用到工业提取中能够在一定程度上降低生产成本,提高收益。但是这些方法提取的花色苷通常含有大量杂质、纯度较低[23],应用受到限制,因此需要对花色苷粗品纯化的有效方法进行研究,并对得到的较高纯度花色苷结构进行确定,增强高纯度花色苷在食品、药品以及化妆品中的应用。
树脂吸附柱层析是用于分离纯化粗产物的一种重要方法。Xue等[24]采用大孔树脂和Sephadex LH-20相结合的方法分离纯化蓝莓中的花色苷,花色苷纯度从4.58%提高到90.96%。王丹阳[25]利用大孔树脂AB-8纯化葡萄籽中的原花色苷,使花色苷纯度从41.62%提升至77.34%,之后采用Sephadex LH-20对粗提物进一步纯化,使花色苷纯度高达90.53%。大孔树脂纯化方法具有操作简便、纯化效率高的特点,本论文采用大孔树脂对连续逆流提取得到的黑枸杞和桑葚花色苷粗品进行纯化研究,并对纯化得到的花色苷中主要成分进行定性分析,为黑枸杞和桑葚花色苷纯化,结构分析等应用基础提供科学参考。
1. 材料与方法
1.1 材料与仪器
黑枸杞果干 产自宁夏中卫;桑葚果干 产自山东潍坊;甲酸 色谱纯,百灵威公司;乙腈 色谱纯,美国TEDIA有限公司;LX-20SS大孔树脂、LX-32大孔吸附树脂 西安蓝晓科技新材料股份有限公司;AB-8大孔吸附树脂 上海麦克林生化科技有限公司;DM-21大孔吸附树脂、LK-66大孔吸附树脂 艾美科健中国生物有限公司;其他试剂 均为分析纯国药公司。
752-N型紫外可见分光光度计 上海菁华科技仪器有限公司;CH-200U型CDEETAH II纯化系统(含蠕动泵和紫外可见检测器) 天津博纳艾杰尔科技有限公司;1260高效液相色谱仪、6460三重四级杆质谱 美国安捷伦公司;BSA-124S万分之一天平、PB-10 pH计 赛多利斯科学仪器有限公司。
1.2 实验方法
1.2.1 黑枸杞和桑葚花色苷提取方法
将黑枸杞、桑葚果干粉碎成粉末,过筛(60目),分别取3 g果粉等量放入a、b、c三个离心管中,在室温下,向a离心管中加入10 mL纯水,在80 r/min条件下搅拌提取2 min后,离心(4000 r/min),将上清液倒入b离心管中,相同条件下搅拌提取2 min后,离心,再将上清液倒入c离心管中,搅拌提取2 min后,离心。再向a离心管重新注入纯水,按之前的操作步骤重复三次,将三次的提取液合并。将提取液冷冻干燥成花色苷粗粉,备用。
1.2.2 花色苷大孔树脂纯化方法
为了提高花色苷纯度,利用大孔树脂对花色苷进行纯化。选择纯化花色苷常用的AB-8大孔树脂、LX-20SS大孔树脂、DM-21大孔树脂、LX-32大孔树脂,采用吸附量、洗脱量以及解吸率等指标对大孔树脂纯化效果进行评价,筛选出适用的大孔树脂。
1.2.2.1 大孔树脂的预处理
将大孔树脂置于乙醇中浸泡24 h,待大孔树脂完全膨胀后,用纯水清洗大孔树脂至无乙醇残留。将大孔树脂转移至5%盐酸中浸泡24 h,随后用纯水清洗至中性。再次将大孔树脂转移至50 g/L氢氧化钠中浸泡24 h,最后用纯水清洗至中性备用。
树脂含水量计算:取2 g经过处理的大孔树脂,在烘箱中干燥24 h,计算含水量。
1.2.2.2 大孔树脂的吸附
分别取1 g处理后的大孔树脂于棕色碘量瓶中,加入50 mL花色苷提取液(0.5 g黑枸杞冻干粉溶于50 mL水中,2 g桑葚粉溶于50 mL水中),用pH示差法测定其中花色苷的含量[26]。将该碘量瓶放置于25 ℃的摇床中120 r/min晃动1 h后过滤,测定滤液中的花色苷含量,计算大孔树脂吸附量。
Aa=(c0−c1)×V1/W (1) 式中:Aa为吸附量,mg/g;c0为溶液中吸附前花色苷浓度,mg/mL;c1为溶液中吸附后花色苷浓度,mg/mL;V1为吸附液体积,mL;W为树脂干质量,g。
1.2.2.3 大孔树脂的洗脱
向过滤后吸附饱和的大孔树脂中加入50 mL浓度为70%的乙醇溶液,混匀后,放置于摇床中120 r/min处理1 h,用pH示差法测定处理后溶液的花色苷含量,按公式(2)计算解吸量。
Bd=c2V2/W (2) 式中:Bd为解吸量,mg/g;c2为洗脱液中花色苷浓度,mg/mL;V2为洗脱液体积,mL;W为树脂干质量,g。
1.2.2.4 大孔树脂解吸率的计算
测定得到大孔树脂的吸附量和解吸量后,按公式(3)计算解吸率。
解吸率(%)=BdAa×100 (3) 式中:Aa为吸附量,mg/g;Bd为解吸量,mg/g。
1.2.3 纯化动态试验
称取20 g预处理的大孔树脂填装入柱,将该填充柱装入纯化系统。称取一定量上述花色苷冻干粉溶于100 mL水中,通过单因素分析方法分别探究不同浓度乙醇洗脱(对于黑枸杞样品,固定溶液流速为3 mL/min,固定载样量为2 g,分别以50%,60%,70%,80%,90%的乙醇进行洗脱;对于桑葚样品,固定溶液流速为10 mL/min,固定载样量为2 g,分别以以10%、20%、30%、40%、50%的乙醇进行洗脱);不同质量的花色苷粉末上样(对于黑枸杞样品,固定溶液流速为3 mL/min,固定洗脱浓度为70%乙醇,载样量分别为1、2 、3 g;对于桑葚样品,固定溶液流速为10 mL/min,固定洗脱浓度为30%乙醇,载样量分别为1、2 、3 、4 、5 g);以及不同洗脱流速条件下花色苷的纯化效果(对于黑枸杞样品,固定洗脱浓度为70%乙醇,固定载样量为2 g,分别设置洗脱流速为1 、3 、5 、7 mL/min;对于桑葚样品,固定洗脱浓度为30%乙醇,固定载样量为2 g,分别设置洗脱流速为1、2 、3、4、5 mL/min)。收集吸光度大于0.05的洗脱液,测定其中的花色苷含量。进行3次重复试验后,取平均值,按公式(4)计算纯化得率。
纯化得率(%)=cVm×100 (4) 式中:c为洗脱液中花色苷浓度,mg/mL;V为洗脱液体积,mL;m为花色苷粉末质量,mg。
1.2.4 花色苷总含量测定方法
pH1.0缓冲溶液:将0.2 mol/L盐酸、纯水和0.2 mol/L氯化钾水溶液以体积比97:53:50混合均匀,静置备用;pH4.5缓冲溶液:称取19.294 g无水乙酸钠,加入至24 mL醋酸中,随后加入纯水定容至500 mL,静置备用。
纯化前、纯化后的提取液经离心后分别取100 μL上清液,分别加入两种缓冲溶液至10 mL,置于40 ℃的水浴锅中进行反应,pH1.0的缓冲溶液反应时间为30 min,pH4.5的缓冲溶液反应时间为20 min。分别在最大吸收波长和700 nm处,检测上述两种缓冲液的吸光度,计算其中的花色苷含量。计算花色苷含量的公式如下所示[27]。
X=ΔAVFMεm×1 (5) 式中:X为黑枸杞中花色苷的含量,mg/g;△A=(Amax nm pH1.0-A700nm pH1.0)-(Amax nm pH4.5-A700nm pH4.5);V为加入溶液的体积,mL;F为稀释倍数;M为矢车菊素-3-葡萄糖苷的相对分子质量,449.2 g/mol;1为光程1 cm;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数,26900 L·mol−1·cm−1;m为样品质量,g。
1.2.5 花色苷定性分析液相色谱串联质谱条件
色谱条件[28]进一步优化为:C18色谱柱(150 mm×4.6 mm,5 μm);检测波长:530 nm;流速:0.4 mL/min;进样量:10 µL;流动相:1%甲酸水溶液(A);乙腈溶液(B)。黑枸杞梯度洗脱程序:0~35 min,10%~25% B;35~45 min,25%~40% B;45~46 min,40%~10% B;46~50 min,10%~10% B。桑葚梯度洗脱程序:0~45 min,5%~14% B;45~48 min,14%~40% B;48~50 min,40%~5% B。质谱条件[29]优化后确定为:ESI离子源,Product模式,正离子模式下进行扫描,扫描范围为m/z=50~1100。离子源氮气温度为350 ℃,流速为8 L/min;离子源喷雾电压为45 psi;鞘气温度400 ℃,鞘气流速为12 L/min。毛细管电压+4000 V;喷嘴电压500 V,用于花色苷定性分析。
1.3 数据处理
数据采用SPSS软件计算标准差,进行方差分析和LSD多重比较分析。对于方差分析,P<0.05表示差异显著,P>0.05表示差异不显著。使用Origin软件进行绘图。
2. 结果与分析
2.1 大孔树脂筛选
不同大孔树脂对黑枸杞花色苷吸附洗脱性能见表1。不同大孔树脂吸附洗脱性能不同的原因主要是受到花色苷的分子特性、树脂的结构、比表面积和极性等因素的影响。本研究中,大孔树脂极性的影响最为显著,吸附量最高的为AB-8大孔树脂和LX-32大孔树脂,吸附量低的为LX-20SS大孔树脂和LK-66大孔树脂,这是由于花色苷含有多个羟基,分子极性较强,容易与极性较强的大孔树脂结合。但AB-8大孔树脂和LX-32大孔树脂吸附饱和后相比于LX-20SS大孔树脂花色苷难以洗脱,解吸量降低,说明AB-8大孔树脂和LX-32大孔树脂两种树脂与花色苷之间相互作用过强,较难被流动相洗脱,因此不宜采用这两种树脂纯化黑枸杞花色苷。可以采用LK-66大孔树脂和LX-20SS大孔树脂对黑枸杞花色苷进行纯化,对于这两种树脂,在解吸率相差不大的条件下,选择吸附量较大的LX-20SS大孔树脂,应用于后续研究。
表 1 不同大孔树脂对黑枸杞花色苷吸附和洗脱性能的比较Table 1. Comparison of absorption and desorption capabilities of different macroporous resins to black wolfberry anthocyanins树脂类型 极性 比表面积 吸附量(mg/g) 解吸量(mg/g) 解吸率(%) LX-20SS 弱极性 500~600 m2/g 20.96 16.10 76.81 LK-66 弱极性 ≥700 m2/g 18.68 15.39 82.39 LX-32 中极性 ≥1000 m2/g 22.55 12.81 56.81 AB-8 中极性 480~520 m2/g 26.06 10.78 41.37 桑葚中的花色苷与黑枸杞中的花色苷种类不同,化合物分子结构存在差异,因此对桑葚花色苷纯化树脂进行筛选。不同大孔树脂对桑葚花色苷吸附洗脱性能见表2。根据解吸量和解吸率的数据可知,DM-21大孔树脂解吸量和解吸率与其他树脂相比都达到了最高值,这与DM-21树脂较大的比表面积以及适合的极性密切相关,可以选择该树脂对桑葚花色苷进行纯化。
表 2 不同大孔树脂对桑葚花色苷吸附和洗脱性能的比较Table 2. Comparison of absorption and desorption capabilities of different macroporous resins to mulberry anthocyanins树脂类型 极性 比表面积 吸附量
(mg/g)解吸量
(mg/g)解吸率
(%)DM-21 弱极性 ≥1000 m2/g 10.20 6.41 62.84 LX-32 中极性 ≥1000 m2/g 9.94 6.16 61.97 LK66 弱极性 ≥700 m2/g 10.69 3.69 34.52 AB-8 中极性 480~520 m2/g 13.23 5.46 41.27 2.2 树脂纯化黑枸杞花色苷分析结果
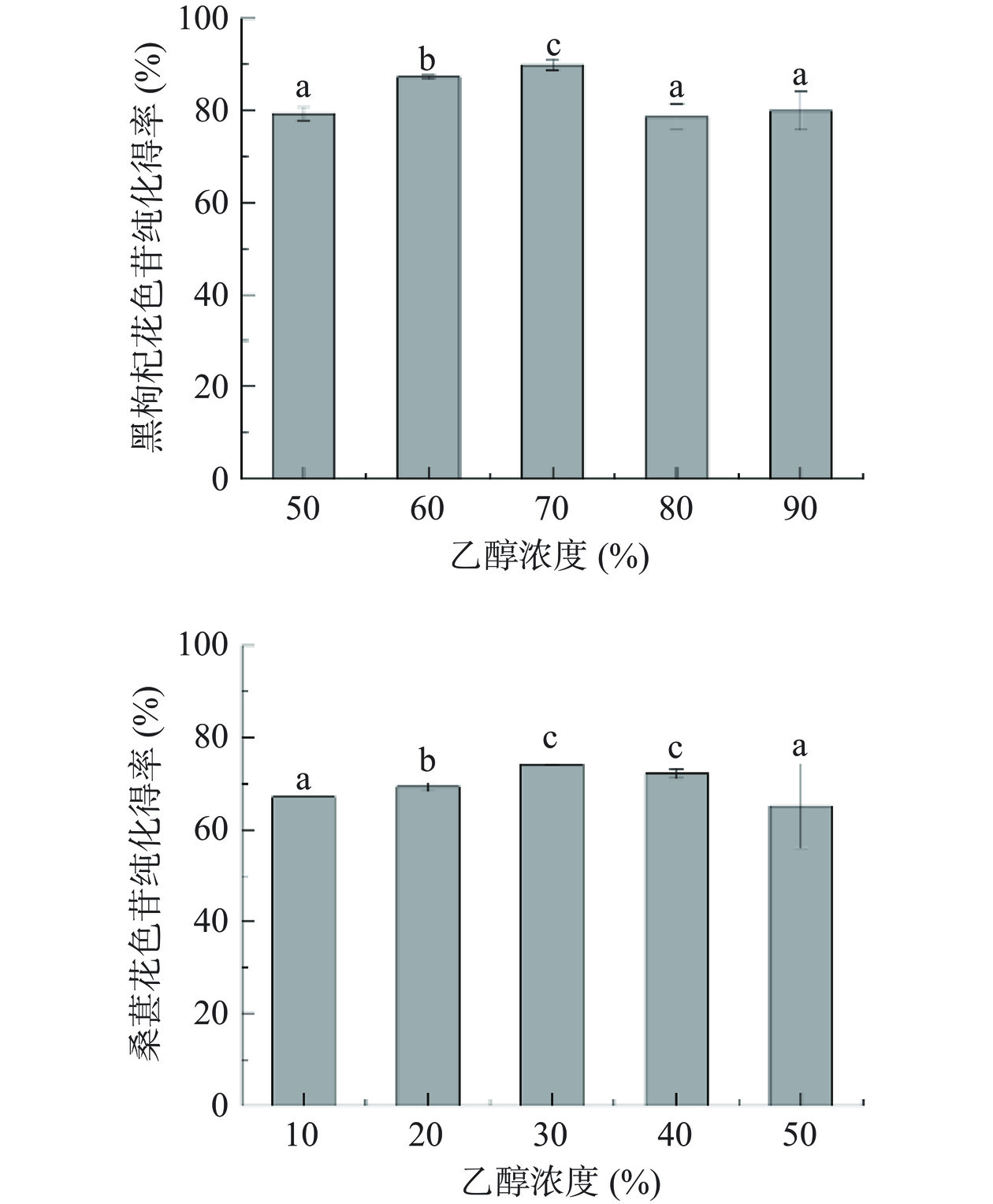
通过对洗脱液组成、载样量、洗脱流速进行优化,优化出纯化花色苷的方法。由图1乙醇浓度对大孔树脂洗脱性能分析可知,花色苷的纯化得率随洗脱剂乙醇浓度的增加呈先上升后下降的趋势,当乙醇浓度为70%时,黑枸杞中花色苷纯化得率达到最大值,相比于其他乙醇洗脱浓度具有显著性差异(P<0.05)。乙醇浓度为 30% 或 40% 时,桑葚中花色苷纯化得率相近(P>0.05),该条件下的纯化得率相比于其他乙醇洗脱浓度条件下的纯化得率更高,且具有显著性差异(P<0.05),因此,考虑到实用性选择30%乙醇作为洗脱剂。洗脱液的极性和花色苷的极性密切相关,当二者极性相近时,根据相似相溶的原则,花色苷更容易被洗脱下来。随着乙醇浓度发生变化,洗脱液的极性也发生变化,当乙醇浓度为70%时,洗脱液的极性与黑枸杞花色苷的极性更接近。而此时LX-20SS大孔树脂为弱极性,黑枸杞花色苷能更好的与乙醇相溶,从而被洗脱下来,达到与其他杂质分离开来的效果。当乙醇浓度为30%时,洗脱液的极性与桑葚花色苷的极性更接近,且DM-21大孔树脂呈弱极性,因此,同样能较好地被洗脱下来。
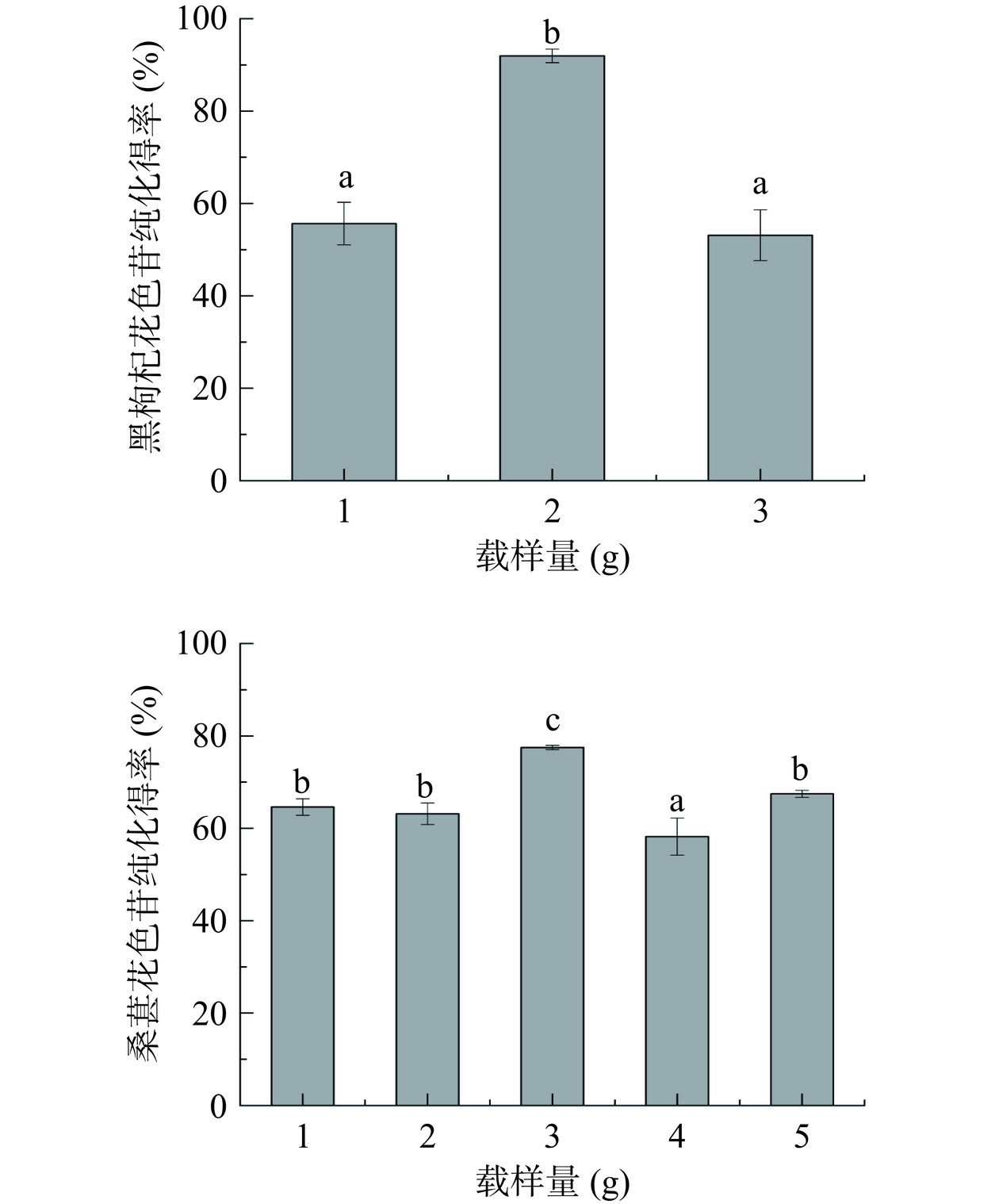
由图2树脂最佳载样量分析,可以看出载样量的增加使LX-20SS大孔树脂、DM-21大孔树脂分别对黑枸杞花色苷的纯化得率、桑葚花色苷的纯化得率呈现先上升后下降的趋势。当载样量为2 g时,黑枸杞花色苷纯化得率达到最大值,与载样量为1 g和3 g时相比有显著性差异(P<0.05)。桑葚花色苷载样量为3 g时,花色苷纯化得率达到最大值,与其他载样量相比有显著性差异(P<0.05)。增加或减少载样量均会影响大孔树脂的吸附能力。当花色苷载样量较少时,大孔树脂吸附部分花色苷,难以被乙醇洗脱下来,从而降低了纯化得率;当载样量较高时,树脂吸附过载,在水洗除杂过程中花色苷流出,降低了树脂的吸附效果,花色苷损失。因此黑枸杞选用2 g花色苷粗粉为最佳载样量,此时,对应的大孔树脂与样品质量比为10:1。桑葚最佳载样量为3 g,此时,对应的树脂与样品质量比为20:3。
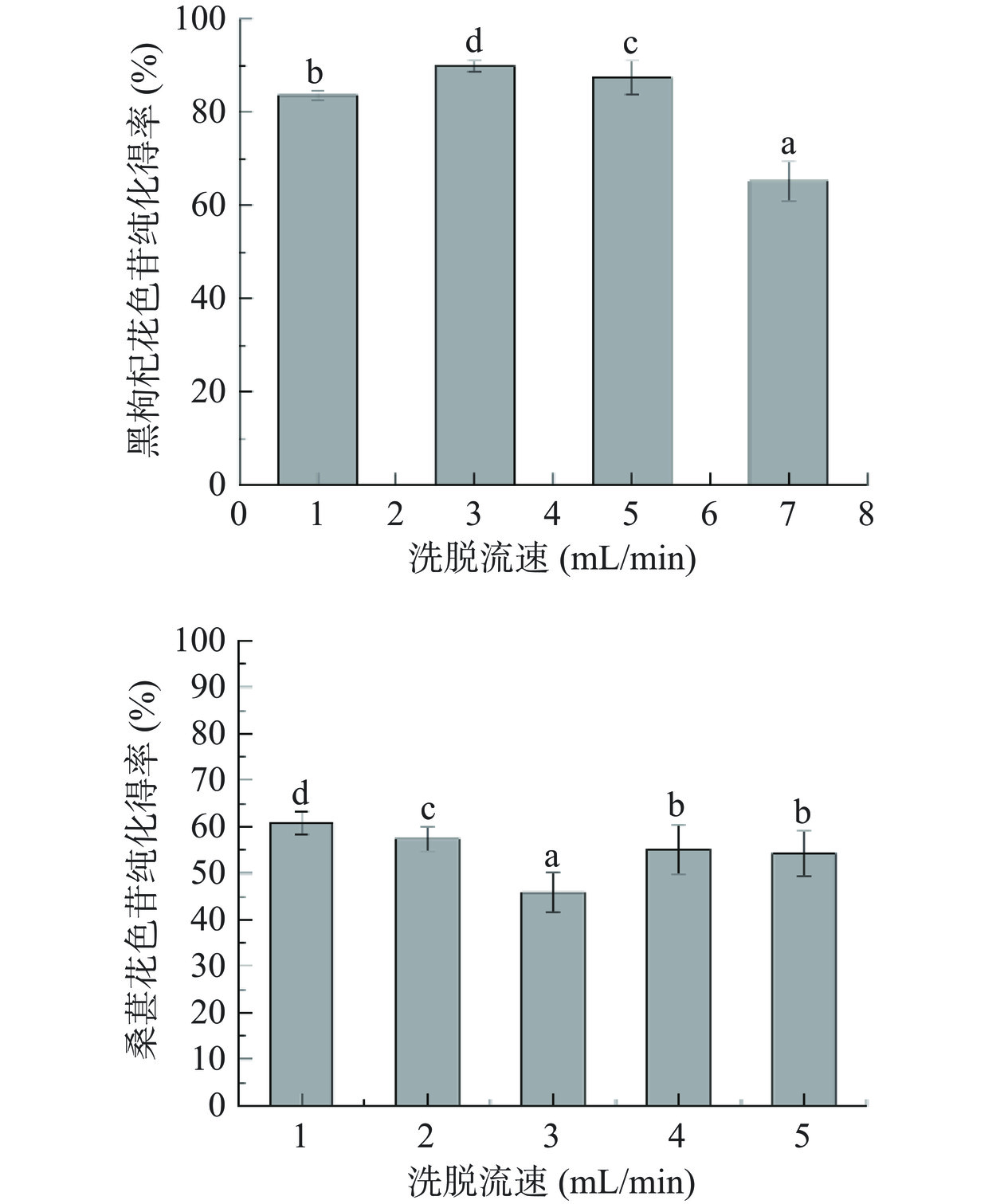
由图3洗脱流速对大孔树脂洗脱性能分析可知,洗脱流速为3 mL/min时黑枸杞花色苷纯化得率最高,与其他洗脱流速相比有显著性差异(P<0.05)。洗脱流速为1 mL/min时,桑葚花色苷纯化得率最高,与其他洗脱流速相比有显著性差异(P<0.05)。这可能是由于洗脱剂流速过慢时,会导致花色苷的解吸时间较长,花色苷冻干粉中的糖等物质易造成树脂的损耗量增加,不利于花色苷的有效分离。当两种花色苷被更快的流速洗脱时,饱和的大孔树脂与洗脱液接触时间变短,洗脱液不能进入树脂内部充分溶解,花色苷不能被全部洗脱到洗脱液里,造成花色苷的洗脱率下降。因此选择合适的流速洗脱有助于提高花色苷的得率。
2.3 纯化前后对比
纯化前后花色苷含量对比见表3,分析可知,经LX-20SS大孔树脂纯化后,黑枸杞花色苷粉末中花色苷含量提高10倍左右;经DM-21大孔树脂纯化后,桑葚花色苷粉末中花色苷含量提高24倍左右。说明LX-20SS和DM-21两种大孔树脂能有效的富集纯化花色苷,纯化得到的花色苷粉末大大提高了花色苷的含量。
表 3 纯化前后花色苷含量对比(n=3)Table 3. Comparison of anthocyanin content before and after purification (n=3)物料 纯化前花色苷含量(mg/g) 纯化后花色苷含量(mg/g) 黑枸杞 14.14±0.35 144.18±3.40 桑葚 4.61±0.13 112.44±2.24 2.4 HPLC-DAD-MS/MS结果分析
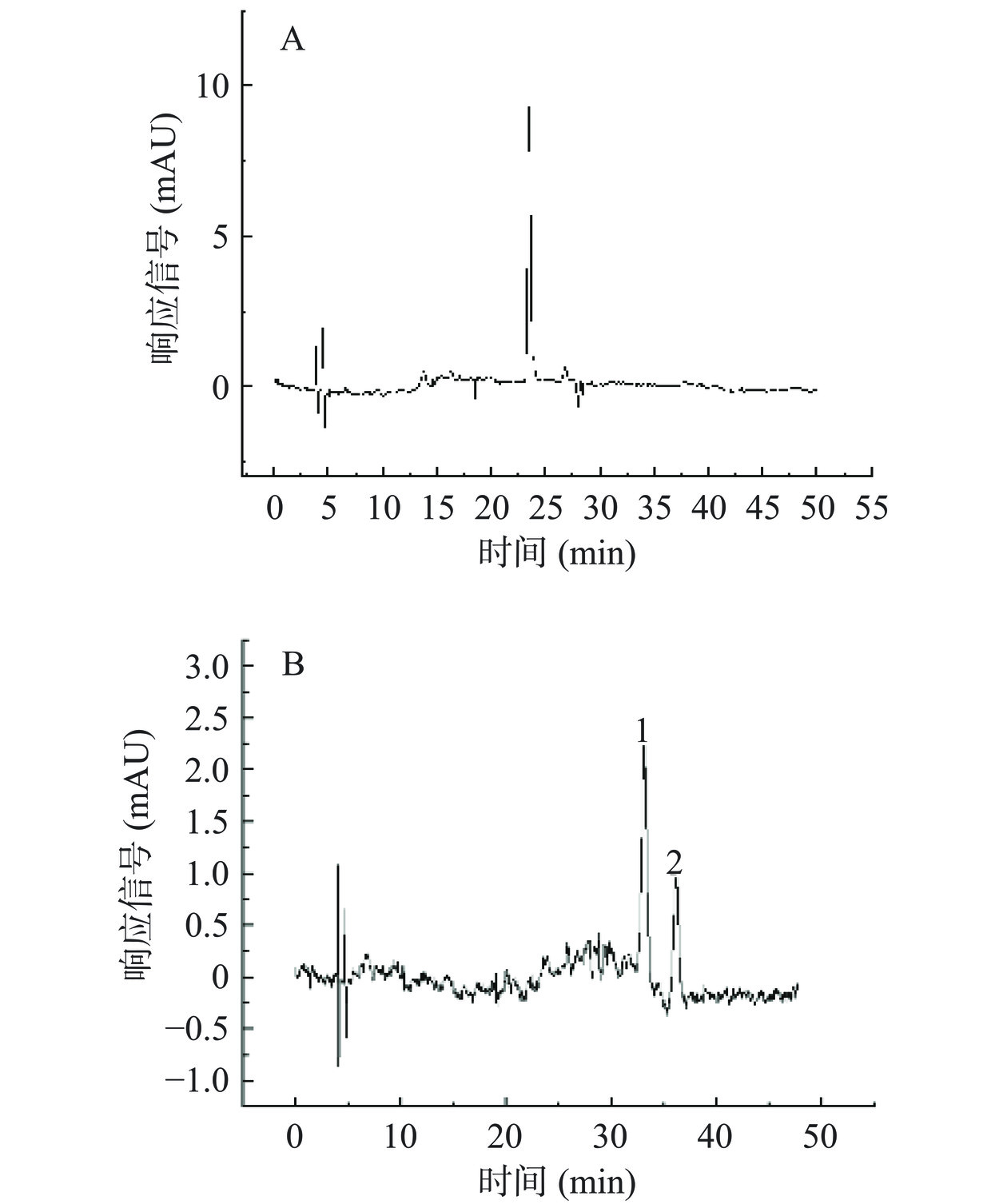
纯化得到的黑枸杞和桑葚花色苷,经HPLC-DAD-MS/MS分析,结果如图4所示。黑枸杞纯化后花色苷粉末中主要包含一种花色苷,通过峰面积判断花色苷含量占比大于95%。桑葚纯化后花色苷粉末中主要含有两种花色苷,通过峰面积比例判断,峰1占总花色苷含量的63.58%,峰2占总花色苷含量的36.42%。
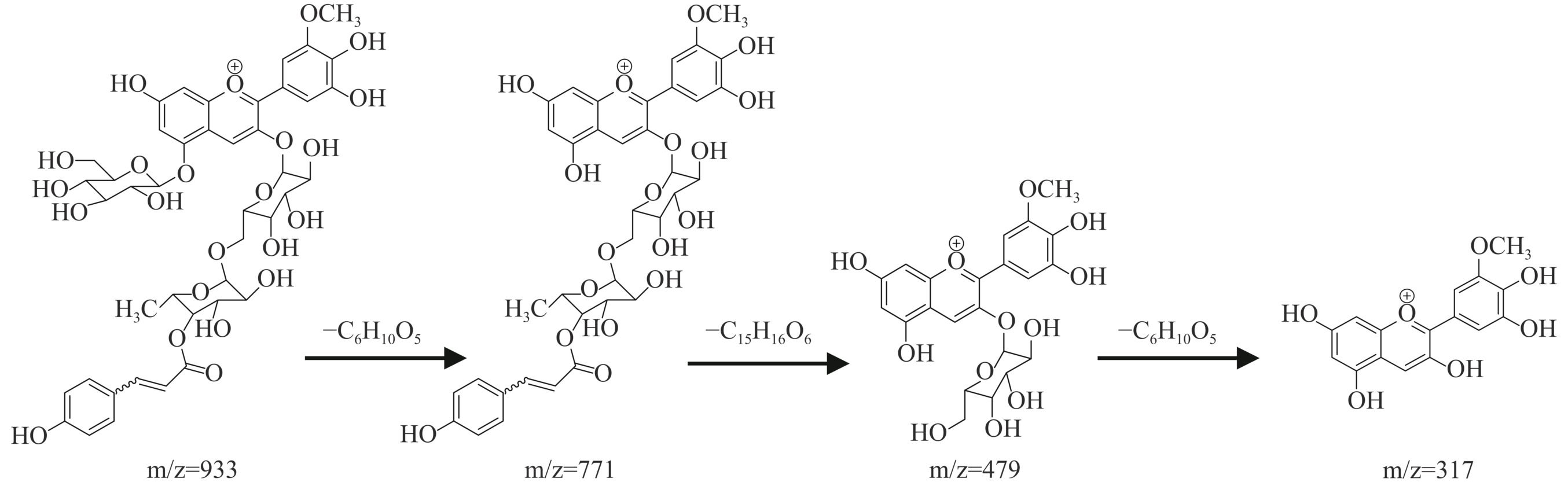
通过质谱对黑枸杞和桑葚花色苷中各色谱峰进行定性分析,其质谱碎裂离子数据见表4所示,通过该表数据可以推导出黑枸杞花色苷的碎裂规律,如图5所示黑枸杞中的花色苷(准)分子离子峰为m/z=933;在二级质谱中黑枸杞花色苷母离子脱去一分子葡萄糖残基时,得到碎片离子m/z=771;再脱去一分子香豆酰鼠李糖残基后,会得到碎片离子m/z=479;再脱除一分子葡萄糖残基,得到矮牵牛花色素正离子(m/z=317)。该碎裂规律可以定性分析出黑枸杞中的花色苷为矮牵牛色素-3-O-芸香糖(香豆酰基)-5-O-葡萄糖苷。
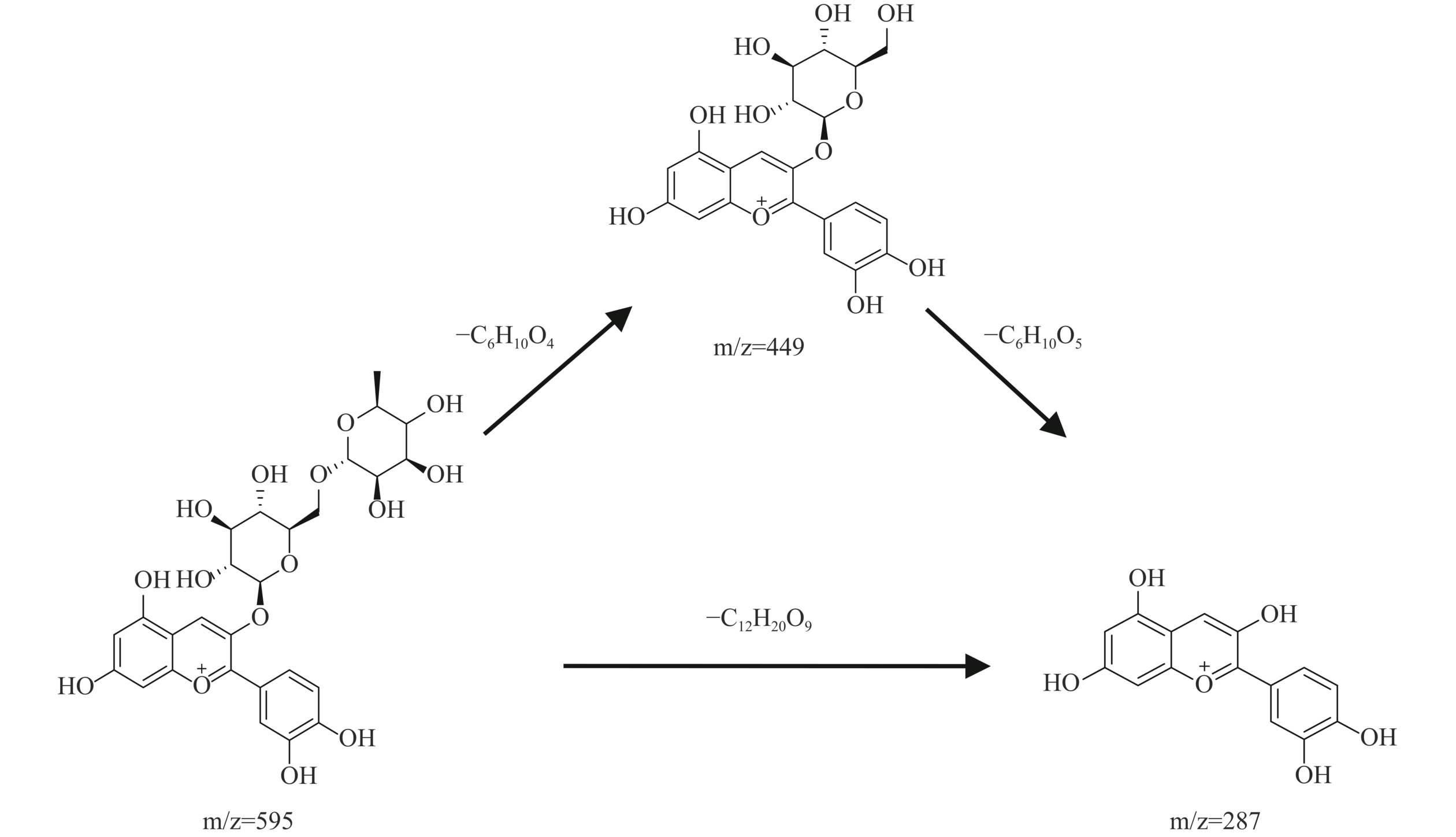
表 4 花色苷的分子离子和碎片离子的质谱数据Table 4. Mass spectrometric data of molecular and fragment ions of anthocyanins化合物 母离子(m/z) 碎片离子(m/z) 碰撞能量(V) 裂解电压(V) 黑枸杞花色苷 933 771,479,317 25 135 桑葚花色苷峰1 449 287 10 135 桑葚花色苷峰2 595 449,287 15 135 通过表4数据可以推导出桑葚花色苷的碎裂规律,如图6所示桑葚中花色苷单体峰1的(准)分子离子峰为m/z=449,在二级质谱中脱去一分子葡萄糖残基时,得到矢车菊色素正离子m/z=287。桑葚中花色苷单体峰2的(准)分子离子峰为m/z=595,在二级质谱中失去一分子鼠李糖残基,得到碎片离子m/z=449,再失去一分子葡萄糖残基得到矢车菊素正离子m/z=287。该碎裂规律可以定性分析出桑葚中峰1为矢车菊素-3-葡萄糖苷,峰2为矢车菊-3-芸香糖苷。
由二级质谱的碎裂规律判断出纯化后黑枸杞中的花色苷主要是矮牵牛色素-3-O-芸香糖(香豆酰基)-5-O-葡萄糖苷,纯化后桑葚中的花色苷主要是由矢车菊素-3-葡萄糖苷和矢车菊-3-芸香糖苷组成。
3. 结论
通过研究表明,LX-20SS大孔树脂和DM-21大孔树脂分别对黑枸杞和桑葚花色苷具有良好的分离纯化效果。LX-20SS大孔树脂对黑枸杞花色苷纯化后得到的粉末中花色苷含量达到144.18±3.40 mg/g。DM-21大孔树脂对桑葚花色苷纯化后得到的粉末中花色苷含量达到112.44±2.24 mg/g。通过高效液相色谱与质谱连用分析表明,黑枸杞中主要含有一种花色苷,为矮牵牛色素-3-O-芸香糖(香豆酰基)-5-O-葡萄糖苷,花色苷含量占比大于95%。桑葚中主要含有两种花色苷,分别为矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷,矢车菊素-3-葡萄糖苷占总花色苷的63.58%,矢车菊素-3-芸香糖苷占总花色苷的36.42%,为黑枸杞和桑葚花色苷的应用、开发提供了科学参考。
-
表 1 不同大孔树脂对黑枸杞花色苷吸附和洗脱性能的比较
Table 1 Comparison of absorption and desorption capabilities of different macroporous resins to black wolfberry anthocyanins
树脂类型 极性 比表面积 吸附量(mg/g) 解吸量(mg/g) 解吸率(%) LX-20SS 弱极性 500~600 m2/g 20.96 16.10 76.81 LK-66 弱极性 ≥700 m2/g 18.68 15.39 82.39 LX-32 中极性 ≥1000 m2/g 22.55 12.81 56.81 AB-8 中极性 480~520 m2/g 26.06 10.78 41.37 表 2 不同大孔树脂对桑葚花色苷吸附和洗脱性能的比较
Table 2 Comparison of absorption and desorption capabilities of different macroporous resins to mulberry anthocyanins
树脂类型 极性 比表面积 吸附量
(mg/g)解吸量
(mg/g)解吸率
(%)DM-21 弱极性 ≥1000 m2/g 10.20 6.41 62.84 LX-32 中极性 ≥1000 m2/g 9.94 6.16 61.97 LK66 弱极性 ≥700 m2/g 10.69 3.69 34.52 AB-8 中极性 480~520 m2/g 13.23 5.46 41.27 表 3 纯化前后花色苷含量对比(n=3)
Table 3 Comparison of anthocyanin content before and after purification (n=3)
物料 纯化前花色苷含量(mg/g) 纯化后花色苷含量(mg/g) 黑枸杞 14.14±0.35 144.18±3.40 桑葚 4.61±0.13 112.44±2.24 表 4 花色苷的分子离子和碎片离子的质谱数据
Table 4 Mass spectrometric data of molecular and fragment ions of anthocyanins
化合物 母离子(m/z) 碎片离子(m/z) 碰撞能量(V) 裂解电压(V) 黑枸杞花色苷 933 771,479,317 25 135 桑葚花色苷峰1 449 287 10 135 桑葚花色苷峰2 595 449,287 15 135 -
[1] 艾则孜江·艾尔肯, 滕亮, 刘梦, 等. 黑果枸杞的花青素成分和药理作用研究进展[J]. 西北药学杂志,2021,36(1):170−173. [AIERKEN A, TENG L, LIU M, et al. Research process on components and pharmacological action of anthocyanin in Lycium ruthenicum. Murray[J]. Northwest Pharmaceutical Journal,2021,36(1):170−173.] AIERKEN A, TENG L, LIU M, et al. Research process on components and pharmacological action of anthocyanin in Lycium ruthenicum. Murray[J]. Northwest Pharmaceutical Journal, 2021, 36(1): 170−173.
[2] 栾琳琳. 桑葚果渣花青素的提取及稳定性研究[D]. 贵阳:贵州大学, 2020. [LUAN L L. Study on the extraction and stability of anthocyanins from mulberry pomace[D]. Guiyang:Guizhou University, 2020.] LUAN L L. Study on the extraction and stability of anthocyanins from mulberry pomace[D]. Guiyang: Guizhou University, 2020.
[3] 谭亮, 董琦, 曹静亚, 等. 黑果枸杞中花色苷的提取与结构鉴定[J]. 天然产物研究与开发,2014,26(11):1797−1802, 1760. [TAN L, DONG Q, CAO J Y, et al. Extraction and identification of anthocyanins in Lycium ruthenicum Murr[J]. Natural Product Research and Development,2014,26(11):1797−1802, 1760.] TAN L, DONG Q, CAO J Y, et al. Extraction and identification of anthocyanins in Lycium ruthenicum Murr[J]. Natural Product Research and Development, 2014, 26(11): 1797−1802, 1760.
[4] 马义虔. 桑椹花色苷的提取、纯化、微胶囊化及应用[D]. 贵阳:贵州大学, 2016. [MA Y Q. Extraction, purification, microcapsulation and application of mulberry anthocyanins[D]. Guiyang:Guizhou University, 2016.] MA Y Q. Extraction, purification, microcapsulation and application of mulberry anthocyanins[D]. Guiyang: Guizhou University, 2016.
[5] VIOLETA R U N. Influence of pH on color variation and stability of cyanidin and cyanidin 3-O-beta-glucopyranoside in aqueous solution[J]. CyTA-Journal of Food,2021,19(1):174−182. doi: 10.1080/19476337.2021.1874539
[6] WANG Y W, YE Y, WANG L, et al. Antioxidant activity and subcritical water extraction of anthocyanin from raspberry process optimization by response surface methodology[J]. Food Bioscience,2021,44:101394. doi: 10.1016/j.fbio.2021.101394
[7] DZHANFEZOVA T, BARBA-ESPIN G, MULLER R, et al. Anthocyanin profile, antioxidant activity and total phenolic content of a strawberry (Fragaria×ananassa Duch) genetic resource collection[J]. Food Bioscience,2020,36:100620. doi: 10.1016/j.fbio.2020.100620
[8] MA Z L, DU B, LI J, et al. An insight into anti-inflammatory activities and inflammation related diseases of anthocyanins:A review of both in vivo and in vitro investigations[J]. International Journal of Molecular Sciences,2021,22(20):11076. doi: 10.3390/ijms222011076
[9] ZHANG L L, CHEN J, LIAO H J, et al. Anti-inflammatory effect of lipophilic grape seed proanthocyanidin in RAW 264.7 cells and a zebrafish model[J]. Journal of Functional Foods,2020,75:104217. doi: 10.1016/j.jff.2020.104217
[10] 邱兰丽, 颜梓一, 贺延苓, 等. 原花青素抗癌的生物学机制研究进展[J]. 药物生物技术,2020,27(2):173−176. [QIU L L, YAN Z Y, HE Y L, et al. Biological mechanisms of proanthocyanidins in prevention and treatment of cancers[J]. Pharmaceutical Biotechnology,2020,27(2):173−176.] QIU L L, YAN Z Y, HE Y L, et al. Biological mechanisms of proanthocyanidins in prevention and treatment of cancers[J]. Pharmaceutical Biotechnology, 2020, 27(2): 173−176.
[11] SASADHAR M. Discovery, development, and design of anthocyanins-inspired anticancer agents-A comprehensive review[J]. Anti-cancer Agents in Medicinal Chemistry,2022,22(19):3219−3238. doi: 10.2174/1871520621666211015142310
[12] CHANG J J, HSU M J, HUANG H P, et al. Mulberry anthocyanins inhibit oleic acid induced lipid accumulation by reduction of lipogenesis and promotion of hepatic lipid clearance[J]. Journal of Agricultural and Food Chemistry,2013,61(25):6069−6076. doi: 10.1021/jf401171k
[13] YAN F J, DAI G, HZHENG X D. Mulberry anthocyanin extract ameliorates insulin resistance by regulating PI3K/AKT pathway in HepG2 cells and db/db mice[J]. Journal of Nutritional Biochemistry,2016,36:68−80. doi: 10.1016/j.jnutbio.2016.07.004
[14] BHUIYAN M I H, KIM H B, KIM S Y, et al. The neuroprotective potential of cyanidin-3-glucoside fraction extracted from mulberry following oxygen-glucose deprivation[J]. Korean Journal of Physiology & Pharmacology,2011,15(6):353−361.
[15] ZHOU L H, CHANG J R, ZHAO W H, et al. Proanthocyanidins regulate the Nrf2/ARE signaling pathway and protect neurons from cypermethrin-induced oxidative stress and apoptosis[J]. Pesticide Biochemistry and Physiology,2021,177:104898. doi: 10.1016/j.pestbp.2021.104898
[16] TSUDA T. Dietary anthocyanin-rich plants:Biochemical basis and recent progress in health benefits studies[J]. Molecular Nutrition & Food Research,2012,56(1):159−170.
[17] WU T, QI X M, LIU Y, et al. Dietary supplementation with purified mulberry (Morus australis Poir) anthocyanins suppresses body weight gain in high-fat diet fed C57BL/6 mice[J]. Food Chemistry,2013,141(1):482−487. doi: 10.1016/j.foodchem.2013.03.046
[18] 刘健南, 王小博. 黑枸杞花青素抑制曲奇饼干中丙烯酰胺效果的研究[J]. 食品研究与开发,2020,41(9):146−150. [LIU J N, WANG X B. Inhibitory effect of anthocyanin from Lycium ruthenicum Murray on acrylamide in cookie[J]. Food Research And Development,2020,41(9):146−150.] LIU J N, WANG X B. Inhibitory effect of anthocyanin from Lycium ruthenicum Murray on acrylamide in cookie[J]. Food Research And Development, 2020, 41(9): 146−150.
[19] 黄涵年, 陆梦杰, 叶素丹. 蓝莓花青素保健饮品加工工艺研究[J]. 保鲜与加工,2022,22(1):56−61. [HUANG H N, LU M J, YE S D. Study on processing technology of blueberry anthocyanin health beverage[J]. Storage and Process,2022,22(1):56−61.] HUANG H N, LU M J, YE S D. Study on processing technology of blueberry anthocyanin health beverage[J]. Storage and Process, 2022, 22(1): 56−61.
[20] 胥鑫萌, 王文权, 孙洁怡, 等. 原花青素在化妆品中的应用[J]. 中国洗涤用品工业,2021(2):56−60. [XU X M, WANG W Q, SUN J Y, et al. Application of proanthocyanidins in cosmetics[J]. China Cleaning Industry,2021(2):56−60.] doi: 10.3969/j.issn.1672-2701.2021.02.006 XU X M, WANG W Q, SUN J Y, et al. Application of proanthocyanidins in cosmetics[J]. China Cleaning Industry, 2021(2): 56−60. doi: 10.3969/j.issn.1672-2701.2021.02.006
[21] 张琼月, 李冰寒, 李文辉. 运用逆流技术高效提取紫薯花青素[J]. 农产品加工,2020(15):36−41. [ZHANG Q Y, LI B H, LI W H. High efficiency extraction of anthocyanins in solanum tuberdsm by countercurrent extraction[J]. Farm Products Processing,2020(15):36−41.] ZHANG Q Y, LI B H, LI W H. High efficiency extraction of anthocyanins in solanum tuberdsm by countercurrent extraction[J]. Farm Products Processing, 2020(15): 36−41.
[22] 栾连军, 陈娜, 刘雪松, 等. 葡萄籽原花青素多级逆流提取工艺研究[J]. 中国食品学报,2010,10(5):31−36. [LUAN L J, CHEN N, LIU X S, et al. Studies on the multi-stage countercurrent extraction technology for the extraction of proanthocaynidins from grape seed[J]. Journal of Chinese Institute of Food Science and Technology,2010,10(5):31−36.] LUAN L J, CHEN N, LIU X S, et al. Studies on the multi-stage countercurrent extraction technology for the extraction of proanthocaynidins from grape seed[J]. Journal of Chinese Institute of Food Science and Technology, 2010, 10(5): 31−36.
[23] 胡金奎. 桑葚花色苷的分离制备、结构分析及其体外活性[D]. 无锡:江南大学, 2013. [[HU J K. Separation and preparation, structural analysis and in vitro acitivity of anthocyanins from mulberry fruits[D]. Wuxi:Jiangnan University, 2013.] [HU J K. Separation and preparation, structural analysis and in vitro acitivity of anthocyanins from mulberry fruits[D]. Wuxi: Jiangnan University, 2013.
[24] XUE H K, SHEN L Y, WANG X R, et al. Isolation and purification of anthocyanin from blueberry using macroporous resin combined Sephadex LH-20 techniques[J]. Food Science and Technology Research,2019,25(1):29−38.
[25] 王丹阳. 葡萄籽原花青素的分离纯化、降解及结构鉴定[D]. 哈尔滨:哈尔滨工业大学, 2019. [WANG D Y. Purification, depolymerization and inentification of proanthocyanidin from grape seed[D]. Harbin:Harbin Institute of Technology, 2013.] WANG D Y. Purification, depolymerization and inentification of proanthocyanidin from grape seed[D]. Harbin: Harbin Institute of Technology, 2013.
[26] SIGURDSON G T, GIUSTI M M. Bathochromic and hyperchromic effects of aluminum salt complexation by anthocyanins from edible sources for blue color development[J]. Journal of Agricultural and Food Chemistry,2014,62(29):6879−7322. doi: 10.1021/jf501950s
[27] 杨萍, 李哲. pH示差法与HPLC测定黑枸杞花青素方法比较[J]. 中国农机化学报,2017,38(7):74−78. [YANG P, LI Z. Comparison between pH differetial method and HPLC method for measuring anthocyanin content of black wolfberry[J]. Journal of Chinese Agricultural Mechanization,2017,38(7):74−78.] YANG P, LI Z. Comparison between pH differetial method and HPLC method for measuring anthocyanin content of black wolfberry[J]. Journal of Chinese Agricultural Mechanization, 2017, 38(7): 74−78.
[28] 中华人民共和国农业农村部. NYT2640-2014 植物源性食品中花青素的测定 高效液相色谱法[S]. 北京:中国农业出版社, 2014. [Ministry of Agriculture and Rural Affairs of the People’s Republic of China. NYT2640-2014 Determination of anthocyanidins in plant origin products-high performance liquid chromatography[S]. Beijing:China Agriculture Press, 2014.] Ministry of Agriculture and Rural Affairs of the People’s Republic of China. NYT2640-2014 Determination of anthocyanidins in plant origin products-high performance liquid chromatography[S]. Beijing: China Agriculture Press, 2014.
[29] JIN H, LIU Y, YANG F, et al. Characterization of anthocyanins in wild Lycium ruthenicum Murray by HPLC-DAD/QTOF-MS/MS[J]. Analytical Methods,2015,7(12):4947−4956. doi: 10.1039/C5AY00612K
-
期刊类型引用(11)
1. 于新海,李濛,周红昕,吴海英,姚文平. 大花卷丹的百合粗多糖提取工艺的研究与分析. 农业与技术. 2025(04): 41-44 .  百度学术
百度学术
2. 何念武,董玉珊,朱姝俣. 连翘多糖提取工艺优化及抗氧化和抑菌活性研究. 商洛学院学报. 2024(02): 59-65 .  百度学术
百度学术
3. 王鑫,周卓,遇世友,岳振歌,修伟业,马永强. 甜玉米芯多糖纳米银的合成、表征及体外活性研究. 食品工业科技. 2024(13): 58-66 .  本站查看
本站查看
4. 杨迎东,王伟东,张睿琪,冯秀丽,白一光,杨盼盼,周俐宏,李雪艳,胡新颖. 不同百合食药用功能指标检测分析. 沈阳农业大学学报. 2024(03): 276-284 .  百度学术
百度学术
5. 伍乔,范茂清. 百合的研究进展. 中国食品工业. 2024(14): 132-134 .  百度学术
百度学术
6. 陈强,王璐,徐峥嵘,罗金超,邓千千,方雨婷,李从虎,程旭. 玉米植物糖原超声辅助提取工艺优化及其生物活性评价. 食品工业科技. 2024(19): 177-186 .  本站查看
本站查看
7. 康桥,孙越,刘梦瑶,赵保龙,李贺贺,王柏文,赵东瑞,孙宝国,孙金沅. 金铃子果皮多糖超声辅助提取工艺优化及其抗氧化和降糖活性研究. 食品工业科技. 2024(21): 164-173 .  本站查看
本站查看
8. 藏颖,梁钟文,刘松,高丹,黄羽诺,李媚,刘红全. 雨生红球藻藻渣多糖提取条件优化及降血脂活性分析. 食品研究与开发. 2024(22): 102-110 .  百度学术
百度学术
9. 于武华,桂明明,何平平,邓小燕. 百合的营养价值及加工技术研究进展. 食品安全导刊. 2024(35): 186-189 .  百度学术
百度学术
10. 代琪,杨海媚,李林珍,叶俏波,罗霄,李及,叶俊龙. 不同品种百合的化学成分及药理作用研究进展. 中国药物评价. 2024(06): 459-463 .  百度学术
百度学术
11. 许梦粤,曾长立,王红波. 药食同源植物多糖提取方法、结构解析和生物活性研究进展. 食品研究与开发. 2023(19): 216-224 .  百度学术
百度学术
其他类型引用(10)





 下载:
下载:
 下载:
下载:
