Optimization of the Preparation of Lotus Seed Resistant Starch through Thermoacidophilic Type Ⅲ Pullulan Hydrolase Synergistic High-pressure Heat Treatments and Its Functional Characteristics
-
摘要: 本研究以莲子淀粉为原料,采用嗜热酸性Ⅲ型普鲁兰水解酶(TK-PUL)与压热联合制备RS3型抗性淀粉(EHP-LRS3)。通过单因素实验和响应面试验对TK-PUL与压热联合制备EHP-LRS3的工艺参数进行了优化,采用扫描电子显微镜和X-射线衍射对EHP-LRS3的形貌、晶体结构进行了观察与分析,并考察了EHP-LRS3对长双歧杆菌的促增殖能力。结果表明,在TK-PUL酶解温度为80 ℃时制备EHP-LRS3的最佳工艺为:向质量分数为35.32%的莲子淀粉乳(pH5.00)中添加25.00 U/g(莲子淀粉)的TK-PUL,将混合物于80 ℃处理12.70 h,再将其依次于121 ℃压热处理10 min、4 ℃回生处理24 h。在最佳工艺条件下,EHP-LRS3的得率为58.46%。扫描电镜分析显示EHP-LRS3呈不规则的沟壑状结构。X-射线衍射分析表明EHP-LRS3的晶体结构呈现出不同于莲子淀粉A型晶体结构的B型晶体结构。EHP-LRS3对长双歧杆菌的促增殖能力优于压热法制备的RS3型抗性淀粉(HP-LRS3)。本研究采用TK-PUL与压热联合制备得到高得率的RS3型抗性淀粉(EHP-LRS3),并验证了EHP-LRS3对长双歧杆菌的促增殖能力,为莲子淀粉的高值化利用提供了理论依据。Abstract: In this study, lotus seed starch was used as the raw material for preparing RS3 resistant starch (EHP-LRS3) through thermoacidophilic type Ⅲ pullulan hydrolase synergistic high-pressure heat treatments. The parameters for this preparation process were optimized using a single-factor experimental design and response surface methodology. The morphological and crystal structures of EHP-LRS3 were observed and analyzed using scanning electron microscopy (SEM) and X-ray diffraction (XRD), respectively, and its pro-proliferative effect on Bifidobacterium longum was investigated. According to the results, the optimal conditions for preparing EHP-LRS3 with TK-PUL enzymatic hydrolysis temperature of 80 ℃ were as follows: Treatment of 35.32% lotus seed starch slurry (pH5.00) with 25.00 U/g (lotus seed starch) TK-PUL at 80 ℃ for 12.70 h, followed by high-pressure heat treatment of the mixture at 121 ℃ for 10 min and retrogradation at 4 ℃ for 24 h. An EHP-LRS3 yield of 58.46% was achieved under these optimal conditions. The SEM analysis revealed that the prepared EHP-LRS3 possessed an irregular ravine-like structure. The XRD analysis showed that the resistant starch had a B-type crystal structure, which differed from the A-type crystal structure of lotus seed starch. The pro-proliferative effect of EHP-LRS3 on B. longum was superior to that of RS3 resistant starch prepared using high-pressure heating alone (HP-LRS3). In summary, a high EHP-LRS3 yield was obtained using both TK-PUL and high-pressure heat treatments. The superior pro-proliferative effect of EHP-LRS3 on B. longum was verified. The results provide a theoretical basis for the high-value utilization of lotus seed starch.
-
抗性淀粉(Resistant starch,RS)作为一种新型膳食纤维,不能被人体胃和小肠消化吸收,但可进入结肠中被肠道菌群发酵利用,进而发挥其降血糖、降血脂、预防心血管疾病和结肠癌等多种生理功效[1−2]。根据来源、结构、消化特性和应用的不同,RS可分为5类抗性淀粉,其中RS3型抗性淀粉对热稳定并且抗酶解能力强,是膳食中抗性淀粉的主要组成部分,具有多种生物活性[3−5]。莲子淀粉中直链淀粉含量高达42%[6−7],使得莲子淀粉较易老化回生为RS3型抗性淀粉。并且已有多个研究表明RS3型莲子抗性淀粉对多种双歧杆菌的增殖及逆环境耐受性具有较好的促进作用,其可作为新型双歧生长因子[8−11]。因此,以莲子淀粉为原料制备RS3型抗性淀粉具有重要应用价值。
RS3型抗性淀粉的制备方法包括:压热法、微波法、超声波-压热法、酶解-压热法等[3,5,12]。其中酶解-压热法结合了压热法和酶解法的优点,可以有效提高RS3型抗性淀粉的得率,已成功应用于绿豆、玉米等RS3型抗性淀粉的制备工艺中[13]。酶解-压热法制备RS3型抗性淀粉主要采用单酶(脱支酶)或双酶(α-淀粉酶和脱支酶)特异性地水解淀粉中糖苷键,增加直链淀粉的含量,从而促进淀粉回生过程中RS3型抗性淀粉结晶的形成[13−14]。α-淀粉酶作用于淀粉中α-1,4-糖苷键,改变淀粉的链长与结构;脱支酶作用于淀粉中α-1,6-糖苷键从而使淀粉水解产物中含有更多的游离直链淀粉分子;该反应体系经压热/冷却循环处理后,不同直链淀粉分子间通过氢键形成双螺旋,最后获得RS3型抗性淀粉。Zhang等[15]以玉米淀粉为原料,先后向糊化玉米淀粉乳加入α-淀粉酶和普鲁兰酶进行连续处理,制备得到抗性淀粉含量为58.87%的RS3型玉米抗性淀粉。这是目前已报道的利用双酶酶解-压热法制备RS3型抗性淀粉的最高得率。目前已报道的RS3型莲子抗性淀粉的制备方法包括:压热法、微波法、超声波-压热法等[16−17],尚未有酶解法应用于RS3型莲子抗性淀粉制备的报道。
本研究拟采用酶解-压热法制备RS3型莲子抗性淀粉,首先采用来源于Thermococcus kodakarensis的双功能嗜热酸性Ⅲ型普鲁兰水解酶TK-PUL处理莲子淀粉,然后对处理后的样品进行压热/冷却循环处理,以获得RS3型莲子抗性淀粉。TK-PUL具有α-淀粉酶和普鲁兰酶的功能[18−20],将TK-PUL应用于RS3型抗性淀粉的制备,可同时发挥α-淀粉酶和普鲁兰酶的功能,有利于提高RS3型抗性淀粉的制备效率。本研究以莲子淀粉为原料,采用酶解-压热法,在单因素实验的基础上,利用响应面法分析,确定制备RS3型抗性淀粉(EHP-LRS3)的最佳工艺条件。在此基础上,通过扫描电镜、X-射线衍射分析所制备EHP-LRS3的晶体结构,并探索EHP-LRS3对双歧杆菌的促增殖作用,从而为莲子淀粉的高值化利用和产业化开发提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
TK-PUL表达载体pNCMO2-tkpulh、短小芽孢杆菌Brevibacillus choshinensis HPD1-SP3、长双歧杆菌Bifidobacterium longum 均由本实验室保存;Ni-NTA亲和层析柱 德国QIAGEN公司;磨皮白莲 湖南忆莲堂莲业有限公司;高直链玉米淀粉HI70 北京涌悦科技有限公司;蛋白质Marker、Bradford法蛋白质定量检测试剂盒 上海碧云天生物技术有限公司;K-RSTAR抗性淀粉测定试剂盒、K-AMYL直链淀粉/支链淀粉测定试剂盒 爱尔兰Megazyme公司;α-淀粉酶Termamyl® 300L、葡萄糖淀粉酶AMG 300L™ 默克化工技术(上海)有限公司;其他试剂 均为国产分析纯。
Tanon-4100全自动数码凝胶图像分析系统 上海天能科技有限公司;UV760CRT紫外可见分光光度计 上海仪电分析仪器有限公司;CMax Plus酶标仪 日本Hitachi公司;Sigma HD型扫描电镜 德国蔡司公司;D8 ADVANCE高分辨粉末X-射线衍射仪 德国布鲁克公司。
1.2 实验方法
1.2.1 TK-PUL的重组表达与纯化
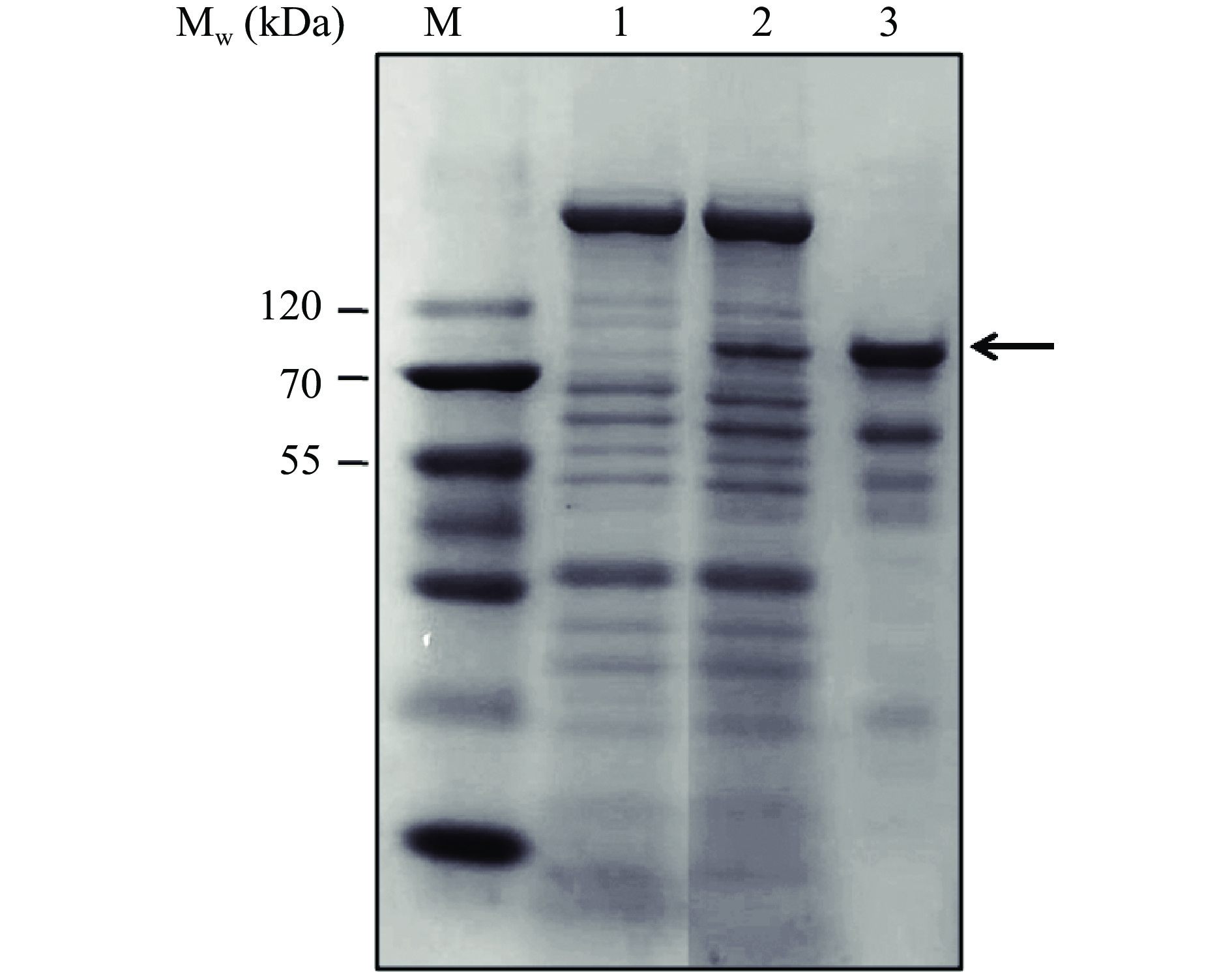
利用电转化法将重组质粒pNCMO2-tkpulh转化入B. choshinensis HPD1-SP3[21−23]。挑取转化子单克隆接种于含50 μg/mL新霉素的10 mL TM培养基中,于37 ℃培养12 h,获得种子液。取0.5 mL种子液,转接入50 mL TM培养基中进行摇瓶培养,于37 ℃、200 r/min,摇瓶发酵培养48 h。待发酵结束后,将发酵液于12000×g下离心5 min,得发酵液上清液。将发酵上清液于80 ℃保温30 min后,于12000×g离心10 min,得保温发酵上清液。采用Ni-NTA亲和层析柱纯化该上清液中目的蛋白质。利用聚丙烯酰胺凝胶电泳检测重组酶的纯度,并采用Bradford法测定重组酶的浓度[24]。
1.2.2 莲子淀粉的提取
莲子淀粉的提取参照文献[16−17]进行。取一定质量的磨皮白莲以及2倍质量的蒸馏水,于室温下浸泡过夜后,置于组织匀浆机中搅碎。将浆液过100目筛,并加入20倍蒸馏水稀释搅拌后,静置沉淀8 h。待淀粉完全沉降后弃去上清液,用蒸馏水清洗沉淀表面,再次加入20倍蒸馏水稀释搅拌后静置沉淀8 h,弃去上清液。用蒸馏水清洗沉淀表面后,将沉淀于50 ℃烘箱烘干,经粉碎并过100目筛,即得莲子淀粉(LSS)。
1.2.3 重组TK-PUL的酶活力测定
以1%(m/v)莲子淀粉为底物,参照文献[25]测定重组酶的比酶活力。即将10 μL酶液与490 μL含1%(m/v)莲子淀粉的50 mmol/L 2-吗啉乙磺酸(2-Morpholinoethanesulphonic acid,MES),pH4.5缓冲液混合,于100 ℃反应30 min后,迅速放入冰水浴中终止反应,然后采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)法[26]测定反应体系中还原糖量。酶活力单位(U)定义:在一定反应条件下,每分钟催化产生1 μmol还原糖的酶量为一个酶活力单位(U)。
1.2.4 重组TK-PUL的酶学性质测定
以1%(m/v)莲子淀粉为底物,测定重组酶的最适反应pH、pH稳定性、最适反应温度及热稳定性。重组酶的酶学性质测定参照文献[25]进行。其中最适反应pH的测定方法为,将酶液与不同pH的底物混合,于100 ℃下反应30 min测定不同pH下酶活。将所测得的最高酶活定义为100%,考察其最适反应pH。pH稳定性的测定方法为,采用不同缓冲液配制不同pH的底物:50 mmol/L MES缓冲液(pH3.0~7.0)、50 mmol/L MOPS(3-(N-Morpholino) propane-sulfonic acid,3-吗啡啉-丙磺酸)缓冲液(pH7.0~9.0)。将酶液用如上不同pH(3.0~9.0)缓冲液稀释,将其在不同pH条件下于37 ℃处理2 h,然后用最适反应pH缓冲液稀释,并根据如上反应体系测定样品的酶活。将未处理样品的酶活定义为100%,计算处理后样品的相对酶活,评价酶的pH稳定性。最适反应温度的测定方法为,采用最适反应pH缓冲液配制底物,按照1.2.3中反应体系混合酶液和底物,分别于40~110 ℃反应30 min,测定不同温度下酶活。以所测得的最高酶活定义为100%,考察酶的最适反应温度。热稳定性的测定方法为,采用最适反应pH缓冲液将样品稀释至适当浓度,将其分别于80、90、100 ℃保温,分时间梯度取出部分样品,根据1.2.3中反应体系测定酶活。将未处理的酶液的酶活定义为100%,计算样品的相对酶活,评价酶的热稳定性。
1.2.5 RS3型莲子抗性淀粉的制备与测定
将莲子淀粉用一定pH的50 mmol/L MES缓冲液配制成一定质量分数的莲子淀粉乳,向其中加入一定量的重组TK-PUL。混合物于80 ℃保温4~16 h后,将混合物于121 ℃处理10 min,随后将其置于室温下冷却,然后于4 ℃回生24 h。最后,样品于60 ℃烘干,经粉碎后过100目筛,即得RS3型莲子抗性淀粉EHP-LRS3。本实验将仅采用压热法(121 ℃、10 min以及4 ℃、24 h)处理得到的RS3型莲子抗性淀粉(HP-LRS3)作为对照。采用K-RSTAR抗性淀粉测定试剂盒测定样品中的RS3型抗性淀粉含量[26]。RS3型抗性淀粉得率的计算公式如式(1)所示。
RS3型抗性淀粉得率(%)=RS3型抗性淀粉含量×未纯化RS3型莲子抗性淀粉质量莲子淀粉质量×100 (1) 1.2.6 RS3型莲子抗性淀粉制备工艺单因素实验
以RS3型抗性淀粉得率为评价指标,在上述RS3型莲子抗性淀粉制备工艺基础上相应地改变某个因素进行单因素实验。莲子淀粉乳质量分数选取15%、20%、25%、30%、35%、40%,固定pH为5.0,TK-PUL添加量为20 U/g,TK-PUL酶解时间为12 h;pH选取4.0、4.5、5.0、5.5、6.0、6.5,固定莲子淀粉乳质量分数为35%,TK-PUL添加量为20 U/g,TK-PUL酶解时间为12 h;TK-PUL添加量选取5、10、15、20、25、30 U/g,固定莲子淀粉乳质量分数为35%,酶解pH为5.0,TK-PUL酶解时间为12 h;TK-PUL酶解时间选取为6、8、10、12、14、16 h,固定莲子淀粉乳质量分数为35%,pH为5.0,TK-PUL添加量为20 U/g。各组实验均重复3次。
1.2.7 响应面试验设计
根据单因素实验结果,采用响应面分析法(Response surface methodology,RSM)优化RS3型莲子抗性淀粉的制备工艺。选取对RS3型抗性淀粉得率影响较大的莲子淀粉乳质量分数(A)、pH(B)、TK-PUL添加量(C)和TK-PUL酶解时间(D)4个试验因素,以RS3型抗性淀粉得率为响应值进行四因素三水平的响应面试验,因素水平编码表如表1所示。
表 1 响应面试验因素水平设计Table 1. Response surface test factor level design水平 因素 A
莲子淀粉乳
质量分数(%)B
pHC
TK-PUL
添加量(U/g)D
TK-PUL
酶解时间(h)−1 30 4.5 15 10 0 35 5.0 20 12 1 40 5.5 25 14 1.2.8 莲子抗性淀粉的纯化
称取一定质量未纯化莲子抗性淀粉,加入3倍质量蒸馏水,用磷酸氢二钠-柠檬酸缓冲液(pH6.0)调节pH至5.0~6.0,加入α-淀粉酶Termamyl® 300L,90 ℃水浴2 h。混合物冷却至室温后,向其中加入葡萄糖淀粉酶AMG 300L™,60 ℃水浴1 h。其中未纯化莲子抗性淀粉、α-淀粉酶Termamyl® 300L和葡萄糖淀粉酶AMG 300L™的质量比为10:1:1。将水解后的莲子抗性淀粉于沸水浴加热5 min,再加入4倍体积95%乙醇于室温下处理12 h。将处理后混合物于4000×g离心20 min,弃去上清液,加入10 mL 95%乙醇洗涤沉淀2次,沉淀于50 ℃烘干,粉碎、过100目筛,即得纯化后莲子抗性淀粉。
1.2.9 扫描电镜观察
将莲子淀粉(LSS)、经压热法制备的RS3型抗性淀粉(HP-LRS3)(已纯化)以及经TK-PUL酶解-压热法制备的莲子RS3型抗性淀粉(EHP-LRS3)(已纯化)于105 ℃烘箱中干燥4~5 h,然后将淀粉样品均匀涂抹在样品台上,进行喷金处理,通过Sigma HD型扫描电镜观察淀粉颗粒形貌。扫描条件:电压100 kV、加速电压20 kV。
1.2.10 X-射线衍射分析
将莲子淀粉(LSS)、经压热法制备的RS3型抗性淀粉(HP-LRS3)(已纯化)以及经TK-PUL酶解-压热法制备的莲子RS3型抗性淀粉(EHP-LRS3)(已纯化)于105 ℃烘箱中干燥4~5 h。采用D8 ADVANCE高分辨粉末X-射线衍射仪对样品进行分析。测定条件:起始角5°,终止角40°,扫描速率4°/min,靶型Cu,电压36 kV,电流20 mA,数据采集步宽0.02°,射线的波长0.1542 nm,扫描方式为连续扫描。
1.2.11 RS3型莲子抗性淀粉对长双歧杆菌体外增殖的影响
长双歧杆菌的基础培养基参照文献[11]。本研究中长双歧杆菌的试验培养基是分别以纯化后RS3型莲子抗性淀粉(EHP-LRS3)、高直链玉米淀粉(HI70)、莲子淀粉(LSS)以及已纯化的莲子抗性淀粉(HP-LRS3)取代基础培养基中葡萄糖(Glu)作为碳源配制而成,其他成分同基础培养基。分别配制碳源浓度分别为0.625、1.25、2.5、5、10、20、40 g/L的Glu基础培养基,以及EHP-LRS3试验培养基、HI70试验培养基、LSS试验培养基、HP-LRS3试验培养基。分别吸取1 mL活化后的菌液接入100 mL不同碳源浓度的基础培养基和试验培养基中。于37 ℃厌氧培养48 h后,以未接种的基础培养基和试验培养基为空白对照,测定培养液的OD600 nm,每个试验组设3组重复。
1.3 数据处理
所有实验均重复3次,实验结果用平均值±标准差表示,运用软件SigmaPlot 14.0对实验数据进行统计分析并作图。采用软件Design-Expert 10.0.7进行Box-Behnken试验设计以及试验数据的响应面分析。
2. 结果与分析
2.1 重组TK-PUL的表达
短小芽孢杆菌Brevibacillus choshinensis表达系统具有较强分泌外源蛋白的能力[22−23]。如图1所示,重组TK-PUL主要位于发酵液上清中,发酵液上清样品的比酶活力达75.24 U/mL。采用Ni2+亲和层析纯化发酵液上清中目的蛋白。SDS-PAGE分析显示重组TK-PUL的分子量约为84 kDa,其大小与TK-PUL的理论分子量相符[25]。
2.2 重组TK-PUL的最适反应pH、最适反应温度、pH稳定性及热稳定性分析
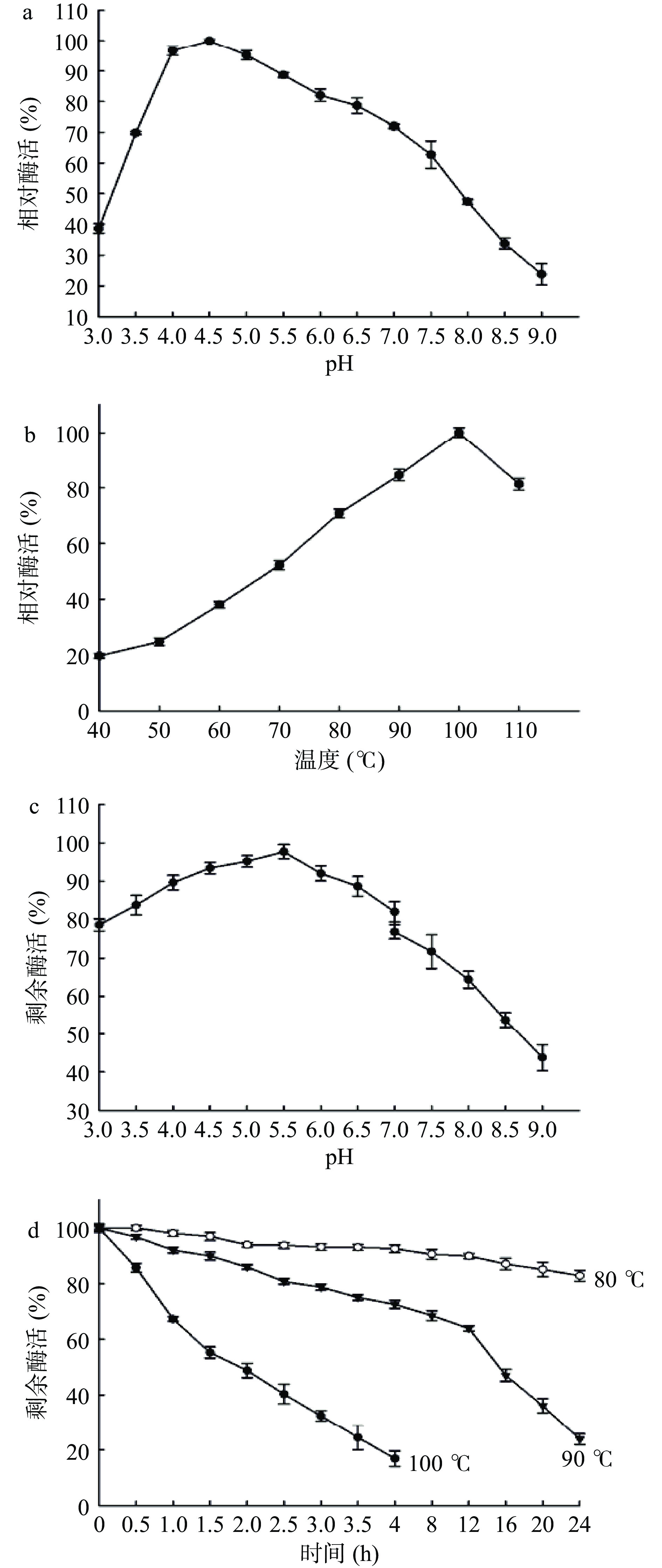
如图2a所示,重组TK-PUL于pH3.5~7.0之间具有70%以上的相对酶活,其最适反应pH为4.5;如图2b所示,重组TK-PUL于80~110 ℃之间具有70%以上的相对酶活,其最适反应温度为100 ℃。以莲子淀粉为底物,重组TK-PUL于100 ℃、pH4.5时具有最高比酶活力,其最高比酶活力为83.25 U/mg。由图2c可知,重组TK-PUL在pH3.5~7.0之间具有较好的pH稳定性,于37 ℃处理2 h后,仍保留80%的剩余酶活。重组TK-PUL于80、90、100 ℃的热稳定性测定结果如图2d所示。重组TK-PUL于90 ℃的半衰期约为16 h,于100 ℃的半衰期约为2 h。于80 ℃保温16 h后,重组TK-PUL仍保留约87%的剩余酶活。本研究中由短小芽孢杆菌分泌表达获得的重组TK-PUL的酶学性质与野生型TK-PUL的酶学性质基本一致[19−21]。
![]() 图 2 温度和pH对重组TK-PUL酶活和稳定性的影响注:a:pH对酶活的影响(反应温度为100 ℃);b:温度对酶活的影响(反应pH为4.5);c:pH对稳定性的影响(采用不同pH缓冲液稀释酶液,于37 ℃处理2 h,再采用pH为4.5的50 mmol/L MES缓冲液稀释酶液,最后于100 ℃测定酶活);d:温度对稳定性的影响(采用pH为4.5的50 mmol/L MES缓冲液稀释酶液,于不同温度保温后,再于100 ℃测定酶活)。Figure 2. Effects of temperature and pH on activity and stability of recombinant TK-PUL
图 2 温度和pH对重组TK-PUL酶活和稳定性的影响注:a:pH对酶活的影响(反应温度为100 ℃);b:温度对酶活的影响(反应pH为4.5);c:pH对稳定性的影响(采用不同pH缓冲液稀释酶液,于37 ℃处理2 h,再采用pH为4.5的50 mmol/L MES缓冲液稀释酶液,最后于100 ℃测定酶活);d:温度对稳定性的影响(采用pH为4.5的50 mmol/L MES缓冲液稀释酶液,于不同温度保温后,再于100 ℃测定酶活)。Figure 2. Effects of temperature and pH on activity and stability of recombinant TK-PUL2.3 莲子RS3型抗性淀粉的制备以及制备工艺参数优化
莲子淀粉的糊化起始温度约为64 ℃,糊化终止温度约为77 ℃[7],TK-PUL于80 ℃具有优良高温活性和热稳定性,因此本研究选取接近莲子淀粉糊化温度的80 ℃作为TK-PUL的酶解温度,并优化了TK-PUL酶解温度为80 ℃时RS3型莲子抗性淀粉的制备工艺。
2.3.1 单因素实验法优化莲子RS3型抗性淀粉制备工艺
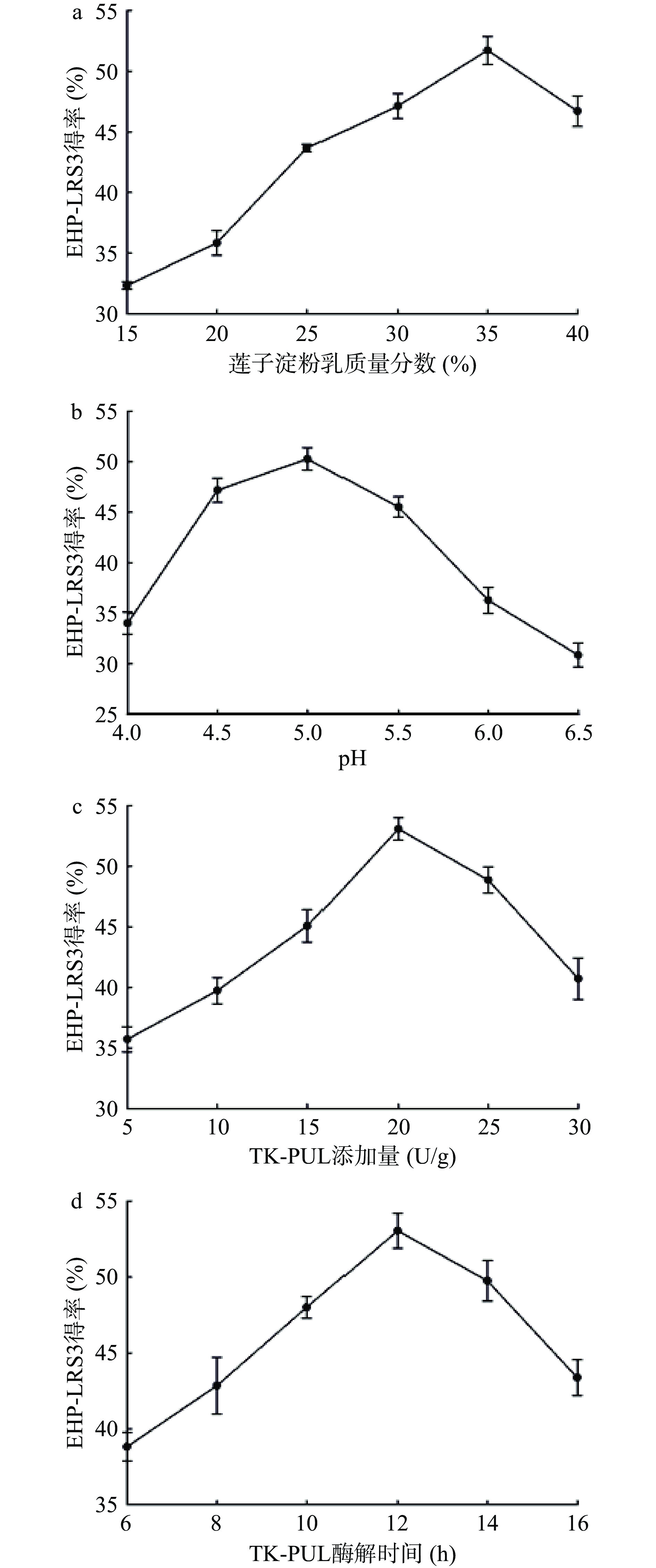
采用单因素实验法研究莲子淀粉乳质量分数、反应pH、TK-PUL添加量以及TK-PUL酶解时间这4个因素对莲子RS3型抗性淀粉(EHP-LRS3)得率的影响,结果如图3所示。由图3a可知,当莲子淀粉乳质量分数为15%时,EHP-LRS3得率较低;随着莲子淀粉乳质量分数的增大,EHP-LRS3得率迅速提高。当莲子淀粉乳质量分数达到35%时,抗性淀粉的得率最高(51.72%),随后EHP-LRS3得率呈下降趋势。这主要是由于莲子淀粉乳质量分数过高时,淀粉糊黏度过大不利于直链淀粉分子之间的相互作用形成抗性淀粉[4−5]。本实验选择35%作为制备莲子RS3型抗性淀粉的最佳莲子淀粉乳质量分数。
图3b显示,反应 pH 为 5.0 时,EHP-LRS3 得率最高(50.26%)。TK-PUL 的最适反应 pH 为 4.5,但是其于 pH5.0 时具有更好的稳定性,这可能是反应pH为5.0时抗性淀粉得率最高的原因。当反应pH为5.0时,TK-PUL具有较高的活性和稳定性,能够大量水解莲子淀粉中α-1,4-糖苷键和α-1,6-糖苷键,产生更多的直链淀粉分子。在后续的压热处理过程中,分子间阻力减弱,更利于抗性淀粉晶体形成,从而使抗性淀粉的得率提高。由此可以推断,TK-PUL的添加量直接关系到EHP-LRS3的得率。本实验选择pH5.0作为制备莲子RS3型抗性淀粉的最佳反应pH。
如图3c所示,在较低酶添加量时,随着TK-PUL添加量的增加,EHP-LRS3得率呈迅速增加趋势。当添加量为20 U/g时,EHP-LRS3得率最高(53.07%)。之后随着TK-PUL添加量的增加,EHP-LRS3得率呈下降趋势。已有研究表明[4,26],适当分子量的直链分子才能够重新缔合并通过形成氢键而紧密聚集,形成抗性淀粉。直链分子的分子量过大或过小均不利于抗性淀粉形成[4,26]。本实验选择20 U/g作为制备莲子RS3型抗性淀粉的最佳TK-PUL添加量。
图3d显示,TK-PUL酶解时间对EHP-LRS3得率的影响趋势与TK-PUL添加量相似,呈先升后降的趋势。这可是由于随着TK-PUL酶解时间的延长,莲子淀粉中直链分子过小而不利于抗性淀粉形成所导致的。在TK-PUL酶解时间为12 h时,抗性淀粉得率最高(53.05%)。本实验选择12 h作为制备莲子RS3型抗性淀粉的最佳TK-PUL酶解时间。
2.3.2 响应面试验法优化莲子RS3型抗性淀粉制备工艺
根据单因素实验结果,采用Design expert 7.1中的响应面试验设计法优化TK-PUL用于制备EHP-LRS3的工艺条件。Box-Behnken试验设计及试验结果见表2。采用Design expert 7.1软件对29个试验点的响应值进行回归拟合分析,响应面试验二次模型的方差分析结果如表3所示。
表 2 响应面试验设计及结果Table 2. Experimental design and results of response surface test试验号 莲子淀粉乳
质量分数(%)pH TK-PUL
添加量(U/g)TK-PUL
酶解时间(h)EHP-LRS3
得率(%)1 30 4.5 20 12 36.60 2 40 4.5 20 12 42.24 3 30 5.5 20 12 45.12 4 40 5.5 20 12 38.64 5 35 5.0 15 10 42.84 6 35 5.0 25 10 44.28 7 35 5.0 20 14 48.96 8 35 5.0 25 14 52.32 9 30 5.0 20 10 37.54 10 40 5.0 20 10 39.00 11 30 5.0 20 14 40.56 12 40 5.0 20 14 46.2 13 35 4.5 15 12 42.72 14 35 5.5 15 12 51.36 15 35 4.5 25 12 51.96 16 35 5.5 25 12 53.16 17 30 5.0 15 12 40.08 18 40 5.0 15 12 45.12 19 30 5.0 25 12 45.24 20 40 5.0 25 12 49.04 21 35 4.5 20 10 41.28 22 35 5.5 20 10 41.16 23 35 4.5 20 14 41.74 24 35 5.5 20 14 50.88 25 35 5.0 20 12 55.44 26 35 5.0 20 12 53.64 27 35 5.0 20 12 53.16 28 35 5.0 20 12 51.84 29 35 5.0 20 12 54.24 表 3 响应面试验的方差分析Table 3. ANOVA for the response surface experiment方差来源 平方和 自由度 均方 F值 P值 显著性 模型 980.35 14 70.02 22.10 <0.0001 ** A 20.95 1 20.95 6.61 0.0222 * B 51.95 1 51.95 16.40 0.0012 ** C 57.05 1 57.05 18.01 0.0008 ** D 109.73 1 109.73 34.63 <0.0001 ** AB 40.49 1 40.49 12.78 0.0030 ** AC 0.4238 1 0.4238 0.1338 0.7200 AD 4.82 1 4.82 1.52 0.2379 BC 15.26 1 15.26 4.82 0.0456 * BD 23.63 1 23.63 7.46 0.0162 * CD 1.02 1 1.02 0.3207 0.5802 A² 476.31 1 476.31 150.33 <0.0001 ** B² 127.73 1 127.73 40.31 <0.0001 ** C² 1.44 1 1.44 0.4544 0.5113 D² 215.44 1 215.44 68.00 <0.0001 ** 残差 44.36 14 3.17 失拟 36.57 10 3.66 1.88 0.2850 纯误差 7.79 4 1.95 总和 1024.70 28 注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01。 表3中方差分析结果显示:模型P值<0.0001,这表示方程模型达到极显著;失拟P值为0.2850,不显著,具有统计学意义。因此该二次多项回归模型成立,应用此模型可以预测EHP-LRS3的得率以及优化EHP-LRS3的制备工艺。试验因素A、B、C、D、AB、BC以及BD的P值均小于0.05,这表明这些试验因素是影响反应的重要因素。其中,pH、TK-PUL添加量以及TK-PUL酶解时间对反应的影响达到极显著程度(P<0.01),莲子淀粉乳质量分数对反应的影响达到显著程度(P<0.05)。该二次多项回归模型的R2为0.9567,说明该方程模型与实际试验结果拟合良好,试验误差小。根据表3,去掉对反应的影响不显著的试验因素,获得描述显著试验因素与EHP-LRS3得率(Y)之间关系的二次多项式方程为:Y=56.35+1.32A+2.08B+2.18C+3.02D−3.18AB−1.95BC+2.43BD−8.57A2−4.44B2−5.76D2。以上二次多项回归模型中二次项系数均为负值,说明该方程模型有极大值。
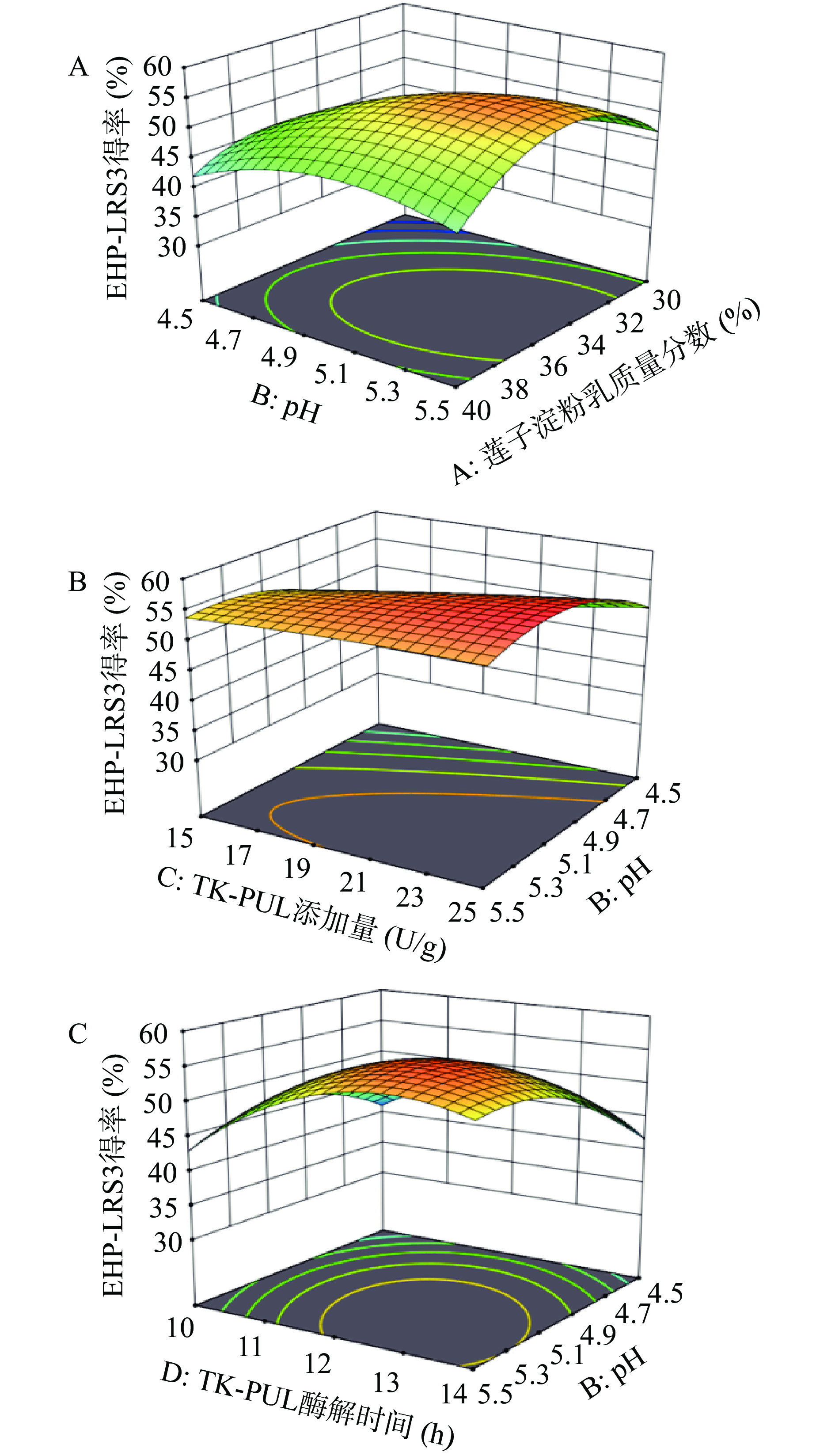
采用Design expert 7.1根据二次多项式方程作出不同因素交互作用的响应面曲线图,如图4所示。响应面曲线图反映出不同因素之间的交互作用强弱以及不同因素对响应值的影响。由表3可知,莲子淀粉乳质量分数与pH对EHP-LRS3得率影响的P值<0.01,说明这两个因素之间的交互作用达到极显著程度;pH与TK-PUL添加量、pH与TK-PUL酶解时间对EHP-LRS3得率影响的P值<0.05,说明因素之间交互作用达到显著程度。由图4a可知,随着莲子淀粉乳质量分数升高与pH增大,EHP-LRS3得率先升高后降低,等高线形状呈椭圆形,莲子淀粉乳质量分数与pH的交互作用对EHP-LRS3得率的影响极显著;图4b显示,随着pH增大与TK-PUL添加量升高,EHP-LRS3得率先迅速升高后缓慢下降,pH与TK-PUL添加量的交互作用对EHP-LRS3得率的影响显著;图4c显示,随着pH增大与TK-PUL酶解时间延长,EHP-LRS3得率先迅速升高后缓慢下降,pH与TK-PUL酶解时间的交互作用对EHP-LRS3得率的影响显著。
基于响应面试验设计结果,TK-PUL应用于制备EHP-LRS3的理论最佳工艺条件为:莲子淀粉乳质量分数35.32%、pH5.00、TK-PUL添加量25.00 U/g、酶解时间12.70 h。在此条件下,EHP-LRS3的理论得率为58.68%。根据最佳工艺条件,通过3组实验进行验证,测得EHP-LRS3的得率分别为58.56%、58.09%、58.72%,平均得率为58.46%±0.33%,与该条件下的理论值58.68%相比,相对误差值小于1%,说明采用响应面法优化得到的制备工艺参数准确可靠。
目前已有较多RS3型莲子抗性淀粉的制备工艺研究,例如Zhang等[16]以压热法制备莲子RS3型抗性淀粉,在莲子淀粉乳浓度为25%、121 ℃下压热处理10 min、4 ℃下回生24 h的条件下,RS3型莲子抗性淀粉的得率为41.89%。Zeng等[17]研究表明,在莲子淀粉乳浓度为15%、微波功率为640 W、微波时间为120 s、4 ℃下回生12 h的条件下,RS3型莲子抗性淀粉的得率为39.53%;在莲子淀粉乳浓度为45%、超声波功率为300 W、超声波处理时间为55 min、115 ℃下压热处理15 min、4 ℃下回生24 h的条件下,RS3型莲子抗性淀粉的得率为56.12%[17]。本研究采用湿提法提取得到莲子中莲子淀粉(LSS)。该莲子淀粉经过压热法(121 ℃下压热处理10 min、于4 ℃下回生24 h)处理后,RS3型抗性淀粉HP-LRS3得率为40.46%±0.29%,与文献报道(41.89%)[17]基本一致;该莲子淀粉经TK-PUL酶解及压热法处理后,RS3型抗性淀粉EHP-LRS3得率为58.46%±0.33%。即莲子淀粉经TK-PUL酶解处理后,产生更多易于结晶的直链淀粉分子,从而使抗性淀粉得率得到大幅提高。本研究采用TK-PUL酶解与压热联合制备RS3型莲子抗性淀粉的得率为58.46%,高于目前通过压热法、微波法、超声波-压热法等制备RS3型莲子抗性淀粉的得率,也验证了酶解-压热法在RS3型抗性淀粉制备中的优势。
2.4 TK-PUL酶解对莲子淀粉结构的影响
电子显微镜观察结果显示,莲子淀粉与莲子抗性淀粉在颗粒形态上具有明显的差异。莲子淀粉颗粒呈椭圆状,大小不一,表面较为光滑(图5a1~a2)。莲子淀粉经处理后,其结构已被破坏,原有的椭圆形态消失,形成无定形紧密结合块状结构。经压热法制备的莲子抗性淀粉HP-LRS3,其整体结构较为光滑,极少部分呈现条纹(图5b1~b2)。而由TK-PUL酶解-压热法制备的莲子抗性淀粉EHP-LRS3则呈现不规则沟壑状结构(图5c1~c2)。
![]() 图 5 莲子淀粉与莲子抗性淀粉的扫描电子显微镜图注:a1:莲子淀粉(LSS),200×;a2:莲子淀粉(LSS),500×;b1:经压热法处理得到的RS3型莲子抗性淀粉(HP-RS3),200×;b2:经压热法处理得到的RS3型莲子抗性淀粉(HP-RS3),500×;c1:经TK-PUL酶解-压热法处理得到的RS3型莲子抗性淀粉(EHP-RS3),200×;c2:经TK-PUL酶解-压热法处理得到的RS3型莲子抗性淀粉(EHP-RS3),500×。Figure 5. Scanning electron micrographs of lotus seed starch and lotus seed resistant starch
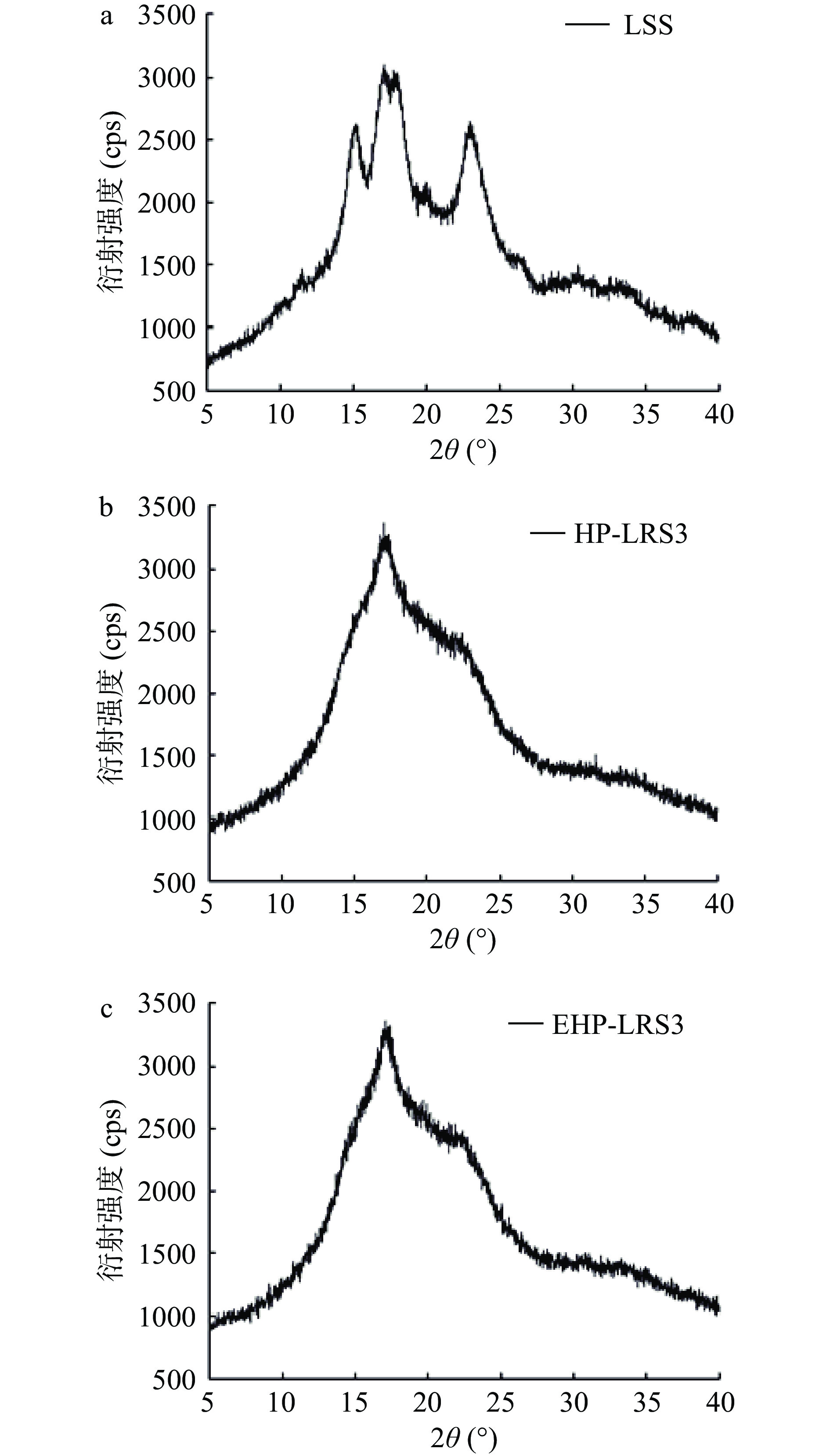
图 5 莲子淀粉与莲子抗性淀粉的扫描电子显微镜图注:a1:莲子淀粉(LSS),200×;a2:莲子淀粉(LSS),500×;b1:经压热法处理得到的RS3型莲子抗性淀粉(HP-RS3),200×;b2:经压热法处理得到的RS3型莲子抗性淀粉(HP-RS3),500×;c1:经TK-PUL酶解-压热法处理得到的RS3型莲子抗性淀粉(EHP-RS3),200×;c2:经TK-PUL酶解-压热法处理得到的RS3型莲子抗性淀粉(EHP-RS3),500×。Figure 5. Scanning electron micrographs of lotus seed starch and lotus seed resistant starch此外,本研究对莲子淀粉及莲子抗性淀粉进行了X-射线扫描,结果见图6。图6a显示莲子淀粉在15.3°、17.2°、18.3°、23.5°处具有较强特征衍射峰,表明莲子淀粉的结构属于典型A型淀粉晶体结构[13,27]。图6b和图6c显示莲子抗性淀粉HP-LRS3和EHP-LRS3在22.0°处具有中强特征衍射峰,在17.0°处具有强特征衍射峰,这些特征衍射峰为 B 型淀粉晶体的特征衍射峰[13,27]。以上结果表明莲子淀粉在经压热法处理或TK-PUL酶解-压热法处理后,结晶结构发生了变化,结晶晶型由A型转变为B型。Zeng等[17]研究结果表明,莲子抗性淀粉的晶体类型仅与其老化回生方式有关。本研究中,仅经压热法处理得到的 HP-LRS3 和经 TK-PUL 酶解-压热法处理得到的 EHP-LRS3 具有相同的晶体结构,这与 Zeng 等[17]的研究结果相符。
2.5 莲子抗性淀粉对长双歧杆菌体外增殖的影响
长双歧杆菌(Bifidobacterium longum)是定植于宿主肠道内具有益生功能的益生菌,它具有调节肠道微生物、加强肠道屏障、提高机体免疫力等功能,与机体健康密切相关[28−29]。本研究考察了莲子淀粉(LSS)、经压热法制备的RS3型抗性淀粉(HP-LRS3)(已纯化)以及经TK-PUL酶解-压热法制备的莲子RS3型抗性淀粉(EHP-LRS3)(已纯化)对长双歧杆菌体外增殖的影响,并以葡萄糖(Glu)和高直链玉米淀粉(HI70)为对照,试验结果如表4所示。对于同种碳源,碳源的浓度对长双歧杆菌的体外增殖作用有一定的影响。当碳源浓度在0.625~20 g/L的范围内时,培养结束时长双歧杆菌培养液的OD600 nm值随着碳源浓度的提高而增加。当碳源浓度为40 g/L时,长双歧杆菌培养液的OD600 nm值均下降,这可能是由于高浓度碳源引起培养基渗透压过高,从而影响了长双歧杆菌的增殖。此外,表4中结果显示,不同碳源对长双歧杆菌体外增殖的促进作用是:EHP-LRS3>HP-LRS3>HI70>LSS>Glu。即两种莲子抗性淀粉对长双歧杆菌的促增殖能力优于高直链玉米淀粉HI70,而高直链玉米淀粉是目前公认的益生元[30]。已有研究表明,莲子抗性淀粉对双歧杆菌的促增殖能力可能与其结构相关[8−11]。与莲子淀粉及高直链玉米淀粉不同,莲子抗性淀粉颗粒具有特殊的无定形紧密结合块状结构。莲子抗性淀粉的特殊结构可以更好地黏附双歧杆菌,保护其免受不良环境的影响,使其能够更好地利用碳源,从而促进自身增殖[8−11]。如上所述,HP-LRS3的颗粒较为光滑,EHP-LRS3的颗粒则呈现不规则沟壑状,即EHP-LRS3的结构更为复杂。这也可能是EHP-LRS3对长双歧杆菌的促增殖能力强于HP-LRS3的原因。
表 4 不同浓度物质对长双歧杆菌数量的影响Table 4. Effects of different concentrations of substances on the number of Bifidobacterium longum物质浓度
(g/L)长双歧杆菌数量(OD600 nm值) Glu EHP-LRS3 HI70 LSS HP-LRS3 0.625 0.025±0.007 0.135±0.034 0.036±0.008 0.031±0.009 0.065±0.008 1.250 0.034±0.006 0.239±0.015 0.047±0.012 0.042±0.007 0.103±0.007 2.500 0.055±0.005 0.438±0.039 0.123±0.015 0.086±0.010 0.184±0.013 5.000 0.186±0.013 1.006±0.021 0.346±0.019 0.255±0.015 0.642±0.057 10.000 0.684±0.017 1.346±0.029 0.769±0.032 0.713±0.024 1.038±0.036 20.000 1.025±0.014 1.775±0.039 1.208±0.037 1.155±0.031 1.325±0.025 40.000 0.943±0.034 1.524±0.053 0.968±0.039 0.955±0.029 1.126±0.031 3. 结论
本研究采用TK-PUL联合压热法制备RS3型莲子抗性淀粉(EHP-LRS3),并分析了EHP-LRS3的形貌和晶体结构,考察了EHP-LRS3对长双歧杆菌的促增殖能力。当TK-PUL酶解温度为80 ℃时,TK-PUL联合压热法制备EHP-LRS3的最佳工艺参数为:莲子淀粉乳质量分数35.32%、pH5.00、TK-PUL添加量25.00 U/g、TK-PUL酶解时间12.70 h,121 ℃压热处理10 min、4 ℃回生处理24 h。在最佳工艺条件下,EHP-LRS3的得率为58.46%。EHP-LRS3呈现出不规则沟壑状结构,晶体结构呈现出不同于原莲子淀粉A型晶体结构的B型晶体结构。EHP-LRS3对长双歧杆菌的促增殖能力优于压热法制备的RS3型莲子抗性淀粉。本研究确定了TK-PUL酶解温度为80 ℃时TK-PUL联合压热制备EHP-LRS3的最佳工艺以及EHP-LRS3对长双歧杆菌的促增殖能力,为拓宽莲子淀粉的应用范围提供了科学依据。但本文只局限于研究TK-PUL酶解温度为80 ℃时EHP-LRS3的最佳制备工艺,随着研究的深入还需进一步探索不同酶解温度下EHP-LRS3的制备工艺和结构分析,从而为TK-PUL联合压热法制备EHP-LRS3的产业化研究提供理论依据。
-
图 2 温度和pH对重组TK-PUL酶活和稳定性的影响
注:a:pH对酶活的影响(反应温度为100 ℃);b:温度对酶活的影响(反应pH为4.5);c:pH对稳定性的影响(采用不同pH缓冲液稀释酶液,于37 ℃处理2 h,再采用pH为4.5的50 mmol/L MES缓冲液稀释酶液,最后于100 ℃测定酶活);d:温度对稳定性的影响(采用pH为4.5的50 mmol/L MES缓冲液稀释酶液,于不同温度保温后,再于100 ℃测定酶活)。
Figure 2. Effects of temperature and pH on activity and stability of recombinant TK-PUL
图 5 莲子淀粉与莲子抗性淀粉的扫描电子显微镜图
注:a1:莲子淀粉(LSS),200×;a2:莲子淀粉(LSS),500×;b1:经压热法处理得到的RS3型莲子抗性淀粉(HP-RS3),200×;b2:经压热法处理得到的RS3型莲子抗性淀粉(HP-RS3),500×;c1:经TK-PUL酶解-压热法处理得到的RS3型莲子抗性淀粉(EHP-RS3),200×;c2:经TK-PUL酶解-压热法处理得到的RS3型莲子抗性淀粉(EHP-RS3),500×。
Figure 5. Scanning electron micrographs of lotus seed starch and lotus seed resistant starch
表 1 响应面试验因素水平设计
Table 1 Response surface test factor level design
水平 因素 A
莲子淀粉乳
质量分数(%)B
pHC
TK-PUL
添加量(U/g)D
TK-PUL
酶解时间(h)−1 30 4.5 15 10 0 35 5.0 20 12 1 40 5.5 25 14 表 2 响应面试验设计及结果
Table 2 Experimental design and results of response surface test
试验号 莲子淀粉乳
质量分数(%)pH TK-PUL
添加量(U/g)TK-PUL
酶解时间(h)EHP-LRS3
得率(%)1 30 4.5 20 12 36.60 2 40 4.5 20 12 42.24 3 30 5.5 20 12 45.12 4 40 5.5 20 12 38.64 5 35 5.0 15 10 42.84 6 35 5.0 25 10 44.28 7 35 5.0 20 14 48.96 8 35 5.0 25 14 52.32 9 30 5.0 20 10 37.54 10 40 5.0 20 10 39.00 11 30 5.0 20 14 40.56 12 40 5.0 20 14 46.2 13 35 4.5 15 12 42.72 14 35 5.5 15 12 51.36 15 35 4.5 25 12 51.96 16 35 5.5 25 12 53.16 17 30 5.0 15 12 40.08 18 40 5.0 15 12 45.12 19 30 5.0 25 12 45.24 20 40 5.0 25 12 49.04 21 35 4.5 20 10 41.28 22 35 5.5 20 10 41.16 23 35 4.5 20 14 41.74 24 35 5.5 20 14 50.88 25 35 5.0 20 12 55.44 26 35 5.0 20 12 53.64 27 35 5.0 20 12 53.16 28 35 5.0 20 12 51.84 29 35 5.0 20 12 54.24 表 3 响应面试验的方差分析
Table 3 ANOVA for the response surface experiment
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 980.35 14 70.02 22.10 <0.0001 ** A 20.95 1 20.95 6.61 0.0222 * B 51.95 1 51.95 16.40 0.0012 ** C 57.05 1 57.05 18.01 0.0008 ** D 109.73 1 109.73 34.63 <0.0001 ** AB 40.49 1 40.49 12.78 0.0030 ** AC 0.4238 1 0.4238 0.1338 0.7200 AD 4.82 1 4.82 1.52 0.2379 BC 15.26 1 15.26 4.82 0.0456 * BD 23.63 1 23.63 7.46 0.0162 * CD 1.02 1 1.02 0.3207 0.5802 A² 476.31 1 476.31 150.33 <0.0001 ** B² 127.73 1 127.73 40.31 <0.0001 ** C² 1.44 1 1.44 0.4544 0.5113 D² 215.44 1 215.44 68.00 <0.0001 ** 残差 44.36 14 3.17 失拟 36.57 10 3.66 1.88 0.2850 纯误差 7.79 4 1.95 总和 1024.70 28 注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01。 表 4 不同浓度物质对长双歧杆菌数量的影响
Table 4 Effects of different concentrations of substances on the number of Bifidobacterium longum
物质浓度
(g/L)长双歧杆菌数量(OD600 nm值) Glu EHP-LRS3 HI70 LSS HP-LRS3 0.625 0.025±0.007 0.135±0.034 0.036±0.008 0.031±0.009 0.065±0.008 1.250 0.034±0.006 0.239±0.015 0.047±0.012 0.042±0.007 0.103±0.007 2.500 0.055±0.005 0.438±0.039 0.123±0.015 0.086±0.010 0.184±0.013 5.000 0.186±0.013 1.006±0.021 0.346±0.019 0.255±0.015 0.642±0.057 10.000 0.684±0.017 1.346±0.029 0.769±0.032 0.713±0.024 1.038±0.036 20.000 1.025±0.014 1.775±0.039 1.208±0.037 1.155±0.031 1.325±0.025 40.000 0.943±0.034 1.524±0.053 0.968±0.039 0.955±0.029 1.126±0.031 -
[1] TEKIN T, DINCER E. Effect of resistant starch types as a prebiotic[J]. Applied Microbiology and Biotechnology,2023,107(2-3):491−515. doi: 10.1007/s00253-022-12325-y
[2] DEMARTINO P, COCKBURN D W. Resistant starch:Impact on the gut microbiome and health[J]. Current Opinion in Biotechnology,2020,61:66−71. doi: 10.1016/j.copbio.2019.10.008
[3] JIANG F, DU C W, JIANG W Q, et al. The preparation, formation, fermentability, and applications of resistant starch[J]. International Journal of Biological Macromolecules,2020,150:1155−1161. doi: 10.1016/j.ijbiomac.2019.10.124
[4] MA Z, BOYE J I. Research advances on structural characterization of resistant starch and its structure-physiological function relationship:A review[J]. Critical Reviews in Food Science and Nutrition,2018,58(7):1059−1083. doi: 10.1080/10408398.2016.1230537
[5] TIAN S Q, SUN Y. Influencing factor of resistant starch formation and application in cereal products:A review[J]. International Journal of Biological Macromolecules,2020,149:424−431. doi: 10.1016/j.ijbiomac.2020.01.264
[6] CHEN C J, LI G T, ZHU F. A novel starch from lotus (Nelumbo nucifera) seeds:Composition, structure, properties and modifications[J]. Food Hydrocolloids,2021,120:106899. doi: 10.1016/j.foodhyd.2021.106899
[7] DHULL S B, CHANDAK A, COLLINS M N, et al. Lotus seed starch:A novel functional ingredient with promising properties and applications in food-a review[J]. Starch-Stärke,2022,74(9−10):2200064.
[8] ZENG H L, HUANG C C, LIN S, et al. Lotus seed resistant starch regulates gut microbiota and increases short-chain fatty acids production and mineral absorption in mice[J]. Journal of Agricultural and Food Chemistry,2017,65(42):9217−9225. doi: 10.1021/acs.jafc.7b02860
[9] ZENG H L, CHEN P L, CHEN C J, et al. Structural properties and prebiotic activities of fractionated lotus seed resistant starches[J]. Food Chemistry,2018,251:33−40. doi: 10.1016/j.foodchem.2018.01.057
[10] LI X, LEI S Z, LIU L, et al. Synergistic effect of lotus seed resistant starch and short-chain fatty acids on mice fecal microbiota in vitro[J]. International Journal of Biological Macromolecules,2021,183:2272−2281. doi: 10.1016/j.ijbiomac.2021.06.016
[11] ZENG H L, ZHENG Y X, LIN Y, et al. Effect of fractionated lotus seed resistant starch on proliferation of Bifidobacterium longum and Lactobacillus delbrueckii subsp. bulgaricus and its structural changes following fermentation[J]. Food Chemistry,2018,268:134−142. doi: 10.1016/j.foodchem.2018.05.070
[12] DUNDAR A N, GOCMEN D. Effects of autoclaving temperature and storing time on resistant starch formation and its functional and physicochemical properties[J]. Carbohydrate Polymers,2013,97(2):764−771. doi: 10.1016/j.carbpol.2013.04.083
[13] CAI L M, SHI Y C. Structure and digestibility of crystalline short-chain amylose from debranched waxy wheat, waxy maize, and waxy potato starches[J]. Carbohydrate Polymers,2010,79(4):1117−1123. doi: 10.1016/j.carbpol.2009.10.057
[14] LI Y, XU J, ZHANG L, et al. Investigation of debranching pattern of a thermostable isoamylase and its application for the production of resistant starch[J]. Carbohydrate Research,2017,446:93−100.
[15] ZHANG H R, JIN Z J. Preparation of products rich in resistant starch from maize starch by an enzymatic method[J]. Carbohydrate Polymers,2011,86(4):1610−1614. doi: 10.1016/j.carbpol.2011.06.070
[16] ZHANG Y, WANG Y, ZHENG B D, et al. The in vitro effects of retrograded starch (resistant starch type 3) from lotus seed starch on the proliferation of Bifidobacterium adolescentis[J]. Food & Function,2013,4(11):1609−1616.
[17] ZENG S X, WU X T, LIN S, et al. Structural characteristics and physicochemical properties of lotus seed resistant starch prepared by different methods[J]. Food Chemistry,2015,186:213−222. doi: 10.1016/j.foodchem.2015.03.143
[18] HAN T, ZENG F, LI Z, et al. Biochemical characterization of a recombinant pullulanase from Thermococcus kodakarensis KOD1[J]. Letters in Applied Microbiology,2013,57(4):336−343. doi: 10.1111/lam.12118
[19] AHMAD N, RASHID N, HAIDER M S, et al. Novel maltotriose-hydrolyzing thermoacidophilic type III pullulan hydrolase from Thermococcus kodakarensis[J]. Applied and Environmental Microbiology,2014,80(3):1108−1114. doi: 10.1128/AEM.03139-13
[20] TOOR K J, AHMAD N, MUHAMMAD M A, et al. TK-PUL, a pullulan hydrolase type III from Thermococcus kodakarensis, a potential candidate for simultaneous liquefaction and saccharification of starch[J]. Amylase,2020,4(1):45−55. doi: 10.1515/amylase-2020-0004
[21] HANAGATA H, MIZUKAMI M, MIYAUCHI A. Efficient expression of antibody fragments with the Brevibacillus expression system[J]. Antibodies,2014,3(2):242−252. doi: 10.3390/antib3020242
[22] MIZUKAMI M, HANAGATA H, MIYAUCHI A. Brevibacillus expression system:Host-vector system for efficient production of secretory proteins[J]. Current Pharmaceutical Biotechnology,2010,11(3):251−258. doi: 10.2174/138920110791112031
[23] YAO D B, ZHANG K, WU J. Available strategies for improved expression of recombinant proteins in Brevibacillus expression system:A review[J]. Critical Reviews in Biotechnology,2020,40(7):1044−1058. doi: 10.1080/07388551.2020.1805404
[24] GREEN M R, SAMBROOK J. Molecular cloning:A laboratory manual[M]. New York:Cold Spring Harbor Laboratory Press, 2012.
[25] 曾静, 何础阔, 郭建军, 等. 嗜热酸性Ⅲ型普鲁兰多糖水解酶TK-PUL保守基序中关键氨基酸残基对其催化性质的影响[J]. 食品科学,2022,43(22):113−120. [ZENG J, HE C K, GUO J J, et al. Effect of key amino acid residues in the conserved regions of thermoacidiphilic type III pullulan hydrolase TK-PUL on its catalytic properties[J]. Food Science,2022,43(22):113−120.] doi: 10.7506/spkx1002-6630-20211208-093 ZENG J, HE C K, GUO J J, et al. Effect of key amino acid residues in the conserved regions of thermoacidiphilic type III pullulan hydrolase TK-PUL on its catalytic properties[J]. Food Science, 2022, 43(22): 113−120. doi: 10.7506/spkx1002-6630-20211208-093
[26] PENG H, QIAN L M, FU Z J, et al. Using a novel hyperthermophilic amylopullulanase to simplify resistant starch preparation from rice starches[J]. Journal of Functional Foods,2021,80:104429. doi: 10.1016/j.jff.2021.104429
[27] SHAMAI K, BIANCO-PELED H, SHIMONI E. Polymorphism of resistant starch type III[J]. Carbohydrate Polymers,2003,54(3):363−369. doi: 10.1016/S0144-8617(03)00192-9
[28] UNDERWOOD M A, GERMAN J B, LEBRILLA C B, et al. Bifidobacterium longum subspecies infantis:Champion colonizer of the infant gut[J]. Pediatric Research,2015,77(1):229−235.
[29] YAO S Y, ZHAO Z X, WANG W J, et al. Bifidobacterium longum:Protection against inflammatory bowel disease[J]. Journal of Immunology Research,2021,2021:8030297.
[30] XIE Z Q, WANG S K, WANG Z G, et al. In vitro fecal fermentation of propionylated high-amylose maize starch and its impact on gut microbiota[J]. Carbohydrate Polymers,2019,2223:115069.
-
期刊类型引用(1)
1. 赵克东,阮长青,李志江,汤华成,王长远. 超声辅助制备抗性淀粉研究进展. 食品工业科技. 2025(05): 8-16 .  本站查看
本站查看
其他类型引用(0)





 下载:
下载:

 下载:
下载:



