Enhanced Extracellular Type III Pullulan Hydrolase Production by Co-expressing Molecular Chaperone in Brevibacillus choshinensis and Fermentation Optimization
-
摘要: 本研究旨在通过共表达分子伴侣蛋白以及优化发酵条件来提高III型普鲁兰水解酶(TK-PUL)在短小芽孢杆菌中的分泌表达水平。通过构建共表达TK-PUL和分子伴侣蛋白的多种重组短小芽孢杆菌,并以胞外酶活为指标对其进行筛选,确定最有利于TK-PUL分泌表达的分子伴侣蛋白及对应的重组短小芽孢杆菌。在此基础上采用单因素实验和响应面法优化重组短小芽孢杆菌的发酵条件。结果表明,共表达分子伴侣蛋白PrsABa的重组短小芽孢杆菌的胞外酶活达到98.79 U/mL,提高了0.31倍。该重组短小芽孢杆菌的最佳培养基包括19.65 g/L 葡萄糖、21.46 g/L 酵母提取物、12.01 g/L MgCl2·6H2O、9.02 g/L 脯氨酸、0.01 g/L FeSO4·7H2O、0.01 g/L MnSO4·4H2O、0.001 g/L ZnSO4·7H2O。在发酵温度为35 ℃、起始发酵pH为7.0的条件下,该重组短小芽孢杆菌于最佳培养基中培养66 h时,其胞外酶活达到192.68 U/mL,提高了1.56倍。本研究通过共表达分子伴侣蛋白和发酵优化实现了TK-PUL在短小芽孢杆菌的高效分泌表达,为TK-PUL的应用提供了基础。
-
关键词:
- III型普鲁兰水解酶 /
- 短小芽孢杆菌 /
- 胞外分子伴侣蛋白 /
- 发酵优化 /
- 分泌表达
Abstract: This study aimed to increase the expression and secretion of type III pullulan hydrolase (TK-PUL) by Brevibacillus choshinensis through the co-expression of molecular chaperone proteins and the optimization of fermentation conditions. By constructing multiple recombinant B. choshinensis co-expressing TK-PUL and molecular chaperone proteins, and screening them using extracellular enzyme activity as an indicator, the most favorable molecular chaperone protein and corresponding recombinant B. choshinensis for TK-PUL secretion and expression were determined. On this basis, single factor experiments and response surface methodology were used to optimize the fermentation conditions of recombinant B. choshinensis. Results showed that, the extracellular enzyme activity of the recombinant B. choshinensis strain co-expressing the molecular chaperone protein PrsABa reached 98.79 U/mL, representing a 0.31-fold increase. The optimal medium for this recombinant B. choshinensis was composed of 19.65 g/L of glucose, 21.46 g/L of yeast extract, 12.01 g/L of MgCl2·6H2O, 9.02 g/L of proline, 0.01 g/L of FeSO4·7H2O, 0.01 g/L of MnSO4·4H2O, and 0.001 g/L of ZnSO4·7H2O. Culturing the optimized recombinant B. choshinensis in the above-mentioned optimized medium for 66 hours at 35 °C and an initial pH of 7.0 increased the extracellular TK-PUL activity to 192.68 U/mL, which represented a 1.56-fold increase. Efficient secretion of TK-PUL in B. choshinensis was achieved through the co-expression of molecular chaperone proteins and the optimization of fermentation conditions. This study provides a foundation for exploring the industrial-scale application of TK-PUL. -
III型普鲁兰水解酶(EC 3.2.1.1/41)能够同时水解淀粉中α-1,4-糖苷键和α-1,6-糖苷键,是具有α-淀粉酶活性和普鲁兰酶活性的双功能酶[1−4]。III型普鲁兰水解酶在淀粉加工工业、烘焙食品工业等工业领域具有重要应用价值。其中,嗜热酸性III型普鲁兰水解酶在淀粉酶法制糖工业具有巨大的应用潜力[5−6]。嗜热酸性III型普鲁兰水解酶可在淀粉酶法制糖工业的液化条件下将淀粉完全酶解为淀粉糖,使淀粉酶法制糖工艺的液化过程和糖化过程合二为一,大大简化淀粉酶法制糖工艺,降低生产成本,提高生产效率。来源于极端嗜热古生菌Thermococcus kodakarensis的嗜热酸性III型普鲁兰水解酶(TK-PUL)是目前已报道的水解活性最高的III型普鲁兰水解酶[7−10]。TK-PUL属于糖苷水解酶类的第13家族(GH13_20),具有优良的热稳定性和高温活性,并且其热稳定性和高温活性均不依赖于Ca2+,可以完全水解淀粉为淀粉糖。已有研究表明,将TK-PUL以1 mg/g 淀粉干物质的使用浓度加入30%玉米淀粉乳中,100 ℃反应10 min,然后于90 ℃反应96 h后,玉米淀粉乳完全转化为淀粉糖,产物中DP1~DP7所占比例为80.5%,DP7+所占比例为8.3%,DPn所占比例为11.2%[9]。
TK-PUL已在大肠杆菌表达系统和枯草芽孢杆菌表达系统中进行表达。重组TK-PUL于大肠杆菌表达系统中表达时,其主要位于重组大肠杆菌的胞内可溶成分中,从重组大肠杆菌获取TK-PUL的纯化过程复杂[8]。此外大肠杆菌的外膜成分含有脂多糖,具有一定的致病性。重组TK-PUL于枯草芽孢杆菌表达系统中分泌表达,重组枯草芽孢杆菌的胞外酶活仅为29.10 U/mL[11]。目前为止,TK-PUL的异源表达策略难以满足工业应用要求。为满足TK-PUL的工业应用要求,需选用其他合适的表达系统来实现TK-PUL的异源高效分泌表达。
短小芽孢杆菌(Brevibacillus choshinensis)具有卓越的蛋白质合成与分泌能力,其胞外蛋白质浓度可达30 g/L,并且其胞外蛋白酶活性低[12−14]。因此短小芽孢杆菌作为优良的异源表达系统被用于各种目的蛋白质的异源分泌表达,比如来源于Bacillus megaterium的α-淀粉酶、来源于Pyrococcus horikoshii的纤维素酶、来源于Bacillus deramifcans的普鲁兰酶等[14]。此外,已有较多研究阐述了一系列提高目的蛋白在短小芽孢杆菌中重组表达水平的策略,比如优化基因表达启动子、优化分泌表达信号肽、优化目的蛋白质序列、提高表达载体的稳定性和拷贝数、共表达分子伴侣蛋白质以及发酵优化等[14]。本研究拟将嗜热酸性III型普鲁兰水解酶(TK-PUL)于短小芽孢杆菌表达系统进行异源分泌表达,并探索通过共表达分子伴侣蛋白质以及发酵优化实现TK-PUL在短小芽孢杆菌中的高效分泌表达,从而为TK-PUL的应用提供了理论基础,并为其他目的蛋白在短小芽孢杆菌中实现高效分泌表达提供了参考策略。
1. 材料与方法
1.1 材料与仪器
短小芽孢杆菌B. choshinensis HPD1-SP3、大肠杆菌Escherichia coli JM109、重组载体pBE-S-Atkp、质粒pNCMO2、质粒pNY326 由本实验室保存;LB培养基(1 L):蛋白胨10.0 g,酵母提取物5.0 g,NaCl 5.0 g 环凯生物科技有限公司;TM培养基(1 L,pH7.0):10 g多聚蛋白胨、5 g牛肉粉、2 g酵母提取物、10 g葡萄糖、0.01 g FeSO4·7H2O、0.01 g MnSO4·4H2O、0.001 g ZnSO4·7H2O 上海生工生物工程股份有限公司;KOD-Plus-neo DNA聚合酶 日本Toyobo公司;DNA限制性内切酶、T4 DNA连接酶、DNA Marker、蛋白质Marker 美国Fermentase公司;DNA胶回收试剂盒、质粒抽提试剂盒E.Z.N.A. 美国Omega Bio-tek公司; In-Fusion® HD Cloning kit 日本Takara公司;Ni-NTA亲和层析柱 德国QIAGEN公司;Bradford法蛋白浓度测定试剂盒 上海生工生物工程股份有限公司;实验所用试剂均为分析纯,国药集团化学试剂有限公司。
Mastercycler gradient型PCR仪 美国Eppendorf公司;TY04S-3C型凝胶成像系统 北京君意东方电泳设备有限公司;SP-752PC型紫外可见分光光度计 上海光谱仪器有限公司;iMark 酶标仪 美国Bio-Rad公司。
1.2 实验方法
1.2.1 重组质粒pNCMO2-tkpulh的构建
基于TK-PUL的编码基因tkpul的碱基序列,设计引物F1和R1(表1),以重组质粒pBE-S-Atkp为模板,扩增基因tkpul。PCR扩增条件为:98 ℃ 变性5 min;98 ℃变性 20 s,60 ℃ 退火20 s,74 ℃ 延伸2 min, 30个循环;74 ℃ 延伸10 min。扩增产物经BamH I和Xba I双酶切,连接至经同样双酶切处理的载体pNCMO2,构建重组质粒pNCMO2-tkpulh。
表 1 构建重组质粒所用引物Table 1. Primer sequences for the construction of recombinant plasmids引物
名称序列 F1 5’-CGGGATCCGAGAGCAACGAAAATCAAAC-3’ R1 5’-TGTCTAGATCAATGGTGATGGTGATGATGCCCCGCTC-3’ F2 5’-TAGTGCGGAGGCTTTCAGGGGAATATAC-3’ BcR 5’-CTACCTGCATGCGAACTATTTGGTTGC-3’ GSR 5’-CTACCTGCATGCGAATTACTGTTTTCCTTG-3’ BaR 5’-CTACCTGCATGCGAATTATTTAGATTCAGAAG-3’ BlR 5’-CTACCTGCATGCGAATCAGCTGCTGCTTGTC-3’ BsR 5’-CTACCTGCATGCGAATTATTTAGAATTGCTTG-3’ F3 5’-AAAGCCTCCGCACTATAATGCCGAAG-3’ R3 5’-TTCGCATGCAGGTAGGGAACAATTAC-3’ 注:下划线标注的部分为限制性酶切割位点。 1.2.2 共胞外分子伴侣蛋白PrsA的表达载体的构建
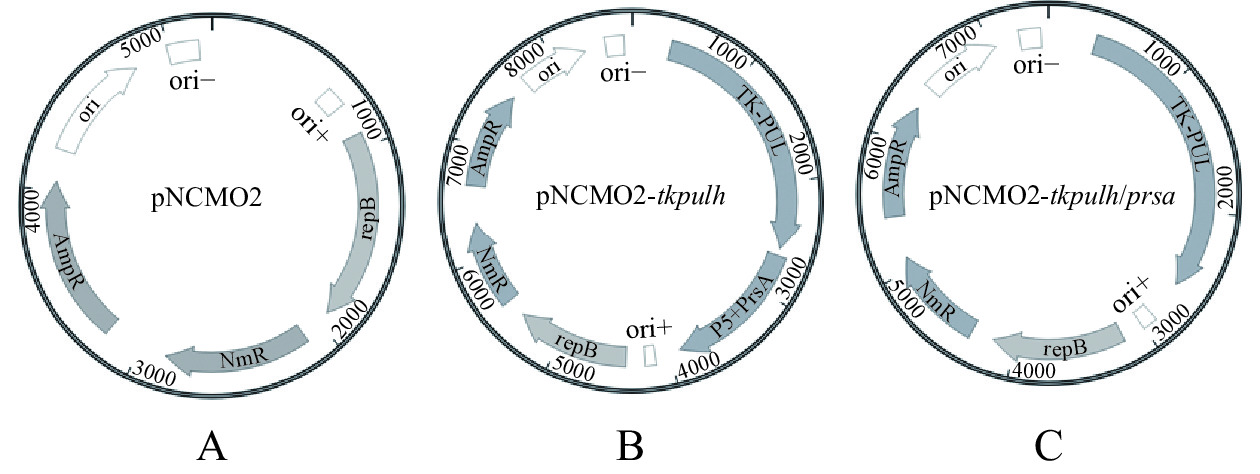
从NCBI网站搜索来源于芽孢杆菌属的胞外分子伴侣蛋白的蛋白质序列和对应的基因序列:来源于短小芽孢杆菌B. choshinensis的PrsABc(蛋白ID:WP_203357373.1)、来源于嗜热脂肪土芽孢杆菌Geobacillus stearothermophilus的PrsAGs(蛋白ID:ALA70949.1)、来源于解淀粉芽孢杆菌Bacillus amyloliquefaciens的PrsABa(蛋白ID:ASF28240.1)、来源于地衣芽孢杆菌Bacillus licheniformis的PrsABl(蛋白ID:AOP14207.1)、来源于枯草芽孢杆菌Bacillus subtilis的PrsABs(蛋白ID:AIY96590.1)。以共表达分子伴侣蛋白PrsABc的表达载体为例,采用化学合成方法合成由来源于质粒pNY326的P5启动子和PrsABc编码基因组成的“P5+PrsABc”碱基序列,根据“P5+PrsABc”碱基序列和In-Fusion® HD Cloning kit的说明书,设计引物F2和BcR(表1),以合成的“P5+PrsABc”碱基序列为模板,进行PCR扩增,获得“P5+PrsABc”碱基序列的线性化片段。同时根据In-Fusion® HD Cloning kit的说明书和重组质粒pNCMO2-tkpulh的碱基序列,设计引物F3和R3(表1),以重组质粒pNCMO2-tkpulh为模板,进行PCR扩增,实现重组载体pNCMO2-tkpulh的线性化。采用In-Fusion® HD Cloning kit连接线性化“P5+PrsABc”碱基序列和线性化重组载体pNCMO2-tkpulh,并将连接产物转化大肠杆菌E. coli JM109感受态细胞,将转化产物全部涂布于含100 μg/mL氨苄青霉素的LB固体平板上,于37 ℃过夜培养。提取转化子中重组质粒pNCMO2-tkpulh/prsabc,将重组质粒送至生工生物工程(上海)股份有限公司进行测序,并与相应基因序列进行比对确认。载体pNCMO2、重组质粒pNCMO2-tkpulh以及重组质粒pNCMO2-tkpulh/prsa的质粒图谱如图1所示。其他共表达分子伴侣蛋白PrsA的重组质粒的构建参照如上构建方法。
1.2.3 重组短小芽孢杆菌的构建与发酵培养
采用电转化法将重组质粒转化入B. choshinensis HPD1-SP3[15],获得重组短小芽孢杆菌。挑取转化子单克隆接种于含50 μg/mL新霉素的10 mL TM培养基中,于37 ℃培养12 h,获得种子液。取0.5 mL种子液,转接入50 mL TM培养基中进行摇瓶培养,于37 ℃、200 r/min,摇瓶发酵培养60 h,获得重组短小芽孢杆菌发酵培养液。
1.2.4 生物量的测定
取1 mL重组短小芽孢杆菌发酵培养液,于12000×g离心5 min,收集菌体沉淀,并水洗三次后,于105 ℃烘干至重量不变,再将样品进行称重,即为细胞干重(dry cell weight,DCW)。
1.2.5 重组TK-PUL的纯化与酶活力测定
待发酵培养结束后,将重组短小芽孢杆菌发酵培养液于12000×g离心5 min,收集发酵液上清,即为发酵液上清样品。采用适量50 mmol/L 2-(N-吗啡啉)乙磺酸 (2-Morpholinoethanesulfonic acid,MES) ,pH6.5缓冲液重悬菌体沉淀,置于冰上用超声波破碎细胞。超声波细胞破碎仪的参数设置为超声波功率为25%、超声波破碎时间3 s、间歇6 s。超声波处理菌体细胞至菌体悬液变为均一的溶液,即为菌体沉淀处理样品。
采用Ni-NTA亲和层析柱纯化发酵液上清样品中重组TK-PUL。利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)[16]检测重组TK-PUL的纯度,根据蛋白质样品在SDS-PAGE图谱上所呈现的带型特点来判断重组TK-PUL的纯度。采用活性印记分析[17]检测TK-PUL的α-淀粉酶酶活,并采用Bradford法测定重组TK-PUL的浓度 [16]。
以1%(m/V) g/100 mL可溶性淀粉为底物,测定发酵培养液上清样品、菌体沉淀处理样品或纯化后重组TK-PUL的α-淀粉酶活性。α-淀粉酶活性测定参照文献[11]进行。酶活力单位(U)定义:在一定反应条件下,每分钟催化产生1 μmol还原糖的酶量为一个酶活力单位(U)[18]。
1.2.6 重组短小芽孢杆菌的发酵培养基优化
在TM培养基的基础上相应地改变碳源、氮源以及培养基添加物(MgCl2·6H2O或脯氨酸)进行单因素实验。选用不同碳源(甘油、蔗糖、麦芽糖、乳糖、可溶性淀粉)替代TM培养基中碳源(10 g/L葡萄糖),不同氮源(牛肉浸粉、多聚蛋白胨、酵母提取物、胰蛋白胨、棉籽粉、大豆蛋白胨、硫酸铵、氯化铵)替代TM培养基中氮源(10 g多聚蛋白胨、5 g牛肉粉、2 g酵母提取物),分别添加质量浓度为0~15 g/L MgCl2·6H2O或脯氨酸,研究不同碳源、氮源和培养基添加物(MgCl2·6H2O或脯氨酸)对重组短小芽孢杆菌发酵生物量及产酶的影响。根据单因素实验结果,采用响应面分析法(response surface methodology,RSM)进一步优化重组短小芽孢杆菌的发酵培养基。选取发酵培养基中影响重组短小芽孢杆菌发酵产酶水平的4个因素葡萄糖、酵母提取物、MgCl2·6H2O、脯氨酸为考察对象,以重组短小芽孢杆菌发酵液上清的酶活(Y)为响应值,采用Design-Expert 10.0.7软件设计4因素3水平的中心组合响应面试验,响应面试验因素水平表如表2所示。
表 2 响应面试验因素水平设计Table 2. Response surface test factor level design水平 因素 A 葡萄糖
浓度(g/L)B 酵母提取物
浓度(g/L)C MgCl2·6H2O
浓度(g/L)D 脯氨酸
浓度(g/L)−1 10 17 9 6 0 20 22 12 9 1 30 27 15 12 1.2.7 重组短小芽孢杆菌的发酵条件优化
在“1.2.3”重组短小芽孢杆菌发酵培养条件的基础上,选择不同的发酵培养温度(25、28、30、33、35、37 ℃)、不同的初始pH(6.0、6.5、7.0、7.5、8.0)以及不同的培养时间(48、54、60、66、72、78 h),分别培养重组短小芽孢杆菌,研究不同发酵培养条件对重组短小芽孢杆菌发酵生物量及产酶的影响。
1.3 数据处理
所有试验均重复3次,试验结果用平均值±标准差表示,运用软件SigmaPlot 14.0和SPSS对试验数据进行统计分析并作图。采用软件Design-Expert 10.0.7进行Box-Behnken试验设计以及试验数据的响应面分析。
2. 结果与分析
2.1 重组TK-PUL于短小芽孢杆菌表达系统的分泌表达
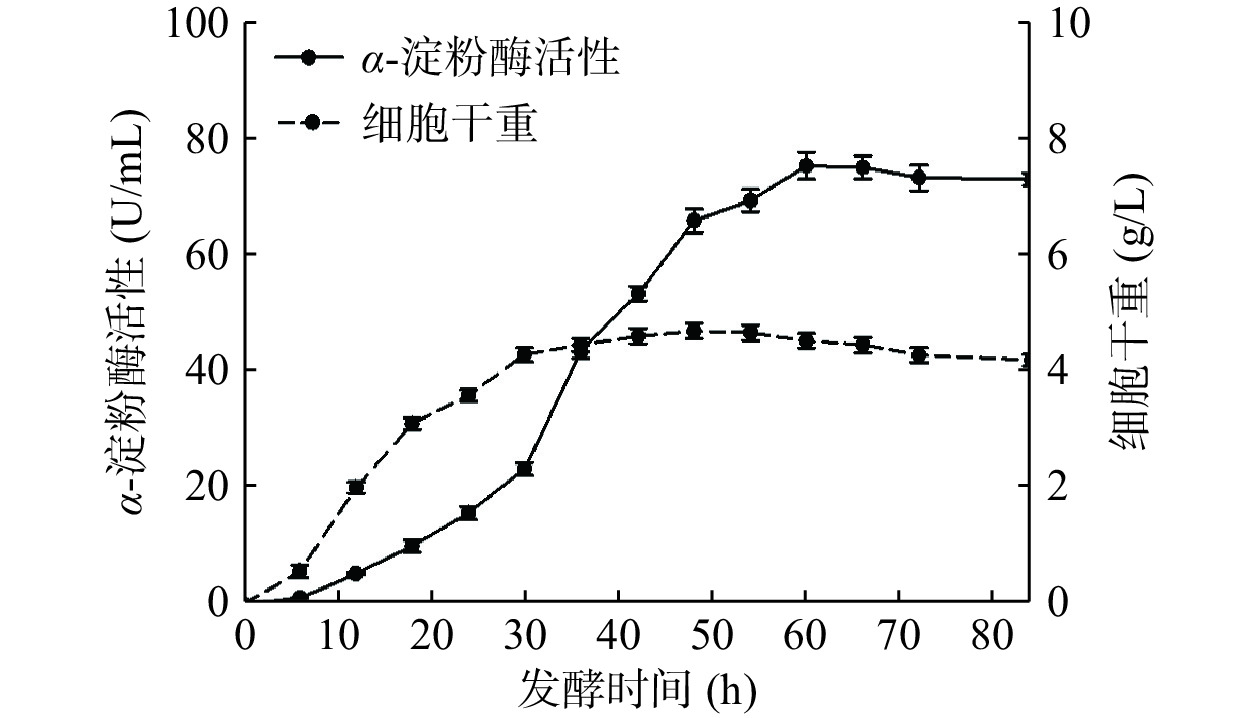
短小芽孢杆菌B. choshinensis表达系统具有较强分泌外源蛋白的能力[12−13]。将重组短小芽孢杆菌B. choshinensis HPD1-SP3/pNCMO2-tkpulh于37 ℃摇瓶发酵培养,其摇瓶发酵曲线如图2所示。当发酵培养48 h时,重组短小芽孢杆菌B. choshinensis HPD1-SP3/pNCMO2-tkpulh的细胞干重达到最大值;当发酵培养60 h时,其胞外α-淀粉酶活性达到最大值。待重组短小芽孢杆菌B. choshinensis HPD1-SP3/pNCMO2-tkpulh摇瓶发酵培养60 h后,将发酵培养液于12000×g离心5 min,分别收集发酵培养液上清和菌体沉淀。分别测定发酵培养液上清和菌体沉淀处理样品的α-淀粉酶活性,结果显示重组TK-PUL主要位于发酵培养液上清中,发酵培养液上清样品的比酶活力达75.24 U/mL,菌体沉淀处理样品的比酶活力仅为1.38 U/mL。
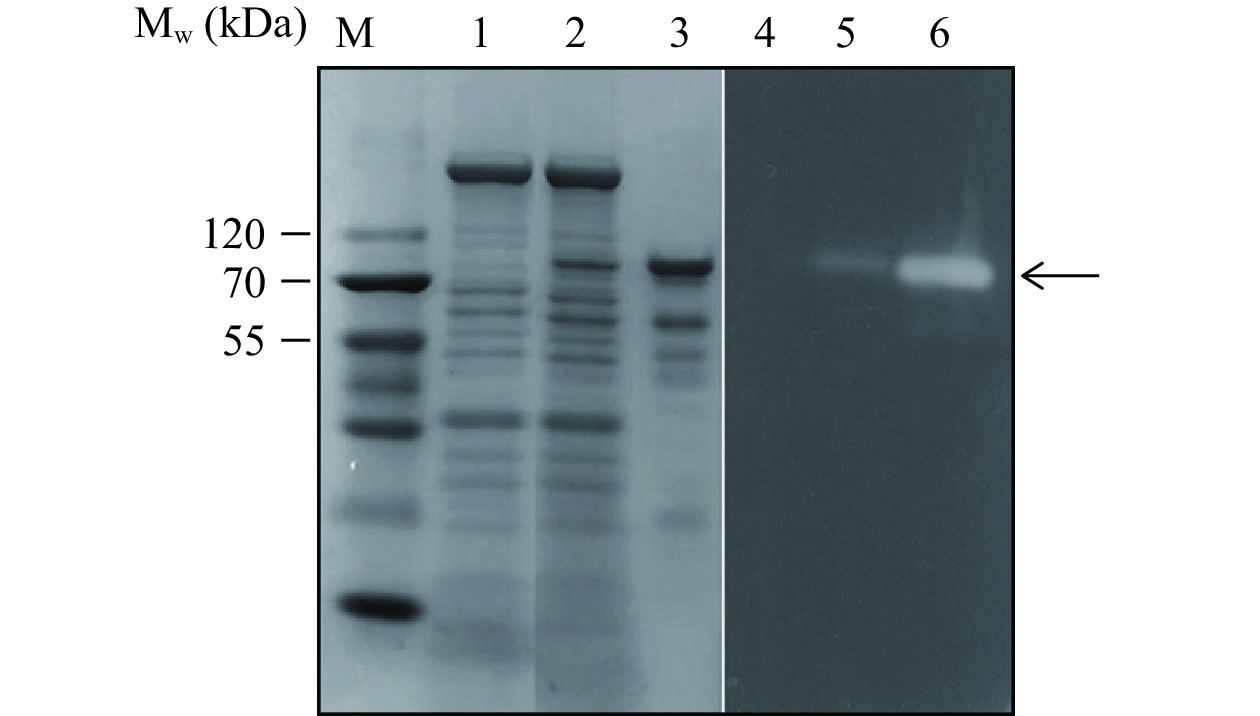
分别对重组菌株B. choshinensis HPD1-SP3/pNCMO2和重组菌株B. choshinensis HPD1-SP3/pNCMO2-tkpulh的发酵液上清进行SDS-PAGE检测和α-淀粉酶活性印记分析,结果如图3所示。重组菌株B. choshinensis HPD1-SP3/pNCMO2的发酵液上清未检测到α-淀粉酶活性,而重组菌株B. choshinensis HPD1-SP3/pNCMO2-tkpulh的发酵液上清检测到明显的α-淀粉酶活性。采用Ni2+亲和层析纯化重组菌株B. choshinensis HPD1-SP3/pNCMO2-tkpulh发酵液上清中目的蛋白。SDS-PAGE检测和和α-淀粉酶活性印记分析结果显示重组TK-PUL的分子量约为84 kDa(图3),其大小与TK-PUL的理论分子量相符[7−8]。
2.2 共表达胞外分子伴侣蛋白PrsA对TK-PUL分泌表达的影响
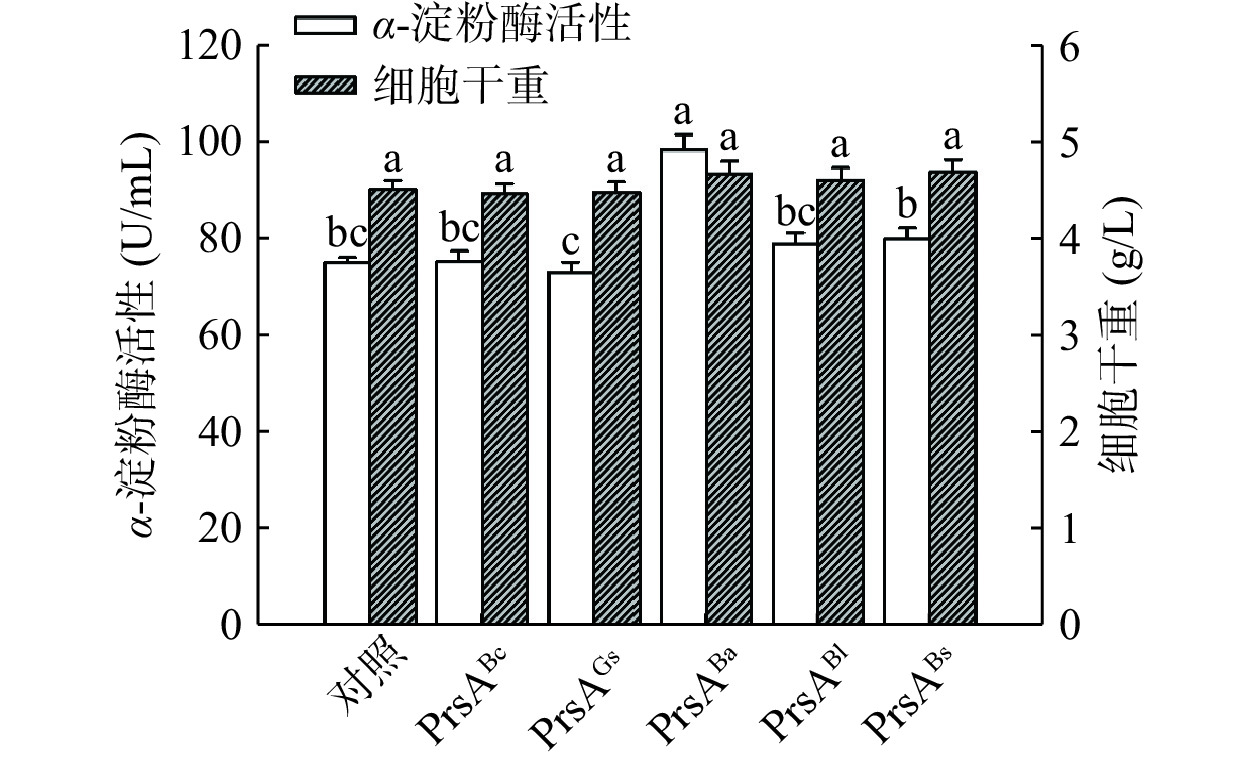
来源于芽孢杆菌属的胞外分子伴侣蛋白PrsA是常见的蛋白质折叠辅助因子[19−20],其通过脂蛋白信号肽锚定在细胞膜的外侧,可辅助跨膜转运后的目的蛋白在细胞膜和细胞壁的间隙中正确折叠成具有生物活性的空间结构[21−23]。本研究选择来源于B. choshinensis的PrsABc、来源于G. stearothermophilus的PrsAGs、来源于B. amyloliquefaciens的PrsABa、来源于B. licheniformis的PrsABl以及来源于B. subtilis的PrsABs作为胞外分子伴侣蛋白的考察对象,考察了共表达不同芽孢杆菌来源的胞外分子伴侣蛋白PrsA对TK-PUL于短小芽孢杆菌表达系统中分泌表达的影响,结果如图4所示。经摇瓶发酵验证,共表达胞外分子伴侣蛋白PrsABa最有利于TK-PUL的分泌表达。其对应的重组短小芽孢杆菌B. choshinensis HPD1-SP3/pNCMO2-tkpulh/prsaBa摇瓶发酵的胞外α-淀粉酶比酶活力为98.79 U/mL,提高了0.31倍。
已有研究表明,在枯草芽孢杆菌表达系统中共表达分子伴侣蛋白PrsA可有效提高PrsA依赖型目的蛋白的分泌表达水平[23−24]。例如,Chen等[24]通过在枯草芽孢杆菌表达系统中共表达PrsABs,将α-淀粉酶AmyL的分泌表达水平提高了2.2倍。另外,不同来源的分子伴侣蛋白PrsA具有一定的底物特异性。共表达分子伴侣蛋白PrsA可能提高、降低或不影响目的蛋白质的分泌表达量。Yao等[21]研究结果表明,共表达PrsABs和PrsABa有利于提高α-淀粉酶AmyS在短小芽孢杆菌中的胞外表达水平,而共表达PrsABc和PrsABl导致α-淀粉酶AmyS的胞外表达水平下降。本研究结果表明,在短小芽孢杆菌表达系统中共表达分子伴侣蛋白PrsABa、PrsABl、PrsABs均不同程度地促进了TK-PUL的分泌表达,共表达PrsABc不影响TK-PUL的分泌表达,而共表达PrsAGs导致TK-PUL的分泌表达水平下降。本研究中共表达PrsABa最有利于TK-PUL的异源分泌表达。Yao等[21]研究结果以及Quesada-Ganuza等[23]研究结果均表明,共表达PrsABa可以不同程度提高各种来源的α-淀粉酶的异源分泌表达水平。结合本研究结果,可以推测来源于B. amyloliquefaciens的胞外分子伴侣蛋白PrsABa具有较弱的底物特异性,在芽孢杆菌表达系统中共表达PrsABa有利于促进多种目的蛋白质的异源分泌表达。
2.3 重组短小芽孢杆菌的发酵培养基优化
2.3.1 单因素实验法优化重组短小芽孢杆菌的发酵培养基
发酵培养基的成分会影响重组菌株的生长及其产酶水平。本研究中重组短小芽孢杆菌所采用的TM培养基包括碳源(10 g/L葡萄糖)、氮源(10 g/L多聚蛋白胨、5 g/L牛肉粉、2 g/L酵母粉)以及金属离子等。碳源和氮源对重组短小芽孢杆菌的生长和蛋白质合成具有非常重要的影响,合适的碳源和氮源有利于促进菌体生长和蛋白质合成分泌[25−26]。另外,发酵培养基中金属离子和其他重要组成部分如脯氨酸也会影响重组短小芽孢杆菌的生长和蛋白质合成[25−26]。
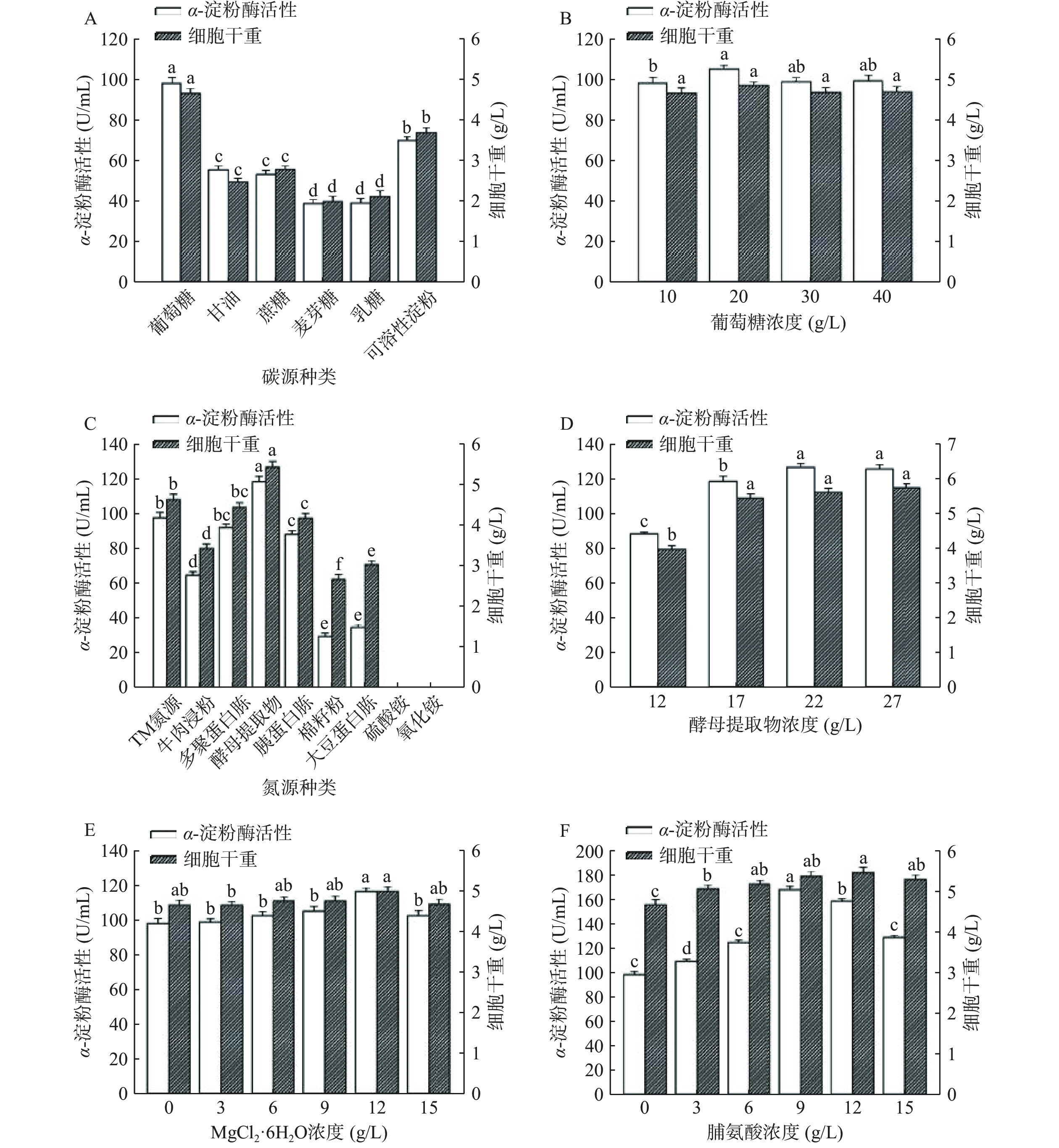
本研究在TM培养基的基础上相应地改变碳源、氮源以及培养基添加物(MgCl2·6H2O或脯氨酸)进行单因素实验,优化重组短小芽孢杆菌B. choshinensis HPD1-SP3/pNCMO2-tkpulh/prsaBa的摇瓶发酵培养基,结果如图5所示。由图5A和图5B可知,采用葡萄糖作为碳源时,重组短小芽孢杆菌的发酵生物量以及产酶水平最高。并且当葡萄糖的浓度为20 g/L时,发酵生物量达到4.88 g/L,发酵液上清的酶活达到105.64 U/mL。图5C和图5D显示选用酵母提取物作为氮源时,重组短小芽孢杆菌的发酵生物量以及产酶水平最高。当酵母提取物的浓度为22 g/L时,发酵生物量达到5.67 g/L,发酵液上清的酶活达到127.84 U/mL。图5E显示向培养基中添加12 g/L MgCl2·6H2O时,重组短小芽孢杆菌的发酵生物量以及产酶水平最高,发酵生物量达到5.02 g/L,发酵液上清的酶活达到117.19 U/mL。在短小芽孢杆菌表达系统中,Mg2+可通过抑制P2启动子的活性,降低目的蛋白质前体的合成,从而提供足够的时间使目的蛋白质前体折叠成为具有正确分子结构的活性蛋白质。例如,Zou等[27]将来源于B. deramificans的普鲁兰酶于短小芽孢杆菌表达系统中进行分泌表达。当表达B. deramificans普鲁兰酶的重组短小芽孢杆菌的发酵培养基中额外添加12 g/L MgCl2·6H2O时,发酵液中B. deramificans普鲁兰酶的表达量降低了30.4%,而发酵液上清的普鲁兰酶活性提高了5.4倍。即重组短小芽孢杆菌表达的B. deramificans普鲁兰酶中,更高比例的B. deramificans普鲁兰酶前体折叠成为具有正确分子结构的活性普鲁兰酶。图5F显示向培养基中添加9 g/L 脯氨酸时,重组短小芽孢杆菌的产酶水平最高,此时发酵生物量达到5.99 g/L,发酵液上清的酶活达到168.79 U/mL。脯氨酸作为发酵培养基的重要组成部分,有利于维持短小芽孢杆菌细胞的完整性和活力,提高异源蛋白质的分泌表达水平[17,28]。Li等[17]研究发现,通过向短小芽孢杆菌发酵培养基中添加脯氨酸来提高异源蛋白质的分泌表达水平具有普遍适用性。
2.3.2 响应面试验法优化重组短小芽孢杆菌的发酵培养基
根据单因素实验结果,选取发酵培养基中影响重组短小芽孢杆菌发酵产酶水平的4个因素葡萄糖、酵母提取物、MgCl2·6H2O、脯氨酸为考察对象,以重组短小芽孢杆菌发酵液上清的酶活(Y)为响应值,采用Design-Expert 10.0.7软件设计4因素3水平的中心组合响应面试验,响应面试验因素水平如表2所示,Box-Behnken试验设计及试验结果见表3。采用Design-Expert 10.0.7软件对29个试验点的响应值进行回归拟合分析,响应面试验二次模型的方差分析结果如表4所示。
表 3 Box-Behnken 试验设计及试验结果Table 3. Design and results of Box-Behnken experimental实验号 A 葡萄糖
浓度B 酵母
提取物
浓度C MgCl2·
6H2O
浓度D 脯氨酸
浓度Y 发酵液
上清酶活
(U/mL)1 −1 −1 0 0 123.79±1.23 2 1 −1 0 0 117.14±1.42 3 −1 1 0 0 104.03±1.62 4 1 1 0 0 104.12±1.37 5 0 0 −1 −1 125.50±1.86 6 0 0 1 −1 118.18±1.67 7 0 0 0 1 120.08±1.76 8 0 0 1 1 125.50±1.98 9 −1 0 0 −1 129.96±1.93 10 1 0 0 −1 119.23±1.89 11 −1 0 0 1 123.41±1.87 12 1 0 0 1 128.54±1.96 13 0 −1 −1 0 117.23±1.97 14 0 1 −1 0 99.94±2.01 15 0 −1 1 0 118.94±2.23 16 0 1 1 0 99.56±1.93 17 −1 0 −1 0 126.73±1.89 18 1 0 −1 0 118.85±2.05 19 −1 0 1 0 124.74±2.21 20 1 0 1 0 123.22±1.90 21 0 −1 0 −1 120.65±1.29 22 0 1 0 −1 98.71±1.03 23 0 −1 0 1 119.99±1.63 24 0 1 0 1 103.36±1.78 25 0 0 0 0 181.83±2.03 26 0 0 0 0 181.45±2.19 27 0 0 0 0 178.88±1.92 28 0 0 0 0 182.50±2.01 29 0 0 0 0 180.90±2.24 表 4 响应面试验二次模型的方差分析结果Table 4. ANOVA results for the response surface quadratic model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 19144.49 14 1367.46 1111.56 <0.0001 ** A 38.74 1 38.74 31.49 <0.0001 ** B 972.36 1 972.36 790.40 <0.0001 ** C 0.2730 1 0.2730 0.2219 0.6448 D 6.24 1 6.24 5.07 0.0410 * AB 11.36 1 11.36 9.23 0.0089 ** AC 10.11 1 10.11 8.22 0.0124 * AD 62.88 1 62.88 51.12 <0.0001 ** BC 1.09 1 1.09 0.8877 0.3621 BD 7.05 1 7.05 5.73 0.0312 * CD 40.58 1 40.58 32.98 <0.0001 ** A² 4808.73 1 4808.73 3908.85 <0.0001 ** B² 11314.57 1 11314.57 9197.23 <0.0001 ** C² 5990.18 1 5990.18 4869.22 <0.0001 ** D² 5290.45 1 5290.45 4300.43 <0.0001 ** 残差 17.22 14 1.23 失拟 9.64 10 0.9640 0.5085 0.8241 纯误差 7.58 4 1.90 总和 19161.71 28 注:*表示差异显著,P﹤0.05;**表示差异极显著,P﹤0.01。 表4中方差分析结果显示:模型P值<0.0001,这表示方程模型达到极显著;失拟P值=0.8241,不显著,说明该模型拟合程度好,可靠性高。因此该二次多项回归模型成立,应用此模型可以预测重组短小芽孢杆菌发酵产酶水平以及优化发酵培养基。由P值可知,一次项A、B、交互项AB、AD、CD以及二次项A2、B2、C2、D2对发酵产酶水平的影响达到极显著程度(P<0.01),一次项D以及交互项AC、BD对发酵产酶水平的影响达到显著程度(P<0.05)。此外,该二次多项回归模型的复相关系数为0.9991,说明该方程模型与实际试验结果拟合良好,试验误差小。根据表4,去掉对反应的影响不显著的试验因素,获得描述显著试验因素与发酵液上清酶活(Y)之间关系的二次多项式方程(Y=181.11−1.80A−9.00B+0.72D+1.69AB+1.59AC+3.97AD+1.33BD+3.19CD−27.23A2−41.77B2−30.39C2−28.56D2)。以上二次多项回归模型中二次项系数均为负值,说明该方程模型有极大值。
基于响应面试验设计结果,最佳发酵培养基为:19.65 g/L 葡萄糖、21.46 g/L酵母提取物、12.01 g/L MgCl2·6H2O、9.02 g/L脯氨酸、0.01 g/L FeSO4·7H2O、0.01 g/L MnSO4·4H2O、0.001 g/L ZnSO4·7H2O。在此条件下,重组短小芽孢杆菌发酵液上清的酶活为181.64 U/mL。采用最佳发酵培养基进行3组验证试验,测得重组短小芽孢杆菌发酵液上清的酶活分别为180.16、182.47、180.39 U/mL,平均值为181.01±1.27 U/mL,与该条件下的理论值的相对误差值小于1%,说明采用响应面法优化得到的制备工艺参数准确可靠。重组短小芽孢杆菌于最佳发酵培养基摇瓶发酵培养后的发酵上清液酶活相对于TM培养基提高了1.41倍。
2.4 重组短小芽孢杆菌的发酵条件优化
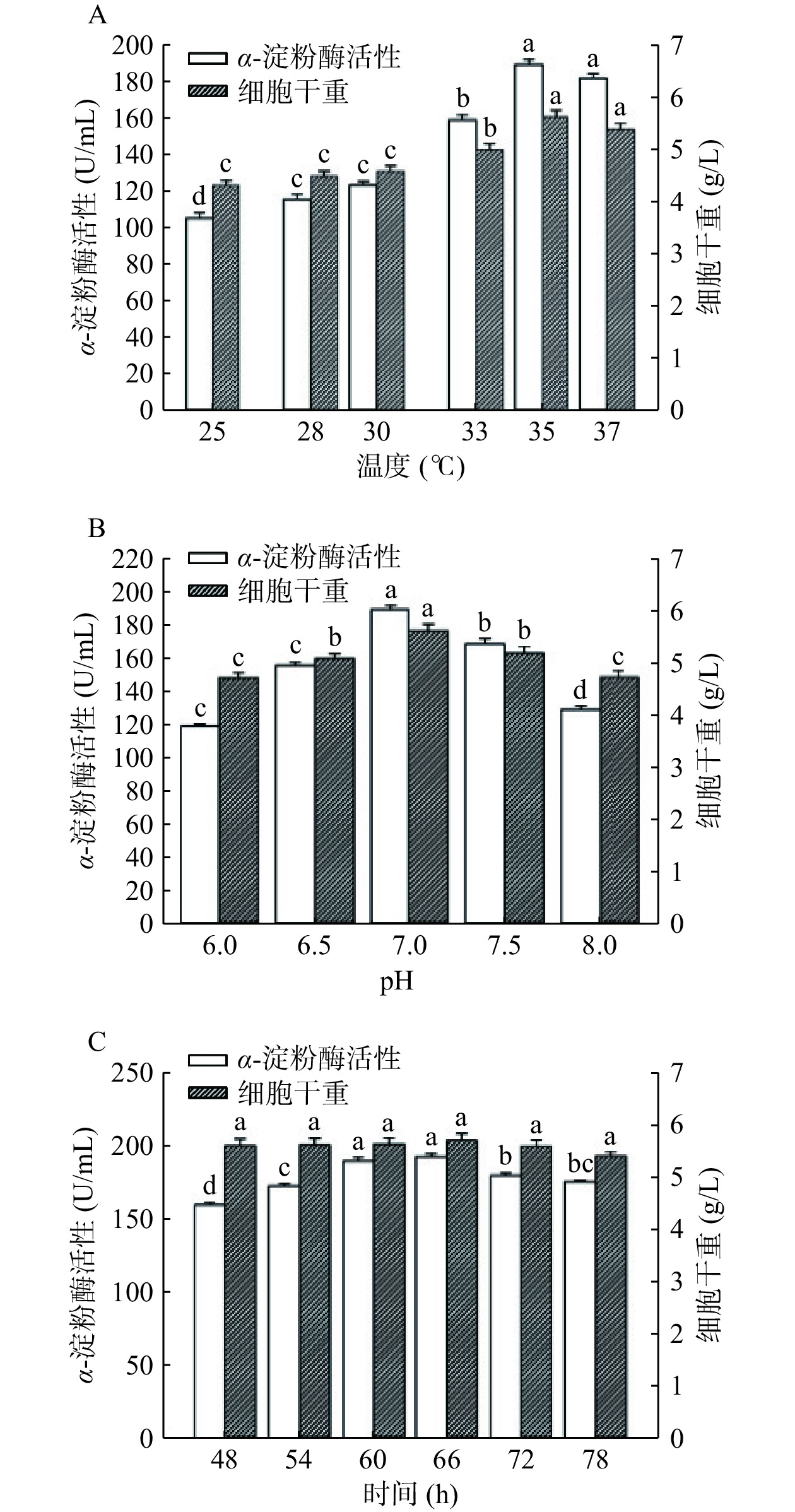
发酵培养温度、发酵初始pH和发酵培养时间也是影响重组短小芽孢杆菌发酵生物量和产酶水平的重要因素[29−30]。本研究也探究了发酵培养温度、发酵初始及培养时间pH对重组短小芽孢杆菌B. choshinensis HPD1-SP3/pNCMO2-tkpulh/prsaBa发酵生物量和产酶水平的影响,结果如图6所示。由图6A可知,在25~35 ℃范围内,随着发酵培养温度的升高,重组短小芽孢杆菌的发酵生物量和产酶水平逐渐升高;温度大于35 ℃后,重组短小芽孢杆菌的发酵生物量和产酶水平下降。这表明35 ℃更适于重组短小芽孢杆菌生长和产酶,因此选取35 ℃为最适发酵培养温度。图6B显示,随着培养基pH的增加,重组短小芽孢杆菌的发酵生物量和产酶水平均呈现先增加后减少的变化趋势。发酵初始pH为7.0时,重组短小芽孢杆菌的发酵生物量和产酶水平最高。这表明pH7.0更适于重组短小芽孢杆菌生长和产酶,因此选取7.0为最适发酵初始pH。图6C显示,当发酵培养时间由48 h延长至66 h时,重组短小芽孢杆菌的发酵生物量和产酶水平持续增加;待发酵培养时间超过66 h后,重组短小芽孢杆菌的发酵生物量和产酶水平略有降低。即随着发酵培养时间的延长,受到碳源、氮源等能源物质的限制,重组短小芽孢杆菌的生长和产酶受限,其生物量和产酶水平不会一直持续增加。此外,在重组短小芽孢杆菌的发酵后期,细胞自身的裂解可能导致其生物量降低,并且其所产的胞外外源酶可能受其自身胞外蛋白酶的降解而导致其产量下降[21]。本研究显示,重组短小芽孢杆菌B. choshinensis HPD1-SP3/ pNCMO2-tkpulh/prsaBa采用最佳发酵培养基于35 ℃、pH7.0下进行摇瓶发酵培养66 h后,其细胞干重为5.69 g/L,发酵上清液酶活达到192.68 U/mL。
3. 结论
本研究通过共表达分子伴侣蛋白提高了嗜热酸性III型普鲁兰水解酶TK-PUL在短小芽孢杆菌表达系统中的分泌表达水平,并进一步优化了重组短小芽孢杆菌的发酵培养基和培养条件。研究结果表明,通过共表达来源于B. amyloliquefaciens的胞外分子伴侣蛋白PrsABa,重组短小芽孢杆菌B. choshinensis HPD1-SP3/pNCMO2-tkpulh/prsaBa的胞外酶活达到98.79 U/mL,提高了0.31倍。重组短小芽孢杆菌的最佳发酵培养基为:19.65 g/L 葡萄糖、21.46 g/L酵母提取物、12.01 g/L MgCl2·6H2O、9.02 g/L脯氨酸、0.01 g/L FeSO4·7H2O、0.01 g/L MnSO4·4H2O、0.001 g/L ZnSO4·7H2O。重组短小芽孢杆菌的最佳发酵温度为35 ℃,最佳起始发酵pH为7.0,最佳培养时间为66 h。重组短小芽孢杆菌B. choshinensis HPD1-SP3/pNCMO2-tkpulh/prsaBa采用最佳发酵培养基于35 ℃、pH7.0下进行摇瓶发酵培养66 h后,其细胞干重为5.69 g/L,发酵上清液酶活达到192.68 U/mL,提高了1.56倍。本研究通过共表达分子伴侣蛋白和发酵优化实现了TK-PUL在短小芽孢杆菌的高效分泌表达,为TK-PUL的应用提供了理论基础,并为其他目的蛋白在短小芽孢杆菌中实现高效分泌表达提供了参考策略。
-
表 1 构建重组质粒所用引物
Table 1 Primer sequences for the construction of recombinant plasmids
引物
名称序列 F1 5’-CGGGATCCGAGAGCAACGAAAATCAAAC-3’ R1 5’-TGTCTAGATCAATGGTGATGGTGATGATGCCCCGCTC-3’ F2 5’-TAGTGCGGAGGCTTTCAGGGGAATATAC-3’ BcR 5’-CTACCTGCATGCGAACTATTTGGTTGC-3’ GSR 5’-CTACCTGCATGCGAATTACTGTTTTCCTTG-3’ BaR 5’-CTACCTGCATGCGAATTATTTAGATTCAGAAG-3’ BlR 5’-CTACCTGCATGCGAATCAGCTGCTGCTTGTC-3’ BsR 5’-CTACCTGCATGCGAATTATTTAGAATTGCTTG-3’ F3 5’-AAAGCCTCCGCACTATAATGCCGAAG-3’ R3 5’-TTCGCATGCAGGTAGGGAACAATTAC-3’ 注:下划线标注的部分为限制性酶切割位点。 表 2 响应面试验因素水平设计
Table 2 Response surface test factor level design
水平 因素 A 葡萄糖
浓度(g/L)B 酵母提取物
浓度(g/L)C MgCl2·6H2O
浓度(g/L)D 脯氨酸
浓度(g/L)−1 10 17 9 6 0 20 22 12 9 1 30 27 15 12 表 3 Box-Behnken 试验设计及试验结果
Table 3 Design and results of Box-Behnken experimental
实验号 A 葡萄糖
浓度B 酵母
提取物
浓度C MgCl2·
6H2O
浓度D 脯氨酸
浓度Y 发酵液
上清酶活
(U/mL)1 −1 −1 0 0 123.79±1.23 2 1 −1 0 0 117.14±1.42 3 −1 1 0 0 104.03±1.62 4 1 1 0 0 104.12±1.37 5 0 0 −1 −1 125.50±1.86 6 0 0 1 −1 118.18±1.67 7 0 0 0 1 120.08±1.76 8 0 0 1 1 125.50±1.98 9 −1 0 0 −1 129.96±1.93 10 1 0 0 −1 119.23±1.89 11 −1 0 0 1 123.41±1.87 12 1 0 0 1 128.54±1.96 13 0 −1 −1 0 117.23±1.97 14 0 1 −1 0 99.94±2.01 15 0 −1 1 0 118.94±2.23 16 0 1 1 0 99.56±1.93 17 −1 0 −1 0 126.73±1.89 18 1 0 −1 0 118.85±2.05 19 −1 0 1 0 124.74±2.21 20 1 0 1 0 123.22±1.90 21 0 −1 0 −1 120.65±1.29 22 0 1 0 −1 98.71±1.03 23 0 −1 0 1 119.99±1.63 24 0 1 0 1 103.36±1.78 25 0 0 0 0 181.83±2.03 26 0 0 0 0 181.45±2.19 27 0 0 0 0 178.88±1.92 28 0 0 0 0 182.50±2.01 29 0 0 0 0 180.90±2.24 表 4 响应面试验二次模型的方差分析结果
Table 4 ANOVA results for the response surface quadratic model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 19144.49 14 1367.46 1111.56 <0.0001 ** A 38.74 1 38.74 31.49 <0.0001 ** B 972.36 1 972.36 790.40 <0.0001 ** C 0.2730 1 0.2730 0.2219 0.6448 D 6.24 1 6.24 5.07 0.0410 * AB 11.36 1 11.36 9.23 0.0089 ** AC 10.11 1 10.11 8.22 0.0124 * AD 62.88 1 62.88 51.12 <0.0001 ** BC 1.09 1 1.09 0.8877 0.3621 BD 7.05 1 7.05 5.73 0.0312 * CD 40.58 1 40.58 32.98 <0.0001 ** A² 4808.73 1 4808.73 3908.85 <0.0001 ** B² 11314.57 1 11314.57 9197.23 <0.0001 ** C² 5990.18 1 5990.18 4869.22 <0.0001 ** D² 5290.45 1 5290.45 4300.43 <0.0001 ** 残差 17.22 14 1.23 失拟 9.64 10 0.9640 0.5085 0.8241 纯误差 7.58 4 1.90 总和 19161.71 28 注:*表示差异显著,P﹤0.05;**表示差异极显著,P﹤0.01。 -
[1] NAIK B, KUMAR V, GOYAL S K, et al. Pullulanase:unleashing the power of enzyme with a promising future in the food industry[J]. Frontiers in Bioengineering and Biotechnology,2023,11:1139611. doi: 10.3389/fbioe.2023.1139611
[2] NISHA M, SATYANARAYANA T. Characteristics, protein engineering and applications of microbial thermostable pullulanases and pullulan hydrolases[J]. Applied Microbiology and Biotechnology,2016,100(13):5661−5679. doi: 10.1007/s00253-016-7572-y
[3] WANG X Y, NIE Y, XU Y. Industrially produced pullulanases with thermostability:Discovery, engineering, and heterologous expression[J]. Bioresource Technology, 2019:360-371.
[4] AKASSOU M, GROLEAU D. Advances and challenges in the production of extracellular thermoduric pullulanases by wild-type and recombinant microorganisms:A review[J]. Critical Reviews in Biotechnology,2019,39(3):337−350. doi: 10.1080/07388551.2019.1566202
[5] OKAFOR D C, OFOEDU C E, NWAKAUDU A, et al. Enzymes as additives in starch processing:A short overview[M]. New York:Academic Press, 2019:149-168.
[6] MIAO M, JIANG B, JIN Z Y, et al. Microbial starch-converting enzymes:recent insights and perspectives[J]. Comprehensive Reviews in Food Science and Food Safety,2018,17(5):1238−1260. doi: 10.1111/1541-4337.12381
[7] HAN T, ZENG F, LI Z, et al. Biochemical characterization of a recombinant pullulanase from Thermococcus kodakarensis KOD1[J]. Letters in Applied Microbiology,2013,57(4):336−343. doi: 10.1111/lam.12118
[8] AHMAD N, RASHID N, HAIDER M S, et al. Novel maltotriose-hydrolyzing thermoacidophilic type III pullulan hydrolase from Thermococcus kodakarensis[J]. Applied and Environmental Microbiology,2014,80(3):1108−1115. doi: 10.1128/AEM.03139-13
[9] AHMAD N, RASHID N, HAIDER M S, et al. Single step liquefaction and saccharification of corn starch using an acidophilic, calcium independent and hyperthermophilic pullulanase:US9340778[P]. 2016-05-17[2020-04-08]. http://www.google.com/patents/US20140227744.
[10] TOOR K J, AHMAD N, MUHAMMAD M A, et al. TK-PUL, a pullulan hydrolase type III from Thermococcus kodakarensis, a potential candidate for simultaneous liquefaction and saccharification of starch[J]. Amylase,2020,4(1):45−55. doi: 10.1515/amylase-2020-0004
[11] 曾静, 郭建军, 袁林. 嗜热酸性普鲁兰水解酶Ⅲ的高效分泌表达及其酶学性质[J]. 食品工业科技,2020,41(3):98−103,109. [ZENG J, GUO J J, YUAN L. Efficient secretory expression of thermoacidiphilic type III pullulan hydrolase and its enzymatic properties[J]. Science and Technology of Food industry,2020,41(3):98−103,109.] ZENG J, GUO J J, YUAN L. Efficient secretory expression of thermoacidiphilic type III pullulan hydrolase and its enzymatic properties[J]. Science and Technology of Food industry, 2020, 41(3): 98−103,109.
[12] HANAGATA H, MIZUKAMI M, MIYAUCHI A. Efficient expression of antibody fragments with the Brevibacillus expression system[J]. Antibodies,2014,3(2):242−252. doi: 10.3390/antib3020242
[13] MIZUKAMI M, HANAGATA H, MIYAUCHI A. Brevibacillus expression system:Host-vector system for efficient production of secretory proteins[J]. Current Pharmaceutical Biotechnology,2010,11(3):251−258. doi: 10.2174/138920110791112031
[14] YAO D B, ZHANG K, WU J. Available strategies for improved expression of recombinant proteins in Brevibacillus expression system:A review[J]. Critical Reviews in Biotechnology,2021,40(7):1044−1058.
[15] OKAMOTO A, KOSUGI A, KOIZUMI Y, et al. High efficiency transformation of Bacillus brevis by electroporation[J]. Bioscience, Biotechnology, and Biochemistry,1997,61(1):202−203. doi: 10.1271/bbb.61.202
[16] GREEN M R, SAMBROOK J. Molecular cloning:A laboratory manual[M]. New York:Cold Spring Harbor Laboratory Press, 2012:101-200.
[17] LI Z, SU L Q, DUAN X G, et al. Efficient expression of maltohexaose-forming α-amylase from Bacillus stearothermophilus in Brevibacillus choshinensis SP3 and its use in maltose production[J]. Biomed Research International,2017,2017:5479762.
[18] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry,1959,31(3):426−428. doi: 10.1021/ac60147a030
[19] YANG H Q, QU J F, ZOU W, et al. An overview and future prospects of recombinant protein production in Bacillus subtilis[J]. Applied Microbiology and Biotechnology,2021,105(18):6607−6626. doi: 10.1007/s00253-021-11533-2
[20] ZHANG K, TAN R T, YAO D B, et al. Enhanced production of soluble Pyrococcus furiosus α-amylase in Bacillus subtilis through chaperone co-expression, heat treatment and fermentation optimization[J]. Journal of Microbiology and Biotechnology,2021,31(4):570. doi: 10.4014/jmb.2101.01039
[21] YAO D B, ZHANG K, ZHU X Y, et al. Enhanced extracellular α-amylase production in Brevibacillus choshinensis by optimizing extracellular degradation and folding environment[J]. Journal of Industrial Microbiology and Biotechnology,2022,49(1):kuab061. doi: 10.1093/jimb/kuab061
[22] XU L Y, ZHANG Y Y, DONG Y H, et al. Enhanced extracellular β-mannanase production by overexpressing PrsA lipoprotein in Bacillus subtilis and optimizing culture conditions[J]. Journal of Basic Microbiology,2022,62(7):815−823. doi: 10.1002/jobm.202200080
[23] QUESADA-GANUZA A, ANTELO-VARELA M, MOURITZEN J C, et al. Identification and optimization of PrsA in Bacillus subtilis for improved yield of amylase[J]. Microbial Cell Factories,2019,18(1):158. doi: 10.1186/s12934-018-1049-x
[24] CHEN J Q, GAI Y M, FU G, et al. Enhanced extracellular production of α-amylase in Bacillus subtilis by optimization of regulatory elements and over-expression of PrsA lipoprotein[J]. Biotechnology Letters,2015,37:899−906. doi: 10.1007/s10529-014-1755-3
[25] ZOU C, DUAN X G, WU J. Efficient extracellular expression of Bacillus deramificans pullulanase in Brevibacillus choshinensis[J]. Journal of Industrial Microbiology and Biotechnology,2016,43(4):495−504. doi: 10.1007/s10295-015-1719-1
[26] CHENG Y M, LU M T, YEH C M. Functional expression of recombinant human trefoil factor 1 by Escherichia coli and Brevibacillus choshinensis[J]. BMC Biotechnology,2015,15(1):32. doi: 10.1186/s12896-015-0115-2
[27] ZOU C, DUAN X G, WU J. Magnesium ions increase the activity of Bacillus deramificans pullulanase expressed by Brevibacillus choshinensis[J]. Applied Microbiology and Biotechnology,2016,100:7115−7123. doi: 10.1007/s00253-016-7386-y
[28] MATSUNAGA R, TSUMOTO K. Addition of arginine hydrochloride and proline to the culture medium enhances recombinant protein expression in Brevibacillus choshinensis:The case of RBD of SARS-CoV-2 spike protein and its antibody[J]. Protein Expression and Purification,2022,194:106075. doi: 10.1016/j.pep.2022.106075
[29] MAEHASHI K, MATANO M, SAITO M, et al. Extracellular production of riboflavin-binding protein, a potential bitter inhibitor, by Brevibacillus choshinensis[J]. Protein Expression and Purification,2010,71(1):85−90. doi: 10.1016/j.pep.2009.12.016
[30] LI H P, XU C M, WEN B Y, et al. Extracellular production of recombinant sus scrofa trefoil factor 3 by Brevibacillus choshinensis[J]. Experimental and Therapeutic Medicine,2020,19(3):2149−2154.
-
期刊类型引用(1)
1. 何高阳. 短小芽孢杆菌拮抗植物病原真菌研究进展. 中南农业科技. 2024(09): 231-236+258 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



